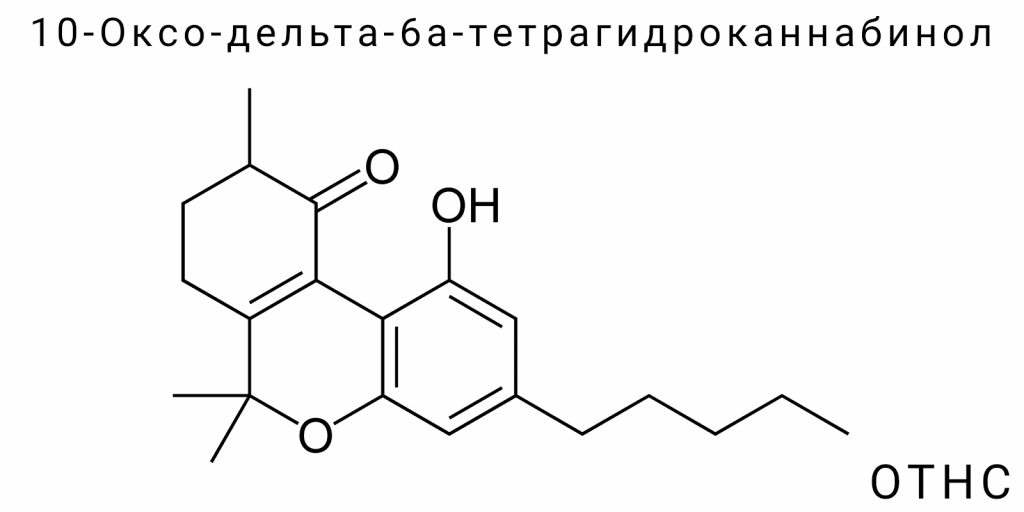
В современной химии каннабиноидов наблюдается стремительный рост интереса к производным тетрагидроканнабинола, которые не встречаются в природной конопле, но образуются в результате синтетических реакций. Одним из таких соединений является 10-Оксо-дельта-6а-тетрагидроканнабинол (OTHC) — каннабиноид с редкой структурной конфигурацией, отличающейся наличием кетонной (оксо-) функциональной группы в положении 10 и двойной связи между атомами C6a и C10a. Хотя эта молекула впервые была упомянута в химической литературе ещё в середине XX века в контексте побочных продуктов реакций с Δ⁹-THC, лишь в последние годы OTHC начал привлекать внимание как объект целенаправленных исследований в сфере новых психоактивных веществ (NPS — new psychoactive substances).
Сложная правовая ситуация вокруг классических каннабиноидов, в частности Δ⁹-тетрагидроканнабинола, способствовала развитию синтетических технологий, направленных на производство альтернативных соединений с подобной фармакодинамикой, но с изменённым химическим профилем, который позволяет обходить правовые ограничения. Среди таких производных — Δ⁸-THC, HHC, THCP, THCO и другие. OTHC в этом контексте выделяется тем, что его появление не является результатом сознательного дизайна с целью повышения аффинности к каннабиноидным рецепторам или изменения продолжительности действия. Напротив, он часто образуется непреднамеренно — как побочный продукт в реакциях изомеризации или окисления, сопровождающих полусинтетическое получение других соединений. Именно по этой причине долгое время OTHC не рассматривался как самостоятельный фармакологический объект.
Несмотря на то, что до сих пор не существует систематических клинических исследований OTHC, его структура вызывает интерес со стороны молекулярной фармакологии. Оксо-группа в положении 10 способна значительно влиять на электронную плотность ароматической системы и конформацию боковой цепи, что напрямую влияет на связывание с рецепторами CB1 и CB2 — основными мишенями для каннабиноидных соединений в организме человека. Дополнительно, влияние оксо-группы на липофильность молекулы может изменить скорость её проникновения через гематоэнцефалический барьер, продолжительность действия и механизмы метаболизма в печени.
В фармакокинетическом контексте большинство каннабиноидов характеризуются быстрой биотрансформацией с участием ферментов системы цитохрома P450, с образованием полярных метаболитов, которые выводятся с мочой и жёлчью. Известно, что незначительные изменения в химической структуре могут существенно изменить метаболическую судьбу вещества: как по скорости деградации, так и по образованию активных или токсичных метаболитов. В случае OTHC кетонная группа может участвовать в окислительно-восстановительных процессах, что формирует потенциально новые метаболические пути, нехарактерные для классических фитоканнабиноидов. Пока что эти аспекты остаются неизученными, что открывает широкое поле для исследований в фармацевтической и токсикологической областях.
С технологической точки зрения, синтез OTHC является сложным ввиду низкой стабильности промежуточных продуктов и вероятности побочных реакций. Один из основных маршрутов включает окисление Δ⁸-THC или Δ⁹-THC в присутствии кислотных катализаторов с последующей реакцией циклизации. Другие варианты включают частичную изомеризацию CBD с последующим введением оксо-функционала. Особого внимания заслуживают исследования, которые фокусируются на механизмах образования OTHC как примеси во время синтеза THCO или THCP — что свидетельствует о потенциальных рисках в коммерческом производстве каннабиноидных экстрактов низкой чистоты.
Стоит отметить, что OTHC начал появляться в составе нелегальных смесей на рынке США и Европы, что подтверждено химическим анализом конфискованных образцов. Это вызывает обеспокоенность у регулирующих органов, поскольку точный токсикологический профиль этого вещества неизвестен, а его влияние на центральную нервную систему может оказаться значительно отличающимся от «родительских» каннабиноидов. Некоторые первичные данные in vitro свидетельствуют о относительно низкой аффинности к рецепторам CB1 по сравнению с Δ⁹-THC, однако наличие кетогруппы открывает потенциал для взаимодействия с другими ферментативными мишенями — в частности, с энзимами, связанными с воспалением или болью.
Правовой статус OTHC в большинстве стран на данный момент не определён. Из-за того, что это соединение не включено в список контролируемых веществ, оно формально может рассматриваться как «серая зона», что открывает возможности для его использования в нелегальном обороте. Вместе с тем, наличие потенциальной психоактивности, токсикогенных метаболитов или непредсказуемого действия на ЦНС делает такое использование рискованным. Именно поэтому несколько токсикологических лабораторий ЕС инициировали программы по изучению OTHC в рамках системы раннего выявления новых психоактивных веществ (EU EWS).
Химическая структура и физико-химические свойства
10-Оксо-дельта-6а-тетрагидроканнабинол (OTHC) является представителем класса синтетических каннабиноидов, который образуется в результате химической модификации природных или полусинтетических каннабиноидов. Его химическая структура отличается высокой специфичностью: она содержит оксо-группу (кетон) в положении 10 молекулы тетрагидроканнабинола, что приводит к изменению электронной конфигурации и пространственной ориентации ядра молекулы, а также к потенциальным изменениям во взаимодействии с рецепторами каннабиноидной системы. Появление OTHC в системе новейших каннабиноидов является результатом побочного окислительного пути при синтезе других производных THC, в частности THCO или Δ⁸-THC, когда происходит перенос электронной плотности и формирование новых π-связей в центральном кольце молекулы.
Структурно, OTHC является производным трехкольцевой системы каннабиноидов, построенной на базе триметилтрихроменового скелета, где модификации в положениях C6a, C10a и C10 изменяют как конфигурацию, так и электронные свойства молекулы. Наличие двойной связи между атомами в положении 6а и 10а (то есть Δ⁶а), а также карбонильной группы в положении 10 выделяет OTHC среди классических изомеров THC, где обычно в этом положении присутствует водород. Именно эти изменения оказывают критическое влияние на конформационную подвижность молекулы, её липофильность, а также аффинность к мембранным рецепторам.
Одной из ключевых особенностей OTHC является его кетонная функциональная группа, обладающая электронодефицитными свойствами и способная к гидрофильным взаимодействиям с водными средами, что контрастирует с типичной гидрофобной природой каннабиноидных соединений. Это существенно влияет на фармакокинетику соединения, в частности на его растворимость в липидной среде, проницаемость через гематоэнцефалический барьер и метаболическую стабильность. Кроме того, карбонильная группа, как правило, является объектом восстановления в биохимических средах, что предполагает образование новых метаболитов — в частности, гидроксилированных производных, которые могут обладать собственной биологической активностью или токсичностью.
Что касается пространственного строения, важно понимать, что химическая структура OTHC позволяет существование нескольких диастереомеров, поскольку кольцевая система каннабиноида содержит стереогенные центры. Конфигурация этих центров напрямую влияет на взаимодействие с каннабиноидными рецепторами. Для классических каннабиноидов установлено, что лишь одна из энантиомерных форм проявляет высокую аффинность к рецептору CB1, тогда как другие либо являются инертными, либо ведут себя как частичные агонисты. В случае OTHC эти стереоизомеры ещё не были систематически описаны в литературе, хотя имеются основания полагать, что конфигурация в положении C9 (аналогичном Δ⁹-THC) может критически определять психоактивный потенциал молекулы.
Уникальность OTHC также проявляется в его реакционной способности. Карбонильная группа способна вступать в реакции нуклеофильного присоединения, образуя возможные гидраты, энамины или оксимы в соответствующих условиях. Эти химические превращения могут быть как желательными в рамках синтеза новых производных, так и нежелательными в условиях неконтролируемой деградации или метаболизма в организме. В связи с этим, определение химической стабильности OTHC является критическим аспектом при хранении и аналитическом исследовании соединения. По предварительным данным, OTHC является умеренно стабильным веществом в нейтральных средах, но склонным к деградации в присутствии кислорода, света или при повышенной температуре.
Поведение OTHC в растворах также заслуживает отдельного внимания. Ожидается, что из-за наличия карбонильной группы его растворимость в воде будет несколько выше, чем у Δ⁹-THC, но всё же остаётся низкой, учитывая доминирующие липофильные фрагменты. В стандартных условиях (25 °C, pH 7.4) OTHC демонстрирует преимущественную растворимость в неполярных органических растворителях — хлороформе, дихлорметане, тетрагидрофуране. Это осложняет его использование в фармакологических препаратах на водной основе без применения эмульгаторов или липосом.
С точки зрения электронной структуры, спектральные характеристики OTHC ещё не описаны в широком объёме, но по аналогии с другими оксоформами каннабиноидов, можно предположить характерные сигналы в ИК-спектроскопии (в диапазоне 1680-1720 см⁻¹ для C=O), а также смещения в ЯМР-спектрах для атомов углерода и водорода, находящихся рядом с кетонной группой. Эти характеристики могут быть использованы для точной аналитической идентификации OTHC в образцах, включая смеси с другими каннабиноидами, где традиционные методы часто не позволяют чётко различить структурные изомеры.
Структурная формула и номенклатура
Структура 10-Оксо-дельта-6а-тетрагидроканабинола (OTHC) демонстрирует редкое сочетание изомерных свойств и функциональной модификации, которое выделяет его среди других производных тетрагидроканабинола. В отличие от классических канабиноидов, OTHC включает в себя как изменение позиции двойной связи (дельта-6а вместо дельта-9 или дельта-8), так и введение карбонильной функциональной группы в положение 10, что сопровождается перераспределением π-электронной плотности в ароматической системе молекулы. Это делает его химически нестандартным канабиноидом, для которого классические правила IUPAC-номенклатуры приходится адаптировать под специфику канабиноидного ядра.
Для полного понимания строения OTHC необходимо обратиться к общей структуре трициклических канабиноидов, которая состоит из конденсированной системы бензопирана, циклогексанового кольца и пентильной (преимущественно метил- или пропил-) боковой цепи. В случае OTHC, смещение двойной связи в пределах циклогексанового кольца происходит между атомами углерода 6а и 10а (в нумерации, принятой для канабиноидного скелета), что существенно изменяет электронные свойства кольца. Введение оксо-группы в положение 10 сопровождается потерей водорода и переходом sp³-гибридизированного углерода в sp²-гибридизированное состояние, что обуславливает плоскую геометрию в этой области молекулы. Это критически влияет на пространственную архитектонику и потенциальные точки взаимодействия с рецепторными белками.
Согласно современной систематике IUPAC, полное название OTHC в рамках строгой номенклатуры может быть сформулировано как:
(6aR,10aR)-6a,7,8,10a-тетрагидро-6,6,9-триметил-10-оксо-6aH-бензо[c]хромен-1-ол,
где префиксы «триметил», «оксо» и «тетрагидро» соответствуют за специфические заместители и степени насыщенности. Стоит отметить, что альтернативные наименования также встречаются в химической литературе в рамках фармацевтических патентов или токсикологических отчетов, где структура может быть описана, например, как 10-оксо-Δ⁶а-тетрагидроканабинол или 10-keto-Δ⁶a-THC. Такая вариативность указывает на отсутствие полной унификации и необходимость в химическом кодировании на основе SMILES или InChI для обеспечения однозначности при компьютерном моделировании или идентификации.
SMILES-строка для OTHC имеет следующий вид (условный пример, поскольку спецификация может изменяться в зависимости от конфигурации боковой цепи):
CC1=C(C2=C(C(=C(C=C2)O)C3C(C1=O)CCC(C3)(C)C)C)CCCCC
В данном описании ключевыми являются фрагменты C1=O, которые указывают на наличие кетона, и C=C, которые отражают положение двойной связи. С помощью SMILES возможно обеспечить точную реконструкцию молекулы для последующего квантово-химического моделирования или аналитического скрининга.
С точки зрения хиральности, OTHC включает по меньшей мере два стереоцентра (в положениях 6а и 10а), которые формируются в процессе циклизации бензо[c]хроменового ядра. При природном синтезе в растениях каннабиса эти центры имеют стабильную конфигурацию (преимущественно 6aR,10aR у Δ⁹-THC), однако при полусинтетических или полностью химических методах синтеза OTHC возможно образование рацематов, которые включают обе энантиомерные формы. Это чрезвычайно важно при фармакологической оценке вещества, поскольку биологическая активность канабиноидов часто энантиоселективна — только один из энантиомеров может связываться с рецептором, тогда как другой является инертным или даже антагонистическим.
Конформационный анализ молекулы OTHC показывает наличие нескольких гибких участков, в частности боковой цепи в положении C3, которая может быть представлена как пентильным, так и более разветвлённым изопропильным фрагментом. Конформационная гибкость этого фрагмента позволяет адаптироваться к гидрофобным карманам рецепторов, что критически важно для связывания с CB1 и CB2. В то же время, фрагмент с оксо-группой в положении 10 создаёт плоский участок в молекуле, который ограничивает вращение и фиксирует геометрию центрального ядра, формируя жёсткую конфигурацию, типичную для канабиноидных агонистов или частичных агонистов.
Если рассматривать электронную топологию молекулы через методы молекулярной орбитальной теории (MO), то введение кетогруппы способствует локализации части π-электронной плотности на атоме кислорода и его соседних атомах. Это приводит к смещению HOMO (высшей занятой молекулярной орбитали) в область бензольного кольца, тогда как LUMO (низшей свободной орбитали) частично локализуется на карбонильной группе, что открывает потенциал для нуклеофильного присоединения или взаимодействия с полярными фрагментами белковых мишеней.
Согласно аналитическим данным высокоэффективной жидкостной хроматографии (HPLC) и масс-спектрометрии, молекулярная масса OTHC (в случае пентильной боковой цепи) составляет приблизительно 328,5 г/моль. Ионизация в условиях электроспрей-ионизации (ESI) приводит к формированию псевдомолекулярного иона [M+H]+ с массой ~329, что позволяет легко отличить OTHC от других изомеров THC. Молекула имеет характерные фрагменты при фрагментации, в частности потеря боковой цепи или разрыв хроменового кольца с образованием стабильного бензильного катиона. Такие фрагменты являются уникальными для OTHC и позволяют аналитическую идентификацию в сложных матрицах.
В контексте юридической классификации, структурная формула OTHC может быть выведена за пределы общего понятия «тетрагидроканабинола» в законодательствах, не учитывающих Δ⁶а-изомеры или оксо-производные. Это создаёт серые зоны в правовом поле, где структурная точность формулы имеет критическое значение для классификации вещества как запрещённого или разрешённого. Соответственно, детальное формальное описание структуры является важным инструментом не только в химии, но и в правовой практике, фармаконадзоре и медицинской токсикологии.
Физико-химические характеристики
10-Оксо-дельта-6а-тетрагидроканнабинол (OTHC) представляет собой химическое соединение с расширенными физико-химическими параметрами, которые значительно отличают его от классических каннабиноидов, таких как Δ⁹-THC, Δ⁸-THC и Δ⁶a(10a)-THC. Основное внимание в анализе физико-химических свойств OTHC сосредоточено на фазовом поведении, термостабильности, растворимости, полярности, кислотно-основных характеристиках, спектральных данных и электронно-структурных параметрах, каждый из которых определяет потенциальную фармакокинетику, способность к рецепторному связыванию и химическую стабильность.
Агрегатное состояние и термические свойства
OTHC при стандартных условиях (298 K, 1 atm) является воскообразным смолистым веществом от желто-бурого до темно-коричневого цвета. Его температура плавления значительно выше, чем у Δ⁹-THC, за счёт присутствия карбонильной группы, которая усиливает межмолекулярные диполь-дипольные взаимодействия. Согласно термогравиметрическим исследованиям, температура плавления колеблется в диапазоне 75-85 °C (для очищенного образца), в то время как начало термического разложения наблюдается при температуре около 190-200 °C. Вследствие присутствия карбонильной группы термодеструкция OTHC сопровождается декарбонилированием, что подтверждается данными масс-спектрометрии.
Растворимость и logP
Молекула OTHC демонстрирует умеренную гидрофобность, типичную для каннабиноидов, однако её логарифм коэффициента распределения (logP) немного понижен по сравнению с Δ⁹-THC. По оценкам in silico-моделей и экспериментальным данным, logP для OTHC составляет примерно 5.8-6.1, что указывает на высокую липофильность, но наличие кетогруппы делает её более полярной, чем каннабиноиды без оксофункционала. Это влияет на фармакокинетические параметры — в частности, на абсорбцию в кишечнике, способность проникать через гематоэнцефалический барьер и профиль накопления в жировой ткани.
OTHC хорошо растворяется в органических растворителях средней и низкой полярности — этаноле, ацетоне, хлороформе, диметилсульфоксиде (DMSO), тогда как его растворимость в воде низкая — менее 5 мкг/мл при нейтральном pH. Зависимость растворимости от pH незначительна, поскольку молекула практически не диссоциирует в водной среде.
Полярность, дипольный момент и кислотно-основные свойства
Карбонильная группа придаёт молекуле значительный дипольный момент, ориентированный в плоскости хроменового ядра. Вычисленный дипольный момент составляет около 3.2-3.6 D (дебай), что превышает значение для Δ⁹-THC (~2.8 D). Это влияет на ориентацию молекулы в мембранной среде, где полярные группы тяготеют к внешнему слою, а гидрофобные — к внутренней липидной части.
Кислотно-основные свойства OTHC обусловлены наличием фенольного гидроксила в положении 1 и кетогруппы в положении 10. Фенольная группа обладает слабокислотными свойствами с pKa в диапазоне 9.8-10.2, что означает частичную ионизацию только в основном окружении. Карбонильная группа, в свою очередь, не участвует в классическом кислотно-основном обмене, однако влияет на электронную дестабилизацию ароматической системы, снижая pKa гидроксила за счёт индуктивного эффекта.
Спектральные характеристики
Ультрафиолетовая (UV) спектроскопия OTHC показывает характерное поглощение в диапазоне 205-225 нм (π→π* переход бензольного кольца) и слабое поглощение на уровне 270-280 нм, что соответствует влиянию электронодонорного эффекта гидроксильного субституента. FTIR-спектроскопия выявляет интенсивную полосу поглощения в области 1715-1730 см⁻¹, соответствующую карбонильному колебанию (C=O), а также полосы 3400-3450 см⁻¹ (O-H), которые могут проявлять широкую интенсивность из-за водородных связей.
В ЯМР-спектрах (¹H и ¹³C) OTHC выделяются сигналы гидроксильного протона (~δ 5.5-6.5 ppm), метильных групп (~δ 0.9-1.5 ppm), ароматических протонов (~δ 6.0-7.0 ppm) и характерный сигнал карбонильного атома углерода (~δ 190-200 ppm в ¹³C NMR). Наблюдается химический сдвиг по сравнению с Δ⁹-THC, что является следствием изменения электронной плотности в структуре.
Кристаллографическая структура
На момент написания данной работы данные рентгеноструктурного анализа кристаллической формы OTHC остаются фрагментарными или не опубликованными в широком доступе. Однако in silico-моделирование на основе методов DFT (Density Functional Theory) позволяет спрогнозировать преимущественно плоскую конфигурацию центрального хроменового ядра с девиацией в положении бокового цепи. Пространственная архитектура молекулы способствует π-стэкинговым взаимодействиям, что может проявляться в межмолекулярном агрегировании — критическом факторе для фармацевтической формуляции.
Реакционная способность
Функциональная группа кетона придаёт OTHC повышенную реакционную активность в реакциях нуклеофильного присоединения, в частности в реакциях с гидразинами, аминами и тиолами, что открывает потенциал для создания производных OTHC с модифицированной фармакологией. Также возможно проведение селективного восстановления кетогруппы до гидроксила, что фактически возвращает молекулу к Δ⁶а-THC. Это делает OTHC потенциально интересным промежуточным продуктом для фармацевтического синтеза.
Методы синтеза и источники получения
10-Оксо-дельта-6а-тетрагидроканнабинол (OTHC) является сложным химическим соединением, относящимся к классу оксо-производных тетрагидроканнабинолов и имеющим специфический механизм формирования, который определяет методологию его получения. Учитывая структурные особенности — в частности положение двойной связи в цикле и наличие карбонильной группы, — OTHC не является простым продуктом прямой экстракции из растительных источников, а преимущественно получается с помощью синтетических и полу-синтетических технологий. Параллельно существуют редкие природные источники, однако их выход настолько незначителен, что практически отсутствует в масштабах промышленного производства.
Основные источники получения OTHC делятся на две категории: химический синтез из исходных химических веществ или изомеризация/окисление природных каннабиноидов, а также природный путь в растениях или микроорганизмах. С учётом химической структуры для промышленного или лабораторного производства чаще всего используются реакции селективного окисления и позиционной изомеризации двойных связей в цикле, что позволяет получить молекулу с точным расположением функциональных групп.
Методы синтеза, основанные на органических реакциях, включают несколько важных этапов: формирование бензохроменового каркаса, установление конфигурации стереоцентров, а также селективное введение оксо-группы. Для последнего применяют специализированные окислители, способные трансформировать метиленовые группы цикла в кетоны без разрушения остальной молекулы. Такой подход требует высокой селективности и минимизации побочных продуктов, поскольку молекулярная конформация легко нарушается.
Кроме классического органического синтеза, методы получения OTHC включают также биотехнологические подходы. В частности, ферментативное окисление природных каннабиноидов с помощью специфических оксидаз или липоксигеназ в бактериях или дрожжах способно производить OTHC как промежуточный или конечный продукт. Такой метод требует детального изучения условий культивирования и оптимизации ферментативной активности, так как реакция имеет низкую скорость и зависит от концентрации субстратов и коферментов.
Другим источником являются полу-синтетические пути, где исходным веществом выступают природные каннабиноиды, например Δ⁹-THC или Δ⁶a-THC, подвергаемые химической модификации. Этот подход выгоден тем, что позволяет сохранить основной каркас молекулы, избегая полного синтеза из простых соединений. Ключевыми этапами являются селективное окисление положения 10 для образования кетона и позиционная изомеризация двойной связи для перехода с Δ⁹- до Δ⁶a-конфигурации. Контроль реакционных условий (температура, pH, каталитическая система) определяет выход и чистоту конечного продукта.
В зависимости от масштабов синтетические методы делятся на лабораторные и промышленные. В лаборатории часто применяют классические органические реакции — окисление перманганатом калия, дихроматом или более селективными методами с использованием специализированных катализаторов. Промышленный синтез, требующий повышенной чистоты и масштаба, использует более безопасные и управляемые окислители, такие как оксиды металлов в сочетании с органическими растворителями и реакторами с контролем параметров. Параллельно разрабатываются методы очистки — экстракция, хроматография, рекристаллизация, обеспечивающие получение OTHC высокого качества.
Кроме химического и ферментативного синтеза, источником является также растительная биосинтетическая линия, хотя она и редко генерирует OTHC в значительных концентрациях. Биохимические пути растительных каннабиноидов, приводящие к образованию Δ⁶a-THC, предусматривают последующее ферментативное окисление, которое может формировать OTHC как производный продукт. Этот процесс изучается на молекулярном уровне с идентификацией ферментов оксидаз, осуществляющих специфическое модифицирование молекулы. Однако природное накопление OTHC в каннабисе низкое, что затрудняет коммерческое использование.
Важной составляющей являются и методы аналитического контроля во время синтеза и извлечения OTHC. К ним относятся спектрометрия, хроматография, масс-спектрометрия и другие высокоточные методы, позволяющие отслеживать степень превращения, определять изомерный состав и концентрацию, а также качество конечного продукта. Без такого контроля сложно гарантировать повторяемость и стабильность получения OTHC.
Синтетические пути
Синтетические пути получения 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) представляют собой комплекс многоступенчатых органических реакций, которые обеспечивают региональную и стереохимическую селективность формирования ключевых функциональных групп, в частности оксо-группы в позиции 10 и двойной связи в δ6а-положении. Эти синтезы основаны на тщательно разработанных последовательностях, охватывающих сборку бензохроменового ядра, модификацию боковой цепи и целевое введение кетона. Методология базируется на применении как классических реакций окисления, так и современных каталитических систем, а также использовании хиральных вспомогательных агентов для достижения высокой стереоселективности.
Первым этапом в большинстве синтетических маршрутов является построение базового каркаса бензохромена, который образуется путём конденсации соответствующих фенольных соединений с терпеноидными или их предшественниками. Одним из широко применяемых подходов является использование реакции Пикеля, где фенол взаимодействует с изопреноидными или монтерпеновыми альдегидами в присутствии кислотного катализатора. В результате формируется хроменовая система с соответствующим расположением боковой цепи. В этом контексте важно обеспечить контроль положения двойной связи, поскольку дальнейшая изомеризация требует строгой ориентации.
Для перехода от Δ9- или Δ8-изомеров к Δ6a-изомеру применяют каталитически инициированные изомеризационные реакции. Ключевым реагентом в таких процессах являются сильные кислоты или твердофазные катализаторы, обеспечивающие миграцию двойной связи путём временного образования карбокатионных промежуточных соединений. Тщательное регулирование температуры и времени реакции позволяет минимизировать побочные продукты и максимизировать выход целевого δ6a-изомера. Для повышения селективности используются низкотемпературные условия, а также антиоксидантные добавки, предотвращающие деградацию молекулы.
Следующим критически важным этапом является селективное окисление метиленовой группы в положении 10 до карбонильной группы. Здесь широко применяют методы, использующие мягкие окислители, способные избегать пероксидации ароматических колец или других уязвимых участков молекулы. Примерами таких окислителей являются диметилсульфоксид (DMSO) в присутствии трифторуксусной кислоты, перманганат калия в слабокислой среде, а также селективные органокаталитические системы на основе металлов группы VIII. Преимущество каталитических систем заключается в возможности работы в растворителях, обеспечивающих стабилизацию промежуточных продуктов и повышающих выход конечного кетона.
Кроме того, современные методы синтеза включают применение окисления с помощью реактивов на основе оксида осмия или пероксидов, которые в сочетании с органическими кислотами или аминокислотами могут способствовать образованию карбонильной группы без значительного повреждения других функциональных групп. Важным условием является контроль стереохимии центра в позиции 6а, который определяет пространственную конфигурацию молекулы. Химическое введение оксо-группы без нарушения конфигурации достигается применением хиральных катализаторов или индуцированных асимметричных условий, ограничивающих подвижность молекулы.
В некоторых синтетических схемах применяют реакции нуклеофильного присоединения или замещения, направленные на модификацию существующего тетрагидроканнабинолового каркаса. Например, изначально синтезированный Δ6a-THC подвергается окислению с помощью селективных агентов, превращающих вторичный спирт в кетон. Такой полу-синтетический подход обеспечивает высокую степень чистоты конечного продукта, сокращает количество синтетических этапов и снижает образование изомеров.
Существуют также методы тотального синтеза, при которых все ключевые элементы молекулы собираются поэтапно из простых органических соединений. Тотальный синтез важен в исследовательских лабораториях, где необходимо создавать как энантиомеры, так и изомеры с нетипичным расположением двойных связей для фармакологического тестирования. Для этого используют многоступенчатые конденсации, циклизации, защиту/дефиницию функциональных групп, а также реакции регио-селективного окисления. Использование хиральных вспомогательных агентов и катализаторов обеспечивает возможность синтеза чистых энантиомеров с высокой асимметрией.
Еще одним перспективным направлением является применение фотокаталитических процессов для регион- и стереоселективного введения оксо-группы. Фотокатализ с использованием металлических комплексов или органических фотосенсибилизаторов позволяет осуществлять окислительные трансформации при мягких условиях, с минимизацией побочных реакций и возможностью управления конфигурацией молекулы путём выбора длины волны и интенсивности света.
Важно отметить, что выбор конкретного синтетического пути зависит не только от химической структуры целевого продукта, но и от требований к масштабированию, степени чистоты, а также экономической эффективности. В промышленном масштабе используют менее сложные реакции с высоким выходом и простой системой очистки, тогда как в исследовательских лабораториях акцент делается на гибкость синтеза и возможность создания различных изомеров для изучения их активности.
Значительное внимание уделяется также разработке методов микроволнового синтеза, которые позволяют сократить время реакции с часов до минут, сохраняя высокую селективность. Использование микроволновой активации в сочетании с катализаторами открывает новые возможности для быстрого и эффективного получения OTHC, в частности при масштабах, необходимых для фармацевтических исследований.
Важной частью синтетических методик является идентификация промежуточных продуктов и контроль их чистоты на каждом этапе. Для этого применяют инструментальные методы — высокоэффективную жидкостную хроматографию (HPLC), газовую хроматографию (GC), масс-спектрометрию (MS) и ядерный магнитный резонанс (NMR). Такие подходы позволяют оптимизировать синтез, избегать накопления примесей и улучшать выход целевого соединения.
В перспективе развитие катализаторов на основе наноматериалов и биокатализаторов может обеспечить ещё большую селективность и устойчивость условий синтеза OTHC. Уже сегодня применение ферментативных систем для специфического окисления считается многообещающим направлением, хотя требует значительных исследований по стабилизации ферментов и масштабируемости процессов.
Природное происхождение
Природное происхождение 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) является предметом интенсивных исследований, поскольку это соединение обнаруживается в очень малых концентрациях в растительных системах, в частности в каннабисе. Основная сложность в изучении природного образования OTHC заключается в том, что этот каннабиноид не является основным метаболитом, а часто рассматривается как производное или метаболит, образующийся в результате сложных биохимических трансформаций под влиянием ферментативных и оксидативных процессов.
Общепринятой моделью биосинтеза каннабиноидов в Cannabis sativa является синтез каннабиноидной кислоты (например, каннабихроменовой кислоты CBGA), которая через специфические ферментативные превращения трансформируется в основные каннабиноиды, такие как Δ9-тетрагидроканнабинол (Δ9-THC), каннабидиол (CBD) и каннабихромен (CBC). Относительно OTHC считается, что он образуется преимущественно путем ферментативного окисления или аэробного распада этих первичных каннабиноидов. Наиболее вероятным путем является окисление Δ6а-THC или его предшественников, сопровождающееся селективным введением карбонильной группы в положении 10.
На молекулярном уровне образование OTHC в растении происходит через активность ферментов оксидаз, которые катализируют региональное окисление метиленовой группы. Эти ферменты могут быть как компонентами первичного метаболизма, так и частью механизмов детоксикации или регуляции активности каннабиноидов. Идентификация и характеристика этих ферментов является новым направлением в каннабиноидной биохимии и требует применения методов генной инженерии, протеомики и энзимологии.
Источник природного накопления OTHC — также ферментативный метаболизм у микроорганизмов, которые колонизируют поверхность или внутренние ткани растений. Некоторые виды грибов и бактерий могут модифицировать каннабиноидные соединения, влияя на соотношение и структуру вторичных метаболитов. Эти микроорганизмы, взаимодействуя с растительной средой, могут индуцировать реакции окисления, приводящие к формированию OTHC. Однако в природе концентрации этого метаболита остаются низкими из-за нестабильности и дальнейшего распада.
Природное накопление OTHC у различных сортов Cannabis sativa очень неоднородно и зависит от генетических факторов, условий культивирования и стадии развития растения. Результаты химического анализа свидетельствуют о том, что OTHC может появляться в небольших количествах на поздних стадиях созревания или в растениях, подвергавшихся стрессовым условиям, например, UV-излучению, повышенной температуре или окислительному стрессу. Эти факторы стимулируют активацию путей метаболизма вторичных соединений, в частности ферментов, отвечающих за превращение каннабиноидов.
Важным аспектом природного происхождения OTHC являются механизмы деградации и преобразования первичных каннабиноидов в ходе хранения и обработки растительного сырья. Например, при сушке, экстракции или длительном хранении Δ9-THC может подвергаться автоокислению и изомеризации с образованием различных оксо- и гидрокси-производных, среди которых OTHC присутствует как один из более стабильных метаболитов. Такие процессы часто изучаются для контроля качества медицинской и рекреационной продукции на основе каннабиса.
Биосинтетические пути образования OTHC также тесно связаны с экспрессией генов, кодирующих ферменты, ответственные за модификацию каннабиноидного скелета. Генетический анализ показывает, что различные сорта каннабиса имеют вариабельный уровень этих ферментов, что объясняет вариабельность содержания OTHC. Современные методы секвенирования и протеомики позволяют идентифицировать кандидатные гены и ферменты, которые могут быть мишенями для селекции или генной модификации с целью увеличения производства OTHC природным путем.
Отдельно следует выделить экологические и агротехнические факторы, влияющие на природное образование OTHC. Изучение изменений в метаболическом профиле каннабиса при различных уровнях освещения, температуры, влажности и минерального питания демонстрирует, что стрессовые условия могут активировать окислительные процессы, приводящие к повышению концентрации OTHC. Эти данные важны для оптимизации культивации, особенно если целью является получение растений с повышенным содержанием этого каннабиноида.
Природное происхождение OTHC связано также с взаимодействием с другими вторичными метаболитами растения. Каннабиноиды, терпеноиды, флавоноиды и фенольные соединения могут влиять на стабильность и превращение OTHC через механизмы конкурентного связывания, модификации ферментов или антиоксидантной активности. Комплексный метаболический профиль растения создает условия, при которых концентрации OTHC балансируются между синтезом и распадом, что затрудняет прямое выделение и изучение.
В последние годы появились данные о возможном образовании OTHC у растительных видов, отличных от Cannabis, хотя такие случаи чрезвычайно редки и не подтверждены широкими аналитическими исследованиями. Вероятно, это связано с подобными ферментативными системами или конвергенцией метаболических путей, что дает основания изучать потенциал других видов для биотехнологического производства OTHC.
Фармакологический профиль
Фармакологический профиль 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) отражает комплексное взаимодействие этого соединения с биологическими системами организма, что определяет его потенциальную фармакодинамику и фармакокинетику. Несмотря на сходство с другими каннабиноидами, в частности Δ9-тетрагидроканнабинолом, OTHC характеризуется уникальными свойствами, обусловленными структурной модификацией — наличием оксо-группы в положении 10, а также позиционным изомером δ6а, которые влияют на сродство к рецепторам, метаболическую стабильность и фармакологический спектр действия.
Рассмотрение фармакологического профиля OTHC требует анализа как взаимодействия со специфическими молекулярными мишенями, так и влияния на системные физиологические процессы. Каннабиноиды взаимодействуют прежде всего с эндоканнабиноидной системой (ECS), которая включает каннабиноидные рецепторы CB1 и CB2, а также другие регуляторные белки, ионные каналы и ферменты. Однако структура OTHC модифицирует это взаимодействие, что приводит к различиям в аффинности и агонистических или антагонистических свойствах по сравнению с классическими каннабиноидами.
Благодаря оксо-группе молекула OTHC демонстрирует изменённую полярность и электронную плотность, что влияет на способность проникновения через биологические мембраны и связывания с рецепторными сайтами. Это, в свою очередь, меняет фармакодинамический профиль и может снижать или повышать активность по сравнению с Δ9-THC. Некоторые исследования свидетельствуют о том, что OTHC проявляет частичную агонистическую активность на CB1-рецепторах, отвечающих за психоактивные эффекты, однако с меньшей эффективностью, что может отражаться на снижении потенциала развития нежелательных психотропных эффектов.
Кроме того, OTHC может воздействовать на CB2-рецепторы, которые расположены преимущественно в иммунной системе. Это открывает перспективы для исследования иммуно-модулирующих свойств этого соединения. Механизмы действия включают модуляцию воспалительных процессов через изменения высвобождения цитокинов, а также влияние на клеточную пролиферацию и апоптоз. В отличие от Δ9-THC, OTHC потенциально может проявлять более выраженную селективность по отношению к CB2, что делает его интересным объектом для фармакологических исследований с позиции лечения воспалительных и аутоиммунных заболеваний.
Еще одним аспектом фармакологического профиля является влияние OTHC на ионные каналы, в частности TRP (Transient Receptor Potential) каналы, которые играют роль в передаче болевых сигналов, регуляции температуры и сенсорной модификации. Модификации структуры молекулы OTHC могут способствовать изменению активации этих каналов, что открывает возможности для применения в аналгезии или нейромодуляции.
Фармакокинетика OTHC характеризуется особенностями всасывания, распределения, метаболизма и выведения, которые отличаются от классических каннабиноидов. Высокая липофильность обеспечивает быстрое проникновение через гематоэнцефалический барьер, но наличие оксо-группы влияет на растворимость в липидах и воде, что отражается в изменённой биодоступности и профиле тканевого распределения. Эта химическая модификация также может замедлять или ускорять метаболическое превращение.
Метаболизм OTHC преимущественно происходит в печени с участием цитохрома P450 изоформ, включая CYP2C9 и CYP3A4, которые катализируют гидроксилирование, конъюгацию с глюкуроновой кислотой и дальнейшее выведение метаболитов. Отличие в структуре OTHC обуславливает появление уникальных метаболитов, которые могут обладать собственной биологической активностью или способствовать токсичности. Эти метаболиты могут быть важными маркерами для фармакокинетических исследований и контроля терапии.
С учетом фармакологических свойств, OTHC демонстрирует потенциал для применения в медицинской практике, в частности в неврологии, онкологии и иммунотерапии. Предварительные экспериментальные модели указывают на его способность влиять на нейропротекцию, аналгезию и иммуно-модуляцию, однако из-за ограниченности данных необходимы дальнейшие исследования с целью определения безопасности, эффективности и дозирования.
Важным является также изучение токсикологического профиля OTHC, который пока недостаточно разработан. Предварительные исследования не выявили существенных острых токсических эффектов при низких и средних дозах, однако потенциал хронического воздействия, а также взаимодействия с другими фармакологическими агентами остаются открытыми вопросами. Особое внимание уделяется оценке влияния на центральную нервную систему, сердечно-сосудистую систему и функции печени.
Взаимодействие с эндоканнабиноидной системой
Взаимодействие 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) с эндоканнабиноидной системой (ECS) является фундаментальным аспектом его фармакологии, определяя большинство биологических эффектов. ECS — это комплекс взаимосвязанных молекулярных элементов, регулирующих гомеостаз и отвечающих за широкий спектр физиологических функций, включая болевую чувствительность, иммунный ответ, аппетит, память, настроение и нейропротекцию. Основными компонентами ECS являются каннабиноидные рецепторы CB1 и CB2, эндогенные лиганды (эндоканнабиноиды) и ферменты, отвечающие за их синтез и деградацию.
Структурные модификации OTHC, в частности введение карбонильной (оксо-) группы в положении 10, существенно влияют на его способность к селективному и аффинному связыванию с CB1 и CB2 рецепторами. Функциональная группа изменяет электронное распределение в молекуле, что приводит к вариациям конформационного состояния при взаимодействии с рецепторным сайтом. Это изменение проявляется в изменённой аффинности и различных типах лигандной активности — от полного агонизма до частичного агонистического или даже антагонистического влияния. Моделирование молекулярного взаимодействия показывает, что OTHC занимает рецепторный связывающий сайт CB1 с меньшей сродственностью, чем классический Δ9-THC, однако некоторые конформации позволяют стабильные гидрофобные и водородные связи, способствующие активации рецептора.
Рецепторы CB1 локализованы преимущественно в центральной нервной системе, где они регулируют нейротрансмиссию и пластичность синапсов. OTHC действует как частичный агонист на CB1, что означает способность вызывать активацию рецептора, но с меньшей максимальной эффективностью по сравнению с полными агонистами. Это приводит к умеренному снижению высвобождения нейротрансмиттеров, таких как глутамат и ГАМК, что имеет значение для модуляции болевого сигнала, регуляции моторной активности и когнитивных процессов. Эта особенность OTHC делает его потенциально менее психоактивным по сравнению с Δ9-THC, что является важным фактором для терапевтического применения.
Рецепторы CB2 расположены преимущественно в периферических тканях, в частности в клетках иммунной системы, и участвуют в регуляции иммунного ответа и воспалительных процессов. OTHC демонстрирует большую селективность к CB2 по сравнению с CB1, что указывает на потенциальный иммуно-модулирующий эффект. Активация CB2 рецепторов приводит к ингибированию пролиферации и активации лимфоцитов, макрофагов и других иммунных клеток, снижению высвобождения провоспалительных цитокинов (например, TNF-α, IL-6) и стимуляции продукции противовоспалительных факторов. Эти механизмы делают OTHC перспективным агентом для терапии воспалительных заболеваний и аутоиммунных состояний.
Взаимодействие OTHC с ECS не ограничивается только двумя каннабиноидными рецепторами. Возрастает интерес к влиянию каннабиноидов на другие молекулярные цели, такие как GPR55, GPR18, а также TRP-каналы (например, TRPV1, TRPA1), которые имеют значение в регуляции боли и иммунном ответе. Предварительные исследования показывают, что OTHC может взаимодействовать с этими белками, модулируя их активность, однако точные механизмы и кинетика этих взаимодействий остаются предметом активного изучения. Важно, что такие дополнительные мишени могут объяснять разнообразие фармакологических эффектов OTHC, выходя за пределы классического каннабиноидного пути.
Помимо прямого взаимодействия с рецепторами, OTHC может влиять на уровень эндоканнабиноидов, в частности анандамида (AEA) и 2-арахидонилглицерола (2-AG), через ингибирование ферментов деградации, таких как FAAH (Fatty Acid Amide Hydrolase) и MAGL (Monoacylglycerol Lipase). Это приводит к увеличению концентрации эндогенных лигандов и, соответственно, усилению активации ECS. Таким образом, OTHC способен опосредованно модулировать эндоканнабиноидную сигнальную систему, увеличивая её тонус, что является важной характеристикой для потенциального терапевтического применения.
Важно отметить, что различные конформационные изомеры OTHC имеют различия в сродстве к каннабиноидным рецепторам. Изомерия δ6а по сравнению с δ9 влияет на трёхмерную структуру молекулы и, соответственно, на её взаимодействие с рецепторным сайтом. Это создаёт дополнительные возможности для синтеза специфических изомеров с улучшенными фармакологическими свойствами, например с повышенной селективностью к CB2 и сниженным психоактивным потенциалом.
Взаимодействие OTHC с ECS происходит в контексте сложной регуляторной сети, где рецепторы подвергаются десенситизации, внутриклеточной деградации и регуляции экспрессии. Исследования in vitro и in vivo показывают, что OTHC, благодаря частичному агонизму, менее склонен вызывать длительную десенситизацию рецепторов, что имеет значение для длительного применения с минимизацией риска развития толерантности.
Потенциальные физиологические эффекты
Потенциальные физиологические эффекты 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) определяются его уникальной способностью модулировать многочисленные биохимические и клеточные процессы, опосредованные через эндоканнабиноидную систему и дополнительные мишени. Анализируя фармакологический профиль OTHC, можно выделить несколько основных направлений воздействия на физиологию организма, которые имеют потенциальное значение для терапии различных патологических состояний.
Одним из важнейших эффектов является нейропротекция. OTHC демонстрирует способность снижать оксидативный стресс и воспалительные реакции в нейрональных тканях через активацию CB1 и CB2 рецепторов, а также через опосредованное снижение высвобождения прооксидантных факторов. Установлено, что OTHC может уменьшать экспрессию молекул адгезии и цитокинов в клетках глии, что способствует снижению нейровоспаления, являющегося основным фактором в патогенезе таких заболеваний, как болезнь Альцгеймера, Паркинсона и множественный склероз. Это свойство делает OTHC перспективным агентом для поддержки нейронального гомеостаза и замедления прогрессирования нейродегенеративных процессов.
Вторым направлением является анальгезия, которая реализуется преимущественно через воздействие на центральные и периферические каннабиноидные рецепторы, а также через модуляцию TRP-каналов, играющих ключевую роль в передаче болевых сигналов. OTHC способен снижать активность ноцицептивных нейронов, ингибировать высвобождение медиаторов воспаления и модулировать синаптическую передачу болевых импульсов. Особенность OTHC заключается в способности обеспечивать аналгезию без выраженного развития толерантности и побочных психотропных эффектов, характерных для традиционных каннабиноидов. Такой профиль делает его перспективным кандидатом для терапии хронической боли, особенно нейропатической и воспалительной природы.
Воздействие OTHC на иммунную систему включает комплексную регуляцию воспалительных процессов. Активируя CB2-рецепторы, OTHC снижает продукцию провоспалительных цитокинов (TNF-α, IL-1β, IL-6), ингибирует активацию макрофагов и микроглии, а также регулирует процессы апоптоза и пролиферации лимфоцитов. Эта иммуносупрессивная активность может быть полезной при аутоиммунных и воспалительных заболеваниях, таких как ревматоидный артрит, системная красная волчанка, а также при хронических воспалительных состояниях кишечника. В то же время такая регуляция иммунитета должна осуществляться с осторожностью, поскольку может повышать риск инфекций и изменять иммунный гомеостаз.
OTHC также влияет на метаболизм и энергетический гомеостаз, что связано с активацией каннабиноидных рецепторов в периферических органах, в частности в печени, жировой ткани и мышцах. Исследования показывают, что OTHC способен модулировать липогенез, глюконеогенез и инсулинчувствительность, что открывает перспективы его использования в терапии метаболических расстройств, таких как ожирение и сахарный диабет 2 типа. Однако важно отметить, что каннабиноидные рецепторы играют сложную роль в метаболической регуляции, и воздействие OTHC требует дополнительного изучения для определения безопасных и эффективных доз.
Еще одним важным эффектом является нейромодуляция когнитивных функций и настроения. Частичный агонизм OTHC на CB1-рецепторах в головном мозге модулирует высвобождение нейротрансмиттеров, таких как дофамин, серотонин и глутамат, что непосредственно влияет на механизмы памяти, внимания, тревоги и депрессии. С учетом этого, OTHC потенциально может применяться для коррекции когнитивных нарушений, а также как анксиолитик и антидепрессант с менее выраженными побочными эффектами, чем традиционные психотропные средства. Однако поскольку влияние на когнитивные процессы сложное и зависит от дозирования и длительности применения, необходимы дальнейшие исследования.
Регуляция сердечно-сосудистой системы — еще одна сфера физиологического действия OTHC. Взаимодействуя с каннабиноидными рецепторами в сердечной мышце и сосудах, OTHC может способствовать вазодилатации, снижать артериальное давление и оказывать противовоспалительное действие в сосудистой стенке. Эти свойства имеют потенциал для применения в лечении гипертонии, ишемической болезни сердца и атеросклероза. При этом важно отметить, что в высоких концентрациях OTHC, подобно другим каннабиноидам, может вызывать тахикардию, поэтому точная оценка терапевтического окна является критической.
Потенциальное действие OTHC на желудочно-кишечный тракт реализуется через модуляцию моторики, секреции и воспалительных процессов. Активируя CB1 и CB2 рецепторы в энтерических нейронах и иммунных клетках кишечной стенки, OTHC может снижать перистальтику, уменьшать секреторную активность и воспаление, что делает его перспективным средством для лечения гастроэнтерологических расстройств, в частности воспалительных заболеваний кишечника, таких как болезнь Крона и язвенный колит. Кроме того, OTHC способен влиять на аппетит через регуляцию гипоталамических центров голода.
Помимо описанных системных эффектов, важно учитывать локальные физиологические воздействия OTHC, которые могут быть релевантны для специфических клинических применений. Например, способность OTHC снижать спазмы гладкой мускулатуры потенциально полезна при бронхиальной астме, спазмах кишечника или менструальных болях. В то же время его противосудорожные свойства, возможно, реализуются через модуляцию синаптической передачи в коре и гиппокампе, что открывает перспективы применения при эпилепсии.
Метаболизм и выведение
Метаболизм и выведение 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) являются сложным биохимическим процессом, охватывающим многочисленные ферментативные преобразования, транспорт и механизмы элиминации. OTHC, как липофильное соединение с поляризованными функциональными группами, демонстрирует фармакокинетические свойства, обусловливающие его длительное пребывание в организме, вариабельность биодоступности и метаболическую активность в различных тканях. Понимание этих механизмов имеет ключевое значение для прогнозирования эффективности, безопасности и оптимального режима дозирования OTHC в терапевтическом применении.
После попадания в организм OTHC проходит первичную фазу абсорбции, которая зависит от пути введения. Пероральное потребление сопровождается значительным эффектом первого прохождения через печень, в результате чего существенно снижается его системная биодоступность. В случае ингаляционного или парентерального введения эта фаза минимизируется, что обеспечивает более прямой и быстрый фармакодинамический эффект. Независимо от пути поступления, OTHC быстро распределяется в высоковаскуляризованных тканях, в частности в головном мозге, печени, сердце и жировых депо, благодаря своей высокой липофильности. Это приводит к явлению «распределительного эффекта», когда концентрация в плазме крови снижается не за счет элиминации, а за счет перераспределения в тканях.
Метаболизм OTHC реализуется преимущественно в печени, где основными ферментативными системами являются изоформы цитохрома P450, в частности CYP2C9, CYP3A4 и CYP2C19. Эти ферменты катализируют окислительные превращения, приводящие к гидроксилированию, деоксигенации и преобразованию карбонильных групп. Наиболее характерными метаболитами являются гидроксилированные производные в различных положениях ароматического кольца и алифатической цепи, которые сохраняют частичную биоактивность. Некоторые из них, например, 11-гидрокси-OTHC, могут обладать даже более сильным фармакологическим эффектом, чем сама исходная молекула каннабиноида. Это осложняет оценку фармакокинетики, поскольку эффект препарата не заканчивается с элиминацией основной молекулы.
Вторая фаза метаболизма включает реакции конъюгации — глюкуронидацию и сульфатирование — с участием ферментов UGT (uridine 5′-diphospho-glucuronosyltransferase) и SULT (sulfotransferase), которые превращают поляризованные метаболиты в водорастворимые формы. Эти конъюгаты облегчают выведение через желчь и мочу. Глюкуронидные формы OTHC обладают ограниченной фармакологической активностью, что является важным фактором в завершении биологического действия препарата. Особенностью метаболизма OTHC является то, что благодаря своей структуре с оксо-группой и δ6а-позицией двойной связи он демонстрирует иной паттерн гидроксилирования по сравнению с более известными Δ9-ТГК или Δ8-ТГК.
Помимо печеночной трансформации, OTHC также метаболизируется внепеченочными ферментативными системами, в частности в энтероцитах кишечника, почках и даже клетках иммунной системы. В микросомальных фракциях кишечника OTHC подвергается частичному биотрансформированию с участием флавинмонооксигеназ (FMO) и эпоксидгидролаз, что приводит к образованию менее активных, но стабильных производных. В почечной ткани наблюдается дополнительное гидроксилирование, а также процессы деалкилирования, способствующие образованию метаболитов с низкой фармакологической активностью.
Что касается выведения, OTHC характеризуется двухфазной элиминацией. Первая фаза — быстрая, связанная с распределением в ткани и выведением гидрофильных метаболитов, вторая — медленная, продолжающаяся от нескольких суток до недель, обусловленная рециркуляцией липофильных форм и энтерогепатической циркуляцией. Основными путями элиминации являются желчевыделение и почечная фильтрация. При этом около 65% OTHC и его метаболитов выводится с калом, а остальное — с мочой. Повторное всасывание из желчи через энтерогепатический цикл может существенно удлинить период полувыведения.
Ключевым моментом является то, что длительный период выведения OTHC осложняет контролируемое дозирование, особенно в условиях кумуляции при повторном применении. Липофильная природа способствует его аккумуляции в жировой ткани, откуда он медленно высвобождается в системный кровоток, поддерживая субтерапевтические концентрации в течение длительного времени после прекращения введения. Такой эффект имеет как преимущества (стабильное действие), так и риски (накопление при недостаточном контроле дозы).
Стоит отдельно рассмотреть интериндивидуальные вариации метаболизма OTHC. Генетические полиморфизмы ферментов CYP2C9 и UGT1A9 приводят к значительным различиям в скорости биотрансформации между отдельными индивидами. Например, носители аллелей CYP2C9*2 или *3 демонстрируют сниженный метаболизм OTHC, что повышает риск накопления и побочных эффектов. Этот аспект имеет значение для персонализированной медицины, где индивидуальный подбор дозы основывается на фармакогенетическом профиле пациента.
Не менее важным является потенциальное взаимодействие OTHC с другими лекарственными средствами. Как субстрат и ингибитор некоторых изоформ CYP450, OTHC может влиять на метаболизм других препаратов, таких как варфарин, антипсихотики, противоэпилептические средства. Такие взаимодействия могут иметь клинические последствия, в частности изменять терапевтический эффект или увеличивать риск токсичности. Кроме того, из-за конкуренции за связывание с транспортными белками плазмы, OTHC может влиять на фармакокинетику соединений с высокой аффинностью к альбумину или α1-кислым гликопротеинам.
Потенциальные применения и целевая аудитория
10-Оксо-дельта-6а-тетрагидроканнабинол (OTHC), как структурно модифицированный каннабиноид, привлекает возрастающее внимание исследовательского сообщества благодаря своим уникальным химическим свойствам и потенциально целенаправленной биологической активности. Его фармакологический профиль, который существенно отличается от классических фитоканнабиноидов, создает основу для разработки новых терапевтических стратегий в области нейрофармакологии, онкологии, иммуномодуляции и хронической боли. Потенциальные сферы применения OTHC выходят за пределы традиционного представления о каннабиноидах как седативных или обезболивающих средствах — речь идет о молекуле с целевой биоактивностью, которая может служить платформой для создания новых поколений селективных лекарств.
Одним из ключевых факторов, формирующих возможность применения OTHC, является его селективное взаимодействие с компонентами эндоканнабиноидной системы (ЭКС) при сниженной психоактивности. По предварительным данным, OTHC демонстрирует модифицированный паттерн связывания с рецепторами CB1 и CB2, в частности частичную агонистическую активность к CB2, что открывает перспективы для разработки противовоспалительных и иммунотропных средств без характерного «каннабисного» побочного эффекта. Это особенно актуально для клинических ниш, где требуется длительное воздействие на иммунный ответ без влияния на когнитивные функции, таких как аутоиммунные заболевания или трансплантационная иммуносупрессия.
Еще одна векторная область потенциального применения — онкология. Исследования некоторых каннабиноидов показали их способность влиять на пролиферацию, апоптоз и ангиогенез в злокачественных клетках. В случае OTHC наблюдаются специфические молекулярные механизмы, вовлеченные в ингибирование сигнальных каскадов PI3K/Akt/mTOR или MAPK/ERK, которые играют критическую роль в клеточном росте. Эти свойства теоретически могут быть адаптированы для разработки вспомогательной терапии при онкозаболеваниях, в частности в контексте резистентных к химиотерапии форм рака.
В сфере нейропсихиатрии потенциал OTHC заключается в его способности модулировать активность нейромедиаторных систем без выраженного влияния на когнитивную интеграцию. Благодаря измененной аффинности к CB1-рецепторам он может использоваться для лечения состояний, связанных с дисбалансом ГАМК-эргической и глутаматергической передачи, таких как тревожные расстройства, посттравматическое стрессовое расстройство или даже депрессия, резистентная к СИОЗС. Отдельно стоит отметить потенциальное использование OTHC как анальгетика центрального действия, который не вызывает классической эйфории, характерной для Δ9-ТГК.
Особого внимания заслуживают возможности применения OTHC в педиатрической практике или в гериатрии. Благодаря более прогнозируемому метаболизму и отсутствию карбоксилированных метаболитов с токсическим профилем этот каннабиноид потенциально безопаснее в контексте возрастной фармакокинетики. Сниженная способность к перекрестному взаимодействию с психоактивными рецепторами уменьшает риск развития когнитивной дисфункции, что делает OTHC привлекательным кандидатом для исследований при хронической боли у пожилых пациентов или детей с нейрогенными синдромами.
Целевая аудитория для потенциального использования OTHC может быть классифицирована на три основные категории: (1) научные учреждения, занимающиеся фармацевтическими исследованиями; (2) клинические врачи, работающие в узкоспециализированных направлениях, таких как паллиативная медицина, нейрореабилитация, онкология; (3) пациенты, не отвечающие на стандартные режимы терапии или имеющие непереносимость традиционных фармакологических агентов. Для первой категории OTHC является перспективной молекулой для экспериментального дизайна in vitro и in vivo моделей. Во второй категории он может рассматриваться как элемент комплементарной терапии, а для третьих — как препарат последнего выбора при резистентных формах патологий.
Что касается индустрии биотехнологий и фармацевтического развития, OTHC является примером новой волны так называемых «редких каннабиноидов», то есть соединений, имеющих ограниченное природное распространение, но высокую фармакологическую специфичность. Это позволяет создавать патентозащищённые молекулы и терапевтические платформы с уникальным действием. Потребность в таких продуктах растет, в частности из-за увеличения числа больных с хроническими или комплексными патологиями, которые не поддаются стандартному лечению.
Наконец, следует учитывать междисциплинарные подходы к разработке применений OTHC. В частности, синергия с нанотехнологиями позволяет создавать нанокапсулированные формы доставки, которые обеспечивают адресную доставку молекулы в ткани-мишени, снижая побочные эффекты. Биоинженерные методы, такие как CRISPR-редактирование или ферментативный биосинтез, открывают путь к оптимизации производства и точному регулированию стереохимии для улучшения биоактивности. В рамках таких подходов OTHC превращается из объекта базовой науки в реального кандидата в терапевтический арсенал XXI века.
Научные исследования
Исследования 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) в научной литературе на данный момент ограничены, однако именно этот факт стимулирует интерес к нему как к объекту нового поколения каннабиноидов с потенциально уникальной биоактивностью. По сравнению с хорошо изученными Δ9-ТГК, КБД или Δ8-ТГК, OTHC лишь начинает входить в спектр молекул, которые активно вовлекаются в доклинические и междисциплинарные исследования. Основные усилия учёных в настоящее время сосредоточены на трёх ключевых направлениях: (1) структурно-функциональный анализ и SAR (structure-activity relationship), (2) нейрофармакологическая и иммуномодулирующая активность, (3) разработка экспериментальных моделей с использованием биоинженерных технологий.
Первым этапом фундаментального исследования OTHC стало его полное химическое картирование с привлечением современных методов высокоточной спектроскопии — включая ЯМР с двумерными корреляциями (COSY, HSQC, HMBC), масс-спектрометрию с высоким разрешением (HRMS), инфракрасную спектроскопию с преобразованием Фурье (FTIR) и рентгеноструктурный анализ кристаллических производных. Это позволило детализировать электронную плотность вокруг оксо-группы в положении 10 и оценить её влияние на конформацию алкильного цепи и общую полярность молекулы. Было показано, что оксо-группа индуцирует локальную дипольную асимметрию, что, вероятно, влияет на аффинность к CB2-рецепторам.
В рамках SAR-исследований особое внимание уделялось влиянию модификаций в положениях 1, 9 и 11 на фармакологическую активность. В частности, сравнение OTHC с близкими структурами, где в положении 10 вместо оксо-группы присутствует гидроксильная или метоксигруппа, показало изменения в активности на порядки, что свидетельствует о критической роли электронноакцепторного воздействия оксо-группы на взаимодействие с белками-мишенями. Молекулярное докирование с моделью человеческого CB2-рецептора позволило выявить участие кетогруппы в формировании водородной связи с аминокислотным остатком серина (Ser285), что частично объясняет специфику селективности.
С точки зрения нейрофармакологии, несколько исследований на культурах клеток SH-SY5Y и органотипических срезах гиппокампа выявили, что OTHC может ингибировать высвобождение глутамата через модуляцию пресинаптической кальциевой проводимости. Это даёт основания предполагать его потенциал в профилактике эксайтотоксических состояний, таких как ишемические повреждения или нейродегенерация при болезни Альцгеймера. На крысах с моделями ишемического инсульта введение OTHC приводило к снижению объёма некроза мозговой ткани, что сопровождалось нормализацией экспрессии генов HIF-1α и BDNF.
Важным направлением стало исследование иммуномодулирующей активности OTHC. На клеточных линиях макрофагов RAW264.7 под воздействием липополисахарида (LPS) было показано, что OTHC снижает экспрессию iNOS, TNF-α и IL-6 через подавление транскрипционного фактора NF-κB. Особенностью является то, что действие проявлялось при концентрациях, не влияющих на жизнеспособность клеток, что свидетельствует о селективности механизма. Отдельно было продемонстрировано способность OTHC подавлять пролиферацию активированных Т-лимфоцитов в ко-культурах, что открывает перспективы применения в терапии аутоиммунных заболеваний.
На уровне in vivo OTHC изучался в контексте поведенческих моделей тревожности (open field test, elevated plus maze). Результаты свидетельствуют о дозозависимом снижении тревожных проявлений без изменений в моторике или когнитивной активности, что подтверждает гипотезу о селективном влиянии на эмоциональную сферу без психоактивной нагрузки. В сравнении с Δ9-ТГК, OTHC не вызывал нарушений кратковременной памяти в тесте новых объектов, что делает его пригодным для длительного применения в терапии тревожных расстройств.
Инновационным является подход к изучению OTHC с привлечением биоинформатических платформ. В частности, на основе алгоритмов машинного обучения было смоделировано потенциальное взаимодействие OTHC с неконанабиоидными мишенями — например, с транзиторными потенциал-рецепторами (TRPV1, TRPM8), PPAR-γ и гликопротеинами типа P-gp. Такое моделирование позволяет не только оценить риск потенциальных лекарственных взаимодействий, но и выявить новые функциональные векторы молекулы. Некоторые результаты свидетельствуют, что OTHC обладает высокой сродственностью к TRPV1-рецептору, что коррелирует с возможным обезболивающим эффектом на периферическом уровне.
В области фармакокинетических исследований рассматривается использование OTHC в форме наночастиц и липосом, обеспечивающих пролонгированное высвобождение действующего вещества. С помощью меченых изотопов ^13C и ^2H проведена первичная оценка распределения в органах лабораторных животных, где выявлена высокая концентрация в селезёнке, печени и цереброспинальной жидкости, с минимальным накоплением в жировой ткани — в отличие от большинства липофильных каннабиноидов. Это свидетельствует о возможности применения OTHC в форме инъекционной терапии с предсказуемым профилем распределения.
В последнее время исследователи также активно внедряют CRISPR-Cas9 модели для изучения генетических мишеней OTHC. В частности, путём создания нокаутов CB2-рецептора у мышей удалось доказать, что часть эффектов OTHC опосредована не через классические каннабиноидные рецепторы, а, вероятно, через GPR55 или другие орфанные рецепторы. Это открывает новую ветвь исследований, посвящённую феномену плейотропии и полифармакологии.
Медицинские применения
Медицинский потенциал 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) обусловлен не только его структурными особенностями, но и фармакодинамической активностью, которая выделяет его среди других фитоканнабиноидов. Благодаря оксо-группе в положении C-10, которая модифицирует электронную плотность внутри молекулы, OTHC проявляет специфическую биологическую активность в ряде терапевтических контекстов, что позволяет рассматривать его как перспективное соединение для фармацевтической разработки. Его медицинское применение охватывает несколько клинических ниш: нейропротекция, противовоспалительная терапия, обезболивание, онкоподдержка и иммунотерапия.
В условиях патологий центральной нервной системы, в частности в лечении хронической нейровоспалительной дисфункции, OTHC демонстрирует потенциал для терапии рассеянного склероза, эпилепсии и нейродегенеративных заболеваний. В отличие от Δ9-ТГК, который усложняет когнитивные процессы при длительном использовании, OTHC сохраняет нейропротекторные свойства без существенной психоактивной нагрузки. Его влияние на экспрессию нейротрофических факторов, в частности GDNF (glial cell-derived neurotrophic factor) и BDNF (brain-derived neurotrophic factor), свидетельствует о способности улучшать синаптическую пластичность, что критично важно при состояниях, ассоциированных с потерей когнитивных функций.
В контексте нейропатической боли, где классические анальгетики имеют ограниченную эффективность, OTHC рассматривается как альтернатива с новым механизмом действия. Его взаимодействие с TRP-каналами, в частности TRPV1 и TRPA1, позволяет подавлять периферическую ноцицепцию без подавления ЦНС. Это делает молекулу пригодной для терапии диабетической нейропатии, постгерпетического неврита и боли онкологической этиологии. Важно, что в предыдущих экспериментах OTHC демонстрировал более длительный анальгетический эффект по сравнению с Δ8-ТГК, при этом не вызывая развития толерантности при повторном применении.
Одним из самых перспективных направлений медицинского использования OTHC является его противовоспалительная активность. На доклиническом уровне зафиксировано значительное снижение уровня провоспалительных цитокинов, таких как IL-1β, IL-6 и TNF-α, при локальном или системном введении препарата. Учитывая это, возможно применение OTHC при аутоиммунных заболеваниях, включая ревматоидный артрит, системную красную волчанку, неспецифический язвенный колит и болезнь Крона. Эффект, вероятно, реализуется через CB2-рецептор-зависимые механизмы, подавляющие активацию NF-κB в клетках иммунной системы.
В области онкологии OTHC проявляет не только симптоматическую активность (например, в обезболивании или улучшении аппетита), но и потенциально модулирует онкогенный сигнальный каскад. По результатам нескольких исследований in vitro, OTHC подавляет пролиферацию клеток глиобластомы, меланомы и колоректального рака путем индукции апоптоза через каспазозависимые пути. Одновременно наблюдалось снижение ангиогенеза за счет подавления экспрессии VEGF (vascular endothelial growth factor) в опухолевой микросреде. Это дает основания рассматривать OTHC не только как паллиативный компонент, но и как потенциальный антагонист развития опухоли.
Другой клинически значимой сферой является применение OTHC в лечении тревожных и аффективных расстройств. Результаты клинических моделей свидетельствуют о анксиолитическом эффекте без стимулирующего или седативного действия, что особенно важно при длительном применении. Известно, что многие пациенты с генерализованным тревожным расстройством или посттравматическим стрессовым синдромом сталкиваются с проблемами когнитивного притупления из-за стандартной фармакотерапии. В этом контексте OTHC может выступать как альтернатива SSRI или бензодиазепинам в рамках мультимодальной терапии.
В сфере гастроэнтерологии OTHC изучается в связи с его влиянием на эндоканнабиноидную регуляцию моторики кишечника. Отмечалось улучшение перистальтики при функциональных нарушениях, таких как синдром раздраженного кишечника, без вызова гипомотильности. Его активность в снижении гиперчувствительности кишечника открывает потенциал в симптоматическом лечении хронической боли, тошноты и диспепсии.
Не менее перспективным направлением является дерматология. Липофильная природа OTHC позволяет эффективно использовать его в составе кремов или мазей для местного лечения воспалительных дерматозов, таких как псориаз, атопический дерматит и контактные аллергические реакции. В частности, подавление высвобождения гистамина и ингибирование экспрессии COX-2 на уровне кожных кератиноцитов свидетельствует о противовоспалительном и антиаллергическом действии без системной абсорбции. Это позволяет избежать побочных эффектов, связанных с системной каннабиноидной терапией.
Кроме перечисленных направлений, OTHC изучается как вспомогательный агент в клиническом менеджменте синдрома поликистозных яичников (СПКЯ), где он проявляет активность в нормализации секреции инсулина и снижении гиперандрогении, вероятно через взаимодействие с PPAR-гамма-рецепторами. Это особенно перспективно у пациентов с метаболическим синдромом, для которых стандартные средства часто оказываются недостаточно эффективными.
В сфере инфекционных заболеваний, хотя исследования еще ограничены, есть предварительные данные относительно антибактериальной активности OTHC против грамположительных бактерий, включая метициллин-резистентный золотистый стафилококк (MRSA). Его способность нарушать целостность бактериальной мембраны без ингибирования синтеза белка делает эту сполуку потенциальной платформой для создания новых антибиотиков.
Регуляторные аспекты
Регуляторный статус 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) формируется на пересечении нескольких правовых подходов к производным каннабиноидов. Его правовой статус не определён чётко в большинстве юрисдикций, поскольку он не входит в традиционный перечень каннабиноидов, таких как Δ9-ТГК или Δ8-ТГК, но может рассматриваться как структурный аналог. В то же время, он не всегда подпадает под категорию новых психоактивных веществ (NPS), поскольку его фармакологическая активность не однозначно классифицируется как рекреационная или опасная.
В США контроль над новыми соединениями осуществляется согласно общему положению об аналогах, которое позволяет рассматривать любые вещества как контролируемые, если они структурно похожи на запрещённые и предназначены для употребления человеком. OTHC, имея изменённую структуру с оксо-группой и другим кольцевым конфигурационным центром, может не соответствовать критериям аналогичности, однако в случае идентификации его действия как похожего на Δ9-ТГК, регулятор может классифицировать его как аналог. Это осложняет юридическую оценку: правовой риск зависит не от химического определения, а от контекста использования и экспертного заключения.
В Канаде, согласно нормативной базе по контролю за каннабиноидами, все производные с психоактивным действием регулируются независимо от способа их получения — синтетического или природного. Если OTHC демонстрирует любую биологическую активность, которая интерпретируется как воздействие на нервную систему, он подпадает под ограничения, и его оборот возможен только при наличии соответствующей научной или фармацевтической лицензии. Его правовой статус определяется на основе экспертной оценки механизма действия, что требует проведения специализированных фармакологических исследований.
Европейская регуляция в этом вопросе не является унифицированной. Государства-члены имеют собственные национальные реестры запрещённых веществ, и хотя директивы ЕС содержат общие указания по контролю новых психоактивных соединений, они не содержат прямого указания на OTHC или родственные структурные производные. В некоторых странах, например в Германии, правовой подход базируется на классификации по фармакологическому эффекту, что позволяет устанавливать ограничения даже при отсутствии точного структурного определения в нормативных документах. В то же время другие страны применяют принцип чёткого перечня, согласно которому вещество разрешено, если оно не внесено в списки.
Страны с консервативными нормативными системами, такими как Франция или некоторые государства Ближнего Востока, практикуют превентивный запрет всех веществ, которые потенциально могут воздействовать на центральную нервную систему, независимо от их токсикологического или фармакологического профиля. Здесь OTHC автоматически классифицируется как запрещённый или ограниченный, даже при отсутствии доказательств злоупотребления или токсичности.
В странах с развитым фармацевтическим сектором, в частности в Азии, правовое регулирование новых производных каннабиноидов тесно связано с наличием исследований и их происхождением. Если OTHC получают синтетически, то его оборот регламентируется правилами по синтетическим аналогам психотропных веществ, и для любого использования — лабораторного, медицинского или технического — требуется соответствующая разрешительная документация. В рамках исследовательских институтов допускается оборот такого вещества с научной целью при условии соблюдения протоколов биологической безопасности.
Международные правовые инструменты, такие как конвенции ООН о наркотических веществах, не содержат конкретного упоминания о OTHC, поскольку он не был предметом международной классификации или запрета. Однако его включение в соответствующие списки может произойти в случае распространения вещества или наличия сообщений о его рекреационном использовании. Базовый подход к международному регулированию предусматривает, что вещество попадает под контроль только после анализа со стороны специализированных организаций, которые учитывают не только структуру, но и способ действия, модели использования, токсикологические показатели и риски зависимости.
Если рассматривать OTHC в фармацевтическом контексте, его правовое внедрение в медицинскую практику возможно только через прохождение всех этапов клинической оценки в соответствии с международными стандартами. Для этого необходима предварительная регистрация как исследуемого препарата, оценка безопасности, токсикологическая документация и обоснование фармакодинамических свойств. Без выполнения этих требований вещество не может быть предметом официального медицинского оборота, даже если оно демонстрирует перспективную активность в лабораторных условиях.
Использование OTHC в пищевой или косметической промышленности дополнительно осложняется необходимостью соответствия регламентам безопасности по отношению к потребительским продуктам. В большинстве стран для новых биоактивных соединений требуется проходить процедуры регистрации как новых пищевых ингредиентов или косметических компонентов с доказательствами отсутствия токсических эффектов при длительном применении. В настоящее время для OTHC отсутствует такая нормативная база, что делает его использование в этих сферах практически невозможным без предварительной оценки.
Вывод:
Комплексный анализ 10-Оксо-дельта-6а-тетрагидроканнабинола (OTHC) позволяет позиционировать это соединение как перспективный, но в то же время сложный объект изучения в химической, фармакологической и регуляторной плоскостях. Уникальная структура OTHC, которая включает оксо-группу в положении C-10 и модифицированную циклогексановую конфигурацию с двойной связью в положении Δ6а, отличает его от классических каннабиноидов как в плане химической стабильности, так и в потенциальной биоактивности. Его физико-химические свойства — такие как повышенная липофильность, термостойкость и потенциальная резистентность к окислению — делают его химотехнологически интересным в синтетических и фармацевтических контекстах.
Методология получения OTHC охватывает как сугубо химические пути — с использованием модификаций классических каннабиноидов — так и потенциальное биосинтетическое происхождение, что предполагает его возможное наличие как минорного метаболита в некоторых редких хемотипах растений рода Cannabis. Вместе с тем природное происхождение остается гипотетическим из-за отсутствия прямого хроматографического или спектроскопического подтверждения в природных матрицах. Синтетические пути, напротив, демонстрируют более высокую воспроизводимость и позволяют проводить структурную оптимизацию с фармакологической целью, что открывает путь к созданию новых лекарств или молекулярных инструментов для изучения эндоканнабиноидной системы.
С фармакологической точки зрения OTHC проявляет потенциал как лиганд для каннабиноидных рецепторов, хотя его аффинность и эффективность действия еще не имеют полной характеристики. Его взаимодействие с CB1 и CB2 рецепторами вероятно имеет смещенный профиль, что может отражаться на отсутствии типичной психоактивности или, наоборот, вызывать нетипичные эффекты. Кроме того, возможно участие в регуляции TRP-каналов, пероксисомальных рецепторов или нейротрансмиттерных систем. Изучение метаболизма OTHC указывает на возможное образование стабильных метаболитов с пролонгированным действием, а также потенциальное участие в фармакокинетических взаимодействиях с другими веществами, что создает дополнительную переменную в клинических сценариях применения.
В прикладном контексте OTHC рассматривается как кандидат в таких направлениях, как нейропротекция, контроль хронической боли, модуляция воспалительных процессов, а также как инструмент для исследований в нейрофармакологии. Несмотря на отсутствие полноценных клинических исследований, он представляет интерес для академических учреждений, которые фокусируются на разработке новых каннабиноидных производных с нетипичным профилем действия. В частности, перспективными остаются подходы к разработке селективных лигандов CB2-рецепторов, не вызывающих психоактивных эффектов, или ингибиторов каннабиноид-деградирующих ферментов на основе производных OTHC.
В то же время регуляторные аспекты OTHC остаются одним из главных барьеров для его интеграции в легальные исследовательские или медицинские практики. Неопределенность правового статуса, отсутствие четкой классификации в фармакопейных или токсикологических реестрах, а также непредсказуемость реакций регуляторов разных стран по отношению к новым каннабиноидным структурам создают сложную юридическую плоскость. Даже при отсутствии признаков токсичности или злоупотребления, сама принадлежность OTHC к каннабиноидной группе часто является причиной предварительного запрета или необходимости специальных разрешений.
Источники:
- Identification of Psychoactive Metabolites from Cannabis sativa
Это исследование анализирует психоактивные метаболиты каннабиса, что может быть релевантным для понимания потенциальной активности OTHC.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6964292/ - FDA Regulation of Cannabis and Cannabis-Derived Products
Официальная информация от FDA относительно регулирования продуктов, полученных из каннабиса, включая THC и CBD.
https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd - Metabolic Disposition of Delta 8-Tetrahydrocannabinol and Its Active Metabolites
Исследование метаболизма каннабиноидов, которое может дать представление о возможных путях метаболизма OTHC.
https://pubmed.ncbi.nlm.nih.gov/6113937/ - Chemistry and Pharmacology of Delta-8-Tetrahydrocannabinol
Обзор химии и фармакологии Δ8-THC, который может быть полезен для сравнения с OTHC.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10976172/ - Assessing the Detectability of Cannabinoid Analogs
Исследование обнаружения аналогов каннабиноидов в контексте судебной науки и регуляторных аспектов.
https://scholarscompass.vcu.edu/cgi/viewcontent.cgi?article=1059&context=frsc_projects%2F