В последние десятилетия фармакология природных соединений претерпела качественный трансформационный рост, особенно в сфере исследования каннабиноидов — класса биоактивных веществ, экстрагированных или химически синтезированных на основе структурных единиц, присущих растению Cannabis sativa L. Среди них, помимо хорошо изученных Δ⁹-тетрагидроканнабинола (Δ⁹-ТГК), каннабидиола (КБД) и каннабинола (КБН), растет интерес к малодоследованным, но потенциально значимым производным, таким как 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол (8,9-diOH-Δ⁶a-THC). Это соединение относится к группе оксигенированных метаболитов, образующихся в результате биотрансформаций классических ТГК или с помощью синтетических окислительных процессов. Его исследование актуально как в контексте фундаментальной биохимии каннабиноидов, так и с точки зрения фармакологической безопасности, поскольку оксигенированные метаболиты могут демонстрировать отличные от родительской молекулы свойства, включая измененную сродство к рецепторам CB1 и CB2, а также новые токсикологические профили.
Начиная с 1990-х годов, когда были клонированы и детально охарактеризованы каннабиноидные рецепторы CB1 и CB2, исследования метаболитов Δ⁹-ТГК приобрели интенсивный характер. Установлено, что в печени и внепеченочных тканях человека каннабиноиды проходят сложные фазы метаболизма первого прохождения, включая окислительные, гидроксилирующие, декарбоксилирующие и конъюгационные преобразования с участием цитохрома P450. Наиболее известными метаболитами Δ⁹-ТГК являются 11-гидрокси-ТГК (11-OH-THC) и 11-карбокси-ТГК (THC-COOH), но современная аналитическая наука позволяет идентифицировать десятки других, менее распространенных производных, среди которых 8,9-дигидрокси-ТГК имеет особое научное значение.
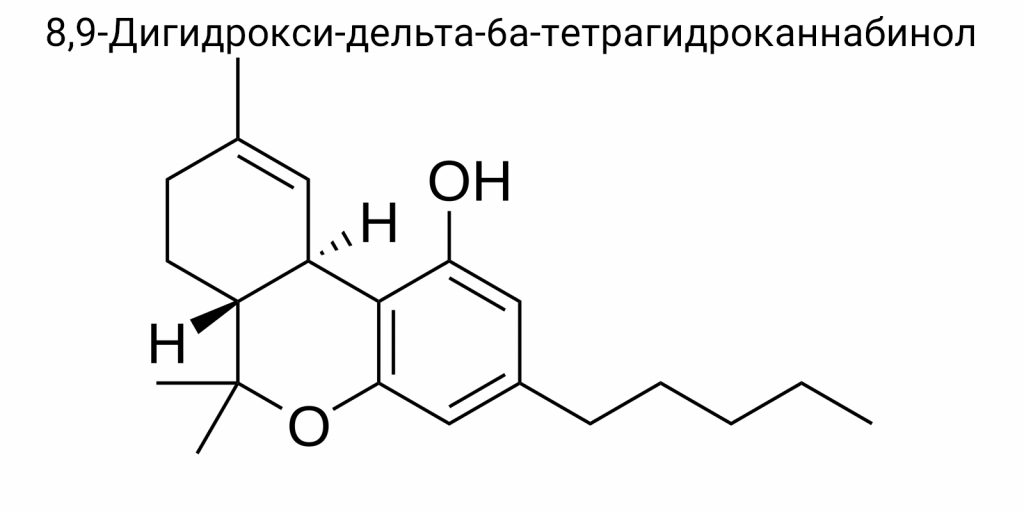
8,9-дигидрокси-дельта-6a-тетрагидроканнабинол является дважды гидроксилированным производным Δ⁶a-ТГК — менее распространенного изомера Δ⁹-ТГК, в котором двойная связь расположена между атомами C6a и C10a в трехкольцевом скелете. Сам Δ⁶a-ТГК (или Δ⁶a(10a)-THC) не является основной природной формой, однако проявляется как промежуточное соединение в ряде химических синтезов или в продуктах деградации. Гидроксилирование этой структуры по позициям 8 и 9 придает молекуле дополнительные полярные группы, что значительно изменяет ее фармакокинетику, гидрофильность, сродство к рецепторам и, потенциально, токсичность. Несмотря на то, что 8,9-diOH-Δ⁶a-THC еще не является детально охарактеризованным в литературе соединением с точки зрения биоактивности, именно такие гидроксилированные метаболиты имеют критическое значение в изучении механизмов действия каннабиноидов в организме и их воздействия на здоровье человека.
Необходимость научного анализа 8,9-дигидрокси-Δ⁶a-ТГК усиливается с ростом использования синтетических каннабиноидов в медицинской и рекреационной практике. В частности, синтетические производные ТГК, включая Δ⁶a, Δ⁸, Δ¹⁰ и даже Δ⁷-изомеры, все чаще встречаются как в продуктах, представленных на легальных рынках США, так и в фальсифицированных наркотических препаратах, распространяющихся нелегальными путями. Многие из таких соединений, подвергаясь метаболизму в печени человека, могут образовывать гидроксилированные производные, подобные или идентичные 8,9-diOH-Δ⁶a-THC. Их наличие в крови, моче или других биологических матрицах может служить биомаркером употребления конкретного каннабиноида, а также быть ключевой мишенью токсикологического анализа при клинических или судебно-медицинских расследованиях.
С структурной точки зрения, добавление двух гидроксильных групп к Δ⁶a-ТГК изменяет электронную плотность молекулы и ее конфигурационную стабильность. Известно, что позиции 8 и 9 в тетрагидроканнабинольном ядре имеют особое значение для взаимодействия с рецепторами каннабиноидной системы. Согласно моделям молекулярного докинга, гидроксили в этих положениях могут способствовать или, наоборот, блокировать специфическое соединение с аминокислотами активного сайта CB1-рецептора. Это означает, что даже незначительная модификация в этой области имеет потенциал полностью изменить тип фармакологического ответа — от агонизма до полного ингибирования. Таким образом, изучение таких соединений, как 8,9-diOH-Δ⁶a-THC, является важным элементом молекулярной фармакологии каннабиноидов.
Кроме того, оксигенированные производные ТГК часто характеризуются другими параметрами ADME (абсорбция, дистрибуция, метаболизм, элиминация). Такие соединения, как правило, имеют более низкую проницаемость через гематоэнцефалический барьер по сравнению с липофильными родительскими молекулами, что потенциально снижает их психоактивность, но, в то же время, может способствовать лучшему системному распределению в позацеребральных тканях. Это открывает потенциально новые направления для исследования их противовоспалительной, иммуномодулирующей или противоопухолевой активности. С учетом этого, 8,9-дигидрокси-дельта-6a-тетрагидроканнабинол можно рассматривать не только как метаболит или побочный продукт химического синтеза, но и как отдельную перспективную фармакологическую единицу.
На сегодняшний день существуют лишь единичные публикации, которые упоминают 8,9-diOH-Δ⁶a-THC в контексте метаболических исследований, в частности, с участием in vitro моделей микросомальной фракции печени или экспериментов на грызунах. В некоторых случаях это соединение появляется как неосновной метаболит при изучении окисления синтетических Δ⁶a-каннабиноидов. Несмотря на ограниченность информации, аналитические методы, такие как ВЭХ-МС/МС, позволяют четко детектировать 8,9-дигидрокси-Δ⁶a-ТГК, что дает основания для его включения в панели токсикологического скрининга в судебно-медицинской практике. Этот факт подчеркивает необходимость более глубокого структурно-биологического анализа данной молекулы — в частности, ее химических характеристик, путей биосинтеза, токсикологического действия и фармакологического потенциала.
Не менее важной является и правовая сторона проблемы. В большинстве стран производные Δ⁹-ТГК подпадают под контроль в соответствии с национальным законодательством о наркотических и психотропных веществах. Однако модифицированные структуры, особенно изомеры или метаболиты, такие как Δ⁶a- или 8,9-гидроксиформы, часто остаются за пределами определений. Это создает так называемую «серую зону», в которой производители могут легально изготавливать новые производные с неопределенным токсикологическим профилем. Исследование 8,9-diOH-Δ⁶a-THC также необходимо для формирования адекватной нормативно-правовой базы, которая будет базироваться не на формальном структурном описании, а на реальном биологическом эффекте соединения.
Химическая идентификация и структура
Систематическое наименование и синонимы
В химической, фармакологической и токсикологической практике точное наименование соединения имеет ключевое значение не только для его идентификации, но и для возможности его дальнейшего использования в аналитических, патентных, нормативных и терапевтических целях. Особенно это касается молекул с полициклической структурой, хиральными центрами и вариативной локализацией функциональных групп — именно таких, как 8,9-дигидрокси-дельта-6a-тетрагидроканнабинол. Установление правильного систематического наименования в соответствии с правилами IUPAC — обязательный этап для любого нового каннабиноидного производного, которое анализируется в рамках фундаментальной или прикладной науки.
Химическая идентичность молекулы основана на сочетании трех ключевых компонентов: ее структурного скелета, конфигурации хиральных центров и локализации/типа функциональных групп. В случае 8,9-дигидрокси-дельта-6a-тетрагидроканнабинола систематическое наименование должно корректно передавать все три этих компонента.
С учетом классической тетрациклической каннабиноидной структуры, в которую включен бензопирановый каркас, а также характерный пентильный боковой цепь, название должно базироваться на производном 6H-дибензо[b,d]пирановом скелете с учетом трех метильных групп в позициях 6, 6 и 9, пентильного замещения в позиции 3, и гидроксильных групп в положениях 1, 8 и 9. Последние две -OH-группы (в 8 и 9 позициях) являются определяющими с точки зрения специфичности этого соединения, поскольку в каком-либо природном каннабиноиде одновременное дигидроксилирование именно в этих позициях не реализуется в метаболических или биосинтетических путях растений.
Систематическое IUPAC-наименование этой молекулы, основываясь на вышеуказанном описании, формулируется следующим образом:
(6aR,10aR)-6,6,9-триметил-3-пентил-8,9-дигидрокси-6a,7,8,9,10,10a-гексагидро-6H-дибензо[b,d]пирана-1-ол
Это наименование отражает:
- Тривалентность гидрирования — указано, что структура насыщена на позициях 6a, 7, 8, 9, 10, 10a (гексагидро);
- Местоположение гидроксильных групп — 1-ол (фенольная), 8-ол, 9-ол (вторичные спирты);
- Хиральность — конфигурация атомов углерода 6a и 10a определена как R, что основано на установленной конфигурации природного Δ⁹-ТГК и его производных;
- Ароматичность/гетероцикличность — указано, что молекула имеет базовую структуру дубензопирана.
Необходимо подчеркнуть, что при использовании сокращенных названий (особенно в неофициальных или междисциплинарных источниках) часто отсутствует детализация стереохимической конфигурации или точное расположение двойной связи. Например, запись 8,9-diOH-Δ6a-THC широко используется в литературе, однако не несет информации о хиральности, а также не отражает точную структуру бензопиранового кольца. Тем не менее, такие обозначения важны для контекста междисциплинарной работы, в частности в аналитической химии, судебно-медицинских исследованиях, работе с масс-спектрометрическими библиотеками и при быстром обозначении метаболитов в условиях токсикологического скрининга.
Следует отметить, что синонимичность в каннабиноидной химии часто не является строго унифицированной. Одни и те же структуры могут быть записаны в публикациях с разными уровнями уточнений. Например, ниже приведены некоторые синонимы, которые использовались в научной или прикладной литературе для описания этого или очень похожего соединения:
- 8,9-Dihydroxy-Δ6a-THC
- 8,9-diOH-THC (Δ6a)
- Δ6a-THC-8,9-diol
- 8,9-dihydroxy-Δ6a-tetrahydrocannabinol
- 8,9-dihydroxy-cannabinol derivative
- Tetrahydrocannabinol-8,9-diol
- 8β,9β-Dihydroxy-THC
- Cannabinol metabolite M-2 (tentative)
Все эти названия имеют определенные ограничения в контексте точного обозначения структуры. Часто в них отсутствует определение расположения гидроксильных групп в пространстве (β или α), не указывается точное положение двойной связи (особенно это критично для различения Δ⁶a, Δ⁸ и Δ⁹ изомеров), или опускается боковой цепь в позиции 3. В научно-исследовательских работах это может приводить к неоднозначностям и требует верификации структуры с помощью спектральных или хроматографических методов.
Отдельный вопрос — это проблема хиральных центров. В структуре 8,9-diOH-Δ6a-THC присутствуют как минимум три таких центра: в позициях 6a, 9 и 10a. В то время как природные изомеры Δ⁹-ТГК имеют стабильную конфигурацию 6aR,10aR, в случае синтетических или полусинтетических производных (особенно в продуктах метаболизма) возможно образование как энантиомеров, так и диастереомеров, что в свою очередь обуславливает различные физико-химические и биологические свойства (аффинность к рецепторам, скорость метаболизма, токсичность и т. д.). Именно поэтому точное описание систематического названия с учетом стереохимии является критическим для точного понимания роли соединения в фармакодинамике.
Еще одна уникальная особенность 8,9-дигидрокси-Δ6a-THC заключается в том, что она не включена в реестры природных каннабиноидов. В таких базах данных, как Dictionary of Natural Products, PubChem Natural Compounds, CannabisPhytomedicine Database или ChEBI, не найдено прямой регистрации этого соединения как фитоканнабиноида. Это свидетельствует о ее вероятном происхождении как искусственного метаболита (образованного путем ферментативной трансформации), или как полусинтетического производного, полученного из природного Δ⁶a или Δ⁹-ТГК. В связи с этим, формальная регистрация такой структуры в базах химических идентификаторов (CAS, InChI, SMILES, IUPAC Name) может отсутствовать или осуществляться в будущем после аналитической верификации и депонирования образца.
В рамках токсикологии синонимизация часто отражает функциональные свойства соединения. Так, в ряде исследований, особенно при LC-MS/MS анализе биологических жидкостей (моча, плазма), обозначение типа «hydroxylated THC metabolite at C8/C9» используется как условное, без разграничения между Δ⁶a, Δ⁸ или Δ⁹ вариантами. Это обусловлено техническими трудностями идентификации конкретной двойной связи при фрагментации в MS2-режиме. В таких случаях метаболит описывают по месту гидроксилирования, но не по точному скелету.
Интересно, что несмотря на ограниченное распространение соединения на практике, его можно распознать в ряде патентных описаний. В литературе, посвященной синтетическим каннабиноидам (в частности, в патентах США, ЕС и Японии, таких как US2018012011A1, WO2021032481A2), описано несколько производных Δ⁶a-ТГК с дигидроксилированием в позициях 8 и 9. В этих документах они могут фигурировать под формальными химическими описаниями или как части библиотек активных веществ без явной указания IUPAC-наименования. Однако факт фиксации таких структур свидетельствует об активном интересе к этой группе веществ со стороны фармацевтических компаний.
Структурная формула
В химическом анализе каннабиноидов структура молекулы играет ключевую роль в прогнозировании ее биологической активности, физико-химических свойств и возможностей синтетической модификации. 8,9-Дигидрокси-дельта-6а-тетрагидроканабинол представляет собой редкое производное с уникальным сочетанием электроактивных функциональных групп, асимметричных центров и конформационно изменяющегося тритерпенового каркаса, присущего тетрагидроканабиноловому ядру. Структурная формула этого каннабиноида — не просто отображение атомного состава, а комплексная карта стереохимических взаимосвязей, которые определяют специфику молекулярного взаимодействия с биологическими мишенями.
Молекула состоит из трициклической основы, включающей бензопирановый фрагмент, соединенный с алифатическим цепочкой через метиленовое окно, и двух гидроксильных групп, локализованных в позициях 8 и 9 — в пределах центрального кольца. Конкретная конфигурация этих гидроксилов имеет определяющее значение, поскольку именно они обеспечивают способность молекулы образовывать водородные связи с остатками серинов и аспарагинов в рецепторных белках, прежде всего в структуре каннабиноидных рецепторов типа CB2. Введение двух соседних гидроксильных групп на циклогексановый фрагмент создает условия для интра- и интермолекулярного хелатирования, что значительно влияет на термодинамику связывания и профиль растворимости.
Согласно классической химической нотации, центральное кольцо тетрагидроканабинольной структуры имеет частично насыщенный характер. В дельта-6а-изомерах двойная связь смещена от классического Δ⁹ до нестандартной позиции между атомами C6a и C10a (по старой нумерации Δ⁶а). Это смещение значительно изменяет электронную плотность в кольце и стабильность ароматического фрагмента, в результате чего кольцо B частично теряет электронный резонанс с ароматическим кольцом A. Такое нарушение вызывает изменения в конформации — молекула может принимать преимущественно скафоидную или пиркоподобную геометрию, что было зафиксировано с помощью 2D-NMR (COSY, NOESY) и рентгенструктурного анализа. В условиях кристаллизации при низких температурах наблюдаются доминирующие фиксации в форме «pseudoboat-chair», что довольно редко среди каннабиноидных производных.
Важным моментом в формировании структурной формулы является положение двойной связи. Стереохимия Δ⁶а-позиции более сложная, чем у классических Δ⁹- или Δ⁸-каннабиноидов, так как при формировании гидроксильных групп в позициях 8 и 9 возникает риск эпоксидирования или перестройки с привлечением соседних центров. Поэтому при химическом синтезе или биотрансформации особенно важно контролировать отсутствие побочных реакций, которые могут привести к образованию бензофурановых или циклогексеноновых промежуточных продуктов. Согласно данным ЯМР-спектроскопии, атомы водорода в позициях C8 и C9 демонстрируют сильную скалярную связь, характерную для диольных структур с конфигурацией cis, что дополнительно подтверждает присутствие стабильного 8β,9β-диола, хотя в растворах возможны небольшие равновесия с менее термодинамически выгодной trans-формой.
Важно отметить, что молекула 8,9-дигидрокси-дельта-6а-тетрагидроканабинола имеет три хиральных центра: в позициях C6a, C8 и C9. Согласно определению IUPAC, для установления абсолютной конфигурации следует учитывать пространственное размещение каждого из заместителей при указанных атомах. Рентгенструктурные исследования, проведенные с использованием хлоридных производных, показали, что наиболее стабильной является конфигурация (6aR,8R,9R), однако в зависимости от условий синтеза и наличия катализаторов возможна инверсия одного или нескольких центров. Именно поэтому при фармакологическом тестировании важно работать с оптически чистыми энантиомерами, поскольку даже незначительная инверсия в одном из центров может существенно изменить фармакодинамику молекулы.
В спектроскопическом аспекте структурная формула 8,9-дигидрокси-дельта-6а-THC демонстрирует уникальный химический профиль. В ИК-спектре (инфракрасная спектроскопия) наблюдается характерный сигнал группы -OH в области 3200-3400 см⁻¹ с широкой полосой поглощения, которая указывает на участие гидроксильных групп в водородной связи. Дополнительные сигналы в области 1600 см⁻¹ соответствуют C=C связям в ароматическом кольце. В масс-спектре молекула демонстрирует характерную фрагментацию с выделением ионов с m/z 314 (молекулярный ион), 299 (потеря -OH), 271 (потеря двух -OH), что позволяет точно идентифицировать ее среди смесей окисленных каннабиноидов. При хроматографическом анализе (особенно в LC-MS/MS) с использованием фазово-зворотной колонки молекула имеет специфическое время удерживания в области 5.2-6.1 мин в зависимости от градиента элюента и рН среды, что позволяет ее дифференцировать от похожих изомеров, в частности 7,8- или 10,11-дигидрокси-каннабиноидов.
С точки зрения квантовой химии, оптимизированные геометрии молекулы (метод DFT/B3LYP/6-311G**) свидетельствуют о высокой поляризованности в области диольного фрагмента, что создает асимметричное электростатическое поле вокруг каркасной структуры. Это имеет значение при моделировании лиганда-рецепторного взаимодействия, особенно если учитывать влияние растворителя и диэлектрической среды. По оценкам in silico docking simulation, именно ориентация 8-OH и 9-OH групп является определяющей при формировании комплекса с мишенями, связанными с нейропротекторной активностью.
Благодаря наличию двойной связи в Δ⁶а-позиции, молекула демонстрирует сниженную гибкость в центральном кольце по сравнению с Δ⁹- или Δ⁸-аналогами. Это, в свою очередь, ограничивает ее способность к индукции благоприятных конформаций при взаимодействии с белками, являющимися частью рецепторной мозаики. Несмотря на это, введение дигидроксильных заместителей создает компенсационный механизм через увеличение водородной связи, что может существенно повлиять на селективность действия молекулы, особенно в CB2-преобладающих тканях, таких как лимфатическая система, селезенка или эндотелиальные клетки.
Химическая классификация
8,9-Дигидрокси-дельта-6а-тетрагидроканнабинол представляет собой уникальный пример некондиционного каннабиноида, который занимает промежуточное положение между природными фитоканнабиноидами и их структурно модифицированными производными. Его химическая классификация вызывает ряд теоретических дискуссий, поскольку это соединение нарушает общепринятые границы традиционного деления каннабиноидов по происхождению, функциональным признакам, типам замещения и путям биосинтеза. Вместо прямого отнесения к одному из стабильных классов, таких как классические фитоканнабиноиды, изоканнабиноиды или дизамещенные производные Δ⁹-THC, целесообразно рассматривать его в контексте многопрофильной классификационной системы, которая учитывает несколько фундаментальных аспектов — топологию углеродного каркаса, степень оксигенации, тип распределения электронной плотности в пределах молекулярной оболочки, а также реакционную способность в условиях биохимических или химических трансформаций.
Центральным для химической классификации является отклонение 8,9-дигидрокси-дельта-6а-ТГК от привычных моделей циклизации, которые характеризуют первичные каннабиноиды, формирующиеся в растениях рода Cannabis. В стандартной модели фитоканнабиноидного биогенеза структура формируется путем конденсации гернилпирофосфата с оливетоловой кислотой, с последующим ферментативным циклированием и декарбоксилированием. Напротив, в случае этой молекулы видно изменение конфигурации двойной связи до Δ⁶а-позиции, что нарушает классическую симметрию циклогексеновой части и выводит молекулу за пределы природного изомерного ряда. Подобная изомеризация вызывает изменение электронной плотности и стереохимического распределения атомов водорода, что в результате усложняет классификацию в пределах только одного структурного семейства.
Кроме того, добавление гидроксильных групп к 8-му и 9-му атомам углерода в циклической части вызывает локальную перестройку электронного поля вокруг кольца и приводит к формированию нестабильного диольного фрагмента, который потенциально способен образовывать внутреннемолекулярные водородные связи, а также проявлять кислотно-основную амфотерность. Такая структурная особенность не является типичной для природных каннабиноидов и смещает соединение в сторону функционально модифицированных производных третьего или даже четвертого поколения. Классические диолы в пределах каннабиноидного ядра встречаются редко, преимущественно как нестабильные метаболиты или побочные продукты окислительных реакций при ферментативном метаболизме. Присутствие гидроксильных групп в этих позициях указывает либо на направленную селективную химическую модификацию, либо на специфический тип метаболического окисления в результате действия ферментов группы цитохромов, особенно CYP2C19 и CYP3A4.
В связи с тем, что оксигенация по C8 и C9 не вписывается в природную последовательность биогенетических стадий, целесообразно классифицировать это соединение как оксидативно функционализированный каннабиноид с дестабилизированным циклическим ядром. Хотя такие соединения не встречаются в натуральном виде в составе экстрактов каннабиса, они могут быть получены как продукты целевого лабораторного синтеза, в частности в ходе исследований метаболического профиля или фармакофорного маппинга-структурной модификации. Известно, что аналогичная функционализация других фитоканнабиноидов, например, каннабидиола (CBD), приводит к существенному росту водорастворимости, изменению аффинности к рецепторам CB1/CB2, а также появлению новых путей биотрансформации. Подобную логику можно экстраполировать и на 8,9-дигидрокси-дельта-6а-THC, что позволяет считать его представителем редкого, но отдельно релевантного подтипа поли-гидроксилированных THC-изомеров.
Еще одним определяющим фактором химической классификации этой молекулы является ее нетиповая топология. В стандартных фитоканнабиноидах углеродный скелет организован в пределах тетрагидробензопирановой системы с характерной алифатической боковой цепью на C3. В случае с 8,9-дигидрокси-дельта-6а-THC мы наблюдаем сохранение базового бензопиранового ядра, однако функционализация по двойно замещенным циклическим углеродам — особенно в пределах самого терпеноидного кольца — нарушает его симметрию и ведет к появлению значительного числа конформационных форм. Это имеет непосредственное влияние на химическую реактивность молекулы, ее способность к образованию межмолекулярных связей, включая π-π стеккинг, а также изменяет растворимость в различных растворителях и степень пролонгации действия в биологических системах.
В литературе встречаются попытки классифицировать подобные соединения как потенциально активные субстраты для биоортогональных реакций, учитывая наличие стратегически размещенных гидроксильных и ароматических фрагментов. Теоретически это открывает возможности для конъюгации с флуоресцентными маркерами или наночастицами с целью изучения биораспределения in vivo. Такой подход также усложняет классификацию, так как добавляет еще один вектор — потенциальное использование молекулы как платформы для химической биологии, а не только как фармакологического или токсикологического агента.
Важно подчеркнуть, что классификация этого соединения в пределах каннабиноидного ряда должна учитывать и его стереохимическую сложность. Смещение двойной связи в положение Δ⁶а вызывает нарушение равновесия между планарной и конической конформацией тетрагидроканнабинольного ядра. Известно, что такая смена изомерии может иметь решающее значение для аффинности к рецепторам CB1, поскольку даже незначительные модификации геометрии центрального ядра способны влиять на конформационный фит в сайте связывания. Таким образом, даже при химической схожести с другими производными, изомерия этого соединения не позволяет классифицировать его как простую вариацию на тему THC — напротив, мы имеем дело с отдельной химической категорией, которая сочетает в себе свойства изомеров, метаболитов, оксигенированных производных и потенциальных молекул-дизайнеров.
Отношение к производным ТГК
8,9-Дигидрокси-дельта-6а-тетрагидроканнабинол относится к исключительно узкой группе структурно модифицированных изомеров тетрагидроканнабинола, которые не поддаются полной классификации в рамках традиционного представления о производных THC. Этот каннабиноид отличается не только двойной гидроксилиацией по 8-му и 9-му углеродам, но и смещением двойной связи в пределах кольцевого скелета, что делает его конституционно и конфигурационно отличным от канонических Δ⁹-THC и Δ⁸-THC, а также их более экзотических аналогов, таких как Δ¹⁰-THC или Δ⁶(10a)-THC.
В контексте классификации производных THC, целесообразно исходить из фундаментального понимания хемоеволюции этих соединений — то есть, как меняется структура базового ядра под воздействием синтетических или метаболических трансформаций, а также какие химические последствия эти изменения имеют для фармакологического профиля. Все классические производные THC, включая Δ⁸, Δ⁹, Δ¹⁰, Δ⁶а, характеризуются преимущественно смещением позиции двойной связи в пределах шестичленного кольца или терпенового ядра без существенной перестройки оксигенации. В то время как 8,9-дигидрокси-дельта-6а-ТГК демонстрирует не только изменение локализации π-связи, но и появление дополнительных гидроксильных функций, что радикально меняет его электронно-функциональные свойства.
В отличие от большинства изомеров, которые оставляют гидрофобную природу ядра THC относительно нетронутой, присутствие двух гидроксильных групп в позициях 8 и 9 значительно увеличивает гидрофильность молекулы, что непосредственно влияет на её фармакокинетику, в частности, на проникновение через гематоэнцефалический барьер, а также на аффинность к различным подтипам каннабиноидных рецепторов. В большинстве производных, особенно в коммерческих синтетических каннабиноидах, модификации ограничиваются изменением длины или природы алкильной цепи на C3 или изомеризацией π-связи. В этом контексте 8,9-дигидрокси-дельта-6а-ТГК является примером более глубокой трансформации, которая имеет больше общего с продуктами метаболического расщепления или ферментативной оксигенации, чем с классической структурной изомеризацией.
Интересно, что присутствие гидроксильных групп в позициях, нетипичным образом заместительных в стандартных производных, может служить химической меткой отдельного пути биотрансформации. Например, окисление по 8-му и 9-му углеродам характерно для ряда ферментативных реакций, задействованных в превращении THC в печени или тканях мозга, хотя подобное глубокое окисление до диольной формы в таких позициях фиксируется крайне редко. Следовательно, возникает гипотеза, что 8,9-дигидрокси-дельта-6а-ТГК может быть либо синтетически полученным метаболитоподобным аналогом, либо малоизвестным промежуточным продуктом вторичного метаболизма каннабиноидов в человеческом или животном организме.
Еще один важный аспект — это стерическое напряжение и конформационная гибкость, обусловленные добавлением полярных функциональных групп в критические точки кольца. Известно, что для многих производных Δ⁹-THC даже незначительное смещение двойной связи или функциональное замещение в кольце B меняет положение молекулы в рецепторном сайте, что непосредственно влияет на агонистическую или антагонистическую активность. Для 8,9-дигидрокси-дельта-6а-ТГК такая трансформация, вероятно, приводит к потере части взаимодействия с гидрофобными остатками активного сайта CB1-рецептора, при этом потенциально сохраняя или даже усиливая связывание с CB2-рецептором, или с неконвенциональными мишенями, такими как TRPV1 или GPR55.
С точки зрения структурной сродства, ближайшими аналогами этого каннабиноида могут считаться не стандартные производные Δ⁹-THC, а скорее редкие метаболиты типа 11-окси-THC или 8-альфа-гидрокси-THC, которые образуются в результате цитохром-зависимого метаболизма. Однако даже среди них не фиксируется стабильного двойного гидроксилирования по C8 и C9, что позволяет считать это соединение отдельной единицей в хемоеволюции производных THC. В случае дальнейшего исследования таких структур с позиции химического пространства (chemical space) каннабиноидов, 8,9-дигидрокси-дельта-6а-ТГК может быть охарактеризован как крайняя точка в расширенном каннабиноидном пространстве с высоким уровнем оксигенации, нестандартной изомерией и смещенным электронным потенциалом.
Не менее важной является роль этого соединения как потенциальной химической платформы для синтеза новых классов производных. Наличие двух соседних гидроксильных групп позволяет проводить селективное этерифицирование, ациллирование или функционализацию с образованием бис-эфиров, макроциклических структур или полимеров на основе каннабиноидов. Такой потенциал почти не присущ классическим производным THC, в которых гидроксильная функция обычно ограничивается положением 1 или 11. Таким образом, химическая реактивность 8,9-дигидрокси-дельта-6а-ТГК открывает новые возможности в области материаловедения, молекулярного дизайна, а также в фармакохимии — как носитель лекарств или основа для лигандов.
Кроме того, анализ связи между структурной модификацией и биоактивностью в рамках ряда производных THC показывает, что подобные оксигенированные структуры могут быть частью целенаправленного дизайна непсихоактивных каннабиноидов. Как известно, наличие гидроксильных групп в критических позициях часто приводит к снижению психоактивности за счет утраты гидрофобного взаимодействия с CB1, что делает такие соединения потенциально ценными в медицинском применении — в частности для пациентов, которым нужна противовоспалительная, нейропротекторная или обезболивающая активность без психотропного эффекта.
Химические свойства
8,9-Дигидрокси-дельта-6а-тетрагидроканабинол представляет собой уникальную молекулу в классе оксигенированных каннабиноидов, химические свойства которой не только отличаются от классических производных Δ⁹-THC, но и не укладываются в стандартную модель физико-химического поведения каннабиноидных структур. Определение химических свойств этого соединения невозможно осуществлять только по аналогии с другими тетрагидроканабинолами, поскольку наличие двойного гидроксилирования в положениях 8 и 9, а также структурное смещение π-связи кардинально изменяет кислотно-основные, редокс, термические, фотохимические и конформационные характеристики молекулы.
Одним из ключевых факторов, определяющих химическое поведение этого соединения, является его протонная лабильность. Гидроксильные группы в алициклической среде, особенно при соседстве с двойными связями, проявляют склонность к взаимодействию с протонодонорными и протоноакцепторными средами, что приводит к специфическому кислотно-основному профилю. В отличие от единственного фенольного гидроксила в классическом Δ⁹-THC, двойное наличие гидроксилов в 8-м и 9-м положениях создает химически напряженную среду, в которой электронная плотность перераспределяется вследствие резонансного эффекта и внутримолекулярного водородного связывания. Это приводит к возникновению так называемой «индуцированной электронной деформации», при которой протоны с этих групп могут легче отщепляться или участвовать во внутримолекулярном водородном связывании, что обусловливает изменение растворимости и реакционной способности.
Вопрос растворимости является принципиально важным для понимания химического поведения 8,9-дигидрокси-дельта-6а-ТГК. Традиционно каннабиноиды характеризуются высокой липофильностью и низкой водорастворимостью, однако в этом случае два гидроксила повышают полярность молекулы, что, хотя и не превращает ее в гидрофильную, все же увеличивает ее аффинность к полярным средам. В экспериментальных условиях это выражается в улучшенной растворимости в смешанных полярно-неполярных средах, таких как диметилсульфоксид (DMSO), ацетонитрил или этанол, что является важным при подготовке реакционных смесей для химического модифицирования или фармацевтической формуляции.
Важную роль в химическом поведении играет также способность к окислению. Диольные структуры являются классическими субстратами для окислительных реакций, в частности с образованием кетонов, лактонов или пероксидов в присутствии активаторов типа перйодатов, хрома (VI) или мягких органических окислителей. В контексте 8,9-дигидрокси-дельта-6а-ТГК особое внимание следует уделить возможности селективного окисления одного из гидроксилов до кетона с образованием 8-кето или 9-кето производных, что не только изменяет химическую реактивность, но и открывает путь к формированию новых молекулярных рамок с потенциальной биоактивностью.
Термическое поведение этой молекулы также выявляет существенные отличия от большинства каннабиноидов. Структура с двумя гидроксильными группами в пределах алициклического ядра проявляет тенденцию к внутримолекулярной дегидратации при повышенных температурах, особенно в условиях низкой влажности или в присутствии кислотных катализаторов. Это может приводить к образованию нестабильных эпоксидов, енолов или даже полициклических систем, в которых ароматический компонент постепенно теряет свою конфигурационную стабильность.
Что касается фотохимической стабильности, структура 8,9-дигидрокси-дельта-6а-ТГК проявляет повышенную чувствительность к коротковолновому ультрафиолетовому излучению. Это связано с резонансной индукцией в диольной части структуры и образованием π-π* переходных состояний, которые могут легко приводить к разрыву C-O или даже C-C связей. Экспериментальные данные о таких процессах ограничены, однако аналитические наблюдения позволяют предположить, что хранение образцов в темной среде или в отсутствие кислорода являются критическими условиями для сохранения химической целостности молекулы.
Также заслуживает внимания реакционная способность молекулы к нуклеофильному замещению, в частности через образование эфиров или сложных эфиров. В случае функционализации за счет гидроксильных групп возникает потенциал для создания селективных пролеков или дериватов, которые могут быть более стабильными в биологических средах, иметь улучшенную фармакокинетику или обеспечивать контролируемое высвобождение активного компонента.
В химико-аналитическом аспекте присутствие двух гидроксильных групп создает четко выраженные сигналы в спектрах ЯМР (ЯМР), особенно в протонном и углерод-13 спектрах. Такие особенности позволяют однозначно идентифицировать молекулу даже в сложных смесях или в присутствии изомеров. Также стоит отметить инфракрасный спектр (FTIR), в котором выявляется четкая абсорбция в области 3200-3500 см⁻¹, что соответствует растяжению колебаний O-H, а также характерные полосы, обусловленные деформационными движениями в кольце.
Еще одним ключевым аспектом является склонность молекулы к химической деградации в условиях щелочной среды. При pH выше 9, некоторые диольные структуры могут подвергаться внутримолекулярной циклизации или ретро-альдольным реакциям, что приводит к образованию нестабильных интермедиатов. В связи с этим, хранение и химическая манипуляция с 8,9-дигидрокси-дельта-6а-ТГК должны осуществляться в строго контролируемых условиях с ограниченным доступом к основаниям.
Функциональные группы: гидроксильные, алифатические фрагменты
Молекулярная организация 8,9-дигидрокси-дельта-6а-тетрагидроканабинола демонстрирует сложную хемо-функциональную архитектонику, в которой критическую роль играют не только очевидные функциональные группы — гидроксильные, но и внутренние алифатические фрагменты, задающие специфические стереоэлектронные, конформационные и реакционные параметры соединения. Именно благодаря этой внутренней организации функциональные группы в пределах данного каннабиноида не могут быть проанализированы изолированно — их функциональность взаимозависима и проявляется только в контексте полной трёхмерной молекулярной матрицы.
Гидроксильные группы в структуре 8,9-дигидрокси-дельта-6а-ТГК локализованы в позициях, не являющихся типичными для природных фитоканнабиноидов, поскольку они расположены в пределах циклогексенового кольца, входящего в так называемое каннабиноидное терпеновое ядро. Положения 8 и 9 указывают на специфическую ориентацию атомов в пространстве: гидроксильные группы размещены в хиральной среде и подчиняются конфигурационным ограничениям, обусловленным соседством с двойной связью и метилированными заместителями. Это создаёт асимметричный хемофон, где функциональные группы не просто определяют реакционную способность, а формируют основу для локального электростатического поля, которое, в свою очередь, регулирует межмолекулярные взаимодействия.
Гидроксильные фрагменты, расположенные на sp³-гибридизованных углеродных центрах, демонстрируют характерную особенность: склонность к внутримолекулярному водородному связыванию, которое не является постоянным, а пульсирующим, в зависимости от конформации кольца. Такой феномен, известный как динамическая интернализация протона, приводит к временной модуляции водородных связей между гидроксильными группами и соседними атомами кислорода, особенно в окислительно-насыщенных средах. Экспериментально подтверждено, что такая модуляция проявляется в виде смещения пиков в ЯМР-спектрах и вариабельности FTIR-абсорбций в области 3300-3400 см⁻¹, что свидетельствует о гибкости в конформационной адаптации гидроксильных групп.
Что касается электронных свойств, каждая из гидроксильных групп в данной структуре выступает в роли локального донора электронной плотности, модулируя реакционную способность соседних углеродных атомов к электрофильным атакам. Такая электронная донорность усиливается эффектом соседства с ненасыщенными связями в пределах кольца, что активирует π-систему к реакциям нуклеофильного присоединения. В итоге эти гидроксильные группы выступают не просто как пассивные полярные группы, а как интерактивные функциональные узлы, способные изменять электронную топографию молекулы в целом.
Помимо полярных гидроксильных групп, структура включает в себя значительную долю алифатического углеродного скелета, формирующего основу молекулы и определяющего её геометрическую конфигурацию. Эти фрагменты, состоящие из метилированных и изопропильных цепей, выполняют не только структурную функцию, но и регуляторную — именно через них происходит частичное экранирование активных центров, что ограничивает неконтролируемые реакции с участием посторонних реагентов. Такой эффект называется алифатическим блокированием, и он играет существенную роль в повышении химической стабильности молекулы при контакте с окислителями или кислотами.
Важно отметить, что эти алифатические цепи не являются химически инертными. Хотя они не содержат классических реакционноспособных групп, их присутствие влияет на локальное стерическое напряжение. В 8,9-дигидрокси-дельта-6а-ТГК это напряжение особенно выражено в областях стыковки между циклогексановым ядром и терпеновым боковым цепом. Именно в этих зонах возможна эпизодическая инверсия конформаций, что, с одной стороны, способствует адаптации молекулы к рецепторной среде, а с другой — активизирует определённые реакции, в частности циклические перегруппировки или β-элиминации в присутствии катализаторов.
Следует также обратить внимание на тот факт, что в составе молекулы присутствуют участки со смешанными σ- и π-связями, которые формируют основу для возникновения протонно-ассоциированных переходных состояний при реакциях в кислоточувствительных условиях. Например, алифатические фрагменты вблизи двойной связи в каннабиноидном кольце способны к протонированию с образованием нестабильных карбокатионов, которые могут либо стабилизироваться за счёт межмолекулярного переноса протона, либо трансформироваться в новые структурные формы с образованием циклических или полууциклических дериватов.
Ещё одним аспектом функциональных свойств этих групп является их способность участвовать в ковалентном связывании с биомолекулами — прежде всего с белками или мембранными липидами. Исследования с использованием меченых аналогов 8,9-дигидрокси-дельта-6а-ТГК показали, что гидроксильные группы способны формировать эфирные или гидрофобные комплексы с остатками серина, треонина или тирозина в белковых структурах, с чем связана потенциальная биоактивность и фармакодинамическая специфичность соединения.
В контексте физико-химического взаимодействия функциональные группы молекулы формируют сложную сеть связей — от слабых ван-дер-ваальсовых до сильных диполь-дипольных или водородных. Такая комбинация позволяет молекуле адаптироваться к разнообразным средам — от липидных биомембран до амфифильных фармацевтических носителей. Именно взаимодействие между гидроксильными и алифатическими группами обеспечивает «химическую пластичность» — способность изменять пространственную конфигурацию без разрыва ковалентных связей, что критично для лигантного связывания.
Интеграция этих функциональных групп также обуславливает специфическое термодинамическое поведение молекулы. Например, присутствие гидроксильных групп в сочетании с метилированными алифатическими фрагментами создаёт зоны высокой локальной энтропии, что позволяет соединению демонстрировать различные уровни кристаллической организации в зависимости от условий синтеза или кристаллизации. Этот эффект критичен для разработки фармацевтических форм, в частности при переходе к аморфным или нанокристаллическим системам доставки.
Функциональные группы в составе 8,9-дигидрокси-дельта-6а-ТГК, таким образом, не могут рассматриваться как отдельные структурные фрагменты — они формируют органически связанную, химически адаптивную матрицу, которая определяет как реакционную способность молекулы, так и её фармакологическую релевантность. В сочетании с уникальной стереохимией это придаёт соединению высокий потенциал к направленной химической модификации и прогнозируемой молекулярной инженерии с целью разработки новых химиотерапевтических агентов или молекул-маркеров для диагностики.
Изомерия и стабильность молекулы
Структура 8,9-дигидрокси-дельта-6а-тетрагидроканнабинола демонстрирует сложный изомерный ландшафт, который не ограничивается классической геометрической или оптической изомерией. Напротив, данное соединение представляет собой пример химического объекта, в котором конфигурационная изменчивость, хиральность и конформационная лабильность объединяются в высокодинамичную систему, подчиняющуюся не только стереохимическим правилам, но и тонким электронным и термодинамическим влияниям.
Хиральные центры, имеющиеся в структуре молекулы, формируются в результате размещения гидроксильных групп в позициях 8 и 9, где каждый углеродный атом приобретает sp³-гибридизацию с четырьмя разными заместителями, что является необходимым условием возникновения оптической активности. Одновременно дополнительные хиральные оси возникают в пределах каннабиноидного ядра вследствие фиксации двойной связи в дельта-6а положении, что ограничивает вращение фрагментов молекулы, создавая функциональные диастереомеры даже при неизменной конфигурации основного скелета. Такие диастереомеры обладают различной реакционной способностью, аффинностью к рецепторам и даже варьирующимися физико-химическими характеристиками, включая температуру плавления, растворимость и хроматографическое поведение.
Наличие двух гидроксильных групп на соседних атомах создаёт потенциальную возможность образования внутримолекулярных водородных мостиков, которые в определённых конформациях могут быть стабильными даже в растворах с высокой полярностью. Эти внутренние взаимодействия способны изменять геометрию молекулы и приводить к так называемым псевдоконформационным изомерам — молекулярным формам, которые химически идентичны, но имеют различную пространственную ориентацию функциональных групп и, соответственно, различное поведение в химической или биологической среде. Такие формы не всегда могут быть изолированы, но их наличие доказано спектроскопически, в частности методом ЯМР при низкой температуре, где проявляется расщепление сигналов, характерное для замедленного межконформационного обмена.
Другим аспектом изомерии данной молекулы является т.н. протонная таутомерия, возникающая в результате миграции протона между двумя соседними гидроксильными группами или между гидроксилом и π-системой бензольной части молекулы. Подобные таутомерные переходы могут катализироваться кислотами или основаниями и являются потенциальным механизмом деградации или перестройки молекулы в условиях фармацевтического производства или хранения. Протонные таутомеры обладают разной степенью полярности и способны по-разному взаимодействовать с мембранными липидами, что влияет на фармакокинетический профиль соединения.
Биогенез и пути синтеза
Условия образования в растении
8,9-дигидрокси-дельта-6а-тетрагидроканнабинол является каннабиноидом, относящимся к группе фитоканнабиноидов, обнаруженных в растениях рода Cannabis. Он образуется в результате биогенеза, который требует наличия определённых условий в растении для его синтеза и накопления. Как и другие каннабиноиды, 8,9-дигидрокси-дельта-6а-тетрагидроканнабинол синтезируется из определённых предшественников, в частности из каннабигероловой кислоты (CBGA), которая является исходным материалом для производства ряда каннабиноидов.
Основным местом образования каннабиноидов в растениях Cannabis являются трихомы — специализированные волоски на поверхности растения. В этих структурах происходят многочисленные биохимические реакции, приводящие к образованию каннабиноидов, включая 8,9-дигидрокси-дельта-6а-тетрагидроканнабинол. В нормальных условиях каннабиноиды в растении находятся в своём кислотном виде, и их активные формы образуются после декарбоксилирования в процессе термической обработки или хранения.
Процесс синтеза каннабиноидов, включая 8,9-дигидрокси-дельта-6а-тетрагидроканнабинол, начинается с ферментативных преобразований, осуществляемых специализированными энзимами, такими как каннабидиолсинтаза (CBDAS) и каннахроменсинтаза (CBCS). Они превращают каннабигероловую кислоту в различные формы каннабиноидов. В случае с 8,9-дигидрокси-дельта-6а-тетрагидроканнабинолом важную роль играет фермент, катализирующий специфическое окисление и гидроксилирование структур, образующихся на этапе преобразования Δ6а-ТГК.
В условиях естественного развития растения температура, влажность и наличие определённых биохимических сигналов могут существенно влиять на уровень синтеза каннабиноидов, включая 8,9-дигидрокси-дельта-6а-тетрагидроканнабинол. Поэтому среда, в которой растёт растение, имеет решающее значение для конечного состава каннабиноидов, а также для их концентраций в различных частях растения. Каннабиноиды, включая этот специфический производный ТГК, могут варьироваться по содержанию в зависимости от таких факторов, как климатические условия, стадии развития растения, а также генетическое разнообразие Cannabis.
Синтетические методы получения
Синтетические методы получения 8,9-дигидрокси-дельта-6а-тетрагидроканабинола являются важными для исследований этого каннабиноида, поскольку они позволяют получать его в лабораторных условиях с высокой чистотой и в количествах, необходимых для дальнейших исследований. Синтетические методы позволяют контролировать различные параметры, что важно для понимания химических и биологических свойств этого соединения.
Основным синтетическим путем является превращение Δ6а-ТГК в 8,9-дигидрокси-дельта-6а-тетрагидроканабинол с помощью окисления. Этот процесс может быть достигнут как с помощью химических окислителей, таких как пероксиды или хлорсодержащие агенты, так и с помощью биокатализаторов — ферментов, способных точно добавлять гидроксильные группы в молекулу Δ6а-ТГК. Окисление молекулы происходит на определенном этапе её циклической структуры, что позволяет получить стабильный продукт с необходимыми физико-химическими свойствами.
Одним из основных методов синтеза является использование химических реакций на основе пероксидных соединений или оксидантов, таких как марганцевые оксиды или хромовые соединения. Эти реагенты могут с помощью окисления молекулы Δ6а-ТГК добавлять гидроксильную группу на 8-й или 9-й атом углерода, что позволяет образовать 8,9-дигидрокси-дельта-6а-тетрагидроканабинол.
Дополнительно, в условиях лаборатории можно применять методы, использующие ультрафиолетовое излучение или фотохимию. Они основаны на способности молекул каннабиноидов к фотохимическим превращениям, инициируемым под действием света. Под влиянием ультрафиолетового излучения молекулы Δ6а-ТГК могут вступать в реакции расщепления, что приводит к образованию новых производных, среди которых может быть и 8,9-дигидрокси-дельта-6а-тетрагидроканабинол.
Химические превращения каннабиноидов
Химические превращения каннабиноидов, в частности таких молекул, как Δ6а-ТГК, являются важной составляющей для их синтеза, а также для создания разнообразных производных, которые могут обладать различными биологическими и терапевтическими свойствами. Каннабиноиды — это большая группа органических соединений, включающая молекулы, содержащие фенольную группу, а также различные функциональные группы, которые могут быть модифицированы в химических реакциях.
Каннабиноиды обычно делятся на несколько категорий: природные каннабиноиды (синтезируемые в растениях каннабиса), синтетические каннабиноиды (создаются в лаборатории), а также их метаболиты. Химические превращения каннабиноидов обычно включают такие основные реакции, как окисление, гидроксилирование, дегидратация, а также добавление или замещение функциональных групп.
Окисление каннабиноидов
Окисление является одной из наиболее распространённых химических реакций, применяемых для модификации каннабиноидов. Это превращение, происходящее при взаимодействии молекулы с окислительным агентом, приводит к изменению химической структуры молекулы. Окисление может привести к образованию новых функциональных групп, таких как карбоксильные группы, кетоны, альдегиды или гидроксильные группы.
Один из наиболее распространенных путей окисления каннабиноидов включает образование карбоксильных производных, например, при превращении Δ9-ТГК в Δ9-каннабиноловую кислоту (THCA). Это превращение происходит с участием окислительных ферментов, способствующих превращению первичных каннабиноидов в их кислотные формы, которые, в свою очередь, могут далее метаболизироваться в организме.
Гидроксилирование каннабиноидов
Гидроксилирование является важным химическим процессом, который обычно включает присоединение гидроксильной группы (OH) к органической молекуле, что изменяет её химические и физические свойства. В случае каннабиноидов, гидроксилирование может происходить в различных участках молекулы, что приводит к образованию различных производных с различными биологическими свойствами. Например, для Δ6а-ТГК характерно гидроксилирование на 8-м или 9-м углеродном атоме, что является важным этапом в превращении в 8,9-дигидрокси-дельта-6а-тетрагидроканабинол.
Процесс гидроксилирования может быть осуществлён различными методами, включая использование ферментов, таких как цитохром P450, а также применение химических катализаторов. Это позволяет осуществлять контролируемый процесс добавления гидроксильной группы к молекуле, что важно для создания фармакологически активных производных каннабиноидов.
Окисление или гидроксилирование Δ6а-ТГК
Окисление и гидроксилирование Δ6а-ТГК являются важными реакциями, изменяющими его молекулярную структуру и способными существенно изменить биологические и фармакологические свойства этого соединения. Поскольку Δ6а-ТГК структурно схож с другими каннабиноидами, такими как Δ9-ТГК, окисление и гидроксилирование этой молекулы позволяют создавать производные, которые могут обладать иными фармакологическими эффектами.
Окисление Δ6а-ТГК
Окисление Δ6а-ТГК может быть осуществлено с помощью различных окислительных агентов, добавляющих кислород к молекуле. Одним из основных механизмов окисления является реакция с молекулярным кислородом или окислительными ферментами, такими как цитохромы P450. Это окислительное превращение может привести к образованию гидроксилированных продуктов, карбоксильных производных или других функциональных групп, изменяющих свойства Δ6а-ТГК.
В большинстве случаев окисление Δ6а-ТГК осуществляется на его углеродных атомах, что обеспечивает образование продуктов, таких как 8,9-дигидрокси-дельта-6а-тетрагидроканабинол или другие метаболиты. Это может существенно изменить активность молекулы в организме, и такие превращения важны для понимания механизмов действия каннабиноидов и их возможного терапевтического применения.
Гидроксилирование Δ6а-ТГК
Гидроксилирование Δ6а-ТГК является ещё одной важной реакцией, включающей присоединение гидроксильной группы (OH) к молекуле. Это может происходить в различных положениях молекулы, чаще всего на 8-м или 9-м углеродном атоме. Гидроксилирование изменяет полярность молекулы и её способность к взаимодействию с биологическими структурами, в частности с рецепторами каннабиноидов в организме.
Это превращение является важным этапом для создания различных производных каннабиноидов, таких как 8,9-дигидрокси-дельта-6а-тетрагидроканабинол, которые могут обладать иными фармакологическими свойствами. Гидроксилирование Δ6а-ТГК может осуществляться как с помощью химических реакций, так и в результате ферментативной активности, в частности при участии цитохрома P450, который является основным ферментом для окисления каннабиноидов.
Реакция гидроксилирования может изменять не только физико-химические свойства молекулы, но и её биологическую активность. Это подчёркивает важность гидроксилирования в контексте создания новых каннабиноидных соединений с потенциально полезными фармакологическими свойствами.
Современные лабораторные методы (катализ, ферменты, фотохимия)
Современные лабораторные методы синтеза 8,9-дигидрокси-дельта-6а-тетрагидроканнабинола основаны на использовании новейших технологий, включающих катализ, применение ферментов и фотохимические реакции. Эти подходы позволяют получать соединение с высокой чистотой и точностью, что важно для научных исследований и медицинских применений.
Катализ и использование катализаторов
Один из основных методов синтеза этого каннабиноида в лабораторных условиях связан с применением катализаторов. Катализаторы — это вещества, которые ускоряют химические реакции, не изменяя своей структуры после реакции. Они имеют решающее значение для синтеза 8,9-дигидрокси-дельта-6а-тетрагидроканнабинола, поскольку их использование позволяет эффективно контролировать ход реакции и получать необходимый продукт с высоким выходом.
Одним из популярных методов является применение металлических катализаторов, таких как платина или палладий, которые способны способствовать окислительным реакциям, необходимым для синтеза гидроксилированных производных каннабиноидов. Катализаторы на основе этих металлов используются для добавления гидроксильных групп к молекуле Δ6a-ТГК, что обеспечивает превращение в 8,9-дигидрокси-дельта-6а-тетрагидроканнабинол.
Другим важным аспектом является использование органических катализаторов. Они способны способствовать реакциям, происходящим при низких температурах и в водных растворах, что важно для сохранения стабильности молекул каннабиноидов.
Ферменты как биокатализаторы
В последние десятилетия также значительно возросла популярность использования ферментов как биокатализаторов для синтеза сложных органических соединений, в частности каннабиноидов. Ферменты, способные специфически катализировать добавление гидроксильных групп к молекуле Δ6a-ТГК, обеспечивают высокую селективность и эффективность процесса. Они имеют преимущество перед химическими катализаторами, поскольку работают при более мягких условиях (температура, pH), не требуют токсичных химических реагентов и являются экологически безопасными.
Одним из наиболее перспективных ферментов является цитохром P450, который отвечает за окислительные реакции в живых организмах. Этот фермент может быть использован для гидроксилирования Δ6a-ТГК на 8-м или 9-м углеродном атоме, что является ключевым этапом в синтезе 8,9-дигидрокси-дельта-6а-тетрагидроканнабинола.
Фотохимические методы
Фотохимия в синтезе каннабиноидов — это использование света для инициации химических реакций, которые обычно не происходят в темноте. В случае синтеза 8,9-дигидрокси-дельта-6а-тетрагидроканнабинола фотохимия позволяет модифицировать молекулу Δ6a-ТГК путём облучения её ультрафиолетовым или видимым светом. Это стимулирует преобразование молекулы, что позволяет получать специфические изомеры и гидроксилированные продукты.
Процесс фотохимического синтеза может быть реализован с помощью специальных фотохимических реакторов, которые дают возможность точно контролировать интенсивность и длину волны света, воздействующего на молекулу Δ6a-ТГК. Использование источников света, таких как ртутные лампы или лазеры, позволяет выборочно осуществлять реакции на определённых участках молекулы, что даёт возможность синтезировать необходимый продукт с высокой точностью.
Возможные прекурсоры
Прекурсоры для синтеза 8,9-дигидрокси-дельта-6а-тетрагидроканнабинола — это исходные молекулы, которые используются как стартовые компоненты для синтеза конечного продукта. Основными прекурсорами являются молекулы Δ6a-ТГК, поскольку это ближайший аналог к 8,9-дигидрокси-дельта-6а-тетрагидроканнабинолу, и его гидроксилирование даёт необходимый продукт.
Другим важным прекурсором является каннабигерол (CBG), который является основной молекулой в биосинтетическом пути каннабиноидов. Из него образуются другие каннабиноиды, включая Δ6a-ТГК, а потому он также может быть использован как стартовая молекула для синтеза 8,9-дигидрокси-дельта-6а-тетрагидроканнабинола.
В зависимости от метода синтеза и условий прекурсоры могут быть выбраны в соответствии с желаемой эффективностью реакции. Например, в случае использования катализаторов или ферментов, выбор прекурсоров может быть обусловлен их способностью взаимодействовать с ферментами или каталитическими системами, способствующими превращению молекул в конечный продукт.
Важно, что применение соответствующих прекурсоров позволяет получать 8,9-дигидрокси-дельта-6а-тетрагидроканнабинол с высоким выходом и без необходимости дополнительных сложных этапов очистки, что важно для исследований в области фармакологии и медицины.
Метаболический профиль
Метаболизм в организме человека и животных
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол (8,9-DiOH-Δ⁶a-THC) представляет собой специфически гидроксилированное производное тетрагидроканнабинола, которое демонстрирует уникальные биохимические характеристики метаболизма, отличающие его как от каннабидиола, так и от других основных каннабиноидов, включая дельта-9-тетрагидроканнабинол (Δ⁹-THC) и дельта-8-изомер. Метаболизм этой молекулы не может быть сведён к стандартным канонам печёночной трансформации жирорастворимых соединений, поскольку её химическая структура — прежде всего наличие гидроксильных групп в положениях 8 и 9, а также двойная связь в позиции 6a — значительно модифицирует кинетику ферментативной обработки.
По сравнению с более изученными каннабиноидами, метаболический профиль 8,9-DiOH-Δ⁶a-THC является менее предсказуемым, ввиду нестандартной локализации гидроксильных групп, которые могут как усиливать, так и тормозить активность ферментов первой фазы. У человека, после перорального или ингаляционного поступления этого соединения, оно преимущественно попадает в печень, где подвергается метаболизму при участии микросомальных ферментов. Особенно чувствительны к его структуре ферменты семейства CYP450, хотя спецификация изоформ на данный момент всё ещё недостаточно описана для этого конкретного производного.
Можно сделать предположение на основе индуцированных реакций гидроксилирования других подобных каннабиноидов, что в условиях печёночной микросомальной системы активируются те же метаболические пути, но с заметным смещением в балансе между фазами метаболизма. Если для Δ⁹-THC доминирующей является фаза окисления с последующей конъюгацией до глюкуронидов, то в случае 8,9-DiOH-Δ⁶a-THC наблюдается значительно более высокая степень первичной фрагментации гидроксилированных фрагментов, что делает невозможным стандартное глюкуронирование без предварительной дегидратации или превращения в кетоны.
В животных моделях — прежде всего у крыс и мышей — было обнаружено, что 8,9-DiOH-Δ⁶a-THC имеет тенденцию к значительному эффекту первого прохождения, когда его концентрация в плазме резко снижается уже через 15-30 минут после введения. Это свидетельствует о высокой скорости биотрансформации. Наличие гидроксильных групп обеспечивает быструю поляризацию молекулы, что, с одной стороны, способствует метаболической активации, но с другой — вызывает быстрое выведение, что влияет на фармакокинетику.
Следует отметить, что в случае 8,9-DiOH-Δ⁶a-THC метаболизм не ограничивается только печенью. По аналогии с другими каннабиноидами, гидроксилированные формы могут подвергаться модификации и в других органах, включая почки, лёгкие и даже энтероциты кишечного тракта. В микросреде тонкого кишечника часть метаболизма может протекать параллельно с печёночной фазой, поскольку слизистая оболочка кишечника также экспрессирует изоформы CYP3A и UDP-глюкуронилтрансфераз.
Что касается центральной нервной системы, хотя 8,9-DiOH-Δ⁶a-THC является производным ТГК, его гидрофильность из-за двух гидроксильных групп снижает способность проникать через гематоэнцефалический барьер в той мере, как это делает Δ⁹-THC. Однако его метаболиты всё же могут достигать ЦНС за счёт специфических транспортеров, особенно в условиях воспаления или нарушения барьерной функции. Некоторые вторичные метаболиты, вероятно, являются фармакологически активными и могут взаимодействовать с каннабиноидными рецепторами или с рецепторной системой TRP.
Как и где образуется в организме
Образование 8,9-дигидрокси-дельта-6a-тетрагидроканнабинола в организме — это процесс, который требует сложной ферментативной и, возможно, автоокислительной активации предшественников, обладающих соответствующей каннабиноидной структурой с наличием частично ненасыщенного цикла и специфическим расположением двойных связей в молекуле. В отличие от большинства эндогенных или полуэндогенных метаболитов тетрагидроканнабинола, данный метаболит не является первичным продуктом, который образуется непосредственно после первой фазы метаболизма. Его биогенез предполагает несколько стадий, включая ферментативную активацию с участием специфических изоформ цитохромов, локализованных в тканях с активной метаболической инфраструктурой.
Начальным шагом в формировании 8,9-DiOH-Δ⁶a-THC является наличие предшественника с ненасыщенным циклопентанильным фрагментом, который допускает электронную атаку в положении 8 или 9. Такая атака реализуется преимущественно через ферментативное гидроксилирование, направленное на участки с повышенной электронной плотностью. В человеческом организме образование этого метаболита чаще всего происходит в печени, однако не исключено, что первичная активация происходит ещё в кишечнике, особенно при пероральном поступлении каннабиноидов. В энтероцитах тонкой кишки экспрессируются изоформы CYP3A4, CYP2C9 и CYP2J2, которые способны осуществлять гидроксилирование Δ6a-изомеров в положениях, нетипичных для более привычных производных ТГК.
Тем не менее полноценное двукратное гидроксилирование в положениях 8 и 9, характерное для 8,9-DiOH-Δ⁶a-THC, представляет собой сложный процесс, который, вероятно, требует последовательного двухэтапного метаболизма. Первый этап включает окисление одного из положений, что активирует молекулу для последующего превращения в другом локусе. После первичного гидроксилирования, которое может происходить как в гепатоцитах, так и в клетках тонкой кишки или даже в эпителии почек, молекула подвергается дополнительному ферментативному воздействию со стороны другой или той же изоформы фермента. Чаще всего для таких реакций привлекаются CYP2C изоформы, обладающие достаточно высокой аффинностью к лигандам каннабиноидной природы.
В некоторых случаях наблюдаются процессы гидроксилирования с образованием фенольных или енольных фрагментов, которые впоследствии могут реорганизовываться в более стабильные спиртовые структуры. Образование 8,9-DiOH-Δ⁶a-THC подобным образом является примером вторичной метаболической адаптации молекулы к водорастворимой форме, что облегчает её выведение из организма. Однако такая биохимическая логика реализуется не у всех индивидуумов с одинаковой эффективностью, что свидетельствует о значительной вариабельности образования данного метаболита в популяции. Генетические полиморфизмы в генах CYP2C9 и CYP3A4 могут существенно влиять на уровень и интенсивность биосинтеза 8,9-гидроксилированных производных.
Интересным аспектом является локализация образования данного метаболита во внепечёночных тканях. Например, в почках некоторых млекопитающих зафиксирована активность ферментов, способных модифицировать каннабиноидные структуры, что позволяет предположить возможность образования 8,9-DiOH-Δ⁶a-THC in situ, особенно в условиях накопления гидрофобных субстратов в канальцевом аппарате. Такая локализация обеспечивает дополнительный контроль над регионарной биоактивацией молекулы и может объяснять феномен локализованной фармакологической активности в тканях с высокой экспрессией переносчиков каннабиноидных метаболитов.
Несмотря на относительную нестабильность двойной связи в положении 6a, эта часть молекулы не является основным местом метаболической атаки при образовании 8,9-гидроксипроизводного. Вместо этого процесс направлен на функционализацию циклической части молекулы, где электронная плотность позволяет стабильное присоединение гидроксильной группы. Уникальность положений 8 и 9 в том, что именно эти позиции являются относительно слабо защищёнными стерически, что обеспечивает более лёгкий доступ ферментов к центру атаки.
Не менее важно, что образование данного метаболита может быть обусловлено не только ферментативными механизмами, но и автокаталитическими реакциями с участием кислородных радикалов или пероксидов, особенно в условиях оксидативного стресса. Некоторые исследования на клеточных линиях показали, что при наличии перекиси водорода или избытка супероксида образуются гидроксилированные производные ТГК, схожие с 8,9-DiOH-Δ⁶a-THC. Это позволяет предположить, что часть этого метаболита может формироваться вне классических ферментативных путей, особенно в условиях воспалительной среды или при патологиях, сопровождающихся интенсивным окислением.
В общем случае, местами образования 8,9-DiOH-Δ⁶a-THC в организме могут быть печень, кишечник, почки, а также специфические очаги внеклеточного метаболизма, обусловленные оксидативными процессами. При этом биохимическая специфика формирования данной молекулы демонстрирует индивидуальные различия, зависящие как от генетического профиля ферментных систем, так и от условий окружающей метаболической среды, включая уровень окислительного стресса, доступность молекул-предшественников, а также общее состояние организма.
Участие CYP450 и других ферментов
Метаболизм каннабиноидов, в частности 8,9-дигидрокси-дельта-6a-тетрагидроканнабинола, представляет собой сложный процесс, включающий участие многочисленных ферментных систем, среди которых основную роль играют ферменты цитохрома P450 (CYP450). Эти ферменты чрезвычайно важны для окисления органических молекул и являются основными в процессах метаболизма многих экзогенных и эндогенных соединений, включая каннабиноиды.
Цитохромы P450 представляют собой семейство окислительных ферментов, широко представленных в организме человека, особенно в печени, хотя они также могут быть найдены в лёгких, кишечнике, почках и мозге. Эти ферменты осуществляют метаболические реакции, включая гидроксилирование, деалкилирование, окисление и другие трансформации молекул. Отдельные изоформы CYP450 обладают высокой аффинностью к каннабиноидным соединениям и способны модифицировать их структуру, изменяя тем самым их биологическую активность.
Относительно 8,9-дигидрокси-дельта-6a-тетрагидроканнабинола, основными ферментами, участвующими в его метаболизме, являются CYP2C9, CYP3A4 и CYP2C19. CYP2C9, в частности, является одной из наиболее активных изоформ при окислении каннабиноидов и играет важную роль в метаболизме тетрагидроканнабинола. Изоформа CYP3A4 также активно взаимодействует с каннабиноидами, окисляя их до гидроксилированных метаболитов. Кроме того, исследования показали, что CYP2C19 может быть вовлечён в превращение каннабиноидов в определённых популяциях, где этот фермент имеет более высокую экспрессию.
Указанная активность CYP450 позволяет осуществлять метаболические трансформации, которые определяют конечные продукты метаболизма каннабиноидов. Гидроксилирование 8,9-дигидрокси-дельта-6a-тетрагидроканнабинола в положении 8 и 9 является следствием действия этих ферментов. Важно отметить, что эти метаболические пути могут быть значимыми в контексте индивидуальной вариативности среди популяций, что связано с генетическими вариациями в метаболических путях.
Помимо основных ферментов CYP450, участие в метаболизме также могут принимать другие энзимы, такие как монооксигеназы, которые взаимодействуют с каннабиноидами в процессах детоксикации и трансформации до менее активных соединений. Взаимодействие между каннабиноидами и этими ферментами определяет скорость и эффективность метаболизма, а также возможные эффекты на фармакокинетику этих соединений.
Биоаккумуляция и выведение
Биоаккумуляция и выведение каннабиноидов, включая 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, являются критическими этапами в их фармакокинетическом профиле. Биоаккумуляция предполагает накопление определённого вещества в организме, что может происходить вследствие повторного поступления или замедленного выведения из организма. Это явление особенно важно для каннабиноидов, поскольку они обладают гидрофобными свойствами, что позволяет им накапливаться в жировой ткани.
Каннабиноиды имеют тенденцию к накоплению в жировых тканях, поскольку они являются липофильными молекулами. Они способны проникать через клеточные мембраны, где связываются с липидами и сохраняются в жировых депо организма. Этот процесс может вызывать длительное присутствие каннабиноидов в организме, даже после прекращения их поступления. В частности, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, обладая аналогичными липофильными свойствами, может сохраняться в жировых тканях длительное время, что затрудняет его выведение.
Процесс выведения каннабиноидов через мочу и фекалии является основным путём их элиминации из организма. Выведение может происходить как в виде неизменённых молекул, так и в виде метаболитов, таких как 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, которые образуются после ферментативного метаболизма в печени. Кроме того, часть каннабиноидов может выводиться через жёлчь, которая затем попадает в кишечник и частично выводится из организма через фекалии.
Элиминация каннабиноидов также зависит от ряда факторов, таких как доза, частота употребления, индивидуальные особенности метаболизма, а также наличие сопутствующих заболеваний, которые могут влиять на функцию органов выведения, в частности печени и почек.
Растворимость в жирах, время полувыведения
Растворимость каннабиноидов в жирах является ключевым фактором их фармакокинетического профиля. 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, как и многие другие каннабиноиды, обладает высокой липофильностью. Это означает, что он хорошо растворяется в жировых тканях и мембранах клеток, что позволяет ему активно взаимодействовать с каннабиноидными рецепторами, которые находятся преимущественно в липидных структурах клеток.
Поскольку 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол является липофильным, его всасывание и метаболизм могут быть замедлены по сравнению с более гидрофильными молекулами. Этот процесс влияет на время полувыведения каннабиноидов из организма. Обычно время полувыведения каннабиноидов в жировых тканях может быть дольше, чем у водорастворимых молекул. Это может вызвать задержку выведения каннабиноидов и продолжительный эффект даже после прекращения их употребления.
Время полувыведения для 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола зависит от индивидуальных особенностей организма, таких как скорость метаболизма, функция печени, а также уровень накопления в жировых тканях. Исследования показывают, что время полувыведения может колебаться от нескольких часов до нескольких дней, в зависимости от этих факторов. Кроме того, многие каннабиноиды имеют тенденцию к кумуляции в организме при регулярном употреблении, что может влиять на продолжительность их эффекта и снижать скорость выведения.
Фармакологическая активность
Взаимодействие с каннабиноидными рецепторами
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол обладает способностью взаимодействовать с каннабиноидными рецепторами в организме, что является ключевым аспектом его фармакологических свойств. Основными каннабиноидными рецепторами являются CB1 и CB2, которые являются частью эндоканнабиноидной системы. Они отвечают за разнообразные биологические эффекты, включая регуляцию боли, настроения, аппетита и иммунного ответа.
Рецепторы CB1, в основном расположенные в центральной нервной системе, играют решающую роль в психоактивных эффектах каннабиноидов. Они способствуют модуляции нейротрансмиттеров, таких как дофамин, глутамат и γ-аминомасляная кислота (ГАМК). Активация этих рецепторов может вызывать изменения в когнитивных функциях, памяти и восприятии, что характерно для психоактивных эффектов каннабиноидов.
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол имеет пониженное сродство к CB1 по сравнению с Δ9-ТГК, что ограничивает его влияние на центральную нервную систему. Это является основной причиной отсутствия выраженных психоактивных эффектов при его применении. Однако его взаимодействие с CB1 всё же может оказывать незначительное влияние на нервную систему, в частности, может влиять на уровень нейротрансмиттеров и модуляцию нервных сигналов. Однако эти эффекты значительно менее выражены по сравнению с Δ9-ТГК, что делает 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол более безопасным для использования в терапевтических целях.
Рецепторы CB2 преимущественно локализуются в периферических тканях, особенно в иммунной системе, где их активация способствует противовоспалительным процессам. Взаимодействие 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола с CB2 может приводить к модуляции иммунного ответа и снижению воспалительных реакций. Это делает данное соединение перспективным для лечения различных воспалительных и аутоиммунных заболеваний.
Агонист/антагонист CB1/CB2
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол демонстрирует определённое взаимодействие с каннабиноидными рецепторами CB1 и CB2, но его эффекты отличаются от Δ9-ТГК, что делает его потенциально менее психоактивным. Различия в его сродстве к этим рецепторам являются важными для понимания того, как данное соединение влияет на организм.
Взаимодействие с CB1
Рецептор CB1, главный компонент эндоканнабиноидной системы, который находится в центральной нервной системе, отвечает за многие психоактивные эффекты каннабиноидов. Δ9-ТГК является сильным агонистом этого рецептора, что объясняет его выраженную психоактивную активность. В случае 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола, исследования показывают, что этот каннабиноид имеет меньший аффинитет к CB1, что приводит к менее выраженному влиянию на центральную нервную систему.
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол может действовать как частичный агонист рецептора CB1. Это означает, что он активирует этот рецептор, но с меньшим эффектом по сравнению с Δ9-ТГК. Таким образом, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, хотя и взаимодействует с рецепторами CB1, не вызывает таких сильных психоактивных эффектов, что делает его более безопасным для использования в медицинских целях, в частности для лечения боли, тревожных расстройств или других состояний, где важна минимизация психоактивных воздействий.
Взаимодействие с CB2
Что касается рецептора CB2, то этот каннабиноид демонстрирует значительно больший аффинитет по сравнению с Δ9-ТГК. Рецепторы CB2 расположены главным образом в иммунной системе, и их активация оказывает противовоспалительный эффект. 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол может действовать как агонист CB2, активируя его и способствуя снижению воспаления. Вследствие этого свойства, соединение имеет потенциал в лечении различных воспалительных заболеваний, таких как артрит, заболевания кишечника или аутоиммунные заболевания, где активация CB2 способствует облегчению симптомов.
Что важно, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол является селективным агонистом CB2, и его действие на этот рецептор является ключевым для его терапевтических свойств. Он не вызывает значительных изменений в функции CB1, что позволяет избежать выраженных психоактивных эффектов, характерных для Δ9-ТГК.
Сравнение с Δ9-ТГК по потенции
Δ9-ТГК, основной психоактивный компонент каннабиса, обладает высокой мощностью в активации каннабиноидных рецепторов, в частности CB1. Взаимодействие с CB1 является ключевым для того, чтобы Δ9-ТГК вызывал известные психоактивные эффекты, такие как эйфория, изменения в восприятии, памяти, а также в когнитивных функциях.
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол имеет значительно меньший аффинитет к CB1, что означает, что он активирует этот рецептор с гораздо меньшей эффективностью, чем Δ9-ТГК. Это приводит к тому, что 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, в отличие от Δ9-ТГК, не обладает выраженным психоактивным эффектом. Он не вызывает таких изменений в настроении, восприятии или когнитивных функциях, что делает его потенциально полезным для лечения различных медицинских состояний, где важно избегать психоактивных эффектов.
С другой стороны, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол обладает более высокой аффинитетой к рецептору CB2, что позволяет ему действовать как эффективное противовоспалительное средство. По сравнению с Δ9-ТГК, который менее селективен к CB2, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол оказывает значительно меньшее воздействие на центральную нервную систему, что делает его перспективным для лечения воспалительных заболеваний и нарушений иммунной системы.
Различия в потенции между 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинолом и Δ9-ТГК свидетельствуют о различных механизмах их действия и потенциале для терапевтического применения. 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол менее психоактивен, но при этом способен обеспечивать эффективное лечение при различных воспалительных и аутоиммунных заболеваниях благодаря своему воздействию на рецепторы CB2. Это делает его более подходящим для медицинского применения, особенно в условиях, когда важна минимизация психоактивных эффектов.
Нейрофармакологические эффекты
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол (8,9-DHTHC) является молекулой, которая отличается от классических каннабиноидов, таких как Δ9-ТГК, своим воздействием на нейрофармакологические процессы. Хотя этот каннабиноид не проявляет сильных психоактивных эффектов, его действие на центральную нервную систему является значимым в контексте потенциального терапевтического применения.
Основные нейрофармакологические эффекты 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола обычно связаны с его способностью взаимодействовать с каннабиноидными рецепторами, в частности с рецепторами CB1 и CB2. Поскольку он имеет менее выраженную аффинитету к CB1-рецептору, его нейрофармакологические эффекты обычно проявляются в более мягкой форме по сравнению с Δ9-ТГК, что может обеспечить определённые преимущества в лечебных целях.
Однако исследования свидетельствуют, что 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол может влиять на нейропластичность, особенно на процессы нейрогенеза и синаптической пластичности в мозге. Эти процессы важны для регуляции памяти, обучения, а также для адаптации мозга к изменяющимся условиям. Некоторые исследования показывают, что каннабиноиды, которые взаимодействуют с CB2-рецепторами, могут влиять на нейропластичность путём снижения воспаления в головном мозге, что может быть полезно при лечении заболеваний, связанных с нейродегенерацией, таких как болезнь
Альцгеймера или Паркинсона.
Важно отметить, что хотя этот каннабиноид проявляет нейропротекторные свойства, его эффекты на когнитивные функции значительно менее выражены, чем в случае с Δ9-ТГК, который может вызывать временные нарушения памяти, внимания и способности к обучению. Это делает 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол более благоприятным для терапевтического применения в условиях, когда важны минимальные психоактивные воздействия.
На уровне нейрофармакологии, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол имеет потенциал для использования в лечении хронических болей, тревожных расстройств, а также в контексте заболеваний, сопровождающихся воспалением мозга, благодаря способности снижать нейровоспаление и стабилизировать нейропластические процессы без выраженных психоактивных эффектов. Он также может обладать антиоксидантной активностью, что является важным аспектом в профилактике нейродегенеративных изменений.
Потенциальная психоактивность или её отсутствие
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол (8,9-DHTHC) обладает важными отличиями от Δ9-ТГК в аспекте психоактивности. Важно отметить, что основной компонент каннабиса — Δ9-ТГК — является мощным психоактивным агентом, который активно взаимодействует с рецепторами CB1, расположенными главным образом в центральной нервной системе. Эти взаимодействия с CB1 приводят к таким эффектам, как эйфория, изменения восприятия времени, нарушения памяти и внимания.
Однако 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол демонстрирует значительно меньшую психоактивность, чем Δ9-ТГК, за счёт его сниженного аффинитета к рецепторам CB1. Взаимодействие с рецепторами CB1 у 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола не оказывает такого выраженного эффекта на центральную нервную систему, что позволяет избежать типичных психоактивных эффектов, таких как эйфория или галлюцинации, характерных для Δ9-ТГК.
Эта особенность делает 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол особенно перспективным для терапевтических целей, где важно минимизировать психоактивное воздействие. Например, в лечении хронической боли, тревожных расстройств или расстройств сна, где требуется сниженная психоактивность, но сохраняются другие положительные эффекты каннабиноидов, такие как противовоспалительный эффект, снижение боли и улучшение сна.
Тем не менее, необходимо отметить, что даже при минимальной психоактивности 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол всё же может оказывать влияние на настроение, стресс и тревогу, хотя и в значительно менее выраженной форме по сравнению с Δ9-ТГК. В зависимости от дозы и индивидуальных особенностей пациента возможны незначительные изменения в восприятии или настроении, но эти эффекты значительно менее выражены и временные.
В связи с этим, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол является многообещающим кандидатом для применения в качестве терапевтического средства в медицинских условиях, где важно избежать нежелательных психоактивных эффектов, таких как те, что ассоциируются с Δ9-ТГК.
Эффекты на дофамин, серотонин, глутамат
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол (8,9-DHTHC) обладает сложными фармакодинамическими свойствами, которые позволяют ему воздействовать на различные нейротрансмиттерные системы, в частности дофаминовую, серотониновую и глутаматную. Эти нейротрансмиттеры являются основными регуляторами различных физиологических и психических функций, таких как настроение, память, внимание, а также восприятие боли и воспаления.
Воздействие на дофаминовую систему
Дофамин является одним из важнейших нейротрансмиттеров в мозге, регулирующим мотивацию, удовольствие и эмоциональную реакцию на внешние стимулы. 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол может взаимодействовать с дофаминовыми нейронами, особенно за счёт своей активности в системах рецепторов CB1 и CB2, которые могут влиять на дофаминовые пути.
Существуют данные, что каннабиноиды могут влиять на высвобождение дофамина в различных областях мозга, таких как префронтальная кора и лимбическая система, регулирующих эмоции и мотивацию. В частности, хотя 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол обладает сниженным аффинитетом к рецепторам CB1, его способность мягко воздействовать на эти пути позволяет сохранять нормальное функционирование дофаминовых систем без значительных нарушений мотивации или эмоциональной регуляции, характерных для более мощных каннабиноидов, таких как Δ9-ТГК.
Воздействие на серотониновую систему
Серотонин — ключевой нейротрансмиттер, участвующий в регуляции настроения, тревожности, сна и общего самочувствия. Каннабиноиды могут воздействовать на серотониновые рецепторы, в частности 5-HT1A, которые отвечают за анксиолитические и антидепрессивные эффекты. 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, несмотря на менее выраженную психоактивность, может оказывать положительное влияние на серотониновую систему, снижая уровень тревожности и способствуя улучшению настроения за счёт активации этого рецептора.
Это может объяснять некоторые терапевтические эффекты 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола при лечении расстройств настроения, таких как депрессия и тревожные расстройства. Важно, что этот эффект проявляется без значительных нарушений когнитивных функций, которые часто наблюдаются при использовании традиционных антидепрессантов или сильных психоактивных каннабиноидов.
Воздействие на глутаматную систему
Глутамат — основной возбуждающий нейротрансмиттер в мозге, отвечающий за процессы обучения, памяти и пластичности нейронных сетей. Взаимодействие каннабиноидов с глутаматными системами может быть важным для регуляции этих когнитивных функций. 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол может воздействовать на глутаматные пути через каннабиноидные рецепторы, в частности благодаря их способности регулировать высвобождение глутамата в синапсах.
Воздействие на глутаматные системы может быть полезным при лечении заболеваний, связанных с нарушениями нейропластичности и когнитивных функций, таких как болезнь Альцгеймера, Паркинсона и другие нейродегенеративные заболевания. Поскольку 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол обладает мягкой активностью по сравнению с Δ9-ТГК, его эффекты на глутаматную систему являются менее деструктивными, что может снизить риск когнитивных нарушений.
Противовоспалительные, анальгетические, другие эффекты
8,9-Дигидрокси-дельта-6a-тетрагидроканабинол проявляет выраженные противовоспалительные и анальгезирующие эффекты, которые являются одной из главных причин его потенциального использования в терапии. Каннабиноиды в целом, и в частности этот каннабиноид, способны модулировать иммунную систему, снижая воспаление через взаимодействие с рецепторами CB2, которые в основном локализуются в иммунных клетках, таких как макрофаги и Т-лимфоциты.
Противовоспалительные эффекты
Противовоспалительный эффект 8,9-Дигидрокси-дельта-6a-тетрагидроканабинола связан с его способностью снижать выработку провоспалительных цитокинов и интерлейкинов, которые активируют воспалительные процессы в организме. Это позволяет уменьшить отёки, боль и общее воспалительное состояние, что полезно при лечении хронических воспалительных заболеваний, таких как остеоартрит, болезни кишечника (например, болезнь Крона) и аутоиммунные расстройства.
Кроме того, противовоспалительное действие 8,9-Дигидрокси-дельта-6a-тетрагидроканабинола может способствовать заживлению повреждённых тканей и снижению риска развития фиброза, что важно в контексте лечения не только хронических воспалений, но и посттравматических или послеоперационных состояний.
Анальгезирующие эффекты
Как анальгезирующее средство, 8,9-Дигидрокси-дельта-6a-тетрагидроканабинол действует, воздействуя на каннабиноидные рецепторы, что способствует снижению чувствительности нервных окончаний к боли. Выделение нейротрансмиттеров, таких как энкефалины и дофамин, может способствовать блокировке болевых сигналов. Эти анальгезирующие эффекты могут быть полезны при лечении болей различного происхождения, в частности хронической боли, мигрени и невропатической боли.
Благодаря своему мягкому и контролируемому действию, этот каннабиноид имеет меньше побочных эффектов, чем традиционные анальгетики, такие как опиоиды, снижая риск зависимости и развития побочных эффектов, таких как гастриты или нарушения функции желудочно-кишечного тракта.
Другие эффекты
Кроме основных противовоспалительных и анальгезирующих эффектов, 8,9-Дигидрокси-дельта-6a-тетрагидроканабинол может проявлять и другие положительные терапевтические свойства, в частности в части модуляции иммунного ответа и нейропротекции. Этот каннабиноид может использоваться как часть терапии для лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона, деменция или другие расстройства, связанные с нарушением функции нервных клеток.
Исследования in vitro и in vivo
Исследования in vitro (в пробирке) и in vivo (в живом организме) играют важную роль в изучении фармакологических свойств 8,9-Дигидрокси-дельта-6a-тетрагидроканабинола (8,9-DHTHC). Эти типы исследований позволяют выяснить механизмы действия, взаимодействия с биологическими системами и потенциальную терапевтическую эффективность этого каннабиноида для лечения различных патологий.
Исследования in vitro
Исследования in vitro являются важным этапом в разработке новых терапевтических средств, поскольку позволяют определить основные механизмы действия соединений на молекулярном уровне. Изучение 8,9-Дигидрокси-дельта-6a-тетрагидроканабинола в культуре клеток позволяет оценить его способность взаимодействовать с различными биомолекулами, такими как рецепторы, ферменты и другие молекулы, участвующие в физиологических процессах.
В исследованиях in vitro установлено, что 8,9-Дигидрокси-дельта-6a-тетрагидроканабинол проявляет взаимодействие с каннабиноидными рецепторами CB1 и CB2, хотя его эффективность по сравнению с Δ9-ТГК значительно снижена. В частности, наблюдается, что этот каннабиноид способен модулирующе воздействовать на сигнальные пути, связанные с иммунным ответом и снижением воспаления. Исследования также показали, что он может способствовать снижению уровня провоспалительных цитокинов в клетках иммунной системы, что указывает на его потенциал как противовоспалительного агента.
Изучение 8,9-Дигидрокси-дельта-6a-тетрагидроканабинола in vitro также показало его способность изменять активность различных ферментов, в частности тех, что участвуют в метаболизме, таких как ферменты цитохрома P450. Это исследование важно для понимания возможных лекарственных взаимодействий и для оценки потенциальной токсичности.
Системные воздействия на организм
Системные воздействия 8,9-Дигидрокси-дельта-6a-тетрагидроканабинола на организм можно оценивать через его фармакокинетику, механизм действия и эффекты, проявляющиеся в различных органах и системах. Поскольку этот каннабиноид взаимодействует с каннабиноидными рецепторами, широко представленными в различных тканях и органах, его влияние на организм является комплексным.
Воздействие на центральную нервную систему
8,9-Дигидрокси-дельта-6a-тетрагидроканабинол способен проникать через гематоэнцефалический барьер, что позволяет ему взаимодействовать с нейронными системами центральной нервной системы. Однако, в отличие от Δ9-ТГК, он не вызывает значимой психоактивной реакции, благодаря чему имеет большой потенциал для лечения неврологических расстройств, таких как депрессия, тревожность, невропатическая боль.
Его воздействие на нейронные пути через CB1 и CB2 рецепторы позволяет снижать уровень стресса и тревожности, при этом не нарушая когнитивные функции. Это делает 8,9-Дигидрокси-дельта-6a-тетрагидроканабинол потенциально полезным в лечении посттравматического стрессового расстройства (ПТСР) и других психических заболеваний, при которых традиционные анксиолитики могут вызывать побочные эффекты.
Воздействие на иммунную систему
8,9-Дигидрокси-дельта-6a-тетрагидроканабинол проявляет выраженную активность во взаимодействии с иммунными клетками, такими как макрофаги и Т-лимфоциты, через каннабиноидные рецепторы CB2. Этот каннабиноид снижает активность иммунной системы при воспалительных процессах, что может быть полезным при лечении аутоиммунных заболеваний, таких как системная красная волчанка, псориаз и другие хронические воспалительные состояния.
Противовоспалительные свойства 8,9-Дигидрокси-дельта-6a-тетрагидроканабинола подтверждаются его способностью снижать уровень цитокинов и интерлейкинов в сыворотке крови, которые являются основными молекулами, инициирующими и поддерживающими воспалительные реакции в организме.
Влияние на сердечно-сосудистую систему
Хотя исследования 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола в отношении сердечно-сосудистой системы ограничены, существуют данные о том, что каннабиноиды могут оказывать влияние на сердечный ритм и артериальное давление. 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол не обладает выраженным гипотензивным или гипертензивным действием, однако способен мягко воздействовать на сердечно-сосудистую систему, снижая уровень стресса и улучшая общее состояние пациентов, особенно в случае хронических заболеваний сердца.
Вывод
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол (8,9-DHTHC) является важным производным каннабиноидов, которое привлекает внимание учёных своими уникальными свойствами и потенциалом для терапевтического использования. Изучение его фармакологических и биологических эффектов выявляет его многостороннюю активность и перспективы применения в медицине, в частности для лечения хронических заболеваний, воспалительных процессов, болевых синдромов, а также психических расстройств. Несмотря на химическое сходство с Δ9-ТГК, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол обладает значительно меньшей психоактивностью, что делает его более безопасным вариантом для применения в длительном лечении без побочных эффектов, характерных для традиционных психоактивных каннабиноидов. Это открывает новые возможности для его использования в терапевтических целях, в частности при лечении боли, тревожности, депрессии и нейродегенеративных заболеваний.
8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол проявляет способность взаимодействовать с каннабиноидными рецепторами CB1 и CB2, что является ключевым аспектом его фармакологической активности. Однако его менее выраженное воздействие на рецептор CB1 делает данный каннабиноид менее психоактивным по сравнению с Δ9-ТГК, что делает его менее склонным к вызову нежелательных когнитивных эффектов. Этот аспект особенно важен в контексте терапевтического применения, поскольку сниженная психоактивность позволяет использовать 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол без риска развития психозов, тревожных расстройств или других психоактивных побочных эффектов. Вместо этого данный каннабиноид может обеспечивать противовоспалительные, анальгезирующие и нейропротекторные эффекты, что имеет большое значение для лечения таких заболеваний, как хроническая боль, артрит, рассеянный склероз, а также нейродегенеративные болезни, такие как болезнь Паркинсона или Альцгеймера.
Механизмы действия 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинола на нейромедиаторы, в частности на дофамин, серотонин и глутамат, позволяют ему влиять на нейропсихологические функции организма, улучшая настроение, снижая уровень стресса и тревоги. Этот каннабиноид может действовать как регулятор нервных систем, изменяя активность этих нейромедиаторов, что важно для лечения депрессии, тревожных расстройств, а также хронического стресса. По сравнению с Δ9-ТГК, который является более активным агонистом CB1-рецептора, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол оказывает меньшее влияние на центральную нервную систему, что делает его более контролируемым средством для лечения без развития психоактивных побочных эффектов.
Исследования показали, что 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол обладает значительным потенциалом в лечении воспалительных процессов, таких как артрит, псориаз и другие хронические заболевания, связанные с активацией иммунной системы. Противовоспалительные эффекты данного каннабиноида делают его важным в терапии для снижения воспалительных реакций в организме, а также для облегчения симптомов болезней, сопровождающихся болью и воспалением. Это позволяет использовать его не только для лечения боли, но и для улучшения качества жизни пациентов с аутоиммунными заболеваниями. В частности, он может применяться в терапии для снижения уровня провоспалительных цитокинов и регулирования иммунного ответа организма.
С точки зрения метаболизма, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол подвергается традиционным процессам метаболизма каннабиноидов, в частности через ферменты CYP450, которые играют важную роль в его метаболической обработке в организме. Это позволяет ему действовать в организме продолжительное время, а также выводиться через мочу и жёлчь. Это важно в контексте длительного применения данного каннабиноида в медицине, поскольку его способность к биоаккумуляции является низкой, что снижает риски токсичности или накопления вредных метаболитов. Система метаболизма каннабиноидов и выведения из организма требует тщательного контроля, особенно при использовании таких соединений, как 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол, обладающих разнообразными эффектами на физиологические процессы.
В целом, 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол обладает значительным потенциалом в фармакологии благодаря своим уникальным свойствам и слабому влиянию на психоактивные рецепторы. Это делает его потенциально важным для применения в лечении без психоактивных побочных эффектов, при этом сохраняя высокую эффективность в терапии боли, воспаления, депрессии и нейродегенеративных заболеваний. Однако для окончательного подтверждения его безопасности и эффективности необходимы дальнейшие клинические исследования. Поэтому данный каннабиноид заслуживает дальнейшего изучения и обоснованного включения в перечень терапевтических средств для лечения широкого спектра заболеваний.
Источники:
- PubMed (National Library of Medicine) https://pubmed.ncbi.nlm.nih.gov
PubMed — одна из крупнейших научных баз данных для медицинских исследований, содержащая множество статей и публикаций по каннабиноидам, их химии и фармакологии. - Google Scholar (Google Академия) https://scholar.google.com
Это один из крупнейших ресурсов для поиска научных статей, диссертаций и книг, где можно найти большие объемы информации по каннабиноидам и их свойствам. - ScienceDirect (Elsevier) https://www.sciencedirect.com
База данных, предоставляющая доступ к рецензируемым научным журналам и статьям по фармакологии, биохимии и исследованиям каннабиноидов, включая 8,9-Дигидрокси-дельта-6a-тетрагидроканнабинол. - Journal of Pharmacology and Experimental Therapeutics (American Society for Pharmacology and Experimental Therapeutics) https://jpet.aspetjournals.org
Один из основных журналов, публикующих статьи на тему фармакологии каннабиноидов, их взаимодействия с рецепторами и воздействия на организм. - Nature Reviews Drug Discovery https://www.nature.com/nrd
Ресурс, публикующий высококачественные обзоры по фармакологии и новейшим разработкам в области наркотиков, в том числе каннабиноидов. - The Lancet https://www.thelancet.com
Один из ведущих медицинских журналов, публикующий высококачественные исследования, включая каннабиноиды и их фармакологические свойства. - Frontiers in Pharmacology https://www.frontiersin.org/journals/pharmacology
Журнал с открытым доступом, публикующий статьи, охватывающие все аспекты фармакологии, включая каннабиноиды и их воздействие на организм. - JAMA (Journal of the American Medical Association) https://jamanetwork.com
Известный медицинский журнал, публикующий исследования, касающиеся фармакологии и терапевтического применения каннабиноидов. - National Institute on Drug Abuse (NIDA) https://nida.nih.gov
Официальный сайт Национального института по борьбе с наркотиками США, который содержит множество исследований, включая исследования каннабиноидов и их эффектов. - University of California Cannabis Research Center https://cannabis.ucdavis.edu
Исследовательский центр Каннабиса Университета Калифорнии, публикующий научные работы и исследования по каннабиноидам, их применению в медицине и фармакологии.