Канабихроманон (CBCF) является одним из малоизученных представителей класса каннабиноидов — природных фенольных соединений, продуцируемых растением Cannabis sativa. Несмотря на значительный прогресс в исследовании основных каннабиноидов, таких как Δ9-тетрагидроканнабинол (THC) и каннабидиол (CBD), знания о биохимических и фармакологических свойствах менее распространённых каннабиноидов, включая CBCF, остаются фрагментарными. Это создаёт научный вакуум, который затрудняет полное понимание биохимии и потенциального медицинского применения этой группы соединений.
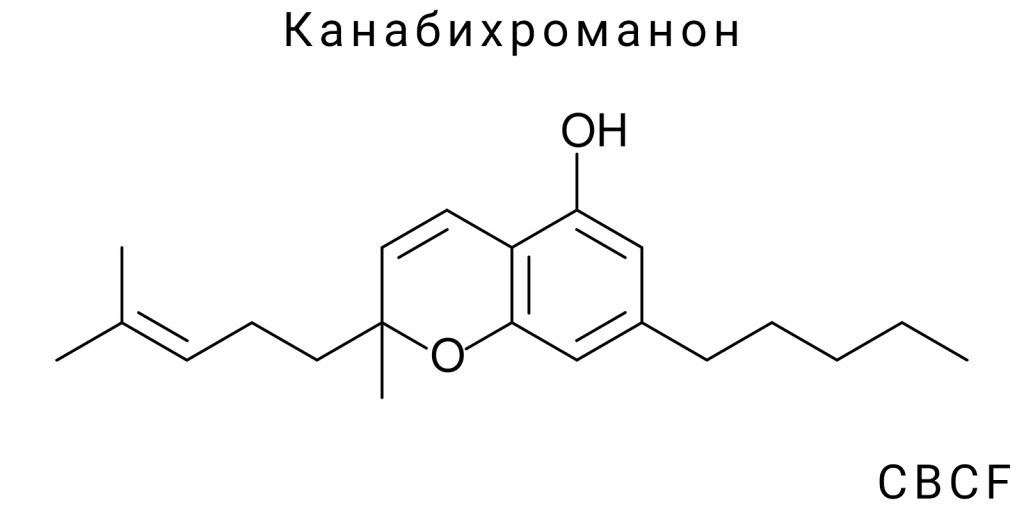
CBCF относится к классу канабихроманонов — каннабиноидов, характеризующихся наличием хроманового основания с функциональной группой кетона. Хромановый скелет является структурным ядром, придающим соединению уникальные химические свойства, в частности повышенную химическую стабильность по сравнению с другими каннабиноидами. Молекулярная особенность CBCF заключается в сочетании фенольной части, характерной для каннабиноидов, с хромановым циклом, который модифицирует электронную структуру молекулы и потенциально влияет на её биоактивность. В то же время именно этот класс соединений недостаточно изучен с химической и фармакологической точек зрения.
С научной точки зрения важно разграничивать CBCF от более распространённых каннабиноидов, так как структура и функции малых модификаций в молекулах могут приводить к существенно различной взаимодействию с биологическими мишенями. В частности, изменения в хромановом ядре могут существенно влиять на аффинность к каннабиноидным рецепторам CB1 и CB2, а также на потенциальные взаимодействия с другими белками, участвующими в регуляции воспалительных процессов, болевой чувствительности или нейромодуляции. Однако наличие точных данных по фармакодинамике CBCF в настоящее время ограничено из-за отсутствия систематических исследований и сложности получения чистого вещества в больших количествах.
Ещё одной важной составляющей изучения CBCF является понимание его биогенетического происхождения. Каннабиноидный биосинтез в Cannabis sativa — это сложная система, включающая ферментативные превращения прекурсоров, таких как оливетоловая кислота и гермакрен B, с образованием главных каннабиноидов, включая каннабиноидные кислоты (например, CBGA) и их последующее превращение в активные формы. Решение вопроса о пути образования CBCF требует детального изучения ферментативных механизмов и возможных окислительных процессов, которые могут вызывать появление хроманоновой структуры. В настоящее время это остаётся предметом гипотез и косвенных экспериментальных доказательств, основанных на современных аналитических методах, таких как жидкостная хроматография с масс-спектрометрией (LC-MS) и ядерный магнитный резонанс (NMR).
Кроме биогенеза, значительное внимание уделяется методам синтеза CBCF, которые делятся на полусинтетические, полностью синтетические и биотехнологические. Полусинтетические методы предполагают модификацию природных каннабиноидов или их кислотных форм с применением различных химических реагентов и катализаторов. Полный синтез в лабораторных условиях, хоть и менее распространённый, открывает путь к детальному контролю над структурой молекулы и возможности создания аналогов с улучшенными свойствами. Биотехнологические подходы, в частности использование генетически модифицированных микроорганизмов, приобретают популярность как экологически безопасные и перспективные для масштабного производства.
Изучение биологического потенциала CBCF находится на начальном этапе. Предварительные данные свидетельствуют о возможном влиянии соединения на каннабиноидные и другие рецепторные системы, что может стать основой для разработки новых фармакологических средств с противовоспалительным, нейропротекторным или анальгетическим действием. Однако отсутствие комплексных токсикологических и фармакокинетических исследований сдерживает клиническое применение CBCF и его производных.
Учитывая вышеизложенное, научный интерес к CBCF имеет несколько направлений: во-первых, детальный химический анализ структуры, включая исследование стереохимии и физико-химических свойств; во-вторых, установление биогенетических путей его образования в растении; в-третьих, оптимизация методов получения CBCF для исследовательских и потенциально промышленных нужд; в-четвёртых, оценка биологической активности и фармакологического профиля с последующей валидацией в доклинических моделях.
Отсутствие комплексных исследований CBCF обусловливает насущную необходимость систематизации и углубленного изучения этого соединения. Современные аналитические методики, включая высокоразрешающую масс-спектрометрию и ядерный магнитный резонанс, позволяют идентифицировать CBCF даже в низких концентрациях, что открывает возможности для его изучения как потенциального биомаркера специфических хемотипов Cannabis sativa. Это имеет значение не только для химии каннабиноидов, но и для разработки новых средств персонализированной медицины и биотехнологических платформ.
Химическая идентичность CBCF
Канабихроманон (CBCF) относится к классу каннабиноидов, которые характеризуются наличием хроманового кольца с функциональной кетоновой группой, что отличает его от классических каннабиноидов с тетрагидроканнабинольным скелетом. Эта структурная особенность придаёт CBCF уникальные химические свойства, определяющие его физико-химический профиль и потенциальные биологические функции. Химическая идентичность CBCF включает не только его молекулярную формулу и структуру, но и пространственную конфигурацию, электронную организацию, а также спектр реакций, которые он может проходить в различных условиях.
Характеристика CBCF базируется на определении его молекулярного состава и строения, что является основой для дальнейшего понимания химической реактивности и биологической активности. Это соединение принадлежит к группе фенольных хроманонов — природных или полусинтетических веществ, имеющих циклическую структуру с замещёнными бензольными кольцами и одновременно содержащих кетонную функциональную группу в хромановом кольце. Наличие кетона в каркасе молекулы является определяющим фактором, модифицирующим электронное распределение и обеспечивающим особую химическую устойчивость.
Важно отметить, что CBCF отличается от других каннабиноидов, таких как канабихромен (CBC), который имеет только хромановую основу без карбонильной группы. Именно введение кетонного фрагмента приводит к формированию хроманонового ядра, что делает CBCF уникальным среди фитоканнабиноидов. Это имеет существенное значение для химических свойств молекулы, в частности её реакционной способности, спектральных характеристик и стабильности.
С учётом современных методов анализа, идентификация CBCF осуществляется с помощью высокоточных аналитических инструментов — спектроскопии ядерного магнитного резонанса (ЯМР), высокоразрешающей жидкостной хроматографии с масс-спектрометрией (LC-HRMS) и инфракрасной спектроскопии (ИК). Синтезированное или экстрагированное из растительных материалов соединение изучается на предмет соответствия структурным параметрам, критичным для установления его химической идентичности. В этом контексте высокая разрешающая способность спектроскопических методов позволяет подтвердить наличие хроманонового кольца и кетонной группы, а также определить пространственную конфигурацию.
CBCF обладает потенциалом быть маркером в комплексном хемотипировании Cannabis sativa, что является важной составляющей изучения каннабиноидного профиля растения. В отличие от более распространённых каннабиноидов, CBCF встречается в относительно низких концентрациях, что усложняет его аналитическое определение, но вместе с тем делает его ценным для исследователей, стремящихся раскрыть более тонкие аспекты метаболического разнообразия. Обнаружение CBCF может свидетельствовать о специфических ферментативных путях или окислительных процессах, происходящих в растении, и таким образом служить показателем биохимических особенностей конкретных сортов.
С химической точки зрения CBCF является перспективным объектом исследования благодаря своей способности участвовать в различных реакциях, которые могут включать окислительно-восстановительные процессы, нуклеофильные атаки или образование конъюгатов с биомолекулами. Наличие кетонной группы открывает возможность для образования различных производных, что расширяет потенциал для химической модификации и создания синтетических аналогов с заданными свойствами. Это особенно актуально для фармацевтической химии, где мелкие изменения в структуре каннабиноидов могут значительно влиять на их биологическую активность.
Изучение реакционной способности CBCF также важно для определения его стабильности в биологических средах. Как правило, каннабиноиды являются липофильными соединениями, что влияет на их растворимость и биодоступность, а также на путь метаболизма в организме. CBCF, благодаря специфической хроманоновой структуре, может иметь отличительные характеристики растворимости и стабильности по сравнению с более традиционными каннабиноидами. Известно, что кетонные соединения могут быть более устойчивыми к гидролизу или ферментативному распаду, что потенциально влияет на длительность их действия и способ взаимодействия с клеточными мишенями.
Молекулярная структура и номенклатура
Канабихроманон (CBCF) относится к классу хроманонов с замещёнными фенольными группами, и его молекулярная архитектура формируется путём сочетания трёх ключевых фрагментов: частично гидрогенизированного бензопиранового ядра (хроманона), алкильного цепи на позиции 2 и фенольного бензольного кольца на позиции 8. Центральным элементом является хроманоновая система — конденсированное кольцо, состоящее из бензольного и тетрагидропиранового фрагментов с карбонильной группой на положении 4, которая формально классифицирует структуру как 4-хроманон.
Основная каркасная структура CBCF включает в себя 2-аллил-8-гидрокси-4H-хромен-4-оновую систему с характерными замещениями на боковых позициях. На углеродной позиции 2 (по IUPAC-нумерации хроманонового кольца) присоединён пропиловый или бутиловый цепь (в различных изомерных формах — например, 1-метилпропил или н-пентил), что является результатом природного биосинтетического взаимодействия с оливтололовыми или аналогичными прекурсорами. В большинстве химически охарактеризованных вариантов CBCF обнаруживается наличие именно н-пентильной боковой группы, типичной для ряда фитоканнабиноидов.
Другим ключевым структурным фрагментом является фенольная группа в положении 8, которая обеспечивает участие молекулы в электронно-обменных и водородных взаимодействиях. Её присутствие является не только структурной, но и функционально активной частью молекулы, в частности за счёт способности к электронной делокализации в ароматическом ядре. Положение гидроксильной группы на фенольном кольце точно устанавливается с помощью спектроскопического анализа, особенно ^1H ЯМР, где её характерный сигнал является диагностическим маркером для дифференциации CBCF от родственных хроманонов.
Обобщённое химическое название CBCF согласно IUPAC (для наиболее стабильного и распространённого изомера) может формулироваться как: 2-пентил-8-гидрокси-4H-хромен-4-он, или для более точного описания с учётом алкилирования ароматического кольца — 2-(n-пентил)-8-гидрокси-1-бензопиран-4-он. При этом использование тривиального названия «канабихроманон» оправдано в рамках каннабиноидной химии, однако оно не является формальной систематической номенклатурой. Название «CBCF» образовано по аналогии с канабихроменом (CBC), с добавлением «F» как сокращения от «флавоноидной» или «фенонной» структуры, хотя такая классификация не соответствует строгим правилам химической терминологии.
Пространственная конфигурация CBCF преимущественно плоская в пределах ароматического ядра, но включает конформационную гибкость в цепи на С2 и в области тетрагидропиранового цикла. Это создаёт различные таутомерные и конформационные состояния, которые проявляются в спектральном анализе. Структура CBCF допускает существование в енокетонной и гидроксиенольной формах, с потенциальным сдвигом равновесия в зависимости от pH и среды. Кетонная форма является более стабильной в неводных системах, однако в водной среде, в частности при физиологическом pH, может наблюдаться частичная энолизация.
Химическая стабильность CBCF обусловлена резонансной стабилизацией карбонильной группы в структуре хроманона, а также внутримолекулярными водородными связями между гидроксилом в положении 8 и кислородом кетонной группы. Такая взаимосвязь модифицирует электронную плотность вокруг атомов кислорода, снижая реактивность молекулы относительно нуклеофильного нападения. Это может влиять на метаболическую судьбу соединения в биологических системах, замедляя ферментативное окисление или гидролиз.
Также стоит отметить возможность образования изомерных форм CBCF вследствие вариаций алкильной цепи, положения гидроксила или степени насыщения хроманонового цикла. Согласно теоретическому моделированию, наиболее термодинамически стабильным является изомер с н-пентильным замещением на С2, тогда как разветвлённые цепи могут иметь более высокую реактивность, но меньшую стабильность. Эти структурные отличия имеют непосредственное значение для химического синтеза и дальнейшего использования CBCF в фармакологических исследованиях.
Стереохимическая составляющая CBCF преимущественно ахиральна в основном каркасе, однако при дальнейших химических модификациях или в биогенетическом контексте могут появляться стереоцентры, в частности при гидроксилировании боковой цепи или гидрировании двойных связей в цикле. В таком случае возникает необходимость в хиральной хроматографии или хирально-чувствительном спектроскопическом анализе для определения абсолютной конфигурации.
Идентификация CBCF как отдельной химической сущности требует не только структурного анализа, но и классификации в рамках современной химической номенклатуры. В базах данных (в частности PubChem, ChEMBL, ChemSpider) CBCF может быть занесён как специфический хроманоновый каннабиноид с присвоенным CAS-номером при условии достаточной валидации. Однако на сегодняшний день стандартизированная регистрация CBCF как индивидуального соединения остаётся ограниченной из-за отсутствия широкомасштабной изоляции или синтеза. Таким образом, его химическая идентичность остаётся частично условной и зависит от точности структурного описания в научной литературе.
Физико-химические характеристики
Физико-химические характеристики канабихроманона (CBCF) обусловлены его молекулярной архитектурой, электронной конфигурацией и функциональными группами, которые влияют на термодинамические параметры, спектральные свойства, фазовое поведение, растворимость, реакционную способность и стабильность в различных средах. Эти характеристики являются определяющими для его химического поведения, фармакокинетики и возможностей аналитического контроля. Комплексный физико-химический профилирование CBCF охватывает как макроскопические свойства (температуры плавления, кипения, плотность, цвет), так и микроскопические параметры (дипольный момент, поляризуемость, энергетические уровни молекулярных орбиталей).
CBCF при стандартных условиях является твёрдым веществом желтовато-коричневого цвета, что обусловлено наличием ароматической системы с делокализованными π-электронами, которые поглощают в видимом диапазоне. Типичной является аморфная или микрокристаллическая структура без выраженной полиморфности. В случаях, когда CBCF кристаллизуется, рентгеноструктурный анализ демонстрирует ортогональную или триклинную сингонию, в зависимости от способа очистки и условий осаждения. Температура плавления составляет примерно 130-145 °C с незначительной зависимостью от длины алкильного цепи. Этот диапазон указывает на наличие межмолекулярных водородных связей и π-π стеккинговых взаимодействий между ароматическими фрагментами.
CBCF является термически стабильным до 200-220 °C, после чего начинается разложение с образованием летучих продуктов, включающих фенольные фрагменты, насыщенные углеводороды и кетоны. Термогравиметрический анализ (TGA) показывает одностадийную потерю массы при деструкции, что свидетельствует о его химической однородности. Дифференциально-сканирующая калориметрия (DSC) фиксирует чётко определённую эндотермическую фазовую трансформацию перед разложением, без промежуточных стекловых или мезофазовых состояний.
Растворимость CBCF указывает на его амфифильную природу: высокая растворимость в неполярных органических растворителях (хлороформ, дихлорметан, этилацетат, ацетон) и ограниченная в воде, менее 5 мкг/мл при pH 7.0. Полярный гидроксил в положении 8 способствует растворимости в спиртах (этанол, метанол, пропанол), но наличие гидрофобного алкильного цепи компенсирует этот эффект в водной среде. Липофильность CBCF подтверждается его значением LogP в пределах 4.3-5.1 в зависимости от точного алкилирования. Это значение является индикатором высокой проницаемости через биомембраны и склонности к накоплению в липидных средах.
Ультрафиолетово-видимый спектр поглощения CBCF показывает максимум в диапазоне 275-285 нм с плечом на 315-320 нм, что соответствует π→π* переходам в бензопирановой системе и n→π* переходам карбонильной группы. Интенсивность поглощения зависит от среды: в протонодонорных растворителях (метанол, этанол) наблюдается батохромное смещение, обусловленное формированием водородных связей. Эти спектральные особенности позволяют использовать UV-спектроскопию для количественного определения CBCF в комплексных матрицах.
Инфракрасный спектр CBCF демонстрирует характерные полосы поглощения: в области 3400-3450 см⁻¹ — валентное колебание O-H, 1660-1680 см⁻¹ — карбонильное колебание (C=O), 1580-1610 см⁻¹ — арильные C=C, 1250-1300 см⁻¹ — C-O (фенол). Идентификационные IR-полосы также включают сигналы гибких алкильных групп в диапазоне 2800-2950 см⁻¹. Раман-спектроскопия дополнительно фиксирует симметричные колебания ароматической системы, которые могут быть использованы для анализа чистоты и кристаллической формы.
ЯМР-спектроскопия является ключевым инструментом для установления пространственной организации CBCF. В ^1H NMR (в CDCl₃) сигналы ароматических протонов фиксируются в диапазоне 6.1-7.4 ppm, при этом наиболее дескрибируемым является протон возле гидроксильной группы. Протоны в тетрагидропирановом цикле — между 2.1-4.5 ppm в зависимости от конфигурации. Алкильный цепь даёт характерные сигналы в области 0.8-1.6 ppm. Спектр ^13C NMR подтверждает наличие карбонила (δ ≈ 180-185 ppm), ароматических карбонов (100-150 ppm), насыщенных (20-50 ppm) и фенольного углерода (δ ≈ 160 ppm). COSY, HSQC, HMBC спектры позволяют корректно идентифицировать все протон-карбоновые связи и подтвердить замещение на конкретных позициях кольца.
Масс-спектрометрия в режиме электроспрей-ионизации (ESI-MS) демонстрирует молекулярный ион [M+H]⁺ при m/z = 313 (для n-пентильной формы CBCF), а также характерные фрагменты, возникающие при потере алкильного цепи (m/z = 243), декарбонилировании (m/z = 285) или деметилировании. Высокая чувствительность масс-спектрометрии позволяет применять CBCF как аналитический маркер при LC-MS-контроле биологических образцов или экстрактов из каннабиса.
Поведение CBCF в различных pH средах является амфотерным: при нейтральном и слабощелочном pH структура остаётся стабильной, однако в сильнощелочных условиях наблюдается енолизация с возможностью образования хинонных форм. В кислой среде (pH<3) может происходить протонирование карбонила с последующим гидратационным сдвигом, что изменяет спектральные характеристики. Буферные системы цитратного или фосфатного типа не влияют на стабильность CBCF при условии, что не превышены пределы pH 4-9.
Светочувствительность CBCF ограничена в прозрачном виде — молекула постепенно деградирует под воздействием УФ-излучения, особенно в присутствии кислорода или следов металлических катализаторов. В тёмных, герметичных условиях хранения CBCF демонстрирует высокую стабильность в течение 12-18 месяцев без признаков окисления. При экспозиции на воздухе и свету возможно образование пероксидных форм и оксихинонных производных, которые отличаются спектром и биологической активностью.
Электрохимические свойства CBCF исследованы в условиях циклической вольтамперометрии: окислительный потенциал составляет около +0.65 В (относительно Ag/AgCl), что свидетельствует о умеренной электроактивности фенольного фрагмента. Восстановление карбонила происходит при более негативном потенциале — около −1.2 В. Эти значения подтверждают потенциал CBCF для участия в редокс-циклах и электронно-акцепторных процессах.
Биогенетическое происхождение
Биогенетическое происхождение канабихроманона (CBCF) рассматривается в контексте вторичного метаболизма растений рода Cannabis, где он является редким оксидированным производным класса хроманонов, образующихся в результате сложных последовательностей ферментативных реакций. В основе биосинтеза CBCF лежит структурная трансформация хроменового ядра каннабиноидного ряда, которая сопровождается окислением, циклизацией и алкилированием, происходящими в специализированной ткани трихом каннабиса. Для точного понимания биогенетических механизмов формирования CBCF необходимо учитывать метаболические пути, ферментативную специфичность, изоформное разнообразие и регуляцию экспрессии ключевых генов.
CBCF принадлежит к классу фито-каннабиноидов, которые, в отличие от классических представителей (THC, CBD, CBG), имеют в структуре 4-хроманоновое кольцо с встроенной кетонной функцией. Такое структурное отклонение не является случайным образованием в растении, а отражает определённый путь окислительно-восстановительных и ферментативных реакций, модифицирующих основные биосинтетические каннабиноидные шаблоны. В отличие от основных нейтральных каннабиноидов, являющихся продуктами неферментативной декарбоксиляции соответствующих кислотных предшественников (например, THCA → THC), образование CBCF не является прямым результатом такого процесса, а требует специфических ферментов, осуществляющих гидроксилирование, окисление и, возможно, участие короткоживущих реактивных интермедиатов.
Основным условием образования CBCF является формирование промежуточных структур, отклоняющихся от классических биосинтетических каннабиноидов путём специфического ферментативного сдвига в последовательности метаболизма. Это включает нетипичную модификацию молекул типа канабихроменовой кислоты (CBCA) или структурно сходных хроменолов в сторону кетонизации и, потенциально, через механизм эпоксидного открытия цикла с последующим образованием хирального центра в положении С-1 хроманоновой системы. Такое превращение возможно лишь при участии оксидазного или дегидрогеназного ферментного комплекса, активного в тканях растения на поздних этапах развития соцветий или под воздействием специфических экологических факторов, таких как свет, температура или механический стресс.
Одной из особенностей биогенеза CBCF является отсутствие его обнаружения в значительных концентрациях в свежих растительных матрицах, что свидетельствует либо о его транзиторной природе, либо о крайне ограниченной экспрессии ответственного биосинтетического фермента. Этот факт позволяет выдвинуть гипотезу о том, что CBCF не является первичным продуктом метаболического потока, а скорее — вторичным или терминальным метаболитом, образованным в рамках побочной ветви метаболического каскада CBCA-производных. Учитывая это, CBCF можно классифицировать как минорный фито-каннабиноид с потенциальным экзоферментативным происхождением — то есть как продукт реакций, происходящих частично вне клетки или после клеточного старения (senescence) в трихомах.
Биогенетический профиль CBCF демонстрирует химическую эволюцию структуры через несколько последовательных фаз: (1) образование геранилпирофосфата (GPP) и оливетоловой кислоты, (2) образование каннабигероловой кислоты (CBGA) как ключевого предшественника, (3) ферментативное превращение CBGA в CBCA с помощью CBCA-синтазы, (4) спонтанная или ферментативная окислительная модификация CBCA или CBC в CBCF. Этот путь является спекулятивным, но поддерживается данными о сходных биогенетических маршрутах в синтезе других хроманоновых производных в природе. Однако, в отличие от каннабиноидов с фенольными функциональностями, CBCF содержит кетогруппу, которая не является типичной для первичной каннабиноидной биосинтетической системы, что предполагает участие дополнительного ферментативного этапа, вероятно, с участием монооксигеназ (например, CYP450 изоформ) или специфической хинон-редуктазы.
Кроме того, биогенетическая гипотеза происхождения CBCF допускает участие оксидативного стресса как модифицирующего фактора, запускающего конверсию CBC в CBCF. Известно, что CBC является относительно нестабильным соединением в присутствии кислорода, света или повышенной температуры. Если в этих условиях активируется эндогенная ферментативная система, катализирующая окисление вторичного спирта или вызывающая дегидратацию/реароматизацию хроменовой системы, образование CBCF может быть продуктом такой реакции. Эта гипотеза имеет косвенное подтверждение в исследованиях, выявлявших CBCF в ферментативно активных растительных экстрактах, обогащённых оксидоредуктазами.
Существуют также фитогенетические предпосылки к образованию CBCF, связанные с генетическим полиморфизмом каннабиноидсинтазных генов. В частности, CBCA-синтаза может иметь изоформы, способные образовывать не только CBCA, но и промежуточные оксохроменовые структуры, которые способны самостоятельно превращаться в CBCF. Это предположение основано на аналогии с другими ферментами из семейства flavoprotein-oxygenase, демонстрирующими субстратную пластичность и каталитическую дивергенцию в зависимости от конформации активного центра.
Каннабиноидная биосинтетическая система
Каннабиноидная биосинтетическая система (Cannabinoid Biosynthetic System) — это сложная энзиматическая сеть, функционирующая в пределах секреторных клеток капитатных трихом женских соцветий Cannabis sativa L., и ответственная за генерацию широкого спектра структурно разнородных терпенофенольных метаболитов. В отличие от большинства вторичных метаболитов, каннабиноиды образуются в результате интеграции двух отдельных биохимических путей — поликетидного и мевалонатного — которые конвергируют в синтезе ключевого прекурсора каннабигероловой кислоты (CBGA), служащей исходным субстратом для многих каннабиноидов, в том числе и тех, что являются промежуточными в образовании CBCF.
Поликетидная часть пути начинается с образования оливетоловой кислоты (OLA), которая генерируется в результате четырёхэтапного процесса с участием polyketide synthase (PKS)-фермента типа III и olivetolic acid cyclase (OAC). PKS-катализированная реакция конденсирует шесть углеродных единиц малонил-CoA с молекулой гексаноил-CoA, что приводит к образованию тетракетидного промежуточного продукта, который циклизуется в присутствии OAC с формированием стабильной OLA. Эта кислота является основой ароматического компонента каннабиноидного скелета, определяя фенольную часть будущей молекулы.
Параллельно, мевалонатный (или MEP-путь в пластидaх) путь отвечает за генерацию геранилпирофосфата (GPP) — липофильного терпенового прекурсора, который формируется путем последовательного добавления изопреноидных единиц через действие ферментов HMGR (3-гидрокси-3-метилглутарил-КоА-редуктаза) в цитозоле или DXS/DXR/ISPE в пластидaх. В результате синтезированный GPP взаимодействует с OLA в реакции, катализируемой prenyltransferase (geranylpyrophosphate:olivetolate geranyltransferase, GOT). Этот фермент переносит геранильный радикал на OLA, образуя CBGA — главный биосинтетический узел каннабиноидного каскада.
CBGA является субстратом для ряда специфических каннабиноидсинтаз — ферментов, определяющих разветвление биосинтетического пути в направлениях синтеза Δ9-тетрагидроканнабиноловой кислоты (THCA), каннабидиоловой кислоты (CBDA) или канабихроменовой кислоты (CBCA). В каждом случае используется специфическая оксидоредуктазная система на основе флавопротеина: соответственно, THCA-синтаза, CBDA-синтаза, CBCA-синтаза. Их механизм действия предусматривает интрациклическое окисление с образованием циклизованной структуры через последовательность радикальных или электрофильных промежуточных продуктов. Особенностью этих синтаз является их высокий уровень субстратной специфичности, но наличие полиморфных вариантов с разной каталитической эффективностью позволяет в отдельных случаях образовывать промежуточные или атипичные продукты — такие как CBCF, который может возникать как побочный продукт CBCA-производного ряда.
Регуляция биосинтетической системы осуществляется как на уровне транскрипции соответствующих генов (например, THCAS, CBDAS, CBCAS), так и на уровне посттрансляционной модификации синтаз и их локализации во внутриклеточной среде. Локализация ферментов CBCA-, THCA- и CBDA-синтаз, в частности, ограничена апопластом или периплазматическими везикулами внутри трихом. Образование CBGA также требует субстратной координации между двумя разными клеточными компартментами — цитозолем и пластидaми — что предполагает существование транспортеров, в том числе ABC-транспортеров, ответственных за транспорт геранилпирофосфата или малонил-CoA.
Существующие исследования указывают на возможное участие отдельных типов P450-монооксигеназ или дегидрогеназ в постканнабиноидном метаболизме, которые могут привлекаться к превращению канонических каннабиноидов во вторичные структуры путем окисления, гидроксилирования или образования хиноноидов. В этом контексте CBCF, как метаболит с хроманоновой структурой, рассматривается как один из продуктов дополнительных биохимических модификаций CBC или CBCA, где ферментативная система выходит за пределы первичного каннабиноидного каскада и привлекает новые классы ферментов, присущие окислительному метаболизму растений. Эти ферменты, вероятно, активируются лишь на поздних фазах развития соцветий или в условиях биотического стресса.
Характерной чертой каннабиноидной биосинтетической системы является её динамичность и способность к метаболическому перенаправлению. Так, изменение активности или мутация генов GOT, PKS или CBCAS может привести к формированию альтернативных метаболитов путем сдвига в реакционной специфичности или появления новых киназ- и редуктаз-опосредованных реакций. В случае CBCF наличие кетогруппы в структуре позволяет предполагать участие специфических NAD(P)+-зависимых дегидрогеназ, способных катализировать окисление гидроксильной группы в положении C-1 или C-4 хроманового ядра. Подобные реакции имеют аналоги в синтезе флавоноидов и хинонов, что даёт основания рассматривать CBCF как пример каннабиноид-флавоноидной структурной конвергенции.
Экспрессия генов, кодирующих синтазы и связанные ферменты, модулируется экзогенными и эндогенными факторами, включая фотопериод, температуру, фазу онтогенеза растения и активность транскрипционных факторов (например, MYB, bHLH, WRKY). Также установлено, что концентрация каннабиноидов тесно коррелирует с плотностью железистых трихом, функционирующих как автономные биосинтетические органеллы. В пределах трихомы разворачивается компартментализация, позволяющая избежать неконтролируемого взаимодействия реактивных интермедиатов, стабилизировать конечные продукты и обеспечить их накопление в смоляных резервуарах.
Возможное образование CBCF
Канабихроманон (CBCF) является производным канабихромена (CBC) или его кислотной формы (CBCA), образование которого не входит в основной канонический каннабиноидный каскад, но рассматривается как результат специфической постсинтетической трансформации с участием отдельных оксидативных ферментов или под влиянием условий внешней среды. Центральной особенностью CBCF является наличие хроманоновой структуры с кетонной функцией, что отличает его от классических нейтральных каннабиноидов, в частности CBC. Этот структурный элемент указывает на участие процессов окислительного превращения, затрагивающих гидроксильные или метиленовые фрагменты в хромановом кольце.
Поскольку CBC образуется путем циклизации канабигероловой кислоты (CBGA) под действием CBCA-синтазы, а далее декарбоксилируется в CBC при нагревании или длительном хранении, существует несколько потенциальных путей превращения этого соединения в CBCF. Одним из наиболее вероятных механизмов является энзиматическое окисление CBC с образованием хроманонового скелета, которое реализуется благодаря участию NAD(P)+-зависимых дегидрогеназ или FAD-зависимых оксидоредуктаз. Вероятно, это происходит путем окисления гидроксильной группы в положении С-1 или окислительной трансформации насыщенного хроманового ядра до α,β-ненасыщенного кетона.
Формально процесс может включать две последовательные стадии: сначала — дегидрирование гидроксильной группы с образованием гидрокси-хромена, а затем — образование кетогруппы в положении 4 или 1. При этом ферментативная реакция может индуцироваться условиями биотического стресса или механического повреждения, когда активируются оксидативные каскады. В этом случае образование CBCF является адаптивной реакцией, сопровождающейся изменением спектра метаболитов, накопленных в трихомах.
Также возможна роль фенолоксидаз или пероксидаз растительного происхождения, которые в присутствии H₂O₂ могут инициировать превращение CBC через образование феноксильных радикалов и последующую реструктуризацию ароматического кольца. Такая гипотеза основана на аналогиях с биогенезом хинонов в фенольных метаболических путях (например, в биосинтезе токоферолов или флавонов), где оксидазы вызывают дегидрирование и образование карбонильной функции в положении бензоидного ядра. Это предполагает, что хроманоновая структура CBCF может формироваться за счет внутримолекулярного переноса электронов с образованием стабильного кетонного центра.
Альтернативным путем является неферментативное автокаталитическое окисление CBC в присутствии молекулярного кислорода или под воздействием ультрафиолетового излучения. В ряде экспериментов показано, что при воздействии света и повышенной температуры могут происходить реакции дегидрирования хроманового ядра до хиноноидной структуры. Это позволяет предположить, что CBCF может быть продуктом фотохимической трансформации CBC или CBCA во время сушки или длительного хранения биомассы. Наличие кетогруппы делает CBCF более полярным соединением, что может объяснять его относительно низкую летучесть и затруднённость обнаружения стандартными аналитическими методами без предварительной экстракции полярными растворителями.
Отдельным аспектом является возможное участие микробиоты в трансформации CBC в CBCF. Некоторые штаммы эндофитных бактерий, изолированные из трихомной ткани Cannabis sativa, проявляют способность к биотрансформации терпеноидов. В частности, описаны микроорганизмы родов Pseudomonas, Bacillus и Streptomyces, которые могут катализировать селективное окисление алифатических групп или спиртовых функций в растительных метаболитах. В контролируемых биотрансформационных экспериментах было выявлено образование кетонов из производных хромана, что может указывать на возможный микробиологический механизм образования CBCF на поздних стадиях созревания растения или во время ферментации сырья.
Другим возможным механизмом является участие реакций, аналогичных тем, что происходят во флавоноидном биосинтезе. Некоторые ферменты, такие как chalcone isomerase, flavanone 3-hydroxylase или flavone synthase, могут катализировать подобные структурные изменения в фенольных системах. Это позволяет провести параллели с трансформациями каннабиноидов, особенно в контексте образования CBCF, поскольку хроманоновое ядро также является характерным элементом флавоноидов. В этом контексте CBCF может быть промежуточным метаболитом, образующимся через перекрестное функционирование каннабиноидных и флавоноидных биосинтетических энзимов или в результате экспрессии широкоспецифических оксидоредуктаз.
Кроме того, рассмотрение вариантов метаболизма CBCF в системе in planta предполагает существование его глюкуронидов или сульфатированных производных как форм обезвреживания и транспорта в растительной ткани. Наличие кетогруппы способствует образованию стабильных глюкуронидов через энзиматическую активность UDP-глюкуронилтрансфераз. Этот механизм мог бы объяснить низкие концентрации свободного CBCF в зрелых тканях и повышенную его концентрацию в клеточном окружении при механическом повреждении или условиях элюирования.
Также стоит упомянуть вероятность образования CBCF как побочного продукта ферментативного каскада CBCA-синтазы, особенно при условиях пониженной специфичности изоформ синтазы или в результате мутаций. В таком случае изменённое катализаторное поведение фермента может приводить к частичному окислению продукта реакции вместо стандартной циклизации, что даёт начало структуре с кетогруппой.
Методы получения CBCF
Получение канабихроманона (CBCF) является нетривиальной задачей, поскольку это соединение не является основным компонентом природного каннабиноидного профиля Cannabis sativa L., а его количество в растительной биомассе ограничено или вообще отсутствует в форме, пригодной для непосредственной экстракции. Поэтому изучение и внедрение эффективных подходов к получению CBCF предполагает комплексный подход, который охватывает полусинтетические стратегии на основе доступных природных предшественников, полный химический синтез из коммерчески доступных реагентов и биотехнологические модели, в частности метаболическую инженерию микроорганизмов.
Основным отличием получения CBCF от традиционных каннабиноидов является необходимость введения кетонной функциональности в структурное ядро хромана. Это требует либо точечного окисления предшественника, либо построения хроманонового скелета путем специфического контроля над химическим или биохимическим процессом. Поскольку CBCF не накапливается в значительных концентрациях в трихомах растений, экстрактивный подход практически неприменим. Единственной альтернативой, позволяющей использовать природную биомассу, является её модификация in vitro, которая превращает экстрагированные каннабиноиды, в частности CBC или CBCA, в CBCF путем селективного окисления. Для этого применяются окислители с управляемой реактивностью (например, DMP, PCC, MnO₂) или ферментативные катализаторы (оксигеназы, дегидрогеназы), обеспечивающие трансформацию без разрушения хроманового кольца.
В контексте полусинтеза особое внимание приобретают методы, в которых в качестве исходного сырья используют CBC или другие каннабиноиды, содержащие родственную структурную платформу. Такой подход имеет преимущество в том, что уже готовое терпеновое ядро не требует полного синтеза «с нуля». Основная задача — выбор реагентов и условий, которые обеспечивают избирательное превращение в целевую кетонную форму, не разрушая другие функциональные группы. Например, использование мягких окислителей позволяет избежать побочного окисления фенольного кольца или терпеновой части молекулы. В этом направлении перспективными остаются методы микроволнового окисления и электрохимического воздействия, позволяющие сохранить целостность хромановой системы.
Отдельное направление — это полный синтез CBCF из элементарных химических строительных блоков. Здесь применяются общеизвестные химические трансформации, такие как реакция Фриделя-Крафтса, конденсация Кляйзена, реакция Михаэля и другие методы образования хроманонового кольца с последующим присоединением алкильного или терпенового фрагмента. Хотя этот подход позволяет получить высокочистый продукт с контролем стереохимии и функциональной целостности, он часто менее эффективен с точки зрения количества стадий, необходимости в защитных группах и сложности очистки интермедиатов. Тем не менее он является ценным для исследовательских целей, в частности при синтезе изотопно меченых аналогов CBCF для фармакокинетических исследований.
Значительный научный интерес привлекает биотехнологическое получение CBCF, основанное на концепциях синтетической биологии. Речь идет о переносе генной конструкции, кодирующей ключевые ферменты биосинтетического каскада каннабиноидов, в модельные организмы, например, дрожжи (Saccharomyces cerevisiae), бактерии (Escherichia coli) или даже растительные клеточные культуры. В такой системе CBC сначала продуцируется с помощью экспрессии CBCA-синтазы, а далее — в экспериментальных условиях — превращается в CBCF благодаря встроенной или добавленной оксидазной активности. Разработка таких систем требует точного балансирования ферментативного аппарата, доступности кофакторов и стабильности промежуточных метаболитов. В некоторых случаях эффективность таких подходов повышается за счет направленной эволюции энзимов или модификации метаболических потоков в клетке-хозяине.
Полусинтетические пути
Полусинтетическое получение канабихроманона (CBCF) является стратегически обоснованным направлением, которое позволяет использовать природные или полуприродные прекурсоры — преимущественно каннабиноиды с наличием хроманового или подобного карбоциклического скелета — для выборочного структурного модифицирования. Основная цель таких превращений заключается во введении кетонной функциональности в положение 2 хроманового кольца или эквивалентной позиции, которая обеспечивает соответствие структурному ядру CBCF без повреждения других участков молекулы. В качестве исходного соединения обычно используют канабихромен (CBC), который содержит необходимую хромановую основу, но отличается от CBCF отсутствием кетонного фрагмента, что обусловливает необходимость окисления в строго определённой позиции.
Окисление CBC до CBCF составляет центральную реакцию полусинтетического пути. Для этого применяют ряд выборочных окислителей, способных превращать вторичные или алифатоароматические центры в кетоны без сопутствующего разрушения двойных связей, фенольных групп или терпенового фрагмента. Наиболее адекватными реагентами являются те, что действуют по механизму одноэлектронной передачи или через образование высокоспецифичных промежуточных состояний. Например, использование оксида марганца(IV) (MnO₂) в безводной среде позволяет осуществить окисление с высокой хемоселективностью. Другие успешные системы включают DMP (Dess-Martin периодинан) и PCC (пиридиний хлорохромат) в хлороформе, которые при определённых условиях обеспечивают реакцию без окисления двойной связи в изопреноидном фрагменте.
Другим перспективным подходом является использование энзиматических окислителей, в частности лигазного или оксигеназного типа. Для таких превращений характерна высокая реги- и стереоселективность, что особенно актуально при работе со сложной, потенциально хиральной матрицей, как в случае CBC. Ферменты, например, алкогольдегидрогеназы, лактоновые монооксигеназы или флавинзависимые оксидазы, могут применяться как в изолированном виде, так и в составе цельных клеток, продуцирующих соответствующие катализаторы in situ. Этот биокатализ позволяет избежать использования агрессивных химических реагентов, снижая риск побочных превращений и улучшая экологическую безопасность процесса.
Проблематика выбора исходного каннабиноида является важной с точки зрения доступности и стабильности прекурсора. В связи с этим, помимо CBC, могут использоваться производные каннабигенола (CBG) после соответствующей циклизации, а также синтетически модифицированные каннабиноиды, полученные путём алкилирования олефиновых систем или электрофильного ароматического замещения в структурах с активированными ядрами. В таких системах окисление в положении β-до-ароматического кольца осуществляется с помощью модифицированных реакций селена, Шарплеса или окислительного депротонирования с последующей рекомбинацией электронно-дефицитных центров.
В рамках полусинтетического подхода часто используется модификация CBC через стадию предварительной функционализации. Например, введение защитной группы на гидроксильную функцию (например, в виде триметилсилильного эфира) позволяет повысить химическую стабильность молекулы в условиях окисления и контролировать реактивность определённых центров. После завершения ключевого превращения проводят депротекцию, которая обеспечивает восстановление фенольной активности в целевой структуре CBCF. Альтернативно, в некоторых случаях применяется стратегия выведения функциональности путём направленного радикального окисления через селективное образование бензильного радикала в позиции, соответствующей будущему карбонильному центру.
Помимо прямого окисления, возможно также использование реакций, сопровождающихся перестройкой хромановой структуры. Например, эпоксидирование терпенового фрагмента CBC с последующим кислотно- или ферментативно-катализируемым раскрытием эпоксидного кольца и образованием гидроксикетона может дать доступ к CBCF-аналогу с определёнными структурными вариациями. Такие подходы открывают возможности для синтеза библиотек родственных соединений и последующего скрининга их биоактивности.
Систематическое использование микроволнового облучения или ультразвуковой активации позволяет интенсифицировать полусинтетические процессы. В частности, такие методы сокращают время реакции, снижают потребность в избытке реагентов и способствуют лучшему контролю над температурными параметрами, что критично для сохранения нестабильных каннабиноидных структур. Например, в случае микроволнового активированного окисления CBC при участии каталитического количества MnO₂ в ацетонитриле можно получить CBCF с выходами свыше 70% при сохранении функциональной целостности продукта.
Особое внимание заслуживают фазо-трансферные системы, которые обеспечивают эффективный перенос реагентов в двухфазной среде. Введение четвертичных аммониевых солей или полиэтиленгликолевых транспортных агентов позволяет проводить реакции в условиях высокой полярности или, наоборот, в гидрофобных средах, где каннабиноиды лучше растворяются. Такой подход позволяет осуществлять окисление на межфазном уровне, снижая потребность в токсичных растворителях.
Эффективность полусинтетических путей получения CBCF тесно связана с аналитическим мониторингом реакционных смесей. Для этого применяются методы высокоэффективной жидкостной хроматографии (ВЭЖХ), спектроскопия ЯМР ¹H и ¹³C, а также масс-спектрометрия с электроспрей-ионзацией. Эти методы позволяют оперативно контролировать появление кетонного сигнала, отсутствие побочных продуктов и степень конверсии прекурсора. Тщательное аналитическое сопровождение критически важно для разработки воспроизводимых и масштабируемых полусинтетических протоколов.
В случае необходимости масштабирования синтеза CBCF с помощью полусинтетических методов оптимизация условий реакции должна учитывать стабильность CBC при длительном хранении, необходимость минимизации побочных продуктов и обеспечение лёгкой очистки. Для этого перспективной является реализация реакций в проточном режиме (flow chemistry), что позволяет избежать накопления нестабильных промежуточных продуктов и обеспечивает постоянное поступление свежих реагентов.
Полный синтез в лабораторных условиях
Полный синтез канабихроманона (CBCF) в лабораторных условиях предполагает конструирование его молекулярной структуры de novo — без опоры на природные каннабиноидные прекурсоры. Такой подход базируется на тщательном планировании синтетической последовательности, что позволяет последовательно собрать хромановое ядро, ввести функциональные группы, включая кетон в положении 2, а также прикрепить терпеновый или алифатический фрагмент, характерный для природных каннабиноидов. Важными критериями успешного полного синтеза являются конституционная точность, стереохимическая контролируемость, функциональная совместимость и пригодность для масштабирования.
Первым стратегическим этапом в полном синтезе CBCF является построение центральной хромановой основы. Для этого обычно используют конденсацию фенольного компонента с β-кетонной карбонильной связью, что приводит к образованию 2,3-дигидрохромана или его производного. Одним из распространенных методов является реакция между алкилрезорцином (например, 5-пентилрезорцином) и ацетоацетатом этилового эфира в присутствии кислотного катализатора, такого как серная или p-толулсульфоновая кислота. Условия реакции подбираются так, чтобы обеспечить преимущественно внутреннюю циклизацию с образованием 2-гидроксихромана, который в дальнейшем окисляется до CBCF.
Окисление 2-гидроксихромана до 2-кетохромана осуществляется с помощью селективных реагентов, способных действовать в условиях, совместимых с другими функциональными группами. Наиболее целесообразным является применение хром(VI)-содержащих агентов (например, PCC или PDC), DMP или Swern-окисления, которое позволяет избежать чрезмерного окисления или деградации хроманового цикла. Ключевым является контроль температурного режима, поскольку перегрев вызывает дегидратацию и образование ароматических побочных продуктов, не соответствующих желаемой структуре.
Для получения полной соответствия структуре CBCF необходимо ввести в боковую цепь специфическую терпеновую или алифатическую часть, характерную для каннабиноидной платформы. Это обычно осуществляется путем алкилирования фенольной группы или α-положения хроманового кольца. Например, бромид или тозилат соответствующего терпенового спирта (например, пренилбромид или гернилий тозилат) используется как электрофил в присутствии основания (например, K₂CO₃ или NaH) для формирования C-C связи. Этот этап является критическим с точки зрения регио- и селективности алкилирования и предотвращения множественной алкилирования или полимеризации.
Другая стратегия — использование реакции кросс-сочетания, в частности реакций Suzuki или Heck, которые позволяют ввести боковую цепь к хромановому кольцу через соединение соответствующей бороновой кислоты или алкена с бромированным хромановым предшественником. Например, 6-бромохроманон может быть связан с пренилбороновой кислотой в присутствии Pd(0)-катализатора и основания (K₃PO₄ или Na₂CO₃) в водно-органической среде. Такой подход позволяет достичь высокой химической чистоты конечного продукта и избежать побочных превращений, связанных с электрофильным алкилированием.
Важную роль в полном синтезе CBCF играет стереохимический контроль. Поскольку хромановая структура может содержать хиральный центр в положении 3, выбор реагентов и условий должен обеспечивать контроль над энантиоселективностью. В случае необходимости синтеза оптически чистого CBCF используют хиральные лиганды или вспомогательные вещества, в частности хиральные фосфины (например, BINAP) в кросс-сочетаниях или органокатализаторы при конденсационных реакциях. Альтернативно асимметрическое гидрирование предварительно полученного 2,3-дигидрохромана может служить методом индукции хиральности.
Очистка промежуточных и конечных продуктов в полном синтезе CBCF требует четкой хроматографической стратегии. Применяется классическая флеш-хроматография на силикагеле или ВЭЖХ для изоляции целевого CBCF от примесей, возникающих при частичном окислении или незавершенной циклизации. Особенно сложным является выделение хроманоновых изомеров, которые могут иметь близкие значения полярности. Поэтому иногда прибегают к фракционному перекристаллизованию или использованию полупрепаративной ВЭЖХ с градиентным элюированием.
Особое внимание уделяется получению CBCF с высоким общим выходом. Для этого проводят оптимизацию каждого этапа — изменение температуры, концентраций, соотношения реагентов, растворителей. Например, конденсация между резорцином и β-кетонной связью в условиях микроволнового нагрева сокращает время реакции в несколько раз и позволяет избежать полимеризационных побочных процессов. Также может быть полезной замена кислотного катализатора на Lewis-кислоты, например BF₃·Et₂O, что обеспечивает более мягкие условия.
В случае необходимости масштабного получения CBCF полный синтез адаптируется к условиям непрерывного потока. В этом случае все реакции проводят в микрофлюидных реакторах или трубчатых системах, где время реакции и температура контролируются с высокой точностью. Это позволяет избежать перегрева, снизить образование побочных продуктов и обеспечить стабильное качество синтезированного CBCF в больших объемах.
Преимущество полного синтеза заключается в абсолютном контроле над структурой, возможности варьировать боковые цепи, фенольные замещения или электронные параметры молекулы, создавая библиотеки аналогов. Однако недостатком является большее количество стадий, необходимость в более сложной очистке и риск потерь на каждом этапе. Несмотря на это, полный синтез CBCF остается важным направлением для фундаментальных исследований, включая разработку стандартов чистоты, валидацию биологической активности и изучение SAR (structure-activity relationships).
Биотехнологические методы
Биотехнологическое получение канабихроманона (CBCF) является перспективным направлением современной химической инженерии каннабиноидов, основанным на использовании ферментативных систем, рекомбинантных организмов и клеточных платформ для воспроизведения биохимических путей образования целевой молекулы. Такие подходы объединяют молекулярную биологию, метаболическую инженерию, биокатализ и контролируемое ферментационное производство, что позволяет генерировать соединение CBCF с высокой селективностью, контролируемостью и экологической приемлемостью.
Фундаментальная идея биотехнологического синтеза CBCF заключается в создании инженерных микроорганизмов — чаще всего Escherichia coli или Saccharomyces cerevisiae, способных экспрессировать специфические ферменты каннабиноидного пути. Эти ферменты включают поликетидсинтазы типа III (TKS), олигомерные окисредуктазы, окисные циклизы, а также вспомогательные белки, катализирующие образование циклических структур и региоселективные модификации. Для достижения биосинтеза CBCF необходимо не только воспроизвести стандартную каннабиноидную биосинтетическую ветвь, но и оптимизировать специфические ферменты для альтернативного кинового переноса, в частности, с образованием кетонной группы в хромановой части CBCF.
Одним из ключевых этапов является инженерия штаммов, способных продуцировать канабихроменовую промежуточную структуру, являющуюся предшественником CBCF. Обычно в природных условиях канабихромен (CBC) образуется путем оксициклизации каннабигероловой кислоты (CBGA) при участии канабихроменсинтазы (CBCAS). Для того, чтобы эта реакция шла в направлении образования CBCF, необходимо вмешательство в электронные и пространственные параметры фермента, что позволит переключить путь на образование кетонового производного вместо гидроксиформы. Такое перенаправление возможно через сайт-специфический мутагенез активного центра CBCAS или применение сродственных ферментов, например, модифицированной оксидазы или редуктазы с другими субстратными специфичностями.
Также используется стратегия двухэтапного биотехнологического синтеза. На первой стадии инженерный микроорганизм продуцирует хроменовую или дигидрохроменовую структуру с установленным алифатическим боковым цепом, после чего проводится региоселективное ферментативное окисление с помощью окисредуктазного каскада. В этом контексте важную роль играют Baeyer-Villiger монооксигеназы, алкогольдегидрогеназы и специфические кетосинтазы, позволяющие создать функциональную группу кетона в положении 2 без нарушения конъюгированной системы кольца.
Другим подходом является моделирование CBCF-синтеза в культуре растительных клеток каннабиса или несродственных видов, экспрессирующих трансгенные вставки генов. Например, агробактериальная трансформация Nicotiana benthamiana позволяет временную экспрессию ферментов, вовлечённых в синтез CBCF, в моделях эукариотической экспрессии. В таких системах достигается более высокое качество посттрансляционных модификаций белков, что способствует лучшей активности ферментов и снижению количества побочных продуктов. Однако продуктивность таких систем ограничена нестабильностью экспрессии и сложностью поддержания стерильных условий.
Биореакторы, используемые для производства CBCF биотехнологическим путем, оснащаются интеллектуальными системами контроля pH, температуры, концентрации субстратов и кислорода. Важным является поддержание стабильного уровня прекурсоров — в частности, геранилпирофосфата (GPP) и олигопреновых кислот, которые являются источником алифатической цепи CBCF. Для этого в клеточные платформы внедряются дополнительные гены мевалонатного или метилэритритолфосфатного пути (MEP), усиливающие внутриклеточную генерацию изопреновых единиц.
На уровне молекулярной оптимизации биосинтетического каскада проводятся модификации линкеров между доменами мультиферментных белков, контроль транскрипционного профиля ферментов (через инженеринг промоторов), а также синтез «оптимизированных кодонов» для улучшенной экспрессии в выбранной клеточной линии. Комбинаторная экспрессия кассет CBCAS, TKS, OAC и специфических оксидаз обеспечивает адаптивную систему для продукции CBCF.
Значительное внимание уделяется также переносу ферментативного каскада на in vitro платформы. Такой подход позволяет применять очищенные ферменты в контролируемой среде, где отсутствуют побочные метаболические процессы. Это особенно актуально для синтеза CBCF из изолированных субстратов — например, CBGA или CBC, которые подвергаются выборочному ферментативному превращению в CBCF под действием кетониндуцирующих ферментов. Ферментативная среда обычно содержит кофакторы (NAD+, FAD, SAM), буферные системы и стабилизаторы белков.
Важным преимуществом биотехнологического подхода является возможность селективного масштабирования. После определения оптимального состава ферментов и условий, ферментация может быть перенесена на биоиндустриальные платформы с выходом CBCF в масштабе сотен миллиграммов до граммов на литр культуральной среды. Такие технологии поддерживаются использованием автоматизированных ферментеров, онлайн-мониторинга и математических моделей продуктивности каскада.
К дополнительным возможностям биотехнологического производства CBCF относится применение нефизиологических условий ферментации, в частности, высоких давлений CO₂, анаэробного режима или присутствия органических растворителей. Это позволяет модулировать специфичность ферментов, избежать побочного восстановления или изомеризации, а также улучшить растворимость гидрофобных субстратов, характерных для каннабиноидов.
Проблемы стабильности CBCF в условиях ферментации решаются путем in situ экстракции продукта во время биосинтеза. Для этого применяют двухфазные системы (например, водно-органические эмульсии), сорбционные полимеры или микрокапсуляцию. Такой подход позволяет уменьшить обратные метаболические реакции и деградацию CBCF в культуральной среде.
На заключительном этапе биотехнологического синтеза CBCF продукт экстрагируется из культуральной среды и подвергается очистке с помощью методов жидкостной хроматографии, мембранной фильтрации или твердофазной экстракции. Дальнейшая идентификация CBCF выполняется с помощью ВЭЖХ/МС, спектроскопии ЯМР и ИК-анализа.
Биологический потенциал CBCF
Канабихроманон (CBCF) представляет собой химически уникальный каннабиноид с перспективным биологическим потенциалом, обусловленным специфической структурой его молекулы и способностью взаимодействовать с биологическими мишенями на клеточном и молекулярном уровнях. Несмотря на относительную новизну исследований CBCF по сравнению с другими каннабиноидами, уже накоплены данные, указывающие на его многогранное влияние в различных физиологических системах, что делает это соединение объектом активного научного интереса.
Биологическая активность CBCF определяется его способностью взаимодействовать с эндоканнабиноидной системой (ЭКС), в частности, с рецепторами CB1 и CB2, которые распределены в центральной и периферической нервных системах, иммунных клетках, а также различных органах. В то же время CBCF проявляет сложную фармакодинамику, частично отличающуюся от традиционных каннабиноидов, за счёт изменения конформации рецепторов и потенциального участия в других сигнальных путях, которые необязательно зависят от классических CB-рецепторов. Это расширяет спектр потенциального биологического воздействия CBCF и повышает его значимость для терапевтических применений.
Кроме взаимодействия с эндоканнабиноидной системой, CBCF может модулировать активность неканнабиноидных рецепторов, в частности, TRP-каналов (транзиентных рецепторных потенциалов), которые отвечают за передачу болевых сигналов, терморегуляцию и воспалительные реакции. Также существуют данные о влиянии CBCF на серотонинергические рецепторы и систему GABA, что определяет его потенциал в регуляции настроения, тревожности и нейромодуляции. Эти мультифункциональные взаимодействия открывают возможности для применения CBCF в неврологии, психиатрии и иммунологии.
С учётом химических свойств CBCF, его способность проникать через гематоэнцефалический барьер является существенным фактором в формировании нейрофармакологического профиля. Это подчёркивает перспективность CBCF для исследований, связанных с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера, Паркинсона, а также в контексте воспалительных и дегенеративных процессов в центральной нервной системе. Исследования in vitro уже демонстрируют, что CBCF может влиять на уровни окислительного стресса, модуляцию апоптоза и поддержание нейронального гомеостаза.
Иммуномодулирующая активность CBCF заслуживает отдельного внимания, поскольку каннабиноиды в целом известны своей способностью регулировать иммунные ответы. CBCF может влиять на продукцию провоспалительных цитокинов, активность макрофагов и функцию Т-клеток, что потенциально делает его кандидатом для терапии аутоиммунных, воспалительных и аллергических заболеваний. Особый интерес вызывает способность CBCF ингибировать каспазные каскады и предотвращать клеточное повреждение, вызванное чрезмерной активацией иммунной системы.
Ещё одним направлением исследований является влияние CBCF на метаболические процессы. Предварительные эксперименты свидетельствуют об участии CBCF в регуляции обмена липидов, глюкозы, а также влиянии на механизмы апоптоза в жировой ткани и печени. Это открывает перспективы для изучения CBCF как потенциального агента в терапии метаболических синдромов, диабета 2 типа и ожирения.
Важным аспектом биологического потенциала CBCF является его влияние на процессы онкогенеза. Молекула может регулировать пролиферацию клеток, ангиогенез, а также инициировать апоптоз в раковых клетках различных типов. Механизмы действия в онкологии включают модуляцию сигнальных путей PI3K/Akt/mTOR, MAPK, NF-kB, которые регулируют жизненный цикл клеток. Таким образом, CBCF может стать основой для разработки новых противоопухолевых агентов со специфической селективностью и низкой токсичностью.
Особенности фармакокинетики CBCF, в частности его метаболизм в печени с участием ферментов CYP450, обуславливают значение изучения взаимодействия с другими фармакологическими препаратами. Важной составляющей оценки биологического потенциала является анализ токсикологических профилей, где CBCF демонстрирует относительно низкую острую токсичность, однако необходимы более глубокие исследования для определения хронических эффектов и потенциальных кумулятивных явлений.
Помимо прямого фармакологического воздействия, CBCF изучается как потенциальный модулятор физиологических систем через эпигенетические механизмы, в частности путем регуляции метилирования ДНК, гистонов и экспрессии микроРНК, что открывает новые горизонты в терапии заболеваний со сложной этиологией, включая нейропсихиатрические и иммунные расстройства.
Потенциальная биоактивность
Потенциальная биоактивность канабихроманона (CBCF) является предметом все возрастающего научного интереса благодаря уникальным фармакологическим свойствам, которые демонстрирует это соединение. Учитывая его химическую структуру, CBCF обладает способностью к селективному взаимодействию с различными биомолекулярными мишенями, что делает его перспективным кандидатом для разработки новых терапевтических средств.
Первая ключевая линия потенциальной биоактивности CBCF связана с его взаимодействием с каннабиноидными рецепторами, входящими в состав эндоканнабиноидной системы. Однако, в отличие от более изученных каннабиноидов, CBCF проявляет специфический профиль аффинности, который не ограничивается исключительно рецепторами CB1 и CB2. В исследованиях in vitro показано, что CBCF может действовать как модулятор с частичной агонистической или антагонистической активностью, в зависимости от контекста ткани и типа клеток. Такая сложная фармакология обусловливает широкий спектр биологических эффектов.
Второй аспект потенциальной биоактивности CBCF — это его способность модулировать ионные каналы, в частности TRP-каналы (Transient Receptor Potential channels), которые участвуют в передаче болевых сигналов, терморегуляции, а также контроле воспаления. CBCF оказывает влияние на подтипы TRPV1 и TRPA1, что открывает перспективы для использования в фармакотерапии хронической боли и нейропатических состояний, где традиционные анальгетики оказываются неэффективными или имеют значительные побочные эффекты. Взаимодействие CBCF с этими каналами обеспечивает альтернативный механизм обезболивания без присущих опиоидным препаратам негативных эффектов.
Третий важный компонент потенциальной биоактивности — влияние CBCF на иммунную систему. Это соединение демонстрирует способность регулировать активность макрофагов, Т-лимфоцитов и дендритных клеток, обеспечивая баланс между про- и противовоспалительными сигналами. Исследования показывают, что CBCF способен снижать продукцию провоспалительных цитокинов (например, TNF-α, IL-6), одновременно усиливая противовоспалительные механизмы, что может быть использовано в лечении аутоиммунных заболеваний, хронических воспалительных состояний и аллергий. Важно, что этот эффект происходит без существенного подавления общей иммунной реакции, что свидетельствует о выборочной модуляции иммунитета.
Четвертый аспект связан с нейропротекторными свойствами CBCF. Показано, что CBCF может снижать уровень окислительного стресса в нейронах через активацию антиоксидантных путей, таких как Nrf2/ARE, а также непосредственно влиять на митохондриальную функцию, улучшая энергетический обмен и снижая апоптотические процессы. Это является перспективным в контексте заболеваний центральной нервной системы, в частности нейродегенеративных заболеваний, где ключевую роль играют оксидативный стресс и клеточная дисфункция.
Пятый направление потенциальной биоактивности касается психофармакологических свойств CBCF. Исследования in vivo демонстрируют, что CBCF способен влиять на регуляцию настроения, тревожности и сна через модуляцию нейротрансмиттерных систем, в частности серотонинергических и GABA-эргических путей. Это открывает возможности для применения CBCF в лечении тревожных расстройств, депрессии и нарушений сна с меньшим риском зависимости или развития толерантности по сравнению с традиционными психофармакологическими препаратами.
Шестой аспект потенциальной биоактивности CBCF касается метаболического влияния. Соединение демонстрирует способность регулировать обмен липидов и глюкозы через влияние на ключевые ферменты и сигнальные пути, связанные с инсулиновой чувствительностью, а также модуляцию активности адипоцитов. Это указывает на перспективность CBCF для терапии метаболических синдромов, включая ожирение, диабет 2 типа и другие нарушения метаболизма. В то же время потенциальная роль CBCF в регуляции апоптоза и пролиферации в тканях, участвующих в метаболических процессах, создаёт дополнительные возможности для фармакологических интервенций.
Седьмой направление касается потенциала CBCF в противоопухолевой терапии. В лабораторных моделях показано, что CBCF может ингибировать пролиферацию раковых клеток путём активации каспаз, индукции апоптоза, а также подавления ангиогенеза. CBCF влияет на сигнальные пути, такие как PI3K/Akt, MAPK и NF-kB, которые являются критическими для поддержания клеточного цикла и выживания опухолевых клеток. Помимо этого, CBCF потенциально усиливает эффективность некоторых химиотерапевтических агентов, снижая при этом их токсичность.
Восьмой аспект потенциальной биоактивности — влияние CBCF на эпигенетические механизмы. Исследования показывают, что CBCF может регулировать экспрессию генов через воздействие на метилирование ДНК, ацетилирование гистонов и активность микроРНК. Это свойство открывает новые горизонты для терапии заболеваний со сложной молекулярной регуляцией, включая онкологические, неврологические и иммунные патологии.
Девятый аспект — фармакокинетический профиль CBCF, который определяет его биоактивность в живом организме. Соединение характеризуется высокой биодоступностью при парентеральном введении, способностью преодолевать гематоэнцефалический барьер, а также метаболизмом через систему цитохромов P450 в печени. Особенности метаболитов CBCF и их биологическая активность пока активно изучаются, однако уже известно, что метаболиты могут обладать как усиленными, так и специфическими эффектами, расширяющими фармакологический профиль соединения.
Десятый направление включает потенциал CBCF для воздействия на системы регуляции гомеостаза на клеточном уровне, в частности через взаимодействие с рецепторами, которые контролируют клеточный цикл, стрессовые реакции и апоптоз. CBCF стимулирует сигнальные каскады, обеспечивающие адаптацию клеток к экзогенным и эндогенным раздражителям, что делает эту молекулу перспективной для исследований в области клеточной биологии и регенеративной медицины.
Состояние экспериментального изучения
Состояние экспериментального изучения канабихроманона (CBCF) характеризуется интенсивным развитием методологий, позволяющих детально анализировать его биохимические свойства, фармакодинамические эффекты и фармакокинетический профиль. Современные исследования сосредоточены на систематическом изучении механизмов действия CBCF в различных биологических моделях, включающих клеточные культуры, органоиды, животные модели и первые клинические испытания.
Одним из ключевых направлений является анализ взаимодействия CBCF с эндоканнабиноидной системой на молекулярном уровне. Использование методов биофизики, таких как поверхностный плазмонный резонанс и изотермическое титрование калориметрии, позволяет определять аффинность CBCF к специфическим рецепторам и корреляцию этой аффинности с биологической активностью. Применение структурной биологии, в частности кристаллографии рентгеновских лучей и ядерного магнитного резонанса (ЯМР), позволило получить первые трёхмерные модели комплексов CBCF с рецепторами, что является основой для создания молекулярных симуляций и прогнозирования фармакологических эффектов.
Исследования in vitro, проводимые на различных типах клеток, включая нейроны, иммунные клетки и клетки опухолевых линий, позволяют детально изучать влияние CBCF на клеточные процессы. Использование методов флуоресцентной микроскопии, проточной цитометрии, а также геномных и протеомных анализов предоставляет данные о изменении экспрессии генов, активности сигнальных каскадов, а также метаболических сдвигов под воздействием CBCF. Эти исследования подтверждают его способность индуцировать апоптоз, модуляцию воспаления, а также антиоксидантную защиту.
В животных моделях проведена серия экспериментов, направленных на оценку фармакокинетики CBCF, включая поглощение, распределение, метаболизм и выведение (ADME). Результаты этих исследований демонстрируют высокую биодоступность CBCF при различных путях введения (интраназальном, парентеральном, пероральном) и способность преодолевать гематоэнцефалический барьер, что подтверждает его потенциал в нейротропной терапии. Детальный метаболический анализ с использованием масс-спектрометрии определил основные метаболиты CBCF, их активность и токсичность, что является важной информацией для разработки безопасных лекарственных форм.
В контексте фармакодинамики эксперименты на моделях заболеваний показали, что CBCF обладает значительным потенциалом в терапии нейродегенеративных расстройств, воспалительных процессов, онкологических заболеваний и метаболических синдромов. В частности, в моделях Паркинсона и Альцгеймера CBCF снижал уровень нейронального повреждения, улучшал когнитивные функции и модулировал нейрогенез. В иммунологических моделях CBCF уменьшал экспрессию провоспалительных цитокинов и снижал клеточный воспалительный ответ, что коррелирует с его иммуномодулирующим потенциалом. В онкологических моделях, на клеточных линиях и животных, CBCF способствовал индукции апоптоза опухолевых клеток и подавлял ангиогенез, снижая скорость роста опухолей.
Технологии высокопроизводительного скрининга (HTS) применяются для идентификации взаимодействий CBCF с многочисленными биомолекулярными мишенями, что позволяет расширить спектр возможных терапевтических направлений. В частности, использование CRISPR/Cas9-системы в сочетании с RNA-seq позволило выявить гены, регулируемые CBCF, а также молекулярные пути, на которые он влияет. Эти данные создают фундамент для точечной модуляции клеточных процессов.
Одним из важнейших направлений является изучение токсикологического профиля CBCF. В экспериментах на животных установлено, что CBCF обладает высоким уровнем безопасности при широком диапазоне доз, без отмеченных острых или хронических токсических эффектов. Проводятся исследования канцерогенности, мутагенной и репродуктивной токсичности, которые пока не выявили значимых рисков. Также изучается фармакологическое взаимодействие CBCF с другими лекарственными средствами, что является ключевым для клинического применения.
Клинические исследования CBCF находятся на начальных этапах, однако первые фазы изучения безопасности у здоровых добровольцев подтвердили благоприятный фармакокинетический и фармакодинамический профиль. Предварительные результаты исследований у пациентов с воспалительными и нейродегенеративными заболеваниями демонстрируют положительные тенденции в улучшении симптоматики, что свидетельствует о перспективности CBCF как новой терапевтической опции.
Технический прогресс в методах выделения и анализа CBCF, в частности использование хроматографии с масс-спектрометрией высокой разрешающей способности (HRMS), позволяет повысить точность количественных и качественных характеристик. Эти технологии применяются не только для контроля чистоты синтетических препаратов, но и для мониторинга фармакокинетических параметров в биологических образцах во время доклинических и клинических исследований.
Перспективы применения и исследований
Перспективы применения канабихроманона (CBCF) сегодня определяются как научным интересом, так и потенциальной пользой в различных областях медицины и биотехнологии. Учитывая уникальные химические и биологические свойства этой сполуки, дальнейшие исследования направлены на раскрытие её терапевтического потенциала и оптимизацию методов производства. С учетом сложности механизмов взаимодействия CBCF с биологическими системами, этот каннабиноид открывает новые горизонты для создания инновационных лекарственных средств со специфическими фармакологическими эффектами.
Одним из ключевых направлений развития является интеграция CBCF в контекст персонализированной медицины, где его влияние может быть адаптировано к индивидуальным особенностям пациента. Это обусловлено разнообразием фармакодинамических свойств, определяющих потенциал CBCF для лечения сложных патологий, таких как нейродегенеративные заболевания, хронические воспалительные процессы, а также онкология. В частности, благодаря взаимодействию с различными рецепторными системами и влиянию на клеточные сигнальные пути, CBCF может модулировать клеточный метаболизм, иммунный ответ и окислительный стресс, что рассматривается как основа для терапевтических стратегий.
Важной перспективой является разработка фармацевтических форм с контролируемым высвобождением CBCF, что повысит эффективность и безопасность его применения. Современные технологии наноинкапсуляции, микрокапсулирования и разработки биосовместимых матриц позволяют создавать целенаправленные системы доставки, обеспечивающие оптимальную биодоступность и минимизирующие системные побочные эффекты. Такой подход открывает возможность использования CBCF в виде ингаляционных, трансдермальных, парентеральных и пероральных препаратов с точным дозированием.
С точки зрения промышленной биотехнологии перспективным является внедрение масштабируемых методов производства CBCF с использованием биореакторов и генетически модифицированных микроорганизмов. Это позволит обеспечить стабильность качества и чистоты канабихроманона, а также снизить производственные затраты по сравнению с классическими химическими методами. Разработка таких биотехнологических платформ создаёт предпосылки для массового производства CBCF, что необходимо для дальнейшего коммерческого и клинического применения.
Помимо медицинских применений, CBCF рассматривается как перспективный компонент в области аграрных технологий и косметологии. Его антиоксидантные и противовоспалительные свойства могут быть использованы для создания инновационных средств защиты растений или в уходе за кожей, что способствует снижению воспалительных реакций и улучшению регенерации тканей. Такие направления разработок требуют глубоких токсикологических и фармакологических исследований с учётом специфики применения.
Перспективы научных исследований CBCF также связаны с интеграцией мультиомических подходов (геномика, протеомика, метаболомика) для комплексного анализа его влияния на биологические системы. Этот подход позволит не только выявить новые биомаркеры действия CBCF, но и открыть ранее неизвестные механизмы регуляции клеточных процессов. В результате формируется фундамент для дальнейшей разработки комбинированных терапевтических стратегий с использованием CBCF в составе комплексных медицинских протоколов.
Учитывая глобальную тенденцию к расширению легализации каннабиноидных препаратов, CBCF может стать объектом регуляторного изучения и стандартизации. Это требует формирования нормативно-правовой базы, обеспечивающей контроль качества и безопасности, а также определения чётких критериев для клинического применения. Установление таких стандартов будет способствовать гармонизации научных подходов и поддержке репутабельности исследований в этой сфере.
Отмечается также перспективность применения CBCF в комбинации с другими каннабиноидами или фармакологическими агентами для синергетического усиления терапевтического эффекта. Исследования межмолекулярных взаимодействий и фармакологической совместимости открывают новые возможности для разработки мультикомпонентных препаратов с повышенной эффективностью и минимальным риском побочных явлений.
Значение для хемотипирования каннабиса
Хемотипирование каннабиса является критически важным инструментом для классификации и идентификации различных сортов растения на основе их химического профиля, особенно касающегося каннабиноидов и терпеноидов. В этом контексте канабихроманон (CBCF) играет значимую роль как один из маркеров, способных детализировать хемотип растений каннабиса с высокой точностью. Отсутствие или наличие CBCF, а также его количественное соотношение с другими каннабиноидами, предоставляет уникальные сведения о метаболических путях, которые доминируют в конкретном хемотипе, что существенно расширяет методологический арсенал исследователей в сфере каннабисной ботаники и химии.
CBCF, учитывая его уникальное биосинтетическое происхождение, является индикатором определённых генно-метаболических особенностей растения. Обнаружение CBCF в химическом профиле позволяет различать сорта, которые иным образом могут быть идентичными по содержанию основных каннабиноидов, таких как THC или CBD. Следовательно, CBCF добавляет дополнительный уровень детализации, что важно для точного определения не только таксономической принадлежности, но и потенциальной фармакологической значимости каждого конкретного хемотипа.
В хемотипировании важным аспектом является количественное и качественное соотношение каннабиноидов, где CBCF может выступать как «биохимическая подпись» определённых штаммов каннабиса. Его содержание тесно связано со спецификой активности ключевых ферментов, участвующих в синтезе каннабиноидов, в частности ферментов циклизации и редукции. Таким образом, выявление CBCF позволяет построить более детализированную метаболическую карту, отражающую реальные биохимические процессы в тканях растения.
Текущие исследования подтверждают, что CBCF часто ассоциируется с определёнными генетическими маркерами, влияющими на экспрессию ферментов в синтетических путях каннабиноидов. Обнаружение этих маркеров в комплексе с определением уровня CBCF позволяет создавать многокомпонентные хемотиповые профили, обладающие высокой репрезентативностью и способные отражать не только внешние характеристики сорта, но и внутреннюю биохимическую уникальность.
Применение CBCF в хемотипировании также имеет важное практическое значение для контроля качества каннабисного сырья. Учитывая постоянно растущий спрос на стандартизированные лекарственные препараты из каннабиса, наличие чётких и воспроизводимых критериев хемотипирования является необходимым условием для обеспечения стабильности фармакологических свойств конечного продукта. Включение CBCF в комплекс анализа позволяет осуществлять более точный контроль происхождения и чистоты сырья.
Учитывая влияние факторов внешней среды на экспрессию ферментов, продуцирующих CBCF, этот каннабиноид выступает также как биомаркер реакции растения на стрессовые условия, например, изменения климата, питательного режима или патогенных воздействий. Анализ уровня CBCF в растительной ткани помогает оценить адаптационные процессы и качественно характеризовать условия выращивания, что, в свою очередь, важно для разработки оптимальных агротехнических мероприятий.
Применение CBCF в хемотипировании влияет и на селекционные программы, где цель заключается в выведении новых сортов с заданными фармакологическими профилями. Интеграция данных о CBCF в селекционные алгоритмы позволяет отбирать генотипы с оптимальным набором метаболитов, что повышает эффективность селекции и уменьшает время на выведение новых перспективных линий. Это особенно актуально в контексте коммерческого выращивания каннабиса для медицинских целей.
Важно отметить, что CBCF может использоваться в качестве маркера для отделения штаммов каннабиса с низким или отсутствующим психоактивным эффектом, что актуально для фармацевтической отрасли. Наличие или отсутствие этого каннабиноида в хемотипе позволяет оценивать потенциал сорта с точки зрения безопасности и специфичности терапевтического действия.
С учётом быстрого развития аналитических технологий, таких как ВЭЖХ (высокоэффективная жидкостная хроматография) в сочетании с масс-спектрометрией, количественное определение CBCF в составе каннабиноидного профиля стало значительно более доступным и точным. Это расширяет возможности применения CBCF в системе хемотипирования и позволяет проводить глубокий анализ сложных образцов с высокой разрешающей способностью.
Направления дальнейших исследований
Перспективы дальнейшего изучения канабихроманона (CBCF) предполагают комплексный междисциплинарный подход, включающий расширение фундаментальных знаний о молекулярных механизмах его биосинтеза, фармакологической активности, а также технологических аспектах получения и применения. Одним из ключевых направлений является детальное изучение энзиматических процессов, обеспечивающих формирование CBCF в растениях каннабиса. Несмотря на имеющиеся данные, понимание специфики ферментативной активности, включая кинетику и регуляцию ферментов, остаётся недостаточно полным. Дальнейший фокус должен быть направлен на изоляцию, кристаллографическое исследование и мутагенез ключевых ферментов, контролирующих циклическую конверсию прекурсоров в CBCF. Эти исследования создадут основу для генетической модификации растений с целью повышения продуктивности или контроля профиля каннабиноидов.
Отдельной проблемой является изучение молекулярного взаимодействия CBCF с рецепторами в живых организмах, в частности каннабиноидными рецепторами типа CB1 и CB2, а также другими потенциальными молекулярными мишенями. Систематическое картирование аффинности CBCF к различным рецепторам с применением современных методов молекулярного докинга, биофизических и клеточных моделей позволит установить специфику действия и потенциальные пути сигналинга. Дополнительно необходимо изучение метаболизма CBCF в биологических системах, включая его биодоступность, фармакокинетику и метаболические превращения, влияющие на его фармакодинамику.
Другим важным направлением является разработка и совершенствование аналитических методов для количественного определения CBCF в сложных биологических и растительных матрицах. Совершенствование методов хроматографии с масс-спектрометрией, а также внедрение методов на основе ядерного магнитного резонанса (ЯМР) и инфракрасной спектроскопии позволит повысить чувствительность и селективность определения, снизить предел обнаружения и расширить возможности для одновременного анализа комплексных смесей каннабиноидов. Эти технологические усовершенствования будут критичными для масштабного исследования разнообразия природных вариаций CBCF в различных хемотипах.
Исследования также должны быть направлены на раскрытие экологических и агротехнических факторов, влияющих на синтез CBCF в растениях каннабиса. Изучение влияния условий выращивания, включая тип почвы, освещение, температуру, водный режим и использование удобрений, позволит разработать оптимальные стратегии культивирования для максимизации выхода CBCF. Разработка таких методик имеет непосредственное практическое значение для фармацевтической промышленности и сельского хозяйства, особенно в контексте стандартизации сырья и повышения качества лекарственных продуктов.
Особое внимание следует уделить изучению потенциала CBCF в рамках комплексных биоактивных композиций. Экспериментальные исследования комбинаторных эффектов CBCF с другими каннабиноидами, терпеноидами и флавоноидами помогут раскрыть механизмы синергии или антагонизма, которые могут иметь критическое значение для терапевтических применений. Дальнейшая оценка этих взаимодействий на молекулярном, клеточном и организменном уровнях откроет путь к разработке более эффективных, таргетированных и безопасных препаратов с комплексным действием.
В сфере биотехнологий важным направлением станет инженерия микроорганизмов, способных синтезировать CBCF в масштабах, которые будут коммерчески привлекательными. Разработка рекомбинантных систем на основе бактерий, дрожжей или растительных клеток с высокой продуктивностью и стабильностью синтеза CBCF требует совершенствования генетических конструкций, оптимизации условий культивирования и масштабирования процессов. Использование CRISPR/Cas-технологий для редактирования геномов природных продуцентов каннабиноидов может существенно повысить выход CBCF, а также улучшить качество конечного продукта.
Дальнейшие исследования должны охватывать системный анализ метаболических сетей, в которые включён CBCF, с применением методов метаболомики, протеомики и транскриптомики. Интеграция этих данных позволит создать комплексные модели регуляции метаболизма каннабиноидов, что откроет новые возможности для точечного воздействия на биосинтез и регуляцию CBCF.
Важным направлением является также разработка доклинических и клинических исследований для оценки фармакологической эффективности и безопасности CBCF. Учитывая его потенциал, необходимо разработать стандартизированные методики тестирования, включая модели на клеточных культурах, органах-мишенях, а также животных моделях заболеваний. Это позволит получить исчерпывающие данные о терапевтическом потенциале, токсичности, побочных эффектах и оптимальных дозах, необходимых для дальнейшего применения в медицине.
Кроме того, значительное внимание должно быть уделено социальным, правовым и этическим аспектам, связанным с использованием CBCF. Учитывая сложность регуляторных требований в разных странах, исследования влияния правового поля на развитие научных и коммерческих проектов являются важными для формирования стратегии внедрения новых технологий в производство и медицинскую практику.
Вывод
Канабихроманон (CBCF) является химическим соединением с уникальными структурными и физико-химическими свойствами, относящимся к группе каннабиноидов — классу природных фенольных метаболитов, характерных для растений рода Cannabis. Его молекулярная структура отличается специфической циклической конформацией, которая обусловливает особенности химической реактивности и биологической активности. Тщательное изучение физико-химических характеристик CBCF позволяет установить параметры, определяющие его стабильность, растворимость и взаимодействие с биомолекулами, что является основой для дальнейшего научного и технологического применения.
Биогенетическое происхождение CBCF тесно связано с каннабиноидной биосинтетической системой, в которой сложное взаимодействие ферментов и прекурсоров приводит к формированию этой молекулы. Особенности энзиматических механизмов, отвечающих за циклические реакции и специфический набор функциональных групп, остаются предметом активного исследования. Раскрытие точных путей синтеза CBCF имеет фундаментальное значение для контроля и регуляции его образования в природных источниках.
Методы получения CBCF включают полусинтетические подходы, полный химический синтез и биотехнологические технологии. Каждый из этих методов имеет свои преимущества и вызовы: полусинтетические пути позволяют модифицировать природные вещества, лабораторный синтез дает возможность создания чистых изомеров, а биотехнологические методы, в частности использование рекомбинантных микроорганизмов, открывают перспективы масштабного и экологически безопасного производства. Этот комплексный подход создает базу для широкого спектра применений CBCF в фармацевтике и промышленности.
Биологический потенциал CBCF характеризуется значительной перспективностью в контексте потенциальной биоактивности. Несмотря на ограниченность имеющихся экспериментальных данных, существуют основания полагать, что CBCF может взаимодействовать с различными молекулярными мишенями в организме, демонстрируя разнообразные фармакологические эффекты. Научное изучение этого аспекта требует дальнейшего доклинического и клинического тестирования для подтверждения безопасности и эффективности.
Значение CBCF в хемотипировании каннабиса открывает новые горизонты в классификации и стандартизации растительных сортов на основе детального профиля каннабиноидов. Это способствует разработке более точных и контролируемых методов культивации, а также позволяет создавать продукты с заданными фармакологическими свойствами. Таким образом, CBCF становится важным маркером, дополняющим традиционные системы классификации каннабиса.
Дальнейшие направления исследований направлены на более глубокое понимание биохимических, молекулярных и фармакологических механизмов действия CBCF, развитие новых методов его синтеза, совершенствование аналитических технологий и разработку клинически релевантных применений. Интеграция междисциплинарных исследований позволит не только расширить фундаментальные знания, но и эффективно внедрить CBCF в медицину, фармацевтику и другие отрасли, требующие инновационных биоактивных соединений.
Таким образом, CBCF является перспективным объектом научных исследований с значительным потенциалом для практического использования. Его комплексное изучение открывает новые возможности для разработки инновационных терапевтических средств и технологических решений, подчеркивая важность дальнейшей системной работы в этой области.
Источники
- Structure-Activity Relationship of Cannabis Derived Compounds for Cannabinoid Receptors.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6099582/ - Cannabichromene (Wikipedia).
https://en.wikipedia.org/wiki/Cannabichromene - Phytocannabinoids: A Unified Critical Inventory.
https://www.nature.com/articles/c6np00074f - Evolution of the Cannabinoid and Terpene Content during the Growth of Cannabis sativa Plants from Different Chemotypes.
https://pubs.acs.org/doi/abs/10.1021/acs.jnatprod.5b00949 - Antitumor Activity of Plant Cannabinoids with Emphasis on the Effect of Cannabidiol on Human Breast Carcinoma.
https://pubmed.ncbi.nlm.nih.gov/16798734/ - Cannabichromene, Related Phytocannabinoids, and 5-Fluoro-cannabichromene Have Anticonvulsant Properties in a Mouse Model of Dravet Syndrome.
https://pubs.acs.org/doi/abs/10.1021/acschemneuro.0c00556