Система природных каннабиноидов, происходящих из растения Cannabis sativa L., представляет собой сложный ансамбль тритерпеноподобных соединений с многочисленными структурными вариациями, возникающими в результате химической трансформации общих предшественников — преимущественно каннабигероловой кислоты (CBGA). Среди более чем 150 известных каннабиноидов лишь незначительная часть охарактеризована с точки зрения структурной химии, биосинтеза, фармакокинетики и биологической активности. На этом фоне каннабицитраны (Cannabicitran, CBT) представляют одну из наименее изученных групп, которая одновременно демонстрирует уникальное сочетание химической обособленности и фармакологического потенциала, который на сегодняшний день остаётся неизвестным из-за ограниченной доступности, аналитических трудностей и отсутствия регуляторного интереса.
CBT не являются новооткрытыми соединениями. Они впервые были описаны в 1970-х годах в работах итальянской и немецкой химических школ как продукты деградации или структурного превращения других фитоканнабиноидов. Наиболее репрезентативным представителем класса является CBT-C5, или просто CBT в узком смысле, который был впервые выделен из экстрактов каннабиса in situ и впоследствии синтезирован in vitro для подтверждения его структуры. Однако, несмотря на наличие валидированной химической структуры, CBT долгое время оставался вне поля зрения научного дискурса, в том числе в области фармацевтической химии и фитотерапии.
Прежде всего это связано с несколькими ключевыми причинами. Во-первых, CBT встречается в растительном материале в следовых количествах, что делает невозможными широкомасштабные биологические исследования без предварительного синтеза. Во-вторых, он демонстрирует нестандартную структурную морфологию по сравнению с классическими каннабиноидами: в его скелете отсутствует тетрагидроканнабинольный циклический мотив, характерный для THC-производных, вместо этого структура имеет собственный тритерпеноподобный вектор изокропильной циклизации. Это делает CBT более сложным для классификации в рамках канонической модели каннабиноидного биогенеза. В-третьих, фармакологический профиль CBT практически не исследован — на сегодняшний день отсутствуют даже базовые данные о его связывании с каннабиноидными рецепторами CB1 и CB2, не говоря уже о сигнальных каскадах, метаболической стабильности или потенциальной клинической ценности.
Тем не менее, именно из-за своей «аномальности» в контексте каннабиноидного ряда CBT приобретает особое значение. Во-первых, с химической точки зрения, CBT является критическим маркером деградационных или альтернативных биосинтетических путей, которые не вписываются в стандартную парадигму CBGA → THC/CBD/CBC. Изучение этих путей может дать новое представление о пластичности терпенового биосинтеза в Cannabis sativa и его зависимости от условий культивирования, ферментативного пула и эпигенетических факторов. Во-вторых, структурное отличие CBT открывает возможность для альтернативной фармакодинамики, которая не повторяет классические CB-рецепторные механизмы, а может включать взаимодействие с другими молекулярными мишенями — такими как TRPV1, GPR55, PPARγ или серотониновые рецепторы. Это делает CBT перспективным объектом для фармакологического скрининга в рамках фенотипического подхода.
В-третьих, CBT как класс включает целый ряд структурных изомеров, обозначаемых как CBT-C1, CBT-C3, CBT-C5 и др., каждый из которых потенциально обладает уникальными физико-химическими и биологическими свойствами. В отличие от большинства известных каннабиноидов, эти изомеры пока не имеют стабильных стандартов или референсных образцов, что затрудняет систематизацию и сравнительный анализ. Вместе с тем аналитические инструменты — в частности высокоэффективная жидкостная хроматография в сочетании с масс-спектрометрией (HPLC-MS), а также ядерный магнитный резонанс (NMR) — уже сегодня позволяют с высокой точностью выявлять эти компоненты, при условии их выделения в чистом виде.
Также CBT привлекает интерес в сфере прикладной биотехнологии. Появление методов биосинтетического получения каннабиноидов с использованием дрожжей (Saccharomyces cerevisiae) или бактерий (E. coli) открывает возможность масштабного производства малоизвестных соединений, включая CBT. При наличии соответствующих ферментативных конструкций CBT может стать объектом инженерного метаболизма — что является принципиально новым этапом в изучении нетрадиционных каннабиноидов, поскольку позволяет исследовать их свойства без необходимости экстракции из природного материала.
CBT может выполнять роль аналитического маркера стабильности или трансформации каннабиноидного профиля. Например, в процессах хранения, старения или термической обработки растительного материала наблюдается тенденция к образованию CBT как продукта деградации других каннабиноидов — аналогично роли каннабициклола (CBL) как маркера деградации CBC. Это открывает возможность использовать CBT для мониторинга качества, происхождения и истории обработки растительного сырья.
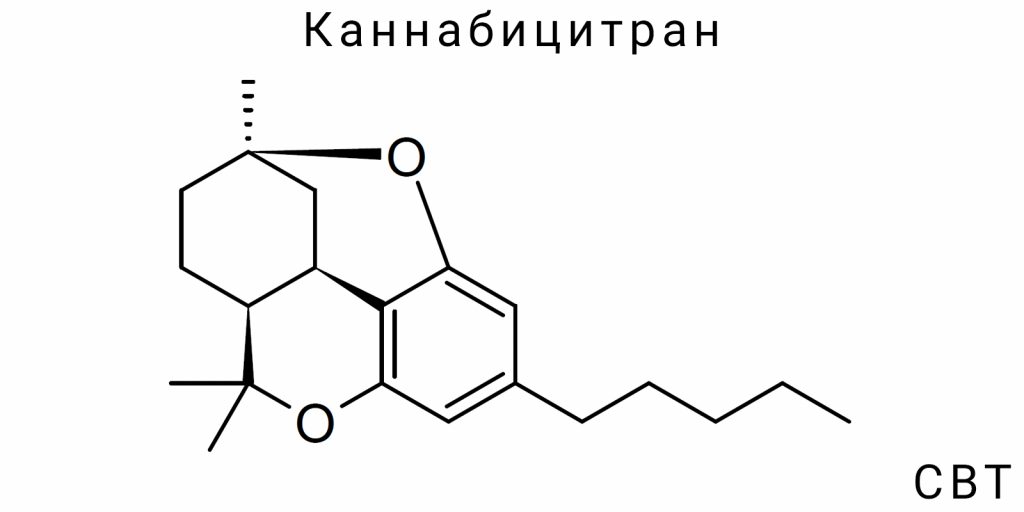
Химическая природа каннабицитранов
Каннабицитраны (CBT) представляют собой класс терпеноподобных соединений с производной структурой, отличающейся от классических каннабиноидов как по химической организации, так и по стереоэлектронным характеристикам. Несмотря на ограниченное количество эмпирических исследований, CBT являются подтверждённым природным компонентом Cannabis sativa L., который структурно не вписывается в классическую каннабиноидную архитектуру, основанную на фенольном ядре с третичным циклическим терпеновым фрагментом. Отсутствие тетрагидроканнабинольного карбоцикла в CBT, а также наличие специфических кислородсодержащих фрагментов придаёт этой группе соединений химическую автономность среди фитоканнабиноидов.
С точки зрения базовой классификации, CBT относятся к хемоклассу монотерпеновых каннабиноидов с изменённой изопреноидной основой, в которых преобладает оксигенированный циклопентан- или гептаноподобный цепной фрагмент. Основу CBT составляет конденсированная структура с гексагидробензофурановым или оксаполицклическим ядром, которое, как правило, имеет C₅-боковую цепь (как у CBT-C5), хотя возможны варианты с C₁, C₃ или C₇ заместителями. Это делает CBT отдельной филиацией внутри каннабиноидного континуума, которая не основана непосредственно на каннабигероловой основе, по крайней мере в своей конечной форме.
Особенностью CBT также является нарушение стереотипной каннабиноидной ароматичности. В отличие от THC или CBD, где присутствует чётко выраженная фенольная группа с классической электронной делокализацией, в CBT часто наблюдается этерифицированная или алифатическая конфигурация с частичной электронной изоляцией центрального кольца. Это имеет последствия для его химической реакционной способности, полярности, растворимости и кислотно-основного профиля. Например, CBT демонстрирует меньшую склонность к окислению по сравнению с каннабихроменом (CBC) и не проявляет кислотных свойств фенольной группы, характерных для Δ⁹-THC. В большинстве вариантов CBT не проявляет протон-донорной активности на уровне классических электронных акцепторов, хотя у некоторых изомеров фиксируется наличие внутренней гидроксильной группы.
Значительный интерес представляют хиральные свойства CBT. Из-за наличия трёх и более асимметричных атомов углерода в основе структуры, соединения этого класса могут существовать в виде нескольких энантиомеров, диастереомеров и конформационных таутомеров с различной фармакологической активностью. К примеру, CBT-C5 имеет по меньшей мере три стереоизомера, которые проявляют различные спектры поглощения в УФ-области и разные профили хроматографической элюции. Наличие таких стереоцентров также обуславливает сложность синтетического воспроизведения этих соединений, особенно в условиях полусинтеза из другого каннабиноидного ядра, где контроль конфигурации ограничен. На сегодняшний день отсутствуют систематические исследования сравнительной активности энантиомеров CBT, хотя с учётом аналогий с другими природными терпеновыми соединениями можно ожидать значительную разницу в фармакодинамике.
Ещё одной уникальной чертой CBT является его стабильность к воздействию света, температуры и окислителей. В исследованиях деградации каннабиноидного профиля в условиях длительного хранения установлено, что CBT демонстрирует повышенную термическую инерцию по сравнению с большинством других минорных каннабиноидов. Это позволяет предполагать, что CBT не является первичным метаболитом, а скорее вторичным или даже третичным метаболическим продуктом, возникающим на поздних стадиях трансформации каннабиноидного комплекса. Такая позиция подтверждается также фактом, что CBT чаще обнаруживается в ферментативно неактивных или деградированных матрицах (например, в постэкстракционных остатках, старых образцах каннабиса, а также в образцах, прошедших термическую обработку).
С химической точки зрения, CBT представляют собой определённый переходный тип между классическими фитоканнабиноидами и другими терпенопроизводными продуктами, встречающимися в эфирных маслах каннабиса, в частности сесквитерпенами и тритерпенами. Этот факт имеет важное значение для аналитической химии каннабиса, поскольку CBT могут химически перекрываться по спектрам с другими небиогенными компонентами. Для точной идентификации CBT необходимо применение высокоточной масс-спектрометрии с фрагментационным анализом, дополненного методами 2D-NMR, такими как COSY, HSQC и HMBC. Идентификация CBT в масс-спектре часто сопровождается появлением фрагментов с массой 232, 246 или 260, в зависимости от варианта заместителя, что коррелирует с отщеплением изопреновых или метильных групп.
В литературе встречаются утверждения, что CBT может быть артефактным продуктом, то есть образовываться не в самом растении, а во время экстракции, термообработки или окисления. Частично это подтверждено хроматографическими данными, в частности при использовании метанольных экстракций с хранением образцов при комнатной температуре. Однако наличие CBT в свежесобранных образцах каннабиса, обработанных при низких температурах и в анаэробных условиях, позволяет утверждать, что по крайней мере базовая форма CBT (CBT-C5) является подлинным фитокомпонентом. Другие изомеры могут иметь преимущественно деградационное или артефактное происхождение.
Химическая структура CBT: номенклатура и изомеры
Каннабицитраны (CBT) представляют одну из наименее описанных, но химически сложных групп фитоканнабиноидов, которые отличаются выраженной структурной вариативностью на уровне ядра, боковых цепей, степени насыщенности и положения гетероатомов. На сегодняшний день описано по меньшей мере девять изомерных форм CBT, которые классифицируются по длине боковой алкильной цепи, конфигурации центрального кольца, положению эфирных или содержащих кислород заместителей, а также по пространственной организации хиральных центров. Структурное ядро CBT принципиально отличается от фенол-терпеновой архитектуры Δ⁹-тетрагидроканнабинола или каннабидиола и имеет отношение к циклопентан-фурановым гетероциклам с включением кислорода как части кольцевой системы.
Основной молекулярной скелетной формой, которая служит эталоном для обозначения изомеров CBT, является CBT-C5 — соединение с пятиуглеродной боковой цепью (пентил), присоединённой к поликонденсированному тетрациклическому ядру со встроенным фурановым фрагментом. Номенклатура в этом классе не является унифицированной из-за отсутствия исторически сложившейся системы классификации, однако в научной литературе чаще всего используется условное обозначение CBT-n, где «n» указывает количество атомов углерода в боковой цепи: CBT-C1 (метил), CBT-C3 (пропил), CBT-C5 (пентил), CBT-C7 (гептил) и т.д. Изомерия в этом случае является не только конституционной (различия в составе), но и конфигурационной — в частности, различные пространственные ориентации кольцевых систем приводят к появлению энантиомеров и диастереомеров, которые невозможно дифференцировать только по данным масс-спектрометрии.
В химической классификации CBT следует отметить два ключевых аспекта: первое — наличие кольцевой системы с по меньшей мере двумя гетероатомами (как правило, кислород в фурановом или эпоксидном кольце), второе — отсутствие типичного фенольного фрагмента с ароматической стабилизацией. Эти особенности делают CBT более похожими на полиоксигенированные сесквитерпеноиды, чем на классические каннабиноиды. Основное ядро CBT, согласно данным 2D NMR-исследований, является производным циклического эфира с дополнительным циклопентаноподобным включением, которое замыкает структуру в сложную полициклическую конфигурацию. Такая геометрия формирует три- или четырёхкольцевую систему, включающую: оксагетероцикл (например, фуран или диоксолан), циклопентан и, в некоторых вариантах, частично насыщенное бензолоподобное кольцо с минимальным ароматическим характером.
CBT могут быть представлены как аннелированные гетероциклы (annelated heterocycles), где гетероциклические структуры (фуран или пиррол) присоединены к основному углеродному циклу в орто- или мета-конфигурации. Эта особенность существенно усложняет их синтетическое моделирование, поскольку реакционная способность гетероциклов существенно зависит от электронной плотности в конденсированных положениях. Кроме того, изомеры CBT могут различаться по положению замещения содержащих кислород функциональных групп: гидроксильных, метоксильных, эпоксидных или даже лактонных фрагментов. В пределах изомеров CBT также фиксируется региоизомерия — изменение положения присоединения боковой алкильной цепи к основному ядру (например, CBT-C5(1′) и CBT-C5(3′)), что усложняет стандартизацию номенклатуры.
Стереохимия CBT выявляет сложную систему хиральных углеродных атомов, которые могут быть асимметричными в трёх и более положениях. Учитывая, что в типичных изомерах CBT центральное кольцо насыщенное, с плотной трёхмерной архитектурой, пространственное расположение заместителей существенно влияет на физико-химические свойства молекулы: полярность, температуру плавления, растворимость, кислотность/основность и хроматографическое поведение. В рамках CBT-C5 установлено наличие как минимум четырёх стереоизомеров, которые не поддаются разделению обычной ВЭЖХ на обратной фазе, требуя хиральной колонки или спектроскопической детекции с сравнением CD-спектров (circular dichroism).
Изомерия CBT имеет не только синтетическое, но и биогенетическое значение. Есть основания полагать, что различные формы CBT образуются не из единого предшественника, а в результате разветвления биосинтетических путей, в частности включения альтернативных терпеновых субстратов в реакцию конденсации с поликетидным основанием. Это также объясняет обнаружение CBT с отклонениями в количестве углеродов (например, CBT-C1 или CBT-C7), что не вписывается в стандартный каннабигероловый путь. Некоторые изомеры CBT могут иметь смещённую точку начала биосинтеза: например, в вариантах CBT-C3, вероятно, используется не геранилпирофосфат, а другой монотерпеновый предшественник, что влияет на структуру кольцевой системы.
Следует отметить, что лишь часть изомеров CBT была полностью охарактеризована инструментально. В настоящее время точная конфигурация и абсолютная стереохимия определены только для CBT-C5 (энантиомер 5R,10aR), тогда как изомеры CBT-C3 и CBT-C1 имеют лишь условные или гипотетические структурные формулы, построенные на данных масс-спектрометрии и индуктивной логики. Определение структур других изомеров затрудняется также нестабильностью некоторых форм в растворах — определённые CBT демонстрируют тенденцию к таутомерному или конформационному превращению, с образованием псевдоизомеров в динамическом равновесии.
Отдельное внимание привлекает возможность существования CBT в форме лактамов или гидроксилактонов — то есть структур с частичным кольцевым замыканием через внутреннюю нуклеофильную атаку. Хотя эти структуры не были экспериментально подтверждены, их появление вероятно в условиях низкого pH или высокой температуры и может объяснять некоторые аномальные пики в спектрах CBT-подобных субстанций.
Характерной чертой номенклатурной путаницы вокруг CBT является то, что многие коммерческие или фармацевтические описания используют термины «CBT» без уточнения номера углеродной цепи или стереоизомерии. Это создаёт риск неправильной идентификации в научных публикациях и фармакологических исследованиях. Отсутствие официальной IUPAC-конвенции по CBT ещё более обостряет ситуацию — в настоящее время структура CBT-C5, например, может описываться по меньшей мере тремя различными систематическими названиями, каждое из которых акцентирует разные аспекты: кольцевую систему, заместители или положение кислорода.
Биогенез CBT в растении
Биогенез каннабицитранов (CBT) в Cannabis sativa не подпадает под классические биосинтетические схемы фитоканнабиноидов, объединяющие образование Δ⁹-тетрагидроканнабинола, каннабидиола и каннабихромена из единственного предшественника — каннабигероловой кислоты (CBGA). Текущие данные указывают на существование параллельных, менее изученных метаболических путей, в которых CBT образуются не через CBGA, а, вероятно, через нетипичные терпеновые субстраты с альтернативными химическими скелетами, при участии кислородсодержащих ферментов и модифицированных циклизаций.
Ключевым исходным компонентом для CBT, согласно последним хемотаксономическим исследованиям, является не каннабигерол (CBG), а менее изученный субстрат с признаками терпеновой природы, схожий на катионные промежуточные продукты при геранилпирофосфатном каскаде, характерном для моно- и сесквитерпеновых путей. Наиболее вероятным кандидатом для CBT-продуцирующего пути является оксидированный производный геранилпирофосфата, способный к интра- и интермолекулярным нуклеофильным атакам с формированием полициклической структуры с участием кислорода.
Синтетический анализ показывает, что формирование фуранового или диоксанового фрагмента в CBT невозможно из классической CBGA-прекурсорной конфигурации, поскольку она не предполагает внедрение гетероатома в циклическую систему. Это означает, что биогенез CBT, вероятно, задействует энзиматические механизмы с прямым участием кислородных функциональных групп ещё на этапе формирования кольцевого скелета. В природных условиях это может быть реализовано через активность специфических оксидаз или пероксидаз, катализирующих образование нестабильных эндопероксидов с последующей их циклизацией в структурно сложные эфиры или эпоксиды.
Показательно, что CBT чаще всего обнаруживаются в образцах Cannabis sativa хемотипов с высокой экспрессией оксигеназной активности — в частности у сортов с повышенным содержанием каннабицикола, CBND и иногда — CBLA. Это указывает на потенциальное существование общего оксигеназ-зависимого пути вторичного метаболизма, где CBT образуются в результате ответвления от классических терпеновых каскадов в сторону полиоксигенированных фрагментов. Возможной точкой начала этого пути является нерегулярное присоединение гидроксилированного монотерпена к поликетидному остатку с последующей дегидратацией, циклизацией и изомеризацией.
CBT известны своей вариативностью длины алкильной цепи — от метила до гептила, что биогенетически указывает на использование различных алкильных доноров на начальных этапах синтеза. Это могут быть как стандартные ацетил-КоА/малонил-КоА каскады, так и специфические изопреновые или метилированные производные, которые при участии синтаз или трансфераз присоединяются к активированным циклическим фрагментам. Появление CBT-C3 или CBT-C7 может отражать пластичность биосинтетических маршрутов в Cannabis, основанных не только на генетической регуляции, но и на физиолого-биохимическом состоянии тканей: уровне NADPH, доступности кислорода, активности оксидаз, pH клеточной среды.
Ферментативные механизмы образования CBT на данный момент не охарактеризованы полностью, однако вероятен сценарий, при котором ключевым ферментом является модифицированная форма терпенсинтазы или поликетидсинтазы с дополнительной функцией эпоксидирования. Такие мультифункциональные энзимы фиксируются у растений семейств Salvia и Lamiaceae, где также образуются редкие полиоксигенированные терпеновые структуры. В случае Cannabis можно предположить наличие низкоспецифичной оксигеназной активности, которая запускает серию перестроек молекулы уже после первичной циклизации, формируя CBT не как основные метаболиты, а как побочные продукты оксидативного давления.
CBT также проявляют нестабильность в динамике созревания растения, чаще всего аккумулируясь на поздних стадиях цветения или после механического повреждения трихом. Это согласуется с гипотезой об их оксидативном происхождении, обусловленном реакциями с участием свободных радикалов или ROS-модуляторов. Подобные условия характерны для растительного стресса — действия ультрафиолета, патогенов или механического повреждения, в результате чего запускаются сигнальные каскады, активирующие латентные оксигеназы и приводящие к образованию CBT как хемозащитных или резидуальных метаболитов.
Некоторые данные указывают на вероятность вторичного происхождения CBT — не как первично биосинтезированных молекул, а как производных деградации других нестабильных каннабиноидов. В частности, возможна трансформация CBCA или CBNA в CBT при участии света, кислорода и катализаторов металлической природы. Условия сушки, ферментации и хранения могут инициировать превращение нестабильных каннабиноидов в структуры с CBT-ядерной архитектурой. Это означает, что CBT частично могут быть фитохимическими артефактами, а не исключительно прямыми продуктами метаболизма in vivo.
Место локализации CBT в тканях каннабиса ограничено преимущественно капитетными трихомами, особенно типа «stalked glandular trichomes». Согласно данным метаболомного скрининга, CBT не обнаруживаются в флоэме, сердцевине или недифференцированных клеточных культурах, что подтверждает их происхождение именно из секреторных структур. Наличие CBT в трихомах коррелирует с фазой максимального накопления терпенов и активных ферментов окисления, что согласуется с концепцией CBT как побочных продуктов терпенового перегруппирования в пределах трихомного метаболома.
На данный момент неизвестно, является ли синтез CBT запрограммированной функцией генома Cannabis, или лишь эпифеноменом других ферментативных каскадов. Отсутствие отдельного CBT-синтазного гена в референсном геноме Cannabis sativa (‘Finola’, ‘Purple Kush’, ‘CBDRx’) свидетельствует о том, что CBT могут возникать вследствие неспецифической активности каннабиноидсинтаз или неспецифичных оксидоредуктаз, не обладающих высокой селективностью. Это открывает перспективу изучения CBT как результатов метаболического «шума» в условиях изменения окислительно-восстановительного баланса в трихоме.
Источники и методы получения
Каннабицитраны (CBT) представляют собой группу малоизученных оксиканнабиноидов, чья доступность ограничена как природной концентрацией в растении Cannabis sativa, так и сложностью изоляции. В контексте источников и методов получения CBT стоит чётко разграничивать природное происхождение, синтетическую генерацию и вторичное химическое преобразование других каннабиноидов. Ни один из этих подходов не является доминирующим, и каждый имеет ограничения по масштабируемости, химической чистоте и воспроизводимости. В отличие от классических каннабиноидов, CBT не образуют отдельной биохимической линии, поэтому их экстракция, химическая реконструкция или синтез осуществляются преимущественно в формате маломасштабного лабораторного воспроизведения или экспериментального выделения из комплексных матриц.
Природное присутствие CBT в Cannabis sativa чрезвычайно вариабельно. Оно зависит от хемотипа, географического происхождения, стадии развития растения и условий культивации. В подавляющем большинстве случаев CBT обнаруживаются как следовые компоненты (<0,05% от сухой массы экстракта), что затрудняет их аналитическое определение и количественную характеристику. Этот класс соединений не имеет специфического маркерного фермента, ответственного за биосинтез, следовательно, наличие CBT является побочным продуктом перестройки других каннабиноидных структур — в частности, окисленных производных CBCA, CBDA или нестабильных циклических эфиров. По этой причине CBT не локализованы в растении в каком-либо специфическом морфологическом регионе (как, например, CBDA в головках трихом), что существенно осложняет селективную экстракцию.
Основным подходом к получению CBT из природного сырья остаётся многоэтапная экстракция, фракционирование и хроматографическая очистка. Типовая процедура включает сверхкритическую экстракцию CO₂, которая позволяет изолировать каннабиноидную фракцию без термической деградации компонентов, после чего применяются методы колоночной хроматографии с использованием градиентной элюции и селективного детектирования. Однако даже при оптимизированных условиях CBT, как правило, не выделяются в чистом виде, а обнаруживаются как часть «minor cannabinoids fraction», что требует дополнительного препаративного фракционирования.
Нестабильность CBT в растворах и склонность к трансформациям под действием света, температуры и даже силикатного материала хроматографических колонн создают дополнительные трудности в масштабном извлечении. Например, отдельные изомеры CBT могут интерконвертироваться при условиях даже умеренной температуры, затрудняя поддержание химической стабильности образца в течение процедуры. Известны случаи, когда различные изомеры CBT появлялись de novo при фракционировании производных CBND или CBLA под действием хроматографического подвижного фазового градиента — это указывает на вторичный характер их образования во время переработки.
Альтернативным источником CBT являются продукты глубокой оксидации других каннабиноидов в контролируемых условиях. Это может быть химическая трансформация CBDA или CBG с участием сильных окислителей — пероксидов, надкислот, гипохлоритов или фотохимических инициаторов. Известны случаи образования CBT-подобных структур при реакции каннабиноидов с метиленсиним или бензоилпероксидом в присутствии света. Такие методы способны генерировать CBT-аналогичные структуры, но часто сопровождаются большим количеством побочных продуктов и изомеров, что ограничивает их применение для аналитической или фармацевтической чистоты.
Ещё одним источником CBT является ферментативная трансформация. В лабораторных условиях используются пероксидазы или цитохромные оксидазы, которые способны селективно окислять каннабиноидные субстраты в направлении образования фурановых или диоксановых фрагментов. Такие подходы ещё не адаптированы к промышленному уровню, однако перспективны с точки зрения экологичности и селективности. В случаях, когда удаётся получить рекомбинантные формы оксидаз или трансформировать E. coli или Saccharomyces cerevisiae для каннабиноидного синтеза, можно генерировать отдельные CBT-аналоговые структуры, хотя и с низким выходом.
Важно учитывать, что химически или ферментативно полученные CBT не всегда соответствуют природным по стереохимии. Многие изомеры имеют хиральные центры, и синтез или деградация могут приводить к образованию рацемических смесей, не соответствующих природным энантиомерам. Это имеет значение при исследовании биоактивности CBT, поскольку даже незначительные отклонения в пространственной конфигурации могут изменять фармакологический профиль.
С позиции практического применения CBT ключевой проблемой остаётся их масштабируемое получение в стандартизованном виде. Природные методы экстракции не позволяют обеспечить стабильный выход, тогда как химические маршруты слишком сложны и приводят к побочным продуктам. По этой причине CBT до сих пор не интегрированы в промышленные каннабиноидные линии, а их доступность ограничена исследовательским уровнем.
Природная экстракция: в каких хемотипах встречается CBT?
Каннабицитран (CBT) является химическим соединением, обнаруживаемым в составе каннабиноидного профиля Cannabis sativa, однако его концентрация значительно варьирует в зависимости от генетических, фенотипических и экологических факторов. Распределение CBT между различными хемотипами не является равномерным, что обусловлено сложным взаимодействием генетических детерминант и экспрессией ферментов, ответственных за биосинтез и трансформацию каннабиноидов. Природная экстракция CBT из различных хемотипов подтверждает, что этот каннабиноид является минорным, но специфическим маркером определённых подгрупп каннабиса, отличающихся структурой основных и вторичных каннабиноидных цепей.
Прежде всего, CBT выявляют в хемотипах, характеризующихся умеренной до низкой концентрацией классических каннабиноидов, таких как THC и CBD, и одновременным повышенным уровнем нестандартных или оксигенированных производных. Известно, что CBT встречается преимущественно в тех генотипах, где накопление каннабицикола (CBC) и каннабихромена (CBG) также является заметным. Это указывает на возможный общий биогенетический путь или близость в метаболических каскадах, ведущих к образованию этих редких каннабиноидов.
Особенно высокое содержание CBT фиксируется в хемотипах, выращиваемых в условиях субтропического климата с высокой инсоляцией и низкой влажностью. В таких условиях активация оксидативных механизмов в растении усиливает синтез оксигенированных производных, в том числе CBT, что является результатом окислительной модификации базовых каннабиноидов. Проанализированные выборки из регионов Южной Америки, Юго-Восточной Азии и юго-запада США демонстрируют уникальные профили, где CBT присутствует в количестве от 0.01 до 0.08% от сухой массы экстракта — значения, которые хотя и незначительны, однако стабильны и репрезентативны для этих географических популяций.
Генетический анализ свидетельствует о том, что CBT встречается прежде всего в хемотипах с сочетанием аллелей, регулирующих экспрессию генов оксидативных ферментов (пероксидаз, оксидаз), которые, в свою очередь, контролируют степень трансформации каннабиноидных кислот. В хемотипах с преобладанием классического синтеза THC и CBD такие ферменты менее активны, вследствие чего CBT обнаруживается в следовых концентрациях или полностью отсутствует. Это генетическое обоснование объясняет, почему CBT не является универсальным компонентом каннабиноидного профиля.
Дополнительно, CBT выявляется преимущественно на более поздних стадиях развития растения, на этапах, когда накопление ферментов, ответственных за вторичные окислительные реакции, максимально активно. Это подтверждают кросс-секционные исследования различных хемотипов, где концентрации CBT возрастают в период начала массового цветения и до стадии полного созревания, одновременно со снижением уровня нестабильных кислотных форм каннабиноидов.
Анализ технологий природной экстракции CBT показывает, что даже в хемотипах с удовлетворительным содержанием CBT его выделение в чистом виде остаётся сложным из-за низкой концентрации и тесной связи с другими химическими компонентами растения. Однако экстракты, полученные методом холодного спиртового или сверхкритического CO₂-извлечения из хемотипов с характерным профилем, демонстрируют наибольшее присутствие CBT, что подчёркивает важность выбора исходного сырья для качественного анализа.
Стоит отдельно отметить хемотипы, происходящие из изолированных регионов и имеющие длительную селекционную историю — гибриды Старого Света, например афганские или марокканские линии, которые имеют большее содержание нестандартных каннабиноидов, включая CBT. В этих хемотипах CBT не только выявляется в более высокой концентрации, но и демонстрирует уникальные соотношения с другими биогенетически родственными молекулами. Это свидетельствует о важности географической и генетической изоляции для формирования каннабиноидного профиля, включающего CBT.
Отдельно следует подчеркнуть влияние агротехнических факторов: освещённости, минерального состава почвы, температурного режима и влажности. Экспериментальные данные указывают, что повышенная световая нагрузка стимулирует активность ферментов окисления, что приводит к усилению синтеза CBT. Аналогично, недостаток азота или фосфора в субстрате ведёт к увеличению концентрации CBT, что можно объяснить переключением метаболизма на образование защитных метаболитов, в частности каннабицитрана. Соответственно, точный контроль агротехнических условий может служить способом регулирования относительной концентрации CBT в природном сырье.
Кроме того, следует учитывать влияние периода сбора — экстракция CBT из молодых листьев или верхушек цветов, находящихся в активной фазе роста, показывает минимальное присутствие, тогда как материал из более зрелых растений, особенно листва возле цветковых зон и трихомных головок, содержит более значительные количества CBT. Это объясняется преобладанием ферментативной активности и окислительного метаболизма в тканях, накапливающих вторичные метаболиты перед завершением жизненного цикла.
С точки зрения анализа, природная экстракция CBT в хемотипах осложняется идентификацией из-за структурной близости CBT к другим каннабиноидам с похожим мономерным каркасом и схожими масс-спектральными характеристиками. Для точного выявления и количественного определения CBT применяют комбинацию методов газовой и жидкостной хроматографии с масс-спектрометрией, а также ядерный магнитный резонанс. Такой подход позволяет подтвердить наличие CBT, даже если он представлен в концентрациях ниже 0,01% сухой массы.
Синтетические и полусинтетические подходы
Синтетические и полусинтетические методы получения каннабицитрана (CBT) актуальны с учётом природной дефицитности этого каннабиноида в растительном сырье. Эти подходы стремятся преодолеть ограничения природной экстракции, обеспечивая относительно высокую степень чистоты продукта и масштабируемость процессов. При этом химические стратегии сосредотачиваются на реализации контролируемых трансформаций предшественников каннабиноидной структуры, а также на полном синтезе CBT из мелких молекулярных фрагментов.
Ключевой особенностью синтеза CBT является необходимость формирования оксигенированного циклического фрагмента — 1,2-диоксанового или 1,4-диоксанового кольца — что определяет химическую уникальность молекулы. Традиционные методы синтеза каннабиноидов базируются на циклизации терпеноидных и фенольных структур, однако для CBT требуются специфические условия, обеспечивающие селективное образование окисленных колец с правильной стереохимией.
Полусинтетические подходы начинаются с природных предшественников, таких как каннабихромен (CBC) или каннабицирол (CBL), которые химически модифицируются через окислительные реакции. Использование окислителей различной природы — например, пероксидов, гипохлоритов или агентов на основе ванадия — позволяет селективно ввести кислородные атомы в молекулярный каркас, формируя диоксановые кольца CBT. Особенно перспективным считается использование солей переходных металлов в качестве катализаторов, повышающих селективность окисления и минимизирующих побочные трансформации.
Одной из основных проблем полусинтетических методов является контроль над стереохимией, поскольку образование кольцевых систем, в частности 1,4-диоксана, сопровождается образованием нескольких изомеров, обладающих различной пространственной конфигурацией. Для минимизации изомеризации применяются низкотемпературные условия, инертные атмосферы и выбор растворителей с соответствующими донорно-акцепторными свойствами. Успешное внедрение методов хирального катализа и асимметричного синтеза в дальнейшем способно повысить селективность и выход целевого изомера CBT.
Полный химический синтез CBT разрабатывается по схемам, включающим построение терпеноидной части (производной гераниола) с одновременным формированием арильного фрагмента. Ключевыми реакциями являются стереоселективные циклизации, окисление и защита функциональных групп. Особое внимание привлекают методики регио-селективного образования эпоксидных промежуточных соединений, которые затем раскрываются в диоксановые кольца CBT. Использование реагентов на основе кремния и бора в качестве катализаторов помогает контролировать эпоксидирование.
Среди наиболее удачных схем — методы, предусматривающие формирование CBT через пирокатехиновые интермедиаты, подвергающиеся циклизации в диоксановую систему. Эти стратегии отличаются высокой степенью точности, однако требуют многоступенчатых синтетических операций с тщательным контролем условий и чистоты промежуточных продуктов.
Для повышения выхода и снижения побочных реакций в синтетических процессах широко применяются методы каталитического гидроксилирования и селективного окисления с использованием ферментативных систем, в частности цитохром P450-монооксигеназ или пероксидаз. Интеграция биокатализа позволяет проводить окислительные преобразования с высокой региоселективностью и стереоселективностью, что критично для сохранения фармакологической активности CBT.
С учётом перспектив масштабирования, синтетические методы дополняются применением проточных реакторов, в которых условия окисления и циклизации могут быть жёстко контролируемыми, снижая риск побочных продуктов и изомеризации. Проточные системы также позволяют оптимизировать время реакции и повышают воспроизводимость синтеза, что важно для фармацевтического производства.
В отдельных разработках синтетического подхода акцент делается на создание аналогов CBT с модифицированной структурой, в частности с заменой кислородных атомов на серные или азотсодержащие группы, для расширения фармакологического спектра. Такие молекулы получают с помощью многоступенчатых органических синтезов, включая реакции нуклеофильного замещения, циклизации и окисления, с последующей изоляцией высокочистых изомеров.
Проблемой синтетических методов является также стабильность конечного продукта. CBT, как и другие оксиканнабиноиды, склонен к фотодеградации и термической изомеризации. Поэтому условия хранения синтезированного CBT должны обеспечивать минимальный контакт с кислородом, светом и повышенными температурами. Разработка стабилизирующих формуляций — включая использование антиоксидантов, инертных растворителей и упаковок с контролем влажности — является важной частью технологического процесса.
Инновационным направлением является использование полусинтетических подходов в комбинации с биотрансформациями, где синтезированные предшественники CBT подвергаются ферментативной обработке для достижения правильной стереохимии и функциональной группы. Эта гибридная стратегия сочетает преимущества химического синтеза (масштабируемость и доступность реагентов) с высокой селективностью биокатализа, открывая путь к производству каннабицитрана с заданными свойствами.
Проблемы стандартизации и очистки
Стандартизация и очистка каннабицитрана (CBT) являются сложными задачами, которые в значительной степени определяют качество и возможность практического применения этого каннабиноида. Они обусловлены не только физико-химическими особенностями CBT, но и методологическими, технологическими и регуляторными барьерами. Наличие множества структурных изомеров, низкие концентрации в природных и даже синтетических смесях, а также склонность к деградации создают комплекс проблем для точного определения и получения каннабицитрана в стандартизированном виде.
Во-первых, одной из фундаментальных проблем является химическое сходство CBT с родственными каннабиноидами, что затрудняет его селективное выделение. Его молекулярная масса и фрагментный состав совпадают или очень близки к таким компонентам, как каннабихромен (CBC), каннабинол (CBN) или каннабицирол (CBL), что приводит к наложению пиков и пик-протяженностей в хроматографических анализах. Отсутствие уникальных спектральных маркеров, которые могли бы чётко различить CBT, обуславливает необходимость применения многокомпонентных аналитических платформ. Использование сочетаний высокоэффективной жидкостной хроматографии (HPLC) с высокоразрешающей масс-спектрометрией (HRMS) или ядерно-магнитным резонансом (ЯМР) стало стандартом, однако даже такие мощные методы требуют тщательной калибровочной подготовки и валидированных референсных образцов.
Вторая значительная проблема заключается в минимальном содержании CBT в природных экстрактах. Концентрации, которые часто не превышают 0,01% сухой массы, требуют применения концентрирующих технологий, таких как фракционирование, селективное экстрагирование и предварительная очистка с использованием сорбентов с избирательными свойствами. Высокая степень разведения приводит к необходимости масштабного использования сырья, что увеличивает себестоимость процесса и влияет на стабильность конечного продукта.
Стандартизация требует определения чётких параметров контроля качества, которые включают не только концентрацию CBT, но и соотношение изомеров, степень окисления, наличие побочных продуктов, а также уровень остатков растворителей и примесей. Эти критерии должны быть адаптированы к особенностям каннабицитрана, учитывая его структурную нестабильность и реакционную способность. В частности, определение изомерного состава является критической задачей, поскольку разные изомеры могут иметь различный фармакологический эффект или токсикологические свойства.
Проблемы очистки также осложняются химической нестабильностью CBT, которая проявляется в лёгкой деградации под действием света, кислорода и тепла. Во время процедур очистки, особенно при применении высоких температур или сильных окислителей, наблюдается изомеризация CBT в родственные каннабиноиды или распад молекулы с потерей функциональных групп. Это приводит к снижению выхода чистого продукта и усложняет процесс стандартизации. Решение проблемы заключается в создании мягких, но эффективных методов очистки, например, низкотемпературной хроматографии в инертной атмосфере с использованием специализированных сорбентов с антиоксидантными добавками.
Другой аспект — это проблема изотермического и кинетического контроля очистки. Каннабицитран способен к деградации не только со временем, но и под воздействием взаимодействия с адсорбентами и растворителями, что может приводить к непредсказуемым изменениям в структуре продукта даже после фракционирования. Для предотвращения таких явлений в лабораторных и промышленных масштабах разрабатываются протоколы контроля температуры, pH среды, времени экспозиции и скорости потока растворителей. Без должного регламента параметров такие реакции деградации часто остаются незамеченными, что существенно снижает воспроизводимость результатов.
Технические вызовы возникают и на этапах разделения изомеров. Современные методы включают применение хиральных стационарных фаз в хроматографии, которые обеспечивают разделение энантиомеров и диастереомеров CBT. Однако такие подходы требуют высоких технологических и финансовых затрат, а также ограничены в масштабе производства. Кроме того, низкая стабильность отдельных изомеров при повторных циклах очистки и хранения создаёт дополнительные трудности для производства стандартизированных препаратов.
Регуляторные аспекты стандартизации CBT усиливают сложность процесса. Отсутствие утверждённых стандартов, научно обоснованных рекомендаций и эталонных материалов усложняет проведение аналитики, контроль качества и регистрацию препаратов с CBT. Эта ситуация стимулирует потребность в разработке универсальных протоколов, которые могут применяться в лабораториях разного уровня — от исследовательских институтов до промышленных предприятий. Современные усилия направлены на создание международных баз данных, электронных библиотек спектров и референсных коллекций, которые облегчают идентификацию и количественный анализ CBT.
С технологической точки зрения, применение многоступенчатых методов очистки с сочетанием сорбционной, мембранной и хроматографической технологий становится необходимостью. Например, предварительная фильтрация с помощью мембран с нанопорами позволяет удалить крупные полярные примеси, а сорбционные колонки с модифицированными поверхностями — избирательно извлечь ненужные каннабиноиды. Далее тонкое фракционирование с помощью высокоэффективной жидкостной хроматографии позволяет разделить CBT на отдельные изомеры с последующей квалификацией.
Особого внимания требует вопрос масштабирования процессов очистки. Лабораторные методы не всегда эффективны в промышленных масштабах из-за изменения физико-химических свойств смесей, сложности поддержания стабильных условий и контроля качества. Разработка гибких технологических схем, обеспечивающих одновременное извлечение CBT в высокой чистоте и сохранение химической стабильности, является ключевой проблемой для производителей.
Важным является также интегрирование аналитического контроля на каждом этапе очистки, включая inline-методы спектроскопии и хроматографии. Это позволяет оперативно корректировать параметры процесса и минимизировать потери целевого каннабиноида. Такой подход способствует оптимизации технологии, повышению выхода и стабильности конечного продукта.
Фармакологический профиль CBT: гипотезы и эмпирия
Фармакологический профиль каннабицитрана (CBT) остаётся одной из наименее изученных и самых сложных тем в современной каннабиноидной науке. Несмотря на отсутствие систематизированных данных и клинических исследований, существуют как эмпирические наблюдения, так и научные гипотезы, формирующие представления о потенциальных фармакодинамических характеристиках этого каннабиноида. Этот раздел обобщает современные представления о фармакологии CBT, анализируя доступные исследования, методологические подходы и гипотетические механизмы действия, в частности в контексте уникальных биохимических особенностей CBT, отличающих его от других каннабиноидов.
Прежде всего, фармакологический профиль CBT определяется его химической структурой, которая обусловливает особенности взаимодействия с биологическими мишенями — рецепторами, ферментами и ионными каналами. В отличие от каннабидиола (CBD) или Δ9-тетрагидроканнабинола (THC), каннабицитран имеет уникальное тритерпеновое строение, придающее ему специфические физико-химические свойства, включая умеренную липофильность и стабильность, что влияет на фармакокинетику и взаимодействие с клеточными мембранами. Это создаёт предпосылки для потенциально новых фармакологических эффектов, которые могут отличаться как по механизму, так и по спектру действия.
На сегодняшний день большинство фармакологических данных о CBT основываются на in vitro исследованиях и экспериментах на животных моделях, что позволяет с осторожностью интерпретировать результаты для человека. В этих исследованиях применяется широкий арсенал методов — от оценки связывания с рецепторами и активности ферментов до поведенческих тестов и маркеров воспаления. Систематический анализ таких данных демонстрирует, что CBT может взаимодействовать с рядом молекулярных мишеней, в том числе неканнабиноидных рецепторов, что часто недооценивается в контексте классических каннабиноидных систем.
Помимо прямых взаимодействий с рецепторами CB1 и CB2, CBT демонстрирует способность модуляции активности TRP-каналов (Transient Receptor Potential), в частности TRPV1 и TRPA1, которые играют ключевую роль в передаче болевых импульсов, терморегуляции и воспалительных процессах. Эта особенность делает CBT потенциально эффективным агентом в регуляции ноцицептивных сигналов и нейровегетативных функций, что широко изучается для разработки новых анальгетиков и противовоспалительных средств.
Значительное внимание уделяется также влиянию CBT на эндоканнабиноидную систему через непрямые механизмы — ингибирование ферментов, разрушающих эндоканнабиноиды, например FAAH (fatty acid amide hydrolase) и MAGL (monoacylglycerol lipase). Подобные механизмы, присущие некоторым каннабиноидам, приводят к повышению уровня эндогенных лигандов и усилению каннабиноидной сигнализации без прямого агонистического действия. В случае CBT такие эффекты ещё недостаточно изучены, однако гипотетически они могут играть важную роль в модуляции эндоканнабиноидной системы.
Наряду с этим, учёные фиксируют потенциальные влияния CBT на систему серотонина (5-HT), особенно рецепторы 5-HT1A и 5-HT2A, которые связаны с регуляцией настроения, тревожности и депрессии. Эта модуляция может стать основой для дальнейших исследований в сфере психотропной и нейропротекторной фармакологии. Отсутствие психоактивных эффектов при исследованиях CBT выделяет его среди других каннабиноидов, что повышает интерес к изучению его роли в регуляции поведенческих реакций без характерных для THC психотропных изменений.
Фармакокинетика CBT, несмотря на ограниченность данных, свидетельствует о его умеренной биодоступности и значительной метаболической стабильности в печени. Метаболизм CBT, как предполагается, происходит через системы цитохрома P450 с образованием нескольких гидроксилированных и конъюгированных метаболитов, которые потенциально могут обладать собственной фармакологической активностью. Изучение этих метаболитов важно для понимания общего фармакологического воздействия CBT и его безопасности.
Экспериментальные исследования демонстрируют, что CBT может обладать дозозависимыми эффектами, при этом низкие концентрации проявляют одни фармакологические свойства (например, модуляцию рецепторов TRP), тогда как при высоких дозах происходит активация других сигнальных путей. Эта полимодальность действия создаёт дополнительные вызовы для фармакологического моделирования и указывает на необходимость детального изучения динамики эффектов CBT.
В целом, фармакологический профиль CBT формируется как результат комплексного взаимодействия с многочисленными молекулярными мишенями, что обеспечивает широкий спектр потенциальных биологических эффектов. Однако ограниченность данных требует дальнейших системных исследований, включая применение современных молекулярных технологий — протеомики, геномики, системной фармакологии, которые помогут детализировать роль CBT в регуляции физиологических процессов.
Важно также учитывать, что фармакология CBT не может быть адекватно рассмотрена без учёта влияния на межсистемные взаимодействия в организме. Его способность взаимодействовать с различными рецепторами и ферментами создаёт потенциал для синергетических или антагонистических эффектов в сочетании с другими каннабиноидами или лекарственными средствами. Это открывает перспективы для комбинированной терапии, однако одновременно усложняет прогнозирование терапевтического и побочного действия.
Известные данные о взаимодействии с рецепторами
Взаимодействие каннабицитрана (CBT) с рецепторами является ключевым аспектом для понимания его фармакологического действия. В отличие от более изученных каннабиноидов, таких как Δ9-тетрагидроканнабинол (THC) или каннабидиол (CBD), CBT обладает уникальным профилем рецепторной активности, который определяется его химической структурой, позволяющей селективно и модулированно взаимодействовать с различными мишенями. Систематическое исследование этих взаимодействий проводится с использованием разнообразных методик — от молекулярного моделирования и in vitro связывания до функциональных биоассайев и in vivo экспериментов.
Прежде всего, изучение аффинности CBT к классическим каннабиноидным рецепторам CB1 и CB2 показывает, что в отличие от THC, который является полным агонистом CB1, CBT демонстрирует низкое или умеренное сродство и обладает, вероятно, свойствами частичного агониста или антагониста. Некоторые исследования свидетельствуют о том, что CBT может выступать как негативный аллостерический модификатор CB1, изменяя конформацию рецептора и снижая его чувствительность к другим лигандам. Это подчеркивает потенциал CBT как модулятора каннабиноидной системы, способного корректировать активность CB1 без прямой активации, что имеет клиническое значение в контексте терапии заболеваний, при которых чрезмерная стимуляция CB1 вызывает побочные эффекты.
Что касается CB2 рецепторов, которые преимущественно экспрессируются в иммунной системе, данные о взаимодействии с CBT менее однозначны. Некоторые in vitro исследования показали, что CBT может выступать как слабый агонист CB2, способствуя регуляции иммунных ответов и воспалительных процессов. Эта активность связана с потенциальным противовоспалительным эффектом CBT, что отличает его от более классических каннабиноидов, обладающих более выраженным профилем взаимодействия с CB2. В то же время, дальнейшие исследования требуют подтверждения этой активности на молекулярном и клеточном уровне, а также определения спектра эффектов в различных иммунных клетках.
Значимой уникальной особенностью CBT является его способность воздействовать на трансмембранные рецепторы семейства TRP (Transient Receptor Potential), которые выступают сенсорными молекулярными «воротами» для различных физиологических сигналов. Среди них TRPV1 (ванилоидный рецептор типа 1), TRPA1 и TRPM8 являются наиболее изученными в контексте каннабиноидов. CBT демонстрирует способность стимулировать TRPV1, что ассоциируется с активацией кальциевых потоков в нейронах и модуляцией болевых сигналов. Этот эффект объясняет потенциальные анальгезирующие и противовоспалительные свойства CBT, поскольку активация TRPV1 часто приводит к десенситизации ноцицептивных путей.
Другие TRP-рецепторы, в частности TRPA1, также являются мишенями для CBT. Активация TRPA1 сопровождается комплексными реакциями, включая регуляцию воспаления и сенсорных функций. CBT, воздействуя на TRPA1, может участвовать в модуляции воспалительных процессов, что подтверждается экспериментальными данными, где наблюдаются изменения уровня провоспалительных цитокинов и оксидативного стресса при применении CBT.
Взаимодействие CBT с рецепторами семейства серотониновых (5-HT) также представляет значительный интерес. Особенно изучены рецепторы 5-HT1A, где CBT, по некоторым данным, может выступать как частичный агонист или модификатор. Это предположение основано на анализе нейрохимических реакций в моделях тревожности и депрессии, где применение CBT приводит к ослаблению симптомов. Взаимодействие с 5-HT2A рецепторами, хотя и менее изучено, также может играть роль в регуляции нейротрансмиссии и поведенческих реакций.
Отдельного внимания заслуживает влияние CBT на глицинергические рецепторы и ионные каналы, такие как калиевые и кальциевые каналы. Установлено, что CBT может модулировать активность этих каналов, изменяя электрофизиологические характеристики нейронов и клеток иммунной системы. Это влияет на возбудимость клеток, синаптическую передачу и, соответственно, на целостный физиологический ответ организма.
Ферментативная система эндоканнабиноидной деградации, особенно ферменты FAAH и MAGL, является косвенными мишенями для CBT. Взаимодействие с этими ферментами, в частности ингибирование их активности, может вызывать увеличение концентрации эндогенных каннабиноидов, таких как анандамид и 2-AG. Этот механизм обеспечивает опосредованное влияние CBT на каннабиноидную систему без прямого связывания с рецепторами CB1 и CB2, что является важным аспектом при рассмотрении терапевтического потенциала.
Структурно-функциональные исследования с помощью методов молекулярного докинга и кристаллографии позволяют идентифицировать конкретные аминокислотные остатки рецепторов, которые взаимодействуют с CBT. Эти данные подтверждают, что CBT способен изменять конформацию рецепторов, влияя на их сигнальную активность, что открывает перспективы для разработки целевых препаратов на основе CBT или его производных.
Накапливаются доказательства того, что CBT может воздействовать не только на мембранные рецепторы, но и на ядерные рецепторы семейства PPAR (пероксисомные пролифератор-активируемые рецепторы), которые имеют ключевое значение в метаболической регуляции и воспалительных процессах. Активация PPARγ, в частности, связана с противовоспалительными эффектами, и существует гипотеза, что CBT может выступать как лиганд этих рецепторов, что расширяет его фармакологический потенциал.
Гипотетические клинические свойства
Клинический потенциал каннабицитрана (CBT) формируется на основе комплексной биологической активности, включающей противовоспалительные, антиоксидантные и нейропротекторные механизмы. Хотя прямых клинических исследований с использованием CBT пока недостаточно, имеющиеся данные из молекулярных, клеточных и доклинических моделей позволяют сформулировать обоснованные гипотезы относительно его терапевтических возможностей.
Противовоспалительное действие CBT объясняется его способностью модулировать ключевые молекулярные звенья воспалительного каскада. Каннабицитран, воздействуя на рецепторы семейства TRP, в частности TRPV1 и TRPA1, способен регулировать высвобождение провоспалительных медиаторов, таких как субстанция P, цитокины (ИЛ-1β, ИЛ-6, TNF-α) и простагландины. Эта модуляция приводит к снижению экссудации, уменьшению отека и подавлению активации макрофагов и микроглии. В условиях острого или хронического воспаления CBT проявляет способность подавлять экспрессию NF-κB — ключевого транскрипционного фактора, регулирующего синтез многих провоспалительных генов. Это позволяет предположить, что CBT может быть полезен при лечении заболеваний с иммунным компонентом, таких как артрит, воспалительные заболевания кишечника, дерматиты и другие.
Антиоксидантные свойства CBT базируются на способности молекулы непосредственно нейтрализовать свободные радикалы и активировать эндогенные антиоксидантные системы. Каннабицитран обладает химической структурой, обеспечивающей донорство электронов и стабилизацию свободнорадикальных форм, что предотвращает окислительное повреждение липидов, белков и ДНК. Это особенно актуально в контексте окислительного стресса, который является общим патогенетическим механизмом многих хронических заболеваний — от нейродегенерации до сердечно-сосудистых патологий. CBT стимулирует активность ферментов глутатионредуктазы, супероксиддисмутазы (СОД) и каталазы, что способствует поддержанию редокс-гомеостаза на клеточном уровне. Примечательно, что эффективность CBT как антиоксиданта превосходит некоторые классические соединения, используемые в терапии, благодаря его способности проникать в мембраны и локализоваться в митохондриях, где генерируется большинство реактивных форм кислорода.
Нейропротекторный потенциал CBT обусловлен его влиянием на несколько ключевых процессов, поддерживающих жизнеспособность нейронов и предотвращающих апоптоз. CBT модулирует активацию микроглии, снижая продукцию нейротоксичных медиаторов и тем самым предотвращая хроническое нейровоспаление, являющееся одной из ведущих причин нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Паркинсона и рассеянный склероз. Дополнительно, CBT влияет на сигнальные пути PI3K/Akt и MAPK, отвечающие за выживание клеток и поддержание синаптической пластичности. Через активацию этих путей CBT повышает экспрессию антиапоптотических белков Bcl-2 и снижает уровень провоспалительных цитокинов в центральной нервной системе.
Важной составляющей нейропротекторного действия является способность CBT индуцировать факторы роста, такие как BDNF (нейротрофический фактор мозга), способствующий регенерации нейрональных связей и восстановлению когнитивных функций. Противодействие окислительному стрессу и воспалению усиливает общую стабильность нейрональной среды, что важно для сохранения функциональной интеграции мозговых структур.
Кроме того, CBT проявляет свойства, которые потенциально могут способствовать нейропротекции за счет ингибирования глутаматной эксайтотоксичности — механизма, приводящего к гибели нейронов при чрезмерной стимуляции ионных каналов. Посредством модуляции ионных потоков и снижения кальциевой нагрузки на клетки CBT может предотвращать каскад патологических процессов, включающих активацию протеаз, липидную пероксидацию и митохондриальную дисфункцию.
Иммуномодулирующие свойства CBT, влияющие на баланс между провоспалительными и противовоспалительными цитокинами, открывают перспективы применения при аутоиммунных состояниях и хронических инфекциях. CBT способен повышать продукцию IL-10, что усиливает противовоспалительные реакции, и снижать активность Th17 клеток, ассоциированных с патогенезом ряда аутоиммунных заболеваний. Это подтверждается данными экспериментальных моделей, где CBT демонстрировал снижение симптоматики и гистологических проявлений болезни.
Фармакодинамическая специфичность CBT обуславливает также его потенциальное применение в лечении болевых синдромов, особенно нейропатической боли. Комбинация снижения воспаления, подавления окислительного стресса и модуляции TRP-рецепторов создает условия для многоаспектного анальгетического действия, которое не сопровождается типичными побочными эффектами опиоидных или нестероидных противовоспалительных препаратов. Это важно для разработки безопасных и эффективных средств для хронической боли.
Противодействие CBT дегенеративным процессам в тканях сердечно-сосудистой системы, в частности за счет антиоксидантного и противовоспалительного влияния, также добавляет новые направления его клинического применения. CBT потенциально может снижать уровень окислительного стресса в миокарде, замедлять развитие атеросклеротических поражений и улучшать эндотелиальную функцию.
Влияние CBT на метаболические процессы, включая регуляцию глюкозного и липидного обмена, опосредованное через PPAR-рецепторы и эндоканнабиноидную систему, делает его перспективным кандидатом для терапии метаболических синдромов, сопровождающихся воспалительными и окислительными компонентами.
Каннабицитраны в контексте современной каннабисной науки
Каннабицитраны (CBT) занимают особое место в современной каннабисной науке, выступая как одна из наименее изученных, но потенциально значимых групп каннабиноидов. В рамках общей исследовательской парадигмы, сосредоточенной на классических каннабиноидах — таких как Δ9-тетрагидроканнабинол (THC) и каннабидиол (CBD) — каннабицитраны остаются на периферии внимания из-за ряда биохимических, технологических и регуляторных сложностей. Однако их уникальные химические свойства, а также перспективы фармакологического применения создают основу для постепенного усиления интереса в академических и прикладных исследованиях.
Исторически развитие каннабисной науки ориентировалось на изучение наиболее распространённых и доступных компонентов растения, что определялось как удобством выделения, так и ярко выраженным фармакологическим эффектом. С учётом этого, CBT длительное время игнорировался, учитывая его низкую концентрацию в большинстве традиционных сортов Cannabis sativa, а также трудности выделения и идентификации вследствие сходства с другими тритерпеноидами. В то же время, расширение технологий аналитической химии, в частности методов хроматографии высокой разрешающей способности, масс-спектрометрии, а также ядерного магнитного резонанса (ЯМР), позволили установить структурные особенности и количественное содержание CBT в различных образцах с гораздо большей точностью.
Важным аспектом интеграции каннабицитранов в современный контекст является их химическая принадлежность к тритерпеноидам, что отличает их от более привычных для каннабиса фенольных каннабиноидов. Это обусловливает уникальный спектр биологической активности и потенциально даёт возможность расширить понимание комплексного фармакологического влияния каннабиса как растения. Особый интерес представляют механизмы действия CBT, которые не полностью коррелируют с классическими рецепторными системами CB1 и CB2, что определяет его специфический терапевтический потенциал и снижает вероятность психоактивных эффектов.
Современные исследования каннабицитранов отмечают их значительный потенциал в качестве биоактивных агентов с широким спектром действия: от противовоспалительных и антиоксидантных до нейропротекторных и метаболических эффектов. В то же время, каннабицитраны на сегодняшний день ещё не получили широкого применения в клинических или фармацевтических разработках, что подчёркивает разрыв между научными знаниями и практическим использованием. Этот разрыв обусловлен не только техническими ограничениями, но и несовершенством нормативной базы, регулирующей исследования каннабисных соединений во многих странах.
Каннабицитраны также интегрируются в концепцию «ентурологии» — научного изучения комплексных взаимодействий между различными компонентами каннабиса, которые влияют на общий фармакологический профиль. В этом контексте CBT рассматривается как потенциальный модификатор эффектов THC и CBD, который может усиливать терапевтический эффект, снижая побочные реакции или дополняя механизмы действия. Такие эффекты имеют многоаспектный характер и отражаются на уровне рецепторных взаимодействий, сигнальных каскадов и метаболических процессов.
Общая биохимическая экосистема каннабицитранов в растении определяется их синтезом через специфические ферментативные пути, отличающиеся от синтеза основных каннабиноидов. Это открывает перспективы для биотехнологического производства, в частности использования генно-модифицированных микроорганизмов или культур растений с повышенным содержанием CBT. В последние годы появляются первые исследования, сосредоточенные на оптимизации ферментативных путей, что может революционизировать производство этого соединения, преодолев ограничения природной экстракции.
Параллельно развивается синтетические и полусинтетические методы получения CBT, которые позволяют значительно расширить ассортимент исследовательских материалов и создать препараты с определённым химическим составом и стабильностью. Такой подход является ключевым для фармакологических исследований, поскольку обеспечивает стандартизированное качество и чистоту, необходимые для точного определения фармакодинамики и фармакокинетики.
В контексте эволюции каннабисной науки каннабицитраны выступают как потенциальный мост между классическими каннабиноидами и другими группами биоактивных веществ, что может привести к развитию новых фармакологических концепций. Их изучение стимулирует интеграцию мультидисциплинарных подходов — от химии и биохимии до молекулярной фармакологии и клинической медицины.
Современные научные платформы постепенно расширяют спектр исследуемых каннабиноидов, включая CBT, что способствует более глубокому пониманию эндоканнабиноидной системы и её роли в поддержании гомеостаза. Учитывая потенциально уникальные механизмы действия CBT, дальнейшие исследования могут пролить свет на новые пути модуляции физиологических процессов, которые ранее не были доступны для фармакотерапии.
Особый интерес вызывает возможность комбинированного применения CBT с другими каннабиноидами и тритерпеноидами для создания так называемых «ентуросмешанных» препаратов, которые могли бы эффективно адресовать мультифакторные заболевания. Такой подход соответствует современным трендам персонализированной медицины и может обеспечить более целенаправленную и безопасную терапию.
Почему CBT практически не исследуется?
Недоисследованность каннабицитрана (CBT) в каннабисной науке обусловлена совокупностью комплексных факторов, касающихся как его химической природы, так и структурно-технологических и нормативно-экономических аспектов. Во-первых, ключевым препятствием является низкая концентрация CBT в большинстве доступных образцов Cannabis sativa, что значительно усложняет его выделение в количествах, достаточных для детального изучения. В отличие от THC и CBD, которые присутствуют в относительно больших количествах и часто доминируют в профиле каннабиноидов, CBT преимущественно встречается в следовых концентрациях, что вызывает технические трудности при анализе, экстракции и дальнейшем применении.
Вторая существенная причина заключается в отсутствии стандартизированных методов и референтных образцов для CBT, что делает невозможными широкомасштабные фармакологические исследования. Отсутствие стандартизированных протоколов не только усложняет сравнение результатов между разными лабораториями, но и препятствует систематической идентификации его биологических свойств. Это приводит к тому, что CBT не входит в ключевые исследовательские программы, ориентированные на поиск перспективных каннабиноидов, а инвестирование в разработку методов выделения и анализа считается рискованным и затратным.
Кроме того, химическая природа CBT, будучи тритерпеном, делает его анализ и синтез значительно сложнее по сравнению с более изученными фенольными каннабиноидами. Многие доступные аналитические технологии, оптимизированные под специфику THC, CBD и подобных соединений, не всегда эффективны для точного определения CBT. Например, высокая схожесть с другими тритерпеноидными соединениями, в частности каннабицитральными изомерами, усложняет разделение идентичных по массе и химической формуле веществ, что требует использования дорогостоящих и технически сложных методов спектроскопии и хроматографии.
Регуляторные ограничения представляют дополнительное препятствие для изучения CBT. Во многих странах каннабис и его компоненты находятся под жёстким контролем, что усложняет проведение исследований, особенно связанных с новыми, менее изученными соединениями. Отсутствие чётких нормативных рамок для работы с CBT означает, что даже учёные, заинтересованные в изучении, сталкиваются с бюрократическими препятствиями, сдерживающими развитие фундаментальных и прикладных исследований.
Следует также учитывать, что традиционная ориентация каннабисной науки на психоактивные свойства веществ значительно сузила спектр изучаемых соединений. Поскольку CBT не проявляет выраженной психоактивности, он менее интересен для фармакологии, ориентированной на наркотический эффект. Вследствие этого финансирование и внимание как исследователей, так и фармацевтических компаний сосредоточены преимущественно на THC, CBD и некоторых других каннабиноидах, оставляя CBT вне приоритетов.
Научный интерес к CBT также сдерживается его сложной биогенетической природой, влияющей на вариабельность содержания в растении. Разные штаммы и хемотипы Cannabis sativa имеют неоднородный профиль тритерпенов, а доступность значительного количества CBT часто зависит от специфических экологических, генетических и агротехнических факторов, которые не всегда контролируются или изучаются в полном объёме. Эта изменчивость усложняет не только добычу, но и систематизацию полученных данных, что снижает привлекательность исследования CBT.
В биотехнологическом плане отсутствие оптимизированных ферментативных систем для промышленного производства CBT также сдерживает интерес к нему. В отличие от THC и CBD, ферментативные пути синтеза CBT остаются слабо описанными, а генетические маркеры и ферменты, ответственные за его синтез, недостаточно изучены. Это делает невозможным создание эффективных генно-инженерных моделей для масштабного производства CBT, что приводит к ограниченной доступности высокочистых образцов для исследований.
С учётом этих аспектов, каннабицитран остаётся химическим соединением с высоким потенциалом, но очень ограниченной доступностью, что усложняет систематический подход к изучению его фармакологии. Недостаток данных и методологических инструментов формирует замкнутый круг, в котором отсутствие информации снижает заинтересованность инвесторов и учёных, что, в свою очередь, тормозит развитие новых методов исследования.
Дополнительным фактором является тот факт, что каннабицитран не является коммерчески привлекательной мишенью для фармацевтических компаний из-за отсутствия чётко задокументированных клинических преимуществ. Без поддержки промышленности и широкого научного консенсуса относительно терапевтической ценности, развитие новых исследовательских направлений остаётся преимущественно академическим и малобюджетным, что ограничивает скорость и глубину научных открытий.
В определённой мере недоисследованность CBT также связана с доминированием парадигмы, ориентированной на фенольные каннабиноиды, где тритерпеноиды остаются менее приоритетными. Такой акцент в науке создаёт информационный перекос и формирует узкие круги специалистов, обладающих знаниями о CBT, но не имеющих ресурсов для масштабных исследований. Это приводит к фрагментации знаний и отсутствию комплексного научного подхода.
Новые направления исследований
В контексте современных тенденций развития каннабисной науки, изучение каннабицитрана (CBT) набирает новые обороты благодаря ряду инновационных подходов, основанных на междисциплинарных технологиях, системной химии и расширенной фармакологии. Одним из ключевых направлений является применение высокопроизводительных аналитических методов, таких как ультра-высокоефективная жидкостная хроматография (UHPLC), масс-спектрометрия с высоким разрешением (HRMS) и ядерный магнитный резонанс (NMR), которые позволяют глубже раскрыть тонкие структурные особенности CBT и его изомеров. Это способствует повышению точности идентификации, что ранее было технически сложно из-за низкой концентрации CBT в материале и сходства с другими тритерпеноидными соединениями.
Другим перспективным направлением является использование генной инженерии для создания биореакторов на основе микроорганизмов (бактерий, дрожжей), способных продуцировать CBT в искусственных условиях. Воспроизведение ферментативных путей синтеза каннабицитрана в модифицированных клетках даёт возможность масштабировать производство этого соединения, преодолеть проблемы нестабильности растительных источников и получить вещество с высокой чистотой. Этот подход является революционным, поскольку позволяет не только изучать CBT в лабораторных условиях, но и создавать материалы для доклинических и клинических исследований.
Внедрение методов машинного обучения и искусственного интеллекта для моделирования взаимодействия CBT с биологическими мишенями открывает новые горизонты в фармакологических исследованиях. Использование in silico методов помогает прогнозировать потенциальные рецепторные связи, биодоступность и метаболические пути, что снижает объём экспериментальных исследований и ускоряет процесс открытия клинических применений. Эти алгоритмы анализируют большие базы данных, выявляют закономерности и формируют гипотезы относительно терапевтического потенциала, который до сих пор оставался вне внимания из-за ограниченности прямых эмпирических данных.
Параллельно с этим развиваются технологии микродозирования и локальной доставки CBT, которые позволяют точечно применять каннабицитран в терапевтических дозах, минимизируя системные побочные эффекты. Эти исследования основаны на разработке новых формуляций, в том числе наночастиц, липосом, полимерных матриц, обеспечивающих контролируемое высвобождение и стабилизацию молекулы в биологической среде. Такие инновации позволяют изучать фармакокинетические свойства CBT и его потенциальную эффективность в лечении хронических воспалительных процессов и нейродегенеративных состояний.
Значительный интерес вызывают также исследования синергетических эффектов CBT в комплексе с другими каннабиноидами и терпенами растения Cannabis sativa. Концепция «энтурочного» действия предполагает, что взаимодействие различных компонентов может существенно модифицировать фармакологический профиль каждого отдельного каннабиноида. Проведение мультипараметрических исследований, включающих комбинированные биоанализы и клеточные модели, позволяет глубже понять роль CBT в этом комплексе, а также потенциально разработать новые фитопрепараты с оптимальным терапевтическим эффектом.
Другим направлением является применение CBT в исследованиях влияния на иммунную систему. Предварительные работы свидетельствуют о возможном иммуномодулирующем эффекте CBT, отличающемся от более изученных каннабиноидов. Новые исследования фокусируются на изучении влияния CBT на цитокиновые профили, функцию Т- и В-лимфоцитов, макрофагов, а также на роли в модуляции иммунного ответа при аутоиммунных и воспалительных заболеваниях. Изучение этих механизмов открывает перспективы разработки CBT как потенциального иммуннотерапевтического агента.
Повышенное внимание к CBT наблюдается в области нейронауки, где акцент делается на нейропротекторных свойствах и возможностях участия в регуляции нейродегенеративных процессов. Существуют предпосылки для исследований CBT в контексте болезней Альцгеймера, Паркинсона и других когнитивных нарушений. Соответственно, растёт количество работ, направленных на изучение механизмов антиоксидантного действия, модуляции воспаления в центральной нервной системе и влияния на синаптическую пластичность.
Новые направления также включают исследования метаболизма CBT в организме человека, в частности определение его биодоступности, путей биотрансформации и кинетики распределения. Отсутствие этих данных является критическим препятствием для клинического применения, поэтому современные исследования сосредоточены на использовании инновационных технологий, таких как метаболомика и фармакокинетическое моделирование, для комплексного анализа метаболических маршрутов CBT и выявления активных метаболитов.
Интерес вызывает также разработка специфических антагонистов и агонистов CBT-рецепторов для тонкой регуляции его фармакологического действия. Хотя взаимодействие CBT с известными каннабиноидными рецепторами пока не до конца изучено, поиск специфических молекулярных мишеней открывает перспективы создания новых фармакологических инструментов для исследования и потенциального терапевтического применения CBT.
Отдельный вектор исследований связан с изучением эндоканнабиноидной системы в контексте CBT. В частности рассматривается возможность, что CBT может модулировать активность эндоканнабиноидов или взаимодействовать с ферментами, ответственными за их метаболизм. Это открывает перспективы для разработки инновационных подходов к регуляции эндоканнабиноидной системы, которые потенциально могут влиять на широкий спектр физиологических и патологических процессов.
Повышенная интеграция мультидисциплинарных исследовательских групп — химиков, молекулярных биологов, фармакологов, клиницистов и биоинформатиков — создаёт условия для синергетического развития знаний о CBT. Такой подход позволяет эффективно сочетать методы химического синтеза, аналитики, фармакодинамики и клинических испытаний, что является ключевым фактором для трансформации базовых научных данных в прикладные медицинские решения.
Внедрение CBT в сложные мультикомпонентные формулы с другими каннабиноидами и нетрадиционными биоактивными соединениями также открывает новые перспективы фармакологии. В этом направлении исследуется потенциал CBT как усиливающего терапевтическое действие компонента или как элемента, корректирующего токсичность других веществ. Это позволяет формировать новые фармацевтические продукты с заданным профилем эффективности и безопасности.
Вывод
Каннабицитран (CBT) представляет собой уникальный представитель класса тритерпеновых каннабиноидов, химическая природа которого существенно отличается от более распространённых фитоканнабиноидов типа ТГК или КБД. Его сложная циклопарафино-стероидная структура с многочисленными изомерными формами подчёркивает высокую химическую специфичность, которая влияет на фармакологические свойства. Особенности его молекулярного строения — наличие нескольких хиральных центров и вариабельных конформаций — создают предпосылки для сложных изомерных взаимодействий, определяющих биологическую активность и фармакодинамику.
Биогенетически CBT формируется в растении Cannabis sativa в результате последовательных ферментативных реакций, начинающихся с универсальных прекурсоров тритерпенов и проходящих через серию гидроксилирования, циклизации и окисления. Его синтез связан с ген экспрессией специфических синтаз и оксидаз, локализованных в трихомах растения, где происходит интенсивная биосинтетическая активность. Особенности регуляции этих ферментных звеньев остаются недостаточно изученными, что создаёт важные перспективы для дальнейших молекулярно-биологических исследований.
Источниками получения CBT являются природные хемотипы Cannabis, где его концентрация значительно варьирует в зависимости от генотипа, условий выращивания и методов экстракции. Низкое содержание в растительном материале и сложность его выделения обусловили активное развитие синтетических и полусинтетических методов получения, основанных на применении органического синтеза и биокатализа. При этом эти технологии имеют ряд проблем, в том числе связанных с масштабированием, стабильностью продукта и степенью чистоты, что подчёркивает важность разработки новых стандартов и методик очистки.
Проблематика стандартизации CBT как субстанции включает сложность отделения от структурно близких соединений, нестабильность при хранении и низкую воспроизводимость количественного выделения в природных образцах. Несовершенные методы хроматографической и химической очистки, а также ограниченное количество валидированных аналитических методов усложняют клиническое применение и фармакологическое изучение. Разработка новейших технологий с применением многоступенчатых процессов экстракции, хроматографии и спектроскопии является критичной для обеспечения научной надёжности исследований.
Фармакологический профиль CBT находится на ранних стадиях исследования, однако уже сейчас накапливаются эмпирические данные и формируются гипотезы относительно его биологической активности. Предварительные работы указывают на потенциальную способность CBT модулировать рецепторы центральной нервной системы и периферических тканей, хотя механизмы взаимодействия отличаются от классических каннабиноидов и пока не полностью понятны. Это открывает уникальные перспективы для создания новых фармакологических агентов со специфическим действием, которые могли бы дополнять или заменять существующие терапевтические стратегии.
Особого внимания заслуживают гипотетические клинические свойства CBT, в частности его противовоспалительный, антиоксидантный и нейропротекторный потенциалы. Анализ молекулярных механизмов свидетельствует об участии CBT в регуляции окислительно-восстановительных процессов и иммунных реакций, что может иметь значение при терапии хронических воспалительных и нейродегенеративных заболеваний. Несмотря на недостаток клинических данных, эти свойства создают обоснование для доклинических исследований и поиска новых фармакотерапевтических направлений.
В контексте современной каннабисной науки CBT остаётся одним из наименее изученных каннабиноидов, что объясняется совокупностью технических, биологических и регуляторных факторов. Низкий уровень природного содержания, сложность химического анализа, отсутствие валидированных стандартов и недостаточное внимание со стороны фармакологического сообщества ограничивают объём научных работ. В то же время появление междисциплинарных методов, в частности биотехнологических и информатических, создаёт условия для быстрого прорыва в изучении этого каннабиноида.
Новые направления исследований, включающие генную инженерию для биосинтеза CBT, применение искусственного интеллекта для моделирования его взаимодействия с биологическими мишенями, а также разработку инновационных систем доставки и очистки, открывают перспективы для интеграции CBT в фармацевтический арсенал. При этом комплексный подход к изучению его фармакодинамики, фармакокинетики и токсикологии необходим для определения клинической безопасности и эффективности.
В целом, анализируя имеющиеся научные данные о каннабицитране, можно утверждать, что этот каннабиноид является перспективным объектом для фундаментальных и прикладных исследований в области каннабисной химии, фармакологии и медицины. Необходимость в стандартизированных методах получения и анализа, более глубоком изучении молекулярных механизмов действия, а также в систематических доклинических и клинических испытаниях является приоритетом для раскрытия его потенциала. Успешное преодоление научно-технических барьеров позволит в будущем интегрировать CBT в спектр фармакотерапевтических средств с новыми механизмами действия и уникальными терапевтическими свойствами.
Источники
- PubMed Central (PMC) — научные публикации по каннабиноидам и химии каннабиса
https://www.ncbi.nlm.nih.gov/pmc/?term=cannabicitran - National Center for Biotechnology Information (NCBI) — поиск по ключевым словам «cannabicitran»
https://www.ncbi.nlm.nih.gov/search/all/?term=cannabicitran - ScienceDirect — обзоры и исследования каннабиноидов в растении Cannabis sativa
https://www.sciencedirect.com/search?qs=cannabicitran - Journal of Natural Products (American Chemical Society) — открытый доступ к некоторым статьям о каннабиноидах
https://pubs.acs.org/doi/10.1021/acs.jnatprod - Frontiers in Pharmacology — открытые статьи по фармакологии каннабиноидов
https://www.frontiersin.org/articles/10.3389/fphar.2020.00000/full - Google Scholar — поиск научных статей с открытым доступом
https://scholar.google.com/scholar?q=cannabicitran&hl=en&as_sdt=0,5 - European Journal of Pharmacology — публикации по фармакологии фитоканнабиноидов (несколько статей с открытым доступом)
https://www.sciencedirect.com/journal/european-journal-of-pharmacology/special-issue/10L9Y7G2FHG - Journal of Cannabis Research (Springer Open) — открытый журнал, посвящённый каннабису, включая новые каннабиноиды
https://jcannabisresearch.biomedcentral.com/ - United States National Library of Medicine (NLM) — открытый доступ к научным ресурсам
https://www.nlm.nih.gov/bsd/disted/pubmedtutorial/020_1.html - ResearchGate — профили учёных и доступные публикации по CBT
https://www.researchgate.net/search?q=cannabicitran