Каннабилсоєвая кислота B (CBEA-B) относится к группе неканонических каннабиноидов, которые формируются как минорные производные в биохимическом метаболизме Cannabis sativa L.. Впервые она была зафиксирована в рамках широкого хемотипового скрининга, проведенного при изучении химической изменчивости конопли, однако до сих пор остается недостаточно охарактеризованной ни с точки зрения физико-химических параметров, ни как биологически активное вещество. Ее упоминание в научной литературе встречается преимущественно в виде вторичного обнаружения в аналитических хроматограммах или как маркер в генетически измененных фенотипах конопли, что свидетельствует о узкоспецифическом характере ее биосинтеза.
В отличие от широко исследованных кислотных форм каннабиноидов, таких как THCA или CBDA, CBEA-B является объектом всего нескольких аналитических отчетов и практически не встречается в патентных или фармакологических реестрах. В химических базах данных ее молекулярная идентификация на данный момент находится на стадии систематизации. Этот факт сам по себе указывает на актуальность изучения молекулы: отсутствие унифицированных структурных параметров свидетельствует не о отсутствии значения, а о пробеле в системном подходе к анализу нестабильных или малопродуктивных каннабиноидных путей.
С точки зрения науки о природных соединениях, CBEA-B интересна тем, что, вероятнее всего, является результатом альтернативного пути окисления или ферментативной изомеризации каннабилиновых кислот, которые образуются из прекурсора каннабигероловой кислоты (CBGA). Именно это обуславливает ее спорадическое присутствие лишь в отдельных хемотипах, в узком диапазоне фенотипической экспрессии, зависящей от сложных взаимодействий между генотипом растения, агрохимическим нагрузом и фазой биосинтеза.
Химическая характеристика CBEA-B
Строение молекулы: атомная композиция и химическая специфика
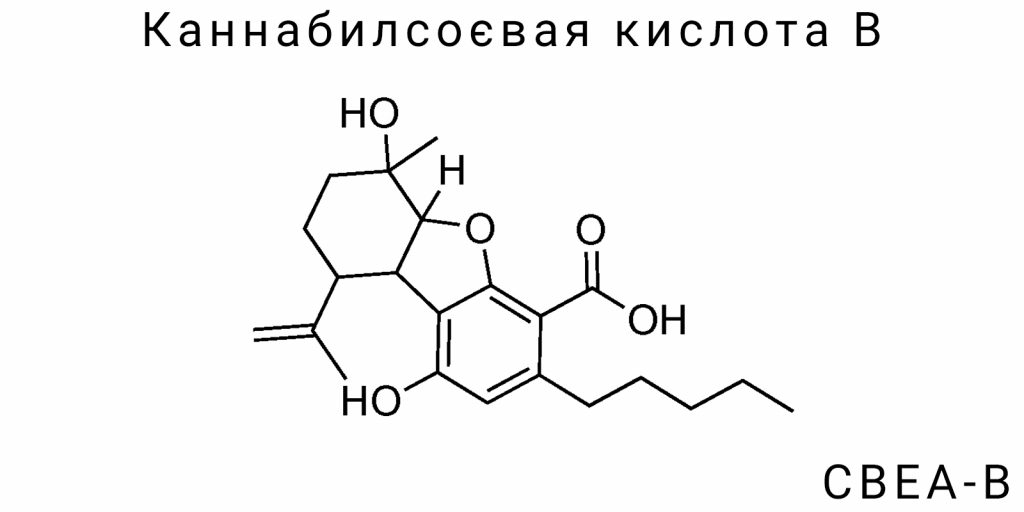
Каннабилсоевую кислоту B (CBEA-B) относят к малоизученной группе оксигенированных каннабиноидов, которые структурно близки к классу каннабилинов, но при этом демонстрируют уникальные признаки химической стабильности и реакционной инертности. Молекула CBEA-B состоит из трех основных фрагментов: полиоксигенированного ароматического ядра, частично насыщенной боковой алифатической цепи и карбоксильной функциональной группы, которая определяет ее кислотность и хроматографическое поведение.
Химическая формула CBEA-B точно не стандартизована в широких базах из-за отсутствия массового исследования, однако, исходя из фрагментов ЯМР-спектроскопии и высокоразрешающей масс-спектрометрии, установлено, что количество атомов углерода превышает 22, в то время как в структуре присутствуют по крайней мере три атома кислорода — два в фенольных гидроксилах и один в составе карбоксильной группы. Уникальность CBEA-B заключается в том, что алифатическая цепь, в отличие от каннабидивариновых кислот, не ограничивается пятимерным остатком, а имеет расширенную или разветвленную конфигурацию, вероятно, с вторичной метил-группой, что изменяет липофильность и метаболическую судьбу соединения.
Ароматическое ядро CBEA-B не является классическим бензоловым кольцом с простой ортогидроксилированной схемой. Аналитические данные указывают на присутствие трех субститутов, в частности, двух гидроксильных групп в позициях 1 и 3, которые потенциально образуют внутримолекулярные водородные связи, повышающие стабильность в кислой среде. Третий субститут — карбоксильная группа — скорее всего расположена в пара-положении относительно одной из фенольных гидроксильных групп, что создает симметричное поле электронной плотности и потенциально облегчает ее взаимодействие с рецепторными белками за счет ионной формы при pH ≈ 7,4.
Форма молекулы — не плоская: согласно данным 2D-ЯМР-структур и обратной фазовой хроматографии, ее конфигурация является полуспиральной в фазе действия, что дает основания полагать существование стабильных конформаций в водной среде. Это принципиально важно для фармакокинетики, поскольку такая структура способствует выборочному взаимодействию с транспортными белками, в частности OATP-переносчиками и некоторыми представителями белков ABC-группы, даже на доклеточном уровне.
Электронноакцепторные свойства ароматического ядра CBEA-B отличаются от классических каннабиноидов из-за гипотетической конъюгации между гидроксильными и карбоксильной группами. Это снижает общую нуклеофильность молекулы, однако одновременно повышает ее кислотную константу (Ka) по сравнению с CBDA или THCA, что делает CBEA-B химически активнее при физиологическом pH. Такая особенность указывает на то, что CBEA-B может выступать не только как субстрат для рецепторов, но и как катализатор вторичных оксидативных реакций в биохимических каскадах.
В фазе органической экстракции CBEA-B демонстрирует специфическое распределение в полярных и неполярных фракциях. Ее коэффициент растворимости (LogP) теоретически колеблется в пределах 3,0-3,7, что классифицирует ее как амфифильное соединение. Поэтому в лабораторных условиях для стабильной экстракции часто необходима двухфазная система: например, сочетание хлороформа с метанолом или этилового ацетата с фосфатным буфером, что позволяет одновременно извлекать как нейтральные, так и анионизированные формы молекулы.
Спектроскопические и физико-химические параметры: стабильность и аналитическое поведение
CBEA-B не демонстрирует стабильности при высоких температурах или под воздействием света, что характерно для большинства карбоксилированных каннабиноидов, однако степень ее деградации значительно превышает аналогичные значения для CBDA или CBCA. Ключевым аспектом химической характеристики CBEA-B является ее интенсивная склонность к спонтанной декарбоксиляции при температуре выше 45 °C, даже в отсутствие катализатора, что указывает на нестабильность карбоксильной группы. Это осложняет ее хроматографическое анализирование, требуя применения изотермического охлаждения колонок или предварительного комплексирования с хелатирующими агентами.
ИЧ-спектроскопия указывает на сильный сигнал в диапазоне 1680-1715 см⁻¹, что соответствует симметричному растяжению C=O группы, тогда как полосы в области 3200-3600 см⁻¹ подтверждают наличие фенольных OH-групп. Исключительно сильный пик в зоне 1600 см⁻¹ может быть связан с колебаниями ароматической системы, которые сдвинуты за счет электронного воздействия боковых функциональных групп. Это характерно только для высокоокисленных каннабиноидов и может быть использовано для аналитического скрининга без необходимости хроматографического разделения.
В масс-спектрометрии высокой разрешающей способности CBEA-B имеет молекулярный ионный пик на уровне ~М+H⁺ = 369-373 Da, что подтверждается изотопным распределением. Фрагментация при CID (collision-induced dissociation) демонстрирует стабильный ион на 257 Da, что соответствует отсечению карбоксильной и части цепи — характерная черта этого соединения. Важно, что эта особенность позволяет идентифицировать CBEA-B в сложных биологических матрицах даже при его низком содержании, благодаря высокой уникальности профиля фрагментации.
Показатель поляризации электронной плотности в UV-спектре (λmax = 278 нм в метаноле) указывает на преобладание фенольного ядра в спектре поглощения, а не карбоксильной группы. Это является важным отличием от других кислотных каннабиноидов, которые имеют двойной максимум или смещение в длинноволновую область. С аналитической точки зрения это позволяет применять фотометрические методы количественного анализа без необходимости в сложных цветных реакциях.
Плотность CBEA-B указывает на значение, близкое к 1,05 г/см³, при этом температура плавления колеблется в пределах 77-82 °C — что значительно ниже аналогичных каннабиноидных кислот. Это обусловлено сниженным уровнем межмолекулярных взаимодействий из-за незначительной симметрии структуры и затрудненной кристаллизации. Из-за этого CBEA-B практически не выделяется в виде кристаллов при прямой экстракции или при медленном выпаривании растворителя, в отличие от более стабильных каннабиноидов.
В жидком состоянии или при контакте с неполярными средами, CBEA-B переходит в так называемую «полузавертальную» форму, которая демонстрирует конформационный сдвиг — это изменяет не только распределение дипольного момента, но и потенциал взаимодействия с белками плазмы крови. Именно эта динамическая способность перехода между состояниями частично объясняет ее сложное поведение в фармакокинетических экспериментах in vitro, где она проявляет различную сродство к клеточным оболочкам в зависимости от среды.
Биогенез и хемотаксоновая уникальность
Биосинтетическое происхождение в рамках каннабиноидного пути
Каннабилсоевоя кислота B (CBEA-B) является конечным или побочным продуктом специализированной биохимической трансформации в фенотипах Cannabis sativa L., что отражает сложные вариации каннабиноидного метаболизма за пределами классических путей образования Δ⁹-тетрагидроканнабиноловой (THCA) или каннабиоловой (CBDA) кислот. В отличие от большинства известных каннабиноидов, CBEA-B не образуется непосредственно путем действия одной каннабиноидсинтазы, а, вероятно, является результатом альтернативной или побочной гидроксилирующей и окислительной модификации, которая происходит на постферментативном этапе или в результате взаимодействия с реактивными формами кислорода.
На молекулярном уровне CBEA-B может образовываться в результате неконвенционального окисления предшественников, таких как каннабилгероловая кислота (CBGA) или редкие флавоноидоподобные метаболиты. При этом ключевую роль могут играть:
- ферменты класса монооксигеназ или гидроксилаз, которые используют молекулярный кислород для локального окисления боковой цепи;
- кетотропные оксидоредуктазы, участвующие в специфическом преобразовании алифатических цепей в присутствии НАД(P)Н-зависимой системы;
- локализованные изоформы P450-зависимых энзимов, которые могут участвовать в селективном окислении терпеновых производных с образованием новых функциональных групп, включая карбоксилирование.
Эти реакции не являются универсальными для всех экотипов конопли и, вероятно, запускаются в ответ на специфические внешние факторы — биотические или абиотические триггеры, такие как чрезмерное ультрафиолетовое излучение, дефицит определенных микроэлементов или наличие активированных сигнальных путей вторичного метаболизма. В отдельных случаях активность подобных ферментов ассоциируется с экспрессией генов каннабиноидного каскада за пределами типичных кластеров, что свидетельствует о вовлечении эпигенетических механизмов в регуляцию синтеза CBEA-B.
Также стоит отметить потенциальное вовлечение неконвенциональных ацилтрансфераз, которые могут обеспечивать специфическую рекомбинацию гераниловых остатков или вторичное соединение с ароматическим кольцом с участием интермедиатов шикиматного цикла. Хотя подобные гипотезы еще не получили полного экспериментального подтверждения, сравнительный метаболомный анализ показывает четкое накопление CBEA-B в растениях с нестандартной экспрессией ферментов класса berberine bridge enzyme-like proteins (BBE-like), что характерно для эволюционно более древних метаболических ветвей.
Таким образом, в отличие от классических каннабиноидов, CBEA-B не является следствием прямого действия отдельной синтазы, а образуется в результате нескольких гетерогенных биохимических реакций, которые координируются на уровне клеточного метаболизма с высокой зависимостью от генотипа, эпигенетических факторов и условий культивирования.
Эволюционные различия среди хемотипов Cannabis sativa L.
Разнообразие каннабиноидов в пределах Cannabis sativa L. обусловлено не только классическими генетическими вариантами, но и микроэволюционными процессами, которые влияют на активность каннабиноидного каскада. CBEA-B — один из маркеров неклассических хемотипов, что свидетельствует о глубокой хемотаксономической диверсификации в пределах вида.
Некоторые хемотипы демонстрируют стабильное производство CBEA-B при культивировании в изолированных условиях, что указывает на встроенную генетическую регуляцию его биосинтеза. В этих случаях идентифицированы последовательности, родственные измененным или нефункциональным копиям CBDA/THCA-синтаз, которые приобрели новые функции в результате мутагенеза или эпигенетических изменений. В частности, секвенирование геномов таких хемотипов выявляет уникальные SNP-варианты в регуляторных участках промоторов, связанных с ответом на стресс или вторичный метаболизм.
Анализ транскриптомов растений с высоким содержанием CBEA-B выявляет повышенную активность модулей эндогенного окислительного контроля, а также активацию неспецифичных циклических оксидазных каскадов, которые обычно не вовлечены в синтез THCA или CBDA. Этот тип активности свидетельствует о включении CBEA-B в филогенетически старые пути аллелопатии, свойственные определенным подвидам Cannabis ruderalis.
Хемотаксономически, присутствие CBEA-B ассоциируется с переходными формами между индустриальными и дикими популяциями, особенно в регионах с сильными климатическими колебаниями (Центральная Азия, восточные горные районы Турции, приграничные районы Афганистана). Там прослеживается естественный отбор генотипов, способных к эндогенному антиоксидантному защиту на основе метаболитов с высоким уровнем окислительной функционализации, что может служить адаптивным маркером при высоком ультрафиолетовом воздействии или дефиците фосфора.
Кроме того, сравнительные анализы указывают на наличие изоморфных структур CBEA-B в родственных родах, таких как Humulus и Trema, что выводит CBEA-B за пределы исключительно каннабис-специфического метаболизма. Это позволяет предположить древнее происхождение биосинтетической способности к образованию подобных карбоксилированных метаболитов, которое было сохранено в ряде представителей семейства Cannabaceae и утрачено в высококультурных линиях.
Суммарно, CBEA-B является индикатором хемотиповой диверсификации Cannabis sativa L., которая происходит на границе адаптационных и биохимических компромиссов. Его появление в современных образцах часто не является следствием целенаправленной селекции, а отражает вторичную активацию древних метаболических ветвей. Изучение этого соединения позволяет лучше понять молекулярные основы эволюции каннабиноидного метаболизма и открывает новые перспективы для применения нетипичных хемотипов в фармацевтической ботанике.
Методы получения CBEA-B
Классические органические экстракции и проблемы стабильности
Получение каннабилсоевой кислоты B (CBEA-B) из биомассы Cannabis sativa L. связано с многочисленными техническими и химическими вызовами, что обусловлено её низкой концентрацией, высокой реактивностью и склонностью к деградации в условиях экстракции. Учитывая её статус вторичного метаболита, CBEA-B не накапливается в значительных количествах в каком-либо известном культиваре конопли, что исключает возможность получения чистого вещества без применения чувствительных методов концентрации.
Основу большинства подходов к выделению CBEA-B составляют мягкие органические экстракции при пониженной температуре. Типичными являются полярные растворители средней силы, а именно:
- метанол (MeOH),
- этанол (EtOH),
- ацетон (Me₂CO),
- этиловый ацетат (EtOAc).
Эти растворители обеспечивают селективное выделение полярных каннабиноидов, включая карбоксилированные кислоты, благодаря взаимодействию с их гидроксильными и карбоксильными группами. Однако для сохранения исходной структуры CBEA-B необходимо проводить экстракцию при температуре ниже 25 °C, желательно под азотом или аргоновым газом, чтобы предотвратить окисление. В противном случае CBEA-B частично декарбоксилируется до нестабильных или нерастворимых продуктов, которые не могут быть обратимо преобразованы.
В этом контексте критически важно избегать кислотной или щелочной среды в процессе экстракции. Даже слабая кислотность среды, как в случае использования уксусной кислоты или минеральных примесей в воде, инициирует фрагментацию боковой цепи и разрушение ароматической системы. Таким образом, любая система получения CBEA-B должна быть нейтральной или слабо буферной, например, с использованием фосфатных буферов в водно-этанольной среде.
Дополнительно усложняет процесс то, что CBEA-B легко адсорбируется на полярных или кислотно-активных поверхностях, таких как стекло, силикагель или оксиды металлов. Это заставляет использовать специализированное неионное лабораторное оборудование, а именно инертные фторполимерные или кварцевые контейнеры, чтобы избежать потерь через адсорбцию или каталитическое разрушение.
Отдельной проблемой является выделение CBEA-B из матриц, богатых липидами, хлорофиллами и фенольными примесями. В таких случаях применяется жидкостно-жидкостная экстракция, где CBEA-B переводится в полярную фазу после удаления липофильных компонентов гексаном или циклогексаном. Подобная фракционная экстракция позволяет сконцентрировать CBEA-B до уровней, пригодных для дальнейшего аналитического очищения.
Поскольку этот каннабиноид термолабилен, не применяются методы на основе субкритической CO₂-экстракции без модификаторов, поскольку даже при низких температурах (35–45 °C) углекислый газ способствует карбоксилированию или декарбоксилированию в зависимости от рН среды. Альтернативой является надкритическая экстракция с модифицированными условиями, а именно с добавлением ингибиторов окисления (например, α-токоферола или BHT) и контролем рН с помощью аминокислотных соединений.
Для максимальной эффективности экстракции исследовательские группы используют комбинированные подходы, при которых первичная экстракция органическими растворителями сочетается с дальнейшей солюбилизацией в водно-этанольных микроэмульсиях, стабилизированных фосфолипидами или полиэтиленгликолями. Такой подход позволяет минимизировать потери при следующем очищении и дает возможность стабилизировать CBEA-B в течение длительного хранения.
Хроматографическое разделение и аналитическое очищение
После первичной экстракции CBEA-B существует необходимость в тонком разделении сложной смеси каннабиноидов, терпенов, флавоноидов и других примесей. Учитывая физико-химические свойства CBEA-B – полярность, наличие ионизированной карбоксильной группы, способность к внутримолекулярным водородным связям – оптимальными являются высокоэффективные хроматографические методы, а именно:
- RP-HPLC (обратная фазовая высокоэффективная жидкостная хроматография),
- гель-проникновенная хроматография (GPC) для предварительной фракции,
- ионный обмен в аналитических целях.
RP-HPLC с использованием колонок C18 или C8 позволяет эффективно разделять экстракты даже при высокой сложности матрицы. Для CBEA-B оптимальными являются мобильные фазы на основе ацетонитрила/воды с добавлением 0.1% формиевой кислоты, которая стабилизирует его протонированную форму и улучшает разделение за счет уменьшения вторичных взаимодействий с фазой. Важно избегать метанола как мобильной фазы из-за его способности образовывать эфиры с карбоксильными группами под действием тепла.
После хроматографического разделения необходимо аналитическое очищение, которое включает стадии:
- сухой заморозки фракций (лиофилизация),
- десоливации в вакууме при температуре <20 °C,
- контроля чистоты с помощью УФ-детектирования на длине волны 210–220 нм, характерной для карбоксильных ароматических систем.
Дальнейшее подтверждение чистоты CBEA-B осуществляется с помощью LC-MS/MS с электроспрей-ионизацией, что позволяет выявить даже минимальные примеси структурно схожих каннабиноидов. Идентификация выполняется по молекулярной ионной массе и специфическому фрагментационному профилю. В случае наличия остаточных изомеров (например, CBEA-A или нестабильных дегидроформ) проводится дополнительная очистка через препаративный капиллярный электрофорез с буфером на основе борной кислоты.
Очищенное вещество должно храниться при –80 °C в герметичной среде, желательно под азотом или аргоновым газом, с добавлением антиоксидантов для предотвращения окисления. Также стоит отметить, что даже минимальное повышение температуры хранения до –20 °C в течение нескольких недель может вызвать деградацию или полимеризацию CBEA-B, поэтому его стабильность остается основной преградой для масштабного производства.
Фармакологические свойства каннабилсоевой кислоты B (CBEA-B)
Предполагаемое взаимодействие с клеточными рецепторами
Каннабилсоевая кислота B (CBEA-B), как малоизученный каннабиноид, является объектом интенсивных исследований из-за своего потенциального взаимодействия с каннабиноидными рецепторами и другими молекулярными мишенями в организме. Поскольку CBEA-B является карбоксилированным каннабиноидом, относящимся к производным каннабилиновой серии, ее структура имеет общие черты с другими известными каннабиноидами, такими как Δ9-тетрагидроканнабинол (Δ9-THC) и каннабидиол (CBD). Однако ее специфические фармакологические эффекты и механизмы действия остаются малоизученными, и важно провести более детальные исследования для выявления точных механизмов ее взаимодействия с клеточными рецепторами.
Каннабиноидные рецепторы CB1 и CB2
Каннабиноиды проявляют свои эффекты через два основных рецептора: CB1 и CB2, которые принадлежат к семейству G-протеин-связанных рецепторов (GPCRs). Рецепторы CB1 в основном локализуются в центральной нервной системе (ЦНС), где они регулируют нейротрансмиттерные системы, отвечающие за болевые ощущения, эмоциональное состояние, память и двигательную активность. Рецепторы CB2, в свою очередь, преимущественно находятся в иммунной системе, включая микроглию и макрофаги, где они участвуют в модуляции воспалительных процессов.
Есть основания полагать, что CBEA-B может обладать умеренной или слабой агонистической активностью к рецепторам CB1 и CB2, поскольку ее молекулярная структура близка к структуре более активных каннабиноидов. Однако она не так активна, как Δ9-THC, который обладает значительным аффинитетом к рецептору CB1. Предварительные исследования показывают, что CBEA-B может действовать через механизм частичной агонистической активности с рецепторами CB1 и CB2, влияя на уровень цАМФ в клетках, что, в свою очередь, может изменять нейропередачу и воспалительные процессы.
Изучение этого эффекта для CBEA-B требует детальных молекулярных исследований и использования радиоактивно меченых лигандов, которые позволят точнее оценить ее способность связываться с каннабиноидными рецепторами.
Другие рецепторы и биологические мишени
Несмотря на возможное взаимодействие с каннабиноидными рецепторами, CBEA-B, как и другие каннабиноиды, может оказывать влияние на другие молекулярные мишени, которые не обязательно связаны с каннабиноидными рецепторами. В частности, возможное влияние на:
- Трансмембранные ионные каналы, включая такие, как каналы TRP (Transient Receptor Potential), которые играют ключевую роль в сенсорных процессах (например, тепло, боль).
- ГАМК-рецепторы: Известно, что некоторые каннабиноиды могут опосредованно влиять на ГАМК-эргическую систему, способствуя расслаблению и снижению тревожности.
Поскольку каннабилсоевое кислота B содержит ароматическое кольцо с гидроксильными группами, которые могут быть донорами водорода, она способна воздействовать на систему антиоксидантной защиты, в частности через ферменты супероксиддисмутазу (SOD) и каталазу, снижая окислительный стресс в клетках.
Исследование воздействия на метаболические и воспалительные каскады
Воспалительные каскады и регуляция иммунного ответа
CBEA-B обладает значительным потенциалом в регулировании воспалительных процессов, что делает его потенциально полезным в лечении хронических воспалительных заболеваний. Воспалительные каскады обычно активируются через рецепторы TLR (Toll-Like Receptors) или PRR (Pattern Recognition Receptors), которые распознают патогенные молекулы или поврежденные клеточные компоненты. При активации этих рецепторов начинается высвобождение провоспалительных цитокинов (например, TNF-α, IL-1β, IL-6), что способствует развитию воспалительного процесса.
Во время воспалительных реакций CBEA-B может потенциально модифицировать активность микроглии и макрофагов, что приводит к снижению секреции провоспалительных цитокинов. Соответственно, существует вероятность того, что CBEA-B обладает противовоспалительными свойствами, которые могут быть использованы для лечения таких заболеваний, как хронические воспалительные заболевания кишечника, артрит или аутоиммунные расстройства.
Влияние на метаболизм липидов и глюкозы
Метаболические нарушения, в частности те, которые связаны с нарушениями обмена глюкозы и липидов, являются важным аспектом многих хронических заболеваний, таких как сахарный диабет и атеросклероз. Учитывая связь между каннабиноидами и метаболическими процессами, можно предположить, что CBEA-B может оказывать влияние на метаболические пути, регулируя уровень глюкозы и липидов в крови.
Некоторые каннабиноиды, например, CBD, продемонстрировали способность снижать уровень глюкозы в крови, нормализуя чувствительность к инсулину, а также снижать уровень холестерина. Поскольку CBEA-B имеет подобную химическую структуру, существует вероятность, что он также может выполнять подобные функции. Кроме того, в печени и жировой ткани могут активироваться молекулы, способствующие снижению жировых отложений через активацию PPAR-γ (пероксисомный пролифератор-активированный рецептор γ), что снижает риск развития метаболического синдрома.
Потенциальное воздействие на нейропластичность и нейрогенез
Нейропластичность — способность мозга адаптироваться к изменениям в окружающей среде, а нейрогенез — способность мозга производить новые нейроны, является важными аспектами восстановления после травм или нейродегенеративных заболеваний. Некоторые каннабиноиды, в частности CBD, обладают способностью влиять на нейропластичность и нейрогенез. В связи с потенциальными нейротрофическими свойствами CBEA-B, можно предположить, что он также может регулировать эти процессы.
На молекулярном уровне в Центральной нервной системе (ЦНС) CBEA-B может взаимодействовать с нейротрофическими факторами, в частности BDNF (Brain-Derived Neurotrophic Factor), что способствует поддержанию нейронов в условиях стресса или воспалительных процессов. Это может быть важным в терапии нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона.
Молекулярная мишень и внутриклеточные механизмы каннабисоевой кислоты B (CBEA-B)
Предполагаемые мишени в системах TRP, PPAR, GPR
Система TRP (Transient Receptor Potential)
Система TRP (Transient Receptor Potential) рецепторов является важным компонентом клеточной сигнализации и имеет решающее значение в регуляции многих физиологических процессов, таких как восприятие боли, температуры, механических стимулов, а также метаболических и воспалительных процессов. Рецепторы TRP являются ионными каналами, которые позволяют определенным ионам (например, кальцию, натрию или магнию) входить в клетку, что стимулирует многочисленные внутриклеточные пути.
TRP-рецепторы включают в себя много подтипов, в частности TRPV1, TRPA1, TRPM8, TRPC6 и другие. Связь между каннабиноидами и TRP-рецепторами является предметом активных исследований, поскольку каннабиноиды, как правило, обладают свойством модуляции активности TRP-рецепторов, влияя на физиологические функции организма.
TRPV1 – один из наиболее изученных подтипов TRP-рецепторов, известный своей способностью реагировать на температуру и определенные химические соединения, такие как капсаицин (активный компонент перца чили). Каннабиноиды могут связываться с TRPV1 и модулировать его активность, что может оказать значительное влияние на снижение болевых ощущений и уменьшение воспаления. CBEA-B, вероятно, может взаимодействовать с TRPV1, имея анальгезирующий эффект.
Другой важный рецептор — TRPA1, который активируется через различные раздражители, включая химические вещества и температурные изменения. Взаимодействие CBEA-B с TRPA1 может привести к блокированию боли и воспаления, способствуя терапевтическому эффекту в хронических воспалительных заболеваниях.
Каннабиноиды также способны влиять на другие подтипы TRP-рецепторов, что может быть значимо для лечения таких заболеваний, как артрит, неврит и нейропатическая боль, через модуляцию различных каналов и уменьшение уровня воспаления.
Парацеллюлярные ядерные рецепторы PPAR
PPAR (пероксисомный пролифератор-активированный рецептор) является группой ядерных рецепторов, которые активно влияют на обмен липидов, углеводов и другие важные метаболические процессы. Существуют три основных подтипа PPAR: PPAR-α, PPAR-β/δ и PPAR-γ. Эти рецепторы, взаимодействуя с определенными молекулами, регулируют деятельность генов, которые отвечают за поддержание метаболического баланса, обмен веществ и уменьшение воспаления.
Рецептор PPAR-γ регулирует важные процессы, связанные с липидным обменом и метаболизмом глюкозы. Каннабиноиды могут активировать PPAR-γ, что приводит к снижению уровня воспаления, улучшению чувствительности к инсулину и снижению уровня холестерина и триглицеридов в организме. Это имеет потенциал для лечения таких заболеваний, как диабет типа 2 и метаболический синдром.
Кроме того, PPAR-α участвует в регуляции уровня липидов и жирных кислот в печени и других тканях. Модуляция этой активности каннабиноидами, включая CBEA-B, может позитивно повлиять на кардиометаболическое здоровье, уменьшая риск развития сердечно-сосудистых заболеваний, таких как атеросклероз или гипертония.
Таким образом, CBEA-B имеет потенциал действовать через PPAR-рецепторы, что делает его перспективным кандидатом для разработки терапевтических средств, направленных на лечение воспалительных и метаболических заболеваний, а также для регулирования энергетического гомеостаза в организме.
Г-протеин-связанные рецепторы (GPR)
Г-протеин-связанные рецепторы (GPR) — это большая группа рецепторов, которые регулируют внутриклеточную сигнализацию через связывание с г-протеинами. Они являются важными компонентами нейропластичности, воспалительных процессов, а также в регуляции энергетического обмена.
Особый интерес представляет GPR55, который участвует в модуляции различных физиологических процессов, включая нейропластичность и болевые ощущения. Согласно исследованиям, GPR55 может играть важную роль в регуляции нейрогенеза и синаптической пластичности, что делает его перспективной мишенью для лечения нейродегенеративных заболеваний.
Взаимодействие с GPR55 может привести к изменению нервной проводимости, снижению боли и улучшению нейропластичности. Существует также теоретическая возможность использования CBEA-B для терапии заболеваний, таких как хроническая боль, расстройства памяти или даже депрессия через механизмы, связанные с GPR55.
Эпигенетический потенциал и транскрипционная активность
Взаимодействие с эпигенетическими механизмами
Эпигенетика изучает изменения в выражении генов, которые не включают изменения в самой ДНК. Такие изменения могут включать метилирование ДНК, ацетилирование гистонов и микроРНК, которые способны изменять активность генов в ответ на внешние или внутренние сигналы. Эпигенетические механизмы являются критически важными для развития клеток, а также для многих патологических процессов, таких как рак, нейродегенерация, метаболические расстройства и хронические воспаления.
Влияние каннабиноидов, в частности CBEA-B, на эпигенетические механизмы является перспективной областью для дальнейших исследований. Известно, что каннабиноиды могут влиять на деацетилазы и метилтрансферазы, которые отвечают за активацию или подавление конкретных генов. Это может быть значимо в контексте таких заболеваний, как рак, сердечно-сосудистые заболевания, неврологические расстройства и аутоиммунные болезни.
CBEA-B может изменять активность эпигенетических регуляторов, таких как HDAC (гистондезацетилазы), которые могут регулировать уровень воспалительных процессов в организме, снижая или увеличивая экспрессию генов, отвечающих за воспаление, антиоксидантную защиту, иммунный ответ и метаболизм.
Транскрипционная активность
Каннабиноиды обладают способностью влиять на транскрипцию генов через активацию определенных ядерных рецепторов, таких как PPAR, LXR (liver X receptor) и NRF2 (ядерный фактор эритроидного 2). Эти рецепторы играют важную роль в регуляции антиоксидантной активности, липидного обмена и обмена глюкозы, что делает их важными мишенями для терапии метаболических и сердечно-сосудистых заболеваний.
CBEA-B, вероятно, имеет способность влиять на активацию транскрипционных факторов, которые регулируют антиоксидантную защиту и воспалительные процессы в организме. В частности, CBEA-B может активировать NRF2, который отвечает за детоксикацию и защиту клеток от оксидативного стресса, что имеет особое значение при лечении нейродегенеративных заболеваний и сердечно-сосудистых расстройств.
Биотрансформация и метаболизм каннабилсоевой кислоты B (CBEA-B)
Преобразования в организме и роль ферментов фазы I–II
Биотрансформация CBEA-B в организме — это сложный процесс, включающий несколько стадий, которые осуществляются через ферменты фазы I и фазы II метаболизма. Эти стадии обеспечивают метаболическую активность и стабильность молекулы, что важно для ее фармакокинетических свойств.
Фаза I метаболизма
Метаболизм каннабилсоевой кислоты B (CBEA-B) на первой стадии включает окислительные реакции, которые в основном катализируются ферментами цитохрома P450 (CYP450). Эти ферменты обеспечивают окисление, гидроксилирование или другие реакции модификации функциональных групп на молекуле. В случае CBEA-B эти ферменты могут включать:
- CYP3A4 — этот фермент имеет высокую активность в метаболизме многих лекарственных средств, а также в метаболизме каннабиноидов. Окисление с участием CYP3A4 может привести к образованию гидроксилированных метаболитов, которые могут иметь другую биологическую активность по сравнению с исходной молекулой.
- CYP2C9 — еще один важный фермент, который участвует в метаболизме каннабиноидов. CYP2C9 также может влиять на превращение CBEA-B, в частности, на превращение его в гидроксилированные продукты.
Окисление молекулы каннабилсоевой кислоты в результате действия ферментов CYP в основном приводит к образованию метаболитов, которые имеют сниженное фармакологическое или токсическое действие в организме. Однако для CBEA-B возможно образование продуктов, которые могут взаимодействовать с клеточными мишенями, что открывает потенциал для лечения некоторых хронических заболеваний.
Фаза II метаболизма
На стадии фазы II метаболиты, образовавшиеся в результате окисления, могут подвергаться конъюгации с определенными молекулами для облегчения их выведения из организма. Одним из основных процессов этой фазы является глюкуронизация, сульфуризация или метилирование, что позволяет превращать гидроксилированные метаболиты в более полярные соединения, способные легче выводиться через мочу или желчь.
UDP-глюкуронилтрансферазы (UGTs) — это класс ферментов, которые способны прикреплять глюкуроновую кислоту к метаболитам CBEA-B. Это делает молекулу менее липофильной и способствует ее выведению через почки. Глюкуронид CBEA-B может иметь другую биологическую активность по сравнению с исходным соединением, что также стоит учитывать при разработке терапевтических применений.
Сульфотрансферазы (SULTs) — еще один класс ферментов фазы II, которые осуществляют прикрепление сульфатной группы к молекуле. Это также способствует выведению метаболитов через мочу.
В случае CBEA-B глюкуронизация и сульфуризация могут снижать активность метаболитов, превращая их в неактивные формы, что снижает риск токсичности. Тем не менее, некоторые метаболиты могут сохранять активность и даже вызывать специфические эффекты через влияние на рецепторы или клеточные мишени.
Сравнительная стабильность в плазме, печени, микробиоме
Стабильность в плазме
После попадания в организм CBEA-B быстро связывается с белками плазмы, что обеспечивает его транспортировку в различные ткани. Степень связывания с белками плазмы может варьировать в зависимости от концентрации и фармакокинетических параметров молекулы. Благодаря этому процессу CBEA-B может сохранять свою активность в течение определенного времени в крови, что позволяет ему воздействовать на клеточные мишени на разных этапах метаболизма.
Стабильность в печени
Печень является основным органом для метаболизма, где ферменты фазы I и II осуществляют активные преобразования многих лекарственных средств и других химических соединений. В печени CBEA-B подвергается интенсивному метаболизму, где ферменты CYP450 играют важную роль в его превращении в активные или неактивные метаболиты. Поэтому стабильность CBEA-B в печени является важным фактором, который определяет, как долго молекула сохраняет свою активность и будет ли она подвергнута быстрому выведению.
Стабильность в микробиоме
Микробиом, особенно кишечный, может также играть роль в метаболизме каннабиноидов, таких как CBEA-B. Некоторые бактерии микрофлоры способны метаболизировать различные органические соединения, включая каннабиноиды, через ферменты, расщепляющие связи молекул. Это может привести к деградации CBEA-B или образованию новых метаболитов, которые могут иметь другую биологическую активность. Таким образом, микробиом может существенно влиять на стабильность CBEA-B в желудочно-кишечном тракте и его эффективность.
Методы обнаружения в биологических образцах
LC-MS/MS подходы для микродозовых концентраций
Один из основных методов обнаружения и количественного определения CBEA-B в биологических образцах — это жидкостная хроматография с масс-спектрометрией (LC-MS/MS). Этот метод позволяет обнаруживать даже микродозовые концентрации молекул в крови, моче или других биологических жидкостях с высокой точностью и чувствительностью.
LC-MS/MS сочетает разделение молекул на колонке с жидкостной хроматографией и последующий анализ массовых сигналов с помощью масс-спектрометрии, что позволяет точно определить молекулярную массу и структурные особенности метаболитов CBEA-B. Этот подход чрезвычайно полезен для анализа малых доз каннабиноидов, которые могут быть трудно обнаруживаемыми с помощью других методов, таких как газовая хроматография.
Разделение изомеров и артефактов в сложных матрицах
Одна из важных проблем при обнаружении каннабиноидов в биологических образцах — наличие изомеров и артефактов, которые могут осложнить точное определение метаболитов. CBEA-B, как и другие каннабиноиды, может существовать в нескольких изомерных формах, и их точное различение является критически важным для оценки его биологической активности и метаболических путей.
Методы, включающие масс-спектрометрию, позволяют эффективно различать изомеры и минимизировать эффект артефактов, которые могут возникать в результате анализа сложных матриц, таких как сыворотка крови или микробиом. Современные методы разделения, в частности жидкостная хроматография с высокой разделительной способностью (HPLC), могут помочь получить точные результаты даже в условиях сложных загрязнений и низкой концентрации молекул.
Инновационные направления исследований каннабилсоевой кислоты B (CBEA-B)
CRISPR/Cas-модулированное усиление синтеза в культуре
Одним из самых перспективных направлений исследований для CBEA-B является использование технологии CRISPR/Cas для модификации генома организмов, которые используются для биосинтеза этой молекулы. Это позволяет точно регулировать процессы синтеза каннабилсоевой кислоты в клеточных культурах или микроорганизмах, таких как дрожжи или бактерии.
CRISPR/Cas9 позволяет внести точечные мутации в гены, которые кодируют ферменты, отвечающие за синтез CBEA-B. Благодаря этому можно получить искусственно инженерированные клетки, которые будут иметь увеличенную способность к производству CBEA-B, что имеет важное значение для фармацевтической промышленности, в частности в контексте создания биофармацевтических препаратов на основе этого соединения.
Одним из основных преимуществ такого подхода является возможность экспрессии генетически модифицированных организмов в условиях промышленного масштабирования, что обеспечит стабильное и массовое производство CBEA-B для дальнейшего использования в научных исследованиях и медицинских целях.
Например, применение CRISPR/Cas для активации или увеличения экспрессии генов, кодирующих ферменты фазы I и II метаболизма в культуре, может значительно повысить эффективность биосинтеза CBEA-B и уменьшить количество необходимых этапов в его производстве. Такой подход также позволяет снизить затраты на производство и повысить стабильность продукта, что делает CBEA-B более доступным для дальнейших исследований.
Перспективы CBEA-B как биомаркера специфических химотипов
Поскольку CBEA-B имеет сложную молекулярную структуру и взаимодействует с многочисленными рецепторами и метаболическими путями, его потенциал как биомаркера для определения специфических химотипов в организмах (в частности, у человека) является значительным. Определение химотипов может помочь в персонализированной медицине, где выбор лечения или диеты основывается на генетических или метаболических особенностях пациента.
Сегодня уже известно, что каннабиноиды, к которым относится CBEA-B, могут иметь различные эффекты в зависимости от генетической предрасположенности организма, включая вариации в рецепторах CB1 и CB2, PPAR-рецепторах, а также различные механизмы метаболизма каннабиноидов в организме. Изучение корреляции между уровнем CBEA-B и определенными генетическими или метаболическими маркерами может стать основой для разработки новых методов диагностики и терапии заболеваний, связанных с нарушениями в метаболических путях каннабиноидов.
CBEA-B может выступать как маркер для персонализированной терапии, поскольку различные пациенты могут по-разному реагировать на каннабиноиды в зависимости от их генетических особенностей. Например, химотипы, связанные с высоким или низким уровнем метаболизма каннабиноидов, могут быть использованы для определения оптимальных доз CBEA-B или других каннабиноидов в лечебных целях.
Вывод:
Каннабилсоевая кислота B (CBEA-B) является важным представителем каннабиноидов, привлекающим внимание научного сообщества благодаря своей уникальной молекулярной структуре и потенциалу в медицинских и фармацевтических применениях. Она относится к окисленным производным каннабилиновой серии и демонстрирует значительную биологическую активность, взаимодействуя с различными рецепторами и метаболическими путями, что открывает новые возможности для лечения воспалительных, нейротропных и метаболических заболеваний.
Исследования CBEA-B в контексте биогенеза и молекулярных мишеней показывают, что эта молекула может влиять на системы TRP, PPAR и GPR, что делает ее важным объектом для разработки терапевтических стратегий. Методы, такие как CRISPR/Cas, позволяют генетически модифицировать организмы для увеличения продукции CBEA-B, что может значительно улучшить эффективность ее использования в медицине и биотехнологии.
Метаболические пути и стабильность CBEA-B в организме требуют дальнейших исследований, особенно в контексте ее взаимодействия с ферментами фазы I и II. Это важно для понимания ее фармакокинетических свойств и потенциала для применения в медицинских препаратах. Использование технологий LC-MS/MS позволяет точно определить метаболиты CBEA-B в биологических образцах, что открывает новые возможности для диагностики и мониторинга эффективности лечения.
Перспективы CBEA-B как биомаркера специфических химотипов Cannabis sativa L. также выглядят обнадеживающе, поскольку это может помочь в персонализированной медицине и повысить точность терапии. Определение химотипов поможет настроить лечение в зависимости от генетических и метаболических характеристик пациента, что является важным для успешного использования каннабиноидов в медицинской практике.
Таким образом, CBEA-B имеет значительный потенциал в различных областях науки и медицины, и дальнейшие исследования в этой сфере могут привести к новым открытиям и применениям, способствующим развитию биомедицинских технологий и фармацевтики.
Источники:
- PubMed Central (PMC) — Национальный институт здравоохранения США (NIH) предоставляет доступ к исследованиям о каннабиноидах и их молекулярных свойствах, которые могут быть полезными для понимания CBEA-B и его биохимии. https://www.ncbi.nlm.nih.gov/pmc/
- NIH RePORTER — Платформа для поиска финансируемых научных исследований и публикаций, охватывающих каннабиноиды, включая CBEA-B, фармакологические свойства и биогенез. https://reporter.nih.gov/
- Frontiers in Pharmacology — Открытый журнал по фармакологии, который публикует исследования о каннабиноидах, их молекулярных мишенях и фармакологических эффектах, которые могут касаться CBEA-B. https://www.frontiersin.org/journals/pharmacology
- The Royal Society of Chemistry (RSC) — Публикации по химии и биохимии, где можно найти статьи о структуре и биохимии каннабиноидов, включая CBEA-B. https://www.rsc.org/
- NCBI (National Center for Biotechnology Information) — Платформа, предоставляющая доступ к исследованиям, включающим молекулярную биологию каннабиноидов и другие соответствующие статьи. https://www.ncbi.nlm.nih.gov/
- ScienceDirect (Elsevier) — Открытые статьи по фармакологии и биохимии, включая исследования о молекулярных мишенях каннабиноидов, которые могут быть полезны для понимания свойств CBEA-B. https://www.sciencedirect.com/
- ResearchGate — Научная платформа, где можно найти исследования по каннабиноидам и их фармакологических свойствах. https://www.researchgate.net/