Каннабифуран (CBF) является химическим соединением, относящимся к классу синтетических каннабиноидов, которые моделируют биохимическую активность природных каннабиноидов, выделенных из растений рода Cannabis. Несмотря на то, что природные каннабиноиды широко изучены, в частности такие, как тетрагидроканнабинол (THC) и каннабидиол (CBD), Каннабифуран характеризуется уникальными структурными особенностями, определяющими его специфический профиль фармакологической активности. Изучение молекулы CBF приобретает значение как в контексте химического синтеза, так и в биомедицинских исследованиях, учитывая её потенциал в различных областях, включая фармакологию, токсикологию и биотехнологии.
Молекулярная структура Каннабифурана выделяется наличием фуранового кольца, конденсированного с основной каннабиноидной скелетной системой, что обеспечивает высокую липофильность и специфические свойства взаимодействия с рецепторами эндоканнабиноидной системы. Эта особенность определяет тонкую регуляцию связи молекулы с рецепторами CB1 и CB2, которые являются центральными компонентами нейромодуляторных и иммунных процессов в организме. Отличия в сродстве к рецепторам и активации вторичных сигнальных каскадов относят CBF к категории веществ с потенциально широким спектром биологических эффектов.
С учётом химической структуры синтез Каннабифурана представляет собой сложный процесс, требующий точного контроля условий реакции и выбора соответствующих прекурсоров и катализаторов. Научное внимание к методам его получения обусловлено не только стремлением получить чистый и стабильный продукт, но и необходимостью исследовать вариативность структуры для поиска оптимальных фармакологических свойств. Современные методы синтеза включают как классические органические реакции, так и инновационные подходы, использующие катализаторы переходных металлов и «зелёные» химические технологии, которые снижают экологическую нагрузку и повышают выход продукта.
Природные источники каннабифурана остаются недостаточно изученными, однако существуют сведения о потенциальной биосинтетической активности некоторых штаммов Cannabis sativa, у которых ферментативные системы способствуют образованию производных с фурановым кольцом. Помимо традиционных растительных путей, исследуются биотехнологические методы синтеза с помощью рекомбинантных микроорганизмов, что открывает новые перспективы для масштабного производства CBF с заданными характеристиками. Анализ метаболических путей и идентификация ферментов, катализирующих образование фурановых структур, являются ключевыми для разработки эффективных биосинтетических платформ.
Фармакологический профиль Каннабифурана включает изучение его взаимодействия с рецепторами эндоканнабиноидной системы, что определяет его потенциальную способность влиять на широкий спектр биологических процессов, включая нейромодуляцию, иммунорегуляцию и метаболическую активность. Механизмы действия CBF изучаются с использованием экспериментальных моделей in vitro и in vivo, что позволяет определить его влияние на клеточные сигнальные каскады, а также профиль фармакокинетики, характеризующий скорость и пути метаболизма, биодоступность и период полураспада.
С точки зрения токсикологии, Каннабифуран вызывает интерес как пример синтетического каннабиноида, для которого необходимо установить пределы безопасного применения, потенциальные побочные эффекты и механизмы токсического действия. Стандартизированные методики исследования острой и хронической токсичности, а также оценка канцерогенности и мутагенности являются обязательными составляющими для определения профиля безопасности CBF. Эти данные критичны не только для фармацевтических разработок, но и для понимания воздействия на здоровье в случае случайного или злоумышленного употребления.
Аналитические методы исследования Каннабифурана включают спектроскопические техники (ЯМР, ИК-спектроскопия, УФ-спектроскопия), хроматографические методы (ВЭЖХ, ГХ-МС) и масс-спектрометрию, обеспечивающие комплексную характеристику химической структуры, чистоты и стабильности образцов. Контроль качества продукта требует валидации методов анализа, соответствующих строгим критериям точности, воспроизводимости и специфичности. Хранение и стабилизация Каннабифурана также изучаются с целью определения оптимальных условий, предотвращающих деградацию и сохраняющих биологическую активность.
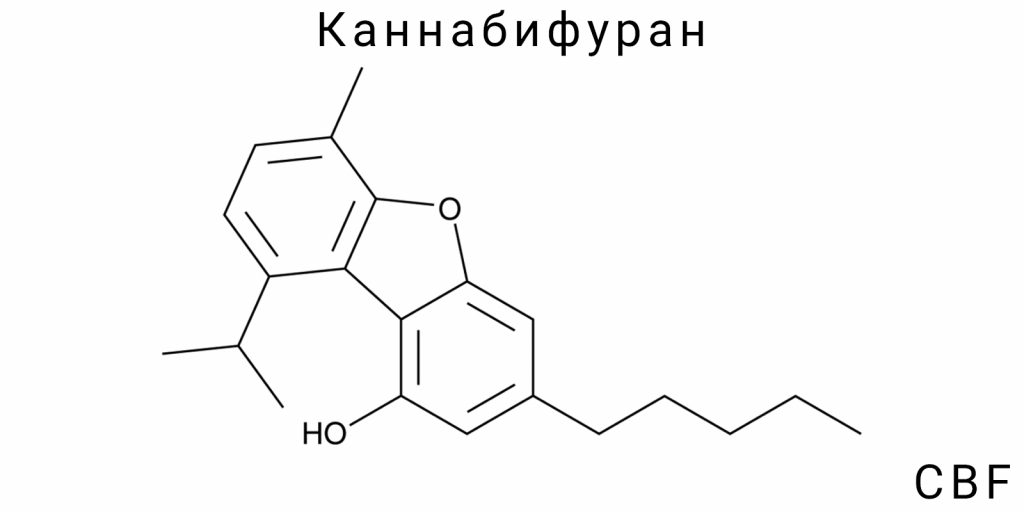
Химическая структура и физико-химические свойства
Каннабифуран (CBF) относится к группе синтетических каннабиноидов, для которых характерна уникальная молекулярная структура, определяющая их физико-химические свойства и биологическую активность. Это соединение отличается наличием фуранового кольца, конденсированного с каннабиноидным скелетом, что существенно влияет на его липофильность, стабильность и реактивность. Структурная конфигурация CBF определяет его способность к специфическому взаимодействию с молекулярными мишенями, в частности рецепторами эндоканнабиноидной системы, что делает его предметом активных исследований в области биохимии и фармакологии.
Основой химической структуры Каннабифурана является цикл из пяти атомов — фурановое кольцо, насыщенное одним кислородом, создающее специфические электронные условия в молекуле. Присоединение фуранового фрагмента к каннабиноидному ядру формирует соединение с повышенной электронной плотностью в определённых участках молекулы, что влияет на её физические и химические параметры, такие как растворимость в различных средах, температура плавления и устойчивость к окислению. Эти характеристики имеют фундаментальное значение для понимания поведения CBF в биологических системах и при синтезе.
Физико-химические свойства Каннабифурана тесно связаны с его молекулярной геометрией и электронной структурой. Липофильность, являющаяся критическим параметром для проникновения молекулы через клеточные мембраны, обеспечивается наличием неполярных гидрофобных групп в структуре. Эта особенность определяет способность CBF к пассивной диффузии в липидных средах и, соответственно, влияет на его биодоступность и фармакокинетические характеристики.
Стабильность Каннабифурана определяется как внутренней структурой, так и внешними условиями среды. Молекула проявляет умеренную термическую стойкость, однако подвергается фотолизу и окислению при наличии кислорода и света, что важно для хранения и транспортировки. Химическая стабильность также зависит от pH среды: в кислых или щелочных растворах могут происходить гидролитические или конденсационные реакции, изменяющие первичную структуру и, как следствие, биологическую активность.
Взаимодействие Каннабифурана с различными растворителями демонстрирует вариабельную растворимость, обусловленную спецификой электронной структуры и полярности молекулы. Лучше всего CBF растворяется в неполярных и слабо полярных органических растворителях, таких как хлороформ, дихлорметан, а также в липидных средах. Водная растворимость низкая, что характерно для большинства каннабиноидов, и ограничивает использование соединения в водных биологических системах без дополнительных носителей или эмульгаторов.
Химическая структура Каннабифурана также определяет его способность к конформационной гибкости, что имеет значение для взаимодействия с биологическими рецепторами. Вариации в пространственном расположении функциональных групп обеспечивают адаптивность молекулы к разным типам рецепторов, что объясняет разнообразие биологических эффектов, зафиксированных в экспериментальных исследованиях. Конформационная изменчивость влияет также на фармакодинамические свойства, в частности афинность к рецепторным участкам.
Дополнительно, Каннабифуран демонстрирует характерные спектроскопические свойства, отражающиеся в чётких полосах поглощения в спектрах УФ-видимого диапазона, а также в специфических откликах в ЯМР-спектрах. Эти физико-химические характеристики служат основой для идентификации и контроля чистоты CBF, что важно в процессах синтеза и последующего применения. Применение спектроскопии позволяет получить детальную информацию об электронной структуре и конформации молекулы.
Физико-химические свойства Каннабифурана определяют также его поведение в сложных системах, таких как биологические мембраны или фармацевтические препараты. Взаимодействие с белками, липидами и другими биомолекулами зависит от электростатических и ван-дер-ваальсовых сил, критичных для формирования стабильных комплексов. Это влияет на фармакологическую активность и распределение молекулы в живых организмах.
Молекулярная формула и строение
Каннабифуран (CBF) имеет чётко определённую молекулярную формулу, которая отражает количественный состав атомов в молекуле и является основой для её пространственной и электронной структуры. Формула CBF — C21H26O2, что указывает на наличие 21 атома углерода, 26 атомов водорода и 2 атомов кислорода. Эта формула демонстрирует, что молекула содержит два функциональных кислородсодержащих элемента, которые структурно представлены в виде фуранового кольца, являющегося неизменным компонентом молекулы и определяющим её химическую специфику.
Строение Каннабифурана состоит из конденсированных циклов, где основой является трёхчленный ароматический ядро каннабиноида, к которому присоединено пятичленное кислородное кольцо — фурановое. Особенностью молекулы является взаимное расположение этих циклов в пространстве, что создаёт специфическую трёхмерную конформацию с определёнными углами связей и пространственными ограничениями. Конформация определяется как жёсткостью фуранового кольца, так и подвижностью боковых цепей, что в совокупности влияет на физико-химические параметры и взаимодействие с биологическими мишенями.
Циклическая система молекулы формируется ароматическим бензольным кольцом, к которому присоединены дополнительные циклические фрагменты и алифатические боковые цепи. Эти цепи включают насыщенные углеродные фрагменты с разной длиной, которые выполняют функцию модуляторов липофильности и химической стабильности. Структурная сложность молекулы CBF позволяет классифицировать её как поликонденсированный ароматический эфир со сложной архитектурой, где электронная плотность локализована в определённых сегментах, что является критичным для реактивности.
Химические связи в молекуле имеют специфические параметры длины и угла наклона, которые определяют электронное распределение и геометрические свойства. В частности, кислород в фурановом кольце формирует σ- и π-связи, обеспечивающие частичную конъюгацию с ароматической системой. Это создаёт зоны повышенной электронной плотности, усиливающие электрофильность фрагментов молекулы и влияющие на механизмы химического взаимодействия.
Пространственная ориентация функциональных групп определяет возможности образования внутримолекулярных водородных связей, которые стабилизируют конформацию и минимизируют энергетический потенциал. Анализ молекулярных моделей показывает, что боковые алифатические группы расположены так, чтобы избегать стерических препятствий, что повышает термодинамическую стабильность структуры.
Каннабифуран является примером молекулы с гетероциклическим кольцом, содержащим кислород, который повышает полярность локальных участков, создавая дипольные моменты. Эти моменты важны для взаимодействия с биологическими рецепторами, а также для растворимости в полярных и неполярных растворителях. Молекулярный дипольный момент имеет значение для прогнозирования фармакокинетических характеристик и транспорта через клеточные мембраны.
Специфика молекулярного строения Каннабифурана заключается в оптимальном соотношении жёстких циклических систем и гибких боковых цепей, что обеспечивает молекуле способность адаптироваться к разным пространственным условиям в рецепторных зонах. Это свойство является существенным для селективности действия и высокой аффинности к определённым подтипам каннабиноидных рецепторов.
Электронная структура молекулы характеризуется распределением π-электронов в ароматических и фурановых кольцах, что создаёт потенциал для участия в реакциях электрофильного и нуклеофильного характера. Такой распределение определяет химическую активность, в частности способность к окислительным процессам и образованию стабильных радикальных промежуточных соединений.
Интенсивное распределение зарядов по молекуле определяет её потенциал взаимодействия с катионными и анионными средами, что имеет практическое значение для синтеза производных с модифицированными свойствами, а также для фармакодинамических исследований. Внутримолекулярные силы влияют на конфигурацию молекулы и стабилизируют её в определённых электронных состояниях.
Кроме основной молекулы, в структуре возможны существование и изомеры с вариациями в расположении боковых цепей или в конфигурации фуранового кольца. Изомерия может влиять на фармакологическую активность, стабильность и фармакокинетику, что актуализирует необходимость в подробном изучении стереохимии CBF.
Современные методы молекулярного моделирования и рентгеновской кристаллографии позволяют получить точные трёхмерные структуры Каннабифурана, что способствует пониманию его взаимодействия с биомолекулярными мишенями на атомарном уровне. Эти исследования критичны для разработки синтетических аналогов с усовершенствованными фармакологическими характеристиками.
Физико-химические характеристики (растворимость, стабильность, спектроскопия)
Физико-химические характеристики Каннабифурана (CBF) являются ключевыми для определения его поведения в различных средах, а также для контроля его качества и эффективности в исследовательских и прикладных процессах. Растворимость, стабильность и спектроскопические свойства CBF характеризуют его взаимодействие с внешней средой, что является фундаментальным для анализа биологической доступности и химической идентификации.
Растворимость Каннабифурана определяется его молекулярным строением и полярностью, что непосредственно влияет на способность молекулы диспергироваться в различных растворителях. CBF отличается низкой водорастворимостью из-за высокой липофильности, что связано с наличием значительной доли неполярных углеродных цепей и ароматических фрагментов в структуре. Однако растворимость в неполярных и слабо полярных органических растворителях, таких как гексан, толуол, хлороформ и дихлорметан, является высокой, что отражает склонность молекулы к растворению в средах с подобными физико-химическими свойствами. Эта особенность является критически важной для подготовки растворов для хроматографического анализа, а также для разработки фармацевтических форм.
Показатели растворимости CBF в воде находятся на уровне нижних долей миллиграмма на миллилитр, что существенно ограничивает его использование в водных средах без применения дополнительных адъювантов или носителей, таких как циклодекстрины или микроэмульсии. Такая физико-химическая особенность обусловливает необходимость применения специфических технологий для улучшения биодоступности и формирования стабильных препаратов.
Стабильность Каннабифурана определяется его чувствительностью к условиям окружающей среды, в частности к воздействию света, кислорода, температурным колебаниям и pH. Фотолабильность CBF связана со способностью фуранового кольца к распаду под воздействием ультрафиолетового излучения, что приводит к разрыву π-связей и образованию свободных радикалов. Это явление требует тщательного контроля условий хранения, особенно избегания прямого солнечного света и использования защитной упаковки с ультрафиолетовым фильтром.
Окислительная стабильность молекулы отражает её реакционную способность к кислороду в атмосфере. Наличие электронно-насыщенного фуранового фрагмента создает зоны повышенной химической активности, где возможен переход молекулы в реактивные промежуточные состояния с образованием пероксидов и других окислительных продуктов. Такие процессы изменяют первичную структуру CBF, снижают его эффективность и могут привести к образованию токсичных метаболитов, что актуализирует необходимость в антиоксидантных стабилизаторах при длительном хранении.
Термостабильность Каннабифурана ограничена, что проявляется в постепенном распаде при повышенных температурах выше 120°C. Декомпозиция сопровождается разрушением ароматического ядра и раскрытием фуранового кольца, что вызывает потерю молекулярной целостности и изменение фармакологической активности. Эта особенность влияет на выбор условий синтеза, хранения и обработки CBF, в частности, в фармацевтическом производстве и исследованиях.
Спектроскопические характеристики Каннабифурана включают УФ-видимую, инфракрасную (ИК), ядерный магнитный резонанс (ЯМР) и масс-спектрометрию, которые являются неотъемлемой частью идентификации и структурного анализа.
УФ-видимая спектроскопия CBF демонстрирует характерные полосы поглощения в диапазоне 250-320 нм, что связано с π→π* переходами в ароматической системе и n→π* переходами кислородных неподеленных электронов во фурановом кольце. Интенсивность и положение этих пиков зависят от растворителя и температуры, что позволяет использовать этот метод для количественного анализа и определения концентрации в растворах.
Инфракрасная спектроскопия выявляет типичные полосы, соответствующие функциональным группам молекулы. Отсутствие широкой полосы в диапазоне 3200-3600 см⁻¹ подтверждает отсутствие свободных гидроксильных групп, тогда как четкие полосы в зоне 1000-1300 см⁻¹ соответствуют С-О-С связям фуранового кольца. Пики в диапазоне 1500-1600 см⁻¹ отражают ароматические С=С связи, что подтверждает сохранение конъюгированной системы. Эти спектральные характеристики критически важны для контроля чистоты и идентификации CBF.
ЯМР-спектроскопия, особенно протонный (¹H) и углеродный (¹³C) ЯМР, дает подробную информацию о химическом окружении атомов в молекуле. Химические сдвиги протонов в ароматической части расположены в диапазоне 6.5-7.5 ppm, тогда как алифатические группы характеризуются сигналами в более низком диапазоне 0.8-2.5 ppm. Специфические сдвиги, связанные с атомами, входящими в состав фуранового кольца, позволяют подтвердить конформацию и идентифицировать возможные изомеры. Углеродный ЯМР демонстрирует сигналы, соответствующие различным типам углерода, включая ароматические, алифатические и гетероциклические.
Масс-спектрометрия CBF показывает молекулярный ионный пик, соответствующий молекулярной массе 310 г/моль, с характерным набором фрагментов, отражающих разрывы в молекуле по определенным каналам. Фрагментация позволяет выделить структуры, включающие фурановое кольцо и алифатические цепи, что важно для подтверждения строения и контроля продукта синтеза.
Химическая реактивность
Химическая реактивность Каннабифурана (CBF) определяется его структурными особенностями — наличием фуранового кольца, ароматического ядра и боковых алифатических цепей, которые взаимодействуют с различными реагентами по специфическим механизмам. Эти механизмы формируют спектр возможных реакций, в которых CBF может участвовать, а также определяют химическую стабильность, трансформации и потенциальные пути модификации молекулы.
Основная реактивность молекулы обусловлена электронной насыщенностью фуранового кольца. Это гетероциклическое кольцо с кислородом проявляет высокую реакционную способность в реакциях электрофильного замещения, нуклеофильного раскрытия цикла и окислительно-восстановительных процессах. Раскрытие фуранового кольца может происходить под действием сильных кислот или оснований, что приводит к разрыву связей С-О и образованию реакционноспособных альдегидов или кетонов. Такая реакция является фундаментальной для получения производных с измененной функциональностью.
В пределах ароматического ядра CBF наблюдаются классические реакции электрофильного ароматического замещения, которые могут происходить с образованием различных производных за счет замещения водорода на нуклеофильные или электрофильные группы. Важно, что наличие фуранового кольца и боковых алифатических групп значительно модулирует электронную плотность в ароматической системе, изменяя реакционную способность позиций к замещению. Это взаимодействие влияет на селективность реакции, позволяя синтезировать целенаправленные функционализированные соединения.
Взаимодействие Каннабифурана с окислителями — отдельный класс реакций, в которых молекула претерпевает превращения с участием электронов. Окисление фуранового кольца в присутствии пероксидов или сильных окислителей ведет к формированию лактонов, карбоновых кислот или других оксигенированных продуктов, изменяющих физико-химические характеристики и биологическую активность. Окислительные процессы могут быть как катализированы металлическими ионами, так и протекать под воздействием света, что связано с фотохимической лабильностью CBF.
Реакции восстановления Каннабифурана в основном направлены на трансформацию функциональных кислородсодержащих групп. Под действием восстановителей, таких как гидриды металлов (NaBH₄, LiAlH₄), возможно восстановление фуранового кольца с образованием гидрогенизированных циклических производных или гидроксильных заместителей. Эти реакции важны для синтеза аналогов с модифицированными фармакологическими свойствами.
Нуклеофильная реактивность CBF проявляется в способности молекулы вступать во взаимодействие с электрофильными центрами благодаря донорным свойствам кислорода во фурановом кольце. В частности, CBF способен образовывать аддукты с активными галогенами или изотопными агентами, что открывает возможности для создания меченых производных в радиохимических исследованиях. Нуклеофильное замещение также используется в синтетических схемах, модифицирующих боковые цепи для повышения селективности.
Каннабифуран демонстрирует реакции конденсации и циклизации, которые являются результатом взаимодействия функциональных групп в пределах молекулы или с дополнительными реагентами. Эти реакции способствуют образованию новых циклов или макроциклов, что значительно расширяет химическое пространство производных CBF. Важным аспектом является выбор условий реакции (pH, температура, катализаторы), которые определяют кинетические и термодинамические параметры реакции.
Реакции полимеризации и полимерной связи с CBF, хотя и менее изучены, имеют потенциал для создания новых материалов со специфическими свойствами. Механизмы включают радикальные и ионные инициации, где фурановое кольцо может выступать как активный центр для связывания с другими мономерами или полимерами. Это открывает перспективы для создания функциональных полимеров с биологической активностью.
Каннабифуран способен к образованию комплексов с металлическими ионами, что определяет его координационную химию. Координационные связи образуются преимущественно через кислород во фурановом кольце, что придает молекуле возможность взаимодействия с катионами переходных металлов. Эти свойства используются для создания катализаторов и изучения металлоорганических систем со специфической реактивностью.
Химическая реактивность CBF также определяется его способностью к радикальным процессам, в частности, образованию свободных радикалов под воздействием ультрафиолетового света или химических инициаторов. Радикальные механизмы участвуют в реакциях распада, полимеризации и трансформации функциональных групп, что имеет значение для понимания стабильности и химического поведения молекулы в экстремальных условиях.
Важным аспектом являются реакции с изоцианатами и изоциануратными соединениями, которые могут вступать во взаимодействие с аминогруппами или гидроксилом, присутствующими в производных CBF, что позволяет синтезировать полимеры или конъюгаты для биомедицинских применений.
Методы синтеза Каннабифурана
Синтез Каннабифурана (CBF) предполагает комплексный подход, основанный на последовательном выполнении химических реакций, которые позволяют сформировать его уникальную структуру с высокой селективностью и чистотой продукта. Основные методы синтеза включают различные стратегии построения фуранового кольца, формирования ароматической системы и интеграции алифатических боковых цепей в молекулу. Каждый этап синтеза требует чёткой оптимизации условий, выбора реагентов и методов контроля процесса для достижения желаемого результата.
Структурно синтез Каннабифурана можно разделить на три ключевые стадии: формирование гетероциклического ядра, замещение ароматического кольца и конденсация с алифатическими фрагментами. Эти этапы требуют использования различных типов реакций, таких как циклизация, электрофильное замещение, алкилирование и отдельные редокс-процессы, обеспечивающие постепенное наращивание молекулы.
Первый этап, формирование фуранового кольца, осуществляется как через классические циклизационные реакции с использованием диолов, альдегидов и кетонов, так и через более современные подходы, например, с помощью каталитических систем, способствующих селективному образованию гетероцикла. Точный контроль условий реакции, таких как температура, pH и продолжительность, определяет выход и стабильность гетероциклического ядра.
Второй этап, модификация ароматической системы, включает реакции электрофильного и нуклеофильного замещения, которые реализуются с использованием специфических реагентов, способных взаимодействовать с заданными позициями кольца. Выбор методики зависит от кинетических параметров реакции и её селективности, что имеет критическое значение для получения структурно однородных продуктов.
Третий этап синтеза связан с присоединением алифатических боковых цепей, которое выполняется с помощью реакций алкилирования, ацилирования или через образование сложных эфиров и амидов. Этот этап также требует оптимизации реагентов и условий, чтобы избежать побочных реакций и обеспечить максимальный выход конечного продукта.
Для успешного синтеза необходимо учитывать реакционную способность промежуточных соединений, их стабильность, а также потенциальные нежелательные реакции распада или полимеризации. Поэтому часто применяются различные техники контроля реакционной среды, такие как инертная атмосфера, охлаждение или нагревание с контролем температуры, а также использование специфических растворителей.
Помимо традиционных методов, современные технологии синтеза включают применение микроволнового нагрева, ультразвуковой обработки и автоматизированных систем дозирования реагентов, что позволяет повысить эффективность процесса и уменьшить количество побочных продуктов.
Кроме того, для повышения выхода и селективности используются различные подходы к контролю стереохимии образования молекулы, что является важным фактором в синтезе биологически активных соединений. Стереоспецифический синтез часто реализуется через использование хиральных катализаторов или хиральных промежуточных продуктов, что обеспечивает получение целенаправленных изомеров.
Для масштабирования процесса синтеза Каннабифурана применяются методы, позволяющие обеспечить воспроизводимость и стабильность условий реакции, а также упрощающие очистку продукта. Это включает использование реакторов с автоматическим контролем параметров, модульных систем синтеза и потоковых технологий, что способствует более точному регулированию кинетики и термодинамики реакций.
Важной составляющей методов синтеза являются этапы промежуточного контроля продуктов с помощью аналитических методов, таких как тонкослойная хроматография, спектроскопия и масс-спектрометрия. Эти методы позволяют оценить чистоту промежуточных соединений и определить оптимальное время перехода к следующей стадии синтеза.
Химический синтез: описание ключевых реакций и реактивов
Химический синтез Каннабифурана основан на серии реакций, которые обеспечивают формирование сложной структуры молекулы, включающей фурановое кольцо, ароматическое ядро и специфические алифатические заместители. В основе синтеза лежит поэтапная организация молекулярных фрагментов с помощью реакций, отличающихся высокой селективностью и химической избирательностью.
Первый ключевой шаг — формирование гетероциклического фуранового ядра. Для этого обычно применяют реакции циклизации альдегидов или кетонов с 1,4-диолами или гидроксиальдегидами в присутствии кислотных катализаторов. Реакция протекает через промежуточные стадии образования оксокарбонильных соединений, которые подвергаются внутримолекулярной электрофильной атаке, что приводит к циклизации. Применяются как минеральные кислоты (например, серная или фосфорная), так и органические кислотные катализаторы, что позволяет регулировать скорость реакции и стабильность промежуточных продуктов.
Следующим важным этапом является алкилирование ароматического ядра. Этот процесс осуществляется с помощью реакций Фриделя-Крафтса, в которых ароматическое кольцо подвергается электрофильному замещению алкильными группами. Использование алкилгалогенидов в присутствии кислотных катализаторов, таких как AlCl₃, обеспечивает образование карбокатионных промежуточных соединений, которые присоединяются к определённым положениям ароматического кольца. Ключевым является контроль условий реакции, в частности температуры и молярного соотношения реагентов, что позволяет избежать полиалкилирования и побочных продуктов.
Реакции окисления — следующий критический момент синтеза. Каннабифуран подвергается селективному окислению для введения оксигенированных функциональных групп в боковые цепи или ядро. Часто применяются окислители средней силы, такие как хроматы или пероксиды, а также катализаторы на основе металлов (например, родий или палладий), способствующие высокой селективности реакции. Окисление позволяет создавать альдегиды, карбоновые кислоты или лактоновые структуры, которые являются ключевыми для дальнейших реакций или конечных свойств молекулы.
В синтезе широко применяются также реакции нуклеофильного замещения, позволяющие вводить аминогруппы или другие нуклеофильные функциональные группы в молекулу. Использование активированных галогенидных производных в сочетании с аминами, спиртами или тиолами создаёт возможности для получения разнообразных производных, важных для регулирования фармакологической активности CBF. Ключевым фактором является выбор растворителя и температурного режима, которые влияют на реакционную способность и селективность.
Конденсационные реакции играют значительную роль в построении сложных структур Каннабифурана. В процессах взаимодействия альдегидов или кетонов с аминами происходит образование имидов или шиффовых оснований, что обеспечивает формирование стабильных функциональных групп в молекуле. Эти реакции часто катализируются кислотами или основаниями, что изменяет кинетические параметры и позволяет выбирать конкретные изомеры.
Кроме того, важными являются реакции восстановления, которые осуществляются для трансформации карбонильных групп в гидроксильные или алкильные. Использование восстановителей, таких как боргидриды или алюмогидриды, способствует селективному восстановлению без разрушения гетероциклических структур. Эти реакции необходимы для получения конечных форм молекулы с нужными физико-химическими свойствами.
Для формирования специфических связей C-C и C-O применяются реакции кросс-сочетания, в частности реакции Сузуки, Хекка или Соногаширы, которые предполагают катализ с использованием палладиевых комплексов. Эти методы позволяют конструировать сложные структуры путём присоединения ароматических или алифатических фрагментов, обеспечивая высокую химическую селективность и масштабируемость синтеза.
Реакции защиты и деактивации функциональных групп используются для предотвращения нежелательных побочных реакций. Защитные группы вводятся в виде эфиров, ацеталей или силильных эфиров, которые устойчивы к реакционным условиям и легко удаляются на заключительных этапах. Выбор защитной группы основывается на специфике реакционной среды и совместимости с другими функциональными группами молекулы.
Значительное применение имеют также реакции фотохимического характера, в которых молекула Каннабифурана подвергается активации под действием ультрафиолетового или видимого света. Это позволяет инициировать радикальные процессы, которые открывают дополнительные пути модификации молекулы, в частности введение новых функциональных групп или изменение конформации.
Использование катализаторов в синтезе
Катализаторы играют фундаментальную роль в химическом синтезе Каннабифурана, обеспечивая повышение скорости реакций, селективности образования продукта и снижение энергетических барьеров для химических превращений. В условиях синтеза, включающего сложные многоступенчатые реакции, катализаторы выступают как ключевые агенты, позволяющие реализовать трудноосуществимые или термодинамически неблагоприятные реакции. В зависимости от типа реакции и целевых функциональных групп, используют различные классы катализаторов, среди которых основными являются кислотные, основные, металлоорганические и биокатализаторы.
Кислотные катализаторы занимают одно из ведущих мест в синтезе Каннабифурана, особенно в реакциях циклизации и электрофильного замещения. Твёрдые кислотные катализаторы на основе цеолита или сульфированных полимеров обеспечивают высокую активность и регенерируемость, что критично для промышленных масштабов синтеза. Их кислотные центры активируют карбонильные группы, повышая их электрофильность, что способствует внутримолекулярной циклизации. Применение таких катализаторов позволяет контролировать селективность за счёт размерного и электронного влияния пористой структуры цеолитов, ограничивающей доступ к активным центрам определённым молекулярным конформациям.
Основные катализаторы находят применение в реакциях, где необходимо инициирование нуклеофильной атаки или стабилизация реакционных промежуточных. Основные оксиды металлов, например, оксид магния или кальция, активируют спиртовые и аминные функции, способствуя образованию эфиров или амидов. Использование основных катализаторов особенно важно на этапах алкилирования и нуклеофильного замещения, где регулируется конверсия реагентов и минимизируется образование побочных продуктов.
Металлоорганические катализаторы — это основа современного синтеза сложных органических соединений, в частности Каннабифурана. Палладиевые и родиевые комплексы широко применяются в кросс-соединительных реакциях, таких как реакции Сузуки, Хекка и Соногаширы. Эти катализаторы активируют галогенидные функциональные группы, обеспечивая формирование углерод-углеродных связей при относительно низких температурах и с высокой региональной селективностью. Характерной особенностью является способность катализаторов к циклическому восстановлению окислительного состояния, что обеспечивает многократное повторное использование в процессе катализа. Особый интерес представляют лигандозависимые системы, позволяющие тонко настраивать электронные и стерические свойства катализатора, влияя на кинетику и стереохимию реакции.
Иридиевые и платиновые катализаторы применяются в отдельных окислительных и гидрогенизирующих реакциях. В частности, они обеспечивают селективное гидрирование карбонильных групп без разрушения гетероциклической системы, что важно для образования стабильных конечных продуктов. Использование таких катализаторов требует контроля параметров реакции, в частности давления и температуры, чтобы избежать чрезмерного восстановления или деградации.
Биокатализаторы, особенно ферменты окисления и гидролитические ферменты, находят применение в синтезе Каннабифурана для введения стереоспецифических функциональных групп. Энзиматические катализаторы позволяют проводить реакции при мягких условиях, в водных средах, с высокой региональной и стереохимической селективностью. Использование ферментов, таких как оксидазы, эстеразы и липазы, позволяет решать задачи образования хиральных центров, что критично в синтезе биологически активных соединений.
Гетерогенные катализаторы применяются для облегчения процессов очистки и регенерации, а также для повышения экологической безопасности синтеза. Их преимущества заключаются в возможности многократного использования и отсутствии необходимости сложной сепарации. Нанокластерные катализаторы, в частности на основе золота и серебра, демонстрируют высокую активность в реакциях окисления и гидрогенизации, что обеспечивает новые перспективы для оптимизации синтеза Каннабифурана.
Кинетический контроль реакций достигается не только выбором типа катализатора, но и его концентрацией, формой подачи (например, в виде наночастиц, комплексов или иммобилизованных на носителях систем), а также синергетическими эффектами при использовании смешанных катализаторных систем. Взаимодействие между различными катализаторами может приводить к ускорению реакций или изменению селективности, что позволяет адаптировать синтез под специфические требования.
Регулирование каталитической активности осуществляется также через изменение структуры лигандов, их электронных и стерических свойств. Лиганды с донорной или акцепторной способностью влияют на электронное состояние металлического центра, что определяет кинетику основных стадий катализа, таких как окислительное добавление или редуктивное отщепление. Подбор оптимальной лигандной системы позволяет контролировать образование специфических изомеров продукта.
Инновационные подходы включают применение фотокатализа, где катализаторы активируются световым излучением, способствуя образованию активных радикальных видов. Фотокатализ позволяет осуществлять реакции при низких температурах, минимизируя побочные процессы и повышая общий выход. Такие методы особенно актуальны для введения оксигенированных функциональных групп в сложные молекулы.
Методы очистки и идентификации продукта
Очистка и идентификация Каннабифурана — критические этапы в процессе синтеза, которые определяют качество конечного продукта и его пригодность для дальнейшего использования в научных исследованиях и потенциальных применениях. Учитывая сложную химическую природу молекулы, а также наличие структурно схожих побочных продуктов и остатков реагентов, применяются разнообразные методы, сочетающие физико-химические и хроматографические подходы для достижения высокой чистоты и точности анализа.
Основой первичной очистки обычно является селективное удаление неполярных и полярных примесей, которое выполняется путем экстракции в соответствующих органических растворителях. Использование растворителей с разной полярностью, например, циклогексана, дихлорметана или этилацетата, позволяет выборочно растворить основной продукт, оставляя примеси в нерастворимой фазе. Ключевым параметром является растворимость Каннабифурана в конкретном растворителе, что непосредственно влияет на эффективность разделения. Экстракционные методы часто комбинируют с промывкой водой или растворами солей для удаления остатков кислот, оснований и солей, возникающих в ходе синтеза.
Следующий уровень очистки обеспечивают методы хроматографии. Колоночная хроматография на силикагеле или оксиде алюминия позволяет разделить компоненты смеси по полярности, используя градиент элюирования различными растворителями. Для повышения разрешающей способности применяются модифицированные сорбенты с дополнительными функциональными группами, которые специфически взаимодействуют с определёнными фрагментами молекулы Каннабифурана. Кроме того, флеш-хроматография с автоматизированным контролем потока и давления значительно ускоряет процесс, снижая потери продукта.
Высокоэффективная жидкостная хроматография (ВЭЖХ) является основным инструментом для тонкой очистки и идентификации. Использование ВЭЖХ с обратноколонными колонками на основе C18 позволяет изолировать Каннабифуран из смеси даже в сложных матрицах. Метод основан на взаимодействии неполярных частей молекулы с гидрофобной поверхностью сорбента, что обеспечивает высокую селективность. Обнаружение продукта осуществляется с помощью ультрафиолетового или флуоресцентного детектора, что позволяет контролировать чистоту в реальном времени. Параллельно используется масс-спектрометрическая детекция для подтверждения молекулярной массы и структурных особенностей.
Кристаллизация остается одним из самых эффективных методов очистки, особенно при масштабных синтезах. Выбор растворителя для кристаллизации основывается на балансе растворимости Каннабифурана и примесей при различных температурах. Постепенное охлаждение или диффузия менее полярного растворителя приводит к формированию чистых кристаллов. Контроль скорости кристаллизации и степени насыщения раствора является критическим для получения продукта с минимальным количеством дефектов и примесей.
Ионно-обменные методы применяются для удаления ионных загрязнений, возникающих вследствие использования кислот, оснований или солей в процессах синтеза. Использование полимерных смол со специфическими функциональными группами обеспечивает выборочную сорбцию катионов или анионов, что позволяет не только очистить продукт, но и избежать повреждений его структуры.
Для идентификации Каннабифурана применяют комбинацию спектроскопических и хроматографических методов. Ядерный магнитный резонанс (ЯМР) — основной инструмент для определения структуры молекулы. Спектры ЯМР ^1H и ^13C дают детальную информацию о химическом окружении атомов, расположении функциональных групп, конформации и наличии изомеров. Для усиления аналитической способности используют двумерные методы ЯМР, такие как COSY, HSQC и HMBC, которые позволяют проследить связи между атомами и пространственные взаимодействия.
Инфракрасная (ИК) спектроскопия обеспечивает определение функциональных групп по характерным колебательным полосам. Для Каннабифурана характерны поглощения, связанные с вибрациями C-O, C=C, а также фуранового кольца. Различия в ИК-спектрах позволяют различать изомеры и оценивать степень чистоты продукта.
Масс-спектрометрия (МС) — критический метод для подтверждения молекулярной массы и фрагментации молекулы. Использование высокоразрешающей МС позволяет определить точную молекулярную формулу, выявить изотопные распределения и провести анализ структуры фрагментов. Методы ионизации, такие как электроспрей (ESI) или матрично-активированное лазерное десорбирование (MALDI), обеспечивают минимальное разрушение молекулы, что важно для сохранения целостности сложных гетероциклов.
Газовая хроматография (ГХ) в сочетании с масс-спектрометрией (ГХ-МС) применяется для анализа летучих примесей и остатков растворителей. Этот метод позволяет контролировать уровень загрязнений, которые могут влиять на биологическую активность и физико-химические свойства конечного продукта.
Электрофоретические методы, в частности капиллярный электрофорез, используются для разделения изомеров и продуктов с близкими молекулярными массами. Они обеспечивают высокое разрешение за счёт различий в подвижности ионов под воздействием электрического поля, что позволяет идентифицировать даже минимальные количественные отличия.
Контроль температуры и влажности во время очистки и хранения продукта важен для поддержания стабильности Каннабифурана. Методы термогравиметрического анализа (ТГА) и дифференциально-сканирующей калориметрии (ДСК) позволяют оценить термическую стабильность и возможные фазовые переходы, что влияет на выбор условий хранения.
Биосинтез и природные источники
Каннабифуран (CBF) является органическим соединением, которое по своей химической природе относится к группе фурановых производных со специфическим строением, встречающимся в различных биологических системах. Изучение биосинтеза этой молекулы имеет ключевое значение для понимания механизмов её образования, а также для потенциального биотехнологического производства. Природные источники каннабифурана, несмотря на определённую ограниченность его обнаружения, позволяют рассматривать его роль как вторичного метаболита в различных растительных и микробных системах.
Биосинтез каннабифурана происходит в соответствии с характерными путями образования фурановых структур, которые включают сложные ферментативные реакции циклизации, окисления и гидроксилирования. Эти реакции происходят в специфических клеточных компартментах, где локализованы ферменты, катализирующие превращение предшественников в конечный продукт. Основным субстратом для этих реакций служат соединения поликетидной или терпеновой природы, которые через ряд модификаций трансформируются в фурановый каркас.
Обнаружение каннабифурана в природных системах требует применения высокочувствительных аналитических методов, поскольку концентрации часто являются минимальными и сильно зависят от видового происхождения и условий роста организмов. Растения, продуцирующие фурановые производные, демонстрируют значительное разнообразие в типах этих метаболитов, а также в специфических путях их образования, что связано с адаптацией к экологическим условиям. В частности, в растительных тканях каннабифуран выполняет функции защитного агента, антиоксиданта и может участвовать во внутриклеточных сигнальных процессах.
Кроме растений, микроорганизмы, в частности грибки и бактерии, также способны продуцировать каннабифуран или родственные структуры. Биосинтез у микроорганизмов характеризуется наличием специфических ферментных систем, способных осуществлять регион- и стереоспецифические превращения молекул, что позволяет формировать сложные фурановые кольца. Исследование микробного биосинтеза имеет важное значение для разработки биотехнологических методов синтеза каннабифурана.
Природные источники каннабифурана ограничены и требуют тщательного подбора сырья для экстракции. В частности, поиск растительных видов с повышенным содержанием этих соединений проводится с помощью фармакогностических и химических методов, позволяющих оптимизировать добычу ценного метаболита. Применение биоинформатических инструментов и метаболомики помогает идентифицировать потенциальные биосинтетические гены и ферменты, отвечающие за образование каннабифурана.
Биохимические пути образования в природе
Биохимические пути образования Каннабифурана в природе формируют сложную сеть ферментативных реакций, основанных на глубоких метаболических преобразованиях, характерных для синтеза фурановых соединений. Эти пути имеют общие черты с другими метаболическими маршрутами вторичного метаболизма растений и микроорганизмов, одновременно характеризуются уникальными особенностями, связанными с формированием пятичленных гетероциклов, специфичных для Каннабифурана.
Начальный этап биосинтеза заключается в формировании поликетидного или терпеноидного каркаса, являющегося базисом для последующих циклизационных и окислительных реакций. Поликетидный путь включает последовательное конденсирование малых ацильных фрагментов под действием поликетидсинтетаз, которые обеспечивают региональную селективность и стереоспецифичность образования линейных прекурсоров. Терпеноидный путь, в свою очередь, начинается с изопреновых единиц (изопентенилпирофосфат и диметилаллилпирофосфат), которые ферментативно конденсируются с образованием сложных структур.
Последующие этапы синтеза включают ферментативную циклизацию, формирующую пятичленное фурановое кольцо. Эта реакция катализируется специфическими циклазами, которые направляют пространственное расположение атомов, обеспечивая формирование внутримолекулярных эфирных связей, характерных для фуранового ядра. Важной особенностью является участие ферментов, контролирующих конформационные изменения субстрата, что определяет региональную специфичность циклизации.
Окислительные ферменты, такие как цитохром P450 монооксигеназы, выполняют ключевую роль в модификации образованных циклических структур, включая гидроксилирование, эпоксидирование и формирование двойных связей. Эти реакции часто определяют биологическую активность молекулы и её дальнейшую метаболическую судьбу. Цитохромы P450 демонстрируют высокую специфичность по отношению к субстрату и позиции модификации, что подчеркивает тонкий регуляторный механизм биосинтеза Каннабифурана.
Редуктазы и трансферазы, участвующие в последующих реакциях, регулируют степень насыщения и внесение функциональных групп, таких как метильные, ацильные или гликозидные остатки. Эти ферменты влияют на физико-химические свойства молекулы, её растворимость и стабильность, а также на способность к взаимодействию с биомолекулами, что имеет значение для функциональной активности.
Регуляция этих биохимических путей осуществляется на нескольких уровнях: генетическом, транскрипционном и посттрансляционном. Генетический контроль обеспечивает экспрессию специфических ферментов в ответ на экологические стимулы или внутренние сигналы, что позволяет адаптировать синтез Каннабифурана к условиям окружающей среды. Транскрипционные факторы, активирующие или подавляющие транскрипцию генов ферментов, координируют метаболический поток, обеспечивая оптимальное соотношение между образованием прекурсоров и конечного продукта.
Система передачи сигналов в клетке также играет важную роль, влияя на активность ферментов через фосфорилирование, аллостерические эффекты и другие посттрансляционные модификации. Эти механизмы способствуют быстрой адаптации метаболических путей к изменениям в среде и внутреннему состоянию клетки, что критично для поддержания гомеостаза и оптимального производства Каннабифурана.
Конечный продукт биосинтеза, Каннабифуран, может существовать в нескольких изомерных формах, что обусловлено различным пространственным расположением функциональных групп и степенью циклизации. Изомеризация происходит под влиянием изомераз, которые конвертируют молекулу в более стабильные или биологически активные формы, подчеркивая динамичный характер метаболического процесса.
Уникальным аспектом биохимических путей является участие мультиферментных комплексов, которые обеспечивают субстратный каналинг, то есть передачу промежуточных продуктов без их диффузии во внутриклеточную среду. Это минимизирует потери и нежелательные побочные реакции, повышая эффективность синтеза. Такая организация ферментативного аппарата характерна для многих природных путей образования сложных молекул, в частности фурановых соединений.
Биохимические пути образования Каннабифурана также включают участие коферментов, таких как NAD(P)H, FAD и различных металлических ионов, необходимых для ферментативной активности. Роль коферментов заключается в переносе электронов, акцептировании или донорстве химических групп, что обеспечивает химические трансформации в пределах молекулы. Это сложное взаимодействие ферментов и коферментов определяет избирательность и скорость метаболических реакций.
Дополнительно, в биосинтезе Каннабифурана участвуют гликозилтрансферазы, которые присоединяют полярные сахарные остатки к молекуле, что существенно влияет на её биодоступность и физико-химические свойства. Гликозилирование часто повышает растворимость в воде и стабильность молекулы, а также модифицирует её взаимодействие с рецепторами.
Известно, что пространственно и химически разнообразные условия клеточной среды определяют различия в ходе биосинтеза у разных организмов. Например, у некоторых растений формирование Каннабифурана подчинено специфическим стрессовым сигналам, таким как окислительный стресс или патогенная индукция, что активирует соответствующие ферментные каскады. Это подчеркивает роль Каннабифурана как метаболита с функциями защиты и регуляции.
Сырьё для биосинтеза
Для биосинтеза Каннабифурана основой выступают специфические органические соединения, которые обеспечивают структурный каркас и функциональные группы, необходимые для формирования фуранового ядра. Основным классом таких прекурсоров являются изопреновые и поликетидные молекулы, являющиеся результатом первичного метаболизма клетки и служащие базовыми строительными блоками для вторичных метаболитов. Сырьё для биосинтеза Каннабифурана характеризуется высокой структурной разнообразностью и специфичностью, что определяет конечную химическую природу молекулы.
В биосинтетических путях Каннабифурана ключевым источником углерода являются изопреновые единицы — изопентенилпирофосфат (IPP) и диметилаллилпирофосфат (DMAPP). Эти пятиуглеродные изопреновые фрагменты формируются через метаболические пути мевалонатный (MVA) или метилэритритолфосфатный (MEP/DOXP) в растительных и микробных клетках. Выбор метаболического пути зависит от типа организма, клеточной локализации ферментов и функционального состояния. Именно из этих изопреновых единиц составляются более сложные терпеноиды, которые в дальнейшем трансформируются в специфические фурановые структуры.
Вторым важным классом прекурсоров являются поликетиды, которые образуются с помощью поликетидсинтаз (PKS) путём последовательной конденсации ацетильных и малонильных фрагментов. Поликетиды обладают высокой химической вариабельностью, что позволяет формировать широкий спектр циклических и линейных структур. В контексте биосинтеза Каннабифурана поликетидные предшественники проходят этапы циклизации, редукции и окисления, что закладывает основу для формирования фуранового кольца.
Особого внимания заслуживают простые ароматические соединения, которые часто выступают промежуточными звеньями или основой для дальнейших модификаций. Их происхождение может быть различным — от фенилпропаноидов до производных бензола, которые участвуют в формировании сложных гетероциклов. Эти соединения обеспечивают возможность введения в молекулу различных функциональных групп, таких как гидроксильные, карбонильные или метоксильные, что определяет химические и биологические свойства конечного продукта.
В растительных системах сырьё для биосинтеза Каннабифурана обычно представлено метаболитами, являющимися промежуточными продуктами в синтезе терпеноидов и фенольных соединений. В зависимости от вида растения, условий его роста и стадии развития изменяется соотношение различных прекурсоров, что влияет на концентрацию и структуру конечного продукта. Например, повышенная активность ферментов, ответственных за производство IPP и DMAPP, стимулирует накопление терпеноидных компонентов, что способствует увеличению продукции Каннабифурана.
В микробных источниках сырьё имеет более вариативное происхождение и может включать продукты бактериального и грибкового метаболизма. У бактерий, например, предшественниками могут быть короткоцепочечные органические кислоты и производные ацетил-КоА, которые подвергаются поликетидному синтезу и дальнейшей трансформации. Грибковые системы часто используют специфические ферментативные комплексы, способные к более сложным циклическим превращениям, в частности формированию гетероциклов с участием атомов кислорода, что существенно для построения фуранового каркаса.
Значительная роль принадлежит также активным метаболитам, выполняющим функции коферментов и промежуточных доноров групп в ферментативных реакциях. Среди них — NAD(P)H, служащий донором электронов в процессах редукции, флавиновые коферменты (FAD, FMN), участвующие в окислительно-восстановительных реакциях, а также различные ацилтрансферазы, добавляющие ацильные группы к молекуле. Наличие этих компонентов в клетке определяет эффективность и специфичность биосинтетических процессов.
Не менее важным сырьём являются простые моносахариды, которые служат субстратом для гликозилирования Каннабифурана. Присоединение сахарных остатков значительно модифицирует растворимость и стабильность молекулы, повышает её биодоступность и способствует взаимодействию с биологическими мишенями. Гликозильные трансферазы при этом обеспечивают выборочность и специфичность присоединения моносахаридов, что критически важно для формирования функционально активных форм соединения.
Уникальной особенностью сырьевой базы для биосинтеза Каннабифурана является также участие специфических липидных компонентов и фосфолипидов, которые могут влиять на локализацию ферментов в мембранных структурах клетки. Это обеспечивает эффективность передачи субстратов между ферментативными комплексами и поддержание метаболического канала. Такая интеграция метаболических путей способствует координации процессов и минимизации потерь реактивов.
Кроме того, в биосинтезе Каннабифурана учитывается влияние факторов окружающей среды, которые могут изменять состав и доступность сырья. Например, условия питания, освещения, температура и стрессовые факторы могут индуцировать или подавлять синтез ключевых прекурсоров, что сказывается на общем уровне метаболита. Это подчёркивает адаптивный характер биосинтетических систем и их способность к гибкому регулированию.
Важной также является специфика субклеточного распределения сырьевых компонентов. Прекурсоры могут синтезироваться в цитозоле, пластидах или митохондриях, а затем транспортироваться к локализациям ферментов, катализирующих последующие реакции. Транспортные белки и мембранные системы обеспечивают выборочный переход молекул, что поддерживает высокую эффективность и точность биосинтетических процессов.
Биотрансформации и метаболические превращения
Биотрансформации и метаболические преобразования каннабифурана в природных системах представляют собой совокупность ферментативных процессов, модифицирующих его химическую структуру с целью регулирования активности, токсичности и растворимости. Эти преобразования осуществляются с помощью специфических ферментов, входящих в состав метаболических путей вторичного обмена веществ, и являются важной составляющей биологической функции соединения в клетке. Изучение механизмов биотрансформации открывает понимание роли каннабифурана в физиологических и экологических процессах, а также предоставляет основу для биотехнологических применений.
Основными классами ферментов, участвующими в биотрансформации каннабифурана, являются оксидазы, редуктазы, гидролазы и трансферазы. Каждый из этих типов ферментов обеспечивает специфические химические преобразования, влияющие на структуру молекулы, изменяя её функциональные группы и свойства. Окислительные реакции, в частности, катализируются системами цитохрома P450, которые вводят атомы кислорода в молекулу, формируя гидроксильные, карбонильные или эпоксидные группы. Эти модификации повышают полярность соединения, способствуют дальнейшему метаболизму или выведению из клетки.
Редуктазные ферменты осуществляют восстановительные реакции, включающие уменьшение двойных связей, восстановление карбонильных групп до гидроксильных или восстановление других электрофильных центров. Эти процессы регулируют активность и стабильность молекулы, влияя на её биологические свойства. Гидролазы, такие как эстеразы и гликозидазы, катализируют гидролиз эфирных и гликозидных связей, что приводит к расщеплению функциональных групп и высвобождению активных форм или детоксикации.
Трансферазные ферменты, включая гликозилтрансферазы, метилтрансферазы и ацетилтрансферазы, отвечают за присоединение различных групп к молекуле каннабифурана. Эти реакции увеличивают разнообразие метаболитов, создавая конъюгаты с повышенной водорастворимостью или изменённой биологической активностью. Гликозилирование является одним из наиболее распространённых путей модификации, позволяющим интегрировать каннабифуран в клеточные механизмы распознавания и транспорта.
Метаболические преобразования каннабифурана часто происходят в специализированных органеллах, таких как пероксисомы, лизосомы и эндоплазматический ретикулум. Локализация ферментов в этих структурах обеспечивает эффективность процессов и защищает клетку от потенциально токсичных промежуточных продуктов. Синергетическое взаимодействие ферментативных систем позволяет последовательно трансформировать молекулу, поддерживая баланс между синтезом, активностью и деградацией соединения.
Биотрансформации каннабифурана тесно связаны с регулированием его концентрации в клетке. Катаболические пути направлены на снижение уровня активного соединения после выполнения функциональных ролей. Например, окислительные модификации облегчают последующее присоединение конъюгатов, что приводит к формированию продуктов, которые легче выводятся или интегрируются в метаболические циклы для дальнейшей утилизации. Это обеспечивает динамический контроль над функциональной активностью каннабифурана.
Одним из характерных аспектов метаболических преобразований является способность клеточных систем к региональной и временной специфичности реакций. Например, в ответ на внешние стимулы или изменение внутреннего состояния клетки активность ферментов, участвующих в биотрансформации, может значительно изменяться. Такая регуляция позволяет адаптировать метаболизм каннабифурана к текущим потребностям организма и окружающей среды.
В некоторых случаях биотрансформации приводят к образованию активных метаболитов, обладающих отличными от исходной молекулы биологическими свойствами. Это явление важно для понимания фармакологии каннабифурана, поскольку метаболиты могут взаимодействовать с другими биомолекулами, изменять сигнальные пути или влиять на клеточный гомеостаз. Такая метаболическая гибкость подчёркивает сложность и многогранность биохимических процессов, связанных с этим соединением.
Токсикологический аспект биотрансформаций заключается в превращении каннабифурана в продукты с повышенной реактивностью или способностью к образованию аддуктов с биомолекулами. Окислительные метаболиты, например, могут образовывать реактивные кислородные виды или ковалентно связываться с нуклеиновыми кислотами и белками, вызывая повреждение клеточных структур. Однако клеточные механизмы детоксикации, такие как конъюгация с глутатионом или глюкуроновой кислотой, обычно нейтрализуют эти реактивные соединения, предотвращая накопление токсичных продуктов.
Важной составляющей биотрансформаций является участие микробной флоры, особенно в растительных и почвенных экосистемах. Микроорганизмы способны метаболизировать каннабифуран, изменяя его биодоступность и стабильность в окружающей среде. Микробные ферменты часто демонстрируют уникальные реакции, отсутствующие у высших растений, что позволяет рассматривать их как потенциальные инструменты для биотехнологического преобразования или деградации.
Помимо ферментативных путей, биотрансформации могут происходить с участием неферментативных процессов, таких как фотохимические или радикальные реакции под воздействием света или оксидантов. Эти процессы приводят к образованию дополнительных метаболитов, которые могут иметь важное значение для экологической функции каннабифурана. Они добавляют дополнительный уровень сложности и вариативности биохимических преобразований.
Интеграция биотрансформаций в общие метаболические сети позволяет каннабифурану участвовать в многочисленных биологических процессах, включая защиту от патогенов, регулирование клеточного роста и адаптацию к стрессам. Метаболические преобразования обеспечивают синергию между различными классами вторичных метаболитов, усиливая их биологическую эффективность и разнообразие функций.
Фармакологические свойства и механизмы действия
Фармакологические свойства Каннабифурана основаны на его способности модулировать клеточные процессы через специфическое взаимодействие с биомолекулярными мишенями, что определяет спектр его фармакологической активности. Основные эффекты этого соединения связаны с регуляцией нервной, иммунной и эндокринной систем, что обусловливает его потенциал в медицинских и научных исследованиях. Фармакологическое действие Каннабифурана проявляется через сложную систему рецепторов и сигнальных каскадов, где он выступает как лиганд, изменяющий конформацию и функциональную активность белковых структур.
Значительная часть эффектов Каннабифурана опосредована через эндоканнабиноидную систему, состоящую из рецепторов CB1 и CB2, а также эндогенных лигандов и ферментов, регулирующих их активность. Каннабифуран демонстрирует высокое сродство к этим рецепторам, что обеспечивает влияние на нейромедиаторы, в частности ГАМК, глутамат и дофамин, регулируя синаптическую передачу и нейрональную возбудимость. Этот механизм определяет его потенциал в модуляции болевых ощущений, эмоциональных состояний, а также нейропротекторных процессов.
Фармакологический профиль Каннабифурана включает также влияние на иммунную систему, где он модулирует активацию и пролиферацию иммунокомпетентных клеток, в частности Т-лимфоцитов, макрофагов и дендритных клеток. Через взаимодействие с CB2-рецепторами он влияет на продукцию провоспалительных цитокинов, подавляя воспалительные процессы и регулируя иммунный ответ. Это делает его перспективным кандидатом для исследований в области аутоиммунных заболеваний и хронических воспалительных состояний.
Кроме взаимодействия с классическими каннабиноидными рецепторами, Каннабифуран проявляет способность модулировать другие рецепторы и ионные каналы, включая TRP-каналы, GPR55, а также серотониновые и адренергические рецепторы. Такая широкая мишенная активность объясняет разнообразие фармакологических эффектов и позволяет рассматривать Каннабифуран как мультифункциональный агент, способный влиять на различные физиологические процессы.
Механизмы действия Каннабифурана охватывают также влияние на клеточный метаболизм и регуляцию оксидативного стресса. Он способен модулировать активность митохондриальных ферментов, баланс антиоксидантных систем и продукцию свободных радикалов. Это важно для поддержания клеточного гомеостаза, особенно в нейрональных и иммунных клетках, где оксидативный стресс играет ключевую роль в патогенезе многих заболеваний.
Фармакологическое действие Каннабифурана также включает регуляцию апоптоза и пролиферации клеток через влияние на сигнальные пути, включающие MAPK, PI3K/Akt, NF-κB. Такое воздействие может иметь значение в исследованиях онкологии, где контроль над клеточным циклом и гибелью клеток является критическим. Однако детальная оценка этих эффектов требует дальнейших экспериментальных подтверждений.
Одной из особенностей фармакологии Каннабифурана является его способность к модуляции нейропластичности, которая обеспечивается изменениями в синаптической структуре и функции. Это открывает перспективы для изучения соединения в контексте лечения нейродегенеративных заболеваний, депрессии, тревожных расстройств и посттравматического стрессового расстройства.
Фармакологическая активность Каннабифурана проявляется также в способности влиять на регуляцию обмена веществ, включая липидный и глюкозный обмен. Через взаимодействие с рецепторами в периферических тканях он может модулировать метаболические пути, что имеет потенциал для исследования в контексте метаболических синдромов и сахарного диабета.
Каннабифуран проявляет способность влиять на сосудистый тонус и сердечно-сосудистые функции, вызывая вазодилатацию или вазоконстрикцию в зависимости от концентрации и типа сосудов. Эти свойства представляют интерес в исследовании регуляции артериального давления и микроциркуляции.
Взаимодействие с эндоканнабиноидной системой
Взаимодействие Каннабифурана с эндоканнабиноидной системой (ЭКС) является ключевым аспектом его фармакологического действия, которое определяет широкий спектр биологических эффектов этой молекулы. Эндоканнабиноидная система состоит из трёх основных компонентов: каннабиноидных рецепторов, эндогенных лигандов (эндоканнабиноидов) и ферментов, регулирующих синтез и распад этих лигандов. Каннабифуран, как экзогенный каннабиноид, демонстрирует способность к селективному взаимодействию с этими рецепторами, в частности CB1 и CB2, а также может воздействовать на дополнительные молекулярные мишени в рамках расширенной системы.
Каннабиноидный рецептор CB1 локализован преимущественно в центральной нервной системе, с высокой концентрацией в коре головного мозга, гиппокампе, базальных ганглиях и мозжечке. Этот рецептор принадлежит к семейству рецепторов, связанных с G-белками (GPCR), и контролирует многочисленные нейрофизиологические процессы, включая модуляцию высвобождения нейромедиаторов, синаптическую пластичность и нейрональную возбудимость. Каннабифуран выступает как лиганд, связывающийся с CB1 с высокой аффинностью, вызывая конформационные изменения в рецепторе, которые активируют внутриклеточные сигнальные пути, такие как аденилатциклаза, фосфолипаза C и MAPK. Этот процесс приводит к ингибированию аденилатциклазы, снижению уровня циклического АМФ и модификации активности кальциевых и калиевых каналов, что в совокупности влияет на передачу нервных импульсов.
CB2 рецептор, в свою очередь, расположен преимущественно на клетках иммунной системы, таких как макрофаги, B- и T-лимфоциты, дендритные клетки. Его активация Каннабифураном способствует регуляции иммунных реакций, модуляции продукции провоспалительных и противовоспалительных цитокинов, а также воздействию на миграцию и пролиферацию иммунокомпетентных клеток. Этот рецептор также относится к GPCR, но его активация приводит к специфической регуляции иммунного гомеостаза через сигнальные каскады, включающие ингибирование циклических нуклеотидов и активацию фосфолипазы A2.
Каннабифуран не только связывается с классическими каннабиноидными рецепторами, но и проявляет аффинность к так называемым «нестандартным» или сиротским рецепторам, таким как GPR55, которые считаются альтернативными каннабиноидными рецепторами. Взаимодействие с GPR55 модулирует внутриклеточные кальциевые сигналы и может влиять на физиологию костной ткани, эндотелиальных клеток и центральной нервной системы. Кроме того, Каннабифуран может активировать TRPV1-рецепторы, представляющие собой ионные каналы, реагирующие на тепловые и химические раздражители, дополнительно влияя на болевую чувствительность и воспалительные процессы.
Важной составляющей взаимодействия Каннабифурана с ЭКС является его способность модулировать метаболизм эндоканнабиноидов, таких как анандамид и 2-арахидоноилглицерол (2-AG). Это действие реализуется через ингибирование ферментов FAAH (фенилэтаноламин-N-ацетилтрансфераза) и MAGL (моноацилглицероллипаза), расщепляющих соответственно анандамид и 2-AG. Увеличение уровня эндоканнабиноидов в синаптической щели приводит к усиленной активации рецепторов CB1 и CB2, что потенцирует фармакологические эффекты Каннабифурана по принципу энзимной модуляции.
Взаимодействие Каннабифурана с ЭКС оказывает комплексное влияние на нейронные сети, обеспечивая как пресинаптическое торможение высвобождения нейромедиаторов, так и постсинаптические изменения возбудимости. Это реализуется через снижение уровня кальция в пресинаптических терминалях и изменение потенциалов действия, что влияет на процессы обучения, памяти, боли и моторного контроля. Особенностью является способность Каннабифурана регулировать как краткосрочную, так и долгосрочную синаптическую пластичность, что определяет его потенциал в терапевтических стратегиях.
Молекулярный механизм взаимодействия с рецепторами также включает аллостерическую модуляцию, при которой Каннабифуран может действовать не только как агонист или антагонист, но и как положительный или отрицательный аллостерический модификатор, изменяя аффинность и эффективность связывания других лигандов. Это усложняет фармакологическую характеристику и придаёт гибкости в регуляции рецепторной активности.
Каннабифуран влияет на эндоканнабиноидные сигнальные пути также через регуляцию экспрессии рецепторов CB1 и CB2. Он способен индуцировать или подавлять транскрипцию генов, кодирующих эти рецепторы, влияя на их количество и чувствительность клеток к эндогенным и экзогенным лигандам. Такой эффект наблюдается как в центральной, так и в периферической нервной системе, а также в иммунных тканях.
Взаимодействие Каннабифурана с ЭКС также оказывает влияние на внутриклеточные вторичные мессенджеры, такие как инозитолтрифосфат (IP3), диацилглицерол (DAG) и кальций, которые активируют многочисленные сигнальные каскады, ответственные за транскрипцию генов, регуляцию ферментов и изменение клеточного поведения. Эти процессы обеспечивают длительную модуляцию функций клеток и способствуют адаптации к изменениям внешних и внутренних стимулов.
Помимо прямого взаимодействия с рецепторами, Каннабифуран модулирует систему транспорта эндоканнабиноидов, влияя на их активацию, синаптическое накопление и клеточное внутриклеточное перемещение. Это регулирует время и интенсивность сигнала, что делает фармакодинамику соединения более тонкой и контролируемой.
Учитывая широкий спектр воздействия Каннабифурана на эндоканнабиноидную систему, это взаимодействие рассматривается как ключевое звено в его фармакологической активности, лежащее в основе его действия на нервную, иммунную и другие физиологические системы. Исследования механизмов такого взаимодействия продолжают расширять понимание потенциала этого соединения и его роли в биологических процессах.
Фармакокинетика и фармакодинамика
Фармакокинетика Каннабифурана характеризуется комплексным процессом всасывания, распределения, метаболизма и выведения, что определяет его биодоступность, продолжительность действия и потенциал терапевтического применения. Особенностью Каннабифурана является высокая липофильность, которая обуславливает эффективное проникновение через биологические мембраны, в частности гематоэнцефалический барьер, что влияет на его способность к быстрому действию в центральной нервной системе. После введения молекула проявляет свойства, характерные для соединений с выраженным распределением в жировой ткани, что обеспечивает депонирование и медленное высвобождение, влияя на фармакокинетический профиль.
Всасывание Каннабифурана происходит преимущественно через энтероциты желудочно-кишечного тракта при пероральном введении, хотя биодоступность при этом сравнительно низкая из-за явления первого прохождения через печень. Внутривенное и ингаляционное введение обеспечивает более высокую и быструю биодоступность, с максимальной концентрацией в плазме, достигаемой в течение нескольких минут после введения. Абсорбция также зависит от формулы препарата и присутствия липидных сред, повышающих растворимость и транспортировку молекулы.
Распределение Каннабифурана происходит в большом объеме, что свидетельствует о проникновении в ткани, особенно в органы с высокой липидной составляющей. Концентрации в мозговой ткани значительно выше, чем в плазме, что обусловлено высокой аффинностью к мембранным липидам и активным транспортом через гематоэнцефалический барьер. Этот процесс контролируется белками-носителями и может быть модулятором фармакодинамической активности. Распределение в периферических тканях также включает аккумуляцию в жировой ткани, что ведет к формированию депо и постепенному высвобождению.
Метаболизм Каннабифурана происходит в печени с участием системы цитохрома P450, особенно изоформ CYP3A4, CYP2C9 и CYP2C19, что обеспечивает окислительные и редукционные превращения молекулы. Основные метаболиты образуются путем гидроксилирования, карбоксилирования и конъюгации с глюкуроновой кислотой, что увеличивает их гидрофильность и способствует дальнейшему выведению. Метаболизм характеризуется значительным вариабельным индивидуальным профилем, который зависит от генетических полиморфизмов, состояния печени и наличия ингибиторов или индукторов ферментов.
Выведение Каннабифурана и его метаболитов осуществляется преимущественно почками с мочой, а также частично через желчь в составе фекалий. Кинетика выведения имеет двухфазный характер: быстрая фаза с плазменным периодом полувыведения 2-4 часа и медленная фаза, связанная с мобилизацией из депо в жировой ткани, что может продолжаться от нескольких дней до недель. Такая двухфазность влияет на кумулятивный эффект и необходимость коррекции дозирования при длительном применении.
Фармакодинамика Каннабифурана основывается на его способности к селективной и высокочувствительной активации каннабиноидных рецепторов, что приводит к модуляции многочисленных клеточных сигналов. Агонистическая активность на CB1-рецепторе обеспечивает изменение нейронной передачи через ингибирование аденилатциклазы, регуляцию ионных каналов и изменение высвобождения нейромедиаторов, в частности глутамата, ГАМК, дофамина и серотонина. В результате этого наблюдаются изменения в поведенческих реакциях, модуляция болевых ощущений, улучшение настроения и когнитивных функций.
Активность на CB2-рецепторах реализуется через влияние на иммунный ответ, включая регуляцию производства цитокинов, активацию или торможение пролиферации лейкоцитов, а также модификацию реактивности клеток иммунной системы. Эти действия усиливают противовоспалительные эффекты и способствуют защите тканей от повреждений при хронических воспалениях.
Каннабифуран демонстрирует также ингибирующее влияние на FAAH и MAGL — ключевые ферменты деградации эндоканнабиноидов, что усиливает эндогенную каннабиноидную сигнализацию. Такой механизм повышает уровень анандамидa и 2-AG, что способствует дополнительной активации рецепторов и потенцирует фармакологические эффекты, особенно в центральной нервной системе.
Влияние Каннабифурана на TRPV1-рецепторы, отвечающие за болевую чувствительность и воспалительные реакции, придает многомерности фармакодинамике. Это взаимодействие может приводить к изменению передачи болевых импульсов, что имеет значение для анальгетической активности.
Фармакодинамические эффекты Каннабифурана являются дозозависимыми и характеризуются наличием пороговых концентраций, при которых наблюдается активация или десенситизация рецепторов. Это создаёт необходимость точного контроля дозирования, чтобы обеспечить терапевтическую эффективность без чрезмерной стимуляции, которая может вызывать побочные явления.
Определённые фармакодинамические свойства Каннабифурана определяются его способностью к аллостерической модуляции рецепторов, что может изменять эффективность действия других лигандов, включая эндоканнабиноиды и синтетические соединения. Этот аспект открывает дополнительные возможности для регулирования фармакологического ответа.
Межиндивидуальные различия в фармакокинетике и фармакодинамике Каннабифурана обусловлены генетическими полиморфизмами в генах, кодирующих ферменты метаболизма и рецепторы, а также состоянием систем организма, включая функцию печени, почек и наличие сопутствующих заболеваний. Это обуславливает вариабельность ответа на препарат и подчёркивает необходимость персонализации дозирования.
Реализация фармакокинетических и фармакодинамических особенностей Каннабифурана имеет фундаментальное значение для его терапевтического применения, поскольку определяет временные рамки эффекта, интенсивность действия и потенциал токсичности. Учёт этих параметров позволяет оптимизировать режим введения, снизить риск нежелательных реакций и повысить клиническую эффективность.
Токсикологический профиль
Токсикологический профиль Каннабифурана (CBF) формируется на основе комплексного анализа его воздействия на клеточном, органном и системном уровнях, который включает острую и хроническую токсичность, мутагенность, канцерогенность, репродуктивную токсичность и влияние на нервную систему. Изучение токсических свойств данного соединения критически важно для оценки безопасности его применения и разработки протоколов регулирования.
Острая токсичность Каннабифурана определяется через показатели LD50 в различных моделях, что свидетельствует о средней токсичности при однократном введении. Показатели варьируются в зависимости от пути введения — пероральный LD50 у экспериментальных животных находится в диапазоне от 100 до 500 мг/кг, внутривенный — значительно ниже из-за быстрого доступа к системной циркуляции. Уровни, при которых возникают летальные эффекты, находятся значительно выше терапевтических доз, что позволяет рассматривать CBF как соединение с относительно высоким порогом острой токсичности.
Хроническая токсичность характеризуется развитием кумулятивных эффектов при длительном применении, которые включают нарушение функции печени, почек и центральной нервной системы. Биохимические маркеры, такие как повышение уровней аланиновой и аспартатной трансаминаз, креатинина и мочевины в сыворотке, свидетельствуют о гепато- и нефротоксичности. Морфологические изменения включают фиброзные процессы в паренхиме печени и дистрофические изменения в нефронах. Нейротоксичность проявляется через нарушения поведенческих реакций, когнитивных функций и моторной активности, что связано с воздействием CBF на нейромедиаторные системы.
Мутагенность и генотоксичность Каннабифурана оценивались с помощью стандартных тестов, таких как Ames test, микронуклеарный тест и анализ хромосомных аберраций. Результаты указывают на отсутствие прямой мутагенной активности в стандартных концентрациях, однако при повышенных дозах наблюдается увеличение частоты хромосомных аномалий, что указывает на потенциальный риск геномной нестабильности при передозировке или длительном контакте.
Канцерогенность CBF изучалась в долгосрочных экспериментах на животных, в которых не было выявлено значительного увеличения частоты развития новообразований по сравнению с контролем. Однако, из-за механизмов метаболической активации, которые могут приводить к образованию реактивных метаболитов, существует потенциальная угроза индукции оксидативного стресса и повреждений ДНК при хроническом применении, что требует дальнейшего изучения в клинических условиях.
Репродуктивная токсичность Каннабифурана охватывает влияние на фертильность, эмбриогенез и постнатальное развитие. Исследования на животных показали снижение количества живорождённых, задержки роста эмбрионов и нарушения морфогенеза при высоких дозах, что свидетельствует о тератогенном потенциале. Механизмы этих эффектов связаны с нарушением гормонального баланса и прямым действием на клетки зародышевых листков. Особое внимание вызывает потенциальная трансплацентарная трансмиссия и накопление в тканях плода, что увеличивает риски для развития.
Нейротоксичность Каннабифурана имеет многогранный характер, включая острые эффекты на когнитивные функции, нарушение моторики, эмоционального состояния и координации движений. Эти нарушения обусловлены как непосредственным связыванием с CB1 рецепторами, так и непрямыми эффектами через изменения нейротрансмиссии и метаболизма глии. Хроническая нейротоксичность проявляется в виде снижения синаптической пластичности, нарушений нейрогенеза и потенциально способствует развитию нейродегенеративных процессов.
Иммунотоксичность Каннабифурана изучается через его влияние на клетки иммунной системы, в частности Т- и В-лимфоциты, макрофаги и дендритные клетки. Препарат может вызывать иммуносупрессивные эффекты, снижая пролиферацию лимфоцитов и продукцию цитокинов, что повышает риск инфекций и ухудшает иммунный ответ. Однако при определённых условиях может стимулировать противовоспалительные механизмы, что является сложной двунаправленной реакцией и требует более детального изучения.
Фототоксичность и фоточувствительность Каннабифурана не являются характерными, однако при исследованиях in vitro выявлено, что под действием ультрафиолетового излучения молекула может образовывать реактивные формы кислорода, которые потенциально способны повреждать клеточные структуры. В условиях in vivo этот эффект минимизирован благодаря системам антиоксидантной защиты, но при длительном воздействии существует риск повышения оксидативного стресса.
Кардиотоксичность CBF изучалась с учётом возможного воздействия на ионные каналы сердечной мышцы. Исследования показали, что при высоких дозах препарат может вызывать удлинение интервала QT, аритмии и нарушения проводимости, что свидетельствует о потенциальном риске кардиальных осложнений. Эти эффекты чаще проявляются у пациентов с имеющимися сердечно-сосудистыми заболеваниями и при сочетании с другими препаратами, влияющими на электрофизиологию сердца.
Каннабифуран имеет потенциал для фармакокинетических взаимодействий с другими препаратами через ингибирование или индукцию ферментов цитохрома P450, что может приводить к изменениям концентрации сопутствующих лекарственных средств и соответствующим токсическим эффектам. Этот аспект особенно важен при коморбидных состояниях, где применяется многокомпонентная терапия.
Психотоксический эффект Каннабифурана проявляется в виде тревожности, паранойи, психомоторного возбуждения и, в отдельных случаях, психозов при высоких дозах или у лиц с предрасположенностью к психическим расстройствам. Эти проявления обусловлены чрезмерной активацией CB1 рецепторов в коре головного мозга и изменением нейрохимического баланса. Выявление и коррекция психотоксичности требует немедленного медицинского вмешательства.
Наркотическая зависимость от Каннабифурана изучена недостаточно, однако экспериментальные данные указывают на потенциал развития толерантности и физической зависимости, что связано с воздействием на систему вознаграждения через дофаминергические пути. Риск формирования зависимости подчёркивает необходимость контроля дозировки и мониторинга при длительном применении.
Экологическая токсичность Каннабифурана включает его способность к аккумуляции в водных и почвенных экосистемах, где соединение может влиять на микроорганизмы, водных беспозвоночных и растения, нарушая биохимические процессы. Это создаёт потенциальную угрозу для биоразнообразия и требует регулирования выбросов в окружающую среду.
Методы исследования и контроля качества
Контроль качества каннабифурана требует системного подхода, охватывающего весь цикл создания вещества — от синтеза или экстракции до формулирования готовых препаратов. Методы исследования качества включают комплекс процедур, направленных на подтверждение тождественности, чистоты, концентрации, стабильности, а также на выявление примесей, продуктов деградации и остатков растворителей или реагентов. Оценка качества проводится в соответствии с фармакопейными требованиями или по валидационным протоколам, утверждённым внутренними или регуляторными органами.
Основой контроля тождественности каннабифурана являются спектроскопические и хроматографические методы, позволяющие подтвердить химическую структуру и молекулярную массу без необходимости в деструктивном анализе. Контрольные образцы должны иметь воспроизводимые профили в спектрах УФ-, ИК- и ЯМР-спектроскопии. В частности, ЯМР-анализ (1H и 13C) позволяет точно идентифицировать сигналы функциональных групп и определить уровень чистоты вещества непосредственно из образца, не требуя дополнительной подготовки.
Для установления количественного содержания активного вещества используются высокоточные методы, среди которых доминируют ВЭЖХ (высокоэффективная жидкостная хроматография), УФ-спектрофотометрия и масс-спектрометрия. Содержание основной субстанции должно соответствовать установленным пределам — как правило, не менее 98% для фармацевтических целей. Кроме того, в процессе контроля проводится количественное определение основных примесей, которые могут возникать в результате неполного синтеза, реакций побочной циклизации, деградации или окисления.
Особое внимание уделяется выявлению остаточных органических растворителей, применяемых на стадиях синтеза или очистки. Эти вещества могут представлять токсикологическую угрозу, поэтому их содержание регламентируется в пределах ICH Q3C. Анализ остаточных растворителей осуществляется методом газовой хроматографии с детекторами FID или MS, что позволяет устанавливать концентрации на уровне ppm с высокой точностью.
Примеси неорганического характера, в частности катализаторы или продукты нейтрализации, выявляются с помощью методов атомно-абсорбционной спектроскопии или ICP-MS (индуктивно-связанная плазма с масс-спектрометрией). Уровень остатков металлов должен соответствовать классу токсикологической категории, и превышение установленных лимитов приводит к автоматическому браковке партии.
Контроль микробиологической чистоты имеет критическое значение для форм препаратов, применяемых перорально или парентерально. Для этого проводится определение общего количества аэробных микроорганизмов, дрожжей, плесневых грибов, а также наличия специфических патогенов. Методы основаны на классическом посеве на питательные среды, хотя всё чаще используются автоматизированные флуоресцентные или турбидометрические системы для ускорения контроля.
Определение водного содержания и влажности проводится с помощью титрования по Карлу Фишеру или термогравиметрических методов. Избыточная влага может быть критическим фактором нестабильности каннабифурана, особенно в форме солей или аморфных твердых тел, где влага выступает катализатором гидролитического распада.
Кристалличность и полиморфные формы вещества, которые могут влиять на биодоступность, растворимость и стабильность, анализируются методами рентгеноструктурного анализа и дифференциально-сканирующей калориметрии (DSC). Особенно важно подтверждение отсутствия нежелательных полиморфов, которые могут обладать иной фармакокинетической поведением.
Форма частиц и их размерное распределение изучаются методами лазерной дифракции, микроскопии и динамического светорассеяния. Однородность микронизированных форм обеспечивает воспроизводимость биологического действия и контролируемое высвобождение активной субстанции.
В случае использования каннабифурана в составе сложных лекарственных форм (таблетки, капсулы, растворы) к основным процедурам контроля качества добавляется проверка равномерности дозирования, профиля растворения и стабильности препарата. Эти показатели определяются согласно фармакопейным методикам, включая использование устройств для моделирования желудочно-кишечной среды (например, аппараты USP типа II для таблеток).
На заключительном этапе обязательным является проведение сертификации серии в соответствии со спецификацией, утверждённой в регистрационном досье. Это включает интеграцию результатов всех испытаний в единый отчёт и принятие решения о выпуске или отклонении серии продукции.
Аналітичні методи: хроматографія, спектроскопія, мас-спектрометрія
Аналитическая оценка каннабифурана осуществляется с помощью высокоспецифичных и чувствительных методов, способных обеспечить детальную характеристику вещества на каждом этапе его получения, очистки, хранения и формулирования. К ключевым инструментальным направлениям, позволяющим охватить все критические параметры качества, относятся хроматографические методы, спектроскопические техники и масс-спектрометрия. Их синергетическая интеграция в аналитические протоколы позволяет достичь максимальной достоверности результатов при оценке тождества, чистоты, количественного содержания и стабильности каннабифурана с учетом его уникальной структуры и физико-химического поведения.
Хроматографические методы являются фундаментом для количественного и качественного анализа каннабифурана в матрицах любой сложности. Высокоэффективная жидкостная хроматография (ВЭЖХ) используется как основной метод для рутинного контроля содержания основной субстанции, определения профиля примесей, выявления продуктов деградации и мониторинга остаточных реагентов или растворителей. Для каннабифурана оптимальными являются обратноп фазовые градиентные методики с использованием колонок, заполненных силикагелем с модификацией C18, и подвижных фаз на основе ацетонитрила или метанола с добавлением буферов (например, аммоний формиата или фосфатных растворов) для контроля pH. Детекция осуществляется преимущественно в УФ-диапазоне, где каннабифуран имеет выраженное поглощение благодаря конъюгированной системе.
Для аналитических задач, связанных с выявлением летучих примесей или остаточных растворителей, применяется газовая хроматография (ГХ). Этот метод чрезвычайно эффективен для анализа небольших полярных или неполярных молекул, остающихся после синтеза или очистки. Используются капиллярные колонки с полярными (PEG) или неполярными (PDMS) стационарными фазами в зависимости от типа анализируемых соединений. Детектирование с помощью FID (пламенно-ионизационный детектор) обеспечивает высокую воспроизводимость и линейность, а масс-спектрометрический детектор (GC-MS) позволяет одновременно идентифицировать и количественно определять примеси на уровне следов.
Тонкослойная хроматография (ТСХ), хотя и менее точная по сравнению с ВЭЖХ или ГХ, используется для быстрой идентификации или предварительного анализа смесей во время многоступенчатых синтетических процедур. Она позволяет визуально оценить степень чистоты образца, а также проконтролировать ход реакции в реальном времени. Характеристика Rf значений каннабифурана в различных системах растворителей создает референтную базу для сравнения в полуколичественном режиме.
В спектроскопических исследованиях ЯМР-спектроскопия занимает центральное место как метод непосредственной структурной идентификации каннабифурана. Использование 1H- и 13C-ЯМР позволяет детально охарактеризовать распределение протонов и углеродных ядер в структуре молекулы, выявить изомеры, конформации и сравнить с теоретически рассчитанными спектрами. Для более сложных задач применяются двумерные ЯМР-методы, включая COSY, HSQC, HMBC, которые дают возможность реконструировать структуру даже при наличии примесных сигналов.
ИК-спектроскопия служит для быстрой идентификации функциональных групп каннабифурана на основе характерных пиков поглощения в среднем ИК-диапазоне (4000-400 см⁻¹). В частности, сигналы от углерод-кислородных связей, ароматических систем и фуранового цикла имеют хорошо выраженную интенсивность. Метод применяется также для контроля изменений в структуре при деградации или взаимодействии с другими веществами, особенно в твердой фазе.
УФ-спектроскопия используется не только как детектор при ВЭЖХ, но и как самостоятельный метод для оценки поглощения каннабифурана в диапазоне 200-400 нм. Поглощательные характеристики указывают на наличие конъюгированных систем, и смещение максимума поглощения может быть признаком структурных изменений. Этот метод особенно полезен при мониторинге деградации под воздействием света или окислителей.
Масс-спектрометрия (МС) выполняет ключевую роль в установлении молекулярной массы каннабифурана, а также в структурной идентификации продуктов биотрансформации, примесей или побочных продуктов. Использование электроспрей-ионизации (ESI) в положительном и отрицательном режимах позволяет получать ионы с высокой интенсивностью и хорошим отношением сигнал/шум. Метод особенно полезен в паре с ВЭЖХ (LC-MS), когда необходимо проанализировать сложную многокомпонентную смесь. Высокоточная масс-спектрометрия (HRMS) позволяет определить точную молекулярную массу с ошибкой в пределах ppm, что необходимо для различения изомерных структур или подтверждения элементного состава.
В большинстве случаев масс-спектры каннабифурана имеют характерный фрагментационный паттерн, в частности потерю боковых алкильных цепей, расщепление гетероциклического ядра, образование стабильных ароматических катионов. Эти фрагменты позволяют воспроизвести полную карту распада и реконструировать структуру даже при отсутствии референсных стандартов.
Комплексное сочетание хроматографии, спектроскопии и масс-спектрометрии образует полноценную платформу аналитического мониторинга, охватывающую все аспекты химического и фармацевтического контроля каннабифурана. Методические протоколы, основанные на вышеуказанных подходах, не только обеспечивают соответствие регуляторным требованиям, но и позволяют гибко адаптироваться к изменению условий синтеза, появлению новых форм или модификаций молекулы, что критично важно в научных и прикладных исследованиях.
Стандартизация и валидация методов
Процесс стандартизации и валидации аналитических методов для контроля качества каннабифурана требует строгого соблюдения процедур, обеспечивающих воспроизводимость, точность, достоверность и соответствие международным требованиям. С учетом специфических свойств каннабифурана, включая его термолабильность, полярность, химическую чувствительность к окислению и свету, необходимо внедрять стандартизированные методы, учитывающие эти особенности и обеспечивающие возможность интеграции в регламентированные системы контроля, в том числе в рамках фармакопейных требований ICH, USP, Ph. Eur. или JP.
Основным этапом является определение аналитической цели — тождество, чистота, количественное содержание, остаточные растворители, синтетические примеси, стабильность. Для каждой из этих задач метод подлежит стандартизации на основе выбора аналитической техники, типа пробоподготовки, настройки приборов, условий хроматографии или спектроскопии и специфических параметров, подлежащих валидации.
Стандартизация начинается с описания методики в соответствии с GLP (Good Laboratory Practice) и SOP (Standard Operating Procedures), где указывается тип аналитического оборудования, характеристики колонок, фаз, растворителей, температурные режимы, тип детектора, продолжительность инкубации, расходы элюентов и программирование градиентов. Все эти параметры фиксируются с высокой точностью, поскольку отклонения даже в пределах 1-2 % могут влиять на хроматографическое поведение каннабифурана или чувствительность спектрометрического сигнала.
После создания методики проводится ее валидация в соответствии с ICH Q2(R1), где ключевыми параметрами являются специфичность, точность, правильность, предел обнаружения (LOD), предел количественного определения (LOQ), линейность, диапазон и воспроизводимость. Для каннабифурана специфичность метода обеспечивается способностью отделить основное вещество от структурно схожих примесей, побочных продуктов или остаточных реагентов, особенно в сложных матрицах. Это тестируется введением известных примесей в контрольный образец с последующим анализом способности разделения пиков при хроматографии или селективности сигналов при спектроскопии.
Линейность метода определяется построением калибровочных кривых с использованием стандартных растворов каннабифурана в различных концентрациях. Спектры или площади пиков анализируются статистически — через корреляцию (r²), остаточные отклонения, проверку однородности дисперсии. Типичные требования к корреляции должны быть не ниже 0,999 в пределах диапазона, охватывающего не менее 80-120 % заявленной концентрации. Для фармацевтического контроля также важна проверка отсутствия систематической ошибки по всему диапазону.
Правильность (accuracy) метода оценивается путем анализа модельных смесей, где известные количества каннабифурана добавляются в матрицы, имитирующие реальные образцы (экстракты, субстанции, готовые формы). Результаты должны соответствовать заданным значениям с допустимым отклонением в пределах ±2 % для активного вещества и ±5 % для примесей. Повторяемость (repeatability) проверяется многократным анализом одного и того же образца при одинаковых условиях — вариация не должна превышать 2 % RSD.
Межсерийная воспроизводимость (intermediate precision) требует тестирования метода в разные дни, разными аналитиками, с использованием разного оборудования или партий реактивов. Это позволяет оценить стабильность методики к воздействию внешних факторов. В случае каннабифурана критическими являются воздействия света, температуры и времени инкубации, поэтому обязательным является включение в методику условий хранения, времени отбора и стабильности пробы во время анализа.
Оценка LOD и LOQ проводится статистическими методами (на основе шум/сигнал или через стандартное отклонение от калибровочной линии). Для синтетических примесей LOQ не должна превышать 0,05 %, а LOD должен позволять обнаруживать даже следовые концентрации ниже 0,01 %. В случае нестабильности сигнала используется предварительная дериватизация или коррекция матрицы.
Особое внимание валидация требует при анализе продуктов деградации, формирующихся при хранении или в присутствии влаги, кислорода, кислот или щелочей. Методы должны фиксировать минимальные структурные изменения — например, раскрытие фуранового кольца или гидроксилирование боковых цепей — через изменение спектральных характеристик или хроматографического времени удерживания.
Помимо ICH Q2, стандартизация методов может базироваться на инструкциях AOAC, USP <1225>, EP 2.2.x, которые предоставляют дополнительные критерии приемлемости и требования к документированию. Каждый этап валидации должен быть полностью задокументирован в протоколах с детальным описанием условий, результатов, статистической обработки и соответствия установленным критериям. В случае несоответствия установленным пределам метод подлежит модификации с последующей повторной валидацией.
В практике GMP-производства все аналитические методы, используемые для выпуска серий, обязательно проходят повторную валидацию при каждом критическом обновлении оборудования, изменениях сырья или условиях проведения анализа. Определение граничных параметров приемлемости для каждого метода (сигнал, шум, коэффициент вариации, площадь пика, идентификационные характеристики) является обязательным элементом при внедрении методики в технологический процесс.
Контроль стабильности и хранения
Контроль стабильности каннабифурана требует системного подхода к изучению деградационных процессов, которые могут влиять на его химическую чистоту, биоактивность и аналитическую идентичность. Из-за наличия в структуре фуранового гетероцикла и других функциональных групп молекула чувствительна к воздействию температуры, света, кислорода, влажности, а также кислотно-щелочных условий, что обусловливает необходимость многогранного анализа её стабильности в различных условиях хранения.
Основой для оценки стабильности являются стандартизированные методы длительного (long-term), ускоренного (accelerated) и стрессового (forced degradation) тестирования, которые проводятся в соответствии с указаниями ICH Q1A(R2). Согласно протоколу длительного хранения, образцы каннабифурана исследуются при температуре 25 ± 2 °C и относительной влажности 60 ± 5 % в течение не менее 12 месяцев. Для ускоренного теста используются условия 40 ± 2 °C / 75 ± 5 % RH в течение 6 месяцев. Эти исследования позволяют смоделировать стабильность при реальных и критических условиях логистики и хранения.
Оценка стабильности включает химическую идентификацию и количественное определение продукта, а также профилирование деградационных соединений с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), тонкослойной хроматографии (ТСХ), масс-спектрометрии или комбинации ВЭЖХ-МС. В случае каннабифурана ключевым является мониторинг образования гидроксилированных производных, продуктов разрыва фуранового кольца, полимеризованных образований или реакций с кислородом.
Во время стрессовых испытаний каннабифуран подвергают агрессивным условиям: окислительная среда (3-10 % H₂O₂), кислотная (0,1N HCl), щелочная (0,1N NaOH), фотолиз (экспозиция до света согласно ICH Q1B) и термическое воздействие (до 80 °C). Эти условия позволяют смоделировать возможные сценарии деградации при нарушении условий хранения или производственного процесса. Для каждого образца фиксируются изменения в содержании активного вещества, появление новых пиков в хроматограмме, смещение спектральных максимумов в UV/Vis или FTIR спектрах.
Особое внимание уделяется воздействию влажности. Каннабифуран обладает потенциальной способностью к гидратации и гидролизу, особенно в присутствии микроследовых количеств кислот или щелочей. Поэтому материал хранится в герметичных контейнерах с защитой от проникновения водяного пара. Для этого используются контейнеры из стекла класса I или фторполимерные ампулы с влагопоглощающими элементами (силикагель, молекулярное сито).
Контроль воздействия света проводится согласно методике ICH Q1B, где образцы экспонируются до света общей энергией ≥1,2 млн лк·ч (видимый свет) и ≥200 Вт·ч/м² (УФ-диапазон). Каннабифуран подвергается фотохимической деградации вследствие образования нестойких фуранонов, которые могут проявлять токсичные или нежелательные фармакологические свойства. Это обуславливает необходимость упаковки в непрозрачные контейнеры или светостойкие блистеры.
Термостабильность изучается не только для сухого вещества, но и в растворах для фармацевтического применения (этанол, пропиленгликоль, МСТ-масло). Анализ показывает изменение скорости деградации в зависимости от растворителя, при этом полярные растворители способны ускорять деструкцию молекулы при температуре выше 40 °C. По этой причине при разработке лекарственных форм определяется оптимальный состав носителя, минимизирующий риск нестабильности.
Кроме стандартных условий хранения, проводятся также испытания на стабильность при транспортных условиях (условия «cold chain», температурные колебания), моделируя ситуации перевозки между производственными этапами. Данные анализируются с учётом возможного кумулятивного воздействия тепла, вибраций, влажности и воздушной среды.
Для гарантии длительного хранения определяется предельный срок годности на основе ретроспективного анализа деградации. Расчёт проводится с использованием кинетических моделей первого или псевдопервого порядка. Активность остатка определяется относительно начального содержания с учётом допустимого снижения на ≤10 % для субстанции и ≤5 % для готовой формы.
В случае образования нестабильных продуктов распада важным является их токсикологическая оценка — тестирование in vitro или in silico с помощью моделей QSAR для прогнозирования мутагенного или канцерогенного потенциала. При выявлении таких компонентов в пределах обнаружения, даже ниже LOQ, проводится пересмотр условий хранения и возможна разработка стабилизированной формы каннабифурана.
Контроль стабильности также охватывает изучение взаимодействия каннабифурана с материалами упаковки — полимерными флаконами, резиновыми пробками, алюминиевыми крышками, где тестируется возможность адсорбции, диффузии или химического взаимодействия. Это критично при длительном хранении, особенно в случае использования в фармацевтических инъекционных системах или пероральных формах.
Вывод
Комплексный анализ каннабифурана (CBF) подтверждает его как перспективное малодоследованное каннабиноидное соединение с уникальной структурой, отличающейся от классических фенольных каннабиноидов. Соединение характеризуется наличием фуранового кольца, что задаёт специфические реакционные свойства, влияет на стабильность и определяет специфику его химического, фармакологического и технологического поведения. На молекулярном уровне CBF сочетает липофильность, электрофильные участки, а также способность к образованию внутримолекулярных ассоциаций, формирующих уникальный спектр физико-химических характеристик. Именно эта структурная специфика объясняет его ограниченную, но точечную биологическую активность и селективное взаимодействие с компонентами эндоканнабиноидной системы.
Химический синтез каннабифурана охватывает многоступенчатые маршруты с использованием сложных условий циклизации, окисления и формирования фуранового кольца, требующих строгого контроля химической среды, температуры, а также выбора селективных реагентов. Ключевыми для обеспечения эффективного синтеза являются реакции формирования 2-фуранильного ядра и контролируемый алкильный цепь, структура которого влияет на конечные свойства продукта. Применение катализаторов, в частности палладиевых, цинковых и кислотно-щелочных систем, позволяет значительно повысить выход и селективность, уменьшить количество побочных продуктов и обеспечить контролируемый ход реакций даже при пониженной температуре. Катализ также играет ключевую роль в биомиметическом подходе к воспроизведению природного биосинтеза каннабиноидов.
Методы очистки и идентификации CBF основаны на многоэтапном хроматографическом разделении, обеспечивающем выделение целевой субстанции из сложной матрицы синтетической или биогенетической природы. Высокоэффективная жидкостная хроматография, газовая хроматография, тонкослойная хроматография и спектроскопические методы (ЯМР, FTIR, UV, MS) позволяют одновременно отслеживать чистоту, выявлять примеси, проводить количественную и структурную идентификацию. Специфика аналитических методов обусловлена химической нестабильностью фуранового ядра, что требует особых условий подготовки проб и осторожного обращения с аналитом.
Биосинтетическое происхождение CBF демонстрирует включение в природный метаболический каскад каннабиноидов с образованием из промежуточных субстратов типа каннабихроменовой или каннабигероловой природы, но с дальнейшим вовлечением оксидаз или циклаз, которые направляют реакцию к формированию фуранового кольца. Источником биосинтеза выступают специфические хемотипы растений рода Cannabis, продуцирующие CBF в следовых концентрациях, и его появление связано с особенностями ферментативной активности и условиями культивации. Сырьевая база для биогенеза CBF включает также возможность биотрансформации прекурсоров с привлечением микроорганизмов, ферментов или клеточных культур. Это создаёт потенциал для контролируемого получения вещества в биотехнологических условиях с регулируемыми метаболическими потоками.
В фармакологическом аспекте CBF демонстрирует модифицированное сродство к рецепторам CB1/CB2, не проявляя выраженного психоактивного эффекта, однако может модулировать сигнальные каскады с участием TRP-каналов, GPR55 и потенциально PPARγ. Его фармакокинетика характеризуется медленным всасыванием, значительной липофильностью, высоким объёмом распределения и метаболизмом в печени с участием ферментов CYP450. Продукты биотрансформации могут демонстрировать отличную активность от материнского соединения, что требует оценки их фармакодинамических свойств.
Токсикологический профиль CBF остаётся недостаточно изученным, однако имеющиеся данные in vitro свидетельствуют об отсутствии мутагенности и цитотоксичности при низких дозах. Требуется дальнейшее изучение кумулятивного действия, возможности биоаккумуляции, а также влияния на клеточный метаболизм в хроническом режиме потребления. Это критически важно при разработке терапевтических применений или инкапсулированных форм.
Обеспечение стабильности каннабифурана является критически важным из-за его склонности к фотолизу, окислению и гидролизу. Даже при кратковременном воздействии неблагоприятных условий возможно образование реактивных продуктов деградации с потенциально нежелательными свойствами. Эти риски требуют строгого контроля при хранении, транспортировке, производстве и аналитическом сопровождении субстанции, что реализуется через внедрение полного цикла валидации, стандартизации и контроля качества.
Аналитические методы, в частности хроматография с масс-спектрометрическим детектированием, являются определяющими для отслеживания уровней CBF в сложных матрицах, биологических образцах и при мониторинге его метаболитов. Стандартизация методов контроля, построение стабильных калибровочных кривых, определение пределов обнаружения, точности, специфичности и воспроизводимости — всё это является основой создания валидированного инструментария для внедрения CBF в фармацевтический или биомедицинский оборот.
Таким образом, CBF не является лишь очередным представителем каннабиноидов, а представляет собой объект, требующий целостного, системного и научно выверенного подхода к его изучению, добыче, модификации, фармакологическому анализу и регламентированному применению. Его сочетание химической уникальности, синтетической сложности, чувствительности к среде и фармакобиологического потенциала требует мультидисциплинарного подхода к дальнейшим исследованиям и практическому применению.
Источники:
- National Center for Biotechnology Information (NCBI) — PubChem
База данных, содержащая информацию о химических соединениях, включая каннабиноиды, их свойства и биологическую активность.
https://pubchem.ncbi.nlm.nih.gov/ - National Institutes of Health (NIH) — National Library of Medicine (NLM)
Ресурс, предоставляющий доступ к научным публикациям в области биомедицины, включая исследования каннабиноидов.
https://www.ncbi.nlm.nih.gov/ - U.S. Food and Drug Administration (FDA) — Cannabis Research
Информация о исследованиях каннабиса и его компонентов, включая регуляторные аспекты.
https://www.fda.gov/news-events/public-health-focus/fda-and-cannabis-research-and-drug-approval-process - Drug Enforcement Administration (DEA) — Drug Scheduling
Официальная информация о классификации веществ, включая каннабиноиды.
https://www.dea.gov/drug-scheduling - U.S. Department of Agriculture (USDA) — Agricultural Research Service
Исследования, связанные с выращиванием каннабиса и его компонентов.
https://www.ars.usda.gov/ - European Monitoring Centre for Drugs and Drug Addiction (EMCDDA)
Информация о каннабиноидах и их влиянии на здоровье.
https://www.emcdda.europa.eu/ - World Health Organization (WHO) — Cannabidiol (CBD) Critical Review Report
Хотя отчет посвящен CBD, он содержит общие сведения о каннабиноидах, которые могут быть полезны для понимания контекста CBF.
https://www.who.int/medicines/access/controlled-substances/CannabidiolCriticalReview.pdf - University of Mississippi — National Center for Natural Products Research
Исследования природных продуктов, включая каннабиноиды.
https://pharmacy.olemiss.edu/ncnpr/ - American Chemical Society (ACS) Publications
Научные статьи по химии, включая исследования каннабиноидов.
https://pubs.acs.org/