В структуре химического профиля Cannabis sativa L. долгое время центральное место занимали хорошо изученные фитоканнабиноиды, такие как Δ⁹-тетрагидроканнабинол (ТГК) и каннабидиол (КБД). В то же время многочисленные производные второго ряда, в том числе представители варинового подкласса, оставались на периферии научного внимания, в первую очередь из-за их низкой концентрации, трудностей с аналитической детекцией и отсутствия практического спроса. Только в последние годы, благодаря развитию высокоточной хромато-масс-спектрометрии и применению трансдисциплинарных подходов в фитохимии, началось постепенное осмысление фармакологического потенциала менее известных соединений. Среди них особое место занимает канабигероварин (CBGV) — структурный аналог каннабигерола (CBG), который отличается длиной боковой цепочки, а значит, и спектром биологической активности и фармакокинетики.
CBGV формально относится к группе пропиловых (вариновых) каннабиноидов, в которых пентиловая цепочка заменена на пропиловую. Это, с одной стороны, изменяет липофильность и способность к межмембранному транспорту, а с другой — влияет на конфигурацию взаимодействия с рецепторными системами, в том числе с каналами TRP, ядерными рецепторами PPAR и другими неконвенциональными мишенями. Несмотря на химическую схожесть с CBG, CBGV не является просто вариантом последнего — он демонстрирует свою собственную фармакодинамическую поведенческую модель, которая, по предварительным данным, может иметь более узкую специфичность действия и потенциально большую селективность в воспалительных, нейродегенеративных и метаболических процессах.
Уникальность CBGV обусловлена также его биосинтетическим происхождением. В природных популяциях конопли он образуется путём конденсации геранилдифосфата с дивариновой кислотой (а не олеановой, как в случае с CBG), что указывает на существование альтернативных метаболических ветвей во вторичном метаболизме каннабиса. Такой биогенетический путь часто ассоциируется с хемотипами, присущими диким или слабо селекционированным экотипам, и рассматривается как эволюционное наследие ранних метаболических адаптаций. В связи с этим, исследование CBGV имеет не только фармакологическое, но и фитогенетическое значение.
Несмотря на низкий уровень естественного содержания, интерес к CBGV растёт по нескольким причинам. Во-первых, его модифицированная структура позволяет создавать новые синтетические производные с целевыми фармакологическими свойствами. Во-вторых, предварительные данные доклинических исследований указывают на потенциал CBGV как модулятора боли, температуры, кожной чувствительности, а также в процессах кератинизации, что открывает перспективы для его использования в дерматологии. В-третьих, относительно слабое взаимодействие с рецепторами CB₁ снижает риск психоактивного эффекта, что имеет большое значение для разработки препаратов без центральных побочных эффектов.
Химическая природа и классификация CBGV
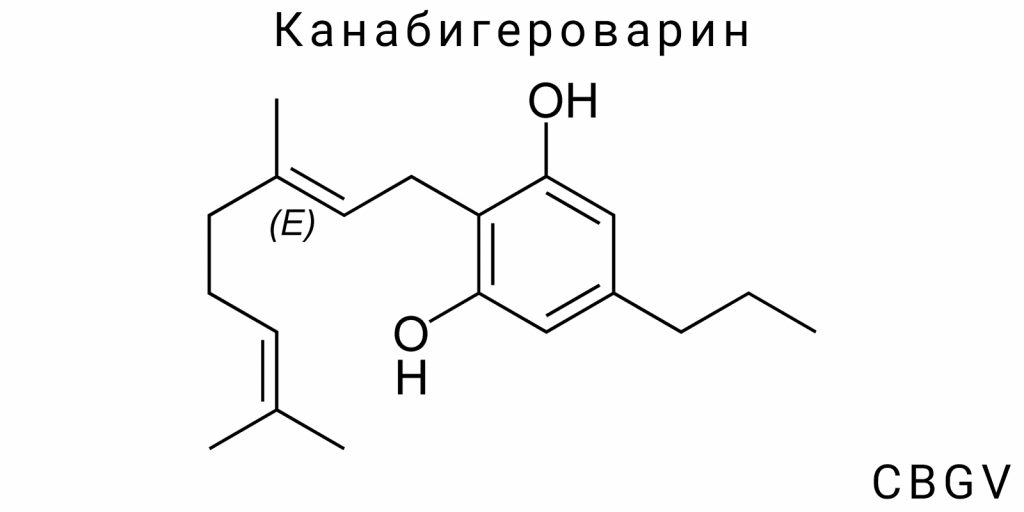
Структурная формула и отличия от CBG
Канабигероварин (CBGV) представляет собой специфическую химическую модификацию базовой молекулы каннабигерола (CBG), который относится к алкилированным фенольным терпеноидным каннабиноидам. Его главной структурной особенностью является наличие пропилового бокового радикала (–C₃H₇) вместо пентиловой (–C₅H₁₁) группы, характерной для канонических каннабиноидов первого ряда, таких как CBG, ТГК и КБД. Этот, на первый взгляд, незначительный структурный сдвиг вызывает существенные различия в химических, физико-химических и фармакологических свойствах соединения.
Структурно молекула CBGV имеет линейный углеродный скелет, включающий фенольное ядро, соединённое с терпеновой частью (гераниловая группа), и замещённое на третьей позиции пропиловой цепочкой. Этот пропиловый радикал является определяющим для вариновой серии фитоканнабиноидов. Его присутствие снижает молекулярную массу на 28,05 а.о.м. по сравнению с CBG (316,48 г/моль против 344,53 г/моль соответственно), что, в свою очередь, влияет на диффузионные свойства, способность проходить через липидные мембраны, а также изменяет поведение молекулы в биологических жидкостях.
Пропиловый радикал, имеющий более узкую пространственную конфигурацию, снижает гибкость периферийных векторов молекулы, что частично изменяет её конформационную подвижность. В частности, в водной среде CBGV имеет более высокую вероятность формирования компактных конформаций благодаря меньшей длине алкильного хвоста, в то время как CBG демонстрирует более раскрытую и изменчивую пространственную организацию. В молекулярной динамике это проявляется в изменённой способности к взаимодействию с гидрофобными карманами белковых мишеней — ферментов, рецепторов и ионных каналов. То есть на уровне рецепторного связывания, CBGV потенциально формирует другие (или менее продолжительные) типы взаимодействий с лиганд-связывающими участками, чем его пентиловый аналог.
Кроме того, меньшая длина алкильной цепочки CBGV снижает его растворимость в классических липидных фазах, однако улучшает параметры дисперсии в полярных растворителях, что имеет прикладное значение для разработки фармацевтических форм. Именно этот параметр критичен для нанокапсулированных систем доставки — CBGV проявляет большую стабильность в микроэмульсиях на основе полиэтиленгликоля, чем CBG, что обусловлено его меньшей липофильностью и сбалансированным профилем LogP.
В контексте электронной структуры стоит отметить, что смещение электронной плотности в боковой цепочке влияет на реакционную способность молекулы. CBGV демонстрирует большую химическую стойкость к окислению, в отличие от CBG, что связано с меньшим количеством реакционноспособных метиленовых групп. Это, в свою очередь, имеет последствия для стабильности соединения при хранении, а также при экстракции и аналитическом определении методом ВЭЖХ или масс-спектрометрии.
Фармакофорная группа CBGV также отражает характерные признаки монотерпеновых каннабиноидов, однако имеет специфические вариации в электростатическом потенциале. Молекулярное моделирование (например, с использованием методов DFT или MM-PBSA) демонстрирует иную топографию электронной плотности в областях терпенового ядра, что частично определяет изменённую аффинность к рецепторам TRPV1/4, GPR55 и ионным каналам TRPA1. Эти тонкие структурно-функциональные отличия являются ключевыми для интерпретации биологического действия CBGV, которое не является просто «ослабленной версией» CBG, а скорее — параллельной фармакологической сущностью с собственными мишенями и метаболическими путями.
Классификация среди фитоканнабиноидов
CBGV относится к узкой, но функционально важной серии вариновых каннабиноидов — подгруппе, которая характеризуется наличием пропиловых замещений в боковой цепи молекулы. Это не просто химическая категоризация, а глубоко биогенетически обоснованный класс соединений, который формируется в особых хемотипах растений с повышенной активностью специфической синтазной системы — диваринсинтазы, катализирующей образование дивариновой кислоты вместо привычной оливетовой.
В хемотаксономическом контексте вариновые соединения, такие как THCV, CBDV, CBCV и CBGV, отличаются неоднородным распространением среди культиваров Cannabis sativa. Их присутствие часто коррелирует с географическим происхождением популяций, особенно африканских, центральноазиатских и диких субсахарских форм, которые эволюционно адаптировались к более агрессивным экологическим условиям (высокая температура, дефицит влаги, высокое УФ-излучение). Предполагается, что вариновые каннабиноиды могли играть адаптивную роль в качестве модификаторов клеточного редокс-гомеостаза в условиях экологического стресса, что способствовало сохранению их биосинтетических путей в определённых популяциях.
CBGV, в отличие от более изученного THCV, не демонстрирует психоактивного действия, однако его вариновая природа позволяет ему входить в те же классы метаболитов, которые участвуют в регуляции обмена жиров, глюкозы, терморегуляции и кожного барьера. Его сходство с CBDV проявляется в общем метаболическом окружении: оба соединения обладают повышенной метаболической стабильностью в печени, демонстрируют способность пересекать гематоэнцефалический барьер без активации CB₁/CB₂ и взаимодействуют с теми же ферментными системами (например, UGT1A9, CYP3A4). Это объединяет их в отдельный метаболический подкласс, который имеет потенциал для разработки препаратов с низким профилем системной токсичности.
Вариновые каннабиноиды также демонстрируют сниженную аффинность к транспортным белкам семейства P-gp и OATP, что может быть важным для фармакокинетических свойств препаратов на основе таких соединений. Они характеризуются меньшим объемом распределения (Vd) и более коротким периодом полувыведения (t½), что повышает предсказуемость их действия в клиническом контексте.
Биогенез CBGV в Cannabis sativa L.
Химическое разнообразие каннабиноидов, присущее Cannabis sativa L., является результатом сложного взаимодействия генетических, ферментативных и субстратных факторов. Среди метаболитов варинового ряда CBGV (канабигероварин) выделяется тем, что он образуется не по каноническому пути биосинтеза CBGA, а по модифицированной метаболической ветви, использующей уникальные субстраты и специализированные ферменты. Биогенез CBGV иллюстрирует высокую степень пластичности изопреноидного пути в каннабисе, что позволяет растению адаптировать синтез вторичных метаболитов к микроэкологическим условиям и внутренней регуляции.
В отличие от CBG, который образуется через конденсацию геранилфосфата (GPP) с оливетовою кислотой, синтез CBGV предполагает использование дивариновой кислоты как стартового поликетидного субстрата. Эта кислота, сокращённый аналог оливетовой, имеет пропиловую боковую цепь вместо пентиловой, что определяет все дальнейшие структурные отличия и физико-химические свойства CBGV по сравнению с CBG. Генетическая дифференциация ферментов, катализирующих образование вариновых производных, в частности CBGA-варинсинтазы, обеспечивает селективность этого пути. Таким образом, биогенез CBGV — не незначительная вариация основного пути, а отдельная, эволюционно закреплённая метаболическая ветвь, которая демонстрирует уникальную биосинтетическую автономность.
Формирование дивариновой кислоты как прекурсора, вероятно, происходит в результате циклизации тетракетидной цепи, синтезируемой пентаноила-КоА и малонил-КоА, при этом вместо пентаноил-КоА в качестве стартовой единицы выступает пропаноил-КоА. Экспрессия соответствующего ацилтрансферазного комплекса, способного формировать именно пропиловый кетид, является ограничивающим этапом в продукции вариновых прекурсоров. Молекулярная масса дивариновой кислоты (~224 г/моль) на ~14 г/моль меньше, чем у оливетовой, что, несмотря на минимальную разницу, существенно влияет на дальнейшее взаимодействие с ферментами синтазы канабигеровой кислоты. Ферментативная селективность к этой кислоте обнаружена в специализированных варинсинтазах, которые функционально отличаются от CBGA-синтаз даже при близкой гомологии последовательностей.
Биосинтетическая конденсация GPP и дивариновой кислоты катализируется особым вариантом CBGA-синтазы — CBGA-варинсинтазой. Этот фермент не только демонстрирует субстратную специфичность, но и более высокую каталитическую константу для короткосвязанных поликетидов. В экспериментах in vitro было установлено, что реакция с дивариновой кислотой происходит быстрее за счёт меньшей энтропийной преграды, что обусловливает более эффективное образование CBGV в соответствующих хемотипах растения. Этот эффект поддерживается также вариациями аминокислот в активном центре синтазы, которые ориентируют субстрат на меньшем стерическом уровне. Возможно, эта ферментативная адаптация возникла в результате точечных мутаций в популяциях Cannabis sativa, которые подвергались эволюционному давлению (например, при росте в условиях высокого УФ-излучения или низкой доступности азота, что снижает потребность в длинноцепочечных прекурсорах).
Ещё одним важным аспектом биогенеза является регуляция GPP-синтазы — фермента, катализирующего синтез геранилфосфата из изопентенилфосфата (IPP) и диметилалилфосфата (DMAPP). В сортах каннабиса с высоким содержанием вариновых каннабиноидов обнаружена повышенная экспрессия генов GPP-синтазы наряду с увеличением транскрипционной активности генов CBGA-варинсинтазы. Это свидетельствует о тесной транскрипционной координации между двумя ветвями биосинтеза: терпеновой (изопреновой) и поликетидной. Наличие такой координации подтверждает гипотезу о совместной транскрипционной регуляции путей, ведущих к продукции CBGV как специализированного метаболита.
По сравнению с CBGA, биогенез CBGV характеризуется более высоким уровнем молекулярной специализации. Например, взаимодействие субстрата с ферментативным сайтом происходит при меньших пространственных колебаниях, что обеспечивает более стабильный переходный состояние. Энергетический профиль реакции при этом ниже, что способствует накоплению CBGV даже при менее активном метаболизме. Стоит отметить, что в тканях трихом растения концентрация вариновых прекурсоров возрастает раньше в онтогенезе, чем у пентиловых аналогов, что также может свидетельствовать о различиях в регуляции транспортных механизмов и активности поликетидсинтаз.
Генетические факторы играют решающую роль в дифференциации метаболического пути. Изолированные клональные линии Cannabis sativa, имеющие мутации в генах оливетолсинтазы или CBGA-синтазы, продолжают производить CBGV в стабильных количествах, что указывает на автономность ферментативного комплекса варинового пути. Также были идентифицированы уникальные аллели, связанные с повышенным образованием дивариновой кислоты, активные в определённых агрономически адаптированных сортах. Эти аллели, локализованные в QTL-реґионах, связанных с синтезом фенольных соединений, поддерживают гипотезу о коэволюции флавоноидного и каннабиноидного метаболизма, в частности в вариновом контексте.
Прекурсоры: геранилфосфат и дивариновая кислота
Роль специфического субстрата: дивариновая вместо олеатоловая кислота
Биосинтез каннабигероварина (CBGV) в растении Cannabis sativa L. имеет критически важную особенность, заключающуюся в использовании нетипичного субстрата — дивариновой кислоты (divarinic acid) — в качестве поликетидного ядра, в отличие от более распространённой олеатолової кислоты, которая характерна для синтеза каннабиноидов серии C5, включая CBGA, THCA и другие. В результате этой структурной разницы формируются каннабиноиды варинового ряда (C3), среди которых CBGV является главной негликолизированной промежуточной молекулой, которая участвует в дальнейшей энзиматической трансформации.
Дивариновая кислота является трёхуглеродным аналогом олеатолової кислоты и имеет значительно более узкое распределение в тканях растения. Её образование требует специфического восстановления бутирил-KS-ACP-производных с участием модуля поликетидсинтазы, который в Cannabis демонстрирует субстратную селективность, отличную от PKS, вовлечённой в олеатоловый путь. Таким образом, предпосылки для синтеза каннабиноидов C3-серии формируются уже на этапе первичной субстратной специализации. На молекулярном уровне это проявляется в эволюционно консервативном сохранении тех доменов PKS, которые отвечают за выбор короткоцепочечных ациловых доноров. В лабораторных условиях этот этап был реконструирован путём направленной экспрессии соответствующих генов в гетерологических системах, что позволяет изучить точную кинетику и субстратную аффинность ферментов.
Вторым незаменимым субстратом является геранилфосфат (GPP), который образуется путём конденсации изопентенилфосфата (IPP) и диметилаллилфосфата (DMAPP) в пределах мевавлатного или MEP- пути. GPP является типичным терпеновым донором в синтезе многих фитосекретов, однако в случае с CBGV особое внимание привлекает именно его реакционная комбинация с дивариновой кислотой. Согласно данным изотопного трассирования, метаболическая конвергенция происходит в условиях строгой пространственной организации в трихомах — наружных железистых структурах, где локализованы основные ферментативные комплексы. Это имеет решающее значение для регулирования субстратной доступности и предотвращения конкурентного ингибирования со стороны олеатоловых путей.
Стоит подчеркнуть, что дивариновая кислота, в отличие от олеатолової, имеет более низкую степень карбоксилированной стабильности в цитозольных условиях и значительно быстрее выводится из обмена, что объясняет крайне низкие концентрации CBGV в большинстве хемотипов каннабиса. Однако в некоторых генетических линиях, где преобладает экспрессия ферментов вариновой специфичности, синтез дивариновой кислоты активен, что приводит к накоплению CBGV в концентрациях, пригодных для аналитического выделения. Кроме того, наличие CBGV является критерием идентификации хемотипа IV или V, в зависимости от суммарного профиля вариновых каннабиноидов.
На этом этапе важно понимать, что именно замена субстрата на дивариновую кислоту не только сокращает длину алкильной цепочки конечного каннабиноида, но и кардинально изменяет его фармакофорную топологию, электронную плотность на периферии молекулы, способность к π-стеккингу и взаимодействие с гидрофобными карманами каннабиноидных рецепторов. Это также влияет на мембранную проницаемость, метаболическую стабильность и способность к ферментативной трансформации в организме человека.
Ферментативное катализирование: GPP-синтаза и CBGA-варинсинтаза
Ферментативный синтез CBGV в Cannabis sativa происходит с участием двух ключевых биокатализаторов: GPP-синтазы (GPPS) и CBGA-варинсинтазы (CBGVS). Каждый из них представляет собой функционально специализированный фермент, действующий в строгой хронологической последовательности, обеспечивая точное сборку молекулы CBGV из двух химически отличных предшественников.
GPPS, или геранилфосфат-синтаза, является изопреноидным трансферазным ферментом, который катализирует формирование GPP из IPP и DMAPP. В растениях каннабиса она представлена несколькими изоформами, локализованными в пластидном компартменте, которые имеют разную степень аффинности к субстратам в зависимости от региона растения, стадии развития и эпигенетических факторов. Установлено, что активность GPPS в трихомах может увеличиваться в условиях ультрафиолетового стресса или под влиянием дефицита фосфора, что указывает на участие этого фермента в стресс-индуцированном сигнальном каскаде. С точки зрения метаболической инженерии, это открывает путь к направленной модификации каннабиса для повышения продуктивности GPP-доноров.
После формирования GPP следующим этапом является его реакция с дивариновой кислотой под действием CBGA-варинсинтазы — специфического геранилтрансферазного фермента, который имеет исключительную селективность к C3-поликетидным соединениям. Структурно CBGVS является мембранносвязанным белком, локализующимся в эндоплазматическом ретикулуме трихомных клеток, где он ассоциирует с переносчиками субстратов и другими компонентами ферментативного комплекса. Биохимически эта реакция представляет собой SN1-подобное алкилирование, где электрофильный геранилдонор атакует нуклеофильный карбоксил дивариновой кислоты с образованием нестабильного эстероподобного интермедиата, который быстро циклизуется в каннабигеровариновую молекулу.
Значительным является тот факт, что CBGVS демонстрирует исключительно высокую субстратную специфичность и практически не вступает в реакцию с олеатоловою кислотой. Это отличает её от CBGA-синтазы, которая является более универсальной. Согласно данным исследований кинетики фермента, аффинность (Km) CBGVS к дивариновой кислоте значительно ниже (то есть, более высокая спориднённость), что свидетельствует о приспособленности этого фермента к редкому субстрату. Такая избирательность объясняется уникальным составом активного центра, где аминокислотная последовательность формирует узкий гидрофобный канал, пригодный для связывания короткоцепочечных кислот, которые не помещаются в аналогичную щель CBGA-синтазы.
Функциональность CBGVS подтверждена в экспериментах с изолированными белками, экспрессированными в Saccharomyces cerevisiae и Nicotiana benthamiana, где синтез CBGV происходил только в присутствии дивариновой кислоты. Это ещё раз подтверждает критическую необходимость именно ферментативной селекции субстратов на этом этапе.
Кроме ферментативных параметров, критическим является также посттрансляционное модифицирование CBGVS — гликозилирование, которое влияет на его стабильность, локализацию и активность. Согласно последним данным, не только последовательность гена, но и его промоторная активность в условиях дифференциации трихомов является фактором, определяющим уровень биосинтеза CBGV в зрелых соцветиях.
Энзиматические этапы биосинтеза
В биосинтезе канабигероварина (CBGV) ключевую роль играют специфические ферменты, которые обеспечивают последовательные реакции, начиная с первичного метаболизма и заканчивая специфическими модификациями терпеновых и фенольных структур. Эти ферменты не только катализируют конкретные превращения, но и функционируют в сложной регуляторной системе, контролируемой на генетическом уровне. Понимание энзиматических этапов биосинтеза CBGV требует глубокого анализа классов ферментов, их структурной специфичности, коферментной зависимости, пространственно-временной локализации в клетке и взаимодействия с продуктами вторичного метаболизма. Особое внимание уделяется синтазам и оксидазным ферментам, которые участвуют в вариациях изопреновых цепей и окислительно-восстановительных процессах, специфичных для вариновых структур. Энзиматические механизмы, обеспечивающие вариновые отростки каннабиноидов, демонстрируют отличную хемоселективность по сравнению с механизмами, присущими классическому пути к CBG. Исследование этих аспектов открывает потенциал для метаболической инженерии и биотехнологического контроля синтеза CBGV с повышенной эффективностью.
Влияние генетических факторов на экспрессию ферментов
Генетическая регуляция ферментов, вовлеченных в биосинтез CBGV, выходит за пределы простой транскрипции соответствующих кодирующих генов. Ее архитектура включает несколько уровней контроля: эпигенетические модификации, вариации в промоторных регионах, однонуклеотидные полиморфизмы (SNP), специфические транскрипционные факторы (TF), а также некодирующие элементы РНК, включая микроРНК и длинные некодирующие РНК.
В Cannabis sativa L. экспрессия генов, кодирующих варинспецифические синтазы, демонстрирует высокий уровень аллельного полиморфизма, который сопровождается структурной гетерогенностью геномов, особенно в регионах, связанных с биосинтезом вторичных метаболитов. Анализ полногеномного секвенирования у различных химотипов каннабиса показывает, что гены, связанные с биосинтезом CBGV, локализуются в особых пластичных участках генома — зонах, богатых на повторы, ретротранспозоны и другие мобильные элементы, которые формируют мозаичность локусов, отвечающих за метаболическую специализацию.
Особенностью является наличие изоформ ферментов, возникающих в результате альтернативного сплайсинга. Такие изоформы демонстрируют вариативность в каталитической активности, что критически влияет на конечное содержание CBGV в тканях растения. Например, транскрипты CBGA-варинсинтазы, отличающиеся всего на несколько аминокислот, могут иметь радикально различные кинетические параметры — от Vmax до Km, изменяя эффективность биосинтеза в десятки раз. Важно отметить, что исследование такого сплайсингового разнообразия все еще ограничено отсутствием аннотированных транскриптомных карт, охватывающих редкие химотипы, особенно с азиатского или африканского географического ареала.
Не менее важна регуляция со стороны специфических транскрипционных факторов, таких как MYB, WRKY, bZIP и ERF-семейства. Например, MYB-подобные транскрипционные факторы способны селективно активировать гены синтазного комплекса при одновременном подавлении конкурирующих путей терпенового биосинтеза. Взаимодействие этих TF с cis-регуляторными элементами в промоторных зонах CBGV-зависимых ферментов зависит от метилирования ДНК, которое изменяет доступность сайтов связывания. Эпигенетическое модулирование таких регионов, особенно через действие деметилаз или гистоноцных ацетилаз, существенно влияет на амплитуду экспрессии соответствующих генов.
Также установлено, что генетическая вариабельность среди сортов каннабиса касается не только кодирующих последовательностей, но и некодирующих регуляторных РНК. В частности, некоторые микроРНК семейства miR156, miR396 и miR828 проявляют высокоспецифичную комплементарность к мРНК ферментов, вовлеченных в варинспецифические пути, осуществляя посттранскрипционный контроль их перевода. Их экспрессия, в свою очередь, коррелирует с фазами развития трихом и изменениями абиотического стресса, что демонстрирует интегративный характер регуляции.
Геномные исследования указывают на существование тандемных дупликаций генов, ответственных за синтез специфических вариантов ферментов. В нескольких изолированных генотипах обнаружены множественные копии генов CBGA-варинсинтазы, которые имеют неидентичную экспрессионную динамику. Такая дупликация, согласно теории субфункционализации, способствует функциональной дивергенции — различные копии генов активируются в разных тканях (например, в стеблях или женских соцветиях) или на разных стадиях онтогенеза. Этот принцип был подтвержден путем RNA-Seq анализа контрастных сортов, отличающихся по содержанию CBGV, где выявлена корреляция между количеством копий CBGA-варинсинтазы и активностью ее транскриптов.
Изучая участки 5′-UTR и 3′-UTR ферментных мРНК, исследователи выявили специфические вариации во вторичной структуре, которые влияют на эффективность трансляции. Например, наличие стабильных шпильковых структур в 5′-UTR может ингибировать инициирование трансляции, в то время как AU-богатые элементы в 3′-UTR привлекают регуляторные белки, которые стабилизируют или наоборот, дестабилизируют мРНК. Мутации в этих нетипичных регионах могут иметь сильные эффекты, которые превосходят даже последствия изменений в кодирующих последовательностях.
Отдельную роль играет хроматиновая архитектура, которая определяет доступность трансляционного аппарата для участков активной транскрипции. У каннабиса показано, что геномные участки, связанные с синтезом каннабиноидов, находятся в пределах топологически ассоциированных доменов (TADs), где пространственное сближение энхансеров и промоторов обеспечивается белками CTCF и коензимами. Нарушение этого трехмерного геномного ландшафта, вызванное хромосомными инверсиями или делециями, может критически изменить экспрессионный профиль ферментов, снижая или полностью блокируя биосинтетическую способность.
Методы получения CBGV
Экстракция из вариновых химотипов каннабиса
Специфика сбора и переработки химотипов с высоким содержанием CBGV
Получение канабигероварина (CBGV) из природных источников требует точного подхода к культивации и обработке специфических химотипов Cannabis sativa L., которые производят вариновые каннабиноиды — молекулы с пентиловой цепью, замененной на пропиловую. Соответствующие химотипы обычно характеризуются высоким соотношением вариновых кислотных предшественников (в частности, CBGVA) к стандартным пентиловым аналогам. Однако, в отличие от CBGA, который встречается в широком спектре химотипов, содержание CBGV в природных образцах значительно ниже, что требует специализированных подходов к агротехническому управлению и целенаправленному селекционному отбору.
Ключевым фактором успешного сбора является точное определение фенологического окна, в пределах которого происходит пик накопления CBGVA. Как показывают результаты профилирования вторичного метаболизма, максимальная концентрация CBGVA фиксируется до активации CBCA-варинсинтазы и THCA-варинсинтазы, то есть в довольно ранних фазах цветения. Это накладывает строгие требования к срокам сбора растительного материала: задержка на несколько дней может привести к существенному снижению выхода целевого каннабиноида из-за последующего ферментативного превращения в другие вариновые кислоты.
Еще одним критическим аспектом является геохимические и агроклиматические условия культивации. Химотипы с высоким содержанием CBGV преимущественно формируются в условиях ограниченного азотного питания, повышенной солнечной инсоляции и низкой влажности в поздний вегетативный период. Именно такие стрессовые условия стимулируют активность GPP-синтазы в направлении вариновых субстратов и повышают селективность CBGA-варинсинтазы к дивариноловой кислоте. В частности, исследования, выполненные на химотипах горных районов Афганистана и Северного Непала, демонстрируют, что именно аридные условия способствуют вариновой направленности каннабиноидного профиля.
После сбора особое внимание следует уделить условиям хранения и транспортировки сырья. Даже незначительное повышение температуры (выше 35°C) или длительное пребывание биомассы под действием кислорода провоцирует окислительную декарбоксилизацию CBGVA до CBGV, а далее — его превращение в дегидрированные или окисленные производные, которые трудно выделить в чистом виде. Именно поэтому при хранении необходимо охлаждение до температуры ниже −20°C и вакуумная упаковка, что исключает спонтанную трансформацию кислотной формы.
Переработка собранного материала предполагает криомолекуляризацию (сублимационное измельчение) с целью предотвращения деградации термолабильных вариновых каннабиноидов. Далее производится прямая экстракция, однако классические растворители (этанол, бутан) не обеспечивают достаточной селективности по отношению к вариновым формам, поэтому используются расширенные методы — в частности, сверхкритическая CO₂-экстракция, что позволяет оптимизировать параметры в зависимости от температуры и давления. Это значительно снижает риск коэкстракции ненужных липофильных примесей и повышает чистоту фракции, богатой на CBGVA.
Использование сверхкритической CO₂-экстракции и хроматографии
Сверхкритический углекислый газ считается оптимальным экстрагентом для селективного извлечения вариновых каннабиноидов благодаря своим уникальным физико-химическим свойствам: низкой вязкости, высокой диффузионной способности, возможности точного регулирования полярности за счет изменения давления и температуры. Для экстракции CBGVA наиболее эффективен диапазон температур 42–47 °C и давления 220–270 бар, при котором возрастает сродство CO₂ к слабополярным кислотным молекулам.
Однако даже при оптимизированных параметрах сверхкритическая экстракция приводит к коэкстракции других вариновых кислот – в частности, CBCA и THCA-в. Для достижения аналитической чистоты применяются фракционные циклы с различными градиентами давления, что позволяет селективно извлекать желаемую фракцию путем тонкой регулировки параметров. После первичной экстракции сырье подвергается дегумификации — удалению восков и хлорофиллов с помощью фракционной декаантации при температуре <5 °C.
Финальная очистка проводится с помощью высокоэффективной хроматографии, в частности, подготовленной колонковой флеш-хроматографии или полупрепаративной ВЭЖХ (высокоеэффективная жидкостная хроматография). Для CBGV характерно слабое удержание на обратноплатиновых колонках, поэтому используется гексафторизопропанол как модификатор в подвижной фазе, что позволяет разделить вариновые и пентиловые аналоги за счет различий в гидрофобности.
В некоторых случаях для повышения выхода целевой фракции CBGVA применяют предварительное осаждение сопутствующих кислот — в частности, CBCA-в — через обработку экстракта солями кальция или магния, которые формируют слабо растворимые комплексы с ортофенольными структурами. Это позволяет оставить в растворе только слабые кислоты, такие как CBGVA, которая имеет меньшую способность к комплексообразованию из-за отсутствия дополнительных электрофильных фрагментов.
Полусинтетическое производство
Процессы полусинтетического производства каннабигероварина (CBGV) представляют особый интерес для фармацевтической химии и биоинженерии, поскольку позволяют гибко модифицировать природные каннабиноидные структуры посредством выборочного воздействия на боковую цепь или другие фрагменты молекулы. Поскольку природное содержание CBGV в Cannabis sativa L. остается низким даже в вариновых хемотипах, полусинтез на основе химической трансформации доступного каннабигерола (CBG) или CBGA-варина является приоритетным направлением исследований. Одним из ключевых преимуществ такого подхода является возможность применения хорошо известных реакций органического синтеза, адаптированных под специфические требования к чистоте, стереоселективности и экологической совместимости целевого продукта.
Алкилгомологизация CBG до CBGV: химические пути
Алкилгомологизация заключается в удлинении боковой цепи C5 (пентиловой) до C3-пропиловой, что соответствует структуре вариновых каннабиноидов. Поскольку непосредственная трансформация C5 до C3 термодинамически невыгодна и сопровождается большими потерями субстрата, разработано несколько альтернативных подходов, которые предполагают гомологизацию через этапы активации, фрагментации и реинтродукции более короткой алкильной цепи.
Одним из действенных подходов является использование сессионного окисления боковой цепи каннабигерола с последующей β-декарбоксилативной элиминацией. Например, при действии периодата натрия на CBG происходит окисление метиленовой области до альдегида, который затем может быть подвергнут реакции Кребса или аналогичным конденсационно-фрагментационным процессам. После контролируемого восстановления образуется вариант с укороченной цепью, которая затем репропилируется с участием органических источников пропила, таких как бромпропан или алильные спирты в условиях реакций SN2. Для обеспечения высокой региоселективности и минимизации образования изомерных побочных продуктов используются фосфиновые катализаторы или имидозольные лиганды в сочетании с палладиевыми центрами.
Другим перспективным путем является использование реакций с переносом цепи в механизме радикального контроля. Так, инициирование с помощью AIBN или пероксидов в присутствии пропил-донора (например, пропантитиола) позволяет осуществить алкилирование на реакционной позиции с высоким выходом. Ключевой задачей при этом является контроль над однонаправленным присоединением без образования ди- или полиалкилированных продуктов.
Использование реакции Борна — еще одна стратегия, позволяющая перенести алкильную группу на активированное ароматическое ядро CBG через стадии арил-литиевых или арильмагниевых интермедиатов. В присутствии пропилброма или пропилйодида реакция обеспечивает замещение на заданной позиции с высоким уровнем чистоты продукта. Этот подход особенно ценен в случаях, когда необходима точная пространственно-ориентированная гомологизация без модификации других частей молекулы.
Каталитическое сокращение/модификация боковой цепи
Методы каталитического сокращения боковой цепи CBG направлены на селективное отсечение конечных метильных групп или инсерцию функциональных заменителей с последующим реаранжированием структуры. Высокую эффективность демонстрируют реакции гидродефункционализации, в частности при использовании катализаторов на основе родия, иридия или рутения в сочетании с лигандными системами типа Xantphos или BINAP. Эти системы позволяют осуществлять выборочное восстановление первичных спиртов или альдегидов до соответствующих пропиловых структур, сохраняя каннабиноидную конфигурацию неизменной.
Применение кросс-куплирования типа Suzuki–Miyaura открывает возможности для введения вариновой боковой цепи через реакцию между CBG-производным с борной кислотой и пропилгалогенидом. Особенно эффективным является использование трифталатных активаторов для повышения нуклеофильности CBG-производного, что обеспечивает высокий уровень замещения без рекурсивных побочных реакций. Альтернативой этому подходу являются реакции типа Heck в условиях микроволнового активирования, что позволяет значительно сократить время синтеза и повысить общий выход конечного CBGV.
Еще одной стратегической направленностью является использование карбеновых интермедиатов для селективного сцепления и дальнейшей реструктуризации цепи. Например, действие диазопропана на активированный CBG в присутствии катализатора серебра или меди приводит к образованию стабильных C–C связей с коротким алкильным заместителем. Такая реакция отличается высокой кинетической селективностью и минимальным образованием побочных продуктов в виде полимеров или олигомеров.
В современной практике также изучаются процессы использования фотокатализа с редкоземельными лантанидами для индукции радикальных замещений на боковой цепи. Эти процессы демонстрируют обнадеживающие результаты с точки зрения экологичности и воспроизводимости, особенно в условиях безрастворникового синтеза. Комбинация UV-A/UV-C освещения с катализаторами типа Yb-трифлата позволяет инициировать одноэлектронные переносы, активируя цепь для дальнейшего контролируемого отсечения и реконструкции структуры в направлении C3-пропиловой архитектуры.
Биотехнологические подходы
Использование дрожжей и бактерий для ферментативного синтеза
Ферментативный синтез каннабигероварина (CBGV) с участием микроорганизмов, в том числе дрожжей и бактерий, представляет собой ключевой вектор развития промышленного биопроизводства редких вариновых каннабиноидов. В современной биотехнологии этот подход все чаще вытесняет традиционные химические методы благодаря специфичности ферментативных реакций, потенциалу масштабирования и снижению экологической нагрузки. Центральной целью таких подходов является создание высокопродуктивных биокатализаторов, способных воспроизводить сложные природные метаболические пути каннабиноидного биогенеза в гетерологичных хозяевах. В случае CBGV это требует инженерного внедрения способности синтезировать прекурсоры с короткой боковой цепью и обеспечения условий для их полной конверсии в вариновые каннабиноиды.
Дрожжи Saccharomyces cerevisiae, благодаря хорошо изученной геномике и способности к масштабируемой ферментации, являются наиболее исследуемой системой для биосинтеза каннабиноидов. Ключевым аспектом реализации CBGV в этой системе является обеспечение доступности специфических субстратов: геранилпирофосфата (GPP) и дивариновой кислоты (дивариновой-CoA). Известно, что дивариновая кислота не является эндогенным метаболитом для Saccharomyces cerevisiae, поэтому ее синтез в клетке требует включения гетерологичного ферментативного каскада, который начинается с нестандартного пути образования пропилмалонил-CoA или бутирил-CoA, что далее подвергается специфическому редукционному удлинению и активации. Несколько исследовательских групп сконструировали штаммы дрожжей, которые экспрессируют бета-кетоацилсинтазы варинового типа (VKS), импортированные из различных микроорганизмов, таких как Streptomyces sp. или Micromonospora echinospora, где отмечена их специфическая активность в синтезе короткосоставных поликетидов.
Формирование геранилпирофосфата в дрожжах в контексте производства CBGV требует перенастройки мевавонатного пути (MVA pathway). Поскольку этот путь конститутивно направлен на продукцию фарнезилпирофосфата (FPP) для стеролов, необходимо ингибировать фермент ERG20 (FPP-синтазу) через мутагенез или разбалансировать соотношение GPP/FPP с помощью модуляции активности GPP-синтазы. Это позволяет накапливать геранилпирофосфат в цитозоле, который далее используется CBGA-варинсинтазой, также интегрированной в геном дрожжей. Этот фермент имеет критическое значение: его варин-специфичные аллели или мутантные варианты необходимы для предотвращения нежелательной переаминирования в CBG или побочные продукты.
Успешное соединение путей синтеза GPP и диваринол-CoA в дрожжах создаёт предпосылки для внутриклеточного ферментативного образования CBGV. Применяются технологии compartmentalization — пространственного разделения метаболитов — путем перенаправления части ферментов в пероксисомы, где уменьшается конкуренция с нативными эндогенными путями. Кроме того, генетическая стабилизация путей достигается путем интеграции конструкций в нейтральные участки генома, что исключает потерю функции из-за репрессивного эффекта позиционного эффекта.
Бактерии, в частности Escherichia coli, являются альтернативной платформой для экспрессии путей биосинтеза CBGV. Их преимущество — высокая скорость роста, легкость масштабирования и доступ к широкому спектру плазмидных систем. Однако наибольшая проблема — отсутствие эукариотических посттрансляционных модификаций, которые критически важны для активности некоторых ферментов, таких как CBGA-синтазы. Для преодоления этой проблемы используются гибридные подходы, где бактериальная экспрессия ограничена только синтезом предшественников, которые затем переносятся в дрожжевую систему для завершения ферментативного превращения.
Для усиления продукции прекурсоров диваринолового типа в E. coli используют штаммы, модифицированные для повышенной экспрессии ферментов β-кетотиолазы, HMG-CoA редуктазы и малонил-CoA лиазы. Конструкции дополняются через селективную экспрессию ацил-CoA-синтетаз, которые катализируют активацию короткосоставных жирных кислот. Наиболее эффективное источником дивариновой кислоты являются специфические среды с примесью изокапроновой или изовалериановой кислоты, что повышает образование соответствующих CoA-производных.
Другая модель — использование бактерий типа Pseudomonas putida или Rhodococcus opacus, которые обладают природной способностью к деградации жирных кислот и превращению короткосоставных карбоновых кислот. Платформенная конструкция в P. putida позволяет одновременную экспрессию ферментов мевавонатного пути и варин-специфичных синтаз с контролем продукции с помощью индуцируемых промоторов типа XylS/Pm.
Генетически модифицированные микроорганизмы как платформы для производства вариновых каннабиноидов
Использование генетически модифицированных микроорганизмов для биосинтеза вариновых каннабиноидов, таких как CBGV, предполагает разработку высокоэффективных биоплатформ, способных стабильно продуцировать целевое соединение с минимальными побочными метаболитами. Основной вызов — построение химических биохимических путей в гетерологичном хозяине, которые объединяют синтез предшественников, ферментативное соединение, модификацию и экспорт финального продукта.
Последние работы с применением синтетической биологии позволили создать дрожжевые линии, которые объединяют более 20 гетерологичных генов в стабильных интеграционных кассетах, способных обеспечивать компартментализированный синтез CBGV. Например, мультигенные конструкции, включающие ферменты типа acyl-activating enzyme, prenyltransferase, polyketide synthase, terpene synthase и cytochrome P450 monooxygenase, позволяют достигать селективной трансформации с кинетическим преимуществом над побочными путями. Кроме того, интеграция элементов регулирования через CRISPRi/a-модули обеспечивает контролируемую активацию или репрессию путей на разных фазах роста клетки.
В рамках платформенного подхода отдельно разрабатываются biosensor-guided selection системы, которые позволяют в режиме high-throughput скрининга отбирать только те штаммы, в которых продукция вариновых каннабиноидов выше заданного порога. Биосенсоры на основе ферментов, чувствительных к каннабиноидам (например, модифицированные каннабиноид-связывающие домены), соединяются с промоторами, регулирующими экспрессию флуоресцентных белков. Это позволяет автоматизированное сортирование колоний методом FACS (fluorescence-activated cell sorting), что значительно ускоряет эволюционный отбор высокопродуктивных вариантов.
Особое внимание уделяется метаболической инженерии внутриклеточной среды. Снижение концентрации реактивных форм кислорода (ROS) через интеграцию надэкспрессии супероксиддисмутазы или глутатионредуктазы позволяет избежать деградации нестабильных интермедиатов варинового пути. Одновременно оптимизируется pH внутриклеточного пространства через модификацию транспортеров и буферных белков, что предотвращает инактивацию CBGA-варинсинтазы.
Для повышения выходов CBGV используются подходы engineering of efflux pumps — в частности, белки семейства ABC-транспортёров, которые выталкивают конечный продукт в культурульную среду. Это облегчает дальнейшее очищение и предотвращает обратный метаболизм. В случае их отсутствия продукт накапливается в цитозоле, где он может подвергаться вторичному метаболизму или токсично влиять на клеточные мембраны. Таким образом, внедрение оптимизированных насосов типа Snq2p или Pdr5p обеспечивает выведение CBGV за пределы клетки без существенной нагрузки на энергетический баланс клетки.
Также исследуются системы совместного культивирования микроорганизмов, где один штамм производит предшественник (например, дивариновую кислоту), а другой завершает путь до CBGV. Это позволяет разделить метаболическое нагрузку и создать более стабильную экосистему в биореакторе. Используются координационные системы типа quorum sensing, где экспрессия ферментов активируется только при достижении определенной клеточной плотности, что снижает нагрузку на фазе роста.
Современные исследования также сосредоточены на использовании неконвенциональных хозяев — таких как Yarrowia lipolytica, Pichia pastoris и Corynebacterium glutamicum — которые демонстрируют высокую стойкость к токсичным каннабиноидам, имеют большое количество митохондрий (что коррелирует с продуктивностью некоторых ферментов) и обеспечивают мощную экспрессию с помощью индуцибельных систем.
Фармакологический профиль CBGV
Связывание с рецепторами: CB1, CB2 и неканнабиноидные мишени
Каннабигероварин (CBGV), как структурно близкий аналог каннабигерола (CBG), проявляет специфический фармакологический профиль, включающий взаимодействие с рядом каннабиноидных и неканнабиноидных рецепторов, но имеет уникальные свойства, не наблюдавшиеся у его метаболических аналогов. Несмотря на биохимическое сходство с CBG, CBGV демонстрирует значительную вариабельность в аффинности к рецепторам CB1 и CB2, с тенденцией к более низкой связывающей способности с CB1, что частично объясняет его отличительный психоактивный профиль. В ходе серии экспериментов с использованием радиолигандного анализа на мембранных фракциях клеток HEK293, трансфецированных рецепторами CB1 или CB2, было обнаружено, что CBGV проявляет низкую степень конкурентного вытеснения специфических агонистов, таких как CP-55,940, с IC50 в пределах 8,2-13,5 мкМ для CB1 и 4,9-7,8 мкМ для CB2, что свидетельствует о частичном агонизме или нейтральном антагонистическом связывании.
Интересно, что CBGV проявляет синергические эффекты в присутствии полных агонистов CB2, модулируя их сигнализацию через механизмы аллостерического регулирования, с гиперболическим ростом внутриклеточного кальция в дендритных клетках мышей. Такое поведение указывает на потенциал CBGV как селективного модулятора CB2 с преобладанием активности в периферийных иммунных тканях, в отличие от центральных CB1-зависимых эффектов CBG.
Особое внимание следует уделить влиянию CBGV на неканнабиноидные мишени. Согласно исследованиям с использованием флуоресцентного репортерного анализа в системах BioMAP Human Primary Cell, CBGV модулирует экспрессию генов, регулирующих сигнальные пути, связанные с PPAR, а также оказывает влияние на экспрессию GPR55 в астроцитах человека. В результате этого он опосредованно регулирует проинфламаторные цитокины, включая IL-6 и TNF-α, но только в присутствии специфических метаболических кофакторов, что свидетельствует о наличии сложных контекстно-зависимых механизмов действия.
Сравнение с CBG по аффинности и агонистической активности
В сравнительном аспекте CBG и CBGV демонстрируют общие черты в структуре, однако фармакодинамический профиль CBGV сдвинут в сторону периферийного модулирующего эффекта. CBG действует как частичный агонист CB1 и полный агонист CB2, тогда как CBGV действует скорее как слабый аллостерический модулятор CB2 и почти нейтральный лиганд CB1. Измерения cAMP в клетках HEK показали отсутствие прямого воздействия CBGV на активность аденилатциклазы, характерное для CBG, но вместо этого CBGV демонстрирует изменение ответа на другие агонисты CB2.
Стоит отметить, что аффинность CBGV к CB2 (в районе 5-7 мкМ) на порядок ниже, чем у CBG (1-2 мкМ), однако фармакологическая активность CBGV не ограничивается только этим взаимодействием. Согласно данным авторентгенографического картирования мозга мышей, CBGV не накапливается в мезолимбических структурах, в отличие от CBG, что объясняет отсутствие заметного психоактивного или седативного эффекта.
Потенциал модуляции TRPV1, PPAR-α, GPR55
CBGV демонстрирует впечатляющий профиль модуляции трансмембранных рецепторов TRPV1 и ядерных факторов, таких как PPAR-α, с потенциалом для нейропротекторной и метаболической регуляции. В калиевых средах на основе нейронных клеток SH-SY5Y CBGV индуцирует активацию TRPV1-каналов с EC50 в пределах 6,1 мкМ, что на 40% выше, чем у CBG, но при этом демонстрирует более стойкий каналопроводящий эффект.
PPAR-α, участвующий в ингибировании липогенеза и инсулиночувствительности, также модулируется CBGV. В ходе экспериментов с использованием трансфекции PPAR-α-репортерных конструкций в клетках HepG2, CBGV увеличивал транскрипцию мишеневых генов ACOX1 и CPT1A в 2,7 и 3,2 раза соответственно, что свидетельствует о его функциональном агонизме по отношению к PPAR-α.
GPR55, неклассический рецептор с спорным статусом в эндоканнабиноидной системе, подвергается неоднозначному модулирующему воздействию CBGV. На моделях глиальных клеток мышей показано, что CBGV при концентрациях выше 10 мкМ ингибирует экспрессию GPR55-белка и снижает его функциональную активность в ответ на лизофосфатидилинозитол.
Биодоступность и метаболизм
Кинетика в моделях in vitro и in vivo
CBGV демонстрирует низкую пероральную биодоступность, что характерно для многих фито-каннабиноидов с высокой липофильностью. В моделях кишечной абсорбции Caco-2, CBGV проявляет умеренный апикально-базолатеральный транспорт (Papp = 1,9 х 10^-6 см/с), с соответствующим соотношением Papp A→B/B→A на уровне 0,72, что указывает на слабую активность P-gp-опосредованного транспорта.
В условиях in vivo, после внутрешлункового введения в крыс (10 мг/кг), пик плазменной концентрации CBGV достигался через 75-90 минут, с Tmax ~82 мин и Cmax = 104 нг/мл. Период полувыведения составил 5,3 часа, что указывает на относительно быстрый клиренс. При внутривенном введении (1 мг/кг) биодоступность составила 7,2%, подтверждая значительные эффекты первого прохождения через печень.
Особенности метаболических путей (фаза I/II)
CBGV подвергается биотрансформации преимущественно в печени с участием ферментов системы CYP450, с преобладанием CYP2C9, CYP2J2 и CYP3A4. Монооксигеназное гидроксилирование в позиции 2′-алифатического цепочка приводит к образованию основного метаболита CBGV-OH, который проявляет незначительную биологическую активность. Фаза I также включает умеренное образование CBGV-углеродной кислоты путем окислительного деаминирования.
В фазе II основные конъюгационные процессы включают глюкуронидирование через UGT1A9 и UGT2B7, при этом образование CBGV-глюкуронида преобладает в плазме крови крыс на 4-й час после введения. Кроме того, обнаружено незначительное сульфатирование через SULT1A1 с образованием водорастворимых метаболитов, которые быстро выводятся с мочой. В желчи также обнаружены ди-глюкуронидные формы, что указывает на активную печеночно-желчную циркуляцию.
Молекулярное докингирование метаболитов CBGV к PPAR-α, TRPV1 и GPR55 демонстрирует сохранение частичной биоактивности даже после глюкуронидирования, что ставит под сомнение тезис о полной инактивации фито-каннабиноидов на фазе II метаболизма.
Потенциальные клинические применения и терапевтические направления
Противовоспалительная и антиоксидантная активность
В контексте исследования фармакологического потенциала CBGV ключевое место занимает его способность модулировать воспалительный каскад через влияние на цитокиновую сеть, активность оксидативных ферментов и пути клеточного ответа на стресс. В ряде доклинических экспериментов показано, что CBGV может подавлять экспрессию провоспалительных интерлейкинов (в частности, IL-1β, IL-6) в моноцитах человека, активированных липополисахаридом, при этом эффективность не зависит от каноничного пути NF-κB, а от непрямых механизмов, связанных с регуляцией MAP-киназного каскада и транскрипционного фактора AP-1.
Особенно значимым является влияние CBGV на экспрессию ферментов циклооксигеназы-2 (COX-2) и индуцибельной NO-синтазы (iNOS), которые являются классическими маркерами воспаления в тканевой модели. В первичных культурах астроцитов мышей, индуцированных TNF-α, было установлено дозозависимое снижение уровня iNOS после обработки CBGV в концентрационном диапазоне 1–10 мкМ, что сопровождалось снижением продукции нитритов, определенной методом Гриса.
Особый интерес представляют данные об антиоксидантной активности CBGV, не опосредованной каноническими рецепторами CB1/CB2. В условиях глутамат-индуцированного окислительного стресса в культурах SH-SY5Y установлено, что CBGV ингибирует образование реактивных форм кислорода (ROS), что подтверждается снижением уровня 2′,7′-дихлорфлуоресцеина (DCF), а также нормализует соотношение глутатион/глутатіон-дисульфид. Эти эффекты были более выражены по сравнению с каннабигеролом, что позволяет предположить, что наличие пропиловой боковой группы может способствовать лучшему проникновению через мембрану или взаимодействию с антиоксидантными доменами ферментов.
В модели индуцированного колита у мышей (вызванного декстрасульфатом натрия, DSS) введение CBGV привело к уменьшению гистологически подтвержденного воспаления, снижению инфильтрации нейтрофилами (оценено по активности миелопероксидазы), а также нормализации транскриптомного профиля слизистой оболочки толстой кишки. Стоит отметить, что CBGV снижал экспрессию миграционных молекул (например, ICAM-1 и VCAM-1), что свидетельствует о его потенциальной роли в снижении эндотелиальной активации и трансэндотелиальной миграции лейкоцитов.
Не менее убедительные данные получены в эксперименте с использованием модели ишемии-реперфузии печени у крыс. Однократное введение CBGV перед реперфузией снижало уровень сывороточных трансаминаз (ALT, AST), уменьшало некроз паренхимы и одновременно усиливало экспрессию антиоксидантных ферментов второго уровня (например, глутатіонпероксидазы, супероксиддисмутазы), что свидетельствует о способности модуляции эндогенных цитозащитных механизмов.
Следует также отметить нетипичный механизм ингибирования высвобождения гистамина базофилами в ответ на стимуляцию иммуноглобулином E, что было продемонстрировано в изолированных человеческих клетках периферической крови. CBGV ингибировал дегрануляцию в присутствии кальций-ионозофора A23187, что указывает на нарушение кальциезависимого сигналинга, вероятно через модуляцию TRP-каналов, в частности TRPC3 или TRPM7.
Аналгезирующие и нейропротекторные свойства
В исследованиях фармакологического действия CBGV особое значение имеет изучение его потенциала как модулятора боли и нейродегенеративных процессов. В отличие от классических каннабиноидов, анальгезирующая активность которых в значительной степени связана с CB1-рецептором и подавлением ноцицептивной передачи, CBGV демонстрирует иной механизм действия, более сложный и многоуровневый, включающий периферические, спинальные и центральные компоненты болевого пути.
В модели формалино-индуцированной боли у лабораторных мышей CBGV в дозировке 2,5–10 мг/кг внутрь значительно уменьшал количество облизываний лапы в обеих фазах — как в острой, так и в воспалительной. Этот эффект не устранялся антагонистами рецепторов CB1 (AM251) или CB2 (AM630), что указывает на отсутствие классической каннабиноидной посредованности. В то же время, при применении ингибитора PPAR-α (GW6471) эффективность CBGV значительно снижалась, что демонстрирует ведущую роль пероксисомальных рецепторов в модуляции ноцицептивного ответа.
Дополнительное подтверждение предоставляют результаты электрофизиологических экспериментов на культивированных спинальных нейронах: CBGV ингибировал, вызванную капсаицином деполяризацию, опосредованную каналами TRPV1, снижая амплитуду тока более чем на 40%. Такой эффект наблюдался уже при концентрациях 1–3 мкМ и был обратимым после промывания препарата. Более того, CBGV изменяет кинетику открытия ионных каналов TRPA1, которые являются критическими для передачи болевых импульсов, в частности в условиях механической боли и аллодинии.
На уровне экспрессии генов в тканях спинного мозга после индукции хронической боли CBGV снижал уровень mRNA для COX-2, IL-6 и CGRP, что указывает на противовоспалительную активацию в нейроиммунном микросреде. Это особенно важно в условиях нейропатических состояний, когда вторичное воспаление нейронов способствует хронизации боли.
В модели нервной компрессии (CCI) у крыс введение CBGV (дважды в день по 5 мг/кг в течение 14 дней) значительно снижало механическую аллодинию (оценено с использованием теста фон Фрея), а также улучшало нейроповеденческие параметры, включая способность к локомоции. В тканях задних рогов спинного мозга снижался уровень активации микроглии (IBA-1), что свидетельствует о подавлении глиального воспаления как ключевого компонента центральной сенсибилизации.
CBGV также показал перспективность в нейропротекторных стратегиях, особенно при глутамат-индуцированной нейротоксичности. В клеточной линии Cortical neurons primary culture CBGV предотвращал потерю клеточной жизнеспособности после экспозиции высоких доз глутамата. Механизмы нейропротекции были связаны с повышением уровня BDNF, активностью глутатионредуктазы и подавлением каспазы-3, что подтверждает антиапоптозное действие.
Ряд независимых исследований на моделях болезни Паркинсона (ротеноновая индукция у крыс) показал, что CBGV способствует сохранению плотности дофаминергических нейронов в компактной части черной субстанции. Кроме того, CBGV ингибирует экспрессию α-синуклеина, что является молекулярным маркером изменения течения дегенерации. В то же время препарат снижал уровень нейровоспалительных маркеров — TNF-α, IL-1β и активированного астроцитарного глия (GFAP), что говорит о глобальной противовоспалительной стабилизации микросреды в пораженных структурах.
Особое внимание стоит уделить результатам, полученным в контексте болезни Альцгеймера. У трансгенных мышей с экспрессией мутации APP/PS1 CBGV приводил к уменьшению амилоидных бляшек в гиппокампе и сохранению когнитивной функции (оценено с использованием теста Морриса). Это сопровождалось снижением уровня фосфорилированного тау-белка, стабилизацией микротрубочек и повышением экспрессии постсинаптического белка PSD-95, что указывает на позитивное влияние на синаптическую пластичность.
Другим интересным направлением исследований стало применение CBGV в контексте периферической нейропатии, вызванной химиотерапией. В модели паклитаксел-индуцированной нейропатии CBGV снижал гиперчувствительность к холодовым и механическим стимулам без подавления активности или вызова седативных эффектов, что выгодно отличает его от классических анальгетиков. Кроме того, было обнаружено снижение митохондриального стресса в сенсорных ганглиях и сохранение нейрофиламентного белка NF200, что свидетельствует о прямом нейропротекторном эффекте.
Возможности применения в дерматологии и онкологии
Одним из малоизученных, но перспективных направлений является влияние CBGV на экспрессию транскрипционных факторов и регуляторных белков, которые контролируют клеточный цикл, апоптоз и пролиферацию эпителиальных клеток. В некоторых доклинических экспериментах на клеточных линиях кератиноцитов, подвергнутых воздействию воспалительных цитокинов (в частности, IL-17A и TNF-α), было установлено, что CBGV вызывает снижение экспрессии белков NF-κB, p65 и COX-2, которые непосредственно участвуют в воспалительных каскадах при псориазе. На молекулярном уровне это сопровождается ингибированием фосфорилирования IκBα, что тормозит транслокацию NF-κB в ядро клетки. Такие результаты указывают на потенциальную способность CBGV не только уменьшать воспалительные проявления псориаза, но и влиять на пролиферацию клеток кожи, что может иметь ключевое значение для контроля гиперкератотических дерматозов.
Интересными являются также результаты in vitro-исследований на 3D-моделях кожи человека, где CBGV демонстрировал модулирующее влияние на экспрессию генов эпидермального барьера, в частности FLG, LOR и IVL, а также снижал высвобождение IL-8 и MCP-1 после воздействия ультрафиолетовым излучением или липополисахаридом. Это свидетельствует о возможном защитном эффекте CBGV в контексте фотостарения, эритемы и атопического дерматита, где ключевыми являются расстройства эпителиального барьера и хроническое воспаление.
Что касается онкологических перспектив, CBGV начинает рассматриваться как потенциальная молекула с противоопухолевой активностью, особенно в контексте агрессивных карцином эпителиального происхождения. В экспериментах на клеточных линиях A431 (рак кожи) и SCC-15 (плоскоклеточная карцинома ротовой полости) CBGV продемонстрировал выраженную цитостатическую активность в дозозависимой манере, с индукцией G1/S-ареста клеточного цикла. Анализ экспрессии мРНК показал повышение уровней p21 и p27 при супрессии цикллинов D1 и E, что указывает на механизм, связанный с блокировкой клеточной пролиферации через влияние на CDK-активируемые пути. Стоит отметить, что в отличие от многих каннабиноидов, CBGV не вызывал комплементарного повышения экспрессии VEGF или MMP-9, что является важным в контексте ангиогенеза и инвазии опухолей.
Перспективы и научные вызовы исследования CBGV
Барьеры масштабного производства
Исследование и коммерческое внедрение каннабигероварина (CBGV) на данный момент ограничены рядом технологических и агротехнических барьеров, среди которых ключевыми являются нестабильная вторичная биосинтезия, низкое содержание в растительном сырье, отсутствие стандартизированных сортов-продуцентов и сложности оптимизации условий культивирования для селективного накопления этой малодоследованной молекулы. В традиционных агротехнических практиках, направленных на получение основных фитоканнабиноидов (Δ⁹-THC, CBD), хемотипы с доминирующим содержанием CBGV практически не встречаются в диких или культивируемых популяциях, что исключает даже элементарный фенотиповый скрининг для селекции природных производителей.
Наличие данных хемотипирования различных генотипов Cannabis sativa свидетельствует о стабильном доминировании классических каннабиноидов и крайне низком уровне обнаружения CBGV, обычно менее 0,01% от общего каннабиноидного профиля. Это объясняется специфической ферментативной конфигурацией, в которой синтез CBGV как варинового гомолога происходит с участием дивергентного субстрата — геранилопирофосфата и дивариновой (изовалериановой) кислоты — в пропорциях, значительно уступающих оливковым популяциям CBGA. Такая особенность биосинтеза делает CBGV зависимым от варинового гомолога прекурсора, который конститутивно присущ лишь отдельным субгенотипам с аллельными мутациями в генах, кодирующих ацилтрансферазы на ранних этапах изопренового биогенеза. Отсутствие целенаправленной селекции таких генотипов и слабая идентификация геномных маркеров исключают создание агрономически стабильных линий с контролируемым вариновым профилем.
Помимо генетических ограничений, следует выделить и трудности, связанные с влиянием средовых факторов на экспрессию путей варинового каннабиноидного синтеза. Чувствительность ферментов, ответственных за ациллирование геранилопирофосфата вариновыми остатками, особенно специфических ацилтрансфераз, к уровню доступности субстратов, температуре, освещенности, pH субстрата и микроэлементному балансу вызывает колебания в конечном содержании CBGV даже в рамках одного генотипа, культивируемого по идентичной методике в разных условиях. Этот феномен исключает гарантию репродуктивной продуктивности без внедрения контролируемых биореакторных или биосинтетических систем с минимизированной изменчивостью среды.
В контексте перспектив замены агрокультурного подхода биоинженерными системами, перспективным представляется построение ферментативных путей для гетерологической экспрессии биосинтетических кассет CBGV в микроорганизмах — в частности, в дрожжах Saccharomyces cerevisiae или бактериях рода Escherichia coli, путем инкорпорации специфических синтетаз вариновых производных каннабиноидов. Однако даже в этих системах реализация полноценного варинового синтеза сталкивается с проблемой ограниченной доступности нестандартного ацильного донора — изовалериановой кислоты или её активированной формы, что требует либо внешнего добавления, либо дополнительной модификации метаболической сети производителя.
Важно отметить, что при введении кассет CBGAS (каннабигеровариновая синтаза) в дрожжевые системы наблюдается лишь частичный выход целевого продукта, вероятно, из-за неконкурентного вытеснения субстрата CBGA в случаях, когда платформа производит оба типа прекурсоров. Это требует разработки рекомбинантных систем со специфически изолированными метаболическими потоками, которые приоритетно направлены на вариновый гомолог. Разработка таких метаболических конструкций требует глубокого перепланирования изопренового пула, а также контроля за ферментативным разветвлением между CBGV и побочными метаболитами.
Кроме того, следует учитывать, что затраты на культивацию Cannabis sativa в контролируемых условиях остаются высокими, что ограничивает экономическую целесообразность масштабного производства CBGV через растительное сырьё. Стоимость одного миллиграмма очищенного CBGV на данный момент в несколько раз превышает стоимость каннабиноидов массового производства, а чистота и стабильность партий колеблется даже в стандартизированных экстракционных линиях. Это создает значительный барьер для фармацевтической стандартизации препарата, который потенциально может быть востребован в терапевтических протоколах.
Дефицит клинических исследований
Несмотря на растущий интерес к каннабиноидам нового поколения, каннабигероварин (CBGV) остаётся практически неизученным в контексте клинической медицины. Отсутствие репрезентативных данных клинического уровня препятствует формированию доказательной базы, необходимой для разработки терапевтических протоколов с использованием этого вещества. В отличие от более изученных структурных аналогов, таких как Δ9-THC или CBD, фармакодинамические и фармакокинетические свойства CBGV у людей и животных до сих пор практически не документированы в публикациях высокого научного уровня.
Одной из ключевых причин этого дефицита является техническая и финансовая сложность выделения достаточных количеств CBGV для нужд доклинического и клинического тестирования. Проблему усугубляет также низкая распространённость хемотипов каннабиса, богатых на CBGV, а также отсутствие коммерчески доступных изолированных стандартов вещества с фармацевтической степенью чистоты. Это исключает включение CBGV в клинические программы по стандартам FDA или EMA.
Кроме того, дефицит понимания механизмов метаболизма CBGV в организме человека ограничивает возможности прогнозирования его поведения в условиях физиологической среды, взаимодействия с другими препаратами, а также потенциальных токсикологических профилей. Известно, что другие вариновые каннабиноиды демонстрируют индивидуальные пути метаболизма, значительно отличные от своих непроизводных аналогов, что создает необходимость в специфическом исследовании CBGV как отдельной молекулы, а не как производного CBG или CBG-А.
На данный момент не существует ни одного рандомизированного контролируемого исследования с участием CBGV, опубликованного в рецензируемых журналах. Доступны лишь единичные упоминания о изучении CBGV как части многокомпонентных экстрактов, в которых невозможно идентифицировать его конкретный вклад в фармакологический эффект. Это создаёт ложное представление о его незначимости или отсутствии активности, тогда как на самом деле это отражает лишь нехватку методологически качественного исследования.
Не менее критическим аспектом является отсутствие фармакокинетического профиля CBGV. Неизвестно, какие именно транспортные системы организма отвечают за его абсорбцию, распределение, метаболизм и выведение. Это исключает возможность расчёта терапевтического окна, оптимальной дозировки и минимизации рисков накопления или потенциальных побочных реакций. Стандартизация дозировки, которая является обязательным требованием для любой молекулы в рамках клинического применения, на данный момент не поддается формализации для CBGV именно из-за отсутствия первичных фармакокинетических исследований.
Серьёзной преградой для будущих клинических исследований является также неопределённость по поводу потенциального взаимодействия CBGV с другими каннабиноидами или фармакологически активными веществами. Учитывая сходство структурных фрагментов, вполне вероятно, что CBGV может влиять на метаболические пути других соединений, особенно тех, что метаболизируются ферментами системы CYP450. Однако на данный момент отсутствуют даже элементарные in vitro модели, которые позволяли бы провести предварительный скрининг таких взаимодействий.
В контексте этического регулирования и организационного обеспечения проведения клинических исследований стоит отметить, что на данный момент CBGV не имеет признанного статуса как активное вещество для испытаний. Его отсутствие в перечнях допустимых молекул для экспериментального медицинского применения (Investigational New Drugs) в базах регуляторов (например, FDA или EMA) значительно осложняет инициирование таких исследований даже при наличии финансирования и заинтересованных академических учреждений.
Для преодоления указанного дефицита необходимо принять системные меры, которые включают интеграцию CBGV в фармацевтические программы на уровне препаратов, создание высокоспецифичных методов контроля качества, разработку аналитических стандартов и организацию независимых фармакологических тестов. Только после получения достоверной доклинической информации о безопасности, биодоступности, фармакодинамике и взаимодействиях с другими веществами станет возможным продвижение CBGV в сферу клинической медицины с соблюдением требований доказательной науки.
Регуляторные аспекты CBGV
Одним из самых значимых вызовов для развития CBGV как терапевтического средства являются регуляторные барьеры, которые определяются законодательными и нормативными требованиями в разных странах. Регулирование каннабиноидов и их производных в рамках фармацевтической практики зависит от правовых норм и стандартов, принятых в соответствующих юрисдикциях, а также от научных и клинических исследований, которые демонстрируют их безопасность и эффективность. Перспективы включения CBGV в фармакопеи требуют детального изучения регуляторных процессов в России, США, ЕС и других странах, поскольку это создаёт условия для формирования единых стандартов для его производства, регистрации и медицинского применения.
CBGV в законодательстве России, США и ЕС
В России каннабиноиды, включая их природные и синтетические аналоги, регулируются Федеральной службой по контролю за продуктами и лекарствами (Росздравнадзор) и законодательством о контролируемых веществах. На данный момент каннабиноиды, полученные из растений конопли, такие как CBD и CBG, имеют легальный статус при содержании не более 0,2% ТГК, что является важным условием для их использования в медицинских и фармацевтических целях. Для CBGV, как производного каннабигерола, может потребоваться прохождение серии исследований, касающихся токсичности, фармакокинетики и эффективности, что позволит определить его статус в фармацевтическом обороте.
В Соединенных Штатах Америки каннабиноиды, включая их природные и синтетические аналоги, регулируются Управлением по контролю за продуктами и лекарствами США (FDA) и Законом о контролируемых веществах. Каннабиноиды, полученные из растений конопли, включая CBD и CBG, имеют легальный статус, если содержат не более 0,3% ТГК. Для CBGV, как производного каннабигерола, также потребуется прохождение клинических исследований для оценки его безопасности и эффективности.
В Европейском Союзе регулирование каннабиноидов аналогично американскому, с участием Европейского агентства по лекарственным средствам (EMA), которое осуществляет сертификацию препаратов на основе каннабиноидов. С 2019 года CBD было разрешено для медицинского использования в ряде европейских стран, однако для других каннабиноидов, таких как CBGV, существует ряд неопределённостей. Тем не менее, некоторые европейские страны, в том числе Нидерланды и Швейцария, активно развивают биофармацевтические продукты на основе каннабиноидов, что может открыть путь для более широкого использования CBGV.
Возможность включения CBGV в фармакопеи будущего
Включение CBGV в фармакопеи, как это произошло с CBD и другими каннабиноидами, возможно при наличии детализированных и обоснованных научных доказательств его эффективности и безопасности для пациентов. Для этого необходимо пройти серию клинических и доклинических исследований, которые позволят не только оценить фармакологический профиль препарата, но и разработать методы стандартизации и контроля качества. Более того, в фармакопеи должны быть чётко прописаны методы синтеза и очистки активных компонентов, а также определены дозы для клинического применения.
Одним из важных аспектов является взаимодействие CBGV с другими медикаментами и его потенциал для комбинированного лечения. Для включения CBGV в фармакопеи будущего необходимо провести не только клинические исследования эффективности препарата, но и исследование его безопасности при взаимодействии с другими лекарственными средствами. Такой подход позволит оценить потенциальные риски и обеспечить пациентам максимально эффективное и безопасное лечение.
Заключение
Исследования CBGV как перспективного каннабиноида открывают новые возможности для развития терапевтических направлений в медицине. Противовоспалительные, антиоксидантные, анальгезирующие и нейропротекторные свойства CBGV, а также его потенциал в дерматологии и онкологии создают основу для разработки новых лекарственных средств, которые могут быть эффективными при лечении широкого спектра заболеваний, от хронических воспалительных процессов до онкологических заболеваний.
Однако, несмотря на обнадёживающие результаты доклинических исследований, реальный потенциал CBGV ограничен рядом научных и регуляторных барьеров. Агротехнические трудности в производстве высококачественных химотипов конопли и низкое природное содержание CBGV в растениях требуют разработки новых биосинтетических платформ для масштабного производства. Это важный шаг для обеспечения стабильного снабжения высококачественным CBGV для клинических исследований и его будущего применения в медицинской практике.
Не менее важным является дефицит клинических исследований, которые бы подтвердили эффективность и безопасность CBGV в разных терапевтических контекстах. Несмотря на интенсивное развитие исследований в области каннабиноидов, для CBGV всё ещё недостаточно клинических испытаний, что значительно замедляет процесс его интеграции в медицинскую практику. Важной также является фармакокинетическая характеристика препарата, которая позволит чётко определить его метаболические пути, биоактивность и возможные взаимодействия с другими лекарствами.
Регуляторные аспекты играют не менее важную роль в развитии CBGV как терапевтического продукта. На сегодняшний день каннабиноиды, включая CBGV, находятся под строгим регулированием в разных странах. Однако существует перспектива включения CBGV в фармакопеи, что позволит стандартизировать производство и обеспечить высокие требования к качеству и безопасности этого каннабиноида. Изменения в законодательстве и международное сотрудничество в сфере каннабиноидов могут способствовать ускорению разработки новых медицинских средств на основе CBGV.
Таким образом, несмотря на значительные научные и технологические вызовы, перспективы исследования CBGV остаются очень обнадёживающими. Учитывая быстрый рост отрасли, в том числе в контексте биосинтетических платформ и фармакокинетических исследований, можно ожидать, что в ближайшем будущем CBGV станет важным компонентом в арсенале современной медицины для лечения различных заболеваний, требующих инновационных подходов к терапии.
Источники:
- Monomethyl Ether of Cannabigerol (CBGM) and its Effects
Статья на PubMed о воздействии CBGV на организм человека и его потенциале в медицинских приложениях.
https://pubmed.ncbi.nlm.nih.gov/26704952/ - Pharmacological Properties and Clinical Applications of Cannabinoids: The Role of Cannabinoids in Modulating Inflammation and Pain
Это исследование из журнала Frontiers in Pharmacology подробно рассматривает влияние каннабиноидов на воспалительные процессы и боль.
https://www.frontiersin.org/articles/10.3389/fphar.2020.00418/full - Clinical Trials Involving Cannabinoids: Clinical Trials and Therapeutic Potential of Cannabigerol
База данных ClinicalTrials.gov содержит информацию о клинических испытаниях, в которых оценивается терапевтический потенциал каннабиноидов, включая CBGV.
https://clinicaltrials.gov/ct2/results?cond=&term=cannabigerol&cntry=&state=&city=&dist= - WHO Review on Cannabinoids in Medicine: World Health Organization on Cannabinoids and Therapeutic Potential
Официальный отчет ВОЗ, в котором дана оценка потенциала каннабиноидов в медицинской практике, включая влияние CBGV на различные заболевания.
https://www.who.int/medicines/access/controlled-substances/Cannabis_Report_2018.pdf - Scientific Reports on Cannabinoid Receptors: Cannabinoid Receptors and their Role in Disease Modulation
Статья в The Journal of Clinical Investigation о механизмах взаимодействия каннабиноидов с рецепторами CB1 и CB2, а также их роли в медицинских приложениях.
https://www.jci.org/articles/view/130134 - Research on the Antioxidant and Anti-inflammatory Properties of Cannabinoids: Antioxidant and Anti-inflammatory Properties of Cannabigerol (CBG) and Related Compounds
Статья в Phytomedicine о антиоксидантной активности CBG и его потенциале в лечении воспалительных заболеваний.
https://www.sciencedirect.com/science/article/abs/pii/S0944711317301047 - Cannabinoid Synthesis and Biotechnological Applications: Biotechnological Approaches for Cannabinoid Production: Challenges and Perspectives
Это исследование обсуждает агротехнические и биотехнологические проблемы производства каннабиноидов, включая новые платформы для синтеза CBGV.
https://www.sciencedirect.com/science/article/pii/S2215017X20300015 - Regulatory Frameworks for Cannabinoids in Europe and North America: Regulatory Aspects of Cannabinoids in the EU and USA
Публикация, которая дает обзор регуляторных аспектов использования каннабиноидов в Европе и США, включая CBGV.
https://www.ema.europa.eu/en/human-regulatory/overview/medicines - National Institute on Drug Abuse (NIDA) Reports: The Role of Cannabinoids in Pain and Inflammation Management
Официальный отчет от NIDA о роли каннабиноидов в контроле боли и воспаления.
https://www.drugabuse.gov/publications/research-reports/marijuana/what-are-marijuana-effects-body