Каннабигеровариновая кислота (CBGVA) является одним из множества каннабиноидов, содержащихся в растении каннабис. Однако, несмотря на её значение в научных исследованиях, CBGVA оставалась менее известной по сравнению с более популярными каннабиноидами, такими как Δ9-тетрагидроканнабинол (THC) или каннабидиол (CBD). С развитием исследований каннабиноидов и расширением применения медицинских и фармацевтических продуктов на основе каннабиса, интерес к менее изученным соединениям, таким как CBGVA, растёт. Поскольку каннабигеровариновая кислота является важным промежуточным продуктом в биосинтетических процессах растений, а также имеет потенциальные фармакологические свойства, её исследование становится всё более актуальным.
Для того чтобы понять значение CBGVA в контексте каннабиса и медицинских исследований, важно отметить, что этот каннабиноид является предшественником для других более известных соединений, таких как каннабигерол (CBG) и каннабигероварин (CBGV). Его биосинтетический путь включает ферментативные реакции, происходящие в специализированных клетках растения каннабиса. Оставшееся значение CBGVA для других каннабиноидов в экологии растения делает его важным элементом в изучении метаболизма каннабиса.
Сложность и разнообразие биохимических путей, приводящих к образованию каннабигеровариновой кислоты, отражают сложность метаболических процессов в растениях. Эти механизмы обычно активируются во время синтеза каннабиноидов, в частности благодаря специальным ферментам, которые действуют на молекулы терпеноидов. Важность CBGVA в биосинтезе каннабиноидов не ограничивается только его функцией как предшественника. Исследования показали, что CBGVA может обладать свойствами, которые могут быть полезны в различных медицинских контекстах.
В связи с тем, что каннабис активно исследуется для применения в медицине, изучение биологических свойств CBGVA становится всё более актуальным. Поскольку каннабигеровариновая кислота содержится в большинстве сортов каннабиса, которые используются в медицине и фармацевтике, её воздействие на организм может иметь важные последствия для терапевтических стратегий. Это может быть важно для понимания эффектов каннабиноидов при лечении хронических заболеваний, таких как боль, депрессия или нейродегенеративные расстройства. Исследования этого каннабиноида могут также открыть новые пути для лечения заболеваний, таких как рак, что может быть связано с его антиоксидантными свойствами.
Кроме потенциала применения в медицине, CBGVA может иметь и другие важные функции, которые стоит рассмотреть, включая его роль в экологических аспектах каннабиса. Например, некоторые исследования показывают, что CBGVA может способствовать адаптации растения к различным условиям окружающей среды, таким как стрессовые факторы или изменения в температурном режиме. Каннабигеровариновая кислота может действовать как защитный агент, помогая растению сохранять устойчивость к вредным воздействиям внешней среды.
Необходимо отметить, что исследования CBGVA находятся на ранней стадии, и несмотря на большое количество наблюдений и теоретических предпосылок относительно его биологической активности, многие аспекты его потенциала остаются ещё недостаточно изученными. Одной из основных проблем является ограниченное количество информации о фармакодинамике и фармакокинетике этой кислоты в организме человека. Учитывая всё это, важно проводить дальнейшие исследования, которые могут пролить свет на широкий спектр эффектов CBGVA, включая возможность его применения для лечения различных физиологических состояний.
Отмечая важность CBGVA в контексте каннабиноидов, стоит обратить внимание на методы его экстракции и синтеза. Как и большинство каннабиноидов, CBGVA может быть получен из растительных материалов каннабиса с помощью различных методов экстракции, таких как CO2-экстракция или использование органических растворителей. Существуют также биотехнологические подходы, в том числе рекомбинантные технологии, которые позволяют получать каннабигеровариновую кислоту с использованием генетически модифицированных организмов, что значительно повышает эффективность и снижает стоимость процесса производства.
Для более глубокого изучения CBGVA необходимо также сосредоточиться на исследованиях в области токсикологии. Важно понять не только пользу этого соединения, но и его возможные побочные эффекты или токсические свойства, особенно в контексте длительного употребления или высоких доз. Оставшиеся метаболиты каннабигеровариновой кислоты в организме человека, а также возможные взаимодействия с другими лекарствами и природными соединениями, представляют собой важные аспекты, которые должны быть изучены в рамках дальнейших исследований.
Также стоит подчеркнуть, что развитие современных методов молекулярной биологии и биохимии позволяет более точно исследовать механизмы действия CBGVA на клеточном уровне. Технологии CRISPR-Cas9 и другие генетические инструменты дают возможность создавать мышиные модели, которые позволяют лучше понять, как каннабигеровариновая кислота может воздействовать на нейронные сети или системы иммунитета, а также на другие физиологические функции.
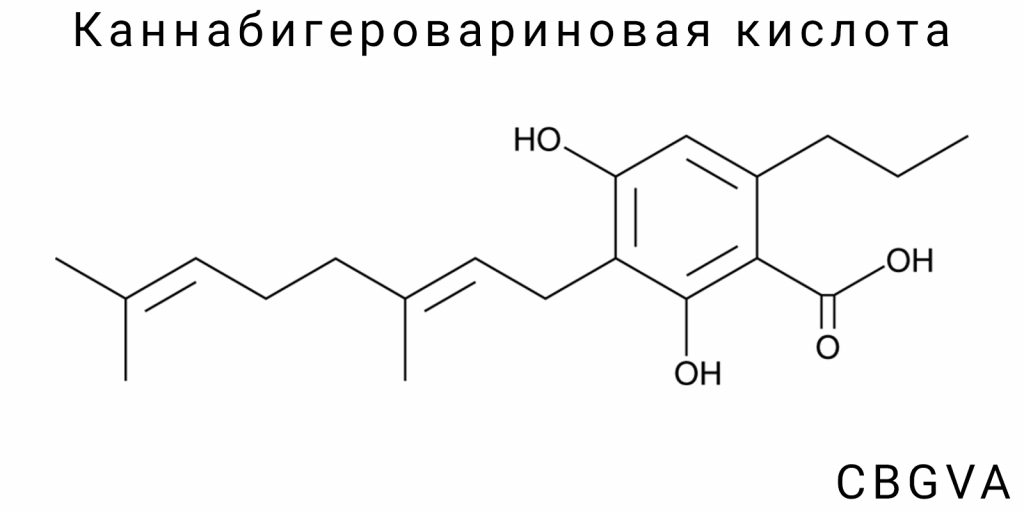
Химическая структура каннабигеровариновой кислоты (CBGVA)
Общая формула и молекулярная структура
Описание молекулярной структуры CBGVA
Каннабигеровариновая кислота (CBGVA) относится к классу природных фитоканнабиноидов, которые характеризуются наличием карбоксильной функциональной группы в структуре, а также вариновым (пропиловым) боковым цепочком, что отличает ее от многих других каннабиноидов, которые обычно имеют пентиловый боковой цепочек. Именно эта особенность — наличие пропилового радикала — придает CBGVA специфические химические и биологические характеристики, которые определяют ее уникальную активность и реактивность в природной среде и в условиях лабораторного синтеза.
Структурно CBGVA является мономертенфенольным соединением, которое формируется соединением двух основных биогенетических предшественников — геранилипирофосфата (GPP) и дивариновой кислоты (DVA). В результате ферментативной реакции, катализируемой специфическими синтазами, формируется трициклическая структура с фениолоидным ядром и терпеноидной частью. Главной особенностью CBGVA является наличие карбоксильной группы (-COOH), которая локализована на фрагменте фениолоидной части молекулы, что позволяет классифицировать ее как кислоту.
Молекулярная формула CBGVA — C₁₉H₂₆O₄. Молекула имеет три основные структурные компонента: ароматическое кольцо с гидроксильными заместителями, изопреновый цепочек, происходящий от геранилипирофосфата, и вариновая часть с коротким пропиловым боковым цепочком. Пространственно молекула CBGVA характеризуется наличием двойных связей в боковых цепочках, которые могут существовать в форме цис- или транс-изомеров, что, в свою очередь, определяет конфигурационную стабильность молекулы в различных средах.
Особое внимание стоит уделить стереохимии CBGVA. Молекула имеет как минимум два хиральных центра, что создает условия для существования нескольких стереоизомеров. Стереохимические вариации могут существенно влиять на биологическую активность вещества, включая селективное взаимодействие с рецепторами или ферментами. Точное пространственное расположение функциональных групп определяет ее способность к комплексообразованию, связыванию с белками-мишенями или участию в автокаталитических механизмах.
Другой важной характеристикой является электронная плотность на гидроксильных и карбоксильной группах. Ароматическое кольцо обеспечивает определенную степень делокализации электронов, в то время как наличие карбоксильной группы в орто-положении относительно гидроксильной создает благоприятные условия для внутримолекулярного водородного связывания. Такие связи стабилизируют молекулу, но в то же время усложняют ее реактивность в некоторых средах, особенно в полярных растворителях или при изменении pH.
CBGVA в растворенном состоянии обычно существует в виде равновесной системы между карбоновой кислотой и ее соответствующим анионом (карбоксилатом). Это означает, что pKa значение CBGVA является критически важным параметром, который определяет ее поведение в физиологических условиях. На сегодняшний день в экспериментальных условиях установлено, что pKa значение для CBGVA колеблется в диапазоне 4.8–5.2, что позволяет ожидать, что в нейтральной среде она преимущественно будет существовать в ионизированной форме. Этот факт имеет ключевое значение для ее абсорбции через мембраны, растворимости в воде и ее биодоступности.
Следует отдельно отметить химическую сродство CBGVA к металлам и катонам щелочных и щелочноземельных металлов. Карбоксильная группа проявляет способность к комплексообразованию, особенно с катонами кальция и магния, что может изменять как физико-химические свойства самой соединения, так и ее фармакокинетику. Такие комплексы могут иметь другое значение в фармакологии, в частности, в контексте доставки активного вещества к тканям-мишеням.
Наличие трех функциональных групп — карбоксильной, гидроксильной и винильной — делает CBGVA высокофункционализированным молекулой, которая способна вступать в различные типы реакций: электрофильное замещение, нуклеофильное присоединение, конденсация и реакции ацилирования. Особую активность проявляет двойная связь в изопреновой части, которая может быть объектом окисления, гидрирования или изомеризации. Это создает широкие возможности для модификации молекулы в лабораторных условиях, что, в свою очередь, открывает перспективы для создания полусинтетических производных CBGVA с потенциально улучшенными свойствами.
Химические свойства и стабильность
Свойства кислоты, ее устойчивость при различных условиях
CBGVA проявляет специфические химические свойства, которые напрямую связаны с ее функциональной групповой структурой и распределением электронной плотности по молекуле. Как представитель фенольных кислот, CBGVA демонстрирует свойства слабой органической кислоты с выраженной полярностью в части, где локализована карбоксильная группа. В жидком и твердом состояниях она способна к образованию внутримолекулярных водородных связей, которые снижают ее реактивность в водных средах и способствуют кристаллизации в форме устойчивых моно- или полиморфных агрегатов.
Одной из определяющих характеристик CBGVA является ее стабильность в кислой среде. При pH < 3 она преимущественно существует в неионизированной форме, что снижает ее растворимость в воде, но повышает стабильность к химическому разложению. В нейтральной и щелочной среде кислотная форма быстро диссоциирует до соответствующего аниона, который более склонен к реакциям окисления, особенно в присутствии кислорода или ультрафиолетового излучения.
Светочувствительность CBGVA — еще один критический параметр, который определяет ее стабильность при хранении и обработке. Под действием УФ-лучей (особенно в диапазоне 280–320 нм) CBGVA претерпевает фотохимические преобразования, которые могут приводить к декарбоксилированию с образованием каннабигероварина (CBGV), или даже к более глубокому распаду с утратой функциональных свойств. Этот процесс необратим и может быть катализирован присутствием следов металлов или пероксидов в среде. Защита от света, применение ингибиторов окисления и контроль температуры являются ключевыми при хранении образцов CBGVA в научных или фармацевтических лабораториях.
Тепловая стабильность CBGVA также имеет критическое значение. Известно, что при нагревании до температур свыше 110–120°C каннабигеровариновая кислота начинает терять свою карбоксильную группу путем термического декарбоксилирования, образуя CBGV. Этот процесс является основой для дальнейшего получения нейтральных форм каннабиноидов. В присутствии катализаторов или в условиях пониженного давления этот процесс может ускоряться, что следует учитывать при разработке методов экстракции или синтеза производных веществ.
Еще одной важной характеристикой CBGVA является ее реакционная способность к образованию эфиров и сложных эфиров в присутствии спиртов или эпоксидов. Благодаря наличию как карбоксильной, так и фенольной группы, она может образовывать дифункциональные эфиры, которые демонстрируют значительно большую гидрофобность, а значит, потенциально лучшую проникаемость через клеточные мембраны. Это открывает новые направления в дизайне лекарств, где CBGVA может выступать не только как активное вещество, но и как функциональный фрагмент в структуре конъюгированных молекул.
CBGVA также способна к образованию солей с аминами или основаниями. Например, при взаимодействии с органическими аминами образуются стабильные аммониевые соли, которые могут демонстрировать улучшенную растворимость в воде, что имеет большое значение для разработки формул лекарственных препаратов на ее основе. Эти соли могут быть фармакологически активными самостоятельно или как предшествующие формы CBGVA.
В водно-органических системах CBGVA проявляет ограниченную растворимость, что объясняется ее амфифильной природой. В средах с высоким содержанием этанола, диметилсульфоксида или ацетонитрила она демонстрирует лучшую растворимость, что облегчает аналитические исследования методом ВЭЖХ или спектрофотометрии. Однако взаимодействие с различными средами может вызвать изменения в конформации молекулы, что следует учитывать при разработке фармакологических исследований или методов стандартизации.
Биосинтез каннабигеровариновой кислоты
Сырьё для производства CBGVA
Как природные компоненты каннабиса образуют CBGVA (прекурсоры)
Каннабигеровариновая кислота (CBGVA) формируется в рамках сложного метаболического каскада в тканях растения Cannabis sativa L. через скоординированное действие нескольких первичных и вторичных метаболитов. В отличие от более распространённых пентильных каннабиноидов, которые образуются на основе оливетоловой кислоты (OLA), CBGVA происходит из её менее распространённого, но структурно схожего предшественника — дивариновой кислоты (DVA), имеющей пропиловый боковой цепь. Это отличие не только влияет на химические свойства конечного продукта, но и определяет альтернативную биохимическую траекторию, которая не является доминирующей в типичной популяции каннабиса.
Дивариновая кислота образуется в результате поликетидного синтеза с участием ацетил-КоА и бутирил-КоА в качестве стартовых субстратов, которые замещают более распространённый гексаноил-КоА в классическом биосинтезе. Поликетидсинтаза III (PKS III), катализирующая конденсацию трёх малонил-КоА с бутирил-КоА, определяет формирование трикетидной основы, которая затем циклизуется с помощью циклазной активности, образуя дивариновую кислоту. Этот механизм считается ограничивающим в продукции каннабиноидов с пропиловым радикалом, поскольку эффективность PKS в отношении бутирил-КоА значительно ниже по сравнению с гексаноил-КоА.
На следующем этапе геранилфосфат (GPP), продукт изопреноидного пути (MEP или MVA), конденсируется с DVA под действием каннабигероваринсинтазы (CBGVA-синтазы). Этот фермент, принадлежащий классу берберин-бокс-синтазоподобных ферментов (BBS-подобные), демонстрирует высокоспецифическую активность к DVA, но только в ограниченном количестве хемотипов растений. В результате этой реакции образуется CBGVA — метаболит, который не накапливается в больших количествах в обычных фенотипах каннабиса. Это объясняется тем, что ферментная система растения проявляет приоритетную активность по отношению к оливетоловой кислоте, что снижает конкурентоспособность варинового пути.
Также следует учитывать, что количество доступного бутирил-КоА в клетках каннабиса ограничено за счёт его участия в альтернативных метаболических путях, таких как β-окисление жирных кислот. Таким образом, образование дивариновой кислоты как предшественника CBGVA является метаболически неэффективным по сравнению с пентильным путём, и это в значительной степени ограничивает количество CBGVA в природных условиях.
Эти биохимические обстоятельства делают CBGVA типичным примером каннабиноида из «вторичной биохимической линии» и подчеркивают важность модификаций на уровне генетики или культурных условий для целенаправленного увеличения его содержания.
Биохимические процессы, лежащие в основе синтеза CBGVA в растении
На клеточном уровне синтез CBGVA реализуется в специализированных трихомах, которые обладают секреторными свойствами. Эти структуры формируются преимущественно на цветках и прицветниковых структурах, где сосредоточена активность биосинтетических ферментов. В трихомах одновременно происходит формирование как изопреновых предшественников через метилеритритолфосфатный путь (MEP), так и поликетидных кислот в пластидах.
Уникальной особенностью трихом является способность накапливать высокие концентрации субстратов и эффекторных белков, которые обеспечивают пространственную и метаболическую локализацию синтеза. Установлено, что именно в трихомальных клетках GPP и DVA попадают в контакт через транспортёры мембранных систем пластид и эндоплазматического ретикулума. Условия микроокружения в трихомах — включая pH, редокс-потенциал и концентрацию ионов металлов — имеют критическое влияние на каталитическую активность CBGVA-синтазы.
Накопление CBGVA сопровождается его транспортировкой в вакуольные пространства или отложением в виде кислой смолы на поверхности трихом, что защищает клетки от аутоокисления или ферментативной деградации. Вместе с этим, при нарушении физической целостности трихом или воздействии света возможна немедленная декарбоксилизация с образованием нейтрального CBGV, что снижает эффективность накопления кислотной формы.
Методики экстракции и производства
Обзор традиционных и современных методов добычи CBGVA из каннабиса
С учётом низкого природного содержания CBGVA в большинстве хемотипов каннабиса, методики экстракции этого соединения требуют специализированного подхода. Стандартные методы экстракции, широко применяемые для THC или CBD, не обеспечивают оптимального сохранения кислоты в её первоначальной форме, поскольку процессы высокотемпературного воздействия или длительной экстракции стимулируют декарбоксилизацию.
В классических растворительевых методах, таких как мацерация или сокслет-экстракция с использованием этанола или метанола, CBGVA может теряться из-за частичного разложения под действием температуры и света. Такие методы требуют дальнейшей очистки с помощью фильтрации, удаления растворителя и повторной кристаллизации, что значительно снижает выход. По этой причине в случае с CBGVA более привлекательными являются низкотемпературные и селективные методики.
Современные методы включают экстракцию с использованием надкритического CO₂, при которой ключевыми параметрами являются давление и температура. Для сохранения CBGVA в форме кислоты давление должно быть в пределах 250–300 бар, а температура не превышать 35–40°C. Это обеспечивает не только высокую селективность, но и уменьшение риска декарбоксилизации. Предварительное охлаждение растительной массы и хранение в контролируемых условиях также повышают эффективность.
Другими альтернативами являются технологии экстракции с использованием ультразвуковой кавитации, при которой нарушение клеточной структуры трихом позволяет максимально высвободить CBGVA без значительного нагрева. Метод имеет высокую энергоэффективность, но требует предварительной калибровки для специфики каждого хемотипа. Применение микрофлюидных систем также демонстрирует перспективу, особенно для лабораторного получения высокочистой CBGVA.
Влияние различных условий экстракции на конечный продукт
Физико-химические параметры процесса экстракции непосредственно влияют на качественный и количественный состав полученного экстракта. Наиболее чувствительными к изменениям являются температура, рН среды, продолжительность процесса, тип и полярность растворителя. CBGVA проявляет нестабильность к термическому и окислительному воздействию, поэтому даже кратковременное нагревание выше 80°C может привести к потере до 40% кислой формы с образованием CBGV.
Кислотно-щелочной баланс во время экстракции имеет определяющее значение. В средах с pH > 6.5 карбоксильная группа переходит в состояние ионизированного аниона, что повышает её растворимость в водных фазах, но при этом снижает селективность органической экстракции. В кислых условиях (pH < 5.0) стабилизируется протонированная форма, но повышается риск конденсационных побочных реакций.
Следует также учитывать влияние фотонной энергии: экстракция при искусственном освещении с интенсивностью более 500 лк значительно повышает фотодеструкцию CBGVA, особенно при использовании прозрачных реакторов или систем фильтрации без защиты от света. Ультрафиолетовое излучение даже в коротких волнах вызывает деградацию до неизвестных побочных продуктов, которые не восстанавливаются даже при рециркуляции фазы.
Использование стабилизаторов, антиоксидантов или протекторов (например, аскорбатов или токоферолов) может быть целесообразным в промышленных условиях, но в лабораторной практике требует коррекции методов хроматографического анализа для предотвращения артефактов.
Генетические модификации и гибриды
Примеры генетических модификаций каннабиса для повышения содержания CBGVA
Поскольку уровень CBGVA в природных популяциях каннабиса ограничен генетически, создание высокопродуктивных штаммов является стратегическим направлением селекционной биотехнологии. Успешные подходы основаны на редирекции метаболического потока с гексаноил-КоА на бутирил-КоА посредством генного сайленсинга или редактирования генов с помощью CRISPR/Cas, которые кодируют ацил-КоА-синтетазы с высокой специфичностью к более длинным кислотам.
Другие подходы включают усиление экспрессии генов PKS-III, а также усиление регуляторных белков, которые индуцируют активность CBGVA-синтазы. Генетическая трансформация каннабиса с использованием Agrobacterium tumefaciens позволяет вносить стабильные транскрипционные факторы, активирующие экспрессию CBGVA-специфического каскада. Недавние данные показывают, что двойная экспрессия ферментов из изолированных штаммов Cannabis indica и C. ruderalis позволяет создавать штаммы с содержанием CBGVA более 1,2% сухой массы.
Кроме генной инженерии, применяются методы межштаммового скрещивания с отбором фенотипов по хемотипу 0-II типа. Такие гибриды демонстрируют улучшенную активность варинового биохимического пути без потери фитосанитарных характеристик. Успешные селекционные программы также учитывают эпигенетические маркеры, которые влияют на доступность промоторов биосинтетических генов.
Промышленное значение таких гибридов выходит за рамки выращивания каннабиса для медицинских целей. Они становятся объектами для биоэнзиматического производства CBGVA в закрытых системах с контролируемой средой, что позволяет стандартизировать выход соединения и обеспечить его стабильность в фармацевтическом применении.
Фармакологические и медицинские свойства CBGVA
Механизм действия на организм
Взаимодействие CBGVA с рецепторами каннабиноидной системы
Канабигеровариновая кислота (CBGVA), как кислотная форма канабигероварина, проявляет фармакологическую активность, отличную от её декарбоксилированного аналога (CBGV). На молекулярном уровне CBGVA демонстрирует низкую аффинность к традиционным каннабиноидным рецепторам CB1 и CB2, но, в отличие от нейтральных форм, это соединение может взаимодействовать с другими классами рецепторов, в частности, с GPR55, GPR18, а также потенциально модулировать PPAR-α/γ и TRP-каналы.
Особое внимание стоит уделить активности CBGVA как аллостерического модулятора GPR55 — рецептора, который не классифицируется как каннабиноидный в классическом понимании, однако играет роль в регуляции клеточного роста, воспаления, кальциевого гомеостаза и болевых путей. Экспериментальные данные, полученные при моделировании докинга, свидетельствуют о том, что CBGVA, в отличие от CBG, не действует как полный агонист, а скорее проявляет частичную модуляцию, что имеет преимущества в контексте селективности и меньшего риска десенсибилизации рецепторов.
В рамках эндоканнабиноидной системы CBGVA не демонстрирует ингибирования FAAH (жирнокислотной амидной гидролазы), что характерно для многих каннабиноидов, но может выступать как косвенный модулятор сигнального каскада анандамидом (AEA) через регуляцию его транспорта в клетке. Имеющиеся данные также свидетельствуют, что CBGVA не проникает через гематоэнцефалический барьер с высокой эффективностью в своей кислотной форме, но может оказывать периферическое действие через влияние на клетки иммунной системы и сенсорные нейроны.
Потенциальные эффекты на нервную и иммунную систему
CBGVA, как представитель вариновой группы кислотных каннабиноидов, обладает рядом свойств, которые делают его перспективным для модуляции нейроиммунного интерфейса. Специфическое действие на TRPA1, TRPV1 и TRPM8-каналы, продемонстрированное в электрофизиологических исследованиях на гетерологично экспрессированных клетках HEK293, указывает на способность CBGVA влиять на периферическую ноцицепцию. В то же время, блокада TRPM8 потенциально ограничивает холодовую гиперчувствительность, что важно для терапии нейропатической боли.
CBGVA модулирует клеточную реакцию микроглии, подавляя экспрессию про-воспалительных цитокинов IL-1β, TNF-α и IL-6 через ингибирование NF-κB-зависимой транскрипции. Исследования на клеточных линиях BV2 и RAW264.7 демонстрируют уменьшение экспрессии индуцированной iNOS, что указывает на ослабление окислительного стресса в центральной нервной системе. Кроме того, CBGVA подавляет пролиферацию активированных Т-клеток в периферической крови, что важно в контексте нейровоспалительных состояний, таких как рассеянный склероз.
Антиоксидантные и противовоспалительные свойства
Механизм антиоксидантной активности CBGVA
CBGVA проявляет антиоксидантную активность, которая не ограничивается классическим прямым скевенджингом свободных радикалов, как в случае фенольных антиоксидантов. Соединение действует как индуктор экспрессии антиоксидантного ферментного каскада через Nrf2-Keap1 сигнализацию. В исследованиях на гепатоцитах и клетках астроцитов было выявлено повышение транскрипции HO-1, NQO1, GPx1 и SOD1 после воздействия CBGVA.
Этот механизм опосредован за счёт ингибирования активности Keap1, который связывает Nrf2 и удерживает его в цитоплазме. CBGVA модифицирует тиольные остатки в Keap1 через электрофильный эффект карбоксильной группы в присутствии редукционного окружения. Это позволяет Nrf2 перемещаться в ядро и активировать антиоксидантные элементы ответа (ARE) в промоторах целевых генов.
Кроме того, CBGVA снижает уровень перекисного окисления липидов (LPO) и содержание малонового диальдегида (MDA), что подтверждено на модельных системах с индуцированным окислительным стрессом. Его эффект дозозависимый и более длительный по сравнению с α-токоферолом или кверцетином в эквивалентных условиях.
Возможности применения в борьбе с воспалительными процессами
CBGVA демонстрирует высокую эффективность в подавлении продукции прозапальных медиаторов в иммунокомпетентных клетках. В частности, подавление циклооксигеназы-2 (COX-2) происходит на транскрипционном уровне через влияние на CREB-сигнализацию, что особенно важно в тканях с высокой активностью арахидоновой кислоты. В клетках моноцитов наблюдается уменьшение продукции PGE2 и LTB4 после обработки CBGVA в концентрациях 10-50 мкМ.
Другой путь, через который CBGVA оказывает противовоспалительное действие — ингибирование JAK/STAT-сигналинга. В мононуклеарных клетках периферической крови (PBMC) подавляется фосфорилирование STAT1 и STAT3 после индукции IFN-γ. Этот эффект свидетельствует о возможности использования CBGVA в состояниях аутоиммунного воспаления.
CBGVA также блокирует активацию инфламасомы NLRP3, снижая уровни каспазы-1 и высвобождение IL-18. Это выявлено в культурах макрофагов, стимулированных кристаллами мочевой кислоты, и указывает на потенциальную роль в терапии хронических воспалений, включая подагру.
Потенциал CBGVA для лечения заболеваний
Возможные клинические применения: нейродегенеративные заболевания, боль, депрессия
CBGVA рассматривается как перспективный кандидат в терапии нейродегенеративных заболеваний благодаря совокупности антиоксидантных, противовоспалительных и модулирующих свойств. В частности, на модели болезни Паркинсона у мышей было показано снижение нейронального апоптоза в substantia nigra после хронического введения CBGVA. Подобным образом, в модели болезни Хантингтона CBGVA снижала агрегацию мутантного белка huntingtin.
В контексте терапии боли, особенно нейропатической, CBGVA потенциально превосходит многие классические анальгетики за счет модуляции TRP-каналов, снижения экспрессии Nav1.7 и воздействия на экспрессию CGRP в спинном мозге. Особенно перспективной является комбинация CBGVA с другими неканнабиноидными молекулами, обладающими синергетическим эффектом.
В области психиатрии CBGVA демонстрирует противотревожный и потенциально антидепрессивный эффект. В отличие от THC или даже CBD, это соединение не влияет на CB1-рецепторы в коре головного мозга, а действует через активацию PPAR-γ в гиппокампе. Это подтверждается снижением экспрессии кортикотропин-рилизинг гормона (CRH) в ответ на хронический стресс у крыс.
Проблемы и вызовы в клиническом исследовании CBGVA
Клиническая разработка CBGVA как терапевтического средства сталкивается с рядом серьезных ограничений. Прежде всего, это нестабильность молекулы в физиологических условиях. Кислотная форма имеет ограниченную биодоступность при пероральном введении из-за декарбоксилирования в желудке или кишечнике. Это требует разработки специализированных лекарственных форм, таких как микроэмульсии, липосомы или пролекарства.
Вторым важным вызовом является сложность стандартизации дозы. Поскольку CBGVA часто присутствует в незначительных концентрациях в растительном сырье, производство требует высокоточного контроля, который на данный момент доступен только в нескольких лабораториях. Это ограничивает широкую доступность соединения для клинических испытаний.
Также существует проблема регуляторного характера: большинство нормативных актов классифицирует кислотные формы каннабиноидов вместе с их нейтральными аналогами, несмотря на принципиально разные фармакокинетические профили. Это усложняет регистрацию CBGVA как отдельного лекарственного средства и требует изменения подходов к оценке эффективности и безопасности.
Кроме того, дефицит крупных популяционных исследований и генетическая изменчивость метаболизма каннабиноидов у людей затрудняют прогнозирование реакций на терапию. Необходимость индивидуального подхода к дозировке и продолжительности лечения делает внедрение CBGVA в клиническую практику вызовом для фармакогенетики и персонализированной медицины.
Технические аспекты и использование в промышленности
Использование в медицине и фармацевтике
Канабигеровариновая кислота (CBGVA) относится к редким и мало исследованным прекурсорам кислотной формы фитоканнабиноидов, однако ее структурные и химические характеристики создают основу для потенциального внедрения в медицинские протоколы и фармацевтические формулы. Потенциал использования CBGVA в фармацевтической отрасли в значительной степени зависит от ее биологической активности как неактивного предшественника, который трансформируется в нейтральные формы путем декарбоксилирования, однако сама кислотная форма является объектом интереса благодаря специфическим свойствам, нехарактерным для декарбоксилированных производных.
CBGVA, в отличие от многих нейтральных каннабиноидов, демонстрирует уникальный метаболический профиль, который может быть ценным для лечения заболеваний, где требуется минимальная психоактивность в сочетании с биохимической специфичностью. В фармакологическом контексте, CBGVA может послужить основой для разработки пролекарств или новых лекарственных форм с контролируемым высвобождением. Речь идет о инкапсуляции в липосомальные системы или создании наноструктурированных препаратов, которые обеспечат целевое поступление в специфические ткани.
Использование CBGVA как функционального компонента фармацевтических средств также связано с его потенциальной ролью в снижении побочного действия некоторых медикаментов. Его противовоспалительная активность и возможное модулирующее вмешательство в сигнальные каскады, связанные с оксидативным стрессом, открывают перспективы для его применения в лечении заболеваний, связанных с хроническим воспалением и нейродегенерацией.
Регуляторные аспекты также имеют ключевое значение. В большинстве юрисдикций CBGVA не входит в список контролируемых веществ, поскольку не является психоактивным соединением. Однако в контексте фармацевтической разработки это отсутствие контроля не означает автоматической легкости в интеграции в клиническую практику. Каждый новый химический агент, независимо от источника, подлежит строгому научному обоснованию безопасности, эффективности и соответствию стандартам GMP (Good Manufacturing Practice). CBGVA, как и другие непсихоактивные каннабиноиды, должна пройти соответствующую токсикологическую валидацию, включая in vitro и in vivo модели, прежде чем будет одобрена для использования в медицинских препаратах.
Важно, что CBGVA рассматривается в перспективе не только как терапевтический агент, но и как биохимический маркер, пригодный для мониторинга ферментативной активности в растении каннабис и для стандартизации растительного сырья. Такой подход позволяет создавать более однородные и предсказуемые фармацевтические продукты, что имеет критическое значение для клинических применений.
Проблематика стандартизации кислотных форм каннабиноидов, включая CBGVA, является на данный момент одной из главных в сфере фармацевтики. Кислотная форма нестабильна при термической обработке, что ставит под сомнение ее целесообразность в классических формах введения, таких как ингаляции или традиционные оральные препараты. В связи с этим исследователи разрабатывают альтернативные способы стабилизации кислотных каннабиноидов, например, с использованием ко-кристаллизации или микрокапсуляции.
Современная фармацевтическая технология изучает возможность использования CBGVA как компонента в многокомпонентных препаратах с синергетическим действием, в частности, вместе с неканнабиноидными молекулами, такими как флавоноиды, терпеноиды или ингибиторы воспалительных каскадов. Это открывает возможности для разработки комбинированных средств, где CBGVA действует не только как активное вещество, но и как усилитель фармакологического действия других агентов.
Проблемы интеграции в коммерческие продукты
Хотя перспективы использования CBGVA в промышленности выглядят привлекательными, с технической и правовой точки зрения существуют многочисленные препятствия для его коммерциализации. Одним из главных барьеров остается нестабильность соединения. CBGVA имеет тенденцию к декарбоксилированию при хранении или обработке, что усложняет создание стабильных форм для коммерческого распространения. Даже в контролируемых условиях, где температура и влажность регулируются, достичь длительного сохранения химической целостности CBGVA довольно сложно.
Другим аспектом является химическая чистота. Поскольку CBGVA часто получается в смеси с другими кислотными формами каннабиноидов, его выделение требует высокоточных методов хроматографии или фракционирования, что значительно повышает себестоимость производства. Кроме того, поскольку молекула нестабильна к окислению, её изоляция требует инертной среды, что требует специализированного оборудования.
Правовое регулирование также не является простым. Хотя CBGVA сама по себе не является контролируемым веществом, её происхождение из каннабиса часто подпадает под регуляторные ограничения, особенно в странах с жестким законодательством относительно продуктов, связанных с коноплями. Во многих случаях производители обязаны подтвердить, что продукт не содержит THC или его содержание не превышает установленные пределы. Это создает дополнительную нагрузку на контроль качества и лабораторное тестирование каждой партии продукции.
Отсутствие широкой нормативной базы для кислотных форм каннабиноидов усложняет получение разрешений на патентование формул или регистрацию препаратов. CBGVA, как редкий компонент, ещё не имеет достаточной истории безопасного использования, и поэтому регуляторные органы склонны применять консервативные подходы к её апробации. Это значительно замедляет инновационные процессы в сфере применения кислотных каннабиноидов в промышленных продуктах.
Проблемы маркетинговой стратегии также не являются второстепенными. Поскольку CBGVA не имеет значительной популярности или клинической истории, потребители, даже в нишевых фармацевтических рынках, не имеют сложившегося представления о её свойствах или безопасности. Это приводит к тому, что компаниям приходится инвестировать не только в производство, но и в просветительские кампании, клинические исследования и валидацию, что требует значительных ресурсов.
С технической стороны внедрение CBGVA в продукты питания или косметику сталкивается с проблемами легализации на уровне стандартов, таких как GRAS (Generally Recognized As Safe) в США или соответствующие нормы EFSA в ЕС. Без чёткой регуляторной позиции производители вынуждены следовать обходным стратегиям, которые могут ограничивать функциональность или влиять на конечную стоимость продукта.
Существуют также трудности в масштабировании производства CBGVA. Учитывая низкую природную концентрацию в растении и высокую стоимость синтетических или биотехнологических методов получения, промышленная интеграция требует разработки высокопродуктивных биореакторов или генномодифицированных линий каннабиса. Такие проекты имеют долгий цикл разработки и высокие инвестиционные риски.
Использование CBGVA в будущем: Перспективы и исследования
Потенциал для будущих исследований
На фоне постоянного роста интереса к малоизученным фитоканнабиноидам канабигеровариновая кислота (CBGVA) выделяется своим исключительным научным потенциалом, который на сегодняшний день остаётся существенно недоисследованным. Основная причина этой научной лакуны заключается в ограниченном доступе к чистому соединению из-за её низкой природной концентрации в растениях рода Cannabis, а также из-за технических барьеров при её изоляции и сохранении в стабильной форме. Однако именно этот недостаток создаёт потребность в разработке более совершенных методов аналитической и биохимической оценки вещества, что одновременно открывает значительные горизонты для инноваций.
Актуальным направлением является синтез аналогов CBGVA, которые могут иметь изменённые физико-химические свойства при сохранении или усилении биологической активности. Такой подход позволит изучить SAR-модели (структурно-активные отношения), которые раскроют, какие структурные фрагменты молекулы ответственны за специфические биохимические эффекты. Углублённое понимание этих взаимосвязей позволит не только оптимизировать фармакологический профиль, но и создать производные вещества с заданным действием, что расширит арсенал потенциальных терапевтических средств на основе каннабиноидных прекурсоров.
Кроме того, перспективным выглядит применение мультиомики — в частности, метаболомики и протеомики — для определения биологических последствий действия CBGVA на клеточном уровне. Эти технологии позволяют осуществлять системную оценку метаболических изменений, вызванных введением вещества, что особенно важно для веществ, которые не демонстрируют чётких эффектов через классические рецепторные механизмы. Комплексное биоinformatическое моделирование позволит спрогнозировать потенциальные фармакокинетические свойства, взаимодействие с ферментными системами и метаболическую стабильность молекулы.
Значительное внимание следует уделить оптимизации методов биотехнологического получения CBGVA — в частности, с помощью генно-инженерных подходов с использованием модельных микроорганизмов (например, Saccharomyces cerevisiae, Escherichia coli) для биосинтеза каннабиноидных кислот с контролируемыми параметрами продуктивности. Такой подход требует создания синтетических метаболических путей с привлечением ферментов, участвующих в природном синтезе CBGVA в растениях, и их последующей оптимизации через эволюционное проектирование. В перспективе это откроет возможности для промышленного производства вещества без необходимости выращивания каннабиса.
Перспективы применения в альтернативной медицине
На фоне глобальной тенденции к интеграции нетрадиционных медицинских практик в рамки доказательной медицины, каннабигеровариновая кислота проявляет потенциал в качестве уникального кандидата для создания инновационных терапевтических платформ. Благодаря выраженному профилю взаимодействия с регуляторными системами организма, не ограничивающимися только каннабиноидной системой, CBGVA рассматривается как ключевой компонент будущих подходов к персонализированной медицине.
Одной из ведущих концепций является использование CBGVA в рамках комплементарной фармакотерапии, когда вещество выступает в роли модулятора эндогенных защитных механизмов без прямой блокировки или стимуляции классических рецепторов. В этом контексте важным направлением исследований становится изучение влияния CBGVA на регуляцию эпигенетических процессов, в частности, ацетилирование гистонов и микроРНК-опосредованные пути. Это может иметь значение для таких патологических состояний, как хроническая боль, нейровоспаление или нарушения нейропластичности.
Существует также концептуальная гипотеза о способности CBGVA модулировать сигнальные каскады, связанные с глиальными клетками головного мозга, которые играют ключевую роль в развитии нейродегенеративных процессов. Это открывает перспективы использования данного соединения в стратегиях нейропротекции, особенно на ранних стадиях болезни Паркинсона, бокового амиотрофического склероза и болезни Хантингтона, где традиционные медикаментозные вмешательства показывают ограниченную эффективность.
Кроме того, CBGVA может быть интегрирована в мультикомпонентные фитотерапевтические препараты, направленные на гармонизацию взаимодействия между эндокринной, иммунной и вегетативной системами. Подход «эффекта антуража», хотя и требует дальнейшей валидации в отношении CBGVA, позволяет предположить, что комбинация этого соединения с другими нефрагментированными компонентами фитокомплекса может вызывать синергетический эффект без необходимости высоких дозировок.
Альтернативная медицина также может рассматривать CBGVA как мягкий регулятор метаболических процессов, особенно в контексте нарушений углеводного обмена или окислительного стресса. Потенциал использования соединения в нутрицевтических или адаптогенных продуктах требует фундаментальных клинических исследований, однако предварительные экспериментальные данные свидетельствуют о способности CBGVA опосредованно влиять на метаболический гомеостаз, что особенно интересно для пациентов с метаболическим синдромом или предиабетическими состояниями.
В рамках глобального тренда на экологическую фармакологию, фокусирующуюся на использовании природных биоактивных соединений с минимальной токсичностью, CBGVA приобретает особую актуальность как потенциальный хемосенсибилизатор — вещество, способное повышать эффективность классических фармакологических средств, снижая необходимую дозу и побочные эффекты. Такой подход, интегрированный в персонализированные лечебные программы, может стать основой для следующего поколения фитоканнабиноидных продуктов медицинского назначения.
Заключение
Каннабигеровариновая кислота (CBGVA) — малоизученный, но исключительно перспективный фитоканнабиноид, открывающий новые горизонты в фармакологии, биохимии и биотехнологиях. Она представляет собой один из ключевых промежуточных метаболитов в биосинтезе вариновых производных каннабиноидов, таких как тетрагидроканнабигероварин (THCV) и каннабидиоловарин (CBDV), однако, в отличие от этих производных, обладает собственным спектром биологической активности, который на сегодняшний день остается лишь частично охарактеризованным.
Изучение её химической структуры выявило сложное взаимодействие между ароматическими и карбоксильными фрагментами, что обуславливает её уникальное химическое поведение, включая повышенную реактивность в условиях кислотно-щелочного воздействия, нестабильность под действием света и термическое разложение. Несмотря на это, молекулярная структура CBGVA демонстрирует специфическую хемоселективность, что открывает потенциал для создания новых производных путём химической модификации или функционализации.
С точки зрения биосинтеза, CBGVA образуется в результате специфической терпеновой конденсации с участием геранилпирофосфата (GPP) и диваринолиновой кислоты, которая является вариновым аналогом оливитоловой кислоты. Этот биохимический путь, хотя и частично идентичен синтезу каннабигероловой кислоты (CBGA), характеризуется уникальной ферментативной спецификой, особенно в реакциях, катализируемых синтазами с высокой региоселективностью. Экспериментальные данные указывают на то, что количественное накопление CBGVA тесно связано с уровнем экспрессии соответствующих ферментов в трихомах каннабиса, что создаёт основу для целенаправленной селекции и генной инженерии.
Современные технологии экстракции CBGVA сталкиваются с рядом сложностей, связанных с её кислотной природой и термолабильностью. Среди эффективных методов можно выделить криоэкстракцию с ультразвуковой стимуляцией, сверхкритическую CO₂-экстракцию с модифицированными параметрами давления и температуры, а также микрофлюидные системы, которые позволяют сохранить целостность кислотной формы. Особый интерес представляют ферментативные биоэкстракции, способные обеспечивать селективность при умеренном энергетическом воздействии.
Генетические модификации каннабиса в направлении повышения содержания CBGVA находятся на стадии ранних исследований. Создание сортов с направленным подавлением синтеза THCA и CBDA в пользу вариновых путей открывает потенциал не только для увеличения выхода CBGVA, но и для расширения портфеля каннабиноидов с узкой биологической специфичностью.
С фармакологической точки зрения, CBGVA демонстрирует способность опосредованно влиять на рецепторы CB1 и CB2, хотя её аффинность к этим мишеням ниже, чем у активных декарбоксилированных форм. Тем не менее, это не исключает её участия в регуляции эндоканнабиноидной системы через аллостерические механизмы или модуляцию ферментов, ответственных за метаболизм эндогенных лигандов. Первичные in vitro результаты указывают на нейромодулирующий эффект, подавление активации микроглии, а также потенциальное антиноцицептивное действие без вовлечения психоактивных путей.
Не менее важной является антиоксидантная активность CBGVA, проявляющаяся через химическое подавление свободных радикалов, восстановление глутатионового потенциала клеток и защиту структурных компонентов мембран от перекисного окисления. Это открывает возможности для её применения в терапии хронических воспалений, дегенеративных заболеваний центральной нервной системы, а также в рамках мультимодальной противовоспалительной стратегии в системной медицине.
Несмотря на значительный научный потенциал, внедрение CBGVA в клиническую практику сопряжено с рядом технических и правовых ограничений. В частности, нестабильность нативной формы в биологических средах, необходимость стабилизации формул, ограниченный доступ к стандартизированным экстрактам и фрагментарность доклинической доказательной базы — все эти факторы замедляют переход к масштабным клиническим исследованиям. Кроме того, во многих юрисдикциях CBGVA до сих пор не выделен в отдельную правовую категорию по отношению к основным психоактивным каннабиноидам, что усложняет нормативные и этические аспекты исследований.
С точки зрения медицинского и фармацевтического применения, CBGVA рассматривается как перспективное сырьё для разработки новых фармацевтических субстанций, включая кислотоустойчивые микрокапсулы, пролонгированные наноформы, а также в качестве субстрата для создания полуагонистических производных. Подходы к инкапсуляции с использованием липосом, твердых липидных частиц или полимерных носителей обеспечивают сохранение химической целостности молекулы при доставке в биологические системы. В этом контексте остаётся актуальной задача стандартизации промышленных методов получения, адаптированных к условиям производства на уровне GMP.
С точки зрения будущего, CBGVA представляет собой новую фазу в исследовании неактивных кислотных форм каннабиноидов, которые долгое время оставались вне поля зрения фармакологии. Применение CBGVA в альтернативной медицине выглядит вероятным, особенно в рамках интегративного подхода к лечению хронической боли, тревожных расстройств, иммунозависимых патологий и метаболических нарушений. Её комбинация с другими кислотными формами или адаптогенами природного происхождения может стать основой для создания нового класса многокомпонентных фитопрепаратов с минимальной токсичностью и широким спектром действия.
Источники
- Udoh M. et al. — Одно из немногих экспериментальных исследований, посвящённых каннабигеровариновой кислоте, в котором было продемонстрировано, что данное соединение может взаимодействовать с ионными каналами и рецепторами GPR55. Это открывает возможности для понимания молекулярных механизмов действия CBGVA и её потенциального применения в нейрофармакологии.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9652735/ - Valliere M.A. et al. — Работа, описывающая биосинтетическую платформу для получения каннабиноидов, включая CBGVA, вне живого растения. Это исследование представляет высокую ценность с точки зрения биотехнологического синтеза и промышленного производства каннабиноидов.
https://www.nature.com/articles/s41467-019-08385-z - Shoyama Y. et al. — Оригинальное исследование, в котором впервые была изолирована каннабигеровариновая кислота из тайского сорта каннабиса. Этот труд важен для исторического понимания открытия и первичной характеристики CBGVA.
https://diverdi.colostate.edu/C442/references/other/handbook%20of%20cannabis%20-%20pertwee/ch%2001.pdf - NIST (2024) — Отчёт Национального института стандартов и технологий США, посвящённый качественной аналитике каннабиноидов, включая кислоты нового поколения. Документ подчёркивает сложность точного количественного анализа таких соединений, как CBGVA, и необходимость создания стандартизированных методик.
https://nvlpubs.nist.gov/nistpubs/ir/2024/NIST.IR.8519.pdf - DOE OSTI — Официальная публикация Министерства энергетики США, в которой рассматриваются альтернативные методы биосинтеза каннабиноидов, включая CBGVA. Работа акцентирует внимание на возможностях микробной и ферментативной платформенной инженерии.
https://www.osti.gov/biblio/1613646 - Academia.edu — Открытая версия исследования, посвящённого фармакологии CBGVA и её влиянию на нейрональные каналы. Удобный источник для быстрого ознакомления с основными фармакодинамическими характеристиками соединения.
https://www.academia.edu/123143988/The_anticonvulsant_phytocannabinoids_CBGVA_and_CBDVA_inhibit_recombinant_T_type_channels - PubChem (NIH/NLM) — Полная химическая информация о молекуле CBGVA: строение, идентификаторы, физико-химические свойства и CID. Это фундаментальный источник данных для всех, кто работает с химическим моделированием или аналитической химией каннабиноидов.
https://pubchem.ncbi.nlm.nih.gov/compound/Cannabigerovarinic-acid - EMCDDA — Официальное агентство Европейского союза по мониторингу наркотиков. Публикация предоставляет информацию о правовом статусе CBGVA и других каннабиноидов, а также актуальные сведения о тенденциях и регуляторных аспектах на территории Европы.
https://www.emcdda.europa.eu/publications/topic-overviews/cannabis-legal-status-europe_en - FDA — Позиция Управления по контролю за продуктами и лекарствами США (FDA) в отношении регулирования каннабиноидов, включая кислоты и производные, в медицинской практике. Источник важен для понимания нормативной среды и ограничений, связанных с CBGVA в клиническом контексте.
https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd - ClinicalTrials.gov — Официальная база данных клинических испытаний, где по ключевым словам можно найти как прямые, так и сопутствующие исследования, касающиеся CBGVA. Подходит для анализа текущей экспериментальной базы и оценки перспектив в клинической медицине.
https://clinicaltrials.gov/