Канабиглендол — это одно из редких и малоизученных природных соединений рода Cannabis, относящееся к классу каннабиноидов. Это химическое вещество представляет особый интерес для ученых, так как его уникальная молекулярная структура и физико-химические свойства отличают его от более распространённых каннабиноидов, таких как тетрагидроканнабинол (THC) или каннабидиол (CBD). Из-за своей низкой концентрации в природных экстрактах канабиглендол остаётся одним из наименее изученных соединений, однако он потенциально может играть важную роль в фармакологии и биохимии каннабиноидов.
Биосинтетические пути формирования канабиглендола в растении Cannabis связаны с ферментативными превращениями прекурсоров каннабиноидов, в частности каннабигероловой кислоты (CBGA) и других кислотообразующих форм. Канабиглендол образуется в результате сложных химических трансформаций, включающих декарбоксилирование и изомеризацию, что делает его структурно и функционально отличным от других каннабиноидов. Несмотря на то, что детальные механизмы биосинтеза ещё полностью не раскрыты, имеющиеся данные свидетельствуют о том, что этот каннабиноид возникает как побочный продукт в метаболических цепочках растения.
Учитывая, что канабиглендол присутствует в растениях в очень незначительных количествах, его выделение для экспериментальных исследований является технически сложной задачей. В связи с этим для получения канабиглендола применяются различные методы: от изоляции из растительного сырья до полусинтетических и полностью синтетических путей химического синтеза. Также начинают развиваться биотехнологические подходы, предусматривающие использование генетически модифицированных микроорганизмов для продукции этого соединения. Разработка эффективных и масштабируемых методов синтеза является ключевой для обеспечения достаточного количества вещества для дальнейших фармакологических и токсикологических исследований.
Фармакологические свойства канабиглендола остаются на данный момент недостаточно изученными. Тем не менее предполагается, что он может взаимодействовать с различными рецепторными системами организма, в частности каннабиноидными рецепторами CB1 и CB2, а также с другими молекулярными мишенями, регулирующими воспалительные процессы, нейропротекцию и иммунные ответы. Существуют отдельные исследования in vitro, указывающие на потенциальные противовоспалительные и нейропротективные свойства этого соединения, однако систематических исследований in vivo и клинических испытаний на людях пока не хватает.
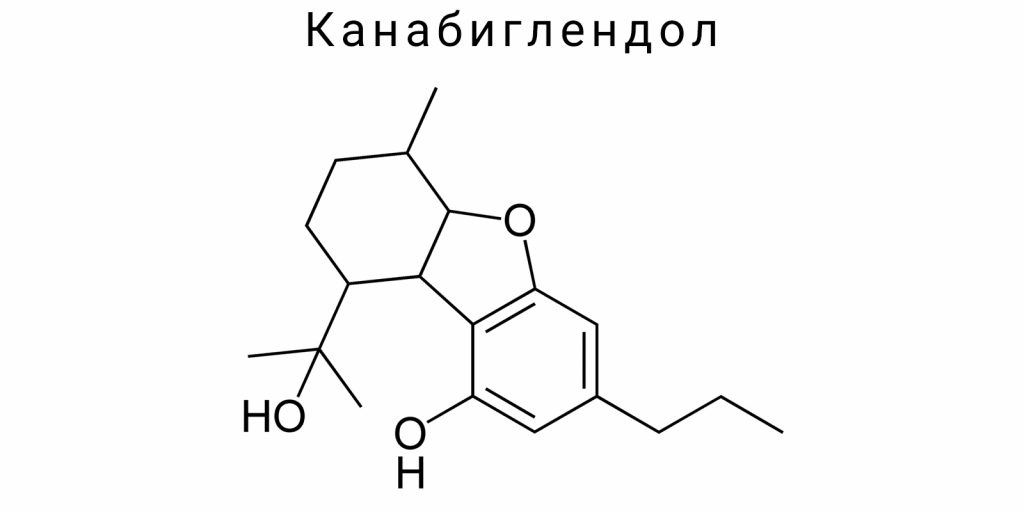
Химическая природа канабиглендола
Канабиглендол является представителем класса фито-каннабиноидов — природных органических соединений, образующихся в растениях рода Cannabis. Это соединение характеризуется уникальными химическими свойствами, которые отличают его от других каннабиноидов и определяют специфику его биологической активности. Химическая природа канабиглендола тесно связана с его молекулярной структурой, которая формирует основную основу для взаимодействия с биологическими мишенями, а также определяет физико-химические свойства, влияющие на растворимость, стабильность и метаболизм вещества.
Канабиглендол по химической природе является производным терпенофенола, содержащим фенольную группу и неполную циклическую структуру, присущую многим каннабиноидам. Основная молекула включает алифатическую боковую цепь и фенольное ядро, которые взаимодействуют для формирования характерной трёхмерной структуры. Отсутствие кислого функционального группирования, в отличие от каннабиноидных кислот, придаёт канабиглендолу нейтральные химические свойства. Такая структура влияет на его способность проходить через клеточные мембраны и взаимодействовать с гидрофобными участками рецепторов.
Химическая формула канабиглендола соответствует классической формуле каннабиноидов, включающей углерод, водород и кислород, но имеет характерные отличия в расположении двойных связей и функциональных групп. Канабиглендол характеризуется наличием нескольких насыщенных и ненасыщенных участков, определяющих его реакционную способность. Особую роль в химической природе этого соединения играет способность к электрофильным и нуклеофильным реакциям, что позволяет модифицировать молекулу для синтетических целей.
Канабиглендол проявляет слабую кислотность из-за фенольной гидроксильной группы, что влияет на растворимость в воде и органических растворителях. Его растворимость относительно низкая в воде, однако он хорошо растворяется в неполярных и слабо полярных средах, что отражает характер гидрофобности молекулы. Эти свойства определяют условия хранения и транспортировки канабиглендола, а также его фармакокинетику.
Термостабильность канабиглендола является важным фактором, влияющим на его возможное применение в медицинских и фармацевтических продуктах. Известно, что каннабиноиды могут подвергаться термической деградации, в частности процессам декарбоксилирования и изомеризации. В случае канабиглендола термическая стойкость относительно высокая, что позволяет сохранять его химические свойства при умеренных температурах, но при повышенных температурах возможно образование побочных продуктов.
В химической природе канабиглендола следует также отметить способность к образованию стереоизомеров из-за наличия хиральных центров в молекуле. Это влияет на его биологическую активность, поскольку разные изомеры могут иметь разную способность взаимодействовать с рецепторами или ферментами. Такие особенности химической природы являются ключевыми при разработке методов синтеза и изучении фармакологии канабиглендола.
Важной составляющей химической природы является также взаимодействие канабиглендола с другими компонентами растительного экстракта, в частности терпенами и другими каннабиноидами. Взаимодействия между молекулами могут способствовать образованию устойчивых комплексов, которые влияют на биодоступность и эффективность соединения в биологических системах.
Канабиглендол, как и другие каннабиноиды, способен к окислительно-восстановительным реакциям, что определяет его поведение в живых организмах и в окружающей среде. Окислительные метаболиты могут образовываться как в процессе деградации под воздействием света и кислорода, так и в результате ферментативного метаболизма, что является важным аспектом токсикологической оценки.
Молекулярная структура и физико-химические свойства
Молекулярная структура канабиглендола определяет его уникальные физико-химические характеристики, которые отличают это соединение от других каннабиноидов. Молекула канабиглендола является терпенофенольным соединением с формулой C₂₁H₃₂O₂. Она состоит из моноциклического терпенного скелета, который содержит три изопреноидных блока, связанных по схеме «2 изопреноидных единиц + фенольная группа». Отличие канабиглендола заключается в специфическом расположении двойных связей и функциональных групп, что обеспечивает характерную геометрию молекулы.
Ключевой особенностью молекулярного строения является наличие фенольной гидроксильной группы, расположенной в положении, которое обеспечивает высокий уровень электронной плотности на ароматическом кольце. Эта особенность существенно влияет на кислотно-основные свойства молекулы, а также на её способность к образованию водородных связей с полярными растворителями и биомолекулами. Отличие позиции гидроксильной группы у канабиглендола по сравнению с другими каннабиноидами определяет специфику его реактивности.
Молекула имеет алифатический боковой цепь, которая состоит из линейной углеродной цепочки, подверженной конфигурационной гибкости. Эта гибкость влияет на способность канабиглендола адаптироваться к различным молекулярным мишеням, в частности рецепторам, за счёт изменения конформации бокового цепа. Вариабельность пространственной ориентации позволяет соединению оптимизировать взаимодействия гидрофобного характера в глубине рецепторных сайтов.
Физико-химические свойства канабиглендола включают температуры плавления и кипения, растворимость, оптические характеристики и электрохимическую активность. Температура плавления молекулы находится в диапазоне, соответствующем аморфному состоянию с тенденцией к образованию кристаллических форм, которые обладают специфическими полиморфными свойствами. Такая полиморфность связана с возможностью различных упаковок молекул в твёрдом состоянии, что существенно влияет на биодоступность и стабильность канабиглендола.
Растворимость канабиглендола имеет полярно-аполярный характер: он практически нерастворим в воде, однако обладает высокой растворимостью в органических растворителях, таких как метанол, этиловый эфир, хлороформ и гексан. Это обусловлено наличием большой гидрофобной части молекулы, а также полярной фенольной группы, что способствует растворению в средах с промежуточной полярностью. Отличная растворимость в органических средах важна для процессов экстракции и очистки канабиглендола.
Оптические свойства молекулы определяются её хиральностью и наличием конформационных форм. Канабиглендол проявляет оптическую активность, которая может быть зафиксирована методами поляриметрии и циркулярного дихроизма. Эти оптические характеристики важны для определения абсолютной конфигурации молекулы, что имеет значение для её взаимодействия с биологическими рецепторами и ферментами.
Электрохимическая активность канабиглендола проявляется в процессах окисления и восстановления фенольной группы. Это соединение может участвовать в радикальных реакциях, в частности образовывать стабильные фенольные радикалы, которые играют роль в биохимических процессах, в том числе в антиоксидантной активности. С помощью методов циклической вольтамперометрии можно исследовать потенциал окисления канабиглендола, что даёт представление о его стабильности и возможности участия в редокс-реакциях.
Термодинамические параметры канабиглендола включают энергию связи и энергию активации конформационных изменений, которые определяют его устойчивость и реакционную способность. Исследования с применением квантово-химических методов показали, что молекула имеет низкую энергию активации для перехода между различными конформациями, что обеспечивает её динамическую гибкость в биологических системах.
Канабиглендол обладает значительным потенциалом образовывать комплексы с металлами, особенно с ионами переходных металлов, благодаря наличию донорных атомов кислорода в фенольной группе. Эта особенность является предметом исследований в контексте разработки новых катализаторов и фармакологически активных металлических комплексов.
Стабильность молекулы в различных физических и химических условиях является важным аспектом, который определяет её практическое применение. Канабиглендол сохраняет свою химическую целостность при воздействии умеренных температур, нейтрального pH и отсутствии окислительных агентов. Вместе с тем он может деградировать под воздействием ультрафиолетового излучения и кислорода, что требует разработки методов защиты молекулы в фармацевтических препаратах.
Изомерия и конформационные особенности
Изомерия канабиглендола является сложным и многогранным явлением, которое оказывает определяющее влияние на его химические, физические и биологические свойства. Изомерные формы этой молекулы охватывают как структурные (конституционные) изомеры, так и стереоизомеры, включающие конфигурационные и конформационные варианты. Анализ изомерии позволяет раскрыть разнообразие молекулярных форм, которые могут возникать в процессе синтеза, биосинтеза, а также во время метаболизма в живых организмах.
Канабиглендол имеет несколько хиральных центров, которые являются основой для существования различных энантиомеров и диастереомеров. Расположение гидроксильной группы и боковых цепей создаёт асимметрию в молекуле, что определяет возможность существования оптически активных изомеров. Конфигурация этих центров критически влияет на взаимодействие с рецепторами, поскольку разные стереоизомеры могут иметь различную аффинность и биологическую активность. Энантиомерная чистота является важной характеристикой для фармакологических исследований и разработки препаратов на основе канабиглендола.
Структурные изомеры канабиглендола связаны с изменениями в расположении двойных связей, позициях гидроксильных групп, а также с вариациями в длине и разветвлении алифатических цепей. Такие изменения приводят к значительным отличиям в химической реактивности и физико-химических свойствах. В частности, смещение положения двойных связей влияет на электронную плотность в молекуле и её способность к взаимодействию с радикалами, а также на спектральные характеристики.
Конформационная изомерия канабиглендола связана с пространственной гибкостью молекулы, которая возникает вследствие вращения вокруг простых ковалентных связей. Особенности конформационного пространства определяются энергетическими барьерами, возникающими из-за стерических взаимодействий между атомами и функциональными группами, а также благодаря электронным эффектам, таким как гиперконъюгация. Важную роль играет взаимодействие фенольной группы с алифатическими цепями, которое может создавать конформации с дополнительной стабилизацией через внутренние водородные связи.
Анализ конформационных изменений в молекуле канабиглендола проводится с помощью методов квантово-химического моделирования и спектроскопии, включая ядерный магнитный резонанс (ЯМР) и инфракрасную спектроскопию. Данные этих методов позволяют идентифицировать наиболее стабильные конформации и определить энергетические барьеры между ними, что имеет важное значение для понимания динамики молекулы в растворе и в биологических средах.
Конформационные особенности оказывают непосредственное влияние на способность канабиглендола взаимодействовать с рецепторами CB1 и CB2, а также с другими молекулярными мишенями. Способность молекулы адаптировать форму позволяет эффективно контактировать с активными центрами белков, что определяет её фармакологический потенциал. Отличия в конформациях могут вызывать изменение аффинности и селективности взаимодействия, что подчёркивает важность изучения этого аспекта изомерии.
Особое внимание следует уделить таутомерии — форме изомерии, при которой происходит перемещение протона с сопутствующим изменением положения двойной связи. У канабиглендола возможны фенол-кетонные и енол-кетонные таутомерные формы, которые обладают разной стабильностью в зависимости от среды. Таутомерия влияет на кислотно-основные свойства молекулы, её реакционную способность и спектральные характеристики.
Важной составляющей изомерии является также геометрическая (цис-транс) изомерия, которая возникает из-за ограниченного вращения вокруг двойных связей в молекуле. В канабиглендоле такие изомеры могут существенно различаться по энергетическому уровню и пространственному расположению функциональных групп, что влияет на их взаимодействие с биологическими мишенями.
Канабиглендол, как и другие каннабиноиды, способен образовывать межмолекулярные комплексы через водородные связи и ван-дер-ваальсовы взаимодействия, которые зависят от конкретной изомерной формы. Эти взаимодействия могут влиять на образование агрегатов в растворе, стабильность в фармацевтических формах и биодоступность.
Учитывая важность изомерии для биологической активности, при синтезе и экстракции канабиглендола критически контролируется соотношение изомеров. Методы хроматографии, такие как высокоэффективная жидкостная хроматография (ВЭЖХ), в сочетании со спектроскопическими методами позволяют разделять, идентифицировать отдельные изомеры и определять их чистоту.
Происхождение канабиглендола
Происхождение канабиглендола тесно связано со сложной биохимической системой растений рода Cannabis, которые являются основным природным источником этого соединения. Канабиглендол образуется как один из многочисленных каннабиноидов, возникающих в процессе метаболизма терпенофенольных соединений в тканях растения. Его происхождение определяется специфическими путями трансформации предшественников, которые интегрируются в общий метаболический контур каннабиноидов.
Исторически канабиглендол не был сразу идентифицирован как отдельный компонент каннабиса из-за его менее выраженной концентрации по сравнению с другими каннабиноидами, такими как тетрагидроканнабинол или каннабидиол. Однако с развитием аналитических методов, в частности хроматографии и спектроскопии, канабиглендол был чётко выделен и идентифицирован как отдельная химическая сущность. Его происхождение связано с природными биохимическими трансформациями, которые происходят в экзокринных железах (трихомах) растения.
Канабиглендол является производным терпеноидного класса с фенольной группой, которая формируется на базе основного скелета терпенов в процессе последовательных ферментативных реакций. Основной биохимической основой для его формирования являются линейные или циклические терпены, которые в растении синтезируются из пировиноградной кислоты, ацетил-КоА и изопреновых предшественников. Далее эти терпены проходят окисление, циклизацию и гидроксилирование, что приводит к формированию характерного скелета канабиглендола.
Процесс формирования канабиглендола часто происходит параллельно с синтезом других каннабиноидов, поскольку все они берут начало от общего прекурсора — канабигероловой кислоты. В растении канабигероловая кислота служит центральной молекулой, которая под действием специфических ферментов трансформируется в различные каннабиноиды, включая канабиглендол. Характерной особенностью биосинтеза канабиглендола является отличие в ферментативных путях и структурных модификациях, которые исключают образование типичных тетрагидроканнабинольных колец.
Происхождение канабиглендола в природе сопровождается также неферментативными реакциями, такими как окисление или деградация предшествующих каннабиноидов. Эти реакции могут происходить под воздействием внешних факторов — света, температуры, а также окислительных агентов. В частности, канабиглендол может образовываться как продукт окисления других терпенофенольных соединений, что подчёркивает его статус как производного в сложной химической цепи метаболизма каннабиса.
Растение рода Cannabis обладает высокой степенью пластичности в синтезе вторичных метаболитов, что обеспечивает вариабельность содержания канабиглендола в зависимости от сорта, условий выращивания и степени зрелости. Генетические особенности отдельных линий растения определяют активность ферментов, катализирующих образование канабиглендола, что, в свою очередь, отражается на количественном содержании этого соединения. Важно отметить, что экологические факторы, такие как освещение, температура, влажность и питательный режим, существенно влияют на экспрессию ферментных систем, ответственных за синтез канабиглендола.
Дополнительно, канабиглендол может образовываться в результате химической трансформации в процессе сушки и хранения растительного сырья. Такие трансформации включают деградацию других каннабиноидов или их кислотных форм, что меняет химический профиль конечного продукта. Это явление важно для точного определения происхождения канабиглендола в исследуемых образцах и для контроля качества фармацевтических препаратов.
Канабиглендол, как природное соединение, отражает эволюционную адаптацию растения Cannabis к окружающей среде. Его синтез, вероятно, имеет экологическое значение, связанное с защитой от ультрафиолетового излучения, вредителей или микроорганизмов. Такая функция характерна для многих вторичных метаболитов, выполняющих роль биохимического барьера, который повышает выживаемость растения в экстремальных условиях.
Понимание происхождения канабиглендола важно не только с фундаментальной точки зрения, но и для практических аспектов — селекции растений с повышенным содержанием этого соединения, оптимизации условий культивирования и разработки технологий экстракции. В частности, информация о биохимических путях позволяет разрабатывать методы ферментативной модификации или химического синтеза канабиглендола в лабораторных условиях.
Биосинтез в растениях рода Cannabis
Биосинтез канабиглендола в растениях рода Cannabis является сложным многоступенчатым процессом, который интегрируется в общий метаболический путь образования каннабиноидов. Этот путь основан на взаимодействии двух основных метаболических цепей — терпеноидной и фенольной, которые конвергируют в синтезе характерного терпенофенольного каркаса молекулы канабиглендола. Ключевым прекурсором в этом процессе является канабигероловая кислота, выступающая как соединение-матрица для формирования разнообразных каннабиноидов, включая канабиглендол.
Начальная фаза биосинтеза включает образование изопреновых единиц, которые являются строительными блоками терпеноидного сегмента молекулы. В растениях Cannabis это происходит преимущественно путем метилэритритолфосфатного (MEP) пути в пластидиях. Изопреновые единицы изопентенилпирофосфат (IPP) и диметилаллилпирофосфат (DMAPP) конденсируются под действием специфических синтаз с формированием геранилпирофосфата (GPP) — основного терпеноидного прекурсора. Этот этап определяет терпеновую основу будущей молекулы.
Параллельно происходит синтез фенольной части через пути фенилпропаноидов, которые начинаются с аминокислоты фенилаланина. Под действием ферментов фенилаланинаминотрансферазы (PAL) и других специфических ферментов происходит формирование ароматических соединений, таких как олигомерные фенолы. Эти соединения далее трансформируются в 1-окси-2-фенилпропанон, который является предшественником для реакции с терпеноидным сегментом.
Канабигероловая кислота формируется путем реакции между терпеноидным прекурсором GPP и фенольным предшественником олигомерного фенола. Эта реакция катализируется специфическим ферментом — канабигерол-синтазой (CBGAS), которая контролирует конденсацию и формирование канабигероловой кислоты. Это центральный этап биосинтеза каннабиноидов, который определяет дальнейшую судьбу молекулы в различных биохимических трансформациях.
Для формирования канабиглендола из канабигероловой кислоты основную роль играют ферментативные модификации, которые изменяют строение молекулы без нарушения основного терпенофенольного каркаса. В этом процессе значительную роль играют оксидоредуктазы, гидроксилазы и лиазы, обеспечивающие селективное окисление, гидроксилирование и циклизацию отдельных фрагментов молекулы.
В частности, ферменты, катализирующие циклизацию терпеноидного цепи, способствуют образованию открытой алифатической структуры, характерной для канабиглендола, в отличие от образования циклических структур у других каннабиноидов. Этот процесс обеспечивает уникальность химической структуры канабиглендола и определяет его специфические физико-химические и биологические свойства.
Гидроксилирование молекулы канабиглендола происходит в определённых позициях, формируя гидроксильные группы, ответственные за полярность молекулы и её способность к взаимодействию с водными средами и рецепторами. Эти реакции катализируются ферментами класса цитохрома P450, которые обладают способностью избирательно модифицировать молекулы, в частности в позициях, влияющих на биологическую активность.
Кроме ферментативных трансформаций, в биосинтезе канабиглендола возможны неферментативные реакции, такие как спонтанное окисление и радикальные процессы, происходящие под воздействием окружающих условий, включая свет и температуру. Эти реакции могут дополнять ферментативный путь, создавая дополнительные варианты молекулы, которые обогащают химический профиль растения.
Важным аспектом биосинтеза является пространственно-временная регуляция ферментов в различных тканях растения. Наивысшая активность ферментативных комплексов наблюдается в трихомах — железистых волосках на поверхности листьев и соцветий. Здесь накапливаются и трансформируются каннабиноиды, включая канабиглендол, что обеспечивает локализованный синтез и защиту растения от внешних факторов.
Уровень экспрессии генов, кодирующих ферменты биосинтеза, строго регулируется как генетическими, так и эпигенетическими механизмами. Факторы окружающей среды, такие как свет, температура и водный режим, влияют на регуляцию этих генов, модулируя синтез канабиглендола и других каннабиноидов в ответ на стрессовые или адаптивные условия.
Молекулярные исследования биосинтеза канабиглендола выявили ряд изоформ ферментов, которые могут иметь тонкие различия в каталитической активности и специфичности, что дополнительно расширяет разнообразие молекулярных форм канабиглендола. Эти изоформы обеспечивают гибкость метаболических путей и могут быть потенциальными мишенями для генной инженерии и биотехнологических методов повышения продуктивности канабиглендола.
Применение современных методов — метаболомики, протеомики и транскриптомики — позволяет интегрировать данные о биосинтетических путях в системное понимание метаболизма канабиглендола в растениях. Эти подходы способствуют открытию новых ферментов, регуляторных факторов и метаболических узлов, формирующих адаптационные стратегии растения.
Природные источники и количественные показатели в растениях
Канабиглендол является вторичным метаболитом, обнаруженным в растениях рода Cannabis, однако его концентрация значительно варьирует в зависимости от ботанического вида, сорта, условий культивирования и стадии развития растения. Природные источники канабиглендола ограничены именно растениями Cannabis, которые относятся к семейству Cannabaceae, хотя потенциальное обнаружение подобных соединений у родственных видов требует дополнительных исследований. Основное накопление канабиглендола происходит в специфических тканях, в частности в железистых трихомах, которые локализуются на листьях, соцветиях и иногда на стеблях.
Разнообразие растительных сортов Cannabis существенно влияет на уровень содержания канабиглендола. Известно, что индика-, сатива- и гибридные линии демонстрируют различные профили каннабиноидов, в которых канабиглендол встречается как в следовых количествах, так и в умеренных концентрациях. Этот факт свидетельствует о генетической детерминированности синтеза канабиглендола, что отражает вариабельность ферментативной активности и регуляторных механизмов у различных генотипов.
Измерение количественных показателей канабиглендола осуществляется с помощью высокоточной аналитической техники, включая газовую хроматографию с масс-спектрометрическим детектированием (GC-MS), жидкостную хроматографию высокого давления (HPLC) и ядерный магнитный резонанс (ЯМР). Аналитические методы обеспечивают не только идентификацию, но и точное количественное определение канабиглендола в различных образцах растительного сырья.
Количественные показатели канабиглендола в растениях варьируют в широком диапазоне, что связано с фактором генотипа, а также влиянием агротехнических и экологических параметров. В традиционных сортах содержание канабиглендола обычно не превышает 0,1-0,3% от сухой массы, хотя в специализированных селекционных линиях эта концентрация может достигать 0,5% и выше. Важно подчеркнуть, что канабиглендол в растениях часто присутствует в форме кислотных прекурсоров, которые при экстракции и хранении могут переходить в декарбоксилированную активную форму.
Вариабельность количественных показателей канабиглендола также зависит от стадии развития растения. Наивысший уровень накопления наблюдается в фазе цветения, когда активность ферментов биосинтеза максимальна, и обеспечивается максимальное производство каннабиноидов. В фазах роста и формирования листьев концентрация канабиглендола меньше, что свидетельствует о тесной связи синтеза этого соединения с репродуктивным циклом.
Экологические факторы, такие как температура, световой режим, влажность и питание растений, оказывают существенное влияние на концентрацию канабиглендола. В частности, повышенная инсоляция и умеренный стресс, вызванный недостатком воды, могут стимулировать активность ферментов биосинтеза, что приводит к росту содержания канабиглендола. Аналогично, оптимальные концентрации макро- и микроэлементов в почве обеспечивают надлежащий метаболизм, способствующий более стабильному накоплению канабиглендола.
Особого внимания заслуживает исследование влияния агротехнических методов — типа выращивания (открытый грунт или тепличные условия), способа внесения удобрений, обработки стимуляторами роста, которые способны значительно изменять концентрацию канабиглендола. Технологии культивирования, оптимизирующие условия роста растения и минимизирующие стресс, могут усиливать накопление этого соединения, что важно для фармацевтической промышленности.
Канабиглендол концентрируется преимущественно в трихомах, которые функционируют как биореакторы для биосинтеза и накопления каннабиноидов. Морфологические характеристики этих железистых образований, включая их количество, размер и плотность на поверхности растения, прямо коррелируют с уровнем содержания канабиглендола. Определение морфометрических параметров трихом является важным инструментом для оценки потенциала растений к производству канабиглендола.
Дополнительно следует отметить, что природное содержание канабиглендола может существенно изменяться в зависимости от технологий послесборочной обработки — сушки, хранения и экстракции. Повышенная температура, доступ кислорода и длительность хранения влияют на стабильность канабиглендола, что может приводить к его частичной деградации или превращению в другие каннабиноиды. Контроль этих параметров является критическим для сохранения химического профиля материала.
Методы изготовления канабиглендола
Изготовление канабиглендола является предметом комплексных исследований, поскольку его природное выделение из растений рода Cannabis ограничено низкой концентрацией и сложностью экстракции. Поэтому разработка эффективных методов получения канабиглендола приобретает важное значение для обеспечения стабильных поставок этого соединения для дальнейших исследований и потенциальных фармацевтических применений. Основные подходы к изготовлению канабиглендола включают выделение из растительного сырья, полусинтетические методы, полный химический синтез и биотехнологические технологии. Каждый из этих методов имеет свои преимущества и ограничения, связанные с продуктивностью, чистотой конечного продукта, экологичностью и экономичностью.
Экстракция канабиглендола из природных источников — растений Cannabis — остается базовым, но не всегда достаточно эффективным методом. Учитывая, что содержание канабиглендола в сырье обычно низкое, количество получаемого продукта ограничено, а процесс требует значительных затрат времени, растворителей и специализированного оборудования. Поэтому поиск альтернативных способов синтеза становится критически необходимым.
Полусинтетические методы позволяют повысить выход канабиглендола путем преобразования более доступных каннабиноидных прекурсоров, полученных из растительного сырья. Эти методы основаны на химических модификациях природных соединений, которые, благодаря наличию характерных функциональных групп, могут быть трансформированы в канабиглендол с высокой селективностью. Использование полусинтетических технологий снижает потребность в масштабных посевах растений, обеспечивает лучший контроль над химической чистотой и структурной однородностью продукта.
Полный химический синтез канабиглендола является наиболее сложным путем с учетом молекулярной структуры и наличия стереохимических центров. Тем не менее развитие методов органического синтеза позволяет воспроизводить структуру канабиглендола из простых химических реагентов, что открывает возможности для массового производства, независимого от сырьевой базы. Преимуществами такого подхода являются контроль над изомерным составом и возможность вариаций в структуре молекулы, что важно для создания производных с улучшенными свойствами. Недостатком является сложность реакционных схем и использование дорогих катализаторов и реагентов.
Биотехнологические подходы с использованием микроорганизмов, таких как генетически модифицированные бактерии или дрожжи, а также культуры клеток растений рода Cannabis, открывают перспективы для экологически чистого, высокопродуктивного и масштабируемого получения канабиглендола. Методы включают экспрессию ферментов биосинтеза канабиглендола в хост-системах, контролируемую ферментацию и оптимизацию метаболических путей. Это направление требует глубокого понимания биохимии каннабиноидов и современных био-инженерных технологий.
Выбор метода изготовления канабиглендола определяется необходимым количеством продукта, требованиями к чистоте, экономической целесообразностью и возможностями применения. Для фундаментальных исследований часто достаточно полусинтетических или экстрактивных методов, тогда как промышленное производство ориентировано на полный синтез или биотехнологические решения. Дальнейшее развитие технологий изготовления канабиглендола будет способствовать расширению его использования в научных, медицинских и промышленных сферах, обеспечивая новые возможности для фармакологического исследования и терапии.
Полусинтетические методы
Полусинтетические методы получения каннабиглендола основываются на химической трансформации природных каннабиноидных прекурсоров, выделяемых из растений рода Cannabis, с последующим получением целевого соединения через селективные реакции модификации. Этот подход сочетает биологическое происхождение субстрата с химической манипуляцией, что позволяет минимизировать сложность синтеза и повысить выход продукта, одновременно снижая затраты на производство по сравнению с полным синтезом.
Использование полусинтетических методов обусловлено низкой концентрацией каннабиглендола в природных экстрактах, что ограничивает их применение в чистом виде. В то же время в растениях рода Cannabis присутствуют другие каннабиноиды, такие как каннабигерол (CBG), которые выступают в качестве эффективных прекурсоров для превращения в каннабиглендол. Основная сложность заключается в проведении химических реакций с высокой селективностью, чтобы избежать побочных превращений и разложения молекулы.
Обычно полусинтетический синтез каннабиглендола начинается с выделения и очистки предшественника, например, каннабигерола, из растительного сырья. Этот процесс включает использование методов хроматографии (колоночной, жидкостной или газовой), которые обеспечивают высокую степень чистоты субстрата, необходимую для последующих химических превращений. Применение специфических растворителей и контролируемых условий экстракции позволяет сохранить целостность молекулы и предотвратить её деградацию.
Одним из ключевых этапов полусинтетического синтеза является проведение селективного гидроксилирования каннабигерола, что обеспечивает формирование характерных для каннабиглендола гидроксильных групп в определённых положениях молекулы. Использование специфических окислителей или ферментативных катализаторов позволяет выполнить эту реакцию с высокой регио- и стереоселективностью. Важной особенностью является необходимость избежать чрезмерного окисления или образования побочных продуктов, что требует точного контроля температуры, pH среды и концентрации реагентов.
Следующим этапом является модификация боковых цепей молекулы, которая позволяет увеличить стабильность каннабиглендола, а также улучшить его физико-химические свойства. Например, проведение этерификации или ацетилирования гидроксильных групп обеспечивает защиту реактивных центров, что необходимо для последующих трансформаций или для повышения биологической стабильности продукта. Эти реакции обычно выполняются в органических растворителях с использованием катализаторов, которые обеспечивают минимизацию побочных реакций.
Оптимизация условий проведения каждого из этапов полусинтетического синтеза критически важна для достижения высокого выхода каннабиглендола с минимальными потерями. Исследования показывают, что температурный режим в пределах 20–40 °C, а также использование буферных систем для поддержания нейтральной или слабокислой среды способствуют сохранению активных функциональных групп и предотвращают гидролиз или деградацию молекулы.
Полусинтетические методы включают также использование специфических катализаторов – как гомогенных, так и гетерогенных. Например, применение катализаторов на основе переходных металлов (платина, палладий, родий) в небольших концентрациях позволяет управлять реакциями гидрирования или гидроксилирования с высокой избирательностью. Кроме того, поддержка катализаторов на носителях с высокой удельной площадью поверхности способствует повышению активности и стабильности каталитических систем.
Совершенствование полусинтетических методов включает инкорпорацию биокатализа – применение ферментов или микроорганизмов, способных селективно модифицировать каннабиноидную структуру без использования жёстких химических реагентов. Такие биокатализаторы обеспечивают мягкие условия реакции, высокую региоселективность и снижение образования побочных продуктов. В то же время их коммерческое применение ограничено необходимостью специального оборудования и контроля ферментативной активности.
Процесс полусинтетического получения каннабиглендола, несмотря на ряд преимуществ, имеет определённые вызовы, среди которых – необходимость многоступенчатой очистки конечного продукта. Это обусловлено тем, что в процессе реакций образуются структурно схожие побочные соединения, которые могут быть трудноотделимыми от целевого каннабиглендола. Для этого применяются комбинированные методы хроматографического разделения, включая тонкослойную, жидкостную и ионообменную хроматографию.
Полусинтетические методы позволяют достичь высокой степени контроля над качеством каннабиглендола, что особенно важно для фармацевтического применения, где требуется максимальная чистота и отсутствие токсичных примесей. Использование природных прекурсоров минимизирует количество синтетических реагентов и снижает влияние производства на окружающую среду.
Полусинтетические технологии обеспечивают возможность масштабирования процесса, адаптируясь от лабораторных условий до промышленных объёмов с относительно небольшими затратами. Гибкость процесса позволяет модифицировать условия реакции в соответствии с конкретными потребностями производства, что делает этот метод одним из приоритетных для коммерческого получения каннабиглендола.
Полный химический синтез
Полный химический синтез каннабиглендола представляет собой процесс создания целевой молекулы из простых химических реагентов без использования природных прекурсоров. Этот подход требует тщательного планирования синтетической стратегии, поскольку молекула каннабиглендола имеет сложную структуру с несколькими функциональными группами и стереогенными центрами. Успешный полный синтез обеспечивает полный контроль над конфигурацией молекулы, позволяя получать продукт с высокой чистотой и изомерной специфичностью, что особенно важно для дальнейшего фармакологического применения.
Основной задачей в полном химическом синтезе каннабиглендола является построение его трициклической структуры, которая состоит из фенольного ядра, пиррольной или хроменовой системы и боковой цепи с алифатическими группами. Сложность также заключается в формировании гидроксильных функций в определённых позициях, а также в поддержании стереохимической чистоты, поскольку молекула содержит несколько хиральных центров, определяющих её биологическую активность.
Процесс синтеза начинается с выбора соответствующих начальных реагентов – простых ароматических или алифатических соединений, которые имеют потенциал для построения основных структурных элементов каннабиглендола. Часто используются производные фенола, изопреновые фрагменты, а также алкилгалогенидные соединения для формирования боковых цепей. Стратегия синтеза ориентирована на поэтапное построение скелета молекулы с использованием последовательных реакций конденсации, циклизации и функционализации.
Одним из ключевых этапов является формирование хроменовой или пиррольной системы через циклические конденсации. Для этого применяются реакции, такие как Пикина или алкилирование по Фриделю–Крафтсу, которые позволяют ввести алифатическую боковую цепь в ароматическое ядро. Эти реакции требуют применения кислотных катализаторов (например, AlCl3, BF3) и строгого контроля условий реакции, чтобы избежать полимеризации или образования побочных продуктов.
Параллельно с формированием циклической системы происходит селективное гидроксилирование определённых атомов углерода, что необходимо для формирования гидроксильных групп в каннабиглендоле. Реакции гидроксилирования часто осуществляются с применением окислителей, таких как пероксиды или хроматы, под контролем стереоспецифичности. Также используются более современные методики, например, катализм на основе металлов платиновой группы, которые позволяют точно регулировать положение и конфигурацию гидроксилов.
Важной составляющей полного химического синтеза является контроль изомерии продукта. Для обеспечения стереоселективности применяются хиральные катализаторы, вспомогательные агенты или же проводятся реакции в специальных средах, способствующих формированию желаемой конфигурации молекулы. Часто используются методы асимметрического синтеза, например, каталитическое гидрирование или эпоксидирование, которые позволяют получать продукты с высокой оптической чистотой.
Процессы изоляции и очистки промежуточных и конечных продуктов являются важной частью полного синтеза. Для этого применяются различные методы хроматографического разделения, экстракции и кристаллизации. Чистота каннабиглендола после полного синтеза должна соответствовать строгим стандартам, что особенно актуально для фармацевтического использования, поскольку любые примеси могут изменить фармакологический профиль соединения.
Для оптимизации реакционных путей используется компьютерное моделирование реакционной кинетики и динамики молекул, что позволяет прогнозировать наиболее эффективные условия проведения синтеза, а также предотвращать образование побочных продуктов. Такой подход значительно сокращает экспериментальное время и затраты на разработку технологии.
Важным аспектом является экономическая целесообразность полного химического синтеза. Хотя этот метод позволяет получать каннабиглендол независимо от природных ресурсов, он часто требует применения дорогостоящих реагентов, сложных катализаторов и высокой энергетической затратности. Поэтому для промышленного применения необходима дальнейшая оптимизация процессов, в частности внедрение многоразовых катализаторов и снижение количества побочных реакций.
В современных исследованиях полный химический синтез каннабиглендола сочетают с методами автоматизированного органического синтеза, что позволяет параллельно выполнять множество реакций с вариацией условий и реагентов. Это способствует быстрому выявлению оптимальных путей синтеза и позволяет создавать новые производные каннабиглендола с улучшенными характеристиками.
Полный синтез позволяет модифицировать структуру молекулы путём замещения функциональных групп или введения новых химических элементов в определённых позициях, что открывает возможности для создания препаратов со специфической активностью. Такие изменения недостижимы или сложны при полусинтетических методах из-за ограничений, связанных с природными прекурсорами.
Биотехнологические подходы
Биотехнологические подходы к производству канабиглендола представляют собой инновационное направление, основанное на использовании биологических систем для синтеза этой сложной каннабиноидной молекулы. В отличие от традиционных химических методов, биотехнология использует живые клетки или их ферментативные системы, что обеспечивает высокую селективность реакций, мягкие условия процесса и потенциально большую экологическую безопасность. Применение биотехнологий позволяет не только значительно упростить синтез канабиглендола, но и открыть новые возможности для генной инженерии и масштабируемого производства.
В основе биотехнологических методов лежит использование микроорганизмов — бактерий, дрожжей, грибов или растительных клеток, способных экспрессировать ферменты, катализирующие превращение природных или синтетических прекурсоров в канабиглендол. Среди наиболее распространённых организмов используют Escherichia coli, Saccharomyces cerevisiae и Aspergillus sp., так как они обладают хорошо изученными генетическими механизмами, высоким уровнем роста и адаптивностью к лабораторным и промышленным условиям.
Первым шагом в биотехнологическом синтезе является идентификация и клонирование генов, кодирующих ферменты, способные осуществлять ключевые реакции в биосинтезе канабиглендола. Эти гены могут быть выделены из природных растений Cannabis или синтезированы искусственно с учётом оптимизации последовательностей для повышения экспрессии в хозяине. Особо важными являются гены, кодирующие оксидоредуктазы, гидроксилазы, изомеразы и синтазы, отвечающие за формирование трёхциклической структуры и функциональных групп молекулы.
Введение этих генов в геном микроорганизмов или растительных клеток осуществляется с помощью векторных систем (плазмиды, вирусные векторы), обеспечивающих стабильную и высокую экспрессию целевых белков. Для повышения эффективности производства генетические конструкции дополняют промоторами сильного уровня, сигналами для транспортных белков и факторами регуляции метаболизма.
Для обеспечения биосинтеза канабиглендола обычно разрабатывают мультигенные системы, в которых ферменты, катализирующие последовательные реакции, экспрессируются одновременно. Это позволяет формировать метаболический путь в хозяине и минимизировать накопление промежуточных продуктов. Использование систем с разветвлённой регуляцией экспрессии и специальным балансом ферментов повышает выход целевого продукта.
Одним из ключевых направлений является оптимизация метаболических потоков клетки, чтобы обеспечить достаточное количество прекурсоров (например, изопреноидных единиц) и коферментов (NAD(P)H, АТФ), необходимых для биосинтетических реакций. Для этого применяют методы метаболического инжиниринга: усиление путей синтеза прекурсоров, снижение активности конкурентных метаболических ветвей, введение дополнительных путей восстановления коферментов.
Важной составляющей является также контроль над процессами стабильности и выхода продукта в живой системе. Биореакторы используют для поддержания оптимальных физико-химических параметров (температуры, рН, аэрации), что обеспечивает максимальную продуктивность микроорганизмов или клеток. Параметры роста культуры настраивают так, чтобы минимизировать стрессовые реакции, которые могут влиять на экспрессию ферментов и продуктивность синтеза.
Применение ферментативных систем в виде изолированных белков является отдельным направлением биотехнологии. В этом случае ферменты канабиглендола синтезируются у гетерологичных хозяев, очищаются и используются в реакционных смесях для катализа специфических превращений. Этот метод позволяет точно регулировать условия реакции, сочетать ферменты в каскадные системы и избегать побочных реакций, характерных для живых клеток.
Для масштабирования производства применяют технологии ферментации с высокой плотностью клеток, а также биоинженерные системы с регулированием экспрессии генов в зависимости от стадии роста культуры. Это позволяет адаптировать производственный цикл под требования промышленного масштаба и обеспечить стабильность качества продукта.
В контексте биотехнологических подходов значительным преимуществом является возможность создания новых штаммов и линий с улучшенной продуктивностью и адаптированных к различным типам сырья. Геномное редактирование, в частности CRISPR/Cas-системы, активно внедряются для целевого улучшения метаболизма и повышения выхода канабиглендола.
Важным фактором также является экологичность процесса. Биотехнологические методы позволяют избежать использования токсичных химических реагентов, снизить энергопотребление и образование отходов, что делает их привлекательными для устойчивого производства. Применение биокатализа и мягких условий реакции снижает риск деградации продукта и способствует лучшему сохранению его фармакологических свойств.
Однако существуют и вызовы, связанные с биотехнологическим синтезом. Это сложность масштабирования процессов, необходимость длительных циклов оптимизации штаммов и реакционных условий, а также высокие требования к чистоте и стабильности ферментов или клеточных культур. Для преодоления этих препятствий проводятся интенсивные исследования в области биоинформатики, системной биологии и биореакторной инженерии.
Интеграция биотехнологических методов с другими подходами, в частности химическим синтезом и полусинтетическими технологиями, открывает перспективы для гибридных производственных линий. Такие комбинированные системы позволяют сочетать преимущества каждого метода, повысить общую эффективность и снизить себестоимость конечного продукта.
Фармакологические свойства
Канабиглендол является одним из малоизученных каннабиноидов, привлекающим значительное внимание в фармакологии благодаря своим уникальным свойствам. Хотя исследования канабиглендола всё ещё находятся на ранних этапах, уже сформировано базовое представление о его фармакологическом профиле, который отличается от классических каннабиноидов по спектру действия и механизмам взаимодействия с организмом. Фармакологические свойства канабиглендола обусловлены его способностью влиять на различные клеточные и молекулярные мишени, участвующие в регуляции боли, воспаления, нейропротекции, а также иммунного ответа.
Основные фармакологические характеристики канабиглендола связаны с его способностью модулировать сигнальные пути, регулирующие гомеостаз организма, особенно в центральной и периферической нервной системе. В отличие от более известных каннабиноидов, таких как тетрагидроканнабинол (THC) или каннабидиол (CBD), канабиглендол демонстрирует отсутствие выраженной психоактивности, что делает его перспективным агентом для терапевтического применения без риска возникновения нежелательных психотропных эффектов. При этом канабиглендол проявляет ряд фармакологических действий, которые могут быть полезными в лечении различных патологических состояний.
С точки зрения молекулярных свойств, канабиглендол способен воздействовать на рецепторы эндоканнабиноидной системы, но при этом взаимодействует с рядом других рецепторов, таких как TRP-каналы, PPAR (пероксисомные пролифератор-активированные рецепторы) и другие белки, регулирующие клеточный метаболизм и воспалительные процессы. Это делает его многофункциональным агентом с потенциальными применениями в фармакотерапии.
Фармакокинетика канабиглендола ещё недостаточно изучена, однако известно, что он обладает высокой липофильностью, что обеспечивает его эффективное проникновение через гематоэнцефалический барьер. Это важно для реализации нейропротекторных и анальгетических эффектов. Метаболизм канабиглендола происходит преимущественно в печени с участием системы цитохрома P450, что определяет потенциальные взаимодействия с другими лекарственными препаратами.
Клинические и доклинические исследования свидетельствуют о способности канабиглендола снижать интенсивность болевых ощущений, особенно при хронической и нейропатической боли, а также иметь противовоспалительное действие за счёт ингибирования высвобождения провоспалительных цитокинов. Кроме того, канабиглендол демонстрирует потенциал в регуляции иммунного ответа, что может быть важно для лечения аутоиммунных и воспалительных заболеваний.
Важной характеристикой канабиглендола является его нейропротекторный потенциал, связанный со способностью уменьшать окислительный стресс и воспаление в нейронах. Это открывает перспективы применения в неврологии, в частности для терапии дегенеративных заболеваний центральной нервной системы.
Хотя доказательства фармакологической эффективности канабиглендола пока базируются преимущественно на экспериментальных моделях, полученные данные создают основу для дальнейших исследований и возможного использования в терапии. Благодаря своим свойствам канабиглендол может дополнить или заменить традиционные каннабиноидные препараты, особенно там, где необходима отсутствие психоактивности и низкий риск побочных эффектов.
Механизмы взаимодействия с биологическими мишенями
Механизмы взаимодействия канабиглендола с биологическими мишенями формируют фундамент для понимания его фармакологических эффектов. Определение этих механизмов является сложной задачей из-за сложности молекулярной структуры канабиглендола и его разноплановой активности на клеточном уровне. В отличие от классических каннабиноидов, канабиглендол обладает особым профилем селективности к рецепторным системам, который позволяет ему проявлять уникальные фармакологические свойства. В этом разделе подробно рассматриваются основные биологические мишени канабиглендола, типы взаимодействий, а также молекулярные пути, которые активируются или ингибируются при его связывании.
Наиболее важными биологическими мишенями канабиглендола являются рецепторы эндоканнабиноидной системы, включающие CB1 и CB2 рецепторы. Однако, по сравнению с классическими каннабиноидами, канабиглендол демонстрирует относительно низкое аффинное связывание с этими рецепторами, особенно с CB1, что объясняет отсутствие выраженной психоактивности. Тем не менее, канабиглендол способен выступать как модулятор этих рецепторов, потенциально влияя на их конформационное состояние и связанный с ними сигнальный каскад. Это действие может быть как частично агонистическим, так и антагонистическим в зависимости от концентрации молекулы и типа ткани.
Кроме рецепторов CB1 и CB2, канабиглендол проявляет значительное аффинное связывание с TRP-каналами, в частности TRPV1, TRPV2 и TRPA1. Эти рецепторы являются ионными каналами, реагирующими на различные физико-химические раздражители и участвующими в передаче болевых сигналов, регуляции воспаления и терморегуляции. Взаимодействие канабиглендола с TRP-каналами модулирует проницаемость клеточных мембран для ионов кальция и натрия, что приводит к изменениям во внутриклеточных сигнальных путях. Такой механизм лежит в основе противовоспалительного и анальгетического действия канабиглендола.
Параллельно канабиглендол взаимодействует с ядерными рецепторами, прежде всего с PPARγ (пероксисомный пролифератор-активируемый рецептор гамма), которые регулируют экспрессию генов, связанных с метаболизмом липидов, глюкозы, а также противовоспалительными реакциями. Взаимодействие с PPARγ обеспечивает транскрипционную регуляцию, приводящую к снижению продукции провоспалительных цитокинов и реактивных форм кислорода, а также поддерживает клеточный антиоксидантный статус. Таким образом, канабиглендол выступает как лиганд, активирующий PPARγ, что делает его перспективным агентом в лечении хронического воспаления и метаболических нарушений.
Еще одним важным аспектом является взаимодействие канабиглендола с ферментами, регулирующими эндоканнабиноидный метаболизм, в частности FAAH (fatty acid amide hydrolase) и MAGL (monoacylglycerol lipase). Эти ферменты отвечают за расщепление основных эндоканнабиноидов, ананамида и 2-арахидоноилглицерола соответственно. Канабиглендол может выступать как умеренный ингибитор FAAH, что приводит к увеличению уровня эндоканнабиноидов в синаптических пространствах и, соответственно, к усилению их физиологических эффектов. Этот механизм обеспечивает непрямое усиление эндоканнабиноидной системы без непосредственного агонистического действия на CB-рецепторы.
Взаимодействие канабиглендола с белками мембранного транспорта также играет роль в его фармакологической активности. В частности, канабиглендол влияет на работу транспортных систем, регулирующих уровни нейромедиаторов, в частности глутамата и гамма-аминомасляной кислоты (ГАМК). Это обеспечивает модуляцию синаптической передачи и имеет значение для нейропротекции, а также регуляции нервной возбудимости.
Кроме классических рецепторов и ферментов, канабиглендол демонстрирует способность к аллостерической модуляции белковых комплексов, участвующих в сигнальных каскадах клеток. В частности, исследования in silico и молекулярного докинга указывают на возможное взаимодействие канабиглендола с протеинкиназами, которые регулируют клеточный цикл и апоптоз, а также с факторами транскрипции, управляющими ответом на окислительный стресс. Такие взаимодействия могут частично объяснять нейропротекторные свойства канабиглендола, а также его влияние на клеточную пролиферацию и выживание.
С учетом мультицелевой природы канабиглендола, его действие на клеточном уровне реализуется через сложное взаимодействие нескольких сигнальных путей. Например, одновременная активация TRP-каналов и PPARγ способствует как острой противовоспалительной реакции, так и длительной регуляции генов, поддерживающих гомеостаз тканей. В то же время модуляция FAAH и влияние на транспортные белки позволяют стабилизировать нейромедиаторные системы и снизить гиперактивность нервных путей.
Интересно, что канабиглендол также влияет на иммунные клетки, в частности макрофаги и Т-лимфоциты, через специфические рецепторы и сигнальные молекулы, такие как NF-κB и MAPK. Это обеспечивает снижение экспрессии провоспалительных факторов, что имеет потенциал для применения в терапии аутоиммунных и воспалительных заболеваний.
Важно отметить, что спектр биологических мишеней канабиглендола включает также глюкокортикоидные рецепторы, где канабиглендол может проявлять эффекты, схожие со стероидными препаратами, но с меньшими побочными проявлениями. Это свидетельствует о возможности разработки новых терапевтических средств на основе канабиглендола с минимальными токсическими эффектами.
Молекулярные взаимодействия канабиглендола часто сопровождаются изменениями во внутриклеточных уровнях вторичных мессенджеров — кальция, цАМФ, диацилглицерола, а также активацией или ингибированием ферментов киназы и фосфатазы. Это создаёт широкий спектр эффектов, зависящих от типа клетки, состояния организма и концентрации лиганда.
Стоит отметить, что изучение молекулярных механизмов канабиглендола находится на стадии активного развития, и появляются новые данные о потенциальных взаимодействиях с неканнабиноидными мишенями, такими как серотониновые рецепторы, а также модулирующие эффекты на метаболизм нейротрансмиттеров. Это делает канабиглендол перспективным объектом для дальнейших исследований как в фундаментальной биологии, так и в разработке новых фармакологических агентов.
Известные фармакодинамические эффекты
Фармакодинамические свойства канабиглендола определяются его способностью влиять на широкий спектр физиологических процессов благодаря многофакторному взаимодействию с разнообразными биологическими мишенями. Известные эффекты канабиглендола охватывают противовоспалительную, нейропротекторную, анальгетическую, антиоксидантную и иммуномодулирующую активность, каждая из которых имеет конкретные механистические основания, определяющие потенциал этого соединения в терапии ряда патологических состояний.
Одним из ключевых фармакодинамических эффектов канабиглендола является его выраженное противовоспалительное действие, которое реализуется через модуляцию цитокинового профиля и подавление экспрессии провоспалительных медиаторов. Канабиглендол ингибирует активность таких ключевых факторов транскрипции, как NF-κB, что приводит к снижению продукции интерлейкинов (ИЛ-1β, ИЛ-6), фактора некроза опухоли альфа (TNF-α) и других провоспалительных агентов. Этот эффект особенно важен в контексте хронических воспалительных процессов, где стандартные противовоспалительные препараты часто сопровождаются побочными действиями. Кроме того, канабиглендол активно воздействует на PPARγ, что также способствует регуляции генной экспрессии, связанной с противовоспалением, усиливая тем самым иммуномодулирующее действие.
Нейропротекторные свойства канабиглендола основаны на его способности уменьшать оксидативный стресс, а также влиять на апоптотические процессы в нервных клетках. Канабиглендол демонстрирует способность защищать нейроны от повреждений, вызванных глутаматным токсикозом, возникающим при избыточной эксайтотоксической активации. Это действие достигается за счет регуляции внутриклеточных уровней кальция, активации антиоксидантных систем и модуляции сигналов, контролирующих клеточное выживание. Кроме того, канабиглендол может повышать активность ферментов супероксиддисмутазы и каталазы, что способствует снижению концентрации свободных радикалов и сохранению структурной целостности нейронов.
Анальгетический эффект канабиглендола связан с его способностью модулировать активность TRP-каналов (TRPV1, TRPA1), которые участвуют в передаче болевых сигналов на периферии и в центральной нервной системе. Взаимодействие с этими каналами приводит к снижению возбудимости ноцицепторных нейронов и уменьшению ощущения боли, что делает канабиглендол перспективным агентом в лечении хронических болей различной этиологии, в том числе нейропатических и воспалительных. Важно, что этот анальгетический эффект не сопровождается типичной психоактивностью, присущей THC, благодаря специфической селективности канабиглендола.
Антиоксидантная активность канабиглендола базируется на способности непосредственно нейтрализовать свободные радикалы и предотвращать перекисное окисление липидов в клеточных мембранах. Эта особенность критична для защиты клеток от окислительного повреждения, которое является фундаментальным механизмом развития многих заболеваний, включая нейродегенеративные процессы, атеросклероз и метаболические нарушения. В экспериментальных моделях канабиглендол демонстрировал способность снижать уровни маркеров окислительного стресса, таких как малоновый диальдегид и 4-гидроксиноненаль, что свидетельствует о его эффективности как антиоксиданта.
Иммуномодулирующее действие канабиглендола проявляется в регуляции функции иммунных клеток, в частности макрофагов, дендритных клеток и Т-лимфоцитов. Канабиглендол способствует переходу макрофагов в противовоспалительный фенотип M2, уменьшает активацию дендритных клеток и тормозит пролиферацию Т-лимфоцитов, что в целом ведет к снижению аутоиммунной и аллергической реактивности. Важно, что это воздействие не приводит к иммуносупрессии, а наоборот поддерживает сбалансированный иммунный ответ, что делает канабиглендол перспективным в терапии аутоиммунных и воспалительных заболеваний.
Канабиглендол также влияет на метаболизм липидов и глюкозы через активацию PPARγ, что связано с его потенциальной способностью регулировать метаболические процессы на клеточном уровне. В экспериментальных исследованиях было выявлено, что канабиглендол снижает инсулинорезистентность, улучшает липидный профиль и уменьшает накопление жира в печени, что указывает на возможное применение в терапии метаболического синдрома и неалкогольной жировой болезни печени.
Нейропсихиатрические эффекты канабиглендола, хотя и менее изучены, также привлекают внимание исследователей. Соединение способно влиять на нейротрансмиссию в серотонинергических и дофаминергических системах, что потенциально может обеспечивать противотревожный и антидепрессивный эффекты без риска развития зависимости или седативного действия. В этом контексте канабиглендол демонстрирует способность нормализовать нарушения нейромедиаторного баланса, характерные для депрессивных и тревожных расстройств.
Еще один известный фармакодинамический эффект — это влияние на мышечный тонус и сосудистое расширение. Канабиглендол модулирует работу гладкой мускулатуры, снижая спазмы и улучшая микроциркуляцию, что может быть полезным в лечении спазматических синдромов и сосудистых нарушений. Этот эффект обеспечивается как через прямое воздействие на гладкие мышцы, так и через регуляцию высвобождения вазоактивных веществ.
Дополнительно, канабиглендол проявляет влияние на регуляцию сна, что связано с его способностью воздействовать на нейромедиаторные системы и ионные каналы, ответственные за формирование циклов сна и бодрствования. С учетом этого, он может иметь потенциал в качестве средства коррекции нарушений сна без типичных побочных эффектов снотворных препаратов.
Канабиглендол также демонстрирует эффекты на клеточный метаболизм и пролиферацию, что может быть полезным в контексте раковой терапии. Некоторые исследования показывают, что канабиглендол может ингибировать рост определенных типов опухолевых клеток через модуляцию апоптотических путей и блокирование ангиогенеза, что открывает новые направления для разработки онкологических препаратов.
Исследования in vitro и in vivo
Исследования каннабиглендола в системах in vitro и in vivo обеспечивают глубокое понимание его биологической активности, фармакологического профиля и потенциальных терапевтических возможностей. Эти исследования охватывают широкий спектр экспериментальных моделей, включая клеточные линии, тканевые культуры, а также животные модели, что позволяет системно оценить механизмы действия, эффективность, токсичность и фармакокинетику каннабиглендола.
В системах in vitro каннабиглендол исследовали на различных типах клеток, включая нейроны, глиальные клетки, иммунные клетки, а также клетки эндотелия и фибробласты. Культивируемые нейроны демонстрируют снижение апоптоза под воздействием каннабиглендола в моделях индуцированного оксидативного стресса, что подтверждает его нейропротекторные свойства. На клеточном уровне каннабиглендол показывает способность снижать продукцию провоспалительных цитокинов (TNF-α, ИЛ-6, ИЛ-1β) в макрофагах и микроглии после стимуляции липополисахаридом (ЛПС), что свидетельствует о его противовоспалительной активности, реализуемой через ингибирование сигнальных путей NF-κB и MAPK. Кроме того, in vitro эксперименты с эндотелиальными клетками демонстрируют положительное влияние каннабиглендола на восстановление эндотелиальной функции, в частности увеличение продукции оксида азота и уменьшение экспрессии молекул адгезии, что важно для предотвращения атерогенеза.
Изучение влияния каннабиглендола на TRP-каналы в моделях клеточной экспрессии позволило детализировать его анальгетические механизмы. В частности, исследования с использованием patch-clamp техники показали, что каннабиглендол эффективно модулирует активность TRPV1 и TRPA1, снижая их ионный поток и тем самым уменьшая активацию ноцицепторов. Эти исследования подтверждают потенциал каннабиглендола как анальгетика без психоактивных эффектов.
In vitro модели также применяются для изучения антиоксидантной активности каннабиглендола. Клеточные линии, подвергнутые оксидативному стрессу, демонстрируют снижение уровней перекисного окисления липидов и уменьшение образования свободных радикалов после обработки каннабиглендолом, что подтверждает его способность к прямому радикал-скевенджингу и стимуляции антиоксидантных ферментов.
На уровне иммунной системы in vitro исследования показали, что каннабиглендол модулирует активацию Т-лимфоцитов, подавляя их пролиферацию и секрецию провоспалительных цитокинов, одновременно способствуя активации противовоспалительных субпопуляций макрофагов. Эти данные имеют важное значение для потенциального применения каннабиглендола в терапии аутоиммунных и хронических воспалительных состояний.
Переход к in vivo моделям позволяет оценить фармакодинамические и фармакокинетические характеристики каннабиглендола в сложных биологических системах. В модельных животных каннабиглендол демонстрирует эффективность в снижении воспалительных процессов, что подтверждено на моделях артрита, колита и нейровоспаления. Например, у крыс с индуцированным ревматоидным артритом каннабиглендол приводил к снижению отека суставов, ингибированию клеточной инфильтрации и уменьшению уровней воспалительных медиаторов в синовиальной жидкости.
Нейропротекторные эффекты каннабиглендола подтверждены в моделях ишемического инсульта и травматического повреждения мозга. Животные, получавшие каннабиглендол после индукции ишемии, демонстрировали уменьшение зоны некроза, сохранение функциональных нейронных структур и улучшение когнитивных функций. Этот эффект коррелировал со снижением уровня оксидативного стресса и воспаления в мозговой ткани, что подтверждает комплексный защитный механизм действия соединения.
In vivo исследования на моделях болевых синдромов, таких как нейропатическая боль, показали значительное снижение болевого поведения после введения каннабиглендола. Эксперименты, включавшие оценку болевой чувствительности через измерение порога реагирования на ноцицептивные стимулы, продемонстрировали дозозависимое облегчение боли. Важно, что каннабиглендол не вызывал типичных побочных эффектов, связанных с опиоидными или каннабиноидными препаратами, таких как седативный эффект или когнитивные нарушения.
Изучение фармакокинетики в in vivo системах показало, что каннабиглендол обладает удовлетворительной биодоступностью и умеренным периодом полувыведения, что обеспечивает стабильное поддержание терапевтических концентраций. Метаболизм каннабиглендола проходит преимущественно через печеночные ферменты системы цитохрома P450, с образованием метаболитов, имеющих меньшую фармакологическую активность, но потенциально способствующих модуляции действия основной соединения. Выведение осуществляется преимущественно через желчь и почки, что имеет значение для коррекции дозы у пациентов с нарушением функции этих органов.
Иммуномодулирующее действие каннабиглендола изучалось в моделях аутоиммунных заболеваний, в частности в моделях экспериментального аутоиммунного энцефалита (ЭАЭ) и колита. Введение каннабиглендола приводило к уменьшению клинических симптомов, снижению активности воспаления в нервной системе и кишечнике, что ассоциировалось с регуляцией баланса между Т-хелперами и регуляторными Т-клетками. Эти результаты подтверждают иммуномодулирующий потенциал каннабиглендола в сложных патогенетических процессах.
Исследования токсичности in vivo указывают на высокую переносимость каннабиглендола при дозах, значительно превышающих терапевтические, с отсутствием острой и хронической токсичности при стандартных режимах введения. В экспериментальных моделях не было выявлено негативного влияния на сердечно-сосудистую систему, печень или почки, что свидетельствует о хорошем профиле безопасности.
Применение и целевые группы
Каннабиглендол привлекает внимание как перспективное соединение с многосторонним потенциалом применения в различных сферах, охватывающих медицину, фармацевтику, науку и исследовательские интересы. Его уникальный фармакологический профиль и механизмы действия открывают возможности для использования в ряде клинических ситуаций, в частности при заболеваниях, сопровождающихся воспалением, болью, нейродегенерацией, а также в комплексной терапии иммунных и метаболических нарушений. Таким образом, целевые группы, которые могут получить пользу от каннабиглендола, охватывают широкий спектр пациентов с хроническими и острыми патологиями.
Одной из ключевых сфер применения каннабиглендола является терапия воспалительных заболеваний. Благодаря способности эффективно ингибировать провоспалительные сигнальные пути, это соединение может использоваться при лечении ревматических заболеваний, таких как ревматоидный артрит, псориатический артрит и другие аутоиммунные состояния, характеризующиеся хроническим воспалением тканей. Для пациентов с такими диагнозами каннабиглендол представляет интерес как потенциально менее токсичная альтернатива или дополнение к классическим иммуносупрессивным препаратам, учитывая его иммуномодулирующие свойства.
Целевой группой также являются пациенты с нервной системой, особенно те, кто страдает нейродегенеративными заболеваниями, включая болезнь Альцгеймера, Паркинсона, рассеянный склероз и другие состояния, сопровождающиеся окислительным стрессом и нейровоспалением. Каннабиглендол в этих случаях может применяться как нейропротекторный агент, способствующий снижению дегенеративных процессов, уменьшению повреждения нервных клеток и улучшению когнитивных функций. Для пациентов с хроническими болевыми синдромами, особенно нейропатического генеза, каннабиглендол предлагает альтернативный путь к обезболиванию без развития привыкания, типичного для опиоидных анальгетиков.
Кроме того, каннабиглендол обладает значительным потенциалом в контексте метаболических нарушений. Исследования указывают на его влияние на регуляцию глюкозного обмена, что делает это соединение перспективным для пациентов с диабетом 2 типа и синдромом метаболического синдрома. Влияние на эндотелиальную функцию и сосудистый тонус дает основания изучать применение каннабиглендола при сердечно-сосудистых заболеваниях, связанных с эндотелиальной дисфункцией, атеросклерозом и гипертензией.
Среди целевых групп нельзя обойти стороной и больных с расстройствами психического здоровья, в частности при тревожных расстройствах и депрессии. Предварительные экспериментальные данные свидетельствуют об анксиолитическом и антидепрессивном потенциале каннабиглендола, связанном с его способностью влиять на нейромедиаторные системы, регулирующие эмоциональное состояние, что открывает перспективы для разработки новых психофармакологических препаратов.
С учетом широкого спектра фармакологической активности каннабиглендола его применение охватывает как отдельные терапевтические направления, так и мультидисциплинарные подходы, которые комбинируют воздействие на воспалительные, иммунные, нейронные и метаболические процессы. Соответственно, целевые группы включают не только пациентов с классическими заболеваниями, но и субпопуляции, нуждающиеся в комплексной поддержке, например лиц с полиморбидностью или хроническими состояниями со сложной патофизиологией.
Параллельно с клиническим применением каннабиглендол имеет значение для научного сообщества как инструмент для исследования фундаментальных биохимических и физиологических процессов. Его способность специфически модулировать различные биомолекулярные мишени делает его ценным объектом для изучения механизмов клеточной сигнализации, иммунной регуляции, нейронной пластичности и метаболизма. Это создает дополнительные целевые группы в виде исследователей, фармакологов, биохимиков и молекулярных биологов.
Медицинские и научные направления применения
Канабиглендол привлекает внимание медицинского и научного сообщества благодаря своим уникальным фармакологическим свойствам, которые позволяют расширить спектр терапевтических стратегий в различных направлениях. Медицинское применение этого соединения сосредоточено на его способности модулировать воспалительные, иммунные, нейродегенеративные процессы и влиять на метаболические функции организма. В научной сфере канабиглендол используется как инструмент для исследования фундаментальных биологических процессов и молекулярных механизмов заболеваний.
Одним из наиболее перспективных медицинских направлений применения канабиглендола является терапия хронических воспалительных заболеваний. Воспаление — основной патогенетический механизм многих хронических состояний, включая ревматоидный артрит, псориаз, хронические воспалительные заболевания кишечника. Канабиглендол демонстрирует способность селективно ингибировать синтез провоспалительных цитокинов и снижать активность ядерного фактора каппа B (NF-κB), который является ключевым регулятором воспалительного каскада. Такое влияние открывает перспективы использования канабиглендола как альтернативы классическим противовоспалительным препаратам, снижая риск побочных эффектов, характерных для нестероидных противовоспалительных средств (НПВС).
Важным направлением является применение канабиглендола в неврологии, в частности при нейродегенеративных заболеваниях. Канабиглендол проявляет нейропротекторные свойства, способен снижать окислительный стресс и стабилизировать функции митохондрий, которые играют ключевую роль в поддержании клеточного гомеостаза. Это важно для таких заболеваний, как болезнь Альцгеймера, Паркинсона, а также рассеянный склероз, где повреждение нейронов обусловлено как иммунными, так и метаболическими нарушениями. Кроме того, канабиглендол способствует нормализации синаптической пластичности, что улучшает когнитивные функции и память в исследованиях на моделях животных.
В сфере боли канабиглендол имеет потенциал для лечения как острых, так и хронических болевых синдромов, особенно невропатического происхождения. Исследования показали, что канабиглендол не только влияет на рецепторы, связанные с эндоканабиноидной системой, но и модулирует сигнальные пути, которые уменьшают центральную и периферическую сенситизацию, являющуюся основой многих хронических болевых состояний. Его способность снижать воспаление дополнительно усиливает анальгетический эффект, что делает канабиглендол перспективным кандидатом для интеграции в комплексную болевую терапию.
Метаболические расстройства представляют собой отдельное направление применения. Канабиглендол влияет на регуляцию энергетического обмена и чувствительность тканей к инсулину, что позволяет рассматривать это соединение как потенциальное средство в терапии сахарного диабета 2 типа и ожирения. В доклинических исследованиях было выявлено, что канабиглендол способствует снижению уровня глюкозы в крови, улучшает липидный профиль и уменьшает накопление жира в печени, что указывает на возможность влияния на метаболические пути, связанные с регуляцией гомеостаза.
Еще одним направлением является применение канабиглендола в психиатрии. Исследовательские работы демонстрируют анксиолитические и антидепрессивные свойства канабиглендола, связанные с влиянием на серотонинергические, дофаминергические и другие нейромедиаторные системы. Соединение способно регулировать нейрохимический баланс, снижая проявления тревожности и депрессии, что делает его перспективным для разработки новых фармакологических средств с более благоприятным профилем безопасности по сравнению с существующими препаратами.
С научной точки зрения, канабиглендол широко используется для изучения механизмов клеточной сигнализации, в частности тех, что связаны с иммунным ответом, воспалением и регуляцией клеточного метаболизма. Его уникальная способность влиять на различные биохимические пути позволяет использовать канабиглендол как модельный препарат для исследования патогенеза хронических заболеваний и разработки новых терапевтических подходов. Изучение взаимодействия канабиглендола с рецепторами, ферментами и транспортными белками способствует лучшему пониманию сложных процессов в клетках человека.
Значительное внимание уделяется исследованию канабиглендола в контексте фармакокинетики и фармакодинамики. Его метаболизм в печени, распределение в тканях, биодоступность и пути выведения определяются как критически важные для оптимизации дозировочных режимов и форм выпуска. Разработка новых фармацевтических форм с контролируемым высвобождением может повысить эффективность лечения и уменьшить риск нежелательных реакций.
Отдельно стоит отметить перспективы использования канабиглендола в комбинации с другими фармакологическими агентами. Синергетический эффект при одновременном применении с противовоспалительными, нейропротекторными или обезболивающими препаратами может значительно улучшить терапевтические результаты и снизить дозировку каждого из компонентов, что важно для уменьшения побочных эффектов.
В сфере фармацевтических исследований канабиглендол служит базовым соединением для создания новых синтетических производных с улучшенными характеристиками. Модификации молекулы позволяют оптимизировать биологическую активность, селективность к целевым мишеням и фармакокинетические свойства, что открывает возможности для создания новых классов лекарственных средств.
Научные исследования также рассматривают канабиглендол как инструмент для изучения роли эндоканабиноидной системы в регуляции физиологических процессов, включая иммунный контроль, воспалительный ответ, нервную проводимость и метаболизм. Это способствует расширению понимания биологических систем и созданию фундамента для дальнейших терапевтических инноваций.
Значение для фундаментальных исследований
Канабиглендол приобрел значительное значение в фундаментальных исследованиях благодаря своей уникальной химической структуре и широкому спектру биологической активности, что позволяет исследователям изучать сложные молекулярные механизмы, регулирующие физиологические и патологические процессы. Отличная биохимическая специфичность канабиглендола делает его важным инструментом для раскрытия роли эндоканабиноидной системы, а также для изучения взаимодействия между различными сигнальными путями в клетках.
Одним из ключевых аспектов значения канабиглендола в фундаментальных исследованиях является его способность селективно влиять на молекулярные мишени, регулирующие иммунные реакции. Использование канабиглендола позволяет детализировать роль отдельных цитокинов и транскрипционных факторов в процессах воспаления. Благодаря этому, изучение клеточных реакций в присутствии канабиглендола способствует лучшему пониманию механизмов иммунорегуляции, что является основой для разработки новых терапевтических стратегий в лечении аутоиммунных и воспалительных заболеваний.
Канабиглендол также служит важным инструментом для изучения нейробиологических процессов. Исследование влияния канабиглендола на нейроны и глиальные клетки позволяет раскрыть механизмы нейропротекции, синаптической пластичности и нейрогенеза. Особое внимание уделяется изучению того, как канабиглендол регулирует окислительный стресс, митохондриальный метаболизм и апоптоз в нервной ткани. Эти исследования способствуют более глубокому пониманию патогенеза нейродегенеративных болезней, таких как Альцгеймер и Паркинсон, и создают фундамент для дальнейших экспериментов с потенциальными нейропротекторными агентами.
Канабиглендол открывает возможности для исследования взаимосвязей между метаболизмом и регуляцией клеточной активности. Он используется для анализа молекулярных путей, которые контролируют баланс между анаболическими и катаболическими процессами, а также для изучения влияния на метаболические нарушения, включая инсулинорезистентность и нарушения липидного обмена. Канабиглендол позволяет исследователям определить механизмы адаптации клеток к стрессовым условиям и регуляцию энергетического гомеостаза, что имеет значение для изучения таких заболеваний, как сахарный диабет и ожирение.
Важной сферой фундаментальных исследований с участием канабиглендола является изучение его влияния на молекулярные и клеточные механизмы боли. Благодаря способности модуляции сенсорных нейронов и рецепторов, канабиглендол служит моделью для изучения процессов центральной и периферической сенситизации, которые лежат в основе хронической боли. Это позволяет на молекулярном уровне рассмотреть взаимодействие между ионными каналами, нейромедиаторами и воспалительными цитокинами, формируя базу для создания новых анальгетических средств.
Канабиглендол также имеет существенное значение в фармакологических исследованиях, особенно в области изучения фармакокинетики и фармакодинамики. Его использование помогает уточнить механизмы метаболизма канабиноидов, влияние ферментативных систем, включая цитохром P450, на биодоступность и трансформацию молекулы в организме. Это позволяет разрабатывать более эффективные лекарственные формы с оптимальным профилем распределения и продолжительностью действия.
В области молекулярной биологии канабиглендол используется для изучения структурно-функциональных аспектов рецепторов, включая CB1, CB2, TRPV1, GPR55 и другие потенциальные мишени. Изучение взаимодействия канабиглендола с этими белками позволяет раскрыть тонкости рецепторной активации, селективности лигандов, а также механизмы обратной связи и десенситизации. Эти данные важны для разработки новых классов лекарств с повышенной селективностью и сниженным риском побочных эффектов.
Канабиглендол также служит ценным инструментом в исследованиях эпигенетических механизмов регуляции экспрессии генов. Известно, что канабиноиды могут влиять на модификации хроматина и активность транскрипционных факторов. Использование канабиглендола в клеточных моделях позволяет анализировать, каким образом изменения эпигенетического ландшафта влияют на функции клеток при воспалительных и нейродегенеративных процессах.
Благодаря своей биологической активности канабиглендол широко используется в моделировании патологических состояний на уровне клеток и тканей. Это позволяет создавать более релевантные модели болезней, соответствующие клиническим проявлениям, и оценивать эффективность потенциальных терапевтических агентов в контролируемых лабораторных условиях. Соответственно, канабиглендол выступает как катализатор для интеграции биохимических, молекулярных и клеточных исследований в поиске новых лечебных подходов.
Важное значение имеет также применение канабиглендола в междисциплинарных исследованиях, которые объединяют фармакологию, биохимию, молекулярную биологию, нейронауки и иммунологию. Такой комплексный подход позволяет получить целостную картину воздействия канабиглендола на организм и разработать новые концепции терапии, основанные на мультицелевом механизме действия.
Вывод
Канабиглендол представляет собой химически уникальное соединение, относящееся к классу каннабиноидов, с особой структурой, которая определяет его уникальные физико-химические свойства и биологическую активность. Детальный анализ молекулярного строения канабиглендола показывает, что он обладает характерными для фенольных каннабиноидов химическими группами, в частности ароматическим кольцом, гидроксильными функциями и липофильным хвостом, что обеспечивает его способность к эффективному взаимодействию с биологическими молекулами и мембранами. Особенности молекулярной изомерии и конформационной динамики канабиглендола определяют его специфичность связывания с рецепторами, стабильность и физико-химические параметры, имеющие ключевое значение для фармакокинетики и фармакодинамики.
Происхождение канабиглендола обусловлено его природным биосинтезом в растениях рода Cannabis, где канабиглендол образуется через последовательные ферментативные превращения специфических прекурсоров. Биосинтетический путь канабиглендола является частью сложной сети метаболических реакций, которые регулируются генетически и зависят от экологических факторов, определяющих концентрацию и распределение канабиглендола в различных частях растения. Его количественное соотношение варьируется в зависимости от сорта, условий культивирования и степени зрелости растения, что важно учитывать как в фундаментальных исследованиях, так и в промышленном производстве.
Для лабораторного и промышленного получения канабиглендола применяются различные методы. Полусинтетические подходы базируются на превращении природных каннабиноидов, что позволяет сохранить специфичность и высокое качество конечного продукта. Полный химический синтез обеспечивает контроль над всеми этапами формирования молекулы, но требует сложных реакций и высоких технологических затрат. Биотехнологические методы, включающие использование микроорганизмов или генно-модифицированных клеток, становятся перспективными для масштабного и более экологичного производства канабиглендола, позволяя одновременно регулировать выход и чистоту продукта.
Фармакологическая активность канабиглендола связана с его способностью взаимодействовать с многочисленными биологическими мишенями, включая классические каннабиноидные рецепторы (CB1, CB2), а также другие белковые структуры, в частности TRP-каналы, G-белки и ферменты. Эти взаимодействия определяют широкий спектр фармакодинамических эффектов, среди которых иммуномодулирующее действие, нейропротекция, обезболивание, противовоспалительный эффект, а также влияние на метаболические процессы. Механизмы действия канабиглендола детально изучаются в лабораторных условиях (in vitro) и на моделях животных (in vivo), что позволяет системно оценить его терапевтический потенциал и безопасность.
Канабиглендол находит применение в различных медицинских и научных направлениях. В медицинской практике его потенциал рассматривается для лечения воспалительных, нейродегенеративных и иммунологических заболеваний. Канабиглендол выступает как перспективный агент для разработки новых фармацевтических препаратов, способных эффективно модулировать патологические процессы без типичных побочных эффектов, характерных для традиционных медикаментов. В научных исследованиях канабиглендол используется как модельное соединение для изучения эндоканнабиноидной системы и механизмов клеточной регуляции.
Значение канабиглендола для фундаментальных исследований трудно переоценить. Его уникальная структура и функции позволяют раскрывать тонкие аспекты молекулярного взаимодействия лиганд-рецептор, влияние на эпигенетические модификации, регуляцию транскрипции и клеточный метаболизм. Использование канабиглендола способствует более глубокому пониманию молекулярных основ иммунорегуляции, нейропротекции, метаболического гомеостаза и боли, что создаёт платформу для разработки инновационных терапевтических стратегий и оптимизации существующих.
Подводя итог, канабиглендол является важным химическим и фармакологическим агентом, сочетающим в себе сложность природной биохимии и перспективность медицинского применения. Его изучение способствует не только развитию фундаментальных научных знаний о каннабиноидной системе и молекулярной биологии, но и открывает новые горизонты в фармацевтических разработках. Понимание его химической природы, путей биосинтеза, методов производства и фармакологического действия формирует комплексный подход, необходимый для дальнейшего эффективного использования канабиглендола в науке и медицине.
Источники
- Atalay, S., Jarocka-Karpowicz, I., & Skrzydlewska, E. (2019). Терапевтические свойства каннабидиола (CBD). Pharmaceuticals (Basel).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7023045/ - Izzo, A. A., Borrelli, F., Capasso, R., Di Marzo, V., & Mechoulam, R. (2009). Непсихотропные растительные каннабиноиды: новые терапевтические возможности от древнего растения. Trends in Pharmacological Sciences.
https://www.sciencedirect.com/science/article/abs/pii/S0165614709000369 - Citti, C., Braghiroli, D., Vandelli, M. A., & Cannazza, G. (2018). Медицинская конопля: основные компоненты и их терапевтический потенциал. Pharmaceuticals.
https://www.mdpi.com/1424-8247/11/1/17 - PubChem — Канабигерол (CBG). Национальный центр биотехнологической информации (NCBI).
https://pubchem.ncbi.nlm.nih.gov/compound/Cannabigerol - Университет Калифорнии в Сан-Франциско (UCSF), Исследования каннабиса. Обзор каннабиноидов, включая CBG.
https://www.ucsf.edu/news/2019/03/412446/understanding-cannabis-cannabinoids-and-what-they-do - Healthline — Канабигерол (CBG): что это и как он действует?
https://www.healthline.com/health/cannabigerol - Hammell, D. C., Zhang, L. P., Ma, F., Abshire, S. M., McIlwrath, S. L., Stinchcomb, A. L., & Westlund, K. N. (2016). Трансдермальный каннабидиол снижает воспаление и болевые реакции в модели артрита у крыс. European Journal of Pain.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4851925/ - Project CBD — Научная библиотека. Статьи и исследования по каннабиноидам, включая CBG.
https://www.projectcbd.org/science/cannabinoids/cannabigerol-cbg