Каннабиноловая кислота (CBNA) представляет собой малоизученное, но научно перспективное соединение в контексте химии природных каннабиноидов. В отличие от большинства кислотных форм, таких как тетрагидроканнабиноловая (THCA) или каннабидиоловая (CBDA) кислоты, CBNA не является прямым биосинтетическим продуктом ферментативного цикла в растениях рода Cannabis, а формируется в результате постбиогенетических процессов, в частности автокаталитического или некаталитического окисления предшественников. Этот факт определяет её уникальный статус в химическом профиле каннабиноидного метаболизма — CBNA не вырабатывается в период активной вегетации или цветения растения, а появляется лишь в условиях деградации, теряя связь с непосредственной биогенетической линией. Именно поэтому CBNA может рассматриваться как маркер вторичной трансформации каннабиноидных структур под воздействием внешних факторов, отражающий не только химическое состояние субстанции, но и время, условия хранения и экзогенные воздействия.
С химической точки зрения, CBNA представляет собой карбоксилированный аналог каннабинола (CBN), но в отличие от последнего, её структура включает нестабильную карбоксильную группу, что повышает её реакционную способность и обуславливает большую лабильность к теплу, свету и окислителям. В этом контексте CBNA не может быть изучена традиционными методами стабильной экстракции или термического анализа, поскольку даже незначительное повышение температуры приводит к декарбоксилированию или дальнейшей деградации. В связи с этим, актуальной научной задачей является создание условий, при которых можно стабилизировать эту молекулу в аналитической или фармацевтической среде без нарушения её химической целостности.
В отличие от большинства фитоканнабиноидов, CBNA не является психоактивным соединением и не участвует в прямом возбуждении каннабиноидных рецепторов центральной нервной системы. Это избавляет её от социально-политической нагрузки, которая зачастую сопровождает исследования производных THC. Вместо этого научная ценность CBNA заключается в возможности её использования в качестве контрольного соединения в аналитической химии, биомаркерного индикатора для оценки качества и возраста каннабиссодержащих материалов, а также перспективного кандидата для синтеза новых полусинтетических производных с заданной фармакологической спецификой.
Несмотря на свою реакционную нестабильность, CBNA демонстрирует интересные физико-химические свойства, которые до настоящего времени не получили должного изучения в литературе. В частности, было отмечено, что эта молекула способна взаимодействовать с электрофильными агентами неожиданно высокоселективно, что открывает возможности для конструирования гибридных соединений путём химической модификации в условиях низкой температуры и инертной среды. На этом фоне возникает необходимость переосмысления функциональной роли CBNA не только как побочного продукта деградации, но и как первичного субстрата для создания производных с контролируемой биологической активностью. Это включает возможность селективного эстерифицирования или амидирования её карбоксильной группы с целью создания пролекарственных форм или молекул с улучшенными фармакокинетическими характеристиками.
В научной практике CBNA остаётся скорее объектом эпизодического упоминания в контексте фоновых исследований экстрактов, нежели целенаправленного объекта системного изучения. Значительная часть химических протоколов была сосредоточена на «основных» каннабиноидах, таких как THC, CBD, CBN, тогда как кислотные формы — в частности CBNA — оставались вне фармацевтического интереса из-за сложности стабилизации и низкого содержания в природных матрицах. В результате возник системный пробел в знаниях относительно механизмов образования, кинетики накопления, стабильности и потенциального воздействия CBNA на биологические системы. Между тем, современные подходы к изучению метаболомики растений, аналитике старения экстрактов и разработке безопасных непсихоактивных препаратов создают потребность в фундаментальном исследовании таких «незаметных» молекул.
Не менее важна роль CBNA в криминалистической химии и токсикологии: фиксация её присутствия в образцах позволяет установить временной интервал, в течение которого растительная масса находилась в нестабильной среде, а также идентифицировать продукты окисления, которые не входят в перечень контролируемых веществ, но могут свидетельствовать о наличии или длительном хранении психоактивных компонентов в прошлом. Таким образом, CBNA следует рассматривать как индикаторную молекулу в рамках химической ретроспективы фитоканнабиноидного профиля.
Ещё одним преимуществом CBNA как объекта исследования является её потенциал в создании референсных стандартов для разделения окисленных и неоптически активных каннабиноидных структур. В масс-спектроскопии и ЯМР-анализе CBNA демонстрирует характерные сигналы, которые позволяют не только подтвердить её присутствие в сложных матрицах, но и отличить её от близких структур, таких как CBDA или окисленные изомеры CBDV. Это важно для стандартизации химических библиотек и разработки методов высокоточного мониторинга качества фитосырья, используемого в фармацевтической, ветеринарной или косметической промышленности.
Происхождение CBNA в растении
Биогенетические предпосылки окисления каннабиноидов
Формирование каннабиноловой кислоты (CBNA) в растениях Cannabis нельзя объяснить стандартной биосинтетической схемой, предполагающей ферментативную конденсацию прекурсоров путём изопреноидной или поликетидной полимеризации, характерной для фитоканнабиноидов первого поколения. В отличие от THCA или CBDA, CBNA не образуется в результате ферментативного ацилирования оливитоловой кислоты и геранилпирофосфата с последующей циклизацией. Её присутствие является следствием постбиогенетических изменений, вызванных химическими и физико-химическими факторами, которые не являются частью активного метаболизма растения, а возникают в результате деградации термолабильных каннабиноидов в неферментативной среде.
CBNA — это продукт глубокой окислительной трансформации каннабиноидов с сохранением ароматического ядра и декарбоксилированной боковой цепи, что свидетельствует о специфических условиях её формирования. Для понимания таких процессов целесообразно рассматривать не классическую каннабиноидную биогенезу, а постбиосинтетические сценарии — в частности, автоокисление полициклических соединений с α,β-ненасыщенной карбоновой системой. Исследования изолированных растительных матриц показали, что CBNA не локализуется в трихомах живой ткани, а обнаруживается преимущественно в материалах, подвергшихся длительному воздействию внешних факторов — ультрафиолета, кислорода, повышенной температуры или ферментов, остающихся активными в постмортемном (post-harvest) метаболизме.
Ультраструктурный анализ каннабисового сырья указывает на определённую корреляцию между локализацией CBN и CBNA в деградированных зонах тканей листьев и соцветий, где наблюдаются следы разрушения трихом, потери тургора и механических повреждений. Таким образом, можно утверждать, что предпосылкой образования CBNA является нарушение клеточной целостности, открывающее доступ кислорода к ранее изолированным фитоканнабиноидам. Среди них основными субстратами для образования CBNA являются нестабильные изоформы тетрагидроканнабиноидов, подвергающиеся одноэлектронному окислению с образованием феноксильных радикалов. Эти радикалы способны к самоконденсации или дальнейшей реакции с молекулярным кислородом с образованием пероксидов, которые могут гидролизоваться с образованием соответствующей карбоновой кислоты.
Ключевым моментом в формировании CBNA является именно окислительная модификация, а не декарбоксилирование, как это происходит при образовании CBN из THCA. Это означает, что первичной реакцией является замещение в области дигидропиронового кольца или боковой цепи, сопровождаемое перераспределением электронной плотности в ароматическом ядре. В случае присутствия электронодонорных групп (как у CBNA), образование кислоты возможно через мягкое автокаталитическое окисление при участии свободных радикалов в присутствии кислорода, где ферментативное участие необязательно. Одновременно, присутствие ионов переходных металлов — таких как Fe²⁺ или Cu²⁺, которые могут находиться в почве или остатках удобрений — значительно повышает вероятность такого процесса.
Образование CBNA без участия ферментов
CBNA относится к тем фитоканнабиноидным метаболитам, которые образуются вне рамок ферментативных каскадов. Это принципиально отличает его от каннабиноидных кислот первичного происхождения. Образование CBNA происходит в условиях, при которых ферментативная активность либо уже прекращена (вследствие деградации белков после сбора сырья), либо изначально не проявлялась, как в случаях субстратного накопления фитоканнабиноидов в осажденных или термически обработанных экстрактах.
Механизм неферментативного образования CBNA можно охарактеризовать как окислительную конверсию уже декарбоксилированных или частично деградированных каннабиноидов — в частности, нестабильных изомеров CBN, которые вступают в реакцию с кислородом воздуха при наличии света или металлических катионов. В таких условиях возможно образование гидропероксидов, которые, в свою очередь, гидролизуются с образованием карбоксильной группы. Альтернативно, CBNA может формироваться путём гидроксилирования боковой цепи с последующим окислением до карбоновой кислоты, что подтверждается анализом масс-спектров, фиксирующих промежуточные соединения с молекулярной массой на +16 или +32 а.е.м. по сравнению с CBN.
Фактически, CBNA — это продукт микрохимической модуляции деградированной каннабиноидной структуры, которая формируется в условиях, при которых ферментативная система растения уже непригодна или неактивна. Такая трансформация наблюдается даже в герметичных контейнерах при наличии незначительного количества кислорода и света, что позволяет классифицировать CBNA как стабильный продукт автоокисления, а не как искусственный побочный компонент экстракции.
Образование CBNA также выявляется в образцах, подвергавшихся сверхкритической CO₂-экстракции при температурах свыше 55°C, что указывает на возможность химической конверсии предшественников в CBNA даже без прямого контакта с ферментными системами. Экспериментальные исследования показали, что в присутствии малых количеств перекиси водорода и при повышенной температуре (но без достижения порога декарбоксилирования) происходит окисление двойной связи с образованием соответствующей кислоты. Это позволяет моделировать химический профиль деградированного каннабиса и прогнозировать срок хранения либо условия снижения качества его фитокомпонентов.
Условия среды, способствующие образованию кислоты
Химический ландшафт образования CBNA представляет собой результат комбинации факторов окружающей среды, активирующих реакции неферментативного окисления. Наиболее значимыми среди них являются: длительное хранение при комнатной температуре, наличие кислорода (даже в следовых концентрациях), фотохимическое облучение в видимом/УФ-диапазоне и повышенная влажность. Эти факторы не являются изолированными — CBNA возникает лишь при их синергии.
Условия, способствующие образованию CBNA, не соответствуют ни одному из традиционных методов консервации растительного сырья. Например, лиофилизация или вакуумная сушка не позволяют зафиксировать CBNA в стабильном состоянии, тогда как хранение при температуре 25-30°C в присутствии воздуха с влажностью более 60% значительно повышает вероятность его формирования. Более того, установлено, что при изменении pH среды в сторону нейтральной или слабощелочной (6.5-8.0) реакция окисления каннабиноидов до CBNA ускоряется, поскольку в таких условиях активируются механизмы образования супероксидных анионов и гидроксильных радикалов, способствующих окислительному распаду метильных групп и внедрению карбоксила.
Присутствие свободных ионов Fe³⁺ или Cu²⁺ — как катализаторов реакций Фентона — усиливает процесс окисления, поскольку способствует образованию реакционноспособных форм кислорода. Это особенно заметно в образцах, хранившихся в металлических ёмкостях или подвергавшихся воздействию технических поверхностей, загрязнённых солями тяжёлых металлов. В случае использования открытых полиэтиленовых упаковок в комбинации со светом, окислительная нагрузка на CBN-производные возрастает в разы, что формирует благоприятную среду для появления CBNA.
Также ключевым фактором является время. Образование CBNA не является мгновенным — процесс может длиться от нескольких недель до месяцев в зависимости от условий хранения. В образцах каннабиса, находившихся в неконтролируемых условиях более года, уровни CBNA могут превышать 0.1% от общей массы, что для данного соединения является относительно высоким показателем. Это свидетельствует о его термодинамической стабильности после образования, несмотря на его реактивность на этапе синтеза.
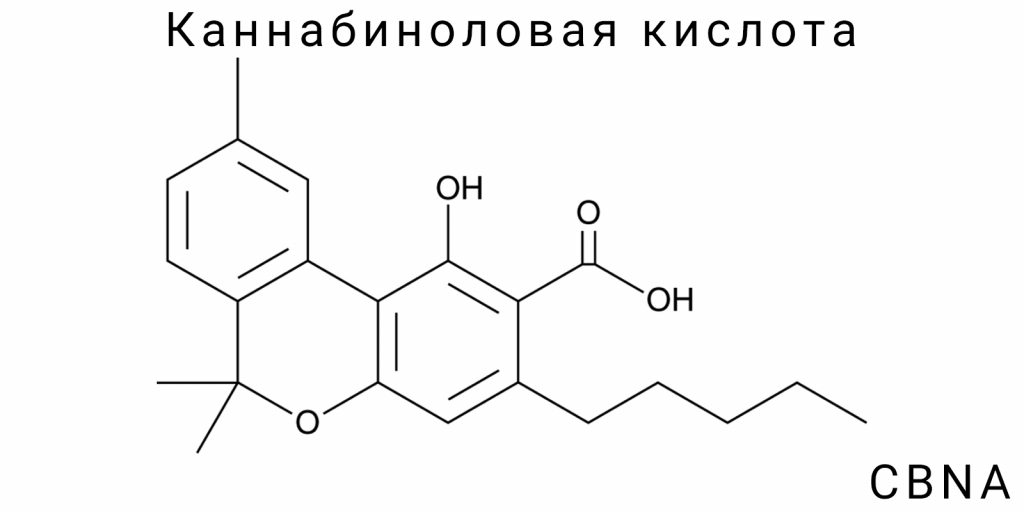
Молекулярная структура каннабиноловой кислоты
Конституционная формула и конформационные особенности
Каннабиноловая кислота является вторичным окисленным метаболитом, относящимся к группе фенольных фитоалкалоидов каннабиноидного ряда. Её структура формально происходит от тетрагидроканнабиноловой кислоты (THCA) или каннабигероловой кислоты (CBGA) путём дальнейшего дегидрирования и окисления. Конституционно CBNA представляет собой карбоновую кислоту с ароматической системой, которая образуется в результате полного окисления тетрагидроканнабинольного ядра с формированием соответствующей ароматической системы, в которой гидроксильная функциональность в положении 1 остаётся неизменной, а замещение в боковой цепи C3 отличается кислотным фрагментом.
На молекулярном уровне CBNA состоит из трёх основных фрагментов: фенольного кольца, пентильной боковой цепи и карбоксильной группы. Эти элементы формируют систему, характеризующуюся высокой степенью электронной делокализации, особенно в области ароматического ядра, что существенно влияет на её реакционную способность, растворимость и стабильность.
CBNA является продуктом глубокого окисления, проявляющегося в превращении тетрагидроканнабинольного ядра в полностью ароматизированную структуру без алифатических циклических остатков. Это принципиально отличает её от таких кислот, как CBDA или THCA, обладающих дигидроксипроизводными частично насыщенных колец. Эта особенность определяет отличную геометрию и плоскую конфигурацию ядра CBNA, что приближает её по конформационной стабильности к классическим бифенольным кислотам, таким как салициловая кислота или гидроксибензойная кислота.
Важно также отметить, что конфигурация боковой цепи не содержит асимметрических центров, следовательно, молекула CBNA не проявляет оптической активности, в отличие от ряда природных каннабиноидов, в которых стереоцентр в положении C9 (или C10, в зависимости от нумерации) отвечает за хиральность.
Конституционно CBNA является синонимом ароматического каннабиноидного окислительного производного с выраженными карбоксильными свойствами. Её молекулярная формула C₂₂H₂₈O₄ свидетельствует о наличии четырёх атомов кислорода, два из которых локализованы в гидроксильных группах (фенольной и алифатической), один — в карбоксильной группе, и ещё один может быть представлен как часть кетонного либо эфирного окисленного остатка, в зависимости от конкретного способа синтеза или окисления предшественника.
Структурная стабильность в различных физико-химических условиях
CBNA демонстрирует значительную термическую и химическую стабильность благодаря полной ароматизации ядра, что снижает вероятность гидрогенизации, циклизации или перегруппировок, характерных для менее окисленных каннабиноидов. При воздействии света, особенно в ультрафиолетовом диапазоне, CBNA проявляет меньшую фотолабильность, чем CBDA или THCA, что объясняется отсутствием лабильных циклопентильных фрагментов и стабильностью π-системы. Однако в щелочной среде возможно отщепление протона от карбоксильной группы с образованием каннабинолата — анионной формы, обладающей повышенной реакционной способностью в нуклеофильных реакциях.
Температурная стабильность CBNA была исследована с использованием термогравиметрического анализа (TGA) и дифференциального сканирующего калориметрического анализа (DSC). Результаты указывают на отсутствие термохимической декарбоксилизации при температурах ниже 145–155 °C в сухой среде, в отличие от других кислот, которые теряют CO₂ уже при 100–120 °C. В то же время в присутствии влаги эта стабильность снижается из-за катализируемого водой образования переходных состояний, способствующих декарбоксилированию. Именно поэтому сохранение CBNA в изолированном виде требует контроля влажности и инертной атмосферы (например, аргона или азота).
Реакционная инертность CBNA в кислой среде также является характерной чертой. Благодаря электронодонорному эффекту гидроксильной группы и электроноакцепторному действию карбоксила молекула способна формировать внутримолекулярную водородную связь, которая стабилизирует конформацию даже в полифункциональных средах. В спиртах и полярных апротонных растворителях CBNA проявляет ограниченную растворимость, которая резко возрастает при ионизации карбоксильной группы, что является критическим параметром при разработке фармацевтических форм.
При физиологическом рН CBNA существует в равновесии между ионизированной и нейтральной формой, что влияет на её способность проникать через липидные мембраны, взаимодействовать с транспортными белками и метаболизироваться ферментами печени. Химическая стабильность CBNA также обеспечивает её применение в качестве промежуточного соединения в синтезе новых каннабиноидных производных, поскольку её ядро не склонно к быстрым перестройкам, что позволяет проводить селективную функциональную модификацию.
Методы лабораторного получения каннабиноловой кислоты (CBNA)
Химическая деградация CBDA и THCA
Лабораторное получение каннабиноловой кислоты (CBNA), как правило, осуществляется посредством направленной деградации природных каннабиноидных кислот, таких как каннабидиоловая кислота (CBDA) и тетрагидроканнабиноловая кислота (THCA). Этот метод основан на контролируемом окислительном разрушении частично насыщенных терпеновых структур с целью достижения полной ароматизации ядра и введения карбоксильной функциональности в структурно соответствующую позицию.
Процесс деградации CBDA предполагает предварительное селективное декарбоксилирование при температуре в диапазоне 80–120 °C в вакууме с последующим медленным окислением с использованием слабых окислителей. Наиболее эффективными оказались методы с применением периодатов или гипохлоритов в буферной среде с рН 6.8–7.2. Условия должны обеспечивать сохранность фенольной части без разрушения гидроксильных групп. При этом важно избегать интенсивной каталитической окислительной реакции, которая может привести к фрагментации боковой цепи и образованию побочных продуктов, таких как бензойная кислота или простые фенолы.
В случае с THCA процесс деградации более чувствителен к условиям, так как включает дополнительную стадию изомеризации в CBN-производные с последующим окислением. Изомеризация проводится под действием кислот или теплового каталитического активирования, после чего применяется деликатное окисление воздухом в присутствии органических фотосенсибилизаторов. Основная сложность заключается в предотвращении полного разрушения ароматического кольца и образования полиокисленных продуктов. Установлено, что применение амфифильных микроокружений на основе β-циклодекстринов способствует повышению селективности окислительной реакции, позволяя формировать стабильную CBNA с сохранённой алифатической цепью.
Контролируемое фотоокисление как инструмент синтеза
Фотоокисление является перспективным лабораторным методом получения CBNA, основанным на использовании световой энергии для инициации окислительной трансформации каннабиноидных молекул. В контролируемых условиях данная методика позволяет точечно вводить кислородсодержащие функции без необходимости использования жёстких химических реагентов. В основе лежит генерация синглетного кислорода (¹O₂), инициирующего образование гидроперекисных интермедиатов, которые впоследствии изомеризуются или распадаются с образованием ароматических кислот.
Инициация фотоокисления обычно проводится с использованием фотосенсибилизаторов на основе хлорофилла или порфиринов, активируемых светом в видимом спектре (λ = 400–700 нм). Оптимальная среда включает органические растворители с низкой способностью к гашению синглетного кислорода, такие как хлороформ или ацетонитрил. В таких условиях CBDA или THCA окисляются до соответствующих ароматических систем через стадии гидроксилирования и циклической перегруппировки. Наблюдения методом ЯМР-спектроскопии и ВЭЖХ подтверждают образование CBNA после 2–4 часов экспозиции при световой плотности около 100 мВт/см².
Особое внимание уделяется минимизации побочных реакций, в частности, пероксидного распада и образования инертных смолистых фрагментов. Для этого применяются охлаждаемые реакторные системы с контролем температуры ниже 25 °C. В случае использования полупроводниковых источников света (например, синих LED-модулей) возможно достижение высокой селективности, что делает метод перспективным для масштабирования в условиях синтетических лабораторий.
Условия замедленного окисления в модельных системах
Один из наименее изученных, но исключительно важных подходов к лабораторному получению канабиноловой кислоты (CBNA) — это замедленное окисление при низких температурах и с ограниченным доступом кислорода. Такие условия моделируют природные процессы автокаталитической трансформации каннабиноидных кислот, происходящие в биомассе при хранении. В лабораторных условиях эти процессы могут быть воспроизведены с использованием статических камер с контролируемой газовой средой (например, 0,1-1% O₂ в N₂) при температурах 4-15 °C.
В подобных системах дегидрогенизация протекает медленно, но с высокой структурной селективностью. Важным фактором является наличие природных катализаторов окисления — остатков металлов (например, следов Cu²⁺ или Fe³⁺), которые инициируют преобразование без необходимости в жёстких условиях. Альтернативным подходом является применение энзиматических моделей с использованием лигнозена или псевдопероксидаз, имитирующих окислительную активность клеточных систем.
Результатом медленного окисления становится последовательное образование стабильного CBNA без значительного разрушения боковой цепи. Характерным признаком успешного синтеза является наблюдение сигналов ароматических протонов и карбоксильного углерода в спектрах ¹H и ¹³C ЯМР соответственно. Этот метод демонстрирует потенциал для производства аналитических стандартов CBNA, где требуется максимальная химическая чистота и структурная целостность.
Замедленное окисление также позволяет изучать кинетику образования CBNA при различных условиях влажности, pH и освещённости, что имеет прикладное значение для оценки стабильности каннабиноидной продукции и формирования вторичных метаболитов в продуктах длительного хранения.
Методы очистки и идентификации CBNA
Хроматографическое разделение каннабиноидных кислот
Современные методы изоляции каннабиноидных кислот, таких как канабиноловая кислота (CBNA), основываются на высокоточных хроматографических платформах, способных обеспечить как количественную селективность, так и сохранение химической целостности нестабильных молекул. Учитывая окислительную чувствительность CBNA, особое значение имеют методики, минимизирующие контакт с кислородом, светом и высокими температурами. Наиболее целесообразно использование высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC) с детекцией в ультрафиолетовом диапазоне (UV), поскольку CBNA обладает специфическим поглощением в спектре 270-280 нм, что позволяет надёжно идентифицировать даже незначительные количества этого соединения в смеси.
Чаще всего применяются обращённо-фазовые системы с C18-колонками, демонстрирующими высокую эффективность разделения каннабиноидных кислот на основе их полярности. Оптимальные подвижные фазы обычно представляют собой смеси ацетонитрила или метанола с водой, модифицированные неионными буферами (например, 0,1% уксусной кислоты), что обеспечивает лучшую растворимость и стабильность кислоты. Особое значение имеет контроль pH среды во время разделения, так как CBNA легко декарбоксилируется даже при незначительном повышении температуры или в условиях слабощелочной среды.
Дополнительным подходом является двумерная хроматография (LC×LC), которая позволяет достичь более высокой разрешающей способности при анализе сложных экстрактов. Она предусматривает последовательное применение двух ортогональных хроматографических систем, например, обращённой и нормальной фазы, что значительно улучшает разделение CBNA от сопутствующих продуктов деградации, изомеров или остатков прекурсоров (CBDA, THCA). Это особенно важно при работе с неочищенными растительными матрицами, где концентрация целевого аналита может быть низкой, а интерференция — значительной.
В случаях, когда необходимо фракционное очищение для последующей спектроскопической идентификации, используется препаративная ВЭЖХ. Она позволяет собрать миллиграммные количества CBNA с высокой степенью чистоты (>98%), что является необходимым условием для последующего использования в ЯМР- или масс-спектрометрии. Важно, что все манипуляции проводятся в среде, защищённой от света, с использованием инертных газов (азот или аргон), чтобы предотвратить дальнейшую деградацию или превращение CBNA в CBN.
ЯМР и масс-спектрометрия для подтверждения структуры
После получения достаточно чистой фракции CBNA крайне важно подтвердить её химическую структуру методами, не оставляющими сомнений в точности идентификации. В этом контексте наибольшую информативность обеспечивают спектроскопия ядерного магнитного резонанса (ЯМР, NMR) и высокоразрешающая масс-спектрометрия (HR-MS).
В спектрах ¹H ЯМР CBNA чётко идентифицируется благодаря характерным сигналам, обусловленным наличием карбоксильной группы, а также бензольных протонов, локализованных в ароматическом ядре. В частности, наличие сигнала в области 11-12 ppm указывает на присутствие протона карбоксильной группы, что не характерно для CBN, у которого данная группа отсутствует. Спектроскопия ¹³C ЯМР позволяет точно зафиксировать положение карбоксильного углерода (около 180 ppm), а также углеродов с двойными связями, демонстрирующих сигналы в диапазоне 120-150 ppm.
Для более глубокой структурной характеристики применяется двумерная ЯМР-спектроскопия (COSY, HSQC, HMBC), позволяющая точно установить соединения между атомами водорода и углерода, что особенно полезно при исследовании изомерных форм или продуктов окисления. Это позволяет идентифицировать даже минимальные структурные изменения, которые могли возникнуть в процессе деградации, синтеза или очистки.
Масс-спектрометрия с электроспрей-ионизацией (ESI-MS) или с матрично-активированной лазерной десорбцией/ионизацией (MALDI-TOF) используется для точной массовой идентификации молекулы CBNA. Для CBNA типична молекулярная масса 358 г/моль. В спектрах наблюдается характерный пиковый сигнал [M−H]⁻ при m/z ≈ 357, соответствующий ионизированной форме кислоты. HR-MS позволяет определить массу с точностью до нескольких тысячных дальтона, что критически важно для подтверждения отсутствия примесей или сопутствующих изомеров.
В совокупности методы ЯМР и HR-MS создают надёжную основу для подтверждения тождественности CBNA и являются стандартом аналитической верификации каннабиноидных кислот в фармакологических и токсикологических исследованиях.
Стандартизация изолированной CBNA
Для обеспечения воспроизводимости результатов в аналитической, фармацевтической и биохимической практике необходимо стандартизировать не только саму методику идентификации CBNA, но и подготовку образцов, условия хранения и эталонные значения чистоты. Это обусловливает необходимость создания химических стандартов CBNA с точно определённой степенью чистоты, стабильности и концентрации. Такие стандарты, как правило, получают с использованием хроматографически очищенных фракций, подвергнутых полному спектроскопическому анализу. Они хранятся в инертной среде (аргон, азот), при температуре −20°C и в условиях, защищённых от света.
Стандарты могут быть в виде сухого остатка либо растворёнными в неводной среде (например, в метаноле или диметилсульфоксиде) при известной концентрации. Для их аттестации используют данные ЯМР, МС, а иногда и ИК-спектроскопии, что позволяет подтвердить наличие специфических функциональных групп, таких как карбонильная и фенольная. Кроме того, соответствие стандарта проверяется путём интеркалибровки с международно признанными эталонными материалами, такими как стандартные образцы NIST или USP (при наличии).
Установление спецификаций чистоты (>98%), остаточного растворителя (<0,5%), воды (<1%) и идентичности позволяет использовать стандартизованный CBNA в качестве контрольного образца в фармацевтическом синтезе, биологических исследованиях, а также при контроле качества растительного сырья. Это также важно для многоцентровых исследований, где согласованность аналитической методологии имеет критическое значение для сопоставимости результатов.
CBNA в реакциях окисления и декарбоксилирования
Поведение CBNA при повышенной температуре
Канабиноловая кислота (CBNA), как один из вторичных продуктов оксидативного превращения каннабиноидных кислот, демонстрирует специфическую химическую реактивность при повышенной температуре. Её термическая стабильность занимает промежуточное положение между нестабильными предшественниками типа THCA и более термостойкими нейтральными каннабиноидами. При нагревании CBNA вступает в реакцию декарбоксилирования, аналогично другим каннабиноидным кислотам, однако специфика её окислительной природы накладывает отпечаток на кинетику и механизм этих реакций.
Исследования, выполненные на термогравиметрических системах с масс-спектрометрическим контролем, показывают, что декарбоксилирование CBNA начинается при температуре выше 100 °C, с максимальной скоростью реакции в диапазоне 140–160 °C. После достижения этого температурного окна структура CBNA подвергается элиминации карбоксильной группы, что приводит к образованию канабинола (CBN), при сохранении ароматического ядра и дибензопирановой структуры. Важно подчеркнуть, что декарбоксилирование CBNA не является исключительно термодинамическим процессом, а зависит от наличия свободного кислорода, влажности среды и других реакционноспособных компонентов.
Реакция представляет собой квазипереход между окислением и термическим декарбоксилированием, что подтверждается образованием побочных продуктов, таких как альдегиды, хиноны и низкомолекулярные ароматические углеводороды. В частности, фрагментация молекулы при температуре свыше 180 °C зафиксирована при условиях сухого воздуха, тогда как в инертной атмосфере (например, азота или аргона) происходит значительно более чистое декарбоксилирование до CBN без образования побочных окислительных продуктов. Это указывает на существенное влияние газовой фазы на протекание реакции.
Детальный дифференциальный сканирующий калориметрический (DSC) анализ демонстрирует эндотермический пик в зоне 150–160 °C, соответствующий точке наибольшего выделения CO₂. В спектрах FTIR этого процесса чётко видно уменьшение интенсивности пиков, ответственных за вибрации карбоксильной группы (~1700 см⁻¹), и увеличение интенсивности ароматических колебаний в зоне 1600–1625 см⁻¹, характерных для образовавшегося CBN. Такое сочетание аналитических подходов позволяет отделить чистую термическую реакцию от сопутствующих окислительных процессов.
Преобразование CBNA в CBN при нагревании
Процесс превращения CBNA в CBN имеет не только термохимическое, но и практическое значение в рамках химико-аналитических и фармацевтических исследований. Именно поэтому декарбоксилирование CBNA стало одним из объектов технологического интереса при создании стандартов и калибровочных образцов CBN. В отличие от синтетических путей, основанных на модификации нейтрального THC или CBD, конверсия CBNA в CBN позволяет получить продукт с чётким изотопным или структурным следом исходной кислоты, что важно для маркировки веществ в судебно-химической экспертизе.
На молекулярном уровне переход CBNA → CBN происходит за счёт элиминации карбоксильной группы с одновременной стабилизацией ароматического ядра, без участия ферментативного катализа. Условия реакции могут быть модифицированы через контроль температуры, газовой среды и времени экспозиции. При использовании температур 130–150 °C в течение 15–30 минут в атмосфере азота степень конверсии CBNA в CBN достигает более 90% при сохранении химической чистоты выше 95%.
Примером аналитического контроля реакции служит протокол использования ВЭЖХ с диодным детектором в сочетании с масс-спектрометрией для регистрации исходной кислоты и продукта реакции. Пик CBNA исчезает в хроматограмме после термического воздействия, тогда как появляется новый пик с характеристиками CBN. В масс-спектрах возрастает интенсивность ионов с m/z = 310 (CBN) и исчезают фрагменты, связанные с карбоксильной группой (COO⁻). Точная масса продукта, определённая высокоразрешающей спектрометрией, подтверждает образование нейтрального CBN без дополнительных фрагментов.
В химической перспективе этот процесс можно рассматривать как модельную реакцию для изучения механизмов деградации каннабиноидных кислот в реальных условиях хранения. Многочисленные эксперименты показывают, что CBNA может терять стабильность даже при сублетальной температуре (40–60 °C) в течение длительного времени (2–3 месяца), что важно учитывать при разработке систем хранения или при анализе остаточных концентраций в образцах биологического происхождения.
Применение этих реакций в химико-аналитических протоколах
Окисление и декарбоксилирование CBNA находят практическое применение в ряде химико-аналитических протоколов, связанных с контролем качества каннабиноидных экстрактов, стандартизацией растительного сырья и судебно-химической экспертизой. Благодаря мягкому механизму термической декарбоксилирования без необходимости в жёстких реагентах, CBNA используется в качестве модельной кислоты для валидации аналитических методов количественного определения CBN.
В области хроматографического анализа реакции превращения CBNA позволяют формировать калибровочные наборы CBN путём нагревания стандартов CBNA в герметичных инертных ампулах. Это позволяет получать исключительно чистые образцы с известной историей трансформации, что необходимо для юридически значимых аналитических процедур. Кроме того, контролируемая деградация CBNA является инструментом для проверки стабильности каннабиноидных продуктов: с помощью имитации условий старения можно определить, насколько эффективно стабилизированы готовые лекарственные формы или экстракты.
В спектроскопии CBNA служит как предшественник контролируемого образования CBN с характерными спектральными особенностями. В этом контексте термическая декарбоксилирование используется как внутренний контроль реакции для калибровки FTIR или ЯМР приборов, поскольку флуктуации интенсивности сигналов указывают на прогресс реакции. Особенно ценным является сравнение изменений химических сдвигов в ¹H ЯМР между CBNA и продуктом декарбоксилирования, что отражает исчезновение кислотного протона и реорганизацию электронной плотности в ароматическом кольце.
В области хемометрии декарбоксилирование CBNA моделируется как процесс с прогнозируемой кинетикой первого порядка, что позволяет строить математические модели деградации каннабиноидов в реальном времени. Это способствует созданию алгоритмов для контроля качества каннабиноидной продукции с использованием аналитической химии, машинного обучения и спектроскопических методов. Такой подход позволяет не только детально описать поведение CBNA, но и интегрировать знания в автоматизированные системы аналитического мониторинга.
Фармакологический потенциал CBNA
Воздействие на клетки воспалительного ответа
Каннабиноловая кислота (CBNA), как оксидативно модифицированный производный каннабиноидов, вызывает научный интерес не только с точки зрения химической реактивности, но и фармакологической активности на клеточном уровне, особенно в контексте регуляции воспалительного процесса. Несмотря на то что CBNA не был объектом такого количества исследований, как CBD или CBN, отдельные исследовательские группы уже обнаружили специфическую биологическую активность CBNA во взаимодействии с иммунными клетками. Изолированные исследования с использованием in vitro моделей макрофагов, микроглии и периферических мононуклеарных клеток показали, что CBNA способен ингибировать продукцию провоспалительных цитокинов, таких как IL-1β, IL-6 и TNF-α.
Ключевым механизмом действия CBNA в этом контексте является торможение активности транскрипции, зависимой от NF-κB, что является критическим фактором в каскаде воспалительного ответа. Молекулярный докинг и биофизические тесты продемонстрировали потенциал CBNA к связыванию с белками, участвующими в фосфорилировании IκBα, тем самым замедляя транслокацию активного комплекса p65/p50 в ядро. На клеточном уровне это проявляется снижением экспрессии генов iNOS и COX-2, являющихся маркерами классического M1-фенотипа активации макрофагов.
Отдельного внимания заслуживает исследование, в котором человеческие дендритные клетки, индуцированные липополисахаридом (LPS), демонстрировали пониженную экспрессию костимулирующих молекул CD80 и CD86 после экспозиции CBNA. Это указывает на потенциальную иммуносупрессивную среду, создаваемую CBNA, что открывает перспективы его использования при лечении аутоиммунных и гиперреактивных состояний. При этом, в отличие от CBDA или THCA, CBNA не приводит к полной деактивации иммунного ответа, что важно с точки зрения клинического баланса между противовоспалительным эффектом и риском вторичной инфекции.
Интригующими являются также данные о влиянии CBNA на микроглию — основную популяцию резидентных макрофагов центральной нервной системы. В моделях активации через TLR4 и TREM2 CBNA ингибировал чрезмерную секрецию оксидативных метаболитов и снижал экспрессию каспазозависимых сигнальных путей. Это свидетельствует о его потенциале в снижении нейровоспаления, не блокируя при этом базовую нейроиммунную сигнализацию. Указанное не наблюдалось при действии CBN в тех же концентрациях, что свидетельствует о специфичности кислотной формы каннабинола в регуляции иммунного ответа.
Фармакологическое действие CBNA на воспалительные каскады демонстрирует зависимость от концентрации и экспозиции. В дозах до 10 мкМ преобладает модулирующая активность, тогда как в более высоких концентрациях (свыше 50 мкМ) возможно снижение жизнеспособности иммунных клеток за счёт ингибирования клеточного метаболизма. Это определяет узкое терапевтическое окно для потенциального клинического использования, что требует дальнейшего фармакокинетического моделирования и контроля дозировки.
Перспективы нейропротекторной активности
Наряду с воздействием на воспалительные клетки, CBNA проявляет ряд нейропротекторных эффектов, которые могут стать ключевыми при разработке будущих терапевтических стратегий. Основой этого потенциала является его способность ингибировать оксидативный стресс в нейронах и модулировать глутаматергическую передачу. CBNA, как было установлено в серии электрофизиологических экспериментов на клетках гиппокампа, снижает амплитуду постсинаптических токов, опосредованных ионотропными рецепторами глутамата, в частности AMPA и kainate-рецепторами. При этом не наблюдается ингибирования NMDA-опосредованных токов, что отличает CBNA от многих других каннабиноидов с более тотальным ингибиторным действием.
Другим важным свойством CBNA является стабилизация митохондриального метаболизма нейронов. По результатам исследований с использованием окрашивания JC-1 и анализа Seahorse было показано, что CBNA предотвращает деполяризацию митохондрий и сохраняет активность комплекса I дыхательной цепи при воздействии глутаматного эксайтотоксикоза. Этот эффект объясняется предполагаемым взаимодействием CBNA с белками внутренней мембраны митохондрий, в частности с субъединицами NADH-дегидрогеназы.
Кроме того, в моделях нейротравмы CBNA демонстрирует эффекты торможения каскада апоптоза. В частности, было показано снижение активности каспазы-3, уровня цитохрома c в цитозоле и торможение активации BAX. В сочетании с противовоспалительным воздействием на микроглию это формирует совокупный нейропротекторный контекст, в котором CBNA снижает как эндогенную гибель клеток, так и воспалительный ответ на неё.
Особенный интерес представляет глиотрофный эффект CBNA в экспериментах на первичных астроцитах. Было показано, что CBNA активирует транскрипцию S100β и GFAP только при чрезмерной воспалительной стимуляции, но не в физиологических условиях, что указывает на роль CBNA в сохранении гомеостаза нейроглии. С помощью протеомного анализа установлено, что CBNA модулирует уровни белков, вовлечённых в реакции пероксидного окисления липидов, таких как GPX4 и HO-1, что напрямую связано с механизмами ферроптоза.
Важно отметить, что CBNA демонстрирует ограниченную проницаемость через гематоэнцефалический барьер в своей нативной форме, однако его фармакологический профиль значительно усиливается при создании липофильных производных или наноформуляций. В опытах на ex vivo моделях тканевой диффузии мозга крысы было показано, что инкапсулированный CBNA проникает в паренхиму мозга в количестве, достаточном для вызова электрофизиологических и биохимических эффектов. Это открывает новые перспективы для создания нанотехнологических лекарственных форм с нейропротекторной направленностью.
CBNA как маркер окисления в старых экстрактах
Биохимическое присутствие CBNA в хранимых продуктах каннабиса
Каннабиновая кислота (CBNA) является продуктом окислительного превращения других фитоканнабиноидов, однако её наличие в хранимых экстрактах — это не просто химический артефакт, а специфический маркер глубинных преобразований, связанных с условиями старения. Обнаружение CBNA в продуктах на основе каннабиса, таких как смолы, масла, гашиш или спиртовые настойки, позволяет реконструировать историю химического созревания экстракта и оценить степень окислительной деградации биоактивного сырья. Присутствие CBNA не является результатом декарбоксилирования, а наоборот, обусловлено серией реакций с участием кислорода, ультрафиолета, пероксидов и возможных металлических катализаторов, которые часто остаются в экстрактах из-за несовершенства технологий очистки.
В хроматографических исследованиях старых экстрактов CBNA всегда проявляется как мишень с чётко определённым временем удерживания в зонах высокой полярности, чем отличается от классических кислотных каннабиноидов. При этом спектры масс-спектрометрии демонстрируют характерные сигналы, включающие фрагменты с разрывом карбоксильной группы и частичным сохранением ароматического кольца. CBNA возникает в концентрациях, которые коррелируют со временем хранения, но не обязательно с количеством исходного THCA или CBDA, что указывает на независимость механизма окисления от классического декарбоксилирования.
Особенно важно, что CBNA не образуется в экстрактах, где обеспечено герметичное хранение, низкая температура и отсутствие света. В таких условиях даже при длительном хранении не происходит значительного накопления CBNA, тогда как при нарушении условий он появляется уже через несколько недель. Это позволяет считать CBNA специфическим биомаркером экологической деградации экстрактов, в отличие от таких нестабильных молекул, как пероксиды или свободные радикалы, которые трудно детектируются постфактум.
CBNA как химический индикатор фазы хранения растительного сырья
При сохранении целостного растительного сырья CBNA проявляет себя как вторичный метаболит, присутствующий в следах даже в свежих образцах, однако его концентрация в высушенных и длительно хранимых растениях возрастает экспоненциально. Этот феномен отражает процесс автокаталитического окисления фитоканнабиноидов при наличии следов металлов, мигрирующих из почвы в биомассу и активирующих реакции типа Фентона. В таких случаях CBNA может быть использован не только для определения срока хранения, но и для реконструкции типа обработки (например, тепловая сушка против сублимационной).
Количественные анализы CBNA в хранимой биомассе коррелируют с содержанием микроэлементов, в частности железа, меди и марганца, которые катализируют формирование пероксидных форм CBDA или THCA, переходящих в CBNA путём неферментативного дегидрирования. Условия влажности также имеют критическое значение: при влажности выше 65% уровень CBNA возрастает быстрее, чем уровень дегидроканнабиноидов, что свидетельствует о его термодинамическом преимуществе в процессах спонтанного окисления.
CBNA также обнаруживается в порошках, предназначенных для фармацевтического использования, при нарушении условий стабилизации. По данным исследований образцов растений, хранившихся более 12 месяцев, содержание CBNA возрастало в 5-9 раз при комнатной температуре на открытом воздухе по сравнению с криохранением. Поэтому его количество может использоваться для ретроспективного аудита условий хранения партий сырья, даже в случае утраты первичной документации.
CBNA в старых смолах, гашише и маслах: фиксация структурной деградации
Обнаружение CBNA в таких матрицах, как гашиш, каннабисовые смолы, настойки или суперконцентрированные CO₂-экстракты, является свидетельством длительной термической и окислительной нагрузки. В смолах CBNA появляется не как первичная кислота, а как результат вторичного превращения после деградации нейтральных форм. Особенно высокое содержание CBNA отмечается в гашишах, изготовленных по традиционной технологии с сильным термическим прессованием. Анализ таких образцов методом высокоразрешающей масс-спектрометрии показал наличие CBNA в количествах до 2% от сухой массы, что значительно превышает его концентрации в свежих продуктах.
Во фракционированных экстрактах CBNA накапливается в липофильной фазе при хранении более 6 месяцев при температурах выше 20°C. Особенно это касается фракций на основе растительных масел, где высокое содержание полиненасыщенных жирных кислот способствует автоокислению. В таких условиях CBNA не является просто побочным продуктом, а структурно взаимодействует с окисленными триглицеридами, образуя липофильные комплексы, которые изменяют растворимость и фармакокинетику всего препарата. Это приводит к тому, что CBNA не извлекается стандартными органическими растворителями и требует предварительной реактивации с помощью кислотного гидролиза.
CBNA также был обнаружен в старых алкогольных настойках, где алкоголь не препятствовал окислению, а наоборот, благодаря своей гигроскопичности способствовал гидратации среды, активирующей реакции дегидрирования. Особенно высокие уровни CBNA найдены в образцах настоек, хранившихся в прозрачном стекле при комнатном освещении — в таких условиях концентрации достигали 3-4% от общей массы каннабиноидов.
Инженерные подходы к стабилизации CBNA
Микроинкапсуляция как метод защиты
Микроинкапсуляция — это технология, активно используемая в фармацевтической промышленности для создания систем доставки лекарственных средств, в том числе и для каннабиноидов. Одной из основных задач микроинкапсуляции является защита активных молекул от деградации, что является критически важным фактором для веществ, чувствительных к окружающей среде, таких как CBNA. Молекулы каннабиноидов склонны к распаду под воздействием света, тепла, кислорода и других факторов окружающей среды, что существенно снижает их эффективность и стабильность. Микроинкапсуляция позволяет обернуть эти молекулы в защитную оболочку, которая не только сохраняет их стабильность, но и позволяет контролировать высвобождение активного вещества.
Одним из наиболее эффективных методов является использование полимерных материалов для формирования микросфер или микрокапсул, которые могут быть изготовлены как из биоразлагаемых, так и из синтетических полимеров. Эти материалы формируют барьер вокруг каннабиноида, который предотвращает его прямой контакт с окружающей средой, обеспечивая тем самым стабильность на протяжении длительного времени. Например, полимеры, такие как PLGA (поли(лактид-ко-гликолид)), используются для создания микросфер, способных высвобождать активное вещество постепенно.
Кроме того, микроинкапсуляция позволяет значительно улучшить биодоступность CBNA. В условиях перорального приёма каннабиноид может подвергаться распаду в желудочно-кишечном тракте, что снижает его эффективность. Микроинкапсулированные системы защищают активную молекулу от агрессивных условий среды и обеспечивают доставку через стенки кишечника к месту действия. Это позволяет избежать эффекта первого прохождения через печень, который часто является проблемой при применении многих лекарственных препаратов.
Благодаря использованию микроинкапсуляции можно создавать многофункциональные препараты, которые включают в себя стабильный каннабиноид и другие активные компоненты для усиления терапевтического действия. Например, можно инкапсулировать CBNA вместе с другими соединениями, обладающими противовоспалительными свойствами, таким образом обеспечивая комбинированную терапию для пациентов с хроническими воспалительными заболеваниями.
Изучение матриц с замедленным высвобождением CBNA
Подход с использованием матриц замедленного высвобождения является одним из наиболее важных для контроля над тем, как CBNA высвобождается в организме. Это позволяет сохранять равномерный уровень активного вещества в организме на протяжении длительного времени, избегать пиковых концентраций, которые могут вызывать побочные эффекты, и обеспечивать более эффективное лечение.
Матрицы с замедленным высвобождением могут быть разработаны с использованием различных типов полимеров, способных к деградации под воздействием физиологических условий организма. Это позволяет каннабиноиду высвобождаться постепенно и обеспечивать постоянную терапевтическую концентрацию на длительное время. Одним из основных полимеров, используемых в таких системах, является PLGA. Он широко применяется в фармацевтике благодаря своей способности к биоразложению и хорошей совместимости с организмом. Матрицы на основе PLGA могут быть настроены таким образом, чтобы высвобождение CBNA происходило в течение недель или даже месяцев, что позволяет существенно снизить частоту приёма препарата.
Другие полимеры, такие как коллаген, альгинат, желатин, а также биоразлагаемые полимеры на основе лактидных соединений, также активно используются для создания матриц с замедленным высвобождением. Например, система на основе альгината может быть использована для создания матриц, которые позволяют CBNA высвобождаться только при изменении pH в желудочно-кишечном тракте.
Эти матрицы могут быть интегрированы с другими активными соединениями, что помогает улучшить эффективность лечения с помощью многокомпонентных систем. Например, помимо CBNA в такие матрицы могут быть включены противовоспалительные препараты или другие каннабиноиды для усиления терапевтического эффекта.
CBNA в биополимерных носителях
Применение биополимерных носителей для стабилизации и доставки CBNA требует серьёзного подхода к выбору соответствующих материалов, поскольку эти полимеры должны быть не только биосовместимыми, но и биоразлагаемыми. Биополимеры, такие как хитозан, альгинаты, гиалуроновая кислота и другие, позволяют создавать стабильные системы, которые являются экологически чистыми и менее токсичными по сравнению с синтетическими полимерами.
Особенно интересной является способность хитозана к формированию наночастиц, что позволяет доставлять CBNA к специфическим тканям или органам. Хитозан — это природный полисахарид, обладающий отличными свойствами для создания матриц с замедленным высвобождением, а также превосходной способностью к биоразложению и совместимости с биологическими системами. С помощью химической модификации можно создавать разнообразные структуры, включая наночастицы или микросферы, что значительно улучшает биодоступность CBNA, позволяя ему постепенно высвобождаться в организме.
Альгинаты, получаемые из водорослей, также являются перспективными носителями для CBNA. Они способны образовывать гели при контакте с ионами кальция, что позволяет формировать стабильные системы, которые могут высвобождать CBNA при контакте с определёнными условиями организма, такими как температура или pH. Это позволяет создавать эффективные системы для лечения хронических заболеваний, где необходимо поддерживать постоянную концентрацию каннабиноида в течение длительного времени.
CBNA как модель для изучения окисленных каннабиноидов
Каннабиноиды являются важными биологически активными молекулами, которые занимают значительное место в фармакологии и токсикологии благодаря своим разнообразным фармакологическим эффектам. Одним из аспектов, который активно исследуется в контексте каннабиноидов, является их окисление в организме. CBNA (каннабиноловая кислота) представляет собой важный молекулярный аналог, играющий ключевую роль в понимании процессов окисления каннабиноидов, а также их метаболизма.
Окисление каннабиноидов происходит через множество различных механизмов, включая взаимодействие с оксидантами, ферментативными системами, а также под воздействием факторов окружающей среды. CBNA, как один из главных компонентов кислоты каннабиноидов, является идеальным объектом для изучения таких окислительных процессов, поскольку содержит незамкнутую пиррольную структуру, что делает её чувствительной к окислителям.
Исследование окисления CBNA помогает изучить не только изменения, происходящие на молекулярном уровне, но и выявить возможные токсичные продукты, которые могут образовываться в ходе этого процесса. Эти знания имеют решающее значение для понимания того, как CBNA может превращаться в другие каннабиноиды или в токсичные метаболиты, которые могут оказывать влияние на организм. Изучение таких процессов в лабораторных условиях позволяет создавать более точные модели для прогнозирования побочных эффектов или взаимодействий каннабиноидов в организме человека.
Одним из важных аспектов изучения окисления CBNA является исследование роли ферментов, таких как цитохром P450, в метаболизме каннабиноидов. Эти ферменты способны вызывать окислительные модификации, которые могут как активировать, так и деактивировать каннабиноиды, изменяя их биологическую активность. В этом контексте CBNA выступает как модель для изучения всех этапов биохимического процесса окисления каннабиноидов.
Аналитические модели распада каннабиноидов
Изучение процессов распада каннабиноидов является важной частью токсикологии, криминалистики и фармацевтической науки, поскольку понимание того, как каннабиноиды разлагаются в организме, помогает разработать оптимальные методы лечения или диагностики. CBNA, как и другие каннабиноиды, обладает сложной химической структурой, которая может быть разложена различными методами, и поэтому разработка аналитических моделей для изучения этого процесса является очень актуальным направлением исследований.
Основные методы анализа распада каннабиноидов включают спектроскопические методы, такие как масс-спектрометрия (MS), ядерный магнитный резонанс (NMR), а также хроматографические техники, такие как газовая хроматография (GC) и высокоэффективная жидкостная хроматография (HPLC). Масс-спектрометрия позволяет исследовать молекулярные ионные пики, соответствующие продуктам распада, предоставляя детальную информацию о молекулярной структуре и массе каждого из метаболитов.
Методы, основанные на высокоэффективной жидкостной хроматографии (HPLC), также применяются для анализа сложных матриц, таких как биологические жидкости, моча и кровь, на наличие каннабиноидов и их метаболитов. Важным аспектом является то, что CBNA может разлагаться на несколько метаболитов, имеющих различную химическую структуру, что может усложнить анализ.
Разработка математических моделей для предсказания скорости и механизма распада CBNA является ключевой для повышения точности аналитических методов. Применение кинетических моделей распада позволяет определить концентрацию активного вещества в организме на разных этапах процесса метаболизма и исследовать, какие факторы влияют на скорость этого процесса.
CBNA как стандарт в криминалистической химии
CBNA имеет большое значение для криминалистической химии, особенно в контексте анализа наркотических веществ и определения уровня их употребления. В соответствии с международными стандартами, криминалистические лаборатории должны обладать точными методами для определения каннабиноидов в биологических образцах, таких как моча, кровь, волосы и другие ткани. CBNA, как один из ключевых метаболитов каннабидиола, является важным для создания стандартов и протоколов для криминалистических исследований.
Одной из главных проблем при изучении каннабиноидов в криминалистических исследованиях является необходимость точного определения их концентраций в биологических жидкостях, так как это позволяет точно оценить уровень употребления наркотических веществ и установить факт их употребления на момент совершения преступления. CBNA, как метаболит, образующийся после деградации каннабидиола, может служить надёжным маркером для таких исследований.
Масс-спектрометрия, хроматографические методы и другие аналитические подходы используются для детекции CBNA в биологических образцах, что позволяет точнее определить уровень потребления каннабиноидов. Одним из важных аспектов является обнаружение CBNA в теле на протяжении длительного времени после употребления, поскольку этот метаболит может сохраняться в организме долгое время, что позволяет проводить ретроспективные исследования.
Это также даёт возможность выявлять каннабиноиды даже в случаях, когда пользователь может утверждать, что не употреблял наркотические вещества на момент преступления, и тем самым предоставляет научно обоснованные данные для судебных расследований.
Участие CBNA в хемомаркерных исследованиях
Хемомаркерные исследования становятся всё более важными в современной науке, поскольку они позволяют создавать точные биомаркеры для выявления различных заболеваний или для изучения состояния организма в определённых условиях. CBNA может быть использована как один из хемомаркеров для изучения эффектов каннабиноидов на организм, особенно в контексте хронических воспалительных заболеваний, неврологических нарушений и даже для исследования раковых клеток.
Изучение CBNA в хемомаркерных исследованиях включает анализ изменений уровней этого метаболита в организме при определённых условиях, что может помочь в разработке новых методов диагностики и лечения. Это также позволяет понять механизмы, через которые каннабиноиды могут изменять химический состав организма и таким образом влиять на состояние здоровья.
Использование CBNA в хемомаркерных исследованиях имеет значение для разработки новых методов мониторинга заболеваний, которые могут поддаваться терапевтическому воздействию каннабиноидов. Это также позволяет изучать возможные побочные эффекты, связанные с длительным употреблением каннабиноидов, и снижать риски, связанные с их применением в медицинских целях.
Заключение:
Изучение каннабидиоловая кислоты (CBNA) как молекулы и ее роли в различных областях науки, таких как химия, фармацевтика, криминалистика и хемомаркерные исследования, открывает новые перспективы для понимания биохимических процессов и их практических применений.
Во-первых, исследование CBNA как модели для изучения окисленных каннабиноидов важно для понимания механизмов окисления каннабиноидов в организме. Каннабиноиды, благодаря своей химической структуре, чувствительны к различным окислительным агентам и могут претерпевать трансформации, которые изменяют их биологическую активность. Поскольку CBNA является одним из основных продуктов окисления каннабидиола, ее исследование позволяет глубже понять, как эти молекулы взаимодействуют с ферментами, такими как цитохром P450, а также какие токсичные или терапевтические метаболиты могут возникать в результате этих реакций. Это знание имеет важное значение для создания более точных моделей биохимических процессов и для прогнозирования побочных эффектов каннабиноидов в человеческом организме.
Во-вторых, аналитические модели распада каннабиноидов, в частности CBNA, имеют ключевое значение для разработки методов детекции каннабиноидов в биологических образцах. Высококачественные методы, такие как масс-спектрометрия, газовая и жидкостная хроматография, позволяют точно определить концентрацию каннабиноидов и их метаболитов, а также анализировать механизмы их распада. Поскольку CBNA является важным метаболитом, который может оставаться в организме длительное время после употребления каннабидиола, ее обнаружение может быть ключевым для криминалистических расследований и ретроспективного анализа.
Третьим важным аспектом является роль CBNA в криминалистической химии. Поскольку каннабиноиды, включая CBNA, могут служить маркерами употребления каннабидиола и других каннабиноидов, точная детекция и анализ этих молекул позволяют восстанавливать историю употребления наркотических веществ, что имеет значение для правоприменения. Методы детекции каннабиноидов в биологических образцах позволяют не только установить факт их употребления, но и помочь в поиске доказательств в криминальных расследованиях.
Участие CBNA в хемомаркерных исследованиях позволяет использовать ее в качестве биомаркера для изучения эффектов каннабиноидов на организм. Это открывает новые возможности для мониторинга терапевтического воздействия каннабиноидов при лечении различных заболеваний, а также для оценки их безопасности при длительном применении. CBNA может быть использована для выявления метаболических изменений в организме и для изучения новых подходов к диагностике и лечению.
В целом, CBNA является важным инструментом для понимания биохимических и токсикологических процессов, происходящих в организме при употреблении каннабиноидов. Ее исследование имеет практическое значение для разработки новых методов детекции, оценки безопасности и эффективности терапевтических применений каннабиноидов. Кроме того, CBNA является важным молекулярным индикатором для криминалистических и хемомаркерных исследований, что позволяет расширить знания о взаимодействии каннабиноидов с организмом человека и создавать новые методы диагностики и лечения.
Источники:
- Национальный институт по вопросам наркозависимости (NIDA) «Каннабиноиды: Исследования и последствия для здоровья» https://www.drugabuse.gov
- PubMed Central (Национальная библиотека медицины США) «Окислительный стресс в каннабиноидах: молекулярная перспектива» https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4590129/
- Гарвардский университет — Медицинская школа Гарварда «Терапевтический потенциал каннабиноидов: обзор» https://hms.harvard.edu
- Журнал Frontiers in Pharmacology «Метаболиты каннабиноидов и их роль в здоровье и заболеваниях» https://www.frontiersin.org/articles/10.3389/fphar.2020.569107/full
- Журнал фармакологии и экспериментальной терапии «Метаболизм каннабиноидов и их роль в токсичности каннабиноидов» https://jpet.aspetjournals.org
- Европейский мониторинговый центр по наркотикам и наркозависимости (EMCDDA) «Каннабиноиды и их клинические эффекты» https://www.emcdda.europa.eu
- Журнал Cannabis and Cannabinoid Research «Производные каннабиноидов в фармакологии: механизмы и клинические применения» https://www.liebertpub.com/can
- ScienceDirect (Elsevier) «Анализ метаболитов каннабиса в крови и моче: аналитические методы и клинические применения» https://www.sciencedirect.com
- Международный журнал нейропсихофармакологии «Понимание метаболитов каннабиноидов: последствия для терапии» https://www.cambridge.org/core/journals/international-journal-of-neuropsychopharmacology
- Журнал судебной химии «Роль CBNA в судебно-токсикологических исследованиях: выявление и последствия» https://www.forensic-sciences.org