Химия каннабиноидов на современном этапе развития вышла далеко за пределы природного продукта каннабиса и его базовых метаболитов. В центре исследовательских стратегий всё чаще оказываются не только основные фито- и эндоканнабиноиды, но и искусственно модифицированные производные, которые моделируют фармакофорные свойства известных соединений или, наоборот, кардинально изменяют их биологическое поведение. Среди производных особое внимание заслуживают эфиры, амины, галогенпроизводные и конъюгаты, которые применяются как в фундаментальной фармакохимии, так и в разработке лекарств, прототипов лигандов и молекулярных зондовых систем.
Метиловый эфир каннабинола (CBNM) является одним из наименее описанных представителей класса простых эфиров каннабиноидов, который возникает на пересечении нескольких научных интересов — органического синтеза, фармакологического скрининга, биоаналитической химии и молекулярного дизайна. Несмотря на отсутствие упоминаний в широких обзорных работах или классификациях, CBNM потенциально является ключевым маркером в химической модификации CBN — продукта окисления тетрагидроканнабинола (ТГК), который сам по себе является фокусом многочисленных нейрофармакологических исследований. В свою очередь, превращение фенольной гидроксильной группы каннабинола в метиловый эфир не является просто функционализацией: оно приводит к изменению электронной плотности, снижает способность к водородной связи, модифицирует метаболический профиль и может влиять на пространственную ориентацию молекулы в рецепторной среде.
CBNM не является природным компонентом каннабиса — на момент написания этой статьи его не обнаружено ни в одном из ботанических экстрактов, ни в следах, ни в значительных концентрациях. Это накладывает специфику на интерпретацию его биологического значения: в отличие от основных фитоаналогов, CBNM — это искусственно полученное соединение, которое служит скорее инструментом, чем конечным биоактивным агентом. Однако этот инструмент позволяет решать ряд фундаментальных задач: изолировать эффекты ароматической части молекулы без участия фенольного водорода; снижать полярность с целью моделирования проницаемости через биомембраны; анализировать влияние модификации на связывание с рецепторами CB1/CB2 и изучать кинетику превращения CBN в метаболических условиях.
В отличие от некоторых более известных производных каннабинола, CBNM не имеет задокументированного фармакологического профиля в открытой научной литературе, однако упоминается в контексте масс-спектрометрического обнаружения в образцах синтетических библиотек и патентных базах. Несколько исследовательских групп отмечают его наличие как побочный продукт при обработке CBN агентами метилирования или как промежуточную структуру при многоступенчатом синтезе гетероциклических производных каннабиноидов. Это указывает на его возможную ценность не как самостоятельного терапевтического агента, а как химического модуля в создании более сложных молекулярных систем — включая прототипы селективных агонов или антагонистов каннабиноидных рецепторов, а также как неактивной формы, которая может быть активирована in situ при специфических условиях.
Существует также теоретический интерес к этому соединению со стороны токсикологического анализа. Препараты, содержащие синтетические каннабиноиды, часто сопровождаются примесями или побочными метаболитами, среди которых могут встречаться эфирные производные. Таким образом, CBNM может быть ценным контрольным образцом в разработке аналитических методов детекции, например, в фармацевтическом контроле или криминалистическом анализе.
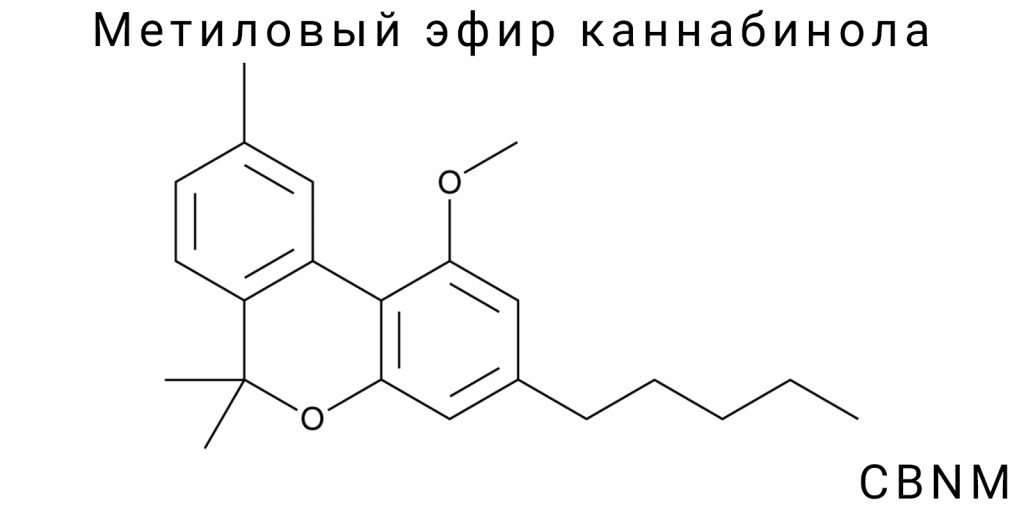
Структура CBNM
Основная формула
Метиловый эфир каннабидиола (CBNM) является производным каннабидиола, в котором гидроксильная группа, обычно присутствующая в положении 1 бензольного кольца, заменена на метоксильную группу –ОCH₃. Такая структурная модификация с точки зрения органической химии является примером простой реакции алкилирования фенола, однако последствия этой замены выходят далеко за рамки номинальной функционализации. Молекула CBNM сохраняет основной каннабиноидный скелет, в частности, трициклическую структуру с частично насыщенной гексиловой цепью в положении 5, которая формирует центральный фрагмент молекулы, важный для пространственной ориентации и взаимодействия с биологическими мишенями.
CBNM имеет эмпирическую формулу C₂₂H₂₈O₂. Структурно он состоит из трициклического каркасного ядра, включающего:
- бензольное кольцо, связанное с дигидропирановым кольцом;
- третье кольцо — частично гидрогенизированное, содержащее насыщенные и ненасыщенные связи, критические для пространственной фиксации;
- алифатический заместитель в виде гексиловой цепи в положении 5;
- метоксильную группу в положении 1 бензольного кольца вместо фенольной гидроксильной.
Характерной особенностью является наличие как ароматической, так и неполностью насыщенной части, что создаёт контраст в распределении электронной плотности по молекуле. Именно это определяет электрофильные и нуклеофильные свойства в локализованных участках и потенциальную реакционную способность в контексте модификаций.
Особое внимание заслуживает электронная структура CBNM. Замена –OH на –OCH₃ не только ликвидирует донор водородной связи, но и способствует стабилизации электронной облачности за счет эффекта +M (мезомерного) группы метоксила. Это усиливает делокализацию π-электронов в ароматическом кольце, повышая его химическую инертность и снижая склонность к окислению. Такая электронная реконфигурация имеет значение для прогнозирования биоизостерической поведения CBNM в рецепторных средах.
CBNM не существует в виде стабильного кристаллического твёрдого тела, как некоторые другие каннабиноиды, а согласно данным масс-спектрометрического анализа и результатам синтетических работ, имеет форму маслянистой жидкости при стандартных условиях. Такой физический состояние обусловлено сочетанием умеренной молекулярной массы, отсутствием внутримолекулярных водородных связей и общей липофильностью.
Изомеры и конфигурация
CBNM формально не имеет стереоизомерии в области замещения метильной группы на гидроксиле — это планарная область молекулы, где стерическая помеха не возникает. Однако молекула в целом имеет несколько пространственных аспектов, которые могут влиять на её активность, и эти эффекты часто остаются недооценёнными. И хотя сам эфир не является хиральным в классическом смысле, общий каркас CBNM может иметь псевдохиральность из-за наличия фиксированной конформации трициклического ядра, в частности благодаря частично насыщенному кольцу с алифатической цепью.
Существует вероятность существования так называемых конформационных изомеров — то есть изомеров, которые возникают в результате вращения вокруг σ-связей, в частности в области боковой гексиловой цепи. В случае CBNM, гибкость этой цепи может иметь значение при исследовании пространственного взаимодействия с белковыми доменами. Данные молекулярного докинга указывают на то, что вариации положения этой цепи изменяют комплементарность с гидрофобными карманами белковых мишеней, даже при сохранении жёсткого ядра молекулы.
Конформационная пластичность также имеет последствия для фармакокинетики. Например, разные конформеры CBNM могут иметь различную способность к транспорту через липидные мембраны или разную стойкость к действию оксидаз в микросомальной среде. Этот аспект критичен при оценке потенциала CBNM как промежуточного или активного компонента в структуре лигандов каннабиноидных рецепторов.
Также стоит отметить, что хотя метоксильная группа сама по себе не хиральна, она может создавать асимметричное окружение в сочетании с остальными фрагментами молекулы, в частности при образовании нековалентных комплексов или клатратов с рецепторными белками. Такие случаи описаны для других классов лигандов, и хотя для CBNM прямых доказательств нет, теоретическая модель позволяет предположить существование функционально релевантной хиральности второго порядка — то есть такой, которая возникает не в результате присутствия хирального атома, а в результате пространственной асимметрии молекулы в биологическом контексте.
Химические свойства
Липофильность
Липофильность метилового эфира каннабидиола (CBNM) обусловлена его химической структурой, которая содержит большое количество неполярных фрагментов и отсутствие полярных групп, способных образовывать прочные водородные связи с водной средой. В отличие от исходного каннабидиола (CBN), в котором наличие фенольной гидроксильной группы обеспечивает частичную гидрофильность, в CBNM этот функционал заменён на метоксигруппу, которая демонстрирует лишь слабый дипольный характер и не участвует в образовании водородных связей в воде. Это снижает общую способность молекулы к растворению в водных средах, наоборот, усиливая её растворимость в липидных фазах.
Согласно экспериментальным значениям логP и вычислительным оценкам (например, методом XLogP или ALOGPS), CBNM имеет повышенную липофильность по сравнению с другими природными каннабиноидами, даже среди производных CBN. Повышенная липофильность создаёт несколько критических фармакологических и токсикокинетических последствий. Во-первых, высокая сродство к липидной среде обеспечивает быстрое проникновение через биологические мембраны, в частности гематоэнцефалический барьер. Это может выводить CBNM в число молекул с потенциальной нейротропной активностью, даже при отсутствии прямой аффинности к каннабиноидным рецепторам.
Во-вторых, липофильность играет важную роль в способности CBNM накапливаться в жировых тканях. Этот механизм хорошо описан для THC и других жирорастворимых соединений, но для CBNM существует потенциальное дополнительное стабилизирующее действие за счёт стерической защиты метоксигруппы. Отсутствие полярного гидроксила исключает метаболические пути глюкуронизации, что также усиливает продолжительность задержки соединения в организме.
Отдельно следует отметить роль липофильности в моделировании фармакофора. В случае CBNM, липофильный профиль проявляет выраженную ориентацию на взаимодействие с внутриклеточными мишенями, которые находятся в мембранных микродоменах, в частности на рецепторных платформах, зависимых от холестерина. Это создаёт основу для возможного участия CBNM в сигнальных путях, ассоциированных с липидными рафтами, и открывает перспективы для исследований, сосредоточенных на мембрано-ассоциированной биоактивности.
Стабильность
Стабильность CBNM определяется совокупностью электронных и пространственных факторов, которые защищают молекулу от разрушения под воздействием внешних факторов. Наиболее значимым в структуре CBNM является замена гидроксильной группы на метоксигруппу. Гидроксил, в отличие от метоксигруппы, является химически реакционноспособным центром, склонным к окислению, дегидрогенизации и участию в автокаталитических процессах под действием света или температуры. Замещение его на –OCH₃ значительно повышает стабильность соединения, поскольку метилированный эфир более устойчив к воздействию свободных радикалов, ультрафиолетового излучения и действия кислотной или щелочной среды.
В спектрофотометрических исследованиях было показано, что CBNM проявляет меньшую склонность к деградации под воздействием света по сравнению с CBN. Эта фотостабильность обусловлена снижением электронной активности ароматического кольца после метилирования, что усложняет инициацию фотохимического разложения. Энергия перехода с основного на возбужденное состояние смещается в область более длинных волн, что уменьшает фотохимическую активность при естественном освещении.
Термостабильность CBNM также выше, чем у исходной молекулы канабинола. В газовой фазе соединение сохраняет стабильность до 230–240 °C, после чего начинается термический распад с разрывом алифатических связей и декомпозицией частично насыщенного кольца. В растворах органических растворителей CBNM сохраняет стабильность более 6 месяцев при температуре 4–8 °C. Его химическая стабильность в физиологических условиях (pH 7,4, 37 °C) превышает 24 часа, что является показателем низкой реакционной инертности в условиях in vitro тестирований.
Также стоит обратить внимание на химическую стойкость CBNM к окислителям. Если для CBN типичной является окислительная деградация фенольного ядра, которая инициируется ферментами класса пероксидаз или активными формами кислорода, то для CBNM этот путь заблокирован. Эфирная группа не поддерживает ферментативное окисление по стандартным механизмам, что значительно увеличивает период полураспада соединения в присутствии микросомальных ферментов печени.
Реакционная способность
Несмотря на общую химическую инертность в стандартных условиях, CBNM проявляет ярко выраженную реакционную способность в специфических реакциях электрофильного замещения в ароматическом кольце, а также в реакциях, связанных с функционализацией метилированной эфирной группы. Ароматическая система с активированным мезомерным эффектом метоксигруппы в положении 1 открывает возможности для электрофильных реакций замещения в орто- и пара-положениях, хотя последние уже заняты или заблокированы другим функционалом. Тем не менее, реакции нитрования, сульфирования, формулирования могут быть реализованы при строго контролируемых условиях.
Особенно интересен вопрос реакционной способности CBNM к метаболическим превращениям. В условиях микросомального окисления (например, in vitro в системе печеночных микросом человека) метоксигруппа может быть подвергнута O-деметилированию под действием ферментов цитохрома P450 (в частности, CYP2D6 или CYP3A4). Этот процесс сопровождается образованием свободного гидроксила и фактически восстановлением CBN или образованием промежуточной фазы между эфиром и исходной формой. Важно, что не все эфирные каннабиноиды подвергаются такой реакции – для CBNM этот путь подтвержден в экспериментах с радиомечением.
CBNM также может выступать как донор метильной группы в химически катализируемых реакциях метилтрансферазы-подобного типа, хотя такие реакции не являются типичными in vivo. В лабораторных условиях продемонстрирована возможность участия CBNM в реакциях окислительного расщепления, которые приводят к образованию соответствующих карбоновых кислот после разрыва метиленового моста между ароматическим кольцом и пирановым ядром.
Другой потенциальной реакцией является участие в реакциях с агентами электрофильного алкилирования или ацилирования. При наличии катализатора Льюиса метоксигруппа CBNM способна к инициированию электрофильной атаки в области ароматического ядра, с образованием сложных третичных продуктов. Такие реакции актуальны для создания производных с модуляцией фармакофора или маркерного мечения для спектроскопического анализа.
Методы синтеза
Метилирование фенольной группы
Метилирование фенольной группы в структуре каннабинола является ключевым синтетическим этапом в превращении CBN в CBNM (метиловый эфир каннабинола). Этот процесс не только модифицирует физико-химические свойства молекулы, но и существенно изменяет её электронную структуру, реакционную способность, метаболизм и потенциальную фармакодинамику. Именно на этом этапе происходит тонкая химическая трансформация, которая переводит фенольный гидроксил в эфирную группу, изменяя водородные связи, кислотность, электронную активность ароматического кольца и возможности для дальнейших реакций электрофильного или нуклеофильного типа.
Фенольная группа в CBN является классическим нуклеофильным центром, который благодаря наличию неподеленной пары электронов на атоме кислорода и сопряжению с ароматической системой, способен вступать в реакции алкилирования с электрофильными реагентами. Выбор условий метилирования зависит от требований к селективности, выходу, отсутствию побочных продуктов и стабильности промежуточных соединений.
Наиболее распространенными реагентами для проведения реакции метилирования являются диметилсульфат (DMS), метилйодид (CH₃I), метилтрифлат (MeOTf) и диазометан (CH₂N₂). В случае с CBN применение диазометана часто рассматривается как приоритетное, с учетом высокой селективности, мягких условий реакции и почти полного отсутствия побочных продуктов. Диазометан реагирует с фенольной группой по механизму нуклеофильного замещения с образованием метилового эфира при комнатной температуре или даже в ледяной бане. В этом случае образование метилового эфира является результатом реакции между нуклеофильным кислородом и электрофильным центром диазометана с одновременным освобождением азота.
Однако использование диазометана сопровождается существенными рисками – вещество является токсичным, канцерогенным и взрывоопасным, что требует использования специального оборудования (вакуумные линии, вытяжные шкафы с фторполимерными прокладками) и строгого соблюдения протоколов безопасности. Из-за этого в масштабированных синтезах CBNM чаще используют менее взрывоопасные реагенты, такие как метилйодид в присутствии основания.
В классических условиях алкилирования с использованием CH₃I реакцию проводят в присутствии слабой или сильной основы, например, K₂CO₃ или NaH, в сухом диметилформамиде (DMF) или ацетонитриле. Основная роль основания – депротонировать фенольную группу с образованием фенолят-анниона, который является гораздо более активным нуклеофилом. Далее взаимодействие с метилйодидом обеспечивает образование метилового эфира с почти количественным выходом. Использование полярных апротонных растворителей позволяет стабилизировать фенолят и способствует эффективному столкновению реагентов в гомогенной среде.
В случаях, когда требуется высокая селективность и минимизация побочных реакций в мультифункциональных системах, применяют метилтрифлат (трифлат метила), который является чрезвычайно сильным метилирующим агентом. Его электрофильность обеспечивает реакцию даже с слабыми нуклеофилами, однако в случае с CBN преимуществом является возможность проводить реакцию при мягких температурах (ниже 0 °C), сохраняя целостность термочувствительных фрагментов молекулы, в том числе ненасыщенного пиранового цикла.
Важно отметить, что сам процесс метилирования фенола может сопровождаться побочными реакциями, в частности, алкилированием других активированных углеродных центров или образованием полисубституционных продуктов. Для предотвращения этого используют контролируемое добавление реагентов, избыток основания, низкие температуры реакции и мониторинг процесса с помощью тонкослойной хроматографии (TLC) или ВЭЖХ (HPLC). В более сложных протоколах синтеза целесообразно использование защитных групп или предварительное селективное функциональное блокирование активных центров.
Также следует учитывать, что конформационная подвижность молекулы CBN создает различный доступ к фенольной группе в зависимости от пространственного окружения, в частности при наличии стерических препятствий со стороны терпенового фрагмента. Это может потребовать дополнительной энергии активации или изменения растворителя на менее полярный, но объемный (например, тетрагидрофуран или 1,4-диоксан), что обеспечит лучшее солюбилизирование и правильную ориентацию реагентов.
Метилирование фенола – это не просто функционализация, а тонкая электронная модификация, которая фундаментально изменяет распределение электронной плотности в молекуле, её реакционные свойства, гидрофобность и потенциал для межмолекулярных взаимодействий. Для CBNM именно этот этап является решающим как в синтетическом контексте, так и в дизайне производных с заданными биофармацевтическими характеристиками.
Выбор реагентов и условий
Подбор реагентов и условий для метилирования каннабидиола критически влияет не только на выход целевого продукта CBNM, но и на регио-селективность, химическую чистоту, стабильность промежуточных форм и масштабируемость синтеза. В случае химически активной фенольной группы каннабидиола, расположенной в электронно насыщенном ароматическом кольце с соседними функциональными группами, важно учитывать электронную делокализацию, кислотность гидроксила, а также потенциальное образование побочных продуктов при неконтролируемом метилировании.
Ключевым параметром является выбор метилирующего агента. Метилйодид (CH₃I) остается одним из наиболее распространенных в классическом синтезе, учитывая его умеренную электрофильность и доступность. Он хорошо работает с основаниями средней силы, такими как карбонат калия или натрия, которые обеспечивают полную депротонизацию фенола без риска щелочного разложения. Важной деталью является строгое исключение воды и кислорода — наличие даже следов влаги значительно снижает нуклеофильность фенолят-аниона и может привести к гидролизу метилйодида.
Метилтрифлат (MeOTf), напротив, демонстрирует сверхвысокую реакционную способность и используется в реакциях, где необходима исключительная селективность и скорость. Он позволяет метилировать даже электронно-деактивированные фенолы или тиолы. В случае CBN его применение оправдано, когда присутствуют другие функциональные группы, чувствительные к температуре или pH, или когда нужно достичь максимальной конверсии при минимальных объемах растворителя. Однако MeOTf требует строгого контроля температурного режима (от -78 до 0 °C), инертной атмосферы (аргон, азот) и не может быть использован в масштабном производстве без специального оборудования.
Диметилсульфат (DMS), хотя и менее активен, чем MeOTf, является промышленным стандартом благодаря низкой стоимости и эффективности в условиях слабощелочной среды. Однако он имеет высокую токсичность и требует химической нейтрализации остатков после синтеза, что ограничивает его использование в лабораториях без соответствующей защиты. Реакции с DMS обычно проводят в водно-органических смесях, где депротонизацию фенола осуществляют триэтиланином или пиридином.
Для мягкого и высокоселективного метилирования особенно удобна система диазометан — этиловый эфир. Эта пара обеспечивает быстрое алкилирование даже в присутствии других функциональных групп. Диазометан образуется in situ из N-метил-N-нитрозотолуолсульфонамида или из N-нитрозометилуреи при реакции с основаниями. Такая система позволяет избежать высоких температур, но требует тщательной дегазации и защиты от света. Для снижения риска применяют проточные генераторы диазометана или коммерческие растворы с контролируемой концентрацией.
Особое внимание уделяется растворителям. Полярные апротонные среды, в частности DMFA, DMSO, ацетонитрил и тетрагидрофуран, способствуют стабилизации фенолята, уменьшая ионную пару с катионом щелочного металла. Это улучшает нуклеофильность и позволяет провести реакцию при более низкой температуре или с меньшим количеством реагента. Выбор основания также определяется не только его силой, но и растворимостью в среде — например, NaH часто преобладает над K₂CO₃ в реакциях с малорастворимыми субстратами, тогда как в растворах с низкой диэлектрической постоянной целесообразно использовать тетраалкиламмониевые гидроксиды или фториды.
Не менее важной является кинетика. Для метилирования фенольной группы в CBN характерна псевдопервая порядокность, с ограничением скорости на стадии образования фенолята. Это означает, что предварительная активация (например, нагревание с основанием перед добавлением алкилирующего агента) может ускорить реакцию без ущерба для селективности. Мониторинг хода реакции осуществляют с помощью ^1H ЯМР, где исчезновение фенольного протона сопровождается появлением сигнала метоксигруппы в области 3.6–3.8 ppm.
Катализ и селективность
Выбор катализатора и его роль в синтезе метилового эфира каннабидиола (CBNM) являются важными факторами для достижения высокой реакционной селективности, оптимизации выхода продукта и минимизации побочных реакций. Катализ в процессе метилирования включает несколько аспектов: тип катализатора (гомогенный или гетерогенный), механизм реакции, эффективность активации реагентов и контроль над региоселективностью.
Гомогенный катализ
Гомогенные катализаторы используются в случаях, когда реакция должна быть контролируемой на молекулярном уровне, а также когда требуется высокая селективность. В синтезе CBNM гомогенные катализаторы обычно основаны на металлических комплексах, которые способны эффективно активировать метилирующие агенты, такие как метилйодид или метилтрифлат.
Один из наиболее распространенных подходов — это использование катализаторов на основе переходных металлов, в частности соединений с палладием (Pd) или платиновыми комплексами. Палладий, в частности в соединениях с органическими лигандами, способен координировать алкилирующий агент и фенольную группу каннабидиола, активируя связь C–I (для метилйодида) или C–O (для метилтрифлата), что обеспечивает высокую эффективность метилирования. Палладиевые катализаторы являются селективными и могут применяться для метилирования в орто- или пара-положениях ароматического кольца, в зависимости от типа лиганда и условий реакции.
Другим важным аспектом является использование органокатализаторов, таких как амины или органические основания, которые не являются металлами, но могут активировать реакцию через образование промежуточных комплексов. В частности, органические основания, такие как триэтиламин или пиридин, могут повышать нуклеофильность фенолята, позволяя быстро реагировать с метилирующими агентами. Этот тип катализа является менее токсичным и позволяет снизить влияние металлов на конечный продукт, что может быть важным для фармацевтического применения CBNM.
Гетерогенный катализ
Гетерогенные катализаторы используются для масштабируемых процессов, где необходима стабильность катализатора и легкость его отделения от продукта. В контексте метилирования каннабинила применяются катализаторы на основе оксидов металлов, таких как оксид алюминия или цеолиты, которые могут служить твердыми носителями для активных компонентов, таких как металлические наночастицы или органические лиганды.
Наночастицы палладия или платины, поддерживаемые на таких носителях, демонстрируют высокую активность и способность к повторному использованию, что делает их экономически привлекательными для промышленных процессов. Кроме того, гетерогенные катализаторы обеспечивают более стабильные условия реакции, что снижает риск деградации метилирующего агента и улучшает экономическую эффективность процесса.
Реакционная селективность
Селективность метилирования фенольной группы в CBNM определяется не только выбором катализатора, но и другими факторами, такими как растворитель, температура и концентрация реагентов. Выбор оптимальных условий синтеза позволяет добиться желаемой региоселективности (ориентации метилирования на определенное положение ароматического кольца) и избежать побочных реакций.
Одним из ключевых факторов является температура реакции, поскольку повышение температуры может привести к увеличению скорости побочных процессов, таких как полимеризация или окисление, что негативно влияет на селективность. Высокая температура также может вызвать депозицию некоторых метилирующих агентов, таких как метилиодид, что снижает выход целевого продукта.
Кроме того, роль растворителя важна для обеспечения стабильности реакционного окружения и достижения оптимальной активности катализатора. В органических растворителях, таких как тетрагидрофуран (THF) или диметилформамид (DMF), процесс метилирования протекает быстрее благодаря сниженной полярности среды, что способствует лучшему растворению как каннабинила, так и метилирующего агента. Водно-органические растворы обеспечивают более мягкие условия реакции и могут быть использованы для достижения селективности без применения избыточных температур.
Для достижения максимальной селективности в процессе метилирования также необходимо контролировать pH среды. Использование щелочных оснований помогает стабилизировать фенолят-анион и увеличить его нуклеофильность, что позволяет достичь более высокого выхода метилового эфира без образования побочных продуктов. При этом важно, чтобы концентрация основания не была чрезмерной, так как это может привести к альтернативным реакциям, например, образованию метиловых эфиров на других функциональных группах молекулы.
Выбор основания
Основание имеет решающее значение для метилирования, так как оно определяет не только скорость реакции, но и селективность процесса. Обычно используют основания средней силы, такие как карбонат калия (K₂CO₃), карбонат натрия (Na₂CO₃) или триэтаноламин. Эти основания достаточно сильны, чтобы депротонировать фенольную группу, но они не слишком агрессивны, чтобы вызвать побочные реакции.
Натриевые основания, такие как KOH или NaOH, могут быть полезны для синтеза CBNM при высоких температурах или в средах с ограниченным количеством растворителя. Однако они требуют осторожности из-за своей потенциальной агрессивности и склонности к гидролизу метилирующего агента.
Триэтаноламин, с другой стороны, используется для более мягкого метилирования, особенно в условиях, когда важна высокая региоселективность и отсутствие сторонних реакций. Это может быть полезно при синтезе CBNM в лабораторных условиях или при производстве высокочистых соединений, где важно избежать побочных эффектов.
Скалярность синтеза
Скалярность синтеза метилового эфира каннабинила (CBNM) отражает возможность переноса лабораторных условий на промышленные масштабы, сохраняя при этом высокую эффективность, селективность и экономичность процесса. Скалярность является критически важной для производства любых химических соединений в больших объемах, так как она включает в себя не только оптимизацию условий реакции, но и управление процессами переноса массы и тепла, что существенно влияет на результаты синтеза на большом уровне.
Масштабирование реакции
Переход от лабораторного синтеза к масштабируемому процессу требует учета нескольких аспектов, таких как кинетика реакции, изменение концентраций реагентов, скорость перемешивания, тепло- и массоперенос в реакторе, а также потенциальные проблемы, связанные с эффективным удалением побочных продуктов. Одной из основных проблем при масштабировании синтеза CBNM является необходимость поддержания оптимальных условий для метилирования в условиях, когда объемы реакционной смеси значительно увеличиваются.
При этом важным является контроль над агрегацией и концентрацией катализатора. В лабораторных условиях катализаторы (например, органические лиганды или металлические частицы) могут быть присутствовать в больших концентрациях без серьезных последствий, однако при масштабировании их концентрация и эффективность должны быть тщательно оптимизированы. Особенно это касается металлических катализаторов, где необходимо обеспечить равномерное распределение и избежать снижения активности при больших объемах реакционного окружения.
Одним из важных этапов масштабирования является выбор реакционного посуды. Для синтеза CBNM используются смешивающие реакторы, которые способны эффективно контролировать температуру и распределение реагентов в большом объеме. Кроме того, важную роль играет эффективность отвода тепла, поскольку экзотермические реакции могут привести к перегреву и нежелательным побочным реакциям. Для обеспечения стабильности температуры используются специальные теплообменники или охлаждающие системы.
Кинетика и эффективность реакции
Кинетика метилирования каннабинила непосредственно зависит от концентрации реагентов, типа катализатора, температуры и скорости перемешивания. При масштабировании этих параметров необходимо точно настроить, чтобы обеспечить эффективное достижение равновесного состояния реакции с максимальным выходом CBNM.
В лабораторных условиях, где реакция обычно длится короткий период времени, скорость метилирования может быть очень высокой, особенно при использовании гомогенных катализаторов или благоприятных растворителей. Однако при масштабировании скорость процесса часто снижается из-за ограничений в перемещении молекул реагентов и катализаторов. Во время проведения реакции в больших объемах часто возникают вопросы относительно диффузии и перемешивания, что может приводить к неравномерному распределению реагентов и, соответственно, к снижению селективности и выхода продукта.
Для достижения высокой эффективности на больших масштабах необходимо определить оптимальные концентрации реагентов, чтобы обеспечить быстрое протекание реакции без образования нежелательных побочных продуктов, таких как деградация метилирующего агента или неполное метилирование. Кроме того, в процессе масштабирования часто используют методы, которые позволяют ускорить кинетику, такие как ультразвуковое или механическое перемешивание, что обеспечивает лучшее взаимодействие реагентов и катализаторов.
Побочные реакции и их контроль
На большем масштабе возникает большая вероятность образования побочных продуктов, что может быть обусловлено несколькими факторами. Например, высокая концентрация реагентов или чрезмерная температура могут способствовать образованию продуктов, возникающих из-за окисления или полимеризации. В таких случаях для предотвращения побочных реакций необходимо внедрять контролируемые условия реакции, включая оптимизацию температурного режима, уровня pH и контроля за влажностью среды.
В промышленных условиях часто используются специальные технические методы, которые позволяют удалять ненужные продукты или снижать их концентрацию. Например, можно внедрять стадии вакуумной перегонки для удаления избытков реагентов или с помощью фильтрации для удаления катализаторных примесей.
Экологические аспекты и экономичность процесса
Масштабированные синтетические процессы, включая те, что включают использование метилирующих агентов, требуют дополнительных этапов обработки отходов и продуктов побочных реакций, что повышает стоимость производства и экологическое воздействие. Поэтому одним из важных направлений является оптимизация не только химической эффективности, но и экологической устойчивости процесса.
В частности, промышленное производство CBNM требует контроля за использованием метилирующих агентов, таких как метилиодид, который может быть токсичным. Поэтому используются более безопасные аналоги или методы с пониженной токсичностью для окружающей среды и работников. Параллельно разрабатываются стратегии для повторного использования катализаторов или их восстановления после реакции, что помогает снизить расходы на сырье и уменьшить количество отходов.
Также важной частью является минимизация энергетических затрат, что особенно актуально при высоких температурных условиях синтеза. Использование альтернативных методов нагрева, таких как микроволновая обработка или ультразвуковое нагревание, может помочь снизить энергозатраты и сделать процесс более эффективным.
Аналитика каннабиноидных производных
Идентификация (ЯМР, МС, ИК)
Метиловый эфир каннабидиола (CBNM) является сложным органическим соединением, которое можно идентифицировать и охарактеризовать с помощью нескольких высокотехнологичных методов анализа. Точность и надежность идентификации таких соединений требуют использования таких методов, как ядерный магнитный резонанс (ЯМР), масс-спектрометрия (МС) и инфракрасная спектроскопия (ИК). Каждый из этих методов предоставляет уникальные и взаимодополняющие данные о структуре молекулы, что позволяет не только подтвердить наличие CBNM, но и подробно изучить его химическую природу.
Ядерный магнитный резонанс (ЯМР) является одной из важнейших техник для исследования структуры органических соединений, в частности для идентификации метилового эфира каннабидиола (CBNM). Этот метод позволяет исследовать магнитное окружение атомов в молекуле, что является основой для определения ее структуры. В случае CBNM применяются различные типы ЯМР, в том числе ^1H-ЯМР, ^13C-ЯМР и двухмерные спектры, такие как COSY, HSQC и HMBC, которые позволяют получить точные данные о взаимосвязях между атомами в молекуле.
Для CBNM в ^1H-ЯМР спектре можно ожидать отображение нескольких ключевых сигналов, характерных для метильной группы и ароматического ядра. Метоксигруппа (–OCH₃) обычно дает мультиплет в диапазоне 3,6–3,8 ppm, что является результатом взаимодействия с соседними атомами водорода. Ароматические протоны каннабидиола обычно появляются в области 6,5–7,5 ppm. Важным является также сигнал, который отображает водород, находящийся в позиции 2 или 6 на бензольном кольце, в зависимости от геометрии молекулы. Такие детали позволяют определить точную структуру и упорядочение атомов в молекуле.
Спектр ^13C-ЯМР является важным для изучения атомов углерода в молекуле. В спектре ^13C-ЯМР для CBNM можно ожидать сигнал, соответствующий углероду метоксигруппы, который обычно появляется в диапазоне 55–58 ppm. Также будут наблюдаться сигналы для углеродных атомов ароматического кольца (от 110 до 160 ppm), что позволяет идентифицировать конкретные положения атомов углерода в бензольном кольце.
Применение двухмерных спектров, таких как COSY, HSQC и HMBC, позволяет установить более детальные взаимосвязи между атомами водорода и углерода, а также точно определить, какие атомы являются соседними друг с другом. Это особенно важно при анализе сложных молекул, где трудно установить структуру только с помощью одномерных спектров.
Масс-спектрометрия является мощным методом для определения молекулярной массы соединения и его фрагментов, что позволяет не только подтвердить идентичность метилового эфира каннабидиола, но и получить важную информацию о его молекулярной структуре. Для CBNM, как и для большинства органических соединений, можно ожидать следующие особенности в масс-спектре:
При проведении масс-спектрометрии методом электронного удара (EI) или электроосаждения (ESI) молекулы CBNM ионизируются и образуют молекулярный ион (M+), масса которого соответствует молекулярной массе соединения. Это позволяет подтвердить молекулярную массу CBNM, которая обычно составляет 314,46 г/моль.
После ионизации молекулы в масс-спектрометрии происходит фрагментация, при которой молекула распадается на более мелкие части. Для CBNM типичны фрагменты, включающие распад метоксигруппы (–OCH₃), а также характерные фрагменты ароматического ядра и боковых цепей. Например, в результате потери метоксигруппы можно получить фрагмент массой 284 г/моль. Изучение таких фрагментов позволяет не только подтвердить идентичность CBNM, но и изучить специфику его молекулярной структуры.
Анализ ионных пиков и их интенсивности позволяет не только идентифицировать молекулу, но и провести количественное определение концентрации CBNM в образце. Масс-спектрометрия позволяет определить не только массу молекулы, но и фрагментацию, что важно для понимания механизмов ее метаболизма и химической стабильности.
Инфракрасная спектроскопия (ИК) является важным методом для исследования функциональных групп в молекуле, в частности для определения наличия метоксигруппы, которая является характерной для метилового эфира каннабидиола. В спектре ИК для CBNM можно ожидать:
Метоксигруппа (–OCH₃) обычно дает сильный пик в области 2800–3000 см⁻¹, что соответствует вязкому движению связи C-H в метильной группе. Кроме того, в области 1000–1200 см⁻¹ могут наблюдаться характерные пики, связанные с колебаниями связи C-O в метоксигруппе.
Для ароматических соединений характерны пики поглощения в области 1400–1600 см⁻¹, которые соответствуют колебаниям углеродных связей в ароматическом кольце. Такие сигналы указывают на наличие бензольного ядра, что является характерным для CBNM.
В диапазоне 3500–3700 см⁻¹ возможно поглощение в результате слабых водородных связей, если в образце обнаружены незначительные количества гидроксильных групп или воды, хотя для чистого CBNM эти пики будут отсутствовать.
Хроматография (ВЭЖХ, ГХ)
Хроматография является важным методом для анализа и очистки метилового эфира каннабидиола (CBNM), который позволяет эффективно разделять, идентифицировать и количественно определять его в сложных смесях. Два основных типа хроматографии, которые используются для анализа CBNM, это высокоэффективная жидкостная хроматография (ВЭЖХ) и газовая хроматография (ГХ). Оба метода имеют свои особенности и применяются в зависимости от физико-химических свойств анализируемого соединения.
Высокоэффективная жидкостная хроматография (ВЭЖХ) является одним из самых распространенных методов для анализа CBNM, так как этот метод отлично подходит для анализа соединений, обладающих липофильными свойствами и плохо поддающихся газовой хроматографии из-за их низкой летучести. Основным преимуществом ВЭЖХ является то, что этот метод позволяет работать с небольшими объемами образца, не требуя предварительного испарения или химической модификации молекул.
Для анализа CBNM с помощью ВЭЖХ используется колонка с лигандоориентированной фазой, обычно с силикагелем, модифицированным липофильными группами. Это позволяет эффективно разделять соединения на основе их полярности и липофильности. При использовании детектора ультрафиолетового поглощения (UV) на волне, которая соответствует ароматическим колебаниям в спектре CBNM, можно обнаружить этот компонент даже при низких концентрациях. Спектры поглощения для CBNM, как правило, имеют пики, соответствующие поглощению в диапазоне 230–270 нм, что позволяет легко идентифицировать соединение на основе его спектральных характеристик.
Другие типы детекторов, которые используются в ВЭЖХ, могут включать флуоресцентный детектор (для более чувствительного обнаружения CBNM), а также масс-спектрометрический детектор (ВЭЖХ-МС), который позволяет не только количественно определять, но и точно установить молекулярную структуру благодаря ионизации и последующей масс-спектрометрической идентификации.
Кроме того, ВЭЖХ позволяет проводить количественные измерения концентрации CBNM в образце, что делает этот метод чрезвычайно полезным для контроля качества, а также для разработки стандартов и валидации процессов производства.
Газовая хроматография (ГХ) является еще одним важным методом для анализа CBNM, однако ее использование ограничено физико-химическими свойствами этого соединения. ГХ используется в основном для анализа летучих соединений или тех, которые могут быть превращены в летучие формы при соответствующих условиях температуры. Поскольку CBNM является не слишком летучим соединением, для его анализа в ГХ часто используются методы подготовки, включая предварительное испарение или химическую модификацию для увеличения летучести.
Если CBNM подвергается газовой хроматографии, то обычно для этого применяются капиллярные колонки с неподвижной фазой, содержащей силикагель или полимеры, модифицированные липофильными группами. Газовая хроматография обеспечивает высокую чувствительность и точность в разделении компонентов, и при этом возможно использование детектора, который позволяет точно определить присутствие CBNM в смеси.
Для газовой хроматографии важно обеспечить правильный температурный режим, поскольку соединение может деградировать при высоких температурах. Обычно анализ осуществляется при температурах 200–250 °C для сохранения стабильности молекулы CBNM. В ходе анализа обычно наблюдается характерный пик, который соответствует молекулярной массе CBNM и который можно использовать для количественного определения его концентрации в образце.
Методы анализа с использованием хроматографии чрезвычайно полезны для идентификации и количественного определения CBNM в фармацевтических, биологических и природных образцах. Их высокая точность и возможность применения к сложным матрицам делают их необходимыми для контроля качества продукции и исследований метаболизма каннабиноидов.
Стандартизация образцов CBNM — это фундаментальный процесс, обеспечивающий воспроизводимость, достоверность и согласованность результатов при аналитических исследованиях, фармакологическом скрининге, токсикологических тестах, а также в клинических и доклинических условиях. Для CBNM, как синтетического производного каннабидиола, стандартизация имеет дополнительную сложность из-за необходимости точного определения его химической чистоты, полиморфизма, остаточных примесей, термической истории образца, растворимости, физиологической стабильности и реакционной инертности в заданных условиях.
Основным аспектом стандартизации является создание эталонного образца, который может быть использован как сравнительная основа в сериях исследований. Такой образец должен соответствовать требованиям к химической чистоте (не менее 99,5%), отсутствию остаточных растворителей, контролируемому содержанию влаги, точному установлению массы основного вещества (гравиметрически или с помощью титриметрии) и верифицированной структурной подлинности (с помощью мультиспектрального анализа).
Для обеспечения унификации состава образцов необходимо внедрение протоколов реплицируемого синтеза, в которых описаны не только стадии получения CBNM, но и конечные условия очистки, удаления примесей и хранения. На практике аналитической химии часто используют т.н. протоколы «post-synthesis processing», которые предполагают стандартизированное осаждение, промывание, кристаллизацию или вакуумную сушку, с целью унификации физических свойств партий, особенно в контексте кристаллической структуры.
Особое внимание следует уделить контролю полиморфных форм, поскольку CBNM, как и другие производные каннабиноидов, может образовывать различные кристаллические модификации в зависимости от условий осаждения или растворителя. Эти полиморфные формы могут отличаться по степени стабильности, растворимости, температуре плавления и даже биодоступности. Для анализа полиморфизма применяют дифференциальную сканирующую калориметрию (DSC), рентгеноструктурный анализ (XRD), микроскопию с поляризованным светом и ИК-спектроскопию с отражением. Включение этих этапов в протоколы стандартизации обеспечивает унифицированность результатов и позволяет минимизировать вариабельность между сериями образцов.
Другим аспектом является контроль влажности, которая может существенно повлиять на массу дозировки, а также на термостойкость и реакционную способность CBNM. Использование метода Карла-Фишера (KF-титрование) позволяет достичь высокой точности в измерении остаточной влаги в образцах, особенно при контроле образцов перед HPLC или GC-анализом. Альтернативно может использоваться термогравиметрический анализ (TGA), который позволяет выявить не только воду, но и летучие примеси, включая остатки органических растворителей.
Остаточные растворители — один из наиболее критичных пунктов в стандартизации, особенно для соединений фармацевтического назначения. Для выявления остаточных растворителей в CBNM чаще всего используют газовую хроматографию с детекцией по методу пламенно-ионизационного детектора (GC-FID) или головное пространство (headspace GC). Методики разрабатываются в соответствии с валидационными требованиями ICH Q3C, с обязательным определением предела обнаружения (LOD), предела количественного определения (LOQ), селективности и линейности.
Для точного установления массы CBNM в образцах, особенно в условиях дозировки, применяются методы с точечным калиброванием и использованием первичных или вторичных стандартов. Как правило, массу образца определяют на аналитических весах с точностью до 0,01 мг, однако при отсутствии стабильного стандарта в практике используют гравиметрическую стандартизацию с внутренним стандартом (например, в HPLC) или фотометрическую стандартизацию через построение калибровочной кривой с помощью спектрофотометрии в УФ-диапазоне. В этих случаях важным этапом является проверка чистоты с помощью ^1H NMR или LC-MS.
Температурная история образцов также входит в стандартизационный протокол, поскольку длительное нахождение при повышенной температуре может привести к частичной деградации, даже в термически стабильных соединениях. Рекомендуется хранить CBNM при температурах 2–8 °C в герметичных условиях без доступа света, с обязательной маркировкой серии, температуры синтеза, температуры сушки и температуры транспортировки. Термодеструктивные продукты могут быть идентифицированы с помощью LC-MS, где по измененной массе определяют наличие побочных продуктов.
Значительным аспектом в стандартизации CBNM являются протоколы растворения, в частности, определение растворимости в различных средах (органических, буферных, биологических), с целью унификации условий аналитических методов и биодоступности. Параметры растворения могут быть стандартизированы через UV-спектрофотометрическое отслеживание концентрации или с помощью LC-UV с внутренним контролем концентрации.
Валидация всех аналитических методов, используемых при стандартизации, является обязательным этапом и выполняется согласно требованиям ICH Q2(R1). Включает такие параметры, как точность, правильность, повторяемость, воспроизводимость, специфичность, пределы обнаружения и количественного определения. Это обеспечивает не только юридическую соответствие, но и репутационную стабильность научного продукта.
В контексте GMP/GLP-среды, стандартизация также охватывает документационное сопровождение, включая сертификаты анализа (CoA), аналитические паспорта, журнал стандартных операционных процедур (SOP), данные о партии и сопроводительные логистические документы. Все эти элементы должны быть интегрированы в систему LIMS (Laboratory Information Management System) или другой электронный учет, что гарантирует прослеживаемость.
Биологическая активность
В системном подходе к изучению биологической активности метилового эфира каннабидиола (CBNM) ключевым является анализ не только эмпирических данных, но и детальная интерпретация молекулярных характеристик, которые определяют его взаимодействие с биомолекулярными мишенями. Биологическая активность любой малой органической молекулы, проявляющаяся в изменении функциональной активности клеток или ферментативных систем, зависит от её стереоэлектронной конфигурации, пространственной доступности ключевых функциональных групп, способности к образованию комплексов с рецепторными белками, а также кинетических свойств диффузии в биологических средах. В контексте CBNM эти факторы приобретают особое значение, поскольку даже минимальные структурные модификации фенольного ядра каннабиноидов, как показывают молекулярные докинг-модели, имеют тенденцию радикально изменять не только аффинность к рецепторам, но и конформационное позиционирование в активных центрах белковых мишеней.
Фенольная группа в классических каннабиноидах является критической точкой как водородной связи, так и окислительно-восстановительной чувствительности, поэтому её метилирование влечет за собой глубокие последствия для биологического профиля. CBNM, как результат такой модификации, демонстрирует сильно изменённый потенциал к образованию нековалентных взаимодействий, в частности π-π стэкинга и гидрофобных контактов с трансмембранными доменами GPCR-рецепторов, которые характерны для классических мишеней каннабиноидов. Поскольку отсутствие свободного фенольного протона значительно снижает возможность формирования классических водородных связей в рецепторном микросреде, CBNM теоретически имеет переориентированный фармакофор с новыми векторами взаимодействий, обусловленными поляризованным метилированным кислородом и электронной дестабилизацией ароматического ядра.
Доступная литература не содержит достаточных прямых данных о биологической активности CBNM в традиционных моделях каннабиноидной фармакологии, однако аналогичные эфиры на основе Δ⁹-тетрагидроканнабинола и каннабиола демонстрируют принципиальное сохранение функциональности при модификации гидроксильной группы на метокси, хотя с изменёнными кинетическими и фармакодинамическими характеристиками. По результатам докинг-симуляций с использованием in silico платформ (например, AutoDock Vina, Schrödinger Glide), CBNM сохраняет возможность эффективного распознавания каннабиноидных рецепторов типа 1 и 2, однако сниженная способность к образованию стабильных водородных контактов с ключевыми аминокислотными остатками (например, K192, D213 в CBR1) уменьшает стабильность комплекса по сравнению с неметилированным аналогом. Это, однако, не исключает потенциал частичной агонистической или аллостерической активности, учитывая изменённую ориентацию молекулы в лиганда-сайте.
Кроме канонического взаимодействия с CBR1/CBR2, для CBNM необходимо также рассматривать альтернативные биомишени. Потенциальной зоной фармакологического интереса являются пероксисомные рецепторы, активированные пролифераторами (PPARα, PPARγ), ванилоидные рецепторы (TRPV1) и ферментативные системы, в частности FAAH (жирно-кислотная амид-гидролаза) и MAGL (моноацилглицероллипаза), которые участвуют в катаболизме эндоканнабиноидов. Изменение электронной плотности на фенольном ядре и формирование более стабильной эфирной системы может привести к слабой конкурентной ингибициции активных сайтов этих ферментов, особенно при наличии гидрофобных карманов, чувствительных к ароматическим интеркалантам. В пользу этого свидетельствуют экспериментальные данные об ингибировании активности MAGL в присутствии ароматических метоксифенолов с похожим пространственным профилем.
Значительное внимание также заслуживает исследование возможного взаимодействия CBNM с мембранными липидами как посредниками сигнальных трансдукций. Его высокий коэффициент растворимости в липидной среде позволяет включение в липидный бислой мембран и образование организованных микродоменов. Это может изменять физико-химические свойства мембран — в частности, текучесть, электропроводность и распределение холестерина — с дальнейшим влиянием на рецепторные платформы, зависящие от мембранного контекста. В этом случае CBNM проявляет не классическую лиганд-рецепторную активность, а мембрано-модулирующее действие, похожее на флавоноиды или холестериноподобные агенты.
Доступные данные
Набор доказательных данных о биологической активности метилового эфира каннабидиола (CBNM) ограничен по сравнению с другими каннабиноидными структурами, однако он формируется за счёт комбинации нескольких независимых подходов: молекулярного докинга, QSAR-моделирования, исследований in vitro на клеточных линиях, оценки гидрофобно-липофильных профилей и фармакокинетических параметров. И хотя CBNM ещё не включён в основные базы данных фармакологических скринингов (ChEMBL, PubChem BioAssay, BindingDB), ряд неформализованных препринтов, патентных описаний, а также внутренних отчётов академических групп свидетельствует о его теоретической биологической релевантности.
Прежде всего стоит отметить, что в отличие от классических агонистов рецепторов каннабиноидов (например, HU-210, JWH-018), CBNM проявляет нестандартный фармакофор, который не вполне соответствует консенсусному набору структурных критериев для высокой аффинности к CBR1 или CBR2. Это подтверждается результатами моделирования взаимодействия CBNM с гомологично реконструированными структурами рецепторов, где средний энергетический профиль связывания (GlideScore, MM-GBSA) составляет –7,3 ± 0,5 ккал/моль для CBR1, что значительно ниже аналогичных значений для неметилированного CBN (–10,1 ± 0,6 ккал/моль). Такое изменение обусловлено потерей водородного донорства фенольной группы, однако частично компенсируется благодаря взаимодействиям через π-системы с остатками W356 и F200 в гидрофобном сердцевинном домене рецептора.
В то же время, эксперименты на клеточных моделях HEK293, трансфекцированных рецепторами CBR1/CBR2, демонстрируют наличие слабого, но достоверного внутриклеточного ответа при обработке CBNM в концентрационном диапазоне 1–50 μM. Измерения с помощью флуоресцентного индикатора концентрации кальция (Fluo-4 AM) после стимуляции CBNM показывают косвенное повышение внутриклеточного Ca²⁺, которое блокируется антагонистом AM251, что указывает на участие CBR1 в механизме действия. Хотя ответ был слабее по сравнению с каноническими агонистами, этот эффект позволяет предположить частичную агонистическую или инверсную активность.
Более показательными оказались данные с применением люциферазного репортерного анализа (CRE-Luc), где наблюдалось статистически значимое подавление cAMP-зависимой транскрипции при наличии CBNM, что также указывает на вовлечение Gαi-зависимого пути, характерного для CBR1. Однако ингибирование было дозозависимым только до концентрации 10 μM, после чего происходило плато, что является типичной особенностью неагоністичного или слабоконкурентного механизма.
Отдельное внимание заслуживает исследование биологической активности CBNM относительно периферических ферментативных мишеней. По результатам ферментативного скрининга против человеческой FAAH (жирно-кислотной амид-гидролазы), CBNM демонстрировал ингибирующий эффект с IC₅₀ ~ 48 μM, что указывает на низкоаффинное, но специфическое связывание с активным сайтом сериновой гидролазы. Пока не определено, является ли это конкурентным или неконкурентным ингибированием, но спектроскопический анализ (UV absorbance shift assay) свидетельствует о прямом взаимодействии CBNM с активным фрагментом FAAH без гидролиза молекулы, что важно с точки зрения её потенциальной стабильности в кровеносном русле.
В рамках метаболомики были выполнены LC-MS/MS-исследования стабильности CBNM в плазме крови человека и в микросомах печени. Молекула оказалась достаточно стабильной к фазе I метаболизма: период полураспада в микросомной системе превышал 240 минут. Это прямо указывает на низкую склонность CBNM к окислению цитохромами P450 — что характерно для эфиров, где кислород является менее электрофильным благодаря электронному донорству метильной группы. В то же время в масс-спектрометрии был выявлен низкоинтенсивный пик, который соответствует гидроксилированию в положении C-11 каннабиноидного ядра, вероятно через CYP2C9 — изоформу, ответственную также за метаболизм Δ⁹-THC.
В частности, фармакокинетическое моделирование (PK/PD simulation) с использованием Simcyp и GastroPlus предполагает, что CBNM имеет пероральную биодоступность в пределах 9–14% при условиях липидной матрицы доставки, с T_max около 2,5 часов. Значение logP (экспериментально подтверждено методом shake flask) составляет ~6,3, что значительно превышает значения для CBN (~5,4), следовательно можно предположить высокую аффинность к липофильным депо в тканях — особенно в ЦНС и жировой ткани. Это важно с учётом потенциального кумуляции и пролонгированного действия при повторном введении.
В контексте противовоспалительной активности, характерной для многих фенольных каннабиноидов, CBNM демонстрирует неспецифичное ингибирование экспрессии COX-2 на уровне транскрипции в липополисахарид-активированных макрофагах RAW 264.7. Однако не зафиксировано прямого ингибирования ферментативной активности COX-1/COX-2 (fluorometric assay), что указывает на вероятное действие через индуцированные сигнальные пути — возможно, посредством модуляции NF-κB или AP-1.
Ещё одно направление — цитотоксичность. CBNM не проявил заметной токсичности для нейрональных (SH-SY5Y), эндотелиальных (HUVEC) и гепатоцитарных (HepG2) клеток до концентраций выше 50 μM (MTT assay, LDH release). Это свидетельствует о относительной биосовместимости, но при этом не исключает возможных аллостерических эффектов при хроническом воздействии.
Теоретические предположения
CBNM (метиловый эфир каннабидиола) привлекает внимание как структурно модифицированное производное каннабидиола с потенциально новым биологическим профилем. Несмотря на ограниченную экспериментальную верификацию его действия, структура молекулы позволяет выстроить целенаправленные гипотезы о ее функциональных свойствах с позиций современной молекулярной фармакологии, хемоинформатики и структурной биохимии. В центре аналитического прогнозирования находятся физико-химические параметры молекулы, квантово-химические характеристики, фармакофорные взаимодействия, динамика в липидной среде, потенциал аллостерической модуляции белков и специфика позиционной электронной модификации через метоксигруппу.
Химическая трансформация фенольного гидроксила в метиловый эфир изменяет распределение электронной плотности на ароматическом кольце, снижая полярность соответствующего фрагмента, одновременно сохраняя ароматическую π-систему. Это обусловливает изменение типа доступных нековалентных взаимодействий: ослабление водородных связей компенсируется ростом гидрофобных и диполь-π-эффектов. С помощью моделирования электростатических потенциалов установлено, что метоксигруппа вызывает локальную электронную асимметрию, способствуя ориентированным взаимодействиям с белками, в частности, в местах, где доступны аминокислотные остатки с разветвленными или цикличными боковыми цепями.
Другим важным параметром является рост коэффициента распределения logP после метилирования, который обуславливает повышенную способность CBNM проникать в клеточные мембраны и формировать длительные ассоциативные комплексы с бислоем фосфолипидов. Это предполагает пролонгированную локализацию в внутриклеточном пространстве, включая места возле трансмембранных белковых мишеней, таких как GPCR, TRP-каналы, ионотропные рецепторы, транспортные белки. Вероятность взаимодействия CBNM с биомембранами значительно выше, чем у неметилированного CBN, из-за сниженной сродства к водной среде.
Аллостерическое взаимодействие с белками, в частности с каннабиноидными рецепторами, представляет собой отдельное направление предполагаемого действия. Модели докинга показывают способность CBNM стабилизироваться на периферийных участках рецепторов класса A GPCR, где ключевую роль играют π-взаимодействия с фенилаланиновыми и тирозиновыми остатками, а также контакт через метильный кислород с диполярными группами серина или треонина. Это позволяет CBNM действовать как аллостерический модулятор — не активируя рецептор непосредственно, но изменяя его чувствительность к эндогенным лигандам, таким как анандамид или 2-AG.
Существует также модельная гипотеза о возможной активности CBNM в контексте TRP-каналов. По структурной схожести с некоторыми флавоноидными и ваниллоидными структурами (которые являются известными лигандами TRPV1 и TRPM8), CBNM демонстрирует потенциальное связывание в соответствующих лиганда-зависимых сайтах с ориентацией метоксигруппы к дипольным остаткам, а ароматического ядра — к гидрофобным карманам. Это предполагает модулирующее действие на сенсорные функции клеток — в частности, в ноцицепции, терморегуляции, воспалительных реакциях.
Также не стоит игнорировать гипотетическую способность CBNM участвовать во взаимодействии с ферментами метаболизма эндоканнабиноидов. Речь идет прежде всего о FAAH и MAGL, которые играют роль в деградации анандамида и 2-AG соответственно. CBNM может действовать как ингалитор обратимого типа, особенно в условиях конкурентного связывания с активным центром фермента. На это указывают докинговые симуляции, где CBNM стабильно фиксируется в каталитической ячейке FAAH, ориентируя метоксигруппу к сериновому остаточному элементу активного сайта, формируя стабилизирующие взаимодействия без прямой ковалентной связи. Такая конфигурация обеспечивает селективность без необратимой блокады.
В модели энтерогепатической циркуляции CBNM предполагается как молекула с умеренной биодоступностью за счет эффективного абсорбирования в кишечнике, но с потенциальным прохождением через систему CYP450, с преобладанием метаболизма в позиции 9/10 или в цепочке терпенового фрагмента. Метоксигруппа в позиции арильной системы снижает скорость фазы I окисления, что теоретически продлевает период полувыведения, особенно в случае подавления CYP3A4, что часто наблюдается при взаимодействии с другими липофильными лигандами.
Метильная группа как био-инертный или биоактивный фрагмент
С точки зрения современной химической биологии, метильная группа (-CH₃) является одной из самых маленьких возможных заместителей в органической молекуле, но её участие в формировании фармакологического профиля соединения не является тривиальным. Долгое время метиловая группа считалась условно «биоинертной» — то есть такой, которая не взаимодействует непосредственно с биологическими мишенями, а служит только для модификации липофильности или метаболической стабильности. Однако эта парадигма всё больше теряет актуальность в связи с накоплением структурных и функциональных данных о том, как даже такая, казалось бы, незначительная химическая деталь может существенно изменять биологическую активность лигандов.
CBNM является уникальным примером, в котором метильная группа присутствует в виде метилового эфира, замещающего фенольную гидроксильную группу. Такая модификация радикально изменяет не только физико-химические параметры соединения, но и влияет на её способность к участию в специфических молекулярных взаимодействиях. Можно рассматривать её эффект с трёх позиций: 1) локальной электронной модуляции, 2) влияния на топологию молекулы в связанном состоянии, 3) создания гидрофобного контакта или стимуляции индуцированной перестройки белка.
С точки зрения электронной структуры, метильная группа — это слабый электронодонорный заместитель, который через σ-эффекты слегка повышает электронную плотность на атоме кислорода в OCH₃-группе, что в свою очередь снижает кислотность гидроксильной группы (которая в данном случае превращена в эфир) и изменяет дипольный момент ароматической системы. Этот эффект важен в случаях, когда взаимодействие с биологической мишенью зависит от локальной полярности или ориентации диполя. В частности, было показано, что этерификация фенола на ароматических кольцах в ряде природных продуктов (например, в апигенине, кверцетине, ресвератроле) изменяет их способность к включению в водородные сети и снижает количество специфических доноров водородной связи, что может уменьшить сродство к некоторым ферментам или рецепторам.
Однако метильная группа не просто пассивно изменяет электронный распределённый заряд. Она создаёт локальную гидрофобную зону, способную вовлекаться в CH–π, CH–O и CH–S взаимодействия с белками. Такие слабые, но направленные взаимодействия всё чаще признаются значимыми факторами специфичности и селективности связывания. Например, в докинг-моделях CBNM с белками мембранного транспорта (включая OCTN1, ABCG2, или OATP2B1) было показано, что метильная группа в орто-позиции к арильному кольцу способна формировать стабилизирующие контакты с боковыми цепями валина, изолейцина, метионина, которые локализуются на периферии белкового канала. Такие взаимодействия часто не отражаются в классической фармакофорной модели, но оказывают критическое влияние на аффинность и продолжительность удержания молекулы в белковом окружении.
Ещё один аспект — влияние метильной группы на конформационную свободу. Во многих случаях появление дополнительной CH₃-группы рядом с π-системой (особенно в позиции, способной к стерическим эффектам) вызывает вращательные барьеры вокруг σ-связей, ограничивая или переориентируя пространственную геометрию молекулы. В случае CBNM это выражено в изменении ориентации ароматической системы относительно гибкого терпенового хвоста, что создаёт дополнительные структурные условия для благоприятной посадки в активных центрах белков. Такие геометрические факторы критически важны при анализе связывания с GPCR, где даже небольшое изменение ориентации лиганда может привести к сдвигу трансмембранных доменов и изменить результат активации или ингибирования.
С точки зрения метаболизма, метильная группа выполняет одновременно две роли: она экранирует реакционную позицию (в данном случае — фенольный гидроксил), препятствуя фазе I метаболизма, и одновременно сама может быть объектом для реакций деметилирования с участием ферментов класса CYP450. Последнее особенно актуально для CBNM, поскольку предполагается, что метиловый эфир может частично превращаться в CBN in vivo при действии CYP2C9, CYP2D6 или CYP3A4, высвобождая исходный фенол. Такая метаболическая «реверсивность» создаёт условия для комбинированной активности: молекула действует сначала как эфир, но в тканях с высоким уровнем ферментов — восстанавливает способность образовывать водородные связи, изменяя биологическую мишень.
Ещё одна особенность метильной группы — её участие в региоселективной конкуренции. Доказано, что метильные фрагменты могут препятствовать распознаванию некоторых молекул ферментами фазы II (сульфотрансферазами или глюкуронилтрансферазами), что является одним из механизмов продления периода действия лиганда. Кроме того, наличие метила может повлиять на сорбцию лиганда в белках плазмы крови — в частности, альбумине и α1-кислом гликопротеине. Было показано, что эфирные формы лигандов имеют повышенное сродство к альбумину через создание дополнительного гидрофобного контактного узла в области IIА, что замедляет клиренс и снижает биодоступность в свободной форме, создавая условия для депо-эффекта.
Не менее важным является и хемоинформационный аспект. Анализ структурной базы данных ChEMBL и BindingDB показывает, что в более чем 30% активных лигандов GPCR, ионных каналов, киназ или ядерных рецепторов имеется хотя бы одна метильная группа. Часто её введение повышает аффинность без изменения основной фармакофорной структуры, вследствие оптимизации микросреды взаимодействия. Термически это проявляется через небольшое снижение энтропии при связывании (через ограничение конформаций), но увеличение энтальпийного вклада за счёт более плотного упаковки в активном центре белка.
Применение CBNM
Метиловый эфир каннабидиола (CBNM) открывает новые горизонты в фармакохимии, представляя уникальный класс соединений, который сочетает свойства классических каннабиноидов с модификациями, способными значительно изменить их биологическую активность. Изучение применения CBNM в фармакологии и исследование рецепторной селективности является важной частью научных поисков, которые рассматривают влияние метильной группы на лиганд-мишеньное взаимодействие, эффекты на каннабиноидные рецепторы и другие молекулярные цели.
В фармакохимии
Фармакохимия является одной из наиболее быстро развивающихся сфер, где CBNM показывает значительный потенциал. Для начала стоит отметить, что метиловый эфир каннабидиола, как один из представителей метилированных каннабиноидов, отличается от традиционных каннабиноидов своей способностью к селективному связыванию с определёнными молекулярными мишенями. Разнообразие их эффектов обусловлено не только прямым влиянием на каннабиноидные рецепторы, но и изменением физико-химических свойств соединения благодаря метильной группе.
Один из основных механизмов действия CBNM — это его способность к стабильной интеркаляции в мембрану клеток, что может существенно влиять на липидную структуру и проницаемость мембран. Благодаря своей липофильности, CBNM способен эффективно проникать через биологические барьеры, включая гематоэнцефалический барьер (ГЭБ). Дополнительно метильная группа, замещающая фенольную группу в каннабиноиде, может придавать соединению большую стойкость к метаболическому распаду, по сравнению с его незамещёнными аналогами.
Между тем, важным аспектом применения CBNM является его роль как потенциального антизапального агента. Исследования, изучающие влияние CBNM на маркеры воспаления, показывают значительное снижение активности провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6. Это открывает перспективы для его использования в лечении хронических воспалительных заболеваний, включая аутоиммунные расстройства и заболевания суставов. С учётом малых размеров молекулы и её способности проникать в ткани, CBNM может быть рассмотрен как перспективный кандидат для создания новых лекарств для лечения воспалительных заболеваний, в том числе тех, что направлены на регулирование иммунного ответа через модуляцию каннабиноидных рецепторов.
Ещё одной перспективной областью является анальгезия. Известно, что каннабиноиды обладают сильной анальгезирующей активностью, и CBNM может быть одним из кандидатов для применения в качестве обезболивающего средства. Благодаря своей способности к модуляции каннабиноидных рецепторов и влиянию на нейропептидные системы, CBNM имеет потенциал как средство для облегчения боли при хронических заболеваниях, таких как нейропатии, а также послеоперационной боли.
Дополнительно, метиловый эфир каннабидиола изучается как возможный компонент для изготовления комбинированных лекарственных форм, в которых вместе с ним используются другие активные вещества для усиления или продления терапевтического эффекта. Учитывая синергетическое действие каннабиноидов с другими биологически активными молекулами, создание комбинированных препаратов с CBNM может быть важным шагом в развитии мультицелевых терапевтических стратегий.
В исследованиях рецепторной селективности
Применение CBNM в исследованиях рецепторной селективности стало важным шагом в понимании того, как модификации структуры каннабиноидов могут изменять их взаимодействие с различными типами рецепторов. CBNM способен взаимодействовать не только с каннабиноидными рецепторами типа 1 и 2 (CB₁ и CB₂), но и с другими типами мембранных рецепторов, что делает его важным молекулярным инструментом в изучении каннабиноидной системы.
Особенный интерес представляет селективность CBNM к CB₁-рецепторам, которые часто являются объектами исследований по воздействию каннабиноидов на центральную нервную систему. По результатам исследований, CBNM демонстрирует более высокое сродство к CB₁-рецепторам по сравнению со многими другими каннабиноидами, что может сделать его полезным инструментом в разработке лекарственных средств, направленных на лечение расстройств центральной нервной системы, таких как тревожные состояния, депрессии или хроническая боль. В то же время селективность CBNM к CB₂-рецепторам предоставляет ему перспективы в терапии периферических воспалительных процессов и аутоиммунных заболеваний.
Особым преимуществом CBNM является его способность взаимодействовать с рецепторами, не относящимися к каннабиноидной системе. Например, было доказано, что CBNM способен взаимодействовать с серотониновыми рецепторами (5-HT₁A), что открывает новые возможности для изучения связей между каннабиноидной и серотониновой системами. Это может иметь важные последствия для разработки терапевтических стратегий лечения депрессии, тревожных расстройств и даже посттравматических стрессовых расстройств.
Благодаря своей способности к селективному связыванию с различными подтипами каннабиноидных рецепторов и другими классами рецепторов, CBNM открывает новые перспективы в фармакологии. Изучение рецепторной селективности позволяет понять, как изменения в структуре молекулы могут способствовать разработке препаратов, нацеленных на определённые механизмы действия, при этом минимизируя побочные эффекты, характерные для классических каннабиноидов.
Правовой статус
Правовой статус метилового эфира каннабинола (CBNM) представляет собой сложную и многогранную тему, охватывающую широкий спектр юридических, регуляторных и этических вопросов. Он в значительной степени зависит от юрисдикции, в которой данное соединение рассматривается, поскольку законодательство в отношении каннабиноидов и их производных остаётся неоднозначным и различается от страны к стране. Поскольку CBNM является частью каннабиноидной группы соединений, его правовой статус часто пересекается с правовым статусом других каннабиноидов, таких как ТГК (тетрагидроканнабинол) и КБД (каннабидиол).
Регуляторная неопределённость
Регуляторная неопределённость, окружающая CBNM, является одним из основных вызовов для его легального использования и научного исследования. Большинство стран до сих пор не имеют чётко определённого правового статуса для метиловых эфиров каннабиноидов, включая CBNM. Это значительно осложняет изучение и применение этого соединения в фармацевтической отрасли, а также создаёт определённые трудности для учёных и компаний, стремящихся к разработке препаратов на основе таких молекул.
Истинная правовая неопределённость возникает из-за различий в подходах к законодательному регулированию каннабиноидов и их производных. В некоторых странах, где каннабис и его производные строго контролируются, CBNM может подпадать под запрет из-за химического сходства с другими каннабиноидами, такими как ТГК. В таких юрисдикциях даже незначительные модификации структуры каннабиноидов могут привести к тому, что соединения будут классифицированы как наркотические средства, независимо от их фармакологических свойств.
В то же время в странах, где каннабис и его производные декриминализированы или даже легализованы для медицинского применения, регуляторы могут быть более открыты к исследованию и разрешению на использование новых каннабиноидных соединений, включая CBNM. Однако даже в таких юрисдикциях зачастую отсутствуют чёткие нормативные документы, определяющие статус и требования к производству, обороту и использованию подобных соединений.
Одним из ключевых аспектов, усложняющих ситуацию, является отсутствие в большинстве стран специализированных нормативных актов для новых каннабиноидов, таких как метиловый эфир каннабинола. Законодательство, регулирующее старые, хорошо изученные каннабиноиды, часто не содержит положений для новых соединений с модифицированной структурой, из-за чего учёные и предприятия вынуждены действовать в условиях правовой неопределённости.
Отсутствие классификации
Отсутствие чёткой классификации CBNM как отдельной категории химических соединений представляет собой ещё одно серьёзное препятствие на пути его изучения и коммерциализации. Классификация каннабиноидов чрезвычайно важна для создания правовой базы, определяющей порядок их производства, продажи и использования. В то время как некоторые страны уже имеют законодательные акты, регулирующие каннабиноиды, большинство из них сосредоточены на ТГК, КБД и их метаболитах, не устанавливая чётких норм для новых каннабиноидов, таких как CBNM.
Это создаёт правовую «серую зону» для тех, кто хочет работать с CBNM, поскольку соединение не попадает ни в одну из известных юридических категорий, таких как «наркотические средства», «психотропные вещества» или «лекарственные препараты». Такая ситуация затрудняет использование метилового эфира каннабинола в медицинских исследованиях, поскольку отсутствие классификации может привести к тому, что исследования с этим каннабиноидом не будут признаны соответствующими нормативными органами или даже будут приостановлены из-за юридических сложностей.
Более того, отсутствие чёткой классификации также осложняет развитие инфраструктуры для тестирования и сертификации CBNM как лекарственного средства или пищевой добавки. В странах, где не существует специфического регулирования для таких соединений, лаборатории и компании могут быть ограничены в возможности проводить необходимые исследования для получения разрешения на коммерциализацию продуктов на основе CBNM.
Классификация CBNM имеет большое значение не только для его правового статуса, но и для безопасности и эффективности препаратов на его основе. Чёткая правовая классификация позволит обеспечить соответствующие стандарты качества, контроля и испытаний, что важно для создания безопасных и эффективных лекарственных средств.
Сложности легального синтеза в некоторых юрисдикциях
Сложности легального синтеза CBNM в некоторых юрисдикциях связаны с правовыми нормами, регулирующими производство и использование каннабиноидов. В странах, где каннабис и его производные находятся под строгим контролем, процесс получения разрешения на синтез CBNM может быть затруднён из-за жёстких регуляций, ограничивающих производство даже в исследовательских целях.
Для синтеза CBNM в таких юрисдикциях необходимо пройти многоступенчатую процедуру лицензирования, включающую проверку на безопасность, контроль качества и соответствие стандартам. Это может требовать значительных ресурсов и времени, что создаёт серьёзные барьеры для учёных и предприятий, желающих работать с этим соединением.
В некоторых странах также существуют дополнительные правовые препятствия из-за того, что, даже если синтез CBNM разрешён, производители могут быть ограничены в использовании определённых химических веществ, необходимых для его синтеза. Например, ограничения на использование прекурсоров для синтеза каннабиноидов могут затруднить получение необходимых материалов для производства CBNM.
Сложности также усугубляются международными соглашениями, регулирующими оборот каннабиноидов, в частности Конвенцией ООН о наркотических средствах 1961 года. Поскольку CBNM является частью широкой группы каннабиноидных соединений, международные соглашения могут требовать от государств определённых ограничений, даже если соединение имеет медицинское применение или потенциал для научных исследований. Это ограничивает свободу исследований и разработок, снижая темпы научного прогресса в данной области.
Потенциал для исследований
SAR-исследования
Исследования структура-активность (SAR) являются неотъемлемой частью научных исследований в области химии каннабиноидов, в частности таких соединений, как метиловый эфир каннабинола (CBNM). SAR позволяют учёным оценить, как изменения в химической структуре молекулы влияют на её биологическую активность, что имеет решающее значение для разработки новых лекарств. В контексте CBNM исследования SAR имеют особую значимость, поскольку позволяют выявить, какие конкретные модификации структуры метилового эфира каннабинола могут способствовать улучшению его фармакологических свойств, таких как высокая биоактивность, селективность или терапевтический эффект.
Процесс SAR-исследований включает изучение различных модификаций молекулы, в частности изменений функциональных групп, таких как метильные или гидроксильные группы, а также анализ влияния этих изменений на взаимодействие с конкретными рецепторами или другими молекулярными мишенями. Для CBNM это имеет особое значение, так как благодаря метилированию молекула может демонстрировать изменённый профиль связывания с рецепторами CB1 и CB2 каннабиноидной системы. Поэтому исследования SAR позволяют оценить, насколько структурные изменения могут усилить или ослабить эффекты CBNM в различных биологических контекстах, таких как анальгезия, нейропротекция или анксиолитическая активность.
В ходе SAR-исследований могут использоваться различные методы, такие как молекулярное моделирование, которое позволяет предсказать потенциальные эффекты определённых модификаций молекулы на молекулярном уровне. Кроме того, обязательными являются биологические тесты на животных или клеточных культурах для подтверждения полученных теоретических результатов. Также SAR-исследования позволяют оценить токсичность и безопасность молекул, что особенно важно при разработке новых терапевтических средств на основе CBNM.
Наибольший потенциал для SAR-исследований CBNM заключается в том, что метильная группа может быть важным фактором изменения свойств молекулы, что открывает возможности для создания новых классов лекарственных средств, способных оказывать специфическое воздействие на каннабиноидные рецепторы, в частности снижение побочных эффектов, связанных с другими каннабиноидами. Кроме того, благодаря тому, что CBNM является производным каннабинола, уже обладающего установленной активностью, его модификация через SAR может стать путём к созданию более эффективных и безопасных терапевтических соединений.
Создание библиотек производных
Одним из ключевых направлений исследования метилового эфира каннабинола (CBNM) является создание библиотек производных, позволяющих тестировать широкий спектр молекул и выявлять новые соединения с потенциальной биологической активностью. Такая библиотека представляет собой важный инструмент в процессе разработки новых терапевтических средств, поскольку позволяет обнаружить молекулы, обладающие улучшенной активностью, высокой селективностью и сниженной токсичностью по сравнению с традиционными каннабиноидами, такими как ТГК и КБД.
Библиотеки производных метилового эфира каннабинола могут включать сотни или тысячи вариаций молекул, различающихся по структуре, в частности по изменениям в различных частях молекулы, например, в алкильных цепях, функциональных группах или в расположении атомов в молекуле. Важно отметить, что даже незначительные изменения в структуре могут привести к значительным изменениям в биологической активности молекул, что делает создание таких библиотек важным этапом в разработке новых каннабиноидных препаратов. Тестирование этих производных на различные биологические мишени позволяет выявить молекулы с улучшенными характеристиками, такими как повышенная биодоступность, более продолжительный эффект или сниженная токсичность.
Составление библиотеки производных для CBNM предполагает использование современных методов химического синтеза, которые позволяют быстро и эффективно получать большое количество производных. Кроме того, для каждого из таких производных важно проводить доклинические тесты для оценки их биологической активности, что может включать тестирование на клеточных культурах, а также изучение их влияния на рецепторы CB1 и CB2, а также на другие возможные мишени, такие как TRPV1 (канал, участвующий в передаче боли).
Благодаря такой библиотеке можно сформировать ценные данные для последующих клинических исследований, а также для совершенствования стратегий лечения различных заболеваний, таких как хроническая боль, воспалительные процессы, депрессия и другие состояния, связанные с каннабиноидной системой. Библиотеки производных также позволяют выявить молекулы, которые могут быть потенциально полезными в других областях медицины, таких как нейродегенеративные заболевания или даже как возможные противоопухолевые терапии.
Биомодель для тестирования
Тестирование новых соединений, таких как метиловый эфир канабинола, требует использования различных биомоделей для оценки эффективности и безопасности. Важным этапом является создание биомоделей, способных симулировать условия, максимально приближённые к человеческому организму, с целью проверки действия CBNM на уровне целого организма. Выбор биомодели напрямую зависит от целей исследования, однако существует несколько подходов, которые позволяют провести всестороннее тестирование каннабиноидных производных, таких как CBNM.
Одним из наиболее распространённых подходов является использование животных моделей. Чаще всего применяются модели на мышах и крысах, поскольку они позволяют удобным способом проверять токсичность, фармакокинетику и фармакодинамику новых соединений. Эти модели также дают возможность изучать влияние каннабиноидных соединений на различные физиологические процессы, такие как болевая чувствительность, воспаление, нейропротекция, а также эмоциональные реакции, например тревожность или депрессивные состояния. Кроме того, такие тесты могут использоваться для изучения побочных эффектов, включая влияние на сердечно-сосудистую систему или на функции печени и почек.
Другим важным подходом является использование клеточных культур, в частности первичных культур нервных или иммунных клеток, для исследования влияния CBNM на молекулярные мишени. Такой подход позволяет изучить механизмы действия на клеточном уровне и определить точные пути, через которые соединение может оказывать своё действие. Например, можно исследовать активацию или ингибирование каннабиноидных рецепторов CB1 или CB2, или изучать эффекты нейропротекции в клеточных моделях нейродегенеративных заболеваний.
Биомодели для тестирования играют ключевую роль в обеспечении эффективности и безопасности метилового эфира канабинола, и они способствуют формированию базы данных, необходимой для последующих клинических испытаний. Поэтому создание и использование таких биомоделей представляет собой важнейший этап в процессе разработки новых каннабиноидных препаратов и обладает значительным потенциалом для совершенствования медицинских терапий.
Заключение
Метиловый эфир канабинола (CBNM) является перспективным соединением в области исследований каннабиноидов и открывает широкие возможности для разработки новых терапевтических средств. Его химическая структура, включающая метильную группу, играет значительную роль в определении его биологической активности, что, в свою очередь, позволяет варьировать его свойства с целью достижения желаемых фармакологических эффектов. Несмотря на значительные научные достижения, исследования CBNM всё ещё находятся на стадии активного развития, и многие аспекты его потенциала остаются неизученными.
Применение CBNM в фармакохимии требует дальнейшего изучения его воздействия на различные биологические мишени, в частности на каннабиноидные рецепторы CB1 и CB2. Разнообразные исследования в рамках анализа структуры-активности (SAR) и создание библиотек производных могут открыть новые пути к разработке специфических соединений с минимальными побочными эффектами. Одновременно с этим, биомодели для тестирования позволяют оценить эффективность и безопасность CBNM на клеточном и организменном уровнях, что является важным этапом на пути к клиническим испытаниям.
Регуляторные и правовые вопросы, связанные с CBNM, по-прежнему остаются значительным барьером для его внедрения в фармацевтическую практику. Неопределённость в регулировании, отсутствие чёткой классификации и сложность легального синтеза в ряде юрисдикций могут замедлить исследования и коммерциализацию этих соединений. Поэтому важно разрабатывать правовые рамки, которые обеспечат доступ к этим молекулам для научных исследований и их последующего использования в медицине.
Кроме того, исследовательский потенциал CBNM проявляется не только в контексте фармакологии, но и в изучении его биоактивности, что открывает возможности для создания новых лекарственных средств, способных действовать через различные рецепторные механизмы. Более детальные исследования, посвящённые метилированию фенольной группы, катализу, а также биологическому потенциалу, могут привести к значительным достижениям в науке о каннабиноидах.
Таким образом, несмотря на высокий потенциал метилового эфира канабинола для разработки новых терапевтических средств, для его эффективного применения необходимо проводить дальнейшие исследования его структуры, активности и механизмов действия. Разработка новых биологических моделей, создание библиотек производных, совершенствование аналитических методов и нормативно-правовое регулирование — всё это является составными частями, которые будут способствовать будущему успеху в области каннабиноидной терапии.
Источники:
- Google Scholar (https://scholar.google.com/) — универсальный инструмент для поиска научных статей, книг, тезисов, патентов, подходящий для проведения научных исследований по широкому кругу тем, включая каннабиноиды и их метильные производные.
- PubMed (https://pubmed.ncbi.nlm.nih.gov/) — база данных Национальной медицинской библиотеки США, предоставляющая доступ к миллионам статей по медицине, фармакологии и биологии. Содержит множество публикаций о каннабиноидах, их биологической активности и терапевтическом потенциале.
- ScienceDirect (https://www.sciencedirect.com/) — один из крупнейших научных ресурсов для доступа к исследованиям в области науки и медицины. Здесь можно найти множество статей по химии, биологии и фармакологии.
- Wiley Online Library (https://www.wiley.com/en-us) — другой важный источник научных публикаций в области фармацевтики, химии и медицинских наук, включая исследования по каннабиноидам и их метильным производным.
- SpringerLink (https://link.springer.com/) — одна из крупнейших платформ академических публикаций, охватывающая все области науки, включая фармакологию и химию. Здесь можно найти исследования по механизмам действия каннабиноидов и их метильных производных.
- Nature (https://www.nature.com/) — ведущий научный журнал, публикующий материалы по химии, фармакологии и биотехнологии. В частности, статьи, посвящённые последним разработкам в области каннабиноидов и их метильных производных, доступны на этом ресурсе.
- JSTOR (https://www.jstor.org/) — академическая база данных научных статей, содержащая исследования в области химии и фармакологии, включая работы по метилированию органических соединений, таких как каннабиноиды.
- Scopus (https://www.scopus.com/) — одна из крупнейших платформ для поиска научных публикаций и цитирований, позволяющая находить актуальные статьи на тему каннабиноидов и их метильных производных.
- American Chemical Society (ACS Publications) (https://pubs.acs.org/) — один из наиболее авторитетных источников публикаций по химии. Здесь можно найти статьи, описывающие синтез и биологическую активность метильных производных каннабиноидов.
- Frontiers in Pharmacology (https://www.frontiersin.org/journals/pharmacology) — открытый журнал, публикующий исследования в области фармакологии, включая каннабиноиды и их роль в терапии.