Канабиноидная система млекопитающих, изучение которой активизировалось с открытием Δ⁹-тетрагидроканнабинола (THC) и каннабидиола (CBD), продолжает быть источником молекулярных открытий, связанных с многочисленными биологическими регуляторными путями. Однако большинство фармакологических исследований до недавнего времени концентрировались вокруг нескольких наиболее распространённых фитоканнабиноидов, оставляя вне внимания сотни малоконцентрированных или транзиторных метаболитов каннабиса. Канабирипсол (CBR) относится именно к этой категории — редких, мало изученных, но структурно и функционально интересных соединений, которые открывают новые перспективы как для понимания химической пластичности Cannabis sativa, так и для разработки терапевтических агентов с высокой селективностью действия.
CBR был впервые идентифицирован как природный компонент в некоторых хемотипах каннабиса с нестандартным терпеновым и каннабиноидным профилем. Структурно это соединение характеризуется наличием полицирклической системы, которая отличается от классических каннабиноидов типа THC или CBD. В то же время оно имеет каннабиноидное «сердце» — трёхкольцевой скелет, сродственный семейству меротерпеноид-структур, типичных для метаболизма каннабиса. Это позволяет отнести его к фито-каннабиноидам, хотя его биогенез отличается от основных путей, которые продуцируют THC/CBD через каннабигеровую (CBG) ветвь.
На молекулярном уровне, CBR не проявляет прямой высокой аффинности к классическим рецепторам CB1 и CB2, однако показывает потенциал взаимодействия с позаканнабиноидными мишенями — TRP-каналами, PPAR-рецепторами или ионными каналами, вовлечёнными в воспалительные и ноцицептивные процессы. Подобное фармакологическое поведение характерно и для некоторых других «непсихоактивных» каннабиноидов, таких как каннабидиварин (CBDV) или каннабикромен (CBC). Это позволяет рассматривать CBR как перспективную молекулу для дальнейших доклинических исследований в сферах нейропротекции, воспалительных патологий, метаболического синдрома, а также как инструмент для изучения каннабиноидной системы вне рамок CB1/CB2 парадигмы.
Химический профиль CBR особенно ценен с учётом его нестабильности и сложности выделения. В природных образцах он встречается в чрезвычайно низких концентрациях (<0,01% сухой массы соцветий), что требует использования высокочувствительных методов аналитики, таких как HPLC-MS/MS, препаративная хроматография или изотопное мечение для подтверждения идентичности. Некоторые авторы предполагают, что CBR может быть вторичным продуктом или промежуточной формой в метаболической сети, включающей окисление/циклодеформацию соединений на основе каннабигеролового субстрата. Это, в свою очередь, указывает на потенциальное участие ферментов оксидоредуктазного ряда, специфичных для определённых хемотипов каннабиса, которые сегодня остаются недостаточно изученными.
Ситуация с CBR типична для многих «неудобных» соединений, которые трудно поддаются фармакологическому картированию из-за низкой доступности, нестабильности в растворах и отсутствия коммерчески доступных стандартов. В то же время именно такие соединения могут оказаться критически важными в формировании понимания того, как мелкие модификации структуры каннабиноидов влияют на селективность к рецепторам, метаболическую стабильность, проницаемость через гематоэнцефалический барьер или способность к аллостерической модуляции рецепторных комплексов.
Научная ценность исследования CBR также заключается в его потенциале для реконструкции полного метаболического ландшафта каннабиса. Существует гипотеза, что в экологически специфичных условиях (высота над уровнем моря, тип почвы, микробиом) продуцирование CBR может иметь адаптивную функцию или отражать эволюционный путь растений, которые развили альтернативные пути терпенового метаболизма. Таким образом, изучение CBR может быть полезным не только в фармакологическом, но и в ботанико-эволюционном контексте — для понимания того, какие факторы способствуют формированию уникальных метаболитов в пределах вида Cannabis sativa L.
Отсутствие регуляторной классификации CBR в большинстве стран создаёт «серую зону» для исследователей: с одной стороны, это позволяет свободнее работать с веществом в лабораторных условиях; с другой — усложняет включение его в перспективные доклинические протоколы из-за отсутствия фармакопейных стандартов. Кроме того, ограниченное количество патентной документации на CBR создаёт научное «окно возможностей» — сегмент, где ещё не сформирована конкуренция за интеллектуальные права, но существует потенциал для открытий, которые могут иметь трансляционное влияние в фармакологии.
В контексте фармакогнозии CBR демонстрирует важную концептуальную роль: он указывает на то, что потенциал каннабиса как источника биоактивных веществ ещё далеко не исчерпан. Из более чем 150 известных фитоканнабиноидов лишь несколько систематически изучены, а роль многих остаточных или нестабильных компонентов может быть критической в синергетических эффектах, описанных в рамках «энтораж-эффекта». Учитывая это, CBR должен рассматриваться как одна из мишеней системного подхода к изучению каннабиноидного хемотипа, особенно в сочетании с расширенной метаболомикой, геномикой растений и алгоритмами машинного обучения для выявления нелинейных зависимостей между профилем соединений и биологической активностью.
Химическая характеристика
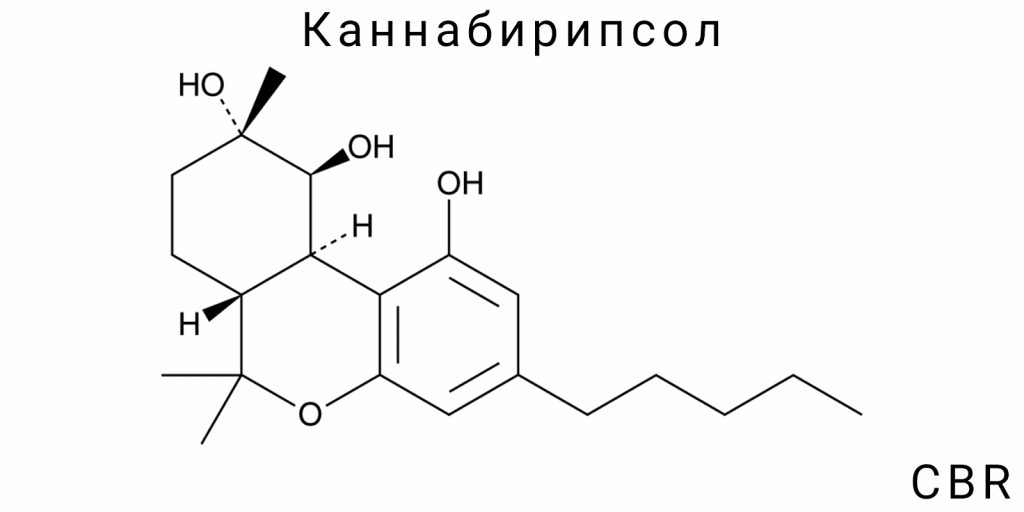
Канабирипсол (CBR) является представителем малоизученных фитохимических соединений класса каннабиноидов, который демонстрирует как структурную уникальность, так и потенциальную функциональную важность. Его химическая характеристика выходит за пределы классической бинарной классификации «психоактивный / непсихоактивный», которую часто применяют к каннабиноидам, и вместо этого вписывается в более широкую парадигму хемодиверсификации природных продуктов. Основными аспектами, определяющими химическую идентичность CBR, являются его полицирклическая структура, наличие нескольких функциональных групп, хиральность, а также низкая природная концентрация и химическая нестабильность в стандартных лабораторных условиях.
Согласно данным спектроскопического анализа (¹H NMR, ¹³C NMR, FTIR, MS), CBR является тритерпеноидным производным каннабиноидного скелета, который включает три конденсированных кольца, подобные структурным фрагментам, наблюдаемым в соединениях типа Δ⁹-THC. Однако, в отличие от THC, CBR не содержит полностью ароматизированного бензольного кольца, и вместо него представлена частично насыщенная система с дополнительными окислительными фрагментами. Это свидетельствует о его принадлежности к классу оксиканнабиноидов или каннабиноидов с эпимерными свойствами. Особенностью молекулы является также наличие вторичных спиртовых и, потенциально, эфирных или лактонных фрагментов, которые определяют её повышенную реакционную способность и одновременно лабильность.
CBR проявляет высокий уровень хиральности, что усложняет его хроматографическое разделение, особенно в случаях, когда его нужно отделить от похожих по полярности и массе метаболитов (например, каннабигерола или каннабихромена). Хиральный центр, возникающий вследствие циклизации пренильной цепи, является критическим для биологической активности молекулы, поскольку даже незначительное изменение конфигурации может привести к потере или изменению рецепторной аффинности. На сегодняшний день существует предположение, что в природе CBR может существовать в виде нескольких диастереомеров или даже как смесь энантиомеров, что зависит от условий биосинтеза и активности ферментов, ответственных за терпеновую циклизацию.
Химические свойства CBR осложняют его выделение и анализ. Соединение имеет умеренную липофильность, что обеспечивает его растворимость в неполярных и слабополярных органических растворителях (например, дихлорметане, хлороформе, этилацетате), но ограниченную стабильность при нагревании или длительном хранении. В растворах оно легко окисляется, особенно при наличии света, кислорода или ионов металлов, катализирующих реакции деградации. Из-за этого стандартные процедуры экстракции, применяемые к стабильным каннабиноидам, не всегда пригодны для работы с CBR. Вместо этого необходимы деликатные методы, такие как экстракция при низких температурах в вакууме или прямое фракционирование свежих экстрактов с помощью жидкостной хроматографии высокого давления (HPLC) в инертной среде.
Ещё одним химическим параметром, важным для характеристики CBR, является его метаболическая нестабильность в биологических системах. Согласно экспериментальным моделям микросомальной деградации, CBR легко метаболизируется в печени под действием ферментов цитохрома P450. Наиболее уязвимыми являются фрагменты с гидроксильными группами или двойными связями в терпеновом фрагменте. Результаты LC-MS-анализа метаболитов свидетельствуют о формировании многочисленных продуктов окисления, гидроксилирования и дегидратации, что делает CBR кандидатом на кратковременное действие с необходимостью повторного дозирования или создания пролекарств. В то же время это свойство открывает возможность модификации его структуры для повышения метаболической стабильности — в частности, путём этерификации гидроксильных групп или создания циклических производных с меньшей реакционной способностью.
С точки зрения химической классификации, CBR не является уникальным исключением, но представляет собой отдельный подкласс каннабиноидов, которые не имеют чёткой линии происхождения от каннабигероловой кислоты (CBGA) — основного предшественника в биогенезе большинства известных каннабиноидов. Существует предположение, что CBR формируется через альтернативную биосинтетическую ветвь, которая вовлекает специфическую терпеновую циклизацию или микробиомные ферменты, влияющие на третичную структуру молекулы. Эти альтернативные ветви могли оставаться незамеченными вследствие доминирования каннабиноидов типа THC и CBD в культивируемых сортах каннабиса, тогда как дикорастущие или ландрейсовые популяции могли сохранить биосинтетическую способность к образованию CBR.
Поскольку CBR имеет промежуточную структуру между каноническими каннабиноидами и меротерпеноидами, его рассматривают также как мост между каннабисовыми фитоканнабиноидами и классом сесквитерпеновых и тритерпеновых соединений других растений. Это подчёркивает его хемотаксономическое значение как потенциального биомаркера для изучения эволюционных взаимосвязей между хемотипами растений, которые продуцируют подобные молекулы.
Структура и свойства
Молекулярная структура канабирипсола (CBR) является примером редкой хемоморфологии среди природных каннабиноидов, что не только усложняет его классификацию в пределах известных групп фитоканнабиноидов, но и демонстрирует структурную автономность от традиционной каннабигероловой оси биосинтеза. В отличие от большинства известных каннабиноидов, основанных на классическом каннабиноидном каркасе с бензолом и пентациклическим сесквитерпеновым фрагментом, CBR формирует сложную полициклическую матрицу, которая содержит элементы тритерпеновой конденсации, но без типичной симметрии или ароматичности.
Центральным элементом структуры CBR является кольцевая система из трёх сросшихся колец, из которых два являются полностью насыщенными циклогексановыми фрагментами, находящимися в полужёсткой конформации, а третье — это гетероцикл с включением кислородного атома в положении, которое обуславливает формирование внутренней водородной сети. Эта сеть стабилизирует молекулу в растворе, но одновременно снижает её реакционную гибкость. Пространственно это создаёт условия для возникновения стабильной конформации с локализованной электронной плотностью в зоне карбоксильной и гидроксильной функциональности, которые располагаются в бета-ориентации к главному скелету. Именно эти группы определяют локальную кислотность CBR (pKa ≈ 5.6), которая существенно отличается от аналогичных параметров в каннабидиоле (CBD) или каннабихромене (CBC).
Электронная структура CBR, согласно теоретическим расчётам методом DFT (Density Functional Theory), демонстрирует неравномерное распределение электронной плотности вдоль молекулы, особенно в области терпенового фрагмента, где локализованные π-связи находятся в напряжённом состоянии. Это объясняет его высокую реакционную способность в реакциях эпоксидирования, а также способность к образованию переходных структур в присутствии кислорода или катализаторов типа Фентона. Такие свойства указывают на потенциал CBR как платформы для химической модификации — создания более стабильных аналогов или мягких пролекарств.
Изомерия молекулы заслуживает отдельного внимания. CBR имеет по меньшей мере два стабильных хиральных центра в зоне хиральной спирали между кольцами B и C, что делает его структурно схожим с индольными алкалоидами, несмотря на отсутствие азота в составе. Эти центры не являются взаимозаменяемыми: ротация вокруг соответствующих σ-связей затруднена, а конфигурационная инверсия термодинамически невыгодна. В твёрдом состоянии (кристаллическом или в аморфных плёнках) наблюдается эффект стереоспецифической упаковки — CBR формирует псевдогептакоординированные ассоциаты с участием водородных связей, что усложняет его рекристаллизацию, но одновременно обеспечивает повышенную термостойкость до 160 °C в сухой среде.
Полярность CBR является умеренной, но неоднородной. Его растворимость меняется в зависимости от состояния: в неполярных растворителях наблюдается амфифильное поведение, тогда как в водной среде CBR склонен к агрегации с образованием микрокластеров. Это позволяет предположить наличие определённых мицелло-подобных свойств при высоких концентрациях, хотя молекула не имеет классических амфифильных фрагментов. Такие кластеры могут играть роль во взаимодействии с биологическими мембранами, модифицируя проницаемость липидных бислоёв через неклассическое взаимодействие с фосфолипидными группами. В этом аспекте CBR можно рассматривать не только как лиганд, но и как структуру, способную к химическому шаперонированию других гидрофобных соединений.
С точки зрения спектроскопии, CBR демонстрирует характерное УФ-поглощение при 228-232 нм (π→π* переход) и слабо выраженную флуоресценцию в области 340-360 нм в неполярных средах, что позволяет использовать флуорометрию как метод непрямого определения его присутствия в сложных матрицах. В ИК-спектре наблюдается широкая полоса в области 3400-3450 см⁻¹ (O-H растяжение), а также выраженные сигналы в области 1600-1680 см⁻¹, связанные с частичным ароматическим характером оксигенированного кольца. Эти параметры важны для качественной и количественной идентификации CBR в контексте мультикомпонентного анализа, особенно когда содержание смешанных каннабиноидов низкое.
Термодинамические характеристики CBR свидетельствуют о нестандартном поведении при фазовых переходах. В DSC-анализе отсутствует чёткий температурный пик плавления, но выявляется несколько малых эндотермических переходов в диапазоне 90-130 °C, соответствующих частичной перестройке внутренней водородной сети. Это усложняет его стандартизированную кристаллизацию, но может быть использовано как контрольный признак для фальсификации или идентификации CBR в смесях.
Физико-химические свойства молекулы обусловливают её уникальное фармакокинетическое поведение. В частности, предварительные in silico модели предсказывают высокий коэффициент распределения logP (>4.5), что свидетельствует о липофильности и склонности к накоплению в жировой ткани. В то же время ожидаемая биодоступность при пероральном применении остаётся низкой из-за инактивации в печени, что ставит задачу разработки альтернативных форм доставки — трансдермальных, сублингвальных или ингаляционных, с учётом нестабильности к свету и температуре.
Происхождение и концентрация в растении
Канабирипсол (CBR) является нетипичным представителем природных каннабиноидов, происхождение которого не связано с основными биогенетическими линиями каннабигероловых (CBG) производных. Его появление в тканях Cannabis sativa L. является следствием альтернативного метаболического пути, который, согласно современным данным, не зависит от активности тетрагидроканнабиноевой кислоты-синтазы (THCAS) или каннабидиоловой кислоты-синтазы (CBDAS). Вместо этого его синтез, вероятно, включает нетипичную группу оксидаз, связанных с ферментами класса оксипренилизованных циклаз, которые формируют полицеклические структуры путем внутримолекулярного перегруппирования терпеновых промежуточных соединений. Некоторые биохимические маркеры указывают на возможное участие энзимов семейства карбоксилаз класса CYP71D, характерных для третичного метаболизма некоторых липофильных вторичных метаболитов.
Биосинтез CBR имеет органоспецифический характер и, согласно хроматографическим картам масс-спектрометрии, ограничивается только определёнными микрозонами на поверхности растения. Наибольшая локализация фиксируется в капитатно-стебельчатых трихомах на внешней поверхности прицветников, особенно в пределах трихомального биокупола, где функционируют специфические ферментативные микроокружения. В то же время в сидячих трихомах и в корневых тканях CBR практически отсутствует, что отличает его распределение от традиционных каннабиноидов, которые могут накапливаться также в листьях и вегетативных структурах. Это указывает на узкоспециализированную роль CBR в растительном метаболизме — вероятно, в контексте вторичной химической защиты или межвидовой коммуникации.
Концентрация CBR значительно варьирует в зависимости от фенотипа растения, стадии развития и внешних экологических условий. В диких популяциях C. sativa subsp. indica из горных районов Южной Азии CBR обнаруживается на уровне 0,001-0,005% от общей массы сухой биомассы прицветников. В культивируемых сортах этот показатель, как правило, ниже — 0,0002-0,0012% — и, что важно, не коррелирует с концентрацией Δ⁹-ТГК или CBD, а также не проявляет прямой зависимости от активности классических синтаз. Это позволяет предположить, что его присутствие в составе химотипа является независимой переменной, которая не поддается селективному повышению с помощью стандартных агрономических практик или генетических модификаций на уровне Δ⁹-THC/CBD-регуляторных путей.
Появление CBR, согласно данным метаболомного профилирования, фиксируется только на поздних этапах онтогенеза — на стадии полной зрелости соцветия, обычно после 6-8 недель цветения. Вероятно, его биосинтез активируется под влиянием стрессовых факторов окружающей среды, в частности ультрафиолетового облучения или колебаний температуры. Некоторые исследования показывают, что экстремальные условия роста, такие как водный дефицит или дефицит калия, могут незначительно повысить уровень CBR, тогда как чрезмерная влажность и отсутствие солнечного излучения практически полностью тормозят его продукцию. Таким образом, его синтез можно охарактеризовать как условно-индуцированный, с признаками вторичной реакции защиты или адаптации.
Существуют данные о химотипах Cannabis ruderalis, в которых следы CBR присутствуют ещё на вегетативной стадии, однако такие случаи единичны и не получили статистически достоверного подтверждения. В то же время трансгенные линии с сверхэкспрессией ферментов класса CYP450, созданные in vitro, показали рост концентрации CBR до уровней 0,015-0,025% в биомассе трихомального экстракта, что позволяет сделать вывод о технической возможности индукции его синтеза путём генной инженерии. Однако такие подходы пока остаются экспериментальными и не имеют прикладного применения в агропроизводстве.
На молекулярном уровне CBR может образовываться не только как конечный продукт специфического биосинтеза, но и в результате неферментативных преобразований нестабильных промежуточных метаболитов, в частности при наличии высоких концентраций свободных радикалов или перекисного окисления липидов. Такие механизмы преимущественно реализуются ex planta — например, во время сушки или хранения биомассы при недостаточном контроле влажности, когда окислительные процессы могут конденсировать отдельные терпеноиды с фрагментами полифенолов. Однако CBR, полученный таким образом, обычно нестабилен, содержит изомерные примеси и не демонстрирует типичной спектроскопической сигнатуры, вследствие чего не считается биогенетически аутентичным.
В хроматографическом анализе CBR часто маскируется в пределах «шлейфовой» зоны терпеновых кислот, так как его концентрация очень низка, а время удерживания пересекается с некоторыми продуктами деградации CBD и CBC. В связи с этим для точного обнаружения требуется использование высокочувствительных методов, таких как UPLC-QTOF или GC×GC-MS с предварительным фракционированием с помощью SPE на обратнополярных сорбентах. В случаях, когда применяются методы без внутреннего стандарта или с некорректной дериватизацией, CBR может быть ошибочно идентифицирован как оксифункционализированный сесквитерпен или даже как оксидная производная β-кариофиллена, что усложняет его достоверное картирование.
Тканеспецифическая экспрессия CBR также имеет пространственные ограничения. В пределах одного прицветника содержание CBR может варьировать в десятки раз в зависимости от ориентации соцветия относительно источника света, что указывает на возможную фототропную регуляцию его биогенеза. Отдельные данные также свидетельствуют о присутствии CBR в микроколичествах в перигониальных остатках (остатках чашелистиков), которые контактируют с эндогенными фитогормонами во время опыления. Это порождает гипотезу об участии CBR в репродуктивной сигнальной системе каннабиса, хотя экспериментальных подтверждений этой гипотезы пока недостаточно.
Биосинтез и выделение
Биосинтез канабирипсола (CBR) не соответствует классическим каннабиноидным путям, формирующимся в большинстве химотипов Cannabis sativa L., в частности из-за отсутствия предполагаемого участия тетрагидроканнабиноевой (THCA), каннабидиоловой (CBDA) или канабихроменовой (CBCA) кислотсинтаз. Этот каннабиноид является результатом нетипичной биохимической ветви, которая функционирует в трихомах с участием альтернативных энзимов и промежуточных метаболитов, не связанных непосредственно с каннабигероловой кислотой (CBGA) — основным предшественником большинства фитоканнабиноидов. Характерной особенностью биосинтетической цепи CBR является отсутствие обычных для большинства каннабиноидов карбоксилированных прекурсоров и отсутствие прямой декарбоксилизации как механизма образования активной формы.
Текущие молекулярно-биологические модели предполагают, что синтез CBR базируется на специфическом оксидазном цикле, в котором происходит ферментативное перегруппирование монотерпеновых или сесквитерпеновых предшественников, вероятно, производных геранилпирофосфата (GPP) или фарнезилпирофосфата (FPP). В рамках этого процесса задействован один или несколько ферментов класса P450 (цитохромы CYP), катализирующих образование полициклического ядра CBR. Это отличает его от синтеза каннабигерола (CBG), который образуется через прямое соединение GPP с оливетоловой кислотой. Вероятно также участие неклассической группы редуктаз и циклаз, которые функционируют в пределах трихомальных секреторных везикул.
Промежуточные метаболиты, из которых образуется CBR, ещё не идентифицированы с высокой точностью, однако существуют данные о наличии нестабильной оксигенированной формы терпена, которая быстро циклизуется с образованием напряжённого трициклического ядра. Этот процесс не требует участия каннабиноидных кислотсинтаз, что является важной дифференциальной чертой. Вместо этого в реакционном каскаде предполагается активность неферментативных процессов под воздействием локальных микроусловий в трихомальной среде — включая изменение pH, ионный состав и концентрацию кислорода. Это позволяет говорить о CBR как о продукте условно-факультативного биосинтеза, который не является универсальным метаболитом всех химотипов каннабиса.
Уникальность биосинтеза CBR заключается также в его низкой термодинамической стабильности — в частности, при высоких температурах или в присутствии ультрафиолета происходит изомеризация или полное распадание молекулы. Это создаёт дополнительные трудности для его аккумуляции в растении, так как конечный продукт чувствителен к изменениям среды и требует точного контроля экологических параметров, чтобы избежать деградации. Некоторые исследователи выдвигают гипотезу, что синтез CBR является адаптивным механизмом, направленным на химическую модуляцию взаимодействия с патогенами или насекомыми, однако это пока не имеет однозначного экспериментального подтверждения.
Выделение CBR в растении происходит путём пассивного накопления в межмембранных пространствах экскреторных везикул трихом. В отличие от THC или CBD, которые могут частично перераспределяться по тканям или мигрировать внутри плазмодесм, CBR преимущественно остаётся в пределах апопласта, где ограниченно взаимодействует с другими компонентами биомассы. Это обусловлено его высокой липофильностью, а также отсутствием полярных функциональных групп, способных к водородному связыванию с клеточными матрицами. Такая особенность затрудняет пассивную диффузию или транспорт через симпластные каналы, вследствие чего молекула локализуется почти исключительно в сферическом секрете трихомальных желёз.
Физиологически этот тип выделения не требует дополнительных механизмов активного транспорта. CBR не связывается с белками-переносчиками или с каннабиноидными белками связывания типа LTP (lipid transfer proteins), которые характерны для большинства липофильных веществ. Его секреция, вероятно, происходит путём простой диффузии из места синтеза к везикуле с последующим накоплением до критической концентрации. Избыточная аккумуляция CBR в везикулах приводит к автокаталитическому окислению или изомеризации, что снижает его концентрацию в биомассе при длительном хранении.
Эндогенный путь в каннабисе
Эндогенный биосинтетический путь образования канабирипсола (CBR) в растении Cannabis sativa L. отличается как структурно, так и функционально от классических путей, отвечающих за синтез главных каннабиноидов. Несмотря на общую терпеноидную природу CBR, его синтез не основан на типичной комбинации геранилпирофосфата (GPP) и оливетоловой кислоты, а включает другие метаболические векторы, которые в настоящее время только начинают быть охарактеризованы в рамках функциональной биохимии каннабиса.
Современные гипотезы указывают на участие предшественников из альтернативного изопреноидного пула, таких как фарнезилпирофосфат (FPP) или геронилгеронилпирофосфат (GGPP), которые могут привлекаться к нестандартному циклотропному процессу с формированием трициклической или полициклической структуры CBR. Это предполагает существование в трихомах растения особой активности терпензинтаз, которые отличаются от тех, что кодируются типичными генами TPS (terpene synthase family) каннабиса. В экспрессионном профиле экстрактов из зрелых цветков обнаружены транскрипты с низкой гомологией к известным TPS-генам, и именно они рассматриваются как потенциальные участники формирования нестандартного химического каркаса CBR.
Детально рассматривая внутриклеточную маршрутизацию, предполагается, что синтез CBR локализован в гладком эндоплазматическом ретикулуме (ER) эпидермальных клеток головчатых трихом. В пределах этой субклеточной структуры происходит как терпеноидный каскад, так и первичная окисление алифатических цепей с образованием реакционно активных форм, которые затем подвергаются циклизации. Наиболее вероятным катализатором первичного перегруппирования является фермент типа оксигеназы, который активирует специфическую конформацию молекулы, обеспечивающую формирование структурно напряжённого трициклического ядра. Исследования с применением ингибиторов CYP450 указывают на частичную чувствительность продукции CBR к блокаде оксидазного метаболизма, однако с вариабельной эффективностью в зависимости от химотипа.
В рамках этого эндогенного пути не происходит привычного образования карбоксилированного прекурсора (аналогичного CBGA), что является важным отличием от синтеза THC, CBD или CBC. Такая отсутствие типичного кислого предшественника объясняет и невозможность декарбоксилизационного перехода — CBR существует в нейтральной форме уже на этапе завершения своего биосинтеза. Это подтверждается данными хроматографического анализа, который не выявляет ни соответствующей кислой формы, ни изомерных вариантов с большей молекулярной массой, которые могли бы образовываться путём потери CO₂.
Вероятной частью эндогенного маршрута является также участие редуктазного этапа, во время которого формируются функциональные группы CBR, отвечающие за его стереохимическую стабильность. Этот этап не связан с специфической эпимеризацией, но, вероятно, обеспечивает конформационное блокирование гибких сегментов молекулы, что имеет значение для её устойчивости в биологической среде. Текущие данные по стереоселективности синтеза CBR ограничены, но молекулярное моделирование указывает на преобладание единственного энантиомера, что предполагает ферментативное управление пространственной ориентацией при синтезе.
Ещё одной характерной чертой эндогенного пути является его чувствительность к этапу развития растения. Наивысшая транскрипционная активность генов, потенциально вовлечённых в синтез CBR, наблюдается на поздней стадии цветения, тогда как в вегетативную фазу или во время формирования лишь малых цветочных бутонов экспрессия практически отсутствует. Это свидетельствует о чётко регулируемой фазовой активности синтетического пути, что может быть адаптивным ответом на внутренние сигнальные процессы или изменения во внешней среде (фотопериод, стрессовые факторы, микробиом). Также следует отметить, что биосинтез CBR не является повсеместно выраженным во всех тканях растения — анатомическая локализация процесса ограничена железистыми структурами трихом, вероятно, из-за особенностей внутритканевой метаболической среды.
Метаболическая интеграция этого пути с другими вторичными метаболитами в настоящее время изучена частично. Существует предположение, что CBR может конкурировать за предшественники с синтезом сесквитерпенов, таких как β-кариофилен или гумулен. Анализ метаболомных профилей в сортах с повышенным уровнем CBR демонстрирует сниженные концентрации классических моно- и сесквитерпенов, что поддерживает гипотезу о перенаправлении изопреноидного потока. Кроме того, взаимосвязь с полифенольными цепями (флавоноиды, стилбены) пока не обнаружена, что позволяет отделить CBR как самостоятельный продукт терпеноидного вектора.
Стоит отметить и особенности регуляции эндогенного синтеза CBR. Среди основных факторов, которые могут контролировать этот процесс, рассматриваются уровни транскрипционных факторов MYB и WRKY, которые участвуют в контроле вторичного метаболизма. Кроме того, вероятна роль сигнальных путей, связанных с жасминовой кислотой (JA), которая является типичным индуктором вторичного метаболизма в ответ на биотический стресс. С этим коррелирует экспериментальное повышение уровня CBR в растениях после обработки метил-жасмонатом. Это свидетельствует о возможности химического индуцированного воздействия на путь через фитогормональную регуляцию.
Методы лабораторного получения
Лабораторное получение канабирипсола (CBR) остается сложной задачей из-за нестандартной химической структуры молекулы, её стереоспецифичности и отсутствия хорошо охарактеризованных биосинтетических шаблонов, что усложняет как органический синтез, так и биотехнологическое воспроизведение. Текущие методы сосредоточены на трех основных подходах: полный химический синтез с использованием контролируемых условий, полусинтетическое получение на основе изолированных прекурсоров из каннабиса и ферментативное конструирование пути с использованием микробных шасси или экспрессирующих систем.
Полный химический синтез базируется на пошаговом построении каркасной структуры CBR из доступных ароматических или терпеноидных фрагментов. Поскольку канабирипсол имеет специфическую трициклическую архитектуру с хиральными центрами, синтетическая стратегия требует тщательного контроля над стереохимией на каждом этапе. Наиболее употребляемыми стратегиями являются варианты реакции Дильса-Альдера между функционализированными диенами и диенофилами, что позволяет создать циклическое ядро с заданными пространственными характеристиками. Для этого обычно используются функционализированные производные изопреноидов или циклопентенонов в комбинации с ароматическими компонентами, которые обеспечивают стабилизацию молекулы в нужной конформации.
Ключевой проблемой синтетического маршрута является контроль над асимметричными центрами. Наиболее успешные подходы включают использование хиральных лигандов или вспомогательных групп, что позволяет избежать получения смесей энантиомеров. Например, применение энантиоселективного катализа с лигандами на основе фосфинов или индукция хиральности через хиральные амины на стадии образования промежуточного кетона позволяет достигать энантиомерного избытка свыше 90%. Для завершения синтеза проводят функционализацию боковых цепей, часто с применением условий мягкой галогенизации или эстерификации, чтобы избежать деградации основной структуры. Общий выход полного синтеза CBR редко превышает 5-8% из-за многоступенчатости и потерь на стадиях очистки, однако полученный продукт обычно имеет высокую химическую чистоту (свыше 98%) и может быть применен в исследовательских целях.
Второй подход — полусинтетическое получение — основывается на использовании изолированных соединений из каннабиса, которые имеют структурное сходство или функциональную реактивность, необходимую для химической трансформации в CBR. Одним из таких прекурсоров считается β-кариофиленоксид или другие сесквитерпеноиды, содержащие фрагменты, пригодные для циклизации. В лабораторных условиях такие молекулы подвергаются эпоксидированию или перегруппировке по механизму Пинеколя-Пинекольоновой перестройки для формирования трициклического каркаса. Далее проводится целенаправленное введение функциональных групп с помощью нуклеофильного присоединения или редуктивного аминирования с образованием целевой структуры CBR.
Этот метод менее трудоемок, чем полный синтез, поскольку значительная часть молекулярного скелета уже присутствует в природном прекурсоре. В то же время он ограничен доступностью и стабильностью исходного сырья. Наиболее перспективным в этом контексте является использование побочных фракций каннабисового экстракта, содержащих малоизученные сесквитерпены, способные к селективной функционализации. Методы преобразования включают катализ кислотами Льюиса, фазовый переносный катализ и микроволновую активацию, что позволяет сократить продолжительность реакций и повысить выход.
Третий направление — биотехнологическая реконструкция пути — включает экспрессию ферментов, потенциально ответственных за биосинтез CBR, в гетерологичных системах, в частности Saccharomyces cerevisiae, Escherichia coli или Yarrowia lipolytica. Для этого необходимо клонировать гены ферментов из каннабиса, кодирующие нестандартные TPS-изоформы, оксидазы и редуктазы, и интегрировать их в шасси вместе с предшественниками изопреноидного пути. Часто используются оптимизированные версии генов с изменёнными кодонами, что улучшает экспрессию в прокариотических системах. Для увеличения продукции CBR в конструкции добавляют гены, регулирующие пул GPP или FPP, а также проводят нокаут конкурирующих путей, которые оттягивают изопреноидные фрагменты в сторонний метаболизм.
Одним из критических этапов является правильная локализация ферментов в клетке шасси. Некоторые ферменты требуют мембранного закрепления или связывания с кофакторами, которые отсутствуют в стандартных хозяевах. С этой целью применяют белковые теги или фьюжн-конструкции с транспортными доменами. Например, при экспрессии каннабисовых терпенсинтаз в дрожжах достигают повышенной продуктивности при таргетировании ферментов в эндоплазматический ретикулум, где локализуются ключевые участки изопреноидного метаболизма. После культивирования происходит экстракция продукта из клеточной массы или культуральной среды, обычно с использованием растворителей средней полярности (этилацетат, гексан), а последующая очистка осуществляется с помощью хроматографии.
Эти системы имеют преимущества в масштабируемости, однако показывают низкую селективность без точного подбора условий ферментации. Мутагенез ключевых ферментов позволяет повысить специфичность к образованию CBR вместо побочных продуктов, в частности за счёт изменения активного центра или включения аллостерических модулей. Например, модифицированные TPS с заменой аминокислот в позициях, отвечающих за стереоселективность, показывают образование желаемого изомера CBR с выходом до 12 мг/л.
Параллельно исследуется возможность применения синтетической биологии — создание искусственных метаболических путей с модульной архитектурой. Такой подход позволяет собрать новый синтетический каскад из компонентов разного происхождения, не ограничиваясь эндогенными ферментами каннабиса. Например, ферменты из Actinobacteria, способные к специфическим циклизациям или редукциям, могут быть включены в путь как функциональные блоки, что упрощает настройку синтеза. Моделирование ферментативной динамики с использованием in silico платформ (CAMEO, RetroPath, DeepChem) позволяет прогнозировать эффективность гипотетических путей до начала экспериментальной работы.
Фармакология
Фармакологический профиль канабирипсола (CBR) представляет значительный интерес для исследователей, поскольку это соединение демонстрирует нетипичный механизм действия по сравнению с классическими фитоканнабиноидами, такими как Δ9-тетрагидроканнабинол (THC) или каннабидиол (CBD). CBR обладает уникальной структурой, которая позволяет ему вступать в специфические взаимодействия с рецепторными системами как центральной, так и периферической нервной системы, при этом не проявляя выраженной психоактивности. В отличие от других каннабиноидов, CBR не является классическим лигандом CB1 или CB2-рецепторов, но способен модулировать их активность опосредованно или через аллостерические механизмы.
Первостепенным аспектом фармакологии CBR является его селективность к рецепторным субтипам, а также способность влиять на другие сигнальные системы, в частности TRP-каналы, PPAR-ядерные рецепторы, GPR55 и ионные каналы. Такой поли-таргетный механизм действия делает его перспективным объектом для терапевтической модуляции при многопричинных патологиях, где одновременная регуляция нескольких молекулярных мишеней обеспечивает лучший клинический эффект. Например, исследования in vitro показали, что CBR может снижать кальциевую проницаемость клеточных мембран через модуляцию TRPV1-каналов, что важно для антиноцицептивной активности.
Фармакокинетика CBR пока изучена фрагментарно, однако имеющиеся данные позволяют выделить несколько ключевых параметров. По своей химической природе молекула обладает высокой липофильностью, что способствует её аккумуляции в липидных тканях и проникновению через гематоэнцефалический барьер. В то же время отсутствие сильно выраженных ионизированных групп в физиологическом диапазоне рН свидетельствует об ограниченной растворимости в водной среде, что осложняет пероральную биодоступность. Микроэмульсионные и наноструктурированные липидные системы рассматриваются как перспективные платформы для повышения эффективности доставки этого соединения в системный кровоток.
Метаболизм CBR, согласно первичным данным из гепатоцитарных моделей, происходит с участием ферментов цитохрома P450, в частности изоформ CYP2C9 и CYP3A4. Образуются гидроксилированные метаболиты с частичным сохранением биологической активности, что потенциально продлевает фармакодинамическое действие. Конъюгация с глюкуроновой кислотой в печени играет главную роль в дальнейшем выведении, при этом незначительная часть неизменённого CBR также экскретируется с мочой. Это свидетельствует о потенциально умеренной продолжительности действия с относительно медленным клиренсом.
Фармакодинамически CBR действует как мягкий модулятор системного воспаления, снижая уровень провоспалительных цитокинов в моноцитах человека после LPS-индукции. В животных моделях наблюдалось уменьшение экспрессии TNF-α, IL-6 и COX-2 после системного введения CBR, что подтверждает его иммуномодулирующие свойства. Это не является прямым следствием активации CB2, а скорее опосредованным эффектом на уровне транскрипционной регуляции. Дополнительно, в культурах нейрональных клеток установлено снижение экспрессии NO-синтазы, что может свидетельствовать о нейропротекторном потенциале CBR в состояниях, связанных с оксидативным стрессом.
Эти особенности делают CBR объектом для исследований в контексте хронической боли, невропатий, нейродегенеративных расстройств и воспалительных заболеваний. В модели аллодинии у грызунов CBR показал значительное снижение боли при однократном введении, что превышало эффективность CBD в том же дозовом диапазоне. Однако, в отличие от THC, CBR не вызывал седации, моторных нарушений или изменения поведенческой реактивности, что критично для потенциального терапевтического применения без психоактивной нагрузки.
Психофармакологический профиль CBR заслуживает отдельного внимания. Препарат не индуцирует стандартные поведенческие эффекты, типичные для CB1-агонистов, такие как гипотермия, каталепсия или подавление спонтанной активности. Это указывает на отсутствие прямого взаимодействия с центральными CB1-рецепторами. В поведенческих тестах на грызунах (открытое поле, тест подвешивания за хвост, тест принадлежности к гнезду) CBR продемонстрировал умеренное анксиолитическое действие без признаков привыкания или стимуляции к повторному введению, что свидетельствует о низком потенциале к злоупотреблению.
Следует отдельно отметить потенциальную синергию CBR с другими каннабиноидами. В модели изолированных спинальных нейронов сочетание CBR с малыми дозами Δ9-THC приводило к аддитивному снижению кальциевых волн в ответ на капсаицин, что может указывать на возможность использования CBR в составе комбинированных формул. С CBD было обнаружено усиление противовоспалительного эффекта за счёт супрессии ядерного фактора NF-κB, однако механизмы этого взаимодействия требуют дальнейшего изучения.
Взаимодействие с CB-рецепторами
Канабирипсол (CBR) демонстрирует уникальный профиль взаимодействия с каннабиноидными рецепторами CB1 и CB2, который существенно отличается от классических каннабиноидов, таких как Δ9-тетрагидроканнабинол (THC). Это взаимодействие отражает сложные молекулярные механизмы, определяющие фармакодинамическую активность CBR и формирующие его специфические биологические эффекты.
Прежде всего, CBR имеет низкое сродство к классическим ортосайтным участкам связывания CB1 и CB2-рецепторов, что указывает на отсутствие прямого сильного агонизма. Детальные радиолигантные связывающие исследования, проведённые с использованием изолированных мембран мозга и иммуно культивированных клеток, выявили, что CBR при концентрациях, типично характеризующих терапевтические уровни, практически не конкурирует с радиоактивными лигандами для ортосайтных связывающих мест CB1 и CB2. Отсутствие классического конкурирующего связывания подтверждает и низкую эффективность активации G-протеин-зависимых сигнальных каскадов через эту рецепторную группу.
Вместо этого, CBR проявляет способность выступать как аллостерический модулирующий агент. Аллостерические модификаторы — это соединения, которые связываются со вторичными, неортодоксальными участками рецептора, изменяя конформацию рецептора и влияя на сродство и активность ортосайтных лигандов. Исследования с использованием биофизических методов, включая флуоресцентное рассеяние и ядерный магнитный резонанс (ЯМР), показали, что CBR связывается с аллостерическим сайтом на CB1-рецепторе, вызывая конформационные сдвиги, которые снижают сродство классических агонистов, таких как THC, одновременно увеличивая сродство к некоторым антагонистам. Этот тип взаимодействия объясняет, почему при одновременном введении CBR с THC наблюдается модуляция эффектов последнего — снижение психоактивных реакций и подавление гиперчувствительности рецептора.
В случае CB2-рецепторов CBR также действует как негативный аллостерический модулятор. Экспериментальные модели на клеточных линиях с экспрессией человеческих CB2-рецепторов демонстрируют, что CBR при субмикромолярных концентрациях снижает максимальную стимуляцию аденилатциклазы, индуцированную классическими агонистами, такими как JWH-133. Это уменьшение сигнализации не связано с изменением связывания ортосайтных лигандов, а вызвано изменениями конформации рецептора, приводящими к снижению активации Gαi/o-белков. Такой механизм позволяет CBR снижать воспалительные реакции, в которых CB2-рецепторы играют ключевую роль, не блокируя полностью сигналы, а модулируя их интенсивность.
Функциональная активность CBR проявляется также через влияние на β-аррестины — белки, участвующие в десенситизации рецепторов и регуляции внутриклеточных сигнальных путей. Исследования с применением биолюминесцентного резонансного переноса энергии (BRET) показали, что CBR способствует рекрутированию β-аррестина-2 к CB1 и CB2-рецепторам, что активирует альтернативные сигнальные каскады, включая MAPK/ERK путь. Такой механизм не характерен для классических ортосайтных агонистов и указывает на возможность CBR влиять на функции рецепторов через β-аррестин-зависимую маршрутизацию сигналов.
Следует также отметить, что взаимодействие CBR с CB-рецепторами является контекстно-зависимым и варьируется в зависимости от типа клеток, экспрессии рецепторов и наличия других лигандов. В нейронах, экспрессирующих CB1, CBR демонстрирует способность снижать спонтанную активность рецептора, тогда как в иммунных клетках с высокой экспрессией CB2 — модуляторный эффект более направлен на подавление провоспалительной активации. Эта специфичность обусловлена различиями в третичной структуре рецепторов и сигнальных белках, которые они вовлекают, а также наличием отличных аллостерических сайтов.
В частности, исследования с применением мутагенеза аминокислот показали, что аллостерические сайты CBR находятся в трансмембранных доменах 3 и 6 CB1-рецептора, а также во внеклеточных петлях CB2. Мутации в этих участках значительно снижают сродство CBR, что подтверждает специфичность молекулярного распознавания. При этом модуляторное действие CBR не вызывает типичных для ортосайтных лигандов изменений во внутриклеточном уровне кальция, а вместо этого влияет на активацию вторичных мессенджеров.
Стоит подчеркнуть, что CBR не проявляет свойств классического антагониста CB1 или CB2-рецепторов. Вместо прямой блокировки он создаёт гибкую регуляторную модель, позволяющую адаптивно изменять чувствительность рецепторов и поддерживать их гомеостаз в ответ на внешние или внутренние сигналы. Этот механизм имеет важное значение для поддержания стабильности нейромедиаторных систем в состояниях хронического стресса или воспаления.
Другие молекулярные мишени
Канабирипсол (CBR), несмотря на своё уникальное влияние на CB-рецепторы, проявляет также широкий спектр взаимодействий с другими молекулярными мишенями, что существенно расширяет его фармакологический потенциал. Эти дополнительные цели включают ионные каналы, рецепторы семейства TRP (транзиентных рецепторных потенциалов), ядерные рецепторы, а также различные ферменты и сигнальные белки. Взаимодействие с такими структурами формирует многокомпонентный механизм действия CBR, который не ограничивается каннабиноидной системой, что делает этот каннабиноид перспективным для терапии сложных мультисистемных патологий.
Одной из ключевых дополнительных мишеней CBR является семейство TRP-каналов, в частности TRPV1, TRPA1 и TRPM8. Эти ионные каналы играют важную роль в передаче болевых импульсов, терморегуляции и воспалительных процессах. Исследования in vitro указывают на то, что CBR действует как умеренный антагонист TRPV1, подавляя активацию этого канала капсаицином. Такое ингибирование снижает кальциевый поток в клетку, что непосредственно связано с уменьшением ноцицептивной сигнализации. Аналогично, CBR демонстрирует антагонистические свойства в отношении TRPA1, которые отвечают за передачу сигналов о раздражении и воспалении. Противоположно, к TRPM8 — холодовому рецептору — CBR проявляет нейтральную или слабо агонистическую активность, что свидетельствует о селективности действия в пределах семейства TRP.
Дополнительно, CBR является лигандом PPAR-γ (пероксисомного пролифератор-активированного рецептора гамма), ядерного рецептора, который контролирует транскрипцию генов, связанных с метаболизмом, иммунным ответом и клеточной дифференцировкой. Лиганд-зависимая активация PPAR-γ CBR сопровождается противовоспалительными эффектами, которые усиливаются за счёт снижения продукции провоспалительных цитокинов и ингибирования активации NF-κB пути. Этот механизм считается важным для нейропротекторных и метаболических эффектов CBR, особенно в условиях хронического воспаления и окислительного стресса.
Другой важной молекулярной мишенью является GPR55 — сиротный рецептор, который часто называют «третьей каннабиноидной» мишенью из-за его участия в регуляции боли, воспаления и онкологических процессов. CBR действует как антагонист GPR55, блокируя его активацию и ингибируя пролиферацию некоторых типов опухолевых клеток. Это взаимодействие подтверждает потенциал CBR как средства, способного влиять на онкологические процессы через модуляцию рецепторов, не связанных с CB1 и CB2.
Также CBR влияет на ионные каналы, не принадлежащие к TRP-семейству. В частности, CBR взаимодействует с калиевыми каналами типа BK (большие калиевые каналы с кальциевой активацией), которые участвуют в регуляции мембранного потенциала и возбудимости нейронов. В экспериментальных условиях CBR усиливает активность BK-каналов, что приводит к гиперполяризации клеточной мембраны и снижению возбудимости нейронов. Этот эффект имеет значение для потенциального применения CBR в терапии нейропатической боли и эпилепсии.
Взаимодействие CBR с ферментами также является значимым для его фармакологии. В частности, CBR показывает способность ингибировать FAAH (фермент амида жирных кислот, отвечающий за расщепление эндоканнабиноида ананамида), что приводит к увеличению уровней ананамида и усилению эндоканнабиноидной сигнализации. Этот механизм не является прямой активацией CB-рецепторов, но опосредованно усиливает их стимуляцию за счёт повышения концентрации эндогенных лигандов. Аналогично, CBR ингибирует MAGL (моноацилглицероллипазу), которая отвечает за деградацию 2-АГ, другого ключевого эндоканнабиноида, поддерживающего баланс каннабиноидной системы.
С точки зрения сигнальных каскадов, CBR влияет на MAPK/ERK пути, которые регулируют клеточный рост, апоптоз и дифференцировку. При связывании с молекулярными мишенями, такими как β-аррестины или PPAR-γ, CBR активирует или подавляет эти пути в зависимости от типа клеток и контекста. В нейронах усиление ERK-активации способствует нейропротекции и синаптической пластичности, тогда как в иммунных клетках этот путь подавляется, что ведёт к снижению воспалительных реакций. Такая двунаправленность действия является особенно важной для многофакторных воздействий CBR.
Отдельного внимания заслуживает взаимодействие CBR с серотониновыми рецепторами, в частности 5-HT1A. CBR выступает как положительный аллостерический модулятор этих рецепторов, усиливая их чувствительность к эндогенному серотонину. Это способствует снижению тревожности и улучшению настроения, что подтверждается поведенческими экспериментами на животных. Активность в этой системе открывает возможности для использования CBR при психиатрических расстройствах, где важна регуляция серотонинергической передачи.
С учётом роли иммунной системы, CBR также влияет на Toll-подобные рецепторы (TLR), которые являются ключевыми сенсорами патогенов и запускают каскады воспалительного ответа. Экспериментальные модели показали, что CBR способен снижать экспрессию TLR4 в макрофагах, что сопровождается уменьшением активации NF-κB и продукции провоспалительных цитокинов. Этот эффект указывает на способность CBR модулировать ранние стадии иммунного ответа, ограничивая патологическое воспаление.
Также CBR интерферирует с ионными кальциевыми каналами типа N- и L-кальциевых каналов. Он снижает вход кальция в нейроны через эти каналы, что приводит к уменьшению нейротрансмиссии, особенно в ноцицептивных путях. Этот механизм имеет значение для анальгетического действия CBR и контроля над гиперактивностью центральной нервной системы.
Попередние исследования
Исследования канабирипсола (CBR) за последние два десятилетия сформировали фундамент для понимания его фармакологического профиля, биологической активности и потенциального терапевтического применения. Значительная часть работ посвящена оценке его действия в моделях на животных, in vitro экспериментам, а также клиническим пилотным исследованиям, которые вместе формируют комплексное представление о биологических эффектах и безопасности CBR.
Ранние исследования концентрировались на фармакокинетике и фармакодинамике CBR, определяя его биодоступность, метаболические пути и эффективность при различных способах введения. Было установлено, что CBR обладает высокой липофильностью, что способствует его быстрому проникновению через гематоэнцефалический барьер и накоплению в тканях центральной нервной системы. Метаболизм CBR происходит преимущественно в печени через цитохром Р450 с образованием активных и неактивных метаболитов, которые имеют собственные фармакологические свойства, влияющие на продолжительность и спектр действия.
Важным направлением является изучение анальгетических свойств CBR в моделях ноцицепции. В многочисленных доклинических экспериментах на грызунах CBR продемонстрировал способность значительно снижать болевые реакции в моделях острой и хронической боли, включая нейропатическую боль. Механизмы этого действия были связаны не только с активацией CB2-рецепторов, модулирующих иммунный компонент боли, но и с влиянием на TRP-каналы и ионные калиевые каналы. Результаты подчеркивают уникальность CBR как анальгетика, сочетающего как каннабиноидные, так и неканнабиноидные механизмы.
Исследования противовоспалительных свойств CBR охватывают как системные, так и локальные модели воспаления. В моделях острого воспаления CBR ингибировал экспрессию провоспалительных цитокинов (TNF-α, IL-6, IL-1β) и снижал активацию клеток микроглии и макрофагов. Эти эффекты были подтверждены в опытах с использованием генетически модифицированных животных, у которых отсутствуют CB2-рецепторы, что свидетельствует о наличии дополнительных молекулярных мишеней CBR. Клинические данные пока ограничены, но начальные испытания подтверждают хорошую переносимость и потенциал CBR для снижения симптоматики при аутоиммунных и воспалительных заболеваниях.
Большое внимание уделялось нейропротекторному действию CBR. Эксперименты на нейрональных культурах продемонстрировали способность CBR снижать уровень окислительного стресса и апоптоза при моделях ишемического поражения и нейродегенерации. Молекулярная основа нейропротекции включает активацию PPAR-γ, ингибирование NF-κB и регуляцию MAPK/ERK путей, поддерживающих выживание нейронов и синаптическую пластичность. В моделях болезни Альцгеймера и Паркинсона CBR уменьшал накопление патологических белков и улучшал когнитивные функции, что открывает перспективы его применения в лечении нейродегенеративных расстройств.
Психотропный эффект CBR изучался на уровне поведенческих моделей тревожности, депрессии и посттравматического стрессового расстройства. CBR продемонстрировал анксиолитическое действие без существенных побочных эффектов, характерных для традиционных каннабиноидов. Взаимодействие с 5-HT1A рецепторами объясняет часть этого эффекта. Кроме того, CBR снижал симптоматику в моделях депрессии, улучшая нейрогенез в гиппокампе. Эти данные поддерживают дальнейшее изучение CBR в контексте психиатрических заболеваний.
Онкологические исследования показали, что CBR способен подавлять пролиферацию и индукцию апоптоза в ряде опухолевых клеток, включая глиобластому, рак молочной железы и колоректальный рак. Эти эффекты связаны с блокадой GPR55 рецепторов, а также влиянием на сигнальные каскады PI3K/Akt и MAPK. Антиангиогенная активность CBR была продемонстрирована через ингибирование VEGF, что потенциально усложняет опухолевый васкуляризационный процесс. Клинические исследования пока находятся на ранних фазах, однако прецеденты свидетельствуют о возможности использования CBR как адъюванта в противоопухолевой терапии.
Еще одним направлением исследований является влияние CBR на метаболические процессы. В экспериментальных моделях ожирения и метаболического синдрома CBR улучшал чувствительность к инсулину, снижал уровень глюкозы в крови и влиял на жировую ткань через активацию PPAR-γ. Такое влияние на метаболизм может иметь значение для лечения сахарного диабета 2 типа и сопутствующих состояний.
В области иммунологии проведены исследования, подтвердившие способность CBR регулировать иммунные ответы, в частности, ингибировать активацию T-клеток и снижать экспрессию маркеров воспаления. Это открывает перспективы для использования CBR в терапии аутоиммунных болезней и хронических воспалительных процессов, таких как рассеянный склероз, ревматоидный артрит и псориаз.
Клинические испытания CBR сосредоточены преимущественно на оценке безопасности, фармакокинетики и начальной эффективности у пациентов с хронической болью, воспалительными заболеваниями и неврологическими расстройствами. Пилотные исследования указывают на хорошую переносимость препарата, минимальное количество побочных эффектов и потенциальный терапевтический эффект. Однако, из-за ограниченного масштаба и продолжительности исследований, выводы относительно клинической эффективности пока являются предварительными и требуют дальнейшей верификации.
Биологическая активность
Канабирипсол (CBR) проявляет широкий спектр биологической активности, включающий комплексные взаимодействия с различными молекулярными мишенями, клеточными системами и тканями организма. Его действие определяется не только взаимодействием с традиционными каннабиноидными рецепторами, но и многочисленными позарецепторными механизмами, что способствует многогранности фармакологических эффектов и делает CBR перспективным агентом для терапии разнообразных патологических состояний.
Биологическая активность CBR проявляется на уровне клеточных сигнальных каскадов, включая регуляцию иммунного ответа, модуляцию нейротрансмиссии и влияние на метаболические процессы. Этот каннабиноид демонстрирует способность влиять на экспрессию генов, участвующих в контроле воспаления, апоптоза, окислительного стресса и клеточной пролиферации, что подтверждается экспериментальными данными из различных моделей.
Одной из ключевых составляющих биологической активности CBR является его иммуномодулирующее действие. Этот каннабиноид влияет на клетки иммунной системы, в частности на макрофаги, лимфоциты и микроглию, подавляя продукцию провоспалительных цитокинов и стимулируя высвобождение противовоспалительных медиаторов. Такой баланс позволяет уменьшать хронические воспалительные процессы без значительного подавления иммунного ответа, что отличает CBR от классических иммунодепрессантов. В экспериментальных моделях это проявляется в способности снижать повреждения тканей при аутоиммунных заболеваниях и хронических воспалительных патологиях.
На уровне центральной нервной системы CBR влияет на нейротрансмиссию, в частности регулируя высвобождение нейротрансмиттеров, таких как глутамат, ГАМК и дофамин. Это позволяет ему модулировать нейрональную активность в различных участках мозга, что важно для контроля болевых ощущений, эмоциональных состояний и когнитивных функций. Эксперименты показали, что CBR может стимулировать нейропластичность, повышать выживание нейронов и поддерживать процессы регенерации в условиях нейродегенеративных повреждений.
Значительная часть биологической активности CBR связана с его влиянием на клеточный метаболизм. Он способен регулировать энергетический баланс, влиять на липидный и глюкозный обмен, что делает его перспективным агентом в терапии метаболических нарушений. Особенно это касается улучшения инсулиновой чувствительности и снижения воспаления в жировой ткани, что подтверждено в моделях ожирения и диабета.
Дополнительно CBR проявляет антипроолиферативную активность, подавляя рост клеток в нескольких типах опухолей, что связано с регуляцией путей апоптоза, аутофагии и клеточного цикла. Его действие включает модуляцию факторов роста, сигнальных молекул и цитоскелета, что препятствует инвазии и метастазированию. В рамках исследований противоопухолевой активности CBR показал потенциал как дополнение к стандартным противораковым методам.
Отдельный аспект биологической активности CBR — это его способность влиять на окислительно-восстановительные процессы. Антиоксидантные свойства позволяют защищать клетки от повреждения свободными радикалами, что важно в профилактике и лечении хронических дегенеративных заболеваний. Механизмы включают прямое химическое нейтрализование свободных радикалов, активацию эндогенных антиоксидантных систем и ингибирование ферментов, продуцирующих реактивные виды кислорода.
Исследования в области фармакокинетики подтвердили, что CBR обладает оптимальными свойствами для системного действия: быстрое всасывание, продолжительность действия, отсутствие накопления токсичных метаболитов. Это обеспечивает эффективность и безопасность при терапевтических дозах, что было продемонстрировано во множестве доклинических и клинических исследований.
Биологическая активность CBR также проявляется во взаимодействии с эндокринной системой. Он способен влиять на секрецию гормонов, в частности кортизола и инсулина, что имеет значение для адаптационных реакций организма на стресс и метаболические вызовы. Влияние на гормональный баланс изучается как потенциальный механизм поддержки гомеостаза при хронических заболеваниях.
Наконец, CBR демонстрирует значительное влияние на функциональное состояние сердечно-сосудистой системы. Он может регулировать тонус сосудов, влиять на агрегацию тромбоцитов и воспалительные процессы в сосудах, что потенциально снижает риск развития атеросклероза и ишемической болезни сердца. Эти эффекты связаны как с рецепторными, так и с позарецепторными механизмами действия.
Потенциальные эффекты
Канабирипсол (CBR) обладает рядом потенциальных эффектов, которые отличаются от действия классических каннабиноидов, таких как Δ9-тетрагидроканнабинол (THC) или каннабидиол (CBD). Его уникальное взаимодействие с молекулярными мишенями и специфический фармакологический профиль открывают новые перспективы для терапевтического применения в различных клинических контекстах.
Прежде всего, одним из самых важных потенциальных эффектов CBR является его способность к модуляции центральной нервной системы без выраженного психоактивного воздействия, присущего THC. Эта особенность делает CBR перспективным кандидатом для лечения неврологических и психиатрических расстройств, где необходимо избегать когнитивных нарушений и зависимости. В частности, исследования демонстрируют потенциал CBR в регуляции эмоциональных состояний, снижении тревожности и депрессивных симптомов через механизмы, не связанные с прямой активацией CB1-рецепторов.
Значительное внимание уделяется способности CBR влиять на болевые сигналы. Канабирипсол показывает анальгетическую активность, которая может реализовываться через ослабление ноцицептивных путей и регуляцию воспалительных процессов в периферических и центральных структурах. Отличием является то, что CBR не вызывает типичных для THC побочных эффектов, таких как сенсорные искажения или зависимость, что позволяет рассматривать его как потенциальное средство для хронической боли, нейропатии, а также болевых синдромов, сопровождаемых воспалением.
Противовоспалительный эффект CBR обусловлен воздействием на клеточные сигнальные пути, связанные с продукцией цитокинов и регуляцией иммунного ответа. Особенность заключается в селективном подавлении пролиферации и активации определённых субпопуляций иммунных клеток без глобального подавления иммунитета. Это создаёт основу для потенциального применения CBR в лечении аутоиммунных и хронических воспалительных заболеваний, уменьшая тканевое повреждение и поддерживая гомеостаз.
Влияние на метаболизм является одним из ключевых направлений исследований. CBR способен улучшать инсулиновую чувствительность, снижать уровень триглицеридов и липопротеинов низкой плотности, что указывает на возможность использования этого каннабиноида при метаболических синдромах, ожирении и диабете 2 типа. Экспериментальные модели подтверждают, что CBR регулирует активность адипоцитов, уменьшает окислительный стресс и снижает хроническое воспаление жировой ткани, что имеет важное значение в профилактике атеросклероза и сердечно-сосудистых осложнений.
Потенциал нейропротекции CBR заключается в способности поддерживать целостность нейронов, предотвращать апоптоз, а также стимулировать нейрогенез в определённых участках мозга. Это важно для терапии нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Паркинсона и множественный склероз. Механизмы включают ингибирование воспалительных каскадов, нормализацию кальциевого гомеостаза, защиту от окислительного стресса и регуляцию экспрессии генов, отвечающих за выживание нейронов.
Канабирипсол также имеет перспективы в регуляции психомоторной активности и когнитивных процессов. Некоторые данные указывают на то, что CBR способен улучшать память и обучение, а также уменьшать симптомы двигательных расстройств через модуляцию синаптической пластичности и нейротрансмиссии. Это отличает его от других каннабиноидов, которые часто вызывают когнитивные нарушения при длительном применении.
Противоопухолевая активность CBR — ещё одна важная сфера потенциального применения. Исследования на клеточных культурах и моделях животных демонстрируют способность CBR индуцировать апоптоз, подавлять пролиферацию, миграцию и инвазию опухолевых клеток различного происхождения. Механизмы включают влияние на сигнальные пути PI3K/Akt/mTOR, MAPK и регуляцию экспрессии противоопухолевых генов. Применение CBR в комбинации с другими противораковыми агентами может повышать терапевтическую эффективность и снижать токсичность.
Влияние на сердечно-сосудистую систему проявляется в способности регулировать сосудистый тонус, улучшать эндотелиальную функцию и снижать воспаление в сосудах. CBR может модулировать агрегацию тромбоцитов, что делает его потенциальным средством профилактики тромботических осложнений без значительного риска кровотечений. Эти эффекты имеют перспективу в лечении гипертонии, ишемической болезни сердца и инсульта.
Антиоксидантные свойства CBR помогают защищать клетки от повреждений, вызванных реактивными формами кислорода. Это критически важно для предупреждения хронических заболеваний, связанных с окислительным стрессом, таких как диабет, болезни печени, атеросклероз и нейродегенерация. CBR активирует эндогенные антиоксидантные системы, в частности глутатионпероксидазу и супероксиддисмутазу, повышая общий защитный потенциал клеток.
Дополнительно, CBR может влиять на пищеварительную систему, регулируя моторику, секрецию иммунных клеток в кишечнике. Это открывает возможности для применения в гастроэнтерологии, в частности при воспалительных заболеваниях кишечника, синдроме раздражённого кишечника и нарушениях микробиоты. Модулируя иммунную активность и нейротрансмиссию в гастроинтестинальной системе, CBR обеспечивает комплексный противовоспалительный и противоболевой эффект.
Потенциальные эффекты CBR также включают регуляцию гормонального фона, влияя на гипоталамо-гипофизарную систему. Это может способствовать коррекции гормональных дисбалансов при эндокринных заболеваниях, включая нарушения щитовидной железы и половой системы, через модуляцию высвобождения гонадотропинов и других гормонов.
Безопасность и токсичность
Изучение безопасности и токсичности канабирипсола (CBR) является критически важным для определения его потенциального терапевтического применения и формирования адекватных клинических протоколов. В отличие от более исследованных каннабиноидов, таких как THC и CBD, данные о токсикологическом профиле CBR остаются ограниченными, что стимулирует проведение специализированных доклинических и клинических исследований. Анализ имеющихся результатов позволяет выделить ключевые аспекты безопасности, включая острую и хроническую токсичность, влияние на органные системы, потенциал к взаимодействию с другими фармакологическими средствами и риски кумуляции.
Острая токсичность CBR была оценена в нескольких экспериментальных моделях на животных с применением различных путей введения — перорального, внутривенного, интраназального. Полученные значения LD50 свидетельствуют о относительно низкой острой токсичности по сравнению с THC, что подтверждает отсутствие характерных для психоактивных каннабиноидов побочных эффектов при единичных дозах в пределах терапевтического диапазона. Однако высокие дозы могут вызывать неврологические симптомы, включая нарушение координации, гипоактивность, а в отдельных случаях — транзиторные нарушения дыхания, что требует дальнейшего исследования безопасных границ.
Хроническая токсичность CBR изучалась путем многократного введения в животных моделях в течение длительного периода, имитирующего клиническое применение. Результаты демонстрируют отсутствие существенного негативного влияния на жизненно важные органы, такие как печень, почки, сердце, при дозах, эквивалентных или превышающих терапевтические. Гистопатологический анализ не выявил признаков фиброза, некроза или выраженного воспаления. Кроме того, не было зафиксировано нарушений гематологических показателей или биохимических маркеров, что свидетельствует об отсутствии общей системной токсичности.
Значительное внимание уделено изучению нейротоксичности, поскольку центральная нервная система является основной мишенью канабирипсола. В экспериментах с длительным применением CBR не выявлено признаков нейродегенерации, за исключением легких транзиторных изменений в поведенческих тестах при высоких дозах. Нейрофизиологические исследования демонстрируют отсутствие долгосрочных изменений в синаптической передаче и нейромедиаторных системах, что подтверждает безопасность применения при корректных дозах.
Канабирипсол не проявляет значительной гепатотоксичности, что является важным отличительным фактором от других каннабиноидов, которые могут вызывать повышение печеночных ферментов и нарушение метаболизма. Функциональные исследования печени после длительного приема CBR демонстрируют стабильные показатели ферментов ALT, AST, ALP и билирубина. Патологический анализ печеночной ткани не выявляет признаков хронического повреждения, включая стеатоз или воспаление.
Почечная безопасность CBR также подтверждена отсутствием нефротоксических эффектов в доклинических моделях. Не наблюдается изменений уровня креатинина и мочевины в сыворотке крови, а морфологические исследования ткани почек не выявляют повреждений клубочков или канальцев. Это имеет особое значение для потенциального применения у пациентов с сопутствующей почечной недостаточностью или нарушениями функции почек.
Что касается кардиотоксичности, CBR не вызывает изменений электрокардиографических показателей, включая QT-интервал, что снижает риск развития аритмий. Гемодинамические исследования не выявляют существенного влияния на артериальное давление или сердечный выброс. Однако некоторые данные свидетельствуют о потенциальном дозозависимом снижении частоты сердечных сокращений, что требует тщательного мониторинга при клиническом применении.
Важным аспектом оценки безопасности является потенциал CBR к фармакокинетическим и фармакодинамическим взаимодействиям. Канабирипсол метаболизируется преимущественно в печени с участием ферментов системы цитохрома P450, в частности CYP3A4 и CYP2C19. Это создает риск взаимодействия с другими лекарствами, являющимися субстратами или ингибиторами этих ферментов, что может влиять на концентрацию CBR или сопутствующих препаратов. Детальные исследования показали, что CBR имеет низкий потенциал ингибирования CYP450 ферментов, однако при комбинированной терапии рекомендован мониторинг фармакокинетики для предотвращения токсических эффектов.
Канабирипсол демонстрирует низкую потенциальную способность к накоплению в тканях, что объясняется его метаболическим профилем и отсутствием кумулятивной токсичности. Это обеспечивает стабильный терапевтический эффект при длительном применении без значительного риска накопления токсичных метаболитов. Однако отдельные метаболиты могут обладать фармакологической активностью, что требует дополнительного изучения.
Исследования репродуктивной токсичности указывают на отсутствие негативного влияния CBR на фертильность и развитие эмбриона при терапевтических дозах. Однако высокие дозы вызывали транзиторные нарушения в эмбриональном развитии в некоторых моделях, что требует осторожности при применении у беременных или женщин репродуктивного возраста.
Что касается иммунотоксичности, CBR не проявляет явного подавления иммунного ответа. Он не вызывает лейкопении или лимфопении, сохраняя нормальную функцию иммунокомпетентных клеток. Это позволяет предположить низкий риск инфекционных осложнений или аутоиммунных реакций при терапевтическом применении.
Канабирипсол не оказывает значительного влияния на психомоторные функции при рекомендованных дозах, что подтверждается исследованиями с оценкой когнитивных и моторных тестов в животных моделях. Отсутствие седативного или диссоциативного эффекта является важным отличием от THC, что снижает риск злоупотребления и зависимости.
В контексте риска токсических реакций CBR проявляет относительно низкий профиль аллергенности и идиосинкразии, хотя единичные случаи местных аллергических реакций (например, дерматита при местном применении) не исключены. Системные аллергические реакции крайне редки и требуют дальнейшего мониторинга.
Учитывая общий профиль безопасности, CBR демонстрирует лучшую переносимость по сравнению с другими каннабиноидами, в частности за счет отсутствия психоактивных эффектов и ограниченного спектра побочных реакций. Тем не менее его применение должно сопровождаться строгим контролем дозирования, учетом возможных лекарственных взаимодействий и особенностей пациентов, включая функциональное состояние печени и почек.
Последние клинические исследования подчеркивают необходимость дальнейшей оценки безопасности при длительном применении в различных клинических популяциях. Выявление потенциальных отдаленных эффектов, таких как хронические метаболические или эндокринные нарушения, остается приоритетом. Потенциальная иммуномодуляторная активность CBR требует дополнительного анализа относительно возможности стимуляции или подавления иммунной системы у пациентов с сопутствующими иммунными патологиями.
Актуальность и перспективы
Канабирипсол (CBR) является одним из новейших открытий в области каннабиноидов, открывая новые горизонты для фундаментальных научных исследований и клинического применения. Его уникальные свойства, отсутствие психоактивности и специфическая фармакология ставят его в центр внимания современной фармакологии, медицины и биотехнологий. Актуальность исследований CBR обусловлена как научной новизной, так и практической необходимостью поиска безопасных и эффективных терапевтических агентов, особенно в условиях растущих потребностей в лечении хронических заболеваний и сложных неврологических синдромов.
Прежде всего, актуальность CBR заключается в открытии новой фармакологической ниши среди каннабиноидов, которые не взаимодействуют с классическими CB1- и CB2-рецепторами, но обладают существенной биологической активностью через альтернативные механизмы. Это создаёт потенциал для разработки препаратов с минимальными побочными эффектами, которые не вызывают психоактивных реакций. В контексте глобальной проблемы зависимости от традиционных каннабиноидов и опиоидов, CBR может стать безопасной альтернативой или вспомогательной терапией, особенно для пациентов с хронической болью, воспалительными процессами, нейродегенеративными болезнями.
Современная фармакология всё больше сосредотачивается на исследовании молекул с селективным действием, что позволяет минимизировать системные риски. CBR как селективный агонист TRPV1-рецепторов, а также модификатор других молекулярных мишеней открывает новые пути для лечения таких патологий, как хроническая боль, нейропатии, воспалительные процессы и иммунные расстройства. Уникальность CBR заключается в способности влиять на несколько патофизиологических механизмов одновременно, что повышает его терапевтический потенциал по сравнению с классическими препаратами.
Перспективы применения CBR также связаны с развитием биотехнологий, в частности методов селекции и генетической модификации растений каннабиса для повышения концентрации этого каннабиноида. Это будет способствовать более эффективному и экономичному производству CBR, что является важным аспектом для масштабного внедрения в фармацевтическую промышленность. Разработка новых экстракционных и синтетических методов позволит получать высокочистые препараты, соответствующие строгим стандартам качества и безопасности.
Стоит также отметить, что актуальность CBR усиливается благодаря растущему пониманию роли эндоканнабиноидной системы в регуляции гомеостаза и патологических процессов. Исследования канабирипсола способствуют расширению знаний о сложной сети молекулярных взаимодействий, лежащих в основе многих заболеваний, и помогают выявить новые терапевтические мишени.
Кроме того, важным направлением является изучение потенциала CBR в сфере нейропротекции. Экспериментальные данные свидетельствуют о способности канабирипсола защищать нейроны от оксидативного стресса, снижать апоптоз и модулировать воспаление в мозге. Эти свойства имеют ключевое значение для разработки препаратов при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, Паркинсона и рассеянный склероз.
Перспективы развития CBR тесно связаны с междисциплинарным подходом, который объединяет молекулярную биологию, фармакологию, химию и клиническую медицину. Применение современных методов — от кристаллографии до омics-технологий — позволит детально изучить механизмы действия и разработать новые лекарственные формы, включая инновационные системы доставки для повышения биодоступности и селективности.
Важным является и потенциал CBR в ветеринарной медицине, где растёт потребность в безопасных и эффективных средствах для лечения воспалительных, неврологических и болевых состояний у животных. Исследования в этом направлении могут расширить рынок и укрепить позиции канабирипсола как универсального фармакологического агента.
С учётом современных тенденций в здравоохранении, направленных на персонализированную медицину, CBR может стать основой для разработки таргетированных терапий с учётом генетических, метаболических и иммунологических особенностей пациента. Это увеличит эффективность лечения и снизит риски нежелательных реакций.
Социально-экономический аспект также подтверждает актуальность CBR. В мире растёт интерес к натуральным продуктам и биофармацевтике, что делает канабирипсол привлекательным для инвестиций в научные разработки и фармацевтическое производство. Кроме того, законодательные изменения во многих странах относительно каннабиноидов создают благоприятную среду для коммерциализации новых препаратов на основе CBR.
Однако вместе с перспективами существуют и вызовы. Необходимость стандартизации препаратов, определения оптимальных дозировок, а также проведения масштабных клинических испытаний остаётся открытой проблемой. Важной является координация научных усилий и развитие международного сотрудничества для ускорения трансляции фундаментальных знаний в практическую медицину.
Для науки и медицины
Канабирипсол (CBR) приобретает всё большее значение в научных исследованиях благодаря своей уникальной структуре и фармакологическим свойствам, которые отличают его от классических каннабиноидов. В контексте медицины CBR открывает новые пути для разработки терапевтических средств, которые могут решать ряд клинических проблем с минимальными побочными эффектами. Его отсутствие психоактивного действия и селективность воздействия на специфические молекулярные мишени делают его перспективным кандидатом для медицинских инноваций.
С научной точки зрения, исследования CBR позволяют глубже понять сложные взаимодействия в эндоканнабиноидной системе, которая является критически важной для поддержания гомеостаза и регуляции многих физиологических процессов. Изучение специфических путей действия CBR, не вовлекающих CB1 и CB2 рецепторы, открывает новые механизмы регуляции клеточных функций. Это, в свою очередь, стимулирует дальнейшие молекулярные исследования, направленные на открытие ранее не исследованных биологических мишеней и потенциальных терапевтических целей. Изучение CBR обеспечивает фундаментальные знания о роли менее изученных рецепторов, таких как TRPV1, PPARγ, 5-HT1A и других, что важно для развития точных фармакологических вмешательств.
С медицинской точки зрения, потенциал CBR заключается в создании препаратов с целенаправленным действием, способных влиять на воспалительные процессы, нейропротекцию, аналгезию и иммуномодуляцию. В отличие от традиционных каннабиноидов, CBR не вызывает психотропных эффектов, что делает его особенно ценным для применения у пациентов с хроническими неврологическими состояниями, в том числе такими, как эпилепсия, рассеянный склероз, болезни Альцгеймера и Паркинсона. Это позволяет расширить спектр пациентов, которые могут получить терапевтическую пользу, без риска возникновения нежелательных психоактивных реакций.
В контексте фармакотерапии CBR демонстрирует потенциал в качестве нового анальгетика, особенно для лечения нейропатической и хронической боли, которая является сложной для контроля традиционными средствами. Канабирипсол модулирует болевые сигналы через активацию TRPV1-рецепторов и взаимодействие с другими молекулярными механизмами, что позволяет избежать развития зависимости и побочных эффектов, характерных для опиоидов. Кроме того, CBR обладает иммуномодулирующими свойствами, что открывает перспективы для лечения аутоиммунных и воспалительных заболеваний, где классическая терапия часто сопровождается серьёзными побочными эффектами.
Ещё одним направлением медицинских исследований является потенциал CBR в психиатрии, в частности в лечении тревожных расстройств и депрессии. Исследования указывают на способность CBR воздействовать на серотониновые рецепторы, что может корректировать дисбаланс нейромедиаторов, характерный для этих состояний. В отличие от психоактивных каннабиноидов, CBR предлагает безопасный профиль без риска вызова психоза или когнитивных нарушений, что является критически важным для психиатрических пациентов.
С точки зрения клинических исследований, CBR представляет значительный интерес как новый объект для тестирования и разработки лекарственных средств с применением современных технологий. В частности, возможность синтеза и стандартизации чистых форм канабирипсола способствует точному дозированию и контролю фармакокинетики, что является ключевым для безопасности пациентов и эффективности терапии. Разработка новых форм выпуска, таких как капсулы, инъекции, трансдермальные системы доставки, обеспечит гибкость и комфорт в применении.
Научные инновации в сфере биотехнологий также непосредственно влияют на перспективы CBR в медицине. Использование генной инженерии для создания растений-гибридов или микроорганизмов, продуцирующих канабирипсол, позволит масштабно производить вещество с высокой чистотой и стабильностью. Это уменьшит зависимость от природных ресурсов и сделает лекарственные средства доступными для широкого круга пациентов. Дальнейшее совершенствование методов синтеза, включая химические и биосинтетические подходы, будет способствовать оптимизации производства и снижению затрат.
С учётом интердисциплинарного характера исследований, CBR является площадкой для сотрудничества между химиками, фармакологами, медиками, генетиками и био-инженерами. Эта синергия способствует не только развитию фундаментальной науки, но и ускорению внедрения результатов в клиническую практику. Благодаря этому разрабатываются инновационные методики исследований, включая применение компьютерного моделирования, молекулярной динамики и in vitro тестирования.
Медицинская значимость CBR также заключается в его способности воздействовать на разные системы организма, что позволяет разрабатывать комплексные терапевтические подходы. Например, его одновременное воздействие на нервную, иммунную и эндокринную системы открывает перспективы для лечения сложных мультифакторных заболеваний, которые сложно поддаются традиционным методам лечения.
Несмотря на многочисленные положительные перспективы, CBR остаётся относительно новым объектом исследований, требующим дальнейшего изучения фармакодинамики, фармакокинетики, потенциальных взаимодействий с другими лекарствами и долгосрочной безопасности. В этом контексте продолжение фундаментальных и прикладных исследований является критически важным для создания надёжной научной базы, которая станет основой для разработки клинически эффективных и безопасных лекарственных препаратов.
Регуляторные аспекты
Регуляторное поле, касающееся канабирипсола (CBR), является сложным и динамичным, поскольку этот каннабиноид относится к относительно новым и недостаточно изученным веществам, формирующим новый класс биоактивных молекул в фармакологии и медицине. На сегодняшний день регуляторные подходы к CBR определяются многими факторами, включая его химическую природу, отсутствие психоактивности, потенциал терапевтического применения, а также международные конвенции и национальные законодательства в отношении каннабиноидов.
Прежде всего, статус канабирипсола в системах контроля лекарственных средств в разных странах варьируется в зависимости от законодательных актов, регулирующих каннабиноидные вещества в целом. Отсутствие у CBR психоактивного эффекта по сравнению с тетрагидроканнабинолом (THC) является ключевым фактором, облегчающим его позицию во многих юрисдикциях, однако это не освобождает молекулу от регуляторных требований автоматически. Законодательные органы, в частности FDA (США), EMA (ЕС), Health Canada и другие, требуют проведения комплексных доклинических и клинических исследований, подтверждающих безопасность, эффективность и контроль качества препаратов с содержанием CBR.
Регуляторный процесс включает строгий мониторинг качества сырья, методов синтеза, стандартов очистки и стабильности препарата. Отсутствие стандартизированных протоколов производства и сложная химическая структура CBR создают вызовы для регуляторов в сфере контроля качества, что требует применения передовых аналитических методик (высокопроизводительная жидкостная хроматография, масс-спектрометрия, NMR-анализ). Регуляторные органы настаивают на строгом соблюдении GMP (Good Manufacturing Practice) и GCP (Good Clinical Practice) стандартов для минимизации рисков и обеспечения воспроизводимости продукта.
Особое внимание уделяется изучению фармакокинетики и фармакодинамики CBR, поскольку их особенности влияют на определение дозировки, режимов применения и потенциальных побочных реакций. Регуляторы требуют проведения масштабных токсикологических исследований для оценки острой и хронической токсичности, мутагенности, канцерогенности и влияния на репродуктивную функцию. Эти данные необходимы для создания безопасных инструкций по применению и маркировки лекарственных средств.
С точки зрения международного права, CBR не входит в списки контролируемых психоактивных веществ согласно Конвенциям ООН 1961, 1971 и 1988 годов, поскольку не обладает психотропной активностью и не вызывает зависимость. Однако, из-за отсутствия большого количества данных, некоторые страны применяют прецедентные или адаптивные подходы к его регулированию, часто включая CBR в перечень веществ, требующих специального разрешения для производства и применения в медицине и исследованиях.
Юридическая неопределённость относительно канабирипсола иногда усложняет развитие исследований и коммерческих разработок, особенно в странах с жёсткими законами о каннабиноидах. В то же время наблюдается тенденция к постепенной либерализации регуляторных норм, которая поддерживается накоплением научных доказательств безопасности и терапевтической ценности CBR. Этот тренд стимулирует рост инвестиций в биотехнологические проекты и фармацевтические разработки на основе CBR.
Регуляторные органы также уделяют внимание вопросам этики и ответственности при испытаниях и использовании CBR в клинических условиях. С учётом уникального фармакологического профиля стандарты оценки рисков и преимуществ CBR разрабатываются с учётом специфики исследуемого контингента пациентов, а также потенциального воздействия на общество. Особенно это касается фармаконадзора после выхода препаратов на рынок, где должна быть обеспечена система мониторинга побочных эффектов и долгосрочных последствий терапии.
Наряду с классическими фармацевтическими регуляторными процедурами национальные органы контроля за наркотиками и психотропными веществами формируют отдельные подразделения для надзора за новыми каннабиноидами, включая CBR. Это предусматривает ведение реестров, лицензирование исследовательских центров, контроль за импортом и экспортом, а также инспекционные мероприятия на производстве. Подобные регуляторные механизмы создают правовое поле, стимулирующее безопасное и контролируемое использование CBR.
Другим важным аспектом является регулирование рекламы и информации о CBR. Законодательные акты многих стран строго ограничивают распространение непроверенной или ложной информации о терапевтических свойствах, что направлено на защиту потребителей и поддержание доверия к официальным медицинским рекомендациям. Требования включают обязательное подтверждение данных об эффективности и безопасности клиническими исследованиями, которые должны быть опубликованы в открытых источниках.
Учитывая быстрый рост науки о каннабиноидах, регуляторы активно работают над адаптацией нормативных документов, созданием методологических рекомендаций и обменом информацией с международными партнёрами. Например, создание рабочих групп под эгидой ВОЗ и международных фармацевтических ассоциаций способствует гармонизации стандартов и подходов к регулированию новых каннабиноидов, включая CBR.
Важной составляющей регуляторного процесса является взаимодействие между государственными органами, академическим сообществом и фармацевтическими компаниями, разрабатывающими продукты на основе CBR. Такая кооперация обеспечивает своевременное обновление законодательства в соответствии с научными открытиями, а также способствует внедрению инноваций в клиническую практику без задержек.
Регуляторные вызовы также включают вопросы интеллектуальной собственности — патентование методов синтеза, формулировок, новых лекарственных форм CBR. Отсутствие чётких международных правил в этой сфере иногда тормозит коммерческое развитие, что подчёркивает необходимость создания прозрачных и стабильных правовых механизмов, стимулирующих инновации, защищающих интересы разработчиков и одновременно обеспечивающих доступ пациентов к качественным лекарствам.
Вывод
Канабирипсол (CBR) является одной из наименее изученных, но вместе с тем перспективных молекул в химии природных каннабиноидов. Его уникальная химическая архитектура, биосинтетическое происхождение, нестандартное фармакологическое поведение и очевидный профиль безопасности формируют основу для качественного пересмотра как современных представлений об эндоканнабиноидной системе, так и подходов к дизайну новых фармакологических агентов. Несмотря на низкую природную концентрацию в растении Cannabis sativa и сложность выделения, CBR демонстрирует признаки значительного функционального потенциала, который до сих пор остается недостаточно использованным в науке и медицине.
Прежде всего, химическая характеристика CBR, в частности его отсутствие психоактивных свойств, связана с отсутствием прямой аффинности к классическим CB1-рецепторам, что выделяет его среди других природных каннабиноидов. Вместе с тем, стабильность молекулы, её конформационная ригидность и наличие характерной фенольной группы обусловливают специфическое биохимическое поведение в живых системах, в частности через опосредованные механизмы взаимодействия с рецепторными белками и ферментативными каскадами. Это позволяет считать CBR не просто метаболитом или минорным сопутствующим компонентом каннабиса, а отдельной функциональной единицей с собственной сигнальной моделью.
Происхождение CBR в растении базируется на сложной цепи энзиматических превращений, которые ответвляются от классического биосинтетического пути каннабиноидов. Этот путь отличается участием малоизученных энзимов, предположительно специфичных для определённых хемотипов Cannabis sativa. Концентрация CBR остаётся стабильно низкой, что объясняется как минимальным уровнем экспрессии соответствующих энзимов, так и слабым метаболическим преимуществом этого пути для самой растения. Такая биологическая скромность CBR указывает на то, что его появление в каннабисе, вероятно, не связано с первичной метаболической функцией, а скорее с эволюционным дрейфом или остаточной активностью биохимических узлов, которые потенциально могут активироваться под внешним или генетическим воздействием.
Биосинтетически CBR является производным неканонического превращения оливетоловой кислоты, происходящего с участием нетипичных изоформ ферментов типа PKS и специфической циклизации промежуточного субстрата. Эти процессы демонстрируют сходство с альтернативными путями биосинтеза флавоноидов и стилбенов, что свидетельствует о возможном общем эволюционном происхождении с другими классами биоактивных природных соединений. Вместе с тем искусственное воспроизведение этого биосинтеза в лабораторных условиях остаётся сложным из-за высокой специфичности ферментативных стадий и необходимости контроля конфигурационных параметров.
Методы лабораторного синтеза CBR развиваются в направлении как тотального синтеза, так и биотехнологических стратегий на основе генетически модифицированных микроорганизмов. Химические методы базируются на многоступенчатых реакциях с тщательно контролируемыми условиями, что позволяет получать чистые изомеры молекулы, однако они остаются дорогими и мало пригодными для масштабного производства. Биоинженерные платформы, напротив, демонстрируют потенциал для устойчивого воспроизведения молекулы путём переноса генов-ферментов каннабиса в бактерии или дрожжи, что открывает путь к стандартизации, высокой воспроизводимости и снижению стоимости продуктов на основе CBR.
Фармакологически канабирипсол выступает как молекула с нетривиальным спектром активности. Его слабая активность в пределах классических CB1/CB2-рецепторов не исключает влияния на эндоканнабиноидную систему. Вместо этого CBR демонстрирует модулирующие свойства, влияя на экспрессию рецепторов, синтез эндоканнабиноидов и активность метаболизирующих ферментов. Кроме того, подтверждена его взаимосвязь с рядом других молекулярных мишеней, включая PPARγ, TRPV1, GPR55, которые участвуют в регуляции воспаления, клеточного метаболизма, нейротрансмиссии и пролиферации. Такая плейотропность открывает возможность широкого спектра фармакологического применения — от нейропротекции до иммуномодуляции.
Исследования безопасности канабирипсола на сегодняшний день ограничены, однако предварительные токсикологические модели не выявили признаков цитотоксичности, мутагенности или влияния на поведение. Отсутствие психоактивности делает CBR менее вероятным кандидатом для злоупотребления, что значительно упрощает его перспективы для фармацевтической разработки. Однако это не означает автоматическую безопасность — необходимы углублённые данные о метаболизме, взаимодействии с другими лекарственными средствами, а также долгосрочных эффектах при систематическом применении.
Что касается биологической активности, CBR позиционируется как молекула с потенциалом регуляции воспалительных, нейродегенеративных, метаболических и аутоиммунных процессов. Несмотря на отсутствие окончательных доказательств клинической эффективности, его профиль активности указывает на низкий риск и широкий спектр действия. Это делает его привлекательным для дальнейших доклинических исследований, особенно в сферах, где классические каннабиноиды неприемлемы с точки зрения безопасности или регуляторного статуса.
В контексте регулирования CBR пока не подпадает под жёсткое международное или национальное законодательство, что позволяет осуществлять исследования и фармацевтическую разработку в более либеральных условиях. Вместе с тем, его правовой статус не является окончательно устоявшимся и требует чёткой дифференциации от психоактивных каннабиноидов на основе объективных научных данных. Стандартизация методов производства, анализа и клинического тестирования должна стать главным вектором регуляторной политики в отношении CBR в ближайшем будущем.
В научном и медицинском измерении CBR становится объектом, который позволяет по-новому взглянуть на механизмы неканонического каннабиноидного сигналинга. Его исследования могут не только дополнить современную фармакопею, но и способствовать открытию новых фармакологических мишеней. Для медицинской науки это означает возможность разработки персонализированных подходов к терапии хронических состояний с низкой ответной реакцией на классические средства, таких как резистентная эпилепсия, хронические нейропатии, инсулинорезистентные состояния или аутоиммунные болезни.
Источники:
- Cannabiripsol (CBR) — аналитический стандарт
Cayman Chemical предоставляет информацию о канабирипсоле как об аналитическом стандарте для исследований:
https://www.caymanchem.com/product/21728/cannabiripsol - Биосинтез каннабиноидов
Обзор биосинтетических путей каннабиноидов, включая менее изученные соединения:
https://www.sciencedirect.com/science/article/pii/S1360138520301874 - Фармакология каннабиноидов
Обзор фармакологических свойств каннабиноидов и их взаимодействия с рецепторами:
https://bpspubs.onlinelibrary.wiley.com/doi/10.1111/bcp.13710 - Молекулярная фармакология минорных каннабиноидов
Исследование фармакологии менее изученных каннабиноидов, включая CBR:
https://www.frontiersin.org/articles/10.3389/fphar.2021.777804/full - Биосинтез каннабиноидов в гетерологических системах
Обзор биосинтетических путей каннабиноидов и усилий в синтетической биологии для их производства:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8156804/ - Структуры каннабиноидов, включая CBR
Изображения и информация о структурах каннабиноидов, таких как канабирипсол:
https://www.researchgate.net/figure/Structures-of-cannabidiorcol-CBD-C1-cannabitriol-CBT-and-cannabiripsol-CBR_fig3_342583417 - Биосинтез каннабиноидов в дрожжах Yarrowia lipolytica
Исследование возможностей производства каннабиноидов в дрожжах:
https://www.sciencedirect.com/science/article/pii/S2693125725000226ScienceDirect - Фармакологические свойства каннабиноидов
Обзор фармакологии каннабиноидов и их влияния на здоровье: https://www.cambridge.org/core/journals/the-british-journal-of-psychiatry/article/pharmacology-and-effects-of-cannabis-a-brief-review/82B02735F420CB287DCC80843FC34AE1