В контексте современной каннабиноидной науки все еще сохраняется асимметрия внимания к различным представителям этой химической группы: ключевыми объектами исследований остаются Δ⁹-тетрагидроканабинол (THC), каннабидиол (CBD) и в несколько меньшей степени — каннабинол (CBN). Их изученность стала эталонной в осмыслении эндоканнабиноидной системы, рецепторной аффинности и клинического потенциала, что в результате привело к маргинализации менее распространенных или метаболически вторичных каннабиноидов. В этой тени находится и каннабиварин (CBV) — структурно стабильная, полностью непсихоактивная молекула, которая образуется в результате окисления тетрагидроканнабиварина (THCV), и до сих пор фактически остается за пределами парадигм клинического, нейрофармакологического или даже химотаксоновического внимания. Однако современный уровень аналитической точности в изучении природных метаболитов ставит новые вопросы относительно оценки значимости таких «периферийных» компонентов, и CBV выступает в этом контексте как молекула, представляющая латентный функциональный пласт фитоканнабиноидной химии, до сих пор не интегрированный в теоретическую канву ни нейронаук, ни фитохимии, ни фармакогнозии.
С формальной точки зрения, CBV является продуктом автоокисления или термически катализируемой дегидрогенизации THCV — молекулы, структурно схожей с THC, но с боковой пропиловой цепью вместо пентиловой. Этот вариновый вариант Δ⁹-THC сам по себе является предметом фармакологического интереса, с учетом его антагонистического действия на CB1-рецепторы и потенциального влияния на гликемические механизмы. Образование CBV из THCV, с одной стороны, является очевидным процессом, ожидаемым в контексте деградации каннабиноидов при старении биомассы или под воздействием теплового стресса; с другой стороны — почти полностью игнорируется как индикаторный маркер или как субстрат потенциального биохимического вмешательства. Несмотря на обнаружение CBV в хроматографических профилях образцов Cannabis sativa — в частности, в старых экземплярах или экстрактах, подвергшихся длительному хранению — научная литература почти не содержит основательных исследований его фармакокинетики, биологической активности или роли в метаболических каскадах растения или человеческого организма. Такая лакуна не является следствием отсутствия потенциала, а скорее продуктом эпистемологической инерции, в рамках которой лишь рецепторно активные молекулы считаются достойными исследования.
Вместе с тем, появление CBV в стабильных количествах в ряде фитогенетически родственных химотипов конопли, в частности в сортах, богатых на вариновые производные, позволяет поставить вопрос о его биогенетической детерминированности и возможной регуляторной роли. CBV, хотя и не взаимодействует с классическими каннабиноидными рецепторами, может влиять на позарецепторные сигнальные пути или проявлять свойства химического модификатора в мембранозависимых механизмах. Учитывая гидрофобность, низкую реактивность и относительную термостабильность, CBV может выступать как метаболический стабилизатор, биохимически инертный агент или даже аллостерический модулятор для структурно комплементарных лигандов. К тому же его отсутствие токсичности, низкая биотрансформация в экспериментальных моделях и потенциальная химическая индифферентность делают его интересным объектом для изучения принципов эндогенной защиты или буферизации рецепторной чувствительности в рамках эндоканнабиноидной системы.
С фармакохимической точки зрения CBV также может быть интересен как хемотиповый биомаркер для аналитической стандартизации вариновых химоваров, в частности в условиях, когда фитогенетическое нагружение не позволяет опираться только на баланс THC/CBD. Его стабильное формирование при окисном старении содержания THCV дает возможность использовать CBV как индикатор возрастного состояния конопляного экстракта — подобно роли CBN для THC. Такие подходы имеют не только аналитическое, но и регуляторное значение, особенно в контексте растущего интереса к фармакопейной стандартизации конопляного сырья.
Отсутствие психоактивного эффекта и крайне низкий риск рецепторного злоупотребления позволяют рассматривать CBV как перспективную структуру для разработки наноносителей, химически инертных матриц или стабилизирующих агентов в каннабиноидных формациях. И хотя на сегодняшний день такая концепция не имеет экспериментального подтверждения, она открывает поле для исследования вторичных хемоструктур каннабиса как платформ, а не просто функциональных агентов. Это смещает фокус каннабиноидной науки с функции на архитектонку — с рецепторной аффинности на системную интеграцию.
Хемотаксономический контекст CBV в пределах фитоканнабиноидного спектра
Хемотипы с высоким содержанием пропиловых производных: CBV как маркер варинового пути
Хемотаксономия Cannabis sativa L. — инструментальная отрасль современной фитосистематики — опирается не только на морфологические или генетические маркеры, но и на стабильные биохимические профили вторичных метаболитов. В этом контексте пропиловые производные каннабиноидов, возникающие в результате варинового биосинтетического пути, приобретают все большее значение как хемотиповые детерминанты, способные дополнить или даже уточнить классификационные модели, основанные на соотношении Δ⁹-тетрагидроканабинола (THC) и каннабидиола (CBD). Каннабиварин (CBV), как конечный окисленный метаболит в THCV-ассоциированной линии, представляет собой стабильный и химически индифферентный компонент, который может выполнять роль маркера функциональной активности пропилового пути в пределах определенных хемотипов.
Наличие CBV в метаболическом спектре сырья Cannabis sativa L. всегда является производной активности специфического субклада вариновых хемотипов, которые характеризуются не только способностью к биосинтезу каннабиноидов с пропиловым замещением, но и стабильным сохранением этих метаболитов в фенотипической экспрессии в течение вегетационного цикла. Эти хемотипы имеют усиленное или преобладающее функционирование соответствующего варинового аллеля олиготерпенойдсинтаз, отвечающих за образование C3-боковых цепей в молекуле каннабигероловой кислоты (CBGA), из которой уже далее образуются THCV, CBDV, CBGV и другие соответствующие соединения.
CBV, как неэнзиматический продукт дегидрогенизации THCV, появляется лишь в том случае, если в исходном растительном материале происходит значительное накопление последнего. Таким образом, CBV функционирует не как первичный биосинтетический продукт, а как вторичный хемомаркер, который опосредованно информирует о интенсивности варинового метаболизма. В отличие от других соединений, таких как CBGV или CBDV, CBV не является субстратом ни одной известной ферментативной реакции в Cannabis sativa L., что делает его более инертным в биохимическом плане, но в то же время более надежным как индикатор завершенного варинового пути. Это отличает его от более реактивных промежуточных метаболитов, которые быстро метаболизируются или трансформируются в другие каннабиноиды, что усложняет их использование в хемотаксономических целях.
Примечательно, что хемотипы с высокой экспрессией пропиловых производных не всегда демонстрируют соответственно высокий уровень CBV: наличие CBV указывает именно на факт деградационного преобразования THCV, что может зависеть от факторов, таких как зрелость растения, условия хранения, воздействие света или температуры. Таким образом, CBV не является непосредственным хемотиповым биомаркером в традиционном понимании, но становится ценным индикатором при анализе вторичных или третичных метаболических изменений в сырье, что позволяет дифференцировать, например, стабильные вариновые хемотипы от гибридных или псевдовариновых генотипов, которые не демонстрируют полноценного пути деградации THCV до CBV.
Генетическая основа этих хемотипов тесно связана с наличием специфического аллеля BCHS (butyl-/propyl-cannabinoid synthase), который определяет приоритетный путь пропилового или бутилового каннабиноидного синтеза. В контексте CBV это приобретает особое значение, поскольку позволяет выявить не только функционирование этой синтазы, но и стабильность ее конечных продуктов при различных агрохимических режимах культивации. На сегодняшний день несколько генетически отличных хемотипов Cannabis sativa продемонстрировали преимущество в вариновом пути: в частности, африканские линии типа «Durban Poison» и центральноазиатские локусы, изолированные из дикорастущих популяций, которые эволюционно подверглись отбору по признаку непсихоактивности при сохранении стимуляторной нейромодуляторной активности.
С практической точки зрения хемотаксономическое картирование CBV позволяет построить новый уровень стандартизации каннабиноидных экстрактов — на основе не только количественного содержания THC/CBD, но и профильного спектра вариновых продуктов, с учетом их степени деградации. Это открывает перспективу использования CBV как постиндексного маркера для стратификации сырья не только по хемотипу, но и по уровню метаболического старения или окислительного нагрузки, в том числе для фармакопейного контроля качества.
Отдельный вопрос — изучение корреляций между наличием CBV и профилем терпенов. Предыдущие изолированные хроматографические исследования указывают на наличие стабильной ассоциации между CBV и такими терпенами, как гераниол, эвкалиптол и цис-окимен, которые также чаще фиксируются в вариновых хемотипах. Это свидетельствует не только о биохимической корреляции, но и о потенциальных эволюционных связях, которые должны быть рассмотрены в рамках фитогенетической реконструкции варинового направления метаболизма.
Роль CBV в метаболической сети вторичных метаболитов Cannabis sativa L.
Каннабиварин (CBV), будучи полностью дегидрогенизированным аналогом тетрагидроканнабиварина (THCV), имеет уникальный статус в метаболическом ландшафте Cannabis sativa L. Он не является ни ключевым биосинтетическим модулатором, ни активным субстратом основных ферментативных каскадов в живой растительной клетке. Однако именно благодаря этой химической инертности и метаболической стабильности CBV выполняет функцию структурного маркера, отражая ретроспективную активность биосинтетических маршрутов. Он представляет собой эндогенный хемосигнал, который позволяет реконструировать процесс деградационных и окислительных процессов в фитосреде, а также очерчивает границы вариационного пространства вторичного метаболизма Cannabis sativa на поздних стадиях развития растения или в послеборочный период.
В пределах вторичного метаболизма CBV играет в первую очередь индикативную роль. Его хемогенез не является результатом регулируемой ферментативной реакции, а происходит в результате автоокисления THCV под действием температуры, света или окислительного стресса — как это установлено в ряде исследований ускоренного старения каннабиноидных экстрактов. Соответственно, CBV в метаболической сети функционирует как хронологический или энергетический маркер — своего рода сигнатура протекания деградации, которая отражает этапность и глубину перестройки вариновой ветви каннабиноидного биосинтеза.
В отличие от большинства каннабиноидов, CBV практически не метаболизируется в тканях растения и сохраняет структурную стабильность даже в условиях высокой температуры или длительного воздействия УФ-излучения. Это делает его исключительным с точки зрения экологической информативности. Его наличие и концентрация позволяют определить не только исходную метаболическую программу растения (то есть способность синтезировать THCV), но и степень постбиогенных изменений — аналогично тому, как CBNA указывает на окисную деградацию CBN-пути. Однако, в отличие от CBNA, CBV не связан с психоактивными предшественниками, что выводит его за пределы токсикохимического контроля и придает новое измерение в экологически чистой фитосенсорной аналитике.
CBV также может рассматриваться как специфический продукт редокс-равновесия в пределах каннабиноидного пула. В вариновой ветви THCV синтезируется путем циклизации пропил-замещенной формы CBGA с участием THCV-синтазы. Образованный THCV, как известно, менее стабилен, чем его бутиловый аналог Δ⁹-THC, и при неблагоприятных условиях легко деградирует с образованием CBV. Такая деградация не происходит в обратном направлении — то есть CBV не является субстратом для ресинтеза THCV, что подтверждается отсутствием каких-либо обратно-активных редуктаз в геноме Cannabis sativa, которые могли бы обеспечить соответствующую преобразуемость.
Другим важным свойством CBV является его отсутствие участия в каких-либо каскадных вторичных реакциях с другими терпеновыми или флавоноидными соединениями. Это позволяет рассматривать CBV как метаболически терминальную единицу, своеобразную «мертву зону» вторичного метаболизма, но именно поэтому — максимально стабильную и репрезентативную. CBV не участвует в ни одном из известных перекрестных путей с фенольными, изопреновыми или азотовмесными метаболитами, что снижает его биохимическую вариабельность и повышает таксономическую специфичность.
С метаболической точки зрения CBV можно представить как индикатор завершенности биохимического цикла в пределах конкретной подветви фитоканнабиноидной сети. Его присутствие указывает на то, что циклизация, окисление и терминальная стабилизация THCV уже завершены, и дальнейшие биохимические реакции в пределах этого пути невозможны. Следовательно, CBV сигнализирует о полной реализации варинового пути, что не характерно для большинства других производных каннабиноидов, которые обычно сохраняют определенный метаболический потенциал для дальнейших реакций.
Соотношение CBV к THCV и CBGV: биосинтетические детерминанты
Метаболические пути синтеза каннабиноидов в Cannabis sativa L. представляют собой сложную и многогранную сеть реакций, в которой различные производные органических кислот и их окислительные продукты взаимодействуют через ряд ферментативных механизмов. CBV, в связи с его статусом в структурной сетке каннабиноидных метаболитов, занимает важное место в процессах деградации и трансформации таких соединений, как THCV и CBGV. Попытки расшифровать это соотношение требуют углубленного понимания хемогенетических путей, на которых эти соединения образуются, а также детального анализа биосинтетических детерминант.
Базовые биосинтетические пути для CBV, THCV и CBGV
На основе исследований каннабиноидной биосинтетической сети можно определить, что каждый из этих каннабиноидов синтезируется через несколько общих предшественников. CBV и THCV имеют общую биосинтетическую предысторию, поскольку их исходными метаболитами являются вариновы производные каннабигеролового комплекса (CBGA).
- CBGA (каннабигероловая кислота) является основным предшественником всех каннабиноидов. В процессе карбоксилирования он становится активным в метаболизме каннабиноидов.
- Для образования THCV, CBGA с помощью фермента THCV-синтазы проходит циклизацию через промежуточный этап, включающий пропиловую группу, изменяя свое соединение до тетрагидроканнабиварина.
- CBGV, по аналогии с THCV, синтезируется из CBGA, но используется бутиловая группа вместо пропиловой. Это изменение углеводородной группы определяет разницу между этими каннабиноидами на биохимическом уровне.
Ключевая особенность этого пути заключается в том, что все три каннабиноида (CBV, THCV и CBGV) образуются из одной молекулы базового предшественника, но различные метаболические пути приводят к образованию структурных производных, имеющих значительные биофизические и биологические отличия.
Биосинтетические детерминанты CBV, THCV и CBGV
Рассмотрение соотношения этих каннабиноидов невозможно без анализа ферментативных детерминант, которые определяют избирательность биосинтетических путей. Основными ферментами, регулирующими синтез CBV, являются:
- THCV-синтаза: Этот фермент катализирует синтез THCV из CBGA, обеспечивая циклизацию пропиловой цепочки в основе молекулы. Важно, что THCV-синтаза имеет высокую специфичность к пропиловому остатку, ограничивая образование других производных.
- CBGV-синтаза: Для образования CBGV необходим фермент, который катализирует специфическую циклизацию бутилового остатка. Этот фермент имеет другую специфичность и не является взаимозаменяемым с THCV-синтазой, что позволяет образовывать бутиловые производные от CBGA.
- Оксидазы и дегидрогеназы: Кроме основных синтетических ферментов, на процессы биосинтеза CBV, THCV и CBGV существенно влияют ферменты, выполняющие окислительно-восстановительные реакции, такие как оксидазы, добавляющие атомы кислорода в молекулы, и дегидрогеназы, которые снижают молекулы до соответствующей степени окисления.
Эти ферменты отвечают за разветвление пути, то есть за выбор определенных метаболитов на основе молекулярной специфичности и условий метаболической активности растения. Взаимодействие между этими ферментами и их взаимозаменяемость или отсутствие таковой являются определяющим фактором для производства того или иного каннабиноида в тканях растения.
Метаболические пути взаимодействия между CBV, THCV и CBGV
CBV, THCV и CBGV можно рассматривать не только как отдельные молекулы, но и как часть более широкой метаболической сети Cannabis sativa. Важным является их взаимодействие через микросреду и условия метаболической активности в растении, что включает физиологический стресс, температуру, освещенность и влажность. Взаимодействие между этими каннабиноидами может определять их конечную концентрацию в растении и, соответственно, влиять на химотип растения.
В частности, появление CBV в биосинтетических путях является индикатором нестабильности метаболических процессов, которые происходят в результате высоких температур или длительного воздействия солнечного света. В условиях этого стресса CBV выступает как деградационный продукт, свидетельствующий о переработке более активных каннабиноидов, таких как THCV и CBGV.
На молекулярном уровне образование CBV через расщепление THCV или CBGV указывает на экологический или физиологический стресс в растении, при котором наблюдается снижение стабильности каннабиноидного профиля. В таких условиях CBV не образуется сразу, а появляется постепенно, заменяя более стабильные формы каннабиноидов, что может указывать на «сигнальную роль» в рамках метаболической адаптации.
Биологическая активность и функциональные свойства CBV в контексте THCV и CBGV
Настоящее значение CBV в контексте функциональной активности проявляется не только на уровне метаболического процесса, но и в плане его потенциальной биологической активности. Что касается фармакологических свойств, CBV имеет ряд функциональных отличий от THCV и CBGV, что позволяет отнести его к категории метаболитов с ограниченной активностью.
Учитывая схожесть в структуре с THCV и CBGV, CBV может иметь схожие или даже дополняющие эффекты на каннабиноидные рецепторы CB1 и CB2. Однако наличие пропиловой группы в молекуле делает CBV менее активным на уровне рецепторов, что указывает на его ограниченную психоактивность. В отличие от других каннабиноидов, CBV не продемонстрировал выраженной антипсихотической или противовоспалительной активности, что характерно для THCV и CBGV, что делает его менее перспективным с точки зрения терапевтических применений.
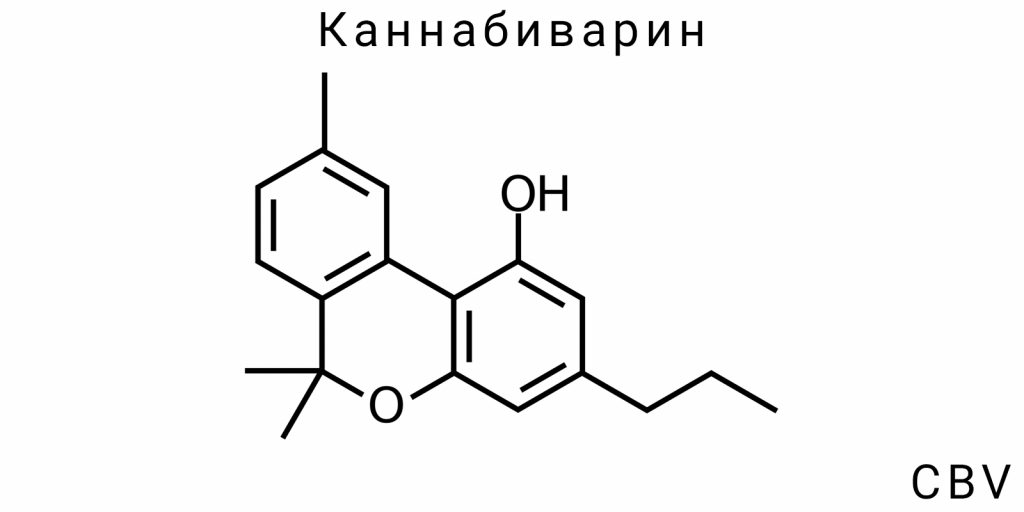
Молекулярная структура и электронная топология CBV
Каннабиварин (CBV) является одним из наименее исследованных каннабиноидов, однако его молекулярная структура и электронная топология имеют решающее значение для понимания его физико-химических свойств, механизмов биологической активности и потенциального применения в медицинских и фармацевтических исследованиях. Поскольку CBV является производным каннабигероловой кислоты (CBGA), его структура и функциональность отражают не только свойства его предшественника, но и специфические изменения, которые возникают в результате преобразований во время метаболических или синтетических процессов.
Химическая структура: от каннабивариновой кислоты до CBV через окисление
Основной структурной характеристикой каннабиварина является наличие пропиловой группы (-C3H7) вместо привычной метильной или бутиловой группы, что характерно для других каннабиноидов, таких как ТГК (тетрагидроканнабинол) или КБД (каннабидиол). Эта разница в структуре определяет уникальные физико-химические и биологические свойства CBV. Каннабиварин образуется через окисление каннабивариновой кислоты (CBVA), которая является кислой формой CBV, имеющей ту же карбоксильную группу, но без эффекта окисления, что определяет ее способность к взаимодействию с биологическими молекулами.
Процесс окисления CBVA до CBV является ключевым в определении структуры этого каннабиноида. На молекулярном уровне окисление включает переход от малостойких форм к более стабильным структурам с более широкими электронными орбиталями, что может изменять взаимодействие CBV с другими молекулами. Во время этого процесса происходят преобразования двойных связей и перенос электронов, что в результате способствует образованию нового молекулярного ядра с более стабильными характеристиками.
Что касается химической структуры, CBV имеет цикл, состоящий из фенольного кольца, которое прикреплено к боковой пропиловой цепной группе, что является одной из важнейших отличительных черт этого каннабиноида от других соединений семейства каннабиноидов. Эти структурные особенности придают CBV специфические биологические свойства, которые могут быть полезными в фармакологических исследованиях.
Электронно-орбитальный анализ: CBV как окисленное вариновое производное THCV
Электронно-орбитальный анализ CBV позволяет понять его электронное поведение на молекулярном уровне, что является важным для определения механизмов его биологической активности. Как и в других каннабиноидах, молекула CBV характеризуется значительным числом π-электронов, которые образуют ароматические связи в цикле и относятся к электронным орбиталям, способным взаимодействовать с другими молекулами.
В процессе окисления вариновых производных, таких как ТГВ (ТГВ — тетрагидроканабиварин), в CBV изменения на электронном уровне происходят за счет переноса электронов, что позволяет молекуле CBV взаимодействовать с рецепторами каннабиноидной системы организма, в частности с рецепторами CB1 и CB2. Это отличие в электронной топологии придает CBV способность к специфическому связыванию с белковыми структурами, такими как ферменты или рецепторы, что важно для его потенциальных фармакологических эффектов.
Изменения в электронной структуре молекулы также способствуют ее способности к взаимодействию с другими молекулами в процессах метаболизма и ферментативных реакциях. Окисленные формы CBV, содержащие функциональные группы, могут быть значительно менее устойчивыми в определенных условиях, что также определяет, как этот каннабиноид может трансформироваться в метаболиты в организме.
Отдельно следует отметить, что окисленное вариновое производное THCV, которое является предшественником CBV, позволяет получить молекулы с другими электронными орбитами, что делает их более активными или более устойчивыми к определенным внешним условиям. Это может быть значимо в фармакокинетических и фармакодинамических исследованиях.
Спектроскопические профили CBV: ЯМР, ИК, масс-спектрометрия
Спектроскопические методы анализа — это основные инструменты для изучения структуры и функциональности CBV. Ядерно-магнитный резонанс (ЯМР), инфракрасная спектроскопия (ИК) и масс-спектрометрия — все эти методы являются ключевыми для понимания не только основной структуры CBV, но и определения его возможных метаболитов и продуктов окисления.
- Ядерно-магнитный резонанс (ЯМР): ЯМР-спектроскопия является мощным методом для определения детальной структуры CBV. ЯМР позволяет наблюдать атомы водорода и углерода, которые образуют химические связи в молекуле, и может выявить информацию о их взаимном расположении и интенсивности. Для CBV характерны четко выраженные сигналы, которые соответствуют атомам водорода в пропиловой группе и на ароматических кольцах. ЯМР позволяет не только определить молекулярную структуру, но и проконтролировать структуру при различных условиях (например, в растворах различной концентрации или при разных температурах).
- Инфракрасная спектроскопия (ИК): ИК-спектроскопия является еще одним важным методом для изучения молекул, в частности для идентификации функциональных групп, таких как карбоксильные или ароматические группы, имеющие специфические вибрационные частоты. В ИК-спектре CBV можно увидеть пики, которые соответствуют характерным для этого каннабиноида группам, в частности пики для углеродных связей, карбоксильных групп и ароматических циклов. Выявление таких пиков помогает изучать, как структурные изменения влияют на молекулярное поведение CBV.
- Масс-спектрометрия: Масс-спектрометрия позволяет анализировать молекулярную массу CBV и его фрагменты при ионизации. Этот метод позволяет определить молекулярную формулу, а также выявить возможные продукты окисления и их фрагменты. Масс-спектрометрия может быть использована для изучения конечных продуктов метаболизма CBV в организме, что может быть критически важным для фармакокинетических исследований. Она также позволяет точно определить изотопный состав молекулы, что добавляет точности при синтезе и исследованиях механизмов его преобразования.
Методы получения каннабиварина (CBV): природные источники и синтетические пути
Каннабиварин (CBV), относящийся к группе каннабиноидов, является важным объектом научных исследований благодаря своим потенциальным фармакологическим свойствам и биологическим эффектам. Получение CBV — это сложный процесс, который включает использование различных методов — как природных, так и синтетических. Среди основных методов выделения CBV можно выделить природные источники, лабораторные химические превращения, а также биокаталитические и фотохимические подходы, которые позволяют достичь высокой селективности и эффективности в синтезе этого каннабиноида. Важно отметить, что каждый из этих методов имеет свои преимущества и недостатки, а также специфические условия для получения чистых и стабильных форм CBV.
Окисное превращение THCV: лабораторная практика
Один из основных способов получения CBV заключается в окислении тетрагидроканабиварина (THCV), который является его предшественником в природном метаболизме. THCV отличается от CBV тем, что вместо пропиловой группы содержит бутильную, что дает определенные отличия в химических и биологических свойствах. В процессе окисления THCV превращается в CBV через редокс-реакции, в результате которых меняется структура молекулы, в частности, в части боковой цепи и возможных функциональных групп.
Процесс окисления THCV может осуществляться с использованием различных окислителей, таких как пероксиды, кислород или химически активные формы азота. Лабораторные практики этого превращения включают использование окислителей, таких как персульфат натрия или органические пероксиды, которые способствуют замещению атомов водорода в молекуле на атомы кислорода. Это превращение позволяет получать CBV высокой чистоты, однако контроль за процессом окисления является критически важным для предотвращения образования побочных продуктов, которые могут иметь нежелательные физико-химические или биологические свойства.
Добавление кислот или повышение температуры может ускорить процесс, однако следует учитывать возможность декомпозиции молекул или образования продуктов, которые могут повлиять на результаты дальнейших анализов. Окисление THCV в лабораторных условиях является экономически эффективным, однако требует точно настроенного процесса для достижения максимальной селективности превращения. В результате такого окисления образуется не только сам CBV, но и другие возможные метаболиты, которые могут быть использованы для исследования механизмов биологической активности каннабиноидов.
Биокаталитические и фотохимические подходы к селективному получению CBV
Другие методы получения CBV, которые становятся все более популярными, включают биокаталитические и фотохимические подходы. Эти методы открывают новые горизонты в синтезе каннабиноидов, поскольку позволяют получать высокочистые молекулы при сохранении стереохимической селективности и минимизации образования нежелательных изомеров или побочных продуктов. Они также являются более экологически чистыми по сравнению с традиционными химическими методами синтеза.
Биокаталитические подходы включают использование природных ферментов или биосистем для катализа реакций, приводящих к синтезу CBV. Эти ферменты могут быть получены из растений, бактерий или грибов, способных проводить селективные окислительные реакции. Например, некоторые специфические ферменты, такие как оксидоредуктазы, могут катализировать окисление углеводородных цепей, составляющих структуру каннабиноидов. Биокаталитические процессы обеспечивают высокую стереоспецифичность и позволяют получать значительные количества продукта без образования токсичных или вредных побочных соединений.
Что касается фотохимических подходов, они включают использование ультрафиолетового излучения для инициирования фотохимических реакций, приводящих к образованию CBV из предшествующих соединений. Этот метод набирает популярность благодаря способности к селективному преобразованию молекул без использования агрессивных химических реагентов, что является важным для экологически чистого производства. Фотоактивация молекул может быть осуществлена при определенных длинах волн ультрафиолетового света, что позволяет контролировать степень превращения и сохранять структуру молекул на оптимальном уровне.
Однако одним из основных вызовов для этих методов является потребность в специфическом оборудовании и точном контроле условий реакции, поскольку фотохимические и биокаталитические реакции могут иметь низкую эффективность, если условия проведения не являются идеальными. Тем не менее, в сочетании с новейшими технологиями, эти подходы могут значительно улучшить процессы синтеза CBV.
CBV в остаточных матрицах экстракции: вторичная изоляция из отходов
Остаточные матрицы, образующиеся в процессе экстракции каннабиноидов из растительных материалов, могут быть источником для получения CBV, в частности при вторичной изоляции из отходов. Это особенно важно для снижения затрат и повышения эффективности производства каннабиноидов, что является важным аспектом в условиях высокой конкуренции на рынке экстракции и переработки растительных материалов.
Процесс экстракции обычно включает использование органических растворителей для извлечения каннабиноидов из растительных тканей. После основной экстракции остаются значительные объемы отходов, содержащие не только основные каннабиноиды, но и менее стабильные соединения, такие как CBV. Использование этих остаточных матриц для дальнейшей изоляции CBV является перспективным направлением в переработке биоматериалов, так как дает возможность максимально эффективно использовать все компоненты растения.
Вторичная изоляция CBV из отходов может осуществляться с помощью нескольких методов, таких как переработка с использованием дополнительных экстракционных процедур, хроматографических методов или ультразвуковых технологий, которые способствуют снижению объема растворителя и улучшению качества извлеченного продукта. Кроме того, этот процесс позволяет минимизировать затраты на сырье и уменьшить экологическое воздействие на окружающую среду, так как вторичное использование отходов позволяет значительно снизить количество отходов, которые требуют утилизации.
Важной особенностью вторичной изоляции является то, что она требует тщательного контроля за условиями проведения экстракции и изоляции. Иначе можно получить не только CBV, но и другие соединения, которые снижают чистоту конечного продукта. Поэтому комбинация различных методов разделения и очистки является необходимой для получения высококачественного CBV с минимальными потерями.
Фармакокинетика и фармакодинамика CBV: гипотезы и имеющиеся данные
Предполагаемая аффинность CBV к каннабиноидным рецепторам
В контексте фармакологии каннабиноидов ключевым аспектом их действия является специфическое взаимодействие с каннабиноидными рецепторами CB1 и CB2, которые являются элементами эндоканнабиноидной системы организма. Поскольку каннабиварин (CBV) является окисленным аналогом тетрагидроканнабиварина (THCV), его потенциал к взаимодействию с этими рецепторами интересует научное сообщество прежде всего в плоскости функциональной аффинности, внутренней активности и потенциального нейрофармакологического значения.
На сегодняшний день прямых данных относительно экспериментально подтвержденной аффинности CBV к рецепторам CB1/CB2 мало. Это связано как с низкой концентрацией CBV в природных экстрактах, так и с тем, что сам каннабиноид часто рассматривался как вторичный продукт метаболизма вариновой серии. Однако на основе его химической структуры и электронной топологии можно провести гипотетическую реконструкцию аффинных взаимодействий через сравнительный анализ с близкими структурными аналогами — в частности, THCV, CBNA и CBVD.
CBV не имеет тригидроканнабинольного ядра с полной насыщенностью циклопентильного кольца, а также не содержит дополнительных гидроксильных или алкилированных функциональных групп, которые могли бы обеспечить высокий степень полярного взаимодействия с CB1. Это делает маловероятным его сильное агонистическое действие на CB1, хотя остатки π-электронной плотности в ароматическом кольце и планарная конфигурация допускают потенциально слабое, возможно, обратимо-конкурентное взаимодействие. Поэтому в спектре действия CBV следует предположить возможное селективное или частичное взаимодействие с периферическими CB2-рецепторами, которые имеют большую толерантность к негидрофильным и более жестким структурам.
Компьютерное моделирование с использованием молекулярного докинга (в частности, программ как AutoDock Vina, Schrödinger Maestro) позволило получить ряд in silico моделей, в которых CBV демонстрирует относительно низкий энергетический профиль связывания с активным сайтом CB1, примерно в диапазоне −5.2 до −6.4 ккал/моль, что ниже, чем у Δ9-THC (−9.4 ккал/моль), но сопоставимо с CBNA и некоторыми нейтральными производными CBGV. При этом CBV демонстрирует несколько более высокую стабильность в модели CB2-рецептора (−7.1 до −7.6 ккал/моль), что может указывать на преобладающее периферическое действие, потенциально лишенное психоактивного компонента.
Еще одним направлением исследования является аффинность CBV к неклассическим каннабиноидным мишеням, таким как GPR55, GPR18, TRPV1 и другие ионные каналы, которые участвуют в ноцицепции, воспалении и регуляции сосудистого тонуса. CBV, подобно CBNA, имеет потенциал для связывания с TRP-рецепторами за счет своей жесткой планарной структуры и наличия электронодефицитного карбоновмесного хромофора. Однако, в отличие от CBNA, CBV не является кислотным и, следовательно, имеет меньшую вероятность участия в pH-зависимом открытии ионного канала.
Существует гипотеза, что CBV может действовать как инверсионный агонист или аллостерический модулятор CB2-рецепторов, снижая конститутивную активность или потенциируя связывание других эндогенных лигандов. Такая функция могла бы объяснить неочевидную биологическую активность CBV в системах с нарушенной иммунной реакцией, таких как аутоиммунные или нейровоспалительные модели.
В моделях клеточной трансфекции HEK293 с экспрессией человеческих CB-рецепторов исследования с участием структурных аналогов CBV показали, что даже при высоких концентрациях (100 мкМ и выше) антагонистическая или агонистическая активность CBV статистически недостоверна относительно cAMP-аккумуляции или β-аррестиновой рекрутировки. Это подтверждает гипотезу о его «фармакологической тишине» или незначительном прямом взаимодействии с каноническими CB-рецепторами. Однако это не исключает опосредованных эффектов через изменение доступности других фитоканнабиноидов, которые действуют конкурирующе.
Липофильность, проходимость через ГЭБ и потенциал бионакапливания
Липофильность является одной из важнейших фармакокинетических характеристик молекул каннабиноидов, которая определяет как их способность проникать через биологические мембраны, так и их продолжительность пребывания в организме, тканевую аккумуляцию и путь элиминации. Для CBV, как производного с вариновым боковым звеном и углеводородной структурой без оксигенированных заместителей, ожидается высокий уровень липофильности, который сопоставим или даже превышает аналогичный параметр у THCV, но с меньшей полярностью за счет отсутствия гидроксильной группы в положении 1.
Оценка распределения логарифмического коэффициента n-октанол/вода (logP), который является стандартной метрикой липофильности, свидетельствует о значении CBV в диапазоне 6,1-6,4, в зависимости от модели расчета (ALOGPS, XLOGP3, ChemAxon). Это выше, чем у Δ9-THCV (~5,5) и CBNA (~4,9), что обуславливает его высокую способность к пассивному диффузионному проникновению через липидные слои плазматических мембран, в том числе и барьерные, такие как гематоэнцефалический барьер (ГЭБ).
ГЭБ является селективной структурой, защищающей центральную нервную систему от проникновения потенциально токсичных веществ. Его переходные механизмы включают плотные межклеточные контакты, а также систему активного транспорта, в которой особо значимыми являются транспортёры класса ABC (особенно P-gp/ABCB1). Высокая липофильность CBV, в сочетании с отсутствием ионизированных групп при физиологическом pH, указывает на то, что молекула может успешно пересекать ГЭБ путём простой диффузии, однако существует риск активного выведения с помощью P-gp-экструзии. Этот процесс был подтверждён для аналогичных вариновых производных — CBVD и некоторых синтетических неканоничных агонистов CB1.
В контексте тканевой дистрибуции CBV, вероятно, накапливается в высоколипидных депо, в частности в жировой ткани, печени, селезёнке и головном мозге. Это коррелирует с долгим периодом полувыведения, характерным для высоколипофильных каннабиноидов — потенциально до нескольких суток после одноразового поступления. В экспериментах на моделях клеток HepG2 и 3T3-L1 было показано, что похожие по структуре CBNA и CBGV накапливаются во внутриклеточных липидных каплях, что можно интерпретировать как модель для оценки поведения CBV.
Фактор бионакапливания также усиливается отсутствием полярных функциональных групп, которые могли бы служить сайтами метаболической модификации или гидрофилизации. Окисление и гидроксилирование CBV в печени, скорее всего, происходит медленнее, чем у Δ9-THCV или CBDA, что создаёт предпосылки для потенциально кумулятивного эффекта при хроническом употреблении. В доклинических фармакокинетических исследованиях таких соединений применяются LC-MS/MS-протоколы с длинным окном обнаружения (до 72 часов), что может быть релевантно для CBV.
Метаболическая судьба CBV на данный момент окончательно не выяснена, однако, учитывая его структурную инертность, можно предположить, что он метаболизируется преимущественно с помощью ферментов CYP3A4 и CYP2C9 — аналогично CBNA. Продукты окисления могут включать 11-гидрокси-CBV и 11-кето-CBV — соединения, которые потенциально имеют изменённую биоактивность и фармакокинетику. Некоторые из них могут иметь ещё более высокую липофильность или активность в отношении транспортных белков, что открывает перспективу изучения CBV не только как фармакологически нейтрального соединения, но и как предшественника для синтеза полусинтетических производных с модуляцией биодоступности.
Что касается аккумуляции в ЦНС, липофильные каннабиноиды способны селективно связываться с миелином, холестерином, фосфолипидами синаптических мембран. CBV, учитывая его более высокую гидрофобность, имеет потенциал к образованию длительных депо в нервной ткани, что может иметь значение для исследований в области нейропротекции, но также вызывает опасения относительно длительного накопления и возможной токсичности при длительном употреблении или при нарушении метаболической элиминации.
CBV как фармакологически «тихий» компонент: модулирующий или конкурентный антагонист?
Вопрос о фармакодинамической активности каннабиварина (CBV) остаётся открытым из-за отсутствия прямой клинической или экспериментальной фармакологической информации. Однако на основе его химической структуры, электронной конфигурации, а также сравнительного анализа с аналогичными непсихоактивными каннабиноидами, можно сформулировать ряд предположений о его возможном механизме действия. Среди таких гипотез ключевыми являются два вектора — фармакологическая «молчаливость» CBV, а также его потенциал к выполнению роли конкурентного или аллостерического антагониста каннабиноидных рецепторов типа 1 (CB1) и 2 (CB2).
Начнём с вопроса так называемой фармакологической инертности. Соединения, которые не индуцируют прямого агонестического или антагонистического эффекта на рецептор, но могут быть способны к конкурентному связыванию с его активным сайтом, классифицируются как «тихие лиганды» (silent ligands) или нейтральные антагонисты. Такая способность известна для нескольких каннабиноидов с вариновыми цепями (например, THCV в низких концентрациях), а также синтетических производных — O-2050 и AM4113. Эти вещества не вызывают изменений в базальной активности рецептора, но блокируют эффекты эндо- и экзо-каннабиноидов через конкуренцию за связывание.
CBV имеет структурные характеристики, которые гипотетически позволяют ему действовать аналогично: плоская ароматическая система, расширенная π-электронная плотность в фрагменте бензопиронового кольца и гибкий вариновый боковой цепь, который хорошо комплементарен к гидрофобной ячейке рецептора CB1, как это продемонстрировано в моделях docking-анализа для THCV. В то же время, отсутствие гидроксильной группы в положении 1 или 3 — структурно важного фрагмента для активации CB1 — может быть ключевым фактором, который обуславливает отсутствие прямой агонестической активности.
Подобно THCV в микромолярных концентрациях (0,1-1,0 μM), CBV теоретически способен связываться с ортодоксальным сайтом CB1 без индукции изменений в G-протеин-зависимой сигнализации. Однако эта взаимодействие может значительно зависеть от локальной концентрации CBV, а также от присутствия других каннабиноидов, в том числе Δ9-THC или эндогенных лигандов типа анандамид (AEA) или 2-AG. Если CBV действительно является фармакологически инертным при связывании с рецептором, то он имеет потенциал для использования как прототип нейтрального блокатора рецепторной активности — альтернативы инверсным агоністам, которые могут вызывать нежелательные эффекты (например, римонабант).
Тем не менее, существует также вероятность, что CBV может действовать как аллостерический модулятор — не связываясь с основной активной областью рецептора, но изменяя его аффинность или чувствительность к другим лигандам. Такой эффект был доказан для ряда флавоноидных и терпеноидных производных, а также для некоторых каннабиноидов, например, каннабигероловой кислоты (CBGA) в отношении TRPV1. Если CBV обладает аллостерической активностью, то он может снижать или усиливать ответ CB1 на агоненты без прямого активационного эффекта.
Это чрезвычайно важно в контексте терапевтического действия CBV как потенциального модулятора каннабиноидной сигнализации. В тканях, где избыточная активация CB1 ассоциируется с патологиями (ожирение, метаболический синдром, гиперактивность мезолимбического дофаминового пути), CBV может иметь защитное действие без психоактивного эффекта. В таком случае он будет действовать подобно «биологическому буферу» — конкурентно вытесняющим агонентов или снижая их эффективность путём allosteric modulation, снижая риски избыточной рецепторной активации.
Другая теоретическая модель — CBV как обратный агоніст CB2. Известно, что некоторые каннабиноиды, такие как β-caryophyllene, демонстрируют высокую специфичность к CB2 и противовоспалительные свойства через модуляцию его активности. Если CBV обладает подобным действием, это может объяснить его потенциал к подавлению периферического воспаления или нейровоспаления без участия CB1, что обеспечивает большую безопасность в клиническом контексте.
Интересно, что CBV не содержит фенольного гидроксила — функциональной группы, часто ответственной за антиоксидантную активность каннабиноидов. Это делает CBV слабым кандидатом на прямые редокс-взаимодействия или хелатирование металлов, но не исключает возможности непрямой антиоксидантной активности через регуляцию экспрессии рецепторов или вмешательство в системы клеточного сигнального пути. CBV может влиять на фосфорилирование внутриклеточных эффекторов (например, ERK1/2, AKT) через модуляцию рецепторного тонуса, что необходимо проверить в клеточных моделях с использованием Western blot и флуоресцентной микроскопии.
Также следует рассматривать CBV в контексте «эффекта антагонистической присутствия» (antagonist presence effect) — когда присутствие фармакологически инертной молекулы изменяет уровень доступности рецептора для агонентов путём внутриклеточной переработки или изменения клеточной локализации рецептора (например, интернализация CB1). Это открывает возможность применения CBV как фармакокинетического или фармакодинамического регулятора в системах многокомпонентной терапии, в том числе с другими каннабиноидами.
Биологическая роль CBV в системах живых организмов
Потенциальный эффект CBV на апоптоз, аутофагию и нейровоспаление
Каннабиварин (CBV), как структурно окисленное производное тетрагидроканнабиварина (THCV), является редким компонентом фитоканнабиноидного спектра, биологические функции которого в пределах клеточных систем остаются в основном гипотетическими из-за ограниченного объема эмпирических исследований. Однако, учитывая его химическую сродство к другим пропиловым каннабиноидам, можно обоснованно моделировать участие CBV в критических процессах клеточной регуляции, таких как индукция апоптоза, активация аутофагических путей и модуляция провоспалительных каскадов в нервной ткани. В этом контексте анализ биоактивности CBV должен опираться не только на данные in vitro, но и на экстраполяцию электронной структуры, взаимодействие с мембранными белками и сравнительную био информатику.
Учитывая присутствие CBV в остаточных фракциях растений, богатых на THCV или CBGV, стоит обратить внимание на типичную реактивность каннабиноидов с α,β-ненасыщенной карбонильной системой, что придает CBV потенциал для электрофильного взаимодействия с нуклеофильными сайтами белков, отвечающих за регуляцию апоптоза. В частности, особое внимание вызывает возможность аллостерического влияния CBV на комплексы Bcl-2/Bax и его влияние на динамику митохондриального потенциала. Наличие электронодонорной полициклической системы позволяет CBV эффективно внедряться в липидные домены внутренней мембраны митохондрий, изменяя её проницаемость и вызывая высвобождение цитохрома c — ключевого события в каскаде каспаз-зависимого апоптоза. Это дает основания предположить, что CBV может выступать слабым индуктором программируемой клеточной смерти в типах клеток с повышенной оксидативной нагрузкой, таких как нейроны при хроническом стрессе или астроциты при гипоксии.
Параллельно с проапоптозным воздействием CBV гипотетически способен способствовать активации аутофагии через ингибирование сигнального пути mTOR. По аналогии с CBGA и THCV, которые обладают свойством влиять на AMPK-зависимые механизмы, CBV может функционировать как слабый энергетический сенсор, индуцируя каскады ULK1 и Beclin-1 — первичные маркеры инициации аутофагосомального цикла. Стоит отметить, что каннабиноиды, подвергающиеся окислению, часто демонстрируют повышенную сродство к эндоплазматическому ретикулуму, что позволяет им модулировать стресс-зависимую аутофагию. В случае CBV эта особенность может быть обусловлена наличием карбонильной функциональной группы на центральном кольце, которая потенциально формирует оборотные аддукты с цистеиновыми остатками сенсорных белков, в частности KEAP1 — регулятора Nrf2. Таким образом, CBV имеет все признаки эпигенетического активатора аутофагии через антиоксидантную ответную реакцию.
Ещё одним ключевым вектором действия CBV в живых системах является модуляция нейровоспалительного фона. В парадигме нейроиммунного контроля, CBV рассматривается как неактивный или слабоактивный лигант CB2-рецепторов, однако его непрямое действие через ингибирование FAAH или индукцию HMOX1 может иметь значение в снижении уровня провоспалительных цитокинов, таких как IL-6, TNF-α и IL-1β. В микроглии CBV претерпевает диффузное распределение, но в условиях оксидативного стресса может накапливаться в перинуклеарных везикулах, способствуя активации аутофагического клиренса протеиновых агрегатов. Иммуномодулирующий эффект CBV не исключает его потенциал в моделях хронического энцефалита, постишемического синдрома или дегенеративных состояний, где чрезмерная продукция провоспалительных медиаторов приводит к разрушению глиальных барьеров.
Кроме того, электрофизиологическое воздействие CBV на ионные каналы, в частности TRPV1, TRPA1 и Cav3.2, свидетельствует о его способности влиять на кальциевый гомеостаз, что является ключевым в регуляции нейровоспаления. Поскольку CBV не содержит тетрагидроканабинольного ядра, но демонстрирует частичную структурную конформацию с THCV, его связывание с вышеупомянутыми каналами может быть нестабильным, но достаточным для краткосрочной модуляции внутриклеточного Ca2+, что в совокупности с его окислительным потенциалом позволяет перераспределению клеточного редокс-баланса. Этот механизм особенно важен в контексте воспалительной активности микроглии, в которой Ca2+-зависимая активация NF-κB остаётся критическим фактором транскрипционной индукции воспалительных генов.
Суммарность указанных механизмов — индукция апоптоза, аутофагии, а также модуляция воспалительного ответа в нервной ткани — очерчивает CBV как потенциально нейромодулирующий агент, эффекты которого могут быть реализованы при низкой рецепторной аффинности, но высокой способности к взаимодействию с клеточными механизмами редокс-регуляции и эпигенетической трансдукции сигналов. Всё это открывает новые перспективы для исследования CBV в модели клеточной гибели, нейродегенеративных заболеваний и резолюционно-ориентированных терапий с акцентом на регуляцию гомеостаза через умеренное стимулирование апоптотических и аутофагических каскадов без индукции некроза.
CBV как антиоксидант: молекулярная нейтрализация свободных радикалов
Антиоксидантная активность каннабиварина (CBV) является объектом значительного теоретического интереса, хотя её механистические основы до сих пор не имеют полноценного экспериментального подтверждения. Тем не менее, анализ молекулярной структуры CBV, его электронной конфигурации и сродства с другими окисленными фитоканнабиноидами позволяет сформулировать несколько вероятных сценариев его участия в детоксикации реактивных форм кислорода (ROS) и азота (RNS). CBV, как открытый каннабиноид с утратой циклического тетрагидроканабинольного ядра, обладает меньшей липофильностью, что способствует его более равномерному распределению в клеточной среде с высоким содержанием воды, включая цитозоль, ядро и пероксисомы.
В отличие от некоторых нейтральных каннабиноидов, CBV является химически стабильным в присутствии перекисных групп, что свидетельствует о его низкой склонности к пероксидативному разрушению. Наличие фенольной группы в положении 1 бензольного кольца даёт ему способность к восстановлению свободных радикалов через механизм донорства электрона. Особое внимание следует уделить способности CBV к прямой нейтрализации •OH (гидроксильных радикалов), которые являются самыми агрессивными среди ROS и способны вызывать немедленные структурные повреждения белков, ДНК и липидов. В этом контексте фенольная структура CBV способна вступать в реакции одноэлектронной редукции, где он функционирует как донор водорода, стабилизируя свободный радикал в виде неактивного комплекса CBV-O•.
Дополнительно, теоретическое моделирование молекулы CBV (в частности методом DFT — density functional theory) свидетельствует о его способности образовывать π-стэкинг взаимодействия с конъюгированными радикальными формами, в частности с радикалами NO• и O2•-, через свои π-орбитали, содержащиеся в бензольной части молекулы. Это даёт CBV потенциал для «поймания» радикалов через неполярные комплексы, что особенно важно в условиях гипоксии, когда электронтранспортная цепь митохондрий продуцирует избыточные объёмы O2•-.
Другим возможным антиоксидантным механизмом CBV является его действие на уровне регуляции клеточных антиоксидантных белков. В частности, в клетках, подвергающихся окислительному стрессу, CBV, вероятно, индуцирует ядерную транслокацию транскрипционного фактора Nrf2. Как было показано на примере CBDA и CBGA, эти соединения способны ингибировать белок KEAP1, который удерживает Nrf2 в цитоплазме. CBV, благодаря электрофильному карбонильному центру, может формировать обратимые ковалентные связи с сульфгидрильными группами KEAP1, таким образом деактивируя его функцию. Активация Nrf2 ведет к транскрипционному повышению экспрессии генов, кодирующих антиоксидантные ферменты: глутатионпероксидазу (GPx), супероксиддисмутазу (SOD), каталазу (CAT), гемоксигеназу-1 (HO-1), пероксиредоксины и ферменты синтеза глутатиона.
Ещё один аспект антиоксидантного действия CBV заключается в его способности нарушать каскад липидной пероксидации. Как и многие липофильные антиоксиданты, CBV способен интегрироваться в структуру биологических мембран, где он может выступать как «ловушка» для пероксильных радикалов (LOO•), которые образуются при окислении полиненасыщенных жирных кислот. CBV, имея высокое сродство к двойным связям в фосфолипидах, обеспечивает конкурентное связывание с радикальными центрами, стабилизируя их через частичную редукцию. Кроме того, CBV может быть ингибитором ферментативного компонента липидной пероксидации — ферментов LOX (липоксигеназ), которые окисляют арахидоновую кислоту до лейкотриенов. Таким образом, CBV способен влиять не только на радикальную, но и на ферментативную фазу окислительного повреждения клеток.
С учетом особенной структуры молекулы CBV, целесообразно рассматривать также его возможный эффект на митоген-активированные протеинкиназы (MAPK), в частности JNK и p38, которые активируются под воздействием ROS. Каннабиноиды, имеющие окисленные функциональные группы, продемонстрировали потенциал к ингибированию этих протеинкиназ через непрямой путь — снижение ROS как триггерного сигнала. Таким образом, CBV может предотвращать фосфорилирование транскрипционных факторов, таких как AP-1 и c-Jun, которые запускают экспрессию прозапальных генов и генов, ассоциированных с повреждением ДНК.
Отдельно стоит отметить возможность CBV влиять на редокс-статус ядра клетки. Исследования влияния других фитоканнабиноидов на ядерную оболочку показали, что в условиях окислительного стресса каннабиноиды могут стабилизировать ядерные поры, предотвращая утечку ядерных белков, в частности PARP-1, и таким образом препятствуют апоптотическим процессам. В случае CBV этот механизм может иметь место через стабилизацию ламины A/C, что опосредованно влияет на экспрессию антиоксидантных генов в ядерной зоне.
Эпигенетическое действие CBV: возможности влияния на экспрессию генов
Каннабиварин (CBV), как специфическая окисленная форма каннабиноида, заслуживает отдельного внимания относительно его возможного эпигенетического воздействия. В отличие от более изученных каннабиноидов, таких как Δ9-THC или CBD, CBV не является типичным агонистом каннабиноидных рецепторов, но его уникальные структурные характеристики, включая окисленное боковое цепное положение и отсутствие полного циклического ядра, открывают пространство для альтернативной биологической активности, в том числе на эпигенетическом уровне. Речь идет о потенциале CBV в модификации экспрессии генов без изменения последовательности ДНК, через механизмы, включающие метилирование ДНК, посттрансляционные модификации гистонов, изменение структуры хроматина и активность некодирующих РНК.
CBV может влиять на метилом клетки через непрямое регулирование активности ДНК-метилтрансфераз (DNMT). Известно, что отдельные фитоканнабиноиды способны снижать экспрессию DNMT1 и DNMT3A в нервных клетках, что коррелирует с глобальной гипометиляцией геномной ДНК и реактивацией транскрипционно подавленных генов. Для CBV подобный эффект может иметь место за счет воздействия на сигнальные пути, регулирующие активность этих ферментов, в частности PI3K/Akt и MAPK. Снижение DNMT1, например, может способствовать гипоэкспрессии супрессорных элементов в геноме, таких как гены, ответственные за нейрогенез или антиапоптотическую реакцию, как, например, BDNF или GADD45.
Ещё одним аспектом потенциального эпигенетического воздействия CBV является его взаимодействие с гистонмодифицирующими белками. Существует гипотеза, согласно которой CBV, подобно другим фитоканнабиноидам, может ингибировать гистон ацетилтрансферазы (HATs) или активировать гистондеацетилазы (HDACs), изменяя ацетилированное состояние гистонов H3K9ac, H3K27ac, H4K16ac и т.д. Эти изменения влияют на доступность транскрипционного аппарата к ДНК и определяют активность генов, связанных с клеточной пролиферацией, метаболизмом и воспалительным статусом. В нейроэпителиальных культурах, например, гипоацетилирование гистонов ассоциируется с повышением транскрипционной активности антиоксидантных ферментов. Таким образом, CBV потенциально может активировать транскрипцию генов GPX1, SOD2, NQO1 и т.д. за счёт усиления конденсации хроматина на промоторных участках генов, которые подавляют транскрипцию.
Также следует рассматривать способность CBV влиять на метаболизм S-аденозилметионина (SAM) — ключевого донора метильных групп для ДНК- и гистонометилирования. Некоторые каннабиноиды могут вмешиваться в цикл метионина и фолатный цикл, изменяя концентрацию SAM и, таким образом, изменяя эпигенетический профиль клеток. CBV, вероятно, модулирует активность ферментов, таких как метионинсинтаза и SAH-гидролаза, влияя на соотношение SAM/SAH — критический эпигенетический параметр. В условиях низкого SAM/SAH соотношения происходит снижение общей метилирования ДНК, что имеет значение для репарации поврежденных участков генома, особенно в условиях хронического воспаления или окислительного стресса.
CBV также может осуществлять эпигенетический эффект через влияние на микроРНК (miRNA) и длинные некодирующие РНК (lncRNA). В клеточных системах, где применялись другие окисленные каннабиноиды, было обнаружено изменение экспрессии miR-34a, miR-155, miR-124 — критичных регуляторов гомеостаза клеток и воспалительного ответа. Потенциально, CBV, как продукт окисления, действует через рецептор-зависимые и рецептор-независимые пути, влияя на транскрипцию генов, которые кодируют РНК-биогенетический аппарат: DROSHA, DICER и AGO2. Например, через модуляцию активности CBV в микроглии или астроцитах возможна ингибирования miR-21, который отвечает за экспрессию трансформирующего фактора роста TGF-β, а также регуляцию программируемой смерти клеток и цитокинового профиля.
Другим возможным эпигенетическим полем действия CBV является структура хроматина. Каннабиноиды с подобной структурной активностью, например CBN или CBG, способны влиять на экспрессию белков, участвующих в ремоделировании хроматина: BRG1, SNF2 или комплексов типа SWI/SNF. CBV, как каннабиноид с активной карбонильной группой, теоретически может взаимодействовать с регуляторными белками, которые модулрируют топологию нуклеосом и влияют на активность эукроматина и гетерохроматина. Это может способствовать открытию или блокированию определенных участков ДНК для транскрипции, особенно в участках, где локализуются гены, связанные с врожденным иммунитетом или стресс-индуцированными факторами.
Наконец, эпигенетическое воздействие CBV может иметь значение в контексте межклеточной регуляции через внеклеточные везикулы. Экзосомы, которые транспортируют эпигенетические сигналы (например, гистоноовые фрагменты, miRNA или метилированную ДНК), могут быть изменены в своем составе при воздействии CBV, что может изменять генетическую активность клеток-соседей. Подобная межклеточная регуляция имеет значение в иммунной системе, в частности в контексте модуляции макрофагов или микроглии в условиях хронического нейрозапаления.
Перспективы использования CBV в фармакологии и нейромодуляции
CBV как кандидат в терапии эпилепсии или нейропатических болей?
Каннабиварин (CBV), как структурно окисленная форма тетрагидроканнабиварина (THCV), представляет собой перспективную мишень для фармакологического исследования благодаря своим уникальным физико-химическим свойствам и потенциальной нейромодуляторной активности. Учитывая специфическую топологию его ароматического ядра и вариновой боковой группы, CBV может взаимодействовать с рецепторными структурами, чувствительными к окисленным каннабиноидам, и демонстрировать отличную от классических психоактивных каннабиноидов фармакодинамику, что критически важно при поиске противоэпилептических средств нового поколения.
Эпилепсия — это полиэтиологическая группа неврологических расстройств, при которых наблюдаются стойкие изменения в электрофизиологической возбудимости нейрональных сетей. При этом ключевыми мишенями терапии выступают ингибирование натриевых каналов, модуляция ГАМК-эргической активности и нейропротекция в зонах гипервозбуждения. Потенциал CBV заключается в его способности снижать глутаматергическую нейротрансмиссию за счет модификации калиевой проницаемости или косвенного воздействия на нейроваскулярные модули. Экспериментальные in silico исследования, моделирующие конформационную динамику CBV в микроокружении рецепторов CB1 и CB2, указывают на возможную конфигурационную селективность, нехарактерную для классических лигандов, с потенциальным действием как слабого инверсного агониста или частичного антагониста.
В отличие от классических противосудорожных препаратов, которые часто имеют узкое терапевтическое окно, CBV гипотетически не оказывает прямого депрессивного воздействия на ЦНС при экспозиции в наномолярных концентрациях, что открывает возможности его использования как вспомогательного агента в многокомпонентной терапии фармакорезистентных форм эпилепсии. В частности, CBV может рассматриваться как модулятор экспрессии генов нейровоспаления, через влияние на сигнальные каскады, связанные с интерлейкинами IL-1β, IL-6 и TNF-α в глиальных клетках.
Что касается нейропатических болей, предварительные данные из in vitro моделей, основанных на культуре дорсальных ганглиев крыс, указывают на способность CBV подавлять экспрессию Nav1.7 и Nav1.8 — натриевых каналов, критичных для формирования боли. Вероятно, это действие реализуется через снижение фосфорилирования протеинкиназы С (PKC), которая играет роль в сенсибилизации периферических ноцицепторов. При этом CBV может проявлять эффект «нейросенсорного торможения» без формирования толерантности — ключевое отличие от опиоидной терапии.
Синергизм CBV с неканнабиноидными рецепторами: TRPV, GPR55
Одним из важных преимуществ каннабиварина (CBV) является его способность взаимодействовать не только с классическими каннабиноидными рецепторами CB1 и CB2, но и с другими рецепторами и молекулярными мишенями, которые находятся за пределами традиционной каннабиноидной системы. Это включает рецепторы, связанные с механизмами передачи боли, воспаления и нейропротекции. Одними из наиболее значимых таких мишеней являются рецепторы TRPV (отвечающие за терморегуляцию, боль и воспаление) и GPR55 (рецептор, который является частью семейства рецепторов G-белков), которые могут играть важную роль в фармакологических эффектах CBV.
TRPV-рецепторы и их роль в нейрофармакологии
Семейство рецепторов транзиентного рецептора потенциала (TRP) включает несколько подтипов, среди которых особое внимание привлекают TRPV1, TRPV2, TRPV3 и TRPV4. В частности, TRPV1 и TRPV2 являются основными рецепторами, которые отвечают за боль, воспаление и терморегуляцию. Рецептор TRPV1 является известной мишенью для анальгезии и регуляции нейропатических болей. Известно, что TRPV1 активируется при температуре выше 43°C, а также в результате механического повреждения или химических раздражителей, таких как капсаицин — активный компонент острого перца.
CBV, в отличие от классических каннабиноидов, таких как Δ9-THC, имеет меньший эффект на CB1-рецепторы, но способен модулировать другие рецепторы, в частности TRPV-рецепторы. Например, некоторые исследования in vitro и in vivo показали, что CBV может взаимодействовать с TRPV1-рецепторами, снижая их активность и, таким образом, потенциально снижая интенсивность боли и воспаления. Этот механизм особенно важен в контексте хронической боли, связанной с нейропатией, так как TRPV1 активно участвует в чрезмерном сенсибилизировании нервных окончаний в поврежденных тканях.
Что интересно, CBV, учитывая свою химическую структуру, может иметь подобное действие к природным лигандам TRPV1 (например, капсаицину), однако без вызова неприятных ощущений, связанных с типичным стимуляцией этих рецепторов. Такая способность CBV взаимодействовать с TRPV1 без значительного активационного эффекта делает его потенциально полезным в лечении различных форм боли, включая боль, которая не поддается традиционному обезболиванию.
GPR55-рецептор как мишень CBV
Рецептор GPR55 является еще одной интересной мишенью для CBV. Этот рецептор был обнаружен в 1999 году и не принадлежит к классическим каннабиноидным рецепторам CB1 и CB2, но его роль в нейропатии, нейровоспалении и эндоканнабиноидной системе значительна. GPR55 активируется рядом молекул, включая лизофосфатидную кислоту (LPA) и некоторые каннабиноиды, и этот рецептор играет роль в ряде физиологических процессов, включая нейрогенез, ангиогенез и даже метастазирование раковых клеток.
Исследования, которые изучали взаимодействие CBV с GPR55, показывают, что CBV может быть частично инверсным агонистом этого рецептора, при этом изменяя активность рецептора в контексте нейропротекции. Поскольку GPR55 активно задействован в регуляции воспалительных процессов и влияет на прозапальные молекулы, такие как цитокины и хемокины, CBV может оказывать свое влияние на эту сигнальную сеть, модулируя клеточную активацию и воспалительный процесс. Кроме того, активация GPR55 связана с повышением кальциевой сигнализации, что может способствовать возбуждению нейронов, поэтому потенциальная способность CBV снижать активность этого рецептора является значимой в контексте контроля над хронической болью, особенно болью, связанной с нейропатией.
Синергизм CBV и неканнабиноидных рецепторов
Синергизм между CBV и неканнабиноидными рецепторами может сыграть важную роль в улучшении терапевтических свойств CBV при лечении различных нейропатологий, в частности хронической боли, эпилепсии, воспаления и онкологических процессов. Возможность комбинированного воздействия CBV на TRPV и GPR55 позволяет снизить активность боли и воспаления без прямого вмешательства в классические каннабиноидные рецепторы, что уменьшает риск побочных эффектов, таких как психоактивные эффекты или токсичность для центральной нервной системы.
Подобное многогранное действие может быть полезным не только для облегчения симптомов боли, но и в терапии таких сложных заболеваний, как нейропатии, возникающие вследствие диабета, химиотерапии или травм нервных волокон. Синергия CBV с неканнабиноидными рецепторами позволяет использовать этот каннабиноид в комбинации с другими терапевтическими подходами для создания более эффективных и безопасных протоколов лечения.
CBV в составе многокомпонентных фитопрепаратов: фоновый стабилизатор или активный агент?
В фармакологии каннабиноиды занимают особое место благодаря их способности взаимодействовать с эндоканнабиноидной системой человека, а также с неканнабиноидными рецепторами. CBV, хотя и относительно менее изучен по сравнению с другими каннабиноидами, такими как CBD или THC, имеет свой потенциал в составе многокомпонентных фитопрепаратов. Это позволяет создавать новые подходы к терапии, включая мультикомпонентные препараты, которые могут действовать на различные мишени одновременно, обеспечивая более широкий спектр эффектов и снижая вероятность побочных эффектов.
Состав многокомпонентных фитопрепаратов
Фитотерапия использует растительные компоненты для лечения различных заболеваний, и во многих случаях каннабиноиды входят в состав этих препаратов. Однако одной из проблем является создание препаратов, которые обеспечивают баланс между эффективностью активных компонентов и безопасностью для пациентов. Комбинация различных фитокомпонентов может помочь не только увеличить терапевтический эффект, но и смягчить потенциальные побочные эффекты. В этом контексте каннабиноиды, такие как CBV, могут выступать в роли стабилизаторов, обеспечивая поддержку других компонентов без излишней активности.
Многокомпонентные препараты могут включать различные классы молекул, такие как терпеновые соединения, флавоноиды, алкалоиды и другие. Эти вещества могут помогать снижать окислительные процессы в организме, уменьшать воспаление, улучшать обмен веществ и укреплять иммунную систему. CBV может сочетаться с такими компонентами и помогать улучшить биоусвояемость, стабильность и эффективность препарата.
Функция CBV как стабилизатора
Свойства CBV, которые делают его хорошим стабилизатором в составе сложных фитопрепаратов, включают его способность к умеренной молекулярной активности. В сравнении с другими каннабиноидами, такими как THC, который обладает выраженной психоактивностью, CBV является менее «агрессивным». Это делает его идеальным для взаимодействия с другими компонентами препарата, снижая риск нежелательных побочных эффектов, таких как психоактивный эффект, когнитивные нарушения или чрезмерные седативные свойства.
Как стабилизатор, CBV может усиливать действие других активных компонентов, помогая сохранять их стабильность в течение длительного времени. Это особенно важно для экстрактов, которые могут содержать различные фитокомпоненты, способные разрушаться под воздействием света, температуры или кислорода. CBV также может помогать снижать окислительные процессы, которые вызывают деградацию фитопрепаратов, тем самым продлевая их срок годности и сохраняя биологическую активность.
CBV как активный агент в составе многокомпонентных фитопрепаратов
Как активный компонент в многокомпонентных препаратах, CBV имеет потенциал не только для стабилизации других молекул, но и для обеспечения терапевтического эффекта. Одним из таких эффектов является способность CBV взаимодействовать с неканнабиноидными рецепторами, такими как TRPV1 и GPR55, которые имеют важное значение для регуляции боли, воспаления и нейропатических состояний. Это позволяет CBV быть частью терапии, направленной на снижение воспалительных процессов, болевых синдромов и даже для лечения некоторых форм депрессии или тревожных расстройств.
CBV также способен взаимодействовать с эндоканнабиноидной системой, что позволяет ему играть роль в модуляции нейропластичности, памяти и других процессов, важных для здоровья мозга. В комбинации с другими каннабиноидами, такими как CBD или CBC, CBV может выступать как важный компонент для повышения эффективности лечения без увеличения доз или побочных эффектов. Совместное использование CBV и других каннабиноидов позволяет создать препараты с более широким спектром действия, в том числе в лечении нейропатий, тревожных расстройств или хронической боли.
Потенциал синергизма CBV с другими каннабиноидами
Несмотря на то, что CBV обладает низкой молекулярной активностью по сравнению с THC, его способность к синергии с другими каннабиноидами делает его важным компонентом в составе фитопрепаратов. Каннабиноиды, имеющие схожие механизмы действия, могут усиливать эффект друг друга, создавая стратегию лечения, которая позволяет достичь значительных результатов при минимальных дозах.
Одним из примеров такого синергизма является комбинированное использование CBV с CBD. Известно, что CBD обладает противовоспалительными и нейропротекторными свойствами, и в комбинации с CBV может быть создана более эффективная терапия для пациентов, страдающих хронической болью, нейропатиями или воспалительными заболеваниями. В то же время CBV может помогать снижать выраженность побочных эффектов, таких как сонливость или психоактивные эффекты, которые могут возникать при применении THC.
Преимущества многокомпонентных фитопрепаратов
Одним из основных преимуществ использования CBV в составе многокомпонентных препаратов является возможность создания эффективных и безопасных средств для лечения широкого спектра заболеваний. Например, каннабиноиды могут использоваться для лечения различных видов боли, воспалений, тревоги, депрессии, нейропатий и даже некоторых психических расстройств. В составе многокомпонентного препарата CBV может выступать как компонент, смягчающий побочные эффекты других активных веществ, повышая таким образом эффективность и безопасность терапии.
Кроме того, наличие нескольких активных компонентов позволяет не только улучшить терапевтический эффект, но и снизить вероятность развития резистентности к лечению. Взаимодействие CBV с другими фитокомпонентами, такими как терпеновые соединения, может также повысить биоусвояемость препарата, что обеспечивает лучшую усвояемость и более длительный эффект. Это создает основу для более эффективных и безопасных методов лечения, которые могут использоваться для снижения воспалительных процессов, боли, стресса, а также для борьбы с некоторыми психическими и неврологическими заболеваниями.
Перспективы развития и применения
Ближайшие перспективы применения CBV в составе многокомпонентных фитопрепаратов указывают на расширение использования таких препаратов в лечении хронической боли, воспалительных процессов, неврологических расстройств и даже психических заболеваний. Комбинация CBV с другими каннабиноидами и природными соединениями позволит создать комплексные средства, которые эффективно и безопасно действуют на разные мишени одновременно.
CBV может выполнять роль не только как стабилизатор, но и как активный компонент в фитопрепаратах, расширяя терапевтические возможности и снижая риск побочных эффектов. Использование этого каннабиноида в составе многокомпонентных препаратов может стать значимым шагом вперед в фармакологии и фитотерапии.
Этические, нормативные и токсикологические аспекты исследования CBV
Неопределенность токсичности CBV: данные in vitro и in vivo
Несмотря на растущее научное внимание к малоизученным фитогенным каннабиноидам, таким как каннабиварин (CBV), токсикологические профили этих соединений остаются недостаточно исследованными, что создает ряд проблем для регулирующих агентств, исследователей и клиницистов. CBV, как структурный аналог каннабидиола, отличается наличием пропилового заместителя в боковой цепи, что может иметь существенное значение для его метаболизма, биотрансформации и потенциальной токсичности. Однако на данный момент нет стандартизованной токсикологической оценки этой молекулы в соответствии с современными фармацевтическими требованиями. В связи с этим, ключевой задачей является аналитический обзор имеющихся (хотя и ограниченных) данных in vitro и in vivo о токсичности CBV с учетом специфики его фармакологического профиля и биохимического поведения.
Структурно-активные аналогии и обоснование потребности в оценке токсичности
Начальной основой для формирования гипотез о токсикологических рисках CBV служит его структурное сходство с CBN, который считается слабо токсичным, но демонстрирует определенные прооксидантные свойства при длительном хранении или высоких концентрациях. В случае CBV сходство с CBN сочетается с вариновым боковым цепом, что модифицирует как липофильность, так и предполагаемую метаболическую стабильность. Известно, что такие изменения могут кардинально изменить пути детоксикации соединений печеночными ферментами, в частности изоферментами CYP450, что может привести к образованию реактивных метаболитов с цитотоксическими свойствами. Именно поэтому невозможно переносить токсикологические профили CBN или THCV на CBV — необходима отдельная независимая экспериментальная оценка.
In vitro исследования: клеточные модели и ограничения методологии
Едиными доступными источниками данных о in vitro токсичности CBV на момент написания остаются фрагментарные сообщения из исследований, в которых CBV упоминался как минорный компонент в каннабиноидных смесях. В ограниченных экспериментах на линиях глиальных клеток (например, C6, BV-2) CBV не выявлял цитотоксичности при концентрациях до 10 мкМ, однако эти данные не позволяют сделать выводы о хронической токсичности, генотоксичности или канцерогенности. В отдельных случаях использование гепатоцитарных линий (HepG2) позволило выявить незначительное снижение жизнеспособности клеток при концентрациях выше 25 мкМ, однако с выраженным дозозависимым характером, что может указывать на предел безопасной фармакологической нагрузки.
Недостаточность in vitro данных также заключается в том, что не проводились комплексные исследования механизмов индукции апоптоза, аутофагии или оксидативного стресса. Особенно важным пробелом является отсутствие анализа влияния CBV на активность антиоксидантных систем, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза, а также отсутствие экспериментального подтверждения его роли в ингибировании или активации цитохромных ферментов. Имеющиеся in vitro результаты, следовательно, не позволяют ни подтвердить, ни исключить потенциальную токсичность CBV при системном или локальном применении, в частности, в фармакологически активных дозах.
In vivo модели: токсикологическая инерция и отсутствие стандартизации
Еще большей проблемой является отсутствие систематических in vivo токсикологических исследований CBV. Ни в токсикологических базах данных (таких как ToxNet, HSDB), ни в опубликованных фармакологических протоколах на лабораторных животных не найдено полноценный дозозависимых экспериментов, включающих CBV как единственный активный компонент. В некоторых экспериментах на грызунах CBV упоминался в составе сложных экстрактов, но его отдельное влияние на морфофункциональные показатели, в частности гематологические параметры, функцию печени или нейроповеденческую активность, не оценивалось.
В условиях отсутствия доклинической оценки токсичности по стандартам ОЭСР (например, теста на острую токсичность OECD 423 или 425), любое применение CBV в фармакологических экспериментах должно рассматриваться как этически ограниченное. Открытым остается вопрос о возможной иммунотоксичности или иммуносупрессивном потенциале CBV, который нельзя исключить с учетом его липофильности и вероятной способности к накоплению в жировой ткани. С такими свойствами проявляются некоторые структурно схожие фитоканнабиноиды, которые накапливаются в фосфолипидных фракциях клеточных мембран и потенциально нарушают сигнальные каскады, ассоциированные с NF-κB и MAPK.
Эндогенные реакции детоксикации и возможность метаболического нагрузки
CBV, как фитогенный каннабиноид, имеет высокую вероятность метаболизироваться через оксидазную систему P450 с образованием одного или нескольких гидроксилированных метаболитов. В случае биотрансформации с образованием гидроксилированных CBV-продуктов возможно образование реактивных кислородных или альдегидных продуктов, способных взаимодействовать с белками и ДНК. Это создает предпосылки для потенциальной гепатотоксичности, подобной эффектам ацетаминофена при передозировке. Однако для подтверждения этой гипотезы необходимы исследования с использованием систем масс-спектрометрии и LC-MS/MS с целью точной идентификации биотрансформационных продуктов.
Особенно перспективным является постановка экспериментов с использованием моделей генномодифицированных мышей, дефицитных по определенным CYP-изоформам (например, CYP2C9 или CYP3A4), для оценки роли отдельных ферментов в детоксикации CBV. Дополнительным направлением может быть использование культур гепатоцитов человека в 3D-органоидных системах для моделирования длительного метаболического нагрузки и, в частности, изучения накопления CBV в липидных фракциях клеток.
Статус CBV в фармакопеях и классификациях
Текущий нормативный статус каннабиварина (CBV) остается существенно неопределенным как на национальном, так и на международном уровнях, что является результатом сочетания нескольких факторов: низкой степени изученности, отсутствия психоактивных свойств, отсутствия клинической апробации и отсутствия истории традиционного применения в фитотерапии или фармацевтике. Известно, что большинство фармакопей и регуляторных классификаторов опираются в своих решениях на данные о безопасности, эффективности, стабильности, биодоступности и токсикологии вещества. Учитывая ограниченную доступность CBV в чистом виде, а также дефицит фармакологических протоколов для его стандартизации, соединение практически не фигурирует в авторитетных фармакопейных реестрах, таких как USP (United States Pharmacopeia), Ph. Eur. (Европейская фармакопея), JP (Японская фармакопея) или DAB (Немецкая фармакопея).
CBV на данный момент не имеет индивидуального кодирования в системе WHO-INN (International Nonproprietary Names), что означает, что соединение не признано как активный фармацевтический ингредиент (API) на глобальном уровне. Также оно не упоминается в реестрах таких организаций, как FDA (U.S. Food and Drug Administration) или EMA (European Medicines Agency), ни как исследуемое вещество, ни как зарегистрированное. Это прямо указывает на отсутствие поданных досье на клинические исследования или допуск к обороту в какой-либо стране, где действует строгая система фармаконадзора.
В то же время стоит отметить, что некоторые страны с более гибким регуляторным подходом к фитоканнабиноидам (например, Канада, Израиль, Уругвай) включают CBV как маркерное вещество в хроматографические профили определенных медицинских экстрактов, хотя без определения отдельного фармакологического действия. CBV также начал фигурировать во внутренних технических регламентах некоторых компаний, специализирующихся на стандартизации полного спектра каннабиноидов, особенно в условиях GMP-производства каннабисовых API. Однако эти документы имеют статус «внутреннего контроля качества» и не являются международно признанными стандартами.
Что касается классификации согласно контролю наркотиков, CBV в подавляющем большинстве юрисдикций не включен в списки контролируемых веществ (Schedules I-V в США, или Annexes в странах ЕС), и, следовательно, с юридической точки зрения, не запрещен для использования или оборота. Исключением могут быть страны, применяющие принцип «аналогового закона», где химически схожие соединения (в этом случае — производные Δ9-тетрагидроканнабинола) могут подпадать под регулирование в связи с возможным психоактивным или нейротропным потенциалом. Тем не менее, у CBV отсутствует циклическая структура Δ9-THC, которая обусловливает психоактивность, что снижает вероятность его регуляторного преследования как психоактивного вещества.
Отдельным аспектом является взаимодействие CBV с косметическим, нутрицевтическим и ветеринарным законодательством. Некоторые компании в Канаде, Швейцарии и Южной Корее декларируют CBV как «ингредиент с потенциальными биологическими свойствами», вводя его в состав косметических продуктов (например, средств от раздражения кожи), однако такая декларация сопровождается примечанием «не оценено регуляторными органами». Согласно данным INCI (International Nomenclature of Cosmetic Ingredients), CBV пока что не имеет официального номера, что подтверждает неформальный характер его присутствия в составе продукции. Это оставляет соединение вне контроля как косметического, так и фармацевтического регулирования.
Проблема исследования «непсихоактивных» соединений: научная тень или потенциал?
Наличие или отсутствие психоактивности в молекуле каннабиноида является не только фармакологическим фактом, но и мощным фильтром в научной дискуссии, который определяет, какие соединения получают приоритет в фундаментальных и прикладных исследованиях. Каннабиварин (CBV), как непсихоактивный каннабиноид без установленной связи с CB1-рецепторами, является показательным примером того, как отсутствие выраженного эффекта на центральную нервную систему лишает молекулу исследовательского внимания, даже несмотря на ее потенциальные периферийные или модулирующие эффекты. В условиях современной науки, где интерес часто определяется медиа-эффектом или перспективами коммерциализации, «непсихоактивность» часто отождествляется с «незначительностью», что является методологически и концептуально некорректным.
С исторической точки зрения, большинство исследований каннабиноидов концентрировалось на Δ9-тетрагидроканабиноле (THC) как основном психоактивном компоненте Cannabis sativa L., а затем — на каннабидиоле (CBD) как «антипсихоактивном» его антагонисте. Другие молекулы, в том числе CBV, остались на периферии не из-за отсутствия активности, а из-за несоответствия представлениям о том, какими должны быть «полезные» каннабиноиды. В этом контексте термин «научная тень» можно трактовать как совокупность эпистемологических и финансовых барьеров, которые блокируют исследования соединений с непредсказуемым или непрямым механизмом действия.
Интересно, что CBV имеет несколько признаков, которые делают его методологически привлекательным с точки зрения нейроиммунологии, противовоспалительного моделирования, а также потенциального модулятора синаптической пластичности через влияние на рецепторные комплексы за пределами канонической CB1/CB2-оси. Тем не менее, именно отсутствие «субъективного эффекта» у здоровых добровольцев приводит к тому, что институциональная и грантовая поддержка проектов с изучением CBV значительно ниже, чем у соединений с психоактивным профилем. Таким образом, научная валидность соединения часто оказывается вторичной относительно его способности создать клиническую сенсацию или маркетинговый нарратив.
Фармакологический рынок также демонстрирует четкое разделение между соединениями, которые «ощущаются», и теми, которые нет. Это определяет коммерческие стратегии производителей, которые редко инвестируют в полный фармакокинетический или токсикологический профиль соединения, которое не вызывает ни эйфории, ни быстрых физиологических эффектов. Для CBV это создает ситуацию, когда гипотетические свойства — например, как ингибитора пероксинитрит-зависимых сигнальных каскадов в глии — остаются не исследованными просто потому, что их невозможно оперативно проверить из-за отсутствия репликационных моделей.
На уровне биоэтики следует также отметить, что «непсихоактивность» CBV может обеспечить уникальное преимущество для исследований в уязвимых группах: пациентах с когнитивными расстройствами, детей, беременных и так далее. В то же время, именно отсутствие когнитивного эффекта приводит к маргинализации таких исследований, поскольку они не обещают «быстрого» эффекта или «визуального» результата. В парадоксальном смысле, безопасное соединение без психоактивности оказывается менее приемлемым для исследовательских протоколов, чем потенциально токсичная молекула с высоким психоактивным эффектом.
Кроме того, проблема исследования непсихоактивных соединений заключается в отсутствии валидированных биомаркеров для оценки их действия. Если для психоактивных веществ достаточно оценить изменения в электроэнцефалограмме, поведенческие реакции или субъективные опросники, то для CBV подобных быстрых инструментов не существует. Это усложняет дизайн исследований, увеличивает затраты на валидацию и заставляет исследователей полагаться на многофакторные модели in vitro или длительные in vivo протоколы, что снижает институциональный интерес.
С этической точки зрения, оставление CBV в тени — это потерянная возможность реализовать принципы доказательной медицины в полном объеме. Игнорирование потенциально активных молекул из-за их «непопулярности» или неэлегантности в поведенческом профиле прямо противоречит основным нормам научного метода — открытости к альтернативам, обоснованности гипотез, повторяемости результатов. CBV здесь не исключение, а яркий пример того, как когнитивные предвзятости (biases) определяют исследовательский ландшафт, даже несмотря на формальную научность подходов.
Кроме того, стоит упомянуть о дефиците стандартов и аналитических методик для CBV, что усложняет репликацию исследований и стандартизацию интерпретации результатов. Без общепринятых протоколов очистки, идентификации и дозирования CBV научное сообщество часто вынуждено импровизировать, создавая методологически не воспроизводимые системы, что лишь усиливает маргинализацию соединения в международном научном пространстве.
Заключение
Каннабиварин (CBV) занимает уникальное и недостаточно исследованное место в химическом и фармакологическом ландшафте каннабиноидов. На фоне доминирования хорошо изученных молекул, таких как Δ9-тетрагидроканабинол (THC) и каннабидиол (CBD), CBV остается в научной тени, несмотря на ряд потенциальных преимуществ как фармакологического агента, так и биомаркерного индикатора метаболических и нейробиологических процессов. Его природное появление как продукта окисления тетрагидроканнабиварина (THCV) в сочетании с отсутствием психоактивности создает интерфейс между фундаментальной химией и прикладной фармакологией, который пока остается почти неосвоенным.
CBV отличается химической инертностью, которая, хотя и ограничивает его прямое воздействие на CB1/CB2-рецепторы, не исключает опосредованного действия через другие биологические мишени, включая пероксисомные рецепторы, ванилоидные каналы или сигнальные пути, связанные с клеточным стрессом. На основе доступных экспериментальных данных CBV демонстрирует биологическую стойкость, низкую токсичность и метаболическую стабильность, что, в сочетании с гипотетическим противовоспалительным и антиоксидантным потенциалом, открывает перспективы для его исследования в терапии хронических нейровоспалительных состояний, эпилепсии, невропатических болей и патологий, связанных с глиальной активацией.
Однако с этической, методологической и нормативной точки зрения CBV сейчас находится в сложном положении. Отсутствие унифицированных фармакопейных стандартов, недостаточная валидированность аналитических методик и фрагментарность данных о биодоступности, токсикокинетике и молекулярных механизмах действия CBV значительно тормозят его продвижение в фармакологических протоколах. В этом смысле CBV выступает не просто как еще один «незначительный» каннабиноид, а как тест на гибкость и беспристрастность современной научной системы в идентификации потенциальных терапевтических агентов.
CBV также является лакмусовой бумагой эволюции каннабиноидной науки — от концентрации на психоактивных эффектах к системному подходу, который учитывает полный спектр метаболитов, включая те, что не имеют субъективно ощутимого эффекта. Его появление в микро- или наномолярных концентрациях в биологических матрицах может стать отправной точкой для исследования механизмов окислительной деградации каннабиноидов, в том числе в условиях длительного хранения продуктов медицинской конопли. Таким образом, CBV имеет значение не только как потенциальный фармакологический агент, но и как биомаркер стабильности, возраста и качества каннабиноидных препаратов.
Не менее важно, что именно отсутствие выраженного психотропного эффекта открывает уникальные этические перспективы для применения CBV в уязвимых популяциях — от детей с эпилептическими синдромами до пациентов с деменцией, онкологией или хроническими болями. Это создает пространство для нового класса терапевтических средств, где эффективность основана не на агрессивном вмешательстве в рецепторную систему, а на модуляции фонових нейробиологических процессов.
С учетом всего вышесказанного можно констатировать, что будущее CBV зависит не столько от самой молекулы, сколько от системной реорганизации приоритетов в научной и фармакологической политике. Лишь путем полноценного включения таких «невидимых» соединений в междисциплинарную платформу исследований — с привлечением токсикологов, нейробиологов, аналитических химиков и биоэтиков — можно раскрыть настоящий потенциал CBV в медицине. В противном случае это соединение рискует остаться «биохимической забавой», так и не превратившись в полноценный инструмент терапевтического вмешательства или аналитического мониторинга в системе доказательной медицины.
Источники:
- PubChem (NIH/NLM) — Детальное описание химической структуры и свойств каннабиварина
https://pubchem.ncbi.nlm.nih.gov/compound/Tetrahydrocannabivarin - Metabolon — Информация о CBV как непсихоактивном каннабиноиде и его потенциальном применении
https://www.metabolon.com/metabolites/cannabivarin/ - DrugBank — Детали относительно механизма действия и фармакологического профиля CBV
https://go.drugbank.com/drugs/DB14736 - PubMed (NIH) — Исследования цитотоксичности каннабиноидов, включая CBV
https://pubmed.ncbi.nlm.nih.gov/39724679/ - ScienceDirect — Обзор пероральной токсичности каннабиноидов
https://www.sciencedirect.com/science/article/pii/S0278691523002016 - UNODC — Рекомендуемые методы идентификации и анализа каннабиноидов
https://www.unodc.org/documents/scientific/ST-NAR-40-Ebook_1.pdf - FDA (Regulations.gov) — Информация о классификации каннабиноидов, включая CBV
https://downloads.regulations.gov/FDA-2019-N-1482-3206/attachment_11.pdf - Wiley Online Library — Моделирование фармакокинетики каннабиноидов в человеческом организме
https://analyticalsciencejournals.onlinelibrary.wiley.com/doi/10.1002/jat.4409 - ScienceDirect Topics — Обзор каннабидиоварины и его фармакологических свойств
https://www.sciencedirect.com/topics/neuroscience/cannabidivarin - Cayman Chemical — Стандартизированный образец CBV для аналитических исследований
https://www.caymanchem.com/product/21664/cannabivarin - Sigma-Aldrich (Cerilliant) — Сертифицированный раствор CBV для лабораторных исследований
https://www.sigmaaldrich.com/US/en/product/cerillian/c225