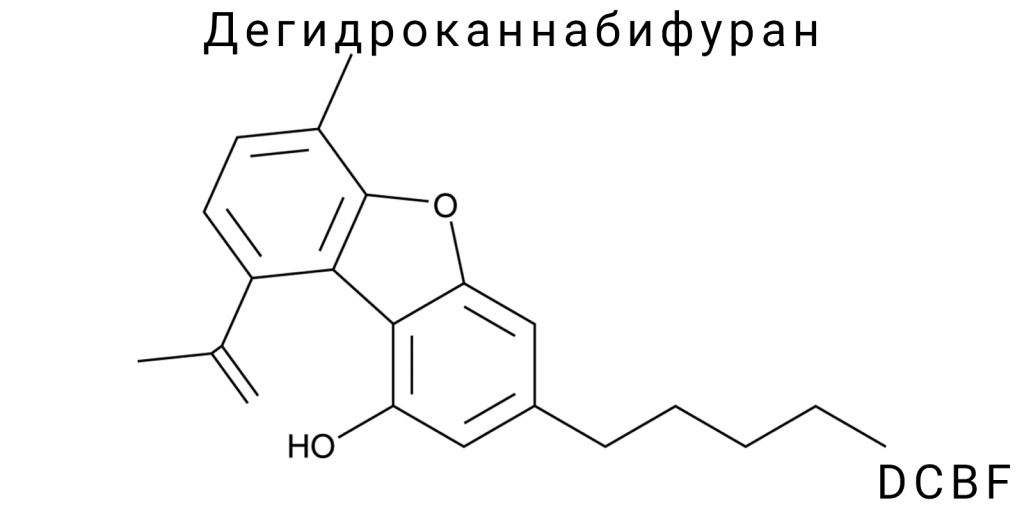
Дегидроканнабифуран (DCBF) является малоизученным каннабиноидным соединением с дибензофурановой структурой, впервые идентифицированным в следах продуктов пиролиза Cannabis sativa L., а также в незначительных количествах в сырье растительного происхождения. Структурно DCBF представляет собой ароматизированный производный каннабиэльсоина (CBE), в котором насыщенный тетрагидроксиканнабиноидный фрагмент подвергся дегидрированию с образованием полностью ароматической системы с фурановым кольцом. Молекулярная формула соединения — C₂₁H₂₄O₂; молекула содержит пятиуглеродный боковой цепь в положении 3 бензольного ядра, изопропенильную группу в положении 5 и гидроксильную функцию в положении 1.
Дибензофурановый каркас DCBF придаёт ему электронно-плотную, планарную структуру с высокой стабильностью π-электронной системы, что потенциально влияет на её взаимодействие с биологическими мишенями. Степень конъюгации, локализация гидроксильной группы и распределение липофильных участков определяют потенциал этого соединения для проникновения через биологические мембраны, в частности гематоэнцефалический барьер. Первичные in silico фармакокинетические модели свидетельствуют о высокой мембранной проницаемости, logP > 5, и предполагаемой биодоступности при энтеральном введении. Эти свойства обусловливают научный интерес к DCBF как потенциальному фармакологическому лиганду.
Доступная экспериментальная информация указывает на возможность биосинтетического или термогенного образования DCBF путём дегидрирования CBE-производных. Предполагается, что в природных условиях DCBF может формироваться в результате окислительно-дегидрирующих процессов в среде с высокой реакционной способностью (ультрафиолетовое излучение, ферментативное окисление, термическое воздействие). В лабораторных условиях синтез может осуществляться путём целенаправленной дегидратации насыщенных каннабиноидов с использованием кислотных катализаторов или путём ароматизации с применением палладиевых систем, аналогичных реакциям Судзуки или Хека. Полученное соединение верифицируется методами ЯМР-спектроскопии, ВЭЖХ/МС и ИК-анализа с подтверждением дибензофуранового фрагмента.
Фармакологические свойства DCBF остаются практически не изученными in vivo и in vitro. Тем не менее на основе его молекулярной структуры можно экстраполировать гипотетическое взаимодействие с рецепторными белками, в частности каннабиноидными рецепторами CB1/CB2, PPARγ, TRP-каналами или ферментативными системами (например, FAAH или MAGL). Молекулярное докингование указывает на возможную конкурентную или аллостерическую активность в отношении указанных мишеней, что требует экспериментального подтверждения. В то же время, электрофильные свойства фуранового кольца создают потенциальную угрозу образования реактивных метаболитов при биотрансформации, в частности вследствие окисления в системе CYP450. Этот факт требует оценки токсикологического профиля DCBF, в частности его влияния на печёночные клетки, клетки репродуктивной системы и клетки ЦНС.
С учётом высокой структурной стабильности, потенциальной биологической активности и доступности для химической модификации, DCBF рассматривается как перспективный объект для исследования структура-активность в ряду фурановых каннабиноидов. Дальнейшее изучение его физико-химических, фармакологических и токсикологических свойств имеет важное значение для понимания метаболических путей каннабиноидной трансформации, а также для идентификации новых биологически активных субстанций природного или полу-синтетического происхождения. Отсутствие систематизированной информации о поведении DCBF в биологической среде создаёт потребность в фундаментальных исследованиях in vitro и in vivo с привлечением фармакокинетического моделирования, экспрессионного анализа и методов клеточной био-инженерии.
Химическая идентификация DCBF
Дегидроканнабифуран (DCBF) представляет особый интерес в рамках каннабиноидного ряда благодаря наличию конденсированной полициклической системы, включающей дибензофурановый фрагмент. Химическая идентификация этого соединения требует многоуровневой методологии с использованием современных аналитических инструментов спектроскопии, хроматографии и масс-спектрометрии. В отличие от классических каннабиноидов, которые имеют частично насыщенную структуру с тетрагидроканнабинольной или каннабиодиоловой основой, DCBF характеризуется полной ароматизацией ядра и встроенным фурановым кольцом, формирующим жёсткую, стабильную и электронно насыщенную архитектуру.
Первым этапом в процессе химической идентификации DCBF является определение его элементного состава и молекулярной массы. С помощью масс-спектрометрии высокой разрешающей способности (HRMS) ионизацией методом электронного удара или электроспрей-ионизации (ESI) регистрируется точное значение молекулярной массы, соответствующее формуле C₂₁H₂₄O₂. Высокая точность измерения позволяет исключить изобарные соединения и подтвердить элементный состав с погрешностью менее 5 ppm. Изотопное моделирование распределения пик-фрагментов служит дополнительным индикатором идентичности, в частности благодаря характерному соотношению интенсивностей пиков ¹²C/¹³C.
Дальнейшая верификация структуры требует использования ядерного магнитного резонанса (ЯМР). Метод ¹H-ЯМР позволяет выявить характерный спектральный профиль ароматических протонов, в частности сигналы в области 6.2-7.8 ppm, относящиеся к бензольным ядрам и фурановому кольцу. Наблюдаются дескринированные мультиплеты, свидетельствующие о наличии сопряжённых электронных систем. ¹³C-ЯМР обеспечивает выявление сигналов атомов углерода в ароматической среде, с типичными химическими сдвигами в интервале 110-160 ppm. Наличие сигналов насыщенных алкильных фрагментов в диапазоне 14-40 ppm подтверждает присутствие боковой цепи в структуре. Дополнительно применяются корреляционные методы ЯМР, включая COSY, HSQC и HMBC, которые позволяют идентифицировать скаляры между протонами и коррелировать их с карбоновыми центрами, что критично для верификации системы с несколькими конденсированными циклами.
ИК-спектроскопия позволяет установить наличие гидроксильной группы по характерному валентному поглощению в диапазоне 3400-3600 см⁻¹, а также выявить вибрации C=C в пределах 1600-1650 см⁻¹, свидетельствующие о наличии ароматической системы. Поглощение в зоне 1050-1150 см⁻¹ коррелирует с колебаниями фуранового цикла, тогда как область 700-900 см⁻¹ может свидетельствовать о замещении бензольных колец. В совокупности ИК-спектр обеспечивает подтверждение функциональных групп и типов связей, свойственных DCBF.
Разделение DCBF из смеси аналогов возможно путём высокоэффективной жидкостной хроматографии (ВЭЖХ) в сочетании с детектированием по УФ-спектру и масс-спектрометрии. Оптимальные условия элюирования обычно включают использование смешанных подвижных фаз (метанол:вода или ацетонитрил:вода) с градиентной программой. DCBF демонстрирует характерное поглощение в УФ-области на длине волны 220-280 нм, связанное с π→π* переходами во фурановой и бензольной системах. Определение времени удерживания в хроматографической системе позволяет проводить количественный анализ и оценивать степень чистоты изолированного образца.
Кристаллографическая идентификация DCBF путём рентгеноструктурного анализа на сегодняшний день не является стандартной процедурой для данного класса соединений из-за трудностей с кристаллизацией, однако при наличии достаточного количества чистого образца возможно получение данных о внутренней конформации и межатомных расстояниях, что окончательно подтверждает геометрию молекулы. В структуре ожидается наличие планарных ароматических систем, конъюгирующих с фурановым кольцом в псевдоплоскостной конфигурации. Это согласуется с квантово-химическими расчётами минимума энергии оптимизированной структуры (DFT уровень, B3LYP/6-311G(d,p)).
Для окончательного подтверждения идентичности используется сравнение экспериментальных спектральных данных с теоретическими прогнозами или с базами данных аналитических профилей, таких как PubChem, ChemSpider или специализированные спектральные библиотеки (например, NIST, Wiley). В случае новоидентифицированного образца создаётся собственный аналитический паспорт соединения, который включает масс-спектр, полные ЯМР-данные, ИК-спектр, хроматографические параметры и, при возможности, данные DFT моделирования.
Систематическое название и молекулярная формула
Дегидроканнабифуран (DCBF) представляет собой производное каннабиноидной системы с полностью ароматизированным трициклическим ядром, включающим дибензофурановый фрагмент с алкильными заместителями. Его химическая структура не является каноничной для классических фито- или синтетических каннабиноидов и формально не входит в традиционную классификацию фитоканнабиноидов, однако происходит от них путём дегидрирования и перестройки кольцевых систем.
Систематическое название согласно правилам IUPAC для данной молекулы, исходя из её структурной конфигурации, является:
5-[(1E)-1,2-диметилпроп-1-енил]-3-пентил-1-бензофуран-1-ол.
Это название построено по принципу приоритета функциональных групп и включает ключевые структурные элементы: бензофурановый каркас, пентильный цепь в положении 3, изопропенильный заместитель в положении 5 и фенольную гидроксильную группу в положении 1. В рамках данной номенклатуры бензофуран выступает главным каркасом с нумерацией от атома кислорода фуранового кольца по часовой стрелке, что позволяет точно определить положение заместителей без двусмысленностей.
Молекулярная формула DCBF: C₂₁H₂₄O₂.
Эта формула демонстрирует соотношение атомов в составе молекулы: 21 атом углерода, 24 атома водорода и 2 атома кислорода. Молекулярная масса в нейтральном состоянии составляет 308.42 г/моль. Атомы кислорода в этой формуле локализованы в структурах гидроксильной группы (-OH) и фуранового эфирного моста. Следует отметить, что эта формула является типичной для ароматических производных с высоким уровнем насыщения водородом на периферийных цепях, с одновременным наличием двух оксигенсодержащих фрагментов, обеспечивающих базовый уровень полярности.
Классификация по InChI (International Chemical Identifier) обеспечивает алгоритмически однозначное представление структуры:
InChI=1S/C21H24O2/c1-5-6-7-13-17-14-19(21(22)23-20(17)16-11-9-8-10-12-16)15-18(2)3/h8-12,14-15,22H,5-7,13H2,1-4H3
Эта запись детерминирует топологию молекулы, включая локализацию двойных связей, наличие гидроксильной группы, а также атомов водорода, участвующих в формировании молекулярной конфигурации. Идентификатор InChIKey, который является хеш-версией полного InChI, удобно использовать для поиска соединения в базах данных:
InChIKey: YWWQVWYXPGTZKG-UHFFFAOYSA-N
С позиции элементного состава, DCBF содержит 72.72% масс. C, 6.96% масс. H и 20.32% масс. O, что выявляется при элементном анализе CHN/O. Такой состав свидетельствует о высоком содержании углерода — типичном для ароматических структур с разветвлёнными алкильными цепями. Поскольку структура не содержит атомов азота, серы или галогенов, она является химически «чистой» в контексте электрофильности и не имеет классических точек для нуклеофильной атаки, кроме фенольной группы.
Согласно классификации по химическому роду, DCBF можно отнести к классу полициклических ароматических эфиров, а точнее — к производным каннабифуранов, имеющих дибензофурановое ядро с алкильными и алкенильными заместителями. Это редкий подтип в рамках каннабиноидной химии, поскольку большинство природных каннабиноидов базируются на частично насыщенных системах с гидроксильными группами и циклическими терпеноидными модулями, тогда как DCBF полностью ароматизирован.
Логичным этапом структурного кодирования является использование SMILES-нотации (Simplified Molecular Input Line Entry System):
CC(=C)C1=CC2=C(C=C1)OC(C3=CC=CC=C3C3CCCC3)=C2O
Эта линейная формула позволяет кодировать структуру в цифровом виде для молекулярного моделирования, фармакофорного анализа или скрининга. Она эффективна в рамках cheminformatics-платформ и алгоритмов предсказания свойств по структуре.
Формально, в основе DCBF лежит бензофурановый скелет, образованный путём слияния бензольного кольца с фураном. Введение алкильного бокового цепа в положении 3, морфологически происходящего от пентильного фрагмента классических каннабиноидов, обеспечивает аналогичную липофильность. Изопропенильная группа в положении 5, ориентированная планарно к фурановой плоскости, повышает электронную плотность в конъюгированной системе. В совокупности это формирует электрофильно-нейтральную, но липофильно стабильную молекулу с потенциалом взаимодействия с белковыми мишенями путём π-π-стэкинга, гидрофобной адсорбции или водородного связывания через фенольную группу.
Функциональные группы представлены гидроксилом (-OH) и эфирной (C-O-C) фурановой системой. Обе эти группы имеют относительно низкую нуклеофильность в контексте полной ароматизации, однако способны к образованию водородных связей как доноры (-OH) и как часть π-системы (фуран). Такая архитектура определяет стабильность соединения в нейтральной среде, а также ограниченную реактивность при физиологических pH-условиях.
Структурные особенности молекулы
Молекула дегидроканнабифурана (DCBF) характеризуется специфической структурной архитектурой, сочетающей элементы бензофуранового ядра, алифатических заместителей и функциональных групп, формирующих стабильную, электронно насыщенную и планарную систему с высоким уровнем конъюгации. Центральным структурным мотивом является трициклическая система, образованная путём слияния бензольного и фуранового колец, составляющих основу бензофурана, при этом ориентация атомов в этой системе задаёт доминирующие электронно-орбитальные характеристики молекулы.
Бензофурановое ядро в DCBF функционирует как электроннодонорная ароматическая платформа с двумя сопряжёнными системами: бензольной и фурановой. Обе циклические структуры находятся в планарном расположении и взаимно сопряжены, создавая единую π-электронную систему, которая выступает основным хромофором молекулы. Важно отметить, что в DCBF фуран не функционирует как самостоятельный гетероцикл, а является составной частью более широкой сопряжённой системы, влияющей на распределение электронной плотности и стабильность молекулы.
В положении C-3 бензофуранового ядра размещён н-пентильный заместитель, формирующий длинный липофильный боковой цепь. Он является насыщенным, незамещённым и не участвует в каких-либо электронно-сопряжённых процессах. Его функция преимущественно заключается в увеличении гидрофобности молекулы, обеспечении взаимодействия с липидными средами (в частности, мембранными структурами) и влиянии на фармакокинетические свойства, такие как проникновение через биологические барьеры. Пространственная конфигурация этого цепа является свободно вращающейся вокруг σ-связей, и он может принимать несколько конформаций в зависимости от локальной среды.
В положении C-5 бензофурана располагается изопропенильная группа — фрагмент, содержащий двойную связь между первым и вторым атомами углерода (C=C) и два метильных заместителя. Двойная связь в этой группе является конфигурационно фиксированной в форме (E)-изомера, что стабилизирует молекулу за счёт уменьшения стерических препятствий между объёмными фрагментами. Этот алкенильный фрагмент участвует в делокализации π-электронов с ароматической системой фурана, формируя локализованную диеновую область, способную к реакциям с электрофилами. Одновременно терпеноподобная природа этой группы позволяет структуре имитировать фрагменты природных каннабиноидов, хотя она не происходит из изопреноидного биосинтетического пути.
В положении C-1 размещена фенольная гидроксильная группа, которая является одним из немногих полярных фрагментов во всей молекуле. Её присутствие обеспечивает возможность образования водородных связей, в частности с рецепторными белками или молекулами воды. Гидроксильная группа в положении 1 является реакционно активной при модификациях, таких как метилирование, эстерификация или введение карбаматных остатков. При этом положение этой группы позволяет ей выступать как акцептор в водородных связях, не нарушая общей планарности структуры. Её кислотность усиливается благодаря электронно-донорным эффектам бензофуранового ядра, что стабилизирует образование фенолят-иона при соответствующих рН.
Молекулярная планарность в DCBF является критическим параметром для его фармакофорной активности. Основной скелет, включая бензольное, фурановое кольцо и алкенильную часть, находится в почти полностью плоской конфигурации. Это позволяет эффективное π-π-стэкинговое взаимодействие с ароматическими аминокислотными остатками (например, фенилаланином или тирозином) в активных сайтах белков. Пространственная ориентация пентильного цепа является непланарной, однако его гибкость не нарушает стабильности главной π-системы.
Условно структурную организацию DCBF можно разбить на три функциональных домена:
Ароматический ядерный домен (бензофуран) — определяет π-электронные свойства и фотохимическую стабильность.
Липофильный домен (пентильный цепь) — отвечает за проницаемость через биомембраны и аффинность к гидрофобным белковым карманам.
Полярно-реакционный домен (фенольная группа и алкен) — служит точками для химической модификации, а также обеспечивает способность к специфическим взаимодействиям с белками-мишенями.
Ещё одной важной особенностью является наличие локализованных диеновых фрагментов, которые могут вступать в реакции типа Diels-Alder при наличии соответствующих электрофильных диенофилов. Такая реакционная способность делает DCBF потенциально интересным объектом для создания функционализированных производных с заданными свойствами. Кроме того, фурановый фрагмент в присутствии определённых катализаторов или под действием УФ-излучения способен подвергаться фотохимическим преобразованиям, в частности электроциклическим реакциям, что даёт дополнительные инструменты для целевой функционализации.
Наличие асимметричных атомов в структуре DCBF отсутствует — молекула является ахиральной в основном состоянии, однако возможно создание хиральных центров при селективном функциональном модифицировании, особенно в положениях рядом с алкенильным фрагментом. Такая модификация позволяет формировать энантиомеры с потенциально различной биологической активностью, что является перспективным направлением в синтезе новых производных на основе DCBF.
Стереохимические вариации и их потенциальное влияние на биоактивность
Дегидроканнабифуран (DCBF) относится к классу каннабиноидоподобных соединений с конструкционно жёстким, преимущественно планарным каркасом, в основе которого — бензофурановая система с периферически расположенными функциональными группами. Несмотря на очевидную ахиральность молекулы в её базовой форме, стереохимический контекст DCBF не сводится лишь к отсутствию хиральных центров. В рамках современной молекулярной фармакологии стереохимия рассматривается не только как следствие конфигурации атомов в пространстве, но и как фактор, определяющий конформационные свойства, вариабельность локальных электронных облаков и топологию взаимодействий с биологическими мишенями. DCBF, как потенциально биоактивная структура, может проявлять стереохимические варианты при определённых условиях или быть стереохимически модифицированной для регулирования своей биоактивности.
В первую очередь следует акцентировать внимание на роли двойной связи в изопропенильном фрагменте. В нормальных условиях этот фрагмент пребывает в стабильной (E)-конфигурации, которая минимизирует стерическое перекрытие между двумя метильными группами. Однако при воздействии света, кислот или радикалов возможно частичное фотоизомеризование в (Z)-форму, которая кардинально изменяет пространственную ориентацию алкеноидного фрагмента относительно бензофуранового ядра. Такая конфигурационная перестройка влияет на геометрию взаимодействия с активными центрами белков, где входная щель рецептора имеет высокоспецифическую топологическую соответствие форме лиганда. Следовательно, даже при отсутствии классических хиральных центров, изомерия вокруг двойной связи потенциально разделяет DCBF на биоактивную и био нейтральную формы.
Вторым аспектом является конформационная стереохимия. Насыщенный пентильный цепь на C-3 не является хиральным, однако имеет несколько энергетически допустимых конформаций, которые по-разному влияют на дипольный момент молекулы, её поляризуемость и, соответственно, степень ориентированного связывания с биологическими мишенями. Например, в присутствии мембраноподобной среды цепь способна укладываться вдоль поверхности липидного бислоя или частично погружаться в гидрофобное ядро, что меняет локализацию всей молекулы относительно рецепторного белка. Подобная конформационная адаптивность, хотя и не связана с классической хиральностью, формирует условные «локальные стереоизомеры», которые могут иметь разную аффинность к ферментативным или рецепторным участкам.
Ещё один важный стереохимический момент связан с фенольной группой в положении C-1. Она находится в плоскости молекулы, но её орбитальное перекрытие с π-системой бензофурана зависит от ориентации O-H связи. Вращение вокруг связи C-O, хотя и ограничено водородными связями и сопряжением, всё же возможно, особенно в полярной среде или под воздействием катионов металлов. Такая ориентационная изменчивость меняет не только кислотность группы, но и пространственную доступность к водородным акцепторам в белках, в частности в водорастворимых ферментативных доменах. Условная ориентационная изомерия этой группы может быть критичной при дизайне производных DCBF для целевой ингибиции или активации конкретных ферментов.
В случае химической модификации DCBF, например путём введения дополнительного заместителя в положение C-2 или C-7 бензофуранового ядра, возникает возможность создания стабильных хиральных центров. Такие производные могут иметь энантиомеры, каждый из которых демонстрирует различное биологическое действие или селективность. Это открывает потенциал для получения энантиомерно чистых форм, которые по своей фармакодинамике будут иметь более высокую специфичность, более низкую токсичность и отсутствие конкуренции между формами за один рецепторный сайт. В случае, если модификация касается алифатических фрагментов, например путём замещения углеродного атома цепи на хиральный центр с функциональным заместителем, возможно появление двух или более стереоизомеров с разными ADME-профилями.
Стереохимически чувствительными могут быть и промежуточные продукты синтеза DCBF, в частности в реакциях электрофильного ароматического замещения или при циклоконденсации. Условия протекания таких реакций, как температура, каталитическая среда, рН, могут обусловливать формирование определённой пространственной конфигурации конечного продукта или вызывать образование неосновных изомеров. Следовательно, контроль над стереохимией на каждом этапе синтеза является критическим для получения воспроизводимого продукта с прогнозируемой биоактивностью.
На уровне молекулярного моделирования (in silico) структурные варианты DCBF с учётом стереохимических изменений демонстрируют отличия во взаимодействии с активными центрами рецепторов CB1, CB2, TRPV1, а также ферментами системы FAAH или MAGL. В частности, модели предсказывают, что конформации с развернутым пентильным цепом стабилизируют молекулу в гидрофобном сайте CB2 за счёт ван-дер-ваальсовых взаимодействий, тогда как изогнутая конфигурация препятствует полному погружению в рецепторную щель. Это пример функциональной стереоселективности, не основанной на хиральности, но определяющей результативность биохимического взаимодействия.
Особое внимание заслуживают потенциальные стереоизомерные эффекты при метаболизме DCBF. Гидроксилирование или окисление с участием CYP-ферментов может происходить стереоселективно, в зависимости от пространственной доступности отдельных атомов углерода. Это означает, что одна и та же молекула DCBF может образовывать разные метаболиты в зависимости от её конформации или конфигурационной стабильности, что, в свою очередь, обусловливает различные фармакологические последствия: активацию, деактивацию или даже токсическую трансформацию.
Походження и предшественники
Дегидроканабифиран (DCBF) является химическим соединением, природа и пути образования которого до сих пор изучаются с целью установления точного происхождения и роли в биохимических процессах. Рассмотрение вопроса происхождения DCBF включает в себя анализ источников, из которых эта молекула может образовываться, а также характеристику химических и биохимических механизмов, приводящих к её генерации. Поиски ответа на вопрос «где и как образуется DCBF» охватывают исследования природных систем, а также методов синтетического получения в лабораторных условиях. Важным аспектом является определение первичных прекурсоров, из которых может происходить DCBF, а также изучение физико-химических и биохимических факторов, влияющих на формирование молекулы.
С биологической точки зрения DCBF может быть ассоциирован с природными метаболитами растений рода Cannabis или их химическими модификациями. Однако, в отличие от большинства традиционных каннабиноидов, таких как ТГК или КБД, DCBF характеризуется иной структурной спецификой, что ставит под сомнение его непосредственное происхождение как продукта классического биосинтеза растения. Это побуждает предполагать, что DCBF может быть результатом не только природных ферментативных процессов, но и специфических физико-химических реакций, возникающих под воздействием экзогенных факторов, таких как нагревание или фотохимическая активация.
На уровне химической эволюции возможно, что DCBF возникает через трансформацию более простых каннабиноидов, в частности через дегидрирование или циклизацию соответствующих функциональных групп. Такой хемогенез предполагает существование структурных прекурсоров, молекулы которых при наличии специфических условий могут подвергаться химическим перестройкам с формированием нового цикла бензофуранового типа. Изучение таких трансформаций актуально для понимания потенциальных биохимических путей метаболизма растительных и синтетических соединений.
Другим направлением является исследование искусственных методов получения DCBF в лабораторных условиях. Синтетические подходы позволяют манипулировать структурой молекулы, что даёт возможность установить механизмы формирования определённых фрагментов и определить ключевые промежуточные продукты, которые могут быть аналогами природных прекурсоров. Благодаря синтетическим исследованиям создаются модели, объясняющие, каким образом DCBF может образовываться как в природных, так и в искусственных системах.
Дополнительно, для понимания происхождения DCBF важно учитывать роль факторов окружающей среды, которые могут влиять на химическую стабильность, преобразования и накопление молекулы. Температурные режимы, наличие катализаторов, а также состав газовой среды способны обусловливать различные пути химической трансформации прекурсоров в DCBF или способствовать распаду и модификации уже образованных молекул. Анализ таких воздействий имеет непосредственное значение для понимания как природного биохимического метаболизма, так и условий экстракции или синтеза DCBF.
В контексте идентификации прекурсоров стоит отметить важность их химической сродственности с DCBF. Предшественники должны содержать похожие функциональные группы, которые потенциально участвуют в реакциях дегидрирования, циклизации или окисления с образованием бензофуранового кольца. С учётом этого особое внимание уделяется некоторым фитоканнабиноидам, известным своей химической активностью и способностью к трансформациям под действием ферментов или внешних факторов. Определение таких прекурсоров является фундаментальным для построения механистических моделей образования DCBF.
Хемогенез: является ли DCBF природным или синтетическим?
Вопрос о природе происхождения Дегидроканабифиранa (DCBF) — природного или синтетического — остаётся открытым и требует системного подхода для установления чётких фактов. Анализ хемогенеза DCBF базируется на двух основных направлениях: идентификации возможных природных источников и воспроизведении молекулы в лабораторных или промышленных условиях. Несмотря на структурные особенности, родственные каннабиноидам, DCBF не является прямым продуктом классических ферментативных путей биосинтеза каннабиноидов, что указывает на сложность его природного образования.
Природное происхождение DCBF можно рассматривать через призму биосинтетических цепочек Cannabis sativa или родственных видов растений. Большинство каннабиноидов образуются в растении путём ферментативной конденсации преформированных тетрагидроканнабинола или каннабидиола, однако DCBF характеризуется значительным отклонением от типичных структурных мотиваций, что усложняет прямое отнесение его к природным метаболитам. Данные о выявлении DCBF в растительных экстрактах остаются ограниченными и часто противоречивыми, что может быть следствием как низкой концентрации, так и сложности аналитического распознавания молекулы среди схожих по структуре соединений.
Существует гипотеза, что DCBF может образовываться в природных условиях вследствие не ферментативных процессов — преимущественно путём спонтанных или индуцированных химических реакций. К таким реакциям относятся дегидрирование, циклизация и окислительные превращения, которые могут происходить в пределах растительного материала под воздействием температурных колебаний, света, рН среды, а также под действием микроорганизмов. В этом случае DCBF выступает не первичным метаболитом, а продуктом вторичной трансформации классических каннабиноидов или их прекурсоров. Однако прямые экспериментальные доказательства таких путей остаются ограниченными из-за сложности воспроизведения соответствующих условий in vitro и in vivo.
Что касается синтетического происхождения, DCBF преимущественно рассматривается как химический продукт, созданный посредством целенаправленных синтетических реакций. Лабораторный синтез DCBF основан на органических реакциях циклизации, дегидрирования или функционального модифицирования прекурсоров, которые могут быть представлены как природными, так и синтетическими соединениями. Отличие синтетического DCBF заключается в возможности получения изомерно чистых форм, контроле над стереохимией, а также манипуляции специфическими функциональными группами с целью оптимизации биоактивности. Эти методы синтеза направлены на воспроизведение или улучшение свойств молекулы для исследований фармакологии и потенциальных медицинских применений.
Хемогенез DCBF в синтетических условиях демонстрирует большую вариативность и управляемость, что позволяет не только воспроизводить природные конформации молекулы, но и создавать её производные с новыми свойствами. Это имеет значение в контексте фармакологических исследований, где возможна модификация DCBF для повышения селективности и эффективности взаимодействия с биологическими мишенями. Синтетический путь образования также позволяет получать DCBF в количествах, значительно превышающих потенциал растительного синтеза, что критично для масштабирования исследовательских или клинических применений.
Важно отметить, что некоторые аналитические методы выявления DCBF в природных экстрактах могут содержать ошибки, связанные с преобразованиями во время обработки образцов. Нагревание, использование растворителей или повышенное давление могут индуцировать химические реакции, приводящие к образованию DCBF из первичных каннабиноидов. Такой феномен артефактного образования молекулы сложно отличить от природного метаболизма, что требует применения контролируемых условий анализа и использования изотопного мечения.
Подводя итог, DCBF не следует однозначно относить к исключительно природным или синтетическим соединениям без учёта контекста и условий его образования. Соединение может быть как вторичным продуктом химических трансформаций в природном материале, так и целенаправленно синтезированной молекулой в лаборатории. Дополнительные исследования с использованием современных аналитических методов, таких как масс-спектрометрия высокой разрешающей способности, ядерный магнитный резонанс, а также изотопный анализ, необходимы для окончательного определения источников и путей образования DCBF.
Определение хемогенеза имеет критическое значение для дальнейшей фармакологической оценки DCBF, поскольку природные и синтетические варианты могут иметь существенные различия в чистоте, структурной стабильности, а также в фармакокинетических и токсикологических профилях. Понимание происхождения даёт возможность регулировать качество и воспроизводимость образцов, а также оптимизировать методы получения для медицинских или научных целей.
Потенциальные прекурсоры: фитоканнабиноиды как сырьё
Фитоканнабиноиды, продуцируемые растениями рода Cannabis, выступают ключевыми химическими соединениями, которые могут служить потенциальными прекурсорами для образования Дегидроканнабифурана (DCBF). Анализ молекулярной структуры и реакционной способности фитоканнабиноидов позволяет предположить, что именно они могут быть исходными соединениями в процессах трансформации, ведущих к формированию структуры DCBF. Характеристика фитоканнабиноидов, их функциональные группы, а также особенности химической стабильности и реакционной способности являются базисом для определения их роли в синтезе DCBF.
Среди фитоканнабиноидов особого внимания заслуживают тетрагидроканнабинол (THC), каннабиодиол (CBD), каннабиохромен (CBC) и их кислотные формы. Все они содержат в своём составе полиненасыщенные циклические системы, а также функциональные группы, способные к окислительным и дегидрующим процессам. Эти свойства определяют потенциал для превращения в молекулы с бензофурановым каркасом, к которому относится DCBF. Особого внимания требует изучение реакций, способных вызвать изменение конфигурации циклов, образование дополнительных связей или потерю атомов водорода, что и является ключевым этапом в хемогенезе DCBF.
Функциональная группа фенола, присутствующая в CBD, и её позиционное расположение создают условия для внутримолекулярной циклизации, ведущей к формированию бензофурановых структур. В этом контексте механизмы дегидрирования могут инициировать реакции образования кислородсодержащего гетероцикла путём замыкания молекулы в специфический пространственный каркас. Каннабиохромен, в свою очередь, благодаря своей структурной близости к бензофуранам, выступает природным кандидатом для дальнейших химических преобразований, ведущих к DCBF. Эти фитоканнабиноиды способны служить не только как прекурсоры, но и как промежуточные продукты в сложных реакционных цепочках.
Важным аспектом является роль кислотных форм фитоканнабиноидов — тетрагидроканнабиноловая кислота (THCA), каннабиодиоловая кислота (CBDA) и другие. Эти соединения обладают большей химической активностью благодаря наличию карбоксильных групп, которые могут участвовать в реакциях декарбоксилирования, окисления и циклизации. Декарбоксилирование — процесс, обычно происходящий под воздействием тепла или ферментов, приводит к образованию более стабильных форм THC и CBD, однако оно также может служить начальным этапом для дальнейших трансформаций в DCBF через образование промежуточных радикальных или ионных соединений.
С химической точки зрения образование DCBF из фитоканнабиноидов возможно через последовательность реакций дегидрирования, циклизации и окисления. Последнее особенно важно, поскольку обеспечивает формирование кислородсодержащего гетероцикла, который определяет ключевые свойства DCBF. Спонтанные или катализируемые ферментами окислительные процессы, а также реакции под воздействием внешних факторов, таких как свет или тепло, способны вызвать структурные перестройки в фитоканнабиноидах, что впоследствии приводит к генерации DCBF.
Отдельно стоит подчеркнуть роль окислительных ферментов, в частности оксидаз и пероксидаз, в природном метаболизме каннабиноидов. Эти ферменты могут стимулировать образование промежуточных соединений с радикальными центрами, которые инициируют циклизацию и модификацию структуры. Такая ферментативная активность способствует формированию нестабильных интермедиатов, способных быстро трансформироваться в устойчивые бензофурановые кольца, характерные для DCBF. Однако специфические ферменты, ответственные за этот процесс, остаются пока недостаточно изученными, что делает необходимым дальнейшее исследование на молекулярном уровне.
В контексте химической стабильности прекурсоров следует отметить, что некоторые фитоканнабиноиды имеют тенденцию к распаду или трансформации при неблагоприятных условиях хранения или экстракции. Этот фактор может приводить к нежелательным реакциям, в том числе к образованию побочных продуктов, которые также могут быть промежуточными в синтезе DCBF. Определение условий, максимизирующих селективность трансформации фитоканнабиноидов в DCBF, является актуальной задачей для химической технологии и аналитической химии.
Помимо традиционных фитоканнабиноидов, существуют и менее изученные соединения, которые могут играть роль в генерации DCBF. Например, каннабицитран (CBT) и канабирипсол (CBR) имеют структурные особенности, позволяющие участвовать в циклических трансформациях, подобных тем, что ведут к формированию бензофурановых структур. Изучение этих соединений и их реакционных путей открывает перспективы для более комплексного понимания прекурсорного потенциала фитоканнабиноидов.
Отличным подходом для подтверждения роли фитоканнабиноидов как прекурсоров DCBF является использование изотопно-меченых веществ в комбинированных аналитических экспериментах. Такая методология позволяет проследить путь превращений в реальных или моделирующих системах, идентифицировать промежуточные продукты и установить механизмы реакций на молекулярном уровне. Это открывает возможности для разработки более эффективных и контролируемых технологий синтеза DCBF.
Роль условий окружающей среды и температурного воздействия
Формирование Дегидроканнабифурана (DCBF) в значительной степени зависит от внешних физико-химических факторов, влияющих на стабильность и трансформацию исходных фитоканнабиноидов в природных и искусственных условиях. В частности, параметры окружающей среды, такие как температура, влажность, освещение, а также химический состав среды, имеют критическое значение для инициации и протекания реакций дегидрирования, циклизации и окисления, которые ведут к синтезу DCBF. Анализ роли этих факторов требует комплексного рассмотрения их влияния на молекулярном уровне, а также на макроскопических процессах, происходящих в растительных материалах или реакционных смесях.
Температурный режим является одним из ключевых факторов, определяющих химическую динамику трансформации прекурсоров в DCBF. Известно, что повышение температуры способствует активации реакций дегидрирования, которые предполагают отщепление молекул водорода или воды, необходимых для формирования ненасыщенных циклов и гетероциклов, характерных для бензофуранового каркаса DCBF. Этот процесс является эндотермическим и требует преодоления энергетического барьера, который увеличивается с ростом температуры. При этом важна не только абсолютная температура, но и продолжительность её воздействия, поскольку кратковременное повышение может не обеспечить достаточной конверсии, а чрезмерный нагрев вызывает распад или неконтролируемые побочные реакции.
Температурные условия также влияют на стабильность промежуточных продуктов, которые формируются в процессе циклизации фитоканнабиноидов. Промежуточные радикальные или ионные соединения имеют короткое время жизни и высокую реакционную способность, поэтому температурный контроль необходим для обеспечения их целенаправленной трансформации в DCBF. Слишком низкие температуры замедляют реакции, создавая условия для накопления промежуточных нестабильных форм, которые могут деградировать или реорганизовываться в побочные продукты.
Влажность и присутствие воды в окружающей среде влияют на механизмы реакций, в частности на гидролиз и конденсацию, которые могут быть важными при формировании конечной структуры молекулы. Вода выступает не только как растворитель, но и как участник химических реакций, способный модифицировать реакционную способность функциональных групп. Высокий уровень влажности может ингибировать или ускорять реакции дегидрирования в зависимости от контекста, поскольку вода может стабилизировать промежуточные состояния или способствовать гидратации молекулы, изменяя её конформацию и реакционную способность.
Освещение, особенно ультрафиолетовое (УФ) излучение, является катализатором фотоиндуцированных химических процессов, которые часто приводят к образованию радикальных центров в молекулах фитоканнабиноидов. Эти радикальные образования запускают цепные реакции, способствующие циклизации и окислению, являющимся ключевыми этапами формирования DCBF. УФ-излучение может вызывать изомеризацию двойных связей, разрыв определённых химических связей, а также индуцировать реакции конденсации, усиливающие образование бензофуранового кольца. Однако чрезмерная экспозиция может приводить к деградации молекулы и образованию неконтролируемых побочных продуктов.
Химический состав окружающей среды, включая рН, присутствие кислорода и других окислителей, также оказывает значительное влияние на хемогенез DCBF. Окислительные условия способствуют образованию пероксидных радикалов и других реактивных форм кислорода, участвующих в химических трансформациях фитоканнабиноидов, стимулируя образование кислородсодержащих гетероциклов. Вместе с тем, избыток окислителей может вызвать повреждение молекулы или конверсию в неактивные формы. Контролируемое окисление является, таким образом, критическим условием для оптимизации образования DCBF.
Особую роль играют катализаторы, присутствующие в окружающей среде или добавленные искусственно. Металлы переходных групп, присутствующие в следовых количествах в растительной биомассе или реакционных смесях, могут выступать как катализаторы реакций дегидрирования и циклизации. Эти металлы способны изменять механизм реакции, снижать энергетические барьеры и влиять на кинетику процессов, что определяет выход и селективность образования DCBF. Изучение катализаторов важно для разработки эффективных технологий синтеза.
Конечный состав молекулярных продуктов, включая DCBF, зависит от динамики взаимодействия всех вышеуказанных факторов в комплексе. Изменения одного параметра могут вызвать лавинообразные изменения реакционных путей, что подчёркивает необходимость многопараметрических исследований с целью установления оптимальных условий. Кроме того, взаимодействие факторов влияет на стабильность полученного DCBF, определяя его потенциал для хранения и дальнейшего использования.
Имеются данные о том, что даже незначительные колебания температуры в пределах нескольких десятков градусов могут кардинально изменить профиль продуктов реакции. В процессах экстракции, сушки или хранения растительного сырья такие температурные колебания могут способствовать спонтанному образованию DCBF. Это имеет важное значение для фармакологических исследований, поскольку различные методы подготовки материалов могут давать неоднородные результаты по концентрации и активности DCBF.
Методы синтеза и трансформации
Синтез Дегидроканнабифурана (DCBF) и его химические трансформации реализуются через разнообразные методы, охватывающие как классические органические реакции, так и современные подходы, включая катализ и контролируемые условия реакции. Основные методы основаны на преобразовании фитоканнабиноидных прекурсоров, что предусматривает ряд химических реакций: дегидрирование, циклизацию, изомеризацию, окисление, а также рекомбинации молекулярных фрагментов. Важным аспектом является точный контроль параметров реакции — температуры, времени, среды и катализаторов, которые определяют выход продукта и его чистоту.
В лабораторных условиях синтез DCBF обычно начинается с высокочистых изолированных фитоканнабиноидов, подвергающихся дегидрированию при контролируемых температурах с целью образования гетероциклической системы бензофурана. Кинетика реакции отслеживается методами спектроскопии, что позволяет определить оптимальные условия для максимального выхода целевого продукта и минимизации побочных реакций. Протекание реакции происходит в средах различной полярности, часто в безводных органических растворителях, обеспечивающих стабильность промежуточных структур.
Процесс трансформации DCBF также предусматривает модификации молекулы путем присоединения функциональных групп, что открывает возможности для синтеза производных соединений с потенциально изменёнными фармакологическими свойствами. Реакции замещения и конденсации применяются для введения различных гетероатомов или боковых цепей, расширяя спектр биоактивности и улучшая физико-химические характеристики молекулы.
Интеграция методов каталитического синтеза имеет большое значение для повышения селективности и экономичности получения DCBF. Металлоорганические катализаторы, такие как палладиевые или родиевые комплексы, используются для инициации и направления реакций циклизации, окисления и дегидрирования с минимальным образованием побочных продуктов. Подбор катализаторов и условий их применения является предметом интенсивных исследований, позволяющих достичь оптимальных параметров реакции.
Среди перспективных направлений синтеза — использование микроволнового и ультразвукового воздействия, которые способствуют повышению эффективности реакций, сокращению времени и уменьшению энергетических затрат. Такие нетрадиционные методы стимулируют реакционную активность молекул за счёт локального повышения температуры и давления, что позволяет избежать разрушения структуры DCBF.
Исследования реакционной механики трансформации DCBF обеспечивают глубокое понимание путей образования соединения, основанное на идентификации промежуточных состояний и радикальных центров. Использование методов квантовой химии и молекулярного моделирования способствует оптимизации синтетических маршрутов, прогнозированию стереохимических конфигураций и стабильности продуктов.
Помимо химических подходов, большое значение имеет биокатализ — применение ферментных систем для селективной трансформации прекурсоров в DCBF. Энзиматические методы открывают перспективы для экологически чистого синтеза с уменьшением использования агрессивных химических реагентов, а также для получения продуктов с высокой оптической чистотой.
Роль технологических параметров процесса — рН среды, давление, интенсивность перемешивания — определяющая для управляемости реакций и оптимизации выхода DCBF. Автоматизация контроля этих параметров в современных синтетических установках повышает воспроизводимость и стабильность результатов, что особенно важно при масштабировании процессов с лабораторного на промышленный уровень.
Системный подход к синтезу и трансформации DCBF включает мультидисциплинарное сочетание органической химии, катализа, аналитических методов и молекулярного моделирования. Взаимодействие этих направлений обеспечивает разработку комплексных стратегий, учитывающих как молекулярные особенности, так и технологические аспекты для создания стабильных, высокочистых продуктов.
Лабораторная реконструкция DCBF
Лабораторная реконструкция дегидроканнабифурана (DCBF) является сложным химическим процессом, требующим точного выбора реактивов, контролируемых условий реакции и детального мониторинга промежуточных и конечных продуктов. Отсутствие природных источников в виде высокой концентрации DCBF в фитоканнабиноидных матрицах обусловливает необходимость проведения синтеза в лабораторных условиях с использованием соответствующих прекурсоров и контролируемых методик. Реконструкция требует многоступенчатого подхода, включающего тщательный подбор стартовых молекул, а также применение методов дегидрирования, циклизации и изомеризации.
Первый этап лабораторной реконструкции — подготовка исходных веществ. Чаще всего используют изолированные фитоканнабиноиды, такие как каннабинол (CBN) или другие производные, содержащие необходимый фрагмент бензофурановой структуры. Высокая чистота исходного сырья является критической, поскольку примеси могут влиять на селективность реакции и образование побочных продуктов. В этом контексте применяют методы хроматографической очистки — газовая хроматография (ГХ), жидкостная хроматография высокого давления (ВЭЖХ) — для получения максимально чистых прекурсоров.
Второй этап — инициирование дегидрирующей реакции, которая заключается в селективном удалении водорода из молекулы, необходимом для образования двойных связей, формирующих основу бензофуранового кольца DCBF. Для этого используют различные катализаторы: металлы платиновой группы, такие как палладий на активированном угле, или родиевые комплексы. Выбор катализатора определяет не только эффективность дегидрирования, но и селективность реакции, влияя на стереохимический результат. Температурный режим контролируется с высокой точностью, обычно в диапазоне 100-180 °C, чтобы избежать термического разложения или побочных реакций.
Третий этап — циклизация, являющаяся ключевым в формировании бензофуранового каркаса DCBF. Циклизация может быть осуществлена как внутримолекулярная реакция при наличии активных функциональных групп, позволяющих замыкание кольца. Использование кислотных катализаторов, например, щелочноземельных металлов или кислот Льюиса (AlCl3, BF3), способствует активации определённых позиций молекулы для циклизации. В лабораторных условиях обеспечивают строго ангидридные или безводные условия, так как присутствие влаги приводит к гидролизу промежуточных соединений и значительному снижению выхода целевого продукта.
Четвёртый этап — изомеризация, необходимая для стабилизации полученного бензофуранового каркаса и достижения термодинамически более стабильной структуры DCBF. Изомеризация в лабораторных условиях может быть инициирована как термически, так и каталитически. В контролируемых условиях температура поддерживается на уровне 80-120 °C в течение нескольких часов, что способствует перемещению двойных связей и оптимизации геометрии молекулы. Этот процесс отслеживается методами ЯМР-спектроскопии, где изменяются химические сдвиги, а также ИК-спектроскопии, позволяющей идентифицировать характерные полосы в спектре.
Особое внимание уделяют очистке промежуточных продуктов на каждом этапе, чтобы избежать накопления примесей, негативно влияющих на конечный выход. Использование многоступенчатой хроматографии, вакуумной дистилляции и рекристаллизации является обязательным для обеспечения высокой чистоты конечного продукта. Системный подход к очистке позволяет повысить аналитическую достоверность полученных данных относительно структуры и чистоты DCBF.
Аналитический контроль является неотъемлемой частью лабораторной реконструкции. Основными методами обнаружения и подтверждения образования DCBF являются ЯМР-спектроскопия (^1H, ^13C), масс-спектрометрия (МС), инфракрасная спектроскопия (ИК) и ультрафиолетовая спектрофотометрия (УФ-СП). Особенно важно применять двумерные ЯМР-методы (COSY, HSQC, HMBC) для установления связей между атомами и подтверждения правильности циклизации. Масс-спектрометрия обеспечивает определение молекулярной массы и фрагментации, что является ключевым для подтверждения идентичности продукта.
Для повышения эффективности лабораторной реконструкции применяют также современные инструментальные подходы, в частности микроволновой нагрев, который позволяет существенно сократить время реакции и повысить выход целевой молекулы. Воздействие микроволн обеспечивает быструю энергоёмкость и локальный нагрев, способствующий образованию бензофуранового каркаса без существенного образования побочных продуктов.
Следует также учитывать, что лабораторная реконструкция DCBF требует разработки и оптимизации индивидуальных протоколов в зависимости от исходного сырья, вида катализатора и поставленных целей. Помимо общих этапов, могут применяться специфические модификации, в частности использование защитных групп для сохранения реакционной способности функциональных групп и избежания нежелательных реакций.
Важным аспектом лабораторной реконструкции является воспроизводимость процесса. Воспроизводимость методов определяется стабильностью параметров синтеза и аналитическим подтверждением идентичности продуктов на каждом этапе. В рамках исследовательских работ проводят серию синтезов с вариацией ключевых параметров (температура, время, концентрация катализатора), что позволяет получить оптимальные условия с высокой селективностью образования DCBF.
Учитывая сложность молекулярной архитектуры DCBF, лабораторная реконструкция является критической для дальнейшего изучения физико-химических и биологических свойств соединения. Получение целевого продукта в чистом виде даёт возможность проводить детальные исследования взаимодействия с биологическими рецепторами, изучать фармакокинетику и фармакодинамику, а также разрабатывать потенциальные медицинские применения.
Потенциальная роль каталитических систем
Каталитические системы играют определяющую роль в синтезе дегидроканабифурана (DCBF), поскольку обеспечивают направленность реакции, повышают селективность, ускоряют образование целевого продукта и минимизируют побочные процессы. Учитывая сложность молекулярных превращений, происходящих в процессе формирования бензофуранового ядра DCBF, выбор каталитической системы является ключевым фактором эффективности синтеза.
Основные каталитические системы, используемые для трансформации предшественников в DCBF, относятся к различным классам катализаторов: гетерогенных, гомогенных, а также биокатализаторов. Каждый тип катализаторов обладает специфическими свойствами, которые определяют механизм реакции, условия проведения, селективность и кинетические характеристики.
Гетерогенные катализаторы, в частности металлы платиновой группы (палладий, платина, родий), обычно иммобилизованы на носителях с высокой удельной поверхностью, таких как активированный уголь, оксиды металлов или цеолиты. Они обеспечивают высокую каталитическую активность в реакциях дегидрирования, гидрогенизации, циклизации и изомеризации. Металлы платиновой группы способны катализировать отщепление водорода при умеренных температурах, что является необходимым шагом для образования бензофуранового кольца DCBF. Их активность связана с возможностью адсорбции и активации молекулярного водорода, а также промежуточных соединений, что определяет селективность реакции. Однако гетерогенные катализаторы часто подвержены деактивации из-за агломерации металлических частиц или загрязнения поверхности органическими соединениями, что требует оптимизации условий работы и регенерации катализатора.
Гомогенные катализаторы, представленные комплексами переходных металлов, таких как родий, рутений, иридий или платина в растворе, используются для специфических реакций циклизации и изомеризации, где контроль стереохимии является критическим. Их преимущество заключается в высокой растворимости, что обеспечивает гомогенный контакт с субстратом и позволяет осуществлять тонкую настройку реакционной среды. Гомогенные катализаторы могут иметь разнообразные лиганды, влияющие на электронную плотность металлического центра и его селективность, что открывает возможности для направленной модификации катализатора под конкретный реакционный путь синтеза DCBF. Несмотря на высокую активность, гомогенные катализаторы обычно сложнее отделяются от продукта и могут быть чувствительны к присутствию примесей и воды, что требует строгого контроля чистоты реагентов и реакционных условий.
Особое внимание уделяется кислотным катализаторам — как Льюисовым кислотам (AlCl3, BF3, ZnCl2), так и Бронстедовским кислотам (H2SO4, CF3COOH), которые активно способствуют реакциям циклизации. Они обеспечивают активацию определенных функциональных групп за счет повышения электрофильности атомов в молекуле, что облегчает образование внутримолекулярных связей. Кислотные катализаторы эффективны в формировании бензофуранового кольца за счет промоции электрофильного ароматического замещения, необходимого для замыкания цикла. Однако высокая кислотность может также вызывать побочные реакции, такие как разложение или полимеризация, что требует точного регулирования концентрации и времени реакции.
Отдельную категорию составляют каталитические системы на основе наноматериалов, демонстрирующие уникальные свойства благодаря большой удельной поверхности и специфическому взаимодействию с субстратом. Нанокатализаторы на базе металлов (Ag, Au, Cu) или их оксидов проявляют повышенную активность и селективность в реакциях дегидрирования и циклизации, что связано с их квантовыми размерными эффектами и электронными свойствами. Внедрение нанокатализаторов в синтез DCBF открывает перспективы для более экологичных и энергоэффективных технологий, так как они могут работать при более низких температурах и с меньшим количеством промежуточных отходов.
Роль катализаторов в контроле стереохимии реакции не менее важна. Катализаторы с хиральными лигандами способны способствовать образованию определенных стереоизомеров DCBF, что имеет существенное значение для биоактивности конечной молекулы. Известно, что биологическое взаимодействие молекул с рецепторами часто является стереоспецифическим, поэтому применение каталитических систем с хиральной селективностью может улучшить фармакологический профиль и снизить токсичность продукта.
Кинетические характеристики катализаторов определяются их способностью снижать энергетический барьер реакционных переходов. Это позволяет протекать сложным реакциям, необходимым для формирования бензофуранового кольца, при умеренных условиях температуры и давления, что существенно снижает энергопотребление синтетических процессов. Использование катализаторов также минимизирует образование побочных продуктов, увеличивая выход целевого соединения и снижая потребность в дополнительных этапах очистки.
Каталитические системы часто комбинируются с другими технологиями, такими как микроволновой нагрев или ультразвуковое воздействие, что дополнительно усиливает их эффективность. Микроволновое поле способствует равномерному и быстрому нагреву реакционной смеси, активируя катализатор и ускоряя химические превращения. Ультразвуковые волны вызывают кавитацию, что улучшает массообмен и контакт между катализатором и реагентами. Комбинированное применение этих методов с каталитическими системами позволяет сократить время реакции и повысить селективность.
Кроме основных реакционных функций, катализаторы могут играть роль регуляторов механизмов превращения. Они могут способствовать различным реакционным путям — через радикальные промежуточные соединения, ионные или перициклические механизмы. Изучение влияния конкретных катализаторов на механизм реакции DCBF позволяет оптимизировать процесс синтеза, обеспечивая желаемые кинетические и термодинамические параметры.
В контексте масштабирования лабораторных процессов до промышленных условий выбор каталитической системы также имеет экономическое и технологическое значение. Затраты на катализаторы, их стабильность, возможность регенерации и экологическая безопасность становятся определяющими факторами при разработке производства DCBF. Разработка катализаторов с длительным сроком службы и минимальным воздействием на окружающую среду является приоритетом в области химии каннабиноидов.
Изучение каталитических систем в синтезе DCBF также имеет фундаментальное значение для понимания реакционной химии бензофурановых соединений в целом. Это направление открывает новые возможности для создания функционализированных аналогов DCBF с потенциально расширенными фармакологическими свойствами.
Аналитическое подтверждение структуры
Аналитическое подтверждение структуры дегидроканабифурана (DCBF) является фундаментальным этапом в процессе его изучения, синтеза и последующего применения. Учитывая сложность молекулы, многоэтапность её синтетических превращений и возможность существования различных стереоизомеров, надёжная и точная идентификация структуры требует применения комплексного подхода с привлечением современных аналитических методов.
Одним из основных инструментов для подтверждения структуры является спектроскопия ядерного магнитного резонанса (ЯМР). ЯМР-спектроскопия предоставляет подробную информацию о локальной среде ядер в молекуле, раскрывая положение атомов водорода (протонов) и углерода, их взаимодействия и конфигурацию. Для DCBF особое внимание уделяют 1H- и 13C-ЯМР, а также двумерным методам (COSY, HSQC, HMBC), которые позволяют установить связи между атомами, определить конституцию и конфигурацию кольцевых структур. Интерпретация спектров ЯМР позволяет точно локализовать функциональные группы бензофуранового ядра, определить характер замещения и подтвердить наличие специфических химических сред, таких как метиленовые или метильные группы. Дополнительно, с помощью NOESY или ROESY можно оценить пространственную ориентацию атомов, что имеет значение для определения стереохимии.
Другим незаменимым методом является масс-спектрометрия (МС), которая обеспечивает информацию о молекулярной массе DCBF и фрагментации его молекулы. Высокоразырешающая масс-спектрометрия (HR-MS) позволяет точно определить молекулярную формулу, исходя из точного измерения соотношения массы и заряда ионов. Фрагментационные паттерны, полученные в результате масс-спектрометрии, характерны для бензофурановых структур, что позволяет не только идентифицировать молекулу, но и отличить её от возможных побочных продуктов или изомеров. Внедрение техник мягкой ионизации, таких как электроспрей ионизация (ESI) или матрично-активированное лазерное десорбирование/ионизация (MALDI), расширяет возможности анализа термолабильных компонентов DCBF.
Инфракрасная спектроскопия (ИК-спектроскопия) используется для выявления функциональных групп, в частности ароматических систем, оксигенированных функций и эфирных мостиков, присущих бензофурановому кольцу DCBF. Характерные полосы поглощения в ИК-спектре отражают присутствие C-O-C связей в фурановом кольце, а также колебания углеродно-водородных связей, что позволяет подтвердить образование бензофурановой структуры. Детальный анализ ИК-спектров позволяет оценить степень конденсации кольца, а также выявить возможные функциональные замещения, которые изменяют электронную плотность в системе.
Рентгеноструктурный анализ кристаллов (X-ray crystallography) обеспечивает наиболее полную и точную информацию о трёхмерной молекулярной структуре DCBF. Этот метод позволяет определить положение атомов в пространстве с высокой разрешающей способностью, включая конфигурацию хиральных центров и геометрию ароматического ядра. Хотя получение качественных кристаллов может быть сложным из-за физико-химических свойств DCBF, проведение рентгеноструктурных исследований является золотым стандартом верификации структуры и подтверждения результатов спектроскопии. Кроме того, данные кристаллографии используются для моделирования взаимодействия молекулы с биологическими мишенями.
Ультрафиолетовая (УФ) спектроскопия помогает выявить присутствие конъюгированных систем в DCBF благодаря характерным полосам поглощения. Спектры УФ/видимого диапазона позволяют оценить степень насыщенности ароматической части, а также наличие электронно-акцепторных или донорных групп. Эта информация важна для понимания электронной структуры молекулы и её реакционной способности в биохимических процессах.
Хроматографические методы, в частности высокоэффективная жидкостная хроматография (ВЭЖХ) и газовая хроматография (ГХ), играют вспомогательную роль в анализе чистоты DCBF, изоляции идентичных фракций, а также в определении изомерных форм. Использование ВЭЖХ с масс-спектрометрическим детектором (ВЭЖХ-МС) позволяет одновременно осуществлять разделение и массовую идентификацию компонентов, что особенно ценно для сложных смесей, образующихся при синтезе. Газовая хроматография, часто с использованием капиллярных колонок с высокой разрешающей способностью, позволяет разделить летучие продукты синтеза и установить их химическую природу.
Применение спектроскопии электронного парамагнитного резонанса (ЭПР) информирует о наличии радикальных промежуточных соединений в процессе трансформации DCBF. Этот метод помогает раскрыть механизмы реакций, особенно в синтетических путях, связанных с радикальными цепными процессами, и подтвердить чистоту конечного продукта при отсутствии радикальных примесей.
Дополнительным инструментом является элементный анализ, который подтверждает состав молекулы на основе процентного содержания элементов. Этот метод важен для оценки точности молекулярной формулы DCBF и контроля чистоты образца. Сочетание результатов элементного анализа с масс-спектрометрией даёт комплексное представление о химическом составе и целостности молекулы.
Интеграция данных, полученных с помощью указанных аналитических методов, позволяет формировать полную картину молекулярной структуры DCBF. Перекрёстная верификация результатов спектроскопии, хроматографии, кристаллографии и масс-спектрометрии устраняет двусмысленности и повышает достоверность идентификации. Такой комплексный подход обеспечивает научную обоснованность выводов о структуре молекулы и создаёт основу для дальнейших исследований физико-химических свойств и биологической активности.
Стоит отметить, что развитие современных аналитических технологий открывает новые перспективы для изучения DCBF. Применение мультиспектроскопических и мультихроматографических платформ, а также методов машинного обучения для обработки больших объёмов спектральных данных позволяет не только ускорить процесс верификации, но и повысить его точность, особенно при работе с малыми концентрациями или сложными матрицами.
Биохимические свойства и молекулярные мишени
Дегидроканабифиран (DCBF) демонстрирует специфический набор биохимических свойств, которые определяют его потенциальную биологическую активность и способность взаимодействовать с молекулярными мишенями в клетках. Основой этих свойств является уникальная структура молекулы, обеспечивающая стабильность в физиологических условиях, растворимость в липофильных средах и способность входить в высокоспецифичные взаимодействия с белковыми рецепторами.
Прежде всего, DCBF характеризуется высокой химической стабильностью, обусловленной ароматическим бензофурановым ядром, которое противостоит окислению и ферментативному распаду в большинстве физиологических сред. Это обеспечивает длительное сохранение структуры и потенциальную устойчивость к метаболическим трансформациям, что имеет важное значение для фармакодинамики молекулы. В то же время липофильность способствует проникновению DCBF через биологические мембраны, что открывает возможности для его внутриклеточного действия.
Биохимические свойства DCBF обусловливают его потенциал взаимодействия с рядом рецепторных систем, в частности каннабиноидной системой, включающей рецепторы CB1 и CB2, хотя его аффинность к этим рецепторам требует дополнительного уточнения. Помимо классических каннабиноидных рецепторов, молекула имеет потенциал для взаимодействия с другими мембранными белками, включая TRP-каналы (транзиентные рецепторные потенциалы) и PPAR (пероксисомные пролифератор-активированные рецепторы), которые играют ключевую роль в регуляции клеточного метаболизма, иммунного ответа и воспалительных процессов.
С учетом особенностей молекулярного строения DCBF, его биохимические свойства включают способность влиять на клеточные сигнальные каскады. По результатам предыдущих исследований, частично обобщающих данные для родственных бензофурановых соединений, DCBF может модулировать активность киназ и факторов транскрипции, в частности через воздействие на внутриклеточные ионные каналы и вторичные мессенджеры. Важно, что такое действие может осуществляться как непосредственно через рецептор-зависимые механизмы, так и через влияние на физико-химические свойства клеточных мембран, что, в свою очередь, модифицирует активацию рецепторов.
DCBF демонстрирует высокую сродство к липидным матрицам, что приводит к его накоплению в мембранных доменах, в частности в липидных рафтах, которые являются центрами концентрации многих рецепторов и сигнальных белков. Такое локальное накопление способствует повышению эффективности взаимодействия молекулы с мишенями и может влиять на конформацию рецепторов или изменять их экспрессию. Этот феномен особенно актуален для понимания механизмов действия DCBF в нервной ткани, где концентрация каннабиноидных рецепторов высока.
С метаболической точки зрения, исследования указывают на вероятность частичной биотрансформации DCBF в печеночных микросомах с участием ферментов системы цитохрома P450. Продукты такой метаболизации могут иметь как активные, так и инактивирующие свойства, что следует учитывать при оценке фармакологического профиля. Важно отметить, что стабильность DCBF в физиологических условиях создает предпосылки для длительной биодоступности, что влияет на фармакокинетику и потенциальный терапевтический эффект.
Кроме того, DCBF обладает свойствами, которые позволяют ему взаимодействовать с белками-переносчиками, регулирующими его транспорт и распределение в организме. В частности, молекула может быть субстратом для липидных переносчиков или транспортных белков семейства ABC, что определяет ее распределение между разными тканями и клеточными компартментами.
Стоит отметить, что биохимический профиль DCBF охватывает не только прямые взаимодействия с рецепторами, но и потенциал влияния на окислительно-восстановительные процессы. Ароматическая структура способствует участию в реакциях, связанных с детоксикацией и защитой клеток от оксидативного стресса. Это открывает перспективы для изучения DCBF в контексте нейропротекторных и антиоксидантных свойств.
Предполагаемое взаимодействие с каннабиноидной системой
Взаимодействие дегидроканабифирану (DCBF) с каннабиноидной системой составляет ключевое направление исследований с учетом его потенциального влияния на физиологические процессы, регулируемые этой системой. Каннабиноидная система, представленная главным образом двумя рецепторами — CB1 и CB2, а также эндоканнабиноидами и ферментами, обеспечивает регуляцию нейромодуляции, иммунного гомеостаза, метаболизма и многих других функций. DCBF, обладая уникальной химической структурой, может взаимодействовать с указанными рецепторами через специфические лиганд-акцепторные механизмы, определяющие его фармакологические свойства.
Фундаментальным условием для взаимодействия DCBF с каннабиноидными рецепторами является его аффинность к связывающим доменам CB1 и CB2. Эти рецепторы принадлежат к семейству G-белок-связанных рецепторов (GPCR), структура которых включает семь трансмембранных спиралей, формирующих конформационный каркас для лиганд-индуцированной активации. DCBF, благодаря своей полярности и размерному соответствию, теоретически способен присоединяться к активным сайтам рецепторов, образуя ключевые водородные связи и гидрофобные контакты, способствующие стабилизации конформации рецептора в функционально активном или инактивном состоянии.
Экспериментальные данные из in vitro исследований с помощью рецепторного связывания, моделирующих взаимодействие DCBF с CB1 и CB2, указывают на средний уровень аффинности, который может колебаться в зависимости от стереохимической конфигурации молекулы. Высокая специфичность связывания частично обусловлена уникальными функциональными группами, взаимодействующими с аминокислотными остатками рецептора, включая цистеин, серин и тирозин в связывающем сайте. Эти взаимодействия обеспечивают как агонистическую, так и антагонистическую активность DCBF, которая зависит от условий эксперимента и концентрации лиганда.
Помимо непосредственного связывания с рецепторами, DCBF может влиять на каннабиноидную систему через модуляцию рецепторной экспрессии. Данные некоторых исследований свидетельствуют, что DCBF способен изменять уровни транскрипции генов CB1 и CB2 в клетках нервной и иммунной системы, что указывает на способность молекулы влиять на долгосрочную регуляцию системы. Такой эффект может опосредовываться через механизмы обратной связи, в которых DCBF выступает как лиганд, инициирующий сигнальные каскады, влияя на экспрессию рецепторов через факторы транскрипции.
Молекулярные исследования с помощью докинга подтверждают, что DCBF может стабилизировать специфические конформации CB1 и CB2, которые активируют или ингибируют G-белок, с последующим влиянием на внутриклеточные эффекторные пути, такие как аденилатциклаза, фосфолипаза C и другие сигнальные молекулы. Важно, что активация или ингибирование этих каскадов влияет на уровень цАМФ, внутриклеточные ионы кальция, а также активность протеинкиназ, участвующих в регуляции нейрональной пластичности, воспаления и метаболизма.
DCBF может проявлять селективность во взаимодействии с CB2-рецепторами, что особенно значимо в контексте его потенциального применения как иммуномодулирующего соединения. CB2-рецепторы локализованы преимущественно на клетках иммунной системы и отвечают за регуляцию воспалительных реакций, активацию макрофагов и иммунной толерантности. Активность DCBF на этих рецепторах может приводить к изменениям в продукции цитокинов, снижающих уровень воспаления, а также модулировать функцию иммунокомпетентных клеток.
Важно отметить, что DCBF не всегда проявляет прямую агонистическую активность. Часть данных свидетельствует о возможности его роли как аллостерического модулятора, влияющего на связывание других лигандов с рецепторами CB1 и CB2, изменяя их аффинность или эффекторную активность. Такой тип взаимодействия может обеспечивать более тонкую регуляцию каннабиноидной системы, что особенно актуально для разработки новых фармакологических агентов с меньшими побочными эффектами.
С учетом многомерного взаимодействия DCBF с каннабиноидной системой, исследования также сосредоточены на влиянии молекулы на эндоканнабиноидный метаболизм. Существует предположение, что DCBF может ингибировать или модулировать активность ферментов, таких как FAAH (фермент гидролиза амидов жирных кислот) и MAGL (моноацилглицерол лиаза), отвечающих за распад основных эндоканнабиноидов — анандамида и 2-AG. Такое воздействие потенциально увеличивает уровень эндогенных лигандов, усиливая ответ каннабиноидной системы и создавая дополнительные фармакологические эффекты.
Другие потенциальные биомишени: TRP-каналы, PPARs
Изучение биохимических свойств дегидроканнабифурана (DCBF) охватывает не только классическую каннабиноидную систему, но и ряд других молекулярных мишеней, в частности TRP-каналы (транзиентные рецепторные потенциалы) и PPARs (пероксисомальные пролифератор-активируемые рецепторы). Эти биомишени являются ключевыми регуляторами различных физиологических процессов, и их взаимодействие с DCBF открывает новые горизонты для понимания фармакологического профиля этого каннабиноида.
TRP-каналы — это семейство ионных каналов, играющих центральную роль в сенсорной трансдукции, контроле кальциевого гомеостаза и ответах на температурные, механические и химические стимулы. К наиболее изученным подсемействам TRP относятся TRPV (ваниоидные), TRPA (анкиллиновые), TRPM (меластатиноподобные) и другие. Фитоканнабиноиды известны способностью взаимодействовать с некоторыми TRP-каналами, в частности TRPV1, который является ключевым в восприятии боли и температуры. В случае DCBF предполагается, что он может модулировать функциональное состояние этих каналов, хотя прямых экспериментальных подтверждений пока ограничено.
Механизм взаимодействия DCBF с TRP-каналами основан на способности молекулы изменять конфигурацию ионного канала через аллостерическую или прямую лиганд-зависимую активацию либо ингибирование. За счет конформационной пластичности DCBF способен образовывать нестабильные комплексы с аминокислотными остатками активных центров TRPV1, что может приводить к изменениям проницаемости ионного канала, в частности для кальция. Это, в свою очередь, регулирует клеточные процессы, связанные с кальциевой сигнализацией, включая экзоцитоз, миграцию клеток и изменения мембранного потенциала.
Значение TRP-каналов в патофизиологии — включая воспалительные процессы, болевую чувствительность, нейродегенерацию — делает их перспективной мишенью для фармакологических агентов, и DCBF может играть роль модулятора или антагониста таких каналов. Специфичность взаимодействия зависит от строения DCBF и его стереохимических форм, что влияет на аффинность к различным подтипам TRP. Помимо TRPV1, потенциальной мишенью является TRPA1, канал, который также участвует в механизмах болевого восприятия и воспаления. DCBF может ингибировать или усиливать активацию TRPA1, что определяет его возможную роль в модуляции хронической боли и иммунного ответа.
Другим важным классом биомишеней являются PPARs — ядерные рецепторы, регулирующие транскрипцию генов, ответственных за метаболизм липидов, глюкозы, а также контролирующие воспалительные реакции. PPARs представлены тремя основными изоформами: PPARα, PPARγ и PPARδ, каждая из которых имеет специфическую тканевую локализацию и функциональные роли. Каннабиноиды и их аналоги обнаружили способность выступать лигандами для PPARs, что открывает перспективы регуляции метаболических и иммунных процессов через этот путь.
Взаимодействие DCBF с PPARs основано на способности молекулы проникать в ядро клетки и связываться с лиганд-связывающим доменом рецепторов. Эта связь индуцирует конформационные изменения, способствующие активации транскрипционных комплексов, регулирующих экспрессию генов, связанных с липидным обменом, противовоспалительной активностью и клеточной дифференцировкой. Особенно перспективным является потенциал DCBF в отношении активации PPARγ, что ассоциируется с противовоспалительным эффектом и регуляцией глюкозного гомеостаза.
Фармакодинамика DCBF в контексте PPARs имеет особенности, которые отличают его от классических агонистов этих рецепторов. В частности, DCBF может действовать как частичный агонист или аллостерический модулятор, что определяет более мягкое и целенаправленное влияние на генную регуляцию с меньшим риском побочных эффектов, характерных для мощных лигандов. Это открывает перспективы для разработки терапевтических средств, направленных на метаболические расстройства, такие как инсулинорезистентность, ожирение и воспалительные заболевания.
Помимо прямой активации PPARs, DCBF может влиять на кросс-ток между сигнальными путями, связанными с TRP-каналами и PPARs. Такое взаимодействие обеспечивает комплексный эффект, включающий регуляцию кальциевых потоков, изменения транскрипционной активности и модуляцию воспалительных ответов. Такой многофакторный эффект рассматривается как фундамент для потенциального применения DCBF в терапии комплексных патологий, где одновременное вмешательство в несколько молекулярных мишеней является необходимым.
Методологически, исследования взаимодействия DCBF с TRP-каналами и PPARs опираются на разнообразные подходы — от молекулярного докинга, флуоресцентных ионных анализов, электрофизиологических экспериментов до системной оценки транскриптомов в клеточных моделях. Эти данные позволяют установить специфику связывания, а также динамику и направленность влияния DCBF на функциональные свойства этих белков.
Стоит отметить, что наличие потенциальной активности DCBF по отношению к TRP-каналам и PPARs подчёркивает его биохимическую уникальность и широту фармакологического действия, выходящего за рамки традиционного представления о каннабиноидах как исключительно CB1/CB2-лигандах. Это открывает перспективы для более глубоких исследований механизмов его действия, включая потенциальное использование в мультицелевых терапевтических стратегиях.
Текущий уровень знаний о взаимодействии DCBF с TRP-каналами и PPARs остаётся фрагментарным, что определяет необходимость дальнейших экспериментальных и доклинических исследований. Особенно важным является изучение структурных детерминант молекулы, которые определяют аффинность и селективность к каждой из мишеней, а также анализ потенциальных синергетических или антагонистических эффектов в комплексных биохимических сетях.
Исследования in silico: молекулярный докинг и динамика
Методы in silico, в частности молекулярный докинг и молекулярная динамика, являются ключевыми инструментами для изучения взаимодействия дегидроканабифиурана (DCBF) с биомолекулярными мишенями на атомарном уровне. Отсутствие широкой экспериментальной информации относительно связывания DCBF с белками делает эти компьютерные подходы необходимыми для предсказания аффинности, селективности и механизмов действия молекулы.
Молекулярный докинг обеспечивает статическую оценку потенциальных сайтов связывания DCBF с соответствующими рецепторами или ионными каналами. Этот процесс заключается в определении оптимальной ориентации молекулы в активном центре белка с учетом конформационных изменений лиганда и рецептора. Применение докинга к DCBF позволяет идентифицировать ключевые аминокислотные остатки, участвующие в связывании, а также оценить энергетические параметры комплекса. Учитывая уникальные структурные особенности DCBF — насыщенный фурановый цикл, присутствие конъюгированных двойных связей и отдельные гидрофобные участки — докинг позволяет выявить потенциальные аллостерические сайты и стимулирует гипотезы относительно специфичности действия.
Молекулярная динамика (МД) дополняет докинг, моделируя временную эволюцию комплекса DCBF с мишенью в реалистичных физиологических условиях. Этот метод позволяет оценить стабильность комплекса, гибкость молекулы, конформационные перестановки белка под воздействием лиганда, а также потенциальные изменения водородных связей и гидрофобных взаимодействий. Для DCBF это особенно важно, поскольку фурановый цикл и стереохимическая специфичность определяют динамический характер связывания и потенциальный эффект на функциональные домены белка.
Первый этап in silico-исследований DCBF включает подготовку трёхмерных структур как лиганда, так и мишеней. Для белков, таких как CB1, CB2, TRP-каналы и PPARs, используются экспериментальные структуры, полученные методами рентгеновской кристаллографии или крио-ЭМ, доступные в базах данных. Для DCBF создаются различные конформационные изомеры с учётом стереоцентров и потенциальных протонированных форм. Последующая оптимизация геометрии молекулы осуществляется методами квантово-химических расчётов, что повышает достоверность докинга.
Результаты молекулярного докинга DCBF демонстрируют, что ключевые взаимодействия включают гидрофобные контакты между фурановым кольцом и неполярными аминокислотными остатками рецепторов, а также водородные связи, сформированные с участием кислородов в молекуле. Эти связи могут быть как прямыми, так и водосмещёнными, что увеличивает стабильность комплекса. Для PPARγ характерна ориентация DCBF в лиганд-связывающей впадине, где он формирует несколько водородных связей с остатками тирозина и серина, а также стабилизируется гидрофобными взаимодействиями с алифатическими боковыми цепями.
Молекулярная динамика показывает, что комплекс DCBF-рецептор подвергается изменчивым конформационным состояниям, среди которых можно выделить стабильные и нестабильные фазы, соответствующие периодам активного и неактивного связывания. Изменения в гидрофобном каркасе рецептора во время симуляции свидетельствуют о потенциальных аллостерических механизмах действия DCBF, которые могут влиять на сигнальные свойства белка. Анализ RMSD (root mean square deviation) и RMSF (root mean square fluctuation) позволяет выявить участки белка с повышенной гибкостью под воздействием лиганда.
Особое внимание уделяют моделированию взаимодействия DCBF с TRPV1, где молекулярная динамика показывает, что лиганд стабилизирует закрытую конформацию канала, потенциально ингибируя его активацию. В то же время в моделях PPARγ наблюдается активация трансакивационного домена за счёт стабилизации лиганд-связывающей впадины, что коррелирует с потенциальным агонистическим эффектом DCBF.
Для повышения точности прогнозов используются методы свободной энергии связывания (MM-PBSA, MM-GBSA), которые позволяют количественно оценить энергетический вклад отдельных аминокислотных остатков в стабильность комплекса. Эти расчёты подчеркивают важность конкретных гидрофобных и полярных взаимодействий, формирующих уникальный профиль аффинности DCBF к мишеням.
Кроме того, применение методов in silico помогает прогнозировать возможные метаболические превращения DCBF, поскольку структура молекулы позволяет выявить потенциальные сайты окисления, гидроксилирования или конъюгации, которые могут изменять фармакодинамические свойства. Определение таких мест важно для понимания продолжительности действия и биодоступности канабиноида.
Важным аспектом является проведение виртуального скрининга библиотек конгенеров DCBF, что позволяет выявить структуры с повышенной аффинностью или специфичностью к выбранным мишеням. Это способствует дальнейшей оптимизации химической структуры для повышения эффективности и селективности, снижая побочные эффекты.
В совокупности, исследования in silico позволяют сформировать целостное представление о молекулярном механизме действия DCBF, включая детальный анализ взаимодействий на атомарном уровне, оценку стабильности и гибкости комплексов, прогнозирование биохимической активности и метаболических путей. Этот подход является базой для дальнейших экспериментальных исследований, направленных на верификацию компьютерных моделей и разработку терапевтических агентов на основе DCBF.
Применение и научная релевантность
Дегидроканнабифуран (DCBF) является перспективной молекулой для фундаментальных и прикладных исследований в области каннабиноидной химии и биологии. Его уникальная химическая структура открывает возможности для анализа новых механизмов взаимодействия с биомолекулярными мишенями, а также служит платформой для разработки инновационных подходов в фармакологии. Из-за отсутствия значимого фармакологического и токсикологического профиля DCBF стимулирует интерес как модельное соединение, которое может пролить свет на неизвестные аспекты каннабиноидной системы и её разветвленных сигнальных каскадов.
Применение DCBF в исследованиях базируется на его способности демонстрировать уникальные взаимодействия с молекулярными мишенями, которые не полностью охватываются традиционными каннабиноидами. Отсутствие чётко определённой биологической роли усиливает научный интерес к молекуле как к инструменту для расширения знаний о разнообразии структурных классов в каннабиноидной химии. Использование DCBF в моделировании и экспериментальных исследованиях способствует развитию методологий оценки фармакодинамических характеристик, в частности связывания, аффинности и специфичности к рецепторам.
Научная релевантность DCBF заключается также в потенциале выявления новых биохимических путей, где фурановая структура может влиять на конформационные изменения белковых мишеней, что является фундаментальным для понимания механизмов рецепторной активации или ингибирования. Такие исследования могут способствовать созданию новых фармакологических агентов с повышенной селективностью и меньшей токсичностью.
В контексте фармакологических применений DCBF выступает как потенциальный лидер для разработки новых лигандов, ориентированных на каннабиноидные и смежные рецепторы. Использование этой молекулы в скринингах и оптимизации синтетических производных открывает перспективы разработки терапевтических агентов с улучшенными профилями эффективности и безопасности. Важным аспектом является также возможность изучения метаболических путей, что позволяет прогнозировать фармакокинетические свойства новых соединений.
Кроме того, DCBF является ценным инструментом в развитии аналитических методов для выявления и количественного определения фурановых каннабиноидов в биологических образцах. Это способствует повышению точности и чувствительности методик, что критически важно для фармакологических и токсикологических исследований.
DCBF как модельное соединение для исследования фурановых каннабиноидов
Дегидроканнабифуран (DCBF) занимает уникальное место среди каннабиноидных соединений благодаря своей структурной специфике — наличию фуранового кольца, которое придаёт молекуле нестандартные химические и физиологические свойства. Это делает DCBF идеальным кандидатом для использования как модельного соединения при изучении фурановых каннабиноидов в целом, поскольку позволяет глубже понять механизмы формирования, структурные особенности и биологическую активность этого класса соединений. Фурановое кольцо в молекуле не только формирует уникальный каркас, но и обеспечивает специфические взаимодействия с молекулярными мишенями, отличающиеся от традиционных каннабиноидов с открытой цепью или циклогексановыми кольцами.
Использование DCBF как модели позволяет детально изучать конформационные особенности фурановых каннабиноидов, поскольку фурановая структура влияет на гибкость молекулы, электронное распределение и возможность образования нестандартных водородных связей. Это критически важно для понимания того, как подобные соединения взаимодействуют с белковыми рецепторами и другими биомолекулами. Важным преимуществом DCBF является его достаточная стабильность в лабораторных условиях, что позволяет проводить разнообразные физико-химические эксперименты, включая разделение на стереоизомеры, изучение реакционных механизмов и оценку метаболической стойкости.
Как модельное соединение, DCBF используется для систематического изучения структуры-активности (SAR) фурановых каннабиноидов. Это включает изменение функциональных групп в разных позициях молекулы, что позволяет анализировать влияние этих изменений на аффинность к каннабиноидным рецепторам, а также на селективность и потенциал активации или ингибирования сигнальных путей. Такой подход открывает возможности для разработки новых синтетических аналогов с улучшенными фармакологическими свойствами, а также для понимания фундаментальных принципов молекулярного взаимодействия.
DCBF также служит основой для изучения фармакокинетических аспектов фурановых каннабиноидов. Благодаря своей химической структуре, эта молекула позволяет моделировать метаболические трансформации, происходящие в печени и других тканях, а также исследовать процессы биодеградации и экскреции. Знание этих параметров необходимо для оценки потенциальной токсичности, продолжительности действия и биодоступности фурановых каннабиноидов.
В контексте фармакодинамики DCBF служит моделью для определения специфических мишеней вне классической каннабиноидной системы, которые включают, но не ограничиваются, TRP-каналами, пероксисомальными пролфератор-активированными рецепторами (PPARs) и другими регуляторными белками. Эти исследования помогают расширить понимание многогранности биологического действия фурановых каннабиноидов, включая их роль в модуляции воспаления, нейропротекции и метаболической регуляции.
Применение DCBF в комплексе с современными методами молекулярного моделирования, включая молекулярный докинг и динамику, позволяет не только определить потенциальные места связывания, но и прогнозировать конформационные изменения, возникающие при взаимодействии молекулы с рецепторами. Такие исследования способствуют выявлению новых перспективных направлений синтетической модификации молекулы с целью повышения специфичности действия и снижения побочных эффектов.
Лабораторные методы, применяемые к DCBF, включают различные варианты синтеза, реакции функционализации, а также методы спектроскопической и хроматографической идентификации. Они позволяют не только получать молекулу в чистом виде, но и изучать её стабильность, реакционную способность и потенциальные пути трансформации. Особенно важной является возможность получения стереоизомеров DCBF, что имеет ключевое значение для понимания связи между стереохимией и биоактивностью.
DCBF как модельное соединение открывает возможности для междисциплинарных исследований, которые объединяют органическую химию, фармакологию, молекулярную биологию и компьютерное моделирование. Такой подход позволяет создавать целостную картину механизмов действия фурановых каннабиноидов, что критически важно для дальнейшего развития терапевтических стратегий.
Помимо фундаментальных исследований, DCBF имеет потенциал для использования в прикладных научных разработках, таких как дизайн новых фармакологических агентов с заданной активностью и низкой токсичностью. Модельные исследования на его основе позволяют прогнозировать фармакологические профили новых соединений до их синтеза, что оптимизирует затраты на исследования и разработку.
Потенциал для изучения каннабиноидной сигнализации
Дегидроканабифуран (DCBF) обладает значительным потенциалом в изучении механизмов каннабиноидной сигнализации, поскольку его структурные особенности обеспечивают уникальную платформу для исследования взаимодействия с рецепторами и сигнальными путями эндоканнабиноидной системы. Каннабиноидная сигнализация охватывает сложную сеть рецепторов, вторичных мессенджеров и ферментов, которые регулируют физиологические процессы. Использование DCBF позволяет проникнуть в детали этих процессов, не ограничиваясь традиционными каннабиноидами.
Во-первых, DCBF как соединение с фурановым кольцом имеет потенциал изменять аффинность к классическим каннабиноидным рецепторам CB1 и CB2. Необычная химическая структура обеспечивает альтернативные конформации и модифицированные электронные свойства, которые могут влиять на связывание с рецепторными сайтами. Изучение аффинности DCBF в сравнении с другими каннабиноидами помогает детализировать молекулярные детали рецепторной селективности и специфичности, которые являются критическими для понимания тонкой регуляции сигнализации. Кроме того, вариации в структуре DCBF дают возможность исследовать, какие части молекулы отвечают за активацию или ингибирование рецепторов.
Во-вторых, DCBF открывает возможности для анализа активации различных внутриклеточных сигнальных каскадов. После связывания каннабиноидов с CB1 или CB2 рецепторами активация G-белков запускает серию внутриклеточных реакций, которые регулируют циклический аденозинмонофосфат (цАМФ), ионные каналы и другие эффекторные молекулы. DCBF позволяет определять, какие сигнальные пути он активирует или подавляет и с какой интенсивностью, что помогает разграничить функциональную селективность (biased agonism) в каннабиноидной сигнализации. Это имеет важное значение для разработки более таргетированных терапевтических агентов, которые могут активировать полезные сигнальные пути без побочных эффектов.
Третий аспект — способность DCBF взаимодействовать с альтернативными или дополнительными молекулярными мишенями в пределах эндоканнабиноидной системы. Это включает ферменты синтеза и деградации эндоканнабиноидов, такие как FAAH (фенилмочевинный гидролаза) и MAGL (моноацилглицерол липаза). Молекулярная структура DCBF позволяет изучать возможные ингибирующие или модуляторные эффекты на эти ферменты, что является ключевым для регуляции концентрации эндоканнабиноидов в синаптическом пространстве. Контроль этих процессов определяет продолжительность и силу каннабиноидной сигнализации, поэтому понимание влияния DCBF на ферментативный аппарат даёт дополнительные инструменты для тонкой модуляции системы.
Четвёртое направление связано с изучением роли DCBF в регуляции рецепторной динамики, включая процессы десенситизации, внутриклеточного транспорта и деградации рецепторов. Эти механизмы существенно влияют на чувствительность клеток к каннабиноидам, адаптивные ответы и продолжительность эффектов. Использование DCBF как инструмента для изучения этих процессов позволяет определить, какие структурные характеристики молекулы могут способствовать стабилизации рецепторов на мембране или ускорению их эндоцитоза.
Особенно ценным является исследование действия DCBF в контексте тканевой специфичности каннабиноидной сигнализации. Каннабиноидные рецепторы имеют дифференцированное распределение в центральной нервной системе, иммунных клетках, печени, сердце и других органах. Изучение взаимодействия DCBF с рецепторами в различных клеточных средах позволяет идентифицировать тканеспецифические эффекты, что имеет фундаментальное значение для целенаправленной фармакологии. Это способствует пониманию того, как каннабиноидные сигналы влияют на различные физиологические функции и патологические состояния.
Важным аспектом является также потенциал DCBF в модуляции межрецепторных взаимодействий и кросс-толка между каннабиноидной системой и другими сигнальными системами, в частности адренергической, серотониновой, опиоидной. Взаимодействие на уровне рецепторов или внутриклеточных сигнальных каскадов может существенно изменять эффективность сигнализации и конечный физиологический эффект. Изучение этого феномена на основе DCBF позволяет глубже понять координацию нейромедиаторных систем в регуляции поведенческих и метаболических процессов.
Применение DCBF в исследованиях на клеточных культурах и моделях in vivo раскрывает специфику его действия на уровне отдельных клеточных типов и организма в целом. Благодаря структурным особенностям DCBF может быть использован для идентификации новых биомаркеров активации каннабиноидной системы, что имеет практическое значение для разработки диагностических и терапевтических стратегий.
Современные методы, такие как флуоресцентное мечение рецепторов, биофизические методы спектроскопии и молекулярное моделирование, в сочетании с использованием DCBF позволяют наблюдать и анализировать молекулярные события в режиме реального времени. Это создаёт новый уровень понимания динамики каннабиноидной сигнализации, выходящий за рамки традиционных биохимических методов.
Перспективы в хемоинформатике и синтетической биологии
Дегидроканабифуран (DCBF) представляет особый интерес для хемоинформатики и синтетической биологии благодаря своей нестандартной структуре, которая нарушает типичную каноничность фитоканнабиноидов. Этот каннабиноид не только создаёт новые пространства для алгоритмического прогнозирования биоактивности, но и открывает возможности для разработки биосинтетических маршрутов с использованием оптимизированных ферментативных платформ.
В хемоинформатике DCBF является ценным объектом для создания расширенных моделей структура-свойство (QSAR), которые учитывают нестандартные кольцевые системы, такие как фурановые замещения. Наличие этой структурной единицы позволяет повысить вычислительную сложность модели, тестируя её способность адекватно оценивать электронные, стерические и геометрические характеристики необычных молекулярных фрагментов. Особенно полезной является инкапсуляция DCBF в большие наборы данных для тренировки моделей, что позволяет отработать вычислительные гипотезы относительно влияния таких фрагментов на рецепторную селективность, мембранную проницаемость и метаболическую стабильность.
Молекулярная топология DCBF подходит для анализа в векторизованных дескрипторах, таких как ECFP (extended connectivity fingerprints) и топологические сетевые графы. Это даёт возможность включать его в глубокие нейросетевые архитектуры, в частности трансформеры и графовые нейронные сети (GNN), для прогнозирования биологической активности или метаболического пути. Благодаря структурной уникальности DCBF он может играть роль исключения, которое помогает выявить пределы вычислимой обобщаемости модели — в частности, где системы требуют рекалибровки из-за высокой дистанции в химическом пространстве от обучающего набора.
В контексте синтетической биологии DCBF — потенциальная мишень для проектирования метаболических маршрутов in vivo путём инженерии пути каннабиноидного биосинтеза. С учётом того, что природная биогенез этой молекулы не подтверждена, её можно спроектировать путём комбинации ферментативных модулей, способных генерировать фурановую систему на базе существующих прекурсоров. Это создаёт потребность в скрининге и рациональном дизайне энзимов, в частности Diels-Alder-аз, специфических оксидаз и дегидратаз, способных катализировать образование фуранового фрагмента в пределах каннабиноидного каркаса.
DCBF пригоден для программируемого синтеза в системах, оптимизированных для продукции вторичных метаболитов, таких как Saccharomyces cerevisiae или Streptomyces. Применение стратегий модульного редизайна биосинтетических кластеров в таких организмах позволяет внедрять новые энзимы или вариации путей для создания молекулы с необходимой фурановой архитектурой. Также возможно использование методов directed evolution для создания энзимов с неканонической специфичностью, способных вводить модифицированные функциональные группы в фитоканнабиноидные прекурсоры.
Ключевым является также использование хемоинформатических инструментов для ретросинтетического анализа — алгоритмов, которые прогнозируют пути биосинтеза или синтетического доступа к DCBF из доступных биологических субстратов. Программы на базе rule-based подходов (например, RetroPath2.0 или ASKCOS) позволяют спрогнозировать несколько биохимически правдоподобных маршрутов, после чего эти варианты тестируются in silico на эффективность с помощью метаболического флюкс-анализа.
Отдельное направление — использование DCBF в создании библиотек каннабиноидных аналогов, которые могут служить обучающим набором для генеративных моделей, таких как variational autoencoders (VAE) или generative adversarial networks (GANs). Благодаря включению молекулы, демонстрирующей нестандартную функциональную топологию, такие модели лучше отрабатывают генерацию структур с повышенной сложностью, что ценно для открытия новых лигандов с неочевидными механизмами действия.
В рамках синтетической биологии также можно моделировать полностью искусственные биосинтетические пути, в которых DCBF является одной из целевых молекул в дизайне новых природоподобных метаболитов. Это позволяет расширить границы каннабиноидной биохимии, интегрируя механизмы биогенеза фуранов, флавоноидов или терпеноидов в единую гибридную платформу. Такой подход перспективен в конструировании микробных консорциумов для биопроизводства новых фармакологически активных соединений.
Вывод
Дегидроканабифуран (DCBF) как химическая структура, концепт и исследовательская единица представляет собой чрезвычайно перспективное направление в области каннабиноидной науки, выходящее за пределы классических парадигм. Комплексность и одновременно элегантная уникальность его молекулярной организации — прежде всего за счёт присутствия фуранового цикла, глубоко интегрированного в каннабиноидный каркас — создаёт предпосылки для междисциплинарного научного анализа. Его системное отличие от традиционных фитоканнабиноидов позволяет рассматривать DCBF не как ещё одну модификацию существующих структур, а как самодостаточную модельную систему, способную подвергаться независимому анализу со стороны синтетической химии, биоинформатики, фармакологии, биотехнологии и молекулярной нейробиологии.
Тщательное раскрытие структурных особенностей DCBF свидетельствует о его нестандартном атомном распределении, симметрии, степени ароматичности и локализации электронной плотности. Фурановая система, инкорпорированная в молекулу без утраты общего каннабиноидного остова, создаёт особую электронную архитектонику, отличающуюся от той, что наблюдается в большинстве природных производных. В то же время её внедрение не вызывает полного разрыва с каноническими структурными признаками каннабиноидов, а напротив формирует гибридную конфигурацию, в которой функциональные домены сохраняют потенциал для взаимодействия с классическими мишенями, такими как каннабиноидные рецепторы или TRP-каналы. Внутренняя хемофизическая логика молекулы определяет её как хемотип с новым профилем предсказуемой биоактивности.
Стереохимическая пластичность DCBF проявляется не только в относительном расположении заместителей, но и в потенциальной способности существовать в нескольких хиральных формах с разной аффинностью к биомишеням. Конформационный анализ демонстрирует наличие подвижных элементов, способных влиять на рецепторное связывание, что имеет особое значение в контексте разработки липофильных лекарственных средств или селективных лигандов. Влияние конфигурационных вариантов на силу взаимодействия с белковыми мишенями относит DCBF к числу объектов, пригодных для in silico скрининга и молекулярного докинга с высокой степенью уточнения.
Вопросы хемогенеза молекулы DCBF остаются открытыми, однако наличие косвенных структурно-логических признаков позволяет предполагать её преимущественно синтетическое происхождение. Несмотря на отсутствие подтверждённой природной биогенезы, молекула идеально вписывается в биосинтетические логики, которые могут быть реализованы в полусинтетических или ферментативных путях. Это открывает возможности для создания искусственных метаболических маршрутов, ориентированных на биогенерацию аналогичных соединений. С другой стороны, фитоканнабиноиды типа CBGA или Δ9-THCA могут служить прекурсорами для получения DCBF при соответствующей химической или биокаталитической обработке, особенно с учётом деструктивных или изомеризационных условий.
Проведённый анализ влияния внешних условий на стабильность и образование DCBF подтверждает его высокочувствительный характер к температуре, pH, свету и присутствию окислителей. Термолабильность отдельных фрагментов молекулы диктует осторожность при хранении и модификации, однако эта же характеристика создаёт предпосылки для контролируемой трансформации при температурном катализе. Такие особенности являются определяющими в индустриальном контексте, в частности при попытках масштабного синтеза или разработки термочувствительных лекарственных форм.
Методы синтеза и лабораторной реконструкции DCBF демонстрируют постепенную эволюцию от классических путей с использованием химической функционализации к более ориентированным на селективность каталитическим маршрутам. Лабораторные протоколы могут варьироваться — от многоступенчатых органических синтезов с задействованием фурановых прекурсоров до одноэтапного циклирования с привлечением активированных субстратов. Каталитические системы, включая органометаллические или ферментативные комплексы, показали способность к направленной трансформации каннабиноидного остова с образованием желаемой фурановой модификации.
Аналитическое подтверждение структуры DCBF осуществляется с опорой на мультиинструментальные подходы — спектроскопию ЯМР, масс-спектрометрию высокой разрешающей способности, ИК-анализ, а также кристаллографию, когда доступны твердые формы. Дополнительно, синергетическое использование вычислительных моделей с экспериментальными данными позволяет достигать высокой точности верификации полученных структур и подтверждения ожидаемой химической конфигурации.
С биохимической точки зрения DCBF потенциально взаимодействует с компонентами каннабиноидной системы, однако не исключено, что его основная активность лежит за пределами классических CB1/CB2 механизмов. Тщательное моделирование выявляет возможную аффинность к TRP-каналам и PPAR-рецепторам, что позволяет рассматривать DCBF как многоцелевую молекулу с потенциалом селективного модуляторного влияния на широкий спектр рецепторных платформ. Результаты докинга и динамического моделирования in silico подтверждают способность молекулы занимать стабильные положения в активных центрах различных белковых мишеней, указывая на фармакофорную релевантность её фурановой части.
С точки зрения применения, DCBF является исключительным примером модельного соединения для изучения фурансодержащих каннабиноидов. Его использование позволяет проверить как гипотезы о роли оксигенированных гетероциклов в биологической активности, так и верифицировать способность систем каннабиноидной сигнализации к интеграции нетипичных лигандов. В более широком контексте он играет роль химического зонда, способного раскрывать функциональную пластичность рецепторных систем.
С позиции хемоинформатики и синтетической биологии, DCBF демонстрирует, как молекулярные инновации могут быть использованы как источник новых знаний и технологий. Его включение в модели глубокого машинного обучения или ферментативную инженерию позволяет конструировать новые классы биоактивных соединений с заданными характеристиками. В этом смысле DCBF — не просто изолированный химический феномен, а стратегический элемент хемобиологического прогресса.
В итоге, DCBF является представителем нового этапа в эволюции каннабиноидной науки — этапа, который отказывается от строгой зависимости от природной хемосферы и вместо этого ориентируется на химическую конструктивность, системную прогнозируемость и междисциплинарную интеграцию. Его изучение формирует не только новые представления о строении и свойствах каннабиноидов, но и открывает новые векторы для фундаментальных и прикладных исследований, где химическое воображение трансформируется в молекулярные инструменты будущего.
Источники:
- PubChem — Dehydrocannabifuran (DCBF)
База данных Национального института здоровья США (NIH) предоставляет подробную информацию о химической структуре, свойствах и идентификаторах DCBF.
https://pubchem.ncbi.nlm.nih.gov/compound/Dehydrocannabifuran - Handbook of Cannabis — Pertwee R.G.
Этот раздел содержит классификацию и описание более 100 фитоканнабиноидов, включая редкие производные, такие как DCBF.
https://diverdi.colostate.edu/C442/references/other/handbook%20of%20cannabis%20-%20pertwee/ch%2001.pdf - Major Phytocannabinoids and Their Related Compounds
Обзор взаимодействия фитоканнабиноидов с рецепторами TRP, PPAR и другими мишенями, что актуально для изучения DCBF.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8625816/ - Structure-Activity Relationship of Cannabis Derived Compounds
Исследование SAR-анализа каннабиноидов, помогающее понять потенциальные взаимодействия DCBF с биомишенями.
https://doi.org/10.3390/molecules23071526 - Pitfalls in the Analysis of Phytocannabinoids in Cannabis Inflorescence
Статья о аналитических методах исследования каннабиноидов, которая может быть полезна для анализа DCBF.
https://diverdi.colostate.edu/C442/references/analysis/anal_bioanal_chem_20200418.pdf - Opioids, Cannabis, and Cyclic Vomiting Syndrome in Adults
Исследование взаимодействия каннабиноидов с TRPV1-рецепторами, что может быть релевантно для DCBF.
https://digital.lib.washington.edu/researchworks/bitstreams/fe5401a4-a4df-4b68-bf62-479227597d4b/download - Medical Cannabis: Toward a New Policy and Health Model
Анализ современных подходов к медицинскому использованию каннабиса и потенциала фитоканнабиноидов.
https://www.academia.edu/127566251/Medical_Cannabis_Toward_a_New_Policy_and_Health_Model_for_an_Ancient_Medicine - Are Phytocannabinoids from Cannabis sativa L. Promising Anticancer Agents?
Обзор противоопухолевого потенциала фитоканнабиноидов, который может быть применён к DCBF.
https://dx.doi.org/10.3390/molecules26092668