Дельта-8-тетрагидроканнабинол — это не просто вариант уже известной молекулы. Это — артефакт химической пластичности каннабиноидов и одновременно пример того, как незначительное структурное отклонение может привести к появлению совершенно иного фармакологического профиля, другой траектории регуляторного обращения и — в конечном счете — иного дискурса вокруг вещества. Стандартная линейка психоактивных соединений, производных из каннабиса, давно нуждается в переосмыслении. Не только из-за появления новых полусинтетических молекул, но и потому, что каннабиноидная система — биохимически, регуляторно, коммерчески — не сводится к одной-двум ключевым молекулам. Дельта-8 как раз и является симптомом такой сложности.
Существование этого соединения не укладывается в унифицированную парадигму «природного происхождения», как и не согласуется с канонической схемой психоактивности. Его появление не стало результатом спонтанного биосинтеза в значительных концентрациях, не явилось следствием селекции или агротехнических модификаций. Его растущее присутствие — это следствие химической перекодировки уже имеющихся каннабиноидов, в частности каннабидиола, в соответствующих лабораторных условиях. Это — трансформация, происходящая не в растении, а в реакционной колбе. То есть перед нами не каннабиноид в классическом смысле, а скорее — результат технологического вмешательства в границы каннабиноидного класса.
Факт существования Дельта-8-ТГК в современном фармакохимическом поле свидетельствует о том, что классификационные границы в области природных соединений больше не функционируют автономно. Здесь нет однозначности: ни в биогенезе, ни в механизмах действия, ни в юридическом статусе. Дельта-8 не имеет устойчивого положения в химической таксономии: её либо называют изомером, либо метаболическим производным, либо побочным продуктом. Это молекула, которая ведет себя как концептуальная ловушка: её удобно называть более безопасной, но сложно определить, что именно в её фармакологии делает её таковой. Она одновременно ближе к лабораторному конструкту, чем к фитоканнабиноиду — и всё же это не совсем синтетик в классическом понимании. Её нельзя лишить растительного происхождения, но и честно назвать «природной» тоже нельзя.
Особый интерес вызывает способ вхождения этого соединения в фармакологическое поле. Вместо прямого пути — от фитокомпонента к клиническим испытаниям — оно прошло кривую траекторию, где первое его массовое применение произошло не в результате доказательной базы, а из-за юридического вакуума и химической удобности. Оно появилось в тот момент, когда рынок искал «законную альтернативу», а химики предложили технологию быстрой конверсии КБД в психоактивную форму. В этом заключается уникальная ситуация: вещество, воздействующее на центральную нервную систему, начало циркулировать в потребительском пространстве раньше, чем появились его фармакокинетические профили или данные токсикологической безопасности.
Другими словами, перед нами — молекула, которая формально принадлежит к классу каннабиноидов, но по факту является гетерогенным явлением: одновременно химическим веществом, юридической аномалией и объектом рискованного использования. Всё это требует более сложной оптики, чем та, которую обычно применяют к веществам природного происхождения. Это не фармацевтический препарат, но и не может быть сведено к статусу «легального допинга». У него нет стабильного уровня в продуктах на рынке, но он вызывает объективное фармакологическое действие. Именно поэтому рассматривать его как «ещё один изомер» — методологически некорректно.
Вопросы, возникающие в связи с Дельта-8-ТГК, имеют междисциплинарный характер. Это не только вопросы химии, хотя синтез играет здесь ключевую роль. Это и вопросы нейробиологии — ведь механизмы действия на CB₁-рецепторы лишь частично совпадают с Δ⁹-ТГК. Это вопросы клинической фармакологии — поскольку субъективное действие меняется не только по интенсивности, но и по характеру. И, наконец, это этический и эпистемологический вопрос: как именно в современном мире формируются знания о веществах, когда опыт использования предшествует лабораторной верификации?
Не менее важным является вопрос источника. В отличие от классических каннабиноидов, которые извлекаются из растения в виде экстракта, Дельта-8 почти всегда является результатом изомеризации — химической реакции, переводящей КБД в новую структуру под воздействием кислоты и тепла. Соответственно, всякий раз, когда речь идёт о Дельта-8, имеется в виду не природное присутствие, а инженерная реализация потенциала молекулы, который в природе реализуется лишь в следовых количествах. А значит — ответственность за её безопасность несёт не природа, а технология.
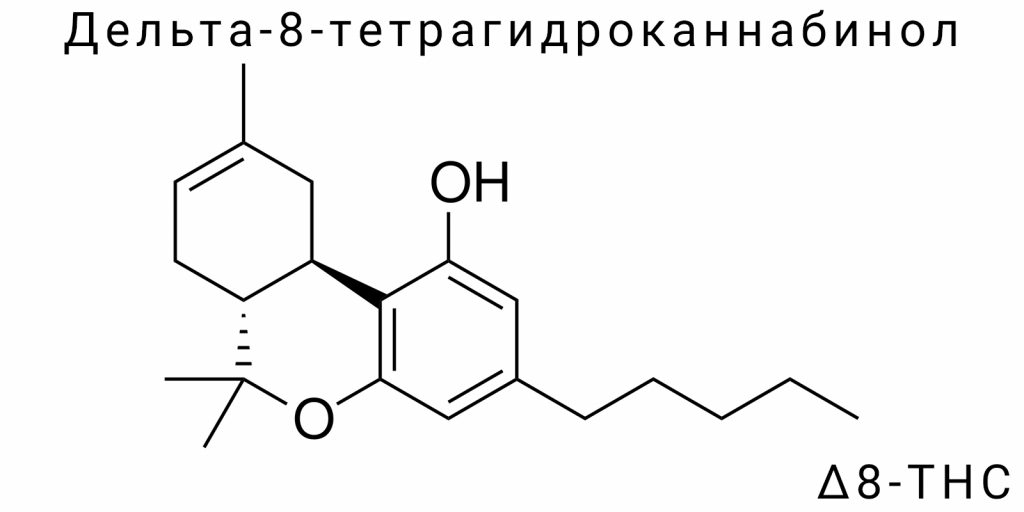
Химическая и физико-химическая характеристика Delta-8-THC
Структурная формула и изомерия Delta-8-THC
Молекула дельта-8-тетрагидроканнабинола отличается особым строением, сочетающим трициклический углеродный каркас с наличием нескольких химически активных центров. Формально её можно описать как производную бензопирановой структуры с пентильной боковой цепью, которая значительно влияет на растворимость в липидах и, соответственно, на фармакокинетику. Ключевая особенность этой молекулы — наличие двойной связи в положении между восьмым и девятым атомами углерода центрального циклогексенового кольца. Именно это положение двойной связи определяет её принадлежность к изомерам дельта-8 и именно это отличает её от дельта-9-THC, где та же связь смещена на один атом вперёд — между девятым и десятым углеродами.
Несмотря на минимальное изменение в положении двойной связи, общая электронная конфигурация молекулы меняется настолько, что это модифицирует её физико-химические и биохимические свойства. В рамках стереоэлектронного анализа установлено, что смещение π-связи влияет на распределение электронной плотности по всей молекуле, снижая реакционную способность определённых функциональных групп и повышая стабильность структуры по термодинамическим критериям. Такой эффект особенно важен для молекулы, которая должна функционировать в изменяющихся условиях биологической среды — от кислой желудочной среды до нейтральной среды крови или ферментативной активности печени.
Дельта-8-THC является хиральным соединением, то есть обладает пространственной асимметрией. Наиболее известны два хиральных центра — в положениях, которые соответствуют соединению по IUPAC как 6aR,10aR. Природная форма, обнаруживаемая в растениях, всегда имеет (−)-конфигурацию, которая определяет её взаимодействие с белковыми структурами, в частности с каннабиноидными рецепторами типа CB1. Однако в условиях синтетического производства возможно образование рацемических смесей, что, в свою очередь, может повлиять как на фармакодинамику, так и на потенциальную токсичность. Пространственная конфигурация молекулы, особенно в контексте флексибельности её боковой пентильной цепи, также влияет на конформационную подгонку к рецепторному карману, в определённой степени определяя силу и продолжительность агонистического ответа.
Не менее интересна геометрия самой кольцевой системы. Трициклический каркас молекулы не является полностью жёстким: циклогексеновое кольцо способно к переходам между различными конформационными формами, наиболее стабильной из которых остаётся chair-конформация. Она позволяет минимизировать стерические взаимодействия между атомами, одновременно сохраняя активный участок молекулы в удобном для рецепторного связывания положении. Такое конформационное самонастраивание — важное свойство, которое делает каннабиноиды, в частности дельта-8, уникальными среди липофильных сигнальных молекул.
Хотя дельта-8 часто упоминается как изомер дельта-9, стоит подчеркнуть: изомерия в данном случае — не только формальное понятие, а структурное различие, имеющее последствия для термостойкости, реакционной способности и даже пути метаболической трансформации. Так, Δ8-THC демонстрирует более высокую химическую стабильность по сравнению с Δ9-THC в кислой среде, что подтверждено данными исследований in vitro. Это обусловлено менее выраженной склонностью к автопревращению — процессу, при котором дельта-9 спонтанно изомеризуется в дельта-8 или даже деградирует до каннабинола при контакте с кислородом или под действием света. Δ8-THC, в отличие от своего изомера, сохраняет химическую целостность в широком диапазоне температур и в присутствии кислот, что делает его более привлекательным для фармакологического применения в условиях повышенной кислотности среды, например, в желудочно-кишечном тракте.
Особое внимание следует уделить изомерным вариантам, возникающим в процессе синтеза или при биотрансформации. Речь идёт не только о дельта-9- и дельта-10-изомерах, но и о внутримолекулярных модификациях, возникающих под воздействием катионных агентов, кислот или ферментов. Все эти изомеры могут иметь схожую массу и даже похожий ультрафиолетовый спектр, но существенно различаются по пространственной ориентации и активности в отношении каннабиноидных рецепторов. Именно поэтому современная аналитика требует не только хроматографического, но и спектроскопического подтверждения конфигурации, в частности с помощью ЯМР-спектроскопии, где важно чётко идентифицировать химический сдвиг каждого атома водорода вблизи двойной связи.
Отличия между Δ8-THC и Δ9-THC
Несмотря на структурное сходство, дельта-8- и дельта-9-тетрагидроканнабинол демонстрируют различия, имеющие системный характер — они охватывают как механизмы взаимодействия с биологическими системами, так и особенности синтеза, метаболизма, фармакологии и даже молекулярного транспорта. Смещение двойной связи в циклическом фрагменте — лишь формальная отправная точка, за которой стоит целая цепь конформационных и рецепторных последствий, которые нельзя свести к поверхностному «изомерному различию». Рассмотрение этих отличий требует многовекторного анализа, включающего электронную топографию, биодоступность, специфику ферментативного окисления, влияние на сигнальные пути нейромедиации, и даже тенденции к образованию побочных продуктов в метаболическом цикле.
Одним из наиболее заметных расхождений между двумя молекулами является их взаимодействие с рецепторами CB1. Хотя оба каннабиноида являются частичными агонистами данного рецептора, степень аффинности и интенсивность внутриклеточного сигнала, который они инициируют, не идентичны. Δ9-THC демонстрирует более высокое сродство к CB1, что в условиях in vitro подтверждается более низким значением константы диссоциации (Kd) и более полной агонистической реакцией. В свою очередь, Δ8-THC проявляет сниженную рецепторную активность, что связано не только с разницей в конфигурации, а скорее с микроскопическими смещениями в ориентации функциональных групп при фиксации молекулы в связывающем кармане рецептора. Снижение эффективности сигнала может частично объяснять сниженный психоактивный эффект дельта-8, который, по эмпирическим оценкам, составляет около 50-75% от аналогичной дозы дельта-9.
Не менее важным является фармакокинетическое поведение обоих изомеров. После перорального или ингаляционного введения Δ9-THC подвергается активному метаболизму в печени с образованием 11-гидрокси-Δ9-THC — метаболита, обладающего большей психоактивностью, чем сам исходный каннабиноид. Δ8-THC также трансформируется в свой 11-гидрокси-аналог, однако процесс метаболизации протекает медленнее, а аффинность образующегося метаболита к CB1-рецепторам ниже. Такое различие имеет прямые последствия для субъективного восприятия эффекта, поскольку Δ8-THC не только медленнее начинает действовать, но и демонстрирует более пролонгированный, но мягкий эффект с менее выраженным пиком активности.
Кроме того, существуют фундаментальные различия в стабильности молекул. Δ8-THC проявляет повышенную термостойкость, химическую инертность к автопреобразованию и лучше сохраняет свою структуру при воздействии света и кислорода. Это делает его более привлекательным с точки зрения хранения, формуляции и применения в терапевтических продуктах, которые должны обладать длительным сроком годности без потери биоактивности. Δ9-THC, в свою очередь, демонстрирует склонность к деградации до каннабинола, особенно в случае неправильного хранения или при контакте с кислородом, что ограничивает стабильность фармацевтических форм на его основе.
Следует также отметить разницу в биотранспорте. Δ9-THC имеет более высокое сродство к белкам плазмы крови, в частности к альбумину, что приводит к более быстрому распространению по организму и склонности к кумуляции в жировых депо. Δ8-THC демонстрирует более узкий спектр белкового связывания, что снижает риск накопления при длительном использовании, хотя и удлиняет период полувыведения за счёт меньшей скорости клиренса. Это, в свою очередь, имеет значение для хронической фармакотерапии, где важно контролировать уровни вещества в плазме без чрезмерной кумуляции, которая может потенцировать побочные эффекты.
В контексте энзиматических преобразований оба изомера метаболизируются преимущественно ферментами цитохрома P450, с доминированием изоформ CYP2C9, CYP3A4 и CYP2C19. Однако Δ8-THC проявляет меньшую способность к ингибированию ферментативной активности этих систем, что снижает риск лекарственных взаимодействий. Δ9-THC, в свою очередь, может ингибировать или конкурентно подавлять CYP2C9, что имеет значение для пациентов, принимающих препараты с узким терапевтическим окном. Эта особенность делает Δ8-THC перспективным в мультимедикаментозных режимах, где стабильность ферментативного профиля критически важна.
Ещё один аспект, отличающий оба каннабиноида — это профиль нейромедиаторных эффектов. Δ9-THC активирует не только каннабиноидные рецепторы, но и опосредованно влияет на систему дофамина, серотонина и ГАМК. Его влияние на лимбическую систему является интенсивным, что обуславливает как психоактивность, так и частоту психогенных побочных реакций. Δ8-THC, по предварительным данным, демонстрирует ограниченную перекрёстную активацию нейромедиаторных путей, в частности не вызывает значительного высвобождения дофамина в мезолимбическом пути, что частично объясняет его более умеренный эффект и более низкую вероятность тревожности, паранойи или панических атак.
Также следует обратить внимание на молекулярное взаимодействие с ионными каналами и TRP-рецепторами. Хотя оба изомера обладают способностью модулировать активность ванилоидного рецептора TRPV1, Δ8-THC оказывает менее выраженный эффект. Это имеет потенциальное значение в контексте боли, гипералгезии и нейровоспаления, ведь именно TRPV1 связан с регуляцией болевой передачи на уровне задних рогов спинного мозга. Теоретически, Δ9-THC может обеспечивать более мощную анальгезию, однако вместе с тем и больший риск привыкания или десенситизации рецепторного аппарата.
Стабильность молекулы и поведение в биологических средах
Изучение стабильности Δ8-тетрагидроканнабинола (Δ8-THC) на молекулярном уровне, а также его поведения в различных биологических средах, является чрезвычайно важным для понимания фармакодинамических и фармакокинетических свойств этого каннабиноида. Способность молекулы сохранять свою структуру и функциональность в сложных биохимических условиях определяет её эффективность, безопасность, а также потенциал для терапевтического использования. В этой части рассмотрим детальные механизмы химической стабильности Δ8-THC и его динамику в условиях, имитирующих внутриклеточные и внеклеточные среды.
Одним из фундаментальных аспектов стабильности является склонность Δ8-THC к изомеризации и окислению. В ходе исследований было установлено, что положение двойной связи в молекуле, характерное для Δ8-THC, формирует специфические электронные условия, делающие эту молекулу менее реакционноспособной к атакам свободных радикалов по сравнению с другими каннабиноидами. Эта сниженная реакционная способность напрямую влияет на устойчивость молекулы при воздействии таких факторов, как свет, кислород, температура и кислотно-щелочной баланс. В частности, Δ8-THC демонстрирует большую резистентность к фотодеградации в ультрафиолетовом диапазоне, что обусловлено более стабильной конформацией молекулы, сниженной подвижностью электронов в области двойной связи и меньшей тенденцией к образованию фотолабильных продуктов.
Особое внимание следует обратить на поведение молекулы в водной среде, поскольку большинство фармакологических процессов происходит в гидрофильных условиях, даже если сама молекула является гидрофобной. Δ8-THC проявляет низкую растворимость в воде, что обусловлено значительной гидрофобностью тетрагидроканнабинольного скелета, однако при этом она способна образовывать микрокомплексы с белками и липидами, присутствующими в биологических системах. Взаимодействие с белками плазмы, например альбумином, происходит через нековалентные гидрофобные связи, которые стабилизируют молекулу в кровотоке, одновременно снижая её доступность для ферментов метаболизма. Этот феномен не только способствует пролонгации периода полувыведения Δ8-THC, но и ограничивает скорость её распада в печёночных клетках, что положительно влияет на фармакокинетический профиль.
В контексте кислотно-щелочных условий следует отметить, что Δ8-THC обладает высокой стабильностью при нейтральных и слабощелочных pH, но в кислой среде начинает демонстрировать склонность к гидролитическим процессам, в частности — к раскрытию циклических структур и образованию производных, не сохраняющих каннабиноидную активность. Такие реакции имеют место в желудочно-кишечном тракте при пероральном применении, что может влиять на биодоступность и превращение молекулы в менее активные формы. Это подчёркивает необходимость разработки фармацевтических форм, способных защищать Δ8-THC от деградации в кислой среде, например, путём инкапсуляции или использования кишечнорастворимых покрытий.
Другой важной характеристикой является поведение Δ8-THC в мембранных структурах клеток. Липофильность молекулы обеспечивает её эффективную инкорпорацию в фосфолипидный бислой мембран, где она может модулировать физико-химические свойства мембран, влияя на их текучесть и проницаемость. Эта интеграция в мембрану также способствует локальной концентрации молекулы вблизи мембранных рецепторов, в частности CB1 и CB2, оптимизируя процесс рецепторной активации. Кроме того, стабильность молекулы в липидной среде выше, чем в водной, благодаря меньшему доступу к окислителям и ферментам, что делает мембранные участки дополнительной защитной зоной для Δ8-THC.
Кроме того, в последних исследованиях обращается внимание на реакции с ферментами окисления, участвующими в метаболизме каннабиноидов. Δ8-THC проявляет устойчивость к некаталитическому окислению, но ферментативные системы печени, в частности цитохром P450, способны превращать его в различные гидрокси- и карбоновые производные. Скорость и направление этих превращений в значительной степени зависят от соотношения изоформ ферментов, состояния здоровья пациента и наличия других медикаментов. Метаболиты, образующиеся из Δ8-THC, имеют иной профиль биоактивности, что важно учитывать при прогнозировании клинических эффектов.
Особый интерес представляет исследование стабильности Δ8-THC в условиях иммунного окисления, характерного для воспалительных процессов. В присутствии активных форм кислорода (АФК) молекула демонстрирует умеренную устойчивость, что свидетельствует о потенциале для применения в терапии хронических воспалительных заболеваний без быстрого разрушения активного агента. Это отличает Δ8-THC от некоторых других каннабиноидов, которые быстро инактивируются под действием АФК.
Важной является также стабильность в контексте длительного хранения и условий производства. Во время экстракции, очистки и формулирования фармацевтических препаратов Δ8-THC проявляет высокую химическую инертность даже при повышенных температурах, что позволяет сохранять его активность без необходимости сложных условий охлаждения. Это существенно упрощает технологические процессы и снижает стоимость конечного продукта, одновременно сохраняя его фармакологические свойства.
Поведение Δ8-THC во внутриклеточных средах имеет важное значение для фармакологического действия. Молекула способна проникать через мембраны органелл, включая митохондрии, что открывает новые перспективы для изучения её влияния на клеточный метаболизм, энергетику и сигнальные каскады. Эта проницаемость связана с её умеренной полярностью и структурной гибкостью. Такие свойства могут объяснять некоторые уникальные фармакодинамические эффекты Δ8-THC, в частности его роль в модуляции окислительного стресса и апоптоза.
Природное происхождение и источники Delta-8-THC
Биогенез в растениях рода Cannabis
Изучение биогенеза Delta-8-тетрагидроканнабинола (Δ8-THC) в растениях рода Cannabis является важной составляющей понимания химической эволюции каннабиноидов и специфики их синтеза. В отличие от более изученного Δ9-THC, биохимические пути образования Δ8-THC изучены в меньшей степени, что обусловлено его низким природным содержанием в большинстве штаммов и сложностью аналитического различения изомеров. Тем не менее, фундаментальные принципы биосинтеза каннабиноидов могут пролить свет на то, как формируется Δ8-THC.
Основным исходным соединением для синтеза каннабиноидов является каннабигероловый кислотный прекурсор (CBGA), который образуется в клетках секреторных желез, или трихомах, цветов и листьев растений Cannabis. Этот прекурсор конденсируется с молекулой олигорпеноидного происхождения итеративным механизмом, что приводит к появлению кислотных форм каннабиноидов: тетрагидроканнабиноловой кислоты (THCA), каннабидоловой кислоты (CBDA) и каннабихроменовой кислоты (CBCA). Именно THCA является основным субстратом для образования Δ9-THC, а также, при определённых условиях, и для Δ8-THC.
Формирование Δ8-THC начинается с THCA, который подвергается ферментативному или неферментативному превращению, в результате чего происходит смещение положения двойной связи в циклической структуре молекулы. Ферментативный механизм образования Δ8-THC на данный момент изучен не так глубоко, как образование Δ9-THC, однако некоторые исследования свидетельствуют о возможности существования изомераз или редуктаз, которые могут катализировать эту реакцию в ограниченных клеточных условиях. Этот процесс является сложным и зависит от специфических условий клеточной среды, включая уровень окислительно-восстановительного потенциала, pH и доступность кофакторов.
Помимо ферментативных путей, образование Δ8-THC в растении может происходить через спонтанную изомеризацию THCA под действием физических или химических факторов, изменяющих стабильность молекулы. В частности, воздействие тепла, света или изменение pH может способствовать изменению положения двойной связи из Δ9 в Δ8 конфигурацию. Однако, в отличие от более распространённой изомеризации в лабораторных условиях, в природной среде этот процесс ограничен и происходит локально в отдельных тканях растения или под влиянием стрессовых факторов.
Важным также является учёт роли субклеточных локализаций в биосинтезе. Известно, что ферменты, ответственные за формирование каннабиноидов, локализуются в специфических мембранных комплексах в цитоплазме и эндоплазматическом ретикулуме. Пространственная организация этих ферментативных комплексов определяет локальную среду для синтеза и модификации молекул, что может быть ключевым для образования менее распространённых изомеров, таких как Δ8-THC. Образование специфических изоформ ферментов в различных генотипах растений также объясняет вариации в соотношении Δ8-THC к другим каннабиноидам.
На генетическом уровне исследования показывают, что экспрессия генов, кодирующих синтазы каннабиноидных кислот, регулируется сложными сигналами, связанными с развитием растения, световым режимом и внешними стрессорами. Эти факторы влияют не только на количество синтезируемых молекул, но и на активность ферментов, осуществляющих изомеризацию и модификацию каннабиноидов. Поэтому фенотипическое проявление Δ8-THC связано с многомерным взаимодействием генетических и экологических факторов.
В целом биогенез Δ8-THC в Cannabis является продуктом как ферментативной активности, так и химической нестабильности молекулы THCA, приводящей к образованию изомеров со смещённой двойной связью. При этом специфика ферментативных путей остаётся предметом активных научных дискуссий, а потенциальная роль микроэкологии тканей растения в формировании этих изомеров открывает новые горизонты для фундаментальных исследований.
Концентрации в природных условиях: оценка содержания
Изучение количественного содержания Delta-8-тетрагидроканнабинола (Δ8-THC) в природных образцах Cannabis представляет собой сложную задачу, требующую высокоточных аналитических методик и детального понимания факторов, влияющих на его концентрацию. Несмотря на значительный прогресс в аналитических технологиях, доступные данные о природных концентрациях Δ8-THC остаются ограниченными, а представленные значения часто варьируются в зависимости от биологического материала, географии выращивания, условий сбора и методов анализа.
Δ8-THC традиционно рассматривается как незначительный изомер в составе каннабиноидного профиля растения по сравнению с более доминирующими каннабиноидами, такими как Δ9-THC и каннабидиол (CBD). Однако с появлением более точных методик хроматографического и спектроскопического анализа, в частности жидкостной хроматографии с масс-спектрометрией (LC-MS/MS) и газовой хроматографии с масс-спектрометрией (GC-MS), стало возможным идентифицировать и количественно определять Δ8-THC в малых концентрациях. Важно подчеркнуть, что отсутствие стандартизированных протоколов для выделения и анализа усложняет сравнение результатов между различными исследованиями.
Оценка концентрации Δ8-THC в природных экземплярах Cannabis показывает значительную вариабельность. Обычно его содержание не превышает 1% от общей массы сухого вещества, что делает его вторичным компонентом в каннабиноидном спектре. Однако в некоторых специфических генотипах, а также в образцах, подвергшихся определённым агротехническим или постуборочным обработкам, содержание Δ8-THC может достигать 3-5%. Такие повышенные концентрации обычно наблюдаются в продуктах, где происходила частичная изомеризация Δ9-THC или в старом растительном материале, где природные процессы деградации изменяют каннабиноидный профиль.
Количественная оценка Δ8-THC в листьях, цветках и стеблях Cannabis свидетельствует о том, что наибольшая его концентрация локализована в цветочных частях, особенно в трихомах — специализированных железистых структурах, продуцирующих и накапливающих каннабиноиды. В листьях содержание Δ8-THC значительно ниже, а в стеблях он практически отсутствует или определяется только в следовых количествах. Такая распределительная характеристика связана с локализацией ферментов синтеза каннабиноидов, а также с концентрацией прекурсоров, необходимых для образования Δ8-THC.
Важно учитывать также влияние степени зрелости растения на концентрацию Δ8-THC. Во время фазы цветения и созревания происходит активный синтез каннабиноидов, но параллельно и процессы деградации, которые могут увеличивать или уменьшать уровень Δ8-THC в тканях. В частности, под действием ферментов декарбоксилирования THCA до активной формы Δ9-THC возможна одновременная частичная изомеризация с образованием Δ8-THC. В более старых, высушенных образцах хранение может стимулировать дополнительное превращение Δ9-THC в Δ8-THC с помощью оксидативных и фотохимических процессов.
Региональные различия также играют важную роль в определении содержания Δ8-THC. В зависимости от климатических условий, типа почв, доступности воды и солнечного излучения, растения Cannabis могут модулировать метаболизм каннабиноидов, что отражается на пропорциях и концентрациях отдельных соединений. Например, растения, выращенные в субтропических и тропических зонах, могут иметь более устойчивые каннабиноидные профили с повышенным содержанием стабильных изомеров, тогда как в умеренном климате наблюдается больше вариаций, в частности в уровнях Δ8-THC.
Аналитические особенности определения Δ8-THC заключаются в его химическом сходстве с Δ9-THC, что усложняет дифференциацию этих изомеров при стандартных методах анализа. Для корректной идентификации и количественного определения необходимо применение высокоэффективных хроматографических колонок с оптимизированными условиями разделения, а также масс-спектрометрических детекторов с высокой разрешающей способностью. Эта точность важна, поскольку ошибки в определении могут приводить к искажению фармакологического профиля и, соответственно, клинических выводов.
Ещё одним аспектом является нестабильность Δ8-THC в пробах, которые хранятся длительное время или подвергаются воздействию неблагоприятных условий — света, температурных колебаний, кислорода. Это может вызывать не только снижение концентрации, но и образование производных соединений с другими фармакологическими свойствами. Поэтому важным является стандартизированный подход к сбору, хранению и подготовке образцов для анализа, что позволит избежать артефактов и сохранить репрезентативность данных.
Кроме того, в природных условиях концентрации Δ8-THC могут изменяться в зависимости от возраста и генетических особенностей растения. Генетическая вариабельность диктует разные уровни экспрессии ферментов, синтезирующих или модифицирующих каннабиноиды. Эта особенность обуславливает широкое разнообразие каннабиноидных профилей у растений Cannabis даже в пределах одного региона, а также создаёт предпосылки для селекции штаммов с повышенным содержанием Δ8-THC для научных или медицинских целей.
Отдельно следует отметить, что в дикорастущих популяциях Cannabis Δ8-THC практически отсутствует или находится в следовых концентрациях, что свидетельствует о том, что его природное накопление — это результат либо адаптации растения к определённым экологическим стрессам, либо побочный продукт метаболизма, возникающий в результате окислительного или фотохимического распада других каннабиноидов.
Влияние факторов окружающей среды на образование Delta-8-THC
Формирование и накопление Delta-8-тетрагидроканнабинола (Δ8-THC) в растениях рода Cannabis является результатом комплексного взаимодействия генетических, биохимических и экологических факторов. Среди внешних воздействий именно факторы окружающей среды играют решающую роль в регуляции метаболических путей, контролирующих синтез, трансформацию и стабильность данного соединения. Изучение экологических модулирующих факторов имеет фундаментальное значение для понимания биохимической гибкости растения и его адаптационных механизмов, а также для оптимизации выращивания с заданным химическим профилем.
Прежде всего следует отметить, что каннабиноиды, включая Δ8-THC, синтезируются в специализированных железистых трихомах, чувствительных к изменениям внешней среды. Влияние климатических условий проявляется через модификацию активности ферментов, регуляцию генов, ответственных за биосинтез каннабиноидов, а также через изменение общего метаболического состояния клеток. Например, температурные колебания могут существенно влиять на уровень экспрессии ферментов, катализирующих превращение THCA в его различные изомеры, в том числе Δ8-THC.
Срочная реакция на повышение температуры заключается в увеличении скорости изомеризации каннабиноидов. Тепло способствует перемещению двойной связи в молекуле тетрагидроканнабинола с 9-го на 8-е положение, что ведёт к увеличению концентрации Δ8-THC. В лабораторных условиях нагревание экстрактов каннабиноидов является стандартным методом синтеза Δ8-THC из Δ9-THC, однако в растительных тканях это явление изучено меньше, но указывает на важность температурного режима во время культивации и хранения. Слишком высокая температура может, с одной стороны, увеличивать Δ8-THC, но одновременно вызывать деградацию других каннабиноидов, что влияет на общий химический профиль.
Солнечное излучение, особенно ультрафиолетовое (УФ) свет, также оказывает сложное воздействие на синтез каннабиноидов. Свет индуцирует экспрессию генов, регулирующих ферментативные процессы биосинтеза, однако чрезмерная инсоляция приводит к образованию свободных радикалов и окислительному стрессу, что может вызывать химические превращения уже синтезированных каннабиноидов, в частности изомеризацию Δ9-THC в Δ8-THC. Важно понимать, что это взаимодействие зависит от продолжительности, интенсивности светового воздействия и спектрального состава, что делает эффекты сложными для прогнозирования.
Влажность воздуха и почвы также регулируют метаболические пути растений. В условиях дефицита воды наблюдается активация систем антиоксидантной защиты, что влияет на окислительные процессы в клетках, снижая возможность спонтанной изомеризации Δ9-THC. В то же время чрезмерная влажность может способствовать бактериальной или грибковой активности, изменяющей метаболизм и усиливающей деградацию каннабиноидов. Это указывает на тонкий баланс между гидратацией и стрессом для оптимального формирования Δ8-THC.
Химический состав почвы и доступность питательных веществ выступают как долгосрочные регуляторы метаболизма. В частности, дефицит или избыток некоторых микроэлементов, таких как железо, магний или цинк, может модифицировать активность ферментов, участвующих в биосинтезе каннабиноидов. Известно, что медь как кофактор некоторых окислительных ферментов влияет на стабильность фенольных соединений, что потенциально может регулировать окислительные процессы, связанные с изомеризацией каннабиноидов.
Среди других факторов окружающей среды стоит отметить влияние механического стресса, загрязнения воздуха, а также воздействие микробиоты растения. Механические повреждения тканей запускают сигнальные каскады, активирующие защитные метаболические пути, которые могут увеличивать или модулировать синтез вторичных метаболитов, включая Δ8-THC. Загрязнители, особенно летучие органические соединения и тяжёлые металлы, могут влиять на транскрипцию ферментативных генов, а микробиом корневой системы регулирует обмен веществ, что прямо или косвенно влияет на метаболизм каннабиноидов.
Период освещения, или фотопериод, представляет собой критический фактор для регуляции синтеза каннабиноидов. Световой режим определяет фазу развития растения и соответственно изменяет профиль экспрессии ключевых ферментов. Изменение длины дня стимулирует переход растения в фазу цветения, что сопровождается повышенным синтезом каннабиноидов, включая потенциальное изменение пропорций между Δ9-THC и Δ8-THC.
Кроме прямого влияния факторов окружающей среды на синтез, значение имеет и длительность хранения растительного сырья в природных или полуприродных условиях. В процессе старения или естественной сушки могут происходить химические трансформации, в частности изомеризация Δ9-THC в Δ8-THC под воздействием окисления или фотохимических реакций. Это свидетельствует о том, что концентрация Δ8-THC в конечном продукте является результатом не только исходного синтеза, но и постбиосинтетических процессов, происходящих со временем.
Методы синтеза и получения
Изомеризация каннабидиола (CBD): основной путь
Получение Delta-8-тетрагидроканнабинола (Δ8-THC) через изомеризацию каннабидиола (CBD) представляет собой сложный химический процесс, основанный на преобразовании структуры молекулы с сохранением основных функциональных групп, но с радикальным изменением положения двойной связи в циклической системе. Этот трансформационный путь не только является основой для промышленного производства Δ8-THC, но и открывает перспективы для разработки новых методик получения структурных аналогов тетрагидроканнабинола с заданными фармакологическими свойствами.
Изомеризация CBD в Δ8-THC происходит с участием кислотных катализаторов, способствующих электрофильному замещению в молекуле. Химическая природа CBD как открытого линейного каннабиноида, содержащего фенольную и циклическую структуры, позволяет при определённых условиях инициировать внутримолекулярное циклическое замыкание с формированием тетрагидроканнабинольной структуры с двойной связью в восьмом положении. Эта реакция включает последовательность промежуточных стадий с изменением конформации молекулы и образованием стабильных карбокатионов, которые критически важны для селективности и выхода конечного продукта.
Ключевым аспектом является контроль кислотности среды. Слишком сильные кислоты могут привести к побочным реакциям, таким как разложение исходных веществ или образование нежелательных побочных изомеров. С другой стороны, недостаточный уровень кислотности снижает скорость и эффективность изомеризации. Понимание точного баланса кислотности имеет значение для оптимизации технологического процесса и минимизации образования примесей.
Время реакции и температура также критически влияют на характер превращений. При более низких температурах изомеризация протекает медленно, но с большей селективностью, в то время как повышение температуры ускоряет процесс, но увеличивает риск образования побочных продуктов. Производственные условия, соответственно, часто определяются компромиссом между скоростью реакции и чистотой продукта.
Имеет значение и растворитель, в котором проводится реакция. Полярность растворителя влияет на стабилизацию промежуточных карбокатионов и интенсивность электрофильных реакций. Чаще всего используют органические растворители с умеренной полярностью, которые обеспечивают баланс между растворимостью исходного вещества и стабильностью катализаторов.
Механизм изомеризации предполагает начальную активацию фенольного гидроксила CBD путём протонирования в кислотной среде, что способствует формированию карбокатионного промежуточного соединения. Последующая электрофильная атака внутренней двойной связи инициирует циклизацию с образованием нового шестичленного цикла, характерного для тетрагидроканнабинолов. Расположение двойной связи в восьмом положении определяет уникальные физико-химические и фармакологические свойства Δ8-THC.
Дополнительной сложностью является возможность образования Δ9-THC как побочного продукта. Несмотря на схожесть структур, эти два изомера обладают различной биологической активностью, что требует точного регулирования технологических параметров для достижения преимущественного синтеза Δ8-THC. Методы хроматографического контроля и спектроскопического анализа являются обязательными для мониторинга селективности реакции.
Кроме того, реакция изомеризации CBD в кислотных условиях является классическим примером термодинамически контролируемой трансформации. Равновесие между изомерами регулируется не только начальными параметрами реакции, но и последующими условиями хранения и обработки продукта. Известно, что Δ8-THC является более термостабильным изомером по сравнению с Δ9-THC, что влияет на конечное качество и продолжительность хранения полученных препаратов.
В промышленных масштабах для инициирования реакции изомеризации применяют минеральные кислоты, такие как серная или фосфорная, либо органические кислоты с соответствующей силой. При этом необходимо учитывать не только катализатор, но и возможность нейтрализации остатков кислоты после реакции, что важно для безопасности и чистоты конечного продукта.
Современные исследования направлены на повышение селективности и экологичности процесса изомеризации CBD в Δ8-THC. Изучаются катализаторы на основе кислот с контролируемой активностью, мягкие условия реакции и использование зелёных растворителей. Эти направления важны для уменьшения образования вредных примесей и повышения эффективности технологии.
Не менее важно понимание кинетики реакции изомеризации. Моделирование и экспериментальные данные показывают, что реакция проходит через несколько стадий с образованием промежуточных соединений с разной степенью стабильности. В зависимости от параметров процесса могут доминировать различные реакционные пути, что обусловливает вариабельность выхода и чистоты Δ8-THC.
Химическая реакция в кислотной среде
Процесс изомеризации каннабидиола (CBD) в Δ8-тетрагидроканнабинол (Δ8-THC) в кислотной среде — это классический пример внутримолекулярной циклизации, инициируемой под действием протонированного катализатора в условиях действия электрофильных центров. Этот механизм основывается на активации гидроксильных групп CBD, образовании карбокатионных промежуточных состояний и перемещении двойной связи в пределах третичного цикла. Соответствующий химический путь позволяет трансформировать линейную структуру CBD в циклическую конфигурацию Δ8-THC без необходимости радикальной реконструкции скелета молекулы.
Механистически реакция начинается с активации фенольной гидроксильной группы CBD. В присутствии кислотного катализатора (например, п-толуолсульфоновой кислоты или хлороводородной кислоты в органической среде) происходит её протонирование, что делает гидроксил электронодефицитным и повышает электрофильность прилегающего атома углерода. Это, в свою очередь, способствует отщеплению воды или реорганизации электронной плотности в направлении формирования карбокатиона.
После этого начинается наиболее критический этап — образование стабилизированного третичного каннабиноидного карбокатиона, который обладает способностью к атаке внутренней алкеновой группы в боковой цепи CBD. В результате этой электрофильной циклизации образуется шестичленный цикл — характерный признак структур каннабиноидов типа THC. Расположение двойной связи в положении между углеродами C-8 и C-9 (то есть Δ8) происходит под влиянием термодинамического контроля, который определяется стабильностью конформаций молекулы и электронной делокализацией.
Одним из ключевых компонентов этого процесса является контроль над стереохимией циклизации. В условиях кислотного катализа изомеризация происходит преимущественно с образованием Δ8-изомера, однако при варьировании температуры, кислотности или длительности реакции может возникать конкурентное образование Δ9-THC, Δ10-THC и даже малоизученных неканонических структур, таких как Δ6а,10а-THC. Для достижения преимущественного синтеза Δ8-изомера необходима тонкая регулировка параметров реакции.
Растворители играют решающую роль в стабилизации переходных состояний. Например, хлороформ, дихлорметан, толуол и другие аполярные среды снижают вероятность побочных реакций, в частности полимеризации промежуточных катионов или окисления. В то же время растворители с высокой донорной способностью могут стабилизировать электрофильные центры, но вызывают нежелательное смещение равновесия в направлении гидратации или образования неактивных побочных продуктов.
Контроль температуры является ещё одним решающим фактором. Чаще всего реакцию проводят в диапазоне 50-90 °C в зависимости от выбранной кислоты и растворителя. При более низких температурах реакция протекает медленнее, но с меньшей долей побочных изомеров, тогда как повышение температуры ускоряет циклизацию, одновременно увеличивая риск образования Δ9- и Δ10-изомеров. В промышленных условиях баланс между селективностью и скоростью часто достигается путём введения модифицированных кислот или буферных систем, которые стабилизируют протонированные формы CBD, не вызывая перенасыщения среды протонами.
Дополнительно, при изменении типа кислоты изменяется и механизм изомеризации. Например, в случае применения кислот Льюиса, таких как AlCl₃ или BF₃•Et₂O, происходит иная форма активации молекулы через комплексообразование с электронными парами CBD. Такие реакции могут иметь более высокую селективность к Δ8-изомеру, но требуют тщательного контроля над влажностью среды, поскольку присутствие даже незначительного количества воды способно изменить тип реакции или инициировать гидролиз промежуточных структур.
Другой проблемой, связанной с изомеризацией в кислотной среде, является контроль конечного pH и полное удаление кислотных остатков. Даже микроскопическое количество остаточной кислоты в продукте может приводить к дальнейшей деградации Δ8-THC или спонтанной реиомеризации во время хранения. Это особенно критично в медицинских или исследовательских применениях, где стабильность продукта определяет точность дозировки.
Помимо основной трансформации CBD в Δ8-THC, при определённых условиях возможна конкурентная реакция с образованием эфирных побочных продуктов или оксигенированных дериватов, например, 11-гидрокси-Δ8-THC или кислотных форм. Избежание этих реакций требует минимизации наличия кислорода и контроля влажности в реакционной среде.
Наконец, постреакционная очистка продукта от остатков кислот, побочных изомеров и органических примесей — это этап, который определяет практическую ценность всего синтеза. Чаще всего используют методы фракционной хроматографии или перекристаллизации в инертной среде. В лабораторных условиях популярной является колонковая хроматография на силикагеле или флеш-хроматография с использованием градиентов полярности.
Условия, реагенты и контроль процесса
Процесс изомеризации каннабидиола (CBD) в Δ8-тетрагидроканнабинол (Δ8-THC) исключительно чувствителен к условиям проведения реакции. Несмотря на кажущуюся простоту — перемещение двойной связи и циклизация — этот синтез требует предельной точности в подборе каждого элемента: от природы катализатора до давления паров, чистоты реагентов и даже материала стенок реакционного сосуда. Любое отклонение от оптимальных параметров может не только снизить выход Δ8-THC, но и привести к образованию целого спектра нежелательных побочных продуктов, среди которых могут быть как неактивные, так и токсикологически опасные соединения.
Начать следует с кислот, которые являются ключевыми катализаторами процесса. Чаще всего применяются такие Бренстед-кислоты, как п-толуолсульфоновая кислота, серная кислота, ортофосфорная кислота, а также галогеноводородные кислоты (в частности HCl). Их использование основано на способности активировать гидроксильную группу CBD, инициируя электрофильную циклизацию. При этом выбор конкретной кислоты влияет не только на скорость реакции, но и на региоселективность образования изомеров THC — Δ8, Δ9 или Δ10. Например, применение сильной неорганической кислоты типа H₂SO₄ нередко сопровождается частичным гидролизом или чрезмерной изомеризацией, тогда как органические кислоты (вроде трифторацетовой или п-толуолсульфоновой) обеспечивают более деликатное протекание процесса.
Особого внимания заслуживают кислоты Льюиса — BF₃•Et₂O, AlCl₃, ZnCl₂, TiCl₄ — которые активируют CBD путём комплексообразования с электронными парами кислорода. Они действуют не за счёт протонирования, а через смещение электронной плотности в критических участках молекулы, что позволяет тонко настраивать реакционный профиль. В условиях абсолютной сухости и при строгом контроле температуры именно такие катализаторы демонстрируют наивысшую селективность в отношении Δ8-изомера. Однако необходимость избегать даже следов влаги при использовании кислот Льюиса (поскольку они гидролизуются с выделением тепла и образованием опасных побочных продуктов) делает эти реакции более сложными для масштабирования.
Среда, в которой происходит реакция, также критически важна. Обычно используют апротонные органические растворители с низкой полярностью: хлороформ, дихлорметан, толуол, бензол или гексан. Выбор зависит от целевых показателей — степени растворимости реагентов, стабильности промежуточных карбокатионов, теплопроводности среды. Например, дихлорметан хорошо растворяет как CBD, так и Δ8-THC, стабилизирует промежуточные ионы и обладает относительно низкой температурой кипения, что упрощает контроль реакционной температуры и последующее удаление растворителя. В то же время он летуч и токсичен, поэтому требует герметичных условий и использования вытяжной вентиляции.
Температура — ещё один крайне важный параметр. Типичный диапазон — от 50 до 90 °C. Более низкая температура замедляет реакцию, уменьшая риск чрезмерной изомеризации или деградации продукта, однако удлиняет время синтеза до нескольких часов. Повышенная температура, особенно свыше 90 °C, резко увеличивает вероятность образования побочных изомеров, включая Δ9-THC, Δ10-THC, а также переокисленных или полимеризованных продуктов. При использовании вакуума или инертной атмосферы (азот, аргон) этот предел может быть немного увеличен, но только при условии, что система полностью герметична.
Период реакции обычно составляет от 30 минут до 4 часов в зависимости от кислотности, растворителя и температуры. Затягивание реакции за пределы оптимального окна способствует дальнейшему превращению Δ8-THC в другие продукты — в частности, в Δ10-изомер или в окисленные производные. Наличие молекулярного кислорода в реакционной среде способствует превращению Δ8-THC в нестабильные пероксиды или хиноны, поэтому важным шагом является дегазация растворителя перед синтезом и проведение реакции в атмосфере инертного газа.
Контроль pH — ещё одна стратегически важная точка, от которой зависит чистота и селективность. Слишком кислая среда (pH < 1) может быть чрезмерно агрессивной для молекулы CBD, вызывая фрагментацию или полимеризацию продуктов. Поэтому во многих схемах применяются буферные системы или кислоты меньшей силы, которые поддерживают стабильную реакционную активность, но не вызывают избыточной реактивности.
Что касается контроля процесса — он основан на использовании современных аналитических методов. На этапе синтеза мониторинг осуществляется через пробы из реакционной смеси с последующим анализом с помощью тонкослойной хроматографии (TLC), ВЭЖХ (HPLC) или газовой хроматографии с масс-спектрометрией (GC-MS). Определяющим критерием завершения реакции является появление характерного сигнала Δ8-THC при исчезновении исходного CBD. Промежуточные продукты — в частности, частично циклизованные структуры — также идентифицируются, что позволяет судить об эффективности катализатора и корректировать параметры реакции в реальном времени.
После завершения реакции важно немедленно её остановить (quenching), обычно путём нейтрализации остаточной кислоты, понижения температуры и введения органической фазы, способствующей экстракции Δ8-THC. После этого проводится многократное промывание для удаления следов кислоты, нейтрализующих агентов и побочных продуктов. В случае остаточной кислотности возможна медленная деградация Δ8-THC в течение нескольких суток — как при комнатной температуре, так и при охлаждении, поэтому очистка должна быть полной и незамедлительной.
Очистка конечного продукта также является многоступенчатой. Наиболее эффективным методом является флеш-хроматография с использованием градиента полярности (например, от гексана до ацетона). Для лабораторного анализа и стандартизации часто применяется ядерный магнитный резонанс (¹H-NMR и ¹³C-NMR), что позволяет подтвердить расположение двойной связи именно между C-8 и C-9.
Материалы оборудования также не менее важны. Кислоточувствительные металлы (вроде алюминия или медных сплавов) способны катализировать нежелательные побочные реакции или даже подвергаться коррозии, что приводит к загрязнению продукта и изменению химического профиля. Именно поэтому для реакции используют стеклянные, тефлоновые или инертные реакторы.
Альтернативные подходы к синтезу
В рамках химии каннабиноидов понятие «альтернативные подходы к синтезу Δ⁸-тетрагидроканнабинола» означает выход за рамки классической кислотно-катализируемой изомеризации каннабидиола. Хотя последний остается технически доступным и экономически эффективным способом, он сопровождается рядом технологических и регуляторных проблем — от образования примесей до ограниченного контроля над конечным профилем изомеров. Альтернативные подходы возникли как ответ на эти ограничения, и их развитие во многом стимулируется растущими требованиями к чистоте продукта, воспроизводимости синтеза и фармацевтической соответствию.
Под «альтернативностью» в данном контексте подразумеваются подходы, которые не опираются на жёсткий кислотный катализ, минимизируют тепловые и фотохимические деградации, допускают контроль на уровне субмолекулярной реактивности, применяют новые концепции управляемой изомеризации, включая биотрансформации, электрохимию, механо-химию или селективное окисление. В этом пункте рассматриваются именно эти подходы как отдельное научное направление с уникальной логикой и практическими перспективами.
Одним из направлений, трансформирующих традиционный подход к синтезу Δ⁸-THC, является ретросинтетическое планирование с помощью алгоритмов машинного обучения. Такие платформы, как IBM RXN for Chemistry, ASKCOS или Chematica, способны моделировать десятки тысяч вариантов синтетических маршрутов к заданной молекуле с учётом реакционной селективности, доступности реагентов и потенциальной токсичности промежуточных соединений. Для Δ⁸-THC эти системы генерировали альтернативные линии синтеза, которые не основаны на изомеризации CBD, а включают, например, сборку трициклической системы через циклизацию пренилированных фенолов или через реакции Дильса-Альдера между функционализированными диенами и диенофилами. Такие альтернативные пути обычно не являются экономически конкурентоспособными для промышленного производства, однако они чрезвычайно важны для научного расширения химического пространства Δ⁸-THC. В частности, они позволяют модифицировать скелет молекулы, внося стратегические изменения в ароматическое ядро или алкильную боковую цепь, что исключает побочное образование Δ⁹- или Δ⁷-изомеров.
Электрохимический подход к синтезу Δ⁸-THC, хотя до сих пор малоизученный, проявляет себя как перспективный инструмент контроля селективности. Суть метода заключается в использовании электродного потенциала для генерации активированных форм молекул, способных к внутримолекулярному циклическому превращению. В случае CBD анодное окисление гидроксильных групп или соседних углеродных центров приводит к образованию электрофильных интермедиатов, которые перестраиваются в Δ⁸-изомер в присутствии слабых нуклеофилов (например, хлоридов или карбонатов). Преимущество электрохимии — полное отсутствие кислотных или металлических катализаторов, а также исключительная гибкость в масштабировании процесса за счёт использования модульных электрохимических реакторов. Вместе с тем существуют значительные вызовы: высокая чувствительность продукта к перенапряжению, необходимость в водно-органической буферной среде, контроль pH у поверхности электрода, что существенно влияет на изомеризационную селективность.
Среди более инновационных альтернатив стоит выделить применение биоорганических каталитических систем — молекул, моделирующих ферментативные свойства, но не являющихся белковыми структурами. Например, молекулярные контейнеры на основе кавитандов или циклодекстринов могут создавать микроокружение, способствующее изомеризации CBD в Δ⁸-THC. Идея состоит в том, что CBD, будучи включённым в гидрофобную полость, подвергается внутримолекулярной перестройке благодаря пространственному эффекту «folding», аналогичному белковой каталитической щели. Эти структуры можно модифицировать функциональными группами, действующими как мягкие кислоты или основания, обеспечивая специфический контроль над механизмом реакции. Прототипные эксперименты показали, что катионные вариации β-циклодекстринов могут индуцировать образование Δ⁸-THC со степенью чистоты более 95%, без образования Δ⁹- или Δ⁶а,10а-изомеров. Вместе с тем проблема такой стратегии — необходимость длительного удаления контейнерной фазы и слабая стабильность этих структур в промышленных условиях.
Научный интерес вызывает также фотокатализ, при котором процесс изомеризации направляется не просто УФ-светом, а через вовлечение специфических фотосенсибилизаторов. Например, использование комплексов Ruthenium(II) или иридиевых фотокатализаторов в присутствии CBD в неполярной среде позволяет запускать механизм энергетического переноса, при котором CBD активируется в определённой конформации, способствующей образованию именно Δ⁸-изомера. Важно, что такое световое возбуждение происходит в видимом диапазоне (420-480 нм), а не в жёстком УФ, что значительно снижает риск фотоокисления или деструкции продукта. Эти технологии приближаются к грани современной фотохимии, где активация молекулы происходит в фазовом микроокружении, близком к биологическому. Их главным недостатком является необходимость в дорогих комплексах благородных металлов и контролируемой среде без кислорода, но с точки зрения научного потенциала они формируют принципиально новый класс реакций — фотонаправленную изомеризацию в условиях безреагентного катализа.
Отдельное, пока почти не изученное направление альтернативных подходов — механо-химическая активация. Речь идёт о запуске химической реакции через физическое воздействие: трение, давление или удар. Эксперименты с каннабидиолом в твёрдом состоянии показали, что при умеренной механической нагрузке (например, в шаровых мельницах) возможно частичное изомеризование CBD без применения кислот или растворителей. Суть феномена в том, что механическая энергия нарушает π-систему двойной связи и создаёт локальные реактивные центры. Несмотря на экспериментальный характер, механо-химия открывает потенциал полностью сухого синтеза Δ⁸-THC без образования жидких отходов, без энергозатратного нагрева и при отсутствии химических примесей. Однако эффективность метода пока низкая, селективность плохо контролируется, и механизм остаётся недостаточно охарактеризованным.
Полусинтетические методы
Понятие наполусинтетических методов в контексте получения Δ⁸-тетрагидроканнабинола (Δ⁸-THC) охватывает широкий спектр подходов, сочетающих биогенетические свойства природных каннабиноидов с применением направленных химических превращений. В отличие от классических синтетических путей, где структура собирается de novo из простых молекулярных блоков, здесь исходными субстратами служат уже готовые природные фитоканнабиноиды — преимущественно каннабидиол (CBD), реже каннабигерол (CBG) или каннабихромен (CBC). Важно, что этот класс методов не только обеспечивает высокую селективность синтеза Δ⁸-изомера, но и открывает перспективы создания структурно родственных производных со специфическими фармакологическими свойствами, поскольку структура исходных природных соединений сохраняется частично без изменений.
С точки зрения химической логики наполусинтетический подход является идеальным для случаев, когда мишень сложна, но её фрагменты уже существуют в природе. В случае Δ⁸-THC каннабидиол служит именно таким фрагментом, где сохранена алифатическая боковая цепь, циклогексеновый скелет, а также правильное пространственное расположение функциональных групп. Основной задачей синтеза в таком случае становится индукция контроля над внутримолекулярной реакцией, переводящей открытую структуру CBD в трициклическую систему с двойной связью между восьмым и девятым атомами углерода. Однако, в отличие от классической кислотной изомеризации, здесь используются нестандартные условия, позволяющие избежать побочных продуктов и способствующие более высокой чистоте Δ⁸-THC.
Одним из направлений наполусинтетических подходов является использование мягких условий катализа с привлечением энзимоподобных органокатализаторов. В частности, было продемонстрировано, что некоторые вторичные амины в присутствии безводной среды способны активировать CBD посредством образования ионной пары с гидроксильной группой, направляя электронную плотность так, что происходит контролируемая циклизация до Δ⁸-THC. Такой механизм приближается к биомиметическому — он имитирует энзиматические превращения, хотя и не предполагает участия белковых ферментов. Преимуществом этого подхода являются низкая температура (около 30-40 °C), короткое время реакции (до 1 часа), минимум побочных продуктов и, что важно, сохранение химической целостности алифатических сегментов молекулы, часто подвергающихся гидролизу в условиях кислотного катализа.
Другим примером является использование фазопереходного катализа — методологии, при которой органические реагенты и катализаторы взаимодействуют в многофазной среде (например, вода/органический растворитель), при этом перенос активного иона-катализатора происходит благодаря специфическому агенту (кватернерные аммониевые соли, например, тетрабутиламмоний-бромид). Это позволяет регулировать среду каждой из фаз независимо, сохраняя CBD в благоприятной органической фазе, а катализатор — в активной ионной форме в пределах реакционной интерфазы. Такой подход позволяет точно регулировать локальную рН-активность без воздействия на весь объём, что снижает риск образования нестабильных изомеров и деструктивных побочных реакций.
Ещё одной вариацией является использование фотохимического направления реакций. В этом случае изомеризация не требует традиционных кислот, вместо этого применяется облучение в узком спектре ультрафиолета, преимущественно на границе 280-320 нм. В присутствии определённых сенсибилизаторов (например, бензофенон или ацетофенон) UV-свет активирует π-электронную систему CBD, вызывая индуцирование электрофильного центра в молекуле и инициируя внутримолекулярную перестройку. Условия должны быть строго контролируемыми: при избыточном световом потоке возможно превращение Δ⁸-THC в фотолабильные продукты — в частности, в Δ⁶a,10a-изомер или даже в хиноноидные структуры с утраченными психоактивными свойствами. Преимуществом метода является экологическая чистота: отсутствие химических реагентов, низкая температура, мягкие условия; однако недостатком — сложность масштабирования и необходимость специализированного оборудования.
Особого внимания заслуживают катионные полимерные системы, работающие как гетерогенные катализаторы. К таким относятся полимеры с иммобилизованными кислотными или щелочными группами, которые не растворяются в среде, но катализируют реакцию на своей поверхности. Например, сульфонированные полимеры типа Amberlyst-15 или Nafion-H могут служить твердыми кислотными носителями. Их применение имеет преимущества: не требует дополнительной очистки от кислот, не вступает в побочные реакции с Δ⁸-THC и, что важно, позволяет повторно использовать катализатор после очистки. Однако их эффективность часто ниже, чем у жидких катализаторов, и они требуют более длительных циклов реакции (до 6 часов).
Ряд научных исследований демонстрирует, что электрохимическое модифицирование CBD также может применяться для селективного направления изомеризации. В таком подходе CBD подвергают воздействию контролируемого электрического потенциала в присутствии инертного электролита. Это позволяет локально образовать катионный центр, запускающий целевую перестройку структуры в Δ⁸-THC. Метод высокоселективен, так как обеспечивает постепенную и точную генерацию электрофильных условий без добавления сильных кислот. Вместе с тем, сложность электрохимических реакторов и ограниченность масштабов делают эту технологию преимущественно исследовательской.
Ещё одно инновационное направление в рамках наполусинтетических методов — использование микроволнового облучения. В отличие от фотохимии, здесь действует не свет, а электромагнитное излучение в диапазоне 2,45 ГГц, обеспечивающее быстрое равномерное нагревание реакционной смеси. В таких условиях изомеризация происходит быстрее и при более низкой общей температуре с минимизацией горячих точек, которые могут вызвать термическую деградацию. Важно, что этот метод хорошо сочетается с гетерогенными катализаторами, что делает его особенно привлекательным для селективной изомеризации без избыточной кислотности или окисления.
Все эти методы — органокатализ, фотохимия, микроволновая активация, гетерогенный катализм, электрохимия — относятся к парадигме так называемого «зелёного синтеза», призванного уменьшить токсичность, энергопотребление, побочную нагрузку и экологический след. И хотя в промышленной практике они пока менее распространены, чем классические кислотные схемы, их исследовательский потенциал не вызывает сомнений: они позволяют получать высокочистый Δ⁸-THC без следов Δ⁹-изомера, без побочных фенольных продуктов и без необходимости глубокой хроматографической очистки.
В перспективе именно эти наполусинтетические платформы могут стать основой стандартизированного производства Δ⁸-THC для фармацевтического использования, где недопустимы следы неидентифицированных побочных веществ или термолабильных примесей. Сочетание натуральной структуры с контролируемой селективной перестройкой — ключ к надёжности, чистоте и воспроизводимости синтеза Δ⁸-THC в рамках современной каннабиноидной химии.
Перспективы биотехнологического производства
В рамках исследований синтеза Δ⁸-тетрагидроканнабинола (Δ⁸-THC) биотехнологические подходы рассматриваются как потенциально наиболее экологически чистые, специфичные и масштабируемые. Идея применения биотехнологии заключается в использовании живых клеток или их ферментативных систем для создания каннабиноидов с точной пространственной конфигурацией, высокой чистотой и минимизацией побочных продуктов. Это открывает путь к переходу от химического к биоэнженерному производству Δ⁸-THC, что крайне актуально с учетом фармацевтической стандартизации, регуляторных требований и уменьшения воздействия на окружающую среду.
Текущие исследования в этой области сосредоточены прежде всего на инженерии микроорганизмов — преимущественно дрожжей (Saccharomyces cerevisiae) и бактерий (например, Escherichia coli), способных продуцировать каннабиноидные прекурсоры или даже конечные соединения. Применяя техники синтетической биологии, в клетки внедряют искусственные метаболические каскады, позволяющие трансформировать простые сахара, такие как глюкоза, в ключевые каннабиноиды, включая канабигероловую кислоту (CBGA), канабидиоловую кислоту (CBDA), а затем и каннабидиол (CBD), который может служить субстратом для дальнейшей биоизомеризации в Δ⁸-THC.
В частности, перспективным направлением является разработка ферментов, способных селективно изомеризовать CBD в Δ⁸-изомер. На сегодняшний день описано несколько ферментативных систем с функциональной активностью в этом направлении, в том числе относящихся к классу окислительно-восстановительных ферментов — флавинзависимых монооксигеназ и энзимов с циклазной активностью. Ранним примером является экспрессия фермента каннабис-синтазы, модифицированного путем точечных мутаций, что снижает его аффинность к образованию Δ⁹-THC и смещает продукцию в сторону Δ⁸-изомеров. Кроме того, речь идет о применении ферментов, иммобилизованных на твердых носителях, что обеспечивает их многократное использование и стабильность в потоке производственной среды.
Одним из самых амбициозных направлений является создание полностью синтетических хромосом в микроорганизмах — так называемых chassis cells, запрограммированных для комплексного биосинтеза каннабиноидов с минимальным вмешательством извне. Примером такого подхода являются проекты Ginkgo Bioworks, Amyris или Demetrix, создающие дрожжевые штаммы, способные продуцировать десятки граммов каннабиноидов с одного литра среды. Хотя в настоящее время основное внимание сосредоточено на CBD и Δ⁹-THC, алгоритмы оптимизации метаболического потока (flux balance analysis, dynamic pathway modulation) позволяют переориентировать каскады на получение Δ⁸-изомеров за счет редизайна ключевых ферментов и условий ферментации.
Другим вариантом является биотрансформация CBD в Δ⁸-THC с помощью микроорганизмов или высших грибов, способных катализировать специфические перегруппировки. Например, виды родов Cunninghamella или Rhizopus демонстрируют способность к специфическому окислению и циклизации с сохранением или изменением геометрии двойной связи. Прединкубация CBD с культурой таких грибов в контролируемых условиях pH и температуры позволяет достичь селективной трансформации без применения кислот или органических растворителей. Однако основными ограничениями таких процессов являются нестабильность метаболитов, необходимость длительных инкубаций и низкий выход продукта.
Кроме того, рассматривается применение ферментов, полученных из растений каннабиса, путем клонирования соответствующих генов и гетерологичной экспрессии в моделях-продуцентах. Например, ферментов из родов THCA-синтаз или CBCA-синтаз, которые модифицируют активные промежуточные формы каннабиноидов на уровне кислотного предшественника. С помощью технологий прямой эволюции такие ферменты можно адаптировать для направленного синтеза Δ⁸-THC, избегая этапа термической или кислотной декарбоксилизации, что значительно снижает энергетические затраты и риск формирования побочных изомеров.
Перспективы биотехнологического производства Δ⁸-THC оказываются особенно привлекательными в контексте будущих фармацевтических применений, где контроль над химической чистотой, отсутствием остаточных кислот, металлов или растворителей является критичным. Биотехнологические платформы позволяют обеспечить такую чистоту за счет ферментативного катализа, компартментализации метаболизма и экспрессии вспомогательных белков для стабилизации целевой молекулы.
Фармакологический профиль Delta-8-THC
Взаимодействие с каннабиноидными рецепторами
Δ8-тетрагидроканнабинол (Δ8-THC) является сложной молекулой, способной взаимодействовать с несколькими типами рецепторов, наиболее важными из которых являются каннабиноидные рецепторы CB1 и CB2. Эти рецепторы входят в семейство G-белок-связанных рецепторов (GPCR), опосредующих многочисленные физиологические процессы, включая регуляцию нервной активности, иммунный ответ и метаболизм. Взаимодействие Δ8-THC с этими рецепторами обладает уникальными фармакодинамическими особенностями, отличающими его от более распространенного Δ9-THC.
CB1-рецепторы локализованы главным образом в центральной нервной системе, особенно в коре головного мозга, гиппокампе, базальных ганглиях и мозжечке. Связывание Δ8-THC с CB1 вызывает аллостерическое изменение конформации рецептора, что активирует внутриклеточные сигнальные каскады. Активированный CB1 ингибирует аденилатциклазу, что приводит к снижению уровня цАМФ, регулирует активность ионных каналов и модулирует выделение нейромедиаторов, таких как глутамат, ГАМК, дофамин и серотонин. Этот механизм обусловливает влияние Δ8-THC на нейронную возбудимость, память, моторику и боль.
По сравнению с Δ9-THC, Δ8-THC обладает более низкой аффинностью к CB1-рецепторам, однако связывание достаточное для стимуляции фармакологической активности, при этом эффекты обычно более умеренные и устойчивые. Эта разница в сродстве влияет на клинические проявления: Δ8-THC демонстрирует менее выраженную психоактивность, что может объясняться иным пространственным расположением двойной связи в молекуле, влияющим на конформацию и сродство к рецептору.
CB2-рецепторы, локализованные преимущественно в периферических тканях, включая иммунные клетки, селезенку, печень и кишечный тракт, также способны взаимодействовать с Δ8-THC. Активация CB2 запускает сигнальные пути, связанные с регуляцией иммунного ответа, включая активацию MAP-киназ (ERK, JNK, p38), что ведет к изменению экспрессии цитокинов и уменьшению воспаления. Таким образом, Δ8-THC способен модулировать иммунный гомеостаз, что имеет потенциал для терапевтического применения при воспалительных и аутоиммунных заболеваниях.
Дополнительно, Δ8-THC проявляет взаимодействие с другими рецепторными системами, выходящими за пределы каннабиноидной системы. В частности, частичный агонистический эффект на ванилоидные рецепторы TRPV1 связан с воздействием на боль и воспаление. Влияние на глутаматергическую, дофаминергическую и серотонинергическую системы осуществляется через опосредованные механизмы, модулирующие синаптическую передачу, обеспечивая комплексный фармакологический профиль.
Учитывая все эти факторы, взаимодействие Δ8-THC с рецепторами отражает тонкий баланс между аффинностью, внутренней активностью и пространственной конфигурацией молекулы, что определяет специфические фармакологические эффекты, отличные от других каннабиноидов. Дальнейшее изучение молекулярной динамики связывания и структурных особенностей этих взаимодействий является ключевым для развития целенаправленных терапевтических средств с использованием Δ8-THC.
Потенциальные терапевтические эффекты Delta-8-THC
Дельта-8-тетрагидроканнабинол (Δ8-THC), хотя и менее изучен, чем его изомер Δ9-THC, демонстрирует широкий спектр потенциальных терапевтических свойств, что делает его интересным объектом для фармакологических исследований. Его уникальный фармакологический профиль, сочетающий умеренную аффинность к каннабиноидным рецепторам с более мягкими психоактивными эффектами, создает предпосылки для применения в медицинской практике. Рассмотрим подробнее три ключевых направления его терапевтического потенциала — антиэметический эффект, анальгезию и влияние на психоэмоциональное состояние, включая тревожность, настроение и аппетит.
Антиеметическое действие Δ8-THC связано с его способностью модулировать активность рецепторов CB1 в центральных зонах, отвечающих за контроль рвотного рефлекса, в частности в хеморецепторной зоне триггерной зоны (CTZ) и прилегающем ядре ствола мозга. Это позволяет уменьшить тошноту и рвоту, вызванные различными факторами, включая химиотерапию, лучевую терапию или другие токсические агенты. Особенность Δ8-THC заключается в более мягком профиле побочных эффектов по сравнению с Δ9-THC, что делает его перспективным для применения у пациентов с повышенной чувствительностью к психоактивным проявлениям.
Анальгетический потенциал Δ8-THC проявляется через взаимодействие с CB1-рецепторами в периферических и центральных структурах, связанных с передачей болевых сигналов, а также через модуляцию TRPV1-рецепторов, отвечающих за восприятие воспаления и термической боли. Фармакодинамические исследования показывают, что Δ8-THC способен уменьшать острые и хронические боли, влияя как на соматические, так и на нейропатические болевые синдромы. Это свойство обусловлено одновременным воздействием на несколько нейротрансмиттерных систем, что позволяет избежать толерантности, характерной для многих опиоидных анальгетиков.
Что касается психоэмоционального влияния, Δ8-THC демонстрирует способность снижать тревожность и улучшать настроение, что обусловлено его регуляторным действием на дофаминергические и серотонинергические системы. Эти эффекты отличаются от Δ9-THC меньшей интенсивностью и стабильностью, что может обеспечить лучшую переносимость при терапевтическом применении. Также имеются данные, что Δ8-THC стимулирует аппетит, что имеет значение для пациентов с анорексией, кахексией или другими состояниями, связанными с потерей массы тела, особенно у онкологических больных.
Антиеметическое действие
Дельта-8-тетрагидроканнабинол (Δ8-THC) проявляет значительный потенциал в подавлении тошноты и рвоты, что является одной из ключевых проблем в клинической практике, особенно среди пациентов, проходящих курс химиотерапии или страдающих от различных токсических воздействий. Его антиэметическая активность связана со способностью модулировать центральные нейронные структуры, контролирующие рвотный рефлекс. Наиболее важными центрами являются хеморецепторная триггерная зона (CTZ), расположенная в продолговатом мозге, и прилегающее ядро, которые интегрируют сигналы, провоцирующие рвоту.
Δ8-THC воздействует на эти зоны через связывание с CB1-рецепторами, локализованными в нейронах, регулирующих высвобождение нейромедиаторов, таких как допамин и серотонин, ключевых для индукции рвоты. В результате происходит снижение возбудимости нейронов CTZ и уменьшение активации рвотного центра. В отличие от Δ9-THC, Δ8-THC обладает меньшим психоактивным эффектом, что делает его более приемлемым для пациентов, которым необходимо симптоматическое облегчение без значительного психотропного воздействия.
Кроме центрального действия, Δ8-THC может также влиять на периферические механизмы, участвующие в регуляции пищеварения и моторики желудочно-кишечного тракта, дополнительно способствуя снижению симптомов тошноты. Его фармакокинетические свойства обеспечивают достаточно продолжительный эффект, что делает возможным использование в режимах с пролонгированным действием.
Учитывая эту фармакологическую специфику, Δ8-THC является перспективным кандидатом для разработки антиэметических препаратов, особенно в контексте онкологической терапии, где токсичность традиционных средств часто ограничивает их применение. Однако необходимы дальнейшие исследования для установления оптимальных доз, безопасности и сравнения эффективности с существующими стандартами лечения.
Анальгетический потенциал
Анальгетические свойства Delta-8-THC обусловлены комплексным воздействием на нейронные сети, модулирующие болевые сигналы как в периферической, так и центральной нервной системе. Его действие реализуется через активацию каннабиноидных рецепторов, преимущественно CB1, которые обнаруживаются в высокой концентрации в области спинного мозга и мозга, ответственных за обработку ноцицептивной информации.
Воздействие Δ8-THC на CB1-рецепторы приводит к подавлению высвобождения нейромедиаторов, передающих болевые импульсы, таких как глутамат и субстанция P. Это ведет к снижению возбудимости нейронов и повышению болевого порога, что уменьшает интенсивность восприятия боли. Кроме того, Δ8-THC взаимодействует с TRPV1-рецепторами, которые играют роль в трансдукции воспалительной и термической боли, расширяя спектр его анальгетического эффекта.
Дополнительно Δ8-THC может влиять на эндокринные и иммунные механизмы, усиливающие или поддерживающие болевой синдром. Например, через активацию CB2-рецепторов происходит снижение воспаления за счет модуляции продукции провоспалительных цитокинов, что особенно актуально при хронических воспалительных состояниях.
По сравнению с традиционными опиоидными анальгетиками, Δ8-THC обладает потенциалом снижать риск развития зависимости и нежелательных побочных эффектов, таких как респираторная депрессия. Его анальгетическое действие более мягкое, но достаточное для уменьшения умеренной и даже сильной боли в отдельных клинических случаях.
В сумме анальгетический профиль Δ8-THC делает его перспективным агентом для лечения различных форм боли, включая нейропатическую, воспалительную и соматическую боль. Однако для клинического применения необходимы дополнительные доклинические и клинические исследования, которые определят его эффективность по сравнению с существующими анальгетиками, а также безопасность и оптимальные режимы дозирования.
Тревожность, настроение, аппетит
Дельта-8-тетрагидроканнабинол (Δ8-THC) демонстрирует значительное влияние на психоэмоциональное состояние, проявляющееся в регуляции тревожности, улучшении настроения и стимуляции аппетита. Эти эффекты являются результатом сложного взаимодействия с центральными нейронными системами, опосредующими эмоциональные реакции, мотивацию и гомеостаз энергетического баланса.
Регуляция тревожности под воздействием Δ8-THC отличается от более психоактивного Δ9-THC благодаря относительно умеренной аффинности к CB1-рецепторам и менее выраженной психоактивности. Молекула модулирует активность глутаматергических и ГАМКергических нейронов в лимбической системе, в частности в миндалине и гиппокампе, которые играют ключевую роль в формировании тревожных реакций. Этот баланс между возбуждением и ингибицией нейронов способствует снижению уровня тревожности без типичных для Δ9-THC параноидальных или панических приступов. Подобное действие подтверждается экспериментальными моделями тревожности, где Δ8-THC демонстрирует способность нормализовать поведенческие реакции без подавления когнитивных функций.
Что касается настроения, Δ8-THC влияет на дофаминергические пути мезолимбической системы, что обеспечивает стимуляцию центров удовольствия и вознаграждения. Это приводит к улучшению эмоционального фона, увеличению мотивации и снижению симптомов депрессии. Уникальная конформация Δ8-THC позволяет ему действовать как частичный агонист на CB1-рецепторы, что создает более контролируемый и предсказуемый эффект по сравнению с Δ9-THC, что имеет значение для терапии аффективных расстройств.
Стимуляция аппетита является еще одним важным терапевтическим аспектом Δ8-THC. Через активацию каннабиноидных рецепторов в гипоталамусе происходит усиление мотивации к приему пищи, в частности увеличение чувства голода и желания употреблять высококалорийные продукты. Этот эффект полезен для пациентов с заболеваниями, сопровождающимися потерей веса и снижением аппетита, такими как онкологические заболевания, ВИЧ-инфекция, хронические инфекции и различные соматические заболевания. Отличие Δ8-THC заключается в сниженной частоте нежелательных психоактивных реакций, что способствует лучшей переносимости и повышает качество жизни больных.
Аспекты безопасности, токсикология и регулирование
Оценка безопасности Дельта-8-тетрагидроканнабинола (Δ8-THC) является критически важной в контексте его все более широкого распространения как психоактивного агента, продающегося на рынке легальных или слабо регулируемых каннабиноидов. Несмотря на структурную родственность с Δ9-THC, предполагающую сходство в фармакодинамике, профиль безопасности Δ8-THC не может автоматически выводиться из характеристик его изомера. Отличия в аффинности к рецепторам, метаболических путях, стабильности молекулы и контекстах употребления делают необходимым отдельный анализ. Поскольку на момент написания значительная часть данных о Δ8-THC ограничена доклиническими моделями и нерандомизированными наблюдениями, особое внимание следует уделять интерпретации результатов в рамках научной осторожности.
Фундаментально, Δ8-THC является частичным агонистом каннабиноидного рецептора типа 1 (CB1), который экспрессируется главным образом в центральной нервной системе. Его действие опосредуется через механизмы, связанные с ингибированием высвобождения нейромедиаторов, включая глутамат, ГАМК, дофамин и ацетилхолин. С учетом этих свойств, Δ8-THC способен влиять на когнитивные процессы, моторную координацию, эмоциональное восприятие и нейровегетативную регуляцию. Поэтому оценка токсичности должна включать как параметры общей безопасности, так и специфические нейропсихотропные эффекты, которые варьируются в зависимости от дозы, длительности применения и индивидуальных особенностей.
На данный момент доклинические токсикологические исследования Δ8-THC ограничены и фрагментарны. Изолированные эксперименты на животных моделях свидетельствуют, что LD50 (летальная доза для 50% популяции) Δ8-THC значительно выше типичных терапевтических или рекреационных доз. Однако летальность в таких моделях не является единственным релевантным критерием безопасности. Более значимыми являются данные о сублетальных дозах, которые влияют на поведение, нейропластичность, сердечно-сосудистую регуляцию, функцию печени и почек. Пока что эти результаты остаются фрагментарными: не существует масштабных исследований, охватывающих мультисистемный анализ токсичности при хроническом приеме.
Особую обеспокоенность вызывает контекст синтетической изомеризации Δ8-THC из каннабидиола (CBD), которая часто проводится кустарным способом с использованием кислотных катализаторов, тяжёлых металлов или нестабильных растворителей. Наличие остатков кислот, побочных продуктов изомеризации, включая неидентифицированные изомеры или окисленные формы, может существенно влиять на профиль безопасности конечного продукта. В таких случаях токсикологическая опасность определяется не только самой активной субстанцией (Δ8-THC), но и смесью непрозрачных примесей, остающихся после синтеза. Независимые химические анализы показывают, что в образцах, представленных на рынке США как «чистый Delta-8», нередко обнаруживается значительная доля других каннабиноидов (например, Δ10-THC, Δ6a,10a-THC) и нежелательных побочных веществ, не проходивших испытаний на токсичность.
Отдельным аспектом является отсутствие нормативно закрепленных стандартов чистоты или фармацевтического соответствия для продуктов, содержащих Δ8-THC. Большинство таких субстанций не проходят ни контроля GMP (Good Manufacturing Practice), ни стандартов фармакопеи. Из-за этого потребители, в том числе те, кто использует Δ8-THC как средство самолечения, фактически оказываются в ситуации токсикологической неопределённости. Это представляет значительную угрозу уязвимым группам — пациентам с онкологическими, неврологическими или психиатрическими состояниями, которые ищут легальную замену Δ9-THC и не могут проверить качество или стабильность препарата.
На данный момент единственным надежным источником токсикологической валидации остаются эксперименты in vitro на клеточных линиях и in vivo на животных. В нескольких исследованиях было выявлено, что Δ8-THC обладает эффектами, сходными с Δ9-THC на синаптическую передачу, но менее выраженной способностью вызывать дезорганизованное поведение или психомоторную дезинтеграцию. Это открывает возможности для терапевтического использования Δ8-THC, однако не снимает необходимости в чёткой стандартизации, контроле дозы и знании механизмов его метаболизма.
Особого внимания заслуживают метаболиты Δ8-THC. Основным метаболитом является 11-гидрокси-Δ8-THC, который способен пересекать гематоэнцефалический барьер и влиять на центральную нервную систему. Его фармакокинетика на данный момент изучена значительно хуже, чем у 11-гидрокси-Δ9-THC, хотя предварительные данные указывают на потенциальную активность, которая может превышать исходное вещество. Отсутствие масштабных исследований в этой области ограничивает возможность точного предсказания длительности и интенсивности действия, что усложняет формирование дозировочных рекомендаций и создаёт риск кумулятивной токсичности.
Данные доклинических и клинических исследований
Несмотря на рост популярности Δ8-THC в отдельных регионах, объем и качество эмпирических исследований по его безопасности и эффективности остаются крайне ограниченными, что вызывает существенный дисбаланс между распространенностью употребления и научным пониманием потенциальных рисков и преимуществ. Систематизированное изучение фармакологических, токсикологических и клинических свойств Δ8-THC в настоящее время находится на начальном этапе, а большая часть имеющихся данных базируется на исследованиях середины — конца XX века или современных in vitro / in vivo тестах, которые часто проводятся с методологическими ограничениями. В этом контексте рассмотрение имеющихся доклинических и клинических данных требует критического подхода с чётким отделением прежних предположений от эмпирически подтверждённых выводов.
Первые попытки изучения Δ8-THC относятся к 1970-м годам, когда в условиях частичного правового вакуума исследователи искали легальные заменители Δ9-THC, которые могли бы сохранять психоактивные и терапевтические свойства при сниженном потенциале побочных эффектов. В этот период было проведено несколько маломасштабных клинических испытаний, в том числе с участием онкологических пациентов, которым назначали Δ8-THC как противорвотное средство в рамках паллиативной помощи. В одном из таких исследований, опубликованном в 1995 году, было сообщено о значительном снижении частоты рвоты после химиотерапии у детей, принимавших Δ8-THC перорально в инкапсулированной форме. Несмотря на положительные результаты (с эффективностью более 90% в снижении тошноты), ограничения включали малую выборку (всего 8 участников), отсутствие контрольной группы и короткий период наблюдения. Ни одно из последующих исследований не подтвердило или не опровергло эти выводы в рамках рандомизированных контролируемых испытаний.
На сегодняшний день клинические исследования Δ8-THC не достигли даже того объема, который характерен для других редких каннабиноидов. Существующие исследования ограничиваются случайными ретроспективными наблюдениями или неформальными опросами потребителей. В таких исследованиях пациенты обычно самостоятельно сообщают о приеме Δ8-THC с целью уменьшения боли, тревожности, стимуляции аппетита или облегчения сна. Однако отсутствие объективных биомаркеров, стандартизированных дозировок и двойного слепого дизайна делает такие данные скорее источником гипотез, чем утверждений.
В целом, среди клинически релевантных вопросов, на которые в настоящее время отсутствуют эмпирические ответы, находятся: оптимальная терапевтическая доза Δ8-THC для конкретных патологий; профиль побочных реакций в различных возрастных и соматических группах; фармакокинетика при различных путях введения (перорально, ингаляционно, трансдермально); а также взаимодействие с другими лекарственными средствами, в том числе ЦНС-депрессантами, антидепрессантами или антипсихотиками. Отсутствие контроля за источниками вещества делает невозможной даже экстраполяцию результатов на коммерчески доступные продукты, которые редко проходят надлежащее химическое очищение и проверку.
Доклинические модели, преимущественно in vivo исследования на грызунах, составляют основной корпус данных о действии Δ8-THC. Они позволяют оценить базовые нейробиологические эффекты, потенциал к формированию зависимости, взаимодействие с другими рецепторными системами и влияние на общий метаболизм. В частности, на мышах показано, что Δ8-THC вызывает значительное снижение общего моторного тонуса, анальгезию, гипотермию и каталепсию — признаки, типичные для каннабиноидов класса CB1-агонистов. Однако степень выраженности этих эффектов ниже по сравнению с Δ9-THC, что подтверждает менее выраженную психоактивность, хотя не исключает потенциал к когнитивным или аффективным нарушениям.
Также заслуживают внимания данные о нейропротекторном действии Δ8-THC. В ряде in vitro экспериментов наблюдалось снижение апоптоза нейронов, индуцированного окислительным стрессом, при предварительной инкубации с Δ8-THC. Механизмы этого эффекта, вероятно, связаны с активацией CB1-рецепторов, но не исключается и дополнительное участие сигнальных каскадов, в частности PI3K/AKT или ERK1/2, что указывает на потенциал Δ8-THC в контексте нейродегенеративных состояний. Однако ни одна из этих моделей не была подтверждена в клиническом сценарии, а экстраполяция из клеточных культур на человеческую ткань требует значительно более осторожного подхода.
Другим важным направлением являются исследования фармакокинетики. В нескольких доклинических работах с использованием масс-спектрометрии установлено, что Δ8-THC имеет умеренную биодоступность при пероральном приеме и высокий уровень липофильности, что обусловливает его кумуляцию в жировой ткани. Это создает условия для пролонгированного действия, но также повышает риск непредсказуемого накопления при длительном употреблении, особенно у пациентов с нарушениями метаболизма или избыточной массой тела. До сих пор отсутствуют данные о периодах полувыведения и взаимодействии Δ8-THC с ферментами печеночного метаболизма (например, CYP3A4, CYP2C9), хотя имеющиеся наблюдения свидетельствуют об аналогичных путях биотрансформации с Δ9-THC.
Потенциальные риски и побочные эффекты
Вопрос безопасности использования Δ8-тетрагидроканнабинола (Δ8-THC) должен рассматриваться в контексте его биологической активности, химической нестабильности, потенциала метаболической биотрансформации, а также отсутствия фармацевтически стандартизованных форм выпуска. В отличие от Δ9-THC, профиль токсичности Δ8-THC остается недостаточно очерченным не только из-за недостатка качественных клинических исследований, но и из-за доминирования неконтролируемых каналов распространения, в том числе синтетических продуктов, полученных из каннабидиола. В таких условиях сформировать надежное представление о побочных эффектах чрезвычайно сложно, особенно учитывая различные способы введения, дозировки, примеси и неравномерную биодоступность.
Одной из ключевых угроз, присущих Δ8-THC, является отсутствие молекулярной чистоты у большинства доступных на рынке образцов. Как известно, Δ8-THC в природных условиях содержится в растениях рода Cannabis в чрезвычайно низких концентрациях, поэтому большинство соединений, считающихся Δ8-THC в коммерческом обороте, на самом деле являются продуктами синтетической или полусинтетической изомеризации CBD. Этот процесс, который обычно происходит в кислой среде с участием катализаторов, генерирует многочисленные побочные изомеры, окисленные продукты и неидентифицированные промежуточные формы, которые остаются в конечном продукте из-за отсутствия хроматографической очистки. Такие примеси могут иметь собственную биоактивность или потенциальную токсичность, о которой наука почти ничего не знает.
Ретроспективные данные и сообщения в системы мониторинга побочных эффектов свидетельствуют о растущем количестве жалоб, связанных с интоксикацией после употребления Δ8-THC. Среди наиболее частых симптомов: параноидальные состояния, нарушение ориентации, психомоторная дисфункция, вестибулярные расстройства, тахикардия, гипотония, сухость во рту, тошнота, дезориентация, судорожные реакции. Часть таких симптомов может быть вызвана не только действием Δ8-THC как CB1-агониста, но и влиянием побочных веществ в неочищенной смеси. Например, неидентифицированные хлорированные или ацетилированные побочные продукты вследствие неправильного синтеза могут обладать нейротоксическим действием или взаимодействовать с печеночными ферментами, нарушая метаболизм других лекарственных средств.
Другим существенным аспектом риска являются ингаляционные формы Δ8-THC, в частности вейп-картриджи. При нагревании субстанций, содержащих остатки кислотных катализаторов или полимерных примесей, образуются токсичные летучие продукты, включая ацетаты, альдегиды, фенолы и бензол-производные. Подобные механизмы фиксировались при употреблении ацетатных форм Δ8-THC, нагреваемых выше 200°C. Особенно тревожен потенциал образования кетена — сильного алкилирующего агента с высокой токсичностью для эпителия дыхательных путей. В случаях массовой интоксикации в США 2021 года, связанных с продуктами Δ8-THC, основной подозреваемой стала именно ацетатная и неочищенная субстанция в вейп-продуктах.
С нейропсихиатрической точки зрения, Δ8-THC имеет потенциал вызывать когнитивные нарушения, особенно у подростков, лиц с семейной историей психических расстройств или при сочетании с другими психоактивными веществами. Хотя его психоактивность несколько ниже, чем у Δ9-THC, даже умеренная стимуляция CB1-рецепторов в центральной нервной системе может вызывать дизрегуляцию дофаминергических и глутаматергических путей, особенно в префронтальной коре. Это проявляется в транзиторных нарушениях внимания, памяти, сна, а у уязвимых индивидов может вызывать панические атаки, психотические эпизоды или эмоциональную дестабилизацию.
Еще одним слабоизученным вектором риска является гепатотоксический потенциал Δ8-THC. Известно, что синтетически полученные каннабиноиды могут проявлять прямую цитотоксичность по отношению к гепатоцитам в высоких дозах или при длительном применении. Δ8-THC, вероятно, метаболизируется с участием ферментов CYP2C9 и CYP3A4, что обусловливает его способность конкурировать с другими субстратами этих систем, в том числе антигипертензивными средствами, антикоагулянтами, противоэпилептическими препаратами. Хотя прямых доказательств гепатотоксичности Δ8-THC нет, отдельные случаи повышения уровней печеночных ферментов у потребителей свидетельствуют о необходимости дальнейшего изучения в этом направлении.
Кроме того, существует проблема кумулятивного эффекта. Липофильная природа Δ8-THC обусловливает его длительное сохранение в жировых депо с медленным высвобождением в системный кровоток. В контексте хронического употребления это может вызвать неожиданные изменения поведения, пролонгированную психомоторную депрессию или толерантность к другим психоактивным веществам. И хотя прямые показатели физиологической зависимости в экспериментальных моделях считаются ниже, чем для Δ9-THC, повторное употребление Δ8-THC может вызывать психологическую зависимость или привыкание на уровне условных рефлексов.
Отдельно следует отметить, что большинство современных продуктов с Δ8-THC не проходят регуляторную сертификацию, поэтому риски, связанные с загрязнением тяжелыми металлами, пестицидами, растворителями (гептан, толуол, этанол) или микробиологическими агентами (плесень, бактерии), остаются высокими. Это делает любые оценки безопасности таких продуктов некорректными до введения нормативов по содержанию примесей, стандартных методов валидации и контроля качества.
Законодательная ситуация в мире и вызовы исследований
Правовой статус Δ8-тетрагидроканнабинола (Δ8-THC) на сегодняшний день является одним из самых спорных аспектов в сфере каннабиноидной политики. Это соединение формально не входило в перечень контролируемых веществ в большинстве юрисдикций в течение длительного времени, что обусловило его широкое распространение, особенно в странах с либерализованным регулированием каннабиноидов. Однако правовая амбивалентность Δ8-THC возникла не случайно — она является прямым следствием разрыва между нормативным полем, которое основывается на классификации природных каннабиноидов, и реальностью, где доминируют полусинтетические аналоги, полученные из каннабидиола.
Международная конвенция о наркотических средствах 1961 года, ратифицированная большинством государств, не содержала упоминания о Δ8-THC как отдельном соединении. Более четкое формулирование появилось в рекомендациях Всемирной организации здравоохранения в 2020 году, когда было предложено рассматривать Δ8-THC как изомер Δ9-THC с похожим психоактивным потенциалом. Однако это предложение не приобрело обязательного характера. Таким образом, на глобальном уровне Δ8-THC часто остается вне формальных рамок контроля, если он не синтезирован непосредственно из Δ9-THC или не получен из растений каннабиса, содержащих его в более высоких концентрациях, чем разрешено законами отдельных стран.
В США регуляторная ситуация с Δ8-THC особенно показательна. После принятия «Farm Bill» в 2018 году, который легализовал конопли (hemp) и все производные каннабиноиды с концентрацией Δ9-THC менее 0.3%, возник правовой вакуум, позволивший массовое производство Δ8-THC из легального каннабидиола. Из-за того, что Δ8-THC не был прямо упомянут в федеральном списке запрещенных веществ, его начали продавать в магазинах, онлайн-платформах и вейп-дистрибьюторах, позиционируя как «законную альтернативу» традиционному Δ9-THC. Однако с 2021 года ряд штатов, включая Нью-Йорк, Колорадо, Аляску и Юту, начали вводить ограничения или полные запреты на его оборот, ссылаясь на отсутствие регулирования качества, токсикологических данных и неконтролируемое распространение среди подростков.
Регуляторные агентства, включая FDA (Управление по контролю за продуктами и лекарствами США), начали выражать тревогу по поводу неконтролируемого рынка Δ8-THC. В 2022 году FDA официально предупредило потребителей о потенциальных опасностях, отмечая частые случаи интоксикаций и госпитализаций, связанных с употреблением продуктов с Δ8-THC. Однако FDA подчеркнуло, что не имеет полномочий запретить оборот этих веществ без законодательного определения их статуса. В результате сложилась ситуация, когда соединение с психоактивным эффектом, схожим с Δ9-THC, распространяется в правовом поле, которое лишь частично признает его существование.
В Европейском Союзе правовое регулирование Δ8-THC зависит от национального законодательства. В большинстве стран он не является отдельно указанным контролируемым веществом, однако его правовой статус трактуется как производный от Δ9-THC или как синтетический каннабиноид, что автоматически подпадает под запрет. Например, в Германии и Франции все психоактивные каннабиноиды, которые не являются частью официально разрешенных препаратов (как, например, дронабинол), считаются запрещенными. В Великобритании Δ8-THC классифицирован как вещество класса B согласно «Misuse of Drugs Act», то есть приравнено к Δ9-THC в правовом смысле. В то же время в странах Восточной Европы или на Балканах ситуация неоднородна: частично опираются на техническую документацию к конопляному сырью, а не на отдельную идентификацию Δ8-THC как вещества.
Одним из главных вызовов в исследовании Δ8-THC являются трудности с легальным доступом к чистому веществу. В большинстве юрисдикций отсутствуют стандарты фармацевтического качества для Δ8-THC, сертифицированные аналитические методы или нормативы допустимых примесей. Это усложняет проведение клинических исследований, токсикокинетики, взаимодействий с другими препаратами. Кроме того, фармакологическое разнообразие полусинтетических образцов, циркулирующих на рынке, не позволяет сделать однозначные выводы на основе лабораторного опыта, так как каждая партия может иметь свой собственный спектр примесей и изомеров.
Еще одним системным барьером для исследования Δ8-THC является отсутствие международной гармонизации в определении понятия «психоактивность». В законодательствах многих стран нет четких критериев, позволяющих определить, что именно считается психоактивным веществом среди каннабиноидов. Соответственно, Δ8-THC может быть классифицирован как «непсихоактивный» в странах, где уровень эффекта не соотносится с Δ9-THC, или же наоборот — автоматически отнесен к запрещенным субстанциям. Эта нормативная разница создает препятствия не только для науки, но и для фармацевтической промышленности, которая нуждается в предсказуемом правовом поле для разработки и регистрации новых препаратов.
Отдельно следует отметить инерционность законодательной политики в отношении новейших каннабиноидов. Существующие нормы часто базируются на устаревших классификациях или на подходах к полностью синтетическим соединениям, не учитывая того, что Δ8-THC имеет полуприродное происхождение, структуру, близкую к Δ9-THC, и может синтезироваться из соединений, формально легальных. Это создает ситуацию нормативного вакуума, где регулятор не имеет достаточных оснований для оперативного вмешательства, а научное сообщество не получает доступа к контролируемым, верифицированным образцам для исследований.
Перспективы и направления дальнейших исследований
Биомедицинские применения
Научный интерес к биомедицинскому потенциалу Δ8-тетрагидроканнабинола (Δ8-THC) в последние годы заметно активизировался в связи с его уникальными фармакодинамическими характеристиками, более низким психоактивным профилем по сравнению с Δ9-THC и потенциальной терапевтической полезностью при ряде патологических состояний. Однако в отличие от хорошо изученного Δ9-изомера, Δ8-THC до сих пор остаётся малоизученным в клиническом аспекте. В то время как большинство современных данных поступают из доклинических исследований или ранних клинических протоколов, новые модели исследований на животных и клеточных культурах свидетельствуют о значительно более широком потенциале, чем предполагалось ранее.
В отличие от Δ9-THC, который демонстрирует высокую аффинность к CB1-рецепторам коры головного мозга, Δ8-THC имеет несколько сниженную сродственность к этим структурам, но при этом проявляет активность в отношении периферических CB2-рецепторов, особенно в клетках иммунной системы и желудочно-кишечного тракта. Этот фармакологический профиль делает его привлекательным кандидатом для разработки препаратов, ориентированных на иммуномодулирующие, противовоспалительные, антиэметические и гастропротекторные эффекты без чрезмерной нейропсихической стимуляции. Речь идёт не только об общих симптоматических применениях, но и о потенциальном участии в лечении хронических и системных заболеваний — таких как воспалительные энтеропатии, нейродегенеративные синдромы, злокачественные опухоли и посттравматические расстройства.
Среди первых документированных применений Δ8-THC в клинической среде были антиэметические протоколы у детей с онкологическими заболеваниями, опубликованные ещё в 1990-х годах. Данные ранних исследований указывали на высокую эффективность Δ8-THC при снижении частоты приступов тошноты и рвоты в ответ на химиотерапию — с минимальными когнитивными побочными эффектами. Эти результаты, хотя и не привели к широкому клиническому внедрению в фармакотерапевтические стандарты, стали основой для дальнейших исследований по использованию Δ8-THC при устойчивых формах тошноты, функциональных расстройствах желудочно-кишечного тракта и синдроме циклической рвоты.
Другим перспективным направлением является применение Δ8-THC при хронической боли неонкологического происхождения, в частности у пациентов с невропатиями, фибромиалгией и хронической тазовой болью. Предварительные доклинические модели демонстрируют, что Δ8-THC способен опосредовать анальгетические эффекты с участием не только каннабиноидных рецепторов, но и косвенно через десенсибилизацию TRPV1-каналов и модуляцию экспрессии простагландинов в воспалительной ткани. При этом наблюдается меньшая вероятность психических нарушений или дизфории по сравнению с Δ9-THC, что открывает перспективы для использования Δ8-THC в терапии боли у уязвимых категорий пациентов — пожилых людей, лиц с тревожно-депрессивным фоном или пациентов с коморбидной патологией ЦНС.
Ещё одним возможным направлением клинического применения является использование Δ8-THC как аппетитстимулирующего средства при кахексии, обусловленной СПИДом, онкологическими заболеваниями или нейродегенеративными процессами. В экспериментах на животных зафиксировано увеличение пищевой активности, а также модификация экспрессии грелина и лептина — гормонов, участвующих в регуляции голода. С учётом менее выраженной психоактивности Δ8-THC по сравнению с Δ9-THC, он может стать более пригодным для длительного применения у пациентов с анорексией различного генеза, в том числе геронтологической.
Потенциал Δ8-THC в сфере психического здоровья вызывает особый интерес. Несмотря на некоторые структурные сходства с Δ9-THC, Δ8-изомер проявляет заметно меньшую склонность к индукции тревожных состояний, панических атак или паранойи, характерных для высоких доз Δ9-THC у чувствительных лиц. Напротив, отдельные модели на животных демонстрируют анксиолитический эффект, связанный с активацией CB1-рецепторов в гиппокампе и префронтальной коре. Это позволяет рассматривать Δ8-THC как возможную молекулярную платформу для создания новых анксиолитиков, особенно в комбинации с другими непсихоактивными фитоканнабиноидами или терпено-модулирующими агентами.
Некоторые пилотные наблюдения также свидетельствуют о потенциале Δ8-THC при лечении посттравматических стрессовых расстройств (ПТСР), где важным является сочетание снижения уровня эмоционального напряжения и подавления навязчивых воспоминаний. Эти эффекты опосредуются через каннабиноидную модуляцию амигдально-гормональных цепей. Хотя доказательная база здесь ещё слаба, нейрофармакологические основания оправдывают проведение контролируемых клинических испытаний.
В дерматологии изучается возможность использования Δ8-THC как местного иммуномодулятора при хронических кожных состояниях, включая атопический дерматит, псориаз и себорейный дерматит. Исследования in vitro показывают, что Δ8-THC может влиять на продукцию интерлейкина-6 и TNF-α в кератиноцитах, а также модулировать экспрессию CB2-рецепторов в кожном барьере. Это указывает на перспективу создания местных противовоспалительных средств нового поколения на основе Δ8-THC или его структурных аналогов.
В области онкологии Δ8-THC изучается преимущественно как средство для поддерживающей терапии — с целью снижения побочных эффектов химиотерапии, стимуляции аппетита, облегчения боли и улучшения качества жизни. Однако в отдельных доклинических экспериментах также наблюдались признаки прямых антипролиферативных эффектов Δ8-THC на некоторые линии опухолевых клеток, включая глиомы, меланомы и карциномы молочной железы. Предполагаемым механизмом действия является индукция апоптоза через внутриклеточные сигнальные пути p38 MAPK и подавление ангиогенеза. Тем не менее, эти данные требуют осторожной интерпретации, так как большинство таких эффектов наблюдались при концентрациях, маловероятно достижимых in vivo без токсических последствий.
Δ8-THC может сыграть роль модельной молекулы для разработки будущих каннабиноидных препаратов с узкой целевой активностью. Его фармакофорная структура позволяет относительно просто модифицировать боковую цепь, ароматическое кольцо или двойную связь для создания соединений с селективным действием на CB2-рецепторы или модуляцией других рецепторных систем — таких как GPR55, TRPV1 или PPAR-γ. Это открывает возможности не только для создания новых препаратов, но и для фундаментального понимания принципов селективности каннабиноидного связывания.
Химическая модификация и дизайн новых молекул
Дельта-8-тетрагидроканнабинол (Δ8-THC), благодаря своей стабильной циклической структуре, химическому сходству с Δ9-THC и при этом сниженной психоактивности, является удобной платформой для создания новых химико-фармацевтических агентов. Его структура позволяет проводить разнонаправленную модификацию, ориентированную как на повышение рецепторной селективности, так и на улучшение фармакокинетических свойств или снижение метаболической нестабильности. В этом контексте Δ8-THC рассматривается не только как природная молекула, но и как фармакофор — базовый скелет, который можно целенаправленно изменять для получения полуавтоматизированных липофильных или амфифильных производных с новыми биологическими свойствами.
Одним из самых перспективных направлений химической модификации Δ8-THC является вариация боковой алкильной цепи в положении 3 бензольного ядра. В природном Δ8-THC эта цепь — пентильная (C5H11), которая является ключевым фактором для гидрофобного взаимодействия с каннабиноидными рецепторами, особенно с CB1. Увеличение длины этой цепи до гептильной или замена её на циклические или ароматические структуры может существенно изменить аффинность к рецепторам, а также изменить профиль связывания с CB2 или даже другими молекулярными мишенями. Например, в ряде экспериментов производные Δ8-THC с циклогексильными или терпеноидными остатками демонстрировали высокую аффинность к CB2-рецепторам селективно, снижая воздействие на центральную нервную систему. Это открывает путь к разработке противовоспалительных средств, лишённых психоактивного потенциала.
Вторым важным вектором является модификация двойной связи между положениями 8 и 9 кольца С. В Δ9-THC эта связь находится в положении 9-10, что в значительной степени определяет его аффинность к CB1. Перенос или гидрогенизация двойной связи в Δ8-THC не только стабилизирует структуру молекулы, но и снижает склонность к окислительному метаболизму с образованием реактивных интермедиатов. Например, дегидрогексилированные производные Δ8-THC демонстрируют лучшую стабильность в присутствии цитохрома P450, что делает их перспективными для перорального применения или пролонгированных форм. Кроме того, насыщение двойной связи ведёт к образованию новых тетрагидроканнабинолиновых аналогов, которые сохраняют способность к связыванию с каннабиноидными рецепторами, но обладают изменёнными фармакологическими свойствами.
Значительный интерес вызывают также производные Δ8-THC с модифицированными функциональными группами на фенольном гидроксиле в положении 1. Эта часть молекулы участвует в водородных связях с CB1-рецептором, а её ацилирование, этелирование или образование карбаматов позволяет манипулировать растворимостью, продолжительностью действия и биодоступностью. В некоторых случаях такие модификации направлены на создание пролекарств, активируемых ферментами желудочно-кишечного тракта или печени. Это позволяет преодолеть ограничения первого прохождения через печень, характерные для каннабиноидов, и стабилизировать активное вещество до момента высвобождения в целевой ткани.
Новый класс молекул формируется также на основе гибридизации Δ8-THC с другими биоактивными фрагментами, например, с фрагментами нестероидных противовоспалительных средств, β-карболинов или даже структур серотониновых антагонистов. Такие молекулы создаются с расчётом на полифармакологию — способность взаимодействовать с несколькими мишенями одновременно, что особенно актуально при боли, воспалении, онкопатологиях или психических расстройствах. В этом контексте Δ8-THC служит не столько как целевой агент, сколько как транспортёр или фармакологический модуль в многокомпонентных структурах. Хотя эти подходы находятся преимущественно на этапе in silico-дизайна или доклинических моделей, полученные данные подтверждают перспективность такого конструкционного подхода.
Ещё одним направлением является конъюгация Δ8-THC с пептидными или полисахаридными остатками для создания новых лигандов с прицельным действием. Это может быть реализовано как стратегия таргетной доставки — например, для поражений кишечника или мозга, где необходима высокая локальная концентрация каннабиноидного агента при минимальной системной нагрузке. Конъюгация с маннозой или галактозой позволяет, в частности, ориентировать молекулы на специфические рецепторы эпителия толстого кишечника или микроглии. Такой подход имеет перспективу не только в фармакологии, но и в направлении молекулярной диагностики, когда Δ8-THC может выполнять роль контрастного агента для визуализации состояний, связанных с воспалением или глиальными поражениями.
Кроме того, существует перспектива модификации Δ8-THC в направлении создания неканнабиноидных аналогов — соединений, которые не связываются с классическими каннабиноидными рецепторами, но всё ещё обладают частью характерных эффектов, таких как противовоспалительный или гастропротекторный. Это особенно актуально в условиях законодательных ограничений или опасений по поводу каннабиноидной безопасности. Замена кольца С или частичная реорганизация структуры в направлении бициклических или линейных систем позволяет получать соединения с новыми механизмами действия — в частности, через PPAR-α/γ, GPR55 или рецепторы эндованилоидной системы.
Применение методов компьютерного моделирования, в частности докинга, динамического моделирования и молекулярного филогенеза, позволяет предсказывать, какие структурные модификации Δ8-THC могут быть наиболее эффективными для связывания с желаемыми рецепторами. В этом контексте синтетическая химия переплетается с биоинформатикой и фармакогеномикой, открывая возможности для персонализированной разработки каннабиноидных лекарств.
В заключение стоит подчеркнуть, что каждая химическая модификация Δ8-THC требует тщательного токсикологического анализа. Даже незначительные изменения в структуре могут радикально повлиять на биобезопасность, включая гепатотоксичность, иммуносупрессию или психоактивные эффекты. Именно поэтому создание новых производных Δ8-THC требует междисциплинарного подхода — с участием химиков, фармакологов, биофизиков и токсикологов — для обеспечения не только эффективности, но и предсказуемого профиля безопасности.
Вызовы стандартизации и контроля качества
С ростом интереса к Delta-8-THC как фармакологически активному веществу возникает комплексная проблема стандартизации, охватывающая все этапы — от первичного получения до конечного продукта. В условиях, когда вещество может происходить из нескольких синтетических или полусинтетических источников, иметь полиморфную химическую чистоту и существовать в различных матрицах (масла, капсулы, ингаляторы, трансдермальные формы), обеспечение стабильности, идентичности и безопасности в каждом препарате требует не только разработки строгих стандартов, но и пересмотра методологической базы современного фармакопейного контроля.
Одним из главных вызовов является неоднозначность в определении «эталонного» состава вещества. В контексте Δ8-THC стандарт не может ограничиваться только массовой долей основного изомера. При синтетическом происхождении почти всегда присутствуют побочные продукты — региоизомеры, остаточные кислоты, побочные каннабиноиды (особенно Δ10, Δ6a,10a или дегидрогексилированные производные), которые обладают собственной биоактивностью или могут взаимодействовать с ферментными системами организма. Это означает, что полная химическая паспортизация должна охватывать мультикомпонентный анализ — включая профилирование изомерного состава, количественную оценку остаточных реагентов, а также характеристику вторичных метаболитов, которые могут образовываться in vivo или при хранении.
Сложность стандартизации Δ8-THC также связана с отсутствием глобально принятых аналитических методов для его разграничения с Δ9-THC, особенно в массовых лабораториях и токсикологических центрах. Изомеры имеют идентичные молекулярные массы, схожие хроматографические свойства и практически не различаются в обычных спектрофотометрических тестах. В результате существует риск как фальсификаций (например, продажа Δ9-THC под видом Δ8), так и ошибок в правовых спорах или клинических контекстах. Создание сертифицированных стандартов с четкой граничной разделительностью, дополненных спектроскопией ядерного магнитного резонанса (^1H- и ^13C-NMR), высокоэффективной жидкостной хроматографией с масс-спектрометрическим детектированием (HPLC-MS/MS) и хиральной газовой хроматографией — является не просто желательным, а критически необходимым.
Отдельным блоком стоит вопрос стабильности Δ8-THC в различных формах. Из-за склонности к окислению, изомеризации обратно в Δ9- или Δ6a,10a-THC при незначительном нагревании или воздействии света происходят необратимые изменения состава. Это ставит под сомнение реальную дозированную эффективность конечного продукта, особенно при длительном хранении. Для этого необходим не просто контроль входящего вещества, а валидация стабильности каждой фармацевтической формы — с учетом упаковки, температуры, влажности, уровня кислорода, типа растворителя или носителя (например, среды на основе МСТ-масла, этанола или ПЭГ-400). Стандартизация должна включать специфические профили деградации в условиях ускоренного хранения (ICH Q1A) с определением кинетики распада и токсикологии продуктов деградации.
Еще более сложной проблемой является оценка остаточных примесей — кислот (например, п-толуолсульфоновой), растворителей (гексан, ацетон, диэтиловый эфир), катализаторов (бор трифторид, фосфорная кислота) или стабилизаторов. В связи с тем, что синтез Δ8-THC обычно не проводится под фармакопейным контролем, а происходит на полупромышленных установках, примеси могут быть токсичными при системном накоплении. Стандартизация должна охватывать не только допустимые пределы, но и обязательное декларирование методов очистки, анализа остаточных реагентов и результатов их полного удаления — согласно требованиям ICH Q3A и Q3C.
Проблемы контроля качества осложняются также коммерческой гетерогенностью продуктов. Сегодня Δ8-THC реализуется в виде масел, вейпов, капсул, съедобных продуктов, косметики и даже ветеринарных препаратов. В каждом случае — разный путь поступления в организм, разная скорость абсорбции, трансформации и элиминации. Это делает невозможным создание универсальной схемы стандартов для всех форм. Даже при идентичной дозировке биодоступность может отличаться в разы в зависимости от формы. Следовательно, качество должно контролироваться не только на уровне вещества, но и на уровне конечного продукта в конкретной форме доставки.
Еще одним вызовом является разрыв между нормативной и научной частями контроля качества. В большинстве юрисдикций Δ8-THC не имеет четкой классификации в фармакопеях, а производители используют стандарты, заимствованные из Δ9-THC или CBD. Это ошибочная практика, поскольку свойства этих веществ — включая растворимость, стабильность, химическую реакцию на реагенты — значительно отличаются. Следовательно, необходимо создавать независимые фармакопейные монографии, учитывающие специфику Δ8-THC как вещества и активного ингредиента. Это касается и методов титрования, спектроскопии, хроматографии, а также требований к влажности, pH среды и механизмов контроля микробиологической чистоты, особенно в препаратах, предназначенных для ингаляционного или парентерального введения.
Также следует упомянуть проблему воспроизводимости исследований. Из-за отсутствия единых стандартов для Δ8-THC различные исследовательские группы работают с продуктами разной чистоты, происхождения и методов получения. Это создает системные трудности в сравнении результатов даже при похожих экспериментах. Терапевтическая эффективность, токсичность, фармакокинетика — все это зависит от того, что именно называют «Δ8-THC» в каждом конкретном случае. Решение этой проблемы возможно только через создание международного эталона (reference standard), одобренного ВОЗ, Европейской фармакопеей или USP, с подробной спецификацией, методами проверки, стабильности и межлабораторной калибровочной верификацией.
Выводы
Delta-8-тетрагидроканнабинол (Δ8-THC) представляет собой сложный объект исследования, который объединяет в себе химическую уникальность, фармакологическую перспективность и серьёзные технологические и регуляторные вызовы. Научный анализ этой молекулы с позиции её химического строения, природного происхождения, методов получения, фармакологии, безопасности и правового статуса создаёт комплексное понимание потенциала и ограничений, лежащих в основе её дальнейшего развития как фармацевтического или биоактивного агента.
Химическая природа Δ8-THC обусловлена особой конституционной изомерией, которая определяет специфику её взаимодействия с каннабиноидными рецепторами, а также стабильность в различных физико-химических условиях. Хотя молекулярная формула совпадает с Δ9-THC, расположение двойной связи в молекулярной цепи кардинально влияет на конформацию, способность к изомеризации, химическую активность и биологическое поведение вещества. Эти фундаментальные различия имеют не только академическое значение, но и практическое влияние на фармакокинетические и фармакодинамические профили, которые до сих пор изучаются в условиях лабораторных и клинических экспериментов.
Природное происхождение Δ8-THC — чрезвычайно низкое содержание в каннабиноидных растениях рода Cannabis, что делает выделение этой субстанции непосредственно из растительного сырья практически неэффективным для массового использования. Биогенетические пути формирования этого изомера пока недостаточно изучены, особенно в контексте факторов внешней среды, которые могут коррелировать с количественным и качественным составом каннабиноидов. Фактически его присутствие рассматривается скорее как побочный продукт эндогенных ферментативных процессов или результат деградации других каннабиноидов под действием физических и химических факторов. Это создаёт предпосылки для поиска альтернативных способов получения, поскольку технологические требования к синтетическим или полу-синтетическим методам остаются ключевыми.
Технологические подходы к синтезу Δ8-THC демонстрируют значительный научно-технический прогресс, особенно в области изомеризации каннабидиола (CBD) в кислотной среде. Применение катализаторов, регулирование температурных и временных параметров реакции, использование различных растворителей и очистных методов формируют основу для производства с высокой чистотой и выходом продукта. Однако наличие примесей, сложность контроля изомеров и остаточных реагентов сохраняет актуальность вопроса качества. В то же время перспективные биотехнологические методы — в частности, применение ферментативного катализа, генно-модифицированных микроорганизмов и клеточных культур — открывают новые горизонты для более экологически безопасного и экономически эффективного производства. Эти подходы, однако, требуют дальнейшего фундаментального изучения механизмов биосинтеза и оптимизации экспрессии ключевых ферментов, определяющих синтетический путь к Δ8-THC.
Фармакологическая характеристика Δ8-THC демонстрирует ряд важных особенностей. Взаимодействие с каннабиноидными рецепторами CB1 и CB2 подтверждает её биологическую активность, однако профили связывания и аффинности несколько отличаются от Δ9-THC, что отражается на клинических эффектах. Психоактивность, хоть и менее выражена по сравнению с Δ9-THC, не исключает её потенциала в клинической практике. Наиболее перспективными являются терапевтические свойства, в частности антиэметическое действие, которое является одним из наиболее хорошо задокументированных, а также анальгетический эффект и влияние на психоэмоциональное состояние, включая снижение тревожности и регуляцию аппетита. Все эти аспекты требуют дальнейших исследований с акцентом на механизмы действия, эффективные дозы и потенциальные побочные реакции.
Особого внимания заслуживает анализ аспектов безопасности, токсикологии и регуляторных ограничений, которые в настоящее время крайне сложны из-за ограниченности доклинических и клинических данных. Определение безопасного профиля требует расширения масштабных исследований, включающих долговременное наблюдение за воздействием на различные системы организма, а также изучение потенциальной токсичности продуктов распада и примесей, которые могут накапливаться в процессе синтеза. Юридическая неоднозначность статуса Δ8-THC в разных странах и регионах создаёт дополнительные барьеры для стандартных процедур оценки и испытаний, а отсутствие единых фармакопейных монографий осложняет контроль качества, что напрямую отражается на безопасности пациентов и потребителей.
Вызовы, связанные со стандартизацией и контролем качества, являются одним из крупнейших «узких мест» в развитии Δ8-THC как фармацевтической субстанции. Разнообразие синтетических методов, неоднородность конечных продуктов, наличие изомеров и сопутствующих веществ, вариабельность биодоступности в различных формах применения — всё это требует формирования комплексной системы контроля, которая объединяет аналитические, технологические, токсикологические и регуляторные критерии. Только при выполнении этих условий можно гарантировать воспроизводимость результатов исследований, безопасность пациентов и потребителей, а также легитимность использования Δ8-THC в медицинской практике.
Что касается перспективных направлений, то биомедицинские применения Δ8-THC открывают широкие возможности для разработки новых терапевтических агентов с профилем эффективности и безопасности, отличным от классических каннабиноидов. Химическая модификация молекулы, включая создание производных и аналогов, потенциально позволяет улучшить фармакокинетику, увеличить селективность к рецепторам и минимизировать побочные эффекты. В то же время стандартизация и контроль качества остаются критически важными аспектами для трансляции фундаментальных знаний в клинические решения.
В целом, Delta-8-THC является сложным, многогранным объектом, объединяющим уникальные химические, биологические и технологические свойства. Изучение этой молекулы требует междисциплинарного подхода, который интегрирует химию, биологию, фармакологию, токсикологию и регуляторную науку. Только во взаимодействии этих сфер возможно создание надёжной платформы для развития Δ8-THC как безопасного и эффективного биоактивного агента с потенциальным медицинским и коммерческим применением в будущем.
Источники:
- National Center for Biotechnology Information (NCBI), PubMed Central (PMC) — база данных научных статей в области биомедицины и фармакологии:
https://www.ncbi.nlm.nih.gov/pmc/ - ScienceDirect — платформа Elsevier с большим количеством публикаций в области химии, фармакологии и биотехнологии (часть контента открыта):
https://www.sciencedirect.com/ - Journal of Cannabis Research — открытый журнал с актуальными исследованиями каннабиноидов:
https://jcannabisresearch.biomedcentral.com/ - U.S. National Library of Medicine (NLM) — официальный ресурс по здравоохранению США, содержащий научные материалы о каннабиноидах:
https://www.nlm.nih.gov/ - Frontiers in Pharmacology — открытый доступ, раздел каннабиноидной фармакологии:
https://www.frontiersin.org/journals/pharmacology - ResearchGate — научная сеть с большим количеством открытых исследований, можно искать статьи по Delta-8-THC:
https://www.researchgate.net/ - Journal of Natural Products — официальный журнал Американского химического общества с исследованиями природных соединений:
https://pubs.acs.org/journal/jnprdf - European Monitoring Centre for Drugs and Drug Addiction (EMCDDA) — отчёты и научные документы по теме каннабиноидов и их воздействия:
https://www.emcdda.europa.eu/ - Harvard Health Publishing — публикации и обзоры о медицинском применении каннабиноидов от Гарвардской медицинской школы:
https://www.health.harvard.edu/ - U.S. Food and Drug Administration (FDA) — официальные документы и заявления по регулированию каннабиноидов:
https://www.fda.gov/ - American Chemical Society (ACS) Publications — большая коллекция рецензируемых статей по химии и фармакологии:
https://pubs.acs.org/ - Cannabis and Cannabinoid Research (Mary Ann Liebert, Inc.) — специализированный журнал с открытым доступом к отдельным статьям:
https://www.liebertpub.com/can - The Journal of Clinical Pharmacology — открытые и рецензируемые исследования по клинической фармакологии каннабиноидов:
https://accp1.onlinelibrary.wiley.com/journal/15524604 - World Health Organization (WHO) — официальные отчёты о безопасности и фармакологии каннабиноидов:
https://www.who.int/ - National Institute on Drug Abuse (NIDA) — научные обзоры, данные исследований и публикации по каннабиноидам:
https://www.drugabuse.gov/