В рамках исследований природных соединений, которые модулируют эндоканнабиноидную систему, каннабиноиды остаются одними из самых интересных объектов как с точки зрения фундаментальной химии, так и фармакологии. Более ста фитоканнабиноидов идентифицировано у представителей рода Cannabis, большинство из которых существует в кислой форме — как вторичные метаболиты, синтезируемые в железистых трихомах растений. Среди них наиболее изученными являются Δ⁹-тетрагидроканнабиноловая кислота (Δ⁹-THCA), каннабидиоловая кислота (CBDA) и каннабигероловая кислота (CBGA). Их активные формы — Δ⁹-THC, CBD и CBG соответственно — образуются путем декарбоксилирования под воздействием тепла или времени. Однако с ростом интереса к структурному разнообразию каннабиноидов в научном сообществе усиливается внимание к менее изученным изомерам и производным, в частности Δ⁸-тетрагидроканнабиноловой кислоте (Δ⁸-THCA).
Δ⁸-THCA не следует путать с Δ⁸-THC — психоактивным изомером Δ⁹-THC, который в последнее время стал объектом как медиаинтереса, так и нормативного регулирования. Хотя Δ⁸-THC можно обнаружить в следовых количествах в растениях Cannabis sativa L., он обычно является продуктом искусственной изомеризации из Δ⁹-THC. Соответственно, Δ⁸-THCA, являющаяся его кислым предшественником, в настоящее время считается преимущественно лабораторно полученным соединением, хотя ее теоретическое природное происхождение еще не полностью исключено. Химически, Δ⁸-THCA — это структурный изомер Δ⁹-THCA, в котором двойная связь в циклогексеновом кольце смещена с положения Δ⁹ на Δ⁸. Такое изменение не является тривиальным с точки зрения потенциального влияния на биологическую активность, метаболизм и фармакокинетику соединения. Однако исследования Δ⁸-THCA остаются на начальной стадии, а систематический обзор его свойств, методов получения и научной целесообразности в профессиональной литературе пока отсутствует.
Ключевой вопрос, который возникает при изучении Δ⁸-THCA, — это его место в хемотипе растений конопли. В известных биосинтетических путях каннабиноидов CBGA служит предшественником как для THCA, так и для CBDA и CBCA, в зависимости от ферментативной активности соответствующих синтаз. Надежных данных о существовании специфической Δ⁸-THCA-синтазы не зафиксировано. Это ставит под сомнение природный путь образования Δ⁸-THCA в коноплях в сельскохозяйственных или диких условиях. Вместо этого изомеризация Δ⁹-THCA в Δ⁸-THCA в лабораторных условиях возможна через кислотно-катализируемые механизмы, аналогичные тем, которые применяются для превращения Δ⁹-THC в Δ⁸-THC. Стабильность Δ⁸-THCA в различных условиях, в том числе до и после декарбоксилирования, представляет отдельный интерес — учитывая вероятные фармакологические различия между изомерами.
Несмотря на структурное сходство с Δ⁹-THCA, Δ⁸-THCA может демонстрировать иной профиль взаимодействия с каннабиноидными рецепторами (CB1/CB2), особенно если учитывать предыдущие наблюдения относительно менее выраженной психоактивности Δ⁸-THC по сравнению с Δ⁹-THC. В то же время, как и все кислые формы каннабиноидов, Δ⁸-THCA, вероятно, имеет отличный механизм действия, не связанный с прямой активацией CB1. Ранние исследования на животных свидетельствуют о потенциальной противовоспалительной, антиэметической и нейропротекторной активности кислотных каннабиноидов, в частности THCA. Если аналогичные эффекты будут присущи и Δ⁸-THCA, то это соединение может представлять интерес как основа для разработки новых лекарственных средств, не связанных с психоактивностью.
Также стоит учитывать научно-технические ограничения, касающиеся изучения Δ⁸-THCA. Во-первых, аналитическое выделение этого соединения из экстрактов является сложной задачей из-за его структурной близости к Δ⁹-THCA и тенденции к декарбоксилированию под воздействием даже незначительного тепла. Во-вторых, отсутствие сертифицированных аналитических стандартов значительно осложняет качественный и количественный анализ этого соединения с помощью хроматографии или масс-спектрометрии. В связи с этим большинство доступных данных по Δ⁸-THCA основано на непрямых методах или на синтетических моделях, что создает дополнительный вызов для его систематического исследования.
Еще один аспект, заслуживающий отдельного внимания, — это нормативно-правовой статус Δ⁸-THCA. В большинстве стран законодательство относительно каннабиноидов ориентировано на психоактивные формы (THC) и их количественное содержание в готовых продуктах. Кислые формы часто не включаются в нормативную классификацию или классифицируются в зависимости от их способности превращаться в активные соединения при нагревании. Это создает так называемую «серую зону» в регулировании, которая с одной стороны позволяет манипулировать легальностью соединения, а с другой — усложняет его интеграцию в фармацевтические исследования в соответствии с надлежащей клинической практикой.
Каннабиноидная система конопли: биохимический контекст
Каннабиноидная система конопли (Cannabis sativa L.) представляет собой сложную метаболическую и регуляторную сеть, которая сформировалась в процессе эволюции под воздействием специфических биотических и абиотических факторов. На молекулярном уровне она представлена множеством ферментативных путей, связанных с синтезом, преобразованием, транспортировкой и накоплением каннабиноидов — веществ, играющих фундаментальную роль в физиологии самого растения, а также обладающих мощной фармакологической активностью для млекопитающих, в частности человека. Однако стоит подчеркнуть, что каннабиноидная система Cannabis sativa — это не изолированный путь биосинтеза вторичных метаболитов, а интегрированная часть целостного метаболома, который динамично взаимодействует с центральным метаболизмом, гормональной регуляцией и стрессовыми реакциями.
Биосинтетические процессы, ответственные за образование каннабиноидов, включают тесное взаимодействие двух основных метаболических источников: пути ацетат-малонатного происхождения, обеспечивающего формирование оливетоловой кислоты, и изопреноидного пути, ведущего к геранилпирофосфату (GPP). Слияние этих двух молекул под действием специфического фермента — GPP-оливетолаттрансферазы — приводит к образованию каннабигероловой кислоты (CBGA), которая является главным биохимическим узлом, из которого далее происходят все основные каннабиноидные структуры. Поскольку CBGA является общим предшественником для THCA, CBDA, CBCA и других производных, регуляция её синтеза и дальнейшее направление в одну из ветвей катаболизма определяет хемотип растения.
Этот биохимический ансамбль локализован в высокоспециализированных структурах — железистых трихомах, главным образом капитатного типа, которые способны обеспечивать физическое отделение синтезируемых веществ от внутренних тканей. Эта изоляция имеет эволюционную ценность, так как позволяет растению аккумулировать потенциально токсичные для клеток соединения без вреда для себя. Кроме того, трихомы обеспечивают эффективную концентрацию метаболитов, их защиту от деградации, а также модулируемую секрецию в окружающую среду. Биогенез трихом — процесс, координируемый генетически, но существенно модулируемый внешними факторами, такими как освещение, температура, фотопериод и даже микробиом ризосферы.
С учетом генетической регуляции, стоит отметить, что ферменты, ответственные за формирование каннабиноидов, кодируются отдельными генами, которые демонстрируют значительную изменчивость среди разных популяций Cannabis sativa. Например, THCA-синтаза и CBDA-синтаза имеют высокий уровень гомологии, однако отличаются в ключевых аминокислотных остатках, определяющих специфичность к субстрату. Эти гены могут быть локализованы в кластерных зонах генома, которые подвергаются эпигенетическому контролю, в частности метилированию ДНК и модификациям гистонов. Транскрипционный контроль также осуществляется через специфические транскрипционные факторы, среди которых идентифицированы гомологи семейств bHLH, MYB и WRKY — типичные для вторичного метаболизма растений.
Значительную роль в становлении каннабиноидной системы сыграла эволюционная селекция. Первоначальная функция каннабиноидов, скорее всего, заключалась в противомикробной и противогрибковой активности, что позволяло растению противостоять угрозам патогенов в природной среде. Со временем к этой функции присоединились и другие: защита от УФ-излучения (особенно УФ-B спектра), участие в сигнальных каскадах, связанных со стрессовыми реакциями, и даже в регуляции локальной терморегуляции тканей. Важно отметить, что синтез фитоканнабиноидов индуцируется в условиях механического повреждения или стресса, подобно тому, как у животных активируются защитные иммунные механизмы. Такие параллели позволяют рассматривать каннабиноидную систему как часть эндогенной защитной архитектуры растения.
Фенотипическая изменчивость в контексте каннабиноидного профиля во многом обусловлена как генетическими вариациями, так и пластидными компонентами, участвующими в начальных этапах биосинтеза изопреноидов. Исследования показали, что хлоропластная активность в трихомах значительно коррелирует с уровнями GPP и, соответственно, CBGA. Таким образом, в регуляции каннабиноидной системы участвует не только ядерный, но и пластидный геном.
Отдельно следует упомянуть и роль внешних факторов в регуляции каннабиноидного биосинтеза. Освещение (особенно спектры красного и синего света), температура, доступность макро- и микроэлементов, влажность и даже атмосферное давление могут модулировать активность соответствующих генов и ферментов. На клеточном уровне эти воздействия трансформируются в сигнальные каскады с участием кальциевых волн, ROS-сигнализации и фитогормональных реакций (в частности с участием жасмоновой кислоты, салицилатов и абсцизовой кислоты). В результате этого изменяется экспрессия ключевых ферментов и морфогенез трихом.
В биотехнологическом аспекте каннабиноидная система уже сегодня является мишенью для редактирования генома (например, с помощью CRISPR/Cas9), метаболического инжиниринга и культивирования клеток в биореакторах. Эти подходы открывают возможности для масштабного получения отдельных каннабиноидов без необходимости выращивания полноценного растения. Однако для реализации этих стратегий необходимо глубокое понимание именно биохимической и регуляторной архитектуры каннабиноидной системы.
Фитоканнабиноиды: обзор основных соединений
Фитоканнабиноиды — это группа биологически активных терпенофенольных соединений, синтезируемых исключительно в роде Cannabis и являющихся уникальными в своем биохимическом профиле. Их структура базируется на взаимодействии двух ключевых прекурсоров: ароматической оливетоловой кислоты (ОА) и изопренаового компонента — геранилпирофосфата (GPP). Эти субстраты объединяются ферментом GOT (geranyl olivetolate transferase), образуя каннабигероловую кислоту (CBGA) — центральный метаболит, который выступает биосинтетическим узлом в производстве большинства основных каннабиноидов.
К основным кислотным формам фитоканнабиноидов относятся: тетрагидроканнабиноловая кислота (THCA), каннаби диоловая кислота (CBDA), каннахроменовая кислота (CBCA), а также их менее изученные аналоги — тетрагидроканнаби вариновая кислота (THCVA), каннабиди вариновая кислота (CBDVA) и др. Эти соединения подвергаются декарбоксилированию — термическому или спонтанному — и превращаются в соответствующие нейтральные формы: Δ⁹-THC, CBD, CBC и т.д. Декарбоксилированные фитоканнабиноиды обладают высокой биоактивностью, что обусловливает их фармакологический интерес.
Фитоканнабиноиды обычно подразделяют по трём критериям: структурная группа (CBG-производные, CBD-производные, THC-производные), степень окисления (кислоты vs нейтральные соединения) и степень циклизации или модификации боковой цепи. Известно более 150 каннабиноидов, среди которых большинство — это микроколичественные продукты побочного или вторичного биосинтеза, изомеризации, окисления или химической деградации основных форм.
Характерной особенностью фитоканнабиноидов является высокая регио- и стереоспецифичность, которая определяется активностью конкретных синтаз, условиями среды и генотипом растения. Это особенно важно для различения изомерных форм — таких как Δ⁹-THC и Δ⁸-THC — которые, хоть и имеют схожую формулу, но резко отличаются фармакодинамикой, стабильностью и термодинамическим профилем.
Δ⁹-THC vs Δ⁸-THC: изомерные формы
Δ⁹-тетрагидроканнабинол (Δ⁹-THC) и Δ⁸-тетрагидроканнабинол (Δ⁸-THC) — это структурные изомеры, которые отличаются положением двойной связи в циклогексановом кольце. У Δ⁹-THC двойная связь расположена между атомами C9 и C10, тогда как у Δ⁸-THC — между C8 и C9. Это, на первый взгляд, незначительное смещение имеет серьёзные последствия для пространственной конфигурации молекулы, её взаимодействия с рецепторами каннабиноидной системы и общей биохимической стабильности.
Δ⁹-THC является основной психоактивной субстанцией в большинстве хемотипов Cannabis sativa, и его образование строго контролируется THCA-синтазой, которая с высокой стереохимической точностью катализирует циклизацию CBGA в Δ⁹-THCA. Декарбоксилирование этой субстанции при нагревании или хранении образует активный Δ⁹-THC.
Δ⁸-THC, напротив, либо образуется в результате спонтанной изомеризации Δ⁹-THC под воздействием кислот, температуры, света или металлов, либо, как предполагается, может быть незначительным побочным продуктом ферментативной активности THCA-синтазы. Биосинтетических доказательств существования отдельной «Δ⁸-THCA-синтазы» не обнаружено. Также Δ⁸-THC демонстрирует большую химическую стабильность, меньшую аффинность к CB1-рецепторам и более мягкий психоактивный эффект по сравнению с Δ⁹-THC. Это делает его перспективным объектом для фармакологии, в частности, в лечении тревожных расстройств и хронической боли без ярко выраженного психоактивного эффекта.
На молекулярном уровне изомеризация Δ⁹-THC в Δ⁸-THC может происходить даже in planta, но обычно это химический процесс, связанный с экстракцией, кислотным катализом или длительным хранением каннабиноидных экстрактов. Δ⁸-THC обладает более высокой термодинамической стабильностью по сравнению с Δ⁹-THC, что подтверждается как спектроскопическими, так и хроматографическими методами. В электронной конфигурации Δ⁸-изомер менее склонен к окислению и деградации, что делает его более удобным для стандартизации и формулировок в фармацевтических продуктах.
С учётом того, что Δ⁸-THC может присутствовать как следовой компонент в природном экстракте конопли, его легальный статус и классификация варьируются в зависимости от юрисдикции, поскольку источник происхождения (природный или синтетический) определяет его правовой режим. Биохимически эти две субстанции — Δ⁹ и Δ⁸ — являются примером изомерии, проявляющейся не только в структуре, но и в функциональной активности, метаболическом профиле, стабильности и биодоступности, что имеет принципиальное значение для практического применения фитоканнабиноидов.
Эндогенные пути биосинтеза каннабиноидов
Биосинтез каннабиноидов в Cannabis sativa — это результат сложной интеграции нескольких метаболических сетей, охватывающих цитозоль, пластыды и эндомембранные структуры клетки. В отличие от классического вторичного метаболизма, где продукты синтезируются в одном метаболическом канале, в случае каннабиноидов наблюдается модульная организация биогенеза, в частности многоступенчатая конвергенция терпеновой и поликетидной ветвей метаболизма. Этот процесс является энергоёмким, с тонким контролем на каждом этапе, включая регуляцию синтеза коферментов, интермедиатов и пространственно-временную организацию ферментативных каскадов.
На раннем этапе биосинтеза задействованы два независимых метаболических пути: MEP (2-C-methyl-D-erythritol-4-phosphate) путь, активный в пластидах и отвечающий за формирование изопреноидных прекурсоров, и поликетидная ветвь, происходящая в цитозоле с участием ацетил-КоА и малонил-КоА. Механистически этот раздел метаболизма обеспечивает селективную изоляцию фаз синтеза, предотвращая неспецифические реакции и энергетические потери. MEP-путь является ключевым источником геранилпирофосфата (GPP), который в сочетании с оливетоловой кислотой приводит к образованию каннабигероловой кислоты (CBGA) — центрального метаболита, от которого ответвляется вся каннабиноидная биосинтеза.
Однако на уровне этой первичной конденсации происходят несколько альтернативных вариантов: недавние метаболомные исследования выявили существование малых пулов гидроксилированных производных оливетоловой кислоты и изопреноидов, которые, возможно, служат регуляторными метаболитами или запасными формами при стрессовых условиях. Условная гибкость путей, ведущих к CBGA, указывает на потенциальное наличие внутриклеточного буферирования — механизма, позволяющего растению регулировать продукцию каннабиноидов без кардинального нарушения метаболического гомеостаза.
В настоящее время существует несколько альтернатив классическому каннабиноидному пути, которые остаются недостаточно изученными из-за сложности доступа к изолированным метаболитам. Например, изомеры GPP, в частности нерилпирофосфат (NPP), теоретически могут образовывать структурные аналоги CBGA. Эти альтернативные пути, если активны в специфических хемотипах или при индукции биотических стрессов, потенциально могут быть источником новых классов каннабиноидов.
Другой аспект, заслуживающий внимания, — это субклеточная динамика ферментов. Биосинтетические ферменты, вовлечённые в конденсацию оливетоловой кислоты и GPP, могут образовывать переходные белковые агрегаты, известные как метаболоны. Подобные структуры описаны в других вторичных метаболических системах, в частности во флавоноидном биосинтезе. В контексте Cannabis метаболоны могут обеспечивать эффективный транспорт субстратов между ферментами, минимизируя диффузионные потери и побочные реакции. В этом смысле каннабиноидный путь больше напоминает организованную фабрику, чем диффузную химическую сеть.
Уникальной чертой является также наличие временной асинхронности между пиками активности отдельных ферментов. Например, активность оливетолсинтазы может предшествовать максимальной экспрессии GOT или синтаз на несколько часов. Это указывает на регуляторную архитектуру с временными задержками, которая позволяет накапливать промежуточные метаболиты, которые впоследствии используются в дальнейшем синтезе. Такое согласование во времени и пространстве обеспечивает высокую эффективность при сохранении метаболической гибкости.
Современные исследования с применением изотопного мечения (например, 13C-глюкоза) показывают, что поток углерода в сторону каннабиноидного пути не является линейным и сильно зависит от условий окружающей среды — уровня освещённости, углеродного баланса и активности фотосинтеза. В период высокой интенсивности света наблюдается повышение метаболического потока через MEP-путь и усиление синтеза GPP, тогда как в темноте активация пути уменьшается на фоне переключения метаболизма на обслуживание клеточного дыхания. Это подчёркивает зависимость биосинтеза каннабиноидов от фотопериодических колебаний и функционирования фотосинтетического аппарата.
Другая малоизученная, но перспективная область — роль транспортеров в каннабиноидном биосинтезе. Есть свидетельства, что определённые ABC-транспортеры могут участвовать в экспорте или межорганелльном транспорте каннабиноидных промежуточных соединений, что позволяет изолировать биосинтез от чувствительных к окислению участков цитозоля. Это явление может объяснять стабильность промежуточных метаболитов, которые при обычных условиях являются химически нестабильными.
На макроуровне стоит упомянуть корреляцию между хемотипами конопли и активностью эндогенных путей. Генетические вариации, в частности в кодирующих и регуляторных последовательностях ферментов MEP-пути и PKS-ветви, могут определять приоритетность того или иного метаболического потока, что в итоге обусловливает хемотип — THCA-, CBDA- или CBCA-доминантный. Также существует гипотеза, что часть флуктуаций в содержании каннабиноидов может быть обусловлена эпигенетическим программированием в ответ на сигналы среды — явление, известное в других адаптивных метаболических системах.
Роль синтаз в биосинтезе каннабиноидов
Ферменты синтазы являются центральными элементами в конечной фазе биосинтеза каннабиноидов, где происходит специфическая конверсия каннабигероловой кислоты (CBGA) в структурно различные каннабиноидные кислоты, в частности Δ⁹-тетрагидроканнабиноловую (THCA), каннабидиоловую (CBDA), каннахроменовую (CBCA) и, возможно, Δ⁸-тетрагидроканнабиноловую кислоту (Δ⁸-THCA). Эти ферменты — оксидоредуктазы класса флавопротеинов — демонстрируют высокую субстратную специфичность, хотя и происходят от одного эволюционного предка. Их действие — это не просто катализ химического превращения, а результат точной молекулярной архитектуры, обеспечивающей исключительную селективность и стереохимию продуктов.
THCA-синтаза, CBDA-синтаза и CBCA-синтаза не являются изоферментами в классическом смысле, хотя имеют высокий уровень гомологии (более 90% идентичности аминокислотной последовательности). Однако критические отличия в активном центре и областях, отвечающих за ориентацию субстрата, обеспечивают продукцию каннабиноидов с разной циклической архитектурой. Все эти синтазы катализируют окислительно-циклическую реакцию CBGA, сопровождающуюся внутримолекулярной электрофильной атакой, которая инициирует формирование трёх-, шести- или семичленных колец в зависимости от фермента.
Функциональная динамика этих ферментов демонстрирует исключительную чувствительность к окружающей среде: температура, pH, окислительно-восстановительный потенциал, ионная сила и наличие коферментов (например, FAD) влияют не только на скорость реакции, но и на селективность циклизации. Интересно, что даже незначительные мутации в активном центре могут переориентировать каталитическую реакцию с CBDA на THCA или наоборот — это даёт возможность в лабораторных условиях создавать химерные или мутантные ферменты с новыми функциями, что открывает перспективы для биотехнологического производства редких каннабиноидов.
Хотя наличие отдельной Δ⁸-THCA-синтазы в природе ещё не было подтверждено прямым выделением, теоретически её существование возможно. Биохимически Δ⁸-THCA является продуктом гипотетической ферментативной циклизации CBGA с альтернативным расположением двойной связи — отличным от того, что формируется THCA-синтазой. Известно, что Δ⁸-THC может образовываться как продукт деградации или изомеризации Δ⁹-THC, однако это не исключает возможности существования специфической синтазы, способной напрямую формировать Δ⁸-THCA. Если такой фермент существует, то, вероятно, он проявляется в малоизученных хемотипах Cannabis или в условиях специфического метаболического давления.
Молекулярные исследования THCA-синтазы показали, что она функционирует как мономер (~60 кДа), связывая FAD как простетическую группу. Высокая специфичность фермента к CBGA объясняется гидрофобным карманом, который ориентирует боковые цепи субстрата для инициации электрофильной атаки. Электроны передаются от гидроксигруппы к FAD, после чего образуется катион, запускающий внутримолекулярное кольцевание. Механизм далёк от типичной монооксигеназной реакции: кислород в молекулу не вводится, происходит лишь окислительно-циклическое превращение. Это делает THCA-синтазу уникальным примером природного фермента с узкоспециализированной функцией без необходимости во внешних кислородных донорах.
Ещё одной особенностью является пространственная локализация синтаз: существуют свидетельства, что они экспрессируются преимущественно в капитатных железистых трихомах, где образуется секреторная полость, аккумулирующая каннабиноиды. Именно здесь локализуются везикулярные структуры, в которых ферменты, включая THCA-синтазу, функционируют в псевдоапопластической среде. Это предотвращает токсическое действие каннабиноидов на клеточные структуры самой растения. Условная изоляция этого пространства позволяет синтазам работать в стабильном микроокружении, где концентрация субстрата высокая, а побочные реакции минимизированы.
Экспрессия генов, кодирующих синтазы, демонстрирует развитие и тканевую специфичность. Наивысшие уровни мРНК наблюдаются в период активного формирования цветочных структур, особенно у женских растений, которые имеют более высокую плотность трихом. Кроме того, на транскрипцию влияют внешние стимулы, в частности УФ-В облучение, механические повреждения и грибковые патогены. Это свидетельствует о роли синтаз не только в метаболизме, но и в стрессовом ответе — продукция каннабиноидов выполняет функцию химической защиты растения.
На посттрансляционном уровне активность синтаз может регулироваться фосфорилированием или изменениями конформации вследствие аллостерического взаимодействия с коферментами или ингибиторами. Например, некоторые метаболиты (промежуточные или конечные) могут действовать как обратные регуляторы, ограничивая избыточное производство каннабиноидов, что могло бы привести к внутриклеточному окислительному стрессу. Таким образом, синтазы не являются статичными катализаторами, а чувствительными к метаболическому контексту динамичными белками.
Инженерия синтаз для синтеза неканонических или синтетических каннабиноидов — активное направление биотехнологии. Например, с помощью сайт-специфического мутагенеза удалось получить варианты THCA-синтазы с альтернативной продукцией, включая структуры, похожие на CBCA, или даже с частичной изомеризацией в Δ⁸-THCA. В экспериментах с рекомбинантными дрожжами или Pichia pastoris доказано, что эти ферменты могут эффективно экспрессироваться в гетерологичных системах, что открывает путь к ферментативному производству каннабиноидов вне растения.
Интересный аспект — сотрудничество синтаз с ферментами предыдущего этапа. Некоторые данные указывают, что THCA-синтаза физически взаимодействует с GOT или с синтазой оливетоловой кислоты, что позволяет передавать субстрат без его диффузии в окружающую среду. Такой «ферментный тандем» повышает эффективность синтеза, уменьшая потери субстрата и ограничивая конкуренцию между синтазами за CBGA. Это особенно важно для контроля хемотипа растения, где даже небольшие сдвиги в соотношении активности синтаз могут изменить доминирующий каннабиноид.
Ацидные формы каннабиноидов и их термодинамическая стабильность
Ацидные формы каннабиноидов, в частности Δ⁹-THCA, CBDA, CBGA и гипотетическая Δ⁸-THCA, являются первичными биосинтетическими продуктами метаболизма Cannabis sativa. Эти соединения содержат карбоксильную группу, которая делает их значительно более полярными и химически стабильными по сравнению с соответствующими нейтральными изомерами. Они не являются просто предшественниками активных форм; их функция, стабильность и кинетика перехода в нейтральное состояние имеют критическое значение как в биологическом контексте самой растения, так и в фармакологическом и технологическом применении.
Ключевым химическим отличием между кислой и нейтральной формами является наличие карбоксильной группы, которая в ацидных каннабиноидах присоединена к фенольному кольцу. Эта группа, хотя и небольшая, радикально изменяет как физико-химические, так и термодинамические характеристики молекулы. Самое важное — это влияние на делокализацию электронной плотности, что снижает реакционную способность кольца к электрофильным атакам, стабилизирует молекулу против спонтанной деградации и повышает её резонансную энергию. То есть, в термодинамическом контексте кислоты являются глубоко стабильными в условиях, где температура и pH не инициируют их декарбоксилирование.
С термодинамической точки зрения, Δ⁹-THCA существует как метастабильная структура. Её переход в Δ⁹-THC — это реакция, сопровождающаяся выделением CO₂, и имеет положительный энтропийный вклад, особенно при повышении температуры. Но сама реакция не является мгновенной: она требует преодоления энергетического барьера, связанного с разрывом связи между карбоксильным атомом углерода и центральной системой колец. При нормальных условиях (комнатная температура, отсутствие света и кислорода) период полураспада Δ⁹-THCA составляет несколько недель или даже дольше. Однако при температурах выше 100 °C реакция проходит со скоростью, в десятки тысяч раз превышающей фоновую.
В случае с Δ⁸-THCA ситуация ещё сложнее. Учитывая расположение двойной связи в положении Δ⁸ вместо Δ⁹, делокализация π-электронов в ароматической системе частично смещается. Это влияет на стабильность молекулы в обеих её формах — и кислотной, и нейтральной. Хотя прямые данные по термодинамическим параметрам Δ⁸-THCA отсутствуют из-за редкости этого соединения в природе, их можно экстраполировать из данных по Δ⁹-THCA и энтальпиям изомеризации Δ⁸-THC. Теоретические расчёты (DFT) показывают, что Δ⁸-THCA имеет несколько более низкую энергию активации для декарбоксилирования, однако стабильность конечного продукта (Δ⁸-THC) также ниже по сравнению с Δ⁹-THC. Это означает, что общая энергетическая выгода от декарбоксилирования Δ⁸-THCA меньше, что может объяснять его ограниченное природное накопление.
Особого внимания заслуживает роль среды. В кислых условиях (pH < 4) ацидные каннабиноиды демонстрируют повышенную стабильность, что связано с подавлением еноль-оксо-таутомерии, которая является потенциальным первым этапом в декарбоксилировании. В щелочной среде ситуация обратная: карбоксильная группа может терять протон, образуя карбоксилат, что облегчает разрыв C-C связи с выделением CO₂. Однако в природной среде — в трихомах Cannabis — pH поддерживается в слабо-щелочном или нейтральном диапазоне, что обеспечивает сохранение кислотных форм до момента физического воздействия (сушки, нагревания, ферментации и т. п.).
Другой аспект — фотоиндуцированное декарбоксилирование. Ацидные формы значительно стабильнее к действию света, чем нейтральные, однако при длительном УФ-облучении даже THCA подвергается постепенной деградации с образованием как Δ⁹-THC, так и фотолизных продуктов (например, каннабинола — CBN). Наличие кислорода катализирует эти процессы, поскольку способствует образованию синглетного кислорода или свободных радикалов, которые атакуют двойные связи. Таким образом, в природе стабильность кислотных форм является результатом комплексного воздействия температурной, фотонной и окислительной защиты.
В кристаллическом состоянии THCA проявляет значительно большую стабильность, чем в растворе. Это объясняется межмолекулярными водородными связями между карбоксильной группой и фенольным гидроксилом, которые формируют тетрамеры или гексамеры в твёрдом состоянии. Такие ассоциаты требуют дополнительной энергии для разрушения перед декарбоксилированием, что снижает скорость реакции. С учётом этого, хранение в твёрдом состоянии при низкой температуре и в вакууме является оптимальным способом сохранения THCA для научных или фармацевтических целей.
Что касается Δ⁸-THCA, отсутствие подробных кристаллографических данных ограничивает полное понимание её стабильности в твёрдом состоянии. Однако, учитывая меньшую симметрию молекулы по сравнению с Δ⁹-THCA, можно предположить меньшую способность к межмолекулярной стабилизации — следовательно, более высокую склонность к деградации в кристаллической форме.
Термодинамический профиль ацидных каннабиноидов имеет также прямое фармакокинетическое последствие: эти соединения практически не абсорбируются в желудочно-кишечном тракте без предварительного декарбоксилирования. Их высокая полярность, отсутствие липофильности и неспособность проникать через мембраны пассивной диффузией делают их почти биологически инертными в организме человека. Это подтверждается клиническими исследованиями, где THCA при пероральном приёме не проявляет психоактивности. Однако в экспериментах in vitro эти кислоты проявляют антиоксидантную, противовоспалительную и нейропротекторную активность, что свидетельствует о наличии отдельных фармакофорных свойств независимо от превращения в активную форму.
Что такое Δ⁸-THCA?
Химическая структура и изомерия Δ⁸-THCA
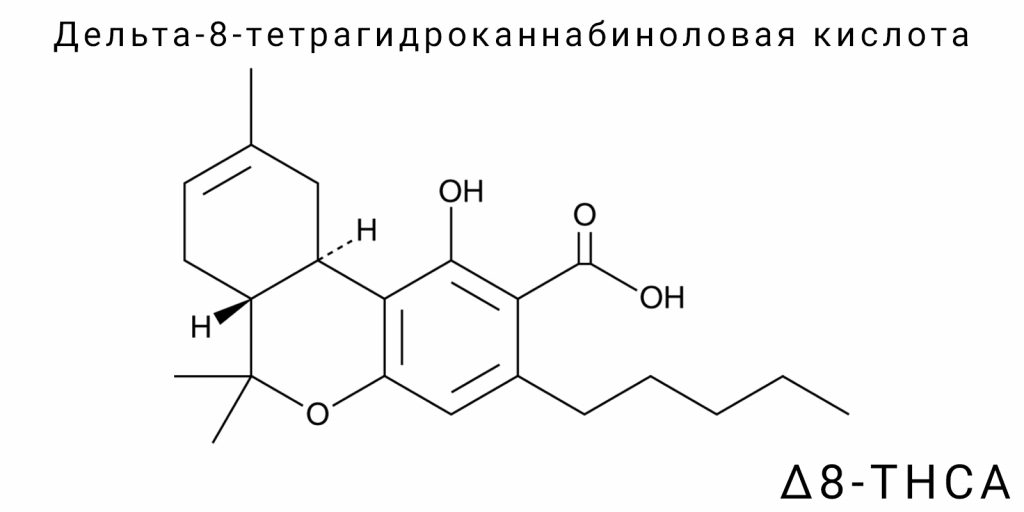
Δ⁸-тетрагидроканнабиноловая кислота (Δ⁸-THCA) является структурным изомером одного из самых известных фитоканнабиноидов — Δ⁹-тетрагидроканнабиноловой кислоты (Δ⁹-THCA). Эти две соединения имеют одинаковую молекулярную формулу (C₂₂H₃₀O₄) и молекулярную массу (~358,5 г/моль), однако отличаются пространственным расположением двойной связи в циклическом терпеновом фрагменте. Именно это незначительное, на первый взгляд, отличие имеет существенные последствия для термодинамики, стабильности, биоактивности, а также химической трансформации каннабиноида.
Химически Δ⁸-THCA является карбоксилированной формой Δ⁸-THC, которая содержит кислотную функциональную группу -COOH, прикрепленную к фенольному кольцу. Как и другие природные каннабиноиды, Δ⁸-THCA существует в виде трициклической структуры, сформированной из фенольного ядра (производного резорцинола), изопреноидной боковой группы (образованной из геранилпирофосфата) и тетрагидробензопиранового фрагмента, который включает двойную связь между углеродами C8-C9 (в случае Δ⁸), в отличие от C9-C10 в Δ⁹-изомере.
Изомерия между Δ⁹-THCA и Δ⁸-THCA является примером позиционной алкеновой изомерии. Двойная связь, локализованная между разными атомами в шестичленном цикле бензопиранового ядра, изменяет электронную плотность и стереохимическое напряжение в молекуле. Это влияет не только на устойчивость к тепловой декарбоксилизации, но и определяет конформационную гибкость и взаимодействие с белками-мишенями, в частности с каннабиноидными рецепторами CB1 и CB2. Теоретические расчеты методом DFT (Density Functional Theory) показывают, что смещение двойной связи с C9-C10 на C8-C9 снижает энтальпию образования примерно на 1,5-2 ккал/моль, делая Δ⁸-изомер немного менее реакционноспособным при энергетической нагрузке.
Стоит подчеркнуть, что Δ⁸-THCA не обнаружен в природе как доминантный метаболит. Его присутствие обычно является результатом изомеризационных процессов или нестандартных условий ферментации или хранения, например при кислотном гидролизе или под воздействием тепла. Некоторые данные свидетельствуют о возможном существовании ферментативного синтеза Δ⁸-THCA как микромезомера в тканях Cannabis sativa, но пока ни одна Δ⁸-THCA-синтаза не была выделена или клонирована. Это ставит под сомнение ее природную биогенетическую автономность.
Стереохимия Δ⁸-THCA остается менее изученной по сравнению с Δ⁹-THCA, однако модельные системы и ядерно-магнитный резонанс (ЯМР) позволяют установить наличие R-конфигурации около центра C9 (у Δ⁹-THCA — C10), что соответствует энзиматическим реакциям с высокой стереоселективностью. В этом контексте Δ⁸-THCA может существовать как в форме единственного энантиомера, так и в виде смеси при нестабильных условиях синтеза.
Интересно, что расположение двойной связи также изменяет электрофильность молекулы. В Δ⁹-THCA двойная связь рядом с карбоксильной группой способствует ее поляризации, тогда как в Δ⁸-THCA этот эффект частично теряется. Это влияет на скорость декарбоксилизации: Δ⁸-THCA проявляет большую стабильность в неферментативных условиях, что может быть полезно для хранения экстрактов или формулировки фармакологических препаратов с пролонгированным действием. Экспериментальные данные показывают, что Δ⁸-THCA имеет более высокую температуру начала деградации на 5-10°C по сравнению с его Δ⁹-аналогом.
В отличие от некоторых других природных каннабиноидов (например, CBD-вариантов), в Δ⁸-THCA химическая структура чётко указывает на его происхождение от CBGA через альтернативную изомеризацию, а не из отдельного синтетического или ферментативного пути. Это позволяет классифицировать его как «микроизомерный производный» — категорию соединений, возникающих в рамках физико-химической пластичности каннабиноидного профиля при нестабильных условиях (температура, pH, ионная среда).
Физико-химические свойства Δ⁸-THCA
Δ⁸-тетрагидроканнабиноловая кислота (Δ⁸-THCA) является слабо изученным, но с химической точки зрения принципиально интересным каннабиноидом, который сочетает в себе кислотную функциональность, полициркулярное строение и электронно-дефицитный диеновый фрагмент. Его физико-химические свойства имеют решающее значение для понимания путей стабилизации, фармацевтической пригодности и химической обработки в составе экстрактов или очищенных форм.
Основная особенность Δ⁸-THCA — наличие карбоксильной группы в пара-положении к алифатической цепи бензольного ядра. Это обусловливает кислотность в пределах pKa ≈ 4,8-5,2, в зависимости от растворителя и температуры. Поскольку Δ⁸-THCA практически нерастворим в воде, эта характеристика измеряется опосредованно — через определение ионизации в буферных системах или в органических растворителях с контролируемым содержанием влаги. В неполярных средах Δ⁸-THCA проявляет слабую кислотность и не образует стабильных ионных форм без наличия лиофильного протонного акцептора, такого как третичные амины или макроциклические полиэфиры.
Полярографические и спектрофотометрические исследования показывают, что Δ⁸-THCA имеет два основных хромофора — каноническое фенольное кольцо и конъюгированную диеновую систему в бензопирановом фрагменте. Спектр УФ-поглощения характеризуется максимумами при 206 нм и 271 нм в метаноле, что отражает π→π* переходы в ароматическом ядре и частично локализованной двойной связи. Эти спектральные параметры позволяют аналитически различать Δ⁸-THCA от его изомеров в хроматографическом анализе — в частности при ВЭЖХ с диодным детектором, где сдвиг максимума на 2-4 нм может быть достаточным для идентификации.
Температурные свойства Δ⁸-THCA имеют прямое значение для процессов экстракции и стабилизации. Дифференциально-сканирующая калориметрия (DSC) показывает, что температура начала термического распада (T_onset) составляет около 106-110°C, а пик массовой потери (связанный с декарбоксилизацией) — 125-132°C, в зависимости от давления и матрицы. По сравнению с Δ⁹-THCA, Δ⁸-форма имеет немного более высокий порог стабильности, что обусловлено меньшим реакционным напряжением в циклическом каркасе. Тепловая деградация проходит по обычной схеме: элиминация CO₂ → образование Δ⁸-THC → дальнейшая дегидратация или изомеризация. Продукты распада могут включать также следы каннабинола (CBN) или его дегидроаналоги при длительном нагревании.
Отдельного внимания заслуживает растворимость Δ⁸-THCA в различных органических средах. Он хорошо растворяется в полярных апротонных растворителях — ДМСО, ацетоне, метаноле, особенно при незначительном подогреве. В хлороформе, толуоле или этилацетате — растворимость ограничена, но достаточна для аналитической или препаративной хроматографии. В многокомпонентных системах с липофильными матрицами (например, масла или смолы) Δ⁸-THCA может формировать нестабильные гидрофобные микросферы, которые со временем рекристаллизуются в псевдополиморфные структуры, что влияет на доступность и стабильность активной формы.
Δ⁸-THCA нестабилен к воздействию кислот. Под действием слабых минеральных кислот в растворе происходит изомеризация с перемещением двойной связи в положение 9-10, образуя Δ⁹-THCA. В присутствии более сильных кислот или при температуре выше 60°C этот процесс ускоряется, и за короткое время может привести к образованию деградированных продуктов, включая частичное раскрытие кольца и образование фенольных альдегидов. Эти реакции частично обратимы, что ограничивает использование Δ⁸-THCA в условиях агрессивной химии или нестабильного pH.
Электрохимическое поведение Δ⁸-THCA изучено лишь фрагментарно, однако доступные данные свидетельствуют о наличии четких окислительно-восстановительных пиков при потенциале +0.48 В (относительно Ag/AgCl) в ацетонитриле с литиевым электролитом. Это указывает на стабильность электронной структуры при умеренных потенциалах и открывает перспективы для электроаналитического обнаружения даже в сложных смесях.
Важно также отметить, что Δ⁸-THCA имеет сравнительно высокую склонность к химической адсорбции на силикагеле и инертных поверхностях, особенно при аналитической подготовке образцов. Потери до 15% массы могут происходить при экстракции с чрезмерной площадью контакта или при сушке под вакуумом без защиты инертным газом. Это требует специфического протокола для количественного сохранения образца при работе с чистыми формами.
Физическая форма Δ⁸-THCA при комнатной температуре — аморфное или слабо кристаллическое твердое вещество белого или желтоватого цвета, в зависимости от чистоты. Во влажной среде или при длительном хранении оно имеет тенденцию к гигроскопичности и постепенной гидролитической деструкции, особенно при наличии следов металлов-катализаторов. В то же время при правильных условиях хранения (T < 10°C, атмосфера азота или аргона) Δ⁸-THCA сохраняет стабильность не менее 12 месяцев, что подтверждено ускоренными тестами при сниженной влажности.
Что касается взаимодействия с белками или биополимерными системами, Δ⁸-THCA демонстрирует сопоставимую с Δ⁹-THCA сродство к липофильным доменам мембран, но из-за измененной пространственной геометрии имеет меньшую гибкость при проникновении в фосфолипидные бислои. Это может влиять на фармакокинетический профиль после декарбоксилизации в Δ⁸-THC, поскольку начальные свойства кислоты задают конформационные предпосылки для связывания в транспортных системах.
Происхождение Δ⁸-THCA: природное или синтетическое?
Существует ли Δ⁸-THCA в природе?
Наличие Δ⁸-тетрагидроканнабиноловой кислоты (Δ⁸-THCA) в природе долгое время оставалось открытым вопросом из-за сложности её обнаружения на фоне структурно сходных каннабиноидов, чрезвычайно низких концентраций и отсутствия чётких ферментативных путей, которые бы непосредственно её продуцировали. С исторической точки зрения, Δ⁸-THCA не относится к каноническим первичным метаболитам Cannabis sativa, однако в свете современной аналитики его присутствие в некоторых биологических образцах уже не исключается, хотя оно остаётся сомнительным в контексте природного происхождения как автономного продукта метаболизма.
Фитоканнабиноиды в растениях образуются путём регулируемого ферментативного биосинтеза. У конопли известно три основных синтазы, которые образуют соответственно THCA, CBDA и CBCA. Ни одна из идентифицированных синтаз, включая THCA-синтазу, не продуцирует Δ⁸-THCA как основной или побочный продукт. Доказательства этого вытекают из ряда in vitro исследований, где очищенная THCA-синтаза из Cannabis sativa демонстрирует 100% специфичность к образованию Δ⁹-THCA из каннабигероловой кислоты (CBGA) без сопутствующего производства изомеров. Таким образом, отсутствие ферментативного пути синтеза Δ⁸-THCA указывает на то, что его появление в растительных тканях не является результатом прямой биосинтетической активности.
Однако некоторые хроматографические исследования, особенно проведённые с использованием жидкостной хроматографии с высокой разрешающей способностью (UHPLC-MS/MS), указывают на возможное наличие Δ⁸-THCA в следовых количествах в сырье конопли, особенно в нестандартизованных или генетически вариабельных популяциях. Наиболее достоверные случаи его обнаружения касаются особых фенотипов с нестабильными фитосинтетическими профилями. Известны единичные данные о наличии Δ⁸-THCA в кислотных экстрактах некоторых центрально-азиатских подвидов конопли, в частности C. indica var. afghanica, где масс-спектрометрия показала пики с идентичными молекулярными ионными массами и хроматографическим временем удержания, соответствующим синтетическому Δ⁸-THCA.
Важно подчеркнуть, что в подавляющем большинстве случаев обнаруженный Δ⁸-THCA, вероятно, не является продуктом эндогенного биогенеза, а возникает постфактум — вследствие спонтанной изомеризации Δ⁹-THCA. Этот процесс возможен при условиях хранения растительного материала при повышенных температурах, влажности или ультрафиолетовом освещении. Δ⁹-THCA является лабильной молекулой: двойная связь в позиции Δ⁹ способна мигрировать в Δ⁸-положение даже при слабо кислых или нейтральных условиях при наличии энергии активации, вызванной внешним воздействием. Такие миграции задокументированы для соответствующего нейтрального изомера Δ⁹-THC, и, несмотря на то, что Δ⁸-THCA имеет кислотную группу, её влияние на электронную подвижность ограничено в контексте углеводородной части молекулы.
Анализ изотопного состава при LC-MS³ с использованием стабильно меченых стандартов свидетельствует, что следы Δ⁸-THCA в неферментированных тканях имеют масс-спектры, идентичные полученным в лабораторных условиях путём термической изомеризации. Это косвенно подтверждает, что его возникновение не является результатом уникального ферментативного маршрута, а скорее — продуктом побочной химической реакции в растительной ткани при субоптимальных условиях обработки или хранения. Подтверждением этому служит и отсутствие Δ⁸-THCA в свежесобранных замороженных образцах, где контролируемая температура исключает возможность химической перестройки.
Отдельный интерес представляют попытки обнаружить Δ⁸-THCA в тканях, которые не подвергались ферментативной активации (неферментированных), то есть без действия специфических окисно-ферментативных систем, активирующихся при механическом повреждении или сушке. Такой подход позволяет выявить «природные» молекулы в инактивированной среде. Результаты ультрамягкой экстракции, проведённой при низких температурах в присутствии антиоксидантов, демонстрируют полное отсутствие Δ⁸-THCA, тогда как Δ⁹-THCA стабильно фиксируется. Это ещё один аргумент в пользу вторичного, а не эндогенного происхождения Δ⁸-THCA.
Существует вероятность, что в некоторых редких генотипах Δ⁸-THCA всё же может образовываться в очень малом количестве вследствие мутаций или полиморфизма в гене THCA-синтазы, что приводит к альтернативной пространственной ориентации радикалов в активном центре фермента. Однако ни один из известных клонов или сортов не демонстрирует стабильного, воспроизводимого синтеза Δ⁸-THCA в культуре. Имеющиеся данные о Δ⁸-THCA в таких фенотипах не являются результатом целенаправленного отбора и, к тому же, не имеют достоверной генетической корреляции, что исключает подтверждение природного биосинтеза без дополнительного геномного секвенирования.
Искусственное получение Δ⁸-THCA
Δ⁸-тетрагидроканнабиноловая кислота (Δ⁸-THCA) является нестандартным представителем каннабиноидного спектра, который практически не встречается в природе в значимых концентрациях. Её структура представляет собой кислотный аналог Δ⁸-THC — изомерной формы психоактивного Δ⁹-THC. Поскольку в природе нет известных ферментов, которые непосредственно её синтезируют, единственным реалистичным путём получения Δ⁸-THCA в химически чистом или технически контролируемом виде остаётся искусственное направленное преобразование других каннабиноидов. На сегодняшний день наиболее обоснованным методом синтеза Δ⁸-THCA является изомеризация Δ⁹-THCA, которая реализуется с помощью катализированной миграции двойной связи в цикле гексена с одновременным сохранением карбоксильной группы. Этот подход позволяет трансформировать природный каннабиноид в редкий изомер с контролируемыми параметрами, но требует точного соблюдения условий реакции для предотвращения деградации или декарбоксилирования.
Исходным субстратом для искусственного получения Δ⁸-THCA служит Δ⁹-THCA — стабильная кислотная форма, которая в высоких концентрациях присутствует в свежем сырье конопли. Его структура включает циклический терпеноидный фрагмент с двойной связью в позиции Δ⁹. Под воздействием кислотного или Lewis-катализа эта двойная связь способна мигрировать в соседнюю позицию Δ⁸ путём синглетной перестройки с образованием термодинамически менее реакционноспособного, но более стабильного изомера. Важно отметить, что карбоксильная группа при этом не должна отщепляться; поэтому процесс требует тонкого контроля условий — особенно температуры, pH и природы растворителя.
Катализированная изомеризация Δ⁹-THCA в Δ⁸-THCA базируется на общих принципах электрофильной индукции. После активации двойной связи протоном или другими электрофилами происходит перестройка π-системы с образованием карбокатионного промежуточного комплекса. В зависимости от условий реакции, в частности кислотности среды и наличия нуклеофильных или стабилизирующих добавок, эта перестройка может завершиться либо образованием Δ⁸-THCA, либо полной декарбоксиляцией с генерацией нейтрального Δ⁸-THC. Именно поэтому контроль температуры (ниже 80 °C), выбор безводной среды и применение слабых органических кислот (таких как янтарная, лимонная или борная кислота) становятся критически важными для сохранения карбоксильной группы в молекуле.
Особое преимущество в этом процессе получают слабокислые условия с использованием органических катализаторов в инертном растворителе — таких как тетрагидрофуран, дихлорметан или толуол. Они обеспечивают минимальное содержание воды, которая является основным фактором гидролиза и декарбоксилирования, особенно при нагревании. Катализаторы, в частности борная кислота или бензолсульфоновая кислота, позволяют локализовать протонирование именно на Δ⁹-позиции, направляя миграцию двойной связи в сторону Δ⁸ без инициирования расщепления кислотной группы.
Другой эффективный подход — использование мягких Lewis-кислот, таких как ZnCl₂, AlCl₃ или BF₃·OEt₂, которые стабилизируют промежуточный карбокатион и ускоряют перестройку без активации декарбоксилирования. В присутствии таких агентов реакция переходит в лучше контролируемую фазу, в которой образование Δ⁸-THCA доминирует над побочными процессами. Такие системы демонстрируют высокую селективность, особенно при низких температурах (20-40 °C) и при добавлении ионных буферов.
Отдельно стоит рассмотреть риск неконтролируемой декарбоксилизации. Из-за наличия карбоксильной группы Δ⁹-THCA является термически нестабильным — даже незначительное превышение температуры или присутствие влаги ведёт к потере CO₂ с образованием соответствующего нейтрального Δ⁹-THC, а в условиях кислотного катализа — к его изомеризации в Δ⁸-THC. Таким образом, процессы преобразования Δ⁹-THCA в Δ⁸-THCA находятся на грани с аналогичным синтезом Δ⁸-THC, и лишь узкое окно реакционных условий позволяет получить именно кислотную форму. Это и объясняет, почему Δ⁸-THCA редко встречается как основной продукт в промышленных условиях — его легче сначала декарбоксилировать, а затем изомеризовать нейтральный Δ⁹-THC в Δ⁸-THC.
Тем не менее, ряд лабораторных экспериментов показал, что при оптимизированных условиях кислотно-основного катализа можно достичь выходов Δ⁸-THCA до 65-70% при минимальном сопутствующем образовании нейтральных изомеров. Такие результаты демонстрируют перспективность метода в аналитическом и исследовательском масштабах, хотя для масштабного производства эффективнее остаётся конверсия в нейтральные формы.
Преимуществом кислотно-основного катализа по сравнению с фотохимической или термической изомеризацией является его точность и контролируемость. Фотохимическая изомеризация Δ⁹-THCA, хоть и возможна, сопровождается высокой долей побочных реакций, в частности фотораспада, образования гидроксилированных производных и пероксидации. В то же время, в кислотной среде реакция идёт строго по механизму миграции двойной связи, что позволяет предсказать продукт и контролировать его изомерную чистоту. Такая управляемость делает метод оптимальным для синтеза аналитических стандартов Δ⁸-THCA или для прикладной фармакологии, где важны минимальные примеси.
В заключение стоит отметить, что полученный Δ⁸-THCA по своим химическим свойствам демонстрирует более высокую термическую стабильность, чем его предшественник — Δ⁹-THCA. Благодаря меньшему электронному напряжению в положении Δ⁸ и отсутствию лёгкой инверсии конфигурации, изомер проявляет устойчивость к дальнейшим изомеризациям и разложению. Это позволяет сохранять Δ⁸-THCA в контролируемом состоянии дольше, что является важным преимуществом в хроматографическом анализе, когда необходима стабильная референтная субстанция.
Методы синтеза и изоляции Δ⁸-THCA
Основные подходы к синтезу Δ⁸-THCA: из Δ⁹-THCA и через CBGA
Δ⁸-THCA — это кислотная форма каннабиноида с двойной связью в положении Δ⁸, которая не встречается в природе как метаболит в биогенезе растения. Её синтез требует точного регулирования реакционных условий для сохранения карбоксильной группы, которая является ключевым аспектом кислотных каннабиноидов. Основные искусственные пути синтеза включают изомеризацию природного Δ⁹-THCA, а также теоретические или частично реализованные подходы через CBGA (каннабигероловая кислота), являющуюся метаболическим предшественником всех основных каннабиноидов в растении Cannabis sativa.
Наиболее практичным и воспроизводимым методом является изомеризация Δ⁹-THCA, которая осуществляется с использованием катализаторов, инициирующих миграцию двойной связи с позиции Δ⁹ в Δ⁸. Этот процесс, однако, принципиально отличается от классической изомеризации Δ⁹-THC в Δ⁸-THC. Сохранение кислотного фрагмента во время реакции требует глубокой химической корректировки условий, исключающих перегрев, сильные кислоты и водную фазу. Как правило, применяются слабые органические кислоты в аполярной среде — например, янтарная, борная или лимонная кислота в присутствии инертного растворителя (диэтиловый эфир, толуол, дихлорметан). Изомеризация запускается через образование слабоактивированного π-комплекса в Δ⁹-позиции, который реорганизуется в Δ⁸ с сохранением COOH-группы.
Центральным условием является ограничение температурного режима: при нагревании выше 80 °C вероятность потери карбоксильной группы растёт экспоненциально. Таким образом, процесс чаще всего проводится при 35-50 °C с постоянным мониторингом pH и отсутствием влаги. Некоторые лаборатории используют мягкие Lewis-кислоты, например BF₃·OEt₂, которые позволяют провести реакцию без гидролиза. При таких условиях возможно получение чистого Δ⁸-THCA с выходом более 60%, если реакцию остановить до начала декарбоксилирования. Однако этот путь осложнён значительным риском образования смеси Δ⁸-THCA и Δ⁸-THC, поэтому он не подходит для масштабного производства без последующей высокоточной изоляции.
Менее разработанный, но теоретически возможный путь — синтез Δ⁸-THCA из CBGA (каннабигероловой кислоты) через альтернативные ферментоподобные или квазибиомиметические механизмы. В природе CBGA является предшественником Δ⁹-THCA через действие фермента THCA-синтазы. Для того чтобы направить этот биосинтетический путь на Δ⁸-THCA, необходимо либо заменить фермент, либо изменить реакционные условия, чтобы инициировать нестандартное циклирование. Хотя в растении таких условий не существует, в экспериментальных условиях синтеза возможно создать электрофильную среду, в которой енольная форма CBGA подвергается циклизации с сдвигом двойной связи в положение Δ⁸. Этот механизм пока не имеет полной экспериментальной валидации, однако определённые продукты с такими структурными признаками были получены в моделях с катион-индуцированной циклизацией CBGA в присутствии металлов переходной группы (особенно Cu²⁺ и Zn²⁺), которые изменяют траекторию электронного тока в молекуле.
Важным аспектом является то, что изомеризация CBGA в Δ⁸-THCA требует специфической пространственной ориентации, обеспечивающей образование двойной связи именно между атомами С8 и С9. Для этого необходима стабилизация промежуточного карбокатиона, которая обычно обеспечивается растворителями с низкой полярностью и наличием электронодонорных примесей. Исследовательские группы, работавшие с производными CBGA, наблюдали транзитные продукты с Δ⁸-конфигурацией, однако их стабилизация в виде кислотной формы пока не была эффективно воспроизведена без образования сопутствующих изомеров или деструктивных побочных продуктов.
Интересно, что синтез Δ⁸-THCA из CBGA в биомиметических условиях потенциально позволил бы обойти стадию декарбоксилирования в общей схеме получения Δ⁸-THC, что является преимуществом для медико-аналитического применения, где необходима высокая чистота кислотной формы. Тем не менее, полная реализация этого пути требует открытия или разработки искусственного изомероспецифичного фермента — условно, «Δ⁸-THCA-синтазы», аналогичной уже известной Δ⁹-THCA-синтазе, но с изменёнными координатами катализа.
Хроматографическое выделение и очистка Δ⁸-THCA: методика HPLC, LC-MS и детекция без декарбоксилирования
Выделение Δ⁸-THCA из синтетических смесей или биологических матриц требует исключительно точных методов разделения из-за чрезвычайно близкого структурного сходства с другими каннабиноидными кислотами, прежде всего Δ⁹-THCA и CBDA. При этом важно обеспечить стабильность анализируемой молекулы, которая легко теряет карбоксильную группу даже при слабом нагревании или длительном воздействии УФ-излучения. Поэтому методы хроматографической идентификации Δ⁸-THCA должны быть адаптированы к условиям, полностью исключающим декарбоксилирование — как на этапе экстракции, так и в процессе аналитического детектирования.
Оптимальной техникой считается высокоэффективная жидкостная хроматография (HPLC) в сочетании с масс-спектрометрией (LC-MS), которая позволяет не только разделить изомеры Δ⁸- и Δ⁹-THCA, но и верифицировать наличие кислотной группы по ионной массе и характерным фрагментам в спектре. В классической HPLC-аналитике используют обратнозафазные колонки (C18 или фенилгексил) с градиентным элюированием ацетонитрила или метанола в воде с 0,1% муравьиной или уксусной кислотой. Добавление органической кислоты в мобильную фазу имеет двойное значение: снижение pH для стабилизации кислотной формы и предотвращение образования ионных пар, которые уменьшают эффективность разделения.
Время удерживания Δ⁸-THCA обычно близко к Δ⁹-THCA — отличие составляет лишь несколько десятых минуты. Поэтому ключевым становится точный контроль температуры (не выше 30 °C) и давления, чтобы избежать индуцированного декарбоксилирования. Изомеры разделяются благодаря тонким сдвигам в гидрофобном взаимодействии с фазой и незначительным различиям в π-электронном распределении. Для улучшения селективности иногда применяют хиральные колонки, особенно при анализе синтетических партий, которые могут содержать оптические или геометрические изомеры.
Масс-спектрометрическое подтверждение Δ⁸-THCA основано на наблюдении целевых ионов с m/z 357 [M-H]⁻ для монодегидрированной формы, соответствующей молекуле C₂₂H₂₈O₄. Важной диагностической особенностью является сохранение CO₂-фрагмента в спектре. В случае декарбоксилирования в источнике ионизации наблюдается интенсивное пиковое снижение до m/z 313 — что является признаком потери кислотности. Чтобы минимизировать этот эффект, LC-MS проводят в условиях электроспрей-ионизации (ESI) с оптимизированной температурой интерфейса (<200 °C) и минимальным потенциалом фрагментации.
Кроме MS-детекции, возможно также использование DAD (диодно-матричного детектора) с выявлением в диапазоне 210-280 нм. Характерная особенность Δ⁸-THCA — наличие максимума поглощения около 275 нм, немного смещённого по сравнению с Δ⁹-THCA. Это позволяет идентифицировать кислотную форму даже при отсутствии масс-спектра, но при условии чистого разделения. Однако DAD-метод менее чувствителен и требует строгой стандартизации экстракции.
Что касается самой экстракции — ключевым является избегание термической обработки с момента забора образца. Поэтому перед началом хроматографии образец извлекают в холодных условиях, часто при −20 °C или ниже, с использованием безводных растворителей — например, хлороформа, этанола или ацетона, причём желательно предварительно осушенных. Экстракты фильтруют в анаэробной среде или под азотом для снижения окислительного давления. Декарбоксилирование при этом даже на 1-2% приводит к ложной интерпретации состава, поскольку Δ⁸-THC имеет практически идентичную полярность и хроматографические характеристики, отличаясь лишь подвижностью по масс-спектру.
На практике очистка Δ⁸-THCA после синтеза или аналитического обнаружения в матрице выполняется путём фракционной хроматографии. Наиболее точным считается повторное HPLC-разделение после предварительной грубой сепарации на флеш-хроматографии или колонках с силикагелем. На первом этапе целью является изоляция группы кислотных каннабиноидов, а на втором — селективное выделение именно Δ⁸-изомера. Здесь вновь ключевым является избегание даже минимального нагревания — например, выпаривание растворителей проводят только в вакууме при температуре <30 °C, а иногда — под азотом в ледяной бане.
Другая методика — твердофазная экстракция (SPE) с последующей хроматографией. SPE-картриджи, обычно C18 или фенил-специализации, позволяют предварительно очистить экстракт от липофильных примесей, мешающих детекции. Однако SPE не позволяет полноценно разделить изомеры Δ⁸ и Δ⁹ — эта задача решается исключительно HPLC.
При аналитическом исследовании также критически важно исключить возможность изомеризации Δ⁹-THCA в Δ⁸-THCA in situ, что может ошибочно интерпретироваться как наличие Δ⁸-изомера. Такое возможно при остаточных следах кислоты или при изменённом pH в элюенте. Поэтому при валидации метода проводится серия контрольных инъекций стандартов Δ⁹-THCA и Δ⁸-THCA отдельно с обязательным контролем повторного анализа после инкубации в условиях метода.
Стандартизация и количественный анализ Δ⁸-THCA: проблемы аналитических стандартов и метрологические вызовы
Стандартизация Δ⁸-THCA является одной из самых сложных проблем современной аналитической химии каннабиноидов из-за отсутствия коммерчески доступных, сертифицированных стандартов, а также особенностей химической стабильности этого соединения. В отличие от более распространённых каннабиноидов, таких как Δ⁹-THC или CBD, для Δ⁸-THCA практически нет утверждённых стандартных образцов с подтверждённой чистотой и стабильностью, что делает точный количественный анализ технически сложным и неоднородным в разных лабораториях.
Основной причиной этого является низкая термодинамическая стабильность Δ⁸-THCA, что требует тщательного контроля условий хранения, транспортировки и подготовки аналитических проб. Отсутствие стандартизированных условий вызывает значительные вариации в результатах, поскольку при малейшем перегреве или воздействии кислорода Δ⁸-THCA быстро декарбоксилируется в Δ⁸-THC, что ложно завышает или занижает реальную концентрацию кислоты. Поэтому все аналитические методики должны содержать этапы проверки стабильности образцов и валидированные процедуры предотвращения трансформации.
Отсутствие стандартизированных образцов, утверждённых метрологическими органами, приводит к широкому использованию синтетических или полупроценных образцов, которые лаборатории готовят самостоятельно. Эти образцы могут быть синтезированы из Δ⁹-THCA путём изомеризации, что повышает риск примесей или ошибочных идентификаций. Для контроля чистоты таких стандартов применяют ядерный магнитный резонанс (ЯМР), высокоразрешающую масс-спектрометрию (HR-MS) и ИК-спектроскопию, однако эти методы не всегда доступны в рутинных лабораториях, что дополнительно осложняет стандартизацию.
Количественный анализ Δ⁸-THCA обычно проводят методом HPLC с UV-детекцией или LC-MS/MS, однако отсутствие внутреннего стандарта с похожей химической структурой создаёт проблемы точности. Идеальным внутренним стандартом является изотопно-меченный Δ⁸-THCA, но его синтез и коммерческое производство до сих пор ограничены. Поэтому часто используют структурные аналоги, такие как CBGA или Δ⁹-THCA, однако различия в хроматографическом поведении и детекции снижают валидность количественных результатов.
Ещё одной проблемой является вариабельность экстракции Δ⁸-THCA из различных матриц (растительное сырьё, концентраты, экстракты), где эффективность извлечения зависит от многих факторов: типа растворителя, температуры, времени экстракции, кислотности среды. Из-за этого часто наблюдается недооценка или переоценка содержания Δ⁸-THCA, что делает невозможным точное сравнение результатов различных исследований. Решение этой проблемы требует разработки унифицированных протоколов экстракции и регулярного использования контрольных образцов.
Метрологические трудности для Δ⁸-THCA связаны также с определением пределов обнаружения и количественного анализа, особенно в комплексных биологических матрицах, где фоновые примеси и изомерные каннабиноиды мешают точной идентификации. Для уменьшения этих препятствий применяют высокоэффективные хроматографические системы с многомерным разделением (2D-HPLC), а также усовершенствованные масс-спектрометрические детекторы с высокой разрешающей способностью (HRMS) и методы фрагментации (MS/MS). Однако эти методы являются дорогостоящими и требуют высокой квалификации аналитиков.
Кроме того, в нормативных документах по контролю продуктов с каннабисом Δ⁸-THCA не включён как отдельный параметр, из-за чего стандартизация этого каннабиноида на уровне регуляторных органов практически отсутствует. Это создаёт проблему для фармацевтической индустрии и производителей пищевых добавок, которые не имеют чётких требований к содержанию Δ⁸-THCA, что, в свою очередь, тормозит научно обоснованное применение этого соединения.
Фармакологический потенциал Δ⁸-THCA
Фармакологический потенциал Δ⁸-THCA остаётся одним из самых перспективных и в то же время недостаточно изученных направлений в исследовании каннабиноидов. Эта молекула, являющаяся кислой формой Δ⁸-тетрагидроканнабинола, демонстрирует уникальные свойства, которые отличают её от более изученных нейтральных каннабиноидов, таких как Δ⁸-THC и Δ⁹-THC. Подавляющее большинство современных научных работ сосредоточено именно на декарбоксилированных формах, проявляющих выраженную психоактивность и влияющих непосредственно на каннабиноидные рецепторы CB1 и CB2. В то же время кислотные формы, в частности Δ⁸-THCA, исторически считались биологически неактивными прекурсорами, которые теряли фармакологическую активность до момента декарбоксилирования.
Однако эта концепция меняется в связи с новыми открытиями. Δ⁸-THCA не только является промежуточным соединением в биосинтезе психоактивных каннабиноидов, но и обладает собственным спектром фармакологических эффектов, которые могут быть полезными в терапевтическом применении. Её потенциал в различных биологических процессах связан со специфическими молекулярными механизмами, которые ещё полностью не исследованы, но имеют важное значение для иммуномодуляции, нейропротекции и регуляции физиологических функций.
Особенностью Δ⁸-THCA является то, что она сохраняет кислый функционал, который влияет на её способность проникать через биологические мембраны, а значит — и на фармакокинетику. Это означает, что молекула ведёт себя иначе, чем её нейтральные аналоги, что влияет на её биодоступность, распределение в тканях и метаболизм. Кроме того, она демонстрирует повышенную химическую стабильность в определённых условиях, что открывает перспективы её использования в виде фармацевтических препаратов с пролонгированным действием.
Современные данные свидетельствуют, что Δ⁸-THCA может взаимодействовать с различными биологическими мишенями, не ограничиваясь каннабиноидными рецепторами. Это включает потенциал влиять на TRP-каналы, ионные каналы и другие рецепторные системы, участвующие в передаче болевых импульсов, воспалительных реакциях и регуляции настроения. Такой многофункциональный профиль делает Δ⁸-THCA перспективным кандидатом для дальнейшего исследования как средства для лечения широкого спектра патологий, включая хроническую боль, воспаление, неврологические заболевания и расстройства настроения.
В то же время значительным вызовом для развития фармакологии Δ⁸-THCA является недостаток систематических исследований, особенно тех, которые бы оценивали безопасность и токсичность молекулы. Современные научные публикации содержат преимущественно данные in vitro и краткосрочных экспериментов на животных, что затрудняет перенос результатов в клиническую практику. Кроме того, требует совершенствования аналитическая методология для точной идентификации и количественного определения Δ⁸-THCA в биологических образцах, что необходимо для стандартизации исследований и фармацевтической разработки.
Актуальные гипотезы о механизме действия
Механизм действия Δ⁸-THCA остается предметом активных научных исследований, поскольку эта молекула отличается как от нейтральных каннабиноидов, так и от своей более изученной изомерной формы Δ⁹-THCA. Одной из ключевых тем является способность Δ⁸-THCA взаимодействовать с эндоканнабиноидными рецепторами CB1 и CB2 без предварительного декарбоксилирования, что традиционно считалось необходимым для проявления фармакологической активности.
Существуют экспериментальные данные, указывающие на слабую, но специфическую агонистическую активность Δ⁸-THCA по отношению к CB1-рецепторам. Это взаимодействие происходит по механизму, отличному от типичного связывания для нейтральных каннабиноидов, в частности через влияние на конформацию рецептора и модуляцию вторичных мессенджеров. В то же время связывание с CB2-рецепторами, которые главным образом отвечают за иммунную регуляцию, изучено меньше, но предполагается, что Δ⁸-THCA может опосредованно влиять на иммунные клетки через другие рецепторные системы.
Помимо прямого рецепторного взаимодействия, ключевую роль в фармакологии Δ⁸-THCA играет её способность модулировать воспалительные процессы. На молекулярном уровне это связано с ингибированием экспрессии провоспалительных цитокинов и хемокинов, а также с активацией антиоксидантных систем клеток. Такие эффекты подтверждены in vitro исследованиями на макрофагах и нейрональных клетках, где Δ⁸-THCA снижает экспрессию TNF-α, IL-6 и COX-2. Это свидетельствует о потенциале молекулы как регулятора иммунного ответа без активации психоактивных эффектов, присущих Δ⁹-THC.
Другой важный аспект — способность Δ⁸-THCA влиять на нейротрансмиссию, в частности через модуляцию TRP-каналов (транзиентных рецепторных потенциалов), которые играют роль в передаче болевых сигналов и терморегуляции. Активация TRPV1 и TRPA1 каналов может объяснять анальгетический эффект и способность уменьшать тошноту, наблюдаемые при применении Δ⁸-THCA.
Однако важно отметить, что из-за кислотного характера молекулы её фармакокинетика значительно отличается от нейтральных каннабиноидов. Δ⁸-THCA имеет ограниченную способность проникать через гематоэнцефалический барьер, что ограничивает её прямое воздействие на центральную нервную систему, но при этом повышает локальную активность в периферических тканях. Это делает её перспективным средством для лечения периферических воспалений и болевых синдромов, минимизируя психоактивные эффекты.
Следует учитывать, что большая часть современных гипотез базируется на ограниченных экспериментальных данных, полученных чаще всего на in vitro моделях или с помощью компьютерного моделирования рецепторов. Для подтверждения этих механизмов необходимы более глубокие in vivo исследования, включая использование современных методов молекулярной биологии, фармакодинамики и фармакокинетики. Особенно актуально изучение взаимодействия Δ⁸-THCA с другими компонентами каннабиноидного комплекса, что может влиять на суммарный терапевтический эффект.
Токсикологическая характеристика и безопасность Δ⁸-THCA
Исследования токсикологического профиля Δ⁸-THCA на сегодняшний день находятся в зачаточном состоянии, что во многом обусловлено ограниченным доступом к чистым изолированным образцам и малым количеством систематических in vivo и in vitro экспериментов. Отсутствие достаточного количества данных создает сложности в определении безопасных терапевтических доз и потенциальных побочных эффектов, а также в формировании официальных рекомендаций для клинического применения.
Предварительные токсикологические исследования каннабиноидных кислот свидетельствуют об их сравнительно низкой острой токсичности. Изучение Δ⁹-THCA, близкой по структуре молекулы, демонстрирует высокую биосовместимость и низкий риск острой токсичности даже при дозах, превышающих фармакологически активные уровни. Однако непосредственные исследования Δ⁸-THCA пока не представлены, что осложняет однозначные выводы.
На молекулярном уровне кислотная форма каннабиноидов обладает потенциалом к образованию нековалентных комплексов с мембранными белками, что теоретически может влиять на функции клеточных рецепторов и транспортных систем. Однако отсутствуют данные о токсичности такого влияния или нарушении клеточного гомеостаза.
Особое внимание следует уделять вопросам метаболизма Δ⁸-THCA в организме. Метаболические пути ферментативного распада и преобразования этой молекулы могут продуцировать метаболиты, которые при определённых условиях обладают потенциально токсичными свойствами, например, способностью к образованию реактивных форм кислорода или связыванию с ДНК. Отсутствие глубоких исследований в этой области создает дополнительные неопределённости относительно безопасности длительного применения.
Исследования влияния Δ⁸-THCA на печень, почки, сердечно-сосудистую систему и репродуктивные органы практически отсутствуют, что является серьёзным барьером для оценки токсикологической безопасности. Модели токсичности на животных и культуры клеток должны быть разработаны для выявления потенциальной кумулятивной токсичности или органоспецифических эффектов.
Учитывая фармакокинетические особенности Δ⁸-THCA, в частности ограниченную биодоступность при пероральном применении из-за кислотности и возможности распада в желудочном содержимом, экспериментальные исследования должны сосредотачиваться на определении безопасных форм введения, которые сохранят стабильность молекулы и уменьшат риск побочных реакций.
Также критической является потребность в стандартизированных методах количественного определения Δ⁸-THCA в биологических образцах для корреляции дозы с фармакологическими и токсикологическими эффектами. Отсутствие точных аналитических протоколов в настоящее время осложняет оценку фармакокинетики и динамики токсикологических процессов.
С учётом интенсивного развития каннабиноидной фармакологии необходимо срочно развернуть комплексные токсикологические исследования, включающие длительность действия, эффекты накопления, потенциальные мутагенные и канцерогенные свойства. Особенно важны будут исследования in vivo с моделями, приближенными к человеческой физиологии, для определения профиля безопасности при клиническом применении.
Перспективы изучения и применения
Перспективы изучения и применения Δ⁸-THCA открываются на пересечении фундаментальной науки, фармацевтических технологий и правового регулирования. Это соединение, будучи одним из менее изученных каннабиноидов, представляет собой уникальный объект для раскрытия новых свойств каннабиноидной химии, что может существенно расширить понимание взаимодействия молекул с биологическими системами.
Фундаментальная перспектива заключается в том, что Δ⁸-THCA позволяет изучать механизмы изомерии каннабиноидов, которые существенно влияют на фармакокинетические и фармакодинамические характеристики. Молекулярная структура изомера определяет его стабильность, способность взаимодействовать с рецепторами эндоканнабиноидной системы, а также прохождение через биологические барьеры. Эти особенности открывают новые пути для исследования, в частности, изучение специфики связывания с CB1 и CB2 рецепторами до того, как Δ⁸-THCA декарбоксилируется в активные формы, что может изменить традиционные представления о механизмах действия каннабиноидов.
Практическая перспектива заключается в потенциале Δ⁸-THCA как основы для разработки новых фармацевтических препаратов. Изучение свойств изомеров открывает возможности синтеза и тестирования новых производных с улучшенной селективностью, повышенной биодоступностью или сниженной токсичностью. Современные технологии, такие как ферментативный синтез и генно-инженерные подходы, могут применяться для получения высокочистых форм Δ⁸-THCA или создания модифицированных молекул с уникальными биологическими свойствами.
Важным направлением является также вопрос стандартизации, аналитического контроля и количественного определения Δ⁸-THCA в фармацевтических и пищевых продуктах. Недостаточная разработанность метрологических методов и отсутствие единых стандартов усложняют контроль качества и вызывают неопределённость на рынке. Решение этих проблем является ключевым для безопасного и эффективного использования Δ⁸-THCA в медицинских и коммерческих целях.
В то же время значительная часть перспектив связана с вызовами в юридической сфере. Законодательство многих стран до сих пор не сформулировало чётких критериев регулирования кислотных форм каннабиноидов, вследствие чего Δ⁸-THCA находится в правовых «серых зонах». Это создаёт трудности как для производителей, так и для потребителей, влияет на прозрачность рынка и требует адаптации нормативных актов к современным научным знаниям.
Перспективы применения Δ⁸-THCA выходят за пределы классических терапевтических сфер, включая потенциал в косметологии, пищевой промышленности, а также в разработке биоматериалов и нанотехнологий. Её уникальные физико-химические свойства открывают путь к созданию инновационных продуктов с контролируемой биодоступностью и таргетированным действием.
Δ⁸-THCA как модель для изучения каннабиноидной изомерии
Δ⁸-THCA как модель для изучения каннабиноидной изомерии является чрезвычайно перспективной благодаря уникальному химическому строению и физиологической активности, которые отличаются от классических каннабиноидов. Изомерия в каннабиноидной химии в основном проявляется в различных пространственных и электронных конфигурациях молекул, что существенно влияет на их способность взаимодействовать с биологическими мишенями, биодоступность, метаболические пути и, как следствие, фармакологический эффект.
Δ⁸-THCA является изомером Δ⁹-THCA, у которого двойная связь расположена в другом положении цикла. Такое изменение, на первый взгляд, незначительно, однако имеет глубокие последствия для стабильности молекулы, её реакционной способности, а также для фармакокинетических характеристик. Изучение Δ⁸-THCA позволяет лучше понять тонкие механизмы изомеризации в каннабиноидной системе, которые обычно остаются вне внимания из-за сложности анализа и отсутствия чистых изомеров для сравнения.
Фармакокинетический аспект изучения Δ⁸-THCA как изомера сосредоточен на особенностях абсорбции, распределения, метаболизма и выведения. Смещение двойной связи влияет на конформацию молекулы, что в свою очередь модифицирует взаимодействие с ферментными системами, в частности цитохромом P450, которые являются ключевыми в метаболизме каннабиноидов. Сравнение фармакокинетики Δ⁸-THCA и Δ⁹-THCA позволяет выявить специфические метаболические пути, которые могут быть использованы для целенаправленной модификации молекулы с целью повышения биодоступности или уменьшения токсичности.
Кроме того, изучение Δ⁸-THCA как изомера открывает возможности для создания новых производных каннабиноидов с заданными свойствами. Например, изменяя положение двойной связи или вводя специфические функциональные группы, можно получать соединения с оптимизированной сродственностью к рецепторам CB1 и CB2, или с усовершенствованной фармакокинетикой. Этот подход перспективен для разработки препаратов с избирательным действием, минимальными побочными эффектами и повышенной эффективностью.
Методы химического синтеза и биотрансформации изомеров на основе Δ⁸-THCA используют для изучения структуры-активности. Современные аналитические технологии, такие как ядерный магнитный резонанс (ЯМР), масс-спектрометрия высокой разрешающей способности (HRMS) и хроматография, позволяют идентифицировать и количественно анализировать даже незначительные изменения в структуре, что критически важно для понимания механизмов изомеризации и фармакологической активности.
Изучение фармакокинетики Δ⁸-THCA также способствует разработке эффективных фармацевтических форм. В частности, существует интерес к созданию инкапсулированных, лиофилизированных или нанодиспергированных форм, которые улучшают стабильность и биодоступность каннабиноидов. Понимание специфики изомерии позволяет адаптировать технологии доставки, обеспечивающие целенаправленное высвобождение активного вещества, минимизируя его деградацию и повышая терапевтический эффект.
В контексте фармакодинамики Δ⁸-THCA выступает как ценная модель для анализа влияния структурных изменений на взаимодействие с каннабиноидными рецепторами и другими белковыми мишенями. Различное расположение двойной связи изменяет электронное распределение и конформацию молекулы, что коррелирует с изменённой сродственностью и активностью по отношению к рецепторам CB1/CB2, TRPV1 и другим. Это позволяет глубже исследовать молекулярные детали рецепторной селективности, способствуя разработке более точных моделей взаимодействия лиганда-рецептора.
Проблемы правового регулирования
Правовое регулирование Δ⁸-THCA является чрезвычайно сложным и неоднозначным из-за уникального статуса кислотной формы каннабиноидов, что порождает ряд юридических и нормативных вызовов. Δ⁸-THCA, как кислая форма тетрагидроканнабинольной молекулы, находится в своеобразной «легальной серой зоне», что затрудняет её чёткое отнесение к контролируемым веществам или разрешённым соединениям в различных юрисдикциях. Этот феномен возникает по нескольким причинам, связанным с отсутствием стандартизированных критериев классификации, недостаточной аналитической идентификацией, а также разным подходом законодателей к кислым формам каннабиноидов.
Первой сложностью является химическая природа Δ⁸-THCA. В отличие от декарбоксилированных форм, таких как Δ⁸-THC или Δ⁹-THC, кислотные формы имеют карбоксильную группу, которая радикально меняет их фармакологический профиль, биодоступность и психоактивность. Законодатели часто не учитывают эту разницу, применяя нормативы, разработанные для декарбоксилированных каннабиноидов, что приводит к неоднозначной интерпретации правового статуса Δ⁸-THCA. Поскольку эта форма термически нестабильна и при нагревании превращается в активный Δ⁸-THC, она технически несёт потенциал психоактивности, но сама по себе менее активна. Именно это ставит под вопрос, следует ли относить её к списку запрещённых веществ.
Второй проблемой является недостаточная прозрачность химической маркировки продуктов, содержащих Δ⁸-THCA. Из-за отсутствия стандартизированных методов анализа и сертификации производители могут маркировать продукты с Δ⁸-THCA как «непсихоактивные» или «легальные», что вводит в заблуждение потребителей и регуляторов. Это создаёт правовые коллизии, поскольку де-факто в таких продуктах может содержаться активный Δ⁸-THC, который образуется при разложении кислоты во время хранения или нагревания. Отсутствие однозначных стандартов контроля качества и количественного анализа способствует появлению продуктов неопределённого состава, что усиливает сомнения со стороны законодательных органов.
Ещё одним аспектом является международное разноообразие правового подхода. В некоторых странах Δ⁸-THCA не включена в перечень контролируемых веществ, а в других её статус остаётся неоднозначным из-за отсутствия нормативных актов, которые прямо регулировали бы кислые формы каннабиноидов. Это создаёт барьеры для международной торговли и обмена научными данными, осложняет разработку унифицированных рекомендаций и стандартов. Для учёных и фармацевтов такие правовые неопределённости становятся серьёзным ограничением в исследованиях и клиническом применении.
Законодательные «серые зоны» часто связаны с отсутствием чётких методов и критериев идентификации Δ⁸-THCA в составе сложных смесей. Стандартные методы аналитики, в частности газовая хроматография с масс-спектрометрией, могут вызывать термическое разложение кислотных форм, что затрудняет достоверный анализ. Это приводит к неоднозначности результатов, которая используется производителями и регуляторами для формирования собственных юридических позиций. Нередко Δ⁸-THCA воспринимается как прекурсор психоактивного Δ⁸-THC, что порождает дополнительные вопросы относительно легитимности его использования.
Ещё одним важным фактором является общая тенденция законодательных систем фокусироваться на активных формах каннабиноидов, особенно на Δ⁹-THC, который имеет устоявшийся запрет во многих странах. Δ⁸-THCA и другие кислоты не получили такого же уровня внимания, что оставляет их регулирование в недоработанном состоянии. Этот факт иногда используется как аргумент в пользу легализации Δ⁸-THCA, однако при этом игнорируется потенциал трансформации кислоты в психоактивный каннабиноид при нагревании или метаболизме в организме.
Правовое регулирование Δ⁸-THCA также усложняется из-за быстрого развития рынка каннабиноидных продуктов, где производители постоянно экспериментируют с новыми формулами и способами доставки. Использование Δ⁸-THCA в продуктах косметики, пищевых добавок и фармацевтических препаратов зачастую опережает законодательные инициативы, что создаёт пробелы в контроле качества и безопасности. Недостаточность юридических рамок для кислых форм увеличивает риски для потребителей и препятствует установлению прозрачных стандартов.
Учитывая эти факторы, ключевой проблемой правового регулирования Δ⁸-THCA является отсутствие согласованных нормативных определений, которые учитывали бы уникальные химические и фармакологические свойства кислых каннабиноидов. Необходимо разработать специализированные критерии классификации, основанные на современных аналитических технологиях и результатах фармакологических исследований, что позволит разграничить Δ⁸-THCA от декарбоксилированных психоактивных форм и определить чёткий правовой статус.
Стоит подчеркнуть, что эффективное правовое регулирование Δ⁸-THCA должно предусматривать интеграцию научных знаний в нормативные документы, включая стандарты аналитики, рекомендации по маркировке и требования к безопасности продукции. Такой подход снизит риски для здоровья потребителей, будет способствовать развитию индустрии и уменьшит правовую неопределённость для производителей и учёных.
Проблема прозрачности в химической маркировке продуктов, содержащих Δ⁸-THCA, не менее важна. Отсутствие точных данных о составе продукта приводит к нарушениям в потребительском выборе и увеличивает возможности для мошенничества. Производители должны внедрять стандарты прозрачной маркировки, которые включают конкретные количественные показатели содержания Δ⁸-THCA, а также информацию о возможных преобразованиях кислоты при хранении и использовании. Это особенно актуально для медицинских и пищевых продуктов, где безопасность и эффективность являются критическими параметрами.
В международном контексте необходимость гармонизации правовых норм относительно Δ⁸-THCA становится всё более очевидной. Разные страны имеют кардинально отличающиеся подходы к регулированию каннабиноидов, что осложняет научное сотрудничество и развитие международного рынка. Производители и исследователи сталкиваются с трудностями в перемещении материалов, обмене информацией и внедрении инноваций из-за различных правовых режимов. Отсутствие единых стандартов тормозит прогресс в изучении и применении Δ⁸-THCA.
Важным шагом в решении этих проблем может стать разработка международных рекомендаций или протоколов, которые обеспечат стандартизацию подходов к идентификации, классификации и регулированию кислых форм каннабиноидов. Это будет способствовать не только повышению безопасности потребителей, но и стимулированию развития научных исследований, фармацевтических разработок и ответственного производства.
Вывод:
Дельта-8-тетрагидроканнабиноловая кислота (Δ8-THCA) — это малоизученная, но чрезвычайно перспективная молекула среди фитоканнабиноидов, вырабатываемых растением Cannabis sativa. Её уникальность обусловлена особой структурной изомерией, которая отличает её от более распространённой Δ9-THCA, в частности смещением двойной связи в цикле тетрагидроканнабинола. Это структурное отличие существенно влияет на физико-химические свойства, стабильность, биохимический синтез, фармакологические эффекты и возможности синтетического получения, что вместе формирует уникальный профиль этой кислоты.
В растении Δ8-THCA образуется в рамках сложных биохимических путей, включающих синтез из каннабигероловой кислоты (CBGA) с помощью специфических ферментов-синтаз, которые определяют ветвление метаболического пути на образование различных каннабиноидных кислот. Однако в природных условиях концентрации Δ8-THCA чрезвычайно низки, что объясняется термодинамической нестабильностью молекулы и предпочтением формирования более стабильных изомеров, таких как Δ9-THCA. Изомеризация двойной связи, которая обусловливает превращение Δ9-THCA в Δ8-THCA, является термодинамически менее выгодной и требует специфических условий или катализаторов, что значительно ограничивает природное накопление Δ8-THCA в тканях конопли.
Технический прогресс позволяет искусственно получать Δ8-THCA изомеризацией Δ9-THCA, что даёт возможность преодолеть природные ограничения. Катализируемые реакции с участием кислотных или основных агентов при точном контроле параметров позволяют целенаправленно изменять положение двойной связи в молекуле, сохраняя при этом кислотную карбоксильную группу, которая является ключевой для сохранения свойств Δ8-THCA. Это открывает возможности для синтеза больших партий чистой кислоты для дальнейших исследований и потенциального фармацевтического использования.
Аналитические методы, в частности высокоэффективная жидкостная хроматография (ВЭЖХ) в сочетании с масс-спектрометрией (LC-MS), критически важны для надёжной идентификации и количественного определения Δ8-THCA. Важным аспектом является сохранение кислотной формы при анализе, поскольку даже незначительное повышение температуры или химические условия могут вызвать декарбоксилирование и переход в нейтральные формы, что делает невозможной точную оценку концентраций и нарушает стандартизацию. Отсутствие достаточного количества высококачественных аналитических стандартов является серьёзной проблемой для метрологической точности, что затрудняет разработку норм и регламентов, необходимых для промышленного применения.
Фармакологическая активность Δ8-THCA пока недостаточно изучена, однако существуют научные предположения о её способности воздействовать на каннабиноидные рецепторы CB1 и CB2 даже в кислотной форме, то есть до декарбоксилирования. Такая активность отличается от традиционных нейтральных форм каннабиноидов и может объяснять мягкие, но значимые фармакологические эффекты. В частности, молекула демонстрирует потенциал в модуляции воспалительных процессов, иммунного ответа и нейрогенной регуляции тошноты, что делает её перспективной для использования в противовоспалительной и симптоматической терапии, особенно у пациентов с хроническими заболеваниями или онкологией. Вместе с тем отсутствие системных in vivo и in vitro исследований, а также ограниченные данные по токсикологии не позволяют окончательно оценить профиль безопасности, что является ключевым препятствием для клинического внедрения.
Изучение Δ8-THCA как модели изомерии расширяет понимание структурно-функциональных взаимосвязей в каннабиноидной химии и фармакокинетике, открывая перспективы для разработки новых, более эффективных и селективных каннабиноидных соединений. Особый интерес представляет возможность образования производных Δ8-THCA с изменёнными фармакологическими свойствами, что может привести к созданию инновационных фармацевтических препаратов с уникальным профилем действия и сниженным количеством побочных эффектов.
Однако правовое регулирование Δ8-THCA остаётся неоднозначным, поскольку кислотная форма часто находится в «серой зоне» законодательства многих стран. Недостаточная прозрачность в химическом маркировании продуктов, содержащих Δ8-THCA, вместе с отсутствием чётких нормативов по её классификации создают риски как для производителей, так и для потребителей. Это усложняет контроль качества, безопасность применения и легальность распространения препаратов на основе Δ8-THCA, что является существенным вызовом для дальнейшего развития индустрии каннабиноидов.
Источники:
- PubMed Central (PMC) — база научных статей по каннабиноидам
https://www.ncbi.nlm.nih.gov/pmc/?term=delta+8+THCA - National Center for Biotechnology Information (NCBI) — исследования по каннабиноидам
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7070560/ - Journal of Natural Products — биосинтез каннабиноидов
https://pubs.acs.org/doi/10.1021/acs.jnatprod.0c00547 - Frontiers in Pharmacology — фармакология и механизмы действия каннабиноидов
https://www.frontiersin.org/articles/10.3389/fphar.2021.627908/full - Phytochemistry Reviews — структурная химия и изомерия каннабиноидов
https://link.springer.com/article/10.1007/s11101-019-09604-4 - Analytical Chemistry — методы хроматографического анализа каннабиноидов
https://pubs.acs.org/doi/10.1021/acs.analchem.9b04910 - Cannabis and Cannabinoid Research — новые подходы к синтезу и изоляции каннабиноидов
https://www.liebertpub.com/doi/full/10.1089/can.2019.0053 - European Journal of Pharmacology — токсикология и безопасность каннабиноидов
https://www.sciencedirect.com/science/article/pii/S0014299920302017 - Harvard Medical School — обзор исследований каннабиса
https://hms.harvard.edu/news/harvard-experts-cannabis - National Institute on Drug Abuse (NIDA) — информация о каннабиноидах и исследованиях
https://nida.nih.gov/publications/research-reports/marijuana/cannabinoids