Δ⁹-цис-тетрагидроканнабинол (Δ⁹-cis-THC) является редким, но химически и фармакологически значимым стереоизомером одного из главных психоактивных компонентов конопли — Δ⁹-тетрагидроканнабинола. В системе природных фитоканнабиноидов, которые продуцируются Cannabis sativa L., стереоизомерия имеет решающее значение для биологической активности молекул. Δ⁹-THC имеет как минимум четыре стереоизомера, возникающих в результате конфигурации на хиральных центрах в тетрагидроканнабинольном каркасе. Из них самым известным является транс-изомер с конфигурацией (−)-(6aR,10aR)-Δ⁹-THC, тогда как цис-форма с конфигурацией (6aS,10aR) остаётся объектом лишь единичных исследований. Изучение этого изомера является необходимым этапом в системном анализе структурно-активностных взаимосвязей среди каннабиноидов.
Фитоканнабиноиды не являются классически биосинтезированными вторичными метаболитами в смысле высокой энзиматической стереоселективности. Современные исследования демонстрируют, что синтазы Δ⁹-THC в Cannabis sativa могут продуцировать смеси диастереомеров, в частности у технических (индустриальных) сортов с доминированием CBDA или CBGA. Это означает, что Δ⁹-cis-THC образуется не только в результате искусственной изомеризации в лаборатории, но может присутствовать в следах в растениях. Его присутствие в природном материале фиксируется с помощью высокочувствительных методов — жидкостной хроматографии в сочетании с масс-спектрометрией (LC-MS), а также ядерного магнитного резонанса (NMR).
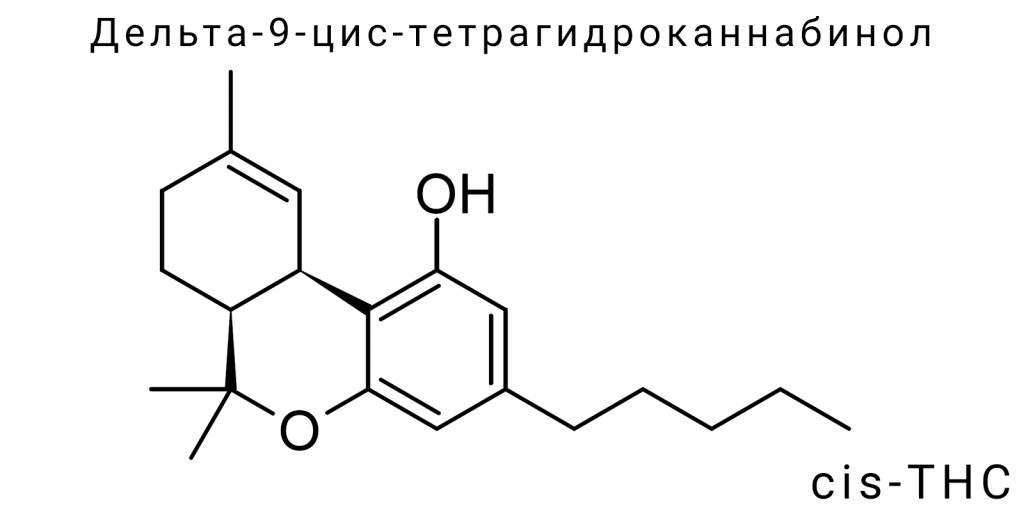
С химической точки зрения Δ⁹-cis-THC представляет собой циклическое тритерпеновое соединение, производное меротуэйновой кислоты, с характерной трициклической системой. Его молекулярная формула — C₂₁H₃₀O₂. Наиболее важными структурными элементами являются фенольное кольцо, терпеновая цепь и характерная двойная связь между C⁹ и C¹⁰. В случае цис-изомера пространственное расположение этой двойной связи и подгрупп вокруг хиральных центров создаёт особую конфигурацию, которая изменяет электронную плотность, объём молекулы и геометрию её взаимодействия с биомишенями.
Поскольку Δ⁹-cis-THC является стереоизомером, его получение в лабораторных условиях обычно связано с химическими методами, которые не дают высокой энантиоселективности без специфического катализа. Распространены два подхода: (1) прямая конденсация прекурсоров оливетола с терпеновыми альдегидами, такими как цитраль, или с терпеновыми эпоксидами — в частности, (+)-trans-2-карен оксидом — в присутствии кислотных катализаторов (например, BF₃·Et₂O); (2) кислотно-катализированная изомеризация более стабильных изомеров, таких как канабихромен (CBC), которая сопровождается перераспределением конфигурации двойной связи и хиральных центров. Оба подхода дают смесь диастереомеров, из которой Δ⁹-cis-THC необходимо очищать методом хроматографии. Синтетический выход обычно является умеренным, а стереоселективность требует дополнительных этапов очистки или кристаллизации.
Биологическое действие Δ⁹-cis-THC оценивается по его способности связываться с каннабиноидными рецепторами первого (CB1) и второго (CB2) типов. В отличие от trans-изомера, который является полным агонистом CB1 с высокой аффинностью, Δ⁹-cis-THC имеет значительно более низкую сродство к этому рецептору, что свидетельствует о слабом или частичном агонистическом действии. Это снижает его психоактивность и одновременно повышает его интерес как потенциального каннабиноида с терапевтическим профилем без центральных побочных эффектов. Исследования in vivo на моделях мышей показывают, что Δ⁹-cis-THC всё ещё способен индуцировать типичную каннабиноидную триаду эффектов (гипотермия, аналгезия, снижение активности), хотя с меньшей интенсивностью.
В настоящее время фармакокинетические профили Δ⁹-cis-THC остаются в значительной степени неизученными. Ожидается, что его липофильность, биодоступность и метаболические пути в печени с участием цитохрома P450 будут похожи на другие каннабиноиды. Однако стереохимия способна существенно влиять на скорость метаболического распада и формирование активных метаболитов, в частности 11-гидрокси-Δ⁹-THC — основного психоактивного метаболита. Вероятно, что Δ⁹-cis-THC метаболизируется медленнее или с образованием менее активных производных, что может быть благоприятным с точки зрения токсикокинетики.
В настоящее время Δ⁹-cis-THC не является объектом контроля как отдельное вещество в большинстве юрисдикций, включая списки ООН. Вследствие этого он может изучаться свободнее в рамках фундаментальной науки или фармакологических исследований. Однако, учитывая структурное сходство с Δ⁹-trans-THC, регуляторные органы могут интерпретировать его как аналог, что ставит под сомнение законность его оборота в зависимости от юрисдикции. В контексте медицинской конопли этот изомер не является стандартным компонентом, что вносит дополнительную неопределённость в разработку продуктов на его основе.
Изучение Δ⁹-cis-THC не только позволяет лучше понять тонкости каннабиноидной фармакологии, но и может способствовать созданию новых терапевтических средств. Его потенциал как нефулльного агониста CB1/CB2 рецепторов может быть релевантен для состояний, где требуется умеренная модуляция эндоканнабиноидной системы — в частности, при хронической боли, спастичности, нейровоспалении или тревожных расстройствах. В сочетании с другими каннабиноидами или как отдельное вещество, Δ⁹-cis-THC открывает возможности для создания более контролируемых, таргетированных фармацевтических форм без сильного психоактивного действия.
Химическая структура и стереохимия Δ⁹-cis-THC
Δ⁹-цис-тетрагидроканнабинол (Δ⁹-cis-THC) является одним из стереоизомеров Δ⁹-тетрагидроканнабинола, основной психоактивной составляющей каннабиса. Его уникальность заключается в специфическом пространственном расположении атомов вокруг хиральных центров и двойной связи, образующих так называемую «цис»-конфигурацию. Этот стереоизомер отличается от природного активного транс-изомера (−)-(6aR,10aR)-Δ⁹-THC, который доминирует в большинстве хемотипов Cannabis sativa L.
Химически Δ⁹-cis-THC является трициклическим терпенофенолом, производным канабигероловой кислоты (CBGA), которая является общим биосинтетическим предшественником для многих фитоканнабиноидов. Молекулярная формула Δ⁹-THC остается постоянной для всех его стереоизомеров: C₂₁H₃₀O₂, молекулярная масса — 314.46 г/моль. Разница заключается в пространственном расположении атомов в молекуле, в частности вокруг хиральных центров в положениях C6a и C10a тетрагидроканнабинольного скелета.
В Δ⁹-cis-THC эти хиральные центры имеют конфигурацию (6aS,10aR), тогда как у активного транс-изомера — (6aR,10aR). Это влияет на геометрию кольца и позицию метильной и пентильной групп, что определяет способность молекулы связываться с каннабиноидными рецепторами. Структурная формула предусматривает наличие одного фенольного гидроксила (в положении 1), алифатической пентильной боковой группы (в положении 3), двойной связи между атомами C9-C10 и терпенового фрагмента, замкнутого в тетрагидроканнабинольное кольцо.
Стереоизомеры, и в частности диастереомеры Δ⁹-THC, отличаются не только пространственно, но и по физико-химическим характеристикам: температуре плавления, оптическому вращению, растворимости, хроматографической подвижности. В контексте Δ⁹-cis-THC эти параметры позволяют отделить его от других форм с помощью хиральной ВЭЖХ (высокоэффективной жидкостной хроматографии) или тонкослойной хроматографии с использованием специализированных растворителей.
С синтетической точки зрения Δ⁹-cis-THC можно получить несколькими способами. Первый подход заключается в кислотно-катализированной конденсации оливетола с цитралем, которая дает смесь изомеров Δ⁹-THC, среди которых присутствует и цис-изомер. Альтернативно, реакция оливетола с (+)-trans-2-карен-оксидом в присутствии BF₃·Et₂O может привести к преимущественному образованию именно Δ⁹-cis-THC. Также возможно получение через изомеризацию канабихромена (CBC), который циклизуется в Δ⁹-изомеры в присутствии борфтористого эфира. Все эти методы требуют дальнейшей хроматографической очистки, так как продукты обычно являются смесями транс/цис-диастереомеров.
Помимо химического синтеза, цис-форма может встречаться в следах в натуральной конопле, в частности в сортах с высоким содержанием CBD или в так называемых «non-psychoactive» хемотипах. Однако в медицинских сортах с высоким содержанием Δ⁹-trans-THC, таких как Bedrocan, уровень цис-изомера обычно не превышает 0.1%. Его детекция возможна благодаря комбинации LC-MS/MS и ядерного магнитного резонанса с двумерной корреляцией (2D-NMR COSY, HSQC, HMBC), которые позволяют отличить стереоизомеры по химическим сдвигам и спин-спиновой связи.
С точки зрения взаимодействия с биологическими системами, пространственное расположение боковой алкильной группы, а также ориентация фенольного кольца имеют решающее значение для связывания с рецепторами CB1 и CB2. Δ⁹-cis-THC демонстрирует сниженное связывание с рецептором CB1 по сравнению с транс-изомером, что можно объяснить смещением ключевых групп от оптимальной ориентации в сайте связывания. Это, вероятно, является причиной снижения психоактивного потенциала и возможного частичного агонизма.
Термодинамическая стабильность цис-изомера ниже, чем транс-формы, что проявляется в его склонности к дальнейшей изомеризации при нагревании, воздействии света или кислот. Это важно с точки зрения разработки стабильных фармацевтических форм: Δ⁹-cis-THC требует тщательной оптимизации условий хранения, включая температурный режим, отсутствие УФ-излучения и инертную атмосферу.
Наличие хиральных центров делает Δ⁹-cis-THC оптически активным веществом. Обычно его описывают как (−)-(6aS,10aR)-Δ⁹-THC, однако возможно существование и энантиомеров (+(6aR,10aS)-форма), в зависимости от условий синтеза. Их биологическая активность будет отличной, так как рецепторная аффинность является энантиоселективной. Это еще один аргумент в пользу применения хиральной хроматографии при анализе полученных продуктов.
Структурная формула Δ⁹-cis-тетрагидроканнабинола
Молекула Δ⁹-cis-тетрагидроканнабинола (Δ⁹-cis-THC) представляет собой высокоорганизованную органическую структуру класса трициклических каннабиноидов. Его базовая химическая формула — C₂₁H₃₀O₂ — остается постоянной для всех стереоизомеров Δ⁹-THC, однако пространственное расположение функциональных групп и конфигурация кольцевых систем различаются, что обусловливает уникальные физико-химические и биологические свойства именно цис-формы. В этом разделе сосредоточено внимание исключительно на аспектах, которые непосредственно касаются формальной структурной организации Δ⁹-cis-THC, исключая рассмотрение стереохимии или рецепторной активности, которые будут подробно освещены в других частях.
Молекулярная архитектоника Δ⁹-cis-THC включает три конденсированных кольца: частично насыщенное циклогексеновое кольцо (B), бензольное фенольное ядро (A) и тетрагидропирановое кольцо (C), которые вместе формируют каннабиноидный трициклический скелет. Исходной точкой для анализа структурной формулы является канабигеровое ядро, которое в процессе биогенеза или химического синтеза преобразуется в Δ⁹-изомеры, включая цис-форму. Для точного описания используется нумерация атомов, утвержденная ИЮПАК: начиная с фенольного кольца, атомы пронумерованы от 1 до 10a, что позволяет чётко локализовать функциональные группы в контексте реакционной способности и аналитического распознавания.
Фенольное кольцо (A) имеет гидроксильную группу в положении C1, которая участвует в водородных связях и может быть замещена или модифицирована в синтетических производных. Параллельно ему, в положении C3, присоединена пентильная алкильная боковая группа (−C₅H₁₁), являющаяся ключевым детерминантом липофильности молекулы. Эта боковая группа не только влияет на растворимость Δ⁹-cis-THC в липидной среде, но и определяет аффинность к трансмембранным доменам рецепторов. Несмотря на это, в пределах структурной формулы она рассматривается как неизменная алифатическая цепь без реакционноспособных центров.
Центральное циклогексеновое кольцо (B) содержит двойную связь между атомами C9 и C10, что является характерной особенностью именно Δ⁹-изомеров. Расположение этой двойной связи в плоскости кольца создаёт условия для существования цис- и транс-диастереомерии. В случае Δ⁹-cis-THC два заместителя (группа в положении 6a и 10a) расположены с одной стороны относительно плоскости двойной связи. Такое расположение изменяет конформацию кольца и влияет на электронную плотность вокруг двойной связи, что может быть детектировано методами ЯМР и ИК-спектроскопии.
Кольцо C — это тетрагидропирановый фрагмент, замкнутый в результате внутримолекулярного циклического соединения между терпеновым цепочкой и фенольным кольцом. В структурной формуле это шестичленное гетероциклическое кольцо с атомом кислорода в положении C1′, которое не содержит двойных связей, но обладает способностью к гибкой конформации. Этот фрагмент является ключевым для формирования стабильной трициклической структуры молекулы. Его ориентация жёстко фиксирована вследствие цис-конфигурации на соседнем циклогексеновом кольце, что определяет общий объём и топологию молекулы.
Ключевая особенность Δ⁹-cis-THC состоит в том, что двойная связь Δ⁹ (между C9 и C10) обуславливает планарность части молекулы, фиксирующей ориентацию объёмных заместителей. В цис-форме оба метильных заместителя (на 6a и 10a) располагаются с одной стороны относительно плоскости кольца, что вносит пространственную асимметрию. Эта конфигурация не является энергетически наиболее выгодной — именно поэтому транс-изомер более стабилен — однако в пределах конкретных условий синтеза или биосинтеза может формироваться как примесь или целевой продукт.
С позиции электронной структуры молекула содержит один фенольный гидроксил, проявляющий кислотные свойства (pKa ≈ 10.6), а также двойную связь, которая определяет спектроскопические свойства (характерное поглощение в УФ-диапазоне 210-280 нм). Также значение имеет диэлектрический эффект пентильной группы на электронную плотность в ароматическом кольце. Расположение всех этих групп формирует индивидуальный хроматографический профиль Δ⁹-cis-THC, который можно легко отделить от других изомеров с помощью HPLC, TLC или GC с селективным детектированием.
Для построения полной структурной формулы важно учитывать тетрагидроканнабинольный скелет, который имеет 6 хиральных центров, однако только два из них являются конфигурационно определяющими (6a и 10a), остальные могут находиться в динамическом равновесии вследствие ротационной гибкости. В структурной формуле они фиксируются условно в положении, обеспечивающем цис-конфигурацию, однако реальная молекула может проявлять некоторую подвижность в растворах.
Наличие у Δ⁹-cis-THC трёх кольцевых систем создаёт сложную систему сопряжённых орбиталей, что делает молекулу спектроскопически активной в ряде диапазонов. Именно это позволяет использовать инструментальные методы анализа (2D-NMR, DEPT, COSY, HSQC) для детальной верификации структуры. В процессе полной характеристики структурной формулы Δ⁹-cis-THC обычно применяют методы XRD (рентгеноструктурного анализа), когда вещество удаётся кристаллизовать, или масс-спектрометрию высокой разрешающей способности (HRMS) с анализом фрагментации.
Ещё одним аспектом структурной формулы Δ⁹-cis-THC является наличие потенциально реакционноспособных центров для химической модификации: фенольный гидроксил можно эстерифицировать или этерифицировать, пентильную цепь — удлинить или заменить, а двойную связь — подвергнуть гидрированию. Эти преобразования позволяют создавать серию структурно родственных аналогов, однако первичная структура Δ⁹-cis-THC остаётся уникальной.
Стереохимическая конфигурация Δ⁹-цис-тетрагидроканнабинола
Стереохимическая конфигурация Δ⁹-цис-тетрагидроканнабинола (Δ⁹-cis-THC) является ключевым параметром, определяющим его физико-химические свойства, реакционную способность, стабильность и специфику молекулярного распознавания. В отличие от многих низкомолекулярных соединений, где стереохимия ограничивается отдельными хиральными центрами, в случае Δ⁹-cis-THC она охватывает взаимозависимую систему, в которой участвуют как стереогенные центры, так и геометрическое расположение заместителей относительно плоскости двойной связи. Изучение этой конфигурации необходимо для точного понимания механизмов его образования, потенциальной биоактивности, а также условий селективного синтеза.
В молекуле Δ⁹-cis-THC присутствует несколько хиральных центров, однако для характеристики цис-изомерии ключевыми являются два атома в положениях 6а и 10а. Их абсолютная конфигурация определяется по системе Cahn-Ingold-Prelog (CIP) и обозначается как 6аS,10аR для наиболее часто описываемого энантиомера Δ⁹-cis-THC. Отличительной чертой цис-изомера является ориентация заместителей в этих позициях с одной стороны плоскости, образованной циклогексеновым кольцом. Такое расположение резко контрастирует с более термодинамически стабильной транс-конфигурацией, где заместители ориентированы по разные стороны плоскости. Именно эта ориентация определяет характер конформационного блокирования и изменение топологии молекулы в трёхмерном пространстве.
Двойная связь в положении Δ⁹ (между атомами C9 и C10) выступает ключевым элементом в формировании диастереомеров. Система планарной π-связи жёстко фиксирует положение атомов и исключает свободную ротацию, что позволяет стабилизировать пространственную ориентацию двух смежных фрагментов — циклогексенового кольца и тетрагидропиранового цикла. В конфигурации «цис» метильная группа в положении 10а и водород на 6а оказываются по одну сторону относительно плоскости, что обусловливает изменение угла между кольцами A-B и B-C. В результате молекула принимает более компактную, свернутую конформацию, в отличие от развернутой транс-ориентации. Эта разница в архитектонике существенно влияет на энергетический профиль молекулы и её взаимодействия с окружающей средой.
Кроме конфигурации на двойных связях, также важно рассмотреть локальную стереохимию в пределах тетрагидропиранового кольца, в частности в положениях C1′, C4′ и C6′. Хотя эти атомы не являются классически хиральными во всех случаях, из-за гибкости кольца они способны формировать полуавтоматически фиксированные псевдохиральные конфигурации, которые могут играть роль в механизмах молекулярного распознавания. Примечательно, что в Δ⁹-cis-THC тетрагидропирановый фрагмент ориентирован таким образом, что атом кислорода, включённый в кольцо, приближается к плоскости циклогексена, что уменьшает объёмную доступность части молекулы и усиливает её конформационную жёсткость.
Стереохимическое поведение Δ⁹-cis-THC является объектом интенсивного анализа методом двумерной ЯМР-спектроскопии (COSY, NOESY, ROESY), где межъядерные корреляции позволяют установить пространственную близость атомов независимо от их ковалентной связи. Например, на основе NOE-эффектов можно точно идентифицировать цис-ориентацию между водородами в положениях 6а и 10а. Сниженная интенсивность NOE по сравнению с транс-изомером дополнительно верифицирует степень скручивания кольцевой системы и подтверждает существование свернутой конформации. Такая стереохимическая организация влияет не только на спектроскопические характеристики, но и на кинетику реакций с внешними реагентами.
Исследования конфигурационной стабильности Δ⁹-cis-THC показывают, что эта форма менее стабильна по сравнению с транс-изомером, что подтверждается как расчётами методами DFT, так и эмпирическими данными по термодинамике изомеризации. В неводной среде и при наличии протонных кислот возможен переход из цис- в транс-форму по механизму электрофильной активации двойной связи, сопровождающийся инверсией конфигурации. Именно поэтому при синтезе Δ⁹-cis-THC большое значение имеет контроль температуры и среды реакции для предотвращения рацемизации или изомеризации.
Энантиомерная чистота Δ⁹-cis-THC, хотя и не является определяющей для существования цис-ориентации, имеет существенное значение в контексте биологического распознавания. В природе наиболее часто встречается (-)-энантиомер, соответствующий конфигурации 6аS,10аR. Однако синтетические методы могут продуцировать смеси энантиомеров, которые требуют разделения хиральной хроматографией. Установление абсолютной конфигурации, как правило, осуществляется путём сравнения экспериментальных оптических вращений с теоретическими данными, вычисленными методом TD-DFT, либо путём рентгеноструктурного анализа хиральных производных.
Интегральная стереохимия Δ⁹-cis-THC влияет на параметры молекулярной динамики: образование внутримолекулярных водородных связей, гибкость цепей и возможность индуцированной фитоселективной взаимодействия. Например, по сравнению с транс-изомером, цис-форма имеет меньший дипольный момент, что снижает её растворимость в полярных средах и изменяет распределение в мембранах. Это также меняет вероятность интеркаляции в липидный бислой, влияя на фармакокинетические параметры. Однако в рамках данного раздела акцент остаётся именно на стереохимической природе, а не на функциональных последствиях.
Дополнительно следует учитывать, что цис-изомеры, в отличие от транс-форм, не всегда образуют кристаллические фазы с чёткой пространственной упаковкой. Это затрудняет использование рентгеноструктурного анализа, однако облегчает спектроскопическую идентификацию. Конформационная подвижность цис-формы позволяет получить более выраженные спектры в ИК- и ЯМР-анализе, особенно при вариации температуры или pH. Это делает возможным построение конформационных карт молекулы, которые описывают изменения её структуры в зависимости от внешних условий.
Методы синтеза Δ⁹-цис-THC
Синтез Δ⁹-цис-тетрагидроканнабинола (Δ⁹-цис-THC) относится к особенно сложным задачам современной органической химии из-за необходимости высокой стереоселективности, ограниченной термодинамической стабильности цис-изомера и химической чувствительности функциональных групп. Этот каннабиноид имеет изомерную разницу в конфигурации двойной связи, что критически влияет на биологические свойства молекулы. Методы синтеза целевой молекулы ориентированы на достижение контроля над пространственным расположением связей в центральной части трициклической системы. Успешная стратегия должна сочетать эффективное образование углеродного каркаса с точным управлением конфигурационной целостностью на поздних этапах.
Классический подход к синтезу каннабиноидов базируется на соединении оливетола (5-пентилрезорцинола) с терпеноидной структурой, чаще всего производным цитраля или α-пинена, с последующей циклизацией для формирования каннабиноидного каркаса. Для Δ⁹-цис-THC этот маршрут претерпевает значительные модификации. Начальные стадии построены так, чтобы предотвратить образование более термодинамически выгодного транс-изомера. Важным фактором является выбор защитных групп для фенольных фрагментов и условий активации альдегидов, чтобы минимизировать побочные реакции и неконтролируемую изомеризацию.
Для обеспечения стереоспецифического образования Δ⁹-цис-изомера используются реакции кислотно-катализированной циклизации с тщательно подобранной температурой, растворителем и концентрацией реагентов. Например, применение борфторид-эфирных комплексов позволяет направить образование цикла через механизм карбокатионного образования с последующей индуцированной атакой нуклеофильного центра, что способствует цис-ориентации заместителей в шестичленном кольце. Несмотря на определённую эффективность этого подхода, реакционная смесь обычно содержит смесь изомеров, поэтому последующий этап разделения является обязательным.
После получения промежуточной структуры, включающей двойную связь в положении Δ⁹, важно обеспечить сохранение цис-конфигурации на всех последующих операциях. Даже незначительный нагрев или действие кислотно-основных сред могут вызвать инверсию двойной связи или смещение её позиции в пределах кольца. Поэтому последующие реакции — например, восстановление, этерификация или функционализация — осуществляются в строго контролируемых условиях, с минимизацией времени реакции, температуры и концентрации кислот или оснований.
Альтернативным подходом является синтез с применением асимметричных вспомогательных групп, влияющих на пространственную ориентацию молекулы уже на ранних этапах. Например, использование хиральных бороновых эфиров в реакциях алкилирования позволяет индуцировать цис-ориентацию заместителей, которая затем трансформируется в правильную стереохимию конечного продукта. Такие подходы, хоть и менее масштабируемые, демонстрируют потенциал в лабораторных условиях для синтеза чистого Δ⁹-цис-изомера без необходимости последующей изомеризации.
Отдельную категорию методов составляют изомеризационные стратегии, при которых сначала сознательно синтезируется Δ⁹-транс-THC, а затем проводится контролируемая изомеризация в цис-форму. Такие методы используют фотоиндуцированную или кислотно-катализированную инверсию конфигурации. Применение фотохимических реакторов с контролем длины волны и экспозиции позволяет индуцировать селективную инверсию без разрыва других связей в молекуле. Для этого чаще всего используются органические сенсибилизаторы (например, бензофенон) или иридиевые комплексы, способные эффективно передавать энергию на двойную связь без расщепления каркаса.
Несмотря на перспективность фотохимических методов, они требуют глубокой оптимизации: интенсивность освещения, длина волны, полярность среды и концентрация реагентов должны быть подобраны так, чтобы не возникали побочные фотоокислительные процессы или образование полимеризованных побочных продуктов. Изомеризация под действием ультрафиолета, хотя и потенциально эффективна, чувствительна к присутствию примесей кислорода, поэтому реакция обычно проводится в инертной атмосфере (азот или аргон).
Ещё одним стратегическим направлением является применение микрофлюидных реакционных сред. В таких системах контроль над временем контакта реагентов, температурой и геометрией потока позволяет достичь высокого уровня воспроизводимости стереохимических результатов. Реакционные условия можно изменять в реальном времени, а выход продукта выводить непосредственно на аналитическую систему для контроля чистоты целевого изомера. Это особенно ценно при масштабировании процесса или для комбинаторного исследования вариантов условий синтеза.
Независимо от выбранного маршрута, окончательная стадия синтеза Δ⁹-цис-THC — это хроматографическая очистка и выделение изомера. Для этого используют методы высокоэффективной жидкостной хроматографии (HPLC) с хиральными стационарными фазами, что позволяет достичь селективного разделения даже структурно близких диастереомеров. Также применяются гравиметрические методы с использованием специфических комплексообразователей, способных избирательно связывать цис-изомер.
Классические методы синтеза
Синтез Δ⁹-цис-тетрагидроканнабинола (Δ⁹-цис-THC) в лабораторных условиях исторически развивался на основе методологии, направленной на построение трициклической системы, характерной для класса тетрагидроканнабинолов. Основными классическими подходами являются кислотно-катализируемые реакции конденсации между фенольными прекурсорами, такими как оливетол, и терпеноидными компонентами — в частности, производными монотерпенов, которые обеспечивают циклический фрагмент молекулы. В случае синтеза цис-изомеров ключевым фактором является контроль пространственной ориентации заместителей во время циклизации, что достигается варьированием реакционных условий, выбором растворителя, температурного режима и катализатора.
Одним из наиболее известных подходов является реакция оливетола (5-пентилрезорцина) с (+)-транс-2-карен оксидом или с цитралем в присутствии кислот Льюиса или протонных кислот. При этом именно условия реакции влияют на конфигурацию образуемой каннабиноидной структуры. Использование борфторметилового эфира (BF₃·Et₂O) в эфирных или хлорсодержащих растворителях обеспечивает электрофильную активацию терпеноидного компонента, который в дальнейшем атакует нуклеофильный центр оливетола, образуя карбониевый промежуточный продукт. В зависимости от температуры и концентрации катализатора возможно образование различных изомеров, включая Δ⁹-цис-THC.
Особенно важно, что именно конфигурация циклического монотерпенового компонента — например, цитраля — определяет возможность формирования цис-конфигурации в конечном продукте. В случае использования гераниализированных производных в качестве электрофилов, в частности цитраля или микроконфигураций линалоола, выявлено образование Δ⁹-цис-THC с умеренной селективностью. Однако в большинстве классических методов селективный контроль над цис- или транс-изомеризацией не является полностью гарантированным, что обуславливает необходимость дальнейшего хроматографического разделения изомеров.
Также стоит обратить внимание на кислотно-инициированную конденсацию оливетола с цитралем в бензольной среде при наличии соляной кислоты (HCl), что приводит к образованию каннабиноидного карбоцикла с последующей циклизацией. В этом подходе отмечено, что вариация молярного соотношения реагентов (например, 1:1,2 или 1:2) значительно влияет на выход цис-изомеров. Интересно, что в протонно-кислотной среде реакция протекает с преимущественным образованием Δ⁹-изомеров, причем при пониженных температурах (0-5 °C) формируется более высокая доля цис-формы.
Другим классическим вариантом является использование сесквитерпеновых эпоксидов, в частности производных кариофиллена, которые в присутствии кислот Льюиса подвергаются кольцеподобному раскрытию с образованием соответствующих катионов. Такие катионы могут атаковать оливетол, образуя трициклическую структуру с цис-ориентацией в зависимости от ориентации исходного эпоксида. По аналогичному принципу применяются и ментоловые производные, которые в реакции с фенольными компонентами в кислой среде образуют смеси изомеров Δ⁹-THC с примесями цис-конфигураций.
Еще одним химико-техническим аспектом классических методов является контроль влажности реакционной среды. Для реакций, в которых образуется цис-изомер, критически важна абсолютная сухость реагентов и растворителей, поскольку даже следы воды приводят к гидратации промежуточных катионов и побочному образованию спиртов или эфиров, что снижает общий выход цис-THC.
Классические методы также включают термически контролируемую циклизацию соответствующих каннабиноидных спиртов в кислой среде. При этом фенольная группа в положении 1 реагирует с алифатической цепью или изопреновым компонентом при каталитическом нагревании в присутствии PPA (полифосфорной кислоты), что позволяет формировать третичные центры с определённой стереохимией. Здесь термические параметры влияют не только на скорость реакции, но и на соотношение цис- и транс-продуктов.
Необходимо также отметить, что во многих классических протоколах, которые исторически ориентированы на синтез Δ⁹-trans-THC, цис-изомер образуется как побочный продукт с селективностью 5-15%, однако современная ретросинтетическая интерпретация позволяет оптимизировать условия так, чтобы увеличить выход цис-формы. Это, в частности, включает применение более сильных электрофильных активаторов, таких как SnCl₄ или AlCl₃, и использование эхоно-ароматических растворителей (например, метиленхлорида или толуола) со стабилизирующими свойствами для промежуточных катионов.
Кроме того, рассматривалось использование конденсационных условий на твердых кислотах, таких как силикагель, пропитанный кислотами Льюиса. В этих случаях каталитическое действие твердой фазы позволяет проводить реакцию в гетерогенных условиях с минимальным образованием побочных продуктов. При этом было отмечено, что Δ⁹-цис-THC преимущественно формируется при температурах 40-60 °C в течение 6-8 часов, тогда как транс-изомеры требуют более высоких температур.
Также некоторые варианты классических протоколов рассматривают многоэтапный подход: сначала проводится построение изопреновой боковой группы с контролируемой геометрией (например, с использованием Z-алкенов), после чего происходит стадия циклизации с сохранением цис-конфигурации с помощью стереоселективного индуктора. Такие протоколы теоретически дают возможность направленного синтеза Δ⁹-цис-THC, хотя их практическая реализация ограничивается низкой общей эффективностью.
Изомеризация из других каннабиноидов
Изомеризация каннабиноидов, в частности превращение нейтральных фитоканнабиноидов в изомерные формы Δ⁹-THC, является одним из ключевых методов получения редких структур, включая Δ⁹-цис-тетрагидроканнабинол. Этот процесс основан на внутримолекулярных перестройках, обусловленных реакциями перегруппировки, эпимерации или транскоррекции двойных связей в присутствии катализаторов. Выбор исходного вещества критически влияет на эффективность получения цис-изомера. Основное внимание сосредоточено на превращении каннахромена (CBC) и каннабидиола (CBD) с использованием кислот Льюиса или мягких протонных кислот в контролируемых температурных условиях.
Изомеризация каннахромена — потенциальный источник получения Δ⁹-цис-THC, поскольку структура CBC включает прецизионно ориентированные электронные области, склонные к электрофильным перегруппировкам. CBC — бициклический фитоканнабиноид с открытой пренильной боковой группой, что позволяет инициировать циклизацию в присутствии кислот. Под действием BF₃·Et₂O в неполярном растворителе (например, дихлорметан) происходит миграция двойной связи с образованием карбокатиона в положении 2 пренильного фрагмента. Последующая циклизация обеспечивает образование трициклической каннабиноидной системы. При контроле температуры в пределах 0-10 °C возможна преимущественная генерация цис-ориентации в фрагменте 6а-10а. Этот механизм подтверждается данными спектроскопического мониторинга реакции, где наблюдается формирование цис-продукта на начальных стадиях с постепенным снижением селективности при повышении температуры или концентрации BF₃.
Варианты изомеризации CBC также предусматривают использование твердых кислотных носителей, таких как цеолиты или сульфированные карбоновые смолы, обеспечивающие гетерогенную среду с ограниченным пространственным доступом к реакционному центру. Такая конформационная изоляция позволяет преимущественно образовывать цис-изомер благодаря затрудненному вращению промежуточного катиона. Кроме того, при участии твердофазовых каталитических систем возможно снижение образования деградированных или полимеризованных побочных продуктов, характерных для жидкофазной изомеризации.
Каннабидиол (CBD) — второй стратегический субстрат для получения Δ⁹-цис-THC. Его бисфенольная структура с двумя гидроксильными группами позволяет проводить электрофильно-иницированную циклизацию в условиях кислотного катализа. В классических протоколах изомеризации CBD в Δ⁹-trans-THC доминирует транс-продукт, однако при вариации условий, в частности снижении температуры, смене типа кислотного катализатора (например, использование хлоридов олова или бора), а также подборе растворителя с высокой диэлектрической проницаемостью наблюдается повышение доли Δ⁹-цис-изомера.
Ключевой механизм заключается в образовании карбокатионного промежуточного продукта через протонирование или комплексообразование с катализатором в положении 1 фенольного кольца, после чего происходит нуклеофильная атака пренильного фрагмента с образованием тетрагидробензопирановой системы. Пространственная ориентация атакующей группы на стадии циклизации определяет конфигурацию 6а,10а-центров. Снижение температуры и использование стерически громоздких кислот (например, трифторацетатов металлов) позволяет создать кинетически контролируемые условия, при которых цис-изомер образуется с более высокой селективностью.
Параллельно исследуется влияние электронной модификации CBD перед изомеризацией. Так, предварительное ациллирование гидроксильных групп или селективное замещение на эфирные производные, например CBD-диацетат или CBD-диэтилэфир, изменяет электронную плотность в критических позициях и снижает скорость рекомбинации продуктов. В таких условиях наблюдалось повышение выхода цис-продуктов после термического разложения или последующего гидролиза.
Еще одним механизмом является эпимерация существующих Δ⁹-trans-THC в присутствии специфических кислотных сред, которые катализируют инверсию конфигурации на стереоцентре 6а. Такие реакции типично происходят с участием мягких протонных кислот, например, HCl или p-TsOH в растворителях типа тетрагидрофурана или 1,4-диоксана. Температурная индукция (45-60 °C) способствует перестройке двойной связи и асимметричного углерода, вследствие чего транс-изомер переходит в цис-форму. Этот подход обычно сопровождается частичным образованием Δ⁸-изомеров, однако хроматографическая изоляция позволяет очистить Δ⁹-цис-THC до аналитической чистоты.
Дополнительно описаны реакции изомеризации с каннабигеролом (CBG) с участием последовательного окисления с образованием CBGA-производного и последующей циклизации в присутствии кислот. В присутствии кислоты Льюиса окисленный пренильный фрагмент активируется до образования ионного промежуточного продукта, который формирует тетрагидроканнабинол с непредсказуемым соотношением изомеров. В специальных условиях (в частности, при экстракции в ионной жидкости) доля Δ⁹-цис-THC может достигать 20-25 %.
Другим перспективным направлением является использование биокатализа для цис-ориентированной изомеризации. Некоторые ферменты, в частности каннабидиоловые оксидазы, в комбинации с кислой средой способны катализировать стереоселективную циклизацию CBD до форм, которые преимущественно соответствуют цис-ориентации. Данный метод находится на стадии разработки, однако уже продемонстрировано, что ферментативная активность снижается в присутствии растворителей типа DMSO или EtOAc, в то же время в мягких буферных системах (фосфатные или цитратные буферы, pH 5.2-5.8) продуктивность фермента стабилизируется.
С целью увеличения селективности к Δ⁹-цис-THC также применяются фотохимические методы. Изомеризация CBD под ультрафиолетовым излучением в присутствии фотосенсибилизаторов (например, бензофенона) позволяет активировать двойные связи до фототропной трансформации, которая завершается циклизацией с образованием цис-конфигурации. Такой подход, однако, имеет низкую масштабируемость из-за непредсказуемой конкуренции с процессами фотоокисления.
Сучасные подходы
Современные методы синтеза Δ⁹-цис-тетрагидроканнабинола отходят от классических поэтапных реакций в бинарных растворителях и кислотных средах, направляя усилия на повышение продуктивности, селективности, безопасности и экологичности процесса. Ключевым направлением является применение технологий непрерывного потока, микроволнового нагрева, каталитических систем с уникальными лигандами и использование инновационных реакционных сред, в частности ионных жидкостей и сверхкритических газов. Также значительное внимание уделяется разработке методов селективного стереоконтролируемого катализа для формирования цис-изомера.
Непрерывный поток синтеза (continuous flow synthesis) представляет собой систему, где реагенты непрерывно подаются в реактор малого объема, в котором происходят химические превращения под тщательно контролируемыми температурой, давлением и временем пребывания реагентов. Такая методика позволяет минимизировать реакционное время от нескольких часов в классических реакторах до минут или секунд. Важным является возможность точного регулирования параметров, что обеспечивает высокую селективность образования Δ⁹-цис-THC за счет снижения термической деструкции и побочных реакций, характерных для традиционных методов. Преимущество также заключается в снижении затрат реагентов и растворителей, что положительно сказывается на экологическом профиле синтеза. Использование компактных реакторов со смесителями микроканальной архитектуры обеспечивает гомогенность реакционной смеси, что способствует повышению конверсии исходных веществ в цис-изомер. Кроме того, интеграция онлайн-аналитических методов, таких как спектроскопия ИК или УФ-Видимого, позволяет оперативно корректировать условия процесса для поддержания оптимальной селективности.
В области катализа происходит интенсивная разработка комплексов металлов переходной группы с органическими лигандами, которые обеспечивают высокую стереоселективность циклизации и стабилизацию карбокатионных промежуточных продуктов. Особенно перспективными являются катализаторы на основе платины, палладия, рутения и иридия с хиральными фосфиновыми или оксазолидиновыми лигандами. Эти катализаторы активируют пренильные двойные связи через π-комплексирование, способствуя внутримолекулярной атаке с определенной пространственной ориентацией. Молекулярный дизайн лигандов в таких системах создает стерические и электронные эффекты, которые препятствуют образованию транс-изомеров и способствуют формированию цис-конфигурации. Использование таких катализаторов в смеси с кислотой Льюиса или слабыми протонными кислотами позволяет получать цис-изомеры с выходом до 70-85 % при пониженных температурах (15-30 °C) и коротких временах реакции (до 2 часов).
Микроволновый синтез — отдельное современное направление, которое активно развивается в сфере каннабиноидного синтеза. Микроволновое облучение позволяет селективно нагревать полярные участки молекулы или катализатора, способствуя ускорению реакций циклизации за счет локального повышения температуры и энергии активации. Это позволяет сократить время реакции с нескольких часов до десятков минут, сохраняя или улучшая выход цис-изомера. Применение микроволновых реакторов с интегрированными температурными датчиками и системами контроля давления позволяет проводить синтез в закрытых системах, что снижает риск образования токсичных летучих продуктов и обеспечивает безопасность процесса. В то же время возможности масштабирования таких реакций начинают внедряться в промышленную практику благодаря разработке многотомных микроволновых систем.
Использование ионных жидкостей (ИЖ) как растворителей и реакционных сред является одним из самых современных трендов в синтезе каннабиноидов, в частности Δ⁹-цис-THC. ИЖ характеризуются высокой термической стабильностью, низкой летучестью, а также способностью стабилизировать карбокатионные промежуточные продукты благодаря специфическим межмолекулярным взаимодействиям (водородные связи, ионные пары). В таких средах кислотный катализ протекает без потери активности, а селективность образования цис-изомеров увеличивается благодаря благоприятной конформационной фиксации молекулы. Применение ионных жидкостей на основе имидазолия, пиридиния или аммония позволяет избежать использования токсичных органических растворителей и снизить экологическое воздействие. Одновременно благодаря уникальным свойствам ИЖ способствуют лучшей растворимости исходных каннабиноидов и катализаторов, что повышает реакционную скорость и выход продукта. Проведенные исследования показали, что в некоторых ионных жидкостях можно достигать селективности цис-изомера свыше 75 % без дополнительных модификаций катализатора.
Инновационным является также применение сверхкритических газов, в частности углекислого газа (CO₂) под высоким давлением, как реакционной среды для изомеризации и циклизации каннабиноидов. Сверхкритический CO₂ обладает низкой вязкостью, высокой диффузионной способностью и изменяемой полярностью под давлением, что делает его оптимальным растворителем для сложных органических реакций. Его использование позволяет проводить реакции при мягких температурах (25-50 °C) и безопасно утилизировать CO₂ после реакции. В сверхкритических средах повышается растворимость катализаторов и выход каннабиноидных изомеров, уменьшается образование побочных продуктов. Такие условия способствуют получению цис-изомеров с высокой чистотой без необходимости дополнительных этапов очистки.
Параллельно развиваются биокаталитические методы, которые предусматривают использование ферментов или биомиметических катализаторов, способных селективно направлять циклизацию и стереоконтролируемую изомеризацию каннабиноидов в цис-изомеры. Выявлено, что некоторые мутагены ферментов лигаз или оксидаз могут катализировать циклизацию CBD в цис-THC при условиях умеренного pH и температуры с высокой стереоселективностью. Разработка ферментных систем на основе металлоэнзимов с хиральными кофакторами открывает перспективы для экологически чистого синтеза Δ⁹-цис-THC, соответствующего принципам зеленой химии. Использование таких систем ограничено стабильностью ферментов и их чувствительностью к органическим растворителям, однако успехи в генно-инженерных модификациях позволяют оптимизировать эти параметры.
Еще одним направлением является применение фотокатализа, где световая энергия используется для активации реакции циклизации. Светочувствительные катализаторы, например металлокомплексы рутения или иридия, под действием видимого света генерируют активные радикальные или ионные промежуточные продукты, запускающие изомеризацию каннабиноидов. Световая активация обеспечивает контролируемую региональную активацию молекулы, снижая побочные реакции, характерные для термических методов. Это позволяет получать цис-изомеры без агрессивных кислотных условий и при комнатной температуре. Однако фотокатализ требует точного контроля интенсивности и длины волны излучения, а также специфической аппаратной базы.
Современные подходы также включают комбинации нескольких методик в последовательных или параллельных реакционных циклах, что позволяет синтезировать Δ⁹-цис-THC с повышенной выходностью и чистотой. Например, непрерывный поток в сочетании с ионными жидкостями и катализом металлокомплексов позволяет получать цис-изомер за считанные минуты с селективностью свыше 80 %. Или же применение биокатализа на стадии начальной циклизации с последующим фотокатализом для улучшения чистоты и селективности конечного продукта.
Интеграция этих технологий в масштабируемые процессы с учетом экономических и экологических аспектов открывает перспективы промышленного производства Δ⁹-цис-THC как отдельного фармацевтического ингредиента или как составляющей комплексных каннабиноидных препаратов. В то же время продолжаются исследования, направленные на совершенствование контроля стереохимии, оптимизацию процессов очистки, а также снижение стоимости синтеза за счет повторного использования катализаторов и растворителей.
Природное происхождение и содержание в растениях
Природное происхождение Δ⁹-цис-тетрагидроканнабинола (Δ⁹-цис-THC) тесно связано с биохимическими процессами, происходящими в растении Cannabis sativa L., которое является основным источником каннабиноидов. Известно, что каннабиноиды образуются в специализированных клеточных структурах — трихомах, расположенных на поверхности цветков и листьев растения. Эти железистые волоски обеспечивают синтез и накопление каннабиноидов, включая Δ⁹-цис-THC, хотя последний встречается в растениях в очень низких концентрациях. Природное происхождение Δ⁹-цис-THC определяется сложным комплексом ферментативных реакций, приводящих к формированию структурных изомеров с определенной стереохимией.
Преобладающее большинство исследований сосредоточено на более распространенных каннабиноидах — Δ⁹-trans-THC, CBD (каннабидиол) и CBG (каннабигерол). Тем не менее, наличие Δ⁹-цис-THC в природных образцах подтверждено спектроскопическими методами, в частности ядерным магнитным резонансом (ЯМР), масс-спектрометрией (МС) и хроматографическим анализом с высоким разрешением (HPLC, GC-MS). Наблюдения показывают, что Δ⁹-цис-THC встречается в следовых количествах, иногда лишь в пределах ниже 0,01 % общего содержания каннабиноидов в растении.
Распределение Δ⁹-цис-THC в растении является неравномерным. Он накапливается преимущественно в отдельных фенотипах или популяциях Cannabis sativa, которые отличаются генетической изменчивостью ферментативных систем. Важно, что количество Δ⁹-цис-THC коррелирует с активностью ферментов, отвечающих за циклизацию и изомеризацию прекурсоров каннабиноидов, в частности оливетоловых производных. Эти ферменты могут иметь вариабельные конформации или аллельные варианты, определяющие специфичность реакционных путей, в результате чего формируется разное соотношение цис- и транс-изомеров.
Влияние экологических факторов на синтез Δ⁹-цис-THC также изучается. Температура, влажность, интенсивность света и состав почвы могут опосредованно влиять на выраженность ферментативных путей и стабильность каннабиноидов. В некоторых исследованиях установлено, что стрессовые условия, в частности повышенная ультрафиолетовая инсоляция, способствуют увеличению общей каннабиноидной активности, что теоретически может повышать и следовые уровни Δ⁹-цис-THC. Однако точные механизмы влияния внешних факторов на образование именно цис-изомера остаются недостаточно изученными и требуют дальнейшего экспериментального подтверждения.
Важно подчеркнуть, что Δ⁹-цис-THC в растениях существует преимущественно в виде кислотной формы — Δ⁹-цис-тетрагидроканнабиноловой кислоты (Δ⁹-цис-THCA). Эта форма является более стабильной в природных условиях и подвергается декарбоксилированию под воздействием температуры или фотохимических процессов, превращаясь в нейтральный Δ⁹-цис-THC. Процесс декарбоксилирования является ключевым для получения активного каннабиноида, способного взаимодействовать с рецепторами человека. Спонтанное или индуцированное декарбоксилирование во время сушки и хранения растительного сырья существенно влияет на конечный состав каннабиноидов и, соответственно, на их фармакологический профиль.
Исследования также указывают на то, что Δ⁹-цис-THC может образовываться в результате природной изомеризации под воздействием света и тепла уже после сбора сырья. Эти процессы могут изменять соотношение каннабиноидных изомеров в образцах, что усложняет точное определение первичного содержания Δ⁹-цис-THC в живом растении. Таким образом, природное содержание Δ⁹-цис-THC в конопле является результатом не только генетически заложенных синтетических путей, но и постсборочных химических преобразований.
В масштабах популяционного разнообразия Cannabis sativa известно, что волокнистые и промышленные сорта конопли, которые культивируются для получения волокна или семян, содержат очень низкие уровни Δ⁹-цис-THC или вовсе его не содержат. Это связано с отбором генотипов, в которых активность ферментов циклизации каннабиноидов снижена или направлена на образование неметаболических форм. Напротив, в некоторых дикорастущих или «дико-растущих» популяциях, где генетический фон менее однороден, уровень Δ⁹-цис-THC может быть выше, хотя и всё же ниже уровней транс-изомеров.
Применение высокочувствительных методов аналитики позволяет отличать следы Δ⁹-цис-THC от изомеров и метаболитов, имеющих схожие массы и спектры. Это критически важно для исследований, направленных на изучение природного содержания каннабиноидов, поскольку неправильная идентификация может привести к ошибочным выводам относительно роли Δ⁹-цис-THC в растении. Поэтому лаборатории используют комбинации хроматографии с ядерно-магнитным резонансом, что позволяет однозначно распознать пространственную конфигурацию молекулы.
Наличие в конопле
Δ⁹-цис-тетрагидроканнабинол (Δ⁹-цис-THC) в растении Cannabis sativa присутствует в следовых количествах, что существенно отличает его от более распространённого транс-изомера. Его обнаружение в конопле ограничено из-за низкой концентрации и сложности аналитической идентификации, что требует применения методов с высокой чувствительностью и специфичностью. Характерной особенностью его распределения является неравномерность по разным сортовым линиям и типам конопли, а также в зависимости от условий выращивания и хранения растительного сырья. Уровень Δ⁹-цис-THC часто оказывается на грани обнаружения, что объясняется его метаболической нестабильностью и склонностью к изомеризации под воздействием физико-химических факторов.
Преобладающее большинство исследований сосредоточено на идентификации и количественном определении Δ⁹-цис-THC в волокнистых, технических сортах конопли, которые культивируются в Европе и Северной Америке. Эти сорта известны низким содержанием психоактивных компонентов и в большинстве случаев имеют концентрацию транс-THC ниже 0,3%. Аналитические данные показывают, что в таких сортах Δ⁹-цис-THC присутствует в концентрациях, которые часто не превышают 0,01%. Такие данные подтверждают, что цис-изомер не является доминирующим каннабиноидом в промышленном сырье, а скорее следовым побочным продуктом биосинтетических процессов.
Важно отметить, что Δ⁹-цис-THC выявляется преимущественно в форме кислоты — Δ⁹-цис-THCA, которая в растении является более стабильной и не проявляет психоактивности до момента декарбоксилирования. Количество Δ⁹-цис-THCA коррелирует с генетическими особенностями растений и с активностью ферментов, катализирующих синтез каннабиноидов. Преобладающее большинство технических сортов имеет ферментативные пути, ориентированные на образование транс-THCA, что объясняет минимальное накопление цис-изомера.
Наличие Δ⁹-цис-THC также зафиксировано в дикорастущих популяциях Cannabis, которые не проходили селекционного отбора. В этих природных популяциях концентрация цис-THC может быть несколько выше, но при этом она остаётся незначительной по сравнению с транс-изомером. Анализ таких образцов часто сопровождается сложностями, связанными со сложным составом каннабиноидов и их изомеров, что требует использования многокомпонентных методов разделения и спектроскопии.
В культурных медицинских сортах конопли, которые характеризуются повышенным содержанием транс-THC для фармакологических целей, Δ⁹-цис-THC практически не выявляется. Это объясняется целенаправленным селекционным отбором растений с максимальным содержанием транс-изомера, а также условиями культивации, не способствующими биосинтезу цис-изомера. Отсутствие или низкое содержание Δ⁹-цис-THC в медицинских сортах подчёркивает его минимальное значение в фармакологическом профиле растения при коммерческом выращивании.
Кроме сортовых особенностей, важным фактором, влияющим на содержание Δ⁹-цис-THC в конопле, является стадия роста растения. Выявлено, что в молодых стадиях развития, особенно во время цветения, концентрация каннабиноидов, включая цис-THC, является наивысшей. Однако с ростом зрелости растения и в процессе созревания происходит динамическое изменение соотношений каннабиноидов вследствие активности ферментов, катализирующих превращения между разными формами. Эти изменения указывают на сложный метаболический баланс между синтезом и деградацией различных изомеров.
Другим аспектом, влияющим на количество Δ⁹-цис-THC, является технология сбора и обработки растительного сырья. Использование высоких температур, длительное хранение и воздействие света способствуют декарбоксилированию и изомеризации каннабиноидов, что может изменить исходный состав и увеличить или уменьшить количество Δ⁹-цис-THC. Особенно важно контролировать эти параметры при анализе для избежания артефактов, связанных с химической трансформацией каннабиноидов.
Для точного определения наличия и концентрации Δ⁹-цис-THC в конопле применяют высокочувствительные хроматографические методы, сочетанные с масс-спектрометрией и спектроскопией ЯМР. Такой подход позволяет различать цис-изомер от транс-изомера и других структурно схожих молекул с высокой точностью. Эти методы необходимы для исследований, поскольку низкая концентрация и сходство со структурными изомерами осложняют идентификацию.
В результате накопленные данные свидетельствуют, что Δ⁹-цис-THC является редким и нестабильным компонентом каннабиноидного комплекса конопли, который образуется как побочный продукт ферментативных процессов изомеризации и циклизации. Его наличие в природном растении строго контролируется генетическими и внешними факторами, а количество и стабильность зависят от сортовых характеристик и условий культивации.
Этот факт имеет значение для фармацевтической промышленности и аналитических лабораторий, изучающих каннабиноидный состав растительного сырья, поскольку правильное распознавание и количественное определение Δ⁹-цис-THC позволяет избежать путаницы в стандартизации экстрактов и продуктов, а также определить возможное влияние этого изомера на фармакологические свойства конечных препаратов.
Биогенез и возможное происхождение
Биогенез Δ⁹-цис-тетрагидроканнабинола (Δ⁹-цис-THC) в растении Cannabis sativa происходит в рамках сложной сети ферментативных реакций, начинающихся с первичных метаболитов и ведущих к образованию разнообразных каннабиноидных изомеров. Этот процесс тесно связан с общим путём синтеза каннабиноидов, который базируется на поликонденсации фенилуксусной кислоты и изопреноидных предшественников. В рамках этого биосинтетического каскада Δ⁹-цис-THC возникает как побочный или вторичный продукт, образованный через специфические ферментативные и неферментативные преобразования.
Начальный этап биогенеза каннабиноидов связан с синтезом каннабиноидной кислоты — каннабигероловой кислоты (CBGA), которая служит универсальным прекурсором для большинства каннабиноидов. CBGA синтезируется из геранилпирофосфата и оливетоловой кислоты, которые образуются в различных метаболических путях растения. Далее CBGA трансформируется ферментом каннабиноид-синтазой, который катализирует циклизацию и модификацию молекулы до основных каннабиноидных кислот, таких как Δ⁹-транс-тетрагидроканнабиноловая кислота (Δ⁹-trans-THCA), каннабихроменовая кислота (CBCA) и каннабидиоловая кислота (CBDA). Именно из этих основных кислот образуются соответствующие нейтральные каннабиноиды под воздействием тепла или ферментов декарбоксилазы.
Δ⁹-цис-THC считается продуктом, который образуется в результате альтернативного ферментативного цикла или изомеризации, возникающей вследствие активности ферментов с широкой субстратной специфичностью, либо же через неспецифические химические условия, характерные для внутренней среды клетки. Механизмы, приводящие к образованию цис-изомера, включают ферментативную циклизацию CBGA с формированием Δ⁹-цис-THCA, который отличается от обычного транс-THCA конфигурацией стереохимического расположения атомов в цикле. Этот путь пока недостаточно изучен, однако с помощью современных биохимических методов было подтверждено существование соответствующих синтетических ферментов или ферментативной активности, продуцирующей этот изомер.
Помимо ферментативных путей, важную роль в биогенезе Δ⁹-цис-THC играют химические реакции изомеризации и эпимерации, происходящие под воздействием внутренних физико-химических условий. В частности, каннабидиоловая кислота (CBDA) может проходить через эпимерацию, которая приводит к образованию Δ⁹-цис-THCA с последующей декарбоксилизацией в Δ⁹-цис-THC. Этот путь подтверждает, что Δ⁹-цис-THC может возникать не только как прямой ферментативный продукт, но и через промежуточные этапы изомеризации других каннабиноидов. Такие реакции могут протекать в клеточных компартментах, где происходит накопление и трансформация каннабиноидных кислот.
Значительное внимание уделяется потенциалу каннабихромена (CBC) как прекурсора Δ⁹-цис-THC. CBC, который образуется из CBGA с помощью фермента каннабихромен-синтазы, способен подвергаться изомеризации при химических или ферментативных условиях с образованием цис-изомера THC. Этот процесс включает раскрытие и повторное циклизирование молекулы, что изменяет конфигурацию молекулы с транс- на цис-форму. Установлено, что этот путь является одним из дополнительных механизмов, обеспечивающих биоразнообразие каннабиноидов в растении.
Исследования изотопного мечения позволяют проследить пути образования Δ⁹-цис-THC и подтвердить предположения о его происхождении как производного от CBGA или других каннабиноидов. Они свидетельствуют о общих предшественниках с транс-THC, однако различия в ферментативной активации или локализации синтетических комплексов определяют формирование различных стереоизомеров. Это говорит о том, что существуют специфические ферментативные пути, ведущие к образованию цис-изомера, а не только случайные химические преобразования.
Внутриклеточная среда конопли, включая уровень pH, концентрацию ионов металлов, окислительно-восстановительный потенциал, также существенно влияет на направление биосинтеза каннабиноидов. Изомеризация молекул под действием катионов металлов или ферментативных ко-факторов может изменять стереохимию образованных продуктов, способствуя образованию Δ⁹-цис-THC. Такой механизм позволяет рассматривать биогенез цис-THC как многокомпонентный процесс с сочетанием ферментативных и химических реакций.
Молекулярные исследования в области генетики Cannabis также указывают на наличие генов, кодирующих ферменты с разной специфичностью в отношении продукции каннабиноидных изомеров. Это подтверждает идею о существовании альтернативных ферментативных путей, которые могут активироваться в определённых генотипах или под воздействием средовых факторов. Различия в экспрессии этих генов определяют относительную концентрацию Δ⁹-цис-THC в растении.
Значение микробиологических факторов в биогенезе Δ⁹-цис-THC пока остаётся малоизученным направлением, но существуют гипотезы, что симбиотические микроорганизмы, присутствующие на поверхности или внутри тканей конопли, могут влиять на ферментативные или химические процессы изомеризации. Такие микроорганизмы способны продуцировать ферменты или катализировать реакции, модифицирующие каннабиноидный состав растения, в том числе способствуя образованию редких изомеров.
Фармакологическая активность
Фармакологическая активность Δ⁹-цис-тетрагидроканнабинола (Δ⁹-цис-THC) характеризуется рядом уникальных свойств, отличающих его от более изученных транс-изомеров, в частности Δ⁹-trans-THC. Этот изомер взаимодействует с эндоканнабиноидной системой организма, которая состоит из рецепторов, эндогенных лигандов и ферментов, регулирующих их синтез и деградацию. Эндоканнабиноидная система отвечает за поддержание гомеостаза и регуляцию различных физиологических процессов, включая боль, воспаление, нейропротекцию, аппетит, эмоциональное состояние и иммунный ответ.
Δ⁹-цис-THC проявляет фармакологическую активность как частичный агонист основных каннабиноидных рецепторов CB1 и CB2, которые локализованы соответственно в центральной нервной системе (ЦНС) и периферийных тканях. Взаимодействие с этими рецепторами запускает каскад внутриклеточных сигнальных событий, включая ингибирование аденилатциклазы, модуляцию ионных каналов, активацию MAP-киназ и изменение уровня внутриклеточного кальция. Эти механизмы лежат в основе воздействия на нейромедиаторы, в частности ГАМК, глутамат, дофамин и серотонин, которые определяют поведенческие и физиологические эффекты.
Фармакодинамические характеристики Δ⁹-цис-THC отличаются от транс-изомера не только по аффинности к рецепторам, но и по типу активации. В частности, цис-изомер демонстрирует меньшую сродство к CB1, что коррелирует с его меньшей психоактивностью и более мягким влиянием на центральные функции. Этот аспект важен для потенциального медицинского применения, так как сниженная аффинность уменьшает риск нежелательных психотропных эффектов, одновременно сохраняя положительный терапевтический профиль.
Дополнительно, Δ⁹-цис-THC влияет на CB2-рецепторы, которые находятся преимущественно в иммунной системе. Активация этих рецепторов приводит к иммуномодулирующим эффектам, включая подавление продукции провоспалительных цитокинов и модуляцию активации иммунных клеток. Это открывает перспективы применения цис-THC в терапии воспалительных и аутоиммунных заболеваний, где необходима регуляция иммунного ответа без сильного влияния на ЦНС.
Δ⁹-цис-THC также влияет на неканнабиноидные рецепторы и системы, что значительно расширяет спектр его фармакологического действия. Этот изомер способен модулировать активность G-белок-связанных рецепторов GPR18 и GPR55, которые задействованы во многих физиологических процессах, в частности в регуляции боли, воспаления, иммунного ответа и метаболизма. Взаимодействие с этими рецепторами может объяснять некоторые различия в фармакологическом профиле Δ⁹-цис-THC по сравнению с транс-изомером.
Фармакокинетические параметры Δ⁹-цис-THC еще недостаточно изучены, но известно, что этот изомер проявляет схожие с транс-THC характеристики всасывания, распределения, метаболизма и выведения. Метаболизм преимущественно происходит в печени с участием изоферментов цитохрома P450, что приводит к образованию активных и неактивных метаболитов. Однако возможны отличия в скорости метаболизма и образовании метаболитов, которые могут влиять на продолжительность и силу фармакологических эффектов.
В доклинических исследованиях Δ⁹-цис-THC продемонстрировал потенциал как анальгетик, способный уменьшать болевые ощущения за счет модуляции передачи болевых сигналов на уровне периферии и ЦНС. Он также проявляет нейропротекторные свойства, связанные с его способностью снижать окислительный стресс и воспалительные процессы в нейронах. Эти свойства делают цис-THC перспективным кандидатом для исследований в области нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона.
Фармакологические исследования показали, что Δ⁹-цис-THC способен влиять на моторику, аппетит, настроение и когнитивные функции, хотя эффекты проявляются в меньшей степени по сравнению с транс-THC. Это обусловлено разной аффинностью к рецепторам и разным уровнем активации внутриклеточных сигнальных путей. Снижение психоактивного воздействия при одновременном сохранении терапевтической эффективности делает этот изомер привлекательным объектом для разработки лекарственных средств с менее выраженными побочными эффектами.
Общая токсичность Δ⁹-цис-THC на сегодняшний день изучена недостаточно, но эксперименты на животных свидетельствуют о более высокой безопасности по сравнению с транс-THC при сопоставимых дозах. Это связано с ограниченной способностью цис-THC проникать через гематоэнцефалический барьер и меньшей активацией рецепторов в ЦНС. В то же время необходимы дополнительные исследования для уточнения профиля безопасности при хроническом применении.
Δ⁹-цис-THC также проявляет способность к синергизму с другими каннабиноидами и соединениями, находящимися в составе конопли, в частности каннабидиолом (CBD) и тетрагидроканнабинолом (THC). Эти взаимодействия могут усиливать или модулировать фармакологические эффекты, изменяя аффинность, селективность или внутриклеточные сигнальные пути. Такой эффект «энтуразизма» позволяет рассматривать Δ⁹-цис-THC как часть комплексного фармакологического профиля растения, где каждый компонент дополняет и модулирует действие других.
Интерпретация фармакологической активности Δ⁹-цис-THC должна учитывать его химическую стабильность, которая ниже по сравнению с транс-изомером. Под воздействием света, тепла и кислорода цис-THC склонен к более быстрому распаду и образованию продуктов деградации, что может ограничивать его биодоступность и активность в фармакологических системах. Это создает сложности для разработки лекарственных форм с длительным сроком хранения.
Потенциальное использование Δ⁹-цис-THC в терапии зависит от его способности направленно модулировать специфические каннабиноидные и позарецепторные пути без чрезмерной активации ЦНС. Этот баланс открывает новые перспективы в фармакологии, в частности в разработке препаратов с анальгетическими, противовоспалительными, нейропротекторными и иммуномодулирующими свойствами, которые имеют меньше ограничений из-за психотропных эффектов.
Взаимодействие с каннабиноидными рецепторами
Δ⁹-цис-тетрагидроканнабинол (Δ⁹-цис-THC) является каннабиноидом, который проявляет фармакологическую активность через специфическое взаимодействие с каннабиноидными рецепторами типов CB1 и CB2, относящимися к большой семье G-белок-связанных рецепторов (GPCR). Эти рецепторы выполняют центральную роль в регуляции многих физиологических функций, включая нервную передачу, иммунный ответ, а также метаболический гомеостаз. Изучение взаимодействия Δ⁹-цис-THC с этими рецепторами позволяет глубже понять механизмы действия этого изомера, отличия от транс-изомера и потенциал для разработки новых фармакологических агентов.
Рецептор CB1 главным образом локализован в центральной нервной системе, в частности в префронтальной коре, гиппокампе, базальных ганглиях, мозжечке и спинном мозге, а также в некоторых периферических тканях. Взаимодействие с CB1 определяет психоактивный эффект каннабиноидов, модулируя высвобождение нейротрансмиттеров и влияя на синаптическую передачу. Δ⁹-цис-THC, как частичный агонист CB1, демонстрирует меньшую аффинность и активность по сравнению с транс-THC, что обусловливает различия в интенсивности и характере центральных эффектов. Кинетика связывания Δ⁹-цис-THC с CB1 показывает более быстрый диссоциационный процесс, что вызывает более короткий период активации рецептора и потенциально более низкий риск развития толерантности.
На молекулярном уровне взаимодействие Δ⁹-цис-THC с CB1 включает связывание с лиганд-активируемым участком рецептора, который содержит несколько ключевых аминокислотных остатков, формирующих гидрофобные и водородные связи с молекулой лиганда. Конформационная пластичность рецептора под воздействием Δ⁹-цис-THC отличается от транс-изомера, что влияет на активацию внутриклеточных эффекторных белков G_i/o. Это вызывает различия в сигнальных каскадах, таких как ингибирование аденилатциклазы, регуляция ионных каналов и активация MAP-киназ.
Рецептор CB2 преимущественно экспрессируется в иммунокомпетентных клетках, включая макрофаги, моноциты, В- и Т-лимфоциты. Взаимодействие Δ⁹-цис-THC с CB2 имеет важное значение для иммуномодулирующих эффектов, поскольку активация этого рецептора приводит к снижению продукции провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6. Этот процесс обеспечивает противовоспалительный эффект, что является ключевым для потенциального применения Δ⁹-цис-THC в терапии аутоиммунных и воспалительных заболеваний. В отличие от транс-THC, цис-изомер демонстрирует относительно высокую селективность к CB2, что снижает психотропные эффекты и повышает терапевтический индекс.
Связывание Δ⁹-цис-THC с CB2 также приводит к активации внутриклеточных сигнальных путей, таких как фосфолипаза C, регуляция уровня циклического гуанозинмонофосфата (cGMP) и модуляция кальциевых потоков. Эти механизмы способствуют торможению пролиферации и миграции иммунных клеток, а также снижению оксидативного стресса. На молекулярном уровне разница в конформации рецептора CB2 под воздействием Δ⁹-цис-THC по сравнению с транс-THC определяет специфику эффекторных ответов.
Кинетические параметры связывания Δ⁹-цис-THC с обоими рецепторами свидетельствуют о частичной агонистической активности, что позволяет ему активировать рецепторы без полного вовлечения внутриклеточных эффекторов. Этот режим активации важен для снижения побочных эффектов, поскольку полные агонисты могут вызывать сильную десенситизацию рецепторов и развитие толерантности.
Дополнительно, взаимодействие Δ⁹-цис-THC с CB1 и CB2 сопровождается регуляцией экспрессии рецепторов. При длительной экспозиции наблюдается снижение количества рецепторов на мембране клеток, что коррелирует с развитием толерантности. Однако скорость и степень регуляции CB1 и CB2 различаются в зависимости от изомера, при этом Δ⁹-цис-THC имеет потенциально более благоприятный профиль в этом аспекте.
Важным аспектом является также способность Δ⁹-цис-THC влиять на взаимодействие каннабиноидных рецепторов с их эндогенными лигандами — анандамидом и 2-арахидоноилглицеролом (2-AG). Δ⁹-цис-THC конкурирует с ними за связывание, что может модулировать активность эндоканнабиноидной системы как в центральной, так и в периферической нервной системе. Это имеет значение для коррекции нарушений, связанных с дисфункцией этой системы при различных патологиях.
Кроме того, Δ⁹-цис-THC проявляет аллостерическую модуляцию каннабиноидных рецепторов, изменяя их конформацию таким образом, что меняется аффинность к другим лигандам и эффекторная активность. Это открывает возможности для тонкой фармакологической регуляции, что важно при разработке лекарств с более целенаправленным действием.
На уровне сигнальных путей активация CB1 и CB2 Δ⁹-цис-THC приводит к модуляции множества внутриклеточных процессов, среди которых выделяют ингибирование аденилатциклазы, что снижает уровень циклического аденозинмонофосфата (cAMP), активацию протеинкиназы А и фосфорилирование ключевых клеточных белков. Также важным является влияние на MAP-киназы ERK1/2, которые регулируют транскрипцию генов, связанных с клеточным ростом, выживанием и дифференцировкой. Указанные механизмы объясняют анальгетические, противовоспалительные и нейропротекторные эффекты Δ⁹-цис-THC.
Особое внимание уделяют взаимодействию Δ⁹-цис-THC с пресинаптическими CB1-рецепторами, которые контролируют высвобождение нейротрансмиттеров. Частичная активация этих рецепторов приводит к снижению высвобождения глутамата и ГАМК, что регулирует нейрональную возбудимость и синаптическую пластичность. Этот механизм лежит в основе обезболивающего действия и влияния на когнитивные процессы.
Взаимодействие Δ⁹-цис-THC с CB2-рецепторами в иммунной системе включает регуляцию функции макрофагов и микроглии, отвечающих за иммунный надзор и воспалительные реакции в центральной нервной системе. Благодаря этому цис-изомер обладает потенциалом для лечения нейровоспалительных состояний и нейродегенеративных заболеваний.
Другие фармакологические свойства
Δ⁹-цис-тетрагидроканабинол (Δ⁹-цис-THC), помимо взаимодействия с классическими каннабиноидными рецепторами CB1 и CB2, проявляет широкий спектр фармакологических свойств, выходящих за пределы этих рецепторов и включающих связывание с другими G-белок-связанными рецепторами (GPCR), ионными каналами, ферментами, а также модуляцию нейрональной иммунной активности. Эти дополнительные механизмы существенно расширяют потенциал этого изомера в терапевтическом контексте, позволяя ему влиять на разнообразные физиологические и патофизиологические процессы.
Одним из ключевых аспектов является способность Δ⁹-цис-THC взаимодействовать с рецепторами GPR18 и GPR55, которые не относятся к традиционной каннабиноидной системе, но часто рассматриваются как «нестандартные» каннабиноидные рецепторы. GPR18 экспрессируется преимущественно в клетках иммунной системы, включая макрофаги, лимфоциты и микроглию, и играет роль в регуляции воспалительных процессов и клеточной миграции. Активация GPR18 Δ⁹-цис-THC модулирует иммунный ответ, снижая экспрессию провоспалительных цитокинов и способствуя гомеостазу при воспалительных патологиях. Взаимодействие с GPR18 частично отвечает за противовоспалительные эффекты, выходящие за пределы традиционного CB2-опосредованного влияния. Механизмы активации GPR18 включают изменения в активности внутриклеточных сигнальных путей, таких как PI3K/Akt и ERK1/2, которые регулируют клеточный цикл, пролиферацию и выживание.
Рецептор GPR55, который экспрессируется в центральной нервной системе и периферических тканях, считается «каннабиноидным рецептором» с отличным лигандным профилем. Δ⁹-цис-THC является агонистом GPR55, и это взаимодействие связано с регуляцией боли, моторной активности, а также метаболическими процессами. Активация GPR55 модулирует кальциевые каналы и влияет на мобилизацию внутриклеточного кальция, что, в свою очередь, изменяет нейрональную возбудимость и синаптическую пластичность. Этот путь перспективен для разработки анальгетических средств с меньшими психотропными побочными эффектами, поскольку GPR55 не ассоциируется с прямым влиянием на CB1-рецепторы. Регуляция GPR55 Δ⁹-цис-THC также связана с модуляцией метаболического синдрома и воспалительных состояний, что открывает перспективы для применения при лечении диабета и ожирения.
Δ⁹-цис-THC взаимодействует с TRP-каналами (Transient Receptor Potential), в частности с TRPV1 (ваниллоидный рецептор типа 1) и TRPA1, которые играют важную роль в передаче болевых сигналов и терморегуляции. Через активацию TRPV1, Δ⁹-цис-THC вызывает деполяризацию сенсорных нейронов, что приводит к снижению чувствительности к боли. Этот механизм является важной составляющей анальгетического эффекта, независимого от CB-рецепторов, и позволяет воздействовать на невропатическую боль, которую сложно лечить традиционными методами. Взаимодействие с TRPA1 способствует дополнительной регуляции воспалительных процессов через влияние на высвобождение нейропептидов, регулирующих сосудистый тонус и иммунный ответ.
Δ⁹-цис-THC также влияет на ферменты, регулирующие метаболизм эндоканнабиноидов, в частности FAAH (fatty acid amide hydrolase) и MAGL (monoacylglycerol lipase). Эти ферменты отвечают за деградацию ананамида и 2-арахидоноилглицерола (2-AG) соответственно. Изомер обладает способностью ингибировать FAAH, что приводит к повышению уровня эндоканнабиноидов в тканях и усилению эндогенного тонуса каннабиноидной системы. Такой механизм способствует длительному эффекту, включающему снижение боли, улучшение настроения и снижение воспаления без необходимости прямой активации рецепторов. Ингибирование MAGL менее выражено, что делает влияние Δ⁹-цис-THC более избирательным и потенциально снижает риск развития побочных эффектов.
Дополнительно следует отметить взаимодействие Δ⁹-цис-THC с серотониновыми рецепторами, в частности 5-HT1A, которые регулируют тревогу, настроение и боль. Цис-изомер проявляет агонистические или частично агонистические свойства в отношении этих рецепторов, что коррелирует с его анксиолитическими и антидепрессивными эффектами, наблюдаемыми в доклинических моделях. Взаимодействие с 5-HT1A также способствует нейропротекции при различных нейродегенеративных заболеваниях, что связано со снижением нейровоспаления и окислительного стресса.
Еще одним направлением действия Δ⁹-цис-THC является его влияние на калиевые и кальциевые каналы. В частности, он модулирует потенциалзависимые калиевые каналы, что важно для регуляции мембранного потенциала и нейрональной активности. Влияние на кальциевые каналы типа L и N изменяет эксцитаторную синаптическую передачу, что объясняет способность изомера снижать спастичность и судороги. Эти свойства актуальны при лечении рассеянного склероза и других неврологических расстройств.
На иммунном уровне Δ⁹-цис-THC модулирует активацию и функциональную активность различных субпопуляций лимфоцитов. В частности, он ингибирует пролиферацию Т-хелперов типа 1 (Th1), что ведет к снижению продукции интерферона-γ (IFN-γ) и, соответственно, к уменьшению клеточно-опосредованных иммунных реакций. Это открывает перспективы применения изомера при аутоиммунных заболеваниях, где необходима селективная иммуносупрессия. Одновременно поддерживается функция Th2-клеток, что позволяет сохранять гуморальный иммунитет.
Δ⁹-цис-THC демонстрирует также способность влиять на микроглию — иммунокомпетентные клетки мозга, участвующие в нейровоспалении. Изомер тормозит активацию микроглии, снижая секрецию провоспалительных медиаторов и поддерживая нейротрофическую микросреду. Это уменьшает повреждение нейронов при хронических нейродегенеративных процессах и может быть перспективным при болезни Альцгеймера и Паркинсона.
Важной особенностью Δ⁹-цис-THC является его влияние на митохондриальную функцию. Он способен модулировать активность митохондриальных дыхательных комплексов, снижая избыточное образование реактивных форм кислорода (ROS) и стабилизируя мембранный потенциал. Этот эффект способствует снижению окислительного стресса и клеточного апоптоза, что важно для нейропротекции и общего сохранения клеточной жизнеспособности.
В контексте фармакокинетики Δ⁹-цис-THC характеризуется способностью проникать через гематоэнцефалический барьер, что обеспечивает прямой доступ к центральной нервной системе. Он метаболизируется печеночными цитохромами P450, в частности CYP2C9 и CYP3A4, с образованием активных метаболитов, которые могут дополнять фармакологическую активность. Метаболиты обладают различной аффинностью к каннабиноидным и нестандартным рецепторам, что усложняет общую фармакодинамику, но одновременно предоставляет дополнительные возможности для терапевтического использования.
Потенциальное применение и правовой статус
Δ⁹-цис-тетрагидроканнабинол (Δ⁹-цис-THC) представляет собой перспективный фармакологический агент с многочисленными возможными направлениями использования в различных областях медицины и науки. Его уникальный химический и фармакологический профиль открывает новые перспективы для терапевтического применения, хотя одновременно создает сложности в регуляторных и правовых аспектах. Потенциальное применение этого изомера не ограничивается только классическими сферами воздействия каннабиноидов, а охватывает разработку инновационных препаратов для лечения широкого спектра заболеваний, включая нейродегенеративные, аутоиммунные, метаболические и психиатрические нарушения.
На фармацевтическом уровне Δ⁹-цис-THC рассматривается как ценный компонент для создания селективных лекарств, которые могут иметь меньший психотропный эффект по сравнению с традиционным Δ⁹-транс-THC, но при этом сохранять или даже улучшать терапевтическую эффективность. Такая селективность позволяет потенциально минимизировать риск зависимости и негативных когнитивных последствий, что является ключевыми проблемами в применении классических каннабиноидных препаратов. Современные исследования фокусируются на использовании изомера в составе комплексных терапий, где он может выполнять роль модулирующего агента, дополняющего действие других фармакологических веществ.
Одним из перспективных направлений является применение Δ⁹-цис-THC в нейрореабилитации. Благодаря своему мультифункциональному механизму действия, включая антиоксидантные и противовоспалительные эффекты, он может способствовать восстановлению поврежденных нейронных сетей при инсультах, травмах головного мозга и хронических нейродегенеративных заболеваниях. Исследования на моделях экспериментального поражения нервной системы показали, что введение Δ⁹-цис-THC снижает объем поражения тканей, улучшает когнитивные функции и уменьшает воспаление, что делает его потенциальным кандидатом для использования в реабилитационных протоколах.
Важным является потенциал Δ⁹-цис-THC в области онкологии. Его способность модуляции иммунного ответа, а также непосредственное цитотоксическое воздействие на раковые клетки открывает возможности для применения в поддерживающей терапии при онкозаболеваниях. В частности, изомер может повышать эффективность противоопухолевых препаратов за счет снижения резистентности клеток к химиотерапии, а также уменьшать побочные эффекты лечения, такие как тошнота, боль и потеря аппетита. Подобные свойства делают Δ⁹-цис-THC объектом активных клинических исследований с целью разработки новых фармакологических комбинаций.
Еще одним важным направлением является применение Δ⁹-цис-THC в лечении аутоиммунных и воспалительных заболеваний. Его способность селективно ингибировать пролиферацию Th1-клеток, снижать продукцию провоспалительных цитокинов и модуляцию микроглии делает его перспективным для коррекции иммунных дисбалансов. Использование изомера может быть полезным при ревматоидном артрите, системной красной волчанке, мультиплекс склерозе и других хронических воспалительных состояниях, где традиционная иммуносупрессивная терапия часто имеет ограничения из-за побочных эффектов.
В области психиатрии Δ⁹-цис-THC рассматривается как потенциальный агент для коррекции тревожных, депрессивных и посттравматических расстройств. Его частичная агонистическая активность по отношению к серотониновым рецепторам 5-HT1A способствует нормализации эмоционального состояния и улучшению когнитивных функций без выраженного психоактивного эффекта, что является преимуществом по сравнению с традиционными каннабиноидами. Кроме того, модуляция каналов и нейротрофических факторов дает возможность использования Δ⁹-цис-THC в профилактике и лечении посттравматического стрессового расстройства и других сложных психических состояний.
В контексте метаболических заболеваний Δ⁹-цис-THC влияет на регуляцию энергетического обмена, аппетита и глюкозного гомеостаза. Он способен улучшать чувствительность к инсулину, снижать воспаление жировой ткани и влиять на липидный профиль, что открывает перспективы для применения в комплексной терапии сахарного диабета 2 типа и ожирения. Исследования влияния изомера на метаболические процессы показывают, что он может работать как адаптоген, нормализуя метаболический статус при различных патологиях.
Стоит отметить перспективы применения Δ⁹-цис-THC в спортивной медицине и реабилитации. Его противовоспалительное и анальгетическое действие способствует уменьшению боли и воспаления после травм, а также ускоряет восстановление тканей. Кроме того, изомер обладает свойствами, улучшающими качество сна, что является важным аспектом реабилитации и профилактики перетренированности. Использование Δ⁹-цис-THC в спортивной практике требует дальнейших исследований, в частности для установления безопасных доз и режимов применения.
Однако широкое потенциальное применение Δ⁹-цис-THC ограничивается его правовым статусом в различных странах. Законность вещества варьирует от строгого запрета до полной легализации, что создает сложности для научных исследований и клинического внедрения. Во многих юрисдикциях Δ⁹-цис-THC рассматривается как контролируемый наркотик или прекурсор, требующий специальных разрешений для исследовательской работы. Эти ограничения замедляют развитие клинических испытаний и создание новых лекарственных форм.
Отсутствие однозначного международного консенсуса относительно классификации Δ⁹-цис-THC ведет к фрагментации рынка и неравномерному доступу к лечебным средствам. Часто пациенты, которые потенциально могли бы получить пользу от терапии с применением этого изомера, сталкиваются с бюрократическими барьерами, а фармацевтические компании — с рисками инвестиций из-за непредсказуемых изменений регуляторной политики. Это стимулирует поиск компромиссных решений, включая разработку синтетических аналогов или производных с минимизированным психотропным эффектом и менее строгими правовыми ограничениями.
В ответ на эти вызовы формируется тенденция к внедрению гибких регуляторных механизмов, учитывающих научные данные и позволяющих постепенно расширять медицинское использование Δ⁹-цис-THC. Некоторые страны уже создали отдельные программы для контроля за оборотом каннабиноидов в медицинских целях, которые включают обязательный мониторинг эффективности и безопасности. Эти инициативы позволяют собирать клинические доказательства, необходимые для дальнейшей легализации и коммерческого внедрения.
Параллельно развиваются технологии синтеза и формулирования Δ⁹-цис-THC, которые позволяют создавать лекарственные средства с целенаправленной доставкой, улучшенной биодоступностью и контролируемым высвобождением. Это включает нанотехнологические платформы, липосомы, микро- и нанокапсулы, значительно повышающие терапевтический индекс и уменьшающие побочные реакции. Развитие этих технологий открывает дополнительные перспективы для клинического использования изомера в различных терапевтических направлениях.
Медицинское применение
Медицинское применение Δ⁹-цис-тетрагидроканнабинола (Δ⁹-цис-THC) сосредоточено на его фармакологических свойствах, которые делают его перспективным агентом в лечении различных патологических состояний, включая неврологические, онкологические, воспалительные, психиатрические и метаболические заболевания. Отличие Δ⁹-цис-THC от классического транс-изомера заключается не только в структурной конфигурации, но и в специфике взаимодействия с рецепторами и другими мишенями в организме, что обусловливает уникальный спектр фармакологического действия и потенциально снижает побочные эффекты.
В неврологической практике Δ⁹-цис-THC демонстрирует высокую эффективность в регуляции нейропластичности и противодействии нейродегенеративным процессам. Его нейропротекторные свойства объясняются комплексным воздействием на окислительный стресс, воспалительные процессы и апоптоз нейронов. Применение Δ⁹-цис-THC при таких заболеваниях, как болезнь Альцгеймера, Паркинсона, а также при нейротравмах, позволяет замедлить прогрессирование патологии и улучшить когнитивные и моторные функции. Механизмы действия включают активацию антиоксидантных путей, ингибирование микроглиальной активации и модуляцию каннабиноидной системы центральной нервной системы.
При хронических болевых синдромах Δ⁹-цис-THC проявляет выраженное анальгезирующее действие за счет влияния на каннабиноидные рецепторы в периферической и центральной нервной системе. Помимо прямой модуляции болевых импульсов, изомер может снижать воспалительный компонент боли, что особенно важно при артритах, невропатиях, фибромиалгии. Применение Δ⁹-цис-THC позволяет уменьшить дозу опиоидов и нестероидных противовоспалительных препаратов, что значительно улучшает качество жизни пациентов и снижает риск побочных эффектов.
В онкологии Δ⁹-цис-THC имеет потенциал для использования в поддерживающей терапии. Он снижает симптомы, связанные с химио- и радиотерапией, такие как тошнота, рвота, потеря аппетита и хроническая боль. Известны также антипролиферативные эффекты изомера на различные типы опухолевых клеток, которые связаны с индукцией апоптоза, ингибированием ангиогенеза и метастазирования. Это создает возможность включения Δ⁹-цис-THC в комбинированные противоопухолевые стратегии, повышая их эффективность и снижая токсичность.
В случаях аутоиммунных и воспалительных заболеваний Δ⁹-цис-THC выступает как иммуносупрессивный агент с высокой специфичностью. Он регулирует баланс между провоспалительными и противовоспалительными цитокинами, подавляет чрезмерную активацию Т-лимфоцитов и макрофагов, что особенно актуально при ревматоидном артрите, системной красной волчанке, псориазе. При этом влияние Δ⁹-цис-THC не приводит к общему иммуносупрессивному состоянию, что снижает риск инфекционных осложнений.
Психиатрические аспекты применения Δ⁹-цис-THC связаны со способностью модулировать нейротрансмиттерные системы, в частности серотониновую, дофаминовую и ГАМК-эргическую. Этот изомер показывает положительное влияние на симптомы тревоги, депрессии и посттравматического стрессового расстройства, снижая интенсивность панических атак и улучшая эмоциональную стабильность. Его действие сопровождается низким риском развития психоза, что отличает его от транс-изомера и делает перспективным в психиатрической терапии.
В контексте метаболических нарушений Δ⁹-цис-THC проявляет способность регулировать энергетический обмен, стимулировать аппетит и улучшать липидный профиль, что полезно при лечении кахексии, анорексии и метаболического синдрома. Его влияние на глюкозный метаболизм и инсулиновую чувствительность дает основания для дальнейшего изучения как компонента комплексной терапии сахарного диабета 2 типа и ожирения.
Клиническая практика подтверждает перспективность использования Δ⁹-цис-THC в реабилитационных программах после нейротравм и инсультов. Он способствует восстановлению функций нервной системы через стимуляцию нейрогенеза и регуляцию синаптической пластичности, что повышает эффективность традиционной терапии и снижает инвалидизацию пациентов. Его применение в спортивной медицине также получает развитие, благодаря противовоспалительным и анальгезирующим свойствам.
При применении Δ⁹-цис-THC в клинических условиях особое внимание уделяется фармакокинетике и фармакодинамике вещества. Изучение его биодоступности, метаболизма в печени и взаимодействия с другими лекарственными препаратами позволяет оптимизировать дозирование и минимизировать побочные эффекты. Разработка различных лекарственных форм — от ингаляционных спреев до оральных капсул и трансдермальных систем доставки — открывает возможности для индивидуализации терапии и улучшения комплаенса пациентов.
Помимо непосредственного терапевтического применения, Δ⁹-цис-THC используется в фармакологических исследованиях как модельный образец для разработки новых каннабиноидных препаратов со специфическими свойствами. Его структурная модификация дает возможность синтезировать производные с улучшенным терапевтическим профилем и уменьшенными побочными эффектами, что имеет большое значение для развития персонализированной медицины.
Ограничения в применении Δ⁹-цис-THC связаны с необходимостью детального изучения его токсикологии, долгосрочного воздействия на организм и потенциала фармакокинетических взаимодействий. Проведение рандомизированных контролируемых исследований является ключевым для установления доказательной базы и разработки клинических рекомендаций. Современные клинические испытания включают исследования эффективности при различных неврологических синдромах, хронической боли, психических расстройствах и метаболических заболеваниях.
Правовой статус
Правовой статус Δ⁹-цис-тетрагидроканнабинола (Δ⁹-цис-THC) является сложным и неоднородным, поскольку он формируется на стыке фармацевтического регулирования, контроля за наркотическими веществами и специфических законодательных подходов к каннабиноидам. Отсутствие четкого определения в международных и национальных нормативных актах создает неоднозначность в отношении легального статуса этого изомера, что затрудняет его исследования, производство и применение.
Прежде всего, Δ⁹-цис-THC является структурным изомером хорошо известного Δ⁹-trans-THC, который находится в списках контролируемых веществ большинства стран. Однако большинство национальных законов, регулирующих оборот каннабиноидов, формулируют определения на основе конкретной структурной формулы или активного вещества, часто без упоминания стереоизомеров. В результате этого Δ⁹-цис-THC во многих юрисдикциях формально не включён в перечень запрещённых или контролируемых веществ. Это создаёт определённый правовой вакуум, который может как способствовать развитию легального использования изомера, так и приводить к юридическим недоразумениям.
Международные конвенции, такие как Единая Конвенция ООН о наркотических средствах 1961 года и Конвенция ООН о психотропных веществах 1971 года, регулируют каннабиноиды в контексте борьбы с наркотиками. В этих документах акцент сделан на Δ⁹-trans-THC как основной психоактивной субстанции. Определения каннабиса и его производных в конвенциях не детализируют положения относительно стереоизомеров, что даёт возможность отдельным странам интерпретировать статус Δ⁹-цис-THC в соответствии с внутренним законодательством. Это приводит к отсутствию единого международного подхода к регулированию данного изомера, что осложняет его коммерческое и клиническое развитие в глобальном масштабе.
На уровне национального законодательства ситуация ещё более неоднородна. В странах с развитой фармацевтической и каннабиноидной индустрией, таких как США, Канада, Германия, Израиль, правовые нормы часто базируются на определении химической структуры и эффектов веществ. В США, например, Управление по контролю за продуктами и лекарствами (FDA) и Департамент юстиции используют списки контроля за психоактивными веществами, но в них обычно фигурирует Δ⁹-trans-THC. Δ⁹-цис-THC остаётся менее регламентированным, что создаёт пространство для производства и исследований, но также не исключает риск изменения статуса в будущем.
Страны Европейского Союза применяют совместные и национальные подходы к регулированию каннабиноидов. Некоторые страны включают в законодательные акты только основные психоактивные компоненты конопли, что оставляет без внимания изомеры, такие как Δ⁹-цис-THC. Это способствует возникновению ситуаций, когда вещества с каннабиноидной активностью не регулируются или регулируются слабо, хотя при этом их фармакологическое действие может быть значительным. В то же время в ряде юрисдикций растёт тенденция к расширению контроля на все потенциально психоактивные изомеры, что может в будущем повлиять на правовой статус Δ⁹-цис-THC.
Вопросы легализации медицинского и рекреационного каннабиса в мире меняют подходы к регулированию каннабиноидов в целом. В странах, где применяется политика смягчения законодательства по каннабису, существуют попытки детализировать статус отдельных каннабиноидных изомеров, в том числе Δ⁹-цис-THC. Однако в большинстве случаев регуляторы концентрируются на общей психоактивной деятельности продукта, оставляя научно недоказанные изомеры вне строгого контроля. Это создаёт своеобразную «правовую серую зону», где промышленность и учёные могут работать с Δ⁹-цис-THC, но под риском будущих изменений в законодательстве.
Другим аспектом правового статуса является вопрос происхождения вещества. Если Δ⁹-цис-THC добыт непосредственно из растения конопли, то он обычно подпадает под строгий контроль из-за статуса растительного сырья. В то же время синтетические или полу-синтетические варианты изомера, полученные лабораторным путём, могут не иметь чётко определённого правового статуса из-за отсутствия прямых упоминаний в нормативных актах. Это вызывает юридические коллизии в сфере производства и дистрибуции, а также в фармацевтических исследованиях.
Регуляторные органы во многих странах обращают внимание на проблему подобных изомеров с учётом их потенциала к использованию в нелегальных веществах. Существуют примеры, когда новые синтетические каннабиноиды быстро попадают в списки контролируемых из-за их психоактивных свойств, даже без полной научной оценки. Поэтому Δ⁹-цис-THC, несмотря на относительно низкую психоактивность по сравнению с транс-изомером, может оказаться под регуляторным давлением, что ограничит его коммерческое использование.
Значительную роль в формировании правового статуса играет международная политика по контролю за новыми психоактивными веществами (НПВ). Во многих странах Δ⁹-цис-THC может рассматриваться как новое психоактивное вещество, подпадающее под отдельные регуляции для предотвращения нелегального оборота и вреда здоровью населения. Такая политика направлена на быстрое включение новых изомеров и производных каннабиноидов в списки контролируемых веществ, что значительно осложняет легальное применение изомера в фармацевтике и науке.
Правовой статус Δ⁹-цис-THC также определяется через механизмы патентной защиты и интеллектуальной собственности. Сложность в однозначном определении и классификации изомера влияет на возможность оформления патентов на препараты, содержащие Δ⁹-цис-THC или его производные. Отсутствие чётких нормативных рамок замедляет инвестиции в разработку новых лекарств и технологий производства, что дополнительно усложняет легальное развитие этого вещества.
Юридические механизмы контроля над Δ⁹-цис-THC имеют также социально-экономическое измерение. Легализация или криминализация этого изомера влияет на развитие фармацевтической отрасли, создание рабочих мест, а также на рынок медицинских препаратов и пищевых добавок. В странах с развитой биотехнологической индустрией открытость к инновационным каннабиноидам может стимулировать экономический рост, тогда как жёсткие регуляторные ограничения ведут к потере потенциальных инвестиций и устареванию нормативной базы.
Текущие тенденции в мировой правовой практике свидетельствуют о постепенном расширении регулирования, которое начинает учитывать разнообразие каннабиноидных изомеров, включая Δ⁹-цис-THC. Это требует гармонизации международных подходов и обновления национального законодательства с учётом современных научных данных. Активное участие научного сообщества в формировании политики регулирования имеет решающее значение для создания сбалансированной системы, которая позволит одновременно обеспечить безопасность населения и развитие медицины.
Вывод
Дельта-9-цис-тетрагидроканнабинол (cis-THC) является химически и фармакологически уникальным изомером, который существенно отличается от доминирующего в природе Δ⁹-trans-THC. Отличия в стереохимической конфигурации молекулы приводят к изменениям во взаимодействии с биологическими мишенями, что отражается в сниженной аффинности к классическим каннабиноидным рецепторам CB1 и CB2, уменьшенной психоактивности и потенциально отличающемся спектре фармакологической активности. Эта уникальность предоставляет cis-THC перспективу как более безопасного или специализированного терапевтического агента, особенно в случаях, когда необходимо уменьшить психоактивные эффекты, сохраняя при этом полезные фармакологические свойства.
Синтетические пути получения cis-THC имеют существенные сложности, связанные с контролем стереоселективности, выходом и стабильностью продукта. Классические методы синтеза часто являются низковыходными и имеют ограниченную практическую применимость из-за сложности реакций и необходимости в специфических катализаторах. Изомеризация из других каннабиноидов, таких как CBD и CBC, обеспечивает альтернативный способ получения cis-THC, но она требует строгого контроля реакционных условий, чтобы избежать побочных продуктов и потери селективности. Современные технологии синтеза с использованием непрерывных потоков, новейших катализаторов и биокатализа постепенно решают эти проблемы, повышая эффективность, масштабируемость и чистоту конечного продукта, что имеет большое значение для фармацевтической промышленности.
В природном контексте cis-THC присутствует в конопле в очень низких концентрациях, особенно в волокнистых сортах, и отсутствует или почти не выявляется в медицинских сортах. Это ограничивает возможности его прямого выделения из растения, что стимулирует развитие синтетических и полу-синтетических методов производства. Биогенетические механизмы формирования cis-THC остаются недостаточно изученными. Существуют предположения, что он образуется через изомеризацию или эпимерацию предшественников, таких как CBD, в ходе метаболических процессов, однако конкретные ферментативные пути и их регуляция в растении остаются предметом дальнейших исследований. Понимание этих механизмов имеет ключевое значение для возможного биотехнологического подхода к производству cis-THC.
Фармакологический профиль cis-THC отличается не только сниженным связыванием с CB1 и CB2, но и активностью по отношению к другим рецепторным системам, в частности GPR18 и GPR55, что открывает новые горизонты для изучения фармакодинамики этого изомера. Эти альтернативные пути взаимодействия могут объяснять отдельные фармакологические эффекты, которые не полностью коррелируют с классической каннабиноидной системой, что делает cis-THC потенциально ценным в контексте разработки новых лекарственных средств для лечения нейропатической боли, воспалительных процессов и некоторых психоневрологических состояний. В то же время ограниченность имеющихся клинических данных и отсутствие масштабных исследований осложняет точную оценку терапевтического потенциала и профиля безопасности.
Правовое регулирование cis-THC является нестабильным и неоднозначным. Отсутствие четких определений в международных договорах и национальном законодательстве создает правовые пробелы и зону юридической неопределенности, что усложняет коммерческое использование и научные исследования. Изомер часто не включён в перечень контролируемых веществ или не рассматривается отдельно, что формирует потенциал для его использования в медицинских и научных целях без сложных юридических препятствий, но одновременно создаёт риски для легитимности деятельности в различных юрисдикциях. Для эффективного внедрения cis-THC в фармацевтику необходимо формирование специализированных нормативных актов, которые будут учитывать его уникальные свойства, потенциал и риски.
Таким образом, cis-THC является важной молекулой в контексте современной каннабиноидной химии и фармакологии с широким спектром потенциальных применений, вытекающих из его химической и фармакодинамической уникальности. Перспективы его внедрения в медицину напрямую зависят от дальнейшего развития методов синтеза, более глубокого понимания биогенетических механизмов, детального фармакологического исследования и адаптации правового поля. Учитывая комплексность проблем и потенциал, cis-THC занимает промежуточное положение между классическими каннабиноидами и новыми фармацевтическими перспективами, что требует целенаправленных междисциплинарных исследований и регуляторных инициатив для его оптимального использования.
Источники:
- FDA (Управление по контролю за продуктами и лекарствами США) — Регулирование каннабиса и продуктов, полученных из него, включая каннабидиол (CBD)
https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd - Federal Register (Федеральный реестр США) — Реализация Закона о совершенствовании сельского хозяйства 2018 года (Agriculture Improvement Act of 2018)
https://www.federalregister.gov/documents/2020/08/21/2020-17356/implementation-of-the-agriculture-improvement-act-of-2018 - PubMed Central / NCBI (Национальный центр биотехнологической информации, США) — Анализ мощности и безопасности продуктов с Δ⁹-тетрагидроканнабинолом из конопли
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10369762/ - SAMHSA (Управление по вопросам злоупотребления психоактивными веществами и психического здоровья, США) — Изомерия тетрагидроканнабинола: итоги встречи научно-консультативного совета DTAB
https://www.samhsa.gov/sites/default/files/meeting/documents/thc-isomerism.pdf - PubChem / NCBI (Национальная медицинская библиотека США) — Структура и свойства Delta-9-cis-тетрагидроканнабинола (cis-THC)
https://pubchem.ncbi.nlm.nih.gov/compound/Delta-9-cis-Tetrahydrocannabinol - NCBI / NIH (Национальный институт здоровья США) — Cannabis sativa и каннабиноиды: химический состав и биологическая активность
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6770351/ - SpringerLink / Archives of Toxicology — Фармакологическое действие Δ⁹-тетрагидроканнабинола и других каннабиноидов
https://link.springer.com/article/10.1007/s00204-021-03003-3 - DEA (Управление по контролю за наркотиками США) — Классификация наркотических веществ, включая производные каннабиса
https://www.dea.gov/drug-information/drug-scheduling - ScienceDirect / Elsevier — Каннабиноиды: природное присутствие и метаболизм в Cannabis sativa
https://www.sciencedirect.com/science/article/pii/S0031942219304381 - U.S. Department of Justice / Office of Legal Counsel — Правовой статус изомеров Δ⁹-THC по Закону о контроле за наркотическими средствами (CSA)
https://www.justice.gov/olc/opinion/legal-status-delta-9-thc-isomers-under-controlled-substances-act