Молекула Δ9-тетрагидроканнабинола (Δ9-THC) — одна из самых известных, одновременно самых спорных и наименее корректно понятых соединений, когда-либо обнаруженных в природе. Её химическая стабильность, биологическая активность и фармакологическая поливалентность давно вывели эту молекулу за пределы простого природного алкалоида или фитокомпонента. Δ9-THC стал предметом исследований в нейронауках, молекулярной биологии, фармакологии, химии природных соединений, а также эпицентром юридических, этических и социальных дебатов. Такой статус обусловлен не только способностью молекулы влиять на центральную нервную систему человека, но и её уникальным механизмом действия, который задействует эндогенную сигнальную систему, обнаруженную в организме человека сравнительно недавно — эндоканнабиноидную систему.
Исторически изучение Δ9-THC началось с изоляции активного компонента каннабиса в 1964 году израильскими химиками Рафаэлем Мешуламом и Юхелем Гаони. Однако использование каннабиса как психоактивного вещества и фитотерапевтического средства насчитывает тысячелетия. Археологические данные свидетельствуют о культивировании Cannabis sativa ещё в IV тысячелетии до н. э. на территории современного Китая. Со временем менялись лишь социокультурные нарративы: от священного растения, инструмента медитации, до объекта криминализации в XX веке. Тем не менее сама молекула THC — стабильная, биохимически активная, липофильная структура — оставалась неизменной, и лишь человеческие знания постепенно расширялись относительно её свойств.
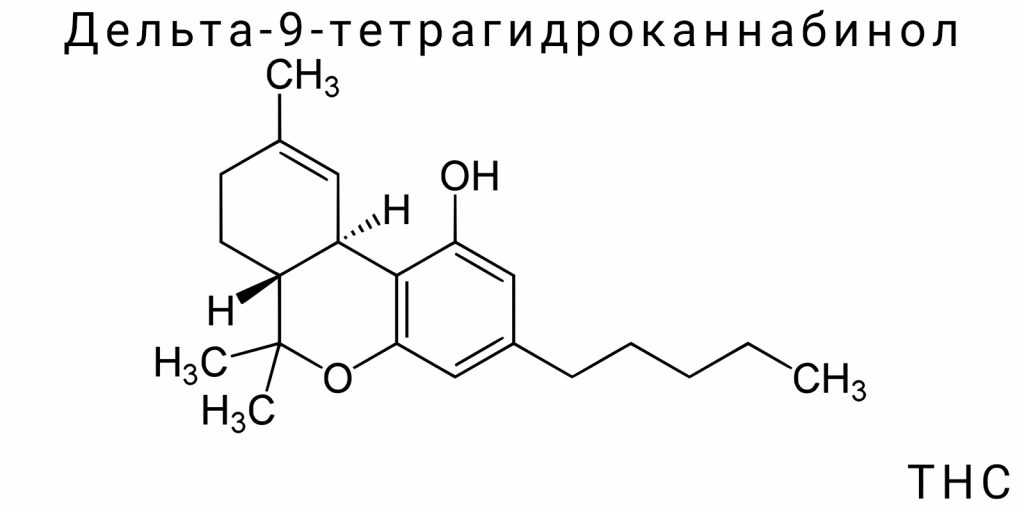
В биохимическом аспекте Δ9-THC является третичным фенолом класса каннабиноидов, который синтезируется в трихомах — микроскопических железах на поверхности женских цветков Cannabis sativa. В природном виде каннабис не содержит психоактивного Δ9-THC, а его кислотный предшественник — тетрагидроканнабиноловую кислоту (THCA), которая под воздействием температуры или длительного хранения проходит процесс декарбоксилирования, превращаясь в активную форму. Этот переход открывает ключ к пониманию механизма психоактивного действия, разворачивающегося через взаимодействие Δ9-THC с каннабиноидными рецепторами первого (CB1) и второго (CB2) типа. Именно такое взаимодействие вызывает эффекты, которые исследователи классифицируют как изменение аффекта, когниции, моторной координации, восприятия боли, аппетита и временной оценки.
Современная наука не сводит THC лишь к психоактивному агенту. Напротив, с развитием нейрофармакологии, биомедицинских технологий и молекулярной диагностики возникает всё более широкое поле применения этой молекулы в медицинском контексте. Обезболивающие, противорвотные, анксиолитические и аппетитостимулирующие свойства THC изучаются как потенциальная альтернатива или дополнение к традиционной фармакотерапии, особенно в онкологии, паллиативной медицине, психиатрии и геронтологии. Многообещающими являются результаты клинических исследований в терапии хронической боли, посттравматического стрессового расстройства (ПТСР), кахексии и глаукомы. Всё это указывает на значительный биомедицинский потенциал THC, который ещё предстоит реализовать в полной мере, но исключительно в рамках строгой научной методологии.
Химическая индустрия одновременно разрабатывает новые методы синтеза, экстракции и очистки THC, позволяющие получать стандартизированные, фармакологически предсказуемые препараты. Вместо традиционного использования высушенного растительного сырья современные лаборатории оперируют чистыми изолятами, дистиллятами, микроэмульсиями и даже наноформами. Благодаря этим технологиям становится возможным точное дозирование, модификация биодоступности, управляемая доставка активного вещества в определённые ткани. Например, сверхкритическая экстракция CO₂ позволяет получать чистую фракцию Δ9-THC без остатков органических растворителей, сохраняя терпеноидный профиль и целостность химической структуры. Такие разработки имеют важное значение для фармацевтического сектора, где биодоступность и стабильность препарата являются критическими параметрами.
В то же время нельзя игнорировать научную сложность изучения THC из-за его высокой фармакодинамической вариативности. Известно, что индивидуальные различия в экспрессии CB1-рецепторов, активности ферментов метаболизма (в частности CYP2C9, FAAH) и даже микробиома желудочно-кишечного тракта существенно влияют на субъективные и объективные эффекты молекулы. Это вызывает потребность в персонализированных исследованиях и применении фармакогенетических подходов в будущем.
В настоящее время научная парадигма относительно THC переживает фазу трансформации: от стигматизированного вещества к объекту системного междисциплинарного анализа. И здесь важно не сводить обсуждение к бинарной дихотомии «польза или вред». Δ9-THC — это не просто «психоактивное вещество» или «лекарство»: это биологически активная молекула, взаимодействующая со сложной сигнальной сетью эндоканнабиноидной системы, последствия которой могут быть как терапевтическими, так и патогенными в зависимости от дозировки, частоты, возраста, генотипа, сопутствующих заболеваний и многих других переменных. Именно такая многовекторность эффектов делает невозможным упрощённое трактование молекулы.
Кроме того, THC — это феномен, имеющий не только биохимическое измерение, но и технологическое, социальное, юридическое и философское. С одной стороны, мы имеем дело с химическим соединением, которое может быть синтезировано в лаборатории или экстрагировано из растительного сырья; с другой — с субстанцией, наделённой сложным историческим и нормативным контекстом. В одних странах Δ9-THC является разрешённым фармацевтическим агентом, в других — незаконным психоактивным веществом. Но ни один правовой статус не меняет объективной химической природы молекулы — её фармакологических свойств, взаимодействий с рецепторами или кинетики в тканях.
В научном понимании важно не делать никаких априорных оценок — ни положительных, ни отрицательных — без строгих доказательств. И именно поэтому современные исследования THC сосредоточены не на моральной или политической легитимности использования, а на точном описании его молекулярного действия, потенциальных рисков и пользы. Такой подход позволяет постепенно превращать THC из объекта табу в полноценный элемент фармакопеи и предмет глубоких междисциплинарных исследований.
Химическая природа Δ9-Тетрагидроканнабинола
Δ9-Тетрагидроканнабинол (Δ9-THC) является представителем класса натуральных липофильных терпен-фенолов, присущих исключительно роду Cannabis. Его химическая природа — пример сложной биоорганической архитектуры, демонстрирующей высокий уровень эволюционной адаптации к взаимодействию с биологическими мишенями млекопитающих. Несмотря на свою природную принадлежность к растительным метаболитам, Δ9-THC сочетает в себе признаки структурной гибкости, стереоспецифичности, функциональной мультипотентности и выраженной химической реактивности. Это не просто фармакологически активное соединение — это биохимически адаптированный сигнальный модулятор, способный изменять нейробиологические паттерны через точное и специфическое взаимодействие с каннабиноидными рецепторами, мембранными липидами, ионными каналами и многочисленными ферментативными системами.
Химическая природа Δ9-THC отражает три фундаментальные особенности: многокомпонентное циклическое строение, значительную гидрофобность и наличие хирального центра. Трициклическая система с ароматическим ядром и частично насыщенными кольцами создает молекулу, которая одновременно является структурно стабильной и конформационно динамичной. Это обеспечивает способность к обратимой адаптации при связывании с белковыми структурами, в частности с гидрофобными карманами рецепторов. Основная молекулярная рамка Δ9-THC содержит бензольный кольцевой фрагмент, обеспечивающий π-π взаимодействия, а также фрагмент изопреноидного происхождения — алифатический пентильный боковой цепь, участвующую в гидрофобных связях с белковыми остатками. Такие цепи играют ключевую роль в селективности и сродстве к каннабиноидным рецепторам, поскольку даже минимальные модификации в этой области приводят к радикальным изменениям фармакологического профиля.
Уникальной чертой Δ9-THC является его способность существовать в виде чётко определённого стереоизомера. Природная форма — это (-)-trans-изомер, который имеет один асимметричный центр при атоме углерода в положении C9. Это означает, что молекула может существовать в двух энантиомерных формах, однако лишь один энантиомер демонстрирует биологическую активность на рецепторах CB1 и CB2. Хиральность в этом контексте не является второстепенной характеристикой — это критический фактор в определении фармакологической специфичности. Исследования с использованием хирально чистых синтетических аналогов доказали, что изменение конфигурации в области C9 приводит к снижению сродства к рецептору более чем в 30 раз, даже при сохранении всех других структурных элементов.
Δ9-THC является химически амфифильным соединением, однако с существенно преобладающими липофильными свойствами. Его коэффициент распределения logP превышает 6, что делает его одним из самых гидрофобных соединений среди натуральных продуктов растительного происхождения с фармакологической активностью. Это свойство обусловливает несколько важных биохимических последствий: во-первых, быстрое накопление в мембранных структурах нейронов и жировой ткани; во-вторых, замедленное выведение из организма; в-третьих, способность к перекрёстному взаимодействию с другими липофильными агентами, включая лекарственные препараты. Именно из-за исключительной липофильности Δ9-THC демонстрирует склонность к нелинейной фармакокинетике, особенно при хроническом употреблении, когда происходит насыщение тканевых депо.
Другим важным аспектом химической природы Δ9-THC является его относительная нестабильность в средах, богатых кислородом, светом и теплом. Окислительная деградация молекулы — главным образом в присутствии ультрафиолетового излучения — приводит к образованию каннабинола (CBN), который значительно уступает THC по аффинности к рецепторам и практически не обладает психоактивным эффектом. Важно отметить, что этот процесс не является мгновенным, а накапливается постепенно, в результате чего старые образцы каннабиса имеют изменённый химический профиль. Именно поэтому химико-аналитическая идентификация и количественное определение THC должны учитывать степень деградации и изомеризации, произошедших во время хранения или обработки образца.
Δ9-THC также проявляет склонность к взаимодействиям с металлическими ионами, в частности Mg²⁺ и Zn²⁺, что может иметь значение в контексте ферментативной трансформации или биоаккумуляции. Исследования in vitro показывают, что Δ9-THC может быть субстратом для систем цитохрома P450, особенно изоферментов CYP2C9 и CYP3A4, которые осуществляют окислительный метаболизм молекулы в печени. Основными метаболитами являются 11-гидрокси-THC (фармакологически активный) и 11-нора-9-карбокси-THC (неактивный, но метаболически стабильный). Это означает, что химическая природа Δ9-THC не ограничивается лишь его структурой в момент поглощения, а включает полный спектр его трансформаций в биологической среде.
Ещё одним малознакомым аспектом химической природы Δ9-THC является его способность к агрегации в липидных средах. Исследования с использованием атомно-силовой микроскопии и спектроскопии флуоресценции показали, что при определённых концентрациях THC может формировать нановезикулы или липидоподобные домены, способные модулировать реологические свойства мембран. Это открывает новое направление изучения мембранно-активных свойств каннабиноидов, которое ранее оставалось практически неисследованным.
С химической точки зрения Δ9-THC — это также соединение с высокой потенциальной реактивностью. Помимо уже упомянутых реакций деградации, молекула способна вступать в конъюгацию с глутатионом, глюкуроновой кислотой или сульфатной группой — процессы, имеющие критическое значение для её обезвреживания и выведения. Такие реакции обеспечивают превращение липофильной молекулы в более водорастворимые производные, которые могут транспортироваться плазмой крови или выводиться через почки. Это указывает на сложное, многоступенчатое взаимодействие химической природы Δ9-THC с детоксикационными системами организма.
Химическая природа Δ9-THC определяет также его взаимодействие с другими фитоканнабиноидами. Исследования синергизма и антагонизма с каннабидиолом (CBD), каннабигеролом (CBG) и каннабихроменом (CBC) указывают, что наличие THC в смеси с другими каннабиноидами изменяет его биологическую активность. Частично это объясняется изменениями в физико-химических свойствах — например, CBD может изменять растворимость THC в водной среде, стабильность при нагревании или метаболический путь.
Структурная формула и основные свойства
Δ9-Тетрагидроканнабинол — это высокомолекулярное соединение с разветвлённой структурной организацией, в основе которой лежит трициклическая система, образованная соединением ароматического кольца, частично насыщенного циклопентана и тетрагидропиранового кольца. Такая архитектура является нетипичной среди природных метаболитов, поскольку сочетает признаки фенильного, терпенового и поликетидного происхождения, что указывает на сложную биосинтетическую эволюцию и глубокую функциональную специализацию. Структура Δ9-THC может быть представлена с помощью развёрнутой конституционной формулы, которая чётко демонстрирует локализацию ключевых функциональных групп, в частности фенольного гидроксила, третичного спирта и метиленовых сегментов пентильного цепи, связанной с ароматическим кольцом в положении C3.
Фенольная гидроксильная группа в положении C1 играет важную роль в реакциях кислотно-основного равновесия, образовании водородных связей, а также потенциальном метаболическом окислении. В свою очередь, третичная гидроксильная группа, расположенная в алициклическом кольце, менее реактивна, однако выступает ключевым центром для фазы II метаболизма, в частности конъюгации с глюкуроновой кислотой. Противоположная сторона молекулы образована пентильной боковой группой — гибким, незамкнутым алкильным фрагментом, который взаимодействует с гидрофобными карманами каннабиноидных рецепторов. Её длина и разветвлённость являются критическими параметрами: вариации даже на один метиленовый фрагмент радикально изменяют сродство к рецепторам CB1 и CB2, что подтверждено многочисленными SAR-исследованиями (Structure-Activity Relationship).
Ещё одним принципиальным структурным элементом является двойная связь в положении Δ9 (между атомами углерода C9 и C10). Именно этот фрагмент определяет принадлежность соединения к категории Δ9-изомеров, в отличие от Δ8- или Δ10-форм, которые менее распространены и обладают изменёнными фармакологическими свойствами. Локализация этой π-связанной системы влияет на планарность части молекулы и её способность к электронной делокализации, что, в свою очередь, отражается на аффинности к мембранным рецепторам. Трёхмерная конфигурация молекулы является полу жёсткой: хотя некоторые связи в алифатических участках способны к свободному вращению, наличие циклических фрагментов значительно ограничивает конформационную гибкость. Это создаёт уникальный профиль взаимодействия с биологическими мишенями, что отличает Δ9-THC от более простых, более гибких липофильных молекул.
Термодинамические параметры THC, такие как температура плавления (~66°C), температура кипения (157°C при давлении 0,05 мм рт. ст.), а также низкая растворимость в воде (<0,003 г/л), отражают его амфифильную, но явно липофильную природу. Способность Δ9-THC к сублимации при пониженном давлении и его нестойкость к длительному нагреванию или УФ-облучению связаны с деликатным балансом между конъюгированными и насыщенными участками молекулы. Этот баланс определяет также спектральные свойства соединения: УФ-абсорбционный максимум в области 270-280 нм, а также специфические колебания в ИК-спектре, отражающие фенольные, алифатические и эфирные вибрации.
В растворе Δ9-THC может образовывать специфические межмолекулярные ассоциаты, особенно в неполярных средах, где гидрофобная агрегация приводит к формированию микрокластеров. Этот эффект не является тривиальным — он изменяет растворимость, диффузию и даже фармакокинетические параметры при трансдермальном или ингаляционном введении. Также важно отметить, что конформационная стабильность молекулы возрастает в липидной среде, что частично объясняет её тропность к липидным доменам биомембран и высокое сродство к нейрональным рецепторам, погружённым в фосфолипидный бислой.
Молекулярная формула: C₂₁H₃₀O₂
Молекулярная формула Δ9-ТГК — C₂₁H₃₀O₂ — отражает точный количественный состав элементов, которые формируют это сложное органическое соединение. Эта формула демонстрирует наличие 21 атома углерода, 30 атомов водорода и 2 атомов кислорода, что соответствует относительной молекулярной массе около 314,45 г/моль. Важно не сводить её к простой числовой конфигурации, ведь каждый из этих атомов участвует в определении функциональных и физико-химических свойств молекулы. Например, из 21 атома углерода по крайней мере 15 участвуют в формировании циклических структур или конъюгированных систем, которые являются критическими для активности на рецепторах CB1/CB2.
Наличие двух атомов кислорода в составе молекулы — это не просто функциональные группы, а стратегически локализованные атомы, которые формируют фенольный гидроксил (-OH) и третичный спирт. Оба этих центра имеют электронодонорный характер, влияют на электронную плотность в локальных участках молекулы и служат как потенциальные точки для химической модификации или биотрансформации. Следует учитывать также изотопный состав — присутствие стабильных изотопов, таких как ¹³C или ²H (дейтерий), может использоваться для мечения молекулы в метаболомных исследованиях или изучении фармакокинетики с помощью масс-спектрометрии.
C₂₁H₃₀O₂ — это формула, которая объединяет в себе терпеновую и фенольную природу: 15 из 21 атома углерода происходят из изопреноидных единиц, что свидетельствует о терпеновой основе молекулы, остальные 6 являются производными фенольного ядра и пентильного цепи. Такой гибридный характер обуславливает особое поведение Δ9-THC в биологических системах, в частности способность к перекрёстному взаимодействию с другими вторичными метаболитами, которые имеют подобную элементную формулу, но различную пространственную структуру.
Молекулярная формула также определяет потенциал к ионизации, хотя Δ9-THC практически не ионизируется при физиологическом pH. Это связано с отсутствием сильнокислотных или сильносщелочных групп, что снижает способность к электростатическим взаимодействиям, но увеличивает проницаемость через липидные мембраны. Кроме того, ограниченное количество атомов кислорода уменьшает полярность молекулы, что напрямую влияет на коэффициент распределения между органической и водной фазами.
Формула C₂₁H₃₀O₂ также накладывает ограничения на спектр возможных реакций, в которых THC может участвовать. Например, реакции галогенирования, эфирификации, ацилирования или окисления могут происходить только с участием определённых участков молекулы. Это критически важно для разработки полусинтетических производных THC, которые обладают модифицированной биодоступностью или специфичностью к рецепторам. Таким образом, базовая молекулярная формула является фундаментом для структурной модификации и химического редизайна в фармацевтическом контексте.
Структура, хиральность, липофильность
Δ9-THC является типичным примером хирального биоактивного соединения с выраженной липофильной характеристикой и структурной сложностью, которая определяет его биохимическое поведение. Хиральный центр локализован в положении C9, где углерод имеет четыре различных заместителя, что создаёт возможность существования двух энантиомеров. Природным является (-)-trans-изомер, обладающий аффинностью к рецепторам CB1/CB2, тогда как другие энантиомеры, хоть и могут быть синтезированы искусственно, лишены значимой биологической активности.
Наличие хиральности у Δ9-THC критически влияет на его фармакодинамику, поскольку рецептор CB1 имеет хиральный карман, чувствительный к конфигурации лиганда. Это означает, что только правильная пространственная ориентация позволяет осуществить полноценное межмолекулярное взаимодействие. Расположение хирального центра также определяет специфичность связывания молекулы в пределах липидного слоя биомембран, поскольку лишь один из энантиомеров может занимать термодинамически стабильную конформацию при встраивании в фосфолипидный бислой.
Липофильность Δ9-THC выражена и многоаспектна. Высокий logP (более 6) указывает на доминирование неполярных участков в молекуле, что обеспечивает пассивную диффузию через мембраны. Это особенно важно для прохождения через гематоэнцефалический барьер, что обусловливает центральное действие THC. Однако такая липофильность вызывает задержку в организме, аккумуляцию в жировой ткани и длительный период полувыведения. Кроме того, она создаёт сложности для водорастворимых фармацевтических форм, что стимулирует поиск липидных носителей или нанотранспортных систем для доставки THC.
Взаимосвязь между структурой, хиральностью и липофильностью — это основа молекулярной фармакологии Δ9-THC. Именно эта триада позволяет молекуле функционировать как природный биоактивный агент, способный к специфическому, гибкому и адаптивному связыванию с широким спектром клеточных мишеней.
Биогенез THC в Cannabis sativa
Биосинтез Δ9-Тетрагидроканнабинола (THC) в растении Cannabis sativa представляет собой сложный многоступенчатый процесс, включающий взаимодействие многочисленных ферментативных реакций в специфических клеточных структурах. Основным биохимическим путём образования THC является каннабиноидный путь, который начинается с синтеза прекурсоров из общеклеточных метаболических сетей и завершается образованием каннабиноидной кислоты — каннабигеновой кислоты (THCA), которая впоследствии при нагревании превращается в психоактивный Δ9-THC. Соответствующие ферменты локализованы преимущественно в масляных железах (трихомах) растения, где формируются характерные кристаллические структуры, отвечающие за накопление и концентрацию каннабиноидов.
Основной биохимический маршрут начинается с конденсации молекулы геранилпирофосфата (GPP) и оливной кислоты (олейной кислоты), которая катализируется ферментом каннабиноид-синтазой. Результатом этой реакции является формирование каннабиноидных кислот — в частности, прекурсора THCA. Далее THCA служит матрицей для формирования активного THC, который является одним из главных психоактивных компонентов. Важно, что биосинтез каннабиноидов — строго регулируемый процесс, зависящий от генетических факторов, экологических условий и стадии развития растения.
Продукция THCA преимущественно происходит в специализированных эпидермальных клетках трихом — микроскопических масляных железах, которые формируют защитный барьер, одновременно накапливая активные метаболиты. Способность трихом к синтезу и хранению каннабиноидов определяет концентрацию Δ9-THC в конечном продукте, а их морфология и плотность являются ключевыми показателями селекции для сортов с повышенным содержанием психоактивных веществ.
Процесс декарбоксилирования, то есть химического превращения THCA в Δ9-THC, происходит под воздействием тепла или длительного хранения. Эта реакция включает потерю карбоксильной группы (CO₂), что изменяет химическую структуру, активируя молекулу к способности связываться с каннабиноидными рецепторами организма человека. Нарушение или неполное декарбоксилирование может значительно снизить фармакологическую активность конечного продукта. Поэтому оптимизация этого процесса является важным этапом в производстве медицинских и рекреационных препаратов из Cannabis sativa.
Каннабиноидный путь биосинтеза
Каннабиноидный путь биосинтеза является одним из наиболее подробно изученных метаболических маршрутов в растениях, который определяет формирование уникальной группы тетрагидроканнабиноловых соединений. Его началом является реакция конденсации изопреноидной единицы геранилпирофосфата с фенольным прекурсором — оливой кислотой, образуя каннабигероловую кислоту (CBGA), которая является ключевым промежуточным продуктом. CBGA, в свою очередь, служит общим предшественником для различных каннабиноидов, включая THCA, CBDA (каннабидиоловая кислота) и CBCA (каннабихроменовая кислота).
Ферментативное преобразование CBGA в THCA происходит под действием фермента THCA-синтазы, являющейся высокоселективной оксидоредуктазой, которая катализирует циклизацию и окисление молекулы. Изучение структуры и механизма действия этого фермента позволяет понять молекулярную специфику образования психоактивного каннабиноида. Генетические вариации фермента, экспрессия соответствующих генов, а также внешние факторы, такие как температура и световой режим, существенно влияют на конечный выход THCA.
В контексте метаболического контроля каннабиноидный путь включает взаимодействие с другими метаболическими звеньями, такими как терпеноидный и фенольный пути, которые поставляют субстраты и определяют химический профиль растения. Такая интеграция обеспечивает не только синтез THC, но и формирование комплекса сопутствующих вторичных метаболитов, которые модулируют фармакологическую активность конечного продукта.
Роль масляных желез (трихом)
Масляные железы, или трихомы, представляют собой микроскопические структуры на поверхности Cannabis sativa, которые выполняют роль биореакторов для синтеза, накопления и хранения каннабиноидов, в том числе THC. Они представлены в трёх основных формах: игольчатые, листовые и капсульные трихомы, из которых капсульные наиболее ответственны за продукцию маслянистого смоляного экстракта.
Морфология трихом предусматривает наличие железистой головки, наполненной липофильной смолой, богатой каннабиноидами и терпеноидными соединениями. Эти смолы защищают растение от патогенов, ультрафиолетового излучения и высыхания. Уровень развития трихом напрямую коррелирует со способностью растения производить THC, поэтому селекция и культивация растений с высокой плотностью трихом является стратегической задачей для повышения выхода психоактивных компонентов.
Биохимические процессы внутри трихом включают высокий уровень экспрессии ферментов каннабиноидного пути, синтез коферментов и активную транспортную деятельность, обеспечивающую локализацию метаболитов в секреторных вакуолях. Также трихомы выступают барьером, изолируя токсичные продукты метаболизма от основных тканей растения, что минимизирует их влияние на физиологические функции.
THCA → Δ9-THC: процесс декарбоксилирования
Преобразование каннабиноидной кислоты THCA в активную форму Δ9-THC является химическим процессом декарбоксилирования, который характеризуется потерей карбоксильной группы (-COOH) в виде углекислого газа. Эта реакция критична для активации психоактивных свойств каннабиноида, поскольку THCA сама по себе не взаимодействует с каннабиноидными рецепторами в организме человека.
Процесс декарбоксилирования происходит при нагревании THCA до температуры около 105-145 °C, что может быть реализовано естественным путем под воздействием солнечного тепла, во время сушки растительного сырья или искусственно в технологических установках. Кинетика реакции зависит от температурного режима, влажности и продолжительности обработки. Чрезмерный нагрев может привести к дальнейшей деградации THC в каннабиноны, обладающие сниженным фармакологическим потенциалом.
На молекулярном уровне декарбоксилирование вызывает изменение электронной конфигурации молекулы, что повышает её сродство к CB1-рецепторам головного мозга и, как следствие, усиливает психоактивный эффект. Понимание детальной механики этого процесса имеет ключевое значение для оптимизации методов экстракции и производства лекарственных средств, содержащих THC.
Производство: от растения до активной молекулы
Процесс трансформации конопли из биологического сырья в высокоспецифичное активное вещество — Δ9-тетрагидроканнабинол — представляет собой многокомпонентную процедуру, охватывающую полный цикл: от выращивания ботанического материала до получения фармацевтически пригодного субстрата с контролируемыми параметрами чистоты, стабильности и биодоступности. В контексте этого преобразования следует рассматривать не только технологическую сторону, но и биохимическую, агрономическую, а также нормативную, поскольку эти аспекты непосредственно влияют на качественный состав конечного продукта.
Начальным этапом производственного цикла является культивация растений рода Cannabis, которые, в отличие от многих других лекарственных культур, демонстрируют высокий уровень хемотиповой вариабельности. Даже в пределах одного вида могут наблюдаться значительные различия в профиле вторичных метаболитов, включая количественное соотношение Δ9-THC, каннабидиола (CBD), каннабигерола (CBG) и других каннабиноидов. Эта хемоварьируемость обусловлена не только генетическими факторами, но и условиями культивации, такими как фотопериод, температура, влажность, pH и состав почвы, а также интенсивность ультрафиолетового излучения. Практика показывает, что даже незначительные колебания в агротехнических параметрах могут привести к изменению каннабиноидного профиля, в частности концентрации Δ9-THC, в пределах десятков процентов. Именно поэтому современные производственные подходы требуют полной стандартизации условий выращивания, часто с применением закрытых тепличных комплексов, гидропоники или аэропоники с компьютеризированным контролем каждого этапа.
После культивации и сбора растительной массы ключевой задачей является стабилизация сырья и предотвращение деградации каннабиноидов. Это предполагает бережную сушку при температуре, не превышающей порог декарбоксилирования кислоты THCA, которая является неактивной формой Δ9-THC. Сушка должна быть достаточной для предотвращения развития микрофлоры, но при этом не настолько интенсивной, чтобы стимулировать деградацию терпенов или инициировать конверсию THCA в Δ9-THC до того, как этот процесс будет контролируемо реализован на следующем этапе. В этом контексте особую роль также играет стабильность трихом — специализированных железистых структур, в которых происходит синтез и накопление каннабиноидов. Чрезмерное механическое или термическое вмешательство в структуру трихом приводит к потере биоактивных компонентов, что снижает выход целевого вещества.
Следующим этапом является собственно экстракция — выделение Δ9-THC из общего матрикса путем селективного разрушения клеточных стенок и переноса активных соединений в жидкую или полутвердую среду. На этом этапе применяются различные технологии, значительно отличающиеся по эффективности, специфичности, безопасности и экологичности. Традиционно использовали механические методы, такие как просеивание сухого сырья (для получения кефа) или ручное прессование (хэш). В промышленном контексте эти методы считаются недостаточно эффективными, поскольку они не обеспечивают должного уровня концентрации и очистки Δ9-THC. Вместо этого более совершенными являются растворитель-ные методы, предполагающие использование полярных или неполярных экстрагентов (этанола, бутана, гексана, сверхкритического CO₂) с последующей фильтрацией, дистилляцией и рефракционной очисткой. Особо стоит упомянуть современные подходы, включая хроматографические методы, молекулярную дистилляцию, а также экстракцию с помощью сверхкритических флюидов, которые позволяют достигать фармацевтической чистоты без остатков токсичных растворителей.
Полученный экстракт в большинстве случаев содержит Δ9-THC в виде кислой формы — THCA, которая фармакологически неактивна. Превращение THCA в Δ9-THC осуществляется путем контролируемого декарбоксилирования — процесса термического разрушения карбоксильной группы с образованием активной молекулы и выделением углекислого газа. Этот процесс критически зависит от температуры и длительности нагрева: оптимальной считается температура около 110-120°C в течение 30-60 минут, однако в промышленных условиях могут применяться более точные температурно-временные протоколы с использованием вакуумной среды для предотвращения окисления. В результате этого этапа формируется именно та целевая форма Δ9-THC, которая обладает высокой биодоступностью и рецепторной аффинностью.
Заключительный этап производства заключается в стандартизации, анализе и стабилизации полученной субстанции. Это предполагает количественное определение Δ9-THC с помощью ВЭЖХ или ГХ-МС (высокоэффективной жидкостной или газовой хроматографии), определение остаточных растворителей, тяжёлых металлов, микробиологических контаминантов, а также профиля терпенов. Продукт, получаемый на этом этапе, может быть представлен в виде концентрата, изолята, смолы или микроэмульсии — в зависимости от назначения (фармацевтического, нутрицевтического или рекреационного).
Источник: ботанические аспекты Cannabis sativa и Cannabis indica
Семейство Cannabaceae включает несколько ботанических видов, наиболее известными среди которых являются Cannabis sativa и Cannabis indica. Эти виды являются основными источниками для производства Δ9-тетрагидроканнабинола (Δ9-THC) и имеют существенные различия на уровне морфологии, химического состава и биологической активности. Прежде всего важно отметить, что биологические различия между этими видами связаны не только с классическими ботаническими признаками, но и с разной регуляцией синтеза вторичных метаболитов, что определяет их применение в медицинской, промышленной и рекреационной сферах.
Cannabis sativa исторически ассоциируется с северными и умеренными климатическими зонами, имеет более крупные растения с тонкими листьями и менее плотными соцветиями. Этот вид отличается более длительным вегетационным циклом, что может влиять на конечное содержание Δ9-THC. Биохимически sativa склонна продуцировать большее количество психоактивного Δ9-THC по сравнению с другими каннабиноидами, однако существуют значительные вариации в зависимости от генотипа. С точки зрения фармакокинетики и фармакодинамики, продукты из sativa часто характеризуются более стимулирующим эффектом, который связывают с соотношением каннабиноидов и терпеноидов, а также с взаимодействием с рецепторами центральной нервной системы.
Cannabis indica, в свою очередь, имеет более компактный стебель, широкие листья и более плотные соцветия. Этот вид лучше приспособлен к высокогорным и субтропическим климатическим условиям, что проявляется в более коротком цикле цветения и более интенсивной биосинтетической активности вторичных метаболитов. Характерной чертой indica является, как правило, более высокое содержание CBD по отношению к Δ9-THC, что формирует более выраженный седативный эффект конечных препаратов. Эти свойства имеют фундаментальное значение для фармакотерапии, в частности в случаях необходимости снижения тревожности, облегчения боли и улучшения сна.
Генетическое и хемотиповое разнообразие обоих видов определяет не только физические параметры, но и продуктивность синтеза Δ9-THC. Результаты недавних молекулярно-генетических исследований показали, что механизмы регуляции гена THCAS, кодирующего фермент тетрагидроканнабинол-синтазу, различаются между sativa и indica, что подтверждает концепцию их раздельной эволюции и адаптации к разным экологическим нишам. В результате концентрация и химический профиль Δ9-THC могут существенно варьировать не только между видами, но и между отдельными популяциями одного вида.
Морфологические различия
Морфологические особенности Cannabis sativa и Cannabis indica не только определяют внешний вид растений, но и влияют на метаболизм и накопление активных веществ, в частности Δ9-THC. Sativa характеризуется высокими стеблями, которые могут достигать 4-6 метров, и узкими, пальчатыми листьями с длинными, тонкими пальцами. Это обеспечивает эффективное фотос восприятие в условиях открытых пространств и более длительных световых периодов. Соцветия у sativa обычно более разреженные, с меньшей плотностью трихом, что потенциально влияет на концентрацию каннабиноидов в растении.
Indica, напротив, имеет низкорослую, кустистую форму с более широкими листьями, которые толще и крупнее по размеру. Соцветия более компактные, густо покрытые смолистыми трихомами, что обеспечивает повышенное накопление каннабиноидов и терпеноидов. Эта морфология отражает адаптацию к более короткому фотопериоду и более экстремальным климатическим условиям, в частности в высокогорьях. Морфологические различия также влияют на соотношение площади листьев к объему стебля, что отражается в метаболических процессах и накоплении биоактивных компонентов.
Кроме того, разница в структуре трихом между видами известна как ключевой фактор, определяющий продуктивность Δ9-THC. Трихомы у indica более многочисленные и имеют более высокую концентрацию ферментов, отвечающих за синтез каннабиноидов, что способствует увеличению концентрации активной молекулы. В то же время у sativa трихомы более разреженные, что объясняет более низкое среднее содержание Δ9-THC в сырье. Эта морфологическая база имеет важное значение для агрономического выбора сортов с целью оптимизации производства Δ9-THC.
На молекулярном уровне морфологические характеристики также определяют регуляцию генов, участвующих в развитии трихом и метаболизме каннабиноидов. Однако стоит отметить, что межморфологические различия не всегда коррелируют с хемотиповым разнообразием, поскольку факторы внешней среды могут модифицировать экспрессию генов и изменять химический профиль растений. Таким образом, морфология является важным, но не исключительным признаком, характеризующим ботанические особенности источника Δ9-THC.
Содержание THC в зависимости от сорта, почв, агротехники
Концентрация Δ9-THC в растениях Cannabis является динамической величиной, которая в значительной мере зависит от сочетания генетических и экологических факторов, а также от методов агротехнического управления. На уровне сортов существует существенная вариация в продуктивности синтеза Δ9-THC, что является результатом селекционных программ, направленных на повышение терапевтической или рекреационной ценности растений. Некоторые сорта характеризуются экстремально высоким содержанием Δ9-THC, превышающим 20-25%, тогда как другие ориентированы на баланс с другими каннабиноидами, в частности CBD.
Почвенные условия играют критическую роль в определении уровня накопления Δ9-THC, поскольку минеральный состав, структура, аэрация и влагоудерживающая способность влияют на метаболические процессы в растении. Например, дефицит азота может приводить к снижению роста вегетативной массы, но стимулировать повышенный синтез вторичных метаболитов, включая Δ9-THC. Напротив, избыток азота часто ассоциируется с уменьшением концентрации каннабиноидов. Аналогично, уровень фосфора, калия, кальция и микроэлементов имеет прямое влияние на функционирование ферментативных систем, определяющих продуктивность биосинтеза.
Агротехнические практики, в частности режимы полива, освещения, плотность посадок и применение стимуляторов роста, также определяют конечное содержание Δ9-THC. Интенсивность светового режима, особенно в спектре UV-B, стимулирует синтез каннабиноидов через активацию систем защиты растения от ультрафиолетового стресса. В ответ на такие условия растения активизируют производство смолистых веществ, среди которых основным является Δ9-THC. Контроль влажности воздуха и почвы должен обеспечивать оптимальные условия для роста трихом и предотвращать развитие болезней, которые могут снизить качество сырья.
Методы экстракции Δ9-THC
Экстракция Δ9-тетрагидроканнабинола (Δ9-THC) является критическим этапом в производстве как медицинских, так и рекреационных препаратов на основе конопли. Технологическая эффективность, чистота и выход активной молекулы зависят от выбранного метода экстракции. Исторически экстракция базировалась на простых механических принципах, которые со временем трансформировались в более сложные химические и физико-химические процессы, учитывающие химическую природу Δ9-THC, его липофильность и термочувствительность. Каждый метод имеет свои преимущества и недостатки, а также специфическое применение в зависимости от конечных целей производства, объема и нормативных требований.
Основой для эффективной экстракции является правильный подбор сырья, степень измельчения, температура и продолжительность процесса. Δ9-THC, как жирорастворимый и термочувствительный каннабиноид, требует соблюдения условий, предотвращающих его деградацию или трансформацию в другие формы, в частности Δ8-THC или каннабинол. Соответственно, оптимизация методов экстракции заключается в балансе между максимальной эффективностью извлечения и сохранением стабильности молекулы.
Современное развитие технологий предусматривает переход от традиционных, часто малоэффективных методов, к высокотехнологичным системам, включающим использование сверхкритических флюидов, ультразвука и мембранных процессов очистки. В то же время базовые механические и химические способы остаются широко распространенными благодаря простоте, доступности оборудования и экономической выгоде. Понимание их механизмов действия, а также ограничений, важно для комплексного подхода в промышленном масштабе.
Традиционные (механические)
Традиционные механические методы экстракции Δ9-THC основаны на физическом отделении смолистых веществ и трихом от растительной матрицы без использования химических растворителей. Эти методы широко использовались задолго до появления сложных технологий и сохранились в виде базовых подходов благодаря простоте реализации и минимальному воздействию на окружающую среду.
Одним из самых распространенных механических способов является просеивание или фильтрация замороженного измельченного растительного материала через сита разного размера. Этот процесс позволяет отделить смолу, содержащую значительную концентрацию Δ9-THC, в виде так называемой «конской шапки» или сухой конопляной пыли — концентрата трихом. Важным условием является поддержание низких температур, что минимизирует потери летучих компонентов и предотвращает тепловую деградацию Δ9-THC.
Еще одним традиционным методом является прессование (холодное или горячее), при котором механическим давлением из растительной массы выделяют масла, богатые Δ9-THC. Хотя этот метод позволяет получить концентрат без химических примесей, он не обеспечивает высокой чистоты, так как вместе с активными веществами могут экстрагироваться углеводороды, клеточные остатки и другие растительные компоненты.
Использование льда, воды и механического трения в виде водной экстракции также относится к традиционным способам. Этот метод основан на способности смолистых трихом отделяться под воздействием холодной воды и движения, что позволяет получить концентраты, известные как «ваш» или «bubble hash». Он не привлекает химических реагентов, однако более трудоемок и менее масштабируем для промышленного производства.
Недостатком механических методов является более низкая концентрация конечного продукта, наличие примесей, а также значительные потери активного вещества из-за неполного извлечения или деградации в процессе. Тем не менее они остаются привлекательными для небольших производств и потребителей, ориентированных на натуральность и экологичность.
Химическая (экстракция растворителями)
Химическая экстракция Δ9-THC использует органические растворители для растворения и извлечения активной молекулы из растительной ткани. Этот метод является доминирующим в промышленном масштабе из-за высокой эффективности, возможности контроля процесса и получения концентратов с высокой чистотой.
Среди растворителей наиболее распространены бутан, этанол, изопропанол, супер-критический углекислый газ, а также гексан и ацетон. Выбор растворителя определяется химическими свойствами Δ9-THC, в частности его липофильностью, и требованиями к конечной продукции. Например, бутан обеспечивает быструю экстракцию с минимальным воздействием на структуру каннабиноидов, однако связан с рисками пожара и остаточных растворителей. Этанол считается более безопасным и экологичным вариантом, но часто извлекает вместе с Δ9-THC и водорастворимые компоненты, что усложняет дальнейшую очистку.
Процесс экстракции обычно состоит из нескольких стадий: мацерация или пропитывание растительного сырья растворителем, извлечение активных компонентов, фильтрация и выпаривание растворителя. Важно строго контролировать температуру и время контакта для избежания термической деградации Δ9-THC и побочных реакций, которые могут изменить профиль продукта.
Супер-критический углекислый газ как растворитель является инновационным подходом, сочетающим физические свойства газа и жидкости, позволяя эффективно извлекать Δ9-THC при низких температурах и без остаточных примесей. Эта технология обладает высокой селективностью, регулируемой по давлению и температуре, что делает её особенно ценной для получения фармакологически чистых экстрактов. Вместе с тем капитальные вложения и сложность оборудования являются барьерами для её широкого применения.
Химическая экстракция обеспечивает лучшую концентрацию Δ9-THC по сравнению с механическими методами, однако требует тщательной очистки продукта от растворителей и примесей, что имеет большое значение для безопасности конечных препаратов.
Современные технологии очистки
После экстракции следующим важным этапом является очистка концентратов Δ9-THC от побочных веществ, растворителей, хлорофилла, липидов и восков. Современные технологии очистки основаны на физико-химических методах, позволяющих максимально сохранить структуру и активность Δ9-THC при одновременном повышении чистоты и стабильности конечного продукта.
Одним из основных направлений является использование хроматографических методов, включая жидкостную хроматографию высокого давления (HPLC) и колонковую хроматографию, которые обеспечивают селективное разделение каннабиноидов и примесей по разным физико-химическим свойствам. Эти методы широко применяются для производства медицинских препаратов, где необходимы стандартизированные концентрации Δ9-THC.
Интенсивно развиваются мембранные технологии, основанные на селективном проникновении молекул через полупроницаемые мембраны. Они позволяют эффективно отделять Δ9-THC от растворителей и примесей при низких энергетических затратах и без химических реагентов. Такие системы повышают экологичность процесса и упрощают масштабирование.
Ультразвуковая очистка использует высокочастотные звуковые волны для разрушения структур примесей и увеличения растворимости целевых веществ, что ускоряет и повышает качество очистки. Комбинированные подходы с использованием ультразвука и хроматографии открывают новые перспективы в производстве высокочистых экстрактов.
Термические методы, такие как вакуумная дистилляция и ректификация, применяются для удаления летучих растворителей и конденсации Δ9-THC с целью получения максимально концентрированных продуктов. Они требуют точного контроля температурного режима для предотвращения изомеризации и деградации молекулы.
Механизм действия: как Δ9-THC взаимодействует с человеческим организмом
Взаимодействие Δ9-тетрагидроканнабинола (Δ9-THC) с человеческим организмом представляет собой сложный биохимический процесс, который является фундаментальным для понимания фармакологии этой молекулы. Δ9-THC — это липофильное соединение, которое легко проникает через клеточные мембраны, что позволяет ему взаимодействовать с рядом внутриклеточных и мембранных компонентов. Его механизм действия существенно отличается от традиционных фармакологических агентов, поскольку он влияет на специфическую систему рецепторов, которая до открытия эндоканнабиноидной системы оставалась неизвестной.
Основой фармакодинамики Δ9-THC является его способность действовать как агонист на каннабиноидные рецепторы, расположенные в нервной системе и периферических тканях. Это взаимодействие модулирует нейротрансмиссию, влияя на высвобождение многих нейротрансмиттеров, включая допамин, гамма-аминомасляную кислоту (ГАМК), глутамат и серотонин. Благодаря этому Δ9-THC способен изменять когнитивные процессы, восприятие, память, а также физиологические реакции организма.
Важно отметить, что Δ9-THC не является полным агонистом этих рецепторов, а обладает частичной агонистической активностью, что определяет его уникальный профиль действия. Он способен вызывать сложный каскад внутриклеточных событий, включая активацию G-белковых рецепторов, что приводит к ингибированию аденилатциклазы, снижению уровня циклического аденозинмонофосфата (цАМФ) и влиянию на ионные каналы. Это, в свою очередь, вызывает модуляцию электрической активности нейронов и изменение баланса нейромедиаторов.
Δ9-THC также взаимодействует с рецепторами, расположенными вне центральной нервной системы, в частности в иммунной системе, что объясняет его влияние на воспалительные процессы и иммунный гомеостаз. Кроме того, исследуются дополнительные молекулярные цели, включая TRPV1-рецепторы, которые участвуют в передаче болевых сигналов, расширяя спектр фармакологического действия Δ9-THC.
Распределение Δ9-THC в организме характеризуется быстрой абсорбцией при ингаляции и более медленным, но длительным действием при пероральном приёме. Липофильность молекулы способствует её накоплению в жировых тканях и последующей медленной депонизации, что влияет на фармакокинетические параметры и длительность действия. Метаболизм Δ9-THC осуществляется преимущественно в печени через систему цитохрома P450 с образованием активных и неактивных метаболитов, которые оказывают различное воздействие на организм.
Результатом этих молекулярных процессов является сложная палитра биологических эффектов, включая психоактивные проявления, изменение сенсорного восприятия, а также физиологические воздействия, такие как анальгезия, противорвотное действие, модуляция аппетита и воспалительных процессов. Особенности механизма действия Δ9-THC определяют его клиническое применение и потенциальные риски, связанные с длительным использованием.
Эндоканнабиноидная система
Эндоканнабиноидная система является молекулярной платформой, которая обеспечивает целостную интеграцию между нервной, иммунной и эндокринной системами человека. Она функционирует как механизм динамической обратной связи, постоянно поддерживающий гомеостаз — состояние биологического равновесия, необходимое для функционирования тканей и органов в условиях изменения окружающей среды. Центральное значение этой системы проявляется в её способности регулировать синаптическую передачу, нейровоспаление, энергетический обмен, а также процессы мотивации, памяти, боли, сна и иммунного ответа.
В отличие от классических нейротрансмиттерных систем, эндоканнабиноидная система работает преимущественно по ретроградному принципу: эндоканнабиноиды синтезируются «по требованию» в постсинаптических нейронах, а затем диффундируют обратно через синаптическую щель, где взаимодействуют с пресинаптическими рецепторами, изменяя вероятность выделения медиаторов. Этот механизм делает систему уникальной регуляторной матрицей, обеспечивающей тонкую настройку нейрональных сетей и локальную регуляцию клеточной среды. К основным эндогенным лигандам системы относятся анандамид (AEA) и 2-арахидоноилглицерин (2-AG), оба из которых являются производными арахидоновой кислоты и действуют как нестойкие, кратковременные сигналы. Синтез и деградация этих молекул строго контролируются ферментативными системами, включая NAPE-PLD, DAGL, FAAH и MAGL, которые координируют появление и исчезновение эндоканнабиноидов в нужный момент.
Регуляторный потенциал этой системы настолько гибок, что она способна как подавлять, так и стимулировать физиологические процессы в зависимости от тканевого контекста, типа клетки, состояния гомеостаза и наличия внешних раздражителей. Эта пластичность обеспечивается широким спектром эффекторных механизмов, через которые эндоканнабиноиды влияют на внутриклеточные сигнальные пути, включая MAP-киназы, PI3K/AKT, NF-κB и другие. ЭКС, таким образом, становится не просто локальной системой передачи сигналов, а многофункциональной сигнальной сетью, координирующей целостные ответы организма.
CB1 и CB2-рецепторы: локализация, функция
CB1 и CB2-рецепторы являются ключевыми структурными компонентами эндоканнабиноидной системы, реализующими её сигнальные функции путем активации G-белок-связанных каскадов. Они отличаются не только структурно, но и по паттернам экспрессии, аффинности к лигандам и функциональному назначению. CB1-рецепторы преобладают в центральной нервной системе и играют ведущую роль в регуляции синаптической передачи, тогда как CB2 преимущественно представлены в клетках иммунной системы и имеют четко выраженную роль в контроле воспаления и иммуномодуляции.
CB1-рецепторы экспрессируются в высокой плотности в таких областях, как гиппокамп, базальные ганглии, кора, мозжечок и спинной мозг. Их локализация отвечает за контроль моторики, когниции, эмоциональных реакций и сенсорного восприятия. На синаптическом уровне CB1-рецепторы расположены на пресинаптических терминалях, где они ингибируют выделение возбуждающих (глутамат) или тормозных (ГАМК) нейротрансмиттеров. Таким образом, CB1 опосредуют локальное «торможение» обратной связью, снижая чрезмерную активность нейронов. Молекулярно это происходит через активацию Gi/o-белков, которые подавляют аденилатциклазу, уменьшают уровень цАМФ, активируют K+-каналы и блокируют Ca2+-каналы, приводя к гиперполяризации нейронов.
CB2-рецепторы преимущественно локализованы в клетках периферической иммунной системы: макрофагах, нейтрофилах, микроглии, Т-лимфоцитах, дендритных клетках, а также в клетках селезёнки, миндалин и костного мозга. Их функция заключается в модуляции продукции прозапальных и противовоспалительных цитокинов, активации фагоцитоза, контроле пролиферации и апоптоза иммунных клеток. Хотя CB2 в норме редко встречаются в центральной нервной системе, их экспрессия может увеличиваться при нейровоспалении или патологии, что открывает новые возможности для терапии нейродегенеративных и аутоиммунных состояний.
Аффинность Δ9-THC к обоим типам рецепторов подтверждает его способность влиять как на нейрофизиологические, так и на иммунные функции. Но при этом CB1-рецепторы являются главной мишенью для психоактивных эффектов, тогда как CB2 реализуют преимущественно периферийное иммунное действие без выраженных изменений в сознании. Эта дихотомия имеет большое значение для фармакологии: она позволяет создавать селективные молекулы, взаимодействующие только с одним подтипом рецепторов для достижения желаемого терапевтического эффекта с минимальными побочными последствиями.
Агонистическое действие THC
Δ9-ТГК действует как частичный агонист обоих каннабиноидных рецепторов, но особенно сильное действие проявляет в отношении CB1, к которому он имеет высокую сродство. Его агонистическое действие дозозависимо и контекстуально изменчиво. При низких концентрациях Δ9-THC может вести себя как слабый агонист или даже антагонист в присутствии более мощных эндогенных лигандов, таких как 2-AG. Однако при высоких концентрациях он занимает рецепторы и активирует полноценный сигнальный каскад, который изменяет нейротрансмиссию, клеточную активность и поведенческие реакции.
Механизм агонизма Δ9-THC заключается в изменении конформационного состояния CB1-рецептора после связывания, что запускает внутриклеточные события через Gi/o-белки. Это ведёт к снижению активности аденилатциклазы, уменьшению продукции цАМФ, а также к торможению напряжённозависимых кальциевых каналов, отвечающих за экзоцитоз везикул с нейротрансмиттерами. Таким образом, Δ9-THC снижает выделение возбуждающих медиаторов, изменяет баланс возбуждения и торможения в нейрональных сетях, что, в свою очередь, трансформируется в изменения настроения, памяти, внимания, болевого порога и моторной координации.
Особенность частичного агонизма заключается в том, что Δ9-THC не активирует рецептор на полную мощность, как это делают полные агонисты (например, синтетические каннабиноиды), поэтому его действие более умеренное, но более длительное. Это снижает токсикологический риск, но также ограничивает максимальный терапевтический эффект. Более того, Δ9-THC может проявлять инверсную агонистическую активность в присутствии высоких концентраций эндоканнабиноидов, изменяя конфигурацию рецептора в обратном направлении.
Его взаимодействие с CB2-рецепторами менее мощное, но значимое в контексте воспалительных и иммунных процессов. В клетках иммунной системы агонистическое действие Δ9-THC подавляет выделение прозапальных цитокинов, снижает экспрессию молекул адгезии и модулирует реактивность иммунных клеток на внешние сигналы. Это имеет потенциал для использования в лечении аутоиммунных заболеваний, хронического воспаления и даже некоторых форм опухолей.
Фармакокинетика и метаболизм
Фармакокинетика Δ9-Тетрагидроканнабинола представляет собой сложную и вариабельную систему, определяющую биодоступность, динамику распределения, метаболическую трансформацию и выведение вещества из организма. Все эти параметры существенно зависят от пути введения, липофильной природы молекулы и индивидуальных особенностей метаболизма, что обусловливает широкий диапазон вариаций в концентрациях и длительности действия даже при одинаковой дозировке.
После ингаляционного введения Δ9-ТГК быстро абсорбируется через альвеолярную мембрану в легких, достигая пиковых концентраций в плазме в течение 3-10 минут. Абсолютная биодоступность при курении составляет от 10 до 35%, в зависимости от техники ингаляции, объема вдоха, длительности задержки дыхания и потерь при сгорании. При пероральном приеме биодоступность значительно ниже — в пределах 6-10%, что обусловлено пресистемным метаболизмом в печени (эффект первого прохождения) и медленной абсорбцией в желудочно-кишечном тракте. Липофильная природа Δ9-ТГК приводит к его активному связыванию с пищевыми жирами, что удлиняет время до достижения Cmax (от 1 до 3 часов) и увеличивает интериндивидуальную вариабельность.
После попадания в системный кровоток Δ9-ТГК почти полностью связывается с белками плазмы — до 97%, главным образом с альбумином, что ограничивает его свободную фракцию и модулирует скорость проникновения в ткани. Благодаря своей высокой липофильности молекула быстро распределяется в хорошо перфузируемые липидные компартменты: головной мозг, легкие, печень, сердце. При хроническом употреблении наблюдается аккумуляция Δ9-ТГК и его метаболитов в жировой ткани, откуда происходит постепенное высвобождение в течение дней и даже недель после прекращения употребления, что объясняет длительное выявление в биологических средах даже после однократного приема.
Метаболизм Δ9-ТГК преимущественно происходит в печени с участием ферментов системы цитохрома P450, главным образом изоформ CYP2C9, CYP2C19 и CYP3A4. Основным путем является гидроксилирование молекулы с образованием 11-гидрокси-Δ9-ТГК (11-OH-THC), который является фармакологически активным и во многих аспектах даже более мощным, чем материнское соединение. Этот метаболит способен быстро проникать через гематоэнцефалический барьер и вызывать психоактивные эффекты, особенно выраженные при пероральном приеме, где его концентрация возрастает значительно больше, чем при ингаляции. Последующий метаболизм 11-OH-THC приводит к образованию неактивного 11-нор-9-карбокси-Δ9-ТГК (THC-COOH), который является основной мишенью для иммунологических и хроматографических методов выявления в анализах мочи.
Период полувыведения Δ9-ТГК варьирует в широких пределах: от 1-2 часов при остром введении до 5-13 дней при хроническом употреблении вследствие депонирования в жировой ткани. THC-COOH и его конъюгаты выводятся из организма преимущественно с калом (до 65%) и в меньшей степени с мочой (20-35%) в виде глюкуронидированных метаболитов. Гидрофильность вторичных метаболитов обеспечивает их способность к почечной экскреции, однако значительная часть остается доступной для рециркуляции через энтерогепатический путь, что удлиняет общий период выведения.
Особую роль в фармакокинетике играют генетические полиморфизмы CYP2C9, которые определяют скорость превращения Δ9-ТГК в 11-OH-THC. Индивиды с вариантами *2/*3 демонстрируют замедленный метаболизм, что повышает риск кумуляции активной формы и усиления психотропных эффектов. Дополнительно, одновременный прием ингибиторов или индукторов CYP3A4 (например, кетоконазола или рифампицина) значительно изменяет плазменные уровни Δ9-ТГК, что имеет критическое значение при терапевтическом применении у пациентов, получающих сопутствующую фармакотерапию.
Отдельное внимание привлекает фармакокинетика при других путях введения, таких как сублингвальный, трансдермальный или интраназальный. Эти пути способствуют частичному обходу печеночного метаболизма, позволяя достичь более высоких концентраций Δ9-ТГК при сниженной доле 11-OH-THC. Таким образом, фармакодинамический профиль меняется в сторону более короткого, но контролируемого действия, что является преимуществом в медицинском использовании.
Фармакокинетические свойства Δ9-ТГК являются ключевым фактором в определении его дозы, частоты введения, ожидаемых эффектов и рисков. Высокая вариабельность, зависимость от пути введения, метаболического профиля и жировой массы пациента усложняет стандартизацию дозы. Поэтому индивидуализация дозирования является принципиально важным условием для минимизации побочных эффектов и достижения терапевтического результата.
Биологические эффекты
Биологическое действие Δ9-Тетрагидроканнабинола является результатом его селективного взаимодействия с рецепторными структурами эндоканнабиноидной системы, которая интегрирована в ряд регуляторных контуров центральной и периферической нервной системы, а также в иммунную, эндокринную, желудочно-кишечную, сердечно-сосудистую и другие физиологические системы. Это взаимодействие не ограничивается нейромедиаторной модуляцией, а имеет трансмембранные, транскрипционные и метаболические последствия, что делает Δ9-ТГК уникальным соединением с полифункциональным профилем действия. Биологический ответ на Δ9-ТГК не является однородным: он варьирует в зависимости от дозы, пути введения, возраста, генетики, нейробиологического статуса, частоты употребления и контекстуальной обстановки. При этом он проявляется в двух взаимосвязанных, но различных плоскостях: психоактивной и физиологической. Первая обусловливает изменения в восприятии, настроении и поведении, вторая — модулирует болевую чувствительность, тошноту, аппетит, температуру тела, тонус сосудов и другие параметры вегетативной функции.
Психоактивные (эйфория, изменение восприятия)
Психоактивные эффекты Δ9-ТГК являются результатом специфического воздействия на нейромедиаторные системы, прежде всего дофаминергическую, глутаматергическую и ГАМК-ергическую. Через CB1-рецепторы, густо представленные в мезолимбической дофаминовой системе (особенно в вентральной тегментальной области и nucleus accumbens), Δ9-ТГК повышает дофаминовую передачу, вызывая субъективно приятные ощущения, которые квалифицируются как эйфория. Это ощущение не является простым «подъемом настроения», а представляет собой сложное когнитивно-аффективное изменение с формированием гедонистической оценки текущей реальности, и это имеет как нейропсихологические, так и поведенческие корреляты.
Помимо дофаминового влияния, Δ9-ТГК модулирует выделение глутамата и ГАМК в префронтальной коре и гиппокампе. Это объясняет типичные для психоактивного состояния нарушения кратковременной памяти, изменение временных структур мышления, дезориентацию в пространстве и явления гиперфокусировки на незначительных сенсорных деталях. Зрительные, слуховые и соматосенсорные стимулы интерпретируются субъективно как более интенсивные или эмоционально окрашенные. Это формирует феномен измененного восприятия, который не является галлюцинацией в классическом смысле, а скорее представляет собой интенсификацию нормальной перцепции — феномен, особенно характерный для умеренных доз Δ9-ТГК.
Другой фундаментальной характеристикой психоактивного эффекта является дезинтеграция функциональных сетей мозга. ФМРТ-исследования демонстрируют снижение функциональной когерентности в DMN (default mode network) — сети, поддерживающей интроспекцию, самосознание и поток сознания. Это может объяснить такие феномены, как субъективное «растворение эго», потерю идентичности, нарушение внутреннего диалога. При этом активируются салиентная и сенсорная сети, что обусловливает повышенное внимание к сенсорным раздражителям.
Изменение аффективного состояния не всегда ограничивается позитивной валентностью. У части индивидов Δ9-ТГК индуцирует тревогу, параноидальные мысли, обостренную саморефлексию и интероцептивную гиперчувствительность, особенно в незнакомой обстановке или при высоких дозах. Считается, что это обусловлено индивидуальными различиями в чувствительности CB1-рецепторов и соотношении между активностью дофаминовой и ГАМК-ергической систем.
Психоактивный спектр эффектов является дозозависимым: низкие дозы способствуют психомоторной релаксации, повышению настроения, социальной открытости, тогда как высокие могут вызывать когнитивные расстройства, дисфорию или даже кататоноподобные состояния. При хроническом употреблении изменяется чувствительность рецепторных систем (десенситизация CB1, нейроадаптация), что ведет к развитию толерантности, необходимости увеличения дозы для достижения того же эффекта, а также к феномену ангедонии в состоянии абстиненции.
Физиологические эффекты (обезболивание, противорвотный эффект)
Физиологическое действие Δ9-ТГК основано на широкой экспрессии CB1 и CB2-рецепторов в различных органах и тканях, а также на модуляции вторичных сигнальных путей, включая системы циклического АМФ, ионных каналов и факторов транскрипции. Одним из наиболее изученных физиологических эффектов является анальгетический потенциал. Δ9-ТГК оказывает обезболивающее действие как на уровне периферической, так и центральной нервной системы. В спинном мозге каннабиноидные рецепторы регулируют высвобождение субстанции P и глутамата в ноцицептивных синапсах, снижая передачу болевого сигнала. В таламусе и коре — влияют на интеграцию болевой информации, тогда как в мезолимбических структурах — на аффективное восприятие боли. Это объясняет как уменьшение физического дискомфорта, так и психоэмоциональное облегчение, характерное для каннабиноидной аналгезии.
Противорвотный эффект Δ9-ТГК опосредован влиянием на область postrema ствола мозга — зону, отвечающую за детекцию токсинов в крови и инициацию рвотного рефлекса. CB1-рецепторы здесь регулируют активацию серотонинергических 5-HT3-рецепторов, ингибируя рвотные импульсы. Это позволяет использовать Δ9-ТГК в терапии тошноты и рвоты, вызванных химиотерапией, где классические противорвотные могут быть неэффективны. Дополнительно, центральная активация каннабиноидных рецепторов стимулирует гипоталамические механизмы голода, активируя секрецию нейропептида Y и ингибируя провоспалительные цитокины, что объясняет аппетитостимулирующий эффект.
Другие физиологические эффекты включают сосудистую дилатацию (особенно на уровне конъюнктивы), снижение внутриглазного давления, миорелаксацию, тахикардию, транзиторную гипотензию, ингибирование моторики желудочно-кишечного тракта и подавление секреции интерлейкинов. При этом каннабиноиды не вызывают подавления дыхательного центра, что отличает их от опиоидов и делает более безопасными в плане летального передозирования.
Долгосрочные эффекты включают модификацию нейроэндокринных осей, в частности гипоталамо-гипофизарно-гонадной, что проявляется в снижении лютеинизирующего гормона и тестостерона у мужчин при хроническом употреблении. Иммуномодуляторное действие Δ9-ТГК реализуется через CB2-рецепторы на лимфоцитах, макрофагах и микроглии: наблюдается подавление пролиферации Т-клеток, снижение продукции TNF-α, IL-2 и интерферона-гамма, что имеет терапевтический потенциал при аутоиммунных патологиях.
Сферы применения: от медицинской до фундаментальной науки
Δ9-Тетрагидроканнабинол, как фармакологически активное вещество с уникальным профилем действия на эндоканнабиноидную систему, перешёл границы сугубо психоактивного или рекреационного использования и приобрёл статус молекулы с высоким интеллектуальным потенциалом для медицины, биотехнологий и фундаментальных наук. Его молекулярное действие, интегрирующее сигнальные каскады центральной нервной системы, иммунитета, эндокринной регуляции и метаболизма, позволяет рассматривать Δ9-ТГК как модельное соединение не только для симптоматического лечения, но и для исследования базовых принципов гомеостатических механизмов у человека.
Сфера применения Δ9-ТГК разворачивается в трёх взаимосвязанных измерениях: клиническом, исследовательском и технологическом. В клинике его используют как анальгетик, антиэметик, миорелаксант, аппетитостимулятор и даже как иммуномодулятор — при этом в каждом случае точка приложения усилий основана на строго определённых рецепторных и трансдукционных механизмах. Это отличает Δ9-ТГК от многих малоспецифичных фитопрепаратов и приближает его к классу прецизионных лекарств, эффективность которых коррелирует с рецепторной экспрессией, полиморфизмом ферментов метаболизма и состоянием нейронных сетей.
Вне клиники Δ9-ТГК является объектом масштабных исследований в сфере нейронаук, молекулярной биологии, фармакогенетики и психиатрии. Модель действия каннабиноидов позволяет с высокой точностью изучать механизмы синаптической пластичности, формирования кратковременной памяти, нейрогенеза и эпигенетических изменений в мозге взрослого человека. Благодаря способности Δ9-ТГК влиять на внутриклеточные пути передачи сигнала, включая MAPK, PI3K/AKT и CREB-зависимые процессы, он рассматривается как инструментальное средство в нейробиологии на уровне клеточной и сетевой регуляции.
Особый интерес представляют исследования, где Δ9-ТГК используют для моделирования психических состояний: тревожности, диссоциации, деперсонализации, параноидальных идей. Это позволяет проверять гипотезы относительно нейрофизиологической природы шизофрении, тревожных расстройств, ПТСР и даже нейроэтологических механизмов сознания. Каннабиноидные эффекты в этом контексте выступают не как артефакт, а как инструмент доступа к латентным психофизиологическим процессам, которые не могут быть инициированы другими фармакологическими средствами с такой же селективностью.
С прикладной точки зрения Δ9-ТГК открыл новую парадигму в фармацевтическом проектировании — препараты на его основе стали полем тестирования для концепций нанотаргетинга, векторного транспорта в ЦНС, оптимизации биодоступности липофильных агентов, а также персонализированной медицины с учётом фармакогенетических параметров. Коммерческие перспективы охватывают разработку ингаляционных форм, трансдермальных систем, оральных липосомальных капсул и даже интеграцию Δ9-ТГК в платформы «умной доставки» на основе функционализированных наночастиц, способных адресно проникать через гематоэнцефалический барьер.
Фундаментальная наука, в свою очередь, использует Δ9-ТГК как зонд для изучения регуляторных механизмов иммунной системы, нейроваскулярного взаимодействия, интероцепции и нейровизуализации. Каннабиноидные рецепторы, активируемые этим соединением, обнаружены в костной ткани, сердечной мышце, микроглии, кишечнике, поджелудочной железе, что делает его релевантным для исследований в таких областях, как регенеративная медицина, метаболомика, микробиомика, онкология. Кроме того, Δ9-ТГК позволяет отслеживать влияние психоактивных агентов на развитие мозга — как в экспериментальных моделях пренатального воздействия, так и в исследованиях подростковой нейропластичности.
Медицинское использование
Медицинское применение Δ9-Тетрагидроканнабинола основывается не на побочных или второстепенных эффектах психоактивности, а на целенаправленном фармакологическом воздействии на каннабиноидную систему, которая интегрирована в ключевые механизмы регуляции боли, тошноты, аппетита, мышечного тонуса, воспаления и нейроэндокринной гомеостатики. Эндоканнабиноидная система действует как нейромодуляторная надстройка над классическими нейромедиаторными сетями, а Δ9-ТГК, как её мощный экзогенный агонист, обеспечивает терапевтическое вмешательство в патологические состояния, сопровождающиеся нарушением этих регуляторных осей. Именно это обосновывает его включение в медицинские протоколы в различных клинических сценариях — прежде всего при хроническом болевом синдроме, рефрактерной тошноте и кахексии, вызванных иммунодефицитными состояниями. Эти эффекты не являются спорадическими или эмпирическими: они задокументированы в систематических обзорах, двойных слепых рандомизированных исследованиях и клинических метаанализах, подтверждающих как эффективность, так и приемлемый профиль безопасности Δ9-ТГК в терапевтических дозах.
Особенность его медицинского применения заключается в том, что его эффекты часто проявляются в случаях, когда классические фармакологические агенты теряют эффективность или имеют неприемлемый уровень токсичности. Это придаёт Δ9-ТГК статус препарата не первой линии, а высокоспециализированной терапевтической опции, применимой тогда, когда традиционные средства не достигают целевого результата. При этом значение имеет не только его действие на отдельные симптомы, но и поликомпонентная модуляция соматических и нейропсихических параметров пациента, что позволяет достигать многовекторного клинического улучшения.
Терапия хронической боли
Анальгетический эффект Δ9-ТГК в контексте хронической боли не является синонимом подавления болевого сигнала, как в случае опиоидов, а реализуется через гибкое модуляционное вмешательство на нескольких уровнях ноцицептивного процесса: периферическом, спинальном, таламокортикальном и аффективно-мотивационном. Через CB1-рецепторы, расположенные на афферентных нейронах задних рогов спинного мозга, Δ9-ТГК снижает высвобождение глутамата и субстанции P, которые являются ключевыми медиаторами передачи болевого сигнала на первом синаптическом этапе. В центральной нервной системе его действие распространяется на таламус, гиппокамп, миндалевидное тело и префронтальную кору, где реализуется модификация эмоциональной окраски боли и её когнитивной интеграции в общую телесную схему пациента.
В случаях нейропатической боли, резистентной к НПВС или антидепрессантам, Δ9-ТГК проявляет способность снижать сенситизацию, индуцированную глиальными клетками, в частности микроглией, которая активируется в ответ на повреждение нервной ткани. За счёт влияния на CB2-рецепторы, экспрессируемые иммунными клетками в центральной нервной системе, он блокирует продукцию провоспалительных цитокинов (TNF-α, IL-1β, IL-6), усиливающих нейропатическую гипералгезию. Это особенно важно при таких состояниях, как рассеянный склероз, хронический радикулит, постгерпетическая невралгия или диабетическая нейропатия.
Клинические исследования с использованием стандартизированных экстрактов каннабиса, содержащих Δ9-ТГК, показали снижение интенсивности боли, оцененной по визуально-аналоговой шкале, на 30-50% у пациентов с рефрактерной хронической болью. Этот эффект достигается при значительно более низком риске развития зависимости или дыхательной депрессии по сравнению с опиоидами. При этом Δ9-ТГК не только снижает интенсивность болевых импульсов, но и улучшает качество сна, уменьшает мышечную ригидность, тревожность и депрессивные симптомы, которые часто сопутствуют хронической боли и формируют её психосоматический компонент. Важно, что в дозозависимом режиме его эффекты могут быть адаптированы под индивидуальную клиническую картину, а форматы доставки — от ингаляций до сублингвальных спреев — обеспечивают контролируемый фармакокинетический профиль.
С учётом этого Δ9-ТГК всё шире применяется как адъювант к стандартной анальгетической терапии, а в ряде случаев — как монотерапия. Его эффективность особенно выражена у пациентов с противопоказаниями к НПВС из-за желудочно-кишечной токсичности или непереносимости опиоидов из-за тошноты, запоров или когнитивных побочных эффектов. В таких случаях Δ9-ТГК демонстрирует стабильный клинический ответ без формирования медикаментозной зависимости или выраженного синдрома отмены.
Антиеметик при химиотерапии
Антиеметический потенциал Δ9-ТГК основан на его способности модулировать серотонинергическую активность в центральных рвотных центрах, в частности в зоне postrema и nucleus tractus solitarius, где сосредоточены 5-HT3-рецепторы, чувствительные к химиотерапевтическим агентам. Δ9-ТГК блокирует активацию этих рецепторов, ингибируя высвобождение серотонина из энтерохромаффинных клеток кишечника и предотвращая передачу сигнала о токсичности в ЦНС. Это объясняет эффективность каннабиноидов в профилактике и лечении тошноты, резистентной к классическим антагонистам 5-HT3.
У пациентов, получающих препараты, содержащие платину, часто развивается как острая, так и отсроченная тошнота, которую трудно контролировать даже с помощью тройной антиеметической терапии. Δ9-ТГК в таких случаях демонстрирует эффективность как в монотерапии, так и в комбинированных схемах. Его преимущество — влияние не только на рецепторный механизм, но и на интегральную аффективную оценку состояния, что позволяет снижать не только соматический, но и эмоциональный дискомфорт, связанный с химиотерапией. Кроме того, Δ9-ТГК нормализует аппетит, стабилизирует настроение, улучшает сон и уменьшает астенические проявления, являющиеся вторичными к интенсивной рвоте.
Фармакокинетическое свойство Δ9-ТГК — пролонгированное действие при приеме внутрь — делает его особенно полезным в профилактике отсроченной тошноты, возникающей на второй-третий день после введения химиопрепарата. У пациентов с частыми эпизодами рвоты применение Δ9-ТГК позволяет избежать дегидратации, электролитного дисбаланса, нутритивной недостаточности и нарушения режима лечения. Эти преимущества позволили официально утвердить синтетические аналоги Δ9-ТГК (дронабинол, набилон) для использования в онкологии в качестве антиеметиков второго ряда при неэффективности стандартной терапии.
Ключевым также является то, что Δ9-ТГК не блокирует нормальный желудочный мотилитет, в отличие от некоторых антиеметиков, вызывающих гастростаз и ухудшающих абсорбцию питательных веществ. Это особенно важно в условиях истощения, характерного для пациентов, проходящих химиотерапию. При этом эффективная доза может быть минимальной и не сопровождаться выраженными психоактивными эффектами, что критично важно для пожилых пациентов или ослабленных болезнью.
Аппетитостимулятор при ВИЧ
Δ9-ТГК показал клиническую эффективность в терапии ВИЧ-ассоциированной кахексии — состояния, характеризующегося анорексией, мышечной атрофией, потерей подкожной жировой клетчатки и общим снижением нутритивного статуса. Механизм его действия заключается в активации CB1-рецепторов в гипоталамусе, в частности в ядрах arcuate и paraventricular, отвечающих за регуляцию голода и насыщения. Стимуляция этих ядер ведет к повышению экспрессии нейропептида Y и агути-подобного белка, которые инициируют пищевое поведение и увеличение калорийного потребления.
Клинические испытания показали, что Δ9-ТГК способен не только повышать аппетит, но и способствовать стабильному приросту массы тела без потери мышечной массы, что является критическим фактором выживаемости у пациентов с ВИЧ. Его эффект не ограничивается кратковременной эйфорической активацией: при регулярном дозировании он нормализует пищевое поведение, снижает тошноту, устраняет аверсию к пище и уменьшает общую астению. В результате улучшается общее физическое состояние, восстанавливается метаболическая стабильность и снижается риск вторичных инфекций.
Δ9-ТГК также модулирует системное воспаление через CB2-рецепторы, снижая уровень провоспалительных цитокинов, играющих роль в патогенезе ВИЧ-индуцированной кахексии. Это позволяет достичь более стабильного нутритивного эффекта, чем при применении стимуляторов аппетита на основе стероидов или прогестинов, которые сопровождаются значительными побочными эффектами. Δ9-ТГК, в отличие от них, не вызывает гипергликемии, задержки жидкости или гинекомастии, что делает его пригодным для длительного применения.
Эффективность Δ9-ТГК в этой области особенно ценна с учетом ограниченного арсенала безопасных и действенных средств для лечения ВИЧ-ассоциированной анорексии. Его применение способствует сохранению терапевтического режима, улучшению качества жизни и общей прогностической перспективы пациентов с тяжелыми формами иммунодефицита.
Исследования в нейронауках и психофармакологии
Интенсивные исследования Δ9-ТГК в области нейронаук выявили гораздо более сложный профиль его действия, чем первоначально предполагалось, исходя из поверхностной характеристики как «рекреационного психоактивного средства». Подходы современной нейрофармакологии открыли фундаментальную роль каннабиноидной сигнализации в регуляции когнитивных процессов, эмоциональной гомеостатики, синаптического ремоделирования, а также нейровосстановления после стресса или травмы. Δ9-ТГК, взаимодействуя с CB1-рецепторами, экспрессируемыми в высокоорганизованных структурах центральной нервной системы — гиппокампе, префронтальной коре, миндалевидном теле, вентральном стриатуме, — модулирует механизмы памяти, обучения, аффективного состояния и нейропластичности. Это влияние не является унифицированно ингибирующим или стимулирующим, как часто некорректно подается в упрощённых популярных источниках, а скорее контекстозависимым: оно меняется в зависимости от фаз консолидации памяти, типа информации (эмоционально насыщенная или нейтральная), условий стресса, хронической тревожности или нейровисцеральной дисфункции.
Роль Δ9-ТГК в экзогенной модуляции эндоканнабиноидной системы в психонейрофизиологическом контексте подтверждается экспериментальными моделями на животных, функциональной МРТ, PET-исследованиями, электрофизиологией синаптической передачи и анализом транскриптомного профиля нейронов. В частности, выявлено, что действие Δ9-ТГК может приводить к кратковременному подавлению глутаматергической передачи в зоне CA1 гиппокампа, что снижает объем информации, способной к консолидации в долговременную память. В то же время в других контекстах Δ9-ТГК проявляет нейропротекторные свойства: при экспериментальных моделях индуцированной тревожности или посттравматических реакций он нормализует гиперактивность миндалевидного тела и снижает патологическое формирование страхового воспоминания.
Нейронаучные исследования подтверждают, что каннабиноидный тонус — одна из ключевых надстроек над синаптической пластичностью, действующая в формате обратного контроля: CB1-рецепторы, расположенные на пресинаптических терминалях, активируются ретроградными эндоканнабиноидами, выделяемыми постсинаптически, что обеспечивает фокусную синаптическую ингибицию без общего торможения. Экзогенный Δ9-ТГК, активируя те же механизмы, вмешивается в тонкую динамику синаптического веса, иногда усиливая, иногда снижая её в зависимости от активности сетей. Это открывает пространство не только для изучения потенциальных когнитивных рисков, но и для контроля патологического синаптического ремоделирования, например при ПТСР или нейродегенеративных заболеваниях.
Влияние на память, обучение, синаптическую пластичность
Экспериментальные данные демонстрируют, что Δ9-ТГК нарушает кратковременную память у здоровых субъектов путем подавления синаптической передачи в гиппокампе — главной структуре, ответственной за консолидацию событийной памяти. Пресинаптические CB1-рецепторы, активируемые Δ9-ТГК, блокируют высвобождение глутамата и ГАМК, изменяя баланс возбуждения/торможения в ключевых нейрональных микросхемах. Это может приводить к нарушению формирования LTP (долговременной потенциации) — электрофизиологической основы обучения. У молодых здоровых субъектов это проявляется как транзиторное ухудшение вербальной памяти или снижение скорости когнитивной обработки.
В то же время при патологической нейрональной сверхвозбуждаемости, такой как хронический стресс, травматические переживания, эпилепсия или нейровоспаление, Δ9-ТГК выступает как нормализующий агент, который снижает избыточную синаптическую активность и защищает от синаптотоксичности. В таких случаях он блокирует патологическую гиперпотенциацию и препятствует фиксации чрезмерно аффективно окрашенной информации. При моделировании ПТСР у животных Δ9-ТГК предотвращает консолидацию патологической страховой памяти и ускоряет её угасание, что открывает перспективы для терапии расстройств, связанных с патологической персистенцией травматических воспоминаний.
Кроме того, Δ9-ТГК способен влиять на механизмы нейрогенеза. В взрослом гиппокампе экспрессия CB1-рецепторов на нейрональных стволовых клетках определяет скорость пролиферации и дифференцировки новых нейронов. Некоторые данные свидетельствуют, что при хроническом введении низких доз Δ9-ТГК у старых животных происходит восстановление нейропластичности, улучшение когнитивных функций и снижение воспалительного профиля мозга. Это ставит вопрос о потенциале Δ9-ТГК или его модифицированных аналогов в коррекции когнитивного спада при старении или при легких когнитивных нарушениях начальных стадий деменции.
Однако существует и обратная сторона: при хроническом злоупотреблении Δ9-ТГК в подростковом возрасте, когда префронтальная кора и гиппокамп еще находятся в фазе активного развития, фиксируется долговременное снижение LTP, уменьшение объёма синапсов, снижение экспрессии генов, связанных с нейропластичностью (например, BDNF), что коррелирует с дефицитом рабочей памяти и исполнительных функций. Это демонстрирует критическую важность дозирования, возраста, продолжительности и контекста в оценке когнитивного влияния Δ9-ТГК.
Потенциал в терапии PTSD, тревожности
Посттравматическое стрессовое расстройство — это сложная нейропсихиатрическая патология, в основе которой лежит нарушение эндоканнабиноидного контроля над системами эмоциональной памяти, стресс-реакции и торможения страха. У пациентов с ПТСР выявлено снижение базального уровня эндоканнабиноидов в плазме крови, гипоактивность CB1-рецепторов и гиперактивность амигдалы при воздействии травматических триггеров. Δ9-ТГК в этом контексте действует как функциональный модулятор, который компенсирует дефицит эндоканнабиноидной передачи, снижает аффективную интенсивность воспоминаний, ингибирует реактивность гипоталамо-гипофизарно-надпочечниковой оси и ускоряет угасание патологической памяти страха. Это подтверждено в клинических пилотных исследованиях, где применение Δ9-ТГК перед сессиями экспозиционной психотерапии снижало уровень тревоги, способствовало формированию новых ассоциаций безопасности и повышало эффективность психотерапевтического вмешательства.
Помимо PTSD, клинические и нейровизуализационные данные свидетельствуют о том, что Δ9-ТГК в низких дозах может уменьшать патологическую тревожность путем нормализации гиперактивности миндалины и снижения патологической связи между амигдалой и префронтальной корой. В случаях генерализованного тревожного расстройства, социальной фобии и обсессивно-компульсивного расстройства наблюдается положительная динамика на фоне приема Δ9-ТГК, в частности уменьшение физиологических симптомов тревоги — тахикардии, мышечного напряжения, желудочно-кишечных расстройств. Эффекты, однако, имеют узкое терапевтическое окно: при превышении дозы Δ9-ТГК сам по себе может индуцировать тревожность или паническую атаку, что требует строгого контроля и индивидуализации схемы применения.
В спектре тревожных расстройств Δ9-ТГК выполняет роль не седации или торможения, а тонкого реставратора нейроаффективного баланса, где главная мишень — патологическая возбудимость нейронных сетей, реагирующих на незначительные триггеры как на угрозу. Его фармакологическое действие не является изолированным, оно дополняет психотерапевтические подходы, обеспечивая нейробиологическое «пластичное окно», в рамках которого психотерапия может быть эффективнее.
Современные исследования, в том числе с использованием ПЭТ, выявили, что пациенты с ПТСР имеют дефицит CB1-рецепторной плотности, особенно в левой миндалине и гиппокампе. В таких случаях Δ9-ТГК частично компенсирует потерю чувствительности к эндоканнабиноидам, что объясняет его эффективность именно в этой категории пациентов. На этом фоне развиваются исследования синтетических аналогов Δ9-ТГК с модифицированной аффинностью к CB1/CB2 или частичным агонизмом, которые позволят минимизировать риски психоактивности при сохранении терапевтического профиля. Это особенно перспективно для будущей психофармакотерапии тревожных расстройств, рефрактерных к SSRI или SNRI.
Промышленное и фармацевтическое производство
Развертывание производственных линий для изготовления Δ9-ТГК-сырья и препаратов на его основе требует чрезвычайно жесткой технологической, фармацевтической и регуляторной дисциплины. Это не просто масштабирование ботанической экстракции, а скорее сложный многоэтапный биотехнологический процесс, объединяющий агрогеномику, высокоточную экстракцию, хроматографическую очистку, стандартизацию концентраций и включение в пригодные для клинического применения формы. На стыке химии, биоинженерии и молекулярной фармакологии современное производство Δ9-ТГК вышло далеко за пределы каннабис-культивации, вобрав в себя новейшие разработки в области нанотехнологий, векторного транспорта, фармакокинетического программирования и молекулярной стабилизации. Доминирующими парадигмами являются микродозирование, максимальная биодоступность при минимальной психоактивной нагрузке и точное контролируемое действие, ориентированное на специфический рецепторный профиль пациента.
Структура фармацевтического цикла включает выращивание генетически стандартизированных сортов с прогнозируемым профилем каннабиноидов, далее — сверхкритическую CO₂-экстракцию, хроматографическое разделение, фракционную очистку, декарбоксилирование и контрольную стабилизацию Δ9-ТГК. В процессе очистки достигается изоляция не только чистого Δ9-ТГК, но и синтез его фармацевтически адаптированных аналогов — например, дронобинола, левонанабинола или новых вариантов с модифицированной аффинностью к CB1/CB2-рецепторам. Стандарты GMP регламентируют допустимые примеси до микрограммов на грамм, что превращает каннабисовую сыворотку из аграрного продукта в фармацевтическую субстанцию высокой чистоты. Этот уровень контроля необходим для гарантии стабильности фармакокинетики, исключения изменений психоактивности от партии к партии и обеспечения достоверности дозирования в условиях клинического применения.
Значительную роль играет также формат препарата: изолированный Δ9-ТГК в масляной основе, капсулах, микроэмульсиях, назальных спреях или трансдермальных системах. Каждая форма разрабатывается с учетом специфики заболевания, скорости наступления эффекта, длительности действия и профиля нежелательных эффектов. Фармакотехнологи модулируют кинетику высвобождения через использование матричных полимеров, липидных носителей или наносуспензий, адаптируя их к требованиям пациент-ориентированной терапии. Это становится особенно критичным в случаях нейропсихиатрических расстройств или онкопатологий, где допустимый диапазон концентраций в плазме чрезвычайно узкий.
Индустриальная трансформация Δ9-ТГК требует также глубокого правового регулирования. В странах с легализованным медицинским каннабисом применяются модели лицензирования, контрольного протоколирования, электронного рецептурного оборота и полной прослеживаемости партий — от растения до препарата. Это формирует новый подход к стандартизации фитоканнабиноидов как фармакоактивных веществ, которые по всем параметрам должны соответствовать требованиям Европейской фармакопеи или USP. В то же время формируется инновационная экосистема — от биобанков сортов до искусственного интеллекта в оптимизации условий культивации, обеспечивающих необходимый хемотип каннабиноидного профиля для дальнейшего фармацевтического синтеза.
Прецизионная медицина
Прецизионная медицина на основе Δ9-ТГК исходит из принципа индивидуального фармакогенетического профиля пациента — с учётом полиморфизмов генов рецепторов CB1/CB2, ферментов CYP2C9 и FAAH, состояния эндоканнабиноидного тонуса и особенностей метаболизма. Уже установлено, что варианты в гене CNR1 могут модулировать чувствительность к Δ9-ТГК, формируя склонность как к терапевтическому, так и к побочному эффекту — например, когнитивному угнетению или психотическим реакциям. Так же полиморфизм CYP2C9*3 снижает скорость метаболизма Δ9-ТГК, удлиняя его действие и повышая риск кумуляции. В рамках персонализированного подхода это требует адаптации дозы, ритма приёма и формы препарата.
Прецизионная терапия Δ9-ТГК также учитывает специфику клинического состояния: например, у пациентов с нейропатической болью предпочтение отдается высокоскоростным ингаляционным или сублингвальным формам с пиковой концентрацией в течение 5-10 минут, тогда как при онкологическом кахектическом синдроме — медленно действующим трансдермальным системам, обеспечивающим стабильный уровень в течение суток. Для больных с ПТСР или тревожными расстройствами выбираются микродозы с пролонгированным высвобождением, которые не вызывают психоактивности, но обеспечивают нормализацию тонуса амигдалы.
Технологически это реализуется через применение новейших методов микроинкапсуляции Δ9-ТГК в биодеградируемые полимеры, которые позволяют контролировать скорость высвобождения и избегать пиковых колебаний концентрации. Системы с контекстно-зависимой активацией (например, фоточувствительные или pH-чувствительные нанокапсулы) открывают возможность введения Δ9-ТГК в виде «интеллектуальных препаратов», активирующихся только в специфическом микроокружении патологического процесса — например, в зоне нейровоспаления или опухоли.
Отдельным направлением является алгоритмическое программирование фармакотерапии — использование искусственного интеллекта для адаптации схемы назначения Δ9-ТГК в зависимости от биомаркеров пациента, нейровизуализационного профиля, психометрических данных и метаболических индикаторов. Такие системы в экспериментальных условиях уже демонстрируют улучшение контроля хронической боли, снижение тревожности и уменьшение побочных эффектов за счёт точного динамического дозирования в реальном времени. Это создаёт новое измерение в фармакотерапии на основе Δ9-ТГК — не только как вещества, но и как управляемой платформы.
Векторные разработки наноформ THC
Использование нанотехнологий в формировании векторных систем доставки Δ9-ТГК стало одним из ключевых прорывов в преодолении фармакокинетических барьеров этой молекулы. Из-за высокой липофильности и склонности к метаболизму первого прохождения Δ9-ТГК имеет низкую биодоступность при пероральном введении — около 6-10%. Наноформуляции в виде липосом, наноструктурированных липидных носителей, полисахаридных матриц или полимерных нанокапсул обеспечивают защиту молекулы от энзиматической деградации, улучшают её растворимость в водной среде, продлевают время циркуляции и позволяют адресную доставку к специфическим тканям.
В системах векторного транспорта Δ9-ТГК может быть инкапсулирован в наночастицы с модифицированной поверхностной функциональностью — например, с помощью лигандов к рецепторам CD44 (которые экспрессируются при воспалении), или антиепитопов к клеткам опухоли. Это обеспечивает прецизионную локализацию препарата в зонах патологии при минимальной системной экспозиции. При нейродегенеративных заболеваниях, где нарушен гематоэнцефалический барьер, наноформулированный Δ9-ТГК демонстрирует способность проникать в мозг с большей эффективностью, чем обычные липофильные молекулы.
Также разрабатываются гибридные системы, в которых Δ9-ТГК сочетается с другими биоактивными компонентами, например, противовоспалительными пептидами или ингибиторами FAAH, что обеспечивает синергический эффект. Эти композиции позволяют модулировать не только силу и продолжительность эффекта Δ9-ТГК, но и его качественный характер — например, снизить риск психоактивности при сохранении аналгезии.
Векторные формы также открывают путь к новым путям введения — интраназальному, ингаляционному, трансдермальному или даже интракраниальному, что особенно актуально для лечения локализованных опухолей ЦНС или очаговой эпилепсии. Все эти технологии активно патентуются и уже частично входят в клиническую практику в рамках экспериментальных протоколов или расширенного доступа для тяжёлых пациентов.
Заключение
Комплексное изучение Δ9-тетрагидроканнабинола (Δ9-ТГК) в рамках мультидисциплинарного подхода, охватывающего химию, ботанику, биохимию, молекулярную фармакологию, нейронауки, медицину и индустриальные технологии, демонстрирует, что данное соединение является исключительным примером биоактивного природного продукта с многовекторным механизмом действия, высоким биохимическим потенциалом и фармакологической селективностью. В отличие от многих психоактивных веществ растительного происхождения, Δ9-ТГК не только стал объектом интенсивного научного интереса, но и сформировал вокруг себя целую индустрию, которая одновременно руководствуется строгими научными критериями, клиническими протоколами, фармацевтическими стандартами, а также регуляторными, юридическими и социальными ограничениями. Всё это формирует уникальный случай в современной науке, когда химическое вещество, выделенное из природной матрицы, выступает как поли функциональный агент в фундаментальных и прикладных исследованиях.
Химическая природа Δ9-ТГК, проявляющаяся в сложной структурной организации молекулы, определяет его чрезвычайно специфическую биоактивность. Классическая терпеновая структура с наличием ароматического кольца, алифатической цепи и гидроксильной группы не только обеспечивает высокую аффинность к рецепторам эндоканнабиноидной системы, но и влияет на его липофильные свойства, хиральность, метаболическую стабильность и фармакокинетику. Липофильная природа позволяет ТГК свободно проходить через гематоэнцефалический барьер, что обеспечивает быстрый психоактивный эффект. Стереохимия молекулы, в частности её хиральные центры, определяют аффинность к конкретным рецепторным субтипам, что обусловливает частичную агонистическую специфичность, особенно к CB1-рецепторам в ЦНС. Биосинтетическое происхождение Δ9-ТГК в растении Cannabis sativa — ещё одна критически важная цепочка: от синтеза предшественника CBGA до его превращения в THCA и последующего декарбоксилирования до активной молекулы — все эти этапы строго контролируются ферментативными каскадами и условиями окружающей среды, включая температуру, свет и метаболический статус трихом.
Переход от природного происхождения к фармацевтической доступности требует сложной технологической обработки. Производство Δ9-ТГК предусматривает тщательный отбор сортов каннабиса с высоким содержанием каннабиноидов, адаптацию агротехнических условий, в частности специфический pH почвы, контроль ионного состава, индексов освещения, влажности и фенофаз. Морфологические особенности C. sativa и C. indica — различия в расположении соцветий, форме листьев, плотности трихом — прямо коррелируют с качественным и количественным профилем каннабиноидов, что подтверждается аналитикой с помощью методов ВЭЖХ, ГЖХ и масс-спектрометрии. Разница в содержании Δ9-ТГК среди сортов может достигать порядка десятков процентов, что обусловливает необходимость стандартизации сырья, особенно в контексте клинического применения.
Современные методы экстракции — это не просто технологические процессы извлечения, а целое инженерное направление, ориентированное на сохранение химической целостности Δ9-ТГК, снижение уровня примесей и стандартизацию дозирования. Традиционные механические методы, такие как сухое скручивание и ручное добывание трихом, имеют историческую ценность, однако не выдерживают конкуренции с современными химическими и сверхкритическими экстракционными системами. Использование этанола, бутана, CO₂ в сверхкритическом состоянии — это не только повышение выхода, но и возможность точного фракционирования, удаления хлорофиллов, восков и продуктов окисления. Далее происходит многоэтапное очищение, включая зимовку, дистилляцию, адсорбцию на силикагеле или активированном угле, что гарантирует фармацевтическую чистоту субстанции.
Молекулярная мишень Δ9-ТГК — эндоканнабиноидная система — является одним из наиболее сложных и недостаточно изученных регуляторных кластеров в организме человека. CB1-рецепторы, локализованные преимущественно в головном мозге (гиппокамп, базальные ганглии, префронтальная кора), регулируют память, настроение, мотивацию, восприятие боли и моторную координацию. CB2-рецепторы, более представлены в иммунной системе и периферических тканях, опосредуют противовоспалительные, иммуномодулирующие и тканерегенераторные эффекты. Δ9-ТГК, действуя как частичный агонист обоих подтипов рецепторов, модулирует их функцию по принципу конформационной пластичности, что позволяет влиять на широкий спектр физиологических параметров без универсального механизма. Это свойство одновременно является источником терапевтического потенциала и вызовов в стандартизации клинического применения.
Фармакокинетический профиль Δ9-ТГК варьируется в зависимости от пути введения: ингаляционный путь обеспечивает максимальную биодоступность и быстрое достижение пиковых концентраций в плазме, тогда как пероральное применение обусловливает значительный эффект первого прохождения через печень с образованием активного метаболита 11-OH-THC, обладающего повышенной психоактивностью. Наличие энтерогепатической циркуляции удлиняет эффект, способствует кумуляции и, соответственно, осложняет дозирование. Метаболизм происходит преимущественно с участием изоферментов цитохрома P450 — CYP2C9, CYP3A4 — с последующей конъюгацией до глюкуронидов и выведением через почки и желчь. Более 80 метаболитов могут быть идентифицированы в биологических жидкостях после однократного введения, что создаёт сложную картину для токсикокинетики, особенно при хроническом применении или полипрагмазии.
Фармакодинамические эффекты Δ9-ТГК охватывают чрезвычайно широкий диапазон. На уровне ЦНС наблюдаются изменения в нейротрансмиссии дофамина, глутамата, ГАМК и ацетилхолина, что приводит к психоактивным феноменам — эйфории, нарушениям кратковременной памяти, изменённому сенсорному восприятию, синестезии, изменениям во временном восприятии. В то же время, периферические эффекты — вазодилатация, гипотермия, антиметическое действие, миорелаксация — опосредуются сложным каскадом нейроиммунных механизмов, где рецепторное действие сочетается с непрямыми эффектами, такими как ингибирование аденилатциклазы или модификация кальциевых каналов. Биологическое действие Δ9-ТГК не является гомогенным феноменом, а варьирует в зависимости от дозы, времени введения, генетических факторов и состояния эндоканнабиноидного тонуса.
В клиническом применении Δ9-ТГК демонстрирует эффективность в терапии хронической невропатической боли, тошноты и рвоты, вызванных химиотерапией, стимуляции аппетита при кахексии у пациентов с ВИЧ. Однако его применение требует строгой стандартизации, в частности по соотношению с CBD, продолжительности курса, дозированию и пути введения. В нейронауках Δ9-ТГК выступает как экспериментальный инструмент для моделирования изменений в синаптической пластичности, LTP/LTD-динамике, изучения нейровозбудимости при PTSD, тревожных расстройствах и даже депрессии. Новые подходы, включающие наноформуляции, липосомальные системы доставки, микроэмульсии, направлены на повышение биодоступности, минимизацию психоактивности и таргетное воздействие на конкретные ткани.
Векторные разработки включают стратегии с применением носителей, модифицированных пептидов, анти-TAG-антител, направленных на интеграцию Δ9-ТГК в систему прецизионной медицины. Перспективным направлением является конструирование селективных агонистов/антагонистов на базе Δ9-ТГК с заданной аффинностью к CB1 или CB2-рецепторам, что позволит создавать препараты с предсказуемым терапевтическим профилем. Современные индустриальные линии по производству ТГК базируются на интеграции биотехнологий, органического синтеза, аналитического контроля и фармацевтического инжиниринга, что формирует основу для регуляторного допуска в виде GMP-сертифицированных субстанций.
Таким образом, Δ9-тетрагидроканнабинол является полиаспектным объектом, интегрирующим природно-научные, клинические и технологические измерения. Его изучение имеет не только фундаментальное значение для понимания эндогенных механизмов регуляции, но и утилитарную ценность в рамках персонализированной медицины, фармацевтической разработки и биоинженерных инноваций. Этот каннабиноид воплощает переход от стигматизированного растительного компонента к полноценному молекулярному инструменту, способному трансформировать практики лечения, понимание нейробиологии и парадигму фармакотерапии в целом.
Источники:
- Tetrahydrocannabinol (THC) — StatPearls, NCBI Bookshelf
Обзор фармакологии, клинического применения и механизма действия THC.
https://www.ncbi.nlm.nih.gov/books/NBK563174/ - Therapeutic Effects of Cannabis and Cannabinoids — National Academies of Sciences, Engineering, and Medicine
Систематический обзор доказательств терапевтического потенциала каннабиноидов.
https://www.ncbi.nlm.nih.gov/books/NBK425767/ - Cannabis and Cannabinoids (PDQ®) — National Cancer Institute
Государственный ресурс о применении каннабиса в онкологической практике.
https://www.cancer.gov/about-cancer/treatment/cam/hp/cannabis-pdq - FDA and Cannabis: Research and Drug Approval Process — U.S. Food & Drug Administration
О политике FDA по научным исследованиям и легализации каннабиса.
https://www.fda.gov/news-events/public-health-focus/fda-and-cannabis-research-and-drug-approval-process - Cannabis and Brain Health — Centers for Disease Control and Prevention (CDC)
О влиянии THC на функционирование мозга.
https://www.cdc.gov/cannabis/health-effects/brain-health.html - Cannabis and the Brain — Harvard Medical School
Нейробиологические эффекты THC с позиции доказательной медицины.
https://hms.harvard.edu/news-events/publications-archive/brain/cannabis-brain - UChicago Research on Demographic Effects of Cannabis — University of Chicago
Исследования влияния THC на различные демографические группы.
https://news.uchicago.edu/story/uchicago-research-examines-how-cannabis-impacts-distinct-demographics-differently - Industrial Hemp and Medical Cannabis Research — Georgia Southern University
Информация о сортах, составе и промышленных исследованиях каннабиса.
https://ww2.georgiasouthern.edu/research/researchintegrity/cannabis-research/ - Medical Marijuana Research — Philadelphia College of Osteopathic Medicine (PCOM)
Обзор текущих исследований медицинского каннабиса.
https://www.pcom.edu/research/research-areas/medical-cannabis.html - Cannabis and Working Memory — University of Colorado Anschutz Medical Campus
Крупнейшее на сегодняшний день исследование влияния THC на рабочую память.
https://news.cuanschutz.edu/news-stories/largest-study-ever-done-on-cannabis-and-brain-function-finds-impact-on-working-memory - Rising THC Potency and Health Risks — Yale School of Medicine
О росте концентрации THC в современных сортах и потенциальных рисках.
https://medicine.yale.edu/news-article/not-your-grandmothers-marijuana-rising-thc-concentrations-in-cannabis-can-pose-devastating-health-risks/ - Know the Risks of Marijuana — Substance Abuse and Mental Health Services Administration (SAMHSA)
Физиологические и психические последствия употребления THC.
https://www.samhsa.gov/substance-use/learn/marijuana/risks - MedlinePlus — Marijuana Overview
Медицинские аспекты марихуаны и компонента Δ9-ТГК.
https://medlineplus.gov/marijuana.html - Study on THC Enhancement via CBD — University of Mississippi
Исследование потенциала CBD в усилении эффекта THC.
https://olemiss.edu/news/2025/2/cbd-study-chittiboyina/index.html - Cannabis Facts & Statistics — CDC
Актуальные статистические данные по употреблению каннабиса.
https://www.cdc.gov/cannabis/data-research/facts-stats/index.html