Каннабиноиды — это класс терпен-фенольных соединений, которые имеют природное, синтетическое или эндогенное происхождение и взаимодействуют с рецепторной системой эндоканнабиноидов у позвоночных. Растение Cannabis sativa L. является уникальным природным источником фитоканнабиноидов, среди которых выделяется группа кислотных форм — биосинтетических предшественников нейтральных (декарбоксилированных) каннабиноидов. Одной из центральных кислотных молекул является Δ9-тетрагидроканнабиноловая кислота А (THCA-A), которая является непосредственным предшественником психоактивного Δ9-тетрагидроканнабинола (Δ9-THC). В рамках биохимии конопли это соединение играет ключевую роль в метаболическом каскаде, а также выступает объектом независимого фармакологического интереса, учитывая свою непсихоактивную, но биоактивную природу.
THCA-A образуется на позднем этапе биосинтеза фитоканнабиноидов путем ферментативного превращения каннабигероловой кислоты (CBGA) — так называемого «материнского» соединения, из которого синтезируются основные кислотные формы каннабиноидов. Фермент THCA-синтаза, локализованный в трихомах цветов растения, катализирует реакцию окислительного циклизирования CBGA с образованием THCA-A. Этот процесс является высокоспецифичным и генетически детерминированным: соответствующие ферментативные пути активируются в зависимости от хемотипа растения. То есть штаммы с высоким уровнем THCA-синтазы продуцируют преимущественно THCA-A, тогда как другие — CBDA или CBCA в соответствии с наличием CBDA- или CBCA-синтаз.
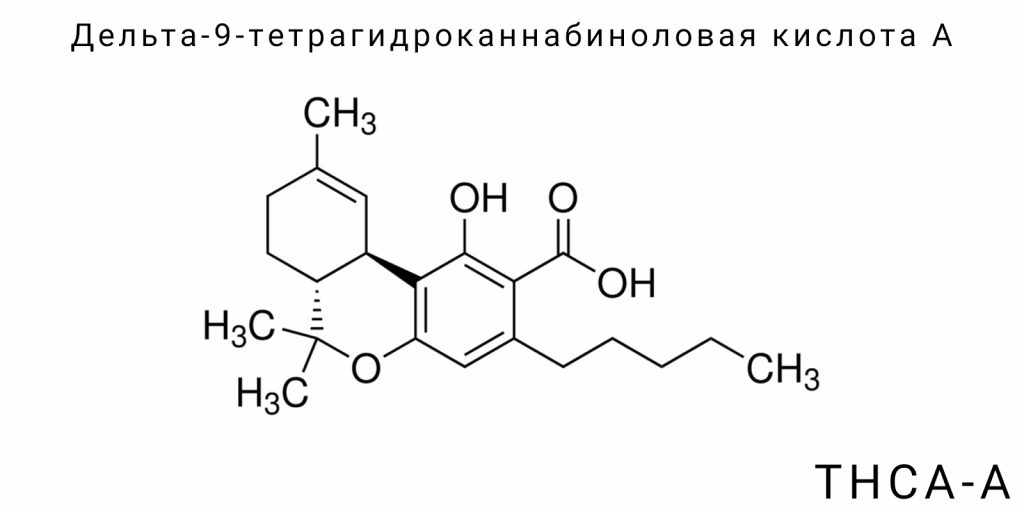
С точки зрения химической структуры THCA-A является карбоксилированной формой Δ9-THC и имеет дополнительную карбоксильную группу (-COOH), что обусловливает ее более высокую гидрофильность, пониженную проницаемость через гематоэнцефалический барьер и другие фармакокинетические свойства. Важно, что при термической обработке (нагревании, сушке или под воздействием ультрафиолета) эта карбоксильная группа отщепляется — происходит реакция декарбоксилирования, результатом которой является образование Δ9-THC, молекулы, которая легко связывается с каннабиноидными рецепторами типа CB1, вызывая психоактивные эффекты.
THCA-A традиционно рассматривалась преимущественно как промежуточная форма, обязательная для получения Δ9-THC. Соответственно, многие исследовательские программы и фармацевтические стратегии были направлены на максимизацию эффективности декарбоксилирования и стабилизацию конечного продукта — Δ9-THC. Однако впоследствии выяснилось, что THCA-A сама по себе обладает фармакологической активностью, которая реализуется посредством механизмов, отличных от канонического CB1/CB2-рецепторного связывания. Она способна влиять на молекулярные мишени, не являющиеся частью эндоканнабиноидной системы, включая ферменты, ионные каналы, ядерные рецепторы и сигнальные белки. В частности, появились данные о ее влиянии на PPARγ-рецепторы (пероксисомальные пролифераторы), модуляцию экспрессии COX-2, подавление выработки провоспалительных цитокинов, а также нейропротекторное действие в условиях гипоксии или окислительного стресса.
Важно отметить, что THCA-A в природных условиях не накапливается в стабильном виде: он быстро подвергается декарбоксилированию даже при незначительном повышении температуры или длительном хранении растительного сырья. Это создает существенные трудности для его лабораторного изучения, требует специальных условий экстракции и хранения, а также усовершенствованных методов аналитического контроля. Стандартизация препаратов на основе THCA-A является сложной задачей даже для ведущих фармацевтических лабораторий, поскольку необходимо учитывать время, температуру, кислотность среды и присутствие кислорода на всех этапах — от сбора сырья до упаковки готового продукта.
Интерес к THCA-A значительно вырос в последнее десятилетие, когда несколько независимых исследовательских групп сообщили о его потенциальных эффектах в контексте хронической боли, аутоиммунных заболеваний, нейродегенеративных процессов (например, болезни Паркинсона или Альцгеймера), а также при химиотерапевтической тошноте. При этом отсутствие психоактивного профиля делает это соединение особенно привлекательным для медицинского применения, так как оно не вызывает состояние эйфории, не нарушает когнитивные функции и не имеет абузного потенциала. С позиции регуляторной политики это означает, что THCA-A может не подпадать под те же самые правовые ограничения, что и Δ9-THC, хотя во многих странах это различие еще не учтено в законодательстве.
Особое значение THCA-A приобретает в сфере прикладной биотехнологии. Изучение и модификация THCA-синтазы — фермента, отвечающего за образование THCA-A — позволяют генетически программировать растения на синтез определенных каннабиноидов. Таким образом, контроль за экспрессией ферментов каннабиноидного пути становится одним из направлений создания целевых сортов конопли для медицинского применения. Известны эксперименты с использованием дрожжей и других микроорганизмов для биосинтетического продуцирования THCA-A in vitro, что открывает возможность масштабного биотехнологического производства без привлечения самого растения Cannabis sativa.
Стоит подчеркнуть, что научная литература по THCA-A до сих пор ограничена по сравнению с нейтральными формами каннабиноидов. Большинство данных получено из доклинических моделей или из описательных фармакобиохимических исследований. Отсутствие широкомасштабных клинических испытаний снижает обоснованность медицинского применения этого соединения, что требует активизации исследовательских программ, создания стандартизированных протоколов и системной оценки безопасности.
Биосинтез и природное происхождение THCA-A
Δ9-тетрагидроканнабиноловая кислота А (THCA-A) является ключевым метаболитом вторичного обмена растения Cannabis sativa L., относящимся к классу кислотных фитоканнабиноидов. Она не существует в виде свободного Δ9-тетрагидроканнабинола (Δ9-THC) в свежих частях растения, а напротив — является его биогенетическим предшественником. В отличие от конечной, декарбоксилированной формы, THCA-A не обладает психоактивной активностью, что открывает перспективы её изучения в медицинских применениях без риска вызвать эмоционально-когнитивные побочные эффекты.
Биосинтез THCA-A происходит через строго регламентированную последовательность ферментативных реакций в рамках каннабиноидного метаболического каскада. Центральной молекулой в этом процессе выступает каннабигероловая кислота (CBGA), которая функционирует как основной предшественник для синтеза трёх основных кислотных каннабиноидов: THCA-A, каннабидиоловой кислоты (CBDA) и каннабихроменовой кислоты (CBCA). В свою очередь, CBGA образуется в результате конденсации геранилпирофосфата (GPP) и оливетоловой кислоты с участием фермента типа «арилпренилтрансферазы», что также является определяющим моментом в каннабиноидном пути.
Дальнейшая судьба CBGA в растении определяется активностью специфических ферментов-синтаз. В случае синтеза THCA-A ключевым является фермент THCA-синтаза, который катализирует реакцию окислительного циклирования, трансформируя CBGA в THCA-A. Эта реакция является строго энзим-опосредованной: при отсутствии THCA-синтазы превращение не происходит, следовательно — образование THCA-A является контролируемым генетическим процессом, зависящим от экспрессии соответствующего гена THCAS. У растений с типом хемотипа I — то есть сортов с преобладающим синтезом Δ9-THC — ферментативный профиль обусловливает доминирование THCA-A как основного каннабиноида.
Этот ферментативный путь обладает пространственной специфичностью: синтез THCA-A происходит главным образом в игольчатых железистых трихомах, которые расположены на женских генеративных органах (особенно — на прицветниках цветов). Именно в этих структурах сконцентрирована активность ферментов, связанных с каннабиноидным биогенезом. Трихомы функционируют как микроорганеллы вторичного метаболизма, где в условиях защищённой среды — в частности, в пределах их секреторного везикулярного пространства — накапливаются биоактивные соединения в кислотной форме. THCA-A образуется внутри таких микрокомпартментов и депонируется в смолистых экссудатах, которые выводятся на поверхность трихом.
Пространственно-временная регуляция синтеза THCA-A в растении Cannabis sativa является динамическим процессом, связанным с фазами вегетации и цветения. Максимальное производство наблюдается на поздних этапах фазы цветения, когда трихомы достигают полной морфофункциональной зрелости. Биосинтетическая активность THCA-синтазы на этом этапе существенно возрастает, что коррелирует с повышением концентрации THCA-A в фитомассе. Важно, что в период роста (вегетативная стадия) концентрация каннабиноидов незначительна, что подтверждает вторичный характер этих соединений — они не являются структурными или энергетическими метаболитами, а выполняют защитно-сигнальные функции.
Природное происхождение THCA-A является результатом комплексной био-инженерной стратегии самого растения, направленной на химическую защиту, адаптацию к окружающей среде, регуляцию взаимодействий с патогенами и опосредованную коммуникацию с биотическими агентами (например, опылителями). Биохимический синтез каннабиноидов — включая THCA-A — относится к классу полиэтидно-терпеновых гибридных путей, которые сочетают элементы двух основных классов метаболитов: жирных кислот и изопреноидов. Это делает каннабиноиды эволюционно уникальными соединениями, обладающими двойным происхождением и широкой функциональной пластичностью.
Каннабиноидный биогенетический путь
Каннабиноидный биогенетический путь в Cannabis sativa представляет собой специфический разветвлённый метаболический каскад, в котором продуцируются три основных кислотных фитоканнабиноида: Δ9-тетрагидроканнабиноловая кислота (THCA-A), каннабидиоловая кислота (CBDA) и каннабихроменовая кислота (CBCA). Все эти соединения происходят от общего предшественника — каннабигероловой кислоты (CBGA). Указанный путь функционирует как эндогенная биосинтетическая программа вторичного метаболизма, активность которой координируется ферментативной системой, обусловленной транскрипционной экспрессией специфических генов. Его уникальность заключается в сочетании элементов поликетидного и мевалонатного пути, которые пересекаются в образовании CBGA, из которого затем специализированные ферменты катализируют соответствующие кислотные каннабиноиды.
В начале биогенеза каннабиноидов происходит синтез оливетоловой кислоты (OA) путём конденсации шести атомов углерода из ацетил-КоА, через последовательное добавление малонил-КоА в поликетидном пути. После образования OA она вступает в реакцию с геранилпирофосфатом (GPP) — продуктом мевалонатного (или MEP, в зависимости от ткани) пути — с образованием CBGA. Этот процесс катализируется арилпренилтрансферазой (APT), которая специфически распознаёт оливетоловую кислоту как арильный субстрат и переносит геранильную группу.
На этом этапе CBGA является ключевой точкой разветвления биогенетического потока. Её дальнейшая судьба зависит от того, какой фермент-синтаза экспрессируется в конкретной клетке трихомы. Если доминирует THCA-синтаза — результатом будет синтез THCA-A; если преобладает CBDA-синтаза — синтез CBDA; соответственно, при экспрессии CBCA-синтазы образуется CBCA. Таким образом, сам хемотип растения, то есть его профиль каннабиноидной продукции, определяется аллельным статусом и активностью одного или нескольких генов синтаз.
THCA-синтаза представляет собой флавопротеин, который катализирует окислительное циклирование CBGA до THCA-A, превращение, сопровождающееся образованием новых циклических структур, характерных для Δ9-тетрагидроканнабинолового ядра. Этот процесс не является термодинамически спонтанным и требует высокой специфичности и пространственной ориентации субстрата в активном центре фермента. Особенностью данного пути является то, что он локализован преимущественно в секреторных клетках головчатых трихом, которые специализируются на продукции смолистых метаболитов.
Важным аспектом также является синхронизация ферментативной активности с фазами онтогенеза растения. В молодых трихомах синтез CBGA является преобладающим, а с ростом ферментативной активности THCA-синтазы происходит смещение в сторону THCA-A. Это свидетельствует о строго регулируемом темпоспецифическом контроле биосинтеза, который координируется гормональной сигнализацией, уровнем транскрипции и, вероятно, эпигенетическими механизмами.
Ферментативное образование THCA-A из каннабигероловой кислоты (CBGA)
Ферментативная трансформация CBGA в THCA-A является ключевой стадией в каннабиноидном биогенезе и определяет специфический каннабиноидный профиль в типичных «THC-доминантных» сортах Cannabis sativa. Этот процесс катализируется ферментом THCA-синтазой — монооксигеназой, осуществляющей окислительное циклирование боковой цепи CBGA. Реакция, происходящая при этом, относится к классу аэробных ферментативных циклизаций, в которой задействован флавин-аденин-динуклеотид (FAD) как кофактор.
CBGA — субстрат для реакции — обладает открытой ароматической структурой, содержащей гидроксильную группу, изопреноидную боковую цепь и карбоксильную функцию. В присутствии THCA-синтазы CBGA проходит процесс окисления с образованием реакционноспособного кватернионного интермедиата, который реорганизуется в тетрагидроканнабиноловую структуру путём электрофильной атаки на ароматическое ядро. Завершается процесс замыканием кольца и стабилизацией электронной структуры, с образованием полноценной молекулы THCA-A.
Эта реакция является стереоселективной и стереоспецифической, то есть THCA-синтаза не только катализирует циклизацию, но и определяет точную конфигурацию хиральных центров в конечном продукте. Отсутствие активности фермента или его замена на CBDA-синтазу изменяет траекторию биосинтеза, что доказывает критическую зависимость конечного состава каннабиноидов от этого одного энзима.
Функционирование фермента возможно только при благоприятных физиологических условиях, в частности при наличии кислорода, достаточном уровне pH и температуре, совместимой с клеточным гомеостазом. Дополнительно, CBGA должен быть предварительно транспортирован к месту локализации синтазы — чаще всего в апопластическое пространство трихом — что указывает на существование активных транспортных систем, вероятно, задействованных во внутриклеточном перемещении каннабиноидных предшественников.
Конечный продукт — THCA-A — аккумулируется в везикулах трихомального секрета и остаётся стабильным в кислотной форме до момента теплового воздействия. При нагревании или длительном хранении происходит неферментативная декарбоксиляция, которая превращает THCA-A в Δ9-THC, обладающий психоактивной активностью. Таким образом, ферментативное образование THCA-A является критической стадией в контроле биологической активности фитоканнабиноидов и опосредует переход между инертной и активной формой соединения.
Роль фермента THCA-синтазы
Фермент THCA-синтаза является функциональным центром синтеза Δ9-тетрагидроканнабиноловой кислоты и играет уникальную роль в определении хемотипа Cannabis sativa. Это белок, который по своей структуре относится к флавин-монооксигеназам (FMO), с молекулярной массой около 60 кДа, кодируется ядерным геном THCAS, активирующимся в трихомальных клетках.
Биохимическая активность THCA-синтазы заключается в катализе внутримолекулярной реакции, в которой CBGA подвергается окислению с образованием фенольного полухинона. Далее происходит циклизация с замыканием пиронового кольца, что формирует каноническую структуру THCA-A. Реакция протекает в мягких условиях, без необходимости в коэнзимах, но требует присутствия кислорода и флавина. Пространственная структура фермента имеет активную «карманную» зону, в которой субстрат фиксируется за счёт гидрофобных и водородных взаимодействий. Эта специфичность к CBGA обеспечивает отсутствие побочных продуктов и максимальную эффективность.
Ген THCAS полиморфен, с существованием аллельных вариантов, которые могут продуцировать неактивные или частично активные белки. Это объясняет фенотипическое разнообразие между сортами: каннабис с низкой активностью THCA-синтазы синтезирует преимущественно CBGA или CBDA, в то время как THC-доминантные генотипы имеют полнофункциональный фермент. Экспрессия THCAS строго тканеспецифична и выявляется почти исключительно в головчатых трихомах.
Фермент демонстрирует высокий уровень консервативности в активном центре, но имеет вариабельные участки, которые могут влиять на каталитическую эффективность. Это создаёт потенциал для биоинженерного редизайна фермента с целью получения новых каннабиноидов или повышения выхода THCA-A в рекомбинантных системах (например, в дрожжах или гетерологичных растениях). Собственно, THCA-синтаза становится объектом биотехнологических исследований, направленных на стандартизированное промышленное производство THCA-A вне пределов самого Cannabis sativa.
Пространственно-временная регуляция синтеза у растения Cannabis sativa
Биосинтез THCA-A у Cannabis sativa происходит неравномерно по всему растению, а имеет выраженную пространственную и фазовую специализацию. Наибольшая концентрация THCA-A аккумулируется в железистых трихомах женских цветков, особенно на прицветниках, тогда как в вегетативных тканях (листьях, стеблях) его уровень низок или отсутствует. Такая локализация обусловлена дифференциацией трихомальных структур как органелл вторичного метаболизма, в которых обеспечивается изолированная среда для ферментативной активности.
Пространственная регуляция синтеза охватывает не только тканевую, но и субклеточную организацию: ферменты, субстраты и продукты синтеза изолированы в пределах апопласта секреторных клеток трихом, что предотвращает нежелательные реакции в цитозоле. Секреторные везикулы, в которых накапливается THCA-A, имеют многослойную липидную оболочку, которая ограничивает диффузию продукта и защищает от деградации.
Временная регуляция не менее важна. Пик синтеза приходится на конец фазы цветения, когда трихомы достигают максимального развития, а транскрипционная активность THCAS возрастает в результате гормональных сигналов — в частности, воздействия жасмонатов, абсцизовой кислоты и, возможно, световых стимулов. Параллельно возрастает и уровень CBGA, что свидетельствует о координации синтеза предшественников и активности THCA-синтазы.
Структурные характеристики молекулы
Химическая и структурная организация Δ⁹-тетрагидроканнабиноловой кислоты А (THCA-A) является центральным фактором, определяющим её биологическую функциональность, физико-химические свойства и отличие от её декарбоксилированного аналога Δ⁹-тетрагидроканнабинола (Δ⁹-THC). Как предшественник психоактивной формы Δ⁹-THC, THCA-A не обладает психоактивным эффектом в своём природном состоянии, однако благодаря своей молекулярной структуре она обладает рядом уникальных свойств, которые обуславливают её функциональную роль в биохимии растения и потенциальное фармакологическое применение. Глубокое понимание химической природы этой молекулы включает анализ её состава, пространственной конфигурации и функциональных групп, а также их влияния на взаимодействие с биологическими мишенями. При этом критически важно различать THCA-A от родственных каннабиноидов, особенно с точки зрения стабильности, полярности и аффинности к рецепторам.
Химическая формула и молекулярная масса
Молекула THCA-A имеет молекулярную формулу C₂₂H₃₀O₄, что отражает наличие двадцати двух атомов углерода, тридцати атомов водорода и четырёх атомов кислорода. Её молекулярная масса составляет примерно 358,48 г/моль. Эта масса выше, чем у Δ⁹-THC, из-за наличия карбоксильной группы (-COOH), которая является ключевым отличительным элементом. Карбоксильная группа делает молекулу более полярной и водорастворимой по сравнению с нейтральным Δ⁹-THC. Кроме того, карбоксильная группа увеличивает кислотность молекулы, хотя она остаётся слабой органической кислотой. В биохимическом смысле это означает, что THCA-A может вступать в водородные связи с белками, липидами или другими молекулами, что придаёт ей специфические фармакокинетические свойства, отличные от психоактивного аналога. С точки зрения органической химии, химическая формула также отражает наличие ароматического кольца, алкильной цепи и изопреноидного фрагмента, который структурно происходит от каннабигероловой кислоты — материнского прекурсора для большинства фитоканнабиноидов.
Ароматическое кольцо, характерное для фенольных соединений, формирует основу молекулы и участвует во множестве реакций окисления и гидроксилирования. Наличие гидроксильной группы в орто-положении относительно карбоксильной группы усиливает электронодонорные свойства этой части молекулы, что может быть важным для хелатирования металлов в почве или взаимодействия с ферментными системами. Наличие боковой пентильной цепи, типичной структурной особенности большинства Δ⁹-каннабиноидов, обеспечивает гидрофобность и влияет на проницаемость клеточных мембран, особенно через липидные бислои. Таким образом, химическая формула THCA-A не является просто количественной характеристикой; она отражает структурно-функциональные принципы, заложенные в самой молекулярной архитектуре, которые определяют биоактивность, растворимость, деградацию и путь метаболизма.
Стереохимия и конфигурация
THCA-A обладает чётко определённой трёхмерной структурой, которая формируется в результате наличия нескольких хиральных центров в молекуле. Основные хиральные центры расположены в области циклогексанового кольца, где конформация влияет на общую биологическую активность вещества. Преобладающая конфигурация этих центров — (6aR,10aR), что соответствует природной изомерии, синтезируемой в растении при участии THCA-синтазы. Конформационная стабильность молекулы поддерживается внутримолекулярными водородными связями, обусловленными взаимодействием гидроксильных и карбоксильных групп, что, в свою очередь, влияет на температуру плавления, растворимость в воде и органических растворителях, а также на химическую реактивность.
Пространственная конфигурация THCA-A определяет его способность избирательно взаимодействовать с биомолекулами, в частности с белками, липидами и нуклеиновыми кислотами, через специфическое пространственно-комплементарное узнавание. Эта специфичность критически важна при изучении потенциальных терапевтических механизмов действия, поскольку даже незначительные изменения в стереохимии могут привести к значительным изменениям биологической активности или полной её утрате. Важно отметить, что стереоизомеры, которые не встречаются в природе, но могут быть синтезированы искусственно, как правило, не обладают такой же биоактивностью, как природная форма, что снова указывает на эволюционную адаптацию ферментативных систем растения к синтезу только одного пространственного варианта.
Кроме того, пространственное расположение атомов определяет способность молекулы к автокаталитическому декарбоксилированию. Наличие карбоксильной группы в α-положении относительно ароматического кольца повышает вероятность термической нестабильности. Этот фактор важен в контексте приготовления экстрактов или продуктов на основе каннабиса, поскольку даже незначительное нагревание может инициировать декарбоксилирование и превращение в Δ⁹-THC. Таким образом, стереохимия THCA-A не только определяет его химическую инертность по отношению к психоактивности, но и программирует термодинамическую судьбу молекулы в процессах внешней обработки.
Отличия от нейтрализованной формы Δ⁹-THC
Ключевое отличие между THCA-A и Δ⁹-THC заключается в наличии карбоксильной группы у THCA-A, которая отсутствует у Δ⁹-THC вследствие процесса декарбоксилирования. Эта структурная разница является определяющей не только с точки зрения химического состава, но и с позиции фармакодинамических и фармакокинетических свойств. THCA-A не взаимодействует эффективно с каннабиноидными рецепторами CB1, которые являются основными мишенями психоактивного Δ⁹-THC. Причина такой неэффективности кроется именно в пространственной и электронной конфигурации молекулы: карбоксильная группа препятствует плотному связыванию с активным сайтом рецептора за счёт стерического ограничения и электростатического несоответствия.
В отличие от Δ⁹-THC, который является липофильным и легко проникает через гематоэнцефалический барьер, THCA-A обладает большей полярностью и, следовательно, характеризуется более слабым проникновением в центральную нервную систему. Это объясняет отсутствие психоактивного эффекта и одновременно открывает возможности для использования THCA-A в терапевтических целях, не связанных с воздействием на психику. Кроме того, THCA-A демонстрирует более стабильные фармакокинетические профили в желудочно-кишечном тракте, где кислота более устойчива к деградации, в отличие от Δ⁹-THC, который легко метаболизируется в печени до 11-гидрокси-THC — активного метаболита с усиленной психоактивностью.
В термическом аспекте THCA-A представляет собой термолабильное соединение, которое при нагревании декарбоксилируется с образованием Δ⁹-THC. Этот переход происходит в пределах температуры 105-120°C, что критично при сушке, курении или термическом экстрагировании. В свою очередь, Δ⁹-THC является термически более стабильной молекулой с расширенным диапазоном применения в фармацевтических препаратах. Однако именно способность THCA-A к контролируемой трансформации в Δ⁹-THC позволяет регулировать уровень психоактивных компонентов в продуктах из каннабиса, что является ключевым фактором в фармацевтической формуляции.
Технологии добычи THCA-A: Сферы применения — от медицины до фундаментальной науки
Δ⁹-Тетрагидроканнабиноловая кислота А (THCA-A), несмотря на свою предшественническую функцию по отношению к психоактивному Δ⁹-THC, сегодня всё больше привлекает внимание как самостоятельная молекула с уникальным спектром свойств. В отличие от других фитоканнабиноидов, её статус как нестабильного, термолабильного кислотного компонента диктует специфические условия для извлечения, хранения и применения. Именно эти особенности послужили стимулом для развития специализированных технологий добычи, очистки и идентификации THCA-A. Однако ещё более значимым является вопрос её практического использования. В настоящее время THCA-A рассматривается как перспективный объект в различных направлениях — от прикладной медицины до фармакогнозии, агрономии и молекулярной биохимии.
Изначально THCA-A в основном воспринималась как переходная форма к Δ⁹-THC и не подвергалась целенаправленному исследованию как биоактивное вещество. Однако расширение методов изоляции нестабильных молекул без декарбоксилирования, в частности через развитие криогенной экстракции и прецизионной хроматографии, открыло путь к экспериментальному и клиническому изучению свойств THCA-A в её первичной кислотной форме. Эта изолированная форма проявила ряд свойств, делающих её особенной по сравнению с нейтрализованными каннабиноидами. Наибольшее количество исследований сосредоточено вокруг её противовоспалительного, нейропротекторного, антипролиферативного и иммуномодулирующего потенциала.
В медицинских исследованиях THCA-A демонстрирует селективную активность в отношении ключевых мишеней воспалительного каскада, таких как COX-1, TNF-α, IL-6, а также факторов транскрипции типа NF-κB. При этом она не стимулирует психоактивные пути, что делает её пригодной для длительного применения у пациентов с хроническими заболеваниями без риска психогенных побочных эффектов. Особенно перспективными являются исследования по поводу нейродегенеративных состояний — таких как болезнь Альцгеймера, Паркинсона, рассеянный склероз. Здесь THCA-A проявляет способность стабилизировать микроглию и регулировать глутаматную нейротрансмиссию, что подтверждается результатами in vitro и исследованиями на животных моделях.
Кроме того, THCA-A проявляет цитостатическую активность в ряде онкологических моделей, включая колоректальный рак, рак молочной железы и глиобластому. Механизм действия основывается на ингибировании клеточного цикла на стадии G1/S, а также модуляции экспрессии генов апоптоза, таких как BAX, BCL-2 и каспазы. Исследователи указывают на способность THCA-A воздействовать на сигнальные пути PI3K/Akt и MAPK, что обеспечивает селективную токсичность для раковых клеток при сохранении жизнеспособности нормальных клеток. В отличие от Δ⁹-THC, который имеет психоактивные ограничения в дозировке, THCA-A позволяет расширить терапевтическое окно и применять более высокие дозы без побочных нейроповеденческих эффектов.
Ещё одним перспективным направлением является гастроэнтерология, в частности терапия воспалительных заболеваний кишечника (ВЗК), таких как болезнь Крона и язвенный колит. В предварительных клинических исследованиях THCA-A снижала уровень маркеров воспаления и способствовала восстановлению слизистой оболочки кишечника через модуляцию эндоканнабиноидной системы без вовлечения рецепторов CB1/CB2. Вероятно, в этом задействованы альтернативные мишени — в частности PPARγ и TRP-каналы, которые остаются активными в кислотных производных каннабиноидов. Этот аспект отражает сложное взаимодействие между химической формой, рецепторной специфичностью и физиологической активностью, что открывает возможности для создания неканонических фармакологических подходов.
В области неврологии исследуются антиконвульсантные свойства THCA-A. Предварительные результаты показывают, что в моделях эпилепсии THCA-A снижает частоту приступов и не изменяет базовый уровень возбудимости, что выгодно отличает её от Δ⁹-THC, который может обладать как противосудорожными, так и провокационными эффектами в зависимости от дозировки. Кроме того, THCA-A не вызывает толерантности даже при длительном применении, что делает её привлекательной альтернативой для пациентов с фармакорезистентной эпилепсией.
Вне клинического контекста THCA-A рассматривается как удобный маркер в фармакогностических исследованиях сортов Cannabis sativa. Её содержание позволяет классифицировать фенотипы каннабиса, отслеживать стадии зрелости соцветий, а также оптимизировать условия культивации. В лабораторных условиях THCA-A выступает в качестве субстрата для изучения каталитических свойств THCA-синтазы, что важно для синтетической биологии и биотехнологий. В частности, разрабатываются методы генетической модификации дрожжей и бактерий, способных к биосинтезу THCA-A путём экспрессии каннабиноидных ферментов. Это открывает путь к биоферментативному производству каннабиноидов без выращивания растений, что имеет потенциал для промышленного масштабирования.
Кроме того, THCA-A активно исследуется в фундаментальной биохимии как модельная структура для изучения взаимодействий малых органических молекул с белками. Её хорошо изученная стереохимия, наличие полярной и гидрофобной частей, а также способность к автокаталитической трансформации делают её идеальным кандидатом для использования в исследованиях ферментативных реакций, молекулярного докинга и протеомики. Спектроскопические и хроматографические методы, разработанные для анализа THCA-A, в настоящее время адаптируются для других природных кислотных каннабиноидов, включая CBDA и CBGA, что расширяет аналитический инструментарий в фитохимии.
Методы экстракции сырой конопли
Экстракция THCA-A из сырой конопли является ключевым этапом для получения чистого и стабильного продукта, сохраняющего кислотную форму каннабиноида. Процесс экстракции требует соблюдения специфических физико-химических условий, поскольку THCA-A представляет собой термолабильное соединение, чувствительное к нагреванию, свету и окислению. Для сохранения биологической активности и химической целостности молекулы применяются низкотемпературные технологии и минимизируется контакт с кислородом и ультрафиолетовым излучением.
Растительное сырьё — сырая конопля — готовится к экстракции путём аккуратного сбора в фазе максимального накопления THCA-A, что, как правило, приходится на конец цветения. Материал измельчается с целью увеличения площади контакта с растворителем, при этом строго контролируется температура, чтобы избежать начала термического разложения. Сырьё после измельчения хранится в холодных условиях, что предотвращает ферментативные превращения и химическую деструкцию.
Выбор метода экстракции зависит от требований к конечному продукту и специфики применения. Экстракция, проводимая при низких температурах с использованием соответствующих растворителей, обеспечивает максимальное сохранение THCA-A. Применение полярных и неполярных растворителей позволяет варьировать спектр извлекаемых соединений — от каннабиноидов до терпеноидов, однако условия процесса строго регламентируют температуру и время контакта, чтобы избежать превращения THCA-A в Δ⁹-THC. Разработанные методики снижают негативное влияние окислительных процессов, в частности за счёт использования инертных газов в зоне экстракции и герметизации продукта.
Сырьё, обработанное соответствующим образом, проходит через технологические циклы, оптимизирующие степень извлечения THCA-A. В рамках этих циклов разработаны условия, минимизирующие присутствие побочных компонентов, таких как хлорофилл, липиды и другие полярные вещества, которые могут повлиять на качество экстракта. В связи с этим применяются предварительные этапы очистки и фильтрации, повышающие селективность извлечения.
Технологические подходы также учитывают необходимость адаптации процесса к промышленным масштабам производства, что требует баланса между выходом продукта и его качеством. Оптимизация эксплуатационных параметров экстракционных систем позволяет поддерживать стабильный уровень активного вещества при минимальных потерях. Также важным фактором является безопасность процесса, что предполагает контроль за возможными остатками растворителей и предотвращение взрывоопасных условий.
Условия сохранения кислотной формы (низкая температура, отсутствие света)
Δ⁹-Тетрагидроканнабиноловая кислота A (THCA-A) является химически нестабильным соединением, которое требует особых условий для сохранения своей кислотной формы в процессе хранения и обработки. Основными факторами, приводящими к деградации THCA-A, являются повышенная температура, воздействие ультрафиолетового и видимого света, а также окислительные процессы, способные инициировать декарбоксилирование — химическое превращение кислоты в нейтральный Δ⁹-тетрагидроканнабинол (THC). Поскольку THCA-A обладает уникальными фармакологическими свойствами, отличающимися от THC, сохранение её структуры является приоритетной задачей в технологиях производства и хранения каннабиноидных препаратов.
Температурный режим является ключевым параметром стабильности THCA-A. При температурах выше 40 °C происходит значительное ускорение декарбоксилирования, что приводит к потере кислотной формы и переходу в активную, но уже нейтральную молекулу THC. В лабораторных и промышленных условиях хранения экстрактов, содержащих THCA-A, рекомендуется поддерживать температуру в пределах от -20 °C до +4 °C. Этот температурный диапазон минимизирует кинетические пути распада и предотвращает активацию термолабильных реакций. Особенно критично поддерживать низкие температуры во время транспортировки и долгосрочного хранения, поскольку даже кратковременное повышение температуры может привести к заметному снижению концентрации THCA-A.
Кроме температуры, существенное влияние оказывает воздействие света, особенно ультрафиолетового (UV) излучения, которое индуцирует фотодеградацию молекулы. THCA-A обладает сопряжённой системой двойных связей в бензольном кольце, что делает её чувствительной к фотохимическим реакциям. При воздействии света нарушается электронная структура, активируются радикальные процессы, способствующие разрушению молекулы или её конверсии. Поэтому весь процесс экстракции, очистки и хранения должен происходить в условиях минимального освещения: используются непрозрачные или янтарные контейнеры, а также изоляция материала от прямых солнечных лучей и лабораторных ламп.
Окислительная среда также существенно влияет на стабильность THCA-A. Контакт с кислородом атмосферного воздуха способствует образованию пероксидных радикалов, которые инициируют полимеризацию или деградацию молекулы. Для минимизации этого процесса используются герметичные контейнеры, часто наполненные инертными газами (аргоном, азотом), которые создают пассивную среду и снижают активность кислорода. Дополнительно в некоторых технологиях применяются антиоксиданты, стабилизирующие экстракты и предотвращающие окислительное повреждение.
Другим аспектом является влияние влажности воздуха. Высокая влажность может способствовать гидролитическим реакциям или активизировать ферментативные процессы, что косвенно влияет на стабильность THCA-A. Поэтому помещения для хранения должны поддерживать оптимальный уровень влажности (около 30-50%) с применением осушителей воздуха или систем климат-контроля.
Этанольная, углекислотная и бутановая экстракция
Экстракция THCA-A из сырой конопли осуществляется с помощью различных растворителей, среди которых этанол, сверхкритический углекислый газ (SC-CO₂) и бутан имеют особое значение благодаря своим физико-химическим свойствам и специфике взаимодействия с растительным материалом. Каждый из этих методов характеризуется своими преимуществами и технологическими вызовами, влияющими на выход и чистоту целевого каннабиноида.
Этанольная экстракция — одна из наиболее распространённых и древнейших технологий. Этанол обладает достаточной полярностью для извлечения широкого спектра фитохимических компонентов, включая THCA-A, терпеноиды и флавоноиды. Его преимуществом является относительная безопасность, доступность и возможность контроля температуры, что позволяет минимизировать декарбоксилирование. Этанол охлаждается до низких температур (-20 °C и ниже), чтобы снизить растворимость нежелательных компонентов, таких как хлорофилл, что облегчает последующую очистку. После экстракции растворитель удаляется вакуумным испарением при температуре ниже 40 °C, что сохраняет кислотную форму THCA-A. Недостатком этанола является то, что он экстрагирует не только каннабиноиды, но и значительное количество других растительных соединений, что усложняет процесс очистки и требует дополнительных шагов фильтрации и хроматографии.
Углекислый газ в сверхкритическом состоянии (SC-CO₂) представляет собой более технологически сложный, но высокоэффективный метод. SC-CO₂ сочетает свойства газа и жидкости, что позволяет глубоко проникать в ткани растения и выборочно растворять целевые компоненты. Контроль давления и температуры позволяет манипулировать растворимостью THCA-A и других соединений, что способствует получению чистых экстрактов с минимальным содержанием примесей. Этот метод особенно ценен тем, что не оставляет токсичных остатков растворителей, а процесс проходит без доступа кислорода, что поддерживает стабильность кислотной формы. В то же время экстракция с помощью SC-CO₂ требует дорогостоящего оборудования и строгого контроля параметров, что ограничивает её применение в малых лабораториях.
Бутановая экстракция характеризуется высокой растворимостью неполярных и слабополярных веществ, что обеспечивает высокий выход каннабиноидов, включая THCA-A. Она проводится при низких температурах, что снижает риск термической деструкции, а растворитель легко удаляется путём испарения. Метод широко используется в промышленных масштабах для получения концентрированных продуктов. Однако бутан является легковоспламеняющимся и токсичным газом, что требует строгого соблюдения правил безопасности и тщательного контроля за остатками в конечном продукте. Важно отметить, что этот метод может извлекать преимущественно неполярные соединения, что иногда требует комбинации с другими техниками для получения комплексных экстрактов.
Методы холодного прессования и живого концентрата (live resin)
Холодное прессование и производство живых концентратов (live resin) — это технологии, позволяющие максимизировать сохранение биологически активных компонентов сырой конопли, включая THCA-A, за счёт минимизации теплового и окислительного стресса на материал. Они представляют собой альтернативу традиционным методам экстракции с применением растворителей.
Холодное прессование основано на механическом выделении экстрактов путём сжатия растительного сырья при низких температурах (обычно около 0-5 °C). Отсутствие нагрева предотвращает декарбоксилирование THCA-A и потерю летучих терпеноидов, которые важны для полного фармакологического профиля продукта. Процесс осуществляется на специализированных прессах с применением медленного сжатия, что минимизирует механическое повреждение тканей и утечку примесей. Полученный концентрат характеризуется высокой концентрацией THCA-A в чистой кислотной форме, сохраняя при этом натуральный состав растительных метаболитов.
Живые концентраты (live resin) производятся из свежесобранного или замороженного сырья конопли, которое не подвергалось сушке или сушилось минимально. Технология заключается в быстром замораживании растения сразу после сбора, что фиксирует химический состав и структуру клеток. Замороженный материал затем подвергается экстракции, обычно с использованием сверхкритического CO₂ или бутана, при низких температурах, что позволяет сохранить максимально полный спектр каннабиноидов, включая нестабильный THCA-A, и летучие терпеноиды. Этот метод является высокотехнологичным и позволяет получать концентраты, близкие по химическому составу к живому растению, обеспечивая максимальную фармакологическую эффективность.
Оба метода, холодное прессование и live resin, применяются для получения продуктов, максимально приближенных к природному составу конопли и отличающихся высокой биологической активностью. Они требуют тщательного контроля температуры и скорости обработки, а также использования специализированного оборудования, минимизирующего контакт с кислородом и светом, сохраняя кислотную форму THCA-A. Эти технологии получили распространение в производстве фармацевтических препаратов, косметических средств и исследовательских материалов, где необходимы высокое качество и стабильность химического состава.
Лабораторное выделение и очистка
В лабораторной практике изолированное получение Δ9-тетрагидроканнабиноловой кислоты A (THCA-A) с высокой степенью чистоты является необходимым условием для дальнейших фармакологических, биохимических или аналитических исследований. В отличие от промышленных методов экстракции, ориентированных на массовое производство каннабиноидных концентратов, лабораторные процедуры предполагают точную селекцию мишенной молекулы среди сложной матрицы вторичных метаболитов, характерных для растения Cannabis sativa. Эта задача осложняется высокой реакционной нестабильностью THCA-A, особенно под воздействием температуры, света или повышенного pH, что обуславливает её быструю декарбоксилизацию до психоактивной формы Δ9-THC. Поэтому любое эффективное выделение и очистка THCA-A требует сочетания специфической температурной стратегии, контроля условий среды и применения высокоточных аналитических методов, в частности хроматографических и спектроскопических техник.
Одной из главных задач лабораторной очистки является сохранение кислотной функциональной группы карбоксила в структуре THCA-A, что определяет её биохимическую специфику и фармакодинамическое отличие от декарбоксилированных форм. Структура кислотного каннабиноида значительно затрудняет классические методы кристаллизации, поэтому приоритет отдаётся методам разделения на основе различной способности молекулярных фракций к взаимодействию по физико-химическим параметрам, таким как полярность, молекулярная масса и сродство к сорбентам. При строгом контроле окружающей среды комбинация жидкостной хроматографии и спектрального мониторинга позволяет получать препараты THCA-A с чистотой более 98%, необходимой для фундаментальной науки и фармацевтического синтеза.
Хроматографические методики (HPLC, TLC, колонковая хроматография)
Хроматография играет ключевую роль в процедуре выделения THCA-A, поскольку позволяет эффективно отделять целевую молекулу от сопутствующих каннабиноидов, терпенов, флавоноидов и хлорофиллов без необходимости в агрессивных химических преобразованиях, которые могут нарушить кислотную форму. Одним из самых точных методов в этом контексте является высокоэффективная жидкостная хроматография (HPLC), применяемая как для аналитического, так и препаративного разделения. Основное преимущество HPLC заключается в способности работать при комнатной или пониженной температуре, что принципиально важно для предотвращения декарбоксилирования THCA-A.
В условиях HPLC происходит разделение сложной смеси за счёт различной степени сродства её компонентов к стационарной фазе (обычно обратной фазы C18) и подвижной фазе, представляющей собой водно-органический градиент. Оптимальные условия для разделения THCA-A включают низкотемпературную подачу элюента, контролируемый pH и детекцию на длине волны около 220-280 нм. С помощью масштабирования параметров потока и концентрации HPLC может быть адаптирована для получения миллиграммовых и граммовых количеств чистого THCA-A.
Тонкослойная хроматография (TLC), хотя и менее чувствительна, остаётся ценным методом для первичного скрининга наличия и чистоты THCA-A в образцах, а также для отслеживания этапов очистки. Она основана на разделении веществ в капиллярном поле тонкого слоя сорбента (обычно силикагеля), где THCA-A проявляется как характерное пятно при использовании специфических проявителей (например, ванилин-сернокислый реагент). Однако TLC не позволяет полноценно идентифицировать или изолировать большие количества вещества и используется лишь как дополнительный метод.
Колонковая хроматография представляет собой классический препаративный подход, позволяющий проводить разделение каннабиноидов в больших объёмах. Для очистки THCA-A колонка заполняется полярным сорбентом (например, силикагелем или алюмосиликатами), а в качестве подвижной фазы используют смеси органических растворителей, в частности гексан, этилацетат, метанол или их градиенты. Очистка проводится в контролируемых температурных условиях для предотвращения термического распада. Последовательное фракционирование элюатов позволяет изолировать целевую фракцию с доминирующим содержанием THCA-A, которая затем подвергается аналитической проверке на чистоту и структурную целостность.
Анализ чистоты и идентификация с помощью спектроскопии (ЯМР, МС)
После хроматографического выделения следующим критическим этапом является подтверждение идентичности и определение степени чистоты THCA-A. Для этого используются высокоточные спектроскопические методы, главным образом ядерный магнитный резонанс (ЯМР) и масс-спектрометрия (МС), которые обеспечивают полный структурный анализ и позволяют верифицировать наличие или отсутствие примесей с точностью до следов.
ЯМР-спектроскопия (NMR) является незаменимой при верификации химической структуры THCA-A. Метод основан на взаимодействии ядер атомов с магнитным полем и выявлении резонансных сигналов, характерных для конкретных типов химического окружения. В случае THCA-A наибольший аналитический интерес представляют протоны карбоксильной группы, олефиновых фрагментов и ароматического кольца, которые позволяют точно дифференцировать кислотную форму от нейтральной Δ9-THC. Использование двумерной ЯМР-спектроскопии (COSY, HSQC, HMBC) позволяет точно картировать все межатомные связи, подтверждая полноту структуры и отсутствие изомеризаций или побочных продуктов.
Масс-спектрометрия (MS) позволяет идентифицировать молекулярную массу и фрагментационный профиль вещества. THCA-A имеет характерную молекулярную массу 358,48 г/моль, а её ионизационные продукты дают характерные пики в спектре с точными массами фрагментов, которые позволяют подтвердить её наличие даже в чрезвычайно малых количествах. При сочетании с хроматографией (например, HPLC-MS) масс-спектрометрия обеспечивает двойной уровень идентификации — как по времени удерживания, так и по спектральной сигнатуре.
В некоторых случаях также используется инфракрасная спектроскопия (FTIR), которая позволяет выявить специфические функциональные группы, в частности карбоксил и фенольные фрагменты, являющиеся ключевыми маркерами THCA-A. Ультрафиолетовая спектроскопия (UV-VIS) также применяется как вспомогательный инструмент для определения концентрации в аналитической среде.
Сочетание хроматографического разделения с многомерной спектроскопической идентификацией обеспечивает высокую степень достоверности в подтверждении структуры и чистоты THCA-A, что критически важно для его дальнейшего применения в экспериментальной биомедицине, токсикологии, фармакокинетике и химическом синтезе производных. Эти методы формируют эталонную процедуру, позволяющую избежать артефактов и ошибочных интерпретаций при исследовании каннабиноидной биохимии.
Фармакологические и физиологические свойства THCA-A
Δ9-Тетрагидроканнабиноловая кислота A (THCA-A) является первичной кислотной формой Δ9-тетрагидроканнабинола (THC), которая накапливается в сыром каннабисе до момента термической или фотохимической декарбоксиляции. Несмотря на структурное сходство с Δ9-THC, THCA-A демонстрирует принципиально иной фармакологический профиль, обусловленный наличием карбоксильной группы, что ограничивает её проникновение через гематоэнцефалический барьер и изменяет аффинность к основным каннабиноидным рецепторам. В течение длительного времени THCA-A рассматривалась лишь как предшественник психоактивного Δ9-THC, однако современная наука постепенно реабилитирует это соединение как независимый биологически активный агент с собственным спектром физиологической активности. Её свойства всё чаще изучаются в рамках прикладной фармакологии, нейронаук, онкобиологии и иммуномодуляции.
Одной из ключевых особенностей THCA-A является её низкая психотропность, что открывает перспективы для создания терапевтических препаратов без риска когнитивной или поведенческой интоксикации. Это значительно расширяет возможности её клинического применения, в частности у пациентов с нейродегенеративными заболеваниями, онкологическими патологиями или хроническими воспалительными состояниями, которые требуют длительного фармакологического сопровождения без изменений в сознании. В данном контексте THCA-A интересна прежде всего как потенциальный модулятор ферментных каскадов, ингибитор провоспалительных сигнальных путей и как агент с нейропротекторным эффектом.
Следует подчеркнуть, что THCA-A не является фармакологически инертной молекулой. Её биоактивность обусловлена не взаимодействием с классическими CB1-рецепторами, к которым она имеет низкое сродство, а через опосредованное воздействие на другие молекулярные мишени, включая ферменты циклооксигеназного каскада (COX-1, COX-2), ионные каналы и, вероятно, сигнальные рецепторы типа PPARγ, TRPV1 и GPR55. Кроме того, появляется всё больше свидетельств того, что THCA-A может действовать как антипролиферативный агент в некоторых опухолевых клеточных линиях, а также проявлять способность к стабилизации нейрональной активности в моделях нейродегенерации. Отдельные исследования указывают на потенциальную противорвотную активность, что может быть использовано при сопровождении химиотерапии.
Другим важным аспектом является ограниченное проникновение THCA-A через гематоэнцефалический барьер, что, с одной стороны, ограничивает её центральные эффекты, но с другой — делает её привлекательной для таргетного действия в периферических тканях, где она может непосредственно влиять на клетки иммунной системы, воспалительные компоненты и рецепторные сети без психоактивного воздействия. Это открывает перспективу создания THCA-A-ориентированных лекарственных форм, направленных на системное, а не нейропсихическое лечение.
Кроме того, THCA-A демонстрирует значительную химическую лабильность, которая требует строгого контроля условий хранения и введения в организм. Фармакокинетические свойства THCA-A всё ещё остаются недостаточно изученными, однако предварительные данные свидетельствуют о том, что её биодоступность при пероральном приёме выше, чем у декарбоксилированной формы, благодаря лучшей растворимости в водной среде. Тем не менее, метаболическая стабильность и пути выведения требуют дальнейших исследований, особенно с учётом возможных трансформаций в желудочно-кишечном тракте и печени.
Биоактивность без декарбоксилирования
THCA-A, как природная кислота, образующаяся в растениях Cannabis sativa, отличается от своей нейтрализованной формы Δ9-THC не только структурно, но и по физиологическим и фармакологическим свойствам. Наиболее важным аспектом биоактивности THCA-A является то, что она функционирует в организме без необходимости предварительного декарбоксилирования, то есть без потери карбоксильной группы, которая существенно влияет на молекулярные взаимодействия и фармакодинамику соединения. Этот факт радикально расширяет возможности использования THCA-A как биоактивного компонента с уникальными характеристиками, отличными от психоактивного THC.
Нейтрализация карбоксильной группы в процессе декарбоксилирования трансформирует молекулу в активный психоактивный каннабиноид, способный проникать через гематоэнцефалический барьер, активно связываться с CB1-рецепторами центральной нервной системы и вызывать психоактивные эффекты. В то же время THCA-A, сохраняя карбоксильную группу, имеет значительно более низкое сродство к каннабиноидным рецепторам, особенно CB1, что объясняет отсутствие типичных для THC психоактивных эффектов при введении неактивированной формы.
Биоактивность THCA-A характеризуется её способностью модулировать различные молекулярные цели в организме, которые не связаны с классическими рецепторами эндоканнабиноидной системы, включая ферментативные системы, ионные каналы и воспалительные сигнальные каскады. Таким образом, THCA-A демонстрирует потенциал как агент, влияющий на физиологические процессы вне пределов центральной нервной системы, открывая путь для фармакологических стратегий без психотропной нагрузки.
Значительный интерес вызывают данные о том, что THCA-A является мощным ингибитором ферментов циклооксигеназы COX-1 и COX-2, ключевых катализаторов синтеза провоспалительных простагландинов. Благодаря этому она может действовать как природный противовоспалительный агент, регулируя активность иммунных клеток и снижая уровень воспалительных медиаторов в тканях. Такое свойство делает её перспективной для исследований в контексте аутоиммунных заболеваний, хронической боли и нейродегенеративных расстройств, где воспалительные процессы играют фундаментальную роль.
Одновременно, THCA-A взаимодействует с различными рецепторами, не относящимися к классической системе CB1/CB2, в частности PPARγ — ядерным рецептором, который регулирует метаболические процессы, дифференцировку клеток и иммунный ответ. Активация PPARγ связана с антивоспалительными, антипролиферативными и нейропротекторными эффектами, что делает это взаимодействие фармакологически значимым. Кроме того, THCA-A может влиять на ионные каналы типа TRPV1, которые участвуют в передаче болевых сигналов и регуляции терморегуляции, что потенциально объясняет некоторые её анальгетические и нейромодулирующие свойства.
Таким образом, биоактивность THCA-A без декарбоксилирования заключается в её способности функционировать как мультицелевой молекулярный агент, который модулирует ключевые физиологические и патофизиологические процессы без психоактивного эффекта. Это открывает перспективы её применения в медицине как базового компонента терапевтических схем, направленных на снижение воспаления, регуляцию иммунного ответа, защиту нейронов и ослабление боли без нарушения когнитивных функций.
Отсутствие психоактивного действия
Отсутствие психоактивного действия THCA-A является одним из наиболее важных её отличий от Δ9-THC, что делает её привлекательной для медицинского применения без сопутствующих побочных эффектов, связанных с интоксикацией. Психоактивность Δ9-THC обусловлена его высоким сродством к CB1-рецепторам, которые локализуются в большом количестве в центральной нервной системе, включая головной мозг, где регулируют нейромедиаторные процессы, психомоторную активность, когнитивные функции и восприятие. THCA-A, имея карбоксильную группу, является более полярной молекулой, что значительно снижает её способность проникать через гематоэнцефалический барьер, ограничивая влияние на центральную нервную систему.
Расположение карбоксильной группы в молекуле THCA-A изменяет её пространственную конфигурацию, что существенно влияет на взаимодействие с рецепторами CB1. Это структурное отличие вызывает снижение сродства молекулы к этим рецепторам на несколько порядков по сравнению с Δ9-THC, поэтому THCA-A не вызывает типичных психотропных эффектов, таких как эйфория, нарушение когнитивных функций или сенсорная дезориентация. В экспериментальных моделях in vitro и in vivo было подтверждено, что THCA-A не активирует сигнальные каскады CB1-рецепторов, что обуславливает её фармакологическую безопасность в этом контексте.
Отсутствие психоактивности не означает, что THCA-A является фармакологически неактивной. Напротив, она проявляет широкий спектр биологических действий на периферическом уровне, в частности через другие молекулярные цели, не ассоциированные с психоактивностью. Однако этот фактор значительно упрощает использование THCA-A в терапии, поскольку пациенты могут принимать препараты на её основе без риска возникновения психических расстройств, а также без ограничений, связанных с координацией движений и мышлением.
Фармакокинетические исследования демонстрируют, что при системном введении THCA-A она обладает ограниченной способностью к накоплению в центральной нервной системе, что дополнительно гарантирует отсутствие продолжительных психоактивных эффектов даже при многократном применении. Это критически важно для разработки безопасных лекарственных форм, ориентированных на лечение хронических воспалительных, нейродегенеративных и онкологических процессов.
В целом, отсутствие психоактивного действия является определяющим фармакологическим преимуществом THCA-A, которое позволяет рассматривать её как безопасный биологический агент для широкого круга медицинских применений, где ограничения, связанные с психотропностью, являются недопустимыми.
Влияние на ферментные системы, рецепторы, воспалительные каскады
THCA-A оказывает комплексное воздействие на ряд ключевых ферментных систем, рецепторов и воспалительных каскадов, что определяет его фармакологический профиль за пределами классической каннабиноидной системы. Одной из наиболее значимых мишеней являются ферменты циклооксигеназы (COX-1 и COX-2), которые катализируют синтез простагландинов — медиаторов воспаления и боли. THCA-A действует как ингибитор этих ферментов, что приводит к снижению продукции провоспалительных простагландинов, эффективно подавляя воспалительный процесс на молекулярном уровне. Этот механизм совпадает с фармакологией нестероидных противовоспалительных препаратов, однако THCA-A имеет потенциал быть более селективным и менее токсичным.
Кроме COX, THCA-A может воздействовать на систему липоксигеназ, участвующую в метаболизме арахидоновой кислоты, а также на другие ферменты, связанные с окислительным стрессом и метаболизмом оксидативных соединений. Подобные взаимодействия способствуют антиоксидантному действию THCA-A, что особенно актуально для нейропротекции и предотвращения дегенеративных изменений в тканях.
Рецепторный профиль THCA-A включает активацию ядерных рецепторов типа PPARγ, которые играют роль в регуляции иммунного ответа, метаболизма глюкозы и дифференцировки клеток. Взаимодействие с PPARγ обеспечивает противовоспалительный и антипролиферативный эффекты, что имеет важное значение при терапии хронических воспалительных и онкологических заболеваний. Уникальность этого взаимодействия заключается в возможности регулировать иммунологические процессы без прямой активации центральной нервной системы.
Дополнительно, THCA-A может модулировать ионные каналы семейства TRP, в частности TRPV1, которые участвуют в передаче болевых сигналов и воспалительных реакциях. Воздействие на TRPV1 может способствовать анальгетическому действию и снижению нейропатической боли, что подтверждается экспериментальными данными.
Кроме того, THCA-A имеет потенциал влиять на другие связанные с G-белком рецепторы, в частности GPR55, которые участвуют в регуляции воспалительных процессов и иммунного ответа. Взаимодействие с этими рецепторами всё ещё изучается, но оно может играть значительную роль в общей фармакологии THCA-A.
Исследование потенциальных эффектов
Потенциальные фармакологические эффекты THCA-A становятся предметом интенсивного исследования благодаря уникальной структуре этой молекулы, которая позволяет ей взаимодействовать с различными биологическими мишенями без проявления психоактивности, характерной для Δ9-THC. Последние научные данные подтверждают, что THCA-A может обладать нейропротекторными, противовоспалительными, а также антиэметическими и противоопухолевыми свойствами. Все эти характеристики придают THCA-A значительный терапевтический потенциал и стимулируют дальнейшие доклинические и клинические исследования.
Нейропротекторное действие THCA-A связано с его способностью модулировать окислительный стресс, воспалительные процессы в нервной ткани, а также сохранять структурную целостность нейронов. Исследования на моделях нейродегенеративных заболеваний показывают, что THCA-A может защищать нервные клетки от апоптотического стресса, снижая уровень свободных радикалов и активируя антиоксидантные механизмы. Кроме того, молекула демонстрирует влияние на специфические сигнальные пути, такие как MAPK и NF-kB, которые регулируют экспрессию провоспалительных генов и цитокинов в мозге, что важно для профилактики дегенеративных процессов.
Противовоспалительный потенциал THCA-A обусловлен способностью подавлять активность ключевых ферментов и молекул, участвующих в генерации и поддержании воспалительной реакции. Особенно важным является его влияние на циклооксигеназы COX-1 и COX-2, что значительно снижает синтез провоспалительных простагландинов. Это позволяет уменьшить локальный и системный воспалительный процесс, что особенно актуально для лечения аутоиммунных заболеваний, артритов, а также хронических воспалительных состояний. Кроме того, THCA-A способен модулировать активность лейкоцитов и макрофагов, подавляя выработку провоспалительных цитокинов, что создаёт дополнительный механизм противодействия хроническому воспалению.
Антиеметические и противоопухолевые эффекты THCA-A исследуются в доклинических моделях и подтверждают широкий спектр его фармакологической активности. THCA-A проявляет способность подавлять пролиферацию раковых клеток, в частности в опытах на культурах опухолевых клеток, таких как лимфомы, рак молочной железы и колоректальный рак. Эти эффекты связаны с индукцией апоптоза, а также способностью подавлять ключевые сигнальные пути, отвечающие за рост и метастазирование опухолей. Антиеметический потенциал THCA-A проявляется в способности снижать тошноту и рвоту, которые часто возникают при химиотерапии, за счёт влияния на рецепторы, регулирующие центры рвоты в центральной нервной системе.
Нейропротекторное действие
Нейропротекторные свойства THCA-A являются одним из ключевых направлений научных исследований, связанных с потенциальным использованием этого каннабиноида в терапии нейродегенеративных заболеваний. Молекулярный механизм действия THCA-A включает способность снижать уровень окислительного стресса, что является одним из фундаментальных факторов в развитии болезней типа Альцгеймера, Паркинсона и других нейродегенераций.
В доклинических моделях THCA-A демонстрирует значительное снижение продукции свободных радикалов и маркеров окислительного повреждения липидов и белков в тканях мозга. Этот эффект связан с активацией эндогенной антиоксидантной системы, в частности с повышением активности ферментов супероксиддисмутазы и каталазы. Благодаря этому THCA-A уменьшает повреждение клеточных мембран, стабилизирует митохондриальные функции и способствует сохранению нейрональной жизнеспособности.
Кроме антиоксидантного действия, THCA-A влияет на воспалительные процессы в мозге, подавляя активность микроглии — ключевых иммунных клеток центральной нервной системы, которые при чрезмерной активации способствуют нейрональному повреждению. Она снижает секрецию провоспалительных цитокинов, таких как TNF-α и IL-1β, что помогает контролировать воспаление и предотвращать дальнейшее нейродегенеративное разрушение.
Также THCA-A модулирует сигнальные пути, связанные с апоптозом, включая каспазный каскад и регуляцию белков семейства Bcl-2, которые контролируют выживание нейронов. Это действие способствует защите мозговых клеток от запрограммированной гибели, что имеет большое значение при хронических заболеваниях, связанных с прогрессирующей утратой нейронов.
Воздействие THCA-A на ионные каналы TRPV1 в нервной системе способствует модуляции болевой чувствительности и регуляции нервной передачи, что может дополнять её нейропротекторный эффект за счёт снижения невропатической боли.
Противовоспалительный потенциал
Противовоспалительная активность THCA-A вытекает из её способности воздействовать на ключевые молекулярные звенья воспалительного процесса, что отличает её от многих других каннабиноидов. Экспериментальные данные показывают, что THCA-A эффективно ингибирует активность ферментов циклооксигеназы COX-1 и COX-2, что приводит к снижению синтеза простагландинов — медиаторов, играющих центральную роль в развитии воспаления, боли и отёка.
Ингибирование COX ферментов обусловливает не только ослабление симптомов, но и замедление прогрессирования воспалительного процесса на молекулярном уровне. При этом THCA-A обладает более селективным профилем действия по сравнению с традиционными нестероидными противовоспалительными препаратами, что потенциально снижает риск побочных эффектов, таких как повреждение желудочно-кишечного тракта.
Кроме влияния на COX, THCA-A подавляет продукцию провоспалительных цитокинов, таких как интерлейкины IL-6 и IL-8, а также фактор некроза опухоли TNF-α, что происходит через модуляцию транскрипционных факторов, в частности NF-kB, которые управляют генетической экспрессией воспалительных медиаторов. Это позволяет THCA-A эффективно регулировать иммунный ответ и снижать хроническое воспаление, которое часто является основой многих хронических болезней, включая аутоиммунные заболевания.
Также THCA-A демонстрирует способность снижать активность макрофагов и инфильтрацию воспалительных клеток в тканях, что дополнительно способствует регуляции воспалительных процессов и способствует восстановлению тканевого гомеостаза.
Антиеметические и противоопухолевые эффекты (данные доклинических исследований)
Антиеметический эффект THCA-A подтверждается исследованиями на моделях тошноты и рвоты, которые часто сопровождают онкологическую терапию. Этот каннабиноид действует через взаимодействие с рецепторами центральной нервной системы, в частности CB1, а также потенциально с 5-HT3 серотониновыми рецепторами, которые являются важными медиаторами контроля рвотного рефлекса. В доклинических исследованиях THCA-A снижает интенсивность и частоту рвоты, что может значительно улучшить качество жизни пациентов, проходящих химиотерапию.
Следует отметить, что THCA-A не проявляет психоактивности, что делает её более безопасной альтернативой классическим каннабиноидам для контроля симптомов химиотерапии.
Противоопухолевые свойства THCA-A являются одним из наиболее перспективных направлений, активно изучаемых в доклинических экспериментах. В культурах раковых клеток THCA-A показывает способность подавлять их пролиферацию, индуцировать апоптоз и останавливать клеточный цикл. Молекулярные механизмы этих эффектов включают активацию каспаз, модуляцию сигнальных путей PI3K/Akt/mTOR и MAPK, которые играют ключевую роль в регуляции роста и выживания опухолевых клеток.
Данные также свидетельствуют о том, что THCA-A может ингибировать ангиогенез — процесс формирования новых кровеносных сосудов, необходимых для роста опухоли и метастазирования. Это достигается за счёт снижения экспрессии факторов роста, таких как VEGF, которые обеспечивают сосудистое развитие опухолей.
Отдельные исследования демонстрируют эффективность THCA-A в отношении опухолей молочной железы, лимфомы, а также колоректального рака, что делает её перспективным агентом для комплексной онкологической терапии, особенно в сочетании с традиционными методами лечения.
Декарбоксилирование: переходы THCA-A в Δ9-THC
Декарбоксилирование THCA-A в Δ9-THC является ключевым химическим процессом, определяющим переход каннабиноидов из неактивной или слабоактивной кислой формы в биологически активную психоактивную форму. THCA-A (транс-каннабигероловая кислота А) по своей природе является прекурсором, который в растении накапливается в виде кислоты. Она не обладает заметным психоактивным действием из-за наличия карбоксильной группы, которая ограничивает её способность к взаимодействию с каннабиноидными рецепторами, в частности CB1, отвечающими за психоактивные эффекты. Процесс декарбоксилирования включает потерю карбоксильной группы в виде углекислого газа (CO₂), происходящую под воздействием тепла, времени и других внешних факторов. Это химическое превращение необходимо для активации THCA-A и образования Δ9-THC, что существенно меняет фармакологические свойства вещества.
Процесс декарбоксилирования является естественным, но может контролироваться условиями приготовления, хранения и обработки каннабиса. При нагревании сырой растительной массы каннабиса или концентратов температура способствует активации реакции расщепления карбоксильной группы, что высвобождает CO₂ и формирует активный каннабиноид. Отсутствие или недостаточность нагрева сохраняет THCA-A в кислотной форме, что обуславливает её фармакологическую специфику.
Важно подчеркнуть, что декарбоксилирование не является мгновенным и проходит через ряд промежуточных состояний, где в зависимости от температурных и временных параметров может происходить частичное или полное превращение. Помимо теплового фактора, на скорость и эффективность декарбоксилирования влияют влажность, наличие катализаторов, а также тип материала, в котором проходит реакция.
С химической точки зрения декарбоксилирование — это простая реакция разложения карбоксильной группы, но с биохимической — это превращение с радикальными последствиями для взаимодействия с рецепторами эндоканнабиноидной системы. После декарбоксилирования Δ9-THC приобретает способность эффективно связываться с рецепторами CB1, вызывая типичные психоактивные эффекты, лежащие в основе рекреационного и терапевтического использования каннабиса.
Понимание и контроль процесса декарбоксилирования критически важны для фармацевтической индустрии и медицинского применения каннабиноидов. От этого зависит как степень активации активных соединений, так и профиль фармакодинамических свойств препаратов, создаваемых на основе каннабиса. Некоторые терапевтические подходы сознательно избегают декарбоксилирования для сохранения специфических эффектов THCA-A, тогда как другие наоборот стремятся к максимальной конверсии в Δ9-THC.
Декарбоксилирование также влияет на стабильность и срок хранения каннабиноидных продуктов, так как THCA-A является относительно более стабильным соединением по сравнению с Δ9-THC, который более чувствителен к окислению и распаду при длительном хранении. Поэтому в условиях производства, хранения и транспортировки каннабиноидов необходимо тщательно регулировать параметры, чтобы избежать нежелательной деструкции или потери активности.
Механизм и кинетика реакции
Декарбоксилирование THCA-A — это химическая реакция, сопровождающаяся отщеплением молекулы углекислого газа (CO₂) от карбоксильной группы, прикрепленной к основному каннабиноидному скелету. Этот процесс происходит за счёт термического воздействия, которое обеспечивает молекуле необходимую энергию для перехода к активной форме — Δ9-тетрагидроканнабинолу (Δ9-THC). Реакция относится к классу термодеструктивных реакций, не требующих участия воды или дополнительных реагентов, но зависящих от температурного режима, времени экспозиции, типа среды и агрегатного состояния самой молекулы. В случае THCA-A происходит разрыв ковалентной связи между карбоксильной группой (-COOH) и остовом молекулы с образованием углекислого газа и переходной формы молекулы, которая почти мгновенно стабилизируется в структуре Δ9-THC.
На молекулярном уровне механизм включает образование переходного состояния с перегруппировкой электронной плотности, вызывающей потерю CO₂. Этот процесс является эндэргоническим на первом этапе, что означает необходимость поглощения энергии, но после достижения переходного состояния реакция становится термодинамически благоприятной. Кинетика реакции сложна, поскольку скорость зависит не только от абсолютной температуры, но и от физико-химических свойств среды: влажности, давления, наличия других компонентов в матрице, а также от морфологии образца (измельчение, плотность, степень дисперсности). Важно отметить, что декарбоксилирование в реальной среде является частью более широкого комплекса деградационных процессов, поэтому его анализ требует изоляции реакции в экспериментальных условиях.
Фармакологическая релевантность этой реакции заключается в том, что именно Δ9-THC проявляет полноценную активность к CB1-рецепторам центральной нервной системы, тогда как THCA-A является антагонистически нейтральным в данном контексте. Поэтому эффективное декарбоксилирование является необходимым условием для приготовления лекарственных форм с психоактивными или центрально действующими эффектами. Дополнительно продукты частичного или неполного декарбоксилирования могут иметь собственную биоактивность, требующую отдельного изучения, поскольку образование промежуточных соединений способно влиять на спектр действия конечного препарата.
Температурная и временная зависимость
Температурная зависимость декарбоксилирования THCA-A отражает классические закономерности термохимических реакций, подчинённых правилу Аррениуса. Повышение температуры способствует ускорению реакции за счёт увеличения средней кинетической энергии молекул и частоты эффективных столкновений. Исследования показывают, что декарбоксилирование THCA-A начинается при температурах выше 90-100°C, тогда как оптимальный диапазон для полного превращения лежит между 110°C и 145°C. В этом диапазоне реакция происходит с максимальной эффективностью без существенного риска термической деградации образованного Δ9-THC. За пределами этих температур — как при слишком низких, так и при слишком высоких — происходят побочные явления: неполное превращение, изомеризация Δ9-THC в Δ8-THC или деградация в CBN.
Временной аспект также критически важен. Для низкотемпературного декарбоксилирования требуются более длительные периоды, иногда до 60-90 минут, тогда как при высоких температурах (свыше 130°C) реакция завершается за 20-30 минут. Однако сокращение времени при высоких температурах сопровождается риском образования продуктов окисления, особенно при наличии кислорода или влаги. В этом контексте обеспечение анаэробной среды и контроль влажности становятся критическими технологическими параметрами, особенно при подготовке экстрактов для медицинского использования.
Наличие воды или других летучих компонентов может изменять температуру кипения системы и таким образом влиять на локальную температуру самой молекулы. Содержание влаги в сырой растительной массе способно отсрочить начало реакции или вызвать неравномерное декарбоксилирование. Поэтому в аналитической практике и промышленном производстве применяют предварительную сушку образца или контроль влажности через вакуумные сушилки. Известно также, что различные матрицы — эфирные масла, липиды, терпеноидные профили — имеют собственный теплопроводный потенциал, что меняет локальные условия реакции и требует коррекции температурного режима в каждом конкретном случае.
Зависимость между температурой, временем и стабильностью конечного продукта является нелинейной, и для достижения оптимального результата часто используют математическое моделирование кинетики реакции. Такие модели позволяют прогнозировать поведение системы при заданных параметрах и адаптировать их под конкретную технологию — сушку, выпекание, экстракцию или синтез концентратов. Определение временной константы реакции в пределах конкретного температурного диапазона даёт возможность точного контроля и минимизации побочных процессов.
Катализ и внешние факторы
Хотя реакция декарбоксилирования THCA-A традиционно считается термически индуцированной, определённые внешние факторы могут выступать как катализаторы или модификаторы кинетики реакции. Самыми очевидными из них являются свет, кислород, влажность, а также присутствие кислотно-основных примесей, которые могут снижать энергию активации или изменять маршрут реакции. В частности, экспозиция к ультрафиолетовому или видимому свету приводит к преждевременному или неравномерному декарбоксилированию, особенно в образцах, хранящихся в прозрачной таре. Свет вызывает фотохимическое возбуждение, которое способно запускать реакции деградации ещё до наступления температурного воздействия, снижая выход Δ9-THC и ускоряя образование окисленных побочных продуктов.
Кислород в присутствии света или высокой температуры действует как мощный окислитель, который не только стимулирует декарбоксилирование, но и приводит к дальнейшей деградации Δ9-THC до CBN, что является нежелательным в большинстве случаев. С учётом этого процессы декарбоксилирования обычно проводят в инертной атмосфере — азота или аргона — либо в условиях вакуума. Это позволяет не только повысить эффективность превращения, но и сохранить стабильность образовавшегося Δ9-THC.
Катализ кислотно-основного типа потенциально возможен в присутствии примесей, таких как минеральные кислоты или щёлочи, которые могут оставаться в материале после экстракции. В таких условиях декарбоксилирование может проходить по альтернативным механизмам с образованием побочных продуктов или даже изменением стереохимии молекулы. Также установлено, что присутствие ионов металлов, особенно Fe³⁺, Cu²⁺ и других переходных элементов, может катализировать реакцию за счёт координации с карбоксильной группой, снижая барьер активации.
Кроме того, сама структура матрицы влияет на эффективность теплопередачи. Например, при использовании растительного материала, содержащего липиды, терпеноиды или остатки целлюлозы, теплопроводность является неравномерной. Это создаёт температурные градиенты, которые локально ускоряют или замедляют реакцию. С учётом этого современные технологии декарбоксилирования предусматривают использование гомогенизированных матриц, стандартизированных по влажности, содержанию органических примесей и размеру частиц.
Биохимические последствия декарбоксилирования
После декарбоксилирования тетрагидроканнабиноловой кислоты A (THCA-A) до нейтральной формы Δ9-тетрагидроканнабинола (Δ9-THC) происходит существенная трансформация фармакологического и рецепторного профиля молекулы. Этот процесс заключается в потере карбоксильной группы с формированием нового пространственного электронного распределения в молекуле, что кардинально изменяет её биохимическую активность. THCA-A в природном состоянии не связывается эффективно с рецептором CB1, что обусловливает её непсихоактивность. Напротив, Δ9-THC является мощным агонистом CB1-рецепторов, что объясняет основную психоактивность каннабиса после нагревания. Помимо взаимодействия с каннабиноидными рецепторами, декарбоксилированная форма демонстрирует также изменённый профиль взаимодействия с другими молекулярными мишенями — в частности, трансмембранными ионными каналами и ферментативными комплексами, такими как COX-2 или FAAH. Эти изменения имеют глубокие биохимические и физиологические последствия, влияя на спектр действия Δ9-THC в организме.
Изменение рецепторного профиля
Рецепторный профиль THCA-A значительно ограничен её структурной полярностью, связанной с наличием свободной карбоксильной группы, которая снижает способность молекулы проникать через гидрофобную мембрану клеток. Соответственно, даже при наличии теоретической аффинности к CB1 или CB2 рецепторам, реальная биодоступность THCA-A в центральной нервной системе ограничена. Это существенно контрастирует с Δ9-THC, который вследствие декарбоксилирования приобретает липофильные свойства, обеспечивающие свободное проникновение через гематоэнцефалический барьер и непосредственную активацию CB1-рецепторов в ЦНС. Эти рецепторы являются Gi/o-связанными GPCR, экспрессированными в высокой плотности в гиппокампе, базальных ганглиях, мозжечке и префронтальной коре — структурах, ответственных за память, моторику, эмоции и восприятие. Взаимодействие Δ9-THC с CB1 вызывает каскад внутриклеточных событий, включая снижение уровня цАМФ, ингибирование кальциевых каналов и активацию GIRK-каналов, что приводит к нейромодуляции.
THCA-A, хотя и демонстрирует некоторую аффинность к CB2-рецепторам, не активирует их в той степени, что наблюдается при действии Δ9-THC или других каннабиноидов. Некоторые данные указывают на возможную аллостерическую модуляцию CB1-рецепторов THCA-A, однако эти эффекты остаются слабыми и кратковременными. Вне каннабиноидных рецепторов THCA-A обладает активностью по отношению к некоторым TRP-каналам, особенно TRPM8 и TRPV1, что потенциально объясняет его слабое противовоспалительное действие. Но после декарбоксилирования молекула Δ9-THC приобретает дополнительную активность по отношению к широкому спектру мишеней: PPARγ, GPR55, а также ингибиторов ацилгидролаз жирных кислот, что обеспечивает более глубокое влияние на нейроэндокринную и иммунную системы.
Появление психоактивности
Ключевым следствием декарбоксилирования THCA-A является переход в состояние, при котором молекула способна вызывать изменение психоэмоционального состояния человека. В основе этого лежит образование Δ9-THC — вещества с высокой аффинностью к CB1-рецепторам в головном мозге. Именно это свойство обеспечивает психоактивность — способность влиять на когнитивные, сенсорные и аффективные процессы. Активированный CB1-рецептор изменяет высвобождение нейромедиаторов, таких как глутамат, ГАМК, дофамин, серотонин, что обуславливает характерные эффекты Δ9-THC: эйфорию, изменения восприятия времени и пространства, снижение тревожности или, наоборот, её усиление, в зависимости от индивидуальной нейрофизиологии.
Психоактивность не появляется постепенно — она является следствием достижения определённого фармакологического порога концентрации Δ9-THC в ЦНС. Этот порог зависит от пути введения, степени декарбоксилирования и степени метаболизации первого прохождения. В случае ингаляции Δ9-THC поступает в мозг практически немедленно, тогда как при пероральном употреблении — после трансформации в 11-гидрокси-THC, который обладает ещё более высокой психоактивностью. THCA-A неспособна пройти эти пути, так как не проникает через гематоэнцефалический барьер в достаточных концентрациях и не активирует CB1.
В контексте клинической фармакологии появление психоактивности — критический параметр, определяющий терапевтическое окно, дозировку, режим введения и популяционные ограничения для пациентов. Декарбоксилирование, хоть и необходимо для активации каннабиноидов как нейротропного вещества, создаёт значительные риски побочных эффектов, особенно при длительном или неконтролируемом употреблении. Психоактивность Δ9-THC является одной из главных причин развития толерантности, зависимости, а также кратковременных когнитивных нарушений. Напротив, THCA-A не ассоциируется с ни одним из этих рисков, что делает его перспективным для создания непсихоактивных терапевтических средств.
На нейрофизиологическом уровне психоактивность Δ9-THC проявляется в модуляции активности γ-ритмов в коре головного мозга, изменениях локальной синхронизации нейронной активности и нарушении стандартного баланса между возбуждающими и тормозящими сигналами. Это объясняет появление изменённого восприятия, творческой активности, а также возможного транзиторного параноидального мышления. В то время как THCA-A не вызывает ни одной из этих реакций, что подтверждено как клиническими наблюдениями, так и данными фМРТ.
Актуальные и перспективные направления применения THCA-A
Несмотря на ограниченную биодоступность и инертность в психоактивном смысле, THCA-A приобретает всё больший интерес со стороны медицинского, фармакологического, аналитического и биотехнологического сообществ. Его ценность не ограничивается статусом предшественника Δ9-THC, а разворачивается в ряде уникальных функциональных применений, где сохранение кислотной формы не только желательно, но и необходимо. Изучение THCA-A происходит в контексте поиска эффективных, но более безопасных для пациентов фитокомпонентов, способных выполнять специфические функции без характерных для нейтрализованных каннабиноидов эффектов. Его потенциал охватывает сферы фундаментальной науки, клинической фармакологии, контроля качества растительного сырья и даже биотехнологий, ориентированных на генетическую модификацию ферментативных систем.
Одним из основных векторов интереса к THCA-A остаётся его природная форма, которая в отличие от Δ9-THC не взаимодействует с каннабиноидными рецепторами CB1 с высокой аффинностью. Это открывает возможность целенаправленной терапии без сопутствующих психоактивных эффектов. В этом контексте растёт роль THCA-A как исследовательского инструмента для разделения эффектов, связанных с CB1-активацией, от других, возможно, периферических или неканнабиноидных механизмов действия.
Наряду с медицинскими аспектами, THCA-A всё активнее рассматривается как маркер биогенетического статуса каннабиса. Его стабильное присутствие в неэкстрагированной растительной массе до момента термической обработки является основой для создания систем контроля качества, аутентичности штаммов, фитосанитарного мониторинга. В аналитической химии THCA-A выступает не только объектом количественного определения, но и индикатором условий хранения, транспортировки и экстракции каннабиса.
Биотехнологические направления исследований также демонстрируют рост интереса к ферменту THCA-синтазе, катализирующему последний шаг в биосинтезе THCA-A. Поскольку этот фермент имеет чётко определённую специфичность к CBGA, его модификация может позволить регулирование соотношения кислотных форм каннабиноидов в растительной биомассе. Это открывает путь к созданию каннабиса нового поколения — штаммов, ориентированных на медицинские нужды без риска конверсии в Δ9-THC даже под воздействием температуры.
Кроме того, THCA-A постепенно интегрируется в комплексную концепцию фитотерапевтической стандартизации. Его включают в протоколы фитоконтроля, в частности при оценке «живых экстрактов» (live extracts), которые сохраняют полный кислотный профиль. Эти экстракты считаются перспективными благодаря сохранению первичного химического состава без термического разложения, что важно при разработке продуктов для микродозированной или местной терапии.
Медицина
THCA-A, как кислотный предшественник Δ9-тетрагидроканнабинола, демонстрирует уникальные свойства, которые выделяют его среди других каннабиноидов и делают чрезвычайно перспективным для медицинских исследований и терапевтического применения. В отличие от своего декарбоксилированного аналога, THCA-A не взаимодействует с каннабиноидными рецепторами CB1 в центральной нервной системе таким образом, который вызывал бы психоактивный эффект. Это сразу ставит его в особое положение: он сохраняет биологическую активность, потенциально полезную для лечения хронических и системных заболеваний, оставаясь при этом лишённым негативного влияния на когнитивные функции или психоэмоциональное состояние.
Этот профиль особенно привлекателен для клинической фармакологии, которая всё больше фокусируется на поиске соединений с максимальной терапевтической селективностью и минимизацией побочных эффектов. THCA-A не проникает через гематоэнцефалический барьер в значимых количествах, избегая взаимодействия с нейрональными CB1-рецепторами, однако демонстрирует активность через другие молекулярные мишени, включая PPARγ, TRP-каналы и потенциально GPR55, что обеспечивает влияние на воспалительные, иммунные, обменные и нейродегенеративные процессы без центрального психотропного эффекта.
Проблема психоактивности Δ9-THC в условиях длительного лечения является фундаментальной в современной медицинской каннабиноидной терапии. Именно поэтому THCA-A рассматривается как стратегически важный кандидат на роль молекулы для безопасного, длительного использования в терапевтической практике, где контроль за сознанием, психической стабильностью и работоспособностью пациента имеет критическое значение. Особого внимания заслуживает применение THCA-A в педиатрической неврологии, гериатрии и при хроническом аутоиммунном воспалении, где минимизация психоактивных эффектов является бескомпромиссным требованием.
Ревматологические состояния, включая ревматоидный артрит и системную красную волчанку, демонстрируют иммуновоспалительную природу, где ключевыми механизмами являются гиперактивация макрофагов, продукция провоспалительных цитокинов и патологическое ремоделирование тканей. THCA-A влияет на эти процессы, модулируя активность циклооксигеназы-2 (COX-2), ингибируя продукцию TNF-α и IL-6, а также проявляя антиоксидантные свойства. Эти действия не только уменьшают интенсивность воспаления, но и замедляют его хронизацию, что особенно важно в терапии хронических воспалительных заболеваний соединительной ткани.
Помимо иммуномодулирующих свойств, THCA-A демонстрирует высокий потенциал для неврологической фармакологии. Его нейропротекторное действие опосредовано, в частности, через активацию ядерного рецептора PPARγ, который способен подавлять нейровоспаление, поддерживать митохондриальную функцию и предотвращать оксидативный стресс. Это открывает перспективы использования THCA-A в лечении таких патологий, как болезнь Альцгеймера, Паркинсона, амиотрофический латеральный склероз, а также посттравматические повреждения головного мозга. Важно, что эта нейропротекция не сопровождается снижением когнитивной продуктивности, изменением мотивации или дезорганизацией сознания — что характерно для Δ9-THC.
Во многих неврологических состояниях, включая эпилепсию, рассеянный склероз, хроническую боль центрального происхождения, применение THCA-A потенциально может снизить частоту обострений, интенсивность симптоматики и потребность в комбинациях с системными иммунодепрессантами или наркотическими анальгетиками. В клинических протоколах, где каннабиноиды уже интегрированы в паллиативную или поддерживающую терапию, замещение Δ9-THC на THCA-A может улучшить переносимость лечения, особенно в уязвимых группах населения.
Отдельное внимание следует уделить возможности использования THCA-A при онкологических заболеваниях как компоненте поддерживающей терапии. Хотя его противоопухолевый потенциал требует дальнейшей верификации, уже сейчас известно о способности этой молекулы снижать тошноту, вызванную химиотерапией, улучшать аппетит и при этом не вызывать зависимости или когнитивного притупления. Это критически важно для пациентов, получающих агрессивное лечение и вынужденных оставаться ментально активными на протяжении длительного периода.
Поиск не-психоактивных альтернатив Δ9-THC
Проблема психоактивности Δ9-THC остаётся одним из главных барьеров для его полноценной интеграции в фармакотерапию. Несмотря на доказанный анальгетический, анксиолитический, противовоспалительный и нейропротекторный потенциал, его способность изменять когнитивные функции, вызывать зависимость и толерантность существенно ограничивает применение в амбулаторных условиях, особенно среди уязвимых категорий — детей, пожилых людей, пациентов с психическими расстройствами. В этом контексте активизировался поиск не-психоактивных молекул с аналогичной или близкой биологической активностью, но без воздействия на центральную нервную систему через CB1-рецепторы. Одним из наиболее перспективных кандидатов в этом направлении является THCA-A — кислотная форма Δ9-THC, которая не проходит через гематоэнцефалический барьер в значимых концентрациях и не связывается с CB1-рецептором в функционально релевантной манере.
THCA-A не вызывает эйфории, не нарушает концентрацию, не провоцирует изменений в восприятии пространства, времени или себя — основных признаков психоактивности Δ9-THC. В то же время он демонстрирует широкий спектр биологической активности, включая противовоспалительное, антиоксидантное, спазмолитическое и нейропротекторное действие. Это позволяет рассматривать его как безопасную альтернативу при состояниях, где использование Δ9-THC является нецелесообразным из-за риска когнитивного или психоэмоционального воздействия. Потенциал THCA-A особенно ценен в контексте терапии хронической боли, аутоиммунных патологий, функциональных неврозов и синдромов мышечной ригидности — где желательна сохранность ментальной ясности без снижения эффективности обезболивания или иммуносупрессии.
На уровне фармакодинамики THCA-A демонстрирует взаимодействие с рядом неканнабиноидных мишеней, среди которых доминируют PPARγ, некоторые TRP-каналы (особенно TRPA1, TRPM8), а также потенциально — GPR55. Эти мишени имеют отношение к регуляции воспаления, апоптоза, окислительного стресса, митохондриальной динамики и глиальной реактивности. В то время как Δ9-THC реализует свою активность преимущественно через CB1 и CB2-рецепторы, THCA-A действует вне этой оси, что позволяет ему иметь отличный спектр эффектов при сохранении базового сходства в антиноцицептивном и нейрозахисном потенциале. Это создаёт уникальную ситуацию, когда структурное сходство двух соединений не предполагает тождественности механизмов действия, но обеспечивает терапевтическую надстройку без побочных эффектов психотропного порядка.
Клинические приоритеты также диктуют необходимость препаратов с длительной безопасностью. Декарбоксилированный Δ9-THC вызывает развитие толерантности, синдрома отмены и может ухудшать память, внимание, провоцировать тревожные расстройства или латентные психозы. В случае THCA-A эти риски отсутствуют даже при длительном применении, что позволяет формировать новые фармакотерапевтические схемы, рассчитанные на месяцы или годы без потери клинической эффективности или когнитивной нагрузки на пациента. При этом THCA-A не накапливается в нервной ткани, не нарушает дофаминовый гомеостаз и не участвует в нейрональной пластичности CB1-зависимого типа, что обеспечивает его фармакологическую инертность в плане формирования зависимости.
Терапевтический потенциал в неврологии и ревматологии
Неврологические и ревматологические заболевания часто объединяют ряд патогенетических механизмов, среди которых доминируют хроническое воспаление, активация глии, окислительный стресс, а также нарушения клеточной энергетики и митохондриального гомеостаза. В таких состояниях традиционная фармакотерапия обычно основана на полипрагмазии — сочетании противовоспалительных, нейромодулирующих, иммуносупрессивных и обезболивающих препаратов, что повышает риск токсических эффектов. В этом контексте THCA-A является перспективной молекулой, способной одновременно влиять на несколько ключевых патофизиологических звеньев без необходимости привлечения большого количества фармакологических агентов.
В нейродегенеративных болезнях, в частности болезни Альцгеймера, THCA-A демонстрирует способность снижать глиальную активацию и секрецию провоспалительных цитокинов, что замедляет дегенерацию нейронов и защищает синаптическую пластичность. Механизмы действия связаны с индукцией антиоксидантных ферментов, снижением продукции оксида азота, нормализацией кальциевого гомеостаза в нейронах и подавлением экспрессии IL-1β и TNF-α в микроглии. В болезни Паркинсона дополнительным фактором действия является улучшение митохондриального метаболизма и снижение образования активных форм кислорода, что уменьшает уровень нейронального апоптоза в нигростриарном комплексе.
У пациентов с рассеянным склерозом THCA-A может снижать интенсивность воспалительных очагов в центральной нервной системе, не вызывая седативного или психоактивного эффекта. Это обеспечивает его пригодность для дневного приёма в амбулаторных условиях, что принципиально важно при поддерживающей терапии. Аналогично, в эпилептологии, особенно детской, THCA-A показывает противосудорожное действие через механизмы, не связанные с CB1-рецепторной ингибиции, а значит — без сопутствующих изменений в настроении, внимании или сне.
В ревматологии ключевыми эффектами THCA-A являются снижение продукции провоспалительных медиаторов в синовиальной ткани, торможение миграции нейтрофилов и подавление ферментативной активности COX-2 без риска желудочной токсичности. Этот эффект особенно полезен при ревматоидном артрите, где воспаление имеет системный характер. THCA-A способен модулировать иммунный ответ без глубокого подавления клеточного иммунитета, что отличает его от стероидных и нестероидных противовоспалительных средств.
Системные заболевания соединительной ткани, включая системную красную волчанку, часто сопровождаются хронической активацией интерферонового ответа и нарушением баланса между Т-хелперами и регуляторными Т-клетками. THCA-A воздействует на эту ось, снижая активность провоспалительных линий, не влияя на общую иммунокомпетентность, что важно для предотвращения вторичных инфекций. Кроме того, его антиоксидантная активность уменьшает риск повреждения сосудистого эндотелия — одного из ключевых механизмов органного поражения при системных васкулитах.
Аналитическая химия и фитоконтроль
Аналитическая химия в контексте каннабиноидов — это фундаментальная отрасль, которая обеспечивает точную идентификацию, количественный анализ и стандартизацию сложных композиций растительного материала. THCA-A, как наиболее распространённая каннабиноидная кислота в сыром каннабисе, выступает не просто как один из многих компонентов, а как ключевой маркер, отражающий биохимическое состояние растения до стадии экстракции или термической обработки. Именно его присутствие и концентрация становятся основой для качественного контроля, разграничения штаммов, а также определения условий сбора и хранения растительного сырья. Точное измерение THCA-A позволяет создавать унифицированные протоколы контроля фитомассы, что чрезвычайно важно для фармацевтической и медицинской промышленности, где каждый грамм сырья должен соответствовать установленным стандартам.
Определение THCA-A осуществляется с помощью современных методов хроматографии, включая ВЭЖХ, ГХ-МС, а также спектрометрии с высокой разрешающей способностью. Применение этих методов обеспечивает не только точность анализа, но и позволяет отличить THCA-A от декарбоксилированных форм, таких как Δ9-THC, что критически важно из-за различия в фармакологических свойствах и законодательном регулировании. Эти аналитические методики позволяют установить время сбора идеального сырья, когда содержание THCA-A максимально, а трансформация в психоактивный THC минимальна. Такой контроль способствует не только более эффективному выращиванию и хранению, но и даёт возможность отказаться от субъективных оценок качества в пользу объективных количественных показателей.
Во время аналитического процесса критической является не только сама количественная характеристика THCA-A, но и её соотношение с другими каннабиноидами и терпены, что формирует уникальный «фитохимический отпечаток» конкретного штамма. Эта составляющая позволяет классифицировать и дифференцировать штаммы каннабиса с высокой точностью, что исключает подмены или несанкционированное расширение ассортимента. Таким образом, THCA-A выполняет функцию биомаркера, который является базисом для создания глобальных библиотек профилей каннабиноидов с высоким уровнем воспроизводимости.
Инновации в области аналитической химии также направлены на разработку быстрых и недорогих методов определения THCA-A в полевых условиях, что открывает новые горизонты для контроля качества в производственных и лабораторных процессах. Появление портативных устройств, основанных на спектроскопии, и биосенсоров, чувствительных к кислой форме THC, способны изменить традиционный подход к фитоконтролю, снизить затраты и повысить оперативность принятия решений. Это особенно актуально для легализованных рынков, где точный учёт активных веществ — вопрос законодательной ответственности и безопасности конечного потребителя.
Интеграция аналитических данных с биоинформатикой и системным анализом открывает перспективы для глубокого изучения динамики биосинтеза THCA-A в пределах отдельных клеточных и тканевых структур растения, что может привести к генетическому усовершенствованию штаммов с заданными фармакологическими свойствами. Это направление имеет большой потенциал для развития индивидуализированных фитопрепаратов с точным дозированием и прогнозируемой эффективностью.
Биомаркер сырого каннабиса
Определение THCA-A как биомаркера сырого каннабиса базируется на его уникальном свойстве быть доминирующей каннабиноидной кислотой в первичной сырьевой массе до начала термической обработки. Это отличает его от большинства других каннабиноидов, которые преимущественно присутствуют в декарбоксилированной форме в высушенном или обработанном продукте. THCA-A, будучи предшественником Δ9-THC, отражает метаболическое состояние растения в момент сбора, что делает его бесспорным маркером свежести и степени биохимической зрелости материала. Отсутствие или значительное снижение уровня THCA-A свидетельствует о начале или завершении процессов деградации и декарбоксилирования, что влияет на качество и фармакологический профиль конечного продукта.
Использование THCA-A в качестве биомаркера принципиально важно в сырьевой базе для фармацевтических препаратов, где строгий контроль состава и стабильности является определяющим фактором. Контроль концентрации THCA-A позволяет оценить не только качество сбора, но и влияние условий хранения, включая температуру, влажность и продолжительность экспозиции. При этом даже незначительные изменения концентрации THCA-A могут сигнализировать о неблагоприятных для целостности каннабиноидного профиля процессах, которые могут снизить эффективность или безопасность продукта.
Кроме того, THCA-A позволяет отличать сырой каннабис от кондитерских или экстрактных продуктов, прошедших тепловую обработку, где уровень кислоты практически отсутствует. Такой биомаркерный подход значительно упрощает процедуры квалификации идентичности материала, предотвращая фальсификации и злоупотребления в коммерческой деятельности.
Исследования свежести сырья на основе THCA-A также открывают возможности для контроля биологической активности и прогнозирования терапевтического профиля продуктов. Высокое содержание THCA-A коррелирует с оптимальным спектром активности, особенно в случае применения каннабиса для лечения воспалительных и нейродегенеративных состояний, что позволяет прогнозировать результативность терапии ещё на этапе сырья.
В условиях массового выращивания каннабиса, где агротехнические условия, удобрения, освещение и время сбора варьируются, THCA-A становится незаменимым индикатором для стандартизации сырья и избежания вариабельности в фармакологических свойствах конечного продукта. Благодаря этому снижается риск непредсказуемых клинических результатов и повышается доверие к препаратам на основе каннабиса.
Контроль качества и соответствие штаммов
Точное определение состава каннабиноидов, в первую очередь THCA-A, выступает фундаментом для контроля качества, что в условиях индустриализации выращивания каннабиса имеет критическое значение. Контроль качества основан не только на количественном анализе, но и на полной идентификации химического профиля, который включает соотношение каннабиноидов, терпенов и флавоноидов. В этом контексте THCA-A является ключевым маркером, определяющим, соответствует ли продукт заявленному штамму и профилю.
Штамм каннабиса — это комплекс генетических и фенотипических характеристик, проявляющихся через фитохимический профиль. Наличие и количество THCA-A в сочетании с другими компонентами создают своеобразный «химический паспорт», используемый для верификации и классификации растений. Эта информация позволяет избежать путаницы в коммерческих поставках, а также гарантирует соответствие между ожидаемыми и фактическими фармакологическими эффектами, особенно в медицинской сфере.
Внедрение стандартов контроля на основе THCA-A обеспечивает выявление подделок и фальсификаций, которые могут иметь место на теневых рынках. Определение соотношения кислоты и декарбоксилированных форм помогает идентифицировать условия хранения и транспортировки, нарушающие технологическую цепочку, а также использовать «химические отпечатки» для отслеживания происхождения продукта. Это даёт возможность разработать системы прослеживаемости и сертификации качества, необходимые для легализованных рынков.
В современных производствах контроль качества становится многоуровневым процессом, где THCA-A измеряется на нескольких этапах — от культивации до конечного продукта. Такие стандарты обеспечивают стабильность и предсказуемость эффектов, что является основой для формирования доверия со стороны медицинских работников и пациентов. Без этого контрольного механизма трудно гарантировать соответствие фармакологических свойств продуктов заявленным требованиям.
Биотехнологии
Современные биотехнологические подходы к каннабису, в частности к метаболизму и синтезу THCA-A, открывают новые горизонты в совершенствовании продуктивности растения, контроле качества сырья и создании специализированных фармакологических продуктов. Биотехнология позволяет не только глубже понять молекулярные механизмы ферментативного синтеза каннабиноидов, но и кардинально изменить способ выращивания и подготовки растений, направляя их метаболизм в нужное русло. В этом контексте ключевое значение имеет инженерия ферментов THCA-синтазы — основного катализатора, преобразующего прекурсоры в активную каннабиноидную кислоту, а также разработка генетически модифицированных штаммов, способных накапливать высокие уровни THCA-A с минимальным или отсутствующим образованием Δ9-THC. Эти направления не только повышают эффективность производства, но создают предпосылки для более безопасного, управляемого и стандартизированного применения каннабиноидов в фармации и медицине.
Инженерия ферментов THCA-синтазы
Фермент THCA-синтаза, катализирующий реакцию превращения каннабигероловой кислоты (CBGA) в THCA, является центральным элементом биосинтетического пути каннабиноидов. Понимание его структуры, каталитической механики и регуляции позволяет осуществлять целенаправленные вмешательства на молекулярном уровне, изменяя активность, специфичность или стабильность фермента. С помощью методов генной инженерии, в частности направленной эволюции, сайт-специфического мутагенеза и рекомбинантной экспрессии, возможно получить варианты фермента с повышенной продуктивностью, меньшей склонностью к деградации или со изменённым субстратным спектром.
Одной из ключевых задач является повышение эффективности синтеза THCA без увеличения образования побочных продуктов или токсичных промежуточных соединений. Инженерия THCA-синтазы позволяет оптимизировать её активный центр для более эффективного взаимодействия с CBGA, что приводит к ускорению реакции и повышению выхода конечного продукта. Также уделяется внимание стабилизации фермента в условиях культивации, где факторы окружающей среды могут влиять на его активность.
Важной задачей является изменение регуляции экспрессии гена THCA-синтазы, что позволяет контролировать количество фермента в тканях растения. С помощью промоторов со специфической активностью в соответствующих клеточных типах можно добиться локализации ферментативной активности в определённых органах или фазах развития. Такой подход открывает возможность более тонкого контроля над синтезом THCA, снижая потери и обеспечивая стабильность состава каннабиноидов.
Инженерия ферментов также предусматривает разработку искусственных биокатализаторов, способных работать в изолированных системах, например, в биореакторах, что открывает перспективы масштабного производства THCA-A вне растительного организма. Этот подход способен значительно снизить производственные затраты, устранить зависимость от агроклиматических факторов и повысить чистоту конечного продукта.
Дополнительно проводятся исследования, направленные на понимание взаимодействия THCA-синтазы с другими ферментами в биосинтетическом пути, что может позволить создание комплексных ферментных систем с синергетической активностью. Это открывает потенциал для манипуляций метаболическими потоками в растении, позволяя корректировать профиль каннабиноидов под конкретные терапевтические задачи.
Интеграция биоинформатических подходов и машинного обучения в процесс инженерии ферментов значительно ускоряет поиск оптимальных вариантов, позволяя моделировать структуру и функцию фермента ещё до проведения лабораторных экспериментов. Это снижает время и стоимость разработки новых биокатализаторов, делая их доступными для коммерческих и научных применений.
Выращивание каннабиса с повышенным содержанием THCA-A без THC
Разработка штаммов каннабиса, способных накапливать значительные количества THCA-A при одновременном снижении или полном отсутствии психоактивного Δ9-THC, является одним из важнейших направлений в современной биотехнологии растений. Это позволяет создавать безопасные для широкого применения продукты с выраженным терапевтическим потенциалом, избегая юридических и клинических проблем, связанных с психоактивностью.
Генетический контроль синтеза Δ9-THC осуществляется на уровне экспрессии ферментов, отвечающих за декарбоксилирование и дальнейшую модификацию THCA. Использование методов генной инженерии позволяет селективно подавлять или мутагенезировать гены, кодирующие ключевые ферменты этого пути, в частности THC-синтазу, которая преобразует THCA в Δ9-THC. При этом фермент THCA-синтаза остается активным, что обеспечивает накопление именно кислой формы.
Методы редактирования генома, такие как CRISPR/Cas9, открывают беспрецедентные возможности для точного и эффективного воздействия на отдельные гены, регулирующие синтез психоактивных каннабиноидов. Это позволяет создавать гибриды и мутанты со стабильным отсутствием THC даже при сохранении высокого уровня THCA-A, что является революционным шагом в производстве фармакологического сырья.
Также широко применяются селекционные подходы, основанные на фенотипическом и молекулярном скрининге растений с естественно низким уровнем THC. Сочетание традиционной селекции с молекулярным маркированием позволяет ускорить процесс формирования новых сортов с заданным химическим профилем.
Совершенствование агротехнических технологий, таких как контроль освещения, температурного режима, питания и влажности, также существенно влияет на баланс между THCA и THC. Биотехнологии позволяют интегрировать эти факторы в комплексные модели управления метаболизмом, обеспечивая стабильность и воспроизводимость производства.
Выращивание таких «безпсихоактивных» штаммов критически важно для разработки медицинских препаратов, которые могут применяться у пациентов с низким порогом чувствительности к психоактивным эффектам или в случаях, когда важно избежать когнитивных нарушений. Кроме того, это расширяет рынок легальных продуктов, делая их доступными в юрисдикциях с жесткими ограничениями на Δ9-THC.
Экологический аспект также приобретает значение: штаммы с высоким содержанием THCA-A без THC могут выращиваться в условиях, не требующих сложного контроля и обеспечивающих стабильность производства без дополнительных затрат на утилизацию психоактивных побочных продуктов.
Этические и регуляторные аспекты
Развитие использования THCA-A в медицинских, научных и промышленных сферах сталкивается с рядом сложных этических и регуляторных вызовов, связанных с позиционированием этого каннабиноида в правовом поле, безопасностью потребителей и общественными нормами. Отсутствие психоактивности THCA-A создает потенциал для его применения как безопасной альтернативы традиционным каннабиноидам, однако отсутствие четких нормативных определений во многих юрисдикциях порождает неоднозначность в регулировании обращения и контроля. Этическая сторона заключается в сбалансировании интересов пациентов и исследователей с правовыми ограничениями, возникающими из-за исторических, политических и социальных факторов, а также в обеспечении прозрачности, качества и безопасности продуктов с THCA-A. Определение места THCA-A в нормативно-правовых документах и международных соглашениях является ключевым для формирования соответствующей инфраструктуры, которая поддержит безопасное внедрение этого соединения в фармацевтическую практику и научные исследования.
Роль THCA-A в нормативно-правовых документах по каннабису
Учитывая отсутствие психоактивных свойств, THCA-A не всегда четко идентифицируется в нормативно-правовых актах, регулирующих оборот каннабиноидов. Это приводит к неоднозначностям в классификации и применении таких продуктов. В большинстве стран законодательство ориентируется на регулирование Δ9-THC как основного психоактивного компонента каннабиса, оставляя THCA-A в «серой зоне». Однако, поскольку THCA-A является предшественником Δ9-THC, многие нормативы включают его под общее определение «каннабиноидов» без детального разграничения. Такой подход создает сложности для производителей и пользователей, особенно в случаях, когда продукты содержат высокий уровень THCA-A при практически отсутствующем Δ9-THC.
Это порождает юридическую неопределенность, в частности в вопросах легальности транспортировки, хранения и использования сырья с высоким содержанием THCA-A. В странах с жестким контролем на психоактивные вещества наличие THCA-A может приводить к задержаниям и конфискации, даже если психоактивных эффектов у вещества нет. Такая ситуация подчеркивает необходимость разработки специфических критериев для идентификации и регулирования THCA-A, учитывающих его фармакологические свойства и потенциал.
Кроме того, в нормативных документах постепенно возрастает внимание к стандартам контроля качества и маркировки продукции с THCA-A, что должно обеспечить четкое информирование потребителя об отсутствии психоактивности и способствовать формированию доверия к таким препаратам. В то же время регуляторы сталкиваются с вызовами стандартизации аналитических методов для точного определения THCA-A в сырье и конечных продуктах, что является основой для законного оборота и научных исследований.
Интеграция новых знаний о THCA-A в нормативную базу требует согласования с международными конвенциями и национальными законами, что является длительным и сложным процессом, но необходимым для преодоления существующих правовых коллизий и обеспечения развития инновационных медицинских продуктов на основе каннабиноидов.
Международные подходы к классификации
На международном уровне классификация и регулирование каннабиноидов, в том числе THCA-A, являются предметом многосторонних дискуссий и неоднородных подходов. Различные страны и международные организации демонстрируют существенные различия в трактовке статуса THCA-A по сравнению с Δ9-THC, что обусловлено историческими, культурными и политическими факторами, а также уровнем научного развития и готовностью нормативных систем к инновациям.
В большинстве международных конвенций, таких как Единая конвенция ООН о наркотических средствах 1961 года, основное внимание уделяется психоактивным каннабиноидам, в частности Δ9-THC, а THCA-A не выделяется как отдельное вещество, что создает законодательные «белые пятна». Это усложняет разработку согласованных политик и способствует региональным расхождениям в подходах к контролю и использованию.
Некоторые страны, особенно те, которые имеют развитые программы легализации медицинского каннабиса, пытаются дифференцировать THCA-A от Δ9-THC в национальных законодательных актах, что позволяет гибче регулировать оборот продукции, в том числе определять пороговые значения содержания психоактивных веществ и внедрять стандарты безопасности. Такой подход обеспечивает легальный доступ к препаратам на основе THCA-A и способствует развитию научных исследований.
В то же время во многих странах регулирующие органы воздерживаются от такого разделения из-за опасений нелегального использования или невозможности эффективного контроля за трансформацией THCA-A в Δ9-THC. Это отражается в запретах или жестких ограничениях на все продукты каннабиса, независимо от специфического каннабиноидного профиля.
Международные организации, такие как Всемирная организация здравоохранения (ВОЗ), постепенно включают оценку немарких или неактивных каннабиноидов в свои рекомендации, однако это происходит медленно и зависит от накопления научных данных. Рекомендации ВОЗ относительно делегализации или смягчения регулирования Δ9-THC не всегда охватывают THCA-A, что создает дополнительную неоднозначность.
Вывод:
Delta-9-Tetrahydrocannabinol Acid A (THCA-A) является фундаментальным химическим соединением в биосинтетическом пути каннабиноидов в растении Cannabis sativa. Его статус как прекурсора психоактивного Δ9-THC определяет его ключевое значение в каннабисной химии, фармакологии и промышленности. Анализ структуры, химической природы и реакционных механизмов THCA-A выявляет сложную природу этой молекулы, которая является одновременно стабильной при низких температурах и чувствительной к термическим и временным воздействиям, что приводит к ее декарбоксилированию и образованию Δ9-THC с характеристиками, кардинально отличающимися от исходного соединения.
С химической точки зрения THCA-A характеризуется карбоксильной группой, которая определяет его кислотные свойства и придает соединению уникальные физико-химические характеристики, оказывающие значительное влияние на его биологическую активность. Основной биохимический процесс, определяющий дальнейшее поведение THCA-A, — это термическое декарбоксилирование, которое не только модифицирует молекулярную структуру, но и кардинально изменяет фармакологический профиль каннабиноида, трансформируя его из неактивной или слабоактивной формы в мощный психоактивный агент Δ9-THC.
Механизм декарбоксилирования требует детального изучения из-за его сложной кинетики и зависимости от внешних факторов, включая температуру, время нагрева, наличие катализаторов и условия среды. Температурная зависимость реакции имеет экспоненциальный характер с резким увеличением скорости при повышении температуры, что объясняет необходимость тщательного контроля технологических процессов, особенно при производстве медицинских и пищевых продуктов на основе каннабиса. Временной фактор и катализаторы, включая металлические и химические агенты, могут модулировать процесс, ускоряя или замедляя превращение, что является критически важным для обеспечения стабильности и прогнозируемости конечного продукта.
С фармакологической точки зрения THCA-A не обладает классическими психоактивными свойствами, характерными для Δ9-THC, из-за отсутствия способности эффективно связываться с каннабиноидными рецепторами CB1 в ЦНС. Вместо этого он проявляет значительный потенциал в регуляции иммунных ответов, противовоспалительном действии, а также может модулировать другие биологические системы, не вызывая привычных побочных эффектов, свойственных Δ9-THC. Эта особенность создает перспективы для применения THCA-A в качестве безопасного терапевтического агента, особенно в областях, где психоактивность нежелательна или вредна.
Важной составляющей фармакологического профиля THCA-A являются изменения рецепторного взаимодействия после декарбоксилирования, которые ведут к появлению психоактивности и значительному повышению аффинности к CB1-рецепторам. Это позволяет рассматривать THCA-A и Δ9-THC как два взаимосвязанных этапа одного биохимического процесса с разными клиническими и социальными последствиями. Появление психоактивности после превращения диктует жесткие требования к контролю процессов декарбоксилирования, особенно в медицинском и коммерческом секторах, где необходимо четко разграничивать продукты с психоактивным эффектом и неактивные.
В аспекте аналитической химии THCA-A выступает важным биомаркером сырого каннабиса, что позволяет идентифицировать качество сырья, его происхождение и степень обработки. Методы точного определения содержания THCA-A являются основой для контроля качества и соответствия штаммов каннабиса, что оказывает непосредственное влияние на стандартизацию продукции и ее законность. Определение соотношения THCA-A и Δ9-THC служит ключевым показателем технологического статуса сырья и позволяет прогнозировать фармакологический эффект конечного продукта.
В биотехнологическом контексте THCA-A открывает новые горизонты для инженерии ферментов, в частности THCA-синтазы, которая отвечает за его синтез в растении. Возможности модификации активности и специфичности этого фермента позволяют получать каннабисные штаммы с повышенным содержанием THCA-A, одновременно снижая или полностью устраняя уровень психоактивного Δ9-THC. Такие технологии кардинально меняют подходы к культивированию и производству каннабиноидных препаратов, открывая путь к легализации и применению без психоактивных рисков.
Выращивание растений с увеличенным содержанием THCA-A без Δ9-THC является стратегически важным направлением, способствующим развитию медицинской каннабитерапии, поскольку позволяет создавать эффективные препараты с минимальными побочными эффектами. Это также имеет социальное значение, так как снижает риски злоупотребления и зависимости, традиционно ассоциируемые с Δ9-THC, и соответствует требованиям регулирующих органов по безопасности и контролю.
Этические и регуляторные аспекты использования THCA-A являются чрезвычайно актуальными, учитывая его законодательный статус и потенциал к терапевтическому применению. Нормативно-правовая база в большинстве стран не содержит четких положений, регламентирующих оборот THCA-A как отдельного химического вещества, что создает трудности в легализации, контроле качества и научном исследовании. Отсутствие точных определений и разграничений с Δ9-THC приводит к юридическим коллизиям, негативно влияющим на инновационное развитие и доступ к терапевтическим средствам.
Управление рисками, связанными с декарбоксилированием THCA-A в Δ9-THC, становится ключевым фактором при разработке стандартов качества и безопасности. Различие между сырьем с высоким содержанием THCA-A и высоким Δ9-THC требует официального признания и внедрения в нормативно-правовые акты, что позволит дифференцировать медицинские продукты по их потенциальной активности и рискам. Такие подходы будут способствовать формированию прозрачного и научно обоснованного правового поля, поддерживающего развитие инноваций в фармацевтике и сельском хозяйстве.
Международная регуляторная практика демонстрирует неоднородность подходов к классификации THCA-A, что осложняет формирование унифицированной стратегии развития каннабиноидных препаратов. Отсутствие согласованных международных стандартов ограничивает обмен научными знаниями, затрудняет торговлю и вызывает различные уровни доступности терапевтических продуктов в разных странах. Для преодоления этих вызовов необходима гармонизация нормативной базы, учитывающая специфику THCA-A как вещества, являющегося предшественником психоактивного Δ9-THC, но само по себе не обладающего его свойствами.
Таким образом, THCA-A можно рассматривать как ключевой компонент будущего развития фармацевтических и биотехнологических направлений, связанных с каннабиноидами. Его уникальные свойства создают основу для безопасных не-психоактивных терапевтических средств, а также для совершенствования агротехнических процессов выращивания каннабиса с оптимизированным химическим профилем.
Этот каннабиноид открывает новые перспективы для персонализированной медицины и высокоточного контроля фармакологических эффектов, обеспечивая баланс между терапевтической эффективностью и безопасностью. Последующие исследования должны быть сосредоточены на детальном изучении биохимических механизмов взаимодействия THCA-A с различными биомолекулами, а также на разработке современных технологий контроля декарбоксилирования и стабилизации соединения в конечных продуктах.
Источники:
- PubMed Central (PMC) — Национальная медицинская библиотека США
База открытых научных статей по медицине, фармакологии и биохимии.
https://www.ncbi.nlm.nih.gov/pmc/ - National Institute on Drug Abuse (NIDA)
Авторитетный ресурс с исследованиями каннабиноидов, фармакологии и влияния на здоровье.
https://www.drugabuse.gov/ - Journal of Cannabis Research
Открытый журнал с публикациями на темы каннабиса, включая фармакологию и биохимию.
https://jcannabisresearch.biomedcentral.com/ - Frontiers in Pharmacology
Авторитетный открытый журнал со статьями по фармакологии каннабиноидов, биохимии и терапии.
https://www.frontiersin.org/journals/pharmacology - ScienceDirect (Open Access Articles)
Платформа Elsevier, содержащая множество открытых статей по фармакологии и биохимии каннабиноидов.
https://www.sciencedirect.com/ - United States Food and Drug Administration (FDA)
Официальные документы и позиции регулятора по каннабиноидам, включая нормативные рекомендации.
https://www.fda.gov/ - European Monitoring Centre for Drugs and Drug Addiction (EMCDDA)
Европейский центр мониторинга наркотиков и их воздействия, содержит аналитические отчёты и нормативы.
https://www.emcdda.europa.eu/ - World Health Organization (WHO) — Экспертный комитет по зависимости от наркотиков (Expert Committee on Drug Dependence Reports)
Оценки и рекомендации по каннабиноидам и их классификации.
https://www.who.int/teams/health-product-policy-and-standards/controlled-substances/expert-committee-on-drug-dependence - Journal of Natural Products (American Chemical Society)
Публикации о химическом составе и биосинтезе каннабиноидов.
https://pubs.acs.org/journal/jnprdf - Cannabis and Cannabinoid Research (Mary Ann Liebert, Inc.)
Научный журнал, специализирующийся на современных исследованиях каннабиноидов.
https://www.liebertpub.com/can - National Center for Biotechnology Information (NCBI) — базы данных генов и белков
Информация о ферментах, генетике и биохимии, включая THCA-синтазу.
https://www.ncbi.nlm.nih.gov/ - Scopus (Open Access Articles)
Библиографическая база данных с доступом к открытым статьям по медицине и биотехнологиям.
https://www.scopus.com/ - Harvard Health Publishing
Обзорные материалы и публикации о каннабиноидах в медицине.
https://www.health.harvard.edu/ - The Journal of Biological Chemistry
Публикации по биохимии ферментов, включая THCA-синтазу и другие ферменты каннабиноидного пути.
https://www.jbc.org/ - National Agricultural Library (NAL) — Министерство сельского хозяйства США
Материалы по сельскому хозяйству, биотехнологиям и контролю качества растений.
https://www.nal.usda.gov/