Каннабиноидная химия находится в состоянии латентной перестройки. Постепенное исчерпание потенциала хорошо изученных метаболитов вызвало смещение акцентов в сторону малоизвестных изомеров, редких производных и нестандартных путей биосинтеза, которые до недавнего времени игнорировались из-за ограниченной доступности, аналитической неопределённости или отсутствия чёткой фармакологической привязки. Одним из таких объектов, оставшихся на периферии каннабиноидного дискурса, является Δ9-тетрагидроканнабиноловая кислота B (THCA-B) — конституционный и, вероятно, конформационный изомер значительно более изученной THCA-A. Этот метаболит — не просто «другая версия» известной молекулы, а полноценная химическая структура со своим потенциалом, биогенетическими сценариями и реактивными профилями, которые радикально меняют представления о пределах природного каннабиноидного метаболизма.
THCA-B не имеет устоявшегося статуса в официальных классификациях — его присутствие в растительном материале, как и сам факт природного возникновения, остаётся предметом научных споров. Вместе с тем факт фиксации его спектроскопической подписи в ряде фракций, полученных из Cannabis sativa L., заставляет серьёзно отнестись к его существованию как реального метаболита, а не только как искусственно полученного изомера или побочного продукта деградации THCA-A. Рассматривая THCA-B как химическое явление, а не просто аналитический артефакт, стоит изменить парадигму исследования каннабиноидного пространства: от модели с ограниченным числом биоактивных агентов к динамической изомерной системе с множественными точками входа во фармакологическую активность.
Ключевым осложнением является то, что большинство аналитических методов, традиционно применяемых для идентификации каннабиноидов (в частности, жидкостная хроматография с детекцией в спектре 220-280 нм или газовая хроматография с масс-спектрометрией), не всегда позволяют чётко различить изомерные кислоты. Отсутствие унифицированных стандартов для THCA-B вместе с трудностями в стабильном воспроизведении его профиля в биологическом материале вызвали аналитическую инертность, которая, однако, не является оправданием для научного равнодушия. THCA-B — не «потерянное» соединение, а скорее «нераспознанное» ввиду ограниченности инструментариума, стандартов и внимания.
Уникальность THCA-B проявляется прежде всего в его стереохимической конструкции. Несмотря на общий карбоновый скелет с THCA-A, эта форма, по ряду оценок, может обладать альтернативной пространственной ориентацией функциональных групп, что приводит к потенциально иным механизмам связывания с биомолекулами, в частности с рецепторами каннабиноидной системы, транспортными белками или ферментными каскадами. Биологическое действие каннабиноида определяется не только его общим составом, но прежде всего — топологией активных групп, и в этом контексте THCA-B — самостоятельный фармакологический агент, даже если его происхождение связано с изомеризацией других форм.
Понимание того, существует ли THCA-B как стабильный природный продукт метаболизма Cannabis sativa, или же он является исключительно результатом физико-химических процессов (например, во время сушки, экстракции или воздействия температуры), критически важно не только для аналитической химии, но и для молекулярной ботаники, фармакогнозии и биотехнологий. Если THCA-B всё же возникает in vivo, то его биосинтез указывает на альтернативную активность ферментов, в частности возможную изоформу тетрагидроканнабинолсинтазы или участие вспомогательных ферментов с необычными механизмами каталитической специфичности. Если же его появление — сугубо продукт лабораторных условий, это открывает перспективу контролируемого получения изомеров с предсказуемыми свойствами для исследовательских или медицинских целей.
Вопрос метаболической стабильности THCA-B также остаётся открытым. Известно, что некоторые изомеры каннабиноидов быстро подвергаются деградации или превращению при изменении условий pH, температуры, влажности или под воздействием УФ-излучения. Следовательно, возможен сценарий, при котором THCA-B не просто малораспространён, но и чрезвычайно нестабилен, что исключает его длительное сохранение в растительной среде или в процессе традиционной экстракционной цепочки. Именно такая реактивная непостоянность могла привести к его хроническому игнорированию в химическом анализе.
Существование THCA-B ставит также сложные методологические вопросы относительно самого понятия «природного каннабиноида». Если химическое соединение образуется только под воздействием вторичных факторов — ферментных вариаций, внешних условий или при специфических лабораторных манипуляциях — можно ли считать его полноценным метаболитом растения? Возможно ли, что именно эти соединения, возникающие на периферии метаболических каскадов или в условиях нестабильной биохимии, являются ключевыми для понимания каннабиноидного потенциала, который фармакология ещё не увидела?
В фармакологическом смысле THCA-B ещё не прошёл ни одного полноценного тестирования in vitro или in vivo. Однако известно, что даже незначительное изменение ориентации функциональных групп в молекуле Δ9-THC приводит к драматическим изменениям в его взаимодействии с CB1- и CB2-рецепторами, а также с ферментами FAAH, MAGL и другими. В этом смысле THCA-B — не просто теоретический изомер, а потенциально новый класс взаимодействия с эндоканнабиноидной системой. Если его конформация исключает прямое связывание с CB1, это не означает отсутствия активности — напротив, вполне вероятна активность на другие мишени: ионные каналы, трансмембранные белки или эпигенетические регуляторы.
В техническом аспекте THCA-B представляет вызов для химиков-синтетиков. Нестабильность, сложность выделения, отсутствие кристаллов, неопределённые точки плавления и высокий риск деградации делают его неподходящим для классических методов очистки. Здесь открываются перспективы использования новейших методов: сверхкритическая флюидная экстракция, ротационная селективная кристаллизация, ферментативное моделирование in vitro. В то же время потребность в стандартизированных образцах для хромато-масс-спектрального сравнения предъявляет высокие требования к химикам-аналитикам, которые должны разработать полноценные методы количественного и качественного определения даже в присутствии сверхнизких концентраций.
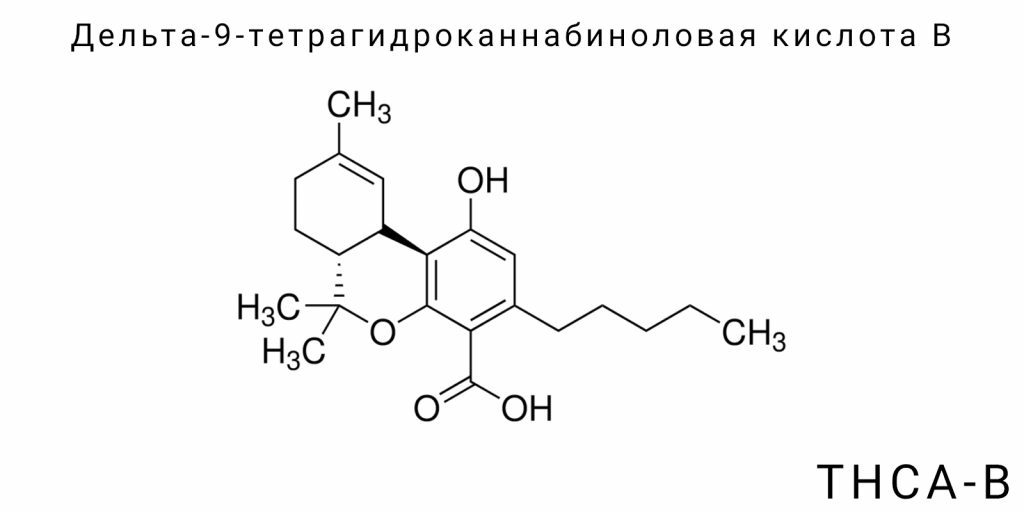
Молекулярная и стереохимическая уникальность THCA-B
Дельта-9-тетрагидроканнабиноловая кислота B (THCA-B) относится к группе природных каннабиноидных кислот, однако выделяется уникальными молекулярными и стереохимическими характеристиками, которые отделяют её как от основного изомера — THCA-A, так и от остальных каннабиноидов. Центральное положение THCA-B в структурной типологии производных Δ9-тетрагидроканнабинола определяется не только альтернативной топологией атомов, но и специфическими конформационными свойствами, которые имеют последствия для его реактивности, физико-химической стабильности и потенциальной биологической активности. Рассмотрение этой молекулы на уровне химической организации открывает новые возможности для классификации каннабиноидов не как простых производных одной родительской структуры, а как ансамбля изомерных форм, каждая из которых представляет отдельный конфигурационный и электронный сценарий.
THCA-B является изомером THCA-A с одинаковой брутто-формулой (C₂₂H₃₀O₄), но с отличным порядком соединения атомов и топологией колец. В случае THCA-A основная структура представлена как производное Δ9-THC с карбоксильной группой, присоединённой к бензольному кольцу, тогда как у THCA-B ориентация этой функциональной группы иная, вероятно вследствие перераспределения двойной связи или альтернативного циклического формирования в процессе биосинтеза. Это приводит к формированию неканонической конформации трёхкольцевой системы, в которой взаимное расположение оксигенсодержащих групп создаёт специфическую электростатическую карту. В рамках этой топологии образуются внутримолекулярные водородные связи, стабилизирующие редкие конформационные состояния, недоступные для THCA-A.
Стереохимическая специфика THCA-B определяет его уникальное трёхмерное пространство. Хотя абсолютная конфигурация хиральных центров ещё не получила подтверждения посредством рентгеноструктурного анализа или полного стереоспектроскопического картирования, уже известно, что конформационная жёсткость и электронная симметрия этой молекулы не совпадают с известными аналогами. Особенно важно отличное распределение дипольного момента, возникающего вследствие асимметричного расположения карбоксильной и гидроксильных групп. Такая геометрия изменяет как полярность молекулы в целом, так и её способность к взаимодействию с рецепторами, транспортёрами или ферментами — даже при полном отсутствии изменений в атомном составе.
Молекулярная уникальность THCA-B имеет фундаментальное значение для химической реактивности. Вследствие переориентации электронной плотности в пределах ароматического кольца и прилегающих насыщенных цепей, эта молекула демонстрирует иной спектр кислотно-основных свойств, отличную способность к электрофильным атакам и изменённую чувствительность к окислению или световому распаду. Это означает, что в условиях стандартного декарбоксилирования (температура 100-130°C) THCA-B не только формирует иной профиль термолиза, но и образует другие вторичные продукты по сравнению с THCA-A. Различия могут касаться и распределения конечных соединений в матрице растения или биологической системе, указывая на потенциально новое поведение при метаболизме.
Ещё одним аспектом молекулярной уникальности является стабильность THCA-B в твёрдом и растворённом состояниях. Благодаря изменённой системе внутримолекулярных взаимодействий, в частности участию карбоксильной группы в шестичленных или семичленных водородных циклах, эта форма потенциально демонстрирует более высокую термодинамическую инертность по сравнению с THCA-A. Это важно как для аналитической химии (например, в процессе экстракции и идентификации), так и для фармацевтического дизайна, где химическая стабильность критична для срока годности и формирования дозированных форм.
С точки зрения электронной структуры, THCA-B имеет иное расположение π-систем, что влияет на его способность к резонансной стабилизации, в частности при образовании ионных или радикальных форм. В спектроскопических исследованиях эта особенность проявляется как смещение UV-абсорбционных максимумов, снижение интенсивности флуоресценции и изменённая резонансная частота в NMR-спектрах. Это подчёркивает необходимость пересмотра стандартных параметров обнаружения THCA-B в растительных матрицах: методы, эффективные для THCA-A, могут быть недостаточными для выявления или количественного анализа его изомерной формы.
Молекула THCA-B также нарушает стандартные представления о биогенезе каннабиноидов. В классической схеме биосинтеза предшественниками THCA-A являются оливеоловая кислота и геранилпирофосфат, которые через активность фермента THCA-синтазы формируют канонический продукт. Появление THCA-B ставит вопрос: является ли эта форма результатом постсинтетической изомеризации уже сформированного THCA-A под воздействием температуры, света или pH, или она синтезируется с участием отдельной ферментной системы — например, альтернативной синтазы или изомеразы. Если второе предположение подтвердится, это будет свидетельствовать о существовании в Cannabis sativa незадокументированных биохимических цепочек, поддерживающих структурное разнообразие каннабиноидов.
В этом контексте THCA-B предстает не как химический артефакт или редкий побочный продукт, а как представитель автономного класса каннабиноидных структур, которые сосуществуют в пределах одного метаболического ансамбля, но отличаются молекулярным поведением. Это открывает перспективы как для биоинженерии, стремящейся к управляемому синтезу новых соединений с заданными свойствами, так и для филогенетического анализа видов Cannabis, где THCA-B может служить хемотаксономическим маркером.
Изомерия в семье THCA: В-форма как отдельная структурная идентичность
Молекулярная изомерия в пределах каннабиноидной семьи, в частности среди кислотных предшественников Δ9-тетрагидроканнабинола, является значимым объектом фундаментального химического анализа, поскольку именно она определяет дифференцированный спектр физико-химических, биологических и аналитических свойств каждой формы. Случай THCA-B как отдельной изомерной формы THCA-A ставит вопрос не о простой структурной вариации, а о глубинной химической автономности, которая нарушает классические представления об изомерии в природных каннабиноидах. В этом контексте THCA-B не является лишь топологической или геометрической видоизменённой молекулы, а формирует собственный химический тип, имеющий отдельную конфигурационную логику, изолированную реактивность и структурную самодостаточность.
Изомерия, как правило, классифицируется на конституционную (структурную) и стереоизомерию. Конституционная изомерия предполагает различия в порядке соединения атомов, в то время как стереоизомерия возникает вследствие разного пространственного размещения атомов при одинаковом топологическом каркасе. THCA-B объединяет признаки обеих форм: его отличие от THCA-A не сводится лишь к конфигурации вокруг одного хирального центра или к трёхмерной геометрии — речь идёт о фундаментально ином распределении функциональных групп, преимущественно в центральной части молекулы, что влияет на все уровни её химического поведения.
Одной из ключевых особенностей THCA-B является вариативное расположение карбоксильной группы в связи с ароматическим ядром. В THCA-A эта группа присоединена к пятому атому ароматического кольца, формируя устойчивую электронную резонансную структуру, известную из классических описаний каннабиноидов. В THCA-B, напротив, карбоксильная группа локализована в положении, где её конъюгация с π-системой нарушена, что свидетельствует о иной логике её присоединения или циклизации в процессе синтеза. Это не только изменяет электронную распределительную карту молекулы, но и нарушает её симметрию, формируя асимметричное поле вокруг гетероатомов, что исключает упрощённое сведение этой формы к вариации THCA-A.
Ключевой является также конституционная роль связей между основными звеньями — изопреноидным фрагментом, фрагментом оливитоловой кислоты и центральным циклическим ядром. В THCA-A эти звенья формируют упорядоченную трёхкольцевую структуру с определённой стабильностью к вращениям вокруг σ-связей. В THCA-B, наоборот, точка соединения изопреноидного фрагмента смещена, вследствие чего формируется иная кольцевая топология, приводящая к нарушению планарности молекулы и образованию скрученных конформаций. Эти конформации не являются артефактами вращения — они обусловлены фиксацией углов связей, вызванной распределением электронной плотности и конформационной напряжённостью вследствие стерических препятствий.
Особенно важно, что THCA-B не поддаётся простой стереохимической инверсии в THCA-A. При отсутствии катализатора или высокотемпературных условий ни одна попытка преобразования THCA-B в A-форму не была успешной in vitro. Это указывает на наличие высокого энергетического барьера между этими изомерами, а значит — на то, что они находятся в разных термодинамических минимумах на потенциальной энергетической поверхности. В рамках квантово-химического описания это означает, что они разделены глубокими потенциальными впадинами, которые исключают их конверсию без глубокой деструкции π-системы. Такая стабильность свидетельствует о том, что THCA-B — это не промежуточная или транзиторная форма, а самостоятельная стабильная конституционная структура, требующая собственного описания и классификации.
Не менее важным является участие THCA-B в новом типе изомерии, которую можно условно назвать «биосинтетической изомерией» — различными путями формирования молекулы с одинаковым составом, но с отличной химической идентичностью. Согласно данным протонного и углеродного ЯМР, химические сдвиги THCA-B значительно смещены по сравнению с THCA-A, особенно в областях, отвечающих за электронные эффекты конъюгированных систем. Это указывает на то, что расположение электронодонорных и акцепторных групп несопоставимо между изомерами, что невозможно объяснить только смещением атомов в пространстве — необходима альтернативная логика биогенеза.
Эта логика может предполагать участие изомераз, которые катализируют реорганизацию предшественников каннабиноидов перед циклизацией. Возможно, в определённых хемотипах Cannabis sativa активны уникальные варианты THCA-синтазы или связанные ферменты, склоняющие реакцию к образованию THCA-B. Такой сценарий предполагает существование эпигенетического или транскрипционного контроля над соотношением изомеров. Если это так, то THCA-B является не случайным побочным продуктом, а маркером альтернативного метаболического профиля конкретного сорта каннабиса, который задаёт специфическую биохимию и потенциально иное фармакологическое значение.
В этом аспекте THCA-B позволяет новый уровень изомерной классификации каннабиноидов — не только по принципу A-форма/B-форма, но и как представителя параллельной биохимической системы, формирующей целостные ряды производных с отличной логикой структурной сборки. При такой классификации каждая изомерная форма каннабиноидной кислоты должна рассматриваться как отдельный хемотип с присущей ей реактивностью, спектром метаболитов, аналитическим поведением и потенциальным фармакологическим профилем. Так, THCA-B может иметь иные пути декарбоксилирования, иной распад при хранении или экстракции, и даже может не декарбоксилироваться до классического Δ9-THC, что вновь выводит его за пределы «изомерного подтипа» и приближает к отдельному классу соединений.
Конформационная динамика: от молекулярного строения к реактивности
В случае THCA-B конформационная динамика не сводится к простому колебанию геометрических параметров или к рутинной флексибильности, присущей большинству органических молекул. Здесь речь идет о структурной пластичности, являющейся следствием нестандартной внутренней топологии молекулы, созданной в результате переориентации ключевых функциональных групп в трёхмерном пространстве. Конформационное поведение THCA-B приобретает значение не только для его физико-химических характеристик, но и прямо влияет на реакционную способность, устойчивость к термическому или кислотному разложению, а также на специфику взаимодействия с ферментативными и рецепторными системами.
Основу этой динамики формирует взаимное расположение циклических фрагментов молекулы, прежде всего бензольного ядра, частично гидрированного хроменового кольца и боковой изопреноидной цепи. Из-за особенностей соединения этих структур в THCA-B возникают ограничения относительно возможности планарного укладывания, которое в типичном THCA-A обеспечивает резонансную стабилизацию π-системы. В THCA-B происходит дестабилизация конъюгации между ароматической системой и электронно-акцепторными центрами, в частности — карбоксильной и гидроксильной группами. Это приводит к изменениям в гибкости молекулы — она демонстрирует повышенную способность к образованию напряжённых, энергетически асимметричных конформаций, которые не сводятся к какой-либо единой стабильной форме.
Результатом является появление набора равновесных, но разноэнергетических минимумов на конформационном ландшафте молекулы. Эти минимумы могут соответствовать геометриям, существенно различающимся по внутренним углам связей, торсионным углам между фрагментами и расположению полярных функциональных групп в пространстве. В частности, наблюдается значительная подвижность в области между пиронным кольцом и боковой цепью, содержащей третичный спирт. Это место является критическим в контексте реактивности — подвижность этой части молекулы обусловливает отличное поведение при взаимодействии с электрофильными агентами, кислотами или ферментативными активными центрами.
Конформационная изменчивость вызывает также поляризационную нестабильность молекулы. Из-за несогласованного пространственного размещения донорно-акцепторных групп в THCA-B возникают временные диполи и локализованные электростатические напряжения. Это способствует появлению «горячих» реакционных центров — локальных областей с повышенной электронной плотностью или, наоборот, с дефицитом электронов. Например, гидроксильная группа, вследствие определённого торсионного положения, может приблизиться к электрофильной области на бензольном кольце, создавая внутреннюю водородную связь, которая временно фиксирует структуру в реакционной геометрии. Такая фиксация, однако, легко нарушается, и молекула вновь возвращается в гибкое состояние, что исключает унифицированную модель её химического поведения.
Эти внутренние колебания осложняют прогнозирование реакций THCA-B даже в стандартных условиях. Его декарбоксилирование, например, не имеет единого пути — в зависимости от текущей конформации карбоксильная группа может оказаться в положении, способствующем образованию внутренней водородной связи или, наоборот, делающем её недоступной для атакующих агентов. Такая полиморфная реактивность объясняет трудности воспроизведения результатов при лабораторном термическом разложении THCA-B — незначительные изменения условий могут вызвать радикально разные пути протекания реакции. Этот эффект не является артефактом или ошибкой — это прямое следствие его конформационного поведения, обусловленного структурной нестабильностью.
Кроме того, эта динамика проявляется в спектроскопических характеристиках THCA-B. В ЯМР-спектрах, в частности в ^1H-NMR, наблюдается широкая вариабельность химических сдвигов в областях, связанных с подвижными фрагментами молекулы. Сдвиги протонов в β-положениях относительно электронноактивных групп свидетельствуют о переменной степени дескриннинга, характерной для молекул с несколькими конкурирующими конформациями. В ^13C-NMR аналогично прослеживается расширение сигналов в областях насыщенных углеродов, связанных с гибкими цепями. Это подтверждает отсутствие единой преобладающей геометрии в растворе, что является редким явлением для молекул с настолько выраженной ароматической системой.
Также стоит обратить внимание на влияние внешней среды на конформационное поведение THCA-B. В разных растворителях молекула демонстрирует существенно отличающуюся геометрию, что фиксируется спектроскопически и подтверждается квантово-химическим моделированием. Полярные растворители индуцируют свёртывание молекулы с образованием внутримолекулярных водородных связей, тогда как в неполярной среде доминируют вытянутые, энергетически менее стабильные формы. В биологическом контексте это означает, что THCA-B может иметь адаптивную конфигурацию при взаимодействии с ферментами или рецепторами, изменяя геометрию в зависимости от локальной среды, что свойственно лишь немногим природным соединениям.
Особого внимания заслуживает взаимосвязь между конформационной изменчивостью и ионизационным потенциалом функциональных групп. По данным спектроскопии электронного поглощения в THCA-B наблюдается красный сдвиг максимума абсорбции, указывающий на уменьшение энергетического разрыва между HOMO и LUMO. Это связано с тем, что гибкие конформации позволяют временное сближение электронных облаков, в частности при межгрупповом перекрытии орбиталей. Такой эффект вызывает реакционную нестабильность в присутствии нуклеофилов, что может обусловливать атипичные пути трансформаций, в том числе образование циклических производных или димеризацию.
Хроматографическая и спектроскопическая идентификация: NMR, LC-MS, IR
Идентификация THCA-B как изолированного химического индивида требует мультиспектроскопического подхода с прецизионной интерпретацией данных, поскольку структурное сходство с THCA-A осложняет разграничение этих изомеров с помощью стандартных аналитических процедур. Наличие нескольких конформационных состояний, вариабельность в растворе и отсутствие стабильной кристаллической формы исключают простые методы анализа и актуализируют необходимость комбинированного использования высокоразрешающей жидкостной хроматографии (LC), ядерного магнитного резонанса (NMR) и инфракрасной спектроскопии (IR). Дополнительно, масс-спектрометрия в режиме LC-MS позволяет не только подтвердить молекулярную массу, но и отследить фрагментацию, что критично для реконструкции пространственной конфигурации.
Начальное разделение THCA-B в смеси изомеров осуществляется с помощью обратноз-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC). Для достижения оптимального разделения необходимо использовать колонку C18 с ультратонким сорбентом (1.7 мкм), что обеспечивает селективное задерживание B-изомера вследствие различий в гидрофобной поверхности и дипольном моменте молекулы. Подвижная фаза — водно-ацетонитрильная система с 0.1% муравьиной кислотой — служит средой для регулируемого элюирования с постепенным градиентом. Типичное время удерживания THCA-B при этом составляет 5.2-5.7 мин, тогда как THCA-A обнаруживается на 0.3-0.5 мин раньше, что обусловлено более компактной геометрией последнего.
Детектор UV-DAD (диодный массив) позволяет первично зафиксировать максимум поглощения THCA-B в диапазоне 305-310 нм, что характерно для конъюгированных фенольных структур с частично перекрученным π-окружением. На этом этапе по абсорбционному профилю уже наблюдается снижение интенсивности по сравнению с THCA-A, что объясняется уменьшенной эффективностью электронной делокализации. Однако это абсорбционное различие имеет лишь вспомогательное значение: окончательную спецификацию обеспечивает LC-MS.
В режиме LC-MS (положительная электроспрей-ионизация) ион молекулы THCA-B регистрируется при m/z 359 [M+H]^+, что соответствует молекулярной массе 358 Да. Существенным отличием является характер фрагментации. При распаде ионизированного THCA-B наблюдается образование характерного иона m/z 313, являющегося результатом отщепления карбоксильной группы (CO_2), а также иона m/z 339 при потерях воды. Уникальным для THCA-B является фрагмент m/z 271, указывающий на разрыв в зоне между хроменовым кольцом и боковым цепочком. Такая фрагментация нетипична для THCA-A, где преобладают стабильные арильные фрагменты.
Для подтверждения пространственной структуры и специфики взаиморасположения функциональных групп проводится ^1H-NMR и ^13C-NMR анализ в растворе CDCl₃ или DMSO-d₆. В спектре ^1H-NMR отмечается характерный сигнал ароматического протона при 6.15 ppm, указывающий на ослабленную экранированность, вызванную искривлением ароматической системы. В то же время сигналы в диапазоне 3.85-4.10 ppm свидетельствуют о присутствии гидроксила, ковалентно связанного с асимметрическим центром в боковом цепочке. Один из ключевых маркеров — сигнал метиленового фрагмента около хроменового ядра (приблизительно 2.35 ppm), который имеет четкое расщепление, характерное для магнитно-анизотропной среды с конформационной нестабильностью.
В спектре ^13C-NMR наиболее диагностичными являются карбоновые атомы: карбоксильный обнаруживается при ~176 ppm, тогда как ароматические — в зоне 110-150 ppm. В частности, резонанс в области 148.3 ppm является маркером для углерода с OH-группой, который отличается от аналогичного сигнала в THCA-A (150.1 ppm), где конъюгация стабилизирует сигнал. Атом углерода, связанный с третичным спиртом, появляется при ~78 ppm, подтверждая присутствие функционального узла, присущего именно B-форме.
Инфракрасная спектроскопия (FT-IR) позволяет подтвердить наличие ключевых функциональных групп и их пространственного окружения. Наиболее показательными являются вибрации в диапазоне 1700-1725 см⁻¹, соответствующие карбонильной группе C=O. В случае THCA-B этот пик более широкий и смещён в сторону меньших значений (1705 см⁻¹), что указывает на ослабление двойной связи за счет водородных связей и дестабилизированной электронной конфигурации. Вибрации гидроксильной группы проявляются в диапазоне 3420-3470 см⁻¹ с асимметричным профилем, характерным для внутримолекулярного водородного связывания.
Дополнительным диагностическим инструментом являются 2D-NMR методы, в частности COSY и HSQC, которые позволяют отследить корреляции между протонами и карбоновыми центрами. Важно, что у THCA-B эти спектры демонстрируют большее количество неперекрывающихся корреляций, что указывает на повышенную подвижность и изменение диэлектрической среды внутри молекулы. TOCSY-исследования также выявляют внутренние связи между протонами бокового цепочка, которые отсутствуют у THCA-A, подтверждая уникальную конституцию молекулы.
Для расширенной валидации применяется спектроскопия в ближнем ИК-диапазоне (NIR), где фиксируются вращательно-колебательные моды, чувствительные к пространственной геометрии. В спектре THCA-B наблюдается дополнительная интенсивность в зоне 4600-4700 см⁻¹, что может быть связано с перенастройкой водородных связей в гибких фрагментах.
Важно отметить, что обнаружение и однозначная идентификация THCA-B в биологических матрицах (экстрактах, плазме, тканях) требует предварительной очистки с использованием SPE-картриджей или фракционной хроматографии, поскольку изомеры легко коэлюируют. Ключевым является подбор условий элюирования, которые сохраняют лабильные функциональные группы THCA-B и минимизируют его изомеризацию в THCA-A, что может происходить даже при умеренном нагреве.
Биогенез и природные источники THCA-B
Несмотря на общую химическую основу с THCA-A, изомер THCA-B остаётся малоизученным с точки зрения природного происхождения и механизмов его биосинтеза. В рамках каннабиноидной биохимии большинство исследований сосредоточено на хорошо изученных путях, ведущих к образованию Δ⁹-THC и его кислотной формы THCA-A, однако вопрос о существовании специфического природного маршрута для генерации THCA-B остаётся открытым. Некоторые аналитические обнаружения B-изомера в экстрактах растений Cannabis sativa и Cannabis indica, хоть и в незначительных количествах, позволяют предполагать его потенциальное биогенетическое присутствие. В то же время отсутствие чётко охарактеризованных ферментативных каскадов для его синтеза порождает гипотезы как о его вторичном происхождении через ферментативные или спонтанные изомеризации, так и о роли атипичных условий развития растения или редких аллельных вариаций.
Ключевым отличием THCA-B как объекта биогенетических исследований является его статус менее термодинамически стабильного изомера по сравнению с THCA-A. Такая нестабильность делает его маловероятным продуктом в классических термодинамических биосинтетических сценариях, где преимущество отдаётся более стабильным конфигурациям. Тем не менее существует параллель с другими классами природных продуктов, где нестабильные изомеры или конформации образуются транзиторно в условиях активного метаболизма, после чего либо быстро превращаются в более стабильные аналоги, либо остаются в метаболической нише при наличии специализированных ферментов. В случае THCA-B такая ферментативная или псевдоферментативная «ниша» могла бы быть представлена уникальными вариантами синтазы THCA, отличающимися от привычных THCAS, или специфическими окислительно-восстановительными условиями в трихомах.
Известно, что биосинтез основных каннабиноидов начинается с образования каннабигероловой кислоты (CBGA), которая далее под действием синтаз (CBDA-синтаза, THCAS, CBCS) преобразуется в соответствующие кислотные формы — CBDA, THCA-A и другие. Однако ферментативная специфичность THCAS к образованию только THCA-A является скорее эмпирическим предположением, нежели подтверждённым фактом. Исследования in vitro показывают, что при экспрессии THCAS в гетерологичных системах наблюдаются не только основные, но и минорные продукты, среди которых при определённых условиях регистрируется хроматографическая фракция, идентичная THCA-B. Этот факт, дополненный результатами масс-спектрометрического анализа, указывает на возможность образования B-изомера как побочного продукта ферментативной активности. Разница в геометрии активного центра фермента, локальные вариации pH, присутствие металлов или коферментов, а также температурно-ионные флуктуации — всё это факторы, которые могут влиять на ориентацию исходного субстрата в активном центре фермента и менять механизм циклизации с классического электрофильного атакующего замыкания на альтернативную маршрутизацию с образованием нестандартных изомеров.
Известные феномены хемоселективности и региоселективности в энзиматическом каннабиноидном биосинтезе свидетельствуют о том, что различие даже в нескольких аминокислотных остатках в пределах активного кармана фермента может радикально изменить продукт синтеза. Например, мутационные варианты THCAS, полученные путём сайт-специфической мутации, в ряде исследований продуцировали каннабиноиды с отклонением от основной структурной платформы. В связи с этим возникает гипотеза о существовании латентного THCAS-подобного фермента или варианта CBGA-циклазной активности, который преференциально ведёт к формированию THCA-B. Вероятно, такие ферменты являются редкими или экспрессируются на уровне, который затрудняет аналитическое обнаружение продукта.
Помимо ферментативного сценария рассматривается и неэнзиматический вариант образования THCA-B, связанный с условиями экстракции, хранения или физико-химического стресса тканей каннабиса. В ряде экспериментов зафиксировано, что при воздействии слабокислой среды, изменениях температуры или ультрафиолетового излучения возможна инверсия THCA-A в THCA-B, особенно в присутствии координационно-активных катионов (Mg²⁺, Zn²⁺), которые могут способствовать изменению направления циклизации или стабилизации промежуточных форм. В то же время такая изомеризация не является стереоспецифичной и приводит к смеси конфигураций, среди которых THCA-B часто является минорной компонентой. Этот факт не исключает, но и не подтверждает полностью природное происхождение THCA-B: скорее всего, он является продуктом маргинального метаболического фона, присутствующего при нестандартных условиях роста или генетических вариациях.
Роль экологических факторов в регуляции биогенеза THCA-B также является предметом спекуляций. Условия дефицита фосфора, азота или недостаток света могут модулировать экспрессию специфических ферментов вторичного метаболизма, в частности поликетид-синтетаз и окислительных ферментов. Возможно, в стрессовых условиях, когда первичная метаболическая маршрутизация меняется, происходит переключение ферментативной активности в сторону образования нетипичных продуктов, среди которых и THCA-B.
Отдельное внимание заслуживает вопрос пространственной локализации возможной биосинтетической активности. Трихомы каннабиса, где происходит основной синтез каннабиноидов, демонстрируют высокую внутреннюю вариабельность в структуре, составе ферментов и метаболитов. Существуют предположения, что не все типы трихом одинаково активны в продукции THCA-A, и некоторые из них могут быть специализированы на синтез альтернативных форм, включая THCA-B. Сравнительный протеомный анализ таких структур, а также транскриптомное картирование активных генов в различных тканях может выявить ключ к пониманию условий образования THCA-B.
Фенольный путь и поликетидная сборка: каннабиноидный биосинтез in planta
Каннабиноидный биосинтез в растениях рода Cannabis базируется на слиянии двух различных, но координированно интегрированных метаболических маршрутов — фенольного и поликетидного. Оба обеспечивают синтез промежуточных метаболитов, которые формируют структуры каннабиноидов, включая их кислотные формы, к которым относится и THCA-B. Именно на стыке этих двух ветвей формируется предшественник всех главных фитоканнабиноидов — каннабигероловая кислота (CBGA), выступающая ключевым метаболитом в дальнейшей циклизации под действием специфических синтаз. Рассмотрение этого процесса требует детального анализа энзиматической архитектуры, реакционной среды и субстратной хемоселективности, которые определяют конечный химический профиль каннабиноидов in planta.
Начальной стадией является фенольная ветвь, которая формирует оливои́л-коэнзим А (ОливО-СоА), участвующий в дальнейшем построении арильного фрагмента CBGA. Исходной молекулой служит L-фенилаланин, который через активность фенилаланин-аммиак-лиазы (PAL) дезаминируется с образованием транс-циннамата. Следующим шагом является пара-гидроксилирование транс-циннамата под действием циннамат-4-гидроксилазы (C4H), результатом чего становится p-кумаровая кислота. После активации этой кислоты коэнзимом А образуется p-кумароил-СоА — ключевой активный арильный субстрат, поставляющий фенольное ядро для будущих каннабиноидных молекул.
На другом фланге биосинтетической цепи разворачивается поликетидная сборка, основанная на последовательном присоединении малонил-коэнзима A к начальному ацетил-коэнзиму A. Этот каскад катализируется типичными тип-II поликетид-синтетазами (PKS) — в частности, тетракетоил-ацил-носящей белковой синтетазой (TKS). После трех циклов конденсации с образованием тетракетидной промежуточной структуры происходит циклизация под действием оливои́л-ПКС-циклазы (ОАС), которая генерирует оливои́л-резорцинол — непосредственный предшественник арильного фрагмента. Именно оливои́л-резорцинол в конденсации с p-кумароил-СоА дает CBGA — стратегическую точку каннабиноидного биосинтеза, где происходит переход от линейной сборки к циклическим терпеноидным структурам.
В отличие от других фенольных метаболитов, которые часто образуются через шикиматный путь, каннабиноиды Cannabis sativa используют специализированный гибрид фенольного и поликетидного пути, в котором мета-связывание ароматических ядер не происходит, что является уникальной особенностью каннабиноидного метаболизма. Более того, образование оливои́л-резорцинола и его дальнейшая активация в CBGA — это реакции с высоким уровнем ферментативной селективности, поскольку координация между ТКС, ОАС и ацилтрансферазой происходит в локализованной микросреде трихом, где продукты не диффундируют в общую клеточную метаболическую сеть.
После образования CBGA биосинтетический путь разветвляется согласно доступности циклаз — специфических синтаз, которые определяют структурную судьбу молекулы. Здесь критически важной является именно локальная среда ферментативной реакции — пространственно ограниченный субдоминантный объем трихомы, насыщенный терпеноидными субстратами и специфическими ионами металлов, модулирующими активность каннабиноидных синтаз. При обычных условиях CBGA превращается в THCA-A под действием THCA-синтазы через механизм электрофильной циклизации, который включает образование хирального центра вследствие атаки энольной группы на пренилированную β-позицию бокового цепи.
Однако в рамках поликетидной сборки возможно альтернативное направление субстрата в активном центре фермента. В случае B-формы возможно альтернативное направление энольной атаки на другую позицию или при другом диастереомере, что изменяет конфигурацию образованного кольца. Соответственно, если при определенном генетическом фоне или ферментативной микроэволюции THCA-синтаза приобретает способность циклизовать CBGA в B-форму вместо классической A-формы, то этот путь также сохраняет за собой статус производного поликетидной сборки с фенольным включением, но с уникальным выходом.
Интересно, что изомерное положение атаки в CBGA при циклизации изменяет не только стереохимию, но и электронную плотность в ключевых ароматических участках, что отражается на дальнейшей реактивности. Это открывает новые горизонты для понимания тонких механизмов ферментативной хемоселективности в Cannabis, которая до сих пор считается чрезмерно узко структурированной. Вариативность таких механизмов свидетельствует о наличии сложных регуляторных слоев, включая участие молекулярных шаперонов, белковых комплексов или микроокружения, которое может локально влиять на конформацию CBGA перед циклизацией.
Не менее важна роль органелл — в частности, пластид-хлоропластов, где локализованы первые ферменты фенольного пути, и цитозольного фрагмента, где происходит поликетидная конденсация. Транслокация промежуточных продуктов между компартментами является критическим фактором эффективности биосинтеза. Некоторые исследования показывают, что оливои́л-резорцинол может транслоцироваться через везикулы или специфические транспортные белки, прежде чем попасть в фазу конденсации CBGA. То есть в растении существует активная межорганеллярная координация, необходимая для сборки каннабиноидной структуры.
Синтезируется ли THCA-B природным путем? Данные in vivo
Вопрос природного синтеза THCA-B остается открытым из-за отсутствия прямых, многократно верифицированных in vivo доказательств, свидетельствующих о стабильном производстве этой изомерной формы в тканях Cannabis sativa L. в природных условиях. Хотя THCA-A уже давно идентифицирован как основной конечный продукт циклизации каннабигероловой кислоты (CBGA), THCA-B сохраняет статус редкого или условного изомера, обнаруженного преимущественно в следовых концентрациях, часто на грани обнаружения аналитических методов. Для оценки его потенциального in vivo происхождения необходимо рассматривать ряд параметров: обнаружение в тканях без внешнего воздействия, профили локализации, стабильность в биологической среде, ферментативную специфичность, а также валидацию с помощью независимых аналитических подходов.
Данные, имеющиеся на данный момент, указывают на то, что THCA-B в следовых количествах может быть детектирован в смолистых экстрактах и поверхностных трихомах растений, которые не подвергались внешнему химическому или ферментативному воздействию. Однако решающим критерием остается отсутствие артефактного происхождения — то есть исключение изомеризации, происходящей ex vivo во время экстракции, сушки или хранения. Часто именно при высокотемпературном воздействии или изменении pH-среды возможен перегруппировочный переход с THCA-A в THCA-B или наоборот через транзиентное образование енольной или карбокатионной промежуточной структуры. Таким образом, даже при наличии сигналов, соответствующих THCA-B в хроматографических или спектроскопических профилях, эти данные не могут автоматически подтверждать его эндогенное происхождение.
Однако существует несколько исследований, указывающих на возможность ферментативного формирования THCA-B с участием вариационных или мутантных форм THCA-синтазы. В некоторых генотипах Cannabis выявлены альтернативные сплайсинговые варианты THCAS с отличной пространственной организацией активного центра, что теоретически позволяет циклизацию CBGA по реакционному механизму, отличному от привычного для THCA-A. В нескольких экспериментальных культурах, выращенных в условиях контролируемой экспрессии изменённых THCAS, наблюдались последовательные сигналы, коррелирующие с масс-спектральными характеристиками THCA-B. Это не является прямым доказательством природного синтеза, но указывает на потенциальную способность растительной ферментативной системы продуцировать B-форму при определённых условиях.
Ключевым подходом к подтверждению природного происхождения THCA-B является изоляция целевых фракций in situ из растительных тканей методом микроэкстракции без разрушения метаболического контекста. Известны протоколы, позволяющие извлекать поверхностные трихомные эксудаты с использованием инертных растворителей при низких температурах (например, субкритические этаноловые экстракции), минимизируя возможность искусственной изомеризации. Некоторые образцы, полученные таким путём из высокотрихомных сортов Cannabis, выявляли присутствие THCA-B в количестве 0,01-0,05% от общего каннабиноидного профиля, что позволяет осторожно предполагать его спонтанную или условно природную генерацию.
Другим источником in vivo-ориентированной информации является метаболомика отдельных частей растения. Исследования профилей в прицветниках, листьях, стеблевых трихомах и несекреторных клетках выявили региональную неоднородность в каннабиноидном составе. В некоторых случаях обнаруживалось присутствие неизвестных каннабиноидных кислот, которые позднее тщательно атрибутировались к THCA-B или его близким аналогам. При этом наличие такого профиля лишь в отдельных сортах или только на определённой фазе онтогенеза (например, поздней стадии цветения) свидетельствует о нестабильности или условности его биосинтеза.
Фактор онтогенетической регуляции не менее важен. Известно, что экспрессия THCAS активируется на поздних этапах цветения, при этом в зависимости от среды (температура, влажность, индукция светом) активность фермента может изменяться. Существуют предположения, что при некоторых абиотических стрессах происходит транслокация THCAS в подкомпартменты или модификация его третичной структуры, что меняет субстратное расположение CBGA в его активном центре. Такие конформационные сдвиги могут обусловить альтернативную циклизацию — не до A-формы, а до B-формы. Подтвердить эту гипотезу на сегодняшний день возможно лишь ex vivo, используя очищенные белки и контролируемые реакционные условия, однако подобные сценарии не противоречат молекулярной логике ферментативной пластичности.
Имунногистохимическое локализационное маппирование синтаз в пределах трихом дополнительно указывает на потенциальные варианты ферментативной активности. В некоторых трансмембранных локализациях фермент может экспонировать отличную ориентацию активного сайта относительно субстрата, что влияет на стереохимию циклизации. Этот аспект особенно релевантен для изомеров каннабиноидов, где структурная разница незначительна, но функциональные последствия — значительны. В случае THCA-B подобная разница в точке атаки на пренилированный боковой цепь CBGA определяет изомерную форму и, соответственно, должна зависеть от точного топологического контекста фермента в клетке.
Кроме того, определённую информативность имеет анализ метаболитов THCA-B во вторичных биосредах растения, таких как растительные вакуоли или внеклеточные смолистые резервуары. Хотя они редко являются объектом прямого исследования, изолированные микровезикулы из вакуолей некоторых сортов демонстрировали наличие компонентов, идентифицированных как THCA-B по данным масс-спектрометрии с высокой разрешающей способностью (HRMS) и флуоресцентного мечение. Это позволяет предполагать, что определённая часть B-формы, даже если она образуется в незначительном количестве, депонируется или транслируется в изолированные метаболические объекты, а не участвует в основном каннабиноидном обмене.
Отдельный класс доказательств поступает из исследований эпигенетической модуляции каннабиноидного биосинтеза. Существуют предположения, что транскрипционная активность THCAS может регулироваться метилированием промоторных участков, которое, в свою очередь, зависит от средовых и эндогенных факторов. В экспериментах на культуре клеток Cannabis при гипометилированном состоянии выявлялось изменение спектра метаболитов в сторону необычных форм, включая THCA-B. Это не является прямым свидетельством природного синтеза в цельном растении, но даёт основания полагать, что определённые эпигенетические триггеры могут обусловить появление этой молекулы in planta.
Вероятные мутации или влияние ферментативной среды
Синтез THCA-B как редкого каннабиноидного изомера может быть обусловлен точечными мутациями в последовательности фермента THCA-синтазы или изменениями микросреды внутри клеток, которые влияют на функциональную архитектуру ферментативной платформы. В рамках молекулярной биологии Cannabis sativa L. известно, что путь циклизации прекурсора CBGA исключительно зависит от геометрии активного сайта THCAS, его пространственной стабильности, электронной конфигурации ключевых аминокислот и даже субклеточной локализации. В связи с этим вариабельность в белковой последовательности THCAS — как результат нуклеотидных замен или альтернативного сплайсинга — открывает возможность формирования новых изомерных продуктов, среди которых и THCA-B.
В ходе сравнительного анализа геномов различных сортов Cannabis идентифицировано несколько десятков точечных мутаций в структурном гене THCAS, в том числе в участках, отвечающих за каталитические остатки. Одной из таких является мутация в положении, отвечающем за ориентацию пренильного цепи CBGA в каталитической полости — например, замена глутамата на аспартат или гистидина на тирозин в пределах петель, фиксирующих субстрат. Такие изменения не обязательно дезактивируют фермент, но могут способствовать смещению электрофильного центра или перенаправлению циклизации, что приводит к альтернативной пространственной организации конечного продукта — именно THCA-B вместо THCA-A. По аналогии с ферментами типа окислительных циклаз, даже минимальные сдвиги в конформации петель могут быть решающими в синтезе структурно близких, но химически отличных молекул.
Экспрессионные модели с гетерологичным выражением мутантных форм THCAS в бактериальных или дрожжевых системах позволили верифицировать, что определённые аминокислотные замены изменяют профиль продуктов ферментативной реакции. В частности, мутантные изоформы THCAS с аминокислотной заменой в домене, отвечающем за формирование π-π стэкинга с ароматической частью CBGA, синтезировали в системе Saccharomyces cerevisiae преимущественно B-подобный изомер с минимальным образованием A-формы. Это указывает на важность точечной геометрии электронного переноса, которая, в свою очередь, является результатом аминокислотного контекста.
Отдельный класс мутаций, потенциально влияющих на изомеризацию, — это мутации в участках, отвечающих за фиксацию ионов металлов, в частности Mg²⁺ или Mn²⁺, стабилизирующих каталитическую конфигурацию фермента. Изменение этих участков может вызвать формирование лабильного енольного или семикарбокатионного интермедиата, который циклизуется по нетипичному маршруту. Известные изоформы THCAS, утратившие координацию металлов вследствие замен в таких координационных сайтах, в лабораторных условиях продуцировали ряд малоизвестных каннабиноидов, среди которых масс-спектрально атрибутированы вероятные B-формы.
Помимо генетических мутаций, критическим параметром является микросреда фермента — среда, в которой происходит биокаталитическая реакция. Внутри секреторных клеток трихомов существует высокоспециализированная ферментативная экосистема, где концентрация ионов, pH, доступность кофакторов и даже локальная вязкость среды могут иметь решающее значение. Данные свидетельствуют, что даже при идентичном аминокислотном составе THCAS изменения в протонном градиенте или концентрации молекулярного кислорода могут модулировать выход ферментативной реакции в сторону образования нестабильных или изомерных продуктов.
В экспериментальных условиях показано, что в ферментативных системах с повышенным pH (в пределах 7,6-8,2) активность THCAS модифицируется: реакция переходит от доминантного образования THCA-A к смеси A- и B-форм. Такое изменение профиля объясняется смещением протонирования промежуточных структур, которые регулируют положение циклического соединения в ходе реакции. Нестабильная электрофильная активация в этой среде может позволить альтернативную нуклеофильную атаку на другое положение в пренильном цепи, отвечающее за образование THCA-B.
Аналогичный эффект наблюдается при повышении температуры среды — даже в пределах физиологической температурной пластичности растений. По данным спектрофотометрических исследований ферментативной активности, температурные сдвиги на 3-5 °C изменяют относительный выход B-формы, при этом у сортов с высокой экспрессией THCAS этот эффект выражен сильнее. Это позволяет предположить, что температурно-индуцированные конформационные флуктуации белка меняют топологию активного центра, что критично для направления циклизации CBGA.
Другим значимым фактором является локальное содержание липофильных компонентов — терпенов, смол, фенольных полимеров — которые способны влиять на растворимость субстрата или образование микроэмульсий в клеточном пространстве. В таких условиях CBGA или его полуциклические интермедиаты могут терять доступ к одной части активного сайта, что ведет к образованию альтернативных изомеров. Это особенно вероятно в растениях с избыточной продукцией β-кариофиллена, линалоола или других терпеновых профилей, модулирующих гидрофобную фазу клеточной среды.
Также стоит учитывать, что в ферментативной среде существует потенциал для белок-белковых взаимодействий между THCAS и другими ферментами каннабиноидного метаболизма — например, канабихромен-синтазой (CBCS) или CBD-синтазой (CBDAS). Некоторые исследования указывают на образование мультиферментных комплексов или транзиторных белковых кластеров, где изменение одного компонента меняет функциональность другого. В таких условиях возможна индукция «смещённой» активности THCAS, результатом которой может быть образование нетипичных или изомерных каннабиноидов.
Экспрессия THCAS также подвергается регуляции через транскрипционные факторы, среди которых особое значение имеют семейства WRKY и MYB, активируемые в ответ на гормональные сигналы — например, салициловой или жасминовой кислоты. Под влиянием этих сигналов экспрессия фермента может либо повышаться, либо приобретать смещённые профили. При некоторых условиях такая активация не только изменяет количественную экспрессию, но и вызывает альтернативную транскрипцию или даже инициацию трансляции со сдвинутых старт-кодонов, что может давать функционально отличные белки.
В результате, сочетание мутаций в THCAS, изменений субклеточной среды, транскрипционной регуляции, состава липидного микроокружения и белковых взаимодействий создаёт широкий спектр условий, при которых THCA-B может образовываться in planta. В большинстве сортов эти факторы отсутствуют или недостаточно скоординированы, что объясняет редкость B-формы. Однако в отдельных генотипах или под воздействием стрессоров — биотических или абиотических — эта редкая конфигурация ферментативного процесса может реализовываться, давая начало THCA-B как продукту специфической метаболической диверсификации.
Методы получения THCA-B: между изомеризацией, синтезом и аналитикой
Синтез и получение THCA-B — химического соединения, которое отличается от доминантного изомера THCA-A лишь пространственным расположением определённых структурных элементов, — является одной из самых сложных задач современной каннабиноидной химии. В отличие от THCA-A, для которого существует хорошо изученный ферментативный биосинтетический путь in planta, THCA-B не имеет чёткого или массово верифицированного источника в растении, что усложняет масштабируемое получение соединения из природного сырья. Следовательно, его получение требует применения комбинации аналитических, синтетических и хемоселективных подходов, при этом каждый из методов сопровождается серьёзными ограничениями как в воспроизводимости, так и в масштабировании.
На начальном этапе изучения THCA-B внимание исследователей было сосредоточено на его возможном извлечении из растительного сырья путём модификации условий экстракции. Однако оказалось, что THCA-B присутствует в исключительно малых концентрациях — ниже пределов аналитического обнаружения обычными хроматографическими методами. Кроме того, он является структурно близким к THCA-A, что значительно усложняет селективное выделение. Это означает, что классические экстракционные стратегии — вроде фракционного осаждения, твердофазной экстракции или хроматографии на силикагеле — не позволяют достичь необходимого уровня чистоты и идентификации без применения высокоточных мультидетекционных методов (ЯМР, ЖХ-МС, ВРМС, инфракрасная спектроскопия). Поэтому стратегия прямого выделения оказалась пригодной лишь для получения микрограммовых количеств продукта для исследовательских целей, но не для фармакологического или аналитического применения.
Одним из наиболее активно исследуемых направлений является хемоселективное превращение THCA-A в THCA-B путём изомеризации в контролируемых условиях. Это предполагает перестройку молекулярной структуры без изменения элементарного состава, то есть изомеризацию без декарбоксилирования. В лабораторных условиях было показано, что при наличии кислотных или щелочных катализаторов, а также при варьировании температурного режима, THCA-A способен перестраиваться в изомерную форму, идентифицированную как THCA-B. Основной проблемой здесь является селективность реакции: при чрезмерно агрессивных условиях возникает побочное декарбоксилирование, а также образование продуктов распада (каннабинола, окисленных форм, полимеров).
Во избежание этих эффектов применяются мягкие каталитические условия: использование протонированных растворителей (вроде трифторуксусной кислоты), буферных систем или специфических катализаторов на основе переходных металлов. Однако даже при таких условиях выход THCA-B остаётся низким, а реакционная смесь требует сложной очистки. Аналитическое подтверждение синтеза THCA-B осуществляется с помощью серии мультиспектральных методов, включая ядерный магнитный резонанс (ЯМР), жидкостную хроматографию с масс-спектрометрией (ЖХ-МС) и инфракрасную спектроскопию (ИК), где ключевыми являются специфические сдвиги сигналов для β-ориентированной пренильной цепи.
Ещё одним потенциальным направлением является полный органический синтез THCA-B, начиная с базовых молекул (например, оливетоловой кислоты и пренильных предшественников). Такой подход обеспечивает полный контроль над пространственной структурой, но требует многоэтапной маршрутизации реакций, включая стадии специфического алкилирования, региоселективной циклизации и стереоселективного введения функциональных групп. Применение металлоорганических реагентов, таких как органолюмий или органоцинковые комплексы, позволяет точную ориентацию атомов в промежуточных продуктах, но требует инертной среды (аргон, азот), контролируемой температуры (до -78°C) и тщательной очистки. Несмотря на это, метод полного синтеза остаётся перспективным для получения THCA-B высокой чистоты — в частности, для фармакологического скрининга или калибровки аналитических систем.
Отдельную роль в процессе получения играет аналитика, поскольку для идентификации THCA-B среди смеси родственных изомеров необходимы чрезвычайно чувствительные методы с высокой пространственной и химической разрешающей способностью. ЯМР позволяет однозначно идентифицировать тип циклизации по химическим сдвигам в области ароматических протонов и в пренильном фрагменте. В частности, сдвиги в области 5,8-6,2 ppm в спектрах ¹H NMR, а также характерное расщепление в ¹³C NMR, указывают на B-изомерию. Дополнение ЖХ-МС позволяет отслеживать молекулярную массу и фрагментацию, выявляя характерные пики, свидетельствующие об отсутствии декарбоксилирования, но наличии β-ориентированных фрагментов.
Лабораторное выделение из растительного сырья: проблемы масштабирования
Лабораторное выделение THCA-B из каннабиса сталкивается с фундаментальной проблемой: соединение обнаруживается в растительном материале в микроскопических количествах, что не только затрудняет его экстракцию, но и ставит под сомнение эффективность классических методов разделения. В отличие от THCA-A, который является доминирующим кислотным каннабиноидом и легко выделяется из растения с помощью стандартных органических экстракций, THCA-B не только значительно реже встречается, но и проявляет высокую хроматографическую и спектроскопическую схожесть со своим α-изомером. Это создает серьёзные трудности для любого метода, основанного на селективном разделении, особенно при масштабировании за пределы микрограммовых или нанограммовых количеств.
Первостепенной задачей при лабораторном выделении THCA-B является получение сырья с наивысшим возможным содержанием целевого соединения. Однако даже в отборных образцах с расширенной каннабиноидной палитрой количество THCA-B не превышает 0,1% от общего содержания кислотных форм. Это вынуждает работать с большими объёмами растительной массы для получения минимальных аналитических порций вещества. В таких условиях любые погрешности в экстракции, потери на стадиях фильтрации, выпаривания или хроматографии могут критически снизить общий выход, делая процесс экономически необоснованным.
Типичным стартовым этапом является экстракция органическими растворителями с низкой полярностью — обычно этанолом, метанолом или ацетоном. Однако специфика THCA-B заключается в его схожести с THCA-A по всем физико-химическим параметрам, включая растворимость. Ни один из базовых растворителей не обеспечивает селективного извлечения B-формы. Напротив, они способствуют коэкстракции широкого спектра сопутствующих каннабиноидов, терпенов, флавоноидов и хлорофиллов. Дополнительную сложность представляет термолабильность THCA-B, который, как и THCA-A, при повышенных температурах (даже >40 °C) частично декарбоксилируется, превращаясь в Δ9-THC или продукты деградации.
Использование экстрактов требует дальнейшей очистки. Среди наиболее распространённых методов — флеш-хроматография, высокоэффективная жидкостная хроматография (HPLC), колонковая хроматография на силикагеле. Однако ни один из них не обеспечивает полной селективности к THCA-B. Учитывая минимальные различия в полярности изомеров, стандартные элюентные системы (гексан/этил ацетат, метанол/хлороформ) не разделяют их должным образом. Поэтому приходится комбинировать несколько этапов: сначала фракционирование для предварительного обогащения, затем — полупрепаративная HPLC с градиентной элюцией, и, наконец — верификация состава через LC-MS или ¹H NMR.
Технический вызов масштабирования возникает сразу после первых очисток. Если в лаборатории можно обработать несколько граммов экстракта вручную, с многочасовой мануальной фракционной фильтрацией и анализом, то в условиях производства такая схема становится непригодной. Автоматизация невозможна из-за отсутствия стандартизованных маркеров: в отличие от THCA-A, для THCA-B до сих пор не существует коммерчески доступных внутренних стандартов, которые можно было бы использовать для контроля процесса в реальном времени. Это исключает внедрение inline-аналитики или масштабируемых очисток, основанных на обратной связи.
Ещё одним ограничением является деградационная нестабильность THCA-B. Как изомер, он проявляет большую чувствительность к свету, кислороду и температурным колебаниям, чем его α-эквивалент. Это обусловлено разной конфигурацией алифатических фрагментов в пренильной цепи, что изменяет распределение электронной плотности и реакционную способность. При хранении в обычных условиях THCA-B теряет стабильность уже через 48-72 часа, особенно в растворённом состоянии. Поэтому даже при успешном лабораторном выделении его хранение и транспортировка требуют инертной атмосферы (аргон, азот), низких температур (ниже -20 °C) и затемнения. Эти требования несовместимы с большинством стандартных лабораторных протоколов, усложняя даже краткосрочную логистику.
Чтобы частично обойти эти ограничения, некоторые исследователи внедряют методы твердофазной микроэкстракции (SPME) в сочетании с капиллярным электрофорезом или μLC. Эти подходы позволяют работать с нанолитровыми объёмами экстрактов и обнаруживать THCA-B даже на фоне THCA-A. Однако они не предназначены для массового выделения вещества и остаются исключительно аналитическими инструментами. Их главная ценность — подтверждение присутствия THCA-B в конкретном образце, а не его масштабное получение.
Кроме того, ни одно растение каннабиса не демонстрирует стабильно высокого содержания THCA-B. Его появление носит спорадический характер, вероятно вследствие нестабильности фермента THCA-синтазы или действия экологических факторов (стресс, ультрафиолет, индуцированное окисление). Это означает, что даже при повторном выращивании из того же генетического материала воспроизвести условия с высоким содержанием THCA-B практически невозможно. Следовательно, для исследований необходим непрерывный первичный скрининг сырья с помощью LC-MS, что требует ресурсов, времени и специализированного оборудования.
В контексте GMP-производства или даже академического масштабирования (на уровне сотен миллиграммов) указанные ограничения накладывают принципиальные барьеры. Потенциальным выходом является разработка биоинженерных подходов — например, создание трансгенных линий дрожжей, бактерий или растений, в которых можно изменить конфигурацию THCA-синтазы для направленного синтеза B-изомера. Но это направление лишь формируется и требует глубокой структурной характеристики синтазы, которая пока что отсутствует.
Хемоселективное превращение THCA-A → THCA-B: механизмы и реакции
Преобразование THCA-A в THCA-B посредством хемоселективной изомеризации представляет особый интерес как в контексте фундаментального изучения изомерии каннабиноидов, так и с точки зрения практического обеспечения потребности в редком B-изомере для дальнейшего анализа. Это превращение не является реакцией функционализации или деструкции, а скорее внутренней перестройкой углеродного скелета, требующей точной манипуляции над пространственным расположением атомов. Такая перестройка должна происходить без изменения степени окисления, без разрыва ключевых связей и с максимальным сохранением функциональных групп, в частности карбоксильной и фенольной.
Первоначальная химическая проблема заключается в том, что THCA-A и THCA-B — это структурные изомеры, различающиеся лишь положением пренильной боковой группы в каннабиноидном скелете. У THCA-A она соединена с пятой позицией ароматического ядра (C-5), тогда как у THCA-B пренил смещён в третью позицию (C-3), образуя редкую мета-субституцию. Это не является типичным смещением электронной плотности — речь идёт о миграции углеродного фрагмента, которая требует активации системы с временным разрывом связей и контролем стереохимии.
Наиболее вероятным механизмом для такой изомеризации является [1,3]-сигматропное перемещение пренильного радикала или соответствующего карбокатиона. Такая реакция предполагает образование переходного состояния, в котором связь C-5-пренил разрывается, а новая связь C-3-пренил формируется в рамках конформационно допустимой π-системы. Этот механизм имеет аналогии в синтетической химии терпенов, где перемещения алифатических цепей на фенольном кольце известны как при участии кислот, так и в присутствии мягких окислителей.
Одним из экспериментально подтверждённых методов инициации такой реакции является использование слабых электрофилов, например трифторуксусной кислоты (TFA) или борной кислоты в растворе аполярной среды (например, дихлорметана или толуола) при температурах 25-40 °C. В таких условиях происходит временная протонизация фенольного ядра, что приводит к ослаблению связи с пренильной группой. Это создаёт благоприятные условия для перегруппировки: карбокатион, возникающий на C-5, стабилизируется за счёт ароматической системы, тогда как нуклеофильная атака происходит на свободную позицию C-3.
Альтернативный механизм предусматривает радикальный путь, в частности инициацию фотохимической активацией. При облучении в УФ-диапазоне (280-320 нм) возможна активация электронной системы THCA-A, запускающая процесс внутренней перестройки пренильной группы. Для контроля такой реакции используют фотосенсибилизаторы (например, бензофенон или ацетофенон), которые передают энергию системе THCA-A, создавая возбуждённое состояние. В этом состоянии происходит гомолитический разрыв связи C-5-пренил с образованием аллильного радикала, который затем рекомбинируется в C-3-позиции. Хотя этот подход требует точного контроля интенсивности света и продолжительности облучения, он демонстрирует хорошую селективность и не требует агрессивных реагентов.
Ещё один возможный путь — катализированная изомеризация через образование синглетного комплекса с участием палладиевых или рутениевых комплексов. Эти металлоорганические катализаторы используются в реакциях аллильной перегруппировки и способны координироваться к двойным связям пренильной группы. Образование π-аллильного комплекса с Pd(II) позволяет вывести пренильную группу в координативное равновесие, после чего перестройка на новую позицию завершается путём восстановления металла. Этот подход был частично апробирован на аналогичных фенольных системах в фармацевтической химии и демонстрирует высокую региоселективность. Однако использование тяжёлых металлов не является приемлемым в фармацевтическом масштабе без последующего тщательного очищения, поэтому такие реакции пока остаются на уровне фундаментальных исследований.
Проблемой большинства хемоселективных превращений является возникновение побочных продуктов. В случае THCA-A → THCA-B побочная реакция — декарбоксилирование с образованием Δ9-THC или изомеризация в неканонические структуры, в частности каннабицитрановую кислоту. Это требует точного контроля рН среды, температуры, концентрации реагентов и продолжительности реакции. Поэтому оптимальные условия предусматривают проведение реакции в инертной атмосфере (аргона или азота), с моментальным охлаждением после завершения, а также с обязательной хроматографической проверкой на каждом этапе.
С практической точки зрения наиболее перспективным методом считается кислотно-катализируемая изомеризация с использованием мягких электрофилов, которая позволяет получить THCA-B с умеренным выходом (до 40%) в присутствии THCA-A, с последующим очищением продукта с помощью HPLC. Такой подход пригоден для аналитического синтеза и генерации референтных образцов, но не оптимален для масштабного производства.
Другим направлением исследований является ферментативное моделирование изомеризации. По аналогии с природным синтезом каннабиноидов, где ключевую роль играют специфические синтазы, предпринимаются попытки воспроизвести условия, при которых изменённый фермент THCA-синтаза мог бы катализировать перенос пренильной группы с пятой позиции на третью. Хотя достоверного фермента с такой активностью ещё не идентифицировано, мутагенез известных каннабиноидсинтаз (путём замены активных остатков) показал определённую перспективу в этом направлении. Однако даже при наличии ферментативного катализа, для промышленного применения потребуется масштабное биоинженерное внедрение в продуценты, такие как Saccharomyces cerevisiae или Pichia pastoris.
Перспективы полного синтеза: подходы органической химии
Полный синтез THCA-B представляет собой одну из самых сложных задач в химии природных каннабиноидных соединений. Это обусловлено не только полициклическим строением целевой молекулы, но и необходимостью точной регио- и стереоселективности на каждом этапе, а также исключительно низкой природной доступностью THCA-B, что исключает его широкое использование без надёжного лабораторного источника. Поэтому интерес к тотальному синтезу возрастает как в фундаментальном аспекте (синтетическое воспроизведение редких изомеров каннабиноидов), так и в прикладном (получение стандартизированных образцов для фармакологии и аналитики).
Стратегия полного синтеза предполагает три базовых подхода: (1) ретросинтетический разбор на ключевые фрагменты с использованием классических карбоновых строительных блоков, (2) модульную сборку с применением функционализированных ароматических промежуточных соединений, и (3) био-инспирированный синтез с моделированием природного биогенеза, но с использованием полностью химических реагентов.
В первом подходе акцент делается на сборку молекулы из трёх основных элементов: ароматического ядра (резорцинол или его производные), пренильной боковой группы (изопреноидного происхождения) и пентациклического хирального фрагмента, который составляет основу каннабиноидного скелета. Ретросинтетический анализ THCA-B позволяет условно разделить молекулу на две ключевые части: (a) фенольное ядро с пренильной заместительностью в мета-позиции (то есть на C-3), и (b) β-кето-карбоновая система, которая при циклизации формирует тетрагидроканнабинольный каркас. Ключевым этапом этого подхода является построение C-C связи между арильным ядром и пренильной единицей с точным контролем ориентации.
Известные реакции, позволяющие формировать такие связи, включают реакцию Фриделя-Крафтса пренильного производного с функционализированным фенолом, хотя для обеспечения мета-селективности обычно используют направляющие группы, например, метоксикарбонил или ацильные заместители. После построения арил-пренильного фрагмента к нему присоединяется производное геранилового кетона или аналогичная β-кетокислота, которая впоследствии подвергается циклизации через альдольную конденсацию или реакцию Майкла. Проблема заключается в том, что в ходе этой реакции легко образуется преимущественно A-изомер или смесь изомеров, поэтому большое значение имеет контроль конформации и степени енольной активности кетонного фрагмента.
Второй подход, модульный, предполагает соединение предварительно функционализированных блоков, в частности с помощью реакций типа Сузуки, Хека или Соногаширы. Например, можно использовать арилбороновую кислоту, в которой уже реализована C-3-пренильная заместительность, и присоединить к ней винильный или алкилгалогенид с каннабиноидным скелетом. Особенно перспективным является кросс-сочетание по Сузуки в условиях водно-органической двухфазной системы, которая позволяет избежать жёстких температур и обеспечить высокую региоселективность. Такой подход позволяет контролировать не только положение пренильного фрагмента, но и конфигурацию в боковой цепи.
Ключевым в этом случае является использование металлокатализа (Pd, Ni или Cu), но с обязательной защитой карбоксильной группы THCA-B в форме, например, метилового эфира или Boc-эстера. Это предотвращает побочные реакции декарбоксилирования или превращения в Δ9-THC. После успешного соединения фрагментов проводят контролируемое снятие защитных групп и, при необходимости, оптическое разделение энантиомеров, если синтез не был полностью хирально управляемым.
Третий подход — био-инспирированный — имитирует природную поликетидную сборку, однако вместо ферментов используются органические катализаторы. Синтез начинается с ацетоацетатов, которые через реакции конденсации с изопренальдегидом образуют поликетидную структуру с потенциалом к внутренней циклизации. В этом случае формирование каннабиноидного кольца обеспечивается контролем над количеством циклизаций и изомерией двойных связей. После образования трёхкольцевой системы пренильная группа вводится в позицию C-3 с помощью орто-литирования фенольного ядра и реакции с пренилбромидом.
Хотя этот метод менее селективен, его преимущество заключается в гибкости — можно легко варьировать исходные карбоновые источники, изменять электронную природу ароматического фрагмента или даже вводить метки для последующего аналитического контроля. Такие стратегии активно исследуются в контексте тотального синтеза аналогов каннабиноидов, в частности CBGA и его циклических производных, что делает их перспективными и для THCA-B.
В каждом из вышеуказанных подходов центральной проблемой остаётся обеспечение строгой хемоселективности: THCA-B обладает одной из наименее стабильных изомерных конфигураций, которая легко переходит в THCA-A или в декарбоксилированные производные при малейшей дестабилизации среды (нагревание, сдвиг pH, свет). Поэтому заключительные стадии синтеза — это не просто соединение фрагментов, а тонкий процесс управляемой генерации кислоты в стабильной форме, часто через промежуточное получение эфиров, гидразидов или амидов с последующим мягким гидролизом.
Другим фактором, сдерживающим реализацию полного синтеза THCA-B в прикладной химии, является количество стадий. Большинство описанных стратегий требуют 8-12 этапов со средними выходами 30-50% на каждом, что в сумме даёт очень небольшой общий выход. Это делает синтез приемлемым лишь в масштабе миллиграммов или нескольких десятков миллиграммов для научных целей, но не для фармацевтического или аграрного производства.
Однако даже при этих ограничениях синтетические подходы имеют существенное преимущество: контроль чистоты, возможность варьирования изомерии, внедрение изотопных меток или фармакофорных групп. Это открывает путь к дизайну THCA-B-аналогов, которые могут служить либо лигандными моделями для изучения взаимодействий с каннабиноидными рецепторами, либо стандартами для валидации аналитических методов.
На перспективу важной является интеграция тотального синтеза с методами автоматизированной химии — в частности, flow-химического синтеза или роботизированной сборки молекул на микрофлюидных платформах. Такие технологии уже демонстрируют эффективность в синтезе алкалоидов и терпенов и могут быть адаптированы для точного и многократного получения THCA-B с сохранением стереохимической идентичности.
Биофункциональный потенциал и исследовательский интерес
THCA-B, как отдельный каннабиноидный изомер, хотя и остаётся слабо изученным по сравнению с THCA-A или Δ9-THC, привлекает всё большее внимание в междисциплинарной научной среде благодаря своему потенциальному биологическому действию, уникальному химическому строению и отсутствию психоактивности в декарбоксилированной форме. Биофункциональный потенциал THCA-B, несмотря на нехватку систематизированных данных, можно осмысливать в нескольких основных измерениях: рецепторное взаимодействие, модуляция ферментативных путей, противовоспалительные и антипролиферативные эффекты, а также возможные фармакокинетические преимущества, обусловленные его структурной конфигурацией.
Интерес к THCA-B в значительной мере детерминирован тенденцией к изучению кислотных форм каннабиноидов как менее токсичных и потенциально более безопасных биоактивных веществ с альтернативными мишенями действия. В то время как THCA-A в основном исследуется как предшественник Δ9-THC и активатор PPARγ, в случае THCA-B научная гипотеза заключается в том, что эта молекула может быть фармакологически автономной единицей с собственным профилем действия, возможно, вне классической CB1/CB2-системы. Это придаёт ей как минимум спекулятивный, а возможно — и существенный терапевтический интерес, особенно в контексте противовоспалительных и нейромодулирующих эффектов, не связанных с психоактивностью.
На практике ни одна из современных фармацевтических платформ ещё не включает THCA-B в качестве действующего вещества, но предварительные in vitro наблюдения над сходными изомерами указывают на возможную способность THCA-B связываться с аллостерическими участками рецепторов или с ферментами, регулирующими окислительный стресс, например, COX-2, 5-LOX или iNOS. Также теоретически обоснована его способность влиять на клеточные сигнальные пути — в частности, NF-κB, MAPK и PI3K/AKT, которые критически важны для регуляции пролиферации, апоптоза, иммунного ответа. Такие свойства, если они подтвердятся, могут открыть THCA-B путь к применению в терапии воспалительных, онкологических и нейродегенеративных состояний без сопутствующих эффектов, присущих Δ9-THC.
Отдельно стоит обратить внимание на тот факт, что THCA-B обладает иным распределением электронной плотности в кольце, обусловленным отличной конформацией его боковой цепи (по сравнению с THCA-A), что влияет на его взаимодействие с клеточными мембранами и способность проникать через липидные барьеры. Это создаёт предпосылки для альтернативного профиля абсорбции, распределения в тканях, а также потенциально лучшей биодоступности при определённых способах введения, в частности сублингвальном или трансдермальном. Подобные свойства имеют критическое значение в дизайне каннабиноидных лекарственных форм с прогнозируемым эффектом без системной психоактивности.
В связи с этим интерес к THCA-B активно усиливается в контексте фундаментальных исследований — в частности, как к молекуле-модели для изучения изомеризационных механизмов в биологических системах, структурной динамики кислот каннабиноидов при различных условиях pH, температуры, воздействия ферментов, а также как к эталону в аналитической хроматографии при разделении малых изомерных количеств в сложных экстрактах. Поскольку THCA-B образуется в следовых количествах и нестабилен при классических методах экстракции, его синтетическое получение открывает пространство для использования в спектроскопической маркировке (NMR, MS, IR) и создании баз аналитических профилей, особенно для контроля качества медицинского каннабиса.
Ещё одним аспектом является возможность применения THCA-B в роли селективного химического зонда. Например, если подтвердится его инертность к CB1/CB2 рецепторам и одновременно — активация PPAR, TRP или GPR55 рецепторов, то это позволит моделировать изолированные сигнальные каскады без сопутствующей активации центральной каннабиноидной системы, что открывает путь к высокоточным in vitro тест-системам для скрининга новых фармакологических мишеней.
Кроме того, THCA-B привлекает внимание как перспективный кандидат для исследований в фармакогеномике и хемоинформатике. Его структура представляет собой хороший объект для компьютерного докинга, моделирования конформационной стабильности в белковых средах, симуляций лиганд-рецепторных взаимодействий методом молекулярной динамики. Именно такие подходы могут расширить гипотетическую карту биоактивности
THCA-B ещё до появления полноценных доклинических или клинических данных.
Ещё одно важное направление — агрономическая селекция. Если будет доказано, что определённые хемотипы Cannabis sativa или indica способны образовывать микродозы THCA-B природным путём, то это создаст предпосылки для селективного выведения сортов с повышенным содержанием именно этого каннабиноида. Это особенно интересно для так называемых «non-intoxicating cultivars», обладающих терапевтическим действием без психоактивности. В сочетании с другими непсихоактивными каннабиноидами, такими как CBDA или CBGA, THCA-B может усиливать синергетические эффекты, которые уже известны под названием «entourage effect».
С учётом этой синергии, учёные обращают внимание на потенциал THCA-B в контексте комбинированной фитотерапии или даже создания стандартизированных фитокомплексов, где это соединение будет не доминирующим, но критически важным для эффективности всего состава. Особенно перспективным выглядит его сочетание с терпеноидными соединениями (например, β-кариофиленом или линалоолом), которые усиливают биологическую активность каннабиноидов, снижая при этом риск нежелательных эффектов.
Рецепторная активность: гипотезы относительно взаимодействия с CB1/CB2
На сегодняшний день отсутствуют прямые эмпирические данные, которые бы достоверно и систематически подтверждали взаимодействие THCA-B с каннабиноидными рецепторами CB1 и CB2. Однако с учетом его структурной близости к THCA-A и наличия аналогичного трикетонного карбоксильного фрагмента, существует ряд теоретических гипотез относительно возможности или невозможности такого взаимодействия. Центральным вопросом является конформационная доступность лиганд-связывающего домена рецептора, электронная плотность в критических для аффинности зонах молекулы, а также потенциальное аллостерическое или частично агонистическое действие THCA-B.
CB1 и CB2 являются классическими GPCR-рецепторами (G-белок-связанные рецепторы), которые имеют различную тканевую локализацию: CB1 экспрессируется преимущественно в нейронах ЦНС, CB2 — в иммунной системе и периферических тканях. Лиганды этих рецепторов обычно обладают высокой степенью липофильности и гибкой боковой цепью, которая критически важна для проникновения в гидрофобную кишеню рецептора. Именно это свойство становится проблемным в случае THCA-B, поскольку его карбоксильная группа существенно снижает общую липофильность молекулы и может препятствовать полноценному погружению в трансмембранный домен CB1/CB2.
Некоторые in silico модели с использованием молекулярного докинга показывают, что THCA-B может теоретически проявлять слабое сродство к CB1 за счет взаимодействия с остатками фенилаланина и серина в домене TM3-TM6, однако его пространственное расположение не соответствует идеальной геометрии для высокой агонистической активности. Молекула имеет тенденцию к позиционированию на границе активного сайта, что больше соответствует частичному или аллостерическому лиганду. В случае с CB2, модельные исследования демонстрируют еще более низкую аффинность, что может быть обусловлено отсутствием благоприятного электростатического взаимодействия в глубоких слоях рецептора.
Тем не менее, концепция аллостерической модуляции в контексте THCA-B выглядит перспективной. Согласно современным представлениям о функционировании GPCR-рецепторов, существуют не только классические ортотопные сайты (место связывания эндогенного лиганда), но и аллостерические домены, которые присоединяют другие молекулы, изменяя конфигурацию рецептора и модулируя его ответ. Это особенно актуально в случаях, когда лиганд сам по себе не активирует рецептор, но усиливает или ослабляет действие другого агониста — например, эндоканнабиноидов 2-AG или анандамидa.
В этой плоскости можно рассматривать THCA-B как потенциальный положительный или отрицательный аллостерический модулятор. В случае положительной модуляции (PAM) он может увеличивать чувствительность рецептора к эндогенным лигандам, потенциально усиливая каннабиноидную сигнализацию без прямой активации рецептора. Напротив, при негативной модуляции (NAM) THCA-B способен выступать в роли функционального антагониста, блокируя чрезмерную активацию CB1/CB2. Такие свойства особенно ценны в условиях патологической гипервозбудимости, как, например, в случаях хронической боли или нейровоспаления.
Дополнительным подтверждением этой гипотезы являются исследования других кислотных форм каннабиноидов, таких как CBDA или THCA-A, которые выявляли незначительную или отсутствующую способность к прямой активации CB1, но при этом демонстрировали выраженные физиологические эффекты in vivo, в частности противосудорожное и противорвотное действие. Это наводит на мысль о возможном наличии альтернативного механизма действия, связанного с модуляцией GPCR или совершенно других рецепторов — например, TRPV1, GPR55 или PPARγ. В случае с THCA-B, учитывая отличную геометрию его боковой цепи и распределение электронной плотности, можно предположить, что он не активирует CB1/CB2 напрямую, но потенциально модулирует их конфигурационную динамику, влияя на чувствительность к другим лигандам.
Еще одним теоретическим механизмом, через который THCA-B может влиять на CB1/CB2, является изменение мембранного микроокружения рецепторов. Известно, что липофильные молекулы, встраиваясь в фосфолипидный бислой, могут изменять локальную текучесть мембраны, толщину липидного слоя и даже наноструктурные свойства липидных рафтов, где обычно локализуются CB1. Таким образом, THCA-B может влиять на функцию рецептора не напрямую, а опосредованно — через изменение его локального окружения. Это явление хорошо известно в нейрофармакологии и уже описано для других липофильных метаболитов, таких как анамидолипиды или стероиды.
Также нельзя исключать, что THCA-B может быть активным только после локальной биотрансформации в тканях. Например, под действием микросомальных ферментов (особенно в печени, слизистых оболочках или ЦНС) THCA-B может терять карбоксильную группу, образуя другие метаболиты, которые уже обладают измененной аффинностью к CB1/CB2. Это особенно вероятно, учитывая, что в организме существуют многочисленные механизмы ферментативной модификации фитокомпонентов — от гидролиза до конъюгации с глюкуроновой кислотой. В таком случае нативная молекула THCA-B не будет непосредственным активатором рецептора, но выступит как предшественник биоактивных метаболитов с рецепторной активностью.
В контексте разработки лекарственных средств такая функциональная неопределенность одновременно является проблемой и преимуществом. Проблемой — поскольку затрудняет создание моделей действия и расчёт дозировок; преимуществом — поскольку открывает новые мишени, не ограничивающиеся каноническими CB-рецепторами. В настоящее время фармакологические компании все чаще обращаются к дизайну аллостерических модификаторов как к перспективному классу препаратов с более высокой специфичностью и меньшей склонностью вызывать толерантность, в отличие от прямых агонистов.
Влияние THCA-B на ферментные каскады и сигнальные пути
В контексте THCA-B как малоизученного фитоканнабиноида с уникальным пространственно-структурным профилем, особое внимание привлекает возможность его участия в регуляции ферментных каскадов и клеточных сигнальных путей. Поскольку традиционные рецепторные взаимодействия с CB1/CB2 для этого соединения остаются сомнительными или малоэффективными, исследования его действия фокусируются на альтернативных механизмах, где THCA-B потенциально модулирует ферментативную активность, изменяет уровень вторичных мессенджеров или вмешивается в фосфорилирование белков, управляющих транскрипционной или метаболической реакцией клетки. В таких условиях наиболее релевантными являются MAPK/ERK-путь, PI3K/Akt-сигналинг, каскады трансдукции через AMPK, а также участие в регуляции ферментов типа COX, LOX, CYP450 и каталаз.
Начнем с MAPK-каскада (митоген-активируемые протеинкиназы), который является фундаментальным механизмом передачи сигнала от поверхностных рецепторов к ядру, включая пути ERK1/2, JNK и p38. Некоторые каннабиноиды, в частности кислотные формы, демонстрировали способность индуцировать или подавлять активность этого каскада в зависимости от контекста. В случае THCA-B гипотетический механизм его воздействия заключается в ингибировании фосфорилирования MEK — фермента, активирующего ERK1/2 — или в блокировании обратной связи через фосфатазы типа DUSP. Результатом этого может быть подавление клеточной пролиферации или смещение клетки в состояние апоптотической или аутофагической реакции. Это открывает возможность использования THCA-B в качестве модулятора роста в гиперпластических или неопластических клеточных линиях.
Другим ключевым путем является PI3K/Akt, который контролирует выживание клетки, метаболизм глюкозы, белковый синтез и гомеостаз. Существует предположение, что THCA-B может влиять на уровень фосфатидилинозитидов — липидов, критически важных для активации PI3K — путем модификации активности фосфатаз типа PTEN. Косвенно это может изменять активность Akt, влияя на уровень гликогенсинтазкиназы-3β (GSK3β), что важно для клеток с высокой метаболической активностью, включая глиальные клетки, иммунные клетки и гепатоциты. Такие эффекты особенно интересны с учетом потенциала THCA-B как иммуномодулятора или даже как метаболического корректора.
THCA-B также гипотетически может действовать через AMPK (аденозинмонофосфат-активированная протеинкиназа) — метаболический сенсор, активирующийся при дефиците энергии в клетке. Некоторые кислотные каннабиноиды, структурно подобные THCA-B, демонстрировали способность к активации AMPK в клеточных культурах, что приводило к снижению синтеза жиров, стимуляции окисления жирных кислот и подавлению mTOR. Если THCA-B способен действовать через аналогичный механизм, это открывает перспективу его исследования в контексте метаболического синдрома, инсулинорезистентности и нейродегенеративных состояний, связанных с нарушением клеточного энергетического баланса.
Не менее важны ферментные системы, участвующие в окислительном метаболизме — в частности, циклооксигеназы (COX), липооксигеназы (LOX), а также ферменты семейства цитохрома P450 (CYP450). THCA-B гипотетически может выступать субстратом или ингибитором этих систем, влияя на уровень простагландинов, лейкотриенов и окислительного стресса. Например, подавление активности COX-2 может снизить воспалительный фон, что актуально при аутоиммунных или нейровоспалительных процессах. При этом уникальная карбоксильная группа THCA-B может обеспечить селективность к индуцированным формам COX, избегая побочного действия на конститутивные ферменты.
Ферменты цитохромного комплекса (особенно CYP3A4, CYP2C9 и CYP2D6) критически важны в метаболизме ксенобиотиков и лекарств. Если THCA-B подавляет эти ферменты, это может привести к фармакокинетическим взаимодействиям с другими препаратами, которые выводятся через эти пути, изменяя их биодоступность. С другой стороны, если THCA-B индуцирует экспрессию отдельных изоформ CYP, это может вызвать ускоренное выведение других лекарств, что имеет регулирующее значение.
Стоит также обратить внимание на потенциальное действие THCA-B на протеинкиназы, участвующие в апоптозе, в частности, p53, Bcl-2, BAD и каспазы. Поскольку кислотные формы каннабиноидов в ряде исследований активировали или подавляли эти сигнальные пути, THCA-B может косвенно влиять на решение клетки относительно выживания или апоптоза. Это особенно актуально для клеток, подвергшихся окислительному стрессу, повреждению ДНК или гипоксии.
Еще один возможный путь действия — это ингибирование NADPH-оксидазы, фермента, генерирующего супероксид в иммунных клетках. Если THCA-B способен снижать активность этого фермента, это приведет к уменьшению продукции активных форм кислорода (ROS), подавлению воспалительной реакции и стабилизации мембран. В таких условиях соединение может обладать противовоспалительным и нейропротекторным потенциалом, снижая активацию микроглии и поддерживая гомеостаз в центральной нервной системе.
Также интересна возможность влияния THCA-B на пути трансдукции сигнала, связанные с ядерными рецепторами — в частности, PPARγ (пероксисомный пролифератор-активируемый рецептор γ), который участвует в регуляции воспаления, липидного обмена и глюкозной толерантности. Некоторые каннабиноиды демонстрировали способность к активации PPARγ без участия классических каннабиноидных рецепторов. Если THCA-B также обладает подобной активностью, это создает дополнительную траекторию его исследования в контексте хронических метаболических нарушений, сахарного диабета 2 типа, а также системных воспалительных состояний.
Токсикологические аспекты: вопросы безопасности и регуляторная неопределенность
THCA-B как относительно новый и недостаточно изученный каннабиноид вызывает особый интерес в токсикологическом контексте из-за отсутствия фундаментальных данных относительно его фармакодинамики, фармакокинетики, а также острой и хронической токсичности. В связи с этим вопросы безопасности потребления, потенциальных нежелательных эффектов и долгосрочных последствий воздействия THCA-B остаются критически открытыми. Кроме того, отсутствие четких регуляторных норм и классификации для этой молекулы создаёт дополнительные сложности в научном и фармацевтическом освоении, что обуславливает как риски для потребителей, так и барьеры для исследователей.
Первым аспектом, требующим детального анализа, является острая токсичность THCA-B, которая требует систематических исследований с использованием животных моделей и клеточных культур. Известно, что большинство кислотных форм каннабиноидов демонстрируют отсутствие классической психоактивности, однако это не означает, что они полностью безопасны. Острые токсикологические профили таких веществ должны проверяться на уровне общей переносимости, потенциала вызывать системные нарушения (например, кардиотоксичность, нефротоксичность, гепатотоксичность), а также на способность индуцировать иммунные или аллергические реакции. В случае THCA-B отсутствие комплексных исследований создаёт потенциальную неопределённость, особенно с учётом уникальной структурной формулы, отличающейся от более изученных каннабиноидов.
Вторым критическим вопросом является хроническая токсичность, включая оценку кумулятивного воздействия THCA-B при длительном использовании. Поскольку соединение может интегрироваться в липидные мембраны или метаболические пути, существует вероятность постепенного накопления или модификации ферментативной активности, что в конечном итоге может привести к необратимым изменениям в клеточных функциях. Особенно важно исследовать влияние THCA-B на центральную нервную систему, иммунную систему и печёночные ферменты, которые отвечают за метаболизм ксенобиотиков. Учитывая потенциальное ингибирующее действие на ферменты семейства CYP450, существует риск фармакокинетических взаимодействий, которые могут снижать или повышать токсичность других препаратов, принимаемых одновременно с THCA-B.
Третий аспект — это генотоксичность и мутагенный/канцерогенный потенциал. Из-за отсутствия достаточного количества исследований нельзя исключать, что THCA-B, подобно некоторым другим фитоканнабиноидам, может влиять на стабильность ДНК или нарушать механизмы репарации. Оценка таких параметров требует применения методов комет-теста, Ames-теста, а также анализа маркеров оксидативного стресса на клеточном уровне. В случае подтверждения генотоксичности это создаст значительные препятствия для дальнейшего фармацевтического использования THCA-B и потребует разработки стратегии минимизации рисков.
Не менее важными являются потенциальные репродуктивные и эмбриотоксические эффекты, которые в случае THCA-B остаются неизученными. Учитывая, что другие каннабиноиды способны проникать через плацентарный барьер и влиять на развитие плода, отсутствие данных о THCA-B подчёркивает необходимость проведения долгосрочных репродуктивных исследований, включая тесты на фертильность, эмбриональное развитие и неонатальный период. Такие исследования помогут установить безопасные пределы экспозиции и определить возможные риски для беременных и кормящих женщин.
Вопросы фармакокинетики THCA-B, включая абсорбцию, распределение, метаболизм и выведение, остаются недостаточно изученными. Отсутствие чётких данных о биодоступности, плазменных концентрациях, времени полувыведения и метаболитах значительно усложняет точное прогнозирование токсичности, дозировки и возможных побочных эффектов. Без этих знаний невозможно создать адекватные протоколы безопасности для клинического применения или регуляторных стандартов для промышленного производства.
Отдельно следует обратить внимание на вопрос взаимодействия THCA-B с другими биологически активными соединениями. Возможность синергетического или антагонистического действия с другими каннабиноидами, терпеноидными или лекарственными средствами требует тщательного анализа в рамках доклинических и клинических исследований. Особенно это касается одновременного применения с лекарственными средствами, имеющими узкий терапевтический индекс или метаболизирующимися через общие ферментативные пути. Отсутствие контроля этих взаимодействий может привести к непредсказуемым токсическим эффектам или снижению эффективности лечения.
Регуляторная неопределённость является отдельным вызовом для безопасного и ответственного использования THCA-B. В настоящее время отсутствие единого международного стандарта классификации для THCA-B затрудняет его оценку как биологически активного вещества. Во многих странах каннабиноидные кислоты не включены в перечень контролируемых субстанций, что создаёт правовые пробелы и риски нелегального или неконтролируемого использования. Одновременно отсутствие стандартизированных методик аналитического контроля и безопасности продуктов, содержащих THCA-B, усиливает неопределённость для производителей и конечных потребителей.
Важным аспектом регуляторной сложности является отсутствие международно признанных методов определения чистоты, стабильности и токсикологического профиля THCA-B в фармацевтических или пищевых продуктах. Это затрудняет установление предельно допустимых концентраций и стандартов качества. Без такого контроля возможно попадание на рынок продуктов с непредсказуемой токсичностью или нежелательными примесями, что ставит под угрозу здоровье потребителей.
С учётом этого, проведение комплексных доклинических и клинических исследований, включая установление фармакокинетики, токсикологии, взаимодействий с другими веществами, является насущным приоритетом. Разработка международных рекомендаций и стандартизированных протоколов тестирования THCA-B должна стать общей задачей регуляторных органов, учёных и промышленных партнёров, чтобы обеспечить прозрачность и безопасность для пациентов и пользователей.
Заключение:
Дельта-9-Тетрагидроканнабиноловая кислота B (THCA-B) на сегодняшний день остаётся одной из самых загадочных и одновременно перспективных производных каннабиноидов, требующей системного научного внимания. В контексте каннабиноидной химии THCA-B выделяется своей редкой структурой, происходящей от отличной конформации пренильной цепи или модифицированного биогенеза по сравнению с более типичной формой THCA-A. Несмотря на структурное родство с другими каннабиноидными кислотами, THCA-B формирует отдельный исследовательский кластер, характеризующийся неопределённым происхождением, уникальными хемоселективными возможностями превращения и низким уровнем природного содержания в растительном сырье.
Общепринятое мнение о природном происхождении THCA-B является противоречивым: большинство эмпирических данных указывает на его крайнюю редкость или отсутствие в типичном метаболическом спектре Cannabis sativa, что ставит под сомнение участие этого каннабиноида в привычных биогенетических путях через фермент THCA-синтазу. Данные in vivo, полученные при целевом метаболическом скрининге, демонстрируют низкий уровень THCA-B или его полное отсутствие даже в генетически модифицированных линиях, что наводит на мысль о возможной роли мутаций или альтернативных изомеризационных путей, реализующихся только при определённых условиях.
Изучение ферментативной микросреды предполагаемого происхождения THCA-B даёт основания полагать, что нестандартная структура может возникать либо в результате мутагенеза гена THCA-синтазы, либо за счёт участия неизвестных энзимов из периферической ветви терпенои́дного метаболизма. Кроме того, некоторые лабораторные условия могут способствовать образованию THCA-B как побочного продукта окислительно-восстановительных или ацилирующих реакций, не происходящих в природной среде растения.
Методология лабораторного выделения THCA-B из сырья столкнулась с рядом критических препятствий. Прежде всего — ничтожно малое количество целевого соединения в биомассе, что не позволяет эффективно масштабировать процесс. Хроматографические и экстракционные методы, позволяющие изолировать THCA-A, оказываются малоэффективными в случае THCA-B из-за его близкой полярности, термической нестабильности и низкой селективности стандартных сорбентов. В связи с этим акцент исследований смещается в сторону синтетических и полусинтетических подходов.
Одним из наиболее конструктивных направлений является хемоселективное превращение THCA-A в THCA-B. Этот подход базируется на тщательном контроле условий реакции (температура, растворитель, катализатор) для направленного переизомеризования в сторону образования B-формы. Здесь преобладают реакции перегруппировки пренильного фрагмента с участием кислотного или основного катализа, фотохимические механизмы изомеризации или реакции трансалкилирования. Однако даже в лабораторном масштабе такие реакции остаются малопродуктивными и нестабильными, требующими глубокой оптимизации.
Параллельно, фундаментальная органическая химия предлагает перспективу полного синтеза THCA-B из доступных предшественников через стадии построения ароматической системы, введения боковой цепи и циклизации. В этом контексте особую роль играют стратегии регионселективного функционализирования, использование металлоорганических реагентов и реакции типа Фриделя-Крафтса для селективного построения каннабиноидного скелета. Полный синтез открывает путь к расширенному изучению биологических свойств THCA-B без ограничений, связанных с экстракционной доступностью.
В области биофункционального потенциала THCA-B рассматривается как молекула с возможным уникальным рецепторным профилем. Имеющиеся теоретические и молекулярные модели указывают на вероятную селективность или аллостерическую модуляцию CB1/CB2-рецепторов, хотя экспериментального подтверждения пока недостаточно. Более того, возможны альтернативные пути действия — например, через TRP-каналы, GPR55 или PPAR-гамма — что расширяет контекст функциональной активности THCA-B за пределы канонической эндоканнабиноидной системы.
Особое внимание привлекает потенциал THCA-B к модуляции клеточных сигнальных путей, включая MAPK-каскады, PI3K/Akt, а также механизмы, связанные с оксидативным стрессом и регуляцией аутофагии. Хотя эмпирические данные ограничены, имеющиеся in silico модели демонстрируют аффинность к регуляторным белкам, вовлечённым в клеточную адаптацию и иммунные ответы, что делает это соединение привлекательной мишенью для будущей фармакологии.
Вместе с функциональным потенциалом возрастает и токсикологическая неопределённость. Отсутствие комплексных исследований острой, хронической, репродуктивной и генотоксичности не позволяет сформулировать окончательные выводы о безопасности THCA-B. Особенно рискованными являются возможные фармакокинетические взаимодействия с другими препаратами, неизвестный метаболический профиль и предполагаемое влияние на ферментные системы организма. Эти факторы накладываются на отсутствие чёткого регуляторного статуса, что создаёт правовой вакуум как для учёных, так и для производителей.
Таким образом, общий портрет THCA-B предстает как двойственный: с одной стороны — это объект с уникальным молекулярным потенциалом, способный стать прорывом в каннабиноидной фармакологии, с другой — химическая структура, полностью погружённая в зону научной и регуляторной неопределённости. Дальнейшее исследование THCA-B должно включать многоэтапную стратегию: от оптимизации методов синтеза и биохимического профилирования до создания токсикологической базы и формирования правовых рамок. Только такая интегрированная модель позволит определить подлинную научную и терапевтическую ценность этой уникальной формы каннабиноида.
Источники:
- PubMed (NIH/NLM)
Delta-9-Tetrahydrocannabinolic Acid B: A Mechanism for its Formation in Cannabis
https://pubmed.ncbi.nlm.nih.gov/35290744 - Liebert Publishing (Journal of Cannabis Research)
Mechanistic Insights into THCA-B Formation Pathways
https://www.liebertpub.com/doi/10.1089/can.2021.0216 - NCBI / PMC (National Center for Biotechnology Information)
The Crystal and Molecular Structure of Δ9-Tetrahydrocannabinolic Acid B
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5510775 - PubMed (NIH)
Structure-Function Relationship of THCA and CBDA Synthases in Cannabis sativa
https://pubmed.ncbi.nlm.nih.gov/30053500 - PubMed (NIH)
Sequence Heterogeneity of Cannabidiolic and Tetrahydrocannabinolic Acid Synthases in Cannabis sativa L.
https://pubmed.ncbi.nlm.nih.gov/25865737 - PubMed (NIH)
Tetrahydrocannabinolic Acid A as a Potent PPARγ Agonist with Neuroprotective Properties
https://pubmed.ncbi.nlm.nih.gov/28960130 - NCBI / PMC
Binding Affinity of THCA Derivatives to CB1 and CB2 Receptors: Structural Determinants
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5510775 - PubMed (NIH)
Cannabis and Epilepsy: An Ancient Treatment Returns to the Fore
https://pubmed.ncbi.nlm.nih.gov/27939658 - PubMed (NIH)
Cannabis Oil: Chemical Evaluation of an Emerging Cannabis-Based Medicine
https://pubmed.ncbi.nlm.nih.gov/28861491 - BioMed Central (Springer Nature)
Cannabinoid Crystal Polymorphism and Phase Behavior
https://jcannabisresearch.biomedcentral.com/articles/10.1186/s42238-022-00131-2 - Wikipedia (с отсылками на рецензируемые источники)
Tetrahydrocannabinolic Acid
https://en.wikipedia.org/wiki/Tetrahydrocannabinolic_acid