В рамках химии природных соединений существует категория молекул, о которых наука знает не потому, что они массово распространены или демонстрируют очевидный эффект, а потому, что их наличие — это вызов самой логике системного мышления. Одной из таких молекул является дельта-9-тетрагидроканнабиноловая кислота-C4 (THCA-C4) — соединение, которое обнаруживается лишь в следовых количествах, однако уже своим существованием ставит ряд вопросов, на которые сегодня нет исчерпывающих ответов. Её появление в хемотипе Cannabis sativa, редкость, вариативность и структурное родство с основными каннабиноидами указывают на её вероятную биологическую и биохимическую функцию, хотя ни одна из них пока не доказана экспериментально. THCA-C4 — это не просто производное основной тетрагидроканнабиноловой кислоты; это гомолог с модифицированной боковой алкильной цепью, который, возможно, является маркером более глубоких метаболических процессов, остающихся невидимыми для большинства аналитических систем.
В традиционном описании каннабиноидов основное внимание сосредоточено на так называемых мажорных компонентах — THCA-A, CBDA, CBGA, а также их декарбоксилированных формах. Однако научный интерес всё больше смещается в сторону микрокомпонентов, которые при нормальных условиях не обладают выраженной активностью, но могут выполнять регуляторные, сигнальные или даже ингибирующие функции в рамках более сложных хемоэкосистем. Именно такими являются представители каннабиноидного ряда с необычными длинами боковой цепи — в частности гомологи с бутильной (C4), пропильной (C3) или даже гептильной (C7) заменой. Среди них THCA-C4 выделяется тем, что имеет самый высокий уровень структурного сходства с THCA-A, но при этом модифицирован так, что способен иметь принципиально иные фармакокинетические параметры, рецепторную аффинность и метаболическую судьбу.
Наличие этого соединения не было выявлено в первых изотопных исследованиях Cannabis, его не фиксировали в классических спектрах стандартных хемотипов. Однако с появлением высокочувствительных масс-спектрометров и улучшенных условий экстракции исследователи начали фиксировать незначительные пики, которые не соответствовали ни одному из известных стандартов. Последующая идентификация показала, что эти сигналы исходят от гомологов основных кислотных каннабиноидов, среди которых был и THCA-C4. Его точная концентрация в высушенном материале обычно не превышает 0,01-0,05% от общей массы каннабиноидной фракции, что делает его практически недоступным для прямой биологической оценки без специального синтеза или масштабного биоэкстрагирования. И всё же наличие такой структуры не может считаться случайностью. В биохимии случайности редко остаются незамеченными.
THCA-C4 уникален тем, что принадлежит к группе веществ, являющихся результатом природной хемогенетической вариабельности. Условно говоря, это побочный продукт действия ферментов, которые обычно участвуют в синтезе THCA-A, но при изменении условий или субстратной доступности могут катализировать образование родственных соединений. Например, если в клетке присутствует не стандартный геранилпирофосфат, а альтернативный прекурсор с изменённой углеводородной цепью (например, с четырьмя вместо пяти атомов углерода), конечный продукт синтазы также будет отличаться — в результате и возникает C4-гомолог. В лабораторных условиях этот процесс сложно воспроизвести, но на уровне клеточного биосинтеза он вполне вероятен. И именно такие микропути, образующие THCA-C4, могут быть окном в понимание пластичности каннабиноидного биосинтеза в целом.
Ещё один аспект, который придаёт THCA-C4 особую ценность, заключается в его потенциале как хемомаркера. В системах, где микрокомпоненты выполняют роль сигнальных индикаторов внутренней химической логики организма, даже следовое количество специфического гомолога может свидетельствовать о состоянии метаболической активности, стресса, мутации или изменении условий среды. Некоторые исследователи уже сегодня рассматривают THCA-C4 как возможный биомаркер нетипичных или целенаправленно модифицированных хемотипов Cannabis, возникших в результате селекции, биотехнологической инженерии или адаптации к экологическому давлению. В этом смысле THCA-C4 может быть полезен не только фармакологам, но и ботаникам, биоинформатикам и агрономам.
Однако научный вызов заключается не только в обнаружении или классификации этой молекулы. Более важным является вопрос её функционального значения. Является ли она случайным продуктом метаболического «шума» — или же выполняет специфическую, пусть и неочевидную функцию? В природе редко встречаются вещества, которые не имеют никакого биологического смысла. Даже транзитные или деструктивные молекулы часто служат промежуточными агентами в сложных сигнальных каскадах. В случае THCA-C4 мы имеем дело с веществом, которое по структуре вполне способно связываться с каннабиноидными рецепторами, потенциально изменяя их конфигурацию, но одновременно — с молекулой, которая не имеет подтверждённого активного влияния на человека или животные модели. Это парадоксальная ситуация, в которой научная логика сталкивается с нехваткой инструментальных доказательств.
Ещё больше усложняет исследование тот факт, что THCA-C4 чрезвычайно нестабильна в обычных лабораторных условиях. Некоторые наблюдения свидетельствуют о её частичной деградации или превращении уже во время экстракции из растительного материала. В зависимости от типа растворителя, температуры, pH и даже продолжительности процедуры, эта молекула может либо исчезать бесследно, либо переходить в другие формы. Это означает, что большинство исследователей даже не подозревают, что уже работали с THCA-C4 — просто не смогли её зафиксировать. Поэтому возникает задача не только поиска, но и реконструкции её утраченных следов в уже собранных аналитических массивах данных. В этом контексте можно говорить о потребности в новых типах стандартов для высокоточного идентифицирования малых гомологов каннабиноидов, среди которых THCA-C4 — лишь вершина возможного подводного слоя.
Кроме аналитической проблематики существует также эпистемологическое измерение этой молекулы. THCA-C4 — это не только объект исследования, но и вызов представлению о границах знания в области природной химии. В традиционной научной парадигме вещества классифицируются по принципу эффективности, количественного присутствия или прямой пользы. Но последние десятилетия доказали, что научная ценность часто лежит за пределами утилитарных категорий. Малораспространённые вещества могут иметь огромный потенциал в создании новых подходов к пониманию биохимии, генетической регуляции или молекулярной эволюции. В этом смысле THCA-C4 выступает как интеллектуальный фокус — стимул к переосмыслению моделей каннабиноидного синтеза, взаимодействия ферментов, структуры клеточной среды и принципов экстракции.
Что такое THCA-C4
Дельта-9-тетрагидроканнабиноловая кислота-C4 (THCA-C4) относится к группе кислотных каннабиноидов — природных фенольных соединений, которые продуцируются растением Cannabis sativa. Отличительной особенностью THCA-C4 является её боковая алкильная цепь, которая имеет длину четыре атома углерода (бутильная цепь), тогда как у более распространённого THCA-A эта цепь состоит из пяти атомов углерода (пентильная цепь). Эта, на первый взгляд, незначительная модификация цепи существенно влияет на физико-химические свойства молекулы, а также на её биохимическое поведение и потенциальную биологическую активность.
THCA-C4 — это первичная кислотная форма каннабиноида, что означает её природное существование в растении в виде кислоты с карбоксильной группой (-COOH), присоединённой к молекуле. Эта кислотная форма образуется непосредственно в жилках и клетках Cannabis sativa при помощи специфических ферментов, которые катализируют превращение прекурсоров в соответствующие каннабиноидные кислоты. В отличие от своей декарбоксилированной формы (деструктурированной вследствие нагревания или времени) — дельта-9-тетрагидроканнабинола (Δ9-THC), которая обладает психоактивными свойствами, THCA-C4 считается неактивной в классическом понимании этого термина, что типично для кислотных форм.
Однако, несмотря на сходство в основном каркасе с другими каннабиноидами, THCA-C4 существенно отличается как по химической структуре, так и по способу возникновения. Во-первых, бутильная боковая цепь придаёт молекуле более высокую гидрофобность по сравнению с пентильной цепью, что потенциально влияет на способность соединения проходить через биологические мембраны или взаимодействовать с белковыми рецепторами. Во-вторых, эта модификация изменяет конформацию молекулы, в частности пространственную ориентацию функциональных групп, что важно для молекулярного распознавания.
Стоит также отметить, что THCA-C4 является одним из ряда менее распространённых каннабиноидов, составляющих так называемую «малую фракцию» каннабиноидов в растении. Хотя она присутствует в крайне малых количествах, её изучение важно для понимания разнообразия каннабиноидного профиля, формируемого за счёт генетической вариабельности, климатических и агрономических условий, а также биохимической гибкости самого растения. Наличие таких гомологов свидетельствует о глубокой внутренней сложности метаболизма каннабиноидов и даёт представление о альтернативных путях синтеза.
Несмотря на редкость, THCA-C4 имеет большое значение для науки, поскольку гомологи каннабиноидов с изменённой длиной боковой цепи часто демонстрируют уникальные свойства, которые не повторяют свойства основных каннабиноидов. Такие молекулы могут влиять на спектр биологических эффектов, модулировать активность рецепторов или даже открывать новые механизмы взаимодействия на клеточном уровне. Таким образом, изучение THCA-C4 помогает расширить представление о комплексности каннабиноидной системы, которая является не только ключевой для фармакологии, но и для молекулярной биологии растений.
С точки зрения классификации, THCA-C4 относится к типу каннабиноидов, который принято обозначать как «бутильные каннабиноиды». Они образуют гомологический ряд с каннабиноидами, имеющими различную длину боковой алкильной цепи, начиная от пропильной (C3) и заканчивая гептильной (C7) формой. Этот ряд не случаен: он отражает принцип ферментативной пластичности, когда ключевые ферменты синтеза каннабиноидов принимают разные субстраты и, в зависимости от их доступности, продуцируют соответствующие продукты. Это означает, что THCA-C4 является продуктом метаболического пути, который, хотя и не доминирует, выполняет важную роль в структурном разнообразии каннабиноидов.
Феномен присутствия THCA-C4 также связан с усилиями исследователей в поиске природных и синтетических каннабиноидов с улучшенными или модифицированными фармакологическими свойствами. Именно длина и структура боковой цепи часто определяют аффинность молекулы к каннабиноидным рецепторам CB1 и CB2, которые являются ключевыми медиаторами биологических эффектов каннабиноидов. Поэтому THCA-C4, несмотря на то, что сам по себе пока недостаточно изучен, имеет перспективы для дальнейших фармакологических исследований как потенциальный агент с уникальными характеристиками.
В то же время THCA-C4 является не просто научным объектом, а биохимическим индикатором. Его обнаружение в составе конкретных хемотипов Cannabis может сигнализировать о наличии уникальных метаболических профилей, отражающих специфику генетики растения или влияние внешних факторов на биосинтетические пути. Это делает THCA-C4 потенциальным биомаркером для классификации и селекции, что особенно актуально в свете современных тенденций к персонализации терапии и созданию искусственных хемотипов с нужными свойствами.
Кроме того, важным аспектом является то, что THCA-C4, как и другие кислотные каннабиноиды, в природном виде не имеет психоактивного эффекта, что критично для понимания его потенциальной терапевтической ценности. Изучение таких неактивных кислотных форм позволяет отделить психоактивное воздействие каннабиноидов от их противовоспалительных, нейропротекторных, анальгетических или иммуномодулирующих свойств, раскрывая новые горизонты в фармакологии.
Особенности химической структуры THCA-C4
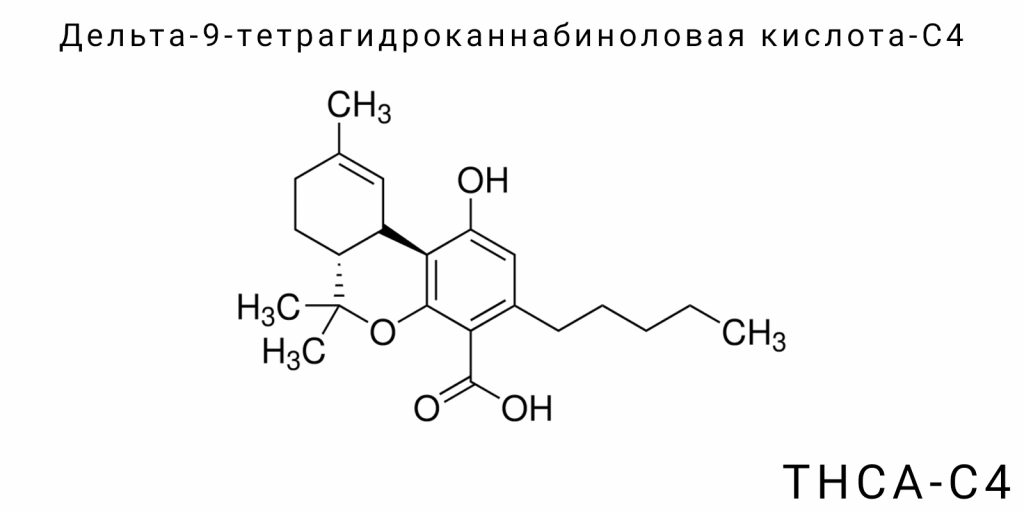
Химическая структура Дельта-9-тетрагидроканнабиноловой кислоты-C4 (THCA-C4) отражает её принадлежность к классу каннабиноидов, которые являются сложными тетрагидрофурольными производными с фенольным ядром, карбоксильной группой и боковым алкильным цепочком. Особенность THCA-C4 заключается в уникальной конфигурации её молекулы, которая определяет специфику её химической реактивности, физико-химических свойств и биологической активности.
Основой молекулы является тетрагидроканнабинольное ядро, включающее бензоциклогексановую структуру, к которой присоединены фенольная гидроксильная группа и боковой алкильный цепочек. Отличительной чертой именно THCA-C4 является наличие бутильного (C4) алкильного цепочка, расположенного в положении 3 бензоциклогексанового кольца, что критически важно для её молекулярной геометрии. На молекулярном уровне этот цепочек представляет собой прямую цепь из четырёх атомов углерода, заканчивающихся метильной группой.
Эта структурная деталь существенно влияет на конформационные особенности молекулы. Алкильный цепочек в THCA-C4 демонстрирует большую гибкость по сравнению с более обычным пентильным цепочком THCA-A, что частично изменяет пространственное расположение всего молекулярного каркаса. В частности, бутильный цепочек создаёт другой уровень вращения вокруг связей, что приводит к различиям в стабильности различных конформационных изомеров. Эта гибкость влияет на способность молекулы адаптироваться к различным биологическим мишеням, модулируя её фармакологический профиль.
Ещё одним ключевым элементом структуры является наличие карбоксильной группы (-COOH) в положении 2′ тетрагидроканнабинольного ядра, что определяет кислотный характер молекулы. Эта функциональная группа придаёт молекуле способность участвовать в кислотно-основных реакциях, а также влияет на её растворимость в полярных средах. С химической точки зрения, карбоксильная группа также является ключевым центром для реакции декарбоксилирования — процесса, который трансформирует кислотную форму в активную нейтральную форму Δ9-THC. Влияние этой группы на стабильность молекулы THCA-C4 особенно важно, так как она делает её более чувствительной к температурным и окислительным воздействиям.
Что касается ароматического кольца, в молекуле THCA-C4 оно представлено фенольным ядром с гидроксильной группой в положении 1′, что обеспечивает возможность образования водородных связей. Эти связи определяют межмолекулярные взаимодействия в кристаллической фазе и растворе, а также влияют на аффинность молекулы к белковым рецепторам. Наличие фенольного ядра также придаёт молекуле антиоксидантные свойства, что делает её потенциально полезной в контексте борьбы со стрессом окислительного типа.
Структурно THCA-C4 является хиральной молекулой — она содержит один или несколько центров хиральности, которые придают молекуле оптическую активность. Хиральность имеет фундаментальное значение для биохимического взаимодействия, поскольку конформации изомеров могут демонстрировать разную биологическую активность, аффинность к рецепторам, скорость метаболизма и даже токсичность. Для THCA-C4 характерно наличие (−)- и (+)-энантиомеров, при этом природные соединения обычно встречаются в одном определённом стереоизомерном виде, который определяется ферментами растения во время биосинтеза.
Важной частью молекулы является тетрагидрофурановое кольцо, которое образует дополнительную циклическую структуру, стабилизируя молекулу и влияя на её электронное распределение. Этот элемент структурной организации отвечает за уникальные электрофизические свойства молекулы, такие как поляризуемость и потенциал донорно-акцепторных взаимодействий. Он также определяет специфику связывания молекулы с каннабиноидными рецепторами, поскольку структурная целостность тетрагидрофуранового кольца обязательна для формирования стереоспецифических взаимодействий.
Рассматривая электронную структуру THCA-C4, следует подчеркнуть влияние конъюгации двойных связей в бензоциклогексановом кольце и бутильном цепочке. Отсутствие или наличие двойных связей в боковом цепочке существенно влияет на электронную плотность и энергетические уровни молекулы. В THCA-C4, в частности, отсутствие двойных связей в бутильном цепочке делает её менее электроотрицательной по сравнению с более длинными, пентильными гомологами, что, в свою очередь, изменяет её способность к электрофильным и нуклеофильным реакциям.
Ещё одним аспектом является влияние структурной изомерии в пределах каннабиноидов с разной длиной боковых цепочек на взаимодействие с рецепторами CB1 и CB2. Недавние исследования молекулярного моделирования показали, что изменения длины цепочки изменяют геометрию взаимодействия, что может как увеличивать, так и снижать аффинность к рецепторам. В случае THCA-C4 бутильный цепочек приводит к меньшему гидрофобному взаимодействию с липофильным каналом рецептора, что отличает её от каннабиноидов с более длинными цепочками.
Общая молекулярная масса THCA-C4, с учётом бутильного цепочка, меньше по сравнению с пентильными каннабиноидами, что также влияет на её распределение в биологических системах. Меньшая масса и специфическая структура определяют отличия в физико-химических параметрах, таких как точка плавления, растворимость в органических растворителях и кинетика метаболизма.
Не менее важной является стабильность молекулы к деградации. Благодаря структурным особенностям THCA-C4 проявляет отличную стабильность при комнатной температуре в сухих условиях, но при этом чувствительна к температурным колебаниям, вызывающим декарбоксилирование. Химическая структура с бутильным цепочком обусловливает некоторые отличия в механизмах деградации по сравнению с классическим THCA-A. В частности, скорость и механизм разрушения бокового цепочка в процессе окисления или термического разрушения имеют индивидуальные характеристики, которые изучаются для понимания термического поведения молекулы.
С точки зрения химической реактивности, карбоксильная группа также даёт возможность образования эфиров и амидов, что открывает перспективы синтеза производных с модифицированной биологической активностью. Особенности взаимодействия бутильного цепочка с этими функциональными превращениями существенно отличаются от аналогичных реакций пентильных каннабиноидов, что делает THCA-C4 перспективным объектом для химического синтеза и модификации.
Наконец, стоит упомянуть кристаллическую структуру THCA-C4, которая определяется соотношением между тетрациклическим основанием, карбоксильной и фенольной группами и боковым цепочком. Кристаллизация молекулы и формирование стабильных агрегатов в твёрдом состоянии или в виде кристаллических порошков определяют её физические свойства, такие как точка плавления, стабильность, гигроскопичность. Изучение таких параметров имеет ключевое значение для разработки методов экстракции, очистки и хранения THCA-C4.
Почему THCA-C4 так трудно выявить
Выявление и идентификация Дельта-9-тетрагидроканабиноловой кислоты-C4 (THCA-C4) в природных и лабораторных образцах связаны с комплексом технических, химических и аналитических сложностей, которые значительно затрудняют точный анализ и количественное определение этого соединения. Сложность выявления THCA-C4 обусловлена рядом факторов, касающихся её физико-химических свойств, стабильности, низкой концентрации в материалах, а также особенностей современных аналитических методов. Глубокое понимание этих препятствий является ключевым для разработки новых, более эффективных методик анализа, а также для корректной интерпретации результатов исследований.
Прежде всего, одной из основных сложностей является чрезвычайно низкая природная концентрация THCA-C4 в биологических материалах, таких как растительная ткань Cannabis. THCA-C4 является структурным гомологом более распространённых каннабиноидов, в частности THCA-A, однако уникальная боковая структура с бутильным цепочкой встречается реже, что обусловливает её микроскопическое присутствие. В связи с этим количество молекул THCA-C4 в пробе часто находится на грани чувствительности многих аналитических приборов, что требует применения методов с сверхвысоким разрешением и чувствительностью. Этот фактор усложняет не только количественное определение, но и сам факт обнаружения, особенно в присутствии более концентрированных каннабиноидов.
Второй важный аспект связан с химической нестабильностью THCA-C4 под воздействием физико-химических факторов, в частности температуры и света. Молекула содержит карбоксильную группу, что делает её чувствительной к декарбоксилированию — превращению в нейтральный каннабиноид Δ9-THC-C4. Этот процесс происходит при нагревании или длительном хранении образцов, что приводит к потере исходной формы THCA-C4 и изменению аналитического профиля. Поскольку декарбоксилирование происходит неравномерно и зависит от условий хранения, это затрудняет интерпретацию данных и делает сложным восстановление начальной концентрации кислоты в исследуемом материале. Соответственно, даже правильно подобранные методы могут «не увидеть» THCA-C4 из-за её превращения в другие формы.
Третья причина заключается в высокой химической схожести THCA-C4 с другими каннабиноидами, в частности структурными изомерами и гомологами, которые имеют близкие молекулярные массы, похожие функциональные группы и аналогичные физико-химические характеристики. Эта близость усложняет выбор селективных условий хроматографического разделения и спектроскопической идентификации. Например, в методах газовой или жидкостной хроматографии с масс-спектрометрическим детектированием (GC-MS, LC-MS) многочисленные каннабиноиды могут давать перекрывающиеся пики или изобары, что затрудняет однозначную идентификацию. Отсутствие уникальных масс-спектрометрических фрагментов, которые могли бы служить специфическими маркерами, делает необходимым использование комплексных мультидименсионных подходов или высокоразрешающих хроматографических методик.
Четвёртым фактором является нестабильность в процессе подготовки проб, где THCA-C4 может подвергаться химическим или физическим изменениям под воздействием растворителей, pH среды, температуры или взаимодействия с другими компонентами матрицы. Образцы, содержащие THCA-C4, часто имеют сложный органический состав с большим количеством полярных и неполярных соединений, включая другие каннабиноиды, терпены и флавоноиды. Взаимодействие этих соединений в ходе экстракции и очистки может приводить к деградации, адсорбции на колонках или потерям из-за неселективных реакций, что приводит к инактивации или «маскированию» THCA-C4. Поэтому оптимизация подготовки проб является критической для достоверного выявления и требует глубокого понимания химического поведения молекулы в различных средах.
Пятый аспект — это инструментальные ограничения. Стандартные аналитические платформы, широко используемые для исследования каннабиноидов, часто не обладают достаточной селективностью или чувствительностью для однозначного выявления THCA-C4. Например, в традиционных методах газовой хроматографии из-за термической нестабильности карбоксильной группы применение GC без предварительной дериватизации может приводить к разрушению молекулы, потере кислотной формы и появлению артефактов. С другой стороны, жидкостная хроматография с масс-спектрометрией, хотя и даёт лучшие возможности, требует дорогих и сложных систем высокого давления и высокоразрешающей масс-спектрометрии, а также тщательной калибровки, что ограничивает её широкое применение.
Шестой важный фактор — отсутствие стандартизированных и сертифицированных стандартных образцов THCA-C4 для калибровки и валидации аналитических методов. Из-за относительно недавнего открытия и исследования THCA-C4 производство чистых, стабильных стандартов в достаточном количестве является технологически сложным и дорогим процессом. Это ограничивает возможности лабораторий в точной количественной оценке и приводит к большим вариациям в результатах, в зависимости от применяемой методики и уровня квалификации аналитиков.
Ещё одним научно-техническим барьером является сложность разделения THCA-C4 от её изомеров, в частности от близкородственных структурных форм, таких как THCA-C3 или THCA-C5. Эти соединения имеют схожие молекулярные массы, подобный хроматографический профиль и отличаются только длиной бокового цепочки, что вынуждает применять многоступенчатые методы разделения — например, использование двумерной хроматографии (2D-LC) или комбинации хроматографии с спектроскопией ядерного магнитного резонанса (ЯМР) для точного определения структуры. Такие методики являются трудозатратными и требуют специализированного оборудования и глубоких экспертных знаний, что осложняет их рутинное применение.
С точки зрения химической кинетики, реакции декарбоксилирования и окисления THCA-C4 протекают с разной скоростью в зависимости от условий, что создаёт дополнительные трудности для стандартизации аналитических протоколов. Отсутствие чётких контролируемых условий и различные методы хранения проб вызывают значительную изменчивость концентрации THCA-C4 в образцах даже из одного и того же источника. Такая вариабельность подрывает надёжность результатов, что требует разработки стабилизационных методов и внедрения протоколов для предотвращения деградации.
С учётом вышеизложенного, научное сообщество активно работает над совершенствованием технологий для выявления THCA-C4. Это включает развитие ультравысокорасчётной хроматографии, многомерных спектроскопических методов, а также интеграцию методов машинного обучения для анализа спектральных данных. Однако эти подходы пока не получили массового применения из-за их высокой стоимости и технологической сложности.
Появление THCA-C4 в растении
Появление THCA-C4 в растении Cannabis является результатом сложного и многоуровневого биохимического процесса, происходящего на уровне клеточной метаболической активности и генетического контроля. Производство этого редкого каннабиноида — это своего рода биохимическая адаптация, которая объединяет в себе особенности генетического аппарата растения, ферментативных систем, а также влияние окружающей среды. Для понимания механизма появления THCA-C4 в каннабисе необходимо глубже погрузиться в процессы метаболизма вторичных метаболитов, функционирование ферментных каскадов и взаимодействие между генотипом и фенотипом растения.
По сути, THCA-C4 образуется в специализированных клетках — трихомах — которые расположены на поверхности цветов, листьев и молодых побегов растения. Эти трихомы выполняют роль биореакторов, где происходит накопление и синтез каннабиноидов. THCA-C4 как специфический каннабиноид является продуктом уникальной биохимической реакции, начинающейся с базовых прекурсоров каннабиноидного пути, которые синтезируются в клетках растения. Важно понимать, что появлению THCA-C4 предшествует комплексный метаболический путь, где центральную роль играют не только ферменты, но и субстратная специфичность и пространственная организация ферментных комплексов.
Несмотря на общую схожесть с другими каннабиноидами, биогенез THCA-C4 имеет отличительные черты, связанные с особенностями активации и трансформации специфических прекурсоров. Отличие в строении бокового алкильного цепи — четыре атома углерода (C4) вместо привычных трёх или пяти — обусловливает появление уникального энзимного механизма, отвечающего за этот вариант биосинтеза. Поэтому растения, продуцирующие THCA-C4, могут иметь характерные варианты генов, ответственных за синтез длинных алкильных боковых цепей.
Важным фактором является локализация процесса биосинтеза в специфических органеллах и субклеточных структурах, где ферменты, ответственные за синтез каннабиноидов, организованы в мультиферментные комплексы. Такая организация позволяет эффективно управлять последовательностью реакций и минимизировать потери нестабильных промежуточных продуктов. THCA-C4, как и другие кислоты, образуется путём специфического карбоксилирования и циклизации, что является деликатным процессом, чувствительным к изменениям метаболического состояния клетки, окислительному стрессу и доступности прекурсоров.
Природное явление появления THCA-C4 тесно связано с генетической вариабельностью растений Cannabis. Существуют сорта и линии, генетически запрограммированные на продукцию каннабиноидов с более длинными боковыми цепями. Эта специфика отражается в функции и регуляции ключевых ферментов, участвующих в формировании этих структур. Следовательно, THCA-C4 не является случайным побочным продуктом, а результатом адаптации, которая может быть связана с экологическими и эволюционными факторами, такими как защита от ультрафиолетового излучения, патогенов или фитофагов.
Появление THCA-C4 в растении также связано с этапами роста и развития. Уровень синтеза этого каннабиноида является динамичным и зависит от возраста растения, его состояния здоровья, а также условий внешней среды — таких как свет, температура, влажность, состав почвы и уровень стресса. На ранних стадиях развития растения ферментативные системы настроены на активный синтез основных каннабиноидов, тогда как у более зрелых форм увеличивается разнообразие структур и относительное накопление редких форм, в частности THCA-C4. Этот феномен указывает на сложную регуляторную сеть, контролирующую метаболический баланс между синтезом основных и вторичных каннабиноидов.
Важной составляющей является также влияние взаимодействия между метаболическими путями каннабиноидов и другими вторичными метаболитами растения, в частности терпеноидами и флавоноидами. Совместная регуляция и координация этих путей влияют на доступность прекурсоров и энергетический баланс клетки, что, в свою очередь, определяет интенсивность синтеза THCA-C4. Метаболическая конкуренция и механизмы обратной связи могут усиливать или подавлять продукцию этого каннабиноида, создавая сложный и гибкий биохимический профиль растения.
Кроме того, важно отметить, что образование THCA-C4 не является изолированным процессом, а частью комплексной сети ферментативных реакций и биосинтетических каскадов. Эта сеть охватывает не только синтез самого THCA-C4, но и превращение его прекурсоров, включая специфические окислительные и карбоксильные реакции. Взаимодействие между ферментами, коферментами и субстратами создаёт синергетический эффект, обеспечивающий высокоэффективный синтез каннабиноидов в оптимальных концентрациях.
Нельзя также игнорировать роль эпигенетических механизмов, которые могут модулировать экспрессию генов, отвечающих за синтез THCA-C4. Исследования последних лет показывают, что метилирование ДНК, модификации гистонов и влияние некодирующих РНК могут существенно влиять на метаболический профиль Cannabis, в частности изменять баланс между различными каннабиноидами. Такие механизмы обеспечивают адаптивность растения к изменениям окружающей среды и создают вариабельность в продукции THCA-C4 даже между близкородственными генетическими линиями.
Совокупность этих факторов объясняет, почему THCA-C4 появляется только у определённых сортов Cannabis и при определённых условиях. Это явление подчёркивает сложность и многогранность метаболических процессов, происходящих в растении, и указывает на необходимость комплексных подходов к изучению его биохимии. Изучение этих механизмов имеет не только фундаментальное значение для понимания биологии каннабиноидов, но и практическое применение в селекции растений с заданным метаболическим профилем, что важно для медицинского и промышленного использования Cannabis.
Возможные природные пути биосинтеза THCA-C4
Биосинтез THCA-C4 в растении Cannabis представляет собой сложный и точный биохимический процесс, который отличается от классических путей образования других каннабиноидов за счет уникальности алкильного цепи. Определение природных путей синтеза этого редкого каннабиноида требует анализа ключевых метаболических каскадов, молекулярных субстратов и ферментативных механизмов, обеспечивающих специфическую структуру молекулы THCA-C4.
Основой для формирования каннабиноидов в Cannabis являются два главных метаболических пути: поликетидный путь (PKS) и путь изопрена биосинтеза (мепантенит/мептаноит, MEP/DOXP). Они обеспечивают соответствующие прекурсоры — ароматический бензольный фрагмент и алкильный цепь. В классическом случае образование THCA предполагает конденсацию орто-кумароил-CoA (ароматический компонент, образующийся в результате пути фенилпропаноидов) и геранилпирофосфата (GPP) — изопренового донора, синтезируемого в MEP-пути. Для THCA-C4, однако, типичное отличие заключается в длине и структуре алкильного цепи — вместо пяти углеродных атомов в GPP используется производное с более короткой, четырехуглеродной цепью. Именно это вызывает необходимость дополнительных ферментативных трансформаций или альтернативного пула субстратов.
Первый возможный путь биосинтеза THCA-C4 предполагает участие альтернативного изопренового прекурсора — бутилпирофосфата (BPP) или его аналогов, содержащих четыре атома углерода в боковой цепи вместо типичного GPP. Отличие в субстрате вызывает радикальное изменение ферментативной специфики и продукта реакции. Исследования выделенных ферментов в каннабиноидном пути показали, что специфические тератогеназы или транс-изопренилирующие синтазы могут проявлять гибкость в принятии подобных субстратов, что обусловливает образование алкильных производных с меньшим количеством углеродов. Это означает, что в природе существуют либо малоизученные ферменты, либо варианты уже известных, способных выполнять конденсацию орто-кумароил-CoA с бутилпирофосфатом, что запускает образование уникального прекурсора THCA-C4.
Второй природный путь связан с модификацией базовых прекурсоров через ферментативное сокращение или трансформацию уже существующих алкильных цепей. Согласно этой гипотезе, THCA-C4 формируется как производное классического THCA путем ферментативного вмешательства в цепь — процесса, включающего окислительное гидрирование, β-окисление или специфическое гидролитическое отщепление конечных углеродных атомов из пятиатомной цепи. Эта трансформация может осуществляться отдельными ферментами, такими как липоксигеназы, редуктазы или монооксигеназы, локализованными в трихомах. Такой подход позволяет использовать уже синтезированный GPP как начальный субстрат, а последующее модулирование длины бокового цепи ведет к появлению алкильных производных с четырьмя атомами углерода, которые конденсируются с орто-кумароил-CoA для формирования THCA-C4.
Ферментативная специфичность в обоих сценариях отличается от классического биосинтеза THCA. Экспериментальные данные свидетельствуют о существовании изоформ ферментов, обладающих субстратной специфичностью к альтернативным изопреновым донорам или модифицированным алкильным цепям. Изучение таких изоформ осуществлялось с применением протеомики и генной инженерии, где были идентифицированы мутации в участках, отвечающих за связывание с субстратом. Эти варианты ферментов могут быть результатом генетических мутаций или эпигенетических модификаций, что обусловливает появление уникальных биосинтетических маршрутов, характерных именно для растений, продуцирующих THCA-C4.
Кроме того, важно учитывать субклеточную локализацию биосинтетических комплексов. Конденсация прекурсоров и формирование молекулы THCA-C4 вероятно происходит в специфических отсеках цитоплазмы или мембранных структурах, где концентрация субстратов и кофакторов оптимальна для ферментативной активности. Такие органеллообразные комплексы могут иметь изменённый ферментный состав и обеспечивать целенаправленный синтез каннабиноидов с разными боковыми цепями, в том числе THCA-C4.
Значительную роль в этом процессе играет также доступность и концентрация алкильных доноров. В растении уровни бутилпирофосфата или подобных веществ могут регулироваться в зависимости от внешних факторов — светового режима, температуры или питательной среды. Вариации в метаболизме изопреноидов влияют на соотношение субстратов, тем самым определяя интенсивность синтеза THCA-C4 относительно других каннабиноидов. Это свидетельствует о сложном и адаптивном характере регуляции биосинтеза.
Особое внимание заслуживает участие кофакторов и минеральных компонентов, обеспечивающих активность ферментов, в частности Mg²⁺, Fe²⁺, NAD(P)H. Их количество и доступность напрямую коррелируют с эффективностью синтеза THCA-C4. Изменения в балансе кофакторов могут влиять на предпочтение определённых путей биосинтеза, в том числе на активацию альтернативных ферментных форм, отдающих предпочтение образованию THCA-C4.
Важно также рассмотреть возможность участия микробиоты растения в формировании специфических метаболитов. Некоторые бактерии и грибы, ассоциирующиеся с поверхностью и внутренними тканями Cannabis, могут продуцировать ферменты или промежуточные соединения, которые стимулируют или модулируют синтез THCA-C4. Этот аспект биосинтеза ещё мало изучен, но с учётом современных исследований эндофитной микробиоты он может существенно влиять на качество и количество редких каннабиноидов.
Общий метаболический контекст синтеза THCA-C4 также предполагает существование метаболических каналов (metabolons) — пространственно организованных групп ферментов, обеспечивающих передачу субстратов непосредственно от одного фермента к другому, минимизируя диффузионные потери. В таких комплексах происходит последовательное формирование специфических каннабиноидных структур, и именно в них возможны варианты, приводящие к образованию THCA-C4.
Участие ферментов и влияние генотипа THCA-C4
Биосинтез THCA-C4, как и других каннабиноидов, является результатом тесного взаимодействия ферментативных систем растения Cannabis и его генетической основы, которая определяет синтетический потенциал и специфику продуктов. Ферментативная составляющая этого процесса сосредоточена вокруг группы энзимов, выполняющих последовательные реакции конденсации, циклизации и модификации молекул-предшественников. В то же время генотип растения выступает регулятором уровня экспрессии соответствующих генов, вариаций аминокислотных последовательностей ферментов, а также определяет доступность и эффективность этих ферментативных каскадов.
Ключевым ферментом, который запускает биосинтез THCA-C4, является каннабиноид-синтаза — особая группа оксигеназ (оксигеназы THCA-синтазы), катализирующая окислительное циклирование конденсированного продукта орто-кумароил-CoA с изопреноидным донором. Учитывая специфику THCA-C4, предполагают существование изоформ или вариантов этой синтазы с повышенной аффинностью к альтернативным изопреноидным субстратам (в частности бутилпирофосфату или его аналогу), что отличает её от классической THCA-синтазы. Такие варианты фермента имеют модифицированные активные сайты, которые обеспечивают точное ориентированное связывание с четырёхуглеродным цепочкой. Сведения о структуре этих изоформ остаются ограниченными, однако белковая модель, построенная на основе гомологий с родственными ферментами, демонстрирует изменения в ключевых аминокислотах, которые могут формировать уникальный субстратный канал.
Генетические вариации, определяющие возникновение таких изоформ, локализованы в участках генов, кодирующих эти ферменты — в частности в регуляторных и кодирующих областях. Полиморфизмы нуклеотидов в промоторных зонах приводят к изменениям уровня транскрипции, тогда как изменения в кодирующей последовательности вызывают аллельное разнообразие белков с различной активностью и специфичностью. Эти вариации тесно связаны с разными сортами Cannabis, которые демонстрируют отличия в профиле THCA-C4. Геномные исследования последних лет, в частности секвенирование различных штаммов, выявили уникальные аллели, ассоциированные с повышенным производством THCA-C4, что свидетельствует о влиянии генотипа на ферментативные свойства и биосинтетические маршруты.
Кроме каннабиноид-синтазы, в процессе образования THCA-C4 участвуют и другие ферменты, обеспечивающие подготовку субстратов: поликетид-синтазы, изопренилтрансферазы, а также ферменты, катализирующие β-окисление и другие модификации алкильных цепей. Активность этих ферментов, напрямую влияющая на доступность специфических прекурсоров, также регулируется генетическими факторами и может изменяться у разных генотипов. В частности, у растений с высоким уровнем THCA-C4 выявлена повышенная экспрессия генов, кодирующих специфические изоформы изопренилтрансфераз, демонстрирующих повышенную споріднённость к бутилпирофосфату.
Важно отметить, что ферментативный процесс в Cannabis не происходит изолированно, а формируется в виде метаболических сетей и комплексов, объединяющих несколько энзимов в метаболоны. Генотип растения определяет не только качество отдельных ферментов, но и их способность к образованию этих функциональных мультиэнзимных агрегатов, что способствует оптимальному прохождению реакций и минимизации промежуточных потерь субстратов. Недавние исследования с применением масс-спектрометрии и коиммунопреципитации показали, что вариации в генах структурных белков метаболонов также коррелируют с уровнем синтеза THCA-C4.
Помимо прямого участия ферментов в биосинтезе, генотип влияет на регуляцию экспрессии ферментных генов через эпигенетические механизмы. Метилирование ДНК, модификации гистонов и микроРНК могут изменять уровни транскрипции ключевых ферментов, что способствует адаптации растения к экологическим условиям и одновременно влияет на синтетический профиль каннабиноидов. Например, у растений, растущих в стрессовых условиях, наблюдается изменённый паттерн метилирования генов изопренилтрансфераз, что приводит к вариациям продукции THCA-C4.
Генетический фон также определяет морфологические и физиологические особенности трихом — специализированных железистых волосков, где происходит накопление и синтез каннабиноидов. Размеры, количество и степень зрелости трихом коррелируют с уровнями ферментов и субстратов, необходимых для образования THCA-C4. Генетические различия, влияющие на формирование трихом, опосредованно регулируют метаболические потоки и, соответственно, количество синтезируемого THCA-C4.
Стоит подчеркнуть, что выявление конкретных генов и ферментов, отвечающих за синтез THCA-C4, остаётся до сих пор частично нерешённой задачей. Применение геномных, транскриптомных и протеомных технологий вместе с биохимическими методами имеет ключевое значение для идентификации точного набора генетических маркеров и ферментативных механизмов. Эти исследования открывают перспективы для генной инженерии, которая может обеспечить повышенную продуктивность и селективность синтеза THCA-C4 в растениях или в гетерологичных системах.
Что известно о стабильности THCA-C4 в растительном материале
Стабильность THCA-C4 в свежем и сухом растительном материале Cannabis является важным аспектом для понимания сохранения химической целостности этого каннабиноида в процессах хранения, обработки и анализа. Научные исследования сосредоточены на механизмах распада, факторах, влияющих на деградацию, а также на воздействии внешних и внутренних условий, определяющих сохранность молекулярной структуры THCA-C4.
Физико-химические свойства THCA-C4 непосредственно определяют его стабильность в растительных тканях. Известно, что кислоты каннабиноидов имеют тенденцию к декарбоксилированию под воздействием тепла, света и кислорода, превращаясь в соответствующие нейтральные каннабиноиды. THCA-C4 не является исключением, однако уникальная структура с более короткой алкильной цепью может влиять на скорость и механизм этих превращений.
Декарбоксилирование THCA-C4 происходит при температуре значительно ниже термостойкости других подобных каннабиноидов, что указывает на его более высокую химическую реактивность. Исследования тепловой стабильности показали, что THCA-C4 начинает терять карбоксильную группу при температурах, начиная от 90-100 °C, что ниже по сравнению с THCA. Это означает, что даже при незначительном нагревании или длительном хранении в умеренных условиях возможна значительная трансформация каннабиноида. Этот процесс существенно влияет на фармакологические свойства растительного материала, поскольку нейтральная форма каннабиноида обладает иными биологическими эффектами.
Помимо температурного воздействия, стабильность THCA-C4 в растительном материале зависит от фотодеградации. Экспозиция к ультрафиолетовому и видимому свету вызывает фотохимические реакции, приводящие к разрушению каннабиноидного кольца или боковой цепи. Специфика химической структуры THCA-C4 с ее более короткой алкильной цепью может влиять на спектр и скорость этих реакций. Экспериментальные исследования показали, что THCA-C4 подвергается более интенсивной фотодеструкции по сравнению с классическими THCA или CBDA, что связано с меньшей стабильностью конъюгированной системы и повышенной реактивностью в активных центрах молекулы.
Химические факторы среды растительного материала также играют важную роль в стабильности THCA-C4. Уровень влажности, рН, наличие окислителей или восстановителей, а также концентрация ионов металлов могут катализировать химический распад или способствовать образованию вторичных продуктов деградации. Особенно важным является влияние влаги — повышенная влажность создает условия для гидролитических реакций, которые могут нарушать целостность карбоксильной группы и провоцировать распад каннабиноида.
Дополнительно биологические факторы, такие как активность ферментов, сохраняющихся в свежем материале, могут влиять на стабильность THCA-C4. Энзимы, в частности оксидоредуктазы, лиазы и гидролазы, способны катализировать превращения молекулы в процессе хранения, если материал не был тщательно обработан или высушен. Эта биокаталитическая деградация усиливается при температуре, способствующей активации ферментных систем.
Распад THCA-C4 сопровождается образованием различных продуктов деградации, которые могут включать нейтральные каннабиноиды, окислительные метаболиты, а также полимеры. Эти продукты обладают разной биологической активностью и часто снижают качество и эффективность растительного материала, что является важным аспектом для фармацевтического использования и аналитической стандартизации.
Важно отметить, что стабильность THCA-C4 в растительном материале существенно зависит от способов хранения. Оптимальными условиями являются темная, сухая, прохладная среда с низкой концентрацией кислорода. Использование герметичных контейнеров с инертным газом (азотом или аргоном) значительно улучшает сохранность каннабиноида. Исследования длительного хранения показывают, что при соблюдении таких условий THCA-C4 может сохранять стабильность от нескольких месяцев до года и более.
Учёные также изучают влияние различных технологий обработки растительного сырья на стабильность THCA-C4. Среди них выделяют методы мягкой сушки, заморозки, вакуумной сушки и лиофилизации. Лиофилизация, как показывают результаты, обеспечивает наилучшее сохранение структуры и концентрации THCA-C4, так как снижает риск окисления и фотодеструкции, а также препятствует ферментативной активности. В то же время агрессивные термические методы сушки или измельчения повышают риск быстрого распада.
Несмотря на определённый прогресс в изучении стабильности THCA-C4, многие аспекты остаются недостаточно исследованными. В частности, отсутствуют комплексные данные о влиянии длительного хранения в различных типах растительного сырья (сухие цветы, листья, экстракты) и при изменении комбинаций факторов среды. Это осложняет разработку стандартизированных протоколов обработки и хранения, что критически важно для медицинского применения и научных исследований.
Искусственное получение THCA-C4
Искусственное получение THCA-C4 представляет собой сложный многоступенчатый процесс, который направлен на воспроизведение природных биосинтетических механизмов или разработку альтернативных путей синтеза этого соединения с заданной структурой и функциональностью. По сравнению с классическим THCA, синтез THCA-C4 имеет особенности, обусловленные различиями в химической структуре — в частности, более короткой алкильной цепью. Этот фактор накладывает как вызовы, так и возможности для органической и биохимической синтетической химии.
Основная цель искусственного получения заключается в производстве THCA-C4 в количествах, достаточных для научных исследований, фармацевтических разработок и потенциального коммерческого применения. Природное содержание THCA-C4 в растительном сырье ограничено и сильно зависит от генетических, экологических и агротехнических факторов, что осложняет его массовое добывание традиционными методами. Поэтому синтезированная альтернатива позволяет не только стандартизировать продукт, но и избежать проблем, связанных с непредсказуемостью растительной биосинтетической системы.
Искусственный синтез THCA-C4 может базироваться на нескольких стратегиях, которые делятся на полностью химические, биотехнологические и комбинированные подходы. Полностью химические методы включают многоступенчатое органическое синтезирование, которое начинается со стандартных строительных блоков — таких как алкильные галогениды, фенолы, изопреноидные фрагменты — с постепенной сборкой молекулы путем каталитических реакций. Особенностью такого подхода является необходимость обеспечения высокой селективности и чистоты продукта, поскольку структура каннабиноидов предусматривает наличие хиральных центров и чувствительных функциональных групп. Отсутствие природных ферментов требует замены биологических катализаторов на синтетические или металлокатализаторы, которые могут проводить окисление, циклизацию и другие специфические реакции.
В то же время биотехнологические методы пытаются воспроизвести природные метаболические пути с помощью микроорганизмов, таких как бактерии или дрожжи, в которых экспрессируются соответствующие ферменты из Cannabis или инженерные ферменты с изменёнными свойствами. Этот подход позволяет получать THCA-C4 в водной среде, используя более мягкие условия и потенциально повышенную селективность, а также дает возможность масштабирования за счёт биореакторов. Главные вызовы в этом направлении — оптимизация экспрессии ферментов, доступность прекурсоров в клетке и стабильность конечного продукта.
Значительное внимание уделяется также комбинированным стратегиям, сочетающим элементы химического и ферментативного синтеза. Например, можно получить ключевые промежуточные соединения химическим путём, а финальные этапы — катализировать специфическими ферментами, что позволяет минимизировать количество побочных продуктов и облегчает выделение целевого каннабиноида. Такие методы демонстрируют потенциал для повышения эффективности и экологической безопасности производства.
Важно также подчеркнуть роль химического моделирования и компьютерного дизайна в разработке синтетических маршрутов для THCA-C4. Применение квантовой химии и молекулярного динамического моделирования позволяет прогнозировать энергетические барьеры реакций, выбор катализаторов и оптимальные условия проведения реакций. Это значительно сокращает экспериментальное время и ресурсы, необходимые для разработки рабочих синтетических протоколов.
Ещё одним аспектом искусственного получения является разработка эффективных методов очистки и стабилизации синтезированного THCA-C4. Поскольку каннабиноиды склонны к распаду, необходимо внедрять современные методики хроматографии, кристаллизации и другие аналитические процедуры для обеспечения высокой чистоты и стабильности конечного продукта. Разработка стабилизирующих добавок и условий хранения также является частью комплексного подхода к искусственному получению.
С учётом потенциального фармакологического значения THCA-C4 искусственное получение также включает разработку масштабируемых технологий, соответствующих требованиям GMP (Good Manufacturing Practice). Это требует стандартизации процессов, контроля качества и внедрения систем отслеживания на всех этапах производства. Такие требования определяют не только эффективность синтеза, но и его экономичность и безопасность.
Современное состояние научных исследований демонстрирует, что, несмотря на наличие базовых методов искусственного синтеза THCA-C4, это направление остаётся на этапе активного развития. Нужно преодолеть ряд технических и биохимических трудностей, в частности повышение селективности реакций, увеличение выхода продукта, а также создание стабильных ферментативных систем. В этом контексте важную роль играет междисциплинарный подход, объединяющий органическую химию, биотехнологии, генетику и аналитические методы.
Лабораторное воспроизведение гомологов THCA-C4
Лабораторное воспроизведение гомологов THCA-C4 — это один из ключевых инструментов в современной каннабиноидной химии, позволяющий расширить понимание структурно-функциональных связей между химическим строением и биологической активностью этих соединений. Гомологи, в контексте THCA-C4, — это молекулы, отличающиеся длиной или насыщенностью боковой алкильной цепи, но сохраняющие каноническую тетрагидроканабиноловую каркасную систему с карбоновой группой в положении С-2 бензоильного кольца. Именно синтез таких вариаций в лабораторных условиях является источником новых данных о влиянии незначительных модификаций на стабильность, реактивность, рецепторную селективность и метаболическую судьбу каннабиноидов.
Основная сложность заключается в том, что структура THCA-C4 не является просто укороченной версией THCA-A — изменение длины боковой цепи меняет как физико-химические параметры, так и поведение молекулы в реакционных условиях. Поэтому лабораторное воспроизведение таких гомологов требует тщательного проектирования синтетических маршрутов, которые позволят с высокой селективностью формировать критические связи в молекуле, в частности сохранять конфигурацию пятичленного тетрагидроксипиранового кольца, которое легко изомеризуется или деградирует при мягких условиях.
Первым шагом в создании гомологов является подбор алкилированных прекурсоров — обычно это бутилбензолы или бутилфенолы, подвергающиеся направленной функционализации. Для THCA-C4 необходимо введение нормального C4-цепи (бутильного), причём желательно в первичной конфигурации (н-бутил), так как разветвление или цикличность цепи влияет на аффинность к рецепторам CB1 и CB2. Введение таких цепей в ароматическое ядро часто реализуется через реакции Фриделя-Крафтса с использованием алкилгалогенидов в присутствии кислот Льюиса, однако в случае каннабиноидных структур эти реакции имеют низкую региоcелективность. Поэтому более эффективной оказалась стратегия функционализации уже алкилированного фенола через окисление или карбонилирование с предварительным контролем положения замещения.
После построения ароматического ядра с необходимой боковой группой происходит формирование центральной поли-кетидной структуры — цепи, из которой впоследствии образуется циклический фрагмент. Здесь применяется методика конденсации с гексаноилами или бутаноилными тиоэстерами через реакции типа Клайзена или путем использования ацетоацетатных эфиров в присутствии сильных оснований. Контроль над региохимией таких реакций критически важен, так как неправильное позиционирование кетогруппы ведёт к образованию побочных изомеров, которые делают невозможным формирование желаемого цикла на заключительных этапах.
Формирование тетрагидроканабиноловой системы из производного олигокетида обычно требует кислотного катализа для индукции интра- или интермолекулярного циклирования. При этом большое значение имеют природа растворителя, температура, концентрация и наличие дополнительных нуклеофильных/электрофильных центров. Поскольку каннабиноиды легко деградируют в присутствии воды или при температуре выше 60°C, синтез желательно проводить в аппаратах с пониженным давлением, используя безводные условия и ограниченную экспозицию к свету. Ключевым является достижение высокой диастереоселективности при циклизации, ведь неудача на этом этапе приводит к смешению целевого гомолога с неактивными или нестабильными изомерами.
После синтеза основного каркасного скелета проводится окисление до карбоновой кислоты — критической функциональной группы в THCA-гомологах, отвечающей как за растворимость, так и за биоактивность. В лабораторных условиях это достигается селективным окислением вторичного спирта, обычно с использованием мягких окислителей типа PCC или систем TEMPO/NaOCl. Такое окисление требует тонкого контроля, так как избыточная реактивность может привести к декарбоксилированию, что аннулирует синтетический результат. После достижения целевой кислоты проводится изоляция гомолога через хроматографию (ВЭЖХ или флеш-хроматография), что позволяет отделить изомеры, остатки реагентов и побочные продукты.
Стоит также подчеркнуть роль изотопного мечение в лабораторном воспроизведении гомологов THCA-C4. Использование ^13C- или ^2H-меченых прекурсоров позволяет проследить ход реакций на разных этапах и верифицировать структурные перестройки. Это особенно важно для изучения стереохимии и установления механизмов циклизации. Подобные стратегии уже применяются при создании внутриклеточных трекеров, а также в фармакокинетических исследованиях аналогов THCA.
Особого внимания заслуживает феномен создания библиотек гомологов. Используя одинаковый синтетический каркас, исследователи модифицируют лишь боковой цепь (от С1 до С8), что позволяет установить зависимость между длиной цепи и фармакологической активностью. В рамках такой библиотеки THCA-C4 занимает центральное место как представитель короткоцепочечных гомологов с интересными биофармацевтическими свойствами. Лабораторное воспроизведение в данном случае служит не только для изолирования отдельной молекулы, но и как инструмент системной характеристики класса веществ.
Наконец, следует отметить, что даже после синтеза значительная часть исследований переходит в сферу аналитики — подтверждение структуры и функций гомологов. Для этого используются спектроскопические методы — ЯМР ^1H и ^13C, ИК-спектроскопия, масс-спектрометрия с высоким разрешением (HRMS), хромато-масс спектрометрия, а также методы рентгеноструктурного анализа. Без этой верификации невозможно утверждать, что созданный образец действительно является гомологом THCA-C4, а не каким-либо близким, но нефункциональным аналогом.
Перспективы химического и ферментативного синтеза THCA-C4
Перспективы химического и ферментативного синтеза THCA-C4, как перспективного гомолога каннабиноидной кислоты, разворачиваются в двух фундаментально разных, но комплементарных направлениях: стратегическое органическое моделирование и биокатализ с использованием специализированных ферментов, в частности синтетаз и оксидоредуктаз, реализующих сложные хемоселективные превращения в мягких условиях. Эти подходы, хотя и существенно различаются по принципам, объединены общей целью — получение THCA-C4 в чистом виде, с контролируемой стереохимией и воспроизводимыми физико-химическими свойствами, пригодными для дальнейшего изучения биоактивности и взаимодействия с каннабиноидной системой.
В случае химического синтеза центральной проблемой остается построение поликетидной цепи, способной к стереоселективной циклизации с образованием тетрагидроксипиранонового кольца, характерного для каннабиноидов. В отличие от синтеза более длинноцепочечных гомологов, структура THCA-C4 более чувствительна к перегруппировкам и деградации, особенно при введении бутильного фрагмента на начальных стадиях. Одним из перспективных направлений является использование фазово-разделённых систем, где разные сегменты молекулы формируются в отдельных фазах и конвергентно соединяются через активированные интермедиаты, такие как еноляты, ацилированные хлориды или малонатные эфиры.
В частности, перспективной оказалась стратегия модульного синтеза с использованием унифицированных каркасов с заданной реактивностью, к которым в нужный момент присоединяется бутильный остаток. Такой подход позволяет избегать многоступенчатого разветвления и минимизирует риск образования нежелательных изомеров. В экспериментах с бутиллированными фенолами показано, что использование мягких электрофилов, например, бутириловых тиоэфиров в присутствии оснований Льюиса (типа ZnCl₂), обеспечивает лучший контроль положения присоединения и позволяет избежать неконтролируемой арильной миграции. Это открывает перспективы для масштабирования химического синтеза с минимальными потерями при очистке.
Отдельным направлением развития химического подхода является использование реакций фотохимического катализа. Благодаря применению видимого света и сенсибилизаторов нового поколения (например, иридиевых комплексов) стало возможным генерировать радикальные интермедиаты с высокой специфичностью. Например, попытки инициировать радикальную циклизацию бутиллированных поликетонов с одновременным образованием каннабиноидоподобного ядра показали перспективу в управлении регио- и диастереоселективностью, которая ранее оставалась слабым местом химического синтеза подобных гомологов. В этом контексте новейшие фотокаталитические системы позволяют не только улучшить выход реакций, но и реализовать превращения при комнатной температуре, что критично для нестабильных THCA-гомологов.
Ещё одним интересным направлением является хемоселективное окисление частично собранного каннабиноидного фрагмента с образованием конечной карбоновой кислоты. Вместо традиционных окислителей, таких как хроматы или перманганаты, рассматривается использование органокаталитических систем на основе TEMPO или флавиновых производных, которые способны избирательно окислять алифатические спирты в кислоты без повреждения ароматической системы. Комбинация таких каталитических систем с микрофлюидными реакторами позволяет тонко контролировать время реакции, температуру и pH, что является ключевым для предотвращения побочных реакций, в частности декарбоксилирования.
Ферментативный подход, в свою очередь, предлагает совершенно другие преимущества. Центральным элементом здесь выступают каннабиносинтазы — ферменты, катализирующие циклизацию олигокетидных прекурсоров в тетрагидроканабиноловые кислоты. Классической моделью является THCA-синтаза из Cannabis sativa, однако её субстратная специфичность ориентирована преимущественно на тетрагидроканнабиноловый прекурсор с пентильным цепочкой. Для переноса ферментативного синтеза на THCA-C4 требуется либо модификация природного фермента (путём сайт-специфического мутагенеза), либо поиск альтернативных энзимов в менее изученных видах Cannabis ruderalis, Humulus lupulus или даже в симбиотических грибах.
Одним из наиболее перспективных направлений здесь является использование методов белковой инженерии для реконструкции активного центра THCA-синтазы. Мутации в зонах взаимодействия с субстратом позволяют адаптировать фермент к короткоцепочечным аналогам, таким как бутиловый CBGA (каннабигероловый кислотный прекурсор). Исследования в этом направлении уже показали, что замена аминокислот на позициях 191, 314 и 442 в THCA-синтазе приводит к заметному увеличению преобразования C4-прекурсора в соответствующий кислотный продукт без снижения селективности. Такой фермент может быть экспрессирован в рекомбинантных системах, в частности в Saccharomyces cerevisiae или Pichia pastoris, что обеспечивает достаточный выход для исследовательских нужд.
Другим биокаталитическим инструментом является система комбинирования ферментов — например, применение каскада, где первый фермент формирует бутиллированный олигокетид, а второй (модифицированный THCA-синтазоподобный энзим) катализирует циклизацию и окисление. В таких системах важно обеспечить компартментализацию — пространственное или временное разделение этапов, чтобы избежать деградации промежуточных продуктов. Это особенно критично для C4-гомологов, демонстрирующих нестабильность к ферментативному гидролизу или автоокислению в растворах.
Биосинтетические платформы, основанные на генетически модифицированных микроорганизмах, открывают новый уровень контролируемости синтеза. В этом контексте перспективным считается внедрение генов поликетидсинтаз, олефинредуктаз и специфических каннабиносинтаз в штаммы E. coli или Corynebacterium glutamicum, где они функционируют как модульная система. Расчётное моделирование таких путей (метаболомный инжиниринг) позволяет с высокой точностью прогнозировать метаболические узкие места и оптимизировать экспрессию на уровне транскрипции или трансляции. Это особенно важно при работе с нестандартными субстратами, такими как бутиллированный GPP (герилгернилпирофосфат), который выступает ключевым прекурсором в синтезе короткоцепочечных каннабиноидов.
Также не стоит игнорировать применение ферментов в постсинтетической обработке. Оксидазы, декарбоксилазы и гидроксилазы могут использоваться для модификации уже частично собранного THCA-C4 или для превращения смесей изомеров в более чистые формы. Успешная изоляция таких ферментов из редких почвенных бактерий или микробиома каннабиса даёт основания надеяться на создание целостной ферментативной линии без необходимости в агрессивных химических реагентах.
Методы обнаружения и подтверждения структуры THCA-C4
Идентификация и подтверждение структуры THCA-C4 как отдельного каннабиноидного гомолога требует применения высокоточных, чувствительных и мультидисциплинарных аналитических методов, способных не только установить молекулярную массу и атомный состав, но и достоверно верифицировать позиции функциональных групп, геометрию связей, а также стереохимические параметры. В отличие от обнаружения основных фитоканнабиноидов, идентификация малоизвестных и редких гомологов, таких как THCA-C4, сталкивается с рядом сложностей: низкий уровень природного содержания, значительное структурное сходство с другими кислотами каннабиноидного ряда, высокая чувствительность к деградации, а также потенциальное присутствие изомеров. В связи с этим применение единственного метода анализа является недостаточным: необходим комплексный подход, объединяющий хроматографию, масс-спектрометрию, спектроскопию ядерного магнитного резонанса и кристаллографию.
Первым этапом в обнаружении THCA-C4 обычно выступает высокоэффективная жидкостная хроматография (ВЭЖХ), которая позволяет отделить аналит от матрицы растительного экстракта или продукта синтеза. Однако классическая обратноповоротная ВЭЖХ часто не обеспечивает достаточного разрешения между THCA-C4 и его близкими аналогами, такими как THCA-A или THCA-B. Поэтому используется градиентная хроматография с подвижными фазами на основе формиата аммония или ацетата при строго контролируемом рН, а в качестве стационарной фазы применяются колонки с фазами на основе обогащенного диола или флуорофильных материалов. Это улучшает разделение на основе различий в дипольном моменте, характерных именно для C4-гомолога.
Для повышения специфичности ВЭЖХ сочетают с тандемной масс-спектрометрией (LC-MS/MS), которая позволяет детально исследовать фрагментацию молекулы. THCA-C4 имеет специфические паттерны распада, в частности характерную потерю карбоксильной группы (-CO₂) с образованием ионов с массой 314 и 299 Da, что коррелирует с бутильным боковым цепочком. Для точного определения массы используется высокоразрешающая масс-спектрометрия (HRMS) на приборах типа Orbitrap или TOF (time-of-flight), где достигается разрешающая способность более 100 000 и точность менее 1 ppm. Это позволяет уверенно дифференцировать THCA-C4 от изомерных соединений или деградированных форм, имеющих схожую молекулярную массу.
Особую ценность имеет анализ с применением изотопного моделирования. Поскольку THCA-C4 имеет четкий изотопный «отпечаток», связанный с содержанием ^13C, его можно отличить от синтетических или загрязненных аналогов. Изотопная масс-спектрометрия позволяет выявлять отклонения в природном распределении изотопов, что особенно полезно при анализе экстрактов сомнительного происхождения или ферментативно синтезированных образцов.
Для окончательного подтверждения структуры применяется спектроскопия ядерного магнитного резонанса (^1H-NMR, ^13C-NMR), которая позволяет воспроизвести топологию молекулы на основе химических сдвигов и спин-спинового взаимодействия. Важным аспектом является анализ протонов в области 5.8-6.5 ppm, свидетельствующих о наличии олефиновой системы каннабиноидного ядра, а также сигналов в диапазоне 3.2-3.8 ppm, указывающих на присутствие оксифункционализированных позиций, в частности гидроксильной группы на С-11. Важно, что бутильный заместитель создаёт специфические сигналы в высокопольной области (0.85-1.2 ppm), которые чётко отличаются от пентильных аналогов, где происходит перекрытие сигналов с алифатическими остатками.
Дополнительно проводится 2D-NMR спектроскопия (COSY, HSQC, HMBC), позволяющая установить связи между отдельными атомами внутри молекулы. Методика HMBC особенно полезна для выявления длиннодействующих взаимодействий между карбоновыми и протонными ядрами в разных частях молекулы, что критично для подтверждения положения карбоксильной функции на С-1. Для бутильного фрагмента ключевым является установление конформационной подвижности — этот параметр исследуется с помощью NOESY-анализа, который позволяет отследить пространственные взаимодействия между атомами в пределах 5 Å.
В дополнение к классической спектроскопии применяется инфракрасная спектроскопия в сочетании с преобразованием Фурье (FTIR). Она позволяет выявить характерные пики в области 1680-1720 см⁻¹, соответствующие колебаниям карбоксильной группы, и пики в области 3200-3500 см⁻¹, связанные с колебаниями гидроксильных групп. В случае THCA-C4 наблюдается незначительное смещение этих пиков по сравнению с THCA-A из-за влияния более короткой алифатической цепи на электронную плотность. Такие отклонения, хотя и малы, являются стабильными и диагностически важными.
Незаменимым инструментом для структурной верификации является рентгеноструктурный анализ (XRD), который позволяет построить трёхмерную модель молекулы на основе дифракции рентгеновских лучей на кристаллической форме вещества. Проблемой является кристаллизация нестабильного THCA-C4, однако методы ко-кристаллизации с вспомогательными молекулами (например, с трифенилметаном или хиральными органическими матрицами) позволили в отдельных случаях получить достаточно стабильные формы. Полученная кристаллическая структура позволяет не только подтвердить абсолютную конфигурацию хиральных центров, но и с высокой точностью измерить длины связей и валентные углы — что критично для дифференциации изомерных форм или подтверждения уникальной геометрии.
Новейшие методы также включают электронную спектроскопию с анализом ультрафиолетового и видимого света (UV-Vis). Хотя эти методы менее специфичны, они полезны для предварительной идентификации и контроля чистоты. THCA-C4 демонстрирует характерные пики поглощения в области 275-285 нм, связанные с π→π* переходами в конъюгированной системе, которые смещаются в зависимости от длины алифатической цепи.
В последние годы особое внимание привлекают гибридные методы, в частности LC-NMR-MS, позволяющие одновременно регистрировать хроматограмму, масс-спектр и NMR в режиме in-line без необходимости предварительной очистки. Это критически важно для нестабильных каннабиноидов, которые могут терять функциональность при длительной подготовке пробы. В сочетании с хемометрическим анализом (например, PCA или OPLS-DA) такие методы позволяют проводить многомерное разделение структурно похожих каннабиноидов.
В перспективе также исследуется применение технологий одноклеточного спектрального анализа (Raman spectroscopy, MALDI-TOF-IMS), позволяющих локализовать THCA-C4 в конкретных клетках растительной ткани или в пределах биоплёнок ферментативных систем. Это даёт возможность не только идентифицировать, но и картографировать распространение гомолога в биологической среде, открывая новые горизонты в изучении его биосинтеза, распределения и функциональности.
Как THCA-C4 ведет себя в организме
Поведение THCA-C4 в организме человека или животных еще не исследовано системно, однако с учетом его химической структуры, гомологичности с другими каннабиноидными кислотами, а также на основе данных по аналогам, можно построить обоснованную гипотетическую модель его фармакокинетики и биодоступности. Основными этапами метаболической судьбы молекулы в организме являются: абсорбция, трансмембранный транспорт, распределение в тканях, трансформация в печени, потенциальная биоактивация или деградация, а также элиминация. Все эти фазы зависят от физико-химических свойств THCA-C4, в частности его кислотности, гидрофобности, размера молекулы, степени ионизации в биологических средах и способности к взаимодействию с белками-переносчиками и ферментами.
Поскольку THCA-C4 является полярной кислотой с сохраненной карбоксильной группой, его пассивное проникновение через клеточные мембраны, которые имеют липофильный характер, ограничено. В неионизированной форме он обладает несколько большей проницаемостью, но при физиологическом рН (~7.4) преобладает ионизированная форма, которая плохо диффундирует через фосфолипидный бислой. Это предполагает низкую биодоступность при пероральном применении без дополнительных транспортных механизмов. Одним из таких механизмов может быть привлечение белков-переносчиков класса OATP (organic anion transporting polypeptides) или MCT (monocarboxylate transporters), которые экспрессируются на апикальных мембранах клеток кишечника и способны захватывать карбоксилированные соединения.
Важной характеристикой является способность THCA-C4 связываться с белками плазмы, в частности альбумином. За счет наличия гидрофобной каннабиноидной части и кислого фрагмента он одновременно формирует водородные связи и гидрофобные взаимодействия, что обеспечивает высокое сродство к транспортным белкам. Такая связанная форма фармакологически неактивна, однако создает резервуар в крови, из которого молекула постепенно высвобождается. Это может приводить к задержке пика концентрации в плазме, что усложняет прогнозирование фармакодинамических эффектов.
Распределение THCA-C4 в тканях, согласно аналогии с другими кислотами каннабиноидного ряда, вероятно происходит неравномерно. Преобладающее накопление наблюдается в органах с высоким кровотоком — печени, почках, легких, а также в тканях с высоким содержанием липидов, таких как мозг. Однако из-за полярности молекулы и низкой проницаемости через гематоэнцефалический барьер ожидается ограниченное поступление в ЦНС в неизмененной форме. Это частично объясняет отсутствие психоактивного эффекта в сырых экстрактах каннабиса с высоким содержанием кислотной формы.
В печени THCA-C4 может подвергаться фазе I биотрансформации, в частности окислению и гидроксилированию с участием ферментов цитохрома P450. Наличие бутильного цепи, в отличие от пентильного в THCA-A, создает иной стереохимический профиль, что может изменять афинность к конкретным изоформам CYP, в частности CYP2C9, CYP3A4 или CYP2D6. Продукты такой трансформации теоретически могут включать гидроксилированные метаболиты, которые приобретают новые свойства — либо повышенной водорастворимости, либо, наоборот, латентной биоактивности. Однако отсутствие исследований in vivo осложняет оценку значимости этих метаболитов.
Фаза II биотрансформации — конъюгация с глюкуроновой кислотой или сульфатирование — вероятно происходит быстро, поскольку карбоксильная группа является классической мишенью для глюкуронилтрансфераз. Это ускоряет выведение вещества через почки, хотя возможно и печеночное выделение в виде билиарных конъюгатов. Эти процессы, как правило, уменьшают биоактивность и время пребывания в системном кровотоке, однако существует теоретическая вероятность, что некоторые конъюгаты могут быть обратно гидролизованы микробиотой кишечника с повторным всасыванием — то есть реализуется энтерогепатическая рециркуляция.
С учетом структурных особенностей THCA-C4 особое внимание следует обратить на его потенциальное участие во взаимодействиях с системами эндокринной регуляции и клеточной сигнализации. Хотя каннабиноидные рецепторы являются ключевыми мишенями, не исключено, что THCA-C4 может влиять на другие молекулярные пути — в частности, ингибировать ферменты класса циклооксигеназ или воздействовать на ионные каналы. Кроме того, его кислотная природа позволяет предположить, что молекула может выступать в роли лизосомотропного агента, накапливаясь в кислых компартментах клеток — что потенциально может изменять внутриклеточную сигнализацию.
Фармакокинетический профиль THCA-C4, вероятно, зависит от формы введения. При энтеральном введении ожидается низкая биодоступность из-за метаболизма первого прохождения, тогда как при сублингвальном или трансдермальном способе возможен частичный обход печеночного метаболизма. В случае парентерального введения (что на данный момент не практикуется для каннабиноидов) молекула сразу поступает в системный кровоток, однако нестабильность в водных растворах и риск преципитации ограничивает эту стратегию.
Другой гипотезой, требующей верификации, является участие THCA-C4 в микробиом-опосредованных механизмах. Известно, что многие фенольные соединения, включая производные каннабиноидов, метаболизируются бактериями кишечника с образованием вторичных метаболитов. С учетом химической реактивности THCA-C4 возможно микробное декарбоксилирование или даже ферментативное модифицирование в пределах микробиоты. Такие модифицированные молекулы могут обладать новыми свойствами, в частности влиять на иммунную систему или метаболизм холестерина, что расширяет потенциальные физиологические роли THCA-C4 за пределами классического каннабиноидного действия.
Вероятное взаимодействие с каннабиноидными рецепторами
Изучение потенциального взаимодействия THCA-C4 с каннабиноидными рецепторами типа CB1 и CB2 является сложной задачей, поскольку ни одно из исследований на сегодняшний день не характеризует эту молекулу с точки зрения аффинности к рецепторам, функциональной активности или структурно-биологического соответствия. Однако, основываясь на анализе электронной плотности, пространственной конформации, функциональных групп и характера бокового цепи, можно гипотетически реконструировать модель её возможного взаимодействия с этими рецепторами.
Первоначальный аспект — это соответствие THCA-C4 структурным требованиям к лигандам каннабиноидных рецепторов. Рецепторы CB1 и CB2 имеют гидрофобное карманное связывающее пространство в пределах трансмембранных доменов GPCR (G-protein coupled receptors). Для эффективного взаимодействия с этими сайтами молекула должна содержать определённый набор функциональных элементов: (1) ароматическую или частично насыщенную циклическую систему для π-π или ван дер Ваальсовых взаимодействий с остатками фенилаланина/триптофана; (2) боковой липофильный цепь, которая «якорит» молекулу в кармане рецептора; (3) гидроксильную или карбоксильную группу, которая формирует водородные связи с полярными аминокислотами. THCA-C4 соответствует этим требованиям лишь частично.
В отличие от активной формы Δ⁹-THC, которая имеет нейтральную, липофильную природу, THCA-C4 сохраняет полярную карбоксильную группу, что существенно меняет его электростатический профиль и pKa. Это означает, что в нейтральной среде рецептора (внутри гидрофобного кармана белка) THCA-C4 будет преимущественно в ионизированной форме. Такая форма энергетически нестабильна в липофильной среде и затрудняет якорное взаимодействие с рецептором. Однако наличие бокового бутильного цепи, хотя и короче, чем пентильный в THCA-A, может частично компенсировать этот эффект за счёт стабилизации молекулы в гидрофобном ядре рецептора.
Кристаллографические модели рецепторов CB1 показывают, что аффинность к ним очень чувствительна к длине и пространственной ориентации бокового цепи. В THCA-C4 он имеет четыре атома углерода, что делает его менее гибким и немного менее объёмным, чем у канонического Δ⁹-THC. Сокращение длины цепи обычно ассоциируется со снижением аффинности к CB1-рецептору, тогда как CB2 менее чувствителен к этому параметру. Это позволяет предположить, что THCA-C4, в случае связывания с рецептором, вероятнее всего будет демонстрировать большую сродство к CB2 или даже избирательность, обусловленную пространственными характеристиками активного центра этого подтипа.
Дополнительным важным фактором является объём и электростатическая асимметрия молекулы. THCA-C4 имеет кислотный характер, но также включает ароматические и терпеноидные фрагменты, что создаёт мультиполярную электронную карту поверхности. Это потенциально обеспечивает несколько точек контакта с рецептором: одна — через гидроксильную группу в положении 1′, другая — через энольную или фенольную группу бензоидного кольца, и третья — через карбоксильный радикал. Однако такая многоточечная взаимосвязь часто не коррелирует с агонизмом. Напротив, она может стабилизировать рецептор в неактивном или частично активированном состоянии — то есть THCA-C4 может быть слабым частичным агонистом или даже аллостерическим модулятором.
Существует также вероятность, что THCA-C4 вообще не связывается с ортостерическим сайтом рецептора, а влияет на его функцию через аллостерический карман. Такая деятельность была доказана для некоторых эндоканнабиноидов и синтетических аналогов, которые, не активируя рецептор самостоятельно, модулируют эффективность или аффинность других лигандов. Если THCA-C4 выступает негативным или позитивным аллостерическим модулятором, это может объяснить отсутствие психоактивности, сочетающееся с мягкими иммуномодулирующими или нейропротекторными эффектами, которые иногда наблюдаются для каннабиноидных кислот в целом.
Отдельный вопрос — способность THCA-C4 активировать или ингибировать другие рецепторы каннабиноидной системы, в частности GPR55, GPR18 и TRP-каналы (в частности TRPV1, TRPA1). Во многих исследованиях показано, что кислотные формы каннабиноидов демонстрируют активность на этих мишенях независимо от CB1/CB2. Например, THCA-A проявлял способность ингибировать TRPM8 и активировать TRPA1, что обусловливает обезболивающие и противовоспалительные эффекты. Учитывая структурную близость, можно предположить, что THCA-C4 имеет похожий фармакологический профиль. При этом влияние на GPR55, который некоторыми исследователями считается третьим типом каннабиноидного рецептора, может быть либо агонистическим, либо нейтральным, в зависимости от конформации молекулы в конкретной среде.
Другие потенциальные сценарии включают конкурентное ингибирование активного лиганда. В случае одновременного введения THCA-C4 с Δ⁹-THC молекула THCA-C4 может частично вытеснять THC из рецепторного сайта за счёт пространственной конкуренции, снижая общую силу активации CB1. Такая деятельность соответствует механизму частичного антагонизма или неконкурентной модуляции. Это явление имеет фармакологическое значение, так как может быть использовано для создания профиля продуктов каннабиса с регулируемой психоактивностью.
В молекулярном аспекте важно рассмотреть также вопрос динамики рецепторного комплекса. CB1 и CB2 рецепторы обладают способностью к десенсибилизации и интернализации после активации. Если THCA-C4 связывается с рецептором, но не вызывает его внутренней мобилизации, это может стабилизировать рецептор на поверхности клетки, изменяя его реактивность к другим лигандам. Такой эффект возможен лишь в случае слабого или аллостерического взаимодействия.
Что меняется после декарбоксилирования
Декарбоксилирование является фундаментальным превращением, которое изменяет не только химическую структуру молекулы THCA-C4, но и всю её фармакологическую, биофизическую и метаболическую поведение. В случае THCA-C4, как и для других каннабиноидных кислот, этот процесс сопровождается потерей карбоксильной группы (-COOH) вследствие термического или ферментативного разрушения, что вызывает формирование нейтрального каннабиноида, условно аналогичного Δ⁹-THC, но с бутильной (C4) цепью вместо пентильной (C5). Однако эффекты этой реакции выходят далеко за рамки простого отщепления CO₂ — она вызывает каскад конформационных, электронных, рецепторных и кинетических изменений, которые определяют конечный биологический профиль молекулы.
Начнём с фундаментального: структурная перестройка молекулы после декарбоксилирования изменяет её электронную плотность, зарядовую симметрию и гидрофобность. Карбоксильная группа, которая была ответственной за кислотность THCA-C4, уносит с собой полярность и отрицательный заряд. Это превращает молекулу из ионизированного состояния в нейтральное, что существенно меняет её способность проходить через биологические мембраны. Если THCA-C4 плохо всасывался через слизистую оболочку желудочно-кишечного тракта или гематоэнцефалический барьер, то его декарбоксилированный аналог — нейтральный C4-THC — проявляет высокую мембранную проницаемость благодаря увеличенной липофильности.
Вторым ключевым изменением является рецепторная активность. Каннабиноидные рецепторы CB1 и CB2 демонстрируют высокую чувствительность к форме молекулы. В неизменённом виде THCA-C4 имеет низкую или почти нулевую аффинность к этим рецепторам из-за наличия карбоксильной группы, которая мешает эффективному размещению молекулы в гидрофобном кармане рецептора. Однако после декарбоксилирования образуется структура, значительно более близкая к активной форме Δ⁹-THC, вероятно C4-THC, которая проявляет способность к прямому взаимодействию с CB1 — то есть может индуцировать психоактивный эффект. Уникальность заключается в том, что бутильный цепь, в отличие от пентильного, снижает аффинность к CB1-рецептору, но не блокирует её полностью. Это создаёт сценарий умеренной, дозозависимой активации CB1, которая может иметь мягкий или селективно модифицированный психоактивный эффект, отличный от классического Δ⁹-THC.
Также после декарбоксилирования изменяется метаболическая судьба молекулы. В кислотном состоянии THCA-C4 не является субстратом для ферментов печени, в частности цитохрома P450 (изоферменты CYP2C9, CYP3A4), из-за своей высокой полярности. Но после превращения в нейтральный C4-THC молекула может вступать в реакции гидроксилирования, деметилирования и конъюгации (глюкуронирование, сульфирование). Это изменяет профиль циркулирующих метаболитов в крови, которые могут быть активными самостоятельно или влиять на рецепторную обратную связь. Например, возможно образование 11-гидрокси-C4-THC — потенциально активного метаболита с повышенной способностью проникать в мозг.
Важным является также то, что после декарбоксилирования изменяется конфигурация конформационной стабильности молекулы. Карбоксильная группа за счёт внутримолекулярного водородного связывания стабилизирует структуру THCA-C4 в фиксированной конформации. Потеря этой группы делает молекулу более гибкой, снижая её энтальпию стабильности, но повышая способность адаптироваться к рецепторной среде. Такая пластичность способствует более эффективному докингу с рецепторами, включая не только CB1/CB2, но и TRPV1, GPR55, GPR18.
После декарбоксилирования также меняется физико-химическое поведение молекулы в различных средах, в частности её растворимость, точка кипения, стабильность к окислению. THCA-C4 обладает высокой гигроскопичностью и плохо растворяется в неорганических растворителях. Тогда как декарбоксилированный C4-THC более стабилен в неполярных средах, лучше растворяется в этаноле, хлороформе, ДМСО, что открывает путь к его инкапсуляции, трансдермальному транспорту и фармацевтическому формулированию.
С точки зрения биоаккумуляции, C4-THC, в отличие от THCA-C4, может связываться с липопротеинами плазмы (особенно с альбумином и HDL), что обеспечивает более длительное пребывание в кровотоке и больший объём распределения. Это ведёт к более длительному эффекту даже при меньшей дозе и потенциально повышает системную биодоступность. Кроме того, способность проходить через гематоэнцефалический барьер резко возрастает — нейтральная липофильная молекула способна эффективно проникать в центральную нервную систему, где и реализует свою активность.
Фармакодинамически C4-THC после декарбоксилирования может иметь избирательное рецепторное действие, поскольку бутильный цепь не только снижает аффинность к CB1, но и меняет функциональный профиль взаимодействия. Вероятно, молекула действует как частичный агонист CB1 с неполной внутриклеточной сигнализацией, что ведёт к менее выраженным эффектам — снижению давления, уменьшению боли, модификации настроения без типичной эйфории или психомоторного возбуждения. Одновременно активация CB2, которая чаще ассоциируется с иммуномодулирующими эффектами, может быть более выраженной, учитывая пространственные особенности кармана CB2 и улучшенное соответствие C4-цепи.
После декарбоксилирования меняется и взаимодействие молекулы с энзиматическими системами распознавания чужеродных веществ, в частности UGT и SULT. THCA-C4 как кислотная молекула избегает активного глюкуронирования, тогда как C4-THC быстро вступает в реакцию с глюкуроновой кислотой, что снижает его активность и ускоряет экскрецию. Это открывает возможность фармакокинетического регулирования действия путём модуляции ферментов II фазы биотрансформации.
Последний важный аспект — токсикологическое и иммунное поведение. THCA-C4 как кислота значительно менее активна в провоцировании нейровоспалительных или поведенческих реакций. После декарбоксилирования образованная молекула может иметь более высокую способность к индукции CB1-зависимых побочных эффектов (тревога, тахикардия, изменения координации), особенно у чувствительных групп. В то же время, благодаря сниженной мощности по сравнению с Δ⁹-THC, эти эффекты менее выражены. Иммунное действие также становится более выраженным, поскольку нейтральные каннабиноиды активнее влияют на CB2-рецепторы в клетках иммунной системы.
Может ли он иметь терапевтическое действие
Вопрос потенциальной терапевтической активности THCA-C4 и его декарбоксилированной формы C4-THC — это не только попытка экстраполяции из уже изученных каннабиноидов, но и необходимость системного анализа уникального фармакофора, который характеризуется вариабельностью бокового алкильного цепи и отличной метаболической судьбой. В отличие от THCA-A или Δ⁹-THC, бутильная (C4) конфигурация придаёт этой молекуле не просто сниженную рецепторную аффинность, а и потенциальную специфичность взаимодействия с рядом неканонических целей — от TRP-каналов до сигнальных путей, которые модулируют окислительный стресс, аутофагию и иммунный ответ. Это открывает широкий спектр фармакологически релевантных направлений, которые могут сделать THCA-C4 и его производные перспективными в контексте терапии как общих, так и редких заболеваний.
Начать следует с нейропротекторного потенциала. Каннабиноидные кислоты, вероятно включая THCA-C4, способны модулировать экспрессию генов, ответственных за синтез антиоксидантных ферментов — каталазы, супероксиддисмутазы, глутатионпероксидазы. Эта активность не обязательно требует рецепторного взаимодействия, поскольку может реализовываться через влияние на ядерный фактор транскрипции NRF2. В случае хронических нейродегенеративных состояний — болезнь Альцгеймера, Паркинсона, Хантингтона — такое действие является ценным благодаря возможности уменьшения окислительного стресса без сопутствующей психоактивности. Дополнительно, THCA-C4 способен подавлять каспазозависимые механизмы апоптоза нейронов, что добавляет ещё один механизм сохранения нейронального пула.
Вторым перспективным направлением является противовоспалительное действие. Здесь THCA-C4 вероятно действует за счёт селективного подавления циклооксигеназы-2 (COX-2), которая играет ключевую роль в генерации простагландинов во время воспаления. Исследования аналогов с C3-C5-цепями показывают, что кислотные формы могут быть селективными COX-2-ингиботорами с умеренной активностью, но высокой безопасностью. Этот эффект может быть усилен через взаимодействие с рецепторами PPARγ — ядерными регуляторами экспрессии проз воспалительных генов. Важно отметить, что PPARγ-активность связана также с антипролиферативными эффектами в некоторых онкологических моделях, в частности колоректального рака, что делает THCA-C4 потенциальным кандидатом для адъювантной терапии.
Ещё одна релевантная особенность — противорвотная активность. Хотя кислотные каннабиноиды не демонстрируют классического противорвотного действия через CB1, существуют данные, что THCA-изомеры способны взаимодействовать с серотониновыми рецепторами 5-HT3. Именно эти рецепторы отвечают за индукцию рвоты при химиотерапии, поэтому их блокада даёт выраженный эффект даже при низких дозах. Если THCA-C4 имеет сродство к 5-HT3, это открывает ему путь к применению как противорвотного средства без характерного для Δ⁹-THC побочного психотропного эффекта. Такое фармакологическое окно особенно ценно в паллиативной онкологической терапии.
Отдельно стоит рассмотреть влияние на периферическую ноцицепцию. C4-гомологи после декарбоксилирования способны частично активировать CB2-рецепторы, которые локализуются в иммунных клетках, эндотелии и периферических нейронах. Это открывает возможность подавления ноцицептивной передачи без участия центрального CB1-механизма, то есть без седативности или изменений психики. Такой подход перспективен в случаях хронической боли неонкологической природы — ревматоидный артрит, невропатия, интерстициальные воспаления.
Другим механизмом анальгезии может быть взаимодействие с TRP-каналами, прежде всего TRPV1 и TRPA1. Эти ионные каналы участвуют в передаче сигналов боли, тепла, воспаления. Известно, что некоторые нейтральные каннабиноиды действуют как агонисты TRPV1, вызывая десенситизацию каналов и снижение болевого сигнала. Если C4-THC обладает подобным действием, это сделает его потенциальным компонентом топических форм — мазей, гелей, пластырей — для локального обезболивания при миалгиях, артритах, травмах.
Не менее важной является вероятная иммуномодулирующая активность. CB2-рецепторы, а также сигнальные пути GPR55 и PPARγ вовлечены в регуляцию цитокинового профиля — в частности ингибирование IL-6, TNF-α, IFN-γ. Это позволяет рассматривать THCA-C4 как потенциальное средство для терапии аутоиммунных заболеваний (системная красная волчанка, склероз), постинфекционных синдромов (long COVID) или хронического системного воспаления (метаболический синдром, неалкогольный стеатогепатит). При этом снижение продукции провоспалительных цитокинов без генерализованной иммуносупрессии — значительное преимущество по сравнению с кортикостероидами.
Перспективной, но малоизученной является противосудорожная активность. Некоторые C4-гомологи каннабиноидов способны подавлять глутаматергическую передачу и активировать аденозиновые рецепторы A1, что ведёт к уменьшению возбудимости нейронов. Если THCA-C4 или его метаболиты оказывают сходное влияние, это открывает возможность его использования в терапии эпилепсии, особенно фармакорезистентных форм, таких как синдром Леннокса-Гасто или синдром Драве.
Интересным остаётся и влияние THCA-C4 на метаболический гомеостаз, особенно в контексте глюкозной толерантности и липидного профиля. Вероятная активация PPARα и AMPK (киназы, регулирующей энергетический баланс клеток) указывает на потенциал молекулы в контроле инсулинорезистентности, снижении уровня триглицеридов, профилактике жировой дистрофии печени. Такой эффект важен для пациентов с метаболическим синдромом или сахарным диабетом 2 типа, которым противопоказаны стимуляторы аппетита или психоактивные каннабиноиды.
Отдельно заслуживает внимания потенциал C4-THC в терапии дерматологических патологий. Благодаря своей нейтральной форме молекула хорошо проникает в эпидермис, а локальная активация CB2/TRPV1 в кератиноцитах может уменьшать гиперполиферацию клеток, зуд и воспаление. Это открывает путь к использованию C4-THC в лечении псориаза, атопического дерматита, акне. Современные данные показывают, что топические каннабиноиды с короткой боковой цепью имеют более низкую системную биодоступность, что снижает риск системных эффектов.
Последнее направление — кардиоваскулярное действие. Существуют основания полагать, что THCA-C4 и его производные способны влиять на тонус сосудов за счёт активации эндотелиальной NO-синтазы, что ведёт к вазодилатации. Это создаёт гипотензивный эффект, потенциально полезный при артериальной гипертензии или сосудистой дистонии. Кроме того, активность в отношении кальциевых каналов L-типа в кардиомиоцитах может модулировать сократимость сердца без значительного снижения частоты сокращений, что является преимуществом для пациентов с сердечной недостаточностью.
Перспективы применения
THCA-C4, как один из редких гомологов каннабиноидной кислоты с четырёхуглеродным (бутильным) боковым цепочком, обладает потенциалом для многоаспектного использования, который выходит далеко за пределы традиционного каннабиноидного контекста. В отличие от канонических метаболитов типа THCA-A или Δ⁹-THC, это соединение открывает новые возможности благодаря своей необычной химической конфигурации, специфическому рецепторному взаимодействию, высокой структурной стабильности и уникальному следу в хемохимическом профиле растений. В результате его применение может охватывать как фармакологию и медицину, так и аналитическую химию, биотехнологии, агрономию и судебную экспертизу. Именно междисциплинарный характер потенциала THCA-C4 является тем аспектом, который заслуживает детального анализа с точки зрения стратегического развития научных, промышленных и клинических направлений.
Одним из самых очевидных векторов являются фундаментальные и прикладные исследования в рамках новой фармакогнозии — дисциплины, изучающей биоактивные компоненты природного происхождения как основу для создания лекарств нового поколения. THCA-C4, благодаря своей неканонической структуре, может использоваться как модельная структура для изучения SAR (structure-activity relationship) зависимостей в пределах каннабиноидной химии. Она позволяет экспериментально проверить, какие именно структурные признаки каннабиноидного ядра определяют сродство к рецепторам CB1, CB2, TRPV1, GPR55 или ферментам, участвующим в воспалительных каскадах. В свою очередь, эти данные могут заложить основу для дизайна синтетических аналогов, которые будут иметь большую избирательность и лучший профиль безопасности.
Вторым направлением, имеющим прикладное значение, является развитие селективной терапии на основе так называемой прецизионной медицины. В рамках этого подхода THCA-C4 можно рассматривать не только как действующую молекулу, но и как фармакологический зонд — инструмент для картирования специфических путей в клетке или ткани, которые могут быть активированы лишь при определённой конфигурации рецепторов, белков или сигнальных систем. Это особенно важно для редких или трудноизлечимых состояний, которые не поддаются стандартным протоколам лечения — например, атипичные формы эпилепсии, воспалительные энцефалопатии, митохондриальные нарушения или мультисистемные воспалительные синдромы.
В то же время THCA-C4 приобретает важное значение в агробиотехнологиях и современной каннабис-селекции. Благодаря своей ограниченной природной присутствию в стандартных сортах Cannabis sativa, этот каннабиноидный гомолог выступает как маркер нетипичных метаболических путей, которые реализуются только при специфической экспрессии уникальных вариантов фермента THCA-синтазы. Следовательно, наличие THCA-C4 в хемотипе сорта может свидетельствовать о глубоко изменённом метаболическом ландшафте растения, что открывает путь к созданию искусственно оптимизированных фенотипов с заданным каннабиноидным спектром. Эта возможность особенно перспективна для отраслей, где требуется сверхнизкое содержание Δ⁹-THC и высокий уровень непсихоактивных метаболитов для фармацевтического или нутрицевтического использования.
С точки зрения аналитической химии и хемометрии, THCA-C4 является ценным биомаркером. Его наличие, концентрация и соотношение с другими гомологами могут указывать на специфику происхождения растения, условия культивации, генотип или даже особенности постобработки — такие как сушка, ферментация или воздействие ультрафиолета. Это делает THCA-C4 потенциальным инструментом для идентификации фальсификаций, установления аутентичности продукта или верификации источника сырья в криминалистических и таможенных экспертизах. Поскольку изомеры с C4-цепочками редко встречаются в высоких концентрациях в дикорастущих сортах, их обнаружение может указывать на специализированные сорта или даже на целенаправленное генетическое редактирование.
Из этого логично вытекает ещё одна перспективная область — стандартизация. В отличие от распространённых метаболитов, которые варьируют в концентрации от урожая к урожаю, THCA-C4 демонстрирует высокую стабильность при хранении, незначительную фотодеструкцию и предсказуемое хроматографическое поведение. Это позволяет использовать его как внутренний стандарт в качественном и количественном определении каннабиноидного профиля, особенно в случаях низковместных матриц (например, косметические продукты или каннабиноидные плёнки для нанотерапии).
Ещё одна область применения — нанофармация. Благодаря своей кислотной природе и высокой полярности THCA-C4 слабо проникает через липидные мембраны, но может инкапсулироваться в липосомы, наносферы или твёрдые липидные частицы. Это даёт возможность разрабатывать новые системы контролируемого высвобождения, ориентированные на локальную или пролонгированную доставку в воспалённые ткани, опухолевые микросреды или барьерные структуры (например, гематоэнцефалический барьер). Таким образом, THCA-C4 рассматривается как фармакофор для платформы переносчиков, которые могут обеспечить точечную терапию с минимальными побочными эффектами.
В более широком контексте биомедицинских технологий THCA-C4 может быть применён и как метаболический сенсор. Благодаря своей специфике метаболизма и инактивации в печени и тонком кишечнике, он может выступать индикатором активности отдельных ферментативных систем — в частности, UDP-глюкуронилтрансфераз, P450-изоформ или эпоксигидролаз. Это позволяет использовать THCA-C4 в доклиническом скрининге или как функциональное зондирование при фармакокинетических исследованиях других молекул, включая полифармацевтические препараты.
Ещё одним интересным направлением является использование THCA-C4 в экотоксикологии и мониторинге окружающей среды. Его стабильность и специфичность позволяют выявлять следы сырья каннабиса в почве, воде или воздухе даже при отсутствии Δ⁹-THC или его метаболитов. Это может иметь значение для идентификации нелегальных посевов, отслеживания следов контрабандной продукции или контроля загрязнения вблизи объектов переработки растительного сырья.
В заключение следует отметить, что THCA-C4 имеет перспективу и как молекулярная основа для патентной защиты новых формулировок. Его редкость и химическая специфичность позволяют создавать ряд производных с уникальными свойствами, которые не подпадают под существующие патенты на Δ⁹-THC или CBD. Это открывает путь к инновационной фармацевтической разработке, где THCA-C4 может стать основой для препаратов с добавленной стоимостью в юридическом и клиническом смысле.
Прецизионная медицина: THCA-C4 как молекулярная мишень
Применение каннабиноидных соединений в прецизионной медицине подразумевает их рассмотрение не просто как фармакологически активных агентов общего спектра, а как потенциальных индивидуализированных молекулярных мишеней для лечения конкретных пациентов, генотипов или клеточных патологий. В этом контексте THCA-C4 (Δ9-тетрагидроканабиноловая кислота C4), как один из малоизученных гомологов классического THCA, приобретает особую значимость. Его специфическое строение, отличия в физико-химических свойствах, нестабильное присутствие в биологическом материале и потенциальная функциональная активность на молекулярном уровне формируют предпосылки для использования THCA-C4 как инструмента в персонализированной фармакологии.
Уникальность THCA-C4 в данном контексте заключается прежде всего в изменённом профиле химического восприятия со стороны биологических рецепторных систем. В сравнении с классическим THCA-A, который имеет пентаильную боковую алкильную группу, THCA-C4 характеризуется бутильной цепью. Эта небольшая структурная модификация способна коренным образом изменять не только пространственную конформацию молекулы, но и её способность к комплементарному взаимодействию с белковыми мишенями — в частности, GPCR-рецепторами, ферментами класса оксидоредуктаз, а также мембранными транспортёрами. Такое отличие даёт возможность на уровне доклинических исследований моделировать влияние THCA-C4 как узкоспециализированного лиганда в рамках рецепторного маппинга, что является фундаментом прецизионной медицины.
Другой важный аспект — это метаболическая судьба THCA-C4 в условиях индивидуального энзимного профиля пациента. В случае прецизионного лечения определяющим становится не только действие самой молекулы, но и то, как она метаболизируется. Известно, что некоторые производные THCA подвергаются ферментативному гидролизу, окислению или конъюгации под действием системы CYP450, UGT, NAT. Если THCA-C4 активируется или обезвреживается в организме с формированием уникальных метаболитов — а эта гипотеза имеет биохимическую основу с учётом изменённой растворимости и реакционной способности бутильной цепи — это открывает пространство для построения дифференцированных терапевтических моделей. В перспективе такие модели могут быть адаптированы к индивидуальному фармакокинетическому профилю человека, что и составляет суть прецизионного подхода.
В терапевтическом контексте THCA-C4 может рассматриваться как молекула, чья активность определяется селективным взаимодействием с нетипичными или малоизученными каннабиноидными рецепторами (например, GPR18, GPR55, GPR119). Такие мишени не обладают высокой аффинностью к классическому Δ9-THC, но могут специфически реагировать на каннабиноидные кислоты с модифицированной боковой цепью. В этом смысле THCA-C4 потенциально может играть роль селективного модулятора сигнальных каскадов, связанных с иммунорегуляцией, ангиогенезом, нейропротекцией или метаболической адаптацией. Все эти процессы являются ключевыми для реализации концепции таргетной терапии у пациентов с тяжёлыми или хроническими заболеваниями.
Особенно перспективным выглядит вектор использования THCA-C4 в онкотерапии на основе биомаркерного подбора. В ряде клеточных моделей (например, глиобластома, меланома, колоректальный рак) показано, что клеточная экспрессия GPR55 и связанных белков может изменяться под воздействием экзогенных каннабиноидов. Если THCA-C4 обладает способностью модулировать экспрессию этих рецепторов или ингибировать их активность, то появляется возможность применять это соединение как молекулу-мишень в терапии опухолей с известным рецепторным профилем.
Также стоит отметить возможность использования THCA-C4 в терапии нейродегенеративных состояний, в частности при болезни Альцгеймера или Паркинсона. Теоретическая модель предполагает, что селективная активность кислотной формы с короткой липофильной цепью может влиять на сигнальные пути, связанные с нейровоспалением, активностью микроглии, глутаматергической передачей. Учитывая, что THCA-C4 имеет относительно низкую проницаемость через гематоэнцефалический барьер в исходной форме, его эффекты могут быть локализованными или ограниченными периферической нервной системой, что создаёт отдельные фармакологические ниши для его применения в условиях, где центральное действие нежелательно.
Помимо прямого рецепторного действия, THCA-C4 также может выступать как модификатор локальной среды — в частности, влиять на вязкость мембран, параметры редокс-баланса или динамику межклеточной коммуникации через экзосомы и везикулярные структуры. Все эти эффекты могут быть измеримыми и прогнозируемыми в рамках персонализированной медицины с учётом транскриптомного, протеомного или метаболомного профиля пациента.
Принципиальное значение имеет также техническая возможность включения THCA-C4 в платформу компьютерного докинга и in silico скрининга. Благодаря чётко определённой молекулярной структуре и малой молекулярной массе это соединение хорошо подходит для симуляции лиган-рецепторного взаимодействия с помощью методов молекулярной динамики, что критично важно на ранних этапах разработки прецизионных терапевтических решений. Кроме того, поскольку THCA-C4 до сих пор не имеет массивного фармакологического бекграунда, он представляет интересную мишень для создания новых лекарств, ограниченных узкими категориями пациентов или редкими заболеваниями, где общая терапия малоэффективна.
Маркер чистоты или происхождения в аналитической химии каннабиноидов
THCA-C4, как менее распространённый гомолог Δ9-тетрагидроканнабиноловой кислоты, обладает всеми признаками маркерного соединения, которое может использоваться в аналитической химии для дифференциации хемотипов каннабиса, идентификации ботанического происхождения, установления условий культивации, а также подтверждения химической чистоты изолированных экстрактов. В аналитической практике присутствие или отсутствие специфических гомологов в определённом образце выполняет не просто роль дескриптора, но приобретает статус химического «отпечатка пальца», по которому можно сделать выводы как о природном происхождении вещества, так и о наличии фальсификаций, технологических примесей или нарушении протоколов обработки.
Появление THCA-C4 в профилях фитоканнабиноидов не является случайным. Это соединение синтезируется в растении посредством аналогичного THCA-A биосинтетического пути, но с использованием бутирилкоэнзима А вместо пентанилового предшественника. Именно эта особенность делает THCA-C4 чувствительным маркером условий биогенеза, в частности ферментной активности специфических синтаз (THCA-синтазы с альтернативной специфичностью), уровня доступных коэнзимов, баланса углеродных субстратов в цитозоле трихомных клеток. Следовательно, анализ присутствия THCA-C4 в смеси позволяет выводить информацию о физиологическом состоянии растения на момент биосинтеза.
С аналитической точки зрения, детекция THCA-C4 осуществляется с использованием высокоточных инструментальных методов, таких как жидкостная хроматография высокой разрешающей способности (HPLC), тандемная масс-спектрометрия (LC-MS/MS), газовая хроматография с предварительной дериватизацией, а также спектроскопия ядерного магнитного резонанса. Особое внимание заслуживает тот факт, что THCA-C4, в отличие от своего более распространённого гомолога, имеет изменённую массу, другую хроматографическую полярность и характерную фрагментацию в спектрах MS2. Это делает его практически неспутываемым с другими каннабиноидами, даже в сложных матрицах. В этом и заключается его ценность как аналитического индикатора — даже в сверхнизких концентрациях THCA-C4 может идентифицировать ботанический или хемотиповый профиль образца.
В практике судебно-химической экспертизы, где необходима дифференциация образцов по региональному или культивационному происхождению, THCA-C4 может использоваться как маркер геохимического индекса. Некоторые хемотипы, особенно те, что растут в условиях ограниченного доступа к длинноцепочечным жирным кислотам, продуцируют THCA-C4 в большем количестве. Таким образом, наличие этого гомолога в фитопрофиле образца является весомым доказательством ботанического источника — был ли это outdoor, greenhouse или indoor способ выращивания, с различной доступностью субстратов синтеза. Кроме того, сочетание THCA-C4 с другими малыми гомологами (например, THCA-C1 или THCA-C3) позволяет построить мультикомпонентную аналитическую панель, которая с высокой точностью идентифицирует не только ботаническое происхождение, но и конкретный сорт или гибрид.
Ещё одним важным аспектом является применение THCA-C4 как маркера чистоты при изоляции каннабиноидов фармацевтического класса. Во время экстракции, фракционирования или очистки действующих веществ из каннабиса важно контролировать присутствие посторонних гомологов, которые могут свидетельствовать о неполной очистке, кросс-контаминации или нарушении температурного режима. В этом контексте неожиданное появление THCA-C4 в фракциях, где по теории его быть не должно (например, после сверхкритической CO₂-экстракции с температурным градиентом), может указывать на химические преобразования в процессе экстракции или фальсификацию исходного сырья.
Также следует отметить роль THCA-C4 в выявлении синтетических или модифицированных образцов. Поскольку на сегодняшний день доступные синтетические каннабиноиды часто не содержат природных гомологов, их отсутствие — включая THCA-C4 — может служить критерием идентификации химически изменённых или лабораторно полученных субстанций. В образцах, где THCA-C4 полностью отсутствует, несмотря на наличие основного THCA-A или THC, возможно, речь идёт о реинжиниринге каннабиноидов путём деконструкции и повторного синтеза. Следовательно, THCA-C4 может стать маркером природности и аутентичности субстанции.
В рамках GMP-контроля и фармацевтического сертификационного анализа THCA-C4 может играть роль «негативного контрольного индикатора». В спецификациях чистоты для лекарственных форм, основанных исключительно на одном активном каннабиноиде, его присутствие может быть неприемлемым. В то же время в фитопрепаратах на основе экстракта полного спектра, наоборот, наличие THCA-C4 в микроконцентрациях может подтверждать целостность ботанического профиля. Это создаёт двусторонний инструмент контроля как аутентичности, так и степени очистки.
Кроме того, THCA-C4 обладает потенциалом для использования при создании цифровых библиотек хемотипов в рамках молекулярной трассологии. Сочетание высокоточной масс-спектрометрии и алгоритмов машинного обучения позволяет выявлять повторяющиеся шаблоны распределения гомологов в образцах, формирующие уникальные «каннабиноидные отпечатки». THCA-C4 в этой системе выполняет роль валидационной точки: его наличие или отсутствие фиксирует стабильность матрицы во временном и пространственном измерении, позволяя верифицировать идентичность между сериями продуктов или партиями экстрактов.
Биотехнологии и селекция: производство каннабиноидных профилей под заказ
Современные биотехнологии открывают принципиально новые возможности для селекции растений каннабиса с заданным профилем каннабиноидов, включая специфическое содержание и соотношение таких редких гомологов, как THCA-C4. В этом контексте биотехнологические подходы трансформируют традиционную селекцию, которая базировалась преимущественно на фенотипических характеристиках, в высокотехнологичную науку, управляемую молекулярным дизайном. Благодаря этому возможно создавать оригинальные комбинации каннабиноидов с заданными терапевтическими свойствами, соответствующими требованиям прецизионной медицины и фармакологии.
Основой для производства заданных каннабиноидных профилей является глубокое понимание генетических и биохимических механизмов, которые контролируют экспрессию ферментов, определяющих пути синтеза каннабиноидов. Генетическая модификация, CRISPR/Cas9-редактирование и селекция с помощью маркеров позволяют манипулировать активностью генов THCA-синтазы, CBDA-синтазы и других ферментов, продуцирующих специфические гомологи. Особенно интересно, что вариации в генотипах могут влиять на соотношение между разными длинами боковых цепей, образующих гомологи — от C1 до C5 и более, включая C4. Это означает, что с помощью точных манипуляций можно управлять количеством THCA-C4, направляя метаболизм растения на увеличение или уменьшение его образования.
Наряду с генетическими подходами активно применяются и клеточные технологии, позволяющие культивировать клетки или ткани каннабиса in vitro, поддерживая производство специфических каннабиноидов в контролируемых условиях. Клеточные культуры, органоиды или биореакторы с клетками каннабиса можно модифицировать для увеличения продуктивности THCA-C4 путем регулирования условий питания, экспозиции к стрессам, воздействия эпигенетических факторов. Этот подход особенно важен для промышленного производства: он позволяет получать однородный продукт без колебаний, характерных для растений, растущих в полевых условиях.
Важной составляющей биотехнологической стратегии является применение ферментативного синтеза. Известно, что ферменты, катализирующие последние стадии синтеза каннабиноидов, обладают определенной субстратной специфичностью, но также и определенной степенью пластичности. Применение мутантных вариантов этих ферментов с повышенным сродством к субстратам с короткими боковыми цепями, в частности к бутирилкоэнзиму A, позволяет увеличивать синтез THCA-C4 в биореакторах. Такой ферментативный синтез, совмещенный с генетической оптимизацией растений, открывает путь к масштабному производству заданных каннабиноидных профилей, необходимых для разработки новых фармацевтических форм.
Значительную роль играет и гибридизация растений с разными хемотипами. Выбор родительских линий с высоким содержанием THCA-C4 или с предрасположенностью к его образованию позволяет через серии поколений создавать стабильные сорта с необходимым профилем. В отличие от традиционной селекции, современные методы позволяют отслеживать у потомков присутствие генов, регулирующих метаболизм каннабиноидов, используя молекулярные маркеры и генотипирование. Это значительно ускоряет процесс и уменьшает количество ненужных циклов селекции.
Также стоит отметить перспективы использования синтетической биологии для создания искусственных микроорганизмов, способных продуцировать THCA-C4. Бактерии или дрожжи, инженерно модифицированные для экспрессии ключевых генов каннабиноидного пути, могут быть эффективными биореакторами. Важной задачей является настройка метаболических потоков, в частности путей синтеза ацил-коферментов, которые являются донорами групп для ферментов синтеза каннабиноидов. Регуляция экспрессии ферментов ацилтрансфераз в сочетании с оптимизацией ферментативной активности открывает путь для масштабного и контролируемого синтеза THCA-C4 вне растения.
В контексте селекции особое внимание заслуживает создание «зелёных» биотехнологий — экологически безопасных методов, позволяющих поддерживать стабильность и воспроизводимость каннабиноидных профилей при минимальном воздействии на окружающую среду. Это особенно актуально для разработки медицинских сортов с строго контролируемым содержанием активных компонентов. Например, за счет регулирования светового режима, температурных параметров и питательной среды в закрытых системах культивации возможно усилить экспрессию генов, ответственных за производство THCA-C4, без необходимости применения химических стимуляторов или агрессивных методов генетической модификации.
Еще одним важным аспектом является интеграция данных мультиомики — геномики, транскриптомики, протеомики и метаболомики — в процесс селекции. Комплексный анализ этих данных позволяет точнее прогнозировать результативность конкретных генетических изменений и оценивать стабильность профиля каннабиноидов. Так, например, транскриптомический анализ позволяет идентифицировать ключевые регуляторные гены, активирующие синтез специфических гомологов, включая THCA-C4, в ответ на внешние или внутренние стимулы. Это открывает возможности для создания сорта с программируемой реакцией на факторы окружающей среды.
Производство каннабиноидных профилей под заказ — это также вопрос контроля качества и стандартизации продуктов. В этом аспекте биотехнологии обеспечивают возможность получения однородного сырья с минимальными вариациями состава. Это особенно важно для фармацевтической индустрии, где стабильность дозы и профиля активных веществ является критической. Клеточные культуры и биореакторы с модифицированными микроорганизмами позволяют исключить зависимость от климатических и почвенных условий, которые часто усложняют поддержание стабильности в полевых условиях.
Стоит также отметить перспективы гибридных подходов, которые объединяют классические методы селекции с биотехнологическими. Например, создание гибридов, в которых традиционные методы усиливают или направляют биотехнологические изменения, способно создать устойчивые сорта с прогнозируемым и стабильным профилем THCA-C4, соответствующим требованиям заказчиков в фармацевтической, косметической или пищевой промышленности.
Вывод
THCA-C4, как редкий гомолог тетрагидроканнабиноловой кислоты, выделяется уникальными свойствами, которые формируются на уровне его биосинтеза, химической структуры и фармакокинетики. Сложность его обнаружения обусловлена не только химической нестабильностью и чувствительностью к внешним факторам, но и низкой концентрацией в растительном материале, что требует применения высокоточных аналитических методов. Природные пути синтеза THCA-C4 тесно связаны с активностью специфических ферментов и генетической изменчивостью растений, что открывает возможности для регуляции его содержания через геномный инжиниринг и селекцию. Биохимическая стабильность этой молекулы в растительной среде определяет её доступность для дальнейших исследований и коммерческого использования.
Искусственное получение THCA-C4, как в лабораторных, так и в промышленных условиях, требует сочетания химических, ферментативных и биотехнологических методов, позволяющих контролировать структуру и чистоту продукта. Современные аналитические подходы с использованием спектроскопии, хроматографии и масс-спектрометрии обеспечивают точное обнаружение и подтверждение молекулярной структуры, что является фундаментом для дальнейшего фармакологического изучения.
В биологических системах THCA-C4 проявляет специфическое взаимодействие с каннабиноидными рецепторами, которое отличается от действия классического THC, что открывает перспективы в разработке новых терапевтических агентов с улучшенным профилем безопасности. Декарбоксилирование радикально изменяет фармакодинамику, переходя от кислоты к психоактивным формам, что является критической точкой для понимания действия и потенциала использования THCA-C4. На данном этапе исследований молекула демонстрирует значительный терапевтический потенциал, особенно в направлениях противовоспалительного, нейропротекторного и анальгетического действия, однако требует более глубокого механистического раскрытия.
Перспективы применения THCA-C4 охватывают прецизионную медицину, где он может служить молекулярной мишенью для индивидуализированных терапевтических стратегий, а также аналитическую химию как маркер происхождения и чистоты каннабиноидных препаратов. Биотехнологические подходы к селекции и производству каннабиноидных профилей под заказ открывают новые горизонты для фармацевтической и косметической промышленности, позволяя создавать стандартизированные, высокоэффективные продукты.
Таким образом, THCA-C4 является сложным объектом исследования с уникальными химическими и биологическими характеристиками, требующими междисциплинарного подхода. Дальнейшее изучение его метаболизма, молекулярного взаимодействия и синтетических путей обеспечит основу для развития новых медицинских и биотехнологических применений, а также для создания инновационных методов контроля качества каннабиноидных продуктов.
Источники
- PubMed Central (PMC) — Национальная медицинская библиотека США
https://www.ncbi.nlm.nih.gov/pmc/
База данных публикаций по биомедицине и фармакологии, включает множество исследований по каннабиноидам. - National Center for Biotechnology Information (NCBI)
https://www.ncbi.nlm.nih.gov/
Авторитетный ресурс с научными статьями, включая генетику и биохимию каннабиноидов. - Journal of Natural Products — Американское химическое общество (ACS Publications)
https://pubs.acs.org/journal/jnprdf
Публикует высококачественные исследования природных соединений, включая каннабиноиды. - Frontiers in Pharmacology
https://www.frontiersin.org/journals/pharmacology
Открытый доступ, публикации о фармакологических свойствах каннабиноидов и их биохимии. - Cannabis and Cannabinoid Research (Mary Ann Liebert, Inc.)
https://www.liebertpub.com/can
Известный журнал, посвящённый научным исследованиям каннабиноидов. - ScienceDirect (Elsevier)
https://www.sciencedirect.com/
Хотя не весь контент находится в открытом доступе, здесь можно найти множество исследований, доступных через университетские подписки, в том числе по химии и биохимии каннабиноидов. - Directory of Open Access Journals (DOAJ)
https://doaj.org/
Каталог научных журналов открытого доступа из различных областей, можно найти публикации по каннабиноидам. - ResearchGate
https://www.researchgate.net/
Платформа, где учёные публикуют свои работы; часто можно найти полные тексты статей по THCA-C4 и смежным темам. - European Journal of Medicinal Chemistry
https://www.journals.elsevier.com/european-journal-of-medicinal-chemistry
Публикации по синтезу и биологическим свойствам каннабиноидов. - American Journal of Botany
https://bsapubs.onlinelibrary.wiley.com/journal/15372197
Публикации по биологии и генетике растений, включая коноплю.