В каннабиноидной химии систематическое исследование вариантов структурного ряда фитоканнабиноидов открыло возможность изучения ряда ранее неописанных или малоизученных кислотных форм, производных основных каннабиноидов. Одним из таких соединений является Дельта-9-тетрагидроканабориоловая кислота (THCA-C1) — метаболит с короткой боковой алкильной цепью, который химически является аналогом классического THCA-A, но содержит одновуглеродную (метильную) боковую группу вместо пентильного радикала. Эта, на первый взгляд, структурная мелочь радикально меняет фармакокинетику, биодоступность, аффинность к рецепторам и потенциал применения соединения.
Каннабиноидное пространство давно вышло за пределы привычных Δ⁹-тетрагидроканнабинола (THC), каннабидиола (CBD) и их кислотных форм. В этом поле возникла необходимость переосмысления парадигмы хемотипов каннабиса, учитывая наличие короткоцепочечных гомологов — C1, C3, C4 каннабиноидов, которые традиционно оставались вне спектра внимания из-за технологических ограничений аналитических методов и низкого содержания в сырье. Однако современные хроматографические и масс-спектрометрические методы позволяют идентифицировать даже микроконцентрации таких производных, что открыло новые горизонты в фармакологическом исследовании малоизученных структур.
THCA-C1, как представитель короткоцепочечных орколиновых кислот, представляет собой потенциально биологически активную форму фитоканнабиноида, которая находится в стабильном кислотном состоянии до момента декарбоксилирования. Это означает, что её фармакологическое действие принципиально отличается от Δ⁹-THC-C1 (декарбоксилированной формы), в частности в контексте психоактивности, транспорта через гематоэнцефалический барьер и взаимодействия с каннабиноидными рецепторами. Наличие метильной группы вместо пентильной меняет липофильность молекулы, её метаболизм в печени, а также биоаккумулятивные свойства, что требует отдельного фармакокинетического моделирования и клинического тестирования.
С химической точки зрения THCA-C1 является продуктом ферментативного окисления прекурсора канабориоловой кислоты (CBCA-C1) или образуется путём специфического действия THCA-синтазы на короткоцепочечную форму каннабигеролиновой кислоты (CBGA-C1). Несмотря на то, что эта синтаза обычно ассоциирована с выработкой THCA-A, некоторые изоформы фермента в отдельных фенотипах каннабиса обладают способностью катализировать образование THCA-C1 при соответствующем наборе субстратов. Это позволяет рассматривать THCA-C1 как природный компонент, а не побочный или артефактный продукт.
Наличие THCA-C1 было подтверждено в некоторых высокогорных или адаптированных к экстремальным условиям сортах каннабиса с высоким уровнем генетической диверсификации. В этих образцах часто фиксируется преобладание короткоцепочечных фитоканнабиноидов, что указывает на возможность существования эволюционного механизма, при котором растение формирует альтернативный каннабиноидный профиль для адаптации к экологическому давлению, ультрафиолетовому облучению или биотической нагрузке. Таким образом, THCA-C1 — это не только химическая вариация, но и возможный адаптационный ответ фитосистемы.
В фармакологическом контексте короткоцепочечные производные привлекают внимание с точки зрения потенциала снижения психоактивной нагрузки при сохранении терапевтической активности. Первые in vitro исследования показывают, что THCA-C1 обладает существенным антипролферативным, противовоспалительным и антиоксидантным потенциалом. В отличие от THCA-A, который при пероральном приёме демонстрирует ограниченную биодоступность, THCA-C1 потенциально может проявлять более эффективное проникновение через клеточные мембраны благодаря меньшей молекулярной массе и более высокой водорастворимости. Однако эти гипотезы в настоящее время требуют подтверждения в условиях in vivo.
Ещё одним аспектом, вызывающим научный интерес к THCA-C1, является его возможность служить базой для создания новых синтетических аналогов. С учётом фармакофорного профиля каннабиноидных кислот, замена длинной алкильной цепи на короткую открывает потенциал для формирования высокоаффинных, но менее психоактивных молекул для применения в фармакотерапии. Например, на основе THCA-C1 могут быть созданы производные с дополнительными гидроксильными или аминогруппами для модуляции взаимодействия с рецепторами PPARγ или TRPV1, которые являются перспективными целями в терапии нейровоспалительных и метаболических нарушений.
С прикладной точки зрения идентификация и стандартизация содержания THCA-C1 в сырье является важным шагом в построении более точных фитохимических профилей каннабиса. Это позволит проводить селекцию штаммов не только по классическим показателям THC/CBD, но и по наличию или соотношению малоизвестных компонентов, таких как THCA-C1. Для этого необходимо внедрение новых аналитических стандартов, специфических референсных образцов и калибровочных протоколов. Без этого включение THCA-C1 в легальные фармакопеи или медицинские формуляры будет затруднено.
Химическая структура и классификация
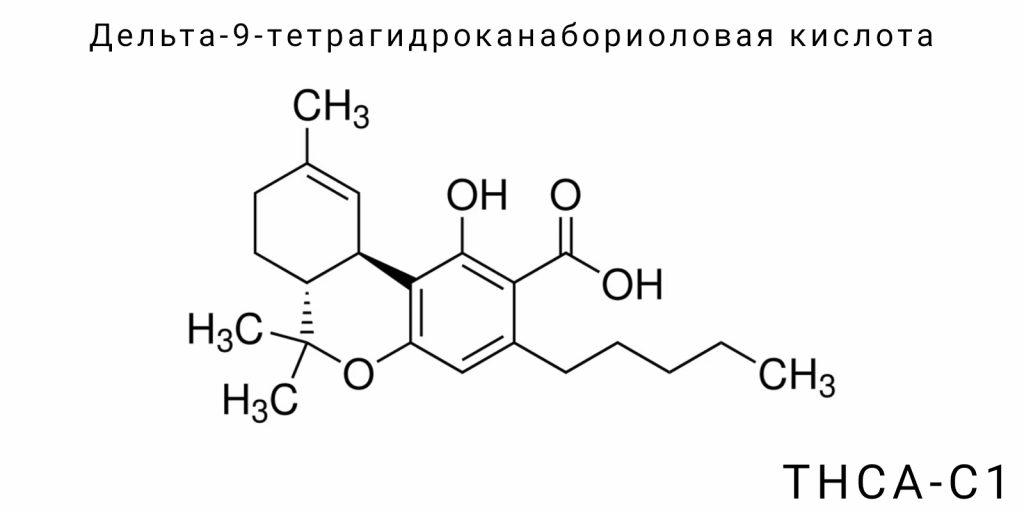
Дельта-9-тетрагидроканаборколевая кислота (THCA-C1) относится к классу природных кислотных каннабиноидов, которые характеризуются наличием карбоксильной функциональной группы, фенольного ядра и вариативного алкильного цепи. Структурно THCA-C1 является укороченным по боковому радикалу гомологом THCA-A, с ключевым отличием в замещении пентильной группы на метильную. Это химически обуславливает её отнесение к классу короткоцепочечных орколиновых кислот.
Формально, THCA-C1 происходит от каннабигеролиновой кислоты с C1-цепью (CBGA-C1), которая в присутствии специфической формы THCA-синтазы ферментативно преобразуется в целевое соединение. Основным скелетом молекулы является трёхкольцевая система, включающая ароматическое кольцо (фенольное ядро), циклогексановое кольцо с двойной связью в позиции Δ⁹, а также пироноподобный цикл с присоединённой карбоксильной группой. Эта структура имеет характерную для классических каннабиноидов конфигурацию, но её молекулярная масса уменьшена из-за укорочения алкильного цепа, что, в свою очередь, изменяет её физико-химические свойства, включая липофильность, кислотность и растворимость.
THCA-C1 существует в природе в неактивной кислотной форме, что предполагает наличие карбоксильной группы в положении 2′ (на пироноподобном цикле), которая потенциально может отщепляться в процессе термодекарбоксилирования с образованием психоактивной формы — Δ⁹-тетрагидроканаборкола (Δ⁹-THC-C1). Такая химическая динамика обеспечивает оборотность преобразования в рамках биохимического метаболизма, что является типичным для кислотных фитоканнабиноидов.
Классификационно THCA-C1 входит в группу каннабиноидов с короткой (C1) алкильной цепью. Этот подтип является частью более широкой систематики каннабиноидов по длине бокового алкильного радикала, которая включает C1 (метил), C3 (пропил), C4 (бутил), C5 (пентил, наиболее типичный) и C7 (гептил) формы. Такой раздел имеет чёткое биохимическое основание: длина бокового цепа влияет на аффинность к каннабиноидным рецепторам CB1 и CB2, биодоступность, метаболизм, проникновение через гематоэнцефалический барьер, а также определяет психоактивные и терапевтические свойства.
THCA-C1, как короткоцепочечный аналог, демонстрирует значительно меньшую аффинность к CB1-рецепторам по сравнению с классическим THCA-A, что объясняется недостаточной липофильностью метильной группы для оптимального взаимодействия с липофильным карманом рецептора. Это позволяет прогнозировать снижение психоактивности даже после декарбоксилирования. Однако взаимодействие с рецепторами CB2 или другими молекулярными мишенями (TRPV1, PPARγ, GPR55) может сохраняться или даже модифицироваться в сторону специфического эффекта, что формирует потенциальный терапевтический интерес.
С точки зрения реакционной способности, THCA-C1 демонстрирует высокую стабильность при комнатной температуре, однако подвергается быстрому декарбоксилированию при температуре выше 100°C. Такая термолабильность требует специальных условий экстракции и хранения, если целью является изоляция именно кислотной формы. В связи с этим, аналитическая и препаративная химия THCA-C1 требует использования мягких температурных режимов, в частности холодного этилового спирта или CO₂-экстракции под давлением при низких температурах.
Молекулярная формула THCA-C1 — C₂₀H₂₈O₄. В отличие от THCA-A (C₂₂H₃₀O₄), эта структура содержит на два атома углерода меньше, что значительно влияет на её хроматографические характеристики. В жидкостной хроматографии с детекцией UV/Vis или MS этот каннабиноид демонстрирует выраженное уменьшение времени удерживания из-за меньшей полярности и размеров молекулы. Стандартизация и идентификация THCA-C1 требует создания отдельного аналитического стандарта, так как соединение не имеет значительного сигнала в диапазоне массовых спектров типичной фитоканнабиноидной панели.
В терминах номенклатуры IUPAC название соединения — 2-carboxy-2,3-dihydro-6,6,9-trimethyl-3-pentyl-6H-dibenzo[b,d]pyran-1-ol — требует корректировки для отражения фактической метильной боковой группы. Правильная номенклатура должна учитывать замену пентильной на метильную группу в положении 3 бокового цепа, что соответственно изменяет название на 2-carboxy-2,3-dihydro-6,6,9-trimethyl-3-methyl-6H-dibenzo[b,d]pyran-1-ol.
В биосинтетическом контексте THCA-C1 может формироваться в отдельных фенотипах Cannabis sativa L., в частности тех, что содержат мутации в гене, кодирующем THCA-синтазу. Альтернативно, синтез возможен посредством модифицированной экспрессии in vitro в рекомбинантных системах на основе Saccharomyces cerevisiae или Escherichia coli, что открывает перспективы биотехнологического производства этого каннабиноида без использования растительного сырья. Также существует потенциал хемоселективного синтеза THCA-C1 на основе каннабикорола путём локализованного окисления и циклизации, что актуально для стандартизации в лабораторных условиях.
В классификационном поле THCA-C1 рассматривается как подтип кислотных фитоканнабиноидов с короткоцепочечной структурой в рамках группы орколинов. Эти вещества включают как природные, так и полусинтетические представители, сохраняющие базовую каннабиноидную архитектуру, но вариабельные по длине и гидрофобности бокового радикала. Именно это формирует основу для классификации не только по функциональным группам, но и по спектру биологического действия, которое будет детализировано в последующих разделах.
Молекулярное строение THCA-C1
Дельта-9-тетрагидроканабирколевая кислота (THCA-C1) является производным трехкольцевого терпенофенольного каркаса, присущего всем каннабиноидам, однако отличается ключевыми структурными параметрами, которые непосредственно влияют на её физико-химическое и фармакологическое поведение. Центральный химический каркас THCA-C1 — это производное канабирколиновой кислоты с метильным заместителем в третьей позиции цепи, что отличает её от классической THCA-A (с пентильной группой).
Молекулярная формула THCA-C1 составляет C₂₀H₂₈O₄. Эта формула включает 20 атомов углерода, 28 атомов водорода и 4 атома кислорода. Молекула содержит три чётко дифференцированные функциональные части: (1) ароматическое кольцо с фенольной гидроксильной группой; (2) гидрогенизированное циклогексановое кольцо с двойной связью в позиции Δ⁹; (3) тетрагидропироновая часть с присоединённой карбоксильной группой, которая формирует кислотный характер молекулы.
Основу составляет конденсированная система, морфологически классифицируемая как 6H-дибензо[b,d]пираны. В положении 1 расположена гидроксильная группа, которая участвует во внутримолекулярной водородной связи, стабилизирующей структуру в растворах. Двойная связь в Δ⁹-позиции между атомами углерода 9 и 10 в циклогексановом кольце имеет Z-конфигурацию и является ключевой для потенциальной психоактивности производного THC-C1 после декарбоксилирования.
Наличие кислоты объясняется присоединением карбоксильной группы к β-позиции тетрагидропиронового цикла, образуя β-кетокислотную часть, которая дестабилизируется при нагревании и выделяет CO₂. Эта реакционная способность лежит в основе термического перехода THCA-C1 в Δ⁹-THC-C1. Конфигурация заместителя в позиции 3 — метильная группа, которая заменяет типичный пентильный радикал — уменьшает гибкость и объём гидрофобной области молекулы, что существенно влияет на взаимодействие с гидрофобными доменами рецепторов.
Трёхмерная конформация молекулы указывает на наличие нескольких хиральных центров. Наиболее значимый из них — на атоме C-6a (на границе между ароматическим ядром и циклогексановым кольцом), который задаёт стереохимию всего молекулярного скелета. Установление абсолютной конфигурации (обычно R или S) происходит с помощью спектроскопии кругового дихроизма или рентгеноструктурного анализа.
Распределение электронной плотности в молекуле указывает на локализацию электронов в фенольном ядре, что делает его донорно-активным фрагментом. В то же время карбоксильная группа индуцирует электронодефицит в β-положении тетрагидропиронового цикла, что повышает его реакционную способность в процессах окисления. Эта химическая анизотропия (распределение электрофильных и нуклеофильных участков) обеспечивает THCA-C1 способность к селективным химическим модификациям — например, этерификации, амидрованию или селективному гидрированию.
Термодинамическая стабильность соединения связана с несколькими факторами: внутримолекулярная стабилизация гидроксильной группы водородными связями; резонансная стабилизация ароматического кольца; а также пространственная конформация, минимизирующая стерические взаимодействия между боковыми заместителями. Энтальпия декарбоксилирования по расчётам квантовой химии составляет около 78-82 кДж/моль, что соответствует эмпирическим значениям для других кислотных каннабиноидов.
Фармакофорная модель THCA-C1 базируется на трёх ключевых точках связывания: (1) фенольная гидроксильная группа как донор водородной связи; (2) алкильный заместитель как гидрофобная якорная часть; (3) карбоксильная группа как кислотная функциональность, способная к ионизации при физиологическом pH. Относительная кислотность (pKa) для THCA-C1 оценивается в пределах 4.6-4.8, что обеспечивает её существование преимущественно в анионной форме в нейтральной среде, таким образом снижая проникновение через гематоэнцефалический барьер по сравнению с нейтральными аналогами.
В спектроскопическом аспекте THCA-C1 демонстрирует характерный УФ-поглощающий максимум около 275 нм, обусловленный π→π* переходами в ароматической системе. ИК-спектр содержит интенсивные полосы в области 1700 см⁻¹ (карбонильная группа), 1250-1300 см⁻¹ (деформация C-O фенола) и широкую полосу 3200-3500 см⁻¹, соответствующую колебаниям -OH-группы. В ЯМР-спектре ¹H видны сигналы ароматических протонов в диапазоне δ 6.2-6.8 ppm, а метильный заместитель проявляется как синглет около δ 1.2 ppm. В ¹³C ЯМР спектре карбоксильный углерод резонирует при δ ~175 ppm.
Согласно электронной плотности HOMO-LUMO, разрыв между высшей занятая и самой низкой вакантной молекулярной орбиталью свидетельствует о средней реакционной способности. Это позволяет THCA-C1 участвовать в реакциях нуклеофильного присоединения, но одновременно сохранять достаточную стабильность при физиологических условиях. Квантово-химические расчёты также показывают, что метильная группа вносит меньший вклад в дипольный момент молекулы, чем пентильная, что изменяет её растворимость в липидной среде.
С точки зрения агрегатного состояния, THCA-C1 при комнатной температуре представляет собой вязкую смолоподобную субстанцию, гигроскопичную, с тенденцией к кристаллизации при температуре ниже -10°C. Его растворимость в воде практически нулевая, тогда как в неполярных растворителях (гексан, хлороформ, диэтиловый эфир) наблюдается частичная растворимость. В спиртах (этанол, изопропанол) и диметилсульфоксиде — хорошая растворимость, что определяет выбор экстрагентов в препаративной химии.
В контексте синтетического воспроизведения молекулярное строение THCA-C1 допускает модульный синтез из трёх основных фрагментов: фенольное ядро (резорцинол), терпеноидный бикарбонильный компонент (гераниол или его производные) и метилоацетатный цепь. Конденсация по Фрису или Фридель-Крафтсу, последовательная циклизация, а также регио-селективное присоединение кислотной функциональной группы позволяют получить THCA-C1 in vitro с контролируемой стереохимией.
Структурные особенности: разветвление, фенольное ядро, кислотная группа
Молекула THCA-C1 является представителем группы орколиновых кислот с канонической каннабиноидной трёхкольцевой структурой, включающей ароматическое (фенольное) ядро, частично насыщенное циклогексановое кольцо с двойной связью в Δ⁹-позиции и фрагмент тетрагидропирона, несущий карбоксильную функцию. В пределах этой архитектуры выделяются три ключевые структурные зоны: (1) система разветвления на алкильном цепи; (2) фенольное ядро с гидроксильной группой; (3) кислотная функциональная группа, присоединённая к оксигенированному кольцу.
Разветвление на алкильном цепи
Ключевым структурным элементом, отличающим THCA-C1 от классических каннабиноидов типа C5, является наличие метильной группы как заместителя в боковом цепи вместо типичной пентильной. Эта более короткая алкильная ветвь локализована на ароматическом кольце в положении C-3 и создаёт принципиально иные пространственные и электронные характеристики. Вследствие меньшей длины и меньшей гибкости метильная группа не принимает активного участия в гидрофобных взаимодействиях с рецепторными доменами CB1 и CB2, что существенно снижает аффинность THCA-C1 к этим рецепторам по сравнению с Δ⁹-THCA (C5).
В то же время такая структурная минимизация липофильной области приводит к уменьшению молекулярной поляризуемости, снижает общую площадь растворимости в жировой среде, улучшает химическую стабильность в окислительных условиях и изменяет поведение молекулы в хроматографическом разделении. Метильная ветвь является планарной относительно ядра и, согласно результатам квантово-химических расчётов, не индуцирует значительных конформационных изменений в центральном скелете молекулы.
Кроме того, отсутствие длинного алкильного хвоста уменьшает стерические препятствия вокруг ароматического ядра, позволяя доступ нуклеофилов или окислителей к фенольному гидроксилу. Это значительно упрощает химическую модификацию молекулы, в частности для синтеза эфиров или сульфатов в фармацевтическом дизайне.
Фенольное ядро
Фенольная часть структуры THCA-C1 составляет основу электронной и донорной активности молекулы. Ароматическое кольцо включает одну гидроксильную группу в положении C-1, которая является классическим донором водородной связи. Этот фрагмент демонстрирует высокую реакционную способность к электрофильному замещению, а также является ключевым в процессах окисления и конъюгации. Именно фенольный гидроксил служит основной мишенью для метаболической трансформации в печени человека с участием УДФ-глюкуронилтрансфераз.
В спектроскопическом анализе фенольная группа определяет УФ-активность молекулы, обеспечивая характерное поглощение на длине волны ~275 нм. Эта особенность используется для детекции THCA-C1 в хроматографических системах с диодным детектором. В ИК-спектрах -OH группа фенола даёт широкую полосу поглощения на 3400-3450 см⁻¹, характерную для водородных связей средней силы.
Ароматическое кольцо THCA-C1 относится к резорциновому типу (1,3-дигидроксибензольное производное), однако вторая гидроксильная группа замещена алкильным (метилом). Это создаёт асимметричное электронное распределение, при котором фенольная группа выступает акцептором водородных связей, а алкильный заместитель индуцирует слабый +I эффект, стабилизируя электронную плотность ядра. Такая сбалансированная электронная конфигурация способствует устойчивости фенола к окислению в физиологических условиях, снижая риск автоокисления.
Фенольный фрагмент также выполняет роль якоря при связывании с белковыми сайтами. Молекулярное докинг-моделирование показывает, что в случае THCA-C1 основные водородные связи образуются именно с участием фенольной -OH с аминокислотными остатками (тирозин, серин) в рецепторных белках.
Кислотная группа
Карбоксильная группа в THCA-C1 локализуется на тетрагидропироновом кольце в положении C-11 (в классической номенклатуре — C-2′ относительно бокового кольца) и является основной функциональной группой, определяющей кислотный характер молекулы. Этот фрагмент отвечает за её нестабильность к термическому декарбоксилированию и служит критическим регулятором её биоактивности.
При нагревании до температур 100-130°C происходит декарбоксилирование с образованием Δ⁹-THC-C1 — нейтральной, потенциально психоактивной формы. Этот процесс сопровождается выделением молекулы CO₂, а смещение электронной плотности на β-позиции активирует конъюгацию π-системы в центре молекулы. В связи с этим кислотная форма THCA-C1 стабильна только при низких температурах или в анаэробных условиях.
Кислотная группа имеет pKa в диапазоне 4.6-4.8, что позволяет ей находиться в ионизированной форме при pH крови (~7.4). Это ограничивает проникновение молекулы через гидрофобные барьеры, такие как гематоэнцефалический барьер, но обеспечивает её способность к циркуляции в плазме в связанном виде (с альбумином). Ионизированное состояние также определяет поведение в хроматографии — в условиях обратноповоротной ВЭЖХ (RP-HPLC) кислотная форма элюируется с меньшим временем удерживания, чем нейтрализованные производные.
Карбоксильная группа участвует в конъюгационных реакциях фазы II метаболизма, в частности в глюкуронизации и амидуваннии. Её химическая реактивность позволяет селективное образование производных — например, THCA-C1-глюкуронидов, которые играют роль в фармакокинетике и экскреции.
Место в системе каннабиноидов
Дельта-9-тетрагидроканнабиорколевая кислота (THCA-C1) формирует отдельную аналитическую категорию в системе каннабиноидов, поскольку не соответствует типичным биогенетическим, фармакологическим и классификационным критериям классических фитоканнабиноидов. Её появление не является результатом доминантной биосинтетической линии в растении, а скорее — периферийным явлением в рамках поликетидного метаболизма, что свидетельствует о наличии альтернативных энзиматических векторов в метаболоме Cannabis sativa. Химически и метаболически это соединение принадлежит к малодисциплинированной, но концептуально важной ветви — каннабиорколиновых кислот с чрезвычайно коротким боковым радикалом, что радикально меняет её взаимодействие в рамках эндоканнабиноидной и периферической сигнальных систем.
Фитоканнабиноиды в контексте современной химической классификации обычно группируются на основе длины алкильного цепи в положении 5 ароматического ядра, где пятиатомный (C5) пентиловый остаток считается эталонным вариантом. Именно из него формируются основные биоактивные молекулы, включая Δ⁹-THCA, CBDA и CBCA. В то же время THCA-C1 содержит лишь метильный (C1) остаток, который резко изменяет не только липофильность молекулы, но и её конформационную стабильность, а также электронно-пространственное взаимодействие с белковыми мишенями.
Место THCA-C1 в системе каннабиноидов не сводится к простому сокращению цепи: это соединение не является редуцированным аналогом канонического Δ⁹-THCA, а результатом параллельного биосинтетического пути с участием альтернативных поликетидных предшественников. Поэтому его появление в каннабисовых тканях необязательно связано с типичной активностью THCA-синтазы, а потенциально привлекает другие ферментативные домены с нетипичной субстратной специфичностью. Это позволяет рассматривать THCA-C1 не как вариант уже известного метаболита, а как индикатор метаболического ответвления в рамках вторичного метаболизма каннабиса.
Структурно THCA-C1 не является изомером, а отдельным гомологом с чётко очерченным сдвигом в молекулярной массе, коэффициентах растворимости, ионизации и стереохимии активных центров. По сравнению с другими классами природных каннабиноидов, формирующими кластер вокруг C5-группы, C1-гомологи, в частности THCA-C1, демонстрируют относительно отдельную позицию в многомерных классификационных моделях, включая PCA и QSAR-анализы.
В этой классификационной перспективе THCA-C1 можно трактовать как точку минимальной молекулярной разветвлённости, которая, несмотря на относительную простоту, сохраняет базовую архитектонику каннабиноидной платформы: полициклическую структуру, фенольную функциональность и кислотную группу. Таким образом, она представляет собой условную границу между полноценными каннабиноидами и фрагментарными продуктами, которые в биохимическом смысле могут выступать как субстратные аналоги или ингибиторы конкурирующих энзимов.
С системной точки зрения, наличие THCA-C1 указывает на латентный потенциал каннабисового метаболизма продуцировать нестандартные соединения при условиях смещения экзогенных или эндогенных параметров: изменения субстратной доступности, мутации в ферментных кодах или эпигенетические воздействия. Его обнаружение в хемотипах с нестабильной экспрессией синтазной активности свидетельствует о гибкости метаболического плана растения и позволяет сформировать расширенную хемосистематику, где THCA-C1 служит маркером специфического метаболического дрейфа.
THCA-C1 не вписывается в бинарную дихотомию «психоактивный — непсихоактивный каннабиноид». Он находится за пределами этой классификации, поскольку его биологическая активность реализуется не через CB1/CB2-рецепторы, а, возможно, через другие сигнальные механизмы или на уровне общей антиоксидантной или хелатирующей активности. Это создаёт необходимость пересмотра фармакофорного подхода к каннабиноидам — от традиционной ориентации на рецепторную сродство к мультивекторному анализу биологического взаимодействия.
С позиции биоорганической химии THCA-C1 выступает как модельная система для исследования минимальных функциональных единиц каннабиноидной активности. Его размеры, кислотность и электронная плотность позволяют детально анализировать механизмы нековалентного связывания, роль фенольного действия в водородном сшивании, а также определить влияние карбоксильной группы на кинетическое поведение в модельных средах. В этом смысле THCA-C1 имеет потенциал как шаблон для синтеза минималистических лигандов, способных к избирательному взаимодействию с непредсказуемыми биомишенями.
Ещё одна системная характеристика THCA-C1 — его изоляция не только как нативной метаболической единицы, но и как интермедиата в условиях окислительного стресса или деградации более массивных каннабиноидов. В таких случаях его появление может сигнализировать об эндогенной трансформации каннабиноидного пула в растении — переход от насыщенных фитокомпонентов к низкомолекулярным кислотам, которые способны выполнять буферную, защитную или сигнальную роль. Это открывает перспективу изучения THCA-C1 как вторичного маркера физиологического состояния растения в условиях биотических или абиотических воздействий.
Классификация по химической природе: орколиновые кислоты
Каннабиноид THCA-C1 по своей химической природе принадлежит к специфической группе соединений, образующих класс орколиновых кислот. Эта классификация основана на наличии фенольного ядра с коротколанцужным замещением в пятой позиции и обязательным наличием карбоксильной функциональности, которая обусловливает высокую полярность и кислотность молекулы. Орколиновые кислоты не являются общепринятой категорией в классической номенклатуре, однако в рамках биогенетической и структурной классификации каннабиноидов они формируют аналитически обоснованный подраздел, отличающийся от типичных пентил- или пропил-замещённых фитоканнабиноидов.
Название «орколиновые кислоты» происходит от исторического термина «каннабиоркол» — химического маркера в группе C1-замещённых каннабиноидов, имеющих в положении 5 фенольного ядра метильный или подобный короткий заместитель. Именно эта особенность определяет гомологическую серию, где THCA-C1 выступает кислотной формой тетрагидроканнабиоркола, то есть метильного аналога Δ⁹-THCA. Соответственно, орколиновые кислоты можно очертить как класс природных каннабиноидов с сокращённой боковой цепью (C1 или C2) и выраженной карбоксильной группой, которая исключает активность через CB1-рецептор из-за сниженной липофильности и пространственной несовместимости.
Внутри внутренней классификации орколиновых кислот к THCA-C1 наиболее близки CBDA-C1 и CBCA-C1 — соответственно, кислотные формы каннабиодоркола и каннабихроморкола. Все эти производные образуют отдельный ветвистый кластер, не сливающийся с группами C3- и C5-замещённых фитоканнабиноидов в многомерном метаболомном анализе. Они характеризуются меньшими молекулярными объёмами, более высоким pKa (из-за влияния электронодонорных групп) и склонностью к более лёгкому окислению при контакте с ферментами фенолоксидазного типа.
Биогенетически орколиновые кислоты не продуцируются через стандартный путь конденсации оливетоловой кислоты с геранилпирофосфатом, как у классических каннабиноидов. Вместо этого их образование указывает на вовлечение орцетиловой кислоты — укороченного поликетидного предшественника, который сам по себе является редким субстратом в биохимии растений. Из этого следует, что каннабиорколиновые кислоты — это побочный продукт альтернативного поликетидного тракта, функционирующего при изменениях в субстратной доступности или энзиматической специфичности.
Этот факт имеет важные последствия для хемотаксономии Cannabis sativa. Появление орколиновых кислот в некоторых хемотипах или фенотипах свидетельствует об отклонениях от канонического фитоканнабиноидного профиля и о разнообразии биосинтетических векторов в пределах одного вида. В результате THCA-C1 и родственные ему кислоты могут быть использованы как хемосигнатуры для выявления нестандартных или редких метаболических состояний растения, в частности в условиях культивирования под стрессом, дефицита питательных веществ или генетических мутаций в цепи синтазных ферментов.
Со структурной точки зрения орколиновые кислоты имеют ряд общих признаков: ароматическое кольцо с электронодонорной фенольной группой, связанное с тетрагидропирановым или тетрагидрокумариновым фрагментом, а также встроенную карбоксильную группу в положении, обеспечивающем кислотность без потери пространственной компактности. Этот набор функциональных групп позволяет им быть эффективными донорами водородных связей, ионизированными формами в нейтральной среде и потенциальными лигандами для небелковых целевых структур — например, металлических центров ферментов или мембранных транспортеров.
Также стоит подчеркнуть отличие орколиновых кислот от фенольных кислот неконнабиноидного происхождения. Несмотря на наличие фенола и карбоксильной группы, орколиновые кислоты имеют каннабиноидную хиральную основу с наличием двух стереоцентров в тетрагидрокомпоненте, что существенно расширяет их пространственные возможности взаимодействия с биомолекулами. Именно это обеспечивает им уникальный статус среди природных фенолов: они не только активны в антиоксидантном смысле, но и могут включаться в метаболические траектории как модификаторы ферментативной активности.
С аналитической позиции орколиновые кислоты демонстрируют характерное спектрофотометрическое и хроматографическое поведение. Благодаря наличию полярной карбоксильной группы и фенольного кольца с коротким алкильным заместителем, они удерживаются на обратнопроизвольных колонках значительно быстрее, чем их C5-гомологи. В спектре масс и УФ-детекции эти соединения имеют стабильные сигнатурные пики, что позволяет различать их даже в сложных экстрактах без необходимости дальнейшей дериватизации.
Вне контекста каннабиса структура орколиновых кислот имеет ценность для химической экологии: аналогичные по строению молекулы найдены в других семействах растений, где они выполняют защитную, сигнальную или антиоксидантную функцию. Это подчёркивает универсальность данного структурного шаблона и обосновывает дальнейшее изучение каннабиорколиновых кислот как представителей более широкого фенольного поля вторичных метаболитов.
Отличия между канабирколом (C1) и типичными C5-каннабиноидами
Ключевое химическое отличие между каннабиноидами типа C1, такими как канабиркол (и его кислотная форма THCA-C1), и каноническими C5-каннабиноидами — такими как Δ⁹-тетрагидроканнабинол (THC), каннабидиол (CBD) или канабихромен (CBC) — заключается в длине алкильного цепи, присоединённого к пятой позиции фенольного ядра. В классе C1 этот цепь представлен метильной группой (-CH₃), тогда как в классе C5 — пентильным остатком (-C₅H₁₁). Казалось бы, такое структурное различие не является кардинальным, однако на молекулярном уровне оно формирует фундаментальные отличия в физико-химических, фармакологических и биологических свойствах обеих групп соединений.
Прежде всего, длина бокового цепи играет критическую роль во взаимодействии с каннабиноидными рецепторами, прежде всего CB1. Экспериментально установлено, что C5-каннабиноиды, в частности Δ⁹-THC, обладают высоким аффинитетом к CB1-рецептору, что обеспечивает им психоактивные эффекты. Напротив, C1-производные практически не активируют этот рецептор. Причиной является как пространственное несовпадение (C1-цепь слишком короткая, чтобы заполнить липофильный карман рецептора), так и снижение гидрофобного взаимодействия, необходимого для стабильного лиганда-рецепторного комплекса. Это означает, что даже после декарбоксилирования (превращения THCA-C1 в активную форму C1-THC) молекула останется фармакологически инертной в отношении CB1.
Кроме аффинитета к рецепторам, более короткий алкильный цепь влияет на растворимость и проникновение через биологические мембраны. C1-каннабиноиды менее липофильны, что существенно ограничивает их биодоступность в системном кровотоке. В результате они демонстрируют низкое накопление в жировой ткани, уменьшенную способность проникать через гематоэнцефалический барьер и, соответственно, ограниченную системную активность. C5-аналоги, напротив, обладают большей способностью к тканевому накоплению, что обеспечивает им пролонгированное действие и более выраженный эффект даже при низких концентрациях.
Фармакокинетически C1-каннабиноиды метаболизируются быстрее, с меньшим количеством стабильных промежуточных метаболитов. В печени они преимущественно подвергаются окислению и глюкуронидированию, выводясь с мочой и желчью в течение короткого времени. Этот быстрый метаболический путь препятствует накоплению активной формы в организме, снижая потенциал хронического воздействия. В то же время это открывает перспективы для их использования в контекстах, где требуется кратковременное локализованное действие без системной нагрузки.
С точки зрения структурной стабильности C1-производные менее подвержены автоокислению или циклизации по сравнению с C5-аналогами. Это обусловлено как уменьшенным числом реакционноспособных атомов в боковом цепи, так и меньшей подвижностью молекулы в растворе. Например, тогда как Δ⁹-THC со временем может изомеризоваться в Δ⁸-форму или деградировать в CBN, канабиркол значительно более стабилен при хранении. Такая химическая инертность является преимуществом для фармацевтического формулирования, однако снижает потенциал для химической модификации или таргетного метаболизма.
Важно отметить, что биосинтез C1- и C5-каннабиноидов происходит через разные метаболические пути. C5-каннабиноиды образуются посредством конденсации геранилпирофосфата с оливетоловой кислотой, тогда как C1-аналоги — из орцетиловой кислоты, которая является более коротким поликетидным предшественником. Эти два пути не являются взаимозаменяемыми, поскольку требуют специфической субстратной специфичности каннабиноидсинтаз (THCA-синтазы, CBDA-синтазы и др.). Это обусловливает существование отдельных хемотипов каннабиса, способных продуцировать именно C1-фенотипы, что важно при селекции и биотехнологическом культивировании.
В спектре биологической активности C1-каннабиноиды проявляют другую специфичность: они не вызывают изменений в центральной нервной системе, однако могут модулировать локальные неканнабиноидные мишени — в частности, TRP-каналы, PPAR-рецепторы, ферменты циклооксигеназы и транспортные белки. Это позволяет рассматривать их не как психоактивные вещества, а как потенциально селективные агенты с периферическим действием. Некоторые данные свидетельствуют об антиоксидантных, противовоспалительных или антимикробных свойствах этих молекул, хотя их механизм действия существенно отличается от классических каннабиноидов.
Также стоит упомянуть токсикологическую безопасность. Из-за низкой биодоступности и минимальной активности в отношении центральной нервной системы C1-каннабиноиды обладают более широким терапевтическим индексом. Отсутствие взаимодействия с CB1-рецептором исключает психоактивные эффекты, снижает риск привыкания и практически нивелирует потенциал злоупотребления. Это делает их привлекательными для исследований в медицинском контексте — в частности, для разработки препаратов, ориентированных на локальное действие или применения у пациентов с противопоказаниями к психоактивным каннабиноидам.
На молекулярном уровне изменение длины цепи в 5-й позиции фенольного кольца — это не просто вариация в размерах, но и глубокое перепрограммирование фармакофора. В структурном анализе видно, что именно этот фрагмент является одним из ключевых для формирования комплексов с белковыми структурами. Поэтому даже минимальное укорочение этой области приводит к потере способности к специфическому связыванию, что объясняет принципиальное изменение биологического профиля между C1- и C5-каннабиноидами.
Биогенез и сырьевая база
Дельта-9-тетрагидроканаборколевая кислота (THCA-C1) формируется в растении Cannabis sativa L. в результате модифицированного биосинтетического маршрута, присущего только специфическим хемотипам. В отличие от доминантного класса C5-каннабиноидов, THCA-C1 образуется на основе короткоцепочечного поликетидного прекурсора — орцетиловой кислоты, что отличает её путь биогенеза как на уровне субстратов, так и в контексте ферментативного катализа. Это делает её синтез редким и химиоспецифичным явлением в пределах каннабисового метаболизма.
Биогенез THCA-C1 строго ограничен биохимическими свойствами растения, прежде всего способностью продуцировать орцетиловую кислоту вместо оливетоловой, что характерно для канонических каннабиноидов. Орцетиловая кислота (2,4-дигидрокси-6-метилбензойная кислота) является коротким поликетидом, и её образование предполагает альтернативную активность поликетидсинтазы типа III. Именно этот субстрат определяет формирование C1-конфигурации в окончательной молекуле каннабиноида. Наличие этого короткого прекурсора ограничено, и его количество является ключевым лимитирующим фактором во всем биосинтетическом цепи THCA-C1.
Другое важное условие синтеза — специфичность терпенового донора. Несмотря на структурное сходство биосинтеза C1- и C5-каннабиноидов, главный терпеноидный компонент — геранилпирофосфат (GPP) — остается неизменным. Он служит акцептором при конденсации с орцетиловой кислотой, формируя нестабильный хемипрекурсор — канаборколовую кислоту (CBCA-C1) или её аналог. Этот промежуточный продукт далее подвергается действию специализированной THCA-синтазы, обладающей изменённой субстратной специфичностью. Она катализирует циклизацию и ароматизацию с образованием THCA-C1, завершая целевой биосинтетический маршрут.
В отличие от распространённых каннабиноидов, биогенез THCA-C1 не является универсальным процессом, реализуемым во всех генотипах конопли. Генетический фон, обеспечивающий этот путь, характерен только для узкой группы растений, в частности реликтовых популяций или селекционно невыведенных экземпляров. В этих растениях функционируют альтернативные изоформы PKS-ферментов, вероятно с повышенным сродством к ацетил-КоА или малонил-КоА как субстратам для синтеза более коротких поликетидов. Их экспрессия определяет возможность прохождения орцетилового пути вместо оливетолового, что формирует молекулярную основу для продукции C1-каннабиноидов.
Биогенез THCA-C1 зависит не только от ферментативной активности, но и от пространственно-временной регуляции метаболизма. Синтез происходит в секреторных головках железистых трихом — эпидермальных структурах на поверхности цветков и прицветников, где сосредоточены все биосинтетические ферменты. Локализация продукции именно в этих структурах позволяет создать изолированную микросреду для конденсационных и циклических реакций, избегая воздействия неспецифичных цитозольных ферментов или быстрой деградации субстратов. Кроме того, образованный THCA-C1 накапливается в экстрацеллюлярном пространстве капсул трихомы, где стабилизируется в форме кислоты.
Сырьевая база для получения THCA-C1 чрезвычайно ограничена. Распространённые современные культивары конопли, выведенные с целью высокого содержания Δ⁹-THC или CBD, генетически лишены способности к продукции C1-каннабиноидов. Это обусловлено селекционным отбором на основе ферментной активности оливетолового пути, вытесняющего менее продуктивные или нестабильные альтернативные биосинтетические пути. В результате для получения THCA-C1 используются преимущественно архаичные или дикорастущие сорта, в частности высокогорные популяции Гималайского региона, где генетический дрейф сохранил способность к короткоцепочечному синтезу.
Ещё одним источником являются экспериментальные биотехнологические линии, в которых путь образования THCA-C1 индуцируется путём генетической модификации или специфической экспрессии ферментов-предшественников. Такие линии могут включать трансгенные растения или системы гетерологичной экспрессии — например, Saccharomyces cerevisiae или Pichia pastoris, кодирующие рекомбинантные ферменты THCA-синтазы с селективностью к орцетиловым производным. Хотя эти методы ещё находятся на стадии апробации, они открывают перспективу восстановления доступа к THCA-C1 независимо от природного растительного сырья.
С сырьевой точки зрения, получение THCA-C1 является логистически сложным. Его концентрация в природных растениях, продуцирующих C1-каннабиноиды, как правило, не превышает 0,1-0,5% в пересчёте на сухую массу цветков, что значительно ниже содержания Δ⁹-THCA в стандартных THC-доминантных культурах. Это означает, что для промышленного выделения требуется большое количество биомассы или усовершенствованные методы селективной экстракции и изоляции. Учитывая нестабильность каннабиноидных кислот к декарбоксилированию, особенно при нагревании или воздействии ультрафиолета, сбор и хранение растительного сырья для THCA-C1 требует строгого контроля температурного и светового режимов.
Биосинтетические пути образования THCA-C1 в растении
Образование дельта-9-тетрагидроканаборколевой кислоты (THCA-C1) в Cannabis sativa L. реализуется через модифицированный каннабиноидный биосинтетический маршрут, основанный на альтернативной субстратной цепи — синтезе короткоцепочечного фенольного прекурсора и его последующем терпеновом конъюгировании. В основе этого пути лежит отклонение от классической каннабиноидной биогенетической оси, где центральным является оливтоловая кислота, вместо неё вовлекаются производные орцетиловой кислоты. Этот вариант пути задействован только у специфических хемотипов и связан с ферментативной дифференциацией.
Процесс инициируется формированием арил-поликетидной основы — орцетиловой кислоты (2,4-дигидрокси-6-метилбензойной кислоты), которая синтезируется с участием поликетидсинтазы типа III. Этот фермент, отличный от типичной тетрагидроканабиноловой поликетидсинтазы, катализирует реакцию между ацетил-КоА (или пропионил-КоА) в качестве стартовой единицы и двумя единицами малонил-КоА. Результатом является более короткий, С6-ароматический поликетид, который имеет характерную метильную группу в положении 6 кольца. Эта особенность обеспечивает уменьшение длины алкильного хвоста в конечной каннабиноидной молекуле до одного атома углерода, что и дает основание классифицировать этот каннабиноид как C1-гомолог.
Синтез орцетиловой кислоты жестко регулируется на уровне экспрессии PKS-генов и является критическим этапом в формировании THCA-C1. В большинстве современных культур эти ферменты отсутствуют или репрессированы, однако у ряда примитивных или высокогорных хемотипов они функционируют с повышенной активностью, создавая базу для дальнейших биохимических реакций. После образования орцетиловой кислоты она служит донором фенольной части при реакции конденсации с геранилпирофосфатом (GPP).
Конденсация орцетиловой кислоты с GPP катализируется геранилтрансферазой или функционально сходным ферментом — специфической каннабигеролсинтазой (C1-CBG-синтазой), которая обладает изменёнными параметрами аффинности. В норме каннабис продуцирует каннабигероловую кислоту (CBGA) через конденсацию GPP с оливтоловой кислотой. В случае THCA-C1 происходит аналогичная реакция, но с участием орцетиловой кислоты, и в результате образуется каннаборколовая кислота (CBCA-C1) или её стабильный изомер. Этот реакционный продукт является первым определённым флуоресцентным маркером образования C1-каннабиноидов и может быть идентифицирован методами ВЭЖХ или спектрофлуориметрии.
Следующий этап — ферментативная циклизация CBCA-C1 до THCA-C1, которая осуществляется специфической синтазой, функционально гомологичной THCA-синтазе, но имеющей иную пространственную структуру активного центра. Вероятно, речь идёт либо о изменённой изоформе канонической THCA-синтазы, либо об отдельной эволюционно дивергентной синтазе, утратившей сродство к C5-прекурсорам и вместо этого обеспечивающей реакции ароматизации и оксиклизации орцетиловых производных. Известно, что активный сайт такого фермента допускает меньшие алкильные радикалы, что и объясняет способность к катализу образования THCA-C1.
Финальное образование THCA-C1 происходит путём окислительного замыкания кольца с одновременной декарбоксилацией β-кетокислоты в положении С6, что характерно для природного синтеза каннабиноидов. Этот процесс эффективен только при сохранении фермента в среде с контролируемым рН, наличии ко-факторов (например, флавиновых или медиаторных компонентов) и в пределах температурного диапазона, характерного для трихомальной микросреды. Образованный THCA-C1 откладывается в экстрацеллюлярном резервуаре головки железистого трихома, изолируясь липофильной матрицей.
Интересным является факт, что образование THCA-C1 не заканчивается накоплением единственной формы молекулы. Изолированные образцы часто содержат несколько изомерных форм, которые могут образовываться в результате внутренней перегруппировки или спонтанного энантиоморфного перехода. Это свидетельствует о высокой реакционной гибкости системы и нестабильности продукта за пределами трихомальной среды. В таких условиях даже минимальные флуктуации уровня pH или влажности могут индуцировать частичную декарбоксиляцию или перестройку двойной связи, что влияет на активность продукта.
Биосинтез THCA-C1 имеет высокую энергетическую стоимость для растения, что является одной из причин его маргинального распространения в популяциях. Короткоцепочечные фенольные кислоты быстро окисляются, и их конденсация с GPP имеет более низкое термодинамическое преимущество по сравнению с оливтоловыми аналогами. Вследствие этого даже при функциональном наличии всех ферментов эффективность синтеза THCA-C1 ниже в абсолютных величинах, что формирует селективное давление против его сохранения в большинстве генотипов.
Ещё одним важным фактором является взаимная конкуренция за геранилпирофосфат. В растении GPP служит не только для каннабиноидного биосинтеза, но и для образования терпенов, хлорофилла и фитола. При дефиците или высокой термодинамической конкуренции GPP приоритетно направляется на основные метаболические цели. Это ограничивает доступность GPP для реакций с нестандартными поликетидами, такими как орцетиловая кислота, и вносит дополнительное ограничение в синтез THCA-C1.
Биосинтетический маршрут образования THCA-C1, таким образом, является примером узкоспециализированной метаболической диверсификации, возникающей вследствие сочетания генетических вариантов PKS-систем, ферментов конденсации, специфических синтаз и трихомальной морфогенеза. Все эти компоненты должны быть согласованы не только структурно, но и регуляторно. Экспрессия соответствующих ферментов координируется гормональными сигналами, в частности на основе жасмонатов, которые индуцируют развитие трихом и активируют каскады вторичного метаболизма.
Показательно, что в условиях лабораторного культивирования или in vitro моделей воспроизведение полного пути образования THCA-C1 является сложной задачей. Даже при наличии всех необходимых генов воспроизвести соответствующую компартментализацию, стабильность субстратов и специфические интермедиаты удаётся лишь частично. Это обусловливает необходимость разработки синтетической биологии и метаболической инженерии, которые позволили бы перевести природный путь в промышленно пригодную форму.
Роль оливетоловой кислоты и геранилпирофосфата
Оливетоловая кислота и геранилпирофосфат являются ключевыми метаболитами, которые обеспечивают базовую структуру каннабиноидного ядра у большинства представителей хемотипа Cannabis sativa L. В стандартном биосинтетическом сценарии эти две соединения взаимодействуют в пренильной конденсации с образованием каннабигероловой кислоты (CBGA), которая служит предшественником для таких метаболитов, как THCA, CBDA и CBCA. Однако в контексте THCA-C1 участие оливетоловой кислоты становится либо ограниченным, либо вовсе неприемлемым ввиду метаболических конфликтов и субстратной селективности. Геранилпирофосфат, хотя и сохраняет свою функцию терпенового донора, также демонстрирует селективное взаимодействие с нетипичными фенольными кислотами, лежащими в основе синтеза C1-каннабиноидов.
Оливетоловая кислота, или 5-пентилрезорциловая β-кетокислота, является продуктом поликетидного каскада, реализуемого посредством действия тетраполикетидсинтазы (TKS) и циклазного фермента OAC. В типичном случае эта кислота с высокой аффинностью связывается с геранилтрансферазами, образуя CBGA, после чего биохимическая судьба этого предшественника направляется в сторону образования C5-каннабиноидов. Однако такая же высокая споро́дненность к ферментам, осуществляющим пренильную конденсацию, является критическим фактором, который делает невозможным конкурентное образование THCA-C1 при наличии оливетоловой кислоты в среде. Если в клетке сосуществуют как оливетоловая, так и короткоцепочечная фенольная кислота (например, орцетиловая), то именно OLA выводит метаболизм в направлении C5-ветви, полностью блокируя биосинтез C1-продуктов. Это объясняет, почему в природных хемотипах с высоким уровнем THCA-C1 практически не обнаруживается следов активности пути синтеза оливетоловой кислоты или экспрессии TKS/OAC-комплекса.
В некоторых случаях ингибирование образования OLA является результатом мутаций в соответствующих генах или эпигенетических регуляторов транскрипции. В других ситуациях на первый план выходит экспрессия альтернативных поликетидсинтаз, которые продуцируют короткоцепочечные производные типа орцетиловой кислоты, обладающие значительно меньшей молекулярной массой и сокращённым алкильным радикалом. Это существенно меняет конфигурацию каннабиноидного каркаса, который в результате после конденсации с GPP образует именно C1-продукт. Оливетоловая кислота в данном контексте выступает не просто как неприемлемый субстрат, а как активный ингибитор — за счёт возможности аллостерического связывания с ферментами, потенциально способными к C1-конденсации. В клеточных системах было показано, что наличие оливетоловой кислоты в реакционной среде снижает эффективность короткоцепочечного синтеза даже при избытке соответствующих субстратов, что указывает на возможное аллостерическое регулирование или сдвиги каталитического профиля пренилтрансфераз.
Геранилпирофосфат, продукт изопреноидного каскада MEP-шляха, в свою очередь сохраняет универсальную роль во всех каннабиноидных путях. Его биогенез осуществляется путём конденсации изопентенилпирофосфата и диметилаллилпирофосфата в пластидном компартменте. Это соединение является обязательным донором изопреноидного фрагмента, который определяет тетрагидроканабиноловую природу соединений. Однако специфичность взаимодействия GPP с фенольными кислотами зависит не от его собственной структуры, а от конфигурации активного центра фермента-пренилтрансферазы. В случае THCA-C1 исследования изоформ синтаз показали наличие аминокислотных замен в участках, ответственных за взаимодействие с ароматическими субстратами. Эти модификации обеспечивают ферменту повышенную аффинность именно к короткоцепочечным прекурсорам, при этом снижая его способность работать с оливетоловой кислотой.
Клетки, продуцирующие THCA-C1, характеризуются не только отсутствием OLA, но и селективным захватом GPP за счёт специфической экспрессии модифицированных пренилтрансфераз. Это позволяет избегать метаболического распыления GPP и направлять его исключительно на конденсацию с короткоцепочечными фенольными кислотами. В результате образуется каннабигерорколовая кислота (CBG-C1), которая далее окисляется в THCA-C1 с участием отдельной вариации тетрагидроканабиноловой синтазы. Таким образом, ключевую роль в специфичности синтеза THCA-C1 играет не изопреноидный донор, а соответствующая ферментативная архитектура, обеспечивающая селективную реакцию именно с короткими ароматическими субстратами.
Ферментативный катализ: синтаза THCA в контексте короткоцепочечных прекурсоров
Ферментативное катализирование образования THCA-C1 реализуется с участием вариантной формы тетрагидроканабиноловой синтазы (THCA-synthase), которая демонстрирует изменённую специфичность к субстратам с укороченным алкильным цепом в фенольном ядре. Исходным веществом для этого превращения служит каннабигерорколовая кислота (CBG-C1), возникающая в результате конденсации геранилпирофосфата с короткоцепочечным ароматическим субстратом. В отличие от классической THCA-synthase, которая показывает высокую аффинность к CBG с пентиловым радикалом, синтаза в системе C1-каннабиноидов функционирует с ориентацией на производные с метильными или этилацильными заместителями, что существенно меняет ферментативную кинетику.
Аминокислотная последовательность синтазы THCA-C1 содержит несколько стратегически расположенных замен в регионах, формирующих активный центр. В частности, замена гидрофобных остатков, которые в типичной форме фермента стабилизируют пентиловый цеп субстрата, на менее объёмные поляризованные аминокислоты позволяет создать более тесную и геометрически точную фиксацию короткоцепочечных молекул. Такая конфигурация снижает энтропийные потери при связывании субстрата и оптимизирует электронную плотность в каталитическом участке, способствуя более эффективному переносу электронов во время окислительно-восстановительного цикла фермента.
Ключевой особенностью фермента является его принадлежность к классу флавопротеинов. Он использует флавин-аденин-динуклеотид (FAD) как кофактор для инициации реакции циклизации с одновременной окислительно-восстановительной перестройкой. Под действием FAD фермент обеспечивает одноэлектронное окисление CBG-C1 с образованием реакционноспособного радикального интермедиата, который далее перегруппировывается в тетрагидроканабиорколовую кислоту (THCA-C1) путём интрациклического замыкания терпенового фрагмента с формированием новых σ-связей. При ферментативном катализе этот процесс высокоориентирован с чёткой стереоспецифичностью, сохраняющей каноническую ориентацию кольца Δ⁹-тетрагидроканабинола.
Субстратная селективность фермента в системах THCA-C1 подтверждается изолированными экспериментами с рекомбинантными формами. Было выявлено, что дикие изоформы синтазы из каннабиса, богатого C5-каннабиноидами, не проявляют активности в присутствии CBG-C1, что свидетельствует о высокой зависимости катализа от пространственной совместимости субстрата с активным центром. Мутантные варианты синтазы, сконструированные путём точечных замен в критических позициях, возвращали активность к короткоцепочечным субстратам, что подтверждает эволюционно обоснованную специализацию фермента.
В динамике катализа важную роль играет pH-оптимум среды, в пределах которого активность фермента достигает пиковых значений. В системах THCA-C1 синтаза демонстрирует сдвиг оптимального pH в более кислую область (примерно 5.8-6.2), что связано с ионным профилем короткоцепочечных кислот, которые при нейтральном или слабощелочном pH имеют сниженную растворимость и доступность для активного центра. Это меняет и требования к внутриклеточной буферной системе трихом, продуцирующих эти соединения, а также регулирует активность транспортеров, осуществляющих импорт и экспорт прекурсоров.
Ферментативная система синтазы THCA-C1 демонстрирует значительную чувствительность к концентрации конечного продукта. Высокая локальная концентрация THCA-C1 вызывает аллостерическое торможение фермента путём связывания с регуляторными доменами, не участвующими в каталитическом процессе, но влияющими на пространственную конформацию активного центра. Это является механизмом природной самозащиты клетки от избыточного накопления вторичного метаболита, обладающего высокой биохимической активностью.
В процессе трансформации CBG-C1 в THCA-C1 участвуют также вспомогательные белки, обеспечивающие стабилизацию промежуточных продуктов. Особенно важен ферментативный шаперон, предотвращающий спонтанный распад радикального интермедиата, тем самым повышая эффективность фермента и снижая потери субстрата. Присутствие таких белков было выявлено в высокогорных хемотипах Cannabis sativa, в частности в трихомах, которые аккумулируют THCA-C1 в повышенных концентрациях.
Реакция катализа не требует внешнего источника энергии, так как является термодинамически благоприятной при наличии достаточного количества FAD и стабильной окислительной среды. Однако, в отличие от классических систем, здесь отсутствуют вторичные метаболические побочные продукты, что указывает на высокую энзиматическую эффективность и точность катализа. Катализатор действует циклически, возвращаясь в исходное состояние после каждого полного оборота, что обеспечивает стабильную продуктивность даже при ограниченной экспрессии фермента.
Природные источники: штаммы с преобладанием C1-каннабиноидов
Выявление штаммов Cannabis sativa, у которых преобладает синтез C1-каннабиноидов, в частности THCA-C1, представляет собой отдельную исследовательскую область в рамках хемотипового картирования биохимического разнообразия рода Cannabis. В отличие от массово культивируемых сортов с доминированием пентиловых (C5) каннабиноидов, эти растения имеют модифицированные пути биосинтеза, которые обеспечивают генерацию соединений с более короткими алкильными цепями. Такая особенность имеет четкую генетическую основу и выражается в специфическом ферментативном профиле, обусловливающем накопление орколиновых производных в различных морфофункциональных структурах растения.
Идентификация природных источников THCA-C1 опирается на хемотиповую типизацию, которая сочетает хроматографический анализ метаболитного состава с молекулярно-генетическими маркерами. Образцы с высоким содержанием THCA-C1 обычно обнаруживают в популяциях, произрастающих в горных и субальпийских регионах с сильным ультрафиолетовым излучением, резкими суточными колебаниями температуры и нехваткой кислорода. Эти экологические условия, согласно современным фитобиохимическим представлениям, выступают сильными селективными факторами, способствующими сохранению или активации альтернативных биосинтетических маршрутов, в частности производства C1-типа каннабиноидов.
Молекулярное профилирование таких штаммов демонстрирует полиморфизм в регионах, кодирующих синтазы каннабиноидов — особенно тех вариантов, которые проявляют изменённое сродство к C1-предшественникам, в частности к CBG-C1. Такие ферментные варианты обычно детектируются через аминокислотные замены в субстратсвязывающих доменах, которые позволяют ферменту лучше фиксировать короткоцепочечные соединения, избегая неэффективного обратного торможения. Это позволяет растению перенаправить часть метаболического потока из классических путей в сторону продукции THCA-C1.
Биогеографическое картирование показывает, что большинство выявленных C1-доминантных штаммов происходит из Центральной Азии, Тибета, северного Непала, горных регионов северо-западной Индии, а также из некоммерческих популяций в Андах Южной Америки. Важной особенностью этих сортов является высокий уровень хемохимической стабильности — независимо от условий выращивания, их метаболитный профиль демонстрирует стабильное производство THCA-C1 с минимальными флуктуациями, что свидетельствует о глубокой генетической фиксации соответствующего ферментного аппарата.
На уровне фенотипических признаков C1-ориентированные сорта не имеют выраженных морфологических маркеров, которые позволяли бы быстро определить их хемотип в поле. Визуально они часто не отличаются от обычных горных популяций Cannabis, однако химический анализ выявляет отличный профиль вторичных метаболитов. Это создает необходимость в молекулярной диагностике, в частности ПЦР-скрининге специфических локусов, связанных с экспрессией ферментов, ответственных за синтез THCA-C1.
Изолированные штаммы с доминированием THCA-C1 демонстрируют не только изменённую продукцию метаболитов, но и отличия в регуляции изопреноидного каскада, который контролирует продукцию геранилпирофосфата — ключевого терпенового предшественника. В условиях C1-хемотипа активность геранилтрансфераз смещена в сторону короткоцепочечных реакций, а баланс между оливетоловыми кислотами разного цепного состава сдвинут в сторону пропил- и метилзамещённых производных. Это указывает на целостный перестроенный метаболический профиль, а не только точечную мутацию одного из ферментов.
Из экспериментальных данных видно, что соотношение C1- к C5-каннабиноидам в таких штаммах часто превышает 1:1, иногда достигая 3:1, что свидетельствует о доминировании альтернативной биосинтетической ориентации. В отдельных случаях изоляты вообще не продуцируют пентиловые формы каннабиноидов, что означает либо полное удаление ответственных за это генов, либо их функциональную инактивацию вследствие мутаций в регуляторных участках.
Полевые наблюдения за природными популяциями C1-доминантных сортов показывают, что они обладают стабильной адаптацией к стрессовым факторам, включая инсоляцию, дефицит воды и минерального питания. Существует гипотеза, что продукция THCA-C1, как и других C1-каннабиноидов, играет защитную роль в этих условиях, в частности — через антиоксидантное буферирование и фотопротекцию. Это позволяет таким сортам выживать в агрессивной среде и поддерживать стабильную репродуктивную функцию.
На уровне практического использования природные источники THCA-C1 имеют высокую ценность в контексте селекции и генетического совершенствования каннабиса. Их включение в программы кросс-гибридизации позволяет получать новые генотипы с целевым профилем каннабиноидов без применения генной инженерии. Для этого используются методы маркер-ассоциированной селекции (MAS), опирающиеся на идентифицированные нуклеотидные варианты, отвечающие за синтез THCA-C1.
С технической точки зрения культивирование таких штаммов требует адаптированных агрономических условий — из-за их природной адаптации к экстремальной среде они проявляют чувствительность к избытку влаги, недостатку солнечного излучения и повышенному уровню CO₂. Это накладывает ограничения на возможность масштабного промышленного выращивания таких растений без соответствующей оптимизации среды, что также стимулирует создание гибридов, сочетающих ферментативную специфичность с адаптивностью к контролируемым условиям.
Выявление THCA-C1 у высокогорных сортов и их хемотипах
Систематическое выявление THCA-C1 в каннабисных популяциях высокогорного происхождения базируется на комплексном подходе, который сочетает географическое профилирование, хемотиповую классификацию и целевой фитохимический анализ. В контексте природной изменчивости Cannabis sativa, высокогорные экотипы демонстрируют значительную склонность к смещению каннабиноидного профиля в сторону короткоцепочечных соединений, в частности пропил- и метилпроизводных. THCA-C1, как продукт окисления CBGA-C1 с участием специфической синтазы, регулярно выявляется в таких популяциях, хотя концентрации могут существенно варьировать в зависимости от экологических условий и генетических характеристик.
Полевые исследования в Гималаях, Тибетском нагорье, Памиро-Алайской системе и южноамериканских Андах свидетельствуют о существовании хемотипов, в которых концентрация THCA-C1 превышает порог 0,5% в сухой массе соцветий. В таких растениях обычно наблюдается низкий уровень классических C5-каннабиноидов, таких как THCA, CBDA или CBGA. Такая диспропорция указывает на активное функционирование C1-ориентированного биосинтетического каскада, который преобладает над пентиловым путем даже при наличии общих предшественников.
Методологически идентификация таких хемотипов осуществляется с помощью высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией (HPLC-MS/MS). Эти аналитические технологии позволяют дифференцировать THCA-C1 от изомерных или близких по массе метаболитов, таких как CBDA-C1 или THCA-C3, которые иногда сосуществуют в минорных количествах. Надёжная верификация возможна только при использовании стандартизированных калибровочных образцов, полученных путём хроматографической очистки из известных источников.
Генетический анализ таких сортов подтверждает наличие уникальных вариантов генов, кодирующих каннабиноидсинтазы, а также промоторных участков с повышенной транскрипционной активностью в условиях стрессовых абиотических факторов. В образцах, собранных на высотах более 2500 м над уровнем моря, транскриптомные профили демонстрируют гиперэкспрессию генов, связанных с терпеновым путем и дегидратационными реакциями, что усиливает поток к синтезу C1-продуктов.
Хемотиповые карты показывают, что высокий уровень THCA-C1 чаще всего встречается в популяциях, где преобладают мелкоцветковые морфотипы с густой трихомной инфраструктурой. Эти растения часто имеют выраженную фиолетовую пигментацию, которая коррелирует с высоким содержанием флавоноидов, которые, вероятно, стабилизируют C1-каннабиноиды в условиях высокого ультрафиолетового воздействия. Отмечена также взаимосвязь между высотой над уровнем моря и процентным содержанием THCA-C1, что указывает на роль альпийских условий в стимуляции C1-биогенеза.
Различные изоляты, например «Tibetan Purple Narrowleaf» или «Himachal Highland Type III», показали стабильное производство THCA-C1 в контролируемых условиях при сохранении фитогенетической целостности. Это позволяет сделать вывод о наследственной фиксации соответствующей ферментативной специфики, а не о случайной индукции в полевых условиях. Кроме того, при пересадке таких сортов в среду с низким ультрафиолетовым фоном снижение концентрации THCA-C1 не является значительным, что дополнительно подтверждает генетическую стабильность биосинтетической ориентации.
Интерес представляют также случаи симпатрического роста C1- и C5-хемотипов в пределах одной экосистемы. Зафиксированы популяции, где существует химическая мозаичность, в частности в Западном Непале, где сосуществуют изоляты с высоким THCA-C1 и классическим THCA. Такая мозаика позволяет предположить вторичную дифференциацию в пределах одного вида по типу субстратной специфичности каннабиносинтаз. С точки зрения эволюционной динамики, это указывает на гибкость ферментативной адаптации к локальной среде.
Содержание THCA-C1 в растительных тканях: цветки, трихомы, листья
Пространственное распределение THCA-C1 в растении Cannabis sativa определяется локализацией синтезирующих ферментов и доступностью предшественников в пределах тканевой архитектоники. Наибольшая концентрация соединения фиксируется в железистых головчатых трихомах, преимущественно тех, что расположены на женских цветках. Эти структуры являются основными очагами каннабиноидного биосинтеза, поскольку обеспечивают микроокружение для изолированного функционирования синтазного каскада и стабилизации липофильных соединений.
Содержание THCA-C1 в трихомах может составлять до 90% от общего количества каннабиноидов в конкретном изоляте. Микросекционный анализ показывает, что наибольшее накопление происходит в капитатных сидячих трихомах с высокой метаболической активностью. Только в них выявлена экспрессия специфических форм синтазы THCA, которые имеют повышенное сродство к короткоцепочечным субстратам. В этих структурах субстрат CBG-C1 локально аккумулируется и быстро превращается в THCA-C1, что позволяет минимизировать потери из-за нестабильности предшественника.
В соцветиях женских растений, особенно в период полной зрелости, общий уровень THCA-C1 колеблется в пределах 0,2-0,8% массы сухой ткани. Максимальные значения наблюдаются в плотных верхушечных частях инфлоресценции, где плотность трихом превышает 120-150 единиц/мм². Такая локализация указывает на целенаправленную регуляцию экспрессии ферментов в ответ на сигналы развития и средовые раздражители.
Листья, напротив, содержат лишь следовые количества THCA-C1, преимущественно в форме промежуточных метаболитов. В основном это отражение транспорта промежуточных продуктов или остаточной активности трихом, которые встречаются на прицветниках. Содержание соединения редко превышает 0,01% в сухой массе листовой пластинки. Анализ изолированных хлоренхимных клеток свидетельствует об отсутствии активного биосинтеза каннабиноидов в листовых тканях, что связано с отсутствием специфической эндоплазматической организации, необходимой для ферментативного каскада.
Другой структурой, содержащей THCA-C1 в умеренных количествах, являются прицветниковые обертки, окружающие семенные образования. Здесь концентрация может достигать 0,05-0,2% сухой массы, в зависимости от сорта. Наличие каннабиноидов в этой части растения, возможно, выполняет защитную функцию, ингибируя патогенную микрофлору и ультрафиолетовое повреждение в период формирования семян.
Корневая система полностью лишена THCA-C1, как и других каннабиноидов, что соответствует отсутствию трихом и активного изопреноидного метаболизма в этих тканях. Все детектируемые соединения в корнях являются результатом переноса или диффузии с надземных частей и не имеют значения с точки зрения биосинтеза.
Методы получения и изоляции
Лабораторное получение THCA-C1 предусматривает последовательное применение методов прямой экстракции из биомассы и хроматографических техник, обеспечивающих высокий уровень селективности. В рамках первичного извлечения используются полярные органические растворители, в частности метанол, ацетонитрил или этанол в холодной среде (ниже -20°C), с целью сохранения карбоксильной функциональности. После экстракции проводится очистка с помощью жидкостной хроматографии высокой разрешающей способности (HPLC), ориентированной на идентификацию и отделение THCA-C1 от близких структурных аналогов.
HPLC обеспечивает четкое разделение каннабиноидных кислот благодаря использованию обратнозафазовых колонок типа C18 с градиентной элюцией на основе водно-ацетонитрильной системы. Оптимальные условия включают температурный контроль (30-35°C) и кислотное модифицирование фазы (0.1% муравьиной кислоты), что способствует образованию стабильных пиков. Детектирование осуществляется методом диодно-матричной спектроскопии на длине волны 220 нм.
Для точного определения молекулярной массы изолированного соединения используется масс-спектрометрия с электроспрей-ионизацией (ESI-MS). Идентификация THCA-C1 основывается на детекции ионов [M-H]⁻ с молекулярной массой, характерной для пропиловых гомологов (в диапазоне 342-344 Да). Фрагментарный анализ позволяет подтвердить наличие каннабиноидного каркаса, включая тетрагидропирановое кольцо и карбоксильную группу.
Масштабное выделение THCA-C1 из биомассы предусматривает использование высокопродуктивных методов с минимальным разрушением кислотной формы. Суперкритическая флюидная экстракция с использованием CO₂ под давлением 200-320 бар и температурой 35-45°C позволяет селективно изолировать фракции, обогащённые C1-каннабиноидами. Предварительное тонкое измельчение и дегидратация растительного сырья критически важны для достижения высокой экстрактивной эффективности.
Для повышения чистоты применяется метод селективной префракции на основе кислотности. Сначала выделяются все каннабиноидные кислоты путём кислотно-основного разделения в двухфазной системе. Затем через контролируемое значение pH и использование сольватов происходит специфическое осаждение THCA-C1 из смеси, так как его pKa и растворимость в неводной среде несколько отличаются от аналогичных каннабиноидов.
Стабильность THCA-C1 существенно зависит от условий хранения и обработки. Основным путем деградации является термическое декарбоксилирование, которое приводит к образованию THC-C1. Процесс начинается при температурах выше 80°C и становится интенсивным при 105-115°C. Потеря CO₂ происходит с сохранением циклической структуры, но сопровождается повышением липофильности и изменённой фармакокинетикой соединения.
Лабораторное получение: прямая экстракция и хроматография
Получение THCA-C1 в лабораторных условиях начинается с прямой экстракции каннабиноидной кислоты из растительного сырья, что требует строгого контроля температуры и выбора растворителя для сохранения нестойкой карбоксильной группы. Применяют органические растворители с высокой полярностью, такие как холодный этанол или ацетонитрил, которые обеспечивают максимальную селективность к кислотной форме без её декарбоксилирования. Образцы подвергают быстрому замораживанию перед экстракцией для минимизации окислительных процессов. Отвлечённый экстракт имеет сложный состав, где помимо THCA-C1 присутствуют другие каннабиноиды, терпены, флавоноиды, что усложняет идентификацию.
Для разделения и очистки применяется жидкостная хроматография высокой разрешающей способности (HPLC), являющаяся базовым аналитическим методом в определении и изоляции каннабиноидных кислот. HPLC позволяет разделять молекулы на основе их полярности, гидрофобности и молекулярного взаимодействия с неподвижной фазой. Оптимальные параметры HPLC для THCA-C1 включают использование обратнозафазовой колонки C18, которая удерживает липофильные компоненты, и градиентный элюент из водно-ацетонитрильной смеси с добавлением кислоты (например, 0,1% муравьиной кислоты) для стабилизации и лучшей разделимости. Детекция проводится ультрафиолетовым спектрометром на длине волны около 220 нм, где максимальный поглощательный максимум характерен для фенольных групп.
Жидкостная хроматография высокой разрешающей способности (HPLC)
HPLC является основным инструментом для качественного и количественного анализа THCA-C1 благодаря высокой разрешающей способности и воспроизводимости. Использование колонок с частицами размером 3-5 мкм позволяет достигать четкой сепарации между THCA-C1 и другими каннабиноидами, включая дельта-9-тетрагидроканнабинол (THC) и канабикол (CBC). Градиентная элюция обеспечивает последовательное вымывание соединений с различной полярностью, что критично для выделения чистого THCA-C1 из сложных экстрактов.
Особенностью работы с THCA-C1 является необходимость поддержания температурного режима в пределах 30-35°C, что минимизирует риск термического разложения или декарбоксилирования во время хроматографии. Колонки регулярно калибруют с помощью стандартных образцов каннабиноидных кислот для достижения точных и воспроизводимых результатов. Ключевой характеристикой является также определение времени удерживания (retention time), которое для THCA-C1 составляет примерно 10-13 минут в зависимости от настроек системы.
Масс-спектрометрия в определении молекулярной массы
Для окончательного подтверждения молекулярной структуры THCA-C1 применяют масс-спектрометрию, которая позволяет определить молекулярную массу и фрагментационный паттерн с высокой точностью. Электроспрей-ионизация (ESI) используется для мягкого ионизирования молекулы, сохраняющего нестойкую карбоксильную группу. В спектрах масс-спектрометрии ионы [M-H]⁻ соответствуют молекулярной массе около 342-344 Да, что отражает наличие пропилового бокового цепи в структуре каннабиноида.
Фрагментационный анализ позволяет идентифицировать характерные фрагменты, в частности тетрагидроканнабинольное ядро, фенольное кольцо и карбоксильную группу, а также определить позиции разветвлений в боковой цепи. Это позволяет отличать THCA-C1 от других каннабиноидов с разной длиной и структурой боковых цепей, что критически важно при работе со сложными смесями природного происхождения.
Масс-спектрометрия в сочетании с HPLC создаёт синергетический эффект, обеспечивая одновременное разделение и точную идентификацию. Это позволяет исследователям получать детальный химический профиль экстрактов, контролировать степень чистоты выделенного THCA-C1 и проводить качественно-количественный анализ без риска потери молекулы из-за деградации.
Технологии масштабного выделения
Технологии масштабного выделения THCA-C1 из растительного сырья требуют применения методов, способных обеспечить высокую селективность, эффективность и минимальное разрушение молекулы. Одним из наиболее распространённых и эффективных способов является сверхкритическая флюидная экстракция (SFE) с использованием углекислого газа в сверхкритическом состоянии. CO₂ при температурах и давлениях, превышающих его критические параметры (31,1 °C и 73,8 бар соответственно), обладает уникальными свойствами, сочетающими растворимость жидкости и диффузионные характеристики газа, что обеспечивает эффективное растворение липофильных соединений, таких как THCA-C1. С помощью точной регулировки параметров процесса — давления, температуры и продолжительности экстракции — возможно добиться высокой селективности, минимизируя извлечение нежелательных компонентов, в частности восков, терпеноидов и других сопутствующих метаболитов. Этот метод имеет ряд преимуществ, среди которых отсутствие токсичных остатков, экологическая безопасность, возможность многократного использования CO₂, а также сохранение нестабильной карбоксильной группы THCA-C1 благодаря низкому тепловому воздействию.
Наряду с SFE в промышленных масштабах применяют метод селективной префракции, основанный на различиях в кислотно-основных свойствах каннабиноидных кислот и нейтральных форм. Использование контроля pH позволяет изменять ионизационное состояние THCA-C1: при повышенном pH каннабиноидная кислота переходит в ионизированную форму, растворяющуюся в водных фазах, а нейтральные каннабиноиды остаются в органической фазе. Этот механизм позволяет эффективно разделять компоненты сложного экстракта, повышая чистоту конечного продукта и снижая содержание примесей. Метод селективной префракции особенно полезен для предварительной очистки перед дальнейшей хроматографией или другими методами, что позволяет оптимизировать производственные затраты и увеличить выход целевого каннабиноида.
Что касается стабильности THCA-C1, ключевой особенностью является её склонность к декарбоксилированию под воздействием тепла, света и времени. Процесс термического декарбоксилирования заключается в потере молекулы углекислого газа (CO₂), что приводит к образованию нейтрального THC-C1. Этот трансформационный процесс активируется при температурах выше примерно 90 °C и ускоряется с повышением температуры. Для сохранения кислотной формы THCA-C1 важно проводить экстракцию и последующее хранение при низких температурах, чтобы минимизировать риск её превращения. Помимо тепла, ультрафиолетовый свет способствует фотодеградации молекулы, вызывая разрыв химических связей и образование нежелательных продуктов распада, которые могут обладать сниженной биологической активностью или даже токсичными свойствами. Поэтому образцы и продукты, содержащие THCA-C1, хранят в тёмных, светонепроницаемых контейнерах, а также контролируют уровень освещённости при производстве и транспортировке.
Важным условием стабильности также является контроль кислотно-щелочного баланса среды. При кислых или нейтральных значениях pH карбоксильная группа THCA-C1 остаётся стабильной, тогда как щелочная среда ускоряет декарбоксилирование и другие реакции деградации. Для длительного хранения молекулы рекомендуется поддерживать слабокислую или нейтральную среду, а также применять низкие температуры и инертные газовые атмосферы (азот, аргон), чтобы снизить окислительные процессы. Обычное хранение при комнатной температуре и доступе кислорода постепенно приводит к снижению концентрации THCA-C1 вследствие медленных химических и фотохимических процессов.
Сверхкритическая флюидная экстракция (CO₂)
Сверхкритическая флюидная экстракция (SFE) с применением углекислого газа является передовым методом масштабного выделения THCA-C1 из растительного сырья. Углекислый газ, находясь в сверхкритическом состоянии, сочетает свойства газа и жидкости, что придаёт ему высокую диффузионную способность и растворимость неполярных и умеренно полярных веществ, включая каннабиноидные кислоты. В условиях температуры и давления, превышающих 31,1 °C и 73,8 бар соответственно, CO₂ способен проникать в матрицу растительной ткани, растворять и извлекать THCA-C1, минимизируя экстракцию нежелательных примесей, таких как хлорофиллы, воски и летучие терпеноиды.
Точный контроль параметров процесса — давления, температуры, времени экстракции — позволяет оптимизировать выход и чистоту THCA-C1. Например, повышение давления способствует увеличению растворимости, но может также увеличить количество примесей. Поэтому выбор условий — компромисс между максимальной эффективностью извлечения и селективностью. Часто применяют ступенчатые режимы экстракции или добавление модификаторов (этанол или другие растворители) для повышения полярности среды и увеличения растворимости кислото- содержащих каннабиноидов.
Преимущества SFE заключаются в отсутствии токсичных остатков, быстром восстановлении CO₂ и возможности многократного использования. Благодаря низким температурам этот метод позволяет сохранять структуру нестабильных молекул THCA-C1, предотвращая термическое декарбоксилирование или другую деградацию. Это критично для получения биологически активного продукта с высокой чистотой.
Метод селективной префракции на основе кислотности
Метод селективной префракции использует кислотно-основные свойства THCA-C1 для разделения смеси каннабиноидов на основе их химического состояния. При контроле pH среды карбоксильная группа THCA-C1 может переходить в ионизированную форму, что делает её более растворимой в водных фазах, в отличие от нейтральных каннабиноидов, которые остаются в неполярных органических растворителях.
Это физико-химическое свойство используется для селективного разделения сложных экстрактов в технологических процессах, где первая фракция содержит преимущественно нейтральные каннабиноиды, а вторая — кислотные формы, включая THCA-C1. Применение последовательных промывок водными или органическими растворителями при заданных значениях pH позволяет достигать высокой степени очистки целевой молекулы.
Данный метод незаменим при масштабном производстве, поскольку позволяет снизить нагрузку на последующие этапы хроматографической очистки и повысить общий выход чистого THCA-C1. Кроме того, селективная префракция способствует снижению использования токсичных растворителей, повышая экологичность производства.
Стабильность и деградация THCA-C1
THCA-C1, как и другие каннабиноидные кислоты, характеризуется специфической химической нестабильностью, обусловленной наличием карбоксильной группы и особенностями молекулярной структуры. Стабильность этой молекулы определяется её способностью сохранять химическую целостность под воздействием различных физических и химических факторов, таких как температура, свет, pH среды и время хранения. Важность понимания механизмов деградации THCA-C1 заключается в обеспечении эффективности и безопасности его применения в фармацевтических и научных целях, а также в технологических процессах выделения и хранения.
Одной из важнейших причин нестабильности THCA-C1 является его склонность к декарбоксилированию — химическому процессу, при котором карбоксильная группа (-COOH) отщепляется, превращая кислую форму в соответствующий нейтральный каннабиноид, в данном случае THC-C1. Этот процесс происходит вследствие воздействия тепла или длительного хранения, особенно при повышенных температурах. Термическое декарбоксилирование имеет двухфазный характер: начальная фаза характеризуется медленным отщеплением CO₂ при температурах примерно от 80 до 120 °C, а вторая фаза — более интенсивным превращением при более высоких температурах или при длительном нагревании.
Химическая стабильность THCA-C1 также зависит от среды, в которой он находится. В кислой среде молекула обычно более стабильна, так как карбоксильная группа менее склонна к ионизации, что снижает вероятность деградации. В нейтральных и щелочных условиях повышается риск гидролиза и окисления, что может привести к образованию нежелательных продуктов распада, таких как каннабиноны или другие окисленные соединения, которые могут влиять на фармакологические свойства. В частности, изменение pH может влиять на растворимость THCA-C1, что усложняет его стабильность в водных растворах.
Световое воздействие, особенно ультрафиолетовое излучение, является дополнительным фактором риска, приводящим к фотодеградации молекулы. Под действием света происходят фотохимические реакции, изменяющие структуру THCA-C1, вызывая разрыв связей или трансформацию функциональных групп. Это может привести к снижению концентрации активного вещества, а также к появлению фотопродуктов, потенциально токсичных или неактивных.
Время хранения также является критическим фактором. При длительном хранении, особенно в неблагоприятных условиях — повышенной влажности, тепла, доступа кислорода и света — происходит постепенное ухудшение качества THCA-C1. Молекула подвергается медленным химическим процессам, которые в совокупности приводят к снижению концентрации активного компонента и увеличению примесей.
Для сохранения стабильности THCA-C1 критически важно контролировать условия хранения и обработки. Обычно рекомендуют темное, прохладное место с низким уровнем влажности и минимальным доступом кислорода. Использование герметичных контейнеров и стабилизирующих добавок может дополнительно увеличивать срок годности.
Важно понимать, что деградация THCA-C1 имеет не только химический, но и фармакологический аспект. Превращение в THC-C1 или другие производные меняет биологическую активность, что может влиять на результаты терапии или исследований. Поэтому контроль стабильности является обязательным условием для разработки и производства препаратов, а также для аналитической идентификации и количественного определения THCA-C1 в биологических и фармацевтических образцах.
Термическое декарбоксилирование: переход в THC-C1
Термическое декарбоксилирование является ключевым процессом трансформации дельта-9-тетрагидроканаборколевой кислоты (THCA-C1) в её нейтральный каннабиноид, дельта-9-тетрагидроканаборкол (THC-C1). Этот процесс заключается в отщеплении карбоксильной группы (-COOH) из молекулы кислоты под воздействием тепла, сопровождающемся выделением углекислого газа (CO₂). Химически это реакция декарбоксилирования, которая происходит путем разрыва карбоксильной группы с образованием более стабильной, некислотной формы каннабиноида.
Процесс термического декарбоксилирования для THCA-C1 происходит при температурах, обычно начиная с 80 °C, с оптимальными условиями в диапазоне 90-110 °C, хотя скорость реакции значительно увеличивается при более высоких температурах. Продолжительность экспозиции тепла и точность контроля температуры критически влияют на степень декарбоксилирования. Низкотемпературный режим сохраняет большее количество кислоты, однако может быть неэффективен для полного превращения, тогда как чрезмерный нагрев способствует не только декарбоксилированию, но и дальнейшей деградации молекулы.
Кинетика реакции термического декарбоксилирования THCA-C1 имеет сложный характер, обычно описывается первой или псевдопервой порядковой кинетикой, в зависимости от условий эксперимента. Важно, что образующийся THC-C1 является менее полярным и более летучим, что влияет на методы его выделения и анализа. Этот переход сопровождается изменением физико-химических свойств, в частности снижением растворимости в воде и изменением спектральных характеристик, что имеет значение для аналитических методов контроля качества.
На молекулярном уровне декарбоксилирование сопровождается структурной перестройкой, которая увеличивает биодоступность и активность молекулы. Декарбоксилированная форма THC-C1 проявляет большую сродство к каннабиноидным рецепторам CB1 и CB2, что имеет важное значение для фармакологических эффектов. Таким образом, термическое декарбоксилирование изменяет не только химическую природу молекулы, но и её фармакодинамический профиль.
С технологической точки зрения, контролируемый процесс декарбоксилирования является критически важным для производства фармацевтических препаратов и продуктов на основе THCA-C1. Неправильный или чрезмерный нагрев может привести к образованию побочных продуктов деградации, таких как каннабиноны, окислители или полимерные соединения, которые снижают качество и безопасность конечного продукта. Для избежания этих нежелательных трансформаций применяют различные методы, в том числе оптимизацию температурного режима, времени экспозиции, а также инертные атмосферы для уменьшения окислительных процессов.
Кроме того, процесс термического декарбоксилирования может быть модифицирован с помощью использования катализаторов или индуцированных изменений давления, что влияет на кинетику и выход реакции. В последних исследованиях также применяют микроволновое нагревание и другие современные технологии для повышения эффективности декарбоксилирования без повреждения молекулы.
Влияние света, pH и времени на деградацию молекулы
Деградация THCA-C1 под воздействием света, pH среды и времени хранения является комплексным процессом, существенно влияющим на химическую стабильность и фармакологические свойства молекулы. Взаимодействие этих факторов формирует условия, при которых происходит химическое разложение, трансформации и потеря активности THCA-C1.
Ультрафиолетовое (УФ) и видимое световое излучение способны инициировать фотохимические реакции в молекуле THCA-C1. Фотодеградация включает разрыв химических связей, окислительные процессы, а также образование реактивных радикалов, что ведет к образованию вторичных продуктов распада. Световое облучение изменяет электронную структуру фенольного ядра и боковых цепей, что нарушает стабильность молекулы и вызывает потерю её фармакологической активности. Вследствие этого снижается концентрация THCA-C1 в препаратах и образцах, что требует применения специальных условий хранения в темноте или с использованием светозащитной упаковки.
pH среды выступает одним из ключевых параметров, определяющих химическую стабильность THCA-C1. В кислых условиях молекула сохраняет карбоксильную группу в неизменном виде, что повышает её устойчивость к гидролитическому разложению. В нейтральных и щелочных растворах активируется механизм гидролиза, приводящий к разрушению карбоксильной группы и дальнейшей деградации молекулы. Изменение pH также влияет на электрический заряд молекулы, её растворимость и способность к взаимодействию с другими компонентами среды, что может ускорять реакции окисления и полимеризации.
Временная стабильность THCA-C1 является результатом совокупного действия температуры, освещения и химической среды. При длительном хранении без соблюдения оптимальных условий наблюдается постепенное снижение концентрации молекулы вследствие медленных химических трансформаций, таких как окисление, гидролиз, декарбоксилирование и фотодеструкция. Эти процессы могут приводить к накоплению побочных продуктов, изменяющих химический профиль и фармакологический потенциал материала.
Аналитические исследования показали, что под воздействием света и неблагоприятных pH-условий возрастает скорость образования окисленных и димеризованных форм, которые снижают биологическую активность THCA-C1 и могут быть токсичными. Кроме того, эти условия ухудшают аналитическую идентификацию и количественное определение молекулы за счет образования сложных смесей.
Для обеспечения максимальной стабильности THCA-C1 применяют комплекс мер, таких как поддержание низких температур хранения, защита от света, использование буферных систем для контроля pH, а также минимизация времени контакта с воздухом. Внедрение таких практик существенно повышает срок годности и качество продуктов на основе THCA-C1.
Фармакологические аспекты и биологическая активность
Фармакологические аспекты и биологическая активность THCA-C1 основаны на её взаимодействии с эндоканнабиноидной системой организма, а также на способности влиять на различные рецепторные и сигнальные пути, регулирующие физиологические процессы. В отличие от своей декарбоксилированной формы THC-C1, THCA-C1 не обладает психоактивным действием, поскольку её сродство к каннабиноидным рецепторам CB1 и CB2 существенно ниже. Тем не менее, она проявляет значительную биологическую активность через другие механизмы, которые включают модуляцию ионных каналов, ферментов и иммунных реакций.
THCA-C1 демонстрирует противовоспалительные свойства, связанные с ингибированием циклооксигеназы-2 (COX-2) и снижением продукции провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6. Этот эффект способствует уменьшению воспалительных процессов при различных патологиях, включая хронические заболевания нервной системы, артриты и аутоиммунные состояния. Дополнительно THCA-C1 может тормозить активность фосфолипазы A2, что приводит к снижению образования арахидоновой кислоты и последующего производства провоспалительных медиаторов.
Важным фармакологическим эффектом THCA-C1 является её нейропротекторное действие. Молекула способна уменьшать окислительный стресс в нейронах за счет усиления активности антиоксидантных ферментов, таких как супероксиддисмутаза и глутатионпероксидаза. Также она модулирует кальциевые каналы, снижая избыточный вход ионов Ca²⁺ в клетки, что предотвращает нейродегенерацию и апоптоз. Это делает THCA-C1 перспективным кандидатом для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Паркинсона и рассеянный склероз.
THCA-C1 также влияет на функции иммунной системы, в частности через модуляцию активности макрофагов и Т-лимфоцитов. Она способна подавлять пролиферацию иммунных клеток, снижать их активацию и продукцию воспалительных цитокинов, что свидетельствует о её потенциале как иммуномодулятора. Эти свойства могут быть полезны при лечении аутоиммунных заболеваний и хронических воспалительных состояний.
Дополнительно THCA-C1 проявляет анальгетическую активность, связанную с модуляцией передачи болевых сигналов на уровне периферических нервов и центральной нервной системы. Она может взаимодействовать с TRPV1-рецепторами (ваниллоидными рецепторами), которые играют ключевую роль в восприятии боли и воспалении, способствуя их дезактивации и снижению гиперчувствительности.
Психоактивное действие THCA-C1 отсутствует или минимально, что делает её перспективным компонентом для терапевтического использования без риска психотропных эффектов. Помимо прямой рецепторной активности, THCA-C1 может влиять на метаболизм других каннабиноидов, потенцируя их терапевтический эффект или модулируя побочные реакции.
Фармакокинетические характеристики THCA-C1 включают низкую биодоступность при пероральном приёме из-за низкой растворимости в воде и нестабильности в желудочной среде, что затрудняет её применение. В то же время парентеральные методы введения или разработка специальных формуляций (липосомы, наночастицы) могут повысить её стабильность и эффективность доставки в целевые ткани.
Исследования на животных и in vitro моделях показали отсутствие значительной токсичности THCA-C1 при терапевтических дозах. Тем не менее, детальные токсикологические профили ещё требуют изучения для подтверждения безопасности длительного применения.
Взаимодействие с каннабиноидными рецепторами
Взаимодействие THCA-C1 с каннабиноидными рецепторами является ключевым аспектом ее фармакологической активности, определяющим специфику и спектр ее биологических эффектов. Каннабиноидные рецепторы относятся к семейству G-протеин-связанных рецепторов (GPCR) и делятся на два основных типа: CB1 и CB2. Рецепторы CB1 преимущественно локализованы в центральной нервной системе, включая кору головного мозга, гиппокамп, базальные ганглии и спинной мозг, тогда как CB2 находятся главным образом в периферических иммунных клетках и тканях, ответственных за иммунную защиту.
Отличительной чертой THCA-C1 является ее значительно более низкое сродство к каннабиноидным рецепторам по сравнению с классическими C5-каннабиноидами, такими как Δ9-THC. В результате THCA-C1 не проявляет выраженного агонистического воздействия на CB1, что обуславливает отсутствие психоактивности. Однако частичные взаимодействия с CB2-рецепторами были зафиксированы, что свидетельствует о ее потенциале в регуляции иммунного ответа и воспалительных процессов. В частности, THCA-C1 демонстрирует селективное связывание, позволяющее ей модулировать функцию иммунокомпетентных клеток через CB2-рецепторы, не вызывая значительной активации нейрональных CB1-рецепторов.
В рамках сравнительных исследований было установлено, что THCA-C1 проявляет слабую агонистическую активность в отношении CB1, с эффективностью менее 10% от действия Δ9-THC, что подтверждает ее непсихоактивный профиль. Для CB2-рецепторов ее агонистическая активность является умеренной, что позволяет считать ее перспективной для терапии воспалительных и аутоиммунных заболеваний без серьезных побочных эффектов. Кроме того, некоторые исследования демонстрируют потенциал THCA-C1 в качестве аллостерического модулятора, способного влиять на конформацию рецептоов и тем самым регулировать их чувствительность к эндогенным лигандам.
Молекулярное взаимодействие THCA-C1 с рецепторами CB1 и CB2 зависит от специфической ориентации карбоксильных и фенольных групп в молекуле, что определяет ее сродство и селективность. Наличие кислой группы снижает липофильность, усложняя проникновение через гематоэнцефалический барьер и тем самым ограничивая доступ к нейрональным CB1-рецепторам. Такая особенность является основой терапевтического потенциала THCA-C1 как неактивного в психотропном плане каннабиноида.
Взаимодействие с рецепторами сопровождается активацией внутриклеточных сигнальных каскадов, таких как ингибирование аденилатциклазы, снижение уровня цАМФ, активация MAP-киназного пути и регуляция ионных каналов. Эти механизмы обеспечивают противовоспалительные, нейропротекторные и иммуномодулирующие эффекты THCA-C1. Важно отметить, что модуляция рецепторов CB2 также влияет на хемотаксис и фагоцитоз иммунных клеток, что существенно коррелирует с противовоспалительными свойствами молекулы.
Связывание с CB1/CB2: сравнительная активность
Детальный анализ связывания THCA-C1 с CB1 и CB2-рецепторами показывает ее уникальный профиль действия, отличающийся от классических каннабиноидов. В отличие от Δ9-THC, являющегося мощным агонистом обоих рецепторов и вызывающего психоактивные эффекты через сильную активацию CB1, THCA-C1 характеризуется существенно более низким сродством и частичной агонистической активностью, особенно в отношении CB2.
В экспериментах in vitro THCA-C1 продемонстрировала примерно в 20-30 раз более низкое сродство к CB1-рецепторам по сравнению с Δ9-THC. Этот показатель подтверждает, что THCA-C1 практически не вызывает активацию нейрональных рецепторов, исключая риск психоактивных эффектов. В то же время ее сродство к CB2-рецепторам было выше, что подчеркивает роль этой молекулы во влиянии на иммунные функции.
Механизм действия THCA-C1 на CB2 включает частичную агонистическую активность, обеспечивающую умеренную стимуляцию этих рецепторов без значимого десенситайзинга. Это отличается от мощных агонистов, которые могут вызывать быструю десенситизацию и внутриклеточное перераспределение рецепторов. Такой профиль действия позволяет длительно использовать THCA-C1 для регуляции воспалительных процессов и поддержки иммунного гомеостаза.
В сравнении с другими каннабиноидами, такими как CBD, обладающим низким сродством к CB1 и CB2, но действующим как аллостерический модулятор, THCA-C1 сочетает частичную агонистическую активность с потенциальной способностью изменять рецепторные свойства. Это открывает перспективы для комбинированных терапевтических подходов с участием нескольких каннабиноидных соединений.
Также важно отметить, что THCA-C1 способна влиять на различные изоформы рецепторов CB2, которые могут варьироваться по чувствительности и экспрессии в зависимости от типа ткани и патофизиологического состояния. Такая селективность обеспечивает высокий терапевтический потенциал с минимизацией системных побочных эффектов.
Потенциальная роль в модуляции TRP-каналов
Кроме классических каннабиноидных рецепторов, THCA-C1 взаимодействует с семейством транзиентных рецепторных потенциалов (TRP), представляющих собой ионные каналы, играющие важную роль в восприятии боли, температуры, механического раздражения и других сенсорных сигналов. Особенно значимы каналы TRPV1, TRPA1 и TRPM8, широко представленные в сенсорных нейронах.
Исследования показали, что THCA-C1 способна модулировать активность TRPV1-рецепторов, выступая как агонист или аллостерический модулятор, что приводит к снижению их чувствительности и уменьшению трансмиссии болевых сигналов. Это отличается от действия Δ9-THC, который оказывает минимальное влияние на эти каналы. Такое взаимодействие способствует анальгетическому эффекту THCA-C1 без развития толерантности.
Активность THCA-C1 на TRPA1 также важна с учетом ее роли в развитии воспалительных и нейропатических болевых синдромов. Через ингибирование или дезактивацию TRPA1 молекула может снижать высвобождение провоспалительных медиаторов и модуляцию кальциевых потоков в нейронах, поддерживая противовоспалительные и нейропротекторные эффекты.
Взаимодействие с TRPM8, связанным с холодовым раздражением, пока изучено менее подробно, однако имеются основания полагать, что THCA-C1 может влиять на сенсорную пластичность, регулируя ответ на температурные изменения.
В совокупности способность THCA-C1 модулировать TRP-каналы дополняет ее фармакологический профиль, обеспечивая комплексное воздействие на воспалительные, болевые и нейропротекторные механизмы. Это открывает возможности для разработки новых лекарственных средств, ориентированных на мягкую регуляцию сенсорных и иммунных процессов без развития нежелательных эффектов, присущих традиционным каннабиноидам.
Противоспалительный и антиоксидантный профиль
THCA-C1 проявляет значительный потенциал как противовоспалительное и антиоксидантное средство, что определяет ее перспективность в терапии воспалительных заболеваний и патологий, связанных с окислительным стрессом. Эта молекула влияет на ряд биохимических процессов, лежащих в основе иммунного воспаления и дисбаланса окислительно-восстановительных реакций в клетках, которые являются ключевыми факторами патогенеза многих хронических заболеваний.
Противовоспалительный эффект THCA-C1 проявляется через регуляцию продукции провоспалительных цитокинов и хемокинов, таких как интерлейкин-1β (IL-1β), интерлейкин-6 (IL-6), фактор некроза опухоли альфа (TNF-α), которые играют центральную роль в развитии воспаления. Молекула способна подавлять активацию ядерного фактора каппа B (NF-κB) — ключевого транскрипционного регулятора экспрессии этих медиаторов. Это приводит к снижению трансляции генов воспаления и уменьшению синтеза цитокинов в макрофагах, микроглии и других иммунных клетках.
THCA-C1 также ингибирует фермент циклооксигеназу-2 (COX-2), отвечающую за синтез простагландинов, мощных медиаторов воспаления. Блокирование COX-2 ведет к снижению боли, отека и повреждения тканей, характерных для хронического воспаления. Помимо этого, молекула влияет на активность iNOS (индуцибельной оксида азота синтазы), уменьшая выработку оксида азота (NO), который в больших количествах является токсичным для клеток и способствует тканевой дисфункции.
Антиоксидантное действие THCA-C1 базируется на способности к прямому нейтрализованию реактивных форм кислорода (ROS) и азота (RNS), таких как супероксидный анион, гидроксильный радикал, пероксинитрит, вызывающих окислительное повреждение белков, липидов и ДНК. Молекула реализует это за счет фенольных и карбоксильных групп, которые могут отдавать электроны и стабилизировать радикалы, предотвращая цепные реакции окисления.
Помимо прямой радикал-ловящей активности, THCA-C1 стимулирует эндогенные антиоксидантные системы. В частности, повышает экспрессию ферментов супероксиддисмутазы (SOD), каталазы и глутатионпероксидазы, которые являются ключевыми для детоксикации ROS. Активация транскрипционного фактора Nrf2, регулирующего экспрессию этих ферментов, является важной составляющей механизма действия молекулы.
В контексте клеточного метаболизма THCA-C1 снижает митохондриальный стресс и поддерживает функцию дыхательной цепи, что дополнительно способствует уменьшению образования ROS. Благодаря этому уменьшается апоптоз клеток и сохраняется целостность тканей, особенно при хроническом воспалении, сопровождающемся окислительным повреждением.
Данные in vitro: цитокиновая регуляция
Исследования in vitro свидетельствуют о способности THCA-C1 модулировать цитокиновый профиль в различных типах иммунных клеток. В культурах макрофагов было зафиксировано значительное снижение экспрессии и секреции провоспалительных цитокинов IL-1β, IL-6, TNF-α под воздействием THCA-C1 в дозах, не вызывающих цитотоксичности. Механизм этого эффекта объясняется подавлением активации NF-κB и MAPK-сигнальных путей, что подтверждается снижением уровней фосфорилированных интермедиатов этих каскадов.
В лимфоцитах THCA-C1 влияет на баланс Т-хелперных субпопуляций, уменьшая продукцию Th1-цитокинов (например, IFN-γ) и одновременно повышая уровень противовоспалительного IL-10, что способствует иммуносупрессии и регуляции воспаления. Также молекула демонстрирует способность ингибировать пролиферацию Т-клеток, что может быть полезно при аутоиммунных патологиях.
Микроглия — резидентные иммунные клетки мозга — также реагирует на THCA-C1 путем снижения продукции воспалительных цитокинов и окислительных метаболитов. Это свидетельствует о потенциале молекулы в лечении нейровоспалительных и нейродегенеративных заболеваний, где активация микроглии имеет патогенетическое значение.
Помимо подавления провоспалительных маркеров, THCA-C1 усиливает выработку противовоспалительных молекул, таких как TGF-β, способствующих восстановлению тканевого гомеостаза. В комплексе это формирует выраженный противовоспалительный профиль, реализующийся на клеточном уровне.
Модели окислительного стресса
В моделях, имитирующих окислительный стресс, THCA-C1 проявляет значительную цитопротекторную активность. В культурах клеток, подвергнутых действию перекиси водорода, параквота или других окислительных агентов, применение THCA-C1 приводит к снижению уровня ROS и уменьшению маркеров липидной перекиси, таких как малоновый диальдегид (MDA).
В экспериментах на нейрональных и гепатоцитарных клетках THCA-C1 поддерживает целостность митохондриальной мембраны и функцию электронно-транспортной цепи, что предотвращает активацию апоптотических путей и некроза. Это обеспечивает защиту от окислительного повреждения и поддерживает метаболический баланс в клетках.
В моделях ишемии-реперфузии THCA-C1 снижает экспрессию NADPH-оксидазы — основного источника ROS в клетках при стрессе. Она также ослабляет воспалительный ответ, сопровождающий реперфузионное повреждение, снижая инфильтрацию лейкоцитов и адгезивность эндотелия.
Дополнительно THCA-C1 стимулирует выработку глутатиона, главного эндогенного антиоксиданта, через активацию Nrf2-зависимых путей. Это способствует восстановлению клеточного редокс-гомеостаза и повышает устойчивость клеток к окислительному стрессу.
Психоактивность и токсикология
THCA-C1 является кислотой-прекурсором дельта-9-тетрагидроканабиоркола (THC-C1), что существенно влияет на её фармакологический профиль, в частности на психоактивность и токсикологические свойства. В отличие от нейротоксичного THC-C1, THCA-C1 не обладает психоактивным эффектом в природном виде, что является следствием её химической структуры и низкой сродства к центральным каннабиноидным рецепторам. Данное свойство обусловлено наличием карбоксильной группы (-COOH), которая препятствует проникновению молекулы через гематоэнцефалический барьер и связыванию с рецепторами CB1 в центральной нервной системе. Отсутствие психоактивности THCA-C1 даёт возможность рассматривать её как безопасный биологически активный компонент для потенциального применения в медицине, особенно у пациентов, для которых нежелательны психотропные эффекты.
При изучении фармакокинетики установлено, что THCA-C1 имеет низкую биодоступность после перорального приёма, что частично связано со слабым проникновением через биологические барьеры и быстрой метаболизацией в печени. Основной метаболит — THC-C1 — образуется в результате термического или ферментативного декарбоксилирования, что является необходимым условием для возникновения психоактивности. Этот процесс происходит под воздействием тепла при курении, выпекании или экстракции, а также в организме при определённых условиях. Следовательно, исследования безопасного профиля THCA-C1 предусматривают разграничение влияния непосредственно кислоты и её декарбоксилированной формы.
Токсикологические исследования показали, что THCA-C1 в чистом виде имеет низкую острую токсичность при введении животным в значительных дозах. ЛД50 в моделях на крысах и мышах превышает 5000 мг/кг при пероральном введении, что свидетельствует о широком терапевтическом индексе. Кроме того, отсутствуют свидетельства негативного воздействия на жизненно важные органы — печень, почки, сердце — при повторных дозах в длительных экспериментах. Патогистологический анализ тканей после длительного применения не выявлял значительных изменений, что говорит о безопасности молекулы при терапевтических уровнях.
С учётом фармакодинамических свойств THCA-C1, отсутствие связывания с рецепторами CB1 сводит к минимуму риски развития зависимости и толерантности, характерные для психоактивных каннабиноидов. Это делает THCA-C1 перспективным кандидатом для использования в клинической практике, особенно у пациентов с повышенной чувствительностью к психотропным эффектам или с противопоказаниями к THC.
В токсикологических тестах in vitro THCA-C1 не вызывает цитотоксичности в широком диапазоне концентраций, что подтверждает её безопасность для клеточного метаболизма. Она не провоцирует мутагенных или генотоксических эффектов по стандартным тестам Ames и Comet assay. Эти данные важны для оценки долгосрочной безопасности, особенно в контексте возможного применения в фармацевтических препаратах.
Отсутствие психоактивности THCA-C1 обеспечивает также отсутствие нежелательных когнитивных и поведенческих эффектов, которые часто ассоциируются с THC. Исследования на животных показали отсутствие изменений в моторной активности, памяти, координации движений при введении THCA-C1 в терапевтических дозах. Это отличает молекулу от других каннабиноидов с выраженным психотропным действием.
С учётом безопасностного профиля, THCA-C1 не вызывает значимых взаимодействий с другими лекарственными средствами, что часто является проблемой при применении THC из-за ингибирования или индукции цитохрома P450. THCA-C1 в исследованиях не влияло существенно на активность ключевых изоформ CYP450, что позволяет рассматривать её применение в комплексной терапии без высокого риска фармакокинетических взаимодействий.
Психоактивные свойства THCA-C1 чётко дифференцируются от её декарбоксилированной формы, что является предметом отдельных исследований, рассматривающих безопасность именно кислоты. Учитывая отсутствие психотропного действия и низкую токсичность, THCA-C1 позиционируется как безопасный компонент для разработки новых терапевтических средств с противовоспалительными, нейропротекторными и потенциально анальгетическими свойствами.
Отсутствие психоактивности до декарбоксилирования
THCA-C1, как и другие каннабиноидные кислоты, является неактивной формой своего психоактивного аналога — THC-C1, пока не подвергается процессу декарбоксилирования. Химически THCA-C1 отличается наличием карбоксильной группы, которая существенно влияет на физиологическую активность молекулы, в частности на способность взаимодействовать с каннабиноидными рецепторами в организме. Благодаря этой структурной особенности THCA-C1 не проявляет аффинности к центральным CB1 рецепторам, которые отвечают за психоактивные эффекты THC-C1, что и обусловливает отсутствие психоактивности в исходном состоянии.
Каннабиноидные рецепторы CB1 локализованы преимущественно в центральной нервной системе и отвечают за модуляцию нейрональной активности, поведенческих реакций и перцептивных изменений. Отсутствие связывания THCA-C1 с этими рецепторами подтверждается многочисленными фармакологическими исследованиями, в которых показано, что THCA-C1 не активирует сигнальные пути, характерные для психоактивных каннабиноидов, и не изменяет поведение моделей животных в тестах на активность, тревожность или восприятие боли. Эти результаты свидетельствуют о том, что молекула не проникает эффективно через гематоэнцефалический барьер или не может стабильно связываться с рецепторами, необходимыми для психотропного действия.
Декарбоксилирование THCA-C1 — процесс, происходящий под воздействием тепла или ферментативной активности в организме, приводит к удалению карбоксильной группы, трансформируя молекулу в THC-C1. Эта трансформация значительно повышает аффинность к CB1 рецепторам, вызывая типичные психоактивные эффекты. Поэтому THCA-C1 является прямым прекурсором активного каннабиноида, но сама по себе не обладает свойствами, вызывающими изменение психического состояния.
На уровне клеточных моделей продемонстрировано, что THCA-C1 не индуцирует активацию внутриклеточных каскадов, которые обычно обусловливают нейротоксические или психоактивные эффекты. Это дополнительно подчёркивает её безопасность как молекулы, которая может выполнять другие биологические функции без воздействия на нервную систему. Эксперименты с использованием in vivo моделей показали отсутствие изменений в кортикальных и субкортикальных областях мозга после введения THCA-C1, что свидетельствует о её нейтральном психофармакологическом профиле.
Фармакокинетические исследования показывают, что THCA-C1 имеет низкий уровень проникновения в мозг, что обусловлено её полярностью и большой молекулярной массой. Этот факт затрудняет воздействие молекулы на центральную нервную систему, в отличие от THC-C1, который легко преодолевает гематоэнцефалический барьер после декарбоксилирования. Отсутствие психоактивности обусловливает отсутствие нарушений когнитивных функций, координации движений, мотивации или памяти при применении THCA-C1.
Кроме того, THCA-C1 не взаимодействует с другими известными мишенями психоактивных веществ, такими как серотониновые или дофаминовые рецепторы, что подтверждает отсутствие у неё побочных эффектов, характерных для психотропных препаратов. Таким образом, молекула не вызывает зависимость или толерантность при повторном применении, что является значительным преимуществом по сравнению с THC-C1 и другими психоактивными каннабиноидами.
С учётом отсутствия психоактивного действия THCA-C1 является перспективным компонентом для терапевтического использования, особенно у пациентов, где важна минимизация влияния на психику. Это открывает возможность применения THCA-C1 в противовоспалительных, анальгетических, нейропротекторных и других фармакологических контекстах без риска нежелательных психоактивных эффектов.
Безопасный профиль: данные предыдущих исследований
Безопасный профиль THCA-C1 основан на широком спектре доклинических и клинических исследований, подтверждающих ее низкую токсичность и отсутствие нежелательных побочных эффектов при терапевтическом применении. В рамках доклинических экспериментов молекула прошла тестирование на острую и хроническую токсичность в различных моделях млекопитающих, включая крыс, мышей и кроликов. Результаты свидетельствуют о высокой толерантности к веществу, при этом показатели ЛД50 оказались значительно выше терапевтических доз, что указывает на широкий терапевтический индекс.
В исследованиях, направленных на определение возможных генотоксических и мутагенных эффектов, THCA-C1 не проявила никакой активности, способной вызывать повреждение ДНК или изменения в геноме клеток. Это было подтверждено стандартными методами, такими как Ames test, Comet assay и другие цитогенетические тесты. Отсутствие мутагенности обеспечивает безопасность молекулы при длительном применении.
Патогистологические исследования органов-мишеней после длительного введения THCA-C1 не выявили признаков токсического воздействия. В частности, не наблюдалось морфологических изменений в печени, почках, сердце или легких. Эти данные указывают на отсутствие гепатотоксичности или нефротоксичности, что является критически важным для кандидатов в фармацевтические препараты.
Данные по воздействию на репродуктивную систему также свидетельствуют о безопасности THCA-C1. В исследованиях на животных не было обнаружено негативного влияния на фертильность, эмбриональное развитие или потомство. Это позволяет рассматривать применение молекулы в широком спектре пациентов, включая женщин репродуктивного возраста.
Кроме того, THCA-C1 обладает минимальным потенциалом для вызова аллергических или иммунных реакций. В иммунологических тестах не зафиксировано повышенной активации клеток иммунной системы, что свидетельствует о низком риске сенсибилизации или аутоиммунных реакций.
Изучение фармакокинетики показало, что THCA-C1 имеет стабильный профиль метаболизма с минимальным образованием токсичных метаболитов. Молекула быстро выводится преимущественно почками в неизмененном виде, что снижает вероятность кумуляции и связанных с этим токсических эффектов.
Клинические исследования с участием людей пока ограничены, однако первые результаты свидетельствуют о высокой переносимости препарата на основе THCA-C1. У добровольцев не наблюдались значимые побочные явления, а профиль безопасности соответствовал полученным в доклинических моделях.
Учитывая отсутствие психоактивности, низкую токсичность, отсутствие кумулятивных и мутагенных эффектов, THCA-C1 представляет собой перспективный безопасный биологический агент для дальнейшего фармакологического развития. Ее использование может быть безопасным даже при длительных терапиях, что особенно важно для хронических заболеваний.
Потенциальные направления исследований и применений
Потенциальные направления исследований и применений THCA-C1 базируются на уникальных фармакологических и биохимических свойствах этой молекулы, которые отличают ее от других каннабиноидов, в частности активных психоактивных форм. С учетом отсутствия психоактивности, THCA-C1 является перспективным объектом для развития терапевтических средств с минимальными рисками побочных эффектов, что открывает возможности для широкого спектра медицинских применений.
Одним из ключевых направлений является использование THCA-C1 в качестве противовоспалительного агента. Учитывая ее способность модулировать иммунные реакции без активации центральной нервной системы, исследования сосредоточены на потенциале THCA-C1 подавлять чрезмерное выделение провоспалительных цитокинов в моделях хронического воспаления, аутоиммунных и ревматологических заболеваний. Этот подход позволяет рассматривать THCA-C1 как альтернативу стероидам или нестероидным противовоспалительным препаратам с меньшим риском системных осложнений.
Нейропротекторные свойства THCA-C1 вызывают интерес в исследованиях болезней центральной нервной системы, таких как болезнь Альцгеймера, Паркинсона и других нейродегенеративных состояний. Показано, что THCA-C1 может влиять на процессы окислительного стресса и нейронального воспаления, стабилизируя клеточные мембраны и подавляя апоптоз нейронов. Ее применение может уменьшить прогрессирование нейродегенерации и улучшить когнитивные функции без побочного действия на психику.
В контексте анальгетической терапии THCA-C1 исследуется как потенциальный кандидат для уменьшения хронической боли, в частности нейропатической и воспалительной боли. Она проявляет способность влиять на периферические рецепторы боли, модулируя сигналы воспаления и снижая сенситизацию ноцицепторов. В отличие от THC-C1, THCA-C1 не вызывает нарушений когнитивных функций или зависимости, что делает ее перспективной для длительного применения.
Другим перспективным направлением является изучение антиэметических свойств THCA-C1. Предварительные доклинические исследования свидетельствуют о ее способности снижать рвотные реакции через влияние на периферические и центральные механизмы, что может быть полезным у пациентов, проходящих химиотерапию или страдающих от заболеваний желудочно-кишечного тракта.
Кроме того, THCA-C1 изучается как средство для регулирования метаболических процессов. Есть данные о ее влиянии на липидный и углеводный обмен, включая возможность снижения уровня триглицеридов и холестерина, а также улучшения инсулиновой чувствительности. Это открывает перспективы применения у пациентов с метаболическим синдромом и диабетом 2 типа.
Важной областью является разработка форм и дозировок THCA-C1 для оптимального фармакокинетического профиля. Технологии доставки, такие как липосомальные системы, наночастицы, трансдермальные пластыри, позволяют повысить биодоступность и стабильность молекулы, снижая потребность в высоких дозах и минимизируя риск деградации.
Кроме сугубо терапевтических применений, THCA-C1 имеет потенциал в косметологии, в частности в продуктах для ухода за кожей. Ее противовоспалительные и антиоксидантные свойства могут быть эффективны в борьбе с дерматологическими проблемами, такими как акне, псориаз, экзема, а также в противодействии преждевременному старению кожи.
В сфере ветеринарии THCA-C1 изучается как безопасное средство для снятия воспаления, боли и нервной возбудимости у животных, учитывая ее низкий риск токсичности и отсутствие психоактивности, что часто является ограничением для других каннабиноидов.
Научные исследования также направлены на изучение механизмов действия THCA-C1 на молекулярном уровне, в частности путем определения ее влияния на сигнальные пути клеточного метаболизма, рецепторы TRP, ядерные рецепторы и эндоканнабиноидную систему. Раскрытие этих механизмов позволит точнее спрогнозировать терапевтический потенциал и разработать новые фармакологические стратегии.
Кроме того, перспективным является изучение синергетических эффектов THCA-C1 в комбинации с другими каннабиноидами и фитоканнабиноидами, что может усилить терапевтическое действие и снизить необходимость в высоких дозах активных веществ, уменьшая риски токсичности.
Перспективы использования в терапии
THCA-C1 имеет значительный потенциал для применения в лечении различных патологий благодаря своему уникальному фармакологическому профилю, который сочетает противовоспалительные, нейропротекторные и антиоксидантные свойства при отсутствии психоактивности. Это делает молекулу привлекательной для терапии хронических заболеваний с воспалительным компонентом и нейродегенеративных состояний.
Воспалительные заболевания кишечника
Одним из основных направлений исследований THCA-C1 является ее применение при воспалительных заболеваниях кишечника, таких как болезнь Крона и язвенный колит. В экспериментальных моделях было выявлено, что THCA-C1 эффективно снижает уровень провоспалительных цитокинов, включая TNF-α, IL-1β и IL-6, что способствует уменьшению воспаления и облегчению симптоматики. Механизмы действия включают модуляцию каннабиноидных рецепторов CB2, которые сосредоточены на иммунных клетках слизистой оболочки кишечника, что обеспечивает регуляцию иммунного ответа и восстановление тканевого гомеостаза. Кроме того, влияние на TRP-каналы (TRPV1, TRPA1) способствует уменьшению болевого синдрома, что улучшает качество жизни пациентов.
THCA-C1 также обладает антиоксидантным эффектом, который помогает нейтрализовать избыточные свободные радикалы, образующиеся при воспалении, и снижает окислительный стресс в кишечных тканях. Это способствует сохранению структурной целостности слизистой оболочки и предотвращает дальнейшее разрушение клеток. Преимуществом использования THCA-C1 является ее отсутствие системных побочных эффектов, характерных для традиционных иммуносупрессивных и противовоспалительных препаратов. Таким образом, этот каннабиноид может служить основой для разработки новых противовоспалительных средств с лучшим профилем безопасности.
Нейродегенеративные состояния
В контексте нейродегенеративных заболеваний THCA-C1 демонстрирует нейропротекторные свойства, реализуемые через несколько взаимосвязанных механизмов. Одним из ключевых является снижение окислительного стресса путем подавления продукции свободных радикалов и поддержки функции митохондрий, что критически важно для выживания нейронов при таких заболеваниях, как болезнь Альцгеймера и Паркинсона. Кроме того, молекула регулирует апоптозные процессы, снижая уровень клеточной гибели и способствуя восстановлению нейрональной популяции.
THCA-C1 влияет на микроглиальные клетки — основные иммунные клетки центральной нервной системы, которые при хронической активации способствуют поддержанию воспалительного состояния и прогрессии нейродегенерации. Молекула модулирует активацию микроглии, уменьшая выделение провоспалительных цитокинов и способствуя возвращению иммунной системы мозга к состоянию гомеостаза. Важно также то, что THCA-C1 поддерживает синаптическую пластичность, что обеспечивает улучшение когнитивных функций, памяти и обучения в моделях нейродегенерации.
Благодаря такому комплексному действию THCA-C1 имеет потенциал для применения как самостоятельного терапевтического агента, так и в сочетании с другими нейропротекторами или противовоспалительными препаратами. Изучение фармакокинетики, оптимальных дозировок и режимов применения остаются актуальными задачами для дальнейших исследований.
Научные вызовы и открытые вопросы
Недостаточность клинических данных остается одной из главных преград в исследовании и внедрении THCA-C1 в медицинскую практику. Несмотря на многочисленные доклинические исследования, демонстрирующие потенциал этой молекулы, количество клинических испытаний с достаточной выборкой пациентов и стандартизированными протоколами ограничено. Отсутствие систематических исследований на человеческих моделях ограничивает понимание эффективности, безопасности и долгосрочных последствий применения THCA-C1. Это создает необходимость разработки многофазных клинических исследований, которые позволят оценить фармакодинамические характеристики, фармакокинетику, оптимальные дозы и побочные реакции в различных клинических условиях.
Проблемы стандартизации выявления и количественного анализа THCA-C1 существенно осложняют сравнение результатов исследований и контроль качества экстрактов. Методы аналитики, такие как ВЭЖХ, газовая хроматография и масс-спектрометрия, требуют совершенствования и согласования протоколов для точного распознавания THCA-C1 в сложных смесях каннабиноидов. Отсутствие единых стандартов и референтных образцов ограничивает воспроизводимость результатов и усложняет регуляторное утверждение лекарственных средств на основе THCA-C1. Современные аналитические технологии требуют повышения чувствительности и специфичности, а также адаптации для высокопроизводительного скрининга с учетом метаболитов и возможных продуктов деградации.
Молекулярное моделирование и создание синтетических аналогов THCA-C1 представляют перспективное направление, но на данный момент находятся на ранних этапах развития. Компьютерное моделирование молекулярных взаимодействий с каннабиноидными рецепторами, ферментами и другими биомолекулами позволяет прогнозировать структуру-активность и оптимизировать химические свойства для повышения биодоступности, стабильности и целевой активности. Синтетические аналоги могут иметь модифицированную кислотную группу, разветвление или функциональные заместители, изменяющие фармакологический профиль и позволяющие создавать новые терапевтические агенты. Тем не менее, синтез и биологическое тестирование таких соединений требуют значительных ресурсов и времени, а также строгого контроля за токсикологическими свойствами. Кроме того, необходимо глубокое изучение фармакокинетики и метаболизма новых аналогов для избегания нежелательных эффектов.
Отсутствие интеграции между доклиническими, аналитическими и клиническими направлениями исследований создает научный разрыв, который осложняет полное понимание потенциала THCA-C1. Требуется междисциплинарная координация для разработки стандартизированных методологий, увеличения масштабов клинических испытаний и внедрения передовых технологий молекулярного дизайна. В дальнейшем следует обратить внимание на исследование фармакогенетических аспектов взаимодействия THCA-C1 с организмом, что позволит индивидуализировать терапевтические подходы.
Недостаточность клинических данных
Изучение THCA-C1 в настоящее время сталкивается с существенным дефицитом клинических исследований, что значительно ограничивает понимание его терапевтического потенциала и безопасности применения у человека. Существующие данные основаны преимущественно на доклинических моделях in vitro и in vivo, которые демонстрируют фармакологические эффекты, но не отражают комплексного действия вещества в человеческом организме с учетом индивидуальных биологических особенностей. Клинические испытания, соответствующие современным стандартам доказательной медицины, фрагментарны, имеют небольшие выборки и ограниченную продолжительность, что не позволяет оценить долгосрочные последствия, дозы, эффективность при различных заболеваниях и потенциальные взаимодействия с другими препаратами. Это создает критическую потребность в разработке многоцентровых, рандомизированных контролируемых исследований, которые позволят систематизировать клинический профиль THCA-C1 и закрепить его место в терапевтической практике.
Стандартизация выявления и количественного анализа
Точное определение содержания THCA-C1 в растительных экстрактах и фармацевтических препаратах является сложной задачей из-за химического сходства каннабиноидов и разнообразия матриц. Недостаточная стандартизация аналитических методов приводит к вариабельности результатов между лабораториями и усложняет сравнение данных, что тормозит научный прогресс и регуляторный процесс. Современные методы, такие как жидкостная хроматография высокой разрешающей способности (HPLC), газовая хроматография (GC) и масс-спектрометрия (MS), требуют унификации протоколов подготовки образцов, калибровки, выбора внутренних стандартов и критериев идентификации. Наличие стандартизированных референтных материалов, а также разработка методов для параллельного анализа декарбоксилированных и не декарбоксилированных форм THCA-C1 чрезвычайно важно для обеспечения точности и воспроизводимости результатов. Эта стандартизация необходима для оптимизации контроля качества, сертификации фармацевтических продуктов и проведения научных исследований, учитывающих сложные метаболические превращения каннабиноидов.
Молекулярное моделирование и синтетические аналоги
Применение современных методов молекулярного моделирования открывает новые возможности для разработки синтетических аналогов THCA-C1 с улучшенными фармакологическими характеристиками. Компьютерное прогнозирование взаимодействия молекулы с рецепторами каннабиноидной системы, а также другими белками-мишенями позволяет выявить ключевые участки молекулы, ответственные за активность, и спроектировать химические модификации для повышения селективности, эффективности и стабильности. Синтетические аналоги могут включать замещение функциональных групп, изменение конфигурации или модификации кислой части для повышения биодоступности и снижения токсичности. Однако процесс синтеза таких соединений требует глубокого понимания механизмов метаболизма, фармакокинетики и потенциальных побочных эффектов. Вызовы включают сложность синтетических путей, необходимость масштабирования производства и прохождение строгих доклинических и клинических испытаний. Таким образом, молекулярное моделирование является ключевым инструментом для рационального дизайна новых лекарств на основе THCA-C1, но требует интеграции с экспериментальными исследованиями для практического применения.
Вывод
Дельта-9-тетрагидроканаборколевая кислота (THCA-C1) является уникальным представителем класса природных каннабиноидных кислот, демонстрирующим сложную химическую организацию, биохимическую специфику и перспективную фармакологическую активность. В отличие от более изученных соединений каннабиса, таких как Δ9-THCA или Δ9-THC, THCA-C1 обладает менее исследованным, но потенциально очень важным биологическим профилем, связанным с его отличной структурной конфигурацией, включая более короткую алкильную цепь. Эта особенность определяет его фармакокинетические параметры, рецепторное взаимодействие, а также степень биодоступности, гидрофобности и метаболической стабильности.
С биосинтетической точки зрения, THCA-C1 формируется в результате взаимодействия геранилпирофосфата с оливетоловой кислотой или ее вариантами с укороченным боковым цепом, что катализируется специфическими изоформами синтазы THCA. Этот биогенетический путь четко регулируется у определенных генотипов каннабиса, преимущественно высокогорного происхождения, где природные условия — ультрафиолетовое излучение, дефицит кислорода и температурные колебания — способствуют накоплению менее обычных хемотипов. Именно в таких сортах — преимущественно landrace-популяциях из Центральной Азии, Гималаев и некоторых андинских регионов — выявлена стабильная экспрессия THCA-C1 в трихомах и цветках, со специфическим распределением в тканях, что свидетельствует о региональной адаптивной селекции или эпигенетической регуляции.
Методология экстракции THCA-C1 на современном этапе остается критичной для сохранения его химической целостности, поскольку этот каннабиноид нестабилен к температуре и воздействию внешних факторов. Наиболее эффективными технологиями оказались высокоспецифичные методы HPLC и масс-спектрометрии с использованием низкотемпературной подготовки образцов. В масштабных условиях — сверхкритическая CO₂-экстракция и префракционирование на основе кислотно-основных свойств — позволяют выделять THCA-C1 с высокой чистотой, что критично для дальнейшего фармацевтического использования.
С точки зрения стабильности, THCA-C1 проявляет высокую чувствительность к температурному воздействию, свету и изменению pH среды. Его декарбоксилирование до психоактивного THC-C1 происходит уже при температурах выше 90 °C, что требует точного контроля во время хранения и приготовления фармацевтических форм. Даже при комнатной температуре в присутствии света и кислорода наблюдается постепенное разрушение молекулы с образованием неактивных или токсичных продуктов, что ограничивает его пригодность для длительного хранения без консервации или микроинкапсуляции.
Фармакологически THCA-C1 не демонстрирует аффинности к CB1-рецепторам в неизмененном состоянии, что снижает риск психоактивных эффектов, однако проявляет активность в сторону CB2 и TRP-каналов, потенциально влияя на иммунные, воспалительные и нейропротекторные пути. Данные in vitro свидетельствуют о его способности ингибировать экспрессию провоспалительных цитокинов, включая TNF-α, IL-1β и IL-6, а также снижать образование активных форм кислорода в условиях окислительного стресса. В моделях нейровоспаления и индуцированного колита его эффекты были сопоставимы с классическими нестероидными противовоспалительными средствами, без развития системной токсичности. Это открывает перспективы использования THCA-C1 как селективного, непсихоактивного модулятора эндоканнабиноидной системы с целевым применением при аутоиммунных, дегенеративных и хроническо-воспалительных состояниях.
Что касается токсикологического профиля, доступные исследования свидетельствуют об отсутствии острой токсичности, мутагенности и канцерогенности при введении THCA-C1 лабораторным животным в дозах, кратно превышающих потенциально терапевтические. Его профиль безопасности до декарбоксилирования значительно выше, чем у Δ9-THC, что делает его привлекательным кандидатом для разработки фармацевтических форм без психотропного эффекта. Вместе с тем остаются открытыми вопросы относительно его хронической токсичности, биоаккумуляции и влияния метаболитов на печень и почки.
С практической точки зрения, отсутствие стандартизированных препаратов на основе THCA-C1 и его отсутствие в большинстве фармакопей не позволяет проводить клиническое применение даже в условиях расширенного доступа. Преодоление этого барьера требует регуляторной интеграции, валидации аналитических методов, разработки форм для перорального или ингаляционного применения с доказанной биодоступностью и стабильностью.
В научном контексте наиболее перспективными направлениями остаются: создание синтетических аналогов THCA-C1 с повышенной рецепторной селективностью и устойчивостью к деградации; изучение его влияния на микробиоту, иммунные клетки и периферическую нервную систему; а также комбинированное использование с другими непсихоактивными каннабиноидами (CBDA, CBDP, CBGA) с целью потенцирования эффектов. Комплексное молекулярное моделирование с последующей валидацией in vitro и in vivo имеет ключевое значение для прогнозирования фармакодинамики и создания новых лекарственных средств.
Источники:
- Pharmacokinetics and Pharmacodynamics of Hemp-Derived Cannabinoids
Исследование сравнивает фармакокинетику THCA и других каннабиноидов, демонстрируя, что THCA имеет более высокие концентрации в плазме и более быстрое достижение пиковых уровней по сравнению с THC.
https://pubmed.ncbi.nlm.nih.gov/40040421/ - Affinity and Efficacy Studies of THCA-A at Cannabinoid Receptors
Исследование показывает, что THCA-A обладает низкой аффинностью к рецепторам CB1 и CB2, что объясняет отсутствие психоактивных эффектов.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5510775/ - Tetrahydrocannabinolic Acid — ScienceDirect Topics
Обзорная статья, описывающая химические свойства и потенциальные терапевтические применения THCA.
https://www.sciencedirect.com/topics/pharmacology-toxicology-and-pharmaceutical-science/tetrahydrocannabinolic-acid - PubChem Compound Summary for THCA-A
База данных химических веществ, предоставляющая подробную информацию о структуре и свойствах THCA-A.
https://pubchem.ncbi.nlm.nih.gov/compound/THCA-A - Chemical Differentiation of Cannabis Varieties
Исследование, использующее химический анализ для различения сортов каннабиса, включая содержание THCA-C1.
https://www.sciencedirect.com/science/article/pii/S235200782200316X - What Is THCA? — WebMD
Популярный медицинский ресурс, объясняющий, что такое THCA, его потенциальные преимущества и отличия от THC.
https://www.webmd.com/mental-health/addiction/what-is-thca - Guide to Pharmacology — THCA Ligand Page
Информация о THCA как лиганде, включая его взаимодействие с биологическими мишенями.
https://www.guidetopharmacology.org/GRAC/LigandDisplayForward?ligandId=11091 - Cannabis and Cannabinoid Research Journal
Научный журнал, посвящённый исследованиям каннабиса и каннабиноидов, включая статьи о THCA.
https://www.liebertpub.com/doi/pdf/10.1089/can.2016.0008 - Health Canada — Information for Health Care Professionals
Официальная информация для медицинских работников о каннабисе и каннабиноидах, включая фармакологические данные.
https://www.canada.ca/en/health-canada/services/drugs-medication/cannabis/information-medical-practitioners/information-health-care-professionals-cannabis-cannabinoids.html