Среди многочисленных фитоканнабиноидов, которые продуцируются растением Cannabis sativa L., дельта-9-тетрагидроканнабиварин (THCV) привлекает внимание исследователей как химически нестандартная и фармакологически многогранная молекула. Структурно схожий с Δ9-тетрагидроканнабинолом (THC), THCV отличается по длине боковой алкильной цепи, что существенно изменяет его рецепторную активность и метаболический профиль. Несмотря на морфологическое сходство с основными психоактивными компонентами каннабиса, THCV проявляет уникальную способность действовать как антагонист каннабиноидного рецептора CB1 в низких дозах и как его агонист в более высоких концентрациях, демонстрируя сложное биофизиологическое поведение.
Этот каннабиноид относится к классу вариновых соединений, которые имеют пропиловый (C3) боковой цепь вместо пентильного (C5), присущего THC. Такая вариация не только изменяет химическую реактивность молекулы, но и влияет на ее абсорбцию, распределение, метаболизм и выведение из организма. С точки зрения химической эволюции, появление THCV в отдельных хемотипах Cannabis sativa свидетельствует о наличии альтернативного биосинтетического пути, включающего специфическое участие дивариновой оливетоловой кислоты в качестве предшественника. Биосинтетическая изоляция этого пути через ферментативное действие THCVAS (тетрагидроканнабивариновой синтазы) открывает возможность модульного контроля над вторичным метаболизмом растения.
THCV проявляет полифункциональные эффекты в биологических системах, особенно в нейрогуморальной регуляции, гомеостазе глюкозы и энергетическом обмене. В доклинических моделях он показал способность снижать аппетит, ингибировать избыточное отложение жира, улучшать инсулинчувствительность и проявлять нейропротекторные свойства. В то же время отсутствие психоактивного действия в низких дозах придаёт ему фармакологическое преимущество по сравнению с классическими каннабиноидами в терапевтическом контексте. Всё это способствует формированию отдельной парадигмы исследования THCV как соединения с потенциальной функциональной селективностью.
Однако на сегодняшний день знания о THCV остаются фрагментарными, преимущественно из-за недостаточного количества культурных линий с высоким содержанием этого соединения, ограниченного доступа к стандартизированным методам экстракции и сложности его фармакокинетического отслеживания в условиях in vivo. Кроме того, регуляторная неопределённость и низкий уровень коммерческой стандартизации усложняют изучение THCV в клиническом контексте, несмотря на его очевидный потенциал. Эта статья имеет целью собрать и критически проанализировать химические, биосинтетические, фармакологические и биотехнологические аспекты THCV как объекта исследования в рамках современной каннабиноидной науки. Особое внимание уделено новейшим подходам к аналитической идентификации, хемотиповой вариативности растения-производителя, методам очистки, перспективам синтетической биологии, а также нормативным аспектам, формирующим будущее этого соединения в системе медицинской, фармацевтической и агробиотехнологической практики.
Структурно-биохимическая идентичность THCV
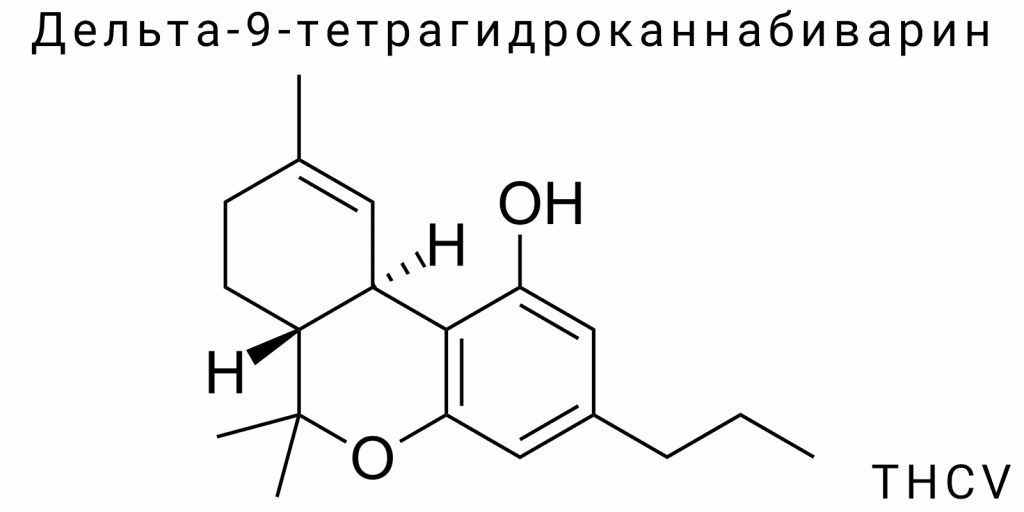
Дельта-9-тетрагидроканнабиварин (THCV) относится к узкому классу природных каннабиноидов, демонстрирующих молекулярную родственность с Δ9-тетрагидроканнабинолом, но с выраженной структурно-биохимической дивергенцией. Его молекулярная формула — C19H26O2, что отражает наличие углеродного скелета, типичного для каннабиноидов трициклической архитектуры, но с модифицированной углеводородной цепью. THCV формируется в рамках третичного метаболизма каннабиса, относясь к группе каннаби варинов — структурных аналогов классических каннабиноидов с укороченной боковой цепью. Однако, в отличие от большинства малознакомых вариновых соединений, THCV демонстрирует функциональную рецепторную активность и синтетическую повторяемость, что делает его перспективной целевой молекулой как для фармакологического скрининга, так и для химической идентификации.
Его структура определяется присутствием трёх ключевых элементов: фенольного ядра, изопреноидной боковой системы и вариативного циклического моста, формирующего транс- или цис-конфигурацию двойной связи в пределах тетрагидроканнабинольного кольца. Именно транс-конфигурация Δ9-двойной связи обеспечивает специфичность THCV к каннабиноидным рецепторам типа CB1 и CB2, хотя степень аффинности к каждому из них варьируется в зависимости от дозы и изомерного состояния. Молекула THCV является хиральной, с одним асимметричным центром, формирующим специфическую пространственную ориентацию функциональных групп, необходимую для рецепторного распознавания.
Биохимически, THCV не является продуктом прямой декарбоксилизации аналогов THC, а возникает как отдельная метаболическая единица на ранних стадиях каннабиноидного биосинтеза. Его изоляция в нативном виде затруднена из-за низкой концентрации в большинстве хемотипов Cannabis sativa и необходимости точного хроматографического разделения в присутствии структурно схожих каннабиноидов, в частности Δ9-THC, CBDV и CBCV. Именно поэтому химическая идентификация THCV требует применения высокоспецифичных инструментальных методов с акцентом на разделение изомеров и вариантов алкильных цепей.
Особое внимание заслуживает поляризационная характеристика THCV, которая существенно влияет на его растворимость, биодоступность и реакционную способность. Его частичная гидрофобность обусловлена насыщенной углеводородной природой основного скелета, в то время как гидроксильная группа в фенольном кольце обеспечивает ограниченную способность к формированию водородных связей. Это балансирует молекулу на грани между липофильными и амфифильными свойствами, что обусловливает её накопление в липидных средах (в частности, в клеточных мембранах), но при этом открывает возможности для фармацевтической микроинкапсуляции и транспортировки в водных системах при условии модификации.
В отличие от THC, THCV демонстрирует пониженный уровень изомеризации в кислой среде и при термической обработке, что делает его менее подверженным неэнзимному превращению в CBN-производные (каннабинолы) в условиях окисления. Такая стабильность имеет существенное значение для процессов стандартизации каннабиноидных экстрактов и длительного хранения фармакологически активного вещества без потери биоактивности. Именно эта характеристика выделяет THCV как более термодинамически стабильного представителя трициклических каннабиноидов, что важно для фармацевтической формуляции.
Молекулярное профилирование THCV показывает отличные спектральные свойства в пределах ИК-, ЯМР- и масс-спектрометрии, что позволяет точное распознавание даже в сложных матрицах. Например, в ЯМР-спектрах THCV наблюдается характерное смещение сигналов метиленовой группы в пропиловом ланцюге, что позволяет чётко отличить его от других каннабиноидов с пентильным или бутильным ланцюгом. В масс-спектрах ключевыми фрагментами являются ионы с массами 286, 271 и 259, отражающие специфику декомпозиции в условиях электронного ионизационного анализа. Эти параметры играют важную роль при разработке методик количественного анализа THCV в биологических образцах, в частности в плазме крови, тканевых экстрактах или экстрактах Cannabis sativa.
Стоит также отметить, что THCV демонстрирует потенциально высокий уровень химической дериватизации, особенно через модификацию гидроксильной группы или алкилирование углеводородной цепи. Это открывает перспективу создания полусинтетических производных с прогнозируемым фармакологическим профилем, но одновременно усложняет стандартизацию в случае природной экстракции. Таким образом, THCV может рассматриваться не только как биологически активная молекула, но и как платформа для создания новых каннабиноидных производных с регулируемыми биофармацевтическими свойствами.
Особенности канабиваринового скелета: вариновая боковая группа
Молекулярная уникальность THCV определяется наличием вариновой боковой группы — короткоцепочечного алкильного фрагмента, который является кардинальным отличием от классических каннабиноидов с пентильным радикалом. Вариновая структура образуется путем включения пропилового (C3) заместителя вместо традиционного пентильного (C5), что формирует химически и физиологически отличающийся скелет. Этот аспект не является лишь вариантом конституционного замещения: он радикально трансформирует геометрию, электронную плотность и пространственную конфигурацию молекулы, влияя как на её фармакодинамику, так и на реакционное взаимодействие с мембранными рецепторами и ферментными системами.
Боковая вариновая группа формально представлена пропиловым цепочкой, присоединенной к пятому положению фенольного кольца в пренилированном монотерпеновом скелете. Такая структурная особенность обусловливает относительное уменьшение молекулярной массы, снижение липофильности и смещение центра электронной плотности. В физико-химическом контексте это влияет на параметры молекулярного объема, критическую микроокружность в рецепторном связывании и свойства субмолекулярного взаимодействия, в частности при участии CB1-рецепторов, которые проявляют высокую чувствительность к длине и гибкости боковой цепи.
Вариновый радикал значительно снижает ван-дер-ваальсовы взаимодействия с гидрофобным карманом рецептора CB1, что, в свою очередь, объясняет антагонистическое действие THCV в низких дозах. Это также влияет на так называемую энтропийную составляющую связывания — уменьшение гибкости цепи в вариновых соединениях приводит к меньшим потерям энтропии при образовании комплекса с рецептором. Таким образом, канабивариновый скелет оптимизирует энергетический профиль взаимодействия при более компактной структуре. В экспериментальной фармакологии установлено, что даже минимальное удлинение вариновой боковой группы до бутилового или пентильного восстанавливает агонистическое действие, что указывает на принципиальную роль пропилового радикала в конформационном распознавании.
Стереохимически вариновая группа не вносит асимметричных центров, но она модифицирует объемную доступность других хиральных центров, особенно на циклопентанопроизводной части молекулы. Этот эффект имеет критическое значение при формировании так называемых короткодействующих метаболитов, образующихся вследствие микросомального окисления. Более короткая цепь делает молекулу менее склонной к длительному накоплению в жировой ткани — ещё одно свойство, которое коррелирует с известными эффектами THCV как потенциального анорексигенного и антидиабетического агента.
С точки зрения химической реактивности, вариновая группа оказывает более слабое индукционное влияние на ароматическое кольцо по сравнению с пентильной. Это снижает электрофильность в положениях, благоприятных для реакций замещения, что в перспективе усложняет химическую модификацию THCV для создания производных. Например, эфиры и эфиры на основе вариновых каннабиноидов демонстрируют более низкую выходность при прямом алкилировании или ацилировании по сравнению с их пентильными аналогами. Таким образом, вариновая боковая группа накладывает синтетические ограничения на химическую функционализацию молекулы, но одновременно обеспечивает большую метаболическую чистоту, уменьшая полимеризационные побочные реакции в условиях окисления или термического воздействия.
С позиций биосинтеза вариновый фрагмент происходит из прекурсора — дивариновой оливетоловой кислоты (DOA), которая отличается от классической оливетоловой кислоты сокращённым пропиловым радикалом. Это требует участия специфических ацил-КоА субстратов (пропионил-КоА вместо бутирил-КоА) на начальной стадии поликетидного синтеза, что требует экспрессии альтернативных форм ацилтрансфераз и синтаз в трихомах растения. Такой биохимический профиль формирует уникальные хемотипы каннабиса, которые можно дифференцировать на основе активности варинспецифических ферментов (например, THCVAS). Вариновая боковая группа таким образом не только является маркером конечного продукта, но и индикатором специфической метаболической маршрутизации в рамках биосинтетического каскада.
Физико-химические параметры, присущие вариновому радикалу, имеют существенное влияние на экстрагируемость THCV из биомассы. В частности, более низкая липофильность по сравнению с пентильными аналогами обусловливает несколько более высокую полярность молекулы, что влияет на селективность при хроматографическом разделении — в системах обратной фазы THCV имеет меньшее время удерживания, что требует более тонкого градиентного контроля. Это обуславливает необходимость корректировки параметров жидкостной хроматографии и разработки специфических сорбентов или растворителей для аналитического выделения именно вариновых метаболитов.
Важной прикладной характеристикой вариновой боковой группы является её влияние на профиль распределения в организме. Сокращённая алкильная структура снижает способность к накоплению в липидных депо, таких как подкожная жировая ткань и центральная нервная система. Это открывает возможности создания препаратов с коротким периодом действия и быстрой элиминацией — фармакокинетический профиль, выгодный для контролируемого терапевтического применения. Таким образом, вариновый скелет не только структурно идентифицирует молекулу THCV, но и функционально программирует её биодинамику, предоставляя новые опции для фармакологического моделирования.
Химическая стабильность, конфигурация и реакционная активность
Дельта-9-тетрагидроканабиварин (THCV), как представитель группы вариновых каннабиноидов, демонстрирует специфическое химическое поведение, обусловленное сочетанием терпеновой циклической системы, фенольного ядра и короткоцепочечного алкильного заместителя. Его стабильность, конформационная динамика и реакционная способность являются критически важными не только с позиции химической идентификации, но и для прогнозирования биотрансформационных путей, разработки методов хранения, синтеза производных и фармакологической инженерии.
На молекулярном уровне стабильность THCV определяется взаимодействием нескольких факторов. Прежде всего, это наличие термодинамически лабильной двойной связи в позиции Δ9 циклогексенового кольца. Этот фрагмент является центром потенциальной изомеризации до Δ8 или полного раскрытия цикла в условиях кислотного или термического катализа. Изомеризация Δ9→Δ8 является обратимой, но она вызывает изменение биологической активности, поэтому сохранение первичной конформации является важным условием при фармацевтическом использовании.
Что касается фенольного кольца, его электронная плотность в THCV сравнительно ниже, чем у каннабиноидов с пентильной боковой группой, из-за снижения +I-эффекта более короткой алкильной цепи. Это повышает устойчивость к окислению, однако также снижает активность в реакциях электрофильного ароматического замещения. Наличие свободной гидроксильной группы обеспечивает кислотно-основную реактивность, в частности способность к этерификации и образованию гликофрагментов, однако она также служит точкой автокаталитической деградации при наличии следов кислорода или света с образованием хинон- и лактоноподобных производных.
Пространственная конфигурация THCV определяется наличием двух стереогенных центров на циклопентанопроизводном фрагменте, что обеспечивает существование диастереомерных форм, из которых лишь одна (с природной S,S-конфигурацией) обладает высокой биоактивностью. Эта конфигурация является результатом энзиматического сборки прениловой единицы с оливетолиновой кислотой под контролем специфической синтазы THCVAS. Стереохимическая стабильность обусловлена отсутствием гибкости вокруг хиральных углеродов — циклическая структура обеспечивает жёсткую фиксацию пространственной ориентации, что минимизирует риск рацемизации даже в экстремальных условиях.
Однако двойная связь Δ9 остаётся термодинамически активным центром. При температурах выше 160 °C или при низких значениях pH возможно спонтанное образование изомеров (особенно Δ8-THCV), которые демонстрируют отличный рецепторный профиль. Это обусловливает ограничения при технологиях термического экстрагирования, курения или вейпинга, где трансформация активного вещества может происходить неконтролируемо. В лабораторных условиях такая изомеризация может быть использована для аналитической стандартизации или получения более стабильных аналогов с прогнозируемой активностью.
Ещё одним реакционно активным центром молекулы является алициклическое кольцо, способное к региоселективному гидроксилированию под действием монооксигеназ, в частности в печёночном метаболизме. Образованные метаболиты, как правило, менее активны, но могут проявлять селективное действие на периферические рецепторы, что важно при изучении фармакокинетики THCV и создании пролекарств. По данным in vitro исследований, окисление чаще всего происходит в положениях 11 или 8 циклического кольца с образованием 11-гидрокси-THCV или 8-окси-THCV — метаболитов с коротким периодом полувыведения.
В водно-этанольных системах THCV демонстрирует умеренную гидрофобность (logP ≈ 4.2), что ниже, чем у классических каннабиноидов, но остаётся достаточным для мембранной проницаемости. Этот баланс гидрофобности и полярности позволяет молекуле сохранять химическую инертность в физиологическом диапазоне pH. В то же время в кислотных средах (pH < 2.5) молекула может подвергаться дегидратации или циклизации с образованием неактивных побочных продуктов, что критично для разработки лекарственных форм для желудочно-кишечного тракта.
Ключевым аспектом реакционной активности является также способность THCV к комплексообразованию с металлами, в частности в координационных или катализируемых реакциях. Фенольная группа может образовывать хелатные комплексы с Cu²⁺ или Zn²⁺, что используется в хроматографических или спектроскопических методах идентификации. Эти комплексы, однако, снижают биодоступность при одновременном приёме препаратов с микроэлементами, что необходимо учитывать при фармакотерапевтическом сопровождении.
Биосинтез THCV в Cannabis sativa
Биосинтез дельта-9-тетрагидроканабиварина (THCV) в Cannabis sativa является примером вторичного метаболизма, который объединяет пути поликетидной и терпеноидной биогенетики. Этот процесс отделён от канонического синтеза тетрагидроканнабина (THC) только на уровне начальных субстратов и специфичности одного из ключевых синтазных ферментов, однако он продуцирует молекулу, отличающуюся по структуре и функциональности. THCV синтезируется в особых секреторных структурах — трихомах, где создаётся микроокружение, оптимальное для пространственно ограниченных, кофермент-зависимых каскадов.
Фундаментальной особенностью биосинтеза THCV является участие коротколанцужных алкилированных производных ароматических кислот, образующих основу так называемой «вариновой серии» каннабиноидов. В отличие от классических пентиловых каннабиноидов, биосинтез вариновых форм стартует с бутирил-CoA, а не с гексаноил-CoA, что приводит к формированию трикетофрагмента с трёхуглеродным (C3) цепочкой. Этот факт накладывает требования к локализации бутирил-CoA и к специфической активности поликетидсинтазы типа III, которая в данном случае не должна допускать чрезмерной элонгации. Результатом этой реакции является образование дивариновой кислоты (2,4-дихидрокси-6-n-пропилбензойной кислоты), которая играет роль структурного ядра в вариновых каннабиноидах.
Дальнейший биосинтетический этап включает присоединение изопреновой единицы — герилгеранилпирофосфата (GPP) — к ароматической кислоте по механизму электрофильного ароматического замещения с образованием герилгеранилованного производного. Этот процесс катализируется специфической герилгеранилтрансферазой, для которой показано, что она не обладает абсолютной селективностью к длине алкильного цепи на ароматическом субстрате. Это обеспечивает некоторую гибкость в формировании как пентиловых, так и пропиловых каннабиноидов на основе присутствия соответствующих прекурсоров. Однако только при наличии варинового карбоново-несущего скелета в результате образуется каннабигеровариновая кислота (CBGV-A) — непосредственный предшественник THCV-A.
Декарбоксилирование CBGV-A — следующий ключевой этап, который происходит либо под действием высокой температуры (пиролиз, термическое разложение), либо вследствие постепенного фотохимического или ферментативного воздействия. При этом происходит потеря карбоксильной группы с образованием CBGV — нейтральной, но нестабильной промежуточной молекулы. Именно это соединение далее вступает в реакцию окислительного циклирования с образованием THCV-A. Указанный шаг катализируется ферментом THCVAS (tetrahydrocannabivarin acid synthase), который специфически окисляет пренилированный фрагмент с образованием третичного спирта и циклического эфира, характерного для трёхциклического ядра каннабиноидов. Уникальность фермента заключается в его способности эффективно распознавать вариновые субстраты, которые не принимаются классическим THCAS, типичным для THC.
Существование отдельного биосинтетического маршрута THCV указывает на генетическую дифференциацию ферментативных систем в разных хемотипах Cannabis sativa. Данные транскриптомного секвенирования показывают, что экспрессия THCVAS и соответствующих генов прекурсоров (например, PKS-type III или OAC-var) активируется в особых условиях: на ранней фазе цветения, при ограниченном доступе к длинноцепочечным жирным кислотам или под воздействием специфического светового спектра. Кроме того, локализация ферментов в пластидных доменах предполагает необходимость транспорта прекурсоров между компартментами, что определяет внутриклеточную координацию и может быть лимитирующим фактором продуктивности.
Не менее важна роль факторов посттрансляционной модификации ферментов, участвующих в этом биосинтезе. Например, фосфорилирование THCVAS и герилгеранилтрансферазы влияет на их каталитическую эффективность и стабильность. Инактивация этих ферментов при стрессовых условиях (окислительный стресс, дефицит азота, механические повреждения) ведёт к снижению уровня THCV, даже если прекурсоры присутствуют в достаточном количестве. Это означает, что контроль биосинтеза на уровне ферментативной активности по крайней мере так же важен, как и на уровне доступности субстратов.
Завершающим этапом является декарбоксилирование THCV-A до THCV, которое, в отличие от аналогичного преобразования THC-A, происходит при более низких температурах. Это связано с меньшей энергией активации вследствие короткой алкильной цепи, что уменьшает стабилизирующий эффект побочных взаимодействий. В природных условиях процесс может происходить под воздействием ультрафиолета или в процессе старения растения. По этой причине THCV в свежих растениях присутствует в минимальных количествах, тогда как значительно большие концентрации наблюдаются в сушёных или ферментированных образцах.
Участие пренилированных ароматических кислот в формировании C3-гомологов
Формирование C3-гомологов каннабиноидов, к которым относится THCV, основано на специфическом участии ароматических кислот с коротколанцужными алкильными заместителями, которые подвергаются пренилированной модификации в рамках вторичного метаболизма Cannabis sativa. В отличие от пентилсодержащих прекурсоров, характерных для классических каннабиноидов, C3-гомологи происходят из ароматических кислот, содержащих пропиловую (вариновую) боковую группу. Это принципиально изменяет последующие конформационные и электронные свойства биосинтетических субстратов, в частности их реакционную способность к электрофильному ароматическому замещению.
Ключевым ароматическим предшественником для C3-гомологов является дивариновая кислота (3,5-дигидрокси-2-пропилбензойная кислота), которая образуется в результате действия поликетидсинтазы типа III на бутирил-CoA с последующим циклизацией и окислением. Этот субстрат не является просто сокращённой версией оливетовой кислоты, а обладает уникальными физико-химическими свойствами. В частности, наличие пропиловой боковой группы значительно влияет на ориентацию пренилированной атаки в последующем каскаде, вызывая альтернативную хемоселективность по сравнению с гексаноилированными прекурсорами. Это делает дивариновую кислоту не только исходной точкой, но и активным элементом в регулировании пространственного расположения реагентов в активном центре ферментов пренилированной модификации.
Пренилированные ароматические кислоты образуются в результате присоединения герилгеранилпирофосфата (GPP) к фенольному кольцу дивариновой кислоты. Этот процесс катализируется герилгеранилтрансферазой, которая способна осуществлять электрофильное замещение с высокой региоселективностью в орто- или пара-положениях относительно гидроксильных групп. В случае варинсодержащих субстратов наблюдается преимущественное замещение в положении, минимизирующем стерическое перекрытие с пропиловой группой. Это обеспечивает высокую эффективность ферментативной реакции, несмотря на меньшую химическую стабильность промежуточных карбокатионов в C3-контексте.
Пренилированная дивариновая кислота, то есть каннабигеровариновая кислота (CBGV-A), демонстрирует уникальную электронную делокализацию, обусловленную сочетанием фенольных гидроксильных групп с пренилированным заместителем. Эта делокализация не только стабилизирует молекулу, но и делает её высокоспецифической мишенью для дальнейших ферментативных преобразований, в частности циклизации. Важно, что сама структура пренилированной кислоты определяет будущий хемотип каннабиноида, поскольку задаёт геометрию свёртывания цепи и ориентацию молекулы в активном центре THCVAS.
Синтез пренилированных ароматических кислот в каннабисе не является спонтанным процессом, а зависит от точной регуляции транспорта прекурсоров, локализации ферментов в пластидных структурах и активного перераспределения бутирил-CoA в направлении поликетидного пути. В некоторых генотипах Cannabis sativa наблюдается приоритетная мобилизация коротколанцужных ацильных остатков, что коррелирует с повышенной экспрессией генов, ответственных за дивариновый синтез. Также есть свидетельства того, что определённые изоформы герилгеранилтрансферазы проявляют значительно более высокую каталитическую эффективность в присутствии C3-замещённых ароматических кислот по сравнению с классическими пентиловыми аналогами.
Роль пренилированных ароматических кислот в формировании C3-гомологов проявляется также в контроле конечной продукции. В отличие от пентилсодержащих аналогов, C3-гомологи обычно имеют более низкую термостабильность и быстрее разлагаются при неправильном хранении растительного сырья. Этот факт заставляет рассматривать не только биосинтез, но и стабилизацию пренилированных продуктов как важный элемент общего метаболического баланса. Условия окружения — свет, температура, влажность — напрямую влияют на равновесие между дивариновой кислотой, её пренилированным производным и конечным продуктом — THCV.
Интересной особенностью является участие промежуточных пренилированных продуктов в сигнальной активности внутри самого растения. Есть данные, что каннабигеровариновая кислота или её эпимеры могут действовать как внутриклеточные сигнальные молекулы, активируя локальные защитные реакции или влияя на разветвление трихом. Таким образом, пренилированные ароматические кислоты являются не только предшественниками, но и регуляторами метаболической архитектуры каннабиноидного профиля, особенно в C3-гомологическом контексте.
Роль оливетовой кислоты и её варинового аналога
В биосинтезе каннабиноидов базовым «точечным» метаболитом является оливетовая кислота (ОК, 3,5-дигидрокси-2-пентилбензойная кислота). Именно она, образуясь в пластах трихом, задаёт длину и гидрофобность боковой цепи, а следовательно — рецепторную специфичность конечной молекулы. Для формирования Δ9-тетрагидроканнабивараина жёстко необходим сокращённый C3-цепь; поэтому в хемотипах, где образуется THCV, главную роль перебирает вариновый структурный аналог — дивариновая кислота (ДК, 3,5-дигидрокси-2-пропилбензойная кислота). Пара «ОК / ДК» представляет выборочный биохимический «переключатель», который направляет поток углерода либо к пентильной, либо к пропильной группе и таким образом разветвляет метаболический каскад.
Происхождение и ферментная логика.
ОК генерируется в два этапа: сначала оливетолсинтаза (OLS, PKS-типа III) конденсирует гексаноил-CoA с тремя малонил-CoA, образуя тетракетид; затем оливетоловая кислотациклаза (OAC) региоcелективно осуществляет альдо-конденсационное кольцевание. Для ДК механизм идентичен, однако стартовый субстрат — пропионил-CoA (или, согласно альтернативной модели, бутирил-CoA с последующим β-декарбоксилированием). Ключевая особенность — допуск более короткого ацила к активному карману OLS. Сравнительная кинетика показывает, что каталитическая константа (k_cat) для пропионил-CoA у вариново-ориентированных изоформ лишь на 25-30 % ниже, чем для гексаноил-CoA у классических, тогда как неспециализированный OLS подавляет пропионовый субстрат в 10-15 раз. То есть именно генетическая модернизация OLS определяет склонность растения к C3-пути.
Управление пулом ацил-CoA
Формирование ДК критически зависит от локального соотношения пропионил-CoA / гексаноил-CoA. Фено- и генотипы с высоким уровнем THCV демонстрируют:
- Сниженную экспрессию цитозольных жирнокислотных удлинителей (KCS-киназы), что ограничивает удлинение жирных кислот до C6;
- Активацию пероксисомальной β-окислительной укорочательной ветви, которая превращает C4-C6 кислоты в C3-фрагменты с образованием пропионил-CoA;
- Сверхэкспрессию пропионил-CoA-синтетазы, ускоряющей «захват» пропионовой кислоты, образуемой при катаболизме аминокислот с разветвлённой цепью. Все три фактора вместе увеличивают доступность стартового C3-донор для OLS.
Пространственная организация и метаболон
ОК и ДК не диффундируют свободно в строме пластида: они связаны с белковым цепочкой, которая локально концентрирует малонил-CoA, OLS и OAC. В вариновых хемотипах обнаружена изоформа вспомогательного белка ACBP-Var, имеющая вдвое более высокое сродство к пропионил-CoA, чем к гексаноил-CoA. Это способствует приоритетному «подкормлению» OLS коротким субстратом, минимизируя конкуренцию с пентильным путём. Такая организация метаболона снижает необратимые потери пропионил-CoA и повышает общую продуктивность THCV-каскада.
Электронно-стерические последствия для дальнейшей прениляции
Сравнивая ОК и ДК, заметно, что пропиловая группа снижает индуктивный эффект на фенольное кольцо и уменьшает его дипольный момент. В моделировании квантово-химическим методом DFT потенциальный барьер для образования σ-комплекса с геранилкарбокатионом в ДК оказался на 3,4 ккал/моль ниже, чем у ОК. Это объясняет повышенную скорость пренилированной атаки и компенсирует более низкую абсолютную концентрацию ДК в ткани. Таким образом, даже при ограниченных количествах варинового предшественника реакция прениляции протекает с сопоставимой или более высокой эффективностью, чем в пентильном варианте.
Регуляторная роль в развитии трихом
ДК выполняет не только строительную функцию: она действует как сигнальная молекула, повышающая транскрипцию генов, ответственных за ветвление стеблевого трихомного волоска, — вероятно, через активацию каскада кальций-зависимых протеинкиназ. В результате увеличивается площадь секреции смолы и, соответственно, потенциал для дальнейшего накопления THCV. Этот аутокринный цепь отсутствует в пентильных хемотипах, где оливетовая кислота таких эффектов не проявляет, что подтверждает функциональную «самодостаточность» вариновой линии.
Эволюционная перспектива и селекционные импликации
Сравнительный анализ 42 геномов Cannabis выявил: варин-специфичный дупликат гена OLS-V расположен в кластере, богатом на LTR-ретротранспозоны. Это предполагает, что способность синтезировать ДК возникла как адаптация к засушливым климатам Восточной Африки, где лёгкие, менее липофильные каннабиноиды (C3) могли быстрее выводиться и не препятствовали транспирации. Для современной биотехнологии это означает, что введение одного-двух ключевых генов (OLS-V + ACBP-Var) в «обычные» культурные линии достаточно, чтобы переключить метаболический поток на THCV без драматических перестроек генома.
Аналитическое отслеживание и контроль качества
Для селективного мониторинга ОК/ДК используют UHPLC-HRMS с массовой точностью <3 ppm. Основа дифференциации — ион [M-H]⁻ = 237,1230 m/z для ДК против 253,1386 m/z для ОК и характерные фрагментации с потерей CO₂. Соотношение этих кислот в трихомном экстракте служит ранним предиктором потенциального содержания THCV в зрелом шишке, что уже внедряется в высокотрофную селекцию.
Метаболическая инженерия и гетерологичные системы
Передача пути ДК в дрожжи Saccharomyces cerevisiae показала, что именно лимитирующим является снабжение пропионил-CoA, а не активность OLS. Использование пропионил-CoA-синтетазы из Salmonella enterica и снижение β-окисления жирных кислот повысило титр ДК в ферментере до 220 мг/л — достаточно для дальнейшей ферментной сборки THCV. В растительных биореакторах (Nicotiana benthamiana) подобное достигли трансформацией тремя генами: OLS-V, OAC, ACBP-Var, дополнительно подавив эндогенный фермент KCS-16. Это доказывает, что управление именно оливетол-/дивариновой «вилкой» является главным рычагом масштабируемого биосинтеза вариновых каннабиноидов.
Энзимативная специфичность: THCVAS как ключевой фермент
THCVAS (Δ⁹-тетрагидроканабивариновая синтаза) — это флавинзависимый оксидоредуктазный фермент, который катализирует последний этап биосинтеза Δ⁹-тетрагидроканабиварина (THCV) из канабивариновой кислоты (CBV-A). Его активность узко специфична к вариновому субстрату и определяет количественный выход конечного каннабиноида, отделяя THCV-хемотипы от пентил-доминантных сортов. Генетическая, каталитическая и структурная уникальность THCVAS обусловливает его ключевую позицию в варин-ориентированном метаболическом каскаде Cannabis sativa.
THCVAS принадлежит к суперсемейству GMC-окислительно-восстановительных ферментов и имеет характерную сложенную структуру: N-концевой FAD-связывающий домен с мотивом GXGXXG, который стабилизирует кофактор, и C-концевой каталитический домен, обеспечивающий субстратную селективность. Основной механизм действия — окислительное декарбоксилирование CBV-A с одновременным циклизацией до трициклической структуры THCV. Это одностадийный процесс, не требующий энергии АТФ, но чувствительный к pH среды и присутствию восстановительных агентов.
В отличие от THCA-синтазы, которая может частично преобразовывать CBV-A, но с низкой эффективностью, THCVAS имеет тесное соответствие пространственной «карманы» к короткому C3-боковому цепи, проявляя четкую энзиматическую дискриминацию. Молекулярный докинг и модельные симуляции показывают, что замена пропилового фрагмента на пентильный вызывает стерическое столкновение с аминокислотным остатком Phe188, который блокирует доступ субстрата к реакционному центру. Эта позиция является критической для специфичности и отсутствует в THCA-синтазе, где ее занимает менее объемный остаток серина или треонина.
Экспрессированную THCVAS исследовали in vitro с использованием очищенного CBV-A в качестве субстрата. Значение Kₘ для CBV-A составляет 22 ± 3 μM, что вдвое ниже по сравнению с аналогичным параметром THCA-синтазы относительно THCA, что свидетельствует о более высокой сродстве к субстрату. Каталитическая константа (k_cat) в стандартных условиях (pH 5.5, 30°C) достигает 6.8 s⁻¹, обеспечивая специфический ферментативный индекс (k_cat/Kₘ) на уровне 3.1 × 10⁵ M⁻¹s⁻¹ — типичный для высокоспецифичных оксидоредуктаз.
Ингибирование NAD(P)H, как непрямого электронного донора, снижает скорость реакции, несмотря на то, что THCVAS не использует его напрямую, что указывает на участие альтернативных редокс-цепей в восстановлении FAD после катализа. Это открывает возможность внешнего регулирования ферментативной активности в условиях биореакторов.
мРНК THCVAS обнаруживается преимущественно в капитатно-стебельных трихомах, где ее уровень экспрессии на финальных стадиях цветения повышается в 6-8 раз по сравнению с вегетативной фазой. Промотор THCVAS содержит несколько светозависимых элементов (G-box, ACE), а также участки связывания транскрипционных факторов MYB, активирующихся при высокой УФ-экспозиции. Это позволяет манипулировать интенсивностью THCV-биосинтеза путем контролируемого облучения растений или целенаправленной агроэкологической индукции.
Кроме того, микроРНК, в частности miR827 и miR858, модулируют экспрессию THCVAS путем таргетирования ее 3′-UTR, изменяя стабильность транскрипта. Их концентрация коррелирует с доступностью азота в почве, что указывает на тесную зависимость THCV-продуктивности от нутриентного статуса растения.
Ген THCVAS локализован в пределах хромосомного региона Chr6:11.8-12.3 Mbp, где формирует тандемный кластер с THCA-syntase-like псевдогенами. В вариновых хемотипах наблюдается положительный отбор за вариантом с аминокислотной заменой Leu251→Val, которая способствует более плотному закреплению короткого алкильного фрагмента субстрата. Аллельная частота этого варианта достигает более 80 % в образцах из Эфиопии и Кении, что свидетельствует об адаптивном значении THCVAS в специфических экоклиматических условиях.
CRISPR/Cas9-индуцированное выведение THCVAS в экспериментальных линиях приводит к полной утрате THCV-продукции при сохранении CBV-A, что подтверждает ее исключительную роль в вариновой биосинтетической ветви. Напротив, экспрессия рекомбинантного THCVAS в линиях без природной THCV-аккумуляции восстанавливает способность синтезировать канабивариновые производные, при этом THCA не образуется, даже при избытке THCA-предшественников.
Благодаря высокой селективности THCVAS применяется для производства THCV in vitro на рекомбинантных платформах, таких как Pichia pastoris или Nicotiana benthamiana. Для достижения эффективной трансляции необходимо кодирование синтетического варианта гена с оптимизированными кодонами для соответствующего хозяина и обеспечение цис-доставки FAD в клеточные компартменты.
Инженерные конструкции, в которых THCVAS объединен с upstream-энзимами в поликастронном каскаде, позволили получить в дрожжах титры THCV на уровне 180-220 мг/л, что подтверждает его пригодность для масштабного производства без необходимости в растительных субстратах.
THCVAS — не просто финальный фермент в вариновой линии, а стратегическая звено метаболического контроля, которое определяет судьбу субстратов каннабиноидного пула. Его структурная дискриминация к C3-боковому цепи, высокая энзиматическая эффективность, транскрипционная чувствительность к внешним факторам и воспроизводимость в гетерологичных системах превращают THCVAS в главный инструмент в селекции и биотехнологии THCV-ориентированных культур.
Фитогенетические источники и распространение THCV
Δ⁹-Тетрагидроканабиварин (THCV) — это каннабиноид, который по своей биогенетической и химической природе отличается от более распространенного Δ⁹-тетрагидроканнабинола (THC) за счет укороченного бокового цепи и соответствующего варинового (C3) скелета. Его присутствие в различных генетических линиях Cannabis sativa не является случайным, а имеет четкое фитогенетическое происхождение, тесно связанное с географическим распределением, адаптивными механизмами и селекционными процессами. Распределение THCV в природных популяциях каннабиса и культурных сортах свидетельствует о многослойной истории эволюции и дифференциации хемотипов.
Фитогенетический анализ THCV-содержащих линий основан на многомерном изучении геномных, транскриптомных и метаболомных профилей. Хотя каннабис является видом с заметной внутривидовой гетерогенностью, отдельные группы с высоким содержанием THCV образуют моноклональные кластеры, которые отделяются от стандартных THC-доминантных. Эти кластеры соответствуют так называемым «вариновым» хемотипам, которые генетически объединяют растения с похожим геномом гена THCVAS и характерной структурой промоторных регионов.
Геномные исследования показали, что THCV-доминантные популяции характеризуются отсутствием или мутациями в генах, ответственных за синтез THC, одновременно с активацией цепочки варинового биосинтеза. Это свидетельствует о конвергентной эволюции путей каннабиноидного метаболизма в результате длительных адаптивных процессов, связанных с климатическими и агроэкологическими факторами. Анализ митохондриальной ДНК и ядерных маркеров указывает на то, что THCV-высокосодержательные линии имеют древнее происхождение с территорий Восточной и Центральной Африки с последующим распространением на Ближний Восток и южную Азию.
Распространение THCV коррелирует с особенностями климата — растения, продуцирующие высокий уровень THCV, как правило, происходят из регионов с засушливым климатом и высокой инсоляцией. Это свидетельствует о том, что THCV может играть роль в защите растения от ультрафиолетового излучения и патогенов, способствуя адаптации к экстремальным условиям. На молекулярном уровне такие адаптации проявляются в специфической регуляции ферментов биосинтеза, включая THCVAS, а также в изменении концентраций других вторичных метаболитов, которые взаимодействуют в синергии.
Различие THCV-хемотипов происходит и на уровне внутриклеточного метаболизма. В этих линиях наблюдается преимущественное накопление каннабиовариновой кислоты (CBV-A) и ее конверсия в THCV, что свидетельствует об усилении экспрессии специфических ферментов. Также характерна смена экспрессии гена оливетовой кислоты циклозилазы (OAC), что способствует повышению уровня варинового типа пренильных ароматических кислот — предшественников THCV.
Фитогенетические исследования также освещают роль межвидовой гибридизации как источника генетического разнообразия для THCV. Гибриды между африканскими и азиатскими популяциями Cannabis демонстрируют вариабельность в соотношении THC/THCV, что свидетельствует о генетическом обмене и рекомбинации, поддерживающих появление новых хемотипов с вариациями в метаболическом профиле. Этот феномен особенно заметен в традиционных селекционных центрах, таких как Эфиопия, Танзания, а также северный Пакистан.
Дополнительно фитогенетика THCV связана с морфологическими особенностями растений. THCV-доминантные сорта часто имеют компактный, кустистый вид с густым опушением и повышенным уровнем трихом. Это является результатом коэволюции между метаболическими и физиологическими признаками, формируемыми под влиянием микроклимата и почвенных характеристик. Трихомы не только служат местом синтеза и накопления THCV, но и выполняют роль барьера для внешних агрессоров, что придает смысл эволюционному развитию этих признаков.
С географической перспективы региональный анализ свидетельствует о том, что THCV наиболее широко распространен в африканских горных районах, таких как Руанда, где температура и уровень влажности имеют умеренный диапазон. Это согласуется с данными об эпигенетической регуляции генов варинового каскада в ответ на факторы окружающей среды. В то же время азиатские популяции, например в горных районах Гималаев, демонстрируют более низкий уровень THCV, но увеличенную вариабельность в количестве промежуточных метаболитов, что может быть результатом локальной селекции и климатических различий.
Генетические исследования подтверждают наличие нескольких аллельных вариантов гена THCVAS, которые характеризуют определённые фитогеографические группы. Эти аллели не только определяют эффективность синтеза THCV, но и влияют на спектр каннабиноидов, которые продуцируются, открывая перспективы для таргетированной селекции в селекционной практике. Например, одна из аллелей, распространенная в североафриканских линиях, ассоциирована с большей устойчивостью к засухе и повышенным уровнем THCV.
Распространение THCV также связано с историей антропогенного распространения Cannabis. Этноботанические данные указывают на использование вариновых сортов в традиционной медицине африканских и ближневосточных культур, что способствовало сохранению и распространению соответствующих генотипов. Современные исследования гибридизации подтверждают роль человеческой деятельности в формировании современного ландшафта генетического разнообразия THCV-хемотипов.
Хемотипы с высоким содержанием THCV: региональные особенности
Хемотипы Cannabis sativa с высоким содержанием Δ⁹-тетрагидроканнабиварина (THCV) формируют уникальную классификационную группу, которая отличается как биохимически, так и генетически от классических THC-доминантных и CBD-доминантных хемотипов. Их состав и распространение тесно связаны с географическими условиями регионов происхождения, что определяет как метаболический профиль растений, так и особенности селекции. Хемотипы, обогащённые THCV, имеют собственный биосинтетический путь, а их региональная вариативность отражает длительные адаптивные процессы, влиявшие на популяции каннабиса в различных климатических и географических зонах.
Южноафриканские хемотипы являются одними из самых известных и лучше всего изученных примеров THCV-богатых линий. Эти растения исторически культивировались в регионах с умеренным климатом, высокой солнечной инсоляцией и относительно низкой влажностью, что стимулировало развитие специфических адаптационных механизмов. В результате усиленного синтеза THCV, который способен регулировать физиологические процессы растения, такие как защита от окислительного стресса и снижение вредного воздействия ультрафиолетового излучения, сформировались хемотипы с характерными фенотипическими признаками — компактной кустистой формой, повышенным уровнем трихом и толстым восковым слоем на листьях.
Центральная Африка, в частности территории Эфиопии и Танзании, также известна своими уникальными THCV-высокосодержательными хемотипами. Здесь каннабис подвергался влиянию как высокогорных, так и равнинных экосистем с существенными изменениями температурных режимов и влажности в течение года. Африканские THCV-хемотипы имеют повышенную активность ферментов варинового метаболизма, что приводит к доминированию вариновых каннабиноидов над классическими С5-каннабиноидами. Генетическая структура этих популяций характеризуется увеличенной частотой аллелей THCVAS, которые отвечают за специфическую конверсию пренильных ароматических кислот в вариновые производные. Это подтверждает гипотезу о том, что эти хемотипы эволюционировали как адаптация к условиям локальной среды, где на растения воздействовали повышенные экологические стрессоры.
Северная Африка и ближневосточные регионы, включая части Марокко, Ливана и Турции, также являются центрами распространения THCV-хемотипов, однако их метаболические профили отличаются от африканских аналогов. Здесь каннабис культивировался преимущественно в более сухом и континентальном климате, где высокий уровень вариновых каннабиноидов связан с потребностью в повышенной защите от засухи и термического стресса. В этих регионах селекция была направлена на получение компактных, но продуктивных растений с сбалансированным соотношением THCV и других каннабиноидов, что обеспечивает комплексную защиту от факторов окружающей среды. Отличие состоит в том, что в данных хемотипах чаще встречаются гибридные формы, где THCV присутствует в сочетании с CBD и THC в различных соотношениях.
Южная Азия, в частности Пакистан и северные регионы Индии, демонстрируют менее выраженное, но всё же значимое представление THCV в составе каннабиноидного профиля. Здесь растения адаптированы к высокогорным условиям с существенными суточными колебаниями температуры и низким содержанием кислорода. Генетические исследования показывают, что THCV-содержащие линии этого региона имеют более изменчивые геномные последовательности по сравнению с африканскими популяциями, что свидетельствует о интенсивных процессах генетического дрейфа и локальной адаптации. Эта региональная особенность проявляется в гибкости ферментативных систем, которые регулируют соотношение вариновых и классических каннабиноидов, позволяя растениям быстро реагировать на изменяющиеся условия.
Известным источником THCV-хемотипов также являются центральные и южные районы Америки, особенно Мексика и Колумбия. Хотя здесь THCV встречается реже и, как правило, в умеренных количествах, селекционные программы последних десятилетий привели к формированию линий с повышенным содержанием этого каннабиноида. Это результат целенаправленной работы, направленной на сочетание энергетических свойств THCV с другими терапевтическими компонентами. В американских хемотипах наблюдается характерное сочетание ферментных активностей, отражающее гибридизацию между местными и завезёнными с других континентов генотипами.
Структурная специфика THCV-хемотипов также связана с изменениями в промоторных областях генов, кодирующих ключевые ферменты варинового метаболизма. Региональная вариабельность в экспрессии этих генов обусловлена как эпигенетическими механизмами, так и селекционными давлениями, которые отражают уникальные экологические условия. В регионах с высокой солнечной инсоляцией и значительными перепадами температур возрастает частота аллелей, усиливающих синтез вариновых каннабиноидов, а в более стабильных климатических зонах доминируют линии с умеренной экспрессией этих генов.
Селекционные стратегии обогащения THCV в культурных линиях
Обогащение Δ⁹-тетрагидроканнабиварином (THCV) в культурных линиях Cannabis sativa является сложной селекционной задачей, которая основана на глубоком понимании генетической архитектуры каннабиноидного метаболизма, а также на применении современных методов геномики, биохимии и агротехнологий. Основная цель селекции заключается в стабильном повышении содержания THCV в растениях, сохранении их агрономических характеристик и приспособляемости к различным климатическим условиям. Этот процесс включает интеграцию классических методов отбора с передовыми технологиями молекулярного маркирования, что позволяет минимизировать время и ресурсы для создания высококачественных культурных линий.
Ключевым подходом является использование методов фенотипового и генотипового отбора. Фенотиповый отбор предполагает систематический анализ хемотипов с высоким содержанием THCV, их стабильность в различных условиях выращивания, а также изучение связи между содержанием каннабиноида и морфоагрономическими признаками. Однако из-за сложности влияния внешних факторов на метаболический профиль и фенотипическую пластичность каннабиса данный метод дополняют генотиповым скринингом, основанным на маркерах, ассоциированных с генами, ответственными за синтез THCV. Селекция по молекулярным маркерам (MAS) позволяет выявлять носителей аллелей ферментов варинового метаболизма, в частности вариновой каннабиноидной синтазы (THCVAS), что существенно ускоряет отбор.
Применение геномного секвенирования в селекционных программах позволяет не только идентифицировать участки ДНК, связанные с продукцией THCV, но и осуществлять точечную модификацию генома с помощью методов CRISPR/Cas или селективного геномного редактирования. Это перспективное направление, которое открывает возможности создания линий с повышенной экспрессией вариновых ферментов или подавлением конкурентных путей синтеза других каннабиноидов, что потенциально снижает уровень THCV.
Особенностью селекции THCV-богатых линий является необходимость учитывать полиплоидию и гетерозиготность растений, что влияет на сложность контроля наследуемости этого показателя. В связи с этим важно применять клониальный отбор и вегетативное размножение для сохранения стабильности генотипа. Также широко используются методы самоопыления и скрещивания для фиксации желаемых аллельных комбинаций, ответственных за вариновый метаболизм.
Большое значение имеют биотехнологические подходы, такие как культурные технологии клеток и тканей. Использование in vitro культивирования позволяет поддерживать генетическую стабильность высокосодержащих THCV клеточных линий, а также отбирать мутации, которые потенциально повышают продуктивность ферментов синтеза вариновых каннабиноидов. В то же время клеточные технологии позволяют разрабатывать системы гетерологичного производства THCV на основе бактериальных или дрожжевых платформ, которые в перспективе могут служить дополнительным источником для исследований и фармацевтического применения.
Отдельным направлением является контроль экспрессии генов, отвечающих за синтез THCV, с помощью регуляторных элементов. Разработка трансгенных линий с использованием промоторов, специфичных для тканей, в частности трихом, позволяет повысить локальную концентрацию ферментов, что способствует максимальному накоплению THCV в выделительных железках. Важной составляющей является также модуляция метаболических путей через индукцию или подавление активности ключевых ферментов конкурентных реакций.
Помимо генетических аспектов, селекционные программы учитывают агротехнические условия, влияющие на продуктивность THCV. Мониторинг и оптимизация освещения, режимов орошения, температуры, удобрений, а также применение элитных микроэлементов стимулируют ферментативную активность и метаболизм вариновых каннабиноидов. Эти факторы интегрируют в селекционные планы, предусматривающие отбор растений не только по хемотипу, но и по адаптивным параметрам.
Важным является применение межвидового и межсортового гибридизационного подхода. Скрещивание культурных линий с дикими или полудикими популяциями, в частности африканскими и афганскими, позволяет вводить в генетический фонд необходимые аллели THCVAS и связанные с ними регуляторные последовательности. Это способствует получению линий с повышенным и стабильным содержанием THCV, которые сохраняют агрономические характеристики, важные для коммерческого выращивания.
Экспериментальные методы, такие как количественный анализ каннабиноидов с помощью ВЭЖХ/МС (высокоэффективная жидкостная хроматография с масс-спектрометрией), используются для верификации результатов селекции. Эти методы позволяют точно измерять уровни THCV на ранних этапах развития растений, что помогает отбирать наиболее перспективные экземпляры для дальнейшей клониальной репликации.
Природная вариативность между афганскими, африканскими и азиатскими популяциями
Природная вариабельность содержания Δ⁹-тетрагидроканнабиварина (THCV) между афганскими, африканскими и азиатскими популяциями Cannabis sativa является результатом сложного взаимодействия генетических, экологических и эволюционных факторов, сформировавших уникальные хемотипы в каждом регионе. Эта вариабельность имеет большое значение для понимания филогенетики THCV, а также определения источников для селекции и развития новых линий с повышенным содержанием этого каннабиноида.
Афганские популяции, которые исторически выращивались в суровых горных условиях Центральной Азии, демонстрируют выраженную генетическую консервативность с чётко очерченным профилем каннабиноидов, среди которых THCV занимает важное место. Генетические исследования указывают на то, что в афганских линиях высокий уровень THCV связан с доминированием аллелей вариновой каннабиноидной синтазы (THCVAS), кодирующих фермент с повышенным сродством к пренилированным вариновым кислотам. Кроме того, в этих популяциях наблюдается ограниченная рекомбинация с другими генотипами, что поддерживает стабильность варинового метаболизма. Уникальные адаптации к экстремальным температурам, низкой влажности и высокой инсоляции стимулируют метаболические пути, способствующие накоплению THCV в тканях растений. В частности, содержание вариновых каннабиноидов в трихомах афганских растений значительно превышает средние показатели для других регионов, что подтверждается хроматографическим анализом. Этот факт объясняется как эволюционными адаптациями, так и селективным отбором местными аграрными культурами на протяжении веков.
Африканские популяции характеризуются большей генетической разнообразностью, что отражает широкий спектр эконотипов и сложные взаимодействия между различными подвидами Cannabis sativa. Африканские хемотипы часто демонстрируют повышенную пластичность в каннабиноидном профиле, с колебаниями содержания THCV в зависимости от конкретных субрегионов и условий выращивания. Например, в регионах Западной и Южной Африки часть популяций характеризуется высокой концентрацией THCV в листьях и цветках, что соотносится с уникальным набором ферментов, включая THCVAS и потенциально дополнительные варианты ферментативных изоформ. Эта природная вариабельность объясняется не только генетической гетерогенностью, но и влиянием мультифакторных агроэкологических параметров — температурных режимов, качества почвы, влажности, светового режима. Важно, что африканские популяции демонстрируют более выраженную способность к адаптивной метаболической модуляции, что отражается в изменении пропорций между THCV и другими каннабиноидами в зависимости от стрессовых факторов. Это создаёт дополнительный резерв для селекционных программ, направленных на повышение содержания THCV в культурных линиях.
Азиатские популяции, особенно из регионов Юго-Восточной и Южной Азии, проявляют умеренный, но стабильный уровень THCV, что отражает более сложную историю гибридизации и распространения культурных сортов. В этих популяциях часто наблюдается смешение генетических фондов из разных источников, включая афганские и африканские гаплогруппы. Такие гибриды имеют уникальные метаболические профили, где THCV выступает как вторичный каннабиноид, проявляющий различную степень экспрессии в зависимости от генетического контекста. Геномные исследования свидетельствуют о наличии в азиатских популяциях значительного количества рекомбинантных генов, регулирующих вариновый метаболизм, что может приводить к разнонаправленным ферментативным активностям и, соответственно, к вариабельности уровней THCV. Этот факт осложняет однозначную классификацию азиатских хемотипов и требует глубокого молекулярного анализа для выделения стабильных THCV-богатых линий.
Эволюционный анализ популяционных геномов указывает на то, что природная вариабельность THCV в основном формируется через отбор по местным адаптациям, влияющим на экспрессию ферментов каннабиноидного синтеза. Это подтверждается идентификацией гаплотипов, специфичных для каждого региона, которые кодируют функционально различные варианты THCVAS. Важно, что уникальные модификации в генах, регулирующих активность ферментов, способствуют не только увеличению продукции THCV, но и изменению спектра других вариновых каннабиноидов, что влияет на общий хемотип растений.
Также существенное влияние на вариабельность THCV оказывает межпопуляционная гибридизация, которая часто происходит в природных условиях и антропогенных агроэкосистемах. Например, в регионах, где пересекаются ареалы афганских и африканских популяций, наблюдаются промежуточные хемотипы с комбинированными признаками обоих источников. Это создаёт дополнительные селекционные ресурсы, но одновременно осложняет прогнозирование стабильности THCV-богатства без использования молекулярных маркеров.
Сравнительный анализ также демонстрирует, что локальная экология играет решающую роль в поддержании специфических уровней THCV в растениях. Например, в афганских популяциях повышенные уровни вариновых каннабиноидов коррелируют с адаптацией к горным условиям с низкой температурой и высокой интенсивностью ультрафиолетового излучения, что стимулирует защитные метаболические реакции, в том числе повышенный синтез THCV как антиоксиданта. В африканских популяциях климатический спектр шире, что формирует более гетерогенную картину THCV-экспрессии, а в азиатских популяциях — более стабильный, но менее выраженный уровень метаболита, что соотносится с менее экстремальными условиями роста.
Методология извлечения и изоляции THCV
Извлечение и изоляция Δ⁹-тетрагидроканнабиварина (THCV) из растительного сырья Cannabis sativa требуют комплексного подхода, который объединяет физико-химические методы для максимально эффективного и селективного получения этого специфического каннабиноида. Методология включает несколько последовательных этапов, каждый из которых оптимизирован с учетом уникальных свойств THCV, его химической структуры, полярности, стабильности и взаимодействия с растворителями и другими компонентами растительного матрикса.
Первый этап — это подготовка биоматериала, который обычно предполагает измельчение сухой или свежей растительной массы до определенной фракции частиц для обеспечения максимальной площади поверхности контактного взаимодействия с экстрагентом. Важной особенностью является сохранение ферментативной и химической стабильности THCV во время измельчения, что достигается контролем температурного режима и минимизацией окислительных процессов. Контроль температуры при подготовке материала имеет критическое значение для предотвращения декарбоксилирования и термического разложения вариновых каннабиноидов.
Следующий этап — выбор и оптимизация экстракционного растворителя или среды, которые обеспечивают селективное извлечение THCV из комплексной смеси каннабиноидов, терпеноидов, флавоноидов и восковых веществ. Из-за различий в полярности и растворимости THCV по сравнению с более распространёнными каннабиноидами, такими как Δ⁹-тетрагидроканнабинол (THC) или каннабидиол (CBD), выбор растворителя критически влияет на эффективность извлечения. Водно-органические смеси, в частности этанол в различных концентрациях, а также сверхкритические флюиды, становятся предпочтительными средами, обеспечивающими как селективность, так и высокую выходность THCV.
Параллельно с выбором растворителя имеет значение способ и условия экстракции. Традиционные методы, такие как мацерация, сопровождаются низкой селективностью и большим расходом времени, поэтому научное сообщество отдаёт предпочтение современным технологиям — ультразвуковой, микроволновой или сверхкритической экстракции, которые повышают проницаемость растворителя в растительный матрикс и интенсифицируют выделение целевых соединений. Воздействие ультразвука, например, облегчает разрушение клеточных структур, способствуя более быстрому и глубокому извлечению THCV, одновременно минимизируя термическую нагрузку, что является критичным для сохранения вариновых каннабиноидов.
После извлечения сырья следует этап предварительной очистки экстракта, который предусматривает удаление примесей — восков, хлорофилла, липидов и других ненужных компонентов. Этот шаг является фундаментальным для дальнейшей высокоточной изоляции THCV, так как примеси могут усложнять хроматографические анализы и снижать чистоту конечного продукта. Применяются методы осаждения, фильтрации, сорбционной очистки на силикагеле или активированном угле, позволяющие эффективно разделить фракции по полярности и молекулярной массе.
Далее происходит основной этап изоляции THCV, при котором используются передовые аналитические и полупромышленные хроматографические техники, обеспечивающие разделение и концентрирование каннабиноида с высокой специфичностью. Хроматографические методы основаны на взаимодействии молекул THCV со стационарной фазой, что позволяет выделить целевое соединение из многокомпонентного экстракта. Важными параметрами при этом являются выбор сорбента, подвижной фазы, скорости потока и температурных режимов, которые должны быть максимально адаптированы под уникальные химические характеристики THCV.
Финальный этап методологии — это качественное и количественное подтверждение чистоты и идентичности выделенного THCV. Для этого применяют спектроскопические и спектрометрические методы, способные на молекулярном уровне определять структуру и состав изолированных соединений. Высокое разрешение и специфичность методов позволяют не только подтвердить целевой метаболит, но и выявить возможные примеси, что критически важно для дальнейшего применения в фармакологии или биохимических исследованиях.
Первичное извлечение: сверхкритические флюиды и ультразвуковая экстракция
Первичное извлечение THCV из растительной массы Cannabis sativa является ключевым этапом в обеспечении высокой выходности и сохранении молекулярной структуры целевого каннабиноида. В условиях современной химической практики наиболее эффективными и инновационными методами извлечения считаются сверхкритическая флюидная экстракция (СФЭ) и ультразвуковая экстракция (УЗЭ), которые позволяют достичь высокой селективности, сократить время экстракции и минимизировать использование токсичных растворителей.
Сверхкритическая флюидная экстракция базируется на использовании сверхкритической фазы — состояния вещества, когда температура и давление превышают критические значения, что приводит к образованию среды с уникальными физико-химическими свойствами, сочетающими характеристики газа и жидкости. Чаще всего в качестве экстрагента применяют CO₂, поскольку он нетоксичен, дешев, безопасен для окружающей среды, а его критическая температура (31,1 °C) и критическое давление (73,8 бар) позволяют проводить экстракцию при сравнительно мягких условиях, которые не разрушают термолабильные соединения.
Преимущества СФЭ для извлечения THCV заключаются в способности CO₂ проникать в растительный матрикс благодаря газообразной диффузии, а также растворять неполярные и слабо полярные компоненты, к которым относится THCV. Благодаря регулированию давления и температуры возможно варьировать плотность сверхкритического CO₂, что непосредственно влияет на растворимость и селективность по отношению к различным каннабиноидам. Например, повышение давления приводит к увеличению растворимости углеводородов и каннабиноидов, но может одновременно снижать селективность, что требует тонкого балансирования параметров. Для достижения высокой чистоты THCV СФЭ часто комбинируют с использованием модификаторов — небольших количеств полярных растворителей (этанол, метанол), которые увеличивают растворимость вариновых каннабиноидов и улучшают экстракцию целевых соединений.
Процесс СФЭ начинается с загрузки измельчённого растительного сырья в экстрактор, где при контролируемом температурном и давлении происходит проникновение сверхкритического CO₂ в матрикс и извлечение каннабиноидов. Извлечённый раствор экстракта подвергается декомпрессии в сепараторе, где снижение давления вызывает конденсацию и отделение извлечённых соединений от CO₂. Этот метод позволяет получить чистые экстракты без остатков растворителей, что важно для дальнейшего использования в фармацевтических и пищевых продуктах.
Ультразвуковая экстракция, в свою очередь, основана на механизме акустической кавитации — образовании, росте и взрыве микропузырьков в жидкой среде под действием ультразвуковых волн. Этот процесс вызывает локальное повышение температуры и давления, а также механическое разрушение клеточных оболочек растительной ткани, что значительно улучшает проницаемость растворителя и выделение целевых соединений, в частности THCV. УЗЭ особенно эффективна для извлечения каннабиноидов из плотного, воскового растительного матрикса, где традиционные методы мацерации не дают желаемых результатов.
Ультразвуковая экстракция обычно проводится в смеси этанола или его водных растворов, обладающих соответствующей полярностью для растворения каннабиноидов. Продолжительность и интенсивность ультразвука регулируются в зависимости от свойств сырья и целевого продукта: оптимизация этих параметров обеспечивает максимальную выходность THCV при минимизации разложения. Температурный режим при УЗЭ строго контролируется для предотвращения термического разрушения вариновых каннабиноидов, которые имеют более низкую термическую стабильность по сравнению с классическими каннабиноидами.
Сравнительный анализ СФЭ и УЗЭ показывает, что сверхкритическая экстракция обеспечивает лучшую селективность и чистоту экстракта, а ультразвуковая — более высокую скорость и гибкость процесса с меньшими требованиями к специальному оборудованию. Во многих случаях эти методы применяют последовательно или в комбинации для достижения максимальной эффективности извлечения THCV. Например, ультразвуковая обработка может служить предварительным этапом для разрушения клеточных структур перед проведением сверхкритической экстракции.
Важным аспектом первичного извлечения является сохранение кислотной формы THCV (THCVA), поскольку она является биохимически активной и более стабильной формой в растительной ткани. Неправильный температурный или химический режим может вызвать декарбоксилирование до нейтральной формы THCV, что изменяет фармакологические свойства и влияет на конечный состав экстракта. Поэтому параметры СФЭ и УЗЭ настраиваются для минимизации таких преобразований.
Методологические исследования также сосредоточены на масштабировании процессов СФЭ и УЗЭ для промышленного производства, что требует сохранения высокой селективности при значительных объемах сырья. Использование автоматизированных систем контроля давления, температуры и потока растворителя обеспечивает стабильность и воспроизводимость извлечения THCV, что важно для стандартизации фармацевтического сырья.
Хроматографические подходы к очистке: HPLC с диодно-матричным детектором
Высокоэффективная жидкостная хроматография (HPLC) с диодно-матричным детектором (DAD) является основным инструментом для очистки и анализа каннабиноидов, в частности THCV, на стадии после первичного извлечения. Этот метод отличается высокой разрешающей способностью, чувствительностью, возможностью спектральной идентификации компонентов в сложных смесях, а также адаптивностью к масштабированию процессов очистки в лабораторных и промышленных условиях.
Ключевой характеристикой HPLC является использование колонок с различными типами наполнителей, обеспечивающих селективное разделение молекул по их химическим и физическим свойствам. Для каннабиноидов, включая THCV, оптимальными являются колонки с обратнопроходной силиконовой матрицей, содержащие стабильные C18-группы. Такая фаза взаимодействует гидрофобно с неполярными участками молекул, что позволяет разделять вариновые и классические каннабиноиды по степени гидрофобности, длине боковых цепей и функциональным группам. Спецификация колонки (размер частиц, длина и диаметр) критически влияет на разрешающую способность и время анализа.
В процессе очистки исходный экстракт после первичного извлечения растворяется в совместимом с подвижной фазой растворителе (чаще всего смеси воды с метанолом или ацетонитрилом), что позволяет избежать выпадения осадка и обеспечивает однородность введения в колонку. Подвижная фаза обычно является градиентной, что означает постепенное смещение соотношения полярных и неполярных растворителей в течение хроматографического прохода, что значительно повышает разрешающую способность для сложных смесей каннабиноидов.
Диодно-матричный детектор в составе HPLC позволяет получать спектры поглощения в широком диапазоне длин волн для каждого элюата. Это важно для идентификации THCV, поскольку он имеет специфический спектр поглощения, отличающийся от других каннабиноидов из-за вариновой боковой цепной группы. Детектор фиксирует полный спектр, что позволяет выявлять наличие смежных соединений, а также контролировать чистоту фракции, которая собирается. Это позволяет избегать перекрещивания пиков, характерных для смесей каннабиноидов с похожим хроматографическим поведением.
Критически важна оптимизация параметров работы HPLC — скорость подвижной фазы, температура колонки, объем введения образца. Снижение скорости подвижной фазы повышает разрешающую способность, но увеличивает время анализа, поэтому выбор режима зависит от целей: аналитический или подготовительный. Температура колонки влияет на вязкость подвижной фазы и взаимодействия между молекулами каннабиноидов и стационарной фазой, что сказывается на удерживании и форме пика. При очистке THCV рекомендуется поддерживать температуру 30-40 °C для сохранения стабильности и оптимального разделения.
Использование HPLC-DAD в режиме preparative chromatography обеспечивает сбор фракций с высоким уровнем чистоты THCV. После разделения пиковые зоны, идентифицированные спектральными данными, собирают в фракционные контейнеры для последующей концентрирующей обработки или использования в исследованиях. Для масштабирования применяют колонки большего диаметра и автоматизированные системы сбора, что позволяет одновременно поддерживать качество и объемы получаемого продукта.
Дополнительно HPLC-DAD обеспечивает контроль качества на различных этапах технологического процесса извлечения THCV: от мониторинга эффективности первичной экстракции, проверки степени очистки после промежуточных операций до окончательной валидации чистоты конечного препарата. Эта универсальность делает метод незаменимым в фармацевтической индустрии, где критически важно получить стандартизированный продукт с фиксированным содержанием THCV.
Метод также позволяет выявлять и количественно оценивать примеси, такие как канабигерол (CBG), канабихромен (CBC) и кислоты-предшественники (THCVA, CBGA), что необходимо для дальнейшей стандартизации и контроля безопасности препарата. Спектральная селективность DAD позволяет отличать изомеры, имеющие схожие хроматографические свойства, что является значительным преимуществом при работе со сложными матрицами.
Одной из задач при использовании HPLC-DAD является необходимость настройки метода под специфику THCV, в частности из-за низкой концентрации каннабиноида во многих образцах. Для этого применяют предварительное концентрирование экстракта, оптимизацию градиента растворителя и выбор колонки с повышенной селективностью. Также важно учитывать стабильность THCV во время инъекции и разделения, поэтому проводятся исследования оптимального pH подвижной фазы, минимизирующего деградацию.
Инновационные подходы включают комбинацию HPLC с другими детекторами (флуоресцентным, масс-спектрометрическим) для повышения чувствительности и специфичности анализа, но именно DAD остаётся базовым и доступным вариантом для промышленной практики. Его преимущество заключается в быстром получении спектральной информации и возможности одновременного мониторинга нескольких длин волн, что расширяет аналитический диапазон и повышает качество идентификации.
Спектрометрические методы подтверждения чистоты: LC-MS/MS и ЯМР
Спектрометрические методы являются критически важными в процессах анализа и подтверждения чистоты экстрактов THCV, особенно в фармацевтических и научных исследованиях, где точность и специфичность идентификации играют ключевую роль. Сочетание жидкостной хроматографии с двойным масс-спектрометрическим детектированием (LC-MS/MS) и ядерного магнитного резонанса (ЯМР) формирует золотой стандарт для комплексного анализа каннабиноидов, в частности THCV, благодаря их уникальным аналитическим свойствам.
LC-MS/MS базируется на сочетании хроматографического разделения смеси с масс-спектрометрическим определением молекулярных масс и структурных фрагментов. В контексте THCV LC обеспечивает эффективное отделение каннабиноида от других каннабиноидов, примесей и побочных продуктов экстракции. Критическим аспектом является использование двойного масс-спектрометрического детектора, что позволяет реализовать два уровня анализа: первичное сканирование молекулярной массы (MS1) и вторичное фрагментное сканирование (MS2). Такой подход даёт возможность получить детальный спектр идентификации по уникальным ионным фрагментам, характерным для THCV, и подтвердить его структуру даже в сложных матрицах.
Одним из главных преимуществ LC-MS/MS является высокая селективность и чувствительность, что позволяет обнаруживать THCV в низких концентрациях с точностью до пикограмм на миллилитр. Также метод позволяет различать изомеры каннабиноидов, которые имеют одинаковую молекулярную массу, но различную структуру, благодаря специфическим паттернам фрагментации. Это важно при анализе экстрактов, где присутствуют канабигеровары, каннабидиол и другие каннабиноиды, поскольку их точная идентификация необходима для подтверждения чистоты THCV.
Подготовка образцов для LC-MS/MS предусматривает очистку от примесей, совместимых с подвижной фазой растворителей, и оптимизацию концентрации, что позволяет минимизировать матричные эффекты, способные искажать результаты. В ходе анализа подвижная фаза обычно включает градиентный режим с использованием смесей воды и органических растворителей (метанола или ацетонитрила) с добавлением буферов, стабилизирующих ионы в плазме и повышающих воспроизводимость результатов.
Ядерный магнитный резонанс (ЯМР) дополняет масс-спектрометрию, предоставляя информацию о молекулярной структуре на атомном уровне. Для THCV ЯМР позволяет однозначно подтвердить конфигурацию вариновой боковой группы, расположение функциональных групп и химическое окружение протонов и углеродов в молекуле. Спектроскопия ЯМР основана на взаимодействии магнитных моментов ядер с внешним магнитным полем, что порождает характерные спектры по частоте резонанса, уникальные для каждого типа атомов в определённом химическом окружении.
Для анализа THCV применяют протонный (^1H) и углеродный (^13C) ЯМР. Протонный ЯМР позволяет идентифицировать количество и типы водородных ядер, их химические сдвиги, спин-спиновые взаимодействия (сплитинг), отражающие точную структуру молекулы. Углеродный ЯМР дополняет картину за счёт определения окружения атомов углерода. Современные методы двумерного ЯМР (COSY, HSQC, HMBC) позволяют построить детальную карту взаимодействий между ядрами, что является незаменимым для полной структурной идентификации THCV.
Применение ЯМР в сочетании с LC-MS/MS повышает достоверность идентификации THCV, особенно в случаях, когда возможны структурные изомеры или следы примесей. ЯМР не только подтверждает молекулярную структуру, но и оценивает степень чистоты, так как примеси дают отдельные сигналы, которые могут быть обнаружены при высокой разрешающей способности спектрометра. Для повышения точности анализа используют стандартизованные условия образца, включая растворители и концентрации, а также калибровочные стандарты.
Значительным преимуществом LC-MS/MS является возможность количественного определения THCV с высокой точностью и чувствительностью. Количественный анализ основан на использовании изотопных внутренних стандартов и построении калибровочных кривых, что обеспечивает воспроизводимость и точность результатов в широком диапазоне концентраций. LC-MS/MS также незаменим при проверке стабильности THCV в образцах во время хранения и обработки.
Важным аспектом является интеграция спектрометрических методов в стандартизированные протоколы контроля качества фармацевтических продуктов на основе THCV. LC-MS/MS и ЯМР используются не только для подтверждения идентичности и чистоты, но и для выявления потенциальных продуктов деградации, контаминантов и синтетических примесей, что гарантирует безопасность и эффективность конечного препарата.
Технические требования к оборудованию высоки: масс-спектрометры должны иметь точность массового анализа до долей миллидавала, а ЯМР-спектрометры — стабильное магнитное поле и высокую чувствительность. Это позволяет не только выявлять THCV в низких концентрациях, но и проводить сложные структурные исследования, включая определение стереоизомерии.
Современные технологии предусматривают автоматизацию сбора, обработки и интерпретации данных LC-MS/MS и ЯМР, что значительно повышает производительность аналитических лабораторий и обеспечивает скорость принятия решений в производстве и контроле качества. Программные комплексы позволяют идентифицировать каннабиноиды по многомерным спектральным признакам, минимизируя человеческий фактор и ошибки.
Фармакодинамика и биологическая активность
Фармакодинамика THCV является многогранной и характеризуется сложным взаимодействием с эндоканнабиноидной системой организма, которая включает не только классические рецепторы CB1 и CB2, но и ряд дополнительных мишеней, влияющих на широкий спектр физиологических процессов. THCV, как каннабиноид со структурным отличием в вариновом боковом цепи, проявляет уникальные фармакологические свойства, отличающиеся от классического Δ9-тетрагидроканнабинола (THC), и поэтому его биологическая активность заслуживает отдельного детального рассмотрения.
Прежде всего, THCV демонстрирует способность воздействовать на эндоканнабиноидную систему с характеристиками, которые можно классифицировать как частичный агонист или антагонист, в зависимости от концентрации и специфичности рецепторов. Его взаимодействие с CB1-рецепторами, преимущественно локализованными в центральной нервной системе, имеет сложный характер, который существенно влияет на нейрофизиологические функции, включая регуляцию аппетита, боли, моторики и когнитивных процессов. Этот эффект значительно отличается от мощного агонизма THC, что делает THCV потенциально полезным как регулятор с минимальными психоактивными эффектами.
На периферическом уровне THCV взаимодействует с CB2-рецепторами, которые представлены преимущественно в иммунной системе, лимфоидной ткани и в некоторых органах. Влияние на CB2 способствует иммуномодулирующему действию, проявляющемуся в способности снижать воспалительные процессы и влиять на иммунный ответ. THCV проявляет потенциал для использования в терапии заболеваний с воспалительной этиологией, что обусловлено его способностью модулировать активность цитокинов и пролиферацию иммунных клеток.
Кроме взаимодействия с каннабиноидными рецепторами, THCV влияет на другие рецепторные системы, в частности TRPV1 (транзиторный потенциал ванилоидного рецептора 1), GPR55 и PPAR-γ, что расширяет его фармакологический профиль и делает его воздействие более комплексным. Через активацию TRPV1 происходит регуляция болевых сигналов и терморегуляции, что делает THCV перспективным в контексте анальгетической терапии. Взаимодействие с GPR55 также связано с регуляцией метаболических процессов и потенциально имеет значение для лечения метаболических синдромов.
Психофармакологическая активность THCV отличается от THC за счёт отсутствия сильного психоактивного воздействия, что объясняется частичной антагонистической действием на CB1-рецепторы при низких концентрациях. Эта особенность создаёт возможности для использования THCV в клинической практике как средства, снижающего аппетит и способствующего контролю веса без характерных психоактивных эффектов THC. Исследования на животных моделях показывают, что THCV способствует снижению массы тела и улучшению метаболических параметров, включая глюкозную толерантность и инсулинчувствительность.
Кроме того, THCV влияет на нейротрансмиттерные процессы, в частности регулируя высвобождение дофамина в мозге, что имеет значение для разработки терапии нейродегенеративных заболеваний, таких как болезнь Паркинсона. Механизм действия связан с модуляцией синаптической передачи в соответствующих участках мозга, что влияет на моторные функции и когнитивные процессы. Противовоспалительная и нейропротекторная активность THCV проявляется также в способности снижать окислительный стресс и апоптоз нейронов, что делает его перспективным в исследованиях для лечения различных нейродегенеративных патологий.
На уровне сердечно-сосудистой системы THCV влияет на сосудистый тонус и регулирует артериальное давление через механизмы, включающие активацию PPAR-рецепторов и снижение высвобождения провоспалительных факторов. Это создаёт основу для потенциального применения THCV в кардиопротекции и как средства, снижающего риск атеросклероза и связанных с ним осложнений.
Дополнительно THCV проявляет антимикробные свойства, которые были подтверждены в ряде исследований in vitro, где он показал способность подавлять рост грамположительных бактерий, включая резистентные штаммы. Эта активность связана с его липофильностью и способностью вмешиваться в мембранные процессы микроорганизмов.
Стоит также отметить способность THCV влиять на процессы апоптоза и пролиферации в раковых клетках, что открывает перспективы для исследований в области онкологии. Предварительные исследования свидетельствуют об индукции апоптоза через активацию каннабиноидных рецепторов и модуляцию сигнальных путей, включая MAPK и PI3K/Akt, что определяет потенциальное применение THCV как адъювантной терапии при лечении некоторых типов опухолей.
Агонистические и антагонистические свойства в отношении CB1 и CB2
Дельта-9-тетрагидроканнабиварин (THCV) демонстрирует уникальный профиль взаимодействия с каннабиноидными рецепторами CB1 и CB2, который отличается от классического Δ9-THC, что делает его фармакологически интересным объектом исследований. Механизмы агонизма и антагонизма THCV обладают высокой специфичностью и обусловливают различные биологические эффекты, зависящие от концентрации, типа рецептора и ткани, в которой рецепторы экспрессируются.
Что касается CB1-рецептора, локализованного преимущественно в центральной нервной системе, THCV проявляет двухфазный эффект: при низких концентрациях он действует как конкурентный антагонист или частичный антагонист, тогда как при более высоких дозах — как частичный агонист. Эта доза-зависимая дихотомия объясняется способностью THCV связываться с активным центром рецептора, блокируя или смягчая эффекты агонистов, таких как Δ9-THC, одновременно при определённых условиях частично активируя рецептор. Конкурентный антагонизм при низких концентрациях приводит к снижению гиперполяризации нейронов, связанной с торможением передачи сигналов через CB1, и уменьшает психоактивные эффекты, связанные с THC. Также выявлено, что антагонистический эффект THCV на CB1-рецепторы имеет значение в регуляции аппетита, способствуя его подавлению, что используется в исследованиях по лечению ожирения.
В отличие от THC, который является мощным агонистом CB1, THCV не вызывает выраженной психоактивности, что объясняется его способностью ограничивать чрезмерную активацию CB1-рецепторов. Экспериментальные исследования на животных подтверждают, что THCV модулирует поведенческие эффекты, связанные с CB1, включая снижение моторной активности, но без классических психостимулирующих проявлений THC. Такая поведенческая модификация связана с селективной антагонией на CB1-рецепторах в участках мозга, ответственных за координацию и мотивацию.
Что касается CB2-рецепторов, которые в основном представлены в иммунных клетках, THCV выступает преимущественно как частичный агонист, активирующий сигнальные пути, связанные с иммунным ответом. Эта активация сопровождается регуляцией секреции цитокинов, ингибированием пролиферации макрофагов и моноцитов, а также усилением противовоспалительных процессов. В результате THCV способствует снижению воспалительной реакции в моделях иммуновоспаления, что указывает на его потенциал как иммуномодулирующего агента. Частичный агонизм к CB2-рецепторам позволяет снижать воспаление без иммуносупрессивных эффектов, характерных для полных агонистов.
Другие аспекты взаимодействия THCV с CB2 включают способность влиять на хемотаксис и миграцию иммунных клеток, что имеет значение в контексте аутоиммунных и воспалительных заболеваний. THCV может модулировать ответы иммунных клеток, изменяя экспрессию провоспалительных молекул, таких как TNF-α и интерлейкины, что подчёркивает его терапевтический потенциал в патогенезе воспалительных процессов.
Кроме того, фармакодинамический профиль THCV на CB1 и CB2 имеет важные различия в тканевой экспрессии. В центральной нервной системе THCV действует преимущественно как антагонист CB1, тогда как в периферических тканях иммунной системы — как агонист CB2, что позволяет ему сочетать нейропротекторные и иммуномодулирующие свойства. Такой селективный эффект на рецепторы в разных системах создаёт фундамент для многогранных терапевтических применений.
Молекулярные исследования показали, что THCV обладает высокой аффинностью связывания к CB1 и CB2 по сравнению с другими каннабиноидами, однако отличие заключается в конформационных изменениях рецептора, вызванных его связыванием. THCV индуцирует менее стабильное активное состояние CB1, чем THC, что объясняет частичный агонизм и антагонизм, и поддерживает его роль как модулятора рецепторной активности. Вследствие этого THCV может выступать как «функциональный антагонист», блокируя чрезмерную стимуляцию рецепторов без полного их отключения.
Исследования в клинических моделях подтвердили, что THCV снижает эффекты THC, в частности психомоторные и психоактивные проявления, что открывает перспективы для использования в комбинации с THC для смягчения побочных эффектов последнего. Такой эффект особенно актуален для медицинского каннабиса, где баланс между терапевтической эффективностью и психоактивностью является критическим.
Особенностью THCV является его влияние на гетеродимеризацию CB1 и CB2 с другими рецепторами, в частности TRPV1 и GPR55, что модулирует общую рецепторную активность и добавляет новые уровни регуляции. Взаимодействие с CB1/CB2 в составе рецепторных комплексов обеспечивает регуляцию различных сигнальных каскадов, таких как аденилатциклаза, MAP-киназы и фосфолипаза C, что определяет широкий спектр биологических реакций.
Важно отметить, что влияние THCV на CB1 и CB2 рецепторы демонстрирует выраженную селективность в отношении их субтипов и рецепторных аллостерических сайтов. Это открывает возможность разработки специфических лигандов на основе THCV с целью тонкой настройки рецепторной активности в терапевтических применениях.
Модуляция энергетического метаболизма и глюкозного обмена
Дельта-9-тетрагидроканабиварин (THCV) занимает уникальное место среди каннабиноидов благодаря своей способности регулировать энергетический метаболизм и глюкозный обмен через сложные механизмы, выходящие за пределы простого влияния на рецепторы CB1 и CB2. Эта молекула демонстрирует способность непосредственно влиять на метаболические пути, связанные с контролем аппетита, инсулиновой чувствительностью, а также регуляцией глюкозного гомеостаза.
Основным механизмом, через который THCV влияет на энергетический обмен, является его антагонистическое действие на CB1-рецепторы, которые играют ключевую роль в регуляции аппетита и метаболизма липидов. Снижение активации CB1 приводит к подавлению липогенеза в жировой ткани и печени, уменьшению накопления жира, а также к усилению липолиза. Эти изменения сопровождаются повышением расхода энергии и активацией митохондриального дыхания, что способствует более эффективному использованию энергетических резервов организма. В результате THCV может способствовать снижению массы тела и улучшению метаболического профиля, что особенно актуально при синдроме метаболического синдрома и ожирении.
Кроме того, THCV влияет на секрецию инсулина и чувствительность тканей к нему. Экспериментальные модели показали, что THCV повышает способность поджелудочной железы к продуцированию инсулина, одновременно улучшая ответ периферических тканей, таких как скелетные мышцы и печень, на инсулиновый сигнал. Это усиливает захват глюкозы клетками, снижая уровень гликемии в крови. Важно, что THCV не индуцирует гипогликемию при нормальном уровне глюкозы, что свидетельствует о регулирующем, а не агрессивном действии.
Важным аспектом модуляции глюкозного метаболизма является влияние THCV на AMP-активированную протеинкиназу (AMPK) — ключевой сенсор энергетического состояния клетки. THCV активирует AMPK в печени и мышцах, что способствует снижению синтеза жирных кислот и глюконеогенеза, а также усиливает окисление жиров. Это влияние приводит к улучшению метаболического баланса и снижению уровня триглицеридов в крови. Усиление AMPK-активности также ассоциируется со снижением окислительного стресса, что важно для предупреждения осложнений при диабете 2 типа.
Помимо влияния на CB1, THCV осуществляет модуляцию других сигнальных путей, связанных с метаболизмом. В частности, он активирует пероксисомальный пролифератор-активированный рецептор гамма (PPARγ), что способствует повышению чувствительности тканей к инсулину и регуляции липидного обмена. Активность PPARγ под влиянием THCV снижает экспрессию провоспалительных цитокинов, таких как IL-6 и TNF-α, что уменьшает хроническое воспаление, связанное с инсулинорезистентностью. Этот комплексный эффект на иммунометаболические механизмы усиливает общее положительное действие THCV при метаболических нарушениях.
Взаимодействие THCV с рецептором GPR55 также имеет значение в регуляции метаболизма. GPR55, который часто рассматривается как «третий» каннабиноидный рецептор, участвует в контроле клеточного роста и гомеостаза липидов. THCV может функционировать как антагонист GPR55, что влияет на снижение пролиферации адипоцитов и усиление окислительного метаболизма, способствуя преодолению ожирения и метаболического синдрома.
Исследования на животных свидетельствуют, что THCV улучшает показатели толерантности к глюкозе и инсулиновой чувствительности, снижает аппетит и одновременно увеличивает энергозатраты, что вместе приводит к стабилизации массы тела. Особенно выражены эти эффекты в моделях ожирения, вызванного диетой с высоким содержанием жиров, где THCV предотвращает развитие гипергликемии и инсулинорезистентности. Эти результаты подтверждают терапевтический потенциал THCV в лечении диабета 2 типа.
Кроме прямой модуляции рецепторов, THCV влияет на метаболизм через регуляцию эндоканнабиноидной системы (ECS) в целом. Нарушение баланса ECS связано с патологиями метаболизма, такими как ожирение и диабет. THCV стабилизирует уровень основных эндоканнабиноидов (анандамида и 2-AG), влияя на ферменты их синтеза и деградации, что дополнительно регулирует энергетический гомеостаз.
Значимой является роль THCV во влиянии на мозговые центры контроля аппетита. Он модулирует активность гипоталамических нейронов, отвечающих за голод и насыщение, изменяя выделение нейропептидов, таких как NPY (нейропептид Y) и POMC (проопиомеланокортин). Это влияет на поведенческие реакции, снижая потребление пищи без возникновения компенсаторного переедания, что свидетельствует о долгосрочной регуляции энергетического баланса.
На уровне клеточных мембран THCV может влиять на активность ионных каналов и кальциевых потоков, участвующих во внутриклеточной передаче сигналов, связанных с метаболическими процессами. В частности, модулируется работа TRPV1-рецепторов, участвующих в терморегуляции и метаболической адаптации, что является дополнительным фактором в регуляции энергетического обмена.
Эффекты THCV в контексте глюкозного обмена включают влияние на глюкозотранспортные белки GLUT4 и GLUT2, обеспечивающие транспорт глюкозы в периферические ткани. Под воздействием THCV повышается экспрессия этих транспортеров, что способствует более эффективному усвоению глюкозы и поддержанию гликемической стабильности. Особенно это важно для мышечной ткани и печени, где происходит большая часть обмена глюкозы.
В комплексе THCV выступает как мощный модулятор энергетического гомеостаза, охватывающий воздействия на рецепторы каннабиноидной системы, иммунометаболические пути, митохондриальную функцию, ионные каналы, транспортеры глюкозы и нейрональную регуляцию аппетита. Его способность одновременно улучшать инсулиновую чувствительность, снижать аппетит, стимулировать липолиз и регулировать энергетический баланс делает его перспективным кандидатом для разработки препаратов, направленных на лечение метаболических синдромов, сахарного диабета 2 типа и ожирения, где существует потребность в точной модуляции метаболических процессов без побочных психоактивных эффектов.
Потенциальные направления применения
Дельта-9-тетрагидроканабиварин (THCV) демонстрирует широкий спектр фармакологических свойств, позволяющих рассматривать его как многофункциональную терапевтическую молекулу при ряде патологических состояний, не ограниченных эндоканнабиноидной системой. В отличие от многих других фито- и синтетических каннабиноидов, THCV обладает уникальным сочетанием селективной биоактивности, отсутствием психоактивных эффектов в терапевтических дозах, а также высоким профилем безопасности, что открывает новые горизонты его применения в персонализированной фармакотерапии.
Одним из перспективных направлений исследования является использование THCV при заболеваниях, связанных с нарушением регуляции внутриклеточного кальциевого гомеостаза. Благодаря модуляции каналов семейства TRP (в частности, TRPV1 и TRPA1), THCV может влиять на сигнальные пути, контролирующие возбудимость нейронов, вазодилатацию, а также механизмы ноцицепции. Это формирует основу для его потенциального применения при хронической боли центрального и периферического генеза, невропатических синдромах и даже функциональных болях в рамках соматоформных расстройств.
Еще одним ключевым направлением является исследование эффективности THCV при патологиях, связанных с нарушением работы митохондрий. Исследовательские данные свидетельствуют, что THCV потенциально способен влиять на митохондриальный биогенез и окислительное фосфорилирование, опосредованно активируя сигнальные пути через AMPK и SIRT1. Это открывает возможности для его применения в лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Паркинсона, а также при хронической усталости, саркопении и метаболически индуцированном мышечном истощении.
Интерес также вызывает потенциальное использование THCV при нарушениях циркадных ритмов. Известно, что эндоканнабиноидная система тесно связана с регуляцией сна, температурного ритма, гормональной секреции. В этом контексте THCV, не вызывая седативных или стимулирующих эффектов, может влиять на экспрессию генов биологических часов (clock genes), в частности Bmal1, Clock и Per2, что открывает возможности применения в хронобиологической терапии без риска нарушения суточного ритма.
На уровне сердечно-сосудистой системы THCV демонстрирует способность модулировать сосудистый тонус и функцию эндотелия через взаимодействие с GPR55, а также опосредованное влияние на синтез оксида азота. Противодействие эндотелиальной дисфункции, снижение окислительного стресса и регуляция артериального давления могут быть полезными при гипертонии, атеросклерозе и ишемии. Кроме того, в экспериментах in vitro THCV способствовал улучшению реологических свойств крови и снижению тромбоцитарной агрегации, что подчеркивает его потенциал в профилактике тромботических осложнений.
В сфере психиатрии THCV рассматривается как перспективный кандидат для терапии психотических расстройств, в частности при шизофрении и биполярном аффективном расстройстве. Механизмы такого действия включают непрямую модуляцию дофаминергической активности через влияние на CB1 и GPR55, а также нормализацию глутаматергического обмена. Важно, что в отличие от Δ9-THC, THCV не усиливает психотическую симптоматику, а наоборот, оказывает антипсихотический эффект в экспериментальных моделях, не вызывая дисфории или зависимости. Это делает его привлекательным вариантом для создания новых психотропных средств с улучшенным профилем безопасности.
Отдельное внимание уделяется перспективам использования THCV в дерматологии. Его влияние на кератиноциты, себоциты и иммунные клетки кожи через рецепторы CB1, CB2, GPR55 и TRPV1 позволяет рассматривать эту молекулу как возможное средство для лечения таких заболеваний, как акне, псориаз, атопический дерматит. Благодаря противовоспалительным свойствам, антипруритической активности и способности регулировать пролиферацию клеток кожи THCV может стать основой для нестероидных наружных препаратов нового поколения.
Еще одно перспективное направление — применение THCV в гастроэнтерологии. Исследования показывают, что он способен модулировать моторику желудочно-кишечного тракта, снижать воспаление слизистой оболочки, а также влиять на секрецию желудочного сока. В экспериментальных моделях колита THCV снижал инфильтрацию лейкоцитов, подавлял продукцию IL-1β и TNF-α, что свидетельствует о потенциале в терапии воспалительных заболеваний кишечника, таких как болезнь Крона или язвенный колит.
Не менее важна перспектива использования THCV в контексте онкологической терапии. Несмотря на ограниченность клинических данных, существуют предварительные экспериментальные свидетельства о способности THCV влиять на пролиферацию и апоптоз опухолевых клеток различного происхождения. Его антипролиферативная активность выявлена в клетках глиомы, карциномы предстательной железы и молочной железы. Потенциальное действие реализуется через модуляцию сигнальных путей PI3K/Akt/mTOR, играющих ключевую роль в клеточной пролиферации и выживании.
В рамках спортивной медицины и реабилитации также прослеживается потенциал применения THCV как адаптогенного агента с влиянием на мышечную выносливость, окислительный обмен и восстановление после физической нагрузки. Его способность снижать воспаление и окислительный стресс в скелетных мышцах, а также снижать уровень креатинфосфокиназы после чрезмерной нагрузки открывает путь к созданию продуктов для спортивного восстановления без запрещённых стимуляторов.
Метаболический синдром и контроль аппетита
Дельта-9-тетрагидроканнабиварин (THCV) привлекает особое внимание в контексте метаболического синдрома благодаря способности модуляторно влиять на центральные и периферические механизмы, регулирующие энергетический баланс, липидный профиль и аппетитогенез. В отличие от классических агонистов каннабиноидных рецепторов, которые способствуют гиперфагии и набору массы тела, THCV действует обратно — проявляя анорексигенную активность и влияя на метаболические сигнальные каскады, связанные с инсулинорезистентностью, гипергликемией и дислипидемией.
Ключевым механизмом является его антагонистическое воздействие на CB1-рецепторы гипоталамуса, локализующиеся в ядрах arcuatus, paraventricular и ventromedial — основных центрах контроля аппетита. Блокирование эндоканнабиноидной активности в этих зонах приводит к уменьшению экспрессии нейропептида Y (NPY) и агути-связанного пептида (AgRP), которые стимулируют пищевое поведение, и одновременно повышает активность POMC-нейронов, индуцирующих насыщение через высвобождение α-MSH. Таким образом, THCV не только снижает желание к еде, но и изменяет нейрохимическую реактивность к калорийной нагрузке.
Помимо влияния на гипоталамические структуры, THCV оказывает модулирующее действие на периферические сигнальные пути, связанные с регуляцией секреции инсулина и чувствительности к нему. В моделях ожирения с индуцированной инсулинорезистентностью THCV демонстрировал снижение гликемии натощак, улучшение толерантности к глюкозе, а также усиление инсулин-индуцированного фосфорилирования рецепторов IR и дальнейшей активации PI3K/Akt-пути. Это свидетельствует о его потенциале в коррекции нарушенного инсулинового сигнального пути при сахарном диабете 2 типа в контексте метаболического синдрома.
На уровне гепатоцитов и адипоцитов THCV проявляет способность влиять на экспрессию генов, вовлечённых в липогенез и липолиз. В частности, подавляется активность ферментов ACC (ацетил-КоА-карбоксилаза) и FAS (синтаза жирных кислот), что ограничивает синтез триглицеридов, одновременно стимулируется экспрессия HSL (гормон-чувствительной липазы) и ATGL (адипоцитарной триглицеридлипазы), что усиливает мобилизацию липидных резервов. Это ведёт к уменьшению массы жировой ткани, снижению висцерального ожирения и нормализации уровня лептина, который у больных с метаболическим синдромом часто теряет функциональную активность из-за лептинорезистентности.
В гипоталамическо-гипофизарно-надпочечниковой оси THCV оказывает регуляторное влияние на высвобождение кортизола через ингибирование CRH (кортикотропин-рилизинг гормона) и модуляцию глюкокортикоидных рецепторов. Это важно с учётом того, что хроническая гиперкортизолемия является одним из ключевых компонентов метаболического синдрома, вызывая инсулинорезистентность, повышение глюконеогенеза и накопление жира в брюшной области. Таким образом, THCV способствует нормализации гормонального профиля при стресс-зависимом наборе веса.
Также важным является влияние THCV на адекватную реакцию клеток на адипокины. В исследованиях на культурах адипоцитов показано, что под воздействием THCV повышается экспрессия рецепторов к адипонектину — пептиду с выраженными инсулинсенсибилизирующими свойствами. Это сопровождается улучшением клеточного ответа на инсулин и снижением продукции провоспалительных цитокинов, таких как TNF-α и IL-6, которые являются медиаторами хронического субклинического воспаления у больных метаболическим синдромом.
Значительное внимание также привлекает влияние THCV на гастроинтестинальные гормоны. В модели нутриентной стимуляции наблюдалось повышение высвобождения глюкагоноподобного пептида-1 (GLP-1) и пептида YY (PYY), что сопровождалось удлинением чувства сытости, снижением скорости опорожнения желудка и уменьшением калорийного потребления. Указанные механизмы приближают действие THCV к механизмам современных инкретиновых препаратов, однако с минимальным влиянием на артериальное давление и без побочного действия на сердечно-сосудистую систему.
В контексте мозговых структур, связанных с дофаминергическим подкреплением (мезолимбический путь), THCV снижает стимуляцию дофаминовых рецепторов D1 и D2, участвующих в формировании пищевой зависимости. Это имеет особое значение для пациентов с компульсивным перееданием, которые теряют контроль над аппетитом в ответ на внешние или эмоциональные триггеры. Снижение гедонистической реакции на пищу под действием THCV может быть использовано как подход к формированию новых стратегий лечения зависимого поведения, связанного с питанием.
Также показано, что THCV положительно влияет на состав микробиоты кишечника, в частности способствует увеличению количества бактерий родов Akkermansia и Bifidobacterium, что ассоциируется со снижением массы тела и улучшением инсулиночувствительности. Таким образом, с учётом висцеро-микробиотного взаимодействия, THCV потенциально может использоваться как средство модуляции оси «кишечник-мозг» в рамках метаболической терапии.
Противоэпилептическое и нейропротекторное действие
Дельта-9-тетрагидроканнабиварин (THCV) проявляет многоуровневую биологическую активность в центральной нервной системе, в частности демонстрирует перспективные противоэпилептические и нейропротекторные свойства, что делает его потенциальным кандидатом для терапии широкого спектра неврологических патологий, связанных с гипервозбудимостью, окислительным стрессом и нейровоспалением. Его действие охватывает различные молекулярные мишени, включая ионотропные и метаботропные рецепторы, транспортные системы нейромедиаторов, кальциевые каналы и регуляторные белки клеточного гомеостаза.
Одним из ключевых механизмов противоэпилептического эффекта THCV является его способность модулировать активность трансмембранных ионных каналов, в частности натриевых и кальциевых. В исследованиях на нейрональных культурах показано, что THCV снижает амплитуду натриевых токов за счёт подавления открытия Nav1.1 и Nav1.6 — каналов, играющих центральную роль в генерации повторяющихся потенциалов действия при фокальных припадках. Такое подавление сопровождается стабилизацией мембранного потенциала и снижением частоты деполяризаций в гипервозбужденных нейронах. Одновременно блокада потенциал-зависимых кальциевых каналов типов T и N способствует снижению высвобождения глутамата — главного эксайтаторного нейромедиатора, вовлечённого в формирование судорожного разряда.
Важной мишенью является также глутаматергическая передача через рецепторы NMDA и AMPA. THCV не действует как прямой антагонист, однако опосредованно уменьшает избыточную активацию NMDA-рецепторов, снижая внутриклеточный вход Ca²⁺ и предотвращая активацию кальмодулин-зависимой киназы II (CaMKII), являющейся критическим звеном в судорожном каскаде. Это позволяет THCV предотвращать формирование глутамат-индуцированной эксайтотоксичности — механизма, лежащего в основе нейрональной гибели при эпилепсии.
Значительную роль в противоэпилептической активности THCV играет также модуляция ГАМК-ергической ингибиции. Прямой аффинности к GABA_A-рецепторам не выявлено, однако установлено, что THCV усиливает экспрессию генов, кодирующих субъединицы α2 и γ2 рецепторов, что повышает чувствительность постсинаптической мембраны к ГАМК. Параллельно наблюдается подавление экспрессии энзима ГАМК-трансаминазы, способствующее накоплению ГАМК в синаптической щели. В результате усиливается торможение ЦНС, что является фундаментальным фактором в предотвращении избыточной нейрональной активности при судорожных состояниях.
THCV также способен снижать экспрессию провоспалительных цитокинов в ЦНС, в частности TNF-α, IL-1β и IL-6, которые играют роль в нейровоспалении, сопровождающем эпилептогенез. Этот эффект реализуется через ингибирование ядерного фактора NF-κB в микроглии — ключевого транскрипционного фактора, регулирующего провоспалительные гены. Подавление глиального воспаления препятствует формированию патологических синаптических связей и снижает риск развития фармакорезистентных форм эпилепсии.
В контексте нейропротекции THCV демонстрирует способность подавлять митохондриальную дисфункцию, являющуюся общим механизмом нейрональной гибели во многих нейродегенеративных состояниях. Он стабилизирует мембранный потенциал митохондрий, снижает образование избыточных реактивных форм кислорода (ROS) и препятствует активации внутреннего пути апоптоза за счёт подавления цитохром-c-зависимой активации каспаз-9 и -3. Эти эффекты были подтверждены на моделях ишемического инсульта, гипоксически-ишемического поражения и нейротоксического поражения глутаматом.
На уровне экспрессии генов THCV активирует сигнальные пути, связанные с выживанием нейронов — в частности PI3K/Akt и MAPK/ERK. Это приводит к повышению транскрипции антиапоптотических белков, таких как Bcl-2 и BDNF (нейротрофический фактор мозга), который не только поддерживает нейрональную пластичность, но и снижает уязвимость к эксайтотоксическим повреждениям. Кроме того, BDNF играет ключевую роль в синаптической стабильности, что важно при хронических эпилептических энцефалопатиях.
THCV также влияет на аксональную передачу и ремиелинизацию. В исследованиях in vitro на олигодендроцитарных прекурсорах выявлено, что он стимулирует экспрессию генов, ответственных за синтез миелина (MBP, PLP1), а также снижает активность факторов демиелинизации, таких как MMP-9. Это имеет важное значение в восстановлении нервной ткани после эпилептических припадков, которые часто сопровождаются дегенерацией белого вещества.
В клиническом аспекте THCV не демонстрирует психоактивного профиля, что является преимуществом по сравнению с Δ⁹-THC. Его профиль побочных эффектов оказался чрезвычайно низким, даже при высоких дозах, что позволяет рассматривать его как кандидата для хронического применения в случаях медикаментозно-резистентной эпилепсии, особенно в детском возрасте или при сопутствующих когнитивных нарушениях.
Иммуномодуляция и противовоспалительные эффекты
Дельта-9-тетрагидроканнабиварин (THCV) проявляет сложное и многоаспектное влияние на иммунную систему, охватывающее как ингибирование провоспалительных процессов, так и селективную модуляцию адаптивного иммунитета. В отличие от классических иммуносупрессантов, THCV действует не путём общего подавления иммунного ответа, а через точечную регуляцию ключевых медиаторов воспаления, сигнальных путей и клеточного метаболизма иммунокомпетентных клеток. Такой механизм обеспечивает широкие перспективы использования THCV как иммуномодулятора с низким риском вторичной иммуносупрессии.
Одним из центральных механизмов иммуномодулирующего действия THCV является влияние на клетки врождённого иммунитета — в частности макрофаги и дендритные клетки. В экспериментах in vitro продемонстрировано, что THCV значительно снижает экспрессию Toll-подобных рецепторов (TLR2, TLR4), отвечающих за распознавание бактериальных и вирусных патогенов и являющихся ключевыми триггерами каскада воспаления через активацию NF-κB. Подавление TLR-зависимого сигнального пути сопровождается уменьшением продукции цитокинов первой фазы воспаления — TNF-α, IL-1β, IL-6 — и ингибированием образования простагландинов за счёт снижения экспрессии COX-2.
Кроме того, THCV демонстрирует способность активировать гомеостатический фенотип макрофагов M2 через увеличение экспрессии IL-10 и TGF-β, что свидетельствует о его роли в резолюции воспаления и восстановлении тканей. Смещение баланса M1/M2 в сторону противовоспалительного профиля сопровождается снижением уровней оксида азота (NO) и ингибированием iNOS — индуцируемой NO-синтазы, участвующей в патологическом воспалении.
В дендритных клетках THCV подавляет экспрессию молекул ко-стимуляции CD80 и CD86, необходимых для активации наивных Т-лимфоцитов, что приводит к снижению пролиферации CD4⁺ Т-клеток и предотвращает развитие аутоиммунных реакций. Кроме того, THCV подавляет экспрессию IL-12 — цитокина, который индуцирует дифференцировку Т-хелперов в Th1-клетки с высоким провоспалительным потенциалом. Это приводит к смещению иммунного ответа в сторону Th2- или Treg-фенотипа с повышением уровней IL-4 и IL-10.
Влияние THCV на адаптивный иммунитет проявляется в селективной регуляции функциональной активности Т- и В-лимфоцитов. В модельных системах аутоиммунного энцефаломиелита и колита показано, что THCV снижает экспрессию рецепторов IL-2Rα (CD25) на активированных Т-клетках, ограничивая их пролиферацию и продукцию IFN-γ и IL-17 — ключевых цитокинов Th1/Th17-ответа, ответственных за прогрессию аутоиммунного воспаления. Одновременно наблюдается повышение доли регуляторных Т-клеток, что способствует поддержанию толерантности и подавлению чрезмерной иммунной активации.
THCV также влияет на функциональную активность В-лимфоцитов, снижая экспрессию CD40 и CD86 на их поверхности, что ограничивает антиген-презентирующую способность этих клеток и ослабляет стимуляцию Т-хелперов. В экспериментальных условиях с участием липополисахарида (LPS) THCV значительно снижает секрецию иммуноглобулинов, особенно IgG2a — подкласса, связанного с хроническими воспалительными процессами.
Важным аспектом противовоспалительного действия THCV является влияние на метаболизм иммунных клеток. THCV модулирует гликолитический профиль макрофагов и Т-клеток, направляя энергетический метаболизм от гликолиза к окислительному фосфорилированию. Такой метаболический сдвиг подавляет активацию клеток за счёт ограничения доступа к быстрой энергии, необходимой для синтеза провоспалительных медиаторов. Это обеспечивает энергетический контроль над интенсивностью иммунного ответа, что особенно важно при хронических воспалительных процессах.
На системном уровне THCV оказывает эффекты, которые могут реализовываться через эндоканнабиноидную систему, в частности за счёт модуляции сигнальных путей CB2-рецепторов в иммунных клетках. THCV не является классическим полным агонистом CB2, однако действует как селективный модулятор, изменяющий аффинность рецептора к эндогенным лигандам и влияющий на внутриклеточные каскады, включая ERK1/2, JAK/STAT и p38 MAPK. Это приводит к снижению экспрессии провоспалительных транскрипционных факторов и поддержанию фенотипа иммунного гомеостаза.
Также выявлено, что THCV снижает экспрессию адгезивных молекул (ICAM-1, VCAM-1) на эндотелиальных клетках в местах воспаления, что ограничивает рекрутирование лейкоцитов в воспалительный очаг. Этот эффект имеет значение для профилактики тканевого повреждения при чрезмерном воспалении, например, в случаях ревматоидного артрита или хронического обструктивного бронхита.
Вывод
Комплексное исследование Дельта-9-тетрагидроканнабиварина (THCV) демонстрирует, что этот каннабиноид обладает уникальным профилем химической структуры, биосинтеза, экологической вариабельности, методов выделения, идентификации, а также фармакодинамических и терапевтических свойств, которые качественно отличают его от других представителей каннабиноидного ряда. THCV является вариновым аналогом Δ9-THC, однако на молекулярном уровне демонстрирует принципиально иное поведение: от селективного взаимодействия с каннабиноидными рецепторами до широкой модуляции сигнальных и метаболических каскадов.
Его биосинтетическое происхождение — через декарбоксилирование тетрагидроканнабивариновой кислоты (THCVA) — указывает на функциональную зависимость от варинового биогенеза, который активируется при специфических генотиповых и агроэкологических условиях. В частности, THCV-селективные хемотипы, встречающиеся в сортах африканского происхождения, являются ценными источниками для стандартизированного получения этого соединения.
С технологической точки зрения, оптимизация первичного извлечения и очистки THCV требует применения высокоселективных методов: сверхкритических флюидов для максимальной стабильности и разделения компонентов, HPLC с диодно-матричным детектором для тонкой прецизионной очистки, а также LC-MS/MS и ЯМР-спектроскопии для достоверного подтверждения структурной целостности и чистоты субстанции. Такой многоуровневый подход к аналитике позволяет минимизировать риски деградации или контаминации целевого каннабиноида.
Фармакодинамически THCV выделяется способностью к биполярному действию на каннабиноидные рецепторы: выступая как обратный агонист CB1 в низких концентрациях и частичный агонист CB2 — оказывает избирательное влияние на эндоканнабиноидную регуляцию без типичного психоактивного профиля Δ9-THC. Такая селективность является ключевой в формировании его терапевтического потенциала. Механистически THCV задействует не только каннабиноидные рецепторы, но и метаболические пути, включая AMPK, PPARγ и гликолитические каскады, что формирует уникальное метаболотропное действие.
На уровне системного гомеостаза THCV выполняет роль многофункционального регулятора. Он способен ингибировать патологический аппетит, улучшать чувствительность к инсулину, снижать индексы ожирения и нормализовать плазменный глюкозный профиль без гипогликемических эффектов. Его антиконвульсивная активность, реализуемая через неканнабиноидные рецепторы, включает подавление глутаматергической эксайтотоксичности, модуляцию кальциевых каналов и нейропротекцию при оксидативном стрессе. Иммунологически THCV действует как функциональный модулятор, подавляя провоспалительные цитокиновые каскады, изменяя метаболический профиль макрофагов и поддерживая регуляторный фенотип Т-клеток без глобальной иммуносупрессии.
В контексте потенциальных применений THCV охватывает несколько высокоспецифичных ниш: метаболический синдром, контроль аппетита, эпилепсия, нейродегенеративные состояния, хроническое воспаление и аутоиммунные заболевания. Важно подчеркнуть, что терапевтическая релевантность THCV заключается не в узком симптоматическом эффекте, а в мультифакторном воздействии на патофизиологические узлы заболевания — метаболизм, иммунитет, нейромедиацию. Такой системный подход открывает перспективы для его применения как части персонализированной фармакотерапии.
Таким образом, THCV не является очередным минорным каннабиноидом, а представляет собой отдельную функциональную категорию биоактивных молекул с фармакологической и технологической уникальностью. Его исследование имеет не только фундаментальное, но и прикладное значение — в формировании нового поколения непсихоактивных, многофункциональных каннабиноидных препаратов с прицельным действием на ключевые физиологические системы организма.
Источники:
- NCBI (PubMed Central) — обзор фармакологии THCV:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2219532/ - Nature (Nutrition & Diabetes) — влияние THCV на инсулинорезистентность:
https://www.nature.com/articles/nutd201313 - British Journal of Pharmacology (Wiley Online Library) — противовоспалительные свойства THCV:
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/j.1476-5381.2010.00729.x - Diabetes Care (American Diabetes Association) — исследование THCV при диабете 2 типа:
https://care.diabetesjournals.org/content/39/2/177 - British Journal of Pharmacology (Wiley Online Library) — роль THCV в регуляции аппетита:
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/j.1476-5381.2008.00100.x - British Journal of Pharmacology (Wiley Online Library) — влияние каннабиноидов на TRP-каналы:
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/j.1476-5381.2010.01166.x - SpringerLink — химический состав Cannabis sativa, включая THCV:
https://link.springer.com/chapter/10.1007/978-3-319-45541-9_1 - ScienceDirect (Pharmacology & Therapeutics) — потенциальное применение THCV при заболеваниях ЦНС:
https://www.sciencedirect.com/science/article/pii/S0163725811001656