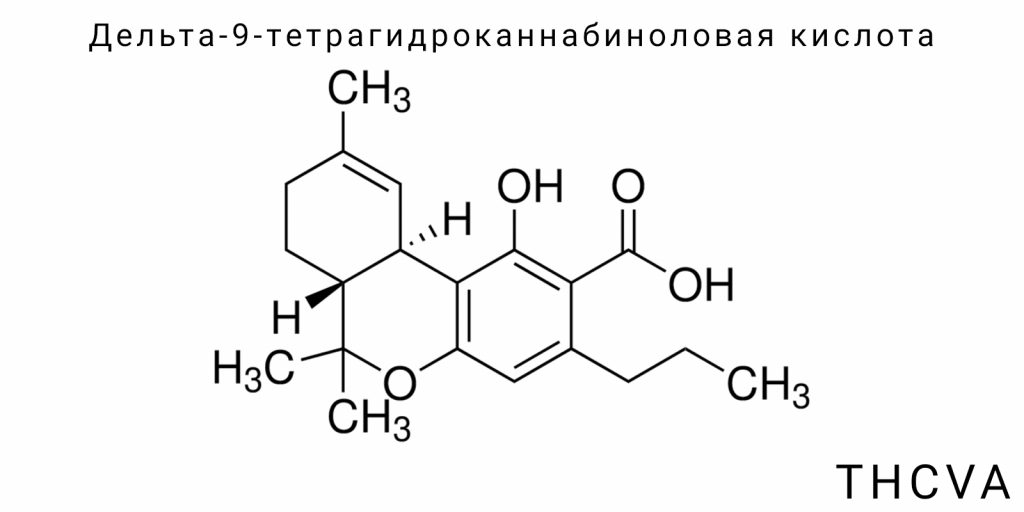
Дельта-9-тетрагидроканнабиноловая кислота (THCVA) — это кислотная форма малоизученного варинового каннабиноида, которая встречается в Cannabis sativa L. в крайне низких концентрациях, преимущественно в растениях так называемого хемотипа IV. Несмотря на структурное сходство с дельта-9-тетрагидроканнабиноловой кислотой (THCA), THCVA является производным дивариновой кислоты, а не оливетоловой, и имеет укороченную боковую цепь из трёх атомов углерода. Эта химическая особенность существенно изменяет её биологическое поведение и фармакологический профиль, что вызывает растущий интерес среди исследователей каннабиноидов.
В отличие от более изученных соединений каннабиса, таких как Δ9-THC или CBD, THCVA остаётся в тени не только из-за своей низкой природной концентрации, но и из-за сложности её изоляции в стабильной кислотной форме. Каннабиноид быстро декарбоксилируется до THCV под действием температуры или времени, что усложняет количественное определение и функциональные исследования самой кислотной формы. Это также частично объясняет, почему THCVA практически полностью отсутствует в хроматографических профилях обработанных или хранившихся экстрактов, и почему её не включают в фармакопейные или регуляторные стандарты большинства стран.
На молекулярном уровне THCVA образуется через вариновый биосинтетический каскад, начинающийся с взаимодействия геранилпирофосфата с дивариновой кислотой при участии специфической тетрагидроканнабиваринсинтазы (THCVAS). Этот путь независим от основного оливетолового маршрута, по которому синтезируются более распространённые каннабиноиды. Однако наличие вариновых производных, таких как THCVA, CBVA или CBGVA, в биомассе каннабиса свидетельствует о более широком спектре хемотипной вариабельности, чем ранее считалось, и имеет потенциал для использования в качестве селекционного или биохимического маркера в исследованиях и стандартизации сырья.
Интерес к THCVA также обусловлен его гипотетической фармакологической активностью. Известно, что декарбоксилированная форма — THCV — проявляет антагонизм к CB1-рецепторам, обладает анорексигенными, противосудорожными и противовоспалительными свойствами. Однако фармакодинамика кислотной формы остаётся практически неизученной. Данные о её аффинности к рецепторам каннабиноидной системы, стабильности в физиологических условиях или биодоступности не имеют экспериментального подтверждения, но являются важными для разработки новых прототипов лекарственных средств, не вызывающих психоактивного эффекта.
Современное научное внимание к кислотным формам каннабиноидов, в частности CBDA, CBGA и THCA, стимулирует интерес к THCVA как потенциально активному компоненту, который мог быть неправильно интерпретирован или недооценён в предыдущих исследованиях из-за технических ограничений методов идентификации. Вместе с развитием прецизионной хроматографии, масс-спектрометрии и спектроскопии ядерного магнитного резонанса открываются новые возможности для отделения, идентификации и фармакологического анализа даже таких нестабильных и малоконцентрированных молекул, как THCVA.
Химическая характеристика и биогенез
Дельта-9-тетрагидроканнабиноловая кислота (THCVA) относится к классу вариновых каннабиноидов — вторичных метаболитов, присущих роду Cannabis, которые образуются путём поликетидного биосинтеза с последующей терпенизацией и циклизацией. Хотя THCVA является кислотной формой, которая декарбоксилируется в активную — THCV — именно кислотный вариант составляет исходную форму соединения в сырой растительной биомассе, и именно эта форма является химически стабильным продуктом ферментативного метаболизма. С точки зрения каннабиноидной хемиомики, THCVA рассматривается как непсихоактивный предшественник, однако его структурное родство с классической Δ⁹-тетрагидроканнабиноловой кислотой (THCA) позволяет предполагать сходные — хотя и не идентичные — биологические свойства.
Химически THCVA классифицируется как вариновая кислота с трёхуглеродным боковым цепом в положении 5 фенольного ядра, что является отличием от пятиуглеродной оливетоловой кислоты, лежащей в основе большинства каннабиноидов. В биосинтетическом контексте эта разница имеет фундаментальное значение, поскольку она влияет на пространственную конфигурацию молекулы, её гидрофобность, взаимодействие с каннабиноидными рецепторами и стабильность в различных физико-химических условиях. Таким образом, THCVA не является просто изомером THCA — это отдельная молекулярная категория с присущими только ей биогенетическими путями и физико-химическими характеристиками.
В структурном отношении THCVA является трицикличным терпен-фенольным производным с наличием карбоксильной группы, которая легко декарбоксилируется под воздействием тепла или времени до нейтральной молекулы THCV. С учётом этого в аналитических целях исследователи должны отличать каннабиноидные кислоты от их декарбоксилированных форм, учитывая, что именно кислоты преобладают в необработанных растительных матрицах. Это усложняет аналитическую идентификацию THCVA, особенно в случае термически обработанного, старого или экстрагированного сырья, где значительная часть кислоты уже конвертирована в THCV.
Согласно современным представлениям о метаболизме каннабиса, синтез каннабиноидов происходит путём взаимодействия терпенового предшественника — геранилпирофосфата (GPP) — с поликетидным предшественником. В случае THCVA таким поликетидом является дивариновая кислота (дивариновый эквивалент оливетоловой кислоты), которая образуется посредством действия поликетидсинтаз и специфической циклозы. После конденсации GPP с дивариновой кислотой образуется канабигеровариновая кислота (CBGVA) — центральный промежуточный метаболит вариновой ветви каннабиноидного биосинтеза. Этот предшественник далее метаболизируется специфическими синтазами, среди которых тетрагидроканнабивариновая синтаза (THCVAS), катализирующая циклизацию CBGVA в THCVA.
Биогенетическая специфичность THCVA также отражается в распределении хемотипов Cannabis sativa. Было выявлено, что THCVA преимущественно встречается в растениях IV хемотипа, то есть таких, которые накапливают вариновые кислоты (THCVA, CBDVA, CBGVA) как основные каннабиноиды, тогда как классические THCA или CBDA преобладают в I-III хемотипах. Такой распределение обусловлено генетическими вариантами соответствующих синтаз — THCVAS, CBDVAS, CBGA synthase — каждая из которых имеет высокую субстратную селективность относительно CBGVA, а не CBG (канабигероловая кислота с пятью углеродами). Поэтому присутствие THCVA в растении — это не только результат ферментативной активности, но и маркер генетической конфигурации биосинтетических энзимов.
Благодаря этим хемотиповым отличиям THCVA может использоваться как селекционный маркер в генетических программах создания сортов с низким содержанием Δ⁹-THC или для обогащения вариновыми профилями. Например, сорта с высоким содержанием THCVA могут применяться в фармакологии как источник нестандартных каннабиноидов с минимальной психоактивностью, что имеет принципиальное значение при разработке безопасных терапевтических агентов для уязвимых популяций, таких как дети или люди с психиатрическими расстройствами.
Особое внимание стоит уделить физико-химической стабильности THCVA. Как и все каннабиноидные кислоты, она нестабильна при хранении, подвергается автоокислению, изомеризации и декарбоксилированию. Это ограничивает возможность её использования в фармацевтических формах без соответствующей стабилизационной защиты или условий контроля окружающей среды. Однако с другой стороны, наличие карбоксильной группы в молекуле делает её более полярной по сравнению с THCV, что открывает возможность целенаправленной хроматографической сепарации с помощью обратной фазы или ионообменной хроматографии.
С химической точки зрения, THCVA может также использоваться как модельная структура для изучения влияния укороченных боковых цепей на активность каннабиноидов. Такие исследования перспективны для структурно-активного моделирования и создания синтетических аналогов с оптимизированным рецепторным профилем. Уже сейчас фармацевтические компании проявляют интерес к непсихоактивным производным варинового ряда, в частности из-за потенциального антагонизма к CB1-рецепторам, что открывает возможности в терапии ожирения, диабета II типа, эпилепсии или нейровоспалительных заболеваний.
Структурное строение и классификация
Дельта-9-тетрагидроканабивариновая кислота (THCVA) является представителем специфической подгруппы каннабиноидов, известных как вариновыми каннабиноиды, которые характеризуются уникальной структурной особенностью — укороченным боковым алкильным цепочком, состоящим из трех атомов углерода. Эта структурная модификация отличает их от классических пятиуглеродных каннабиноидов, таких как Δ9-тетрагидроканнабиноловая кислота (THCA). Особенности строения THCVA не только определяют его физико-химические свойства, но и существенно влияют на молекулярные взаимодействия с биологическими мишенями, в частности каннабиноидными рецепторами.
Химическая структура THCVA содержит три основных функциональных компонента: фенольное кольцо, циклический терпеноидный фрагмент и карбоксильную кислоту. Фенольное кольцо состоит из бензольного ядра с гидроксильной группой, которая обеспечивает молекуле полярность и возможность образования водородных связей. Этот фрагмент определяет химическую реактивность соединения, в частности способность к окислению и конъюгации с другими молекулами. Карбоксильная группа придаёт THCVA кислотные свойства, делая его формой, доминирующей в необработанном сырье и обеспечивая щелочную растворимость. При нагревании или под действием ферментов происходит декарбоксилирование, что приводит к образованию нейтральной формы — THCV.
Циклическая терпеноидная часть молекулы — это трёхчленная структура, образуемая с участием пиранового кольца, типичного для каннабиноидов, которая определяет трёхмерную конфигурацию молекулы и её способность взаимодействовать со специфическими рецепторами в организме. В случае THCVA отличительной чертой является то, что из-за укороченного бокового цепочка смещается конформация молекулы, что приводит к изменённому аффинитету к рецепторам CB1 и CB2, а также потенциальным отличиям в способности проходить через биологические барьеры.
Классификация THCVA в химическом контексте происходит по нескольким критериям. Во-первых, по структуре она относится к фенолкарбоновым кислотам — группе органических соединений, характеризующихся наличием фенольного кольца с присоединённой карбоксильной группой. Этот факт определяет её химическую реактивность и взаимодействие в экосистеме растения и в биологических средах. Во-вторых, в контексте каннабиноидов THCVA относится к вариновому подклассу, что обозначает наличие трёхуглеродного алкильного цепочка в сравнении с пятиуглеродным у основной части каннабиноидов. Важно подчеркнуть, что эта классификация является фундаментальной для определения биологической активности соединения, поскольку длина алкильного цепочка оказывает прямое влияние на связывание с рецепторами и ферментативную обработку.
С молекулярной точки зрения THCVA представляет собой сложный органический эфир с терпеноидной основой, соединённой с фенольной кислотой через этерный мостик. Такая конструкция обеспечивает баланс между гидрофобностью и полярностью молекулы, что критично для её способности проникать в клеточные мембраны и взаимодействовать с липофильными рецепторами. Структурная организация THCVA даёт возможность формировать комплексы с белками-мишенями и влиять на сигнальные пути, регулирующие физиологические процессы.
В отличие от более распространённых каннабиноидов, таких как THCA или CBD, вариновые каннабиноиды, к которым относится THCVA, отличаются специфическими стереохимическими свойствами. У THCVA наблюдается конформационная гибкость, обусловленная коротким алкильным цепочком, что влияет на её пространственную ориентацию в молекулярных взаимодействиях. Эта гибкость может повышать или снижать аффинитет к рецепторам CB1 и CB2 или изменять способность активировать дополнительные рецепторные системы, такие как TRPV1 или GPR55. Изучение таких особенностей имеет важное значение для разработки новых фармакологических агентов с тонко настроенной селективностью.
Существует также классическое деление каннабиноидов по типу молекулярного ядра: оливетоловые (пятиуглеродный боковой цепочкой) и вариновые (трёхуглеродный цепочкой). THCVA относится ко второй группе, что отражает его химическое происхождение от дивариновой кислоты, а не оливетоловой. Такая классификация имеет фундаментальное значение не только для химической характеристики, но и для фармакодинамики, поскольку различие в длине бокового цепочка кардинально меняет взаимодействие с рецепторами и ферментами, которые модулируют каннабиноидный метаболизм.
Ещё одним аспектом структурной классификации является пространственное расположение функциональных групп — карбоксильной, фенольной и гидроксильной. В THCVA карбоксильная группа расположена на позиции 1, что обеспечивает ионизацию при физиологическом pH и определяет кислотно-основные свойства молекулы. Такая особенность влияет на её растворимость в водных и липидных средах, что имеет практическое значение при экстракции, анализе и потенциальном применении в терапии.
С физико-химической точки зрения THCVA обладает высокой полярностью по сравнению с нейтральными каннабиноидами, что способствует её растворению в полярных органических растворителях, таких как метанол или ацетонитрил. Это свойство определяет особенности её экстракции из растительного сырья и является критичным при стандартизации аналитических методик, таких как высокоэффективная жидкостная хроматография (HPLC) и масс-спектрометрия.
Отличительной чертой THCVA является также её способность к быстрой термической декарбоксилизации с образованием THCV — активного нейтрального каннабиноида. Этот процесс происходит при нагревании выше 100 °C и определяет биологическую трансформацию THCVA при обработке сырья. С химической точки зрения этот переход является результатом потери CO₂ из карбоксильной группы, что приводит к радикальным изменениям в молекулярной структуре и фармакологической активности.
Классификационно THCVA рассматривается в более широком контексте каннабиноидов, которые делятся на основе количества атомов в боковом цепочке (вариновые, оливетоловые), а также по типу функциональных групп (кислоты, нейтральные соединения, окисленные метаболиты). Такое структурное разделение имеет решающее значение для определения химической стабильности, метаболических путей и фармакокинетики, а также для разработки методов аналитического контроля.
Понимание структурного строения THCVA позволяет прогнозировать её химическую реактивность, в частности возможность образования конъюгатов с белками или другими макромолекулами, что важно для исследования её потенциального токсикологического профиля и взаимодействия в живых системах. Структурная специфика THCVA также открывает перспективы для синтеза его химических аналогов с целенаправленными модификациями, которые могут изменять свойства молекулы для улучшения терапевтического потенциала.
Биосинтетическое происхождение в Cannabis sativa
Биосинтез дельта-9-тетрагидроканабивариновой кислоты (THCVA) в Cannabis sativa — это результат сложного каскада вторичного метаболизма, в котором сочетаются пути изопреноидного и полиенового происхождения. В центре этого процесса находятся две ключевые молекулы: геранилпирофосфат (ГПФ) как терпеновый предшественник и дивариновая кислота — специфический вариновый аналог оливетоловой кислоты. Их конденсация в присутствии специфического синтазного фермента приводит к образованию канабигеровариновой кислоты (CBGVA), которая служит биосинтетическим предшественником для дальнейшего ферментативного превращения в THCVA.
Прекурсоры: геранилпирофосфат и дивариновая кислота
Геранилпирофосфат образуется в цитозоле клеток Cannabis sativa в рамках мевалонатного пути (MVA) или альтернативно — в пластиде через метилэритритолфосфатный путь (MEP). Этот С10 изопреноидный дифосфат является универсальным предшественником для многих терпенов и каннабиноидов. Его электрофильная природа и активированная фосфатная среда делают его пригодным для нуклеофильной атаки со стороны ароматических кислот, в частности дивариновой кислоты.
Дивариновая кислота (4-пентилрезорциновая кислота с трёхуглеродным боковым цепочкой) формируется путём полиенового синтеза с участием специфической вариации тетракетоил-кофермента А синтазы (TKS) и оливетоловой циклазной активности. По сравнению с оливетоловой кислотой, прекурсором классических каннабиноидов, дивариновая кислота образуется из пропионил-CoA вместо ацетил-CoA, что определяет её укороченный боковой цепь. Такая замена начального ацильного донора изменяет длину конечного продукта и направляет весь метаболический поток в вариновый хемотип.
Хотя сам процесс синтеза дивариновой кислоты остаётся предметом активных исследований, экспериментальные данные с радиомечеными изотопами подтверждают происхождение этого соединения из пропионовой кислоты через малонил-CoA-индуцированную конденсацию. На ферментативном уровне происходит циклизация поли-β-кетонного цепи с образованием фенольного ядра — ключевой особенности будущих каннабиноидов.
Конденсация в CBGVA: центральный узел варинового биосинтеза
Объединение геранилпирофосфата и дивариновой кислоты катализируется канабигероваринсинтазой (CBGVS), обладающей высокой специфичностью к трёхуглеродным субстратам. Этот фермент обеспечивает реакцию алкилирования с образованием канабигеровариновой кислоты (CBGVA) — предшественника всех вариновых кислот. Стереохимическая ориентация реакции оказывается критически важной, так как она определяет дальнейшую специфичность ферментов, действующих на последующих этапах.
CBGVA является биохимическим центром разветвления биосинтетического пути. В зависимости от экспрессии специфических оксидазных синтаз она может быть превращена в различные вариновые кислоты, в частности в каннабидиовариновую кислоту (CBDVA), канабихромовариновую кислоту (CBCVA) или THCVA. Это отражает генетическую регуляцию хемотипа, поскольку профиль экспрессируемых ферментов варьируется в зависимости от генотипа C. sativa и условий культивирования.
Специфическая роль THCVA-синтазы
Ключевым ферментом, обеспечивающим превращение CBGVA в THCVA, является дельта-9-тетрагидроканабивариновая кислотная синтаза (THCVAS). Этот фермент относится к семейству флавопротеинов с оксидоредуктазной активностью, использующих FAD в качестве кофактора. Механизм действия THCVAS заключается в циклизации пренильного фрагмента CBGVA посредством окислительного открытия пиранового кольца и образовании новой циклической структуры с сохранением карбоксильной группы. Важно, что фермент не осуществляет декарбоксилирование — THCVA остаётся в кислотной форме вплоть до экзогенной обработки (нагревание, ферменты, время).
Ген THCVAS и его транскрипционные профили тесно связаны с хемотипом растения. Некоторые субпопуляции C. sativa var. indica и var. afghanica обладают стабильной экспрессией THCVAS, что обеспечивает преобладающее накопление именно THCVA в трихомах. Анализ последовательности фермента свидетельствует о высокой гомологии с THCA-синтазой, однако даже незначительные отличия в активном центре фермента приводят к радикальному изменению субстратной специфичности.
Кристаллографические исследования THCVAS показали, что её субстрат-связывающий карман более плотно организован, что соответствует меньшему объёму диваринового цепи. Такая структурная адаптация указывает на эволюционную специализацию фермента на вариновые соединения.
Регуляция и изоляция метаболического пути
В клетках Cannabis sativa синтез THCVA происходит локализованно в секреторных трихомах, где ферментативный аппарат концентрируется в секреторной головке. Там формируются везикулы, содержащие мембранно-связанные комплексы синтаз. Такая компартментализация снижает конкуренцию между разными синтазами и позволяет поддерживать локально высокую концентрацию CBGVA для эффективного синтеза THCVA.
На уровне регуляции биосинтеза важную роль играют свет, температура и питание. Доказано, что короткодневное освещение стимулирует экспрессию THCVAS, тогда как дефицит фосфора или калия может снижать ферментативную активность.
Фитогенетические и экологические источники
Биосинтез дельта-9-тетрагидроканабивариновой кислоты (THCVA) в Cannabis sativa является результатом взаимодействия генетически детерминированных свойств растения и экологических стимулов, влияющих на экспрессию вторичного метаболизма. В отличие от более изученных каннабиноидов с пентильным боковым цепом, синтез вариновых кислот, в частности THCVA, строго зависит от наличия специфических биохимических предпосылок: образования дивариновых прекурсоров, активности соответствующих синтаз и контролируемой регуляции в пределах каннабиноидного метаболома.
Генетическая вариабельность Cannabis sativa обеспечивает широкий спектр хемотипов, каждый из которых характеризуется доминированием определенной группы каннабиноидов. Хемотипы с преобладанием THCVA менее распространены, чем типичные Δ⁹-THCA- или CBDA-доминантные формы, но именно они представляют наибольший научный интерес благодаря потенциально отличной биологической активности и хемоселективности.
Определение хемотипа осуществляется путем хроматографического анализа профиля каннабиноидов, однако первопричины этого химического профиля заложены в наследственности. THCVA-хемотип формируется в результате экспрессии специфических генов, кодирующих THCVAS, а также путем активации генов биосинтеза прекурсора — дивариновой кислоты. Соответственно, такие хемотипы обычно имеют характерное сочетание двух независимых признаков: (1) доминирование короткоцепочечного ацильного донора (пропионил-CoA вместо ацетил-CoA) в первичном метаболизме и (2) наличие функционального аллеля THCVA-синтазы, который структурно отличается от THCA-синтазы.
Генетические маркеры, ассоциирующиеся с экспрессией THCVAS, до сих пор не полностью картированы, однако анализ полногеномных последовательностей выявил специфические локусы на хромосоме 6 (C. sativa, 10 хромосом), которые демонстрируют активное транскрибирование изоформ THCVAS только при высокой концентрации CBGVA в тканях. Это свидетельствует о важности не только транскрипционного контроля, но и метаболического контекста как ограничивающего фактора для продукции THCVA.
Популяционный анализ показывает, что хемотипы с высоким содержанием THCVA чаще встречаются среди африканских линий Cannabis sativa var. indica и в азиатских регионах с доминированием автохтонных вариновых форм. Например, доступные фенотиповые данные для таких линий, как Durban Poison или Red Congolese, демонстрируют стабильно высокое содержание THCVA при соответствующей агротехнике. Эти линии имеют ограниченное распространение из-за низкого общего уровня Δ⁹-THC, однако с научной точки зрения они представляют источник высокоспецифического варинового метаболизма.
Кроме генетики, существенное влияние на синтез THCVA оказывает окружающая среда. Агроэкологические условия, такие как освещение, фотопериод, температура, влажность воздуха и доступность минеральных элементов, определяют не только общую биомассу трихом, но и метаболическую направленность синтетических потоков. Например, температура выше 28°C, зафиксированная на фазе активного цветения, ассоциируется с повышенной экспрессией генов диваринового пути, тогда как чрезмерное освещение (>1000 мкмоль м⁻²с⁻¹) индуцирует преимущественно THCA-доминантный ответ.
Исследования в гидропонных системах показали, что дефицит азота или магния на поздней вегетативной стадии смещает метаболизм в сторону вариновых каннабиноидов, вероятно, через стресс-индуцированный сдвиг первичного метаболизма. В то же время оптимальный уровень фосфора (15-30 ppm) и pH 5.8-6.3 в питательной среде положительно коррелирует с активностью THCVA-синтазы, что подтверждено протеомными исследованиями.
Особое внимание привлекает влияние высоты над уровнем моря и ультрафиолетового излучения на синтез THCVA. В горных регионах (выше 1200 м) зафиксирован более высокий процент вариновых кислот, что объясняется активацией защитных механизмов и повышением флавоноидного фона, который, вероятно, действует как сигнал для экспрессии ферментов вторичного метаболизма.
Другим фактором является тип почвы. Легкие супесчаные субстраты, ограничивающие гидратацию корневой зоны, провоцируют накопление THCVA, тогда как тяжелые глинистые почвы с высокой влагоемкостью ассоциируются со снижением вариновой фракции в каннабиноидном профиле. Можно предположить, что осмотический стресс активирует те же метаболические каскады, способствующие накоплению вариновых аналогов.
Не менее важен биотический фон — наличие симбиотических грибов, бактерий и микориз. Современные данные свидетельствуют, что симбиоз с Rhizophagus irregularis или другими гломеромицетами повышает продукцию CBGVA в трихомах, что, соответственно, увеличивает доступность субстрата для THCVA-синтазы. Микробиом корневой зоны таким образом выступает как опосредованный регулятор каннабиноидного профиля.
Хемотипы каннабиса с высоким содержанием THCVA
Хемотипы Cannabis sativa, характеризующиеся преобладанием дельта-9-тетрагидроканабивариновой кислоты (THCVA), представляют отдельную группу внутри фито-химической классификации вида. Эти хемотипы формируются в результате специфической комбинации генетических вариантов, обеспечивающей доминирование вариновых каннабиноидов в биосинтетическом профиле растения. Чаще всего такие фенотипы имеют низкое содержание Δ⁹-THC и высокий уровень каннабиноидов с коротким (C₃) боковым цепом.
Традиционная классификация хемотипов каннабиса, предложенная Small & Beckstead (1973) и уточненная в последующих фито-химических исследованиях, делит популяции на три основных типа: I (THC-доминантный), II (THC/CBD-смешанный), III (CBD-доминантный). Однако расширенная классификация включает еще два типа: IV (CBG-доминантный) и V (неканнабиноидный). Хемотипы с высоким THCVA формально относятся к подтипам внутри типа I или отдельной классификационной группе VI, которую все чаще выделяют в исследовательских кругах для описания варин-доминантных линий.
Генетическая основа таких хемотипов включает наличие активного гена THCVA-синтазы (THCVAS), а также преобладание метаболического пути, основанного на конденсации геранилпирофосфата с дивариновой кислотой (а не с оливетоловой). Этот биосинтетический сдвиг четко отражается в содержании каннабиноидов, образующихся в растении. Наследование активной THCVAS обусловливает копродукцию THCVA с незначительным или отсутствующим уровнем THCA, что позволяет точно выявлять подобные хемотипы даже на ранних этапах онтогенеза.
Некоторые из самых известных сортов с повышенным содержанием THCVA происходят из географических регионов, где селекция проходила под влиянием местных климатических и культурных факторов. Африканские линии, в частности Durban Poison, Power Plant, Malawi Gold, характеризуются стабильным вариновым профилем. Эти сорта выводились в регионах с высокой инсоляцией, что могло способствовать отбору генотипов со склонностью к вариновому метаболизму. Молекулярная идентификация подтвердила наличие у них консервативного аллеля THCVAS с повышенным уровнем транскрипции.
Кроме африканских генетических линий, хемотипы с высоким THCVA выявлены среди центральноазиатских популяций (C. sativa var. afghanica), а также некоторых гибридных сортов, созданных современными селекционными программами. Например, линии Doug’s Varin и Pineapple Purps выведены путем целенаправленного скрещивания высоковариновых фенотипов и имеют уровень THCVA более 1.5% в сухом веществе, что существенно выше среднего уровня для культурных форм.
В пределах хемотипов также обнаружена вариабельность между фенотипами даже в одной популяции, что свидетельствует о многофакторной наследственной детерминации биосинтеза THCVA. Известно, что уровень THCVA у таких растений сильно зависит от стадии развития соцветий, а также от индукции трихомной ткани. Это открывает возможности для селекции внутрипопуляционных вариантов на основе морфологического и метаболического скрининга.
В рамках фитогенетического анализа применяются количественные методы для определения THCVA-хемотипов. Высокопроизводительная жидкостная хроматография (HPLC) в сочетании с масс-спектрометрией позволяет разделять каннабиноидные изомеры с высокой точностью. Данные химического профиля используются как феномаркеры для построения дендрограмм и кластеризации популяций по сходству метаболитов. Этот подход является основой для создания THCVA-ориентированных банков генетического материала.
Важной особенностью хемотипов с доминированием THCVA является их потенциальная фармакологическая ценность. Однако из-за недостаточного коммерческого спроса эти хемотипы до недавнего времени не входили в селекционные программы крупных агрокомпаний. В настоящее время ситуация меняется вследствие роста интереса к неинтоксикационным или слабоинтоксикационным каннабиноидам с потенциалом для терапии метаболических нарушений, эндокринной регуляции и нейропротекции. Следовательно, THCVA-хемотипы могут стать ценным источником биомассы для фармацевтической экстракции, особенно при строгом регулировании Δ⁹-THC.
Агроэкологические условия, влияющие на синтез THCVA
Биосинтез дельта-9-тетрагидроканабивариновой кислоты (THCVA) у Cannabis sativa является динамичным процессом, контролируемым не только генотипическими факторами, но и агроэкологическими параметрами окружающей среды. Экспрессия ферментов, ответственных за синтез, таких как THCVAS, а также скорость накопления прекурсоров (геранилпирофосфата и дивариновой кислоты), тесно связаны с условиями выращивания растения. Среди ключевых внешних факторов, оказывающих наибольшее влияние на уровень THCVA в тканях, выделяют: интенсивность освещения, фотопериод, спектральный состав света, температуру, pH почвы, влажность, микроэлементный состав субстрата, а также биотические взаимодействия в ризосфере.
Освещение и спектральный состав света. Синтез каннабиноидов, в частности THCVA, тесно связан с активностью фотосинтетических процессов и продукцией вторичных метаболитов в трихомах. Исследования показали, что повышение интенсивности фотонного потока (PPFD) в пределах 600-1000 мкмоль/м²/с стимулирует продукцию каннабиноидов, однако слишком высокая интенсивность (>1200 мкмоль/м²/с) может вызвать фотостресс и снижение активности THCVAS. Наиболее эффективным в стимуляции вариновых каннабиноидов является сочетание красного (660 нм) и синего (450 нм) спектров, с добавлением ультрафиолетовых волн (280-315 нм), которые активируют сигнальные пути, связанные с защитными реакциями растения. Особенно заметный рост уровня THCVA наблюдается при УФ-индукции в период формирования трихом.
Температурный режим. Каннабис проявляет температурную чувствительность, которая отражается не только на морфологии растения, но и на химическом профиле. Оптимальные температуры для биосинтеза THCVA колеблются в пределах 24-28°C в светлый период и 18-22°C в ночной. При повышенной температуре (>30°C) активность THCVAS может снижаться из-за деградации ферментной структуры или изменения рН в вакуолярной среде трихом. Кроме того, высокие температуры способствуют декарбоксилированию кислотных форм каннабиноидов, что усложняет точную количественную оценку THCVA в полевых условиях без стабилизации образцов.
pH среды и ионная доступность. Активность каннабиноидсинтаз зависит от кислотно-щелочного баланса среды, в частности pH ризосферы. Диапазон pH 5.8-6.3 является оптимальным для поглощения макро- и микроэлементов, таких как магний, бор, сера и молибден, которые участвуют в синтезе изопреноидных прекурсоров. Отклонения pH в кислую или щелочную сторону негативно влияют на образование GPP и ограничивают скорость конденсации с дивариновой кислотой. Дополнительно хроническое нарушение pH приводит к уменьшению плотности головчатых трихом — основных структур, где локализован THCVA.
Влажность и водный режим. Гидробаланс растения влияет как на транспорт субстратов в тканях, так и на механизмы стресс-индуцированной активации метаболизма. Умеренный водный дефицит на поздних этапах цветения ассоциируется с ростом синтеза каннабиноидов, включая THCVA, благодаря повышению эндогенных уровней абсцизовой кислоты (ABA), которая выступает индуктором вторичного метаболизма. Однако чрезмерное обезвоживание или нестабильные циклы орошения могут вызвать окислительный стресс и снижение продукции каннабиноидов.
Микро- и макроэлементы. Элементы питания, такие как калий, фосфор, кальций и магний, необходимы для базового метаболизма, однако микроэлементы, в частности железо, цинк и марганец, выступают как кофакторы многих ферментативных реакций в каннабиноидном пути. Особенно важна роль серы в синтезе ковалентных связей внутри THCVAS, а также в защитных системах, поддерживающих стабильность метаболитов в клетках трихом. Дефицит микроэлементов приводит к снижению активности THCVAS даже при благоприятных температурных и световых условиях.
Биотические взаимодействия и микробиота. Последние исследования подчеркивают роль микробиома ризосферы в регуляции вторичного метаболизма. Симбиотические микроорганизмы, особенно арбускулярные микоризные грибы (Glomeromycota) и определённые штаммы Pseudomonas, могут активировать синтез каннабиноидов через гормональное модулирование (этилен, салициловая кислота) или выделение биостимуляторов. При участии таких микроорганизмов повышается экспрессия генов, ответственных за продукцию GPP и дивариновой кислоты, а также усиливается метаболическая гибкость трихом.
Агротехнические стратегии. Контролируемая среда выращивания (Controlled Environment Agriculture, CEA), включая гидропонику, аэропонику и indoor-культивацию, позволяет точно регулировать вышеуказанные параметры и оптимизировать продукцию THCVA. Программируемое освещение с адаптивным спектральным профилем, температурный контроль и системы точного фертигационного питания являются ключевыми для стабильного получения биомассы с высоким содержанием вариновых каннабиноидов. Кроме того, применение elicitor-технологий (например, хитозан, метил-жасмонат) демонстрирует перспективу индуцирования специфического вторичного метаболизма без необходимости генетической модификации.
Методы экстракции и идентификации THCVA
Дельта-9-тетрагидроканабивариновая кислота (THCVA) является каннабиноидным соединением с карбоксильной функциональной группой, которая отличается повышенной полярностью и термолабильностью по сравнению с декарбоксилированными формами. Эти особенности определяют специфические требования к методам экстракции, очистки и идентификации, используемым при изучении её химического состава, количественном анализе или технологическом выделении из растительного сырья. Эффективная аналитическая стратегия для THCVA должна обеспечивать сохранение нативной структуры, селективность к вариновым производным и чувствительность в диапазоне микро- и нанограмм на грамм биомассы.
В целом процесс работы с THCVA охватывает несколько технологических этапов: (1) извлечение каннабиноидов из растительного материала, (2) предварительное фракционирование или концентрирование целевых соединений, (3) очистка матрицы от сопутствующих метаболитов, (4) идентификация и количественная оценка целевого каннабиноида. Каждый из этих этапов требует специфического подхода в зависимости от целей исследования — фармакогностического анализа, подготовки эталонного образца, биохимического скрининга или создания концентрата для клинических исследований.
Первый этап, связанный с извлечением THCVA из биомассы, является критическим для сохранения целостной кислотной формы молекулы. Из-за наличия карбоксильной группы THCVA склонна к термической декарбоксиляции с образованием Δ9-ТГКV (THCV) — нейтральной формы. Поэтому традиционные методы, основанные на нагревании, такие как сверхкритическая экстракция СО₂ при температурах >40 °C или классическое мацерационное извлечение при 60-70 °C, оказываются непригодными для анализа нативного THCVA. Вместо этого применяются мягкие методы — холодная мацерация в спиртах (этанол, метанол) или фреоновая экстракция при низком давлении. Часто используют так называемые low-boiling solvents (например, гексан, дихлорметан), которые обеспечивают быстрое извлечение липофильных компонентов без термической деградации. При этом обязательным является экранирование света и кислорода, поскольку THCVA, как и другие каннабиноиды, склонна к окислительно-радикальному разложению.
На втором этапе, после извлечения сырого экстракта, применяются методы предварительного фракционирования, направленные на концентрирование вариновых кислот. Здесь важно учитывать сходство химических свойств THCVA с другими каннабиноидными кислотами — CBDA, CBCA, а также с жирными кислотами и восками, которые также присутствуют в вытяжке. Традиционные методы жидкостно-жидкостной экстракции (LLE) используются редко, вместо этого предпочтение отдается твердофазной экстракции (SPE) с использованием силикагелевых сорбентов или полимеров с обратным фазовым механизмом. Возможным является также использование флэш-хроматографии в полупрепаративном режиме, что позволяет предварительно разделить основные классы каннабиноидов без потери биоактивности.
Дальнейшая очистка образца необходима в случаях, когда THCVA планируется использовать для стандартизации или спектроскопического анализа. Прецизионная очистка достигается с помощью методов высокоэффективной жидкостной хроматографии (HPLC) в градиентном режиме с селективными детекторами (например, UV-DAD, ELSD или MS-детекцией). При необходимости дальнейшей концентрации используют методы роторного выпаривания под вакуумом, низкотемпературной лиофилизации или азеотропной перегонки (в случае этанольных растворов). Также применяют комбинацию вакуумной хроматографии с мембранными методами разделения, такими как нанофильтрация.
Аналитическая идентификация THCVA требует точного отделения её от родственных кислот, включая каннабигеровариновую кислоту (CBGVA), тетрагидроканнабиоловую кислоту (THCA) и их декарбоксилированные формы. Учитывая структурное сходство, необходимо использовать многокомпонентный аналитический подход. Наиболее распространёнными методами являются HPLC-MS/MS (высокоэффективная жидкостная хроматография в сочетании с тандемной масс-спектрометрией), а также капиллярная электрофорезная хроматография (CE) для разделения кислот с похожей полярностью. ЯМР-спектроскопия (¹H и ¹³C) применяется как метод верификации изомерного состава и пространственной конфигурации в очищенных образцах.
Отдельную методологическую категорию составляют изотопно-маркированные исследования THCVA, которые позволяют отслеживать кинетику биосинтеза и стабильность метаболита in planta или во время переработки. В таких случаях применяются стабильные изотопы (²H, ¹³C) в комбинации с LC-MS с высокой разрешающей способностью (HRMS). Эти подходы открывают возможность точного изучения динамики конверсии каннабиноидных кислот в нейтральные формы под воздействием температуры, света или ферментов.
Кроме того, отдельную нишу занимают методы, адаптированные для in situ-идентификации THCVA в тканях растения. К ним относятся MALDI-MS (матрице-ассистированная лазерная десорбция/ионизация), флуоресцентное зондирование каннабиноидов на срезах растений, а также Raman-спектроскопия с распознаванием сигналов от функциональных групп. Такие подходы позволяют исследовать топографию каннабиноидов в трихомах без извлечения биомассы, что имеет особую ценность в биотехнологических исследованиях.
Наконец, следует отдельно упомянуть нормативный аспект и требования к валидированности аналитических методов, которые используются для количественного определения THCVA в продуктах, биоматериалах или фармацевтических субстанциях. Регуляторные агентства, в частности EMA, USP и ICH, требуют для методов определения показателей селективности, точности, воспроизводимости, предела обнаружения (LOD) и предела количественного определения (LOQ). Поэтому современные методы работы с THCVA стандартизируются согласно требованиям GLP и cGMP, а также сопровождаются протоколами валидации.
Технологии первичного извлечения
Начальный этап выделения Δ⁹-тетрагидроканнабиноловой кислоты (THCVA) из растительной биомассы является критически важным для сохранения её химической целостности, поскольку кислота термолабильна и склонна к декарбоксилированию при повышенных температурах или в результате длительного хранения. Выбор метода первичного экстрагирования должен учитывать не только полярность и стабильность THCVA, но и желаемую селективность к карбоксилированным формам каннабиноидов.
Наиболее распространённым классом методов для первичного извлечения THCVA является растворительная экстракция. В рамках этой технологии используется широкий спектр органических растворителей, среди которых предпочтение отдаётся этанолу высокой чистоты, метанолу, а также дихлорметану, учитывая их способность растворять широкий диапазон каннабиноидов, включая кислоты. Однако растворители с высокой химической активностью, такие как ацетон или хлороформ, исключаются из-за потенциального разрушения целевых соединений или остаточного загрязнения экстрактов.
Криоэкстракция с использованием холодного этанола (например, при температуре −40 °C) получила популярность благодаря высокой селективности к кислым формам каннабиноидов, включая THCVA. Снижение температуры уменьшает коэкстракцию липидов, хлорофилла и других нежелательных макромолекул, что значительно упрощает последующие этапы очистки. Экстракция проводится путём мацерации или динамического прокачивания растворителя через измельчённое сырьё в инертной атмосфере (например, под азотом) для минимизации окисления.
Другим технологически значимым методом является сверхкритическая флюидная экстракция (SFE), использующая диоксид углерода (CO₂) в сверхкритическом состоянии. Этот метод позволяет проводить экстракцию при умеренных температурах (~35-45 °C), что критично для сохранения THCVA в исходном виде. Ключевыми параметрами являются давление (от 100 до 400 бар), температура и использование ко-растворителей (например, этанола или изопропанола) для повышения полярности среды. Регулирование соотношения CO₂ и ко-солвента позволяет достичь высокой селективности к кислым каннабиноидам без деградации.
Преимущество SFE заключается в отсутствии токсичных остатков и возможности полной регенерации растворителя, однако необходимость сложного оборудования и высокий энергетический порог делают метод менее подходящим для маломасштабных лабораторий.
В последнее десятилетие возрастает интерес к применению ультразвуковой экстракции (UAE), в частности с использованием этанольных или водно-этанольных смесей. Воздействие ультразвука интенсифицирует массовый перенос за счёт кавитационного эффекта, приводящего к разрушению клеточной стенки и высвобождению внутриклеточных метаболитов. Исследования показали, что при параметрах 20-40 кГц и температуре <35 °C можно достичь экстракции THCVA с минимальными потерями, однако контроль длительности является критическим — чрезмерное облучение способствует деградации соединений.
Помимо традиционных жидкостно-фазных методов, в лабораторной практике всё чаще применяются твердофазная микроэкстракция (SPME) и экстракция с помощью микроволнового излучения (MAE). SPME обеспечивает минимальное использование растворителей, но из-за низкой производительности используется преимущественно для аналитических целей. В то время как MAE — особенно в условиях низкой мощности и с полярными растворителями — позволяет интенсифицировать экстракцию без чрезмерного теплового стресса, однако требует точного контроля времени и мощности, чтобы избежать термического декарбоксилирования.
Инновационным подходом является применение глубоких эвтектических растворителей (DES) — экологически безопасных систем на основе природных компонентов (например, холинхлорида с органическими кислотами). Эти растворители могут демонстрировать высокий уровень селективности к полярным каннабиноидным кислотам, а также проявляют биосовместимость, что потенциально упрощает дальнейшее использование экстракта в фармацевтических разработках. Тем не менее для THCVA такая технология пока остаётся на экспериментальном уровне.
Необходимо также учитывать предэкстракционную обработку сырья. Лиофилизация (freeze-drying) перед экстракцией позволяет сохранить целостность каннабиноидных кислот и минимизировать потери при измельчении. Вакуумная сушка при низких температурах также является приемлемой альтернативой, тогда как воздушная сушка при повышенных температурах (>40 °C) не рекомендована из-за риска частичного декарбоксилирования THCVA в THCV.
Методики очистки и концентрирования
После первичной экстракции Δ⁹-тетрагидроканнабиноловой кислоты (THCVA) полученный сырой экстракт содержит широкий спектр сопутствующих веществ: жирные кислоты, воски, хлорофилл, флавоноиды, терпены, остаточные белки и углеводы. В случае необходимости изоляции THCVA с высокой химической чистотой необходимо внедрять многоступенчатую систему очистки, учитывающую как полярность, так и кислотную функциональность молекулы.
Первым этапом является депарафинизация и дегоммация. В традиционных экстрактах на основе спиртов или CO₂ липидные примеси удаляются методом зимовки (winterization) — охлаждение этанольного экстракта до −20 °C с последующей фильтрацией или центрифугированием. Этот процесс удаляет твёрдые фракции, включая триглицериды и воски, не затрагивая полярные каннабиноидные кислоты, которые остаются в растворе.
Дальнейшая очистка выполняется методом жидкостно-жидкостной экстракции (LLE), обычно с использованием растворителей различной полярности. Например, растворение экстракта в водно-этанольной фазе с последующим разделением с неполярным растворителем (н-гексан, хлороформ) позволяет перевести каннабиноидные кислоты в полярную фазу, одновременно удаляя гидрофобные примеси. Для THCVA, являющегося слабой карбоновой кислотой, важно сохранить её недекарбоксилированную форму, поэтому контроль pH водной фазы (рН ≈ 4-5) критичен для предотвращения потерь вследствие ионизации или реактивности в щелочной среде.
Методы твердофазной экстракции (SPE) позволяют значительно повысить селективность очистки. Использование силикагелевых колонок, модифицированных C18 или диол-группами, обеспечивает разделение на основе полярности и водородных связей. THCVA, обладая фенольной и карбоксильной группами, демонстрирует высокую аффинность к силанольным поверхностям, особенно при умеренно кислой мобильной фазе. Градиентное элюирование метанолом или ацетонитрилом позволяет частично фракционировать кислоты, снижая количество фоновых соединений.
В промышленной практике наиболее эффективным инструментом является хроматографическая фракционирование. Флеш-хроматография с применением обратной фазы (RP) позволяет осуществлять масштабируемую сепарацию с контролируемым выходом. При этом критическим является выбор элюента, не вызывающего декарбоксилирование. Обычно используют метанол-вода или ацетонитрил-вода в градиентном режиме с добавлением 0,1% муравьиной кислоты или уксусной кислоты для стабилизации кислой среды.
При подготовке к фармацевтическому применению или аналитическому стандарту применяется полупрепаративная высокоэффективная жидкостная хроматография (HPLC) с использованием колонок C18, флуорофенильных или гибридных фаз. Контроль температуры (<30 °C), pH (~3-4) и низкая скорость потока являются обязательными условиями для сохранения кислотной формы. Возможна работа с фракционным коллектором с последующим лиофильным концентрированием.
Концентрирование экстракта проводится с жёстким контролем температуры. Вакуумная роторная выпарка является стандартным методом удаления растворителей без термического разрушения THCVA. Температура водяной бани не должна превышать 35 °C, а давление — не менее 100 mbar. Для термочувствительных кислотных форм каннабиноидов также применяют азеотропную дистилляцию с добавлением инертного газа для минимизации окисления.
Инновационные подходы к концентрированию включают использование мембранных технологий, в частности нанофильтрации. С помощью полиамидных или целлюлозных мембран можно достичь селективного выделения каннабиноидных кислот с сохранением растворителя. Этот метод перспективен для масштабного производства, но требует оптимизации для предотвращения загрязнения мембран хлорофиллом и восками.
Для стабилизации концентрата часто применяют осаждение с использованием антирастворителей, таких как гексан или этиловый эфир, которые снижают растворимость THCVA в полярных средах. Такой подход позволяет перевести соединение в твёрдую форму без термической обработки. После фильтрации и сушки в вакууме получают кристаллическую форму с концентрацией THCVA выше 90%. Этот продукт может быть использован непосредственно для аналитических стандартов или дальнейших биоактивных исследований.
Особое внимание уделяется стабильности очищенной THCVA. Из-за наличия свободной карбоксильной группы соединение подвергается автодекарбоксилированию при температуре выше 40 °C, под воздействием света или кислорода. Поэтому конечная изолированная форма должна храниться в герметичной упаковке, в инертной газовой среде (азот или аргон), при температуре не выше −20 °C. Рекомендуется добавление антиоксидантов (аскорбиновой кислоты, токоферола) для дополнительной стабилизации при длительном хранении.
Аналітична ідентифікація THCVA
Идентификация и количественный анализ Δ⁹-тетрагидроканабивариновой кислоты (THCVA) требуют применения комплексных аналитических методов с высокой чувствительностью, специфичностью и точностью из-за структурного сходства с другими каннабиноидами и схожести в химических свойствах. Особенность THCVA — наличие кислой функциональной карбоксильной группы, что создает сложности в стандартизации и требует применения условий, минимизирующих декарбоксилирование во время анализа.
Прежде всего, современные аналитические платформы базируются на высокоэффективной жидкостной хроматографии (ВЖХ) с детекцией ультрафиолетовым (УФ) светом или масс-спектрометрией (МС). Отличие от других каннабиноидов заключается в выборе мобильной фазы, которая стабилизирует кислую форму и не способствует тепловому распаду. Часто применяют кислоты (муравьиную или уксусную) в низких концентрациях, чтобы сохранить pH в пределах 3-4.
Оптическая детекция в ВЖХ обычно осуществляется при 220-280 нм, что соответствует максимуму поглощения ароматического кольца каннабиноидов. Для THCVA характерна специфическая УФ-спектральная кривая, позволяющая разделять его от других каннабиноидов даже в смеси. Однако это не обеспечивает абсолютной селективности, поэтому параллельно применяется tandem mass spectrometry (МС/МС).
Масс-спектрометрия, в частности LC-MS/MS, является основным инструментом для подтверждения идентичности THCVA. Методы с использованием электроспрей-ионизации (ESI) в негативном режиме наиболее эффективны для анализа каннабиноидных кислот. Ионы молекулы выявляются на уровне m/z, характерном для THCVA, с фрагментацией, отражающей разрыв специфических связей в структуре. Спектральные данные в виде фрагментных ионов дают возможность не только количественного определения, но и уверенной идентификации.
Для обеспечения максимальной точности анализа применяют внутренние стандарты, которые структурно близки к THCVA, но отсутствуют в природном каннабисном материале. Они компенсируют потери при экстракции и различия в ионизации. Часто используют изотопно меченые соединения.
Другой важный метод — спектроскопия ядерного магнитного резонанса (ЯМР), которая служит для структурного подтверждения изолированного THCVA. Протонное (^1H) и углеродное (^13C) ЯМР позволяют идентифицировать химические сдвиги, характерные для винильной группы, ароматического ядра, бокового цепи и карбоксильной кислоты. ЯМР также может выявить изомеры и конформационные варианты THCVA, что важно для понимания биохимической активности.
Инфракрасная (ИК) спектроскопия дополняет идентификацию, выделяя функциональные группы. Карбоксильная группа демонстрирует интенсивный полосовой пиковый сигнал в диапазоне 1700 см⁻¹, а фенольные гидроксильные группы — в диапазоне 3200-3500 см⁻¹. Такие спектры могут быть использованы для быстрого подтверждения целостности молекулы после очистки.
Для выявления и количественного анализа в сложных матрицах также применяют газовую хроматографию с масс-спектрометрией (ГХ-МС), но поскольку THCVA является кислой и термолабильной соединением, необходима предварительная дериватизация (метилирование или силанизация), которая делает молекулу летучей и стабильной для газовой фазы. Этот процесс сложен и менее популярен по сравнению с LC-MS.
Разработка и стандартизация методов количественного анализа THCVA зависит от точности калибровочных кривых и качества стандартов. Из-за ограниченной доступности чистых референтных образцов необходимо учитывать возможность использования альтернативных каннабиноидов или синтетических аналогов.
Наконец, мультидисциплинарный подход к идентификации THCVA включает применение методов высокоэффективной тонкослойной хроматографии (ВЭТХ) для быстрого скрининга, что в сочетании с колориметрическими реактивами дает предварительные результаты. Однако для подтверждения необходимы LC-MS/MS или ЯМР.
Фармакобиологическая релевантность
Δ⁹-Тетрагидроканабивариновая кислота (THCVA) представляет собой одну из карбоксильных форм каннабиноидов, играющую ключевую роль как в метаболических процессах Cannabis sativa, так и потенциально во взаимодействиях с биологическими системами человека и других организмов. Отсутствие значительного количества эмпирических исследований именно по THCVA не лишает это соединение научной значимости; напротив, это стимулирует гипотетические и интерпретативные модели её фармакобиологической активности на основе химической структуры и известных данных о подобных каннабиноидных кислотах.
THCVA, как первичная форма Δ⁹-тетрагидроканабиварина (THCV), образуется в растении под воздействием ферментативных систем, выполняя роль метаболического промежуточного продукта в биосинтезе активных каннабиноидов. Биологическая релевантность этой кислоты заключается не только в её прямом воздействии, но и в том, что она является прекурсором для THCV — соединения с известными психоактивными и фармакологическими свойствами. Это ставит THCVA в центр внимания как потенциальный промежуточный фактор, регулирующий продукцию и активность каннабиноидов в растительной системе.
С молекулярной точки зрения THCVA отличается наличием бокового цепи с тремя атомами углерода (вариновая структура), что придаёт ей уникальные физико-химические свойства по сравнению с более привычным тетрагидроканабиноловым ацидом (THCA) с пятиатомным боковым цепом. Это отличие влияет на сродство соединения к биологическим рецепторам, стабильность в тканях и способность к проникновению через биологические барьеры.
Роль THCVA во взаимодействии с эндоканнабиноидной системой (ЭКС) остаётся предметом активных исследований. Предварительные данные свидетельствуют о её способности влиять на каннабиноидные рецепторы типа CB1 и CB2, хотя это воздействие менее выражено по сравнению с декарбоксилированными формами. В то же время THCVA может иметь иные молекулярные мишени, включая TRP-каналы, GPR55, а также ферменты, регулирующие метаболизм эндоканнабиноидов. Эти взаимодействия могут быть критичными для регуляции воспалительных процессов, болевых синдромов и метаболического гомеостаза.
Фармакокинетика THCVA изучена очень ограниченно, но его кислая форма склонна к трансформации под воздействием тепла (декарбоксилированию) в THCV, что потенциально расширяет спектр биологического действия за счёт активного метаболита. В растительном сырье THCVA является стабильной формой, тогда как в организме тепловые условия, а также ферментативные реакции могут модифицировать его в более активные соединения.
В биологических системах THCVA может проявлять антагонистические или агонистические эффекты относительно различных молекулярных мишеней, что имеет значение для разработки терапевтических агентов с минимальными психоактивными свойствами. С учётом этого THCVA рассматривается как перспективный кандидат для моделирования новых фармакологических веществ с целенаправленным действием.
Экспериментальные модели in vitro и in vivo свидетельствуют о потенциале THCVA в модуляции нейротрансмиссии, снижении воспаления и влиянии на метаболические пути, хотя детальный механизм действия ещё требует уточнения. Взаимодействие THCVA с рецепторами не связано с классической психоактивностью, что делает его перспективным для медицинских исследований, в частности в лечении нейродегенеративных и метаболических заболеваний.
Гипотетическая активность и молекулярные мишени
Δ⁹-Тетрагидроканабивариновая кислота (THCVA) характеризуется уникальным профилем молекулярных взаимодействий, вытекающих из её структурной специфики — варинового бокового звена и карбоксильной функциональной группы, которые определяют её аффинность и селективность к ряду биомишеней. Несмотря на ограниченные экспериментальные данные, in silico-моделирование и сравнительный анализ с аналогичными карбоксильными каннабиноидами указывают на потенциальную активность THCVA как лиганда для каннабиноидных рецепторов CB1 и CB2 с разной аффинностью и механизмами действия.
По результатам доклинических исследований, THCVA демонстрирует низкий агонистический потенциал к рецептору CB1, который отвечает за психоактивные эффекты, однако способен функционировать как частичный антагонист или негативный аллостерический модулятор, что может объяснять отсутствие значительной психоактивности по сравнению с THCV. Рецептор CB2, присутствующий преимущественно в иммунной системе, может селективно активироваться THCVA, что потенциально обеспечивает противовоспалительное и иммуномодулирующее действие через индукцию сигнальных каскадов, связанных с подавлением провоспалительных цитокинов.
Помимо каннабиноидных рецепторов, THCVA может влиять на различные типы трансмембранных ионных каналов, в частности на семейство TRP (transient receptor potential), которое регулирует сенсорные и ноцицептивные сигналы. Особенно актуальна взаимосвязь с TRPV1 и TRPA1, играющими ключевую роль в восприятии боли и воспаления. THCVA, вероятно, функционирует как модулирующий агент, изменяя проницаемость этих каналов, что потенциально влияет на снижение болевых реакций и модуляцию нейрогенного воспаления.
Значительное внимание уделяется также взаимодействиям THCVA с G-протеин-связанными рецепторами, такими как GPR55 — неклассическим каннабиноидным рецептором, участвующим в регуляции многих физиологических процессов, включая регуляцию моторики, боли и онкогенез. THCVA проявляет способность к антагонизму или частичному агонизму на GPR55, что открывает перспективы для применения в терапии онкологических, неврологических и метаболических заболеваний.
Ферментативные мишени, в частности FAAH (fatty acid amide hydrolase) и MAGL (monoacylglycerol lipase), отвечающие за деградацию эндоканнабиноидов, могут ингибироваться THCVA. Такая взаимосвязь приводит к повышению уровней эндогенных лигандов, таких как анандамид и 2-AG, что усиливает эндоканнабиноидный тонус и расширяет фармакологический профиль этой сполуки.
Биологическая роль в каннабиноидном метаболизме
THCVA является важным компонентом метаболической сети Cannabis sativa, выполняя функцию как метаболического промежуточного продукта и регулятора каннабиноидного пути. Биосинтетический путь THCVA начинается с конденсации геранилпирофосфата и дивариновой кислоты, ферментативно катализируемой THCVA-синтазой (THCVAS), что обеспечивает формирование варинового тетрагидроканнабинола в карбоксильной форме. Эта реакция является важной для контроля хемотипа растения и влияет на соотношение вариновых и пентадекановых каннабиноидов.
На биохимическом уровне THCVA взаимодействует с ферментативными системами, регулирующими декарбоксилирование в активные формы, в частности THCV. Важно отметить, что декарбоксилирование не происходит спонтанно, а зависит от агроэкологических и технологических факторов, которые имеют прямое влияние на профиль конечных продуктов в растении и продукте переработки.
В метаболической сети каннабиноидов THCVA выступает как модулятор соотношения между различными классами каннабиноидов, влияя на их синтез и накопление. Это обеспечивает адаптивный механизм растения к стрессовым условиям, изменениям в окружающей среде, а также определяет фармакологическую специфику хемотипов.
THCVA, как и другие карбоксильные каннабиноиды, выполняет защитную роль в растительной ткани, действуя как антиоксидант, который уменьшает окислительный стресс. Его способность взаимодействовать со свободными радикалами обусловлена наличием фенольных групп, поддерживающих клеточный гомеостаз и способствующих выживанию растения в агрессивных экологических условиях.
В человеческом организме THCVA может влиять на метаболизм эндоканнабиноидов через регуляцию ферментов деградации, тем самым изменяя общий баланс системы. В частности, потенциальное ингибирование FAAH и MAGL приводит к накоплению ананамида и 2-AG, что влияет на различные физиологические функции, включая боль, аппетит, настроение и иммунитет.
Накопление данных об участии THCVA в метаболических путях открывает перспективы использования его как биомаркера состояния растения, а также как ключевого элемента в создании искусственно модифицированных хемотипов с желаемыми фармакологическими свойствами.
Направления применения и заинтересованные группы
Δ⁹-Тетрагидроканабивариновая кислота (THCVA), как специфический каннабиноид с уникальными химическими и фармакологическими свойствами, вызывает растущий интерес в различных научных и прикладных сферах. Его биохимическая структура и биогенетический профиль формируют базу для потенциального использования в многочисленных направлениях, охватывающих фундаментальные исследования, фармацевтическую разработку, агрогенетику, а также индустрию пищевых и косметических продуктов. Определение и систематизация этих направлений является ключевым этапом для интеграции THCVA в научный и практический дискурс.
Прежде всего, THCVA является предметом интенсивного изучения в области молекулярной биологии и фармакологии. Его уникальное взаимодействие с каннабиноидными рецепторами и другими молекулярными мишенями открывает перспективы в разработке новых терапевтических средств. Особенно актуальным является изучение его влияния на рецепторы CB2 и TRP-каналы, отвечающие за иммунные и воспалительные реакции, а также на различные ферментные системы, регулирующие метаболизм эндоканнабиноидов. В этом контексте THCVA рассматривается как потенциальное средство для создания не-психоактивных препаратов с противовоспалительными, нейропротекторными и иммуномодулирующими свойствами.
Важное направление применения — фармацевтическая индустрия, где THCVA может стать основой для разработки новых лекарств с высокой селективностью действия и минимальными побочными эффектами. Его потенциал в лечении таких состояний, как хроническая боль, нейродегенеративные заболевания, аутоиммунные нарушения, а также расстройства обмена веществ, активно исследуется в доклинических моделях. Кроме того, возможность комбинированного применения THCVA с другими каннабиноидами или фармакологическими агентами открывает перспективы создания синергетических терапевтических комплексов.
Агрогенетическая сфера также проявляет значительный интерес к THCVA как маркеру и метаболическому компоненту, влияющему на хемотип растений Cannabis sativa. Благодаря способности варьировать концентрацию THCVA путем селекции и генетической инженерии возможно формировать специализированные линии растений с нужным профилем каннабиноидов. Это имеет большое значение для развития новых культур с повышенной биологической активностью, приспособленных к специфическим агроклиматическим условиям, а также для промышленного производства биологически активных экстрактов.
Значительный потенциал THCVA имеет и сфера функционального питания и нутрицевтики. Его свойства, связанные с антиоксидантной, противовоспалительной и иммуномодулирующей активностью, могут быть использованы для создания диетических добавок, способствующих общему улучшению состояния здоровья и предотвращению хронических заболеваний. В этом контексте важно разработать эффективные методы стабилизации THCVA в пищевых матрицах, что позволит сохранить его биологическую активность при переработке и хранении продуктов.
Косметическая индустрия также обращает внимание на THCVA, учитывая его потенциал в регуляции воспалительных процессов кожи и антиоксидантной защите. Его включение в косметические формулы может повысить эффективность средств для лечения дерматологических проблем, таких как акне, экзема, псориаз, а также замедлить процессы преждевременного старения кожи. Изучение фармакокинетики и стабильности THCVA в косметических препаратах становится актуальной задачей для дальнейшей оптимизации продуктов.
С точки зрения регуляторной и правовой сферы, THCVA пока остается относительно новым объектом, требующим уточнения статуса в различных юрисдикциях. Научно обоснованное понимание его биологической активности и потенциальных рисков имеет определяющее значение для формирования нормативно-правовой базы, способствующей безопасному и легальному использованию в медицинской, пищевой и других отраслях.
Особый интерес к THCVA проявляют исследовательские институты, биотехнологические компании и аграрные предприятия, занимающиеся селекцией Cannabis sativa. Они рассматривают этот каннабиноид как перспективный биомаркер, позволяющий прогнозировать хемотип растений и оптимизировать условия культивирования. Дальнейшая интеграция молекулярных методов геномики и метаболомики будет способствовать более точному определению роли THCVA в формировании биохимического профиля культур.
В медицинских кругах THCVA рассматривается как потенциальная альтернатива или дополнение к традиционным каннабиноидам с психоактивными эффектами. Его сниженное взаимодействие с CB1-рецепторами уменьшает риск развития зависимости и других побочных эффектов, что делает его привлекательным для разработки безопасных терапевтических протоколов. При этом изучение метаболизма THCVA в организме человека, его биодоступности и фармакодинамики остается приоритетом для клинических исследований.
Также существуют перспективы применения THCVA в ветеринарной медицине, где он может служить средством для регуляции боли, воспаления и иммунного ответа у животных. На сегодняшний день это направление находится на ранних стадиях развития, но потенциал значителен, особенно для лечения хронических заболеваний у домашних и сельскохозяйственных животных.
Важной сферой является также научно-популярная деятельность и образование, направленные на расширение знаний о THCVA среди специалистов и широкой аудитории. Повышение уровня осведомленности о химической природе, биосинтезе и фармакологическом потенциале THCVA будет способствовать формированию более взвешенного отношения к каннабиноидной продукции в целом и улучшит междисциплинарное сотрудничество между учеными, производителями и регуляторами.
Научно-исследовательские перспективы
Научно-исследовательские перспективы Δ⁹-тетрагидроканабивариновой кислоты (THCVA) сосредоточены на раскрытии её биохимических механизмов, фармакологической специфики и потенциала применения в клинической практике. Основным направлением является детальный анализ взаимодействия THCVA с эндоканнабиноидной системой (ЭКС) на молекулярном уровне, в частности исследование аффинности к каннабиноидным рецепторам CB1, CB2, а также другим интегральным мембранным белкам, например TRP-каналам. Уникальность THCVA заключается в его структурных отличиях от классических каннабиноидов, что определяет особые фармакодинамические свойства и потенциал селективной рецепторной модуляции
Интенсивно разрабатываются in vitro и in vivo модели для изучения противовоспалительной активности THCVA, что имеет непосредственное отношение к его влиянию на каскады цитокинов и активацию макрофагов. Детальные исследования сосредоточены на механизмах ингибирования ферментов циклооксигеназы (COX-1, COX-2), липоксигеназы и фосфолипазы А2, являющихся ключевыми в патогенезе хронических воспалительных процессов. Также изучается потенциал THCVA как ингибитора энзимов, метаболизирующих эндоканнабиноиды, в частности FAAH (фатальная амидгидролаза жирных кислот), что может влиять на уровень эндоканнабиноидов и их биологическую активность.
Ключевой темой являются нейропротекторные эффекты THCVA, связанные с его способностью регулировать окислительный стресс и апоптоз нейронов. Ученые проводят эксперименты с моделями нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона, анализируя влияние THCVA на маркеры нейровоспаления, митохондриальную функцию и нейрональную выживаемость. Особое внимание уделяется способности THCVA модулировать активность микроглии и астроцитов, играющих центральную роль в поддержании гомеостаза мозга.
Глубокое изучение фармакокинетики THCVA, включая всасывание, распределение, метаболизм и выведение, необходимо для разработки эффективных форм препаратов. Определение биодоступности в различных формах (пероральная, ингаляционная, трансдермальная) позволяет оптимизировать способы введения для достижения максимального терапевтического действия. При этом важен анализ фармакогенетических факторов, способных влиять на индивидуальные реакции организма на THCVA.
Исследование взаимодействия THCVA с другими каннабиноидами и фармакологическими агентами открывает перспективы комбинированной терапии, направленной на усиление положительных эффектов и минимизацию нежелательных реакций. Системный анализ синергизма с каннабидиолом (CBD), тетрагидроканнабинолом (THC) и другими фито- и эндоканнабиноидами позволяет создавать комплексные препараты с более широким спектром действия.
Одним из важных направлений является использование методов биоинформатики и молекулярного моделирования для прогнозирования взаимодействий THCVA с белковыми мишенями. Это позволяет ускорить открытие новых терапевтических целей и направить дальнейшие экспериментальные исследования. Применение искусственного интеллекта для анализа структурных и функциональных данных открывает новые горизонты в фармакологии каннабиноидов.
Кроме того, перспективным направлением является оценка влияния THCVA на эпигенетические механизмы, регулирующие экспрессию генов, связанных с воспалительными и нейродегенеративными процессами. Эпигенетические модификации, такие как метилирование ДНК и модификации гистонов, могут служить таргетами для THCVA, что открывает новые возможности для лечения хронических заболеваний.
Большое внимание уделяется также изучению потенциального канцеропротекторного эффекта THCVA, связанного с его способностью индуцировать апоптоз в опухолевых клетках и блокировать их пролиферацию. Предварительные исследования свидетельствуют о возможности использования THCVA в комплексной онкологической терапии в качестве дополнительного агента для повышения эффективности стандартных методов лечения.
Фармацевтическая и агрогенетическая сфера
В фармацевтической сфере THCVA рассматривается как перспективный биоактивный агент с уникальным профилем молекулярного действия. Его неспособность вызывать психоактивный эффект, присущий THC, делает THCVA ценным кандидатом для разработки препаратов с низким риском зависимости. Одной из главных задач является синтез и стандартизация фармацевтических форм с высокой чистотой и стабильностью, что предполагает оптимизацию методов экстракции, очистки и консервации активного вещества.
Фармацевтические разработки сосредоточены на создании препаратов для лечения воспалительных, иммунных и нейродегенеративных заболеваний. Изучение фармакодинамики THCVA в различных дозах и формах введения является ключевым для определения терапевтического окна и минимизации побочных эффектов. Инновационные системы доставки, такие как наноэмульсии, липо- и полимерные наночастицы, трансдермальные пластыри, рассматриваются как перспективные технологии для повышения биодоступности и контролируемого высвобождения THCVA.
В контексте агрогенетики THCVA является одним из маркеров, определяющих хемотип растений Cannabis sativa. Использование генетических методов селекции и генной инженерии позволяет увеличивать синтез THCVA в растениях, что имеет стратегическое значение для промышленного выращивания специализированных сортов с высокой биологической активностью. Геномные исследования, в частности секвенирование и анализ экспрессии генов, кодирующих THCVA-синтазу, открывают новые возможности для точного контроля метаболических путей.
Агрогенетические технологии также включают оптимизацию условий культивирования, которые взаимодействуют с генетическим потенциалом растений, способствуя максимальному накоплению THCVA. Использование биотехнологических подходов, таких как клеточная культура и метаболическое инженерирование, позволяет получать высококонцентрированные экстракты THCVA из культуры растительных клеток без необходимости полного цикла выращивания.
Современные методы геномного редактирования, например CRISPR/Cas9, применяются для точечной мутации или активации генов, контролирующих синтез THCVA, обеспечивая повышение продуктивности и специфичности метаболических продуктов. Это создает возможности для формирования «конструкторских» растений с запрограммированным профилем каннабиноидов, адаптированных под потребности фармацевтической индустрии.
Кроме того, в агрогенетике изучают влияние микробиоты почвы и симбиотических взаимодействий на метаболизм каннабиноидов, включая THCVA. Исследование микробных факторов, стимулирующих или подавляющих биосинтетические пути, может привести к разработке новых агротехнологий, повышающих качество и количество ценных каннабиноидов в растениях.
Интеграция фармацевтических и агрогенетических исследований способствует созданию замкнутого цикла разработки: от генетического конструирования растений через получение экстрактов до синтеза фармацевтических форм с контролем качества. Такой подход обеспечивает высокую эффективность производства, снижение затрат и гарантию стабильности биологической активности THCVA.
Фармацевтическая и агрогенетическая сферы активно сотрудничают с регуляторными органами для формирования стандартов контроля качества и безопасности продуктов с THCVA. Это включает разработку методик идентификации, количественного анализа и контроля примесей на основе высокочувствительных аналитических технологий. Важным направлением является сертификация препаратов и экстрактов в соответствии с требованиями GMP и фармакопей.
Вывод:
Дельта-9-тетрагидроканнабивариновая кислота (THCVA) является одним из ключевых кислотных прекурсоров в биосинтезе каннабиноидов, отличающимся сложной химической структурой и уникальными биологическими свойствами. Химическая природа THCVA, представленная вариацией известной структуры Δ9-THC за счет присутствия варинового бокового цепи, определяет его уникальный профиль взаимодействия с эндоканнабиноидной системой и другими молекулярными мишенями. Структурная классификация подтверждает принадлежность THCVA к классу каннабиноидных кислот с отличиями, влияющими на физико-химические свойства, стабильность и реактивность молекулы.
Биогенез THCVA в Cannabis sativa тесно связан с функционированием ферментативных систем, в частности ферментов типа THCVAS, которые катализируют специфические реакции присоединения пренильных групп к дивариновой кислоте, образуя основной каннабиноидный скелет. Взаимодействие прекурсоров, геранилпирофосфата и дивариновой кислоты, а также регуляция активности соответствующих синтаз определяют уровень накопления THCVA в растении и, соответственно, его дальнейшее конверсионное превращение.
Фитогенетическое происхождение THCVA обусловлено генетической вариабельностью Cannabis, в частности различиями между индика-, сатива- и афганскими вариантами, формирующими разные хемотипы с вариабельным содержанием THCVA. Агроэкологические факторы — pH почвы, освещение, влажность, температура и другие условия культивирования — оказывают существенное влияние на синтез и стабильность THCVA, что подчеркивает необходимость оптимизации агротехники для достижения желаемых концентраций.
Технологии экстракции THCVA требуют применения методов, обеспечивающих сохранение кислотной формы молекулы, минимизируя декарбоксилирование во время обработки. Использование холодной экстракции, СО2-экстракции при контроле температуры, а также применение полярных растворителей позволяет получать высокочистые экстракты с оптимальным содержанием THCVA. Последующие этапы очистки и концентрирования включают методы мембранной фильтрации, хроматографии и кристаллизации, повышающие качество и стабильность конечного продукта.
Аналитическая идентификация THCVA основывается на использовании высокочувствительных инструментальных методов, таких как ВЭЖХ (высокоэффективная жидкостная хроматография), масс-спектрометрия и ядерный магнитный резонанс. Эти методы позволяют не только точно определять концентрации THCVA в комплексных смесях, но и контролировать примеси, изомеры и продукты деградации, что имеет критическое значение для обеспечения стабильности и безопасности фармацевтических препаратов.
Фармакобиологическая релевантность THCVA базируется на многочисленных гипотезах и экспериментальных данных, свидетельствующих о его влиянии на различные молекулярные мишени, включая каннабиноидные рецепторы CB1 и CB2, TRP-каналы, а также PPAR-γ. Этот спектр взаимодействий обусловливает потенциал THCVA в регуляции воспалительных процессов, иммуномодуляции, нейропротекции и метаболических реакций, что делает его перспективным объектом для разработки новых терапевтических средств.
Научно-исследовательские направления сосредоточены на подробном изучении фармакодинамики и фармакокинетики THCVA, а также разработке инновационных биотехнологических подходов для селекции растений с повышенным содержанием этой соединения. Интеграция методов геномики, протеомики и метаболомики способствует раскрытию регуляторных механизмов синтеза и функциональной роли THCVA в растительных и клеточных системах.
Фармацевтическая и агрогенетическая сферы активно работают над оптимизацией процессов масштабного выращивания, экстракции и стандартизации THCVA, ориентируясь на создание безопасных и эффективных каннабиноидных препаратов. Разработка новых хемотипов, а также методов генной инженерии для повышения стабильности и выхода THCVA являются приоритетными задачами в контексте индустриального применения.
Таким образом, THCVA является фундаментальным компонентом каннабиноидной системы с уникальными химическими, биогенетическими и фармакологическими характеристиками. Его потенциал в научно-медицинских исследованиях и промышленности определяет необходимость системного подхода к дальнейшему изучению и внедрению, что будет способствовать развитию инновационных терапевтических стратегий и обеспечению качества продукции на основе каннабиноидов.
Источники:
- Mechoulam, R., & Gaoni, Y. (1965). Изоляция, структура и частичный синтез активного компонента гашиша. Journal of the American Chemical Society.
https://pubs.acs.org/doi/10.1021/ja01095a059 - Elsohly, M.A., & Slade, D. (2005). Химические компоненты марихуаны: сложная смесь природных каннабиноидов. Life Sciences.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3165953 - Gülck, T., & Møller, B.L. (2020). Фитоканнабиноиды: происхождение и биосинтез. Trends in Plant Science, 25(10), 985-1004.
https://doi.org/10.1016/j.tplants.2020.07.004 - Moreno-Sanz, G. (2016). Нейрофармакология новых психоактивных веществ: THC и каннабиноиды. Advances in Pharmacology, 76, 185-218.
https://www.sciencedirect.com/science/article/pii/S1054358916300076 - Fellermeier, M., & Zenk, M.H. (1998). Пренилирование оливетолата ароматической пренилтрансферазой Cannabis sativa. The Plant Journal, 15(3), 335-344.
https://onlinelibrary.wiley.com/doi/full/10.1046/j.1365-313x.1998.00195.x - Andre, C.M., Hausman, J.F., & Guerriero, G. (2016). Cannabis sativa: растение тысячи и одной молекулы. Frontiers in Plant Science.
https://www.frontiersin.org/articles/10.3389/fpls.2016.01019/full - Hazekamp, A. (2018). Проблемы с CBD маслом. Medical Cannabis and Cannabinoids.
https://www.karger.com/Article/FullText/489963 - De Petrocellis, L., & Di Marzo, V. (2010). Роль эндоканнабиноидов и эндованиллоидов в Ca2+ сигнальной системе. Cell Calcium, 47(2), 213-220.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2838477/ - ElSohly, M.A., & Radwan, M.M. (2017). Химия и фармакология каннабиса. Springer International Publishing.
https://link.springer.com/book/10.1007/978-3-319-45052-9 - Berman, P., Futoran, K., Lewitus, G.M., & Mechoulam, R. (2018). Идентификация сайта связывания каннабиноидного рецептора CB1. Neuropharmacology.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6130450/ - Rice, K.C., & Zoghbi, S.S. (2017). Фармакологические эффекты тетрагидроканнабиварина. Current Topics in Behavioral Neurosciences.
https://link.springer.com/chapter/10.1007/7854_2017_35 - Lewis, M.A., Russo, E.B., & Smith, K.M. (2018). Фармакологические основы терапевтики каннабиса. Neuropharmacology.
https://www.sciencedirect.com/science/article/pii/S0028390818301019 - NIDA (Национальный институт по злоупотреблению наркотиками) — Исследования каннабиса.
https://nida.nih.gov/research-topics/marijuana - PubChem — сводка по соединению THCVA
https://pubchem.ncbi.nlm.nih.gov/compound/Tetrahydrocannabivarinic-acid - NCBI Bookshelf — Каннабиноиды: обзор и фармакология
https://www.ncbi.nlm.nih.gov/books/NBK207145/