В последние десятилетия внимание ученых, медиков и фармакологов всё больше сосредотачивается на глубоком понимании сложных регуляторных систем, которые поддерживают равновесие в организме. Одной из таких ключевых систем, которую только недавно начали широко изучать, является эндоканнабиноидная система. Несмотря на своё название, она связана не только с каннабисом, но и представляет собой универсальную биологическую сеть, функционирующую в организме независимо от внешнего воздействия каннабиноидов. Её открытие открыло новую эпоху в биомедицине, фармакологии и понимании гомеостаза.
Прежде чем подвести итоги, важно ещё раз уточнить: что такое эндоканнабиноидная система? Это комплекс рецепторов, эндогенных лигандов (то есть природных соединений, которые вырабатывает сам организм) и ферментов, которые вместе регулируют широкий спектр физиологических процессов. К ключевым компонентам системы относятся каннабиноидные рецепторы типа 1 (CB1) и типа 2 (CB2), а также эндогенные каннабиноиды — в частности анандамид и 2-АГ — и ферменты, отвечающие за их синтез и расщепление.
На момент открытия эндоканнабиноидной системы в 1990-х годах научный мир был поражён её всеобъемлющим влиянием на такие жизненно важные процессы, как настроение, память, аппетит, боль, воспаление, иммунный ответ, регуляция сна, моторика и др. Это указывает на то, что эндоканнабиноидная система действует не изолированно, а во взаимодействии со многими другими системами — нервной, иммунной, эндокринной.
Современные научные исследования демонстрируют, что дисфункция или дефицит эндоканнабиноидной системы может играть важную роль в развитии хронических заболеваний. К таким могут относиться синдром раздражённого кишечника, мигрень, фибромиалгия, депрессия, ПТСР, тревожные расстройства, а также некоторые аутоиммунные заболевания. Известный научный термин — клинический эндоканнабиноидный дефицит — описывает состояние, при котором природные каннабиноиды вырабатываются в недостаточном количестве, что нарушает способность организма к саморегуляции.
Отдельную роль в исследовании этой системы играет взаимодействие с фитоканнабиноидами — то есть соединениями растения каннабис, которые способны влиять на эндоканнабиноидную систему человека. Самые известные из них — тетрагидроканнабинол (ТГК) и каннабидиол (КБД) — стали объектом многочисленных клинических испытаний. Они действуют через рецепторы CB1 и CB2, которые широко распространены в головном мозге, центральной нервной системе, иммунных клетках и внутренних органах. Таким образом, каннабис не является «внешним» агентом в классическом смысле — его компоненты вписываются в уже существующую биохимическую систему организма.
Однако ответ на вопрос «что такое эндоканнабиноидная система» не ограничивается только перечнем рецепторов и молекул. Речь идёт о целостной концепции — о том, как организм поддерживает стабильность в меняющихся условиях внешней и внутренней среды. ЭКС действует подобно термостату, «чувствуя» отклонения от нормы и активируя соответствующие механизмы восстановления равновесия. Этот принцип, известный как гомеостаз, является центральным в современной физиологии.
С учётом всего вышесказанного можно утверждать, что эндоканнабиноидная система имеет чрезвычайно важное значение для общего здоровья. Она выступает невидимым регулятором, который обеспечивает адаптивность, стабильность и восстановление после стресса, травм или инфекций. И хотя сегодня мы лишь начинаем по-настоящему осознавать её роль, уже сейчас можно говорить о большом потенциале её использования в терапии.
Например, в нейропсихиатрии рассматривается возможность модуляции ЭКС для лечения депрессии, тревожных расстройств, ПТСР. В онкологии — для обезболивания и улучшения качества жизни пациентов. В неврологии — для уменьшения судорог при эпилепсии. И что интересно, некоторые страны уже официально разрешают медицинское применение каннабиноидов при соответствующих клинических показаниях.
Однако необходимо понимать, что активное вмешательство в эндоканнабиноидную систему — это сфера, требующая точного дозирования, контроля и глубокого понимания. Бессистемное или чрезмерное применение фитоканнабиноидов может привести к нежелательным эффектам, включая нарушения когнитивной функции, зависимость или эндогенный дисбаланс.
История открытия эндоканнабиноидной системы
Первые открытия каннабиноидов
История открытия каннабиноидов начинается задолго до понимания их действия на организм. В течение тысячелетий растение Cannabis sativa использовалось в медицинских и ритуальных целях в Китае, Индии, на Ближнем Востоке. Однако лишь в XIX веке начались первые попытки выделить активные компоненты каннабиса химическими методами. Несмотря на это, настоящий прорыв произошёл в XX веке, когда появились технологии хроматографии и спектроскопии, позволившие точно определить химическую структуру веществ, присутствующих в растении.
Первым, кто успешно занимался изоляцией активного компонента каннабиса, был британский химик Роберт Чейз в 1940-х годах, но именно израильский учёный Рафаэль Мешулам вместе со своей командой совершил ключевое открытие в 1960-х. В 1963 году они впервые описали структуру каннабидиола (CBD), одного из основных непсихоактивных компонентов каннабиса. CBD не вызывает изменений сознания, но обладает выраженными противовоспалительными, нейропротекторными и анксиолитическими свойствами.
В 1964 году Мешулам впервые идентифицировал и полностью охарактеризовал тетрагидроканнабинол (THC) — психоактивное вещество, которое отвечает за большинство эффектов, обычно связанных с употреблением марихуаны. Это открытие стало историческим, поскольку дало первое научное объяснение психоактивным свойствам каннабиса. THC был признан главным экзогенным каннабиноидом, то есть внешним соединением, влияющим на биохимию организма.
Особое внимание исследователи обратили на то, что THC действует очень специфично, словно взаимодействует с определённой молекулярной «мишенью» в организме. Но на тот момент сама «мишень» — рецептор, к которому присоединялся THC — оставалась неизвестной. Это вызвало волну дальнейших исследований, ведь если существует такой эффект, то в организме должны быть специфические структуры, способные реагировать на каннабиноиды.
Отдельно стоит отметить, что исследования каннабиноидов велись в условиях регуляторных ограничений. После 1970-х годов каннабис был запрещён во многих странах, что существенно ограничило научные эксперименты. Несмотря на это, учёные из нескольких стран продолжали поиски механизмов действия этих веществ на организм. Тогда стало понятно, что THC — не единственное активное вещество, и что каннабис содержит более 100 различных каннабиноидов, каждый из которых имеет уникальный фармакологический профиль.
Открытие рецепторов CB1 и CB2
Ключевой этап в изучении механизмов действия каннабиноидов был достигнут только тогда, когда исследователи обнаружили, с чем именно эти вещества взаимодействуют в клетках. До 1980-х годов существовало предположение, что THC должен связываться с какими-то специфическими рецепторами, однако их существование оставалось гипотезой. Прорыв произошёл в 1988 году, когда учёные из Университета Сент-Луиса, США, использовали радиоактивно меченый THC для исследования его связывания в головном мозге крыс. Они выявили наличие высокоспецифичных участков связывания — это свидетельствовало о существовании нового типа рецепторов.
В 1990 году исследовательская группа под руководством Лизы Матсуды из Национального института психического здоровья США клонировала первый каннабиноидный рецептор — CB1. Этот рецептор оказался широко распространён в головном мозге, особенно в таких областях, как гиппокамп (память), мозжечок (координация) и базальные ганглии (двигательная активность). Именно CB1 оказался основной мишенью для психоактивного действия THC. Он принадлежит к большой группе рецепторов, известных как G-белок-связанные рецепторы — это тип мембранных структур, активирующих внутриклеточные сигналы после взаимодействия с лигандом.
Второй тип рецептора — CB2 — был открыт в 1993 году. Его экспрессия была выявлена преимущественно в клетках иммунной системы, селезёнке, миндалинах и других периферических тканях. Хотя CB2 не участвует в психоактивных эффектах, он играет критическую роль в регуляции воспаления, иммунного ответа и клеточного гомеостаза. В отличие от CB1, этот рецептор почти не встречается в головном мозге, хотя некоторые исследования доказали его присутствие в микроглии — клетках, отвечающих за иммунную защиту нервной ткани.
Когда была открыта эндоканнабиноидная система
Понятие эндоканнабиноидной системы возникло не одномоментно. Его формирование стало результатом поэтапных открытий: идентификации экзогенных каннабиноидов, открытия соответствующих рецепторов CB1 и CB2, а также изоляции эндогенных соединений, которые эти рецепторы активируют. Если конкретно говорить о том, когда была открыта эндоканнабиноидная система, то ключевой датой считается 1992 год. Именно тогда группа Рафаэля Мешулама обнаружила и описала первый природный лиганд к CB1-рецептору — анандамид (N-арахидоноилэтаноламид). Эта молекула оказалась чрезвычайно похожей на THC по фармакологическим свойствам, но вырабатывается самой нервной тканью.
Второе эндоканнабиноидное соединение — 2-арахидонилглицерол (2-AG) — было обнаружено в 1995 году. Обе вещества способны активировать как CB1, так и CB2, но в разных концентрациях и контекстах. С этим открытием стало очевидно, что организм имеет собственную внутреннюю каннабиноидную систему, которая работает независимо от употребления растительных препаратов. Так сформировалось понятие «эндоканнабиноидная система» как интегрированной регуляторной сети.
Чтобы понять, что такое эндоканнабиноидная система и какова её роль, нужно выйти за пределы химических формул. Это система обратной регуляции: она активируется только тогда, когда происходит физиологическая нагрузка, стресс или нарушение гомеостаза. Её действие кратковременно и локализовано — анандамид и 2-AG быстро синтезируются «на месте» и так же быстро разрушаются, не накапливаясь в запасе. Этот механизм позволяет организму адаптироваться к условиям, корректировать возбуждение нейронов, модулировать боль, аппетит, сон и даже эмоциональные реакции.
Система также взаимодействует с другими сигнальными системами — дофаминовой, серотониновой, глутаматной, что подтверждает её центральное место в нейрофизиологии. Кроме того, рецепторы CB1 и CB2 обнаружены почти во всех тканях тела, что позволяет эндоканнабиноидной системе координировать реакции как на уровне клетки, так и организма в целом.
Строение и составляющие эндоканнабиноидной системы
Эндоканнабиноидная система — это сложная сигнальная сеть, которая выполняет регуляторные функции во многих физиологических процессах организма. Она действует на клеточном уровне и отвечает за поддержание гомеостаза — то есть внутреннего равновесия между возбуждением и торможением, между активностью и восстановлением. Уникальность этой системы заключается в том, что она активируется только тогда, когда организм выходит из состояния равновесия, реагируя на физические, химические или эмоциональные раздражители. Строение эндоканнабиноидной системы охватывает три основные группы элементов: рецепторы, эндогенные каннабиноиды (эндоканнабиноиды) и ферменты, отвечающие за синтез и разрушение этих молекул.
В центре этой системы находятся два главных рецептора — CB1 и CB2. Они расположены на поверхности клеток и являются белками, которые активируют внутриклеточные сигнальные каскады после взаимодействия с соответствующими лигандами. CB1-рецепторы наиболее активно экспрессируются в центральной нервной системе, в частности в областях, отвечающих за память, координацию, эмоции и болевое восприятие. В то время как CB2-рецепторы преимущественно локализуются в клетках иммунной системы, где они регулируют воспалительные реакции, фагоцитоз и выделение цитокинов. Существуют также менее изученные рецепторы, которые могут участвовать в действии эндоканнабиноидов, например, GPR55 или TRPV1, однако CB1 и CB2 остаются основными мишенями.
Следующей ключевой составляющей являются сами эндоканнабиноиды — сигнальные молекулы, которые вырабатываются клетками организма по потребности. Наиболее изученными из них являются анандамид (AEA) и 2-арахидонилглицерол (2-AG). Обе эти вещества синтезируются из липидных прекурсоров в клеточных мембранах и действуют кратковременно, активируя рецепторы в непосредственной близости от места синтеза. Анандамид, который получил название от санскритского слова «ананда» (блаженство), связан с регуляцией настроения, тревожности, аппетита и сна. 2-AG выполняет похожие функции, однако имеет более высокую концентрацию в мозге и более мощный эффект на CB2-рецепторы.
Не менее важны ферменты, которые контролируют уровень эндоканнабиноидов в тканях. Они отвечают за быстрое разрушение сигналов, как только достигнут нужный эффект. Основным ферментом деградации анандамида является FAAH (жирнокислотная амидгидролаза), а для 2-AG — MAGL (моноацилглицероллипаза). Эти ферменты регулируют длительность и интенсивность сигнала, гарантируя, что эндоканнабиноидная активность останется контролируемой и локализованной.
Общая архитектура эндоканнабиноидной системы обеспечивает ей уникальные возможности. В отличие от большинства нейротрансмиттерных систем, эта система работает по принципу обратной передачи сигнала: эндоканнабиноиды синтезируются в постсинаптической клетке и действуют на пресинаптические рецепторы, подавляя выделение нейромедиаторов. Такой механизм позволяет быстро и эффективно регулировать избыточную активность нейронов, что особенно важно в условиях стресса, боли или патологического возбуждения.
Кроме центральной нервной системы, эндоканнабиноидная система охватывает многочисленные периферические органы: желудочно-кишечный тракт, печень, сердце, кожу, половую систему, иммунные органы. Она участвует во многих физиологических процессах: метаболизме глюкозы, липидов, регуляции аппетита, энергетического баланса, иммунного ответа, боли, воспаления, репродукции. Благодаря своей универсальности и способности к адаптивной регуляции, эта система рассматривается как потенциальная мишень для терапии широкого спектра заболеваний — от эпилепсии и депрессии до аутоиммунных нарушений и онкологии.
Описание строения эндоканнабиноидной системы невозможно без учёта её высокой интеграции с другими сигнальными сетями. Эндоканнабиноидные рецепторы непосредственно или опосредованно взаимодействуют с дофаминовой, серотониновой, опиоидной системами. Это объясняет их роль в модуляции удовольствия, боли, тревоги, мотивации и сна. Сама система функционирует как тонкий биологический модератор, который поддерживает нейрохимическое равновесие без чрезмерного вмешательства — до тех пор, пока не наступает физиологическая потребность.
Основные элементы: рецепторы, эндоканнабиноиды, ферменты
Эндоканнабиноидная система состоит из трёх ключевых структурных компонентов: рецепторов CB1 и CB2, эндоканнабиноидных лигандов (анандамида и 2-AG) и ферментов, регулирующих их биосинтез и деградацию. Эти элементы взаимодействуют в реальном времени, обеспечивая динамическую модификацию нейрональной и иммунной активности в зависимости от физиологического контекста. Хотя они функционируют как единое целое, каждый из них обладает уникальными молекулярными свойствами, механизмами действия и функциональными особенностями.
Рецепторы CB1 являются мембранными G-белок-зависимыми рецепторами, кодируемыми геном CNR1, расположенным на хромосоме 6 (6q14-q15 у человека). Их молекулярная масса составляет примерно 53 кДа, и они имеют семь трансмембранных доменов. Высокая концентрация CB1 обнаруживается в неокортексе, гиппокампе, базальных ганглиях, мозжечке и других структурах центральной нервной системы. На клеточном уровне они локализуются преимущественно на пресинаптических терминалях, где регулируют высвобождение нейромедиаторов, в том числе глутамата, ГАМК, дофамина и ацетилхолина. Активация CB1 ингибирует аденилатциклазу, снижает активность кальциевых каналов, стимулирует открытие калиевых каналов, что приводит к гиперполяризации мембраны и подавлению нейротрансмиттерного высвобождения.
Рецепторы CB2, кодируемые геном CNR2 (расположенным на хромосоме 1p36), имеют схожий общий план строения с CB1, но существенно отличаются по паттернам экспрессии. Они присутствуют в иммунных клетках (макрофагах, Т-лимфоцитах, нейтрофилах, дендритных клетках), селезёнке, костном мозге и в меньшем количестве в ЦНС, преимущественно в микроглии. Стимуляция CB2 не влияет напрямую на нейромедиаторную передачу, однако модулирует высвобождение цитокинов, хемотаксис и клеточную пролиферацию. Их активационная среда связана преимущественно с иммунным ответом, воспалением и модуляцией тканевого повреждения.
На уровне эндогенных лигандов главную роль играют анандамид (AEA) и 2-арахидоноилглицерол (2-AG). Оба относятся к классу жирнокислотных производных, но отличаются химической структурой, путями синтеза и фармакологическим профилем. Анандамид синтезируется из N-арахидоноилфосфатидилэтаноламина (NAPE) при участии NAPE-фосфолипазы D. Его биологическая активность ограничена коротким периодом полужизни, который длится всего несколько секунд из-за быстрого ферментативного разрушения. Анандамид является частичным агонистом CB1 и имеет низкое сродство к CB2, однако также способен взаимодействовать с рецепторами TRPV1, отвечающими за температурную чувствительность и ноцицепцию.
2-AG образуется из диацилглицеролов (DAG) в результате действия DAG-липазы α/β. В отличие от анандамида, он является полным агонистом как CB1, так и CB2-рецепторов, демонстрируя более широкий спектр эффектов. Его концентрация в мозге превышает уровень AEA в 100-1000 раз, что подчёркивает его доминирующую роль в тонкой модуляции синаптической передачи. Кроме того, 2-AG участвует в регуляции сосудистого тонуса, нейровоспаления, а также влияет на клеточную адгезию через интегрины и другие молекулы адгезии.
Ферментативная система контролирует уровни эндоканнабиноидов в тканях, определяя их биодоступность и продолжительность действия. Основным ферментом деградации анандамида является жирнокислотная амидгидролаза (FAAH) — сериновая гидролаза, локализованная в цитоплазме. Она расщепляет AEA до арахидоновой кислоты и этаноламина. Мутации в гене FAAH могут быть связаны с повышенным болевым порогом, сниженной тревожностью и уменьшенной интенсивностью негативного аффективного реагирования. На основе её ингибиторов создаются фармакологические препараты с потенциальным анальгетическим, анксиолитическим и антидепрессивным действием.
Для 2-AG основным катаболическим ферментом является моноацилглицероллипаза (MAGL), которая гидролизует 2-AG до глицерола и арахидоновой кислоты. MAGL экспрессируется как в нейронах, так и в астроцитах и обладает высокой активностью в сером веществе мозга. При её подавлении повышается концентрация 2-AG, что может иметь анальгетический эффект, но также вызывать развитие толерантности и десенситизацию рецепторов CB1. Кроме MAGL, в метаболизме 2-AG участвуют ферменты ABHD6 и ABHD12, играющие вспомогательную, но важную роль в тканях с низкой активностью MAGL.
Следует также упомянуть ряд регуляторных белков, которые не участвуют непосредственно в гидролизе или синтезе эндоканнабиноидов, но влияют на их транспорт и локализацию. Один из них — FABP (fatty acid-binding proteins), который участвует в транспортировке анандамида к FAAH в клетке. Подавление этого белка может привести к снижению деградации AEA без влияния на FAAH как фермент, что является перспективным направлением фармакологической модуляции.
Особенностью структуры эндоканнабиноидной системы является то, что её элементы не сохраняются в стабильном активном состоянии. Синтез эндоканнабиноидов запускается «по требованию» (on demand), а рецепторы могут быстро десенсибилизироваться или подвергаться внутренней интернализации при чрезмерной стимуляции. Это придаёт системе высокую пластичность, отличающую её от большинства классических нейротрансмиттерных или гормональных систем. Всё это делает её чрезвычайно чувствительной к изменениям внутренней и внешней среды, обеспечивая эффективный и быстрый ответ в условиях колебаний физиологического баланса.
Типы рецепторов и их локализация в теле
В структуре эндоканнабиноидной регуляции рецепторы типа CB1 и CB2 играют центральную роль как основные точки связи между сигнальными молекулами и клеточными ответами. Хотя они разделяют общие механизмы активации через G-белок-зависимые каскады, их распределение в организме человека демонстрирует чёткую функциональную специализацию. CB1-рецепторы доминируют в центральной и периферической нервной системе, тогда как CB2 сосредоточены в иммунных и гемопоэтических структурах. Такой распределение обеспечивает точечную модификацию физиологических процессов, включая ноцицепцию, моторную координацию, эмоциональную реактивность, воспалительные механизмы, энергетический метаболизм и другие аспекты гомеостатического контроля.
CB1-рецепторы обнаруживаются с чрезвычайно высокой плотностью в головном мозге, в частности в зонах, ответственных за когнитивную интеграцию, память, мотивацию и контроль движений. Наибольшая концентрация зафиксирована в гиппокампе (регуляция кратковременной памяти), базальных ганглиях (двигательная активность), неокортексе (высшие когнитивные функции) и мозжечке (координация движений и равновесие). В гипоталамусе CB1 модулируют аппетит и энергетический обмен, а в миндалевидном теле участвуют в регуляции эмоциональной реактивности, в частности тревоги и страха. В стволовых ядрах мозга активация этих рецепторов влияет на болевую чувствительность, терморегуляцию и автономную функцию.
В спинном мозге CB1 локализуются в дорзальных рогах, где они подавляют передачу болевых сигналов от периферии к ЦНС. Их активация в этих зонах снижает высвобождение глутамата и субстанции Р, ослабляя интенсивность ноцицептивного ответа. На уровне сетчатки глаза CB1-рецепторы модулируют электрофизиологическую активность ганглиозных клеток, влияя на адаптацию к свету.
Вне нервной системы CB1 присутствуют в периферических нейронах автономной нервной системы, в частности в вагусе, симпатических ганглиях и энтеральных нейронах. Их активация приводит к изменению моторики кишечника, секреции ферментов и кровотоку во внутренних органах. В жировой ткани эти рецепторы участвуют в регуляции липогенеза, в печени — в глюконеогенезе, а в поджелудочной железе — в секреции инсулина.
CB2-рецепторы сосредоточены преимущественно в иммунных клетках как в периферической крови, так и в тканях. Наибольшая экспрессия обнаружена в В- и Т-лимфоцитах, макрофагах, нейтрофилах, дендритных клетках и микроглии. В селезёнке, миндалинах, костном мозге и лимфатических узлах CB2 выполняют роль ингибиторов воспалительного ответа: уменьшают продукцию провоспалительных цитокинов, подавляют пролиферацию активированных иммунных клеток и снижают хемотаксис. В микроглии мозга активация CB2 подавляет нейровоспаление, снижая выработку IL-1β, TNF-α и NO. В астроцитах их действие проявляется через контроль локального гомеостаза и защиту нейронов от токсического воздействия воспалительных медиаторов.
CB2 также экспрессируются в тканях периферических органов: в кишечном эпителии, коже, лёгких и костях. В желудочно-кишечном тракте они контролируют баланс между толерантностью к микробиоте и иммунным ответом. В коже рецепторы CB2 вовлечены в процессы заживления, регенерации и торможения патологической пролиферации клеток, в частности при псориазе или дерматитах. В костной ткани CB2 активируются в остеобластах и остеокластах, модулируя баланс между костеобразованием и резорбцией. В лёгких они проявляют себя при воспалительных поражениях и астматических реакциях.
Отдельную категорию составляют нестандартные каннабиноидные рецепторы, которые не относятся к CB1 или CB2, но реагируют на эндоканнабиноиды или каннабиноидные агонисты. К ним относятся GPR55, GPR18, TRPV1 и PPARs. Рецептор GPR55 экспрессируется в костных клетках, надпочечниках и в некоторых участках мозга, в частности в стволе. Его активация стимулирует кальциевую сигнализацию, пролиферацию клеток и может быть связана с болью и воспалением. TRPV1 (ваниноидный рецептор), на который также действует анандамид, локализуется в сенсорных нейронах и участвует в терморегуляции и восприятии боли. PPAR-α и PPAR-γ, ядерные рецепторы, активируются метаболитами эндоканнабиноидов и регулируют экспрессию генов, связанных с метаболизмом липидов и воспалением.
В сердечно-сосудистой системе CB1 и CB2 выполняют противоположные функции. CB1 способствуют вазодилатации через ингибирование высвобождения норадреналина из симпатических нейронов, снижая артериальное давление. CB2, в свою очередь, защищают эндотелий от окислительного стресса и уменьшают адгезию моноцитов к сосудистой стенке. В миокарде оба типа рецепторов влияют на метаболизм, апоптоз и ишемическую резистентность.
В репродуктивной системе CB1 обнаруживаются в гипоталамо-гипофизарно-гонадной оси, регулируя секрецию гонадотропинов, овуляцию и сперматогенез. CB2 экспрессируются в тестикулярных клетках Лейдига, где модулируют синтез тестостерона. В женской половой системе они локализуются в эндометрии, плаценте и фолликулах яичников, регулируя имплантацию эмбриона и поддержку беременности.
Экспрессия обоих типов рецепторов варьирует в зависимости от возраста, пола, гормонального состояния, патологий и даже циркадного ритма. Их активность модулируется не только эндогенными лигандами, но и многочисленными внешними факторами — диетой, стрессом, физическими нагрузками, воздействием лекарств и токсинов. Установлено, что некоторые заболевания сопровождаются изменением экспрессии CB1 или CB2: например, при ожирении наблюдается гиперэкспрессия CB1 в гипоталамусе, а при аутоиммунных заболеваниях — повышение активности CB2 в иммунных клетках.
Через какие рецепторы каннабис взаимодействует с эндоканнабиноидной системой нашего организма?
Механизм действия каннабиса на человеческий организм определяется его способностью непосредственно или опосредованно взаимодействовать с рецепторами эндоканнабиноидной системы. Основную роль в этом процессе играют каннабиноидные рецепторы CB1 и CB2, однако влияние каннабиноидов не ограничивается только этими двумя структурами. Биологически активные компоненты каннабиса, в частности Δ9-тетрагидроканнабинол (ТГК) и каннабидиол (КБД), имеют разную аффинность к ряду молекулярных мишеней, что обеспечивает широкий спектр их фармакологической активности.
Основной психоактивный компонент каннабиса — ТГК — выступает мощным частичным агонистом CB1-рецепторов. Его высокая аффинность к этим рецепторам, локализованным преимущественно в головном мозге, объясняет характерный психотропный эффект. Присоединяясь к CB1, ТГК инициирует каскад внутриклеточной сигнализации, который подавляет высвобождение нейромедиаторов, в частности глутамата, ГАМК, ацетилхолина, дофамина и норадреналина. Это обусловливает изменения в когнитивном восприятии, нарушение кратковременной памяти, повышенную эмоциональную лабильность, изменения моторной активности и изменённую сенсорную обработку.
В то же время ТГК активирует CB2-рецепторы, хотя с меньшей эффективностью. Это взаимодействие влияет на иммунный ответ, снижая синтез провоспалительных цитокинов и модулируя пролиферацию иммунных клеток. В клинических условиях это проявляется как потенциальный противовоспалительный и иммунорегуляторный эффект, особенно в контексте аутоиммунных или воспалительных заболеваний.
Каннабидиол (КБД), хотя и не обладает высокой аффинностью к CB1 и CB2, модулирует их активность опосредованно. В частности, КБД действует как негативный аллостерический модулятор CB1, снижая эффективность связывания ТГК с этим рецептором. Это объясняет, почему продукты с высоким содержанием КБД могут уменьшать психоактивное воздействие ТГК. Кроме того, КБД повышает эндогенную концентрацию ананамида, ингибируя его расщепление ферментом FAAH, тем самым усиливая тонус эндоканнабиноидной системы через эндогенные механизмы.
Помимо классических каннабиноидных рецепторов, активные вещества каннабиса также взаимодействуют с альтернативными мишенями. Одной из них является GPR55 — сиротливый рецептор, часто называемый «третьим каннабиноидным рецептором». ТГК и некоторые другие фитоканнабиноиды могут активировать GPR55, что вызывает противоположные эффекты по сравнению с CB1/CB2, в частности стимуляцию клеточной пролиферации или усиление боли. Его значение особенно заметно в контексте онкологии, так как он обнаруживается в некоторых опухолевых клетках и потенциально модулирует агрессивность опухолей.
TRPV1 (ванилоидный рецептор типа 1) — ещё одна мишень, с которой взаимодействует КБД. Этот ионный канал активируется температурой, кислотами и другими раздражителями, участвуя в формировании болевой чувствительности. КБД выступает как агонист TRPV1, что объясняет его потенциальный анальгетический и противовоспалительный эффект. В некоторых случаях длительная активация TRPV1 КБД приводит к десенситизации рецептора, что может уменьшить гиперчувствительность при хронической боли.
Кроме того, КБД модулирует сигнальные пути через ядерные рецепторы — в частности PPAR-γ. Этот транскрипционный фактор играет ключевую роль в регуляции метаболизма глюкозы, жировой ткани и воспаления. Активация PPAR-γ КБД имеет перспективы при лечении метаболического синдрома, диабета 2 типа и некоторых форм нейродегенерации.
В центральной нервной системе влияние каннабиса через CB1-рецепторы проявляется в различных областях. В гиппокампе подавляется синаптическая пластичность, что влияет на запоминание. В базальных ганглиях модулируется моторная функция, а в мезолимбическом дофаминергическом пути изменяется мотивационное поведение. Установлено, что чрезмерная активация CB1 в этой системе способствует изменению реакции на вознаграждение, что частично объясняет аддиктивный потенциал каннабиса.
На периферии взаимодействие ТГК с CB1 в энтеральной нервной системе подавляет моторику желудочно-кишечного тракта, что клинически проявляется снижением перистальтики и аппетита. Через CB2 на иммунных клетках каннабис может уменьшать секрецию ИЛ-6, ИЛ-1β, TNF-α и других ключевых медиаторов воспаления, что объясняет его эффективность при хронических воспалительных заболеваниях, таких как болезнь Крона, ревматоидный артрит или рассеянный склероз.
В дерматологии взаимодействие каннабиноидов с CB1 и CB2 в коже регулирует пролиферацию кератиноцитов, секрецию себума и активацию местных иммунных клеток. Это открывает терапевтические перспективы для лечения акне, псориаза и атопического дерматита.
Стоит отметить, что каннабиноиды могут взаимодействовать не только с рецепторами эндоканнабиноидной системы, но и изменять активность транспортных белков, которые регулируют поступление эндоканнабиноидов в клетки. Например, КБД может блокировать FABP — белки, переносящие ананамид к FAAH для деградации, тем самым косвенно повышая уровень ананамида в тканях.
Фармакологический профиль каждого каннабиноида зависит не только от его аффинности к рецепторам, но и от метаболических преобразований. Например, 11-гидрокси-ТГК — активный метаболит ТГК, образующийся в печени после перорального употребления, имеет ещё более высокую аффинность к CB1, поэтому психоактивные эффекты продуктов с каннабисом обычно сильнее и продолжительнее, чем при ингаляции.
Физиологические функции эндоканнабиноидной системы
Эндоканнабиноидная система (ЭКС) — это универсальная сигнальная сеть, выполняющая ряд регуляторных функций в теле человека. Её присутствие зафиксировано практически во всех органах и тканях, от головного мозга до периферических клеток иммунной системы, а её физиологическая активность критически важна для поддержания динамического равновесия в организме. Роль ЭКС заключается не в инициировании каких-то процессов, а в регуляции уже активных механизмов на клеточном уровне, что позволяет организму быстро реагировать на изменения окружающей среды, инфекции, повреждения или стрессовые факторы.
Основу регуляторного действия системы составляет её способность интегрировать сигналы между различными функциональными осями: нервной, эндокринной, иммунной, метаболической. Благодаря этому она участвует в контроле над широким спектром процессов: болью, воспалением, энергетическим балансом, настроением, аппетитом, терморегуляцией, моторикой, сном и памятью. Например, в состоянии воспаления эндоканнабиноидная система локально повышает выработку эндогенных каннабиноидов, которые, активируя CB2-рецепторы на иммунных клетках, снижают продукцию провоспалительных цитокинов. Аналогично, при острой боли или травме усиливается высвобождение ананамида в синапсах спинного мозга и мозговых структурах, что уменьшает проведение болевого импульса.
Отдельно стоит обратить внимание на участие системы в краткосрочных и долгосрочных нейрональных изменениях. CB1-рецепторы, присутствующие в зонах мозга, ответственных за обучение и память, играют роль в формировании долгосрочного потенцирования (LTP) или подавления (LTD), тем самым регулируя нейропластичность. Это имеет большое значение как для нормального когнитивного функционирования, так и для процессов адаптации к стрессу, новым ситуациям или изменению окружения.
В центральной нервной системе ЭКС действует как «фильтр сигналов» — она не подавляет всю нейрональную активность, а тонко настраивает интенсивность возбуждения. Это позволяет снизить нейрональный «шум» и поддерживать баланс между возбуждением и торможением. На практике это проявляется в способности организма лучше переносить сенсорные перегрузки, тревожные состояния или эмоциональные возбуждения.
На метаболическом уровне эндоканнабиноидная система координирует процессы хранения и расхода энергии. CB1-рецепторы, которые экспрессируются в гипоталамусе, контролируют сигнал голода и насыщения, а также регулируют чувствительность к инсулину через периферические механизмы. При избыточной активации системы может возникать энергетический дисбаланс, способствующий развитию ожирения, инсулинорезистентности и метаболического синдрома. С другой стороны, при гипофункции этой системы возникают противоположные проблемы — гипометаболизм, сниженный аппетит, кахексия.
В иммунной системе ЭКС функционирует как фактор контроля над воспалительным ответом. CB2-рецепторы активно экспрессируются на макрофагах, Т-клетках, микроглии, где они модулируют их активацию и цитокиновый профиль. Это обеспечивает механизм «отката» после острой воспалительной реакции, чтобы избежать хронического повреждения тканей. Дисфункция этих механизмов может способствовать развитию аутоиммунных заболеваний или персистирующего воспаления.
Важной характеристикой этой системы является её «потребностная» активность — активность эндоканнабиноидов не поддерживается постоянно, а возникает по необходимости, в конкретной локальной среде. Это отличает её от большинства классических нейротрансмиттерных или гормональных систем, в которых существует фоновый уровень активности. Такое регулирование позволяет точечную и временно ограниченную активацию, что снижает риск побочных эффектов и чрезмерной реакции.
В рамках физиологии стресса эндоканнабиноидная система выступает как буферная структура, которая подавляет гиперактивацию оси «гипоталамус-гипофиз-надпочечники». В экспериментальных моделях подавление CB1-рецепторов повышает уровни кортизола и тревожности, в то время как их активация уменьшает реакцию на стрессовые стимулы. Таким образом, ЭКС не только реагирует на стресс, но и формирует эмоциональную стабильность и адаптивность организма.
Среди многочисленных физиологических процессов, в которых участвует эта сигнальная сеть, особое место занимает её роль в развитии — как пренатальном, так и постнатальном. Рецепторы CB1 участвуют в формировании нейрональных сетей, миграции клеток в эмбриональном мозге, синаптогенезе, а также созревании глиальных клеток. Это делает эндоканнабиноидную систему критически важной в раннем онтогенезе, а её дисфункция — возможной причиной нейропсихиатрических расстройств.
Регуляция боли, настроения, аппетита
Эндоканнабиноидная система выступает критически важным внутренним звеном, обеспечивающим гибкую регуляцию ключевых сенсорных и аффективных процессов: ноцицепции (ощущения боли), аффективного поведения (настроения) и метаболической мотивации (аппетита). Эти процессы взаимосвязаны как с точки зрения нейрональной архитектуры, так и через общие молекулярные пути, и эндоканнабиноидная система координирует их работу через локализованную и контекстно-зависимую модуляцию синаптической передачи.
В случае боли эндоканнабиноидная система участвует на всех уровнях её обработки — от периферических ноцицепторов до высших интегративных центров в коре головного мозга. CB1-рецепторы в дорсальных корешках спинного мозга уменьшают выделение возбуждающих нейротрансмиттеров (в частности, глутамата и субстанции Р) в ответ на периферическое раздражение. Это снижает интенсивность передачи болевого сигнала ещё до того, как он достигнет высших структур. Одновременно в таламусе и миндалевидном теле каннабиноидная активация подавляет формирование эмоционального окраса боли, а во лобных структурах коры влияет на когнитивную оценку ситуации.
В экспериментальных условиях установлено, что повышение концентрации эндоканнабиноидов, в частности ананамида, сопровождается снижением чувствительности к механической и термической ноцицепции. Это подтверждается как фармакологическими методами, так и генетическими моделями, где нокаут ферментов, расщепляющих эндоканнабиноиды (например, FAAH), приводит к анальгезии. В клинических исследованиях подобные эффекты наблюдались у пациентов с фибромиалгией, мигренью, синдромом раздражённого кишечника, где традиционная анальгетическая терапия была неэффективной, а модуляция эндоканнабиноидной активности приводила к улучшению состояния.
Что касается регуляции настроения, эндоканнабиноидная система выступает интегративным механизмом между системами дофамина, серотонина, норадреналина и ГАМК. CB1-рецепторы в мезолимбическом дофаминовом пути (особенно в вентральной тегментальной области и nucleus accumbens) регулируют эндогенную дофаминовую активность, которая критически влияет на эмоциональную мотивацию и ощущение удовольствия. При низком уровне эндоканнабиноидной активности нарушается способность испытывать позитивные эмоции (ангедония), а также возрастает восприимчивость к стрессу.
В дорсальном рафе ядра серотонинергической системы CB1-рецепторы модулируют высвобождение серотонина, при этом в зависимости от условий могут как усиливать, так и подавлять эту активность. Это объясняет, почему эндоканнабиноидная система влияет на оба полюса аффективных нарушений — как депрессивные состояния, так и тревожные расстройства. По данным нейровизуализационных исследований, у пациентов с депрессией наблюдается сниженная экспрессия CB1-рецепторов в префронтальной коре, гиппокампе и скоплении базальных ганглиев, что сопровождается уменьшением тонической эндоканнабиноидной активности.
Повышение ананамида или 2-AG у таких пациентов приводит к нормализации нейропластичности, снижению воспаления в центральной нервной системе и восстановлению регуляции стрессового ответа. Такие эффекты достигаются либо прямым воздействием на CB1-рецепторы, либо путем ингибирования ферментов расщепления эндоканнабиноидов. При тревожных расстройствах, наоборот, гиперактивность определённых зон (в частности, миндалика) может контролироваться усилением локального эндоканнабиноидного тонуса.
Механизмы влияния на аппетит и пищевое поведение реализуются через гипоталамус — центральную интегративную зону, которая координирует энергетический баланс. CB1-рецепторы, расположенные в аркуатном ядре, регулируют активность нейронов, синтезирующих нейропептид Y (NPY) и агути-подобный пептид (AgRP) — ключевые модуляторы голода. Активация CB1-рецепторов стимулирует эти нейроны, вызывая ощущение голода даже при наличии достаточного энергетического обеспечения, что объясняет эффект «острого аппетита» после употребления каннабиноидов.
В противоположность этому, в условиях энергетического дефицита система также поддерживает желание пищи, усиливая ощущение удовольствия от еды через воздействие на дофаминергические пути. Это позволяет организму адаптироваться к ограниченным ресурсам и обеспечивать выживание. Однако при хроническом злоупотреблении жирной, сладкой или калорийной пищей чрезмерная стимуляция CB1-рецепторов способствует развитию ожирения и метаболического синдрома.
В периферических тканях, включая печень, поджелудочную железу, кишечник и жировую ткань, эндоканнабиноидная система также регулирует метаболические реакции: влияет на синтез инсулина, секрецию лептина, чувствительность к глюкозе и липолиз. При этом её чрезмерная активность ассоциируется с развитием инсулинорезистентности, а её подавление — с улучшением чувствительности к инсулину.
Эндоканнабиноидная система человека координирует тонкую регуляцию боли, настроения и аппетита через сложное взаимодействие центральных и периферических рецепторов, эндогенных лигандов и сигнальных путей. Её модуляция обеспечивает адаптивный ответ на изменение внутреннего состояния и внешней среды, а также участвует в коррекции патологических состояний, при которых эти процессы нарушены. Благодаря этим свойствам она является перспективной мишенью для фармакологических интервенций в клинической медицине.
Влияние на сон, иммунный ответ, терморегуляцию
Эндоканнабиноидная система участвует в регуляции многих ключевых физиологических процессов, среди которых контроль цикла сна, функционирование иммунной системы и поддержание стабильной температуры тела. Ее активность проявляется в контекстно-зависимой модуляции различных нейрональных, гормональных и иммунных цепей, что позволяет адаптировать организм к изменениям среды или внутренних физиологических состояний.
В регуляции сна основная роль принадлежит CB1-рецепторам, которые экспрессируются в гипоталамических структурах, таламусе, стволе мозга и коре. Их активация изменяет структуру сна, в частности, увеличивает продолжительность медленноволнового сна (SWS) и уменьшает фазы пробуждения. Исследования на животных моделях показали, что ингибиция ферментов FAAH или MAGL, которые расщепляют анандамид и 2-AG соответственно, ведет к увеличению концентрации этих эндоканнабиноидов и, как следствие, к удлинению общего времени сна. Механизм реализуется через торможение активности ареалов, ответственных за поддержание бодрствования, таких как locus coeruleus и ретикулярная формация, а также через опосредованное влияние на секрецию мелатонина в шишковидном теле.
Эксперименты с блокаторами CB1-рецепторов (например, римонабант) демонстрируют, что их деактивация приводит к фрагментации сна, частым пробуждениям и нарушению циркадного ритма. Эндоканнабиноидная система также регулирует фазу быстрого сна (REM): в состоянии дефицита ананамида наблюдается сокращение этой фазы, что ассоциируется с нарушением когнитивной консолидации памяти. В человеческих исследованиях выявлено, что концентрации ананамида в цереброспинальной жидкости изменяются в зависимости от времени суток, достигая пика перед засыпанием, что свидетельствует об участии системы в регуляции суточных колебаний в нейрональной активности.
Что касается иммунного ответа, влияние эндоканнабиноидной системы реализуется преимущественно через CB2-рецепторы, которые экспрессируются в лимфоцитах, макрофагах, дендритных клетках, микроглии и других иммунокомпетентных структурах. Активация этих рецепторов ведет к подавлению высвобождения провоспалительных цитокинов, таких как TNF-α, IL-1β, IL-6, одновременно усиливая секрецию противовоспалительных агентов, в частности IL-10. Это позволяет системе действовать как иммуномодулятор, обеспечивая снижение чрезмерной иммунной реакции, но не подавляя защитную функцию полностью.
В случае аутоиммунных расстройств — таких как рассеянный склероз, ревматоидный артрит, болезнь Крона — эндоканнабиноидная активность имеет терапевтический потенциал. В исследованиях in vivo зафиксировано уменьшение инфильтрации Т-клеток в ткани-мишени при усиленной активации CB2-рецепторов. Механизм действия заключается не только в снижении воспаления, но и в изменении фенотипа клеток с провоспалительного (M1-макрофаги) на регуляторный (M2-макрофаги), что способствует восстановлению поврежденных тканей. CB1-рецепторы, хотя и менее выражены в иммунной системе, также участвуют в модификации нейроиммунных взаимодействий через микроглию в ЦНС.
Во время инфекций эндоканнабиноидная система регулирует баланс между активной противобактериальной защитой и минимизацией повреждения собственных тканей. Например, при сепсисе активация CB2-рецепторов снижает летальность, уменьшая уровень системного воспаления, однако при чрезмерном подавлении иммунного ответа может повыситься риск персистенции возбудителя, что требует тонкой регуляции.
Что касается терморегуляции, эндоканнабиноидная система участвует в поддержании температурного гомеостаза через центральные структуры гипоталамуса. В зонах преоптической области переднего гипоталамуса CB1-рецепторы влияют на нейроны, контролирующие вегетативные реакции, такие как вазоконстрикция, потоотделение и мышечное дрожание. Активация этих рецепторов приводит к снижению температуры тела за счет уменьшения симпатической активности и усиления теплоотдачи.
Экспериментально подтверждено, что анандамид вызывает дозозависимое снижение температуры у животных при введении в мозговые желудочки, при этом этот эффект блокируется антагонистами CB1. В то же время при системном воздействии температурная реакция зависит от дозировки, внешних условий и начального физиологического состояния. В случаях гипотермии эндоканнабиноидная система способствует ограничению тепловых потерь, а при гипертермии — активирует охлаждающие механизмы. Это дает основания считать ее компонентом внутреннего «термостата», который обеспечивает быструю и динамическую реакцию на изменение температурного баланса.
Взаимодействие эндоканнабиноидной системы с другими нейромедиаторными осями, в частности серотониновой, гистаминовой и норадреналиновой, позволяет ей координировать терморегуляторные реакции не изолированно, а в рамках общего гомеостатического контекста. В клинической практике эти свойства потенциально применяются при лечении лихорадочных состояний, нарушений терморегуляции при нейродегенеративных заболеваниях и после черепно-мозговых травм.
Эндоканнабиноидная система и ее роль в контексте сна, иммунной реакции и терморегуляции — это не только структурная сеть рецепторов и лигандов, а полноценная интегративная система, которая координирует нейроэндокринные, иммунные и вегетативные реакции с высоким уровнем адаптивной точности.
Связь с другими системами организма: нервной, гормональной
Эндоканнабиноидная система тесно интегрирована с ведущими регуляторными системами организма — прежде всего нервной и эндокринной. Ее роль заключается не только в модуляции локальных физиологических процессов, но и в координации межсистемного взаимодействия, что обеспечивает адаптивные ответы на внутренние и внешние воздействия. Этот функциональный пересечение реализуется благодаря плотному расположению рецепторов CB1 в структурах центральной нервной системы и экспрессии CB1/CB2 в регуляторных узлах эндокринной оси.
В нервной системе эндоканнабиноидные сигналы выполняют функцию ретроградных нейромедиаторов. Они синтезируются «по требованию» в постсинаптических нейронах и действуют на пресинаптические CB1-рецепторы, временно снижая высвобождение нейромедиаторов — глутамата, ГАМК, ацетилхолина, норадреналина. Это создает кратковременные фазы ингибирования передачи, что позволяет нейронным сетям избегать гиперактивности или чрезмерного возбуждения. Наибольшая плотность CB1 наблюдается в гиппокампе, базальных ганглиях, миндалине, префронтальной коре и мозжечке — зонах, ответственных за память, эмоции, исполнительные функции, координацию движений.
Этот механизм играет ключевую роль в формировании нейропластичности, где эндоканнабиноидные медиаторы участвуют в длительной депрессии синаптической передачи (LTD), влияя на процессы обучения и формирование поведенческих паттернов. В зоне мезолимбического дофаминового пути система модуляции через CB1 регулирует высвобождение дофамина из вентральной тегментальной области в nucleus accumbens, что напрямую связано с мотивацией, наградой, привычками. Это объясняет, в частности, участие эндоканнабиноидной системы в механизмах зависимостей и расстройств аффективного спектра.
Со стороны гормональной системы взаимодействие наиболее явно проявляется в пределах гипоталамо-гипофизарно-надпочечниковой оси (HPA-оси). CB1-рецепторы присутствуют в паравентрикулярном ядре гипоталамуса, где они подавляют высвобождение кортикотропин-рилизинг-гормона (CRH), что в итоге снижает секрецию АКТГ из гипофиза и кортизола из надпочечников. Таким образом, эндоканнабиноидная система выступает естественным ограничителем стрессового ответа, предотвращая его чрезмерную активацию.
В состоянии хронического стресса снижается экспрессия CB1 в гипоталамических и гипофизарных структурах, что ведет к повышенному уровню циркулирующего кортизола. В экспериментальных условиях повышение уровня ананамида или блокада его деградации приводят к нормализации активации HPA-оси. Помимо глюкокортикоидной оси, эндоканнабиноиды регулируют функцию щитовидной железы, половых желез и поджелудочной железы, влияя на выделение Т3/Т4, тестостерона, инсулина и лептина.
Еще один важный вектор пересечения — это взаимодействие с центрами регуляции репродуктивной функции. CB1-рецепторы присутствуют в гипоталамусе и гипофизе, где они влияют на секрецию гонадотропин-рилизинг-гормона (GnRH), лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH). У женщин чрезмерная активация CB1 связана с нарушением овуляторного цикла, снижением секреции эстрогена, а у мужчин — с уменьшением сперматогенеза. Это подтверждает участие эндоканнабиноидной системы в сложной регуляции фертильности через гормональные механизмы.
Отдельно стоит отметить роль системы в периферических гормональных механизмах — особенно в жировой ткани. CB1-рецепторы влияют на адипогенез, экспрессию лептина, резистина, а также инсулиновую чувствительность. Высокая активность CB1 ассоциируется с развитием метаболического синдрома — ожирения, инсулинорезистентности, гипертензии. Фармакологическое блокирование CB1 улучшает гликемический контроль и способствует снижению массы тела, что было подтверждено рядом клинических исследований до прекращения применения римонабанта из-за психиатрических побочных эффектов.
Интегративная функция, которую выполняет эндоканнабиноидная система человека в пределах нервной и гормональной систем, обеспечивает сложную обратную координацию между аффективным состоянием, нейронной возбудимостью, эндокринным ответом и поведенческими паттернами. Это многоуровневое взаимодействие позволяет не только адаптироваться к кратковременному воздействию факторов окружающей среды, но и формировать длительные реакции, изменяющие нейроэндокринный гомеостаз в условиях стресса, болезни или метаболической нагрузки.
Дефицит эндоканнабиноидной системы
Слаженное функционирование эндоканнабиноидной системы является критически важным для поддержания физиологического равновесия, адаптации к стрессу и регуляции многочисленных внутренних процессов. Однако последние десятилетия научных исследований показали, что ее нарушения могут иметь системный характер, вызывая так называемый функциональный или клинический дефицит. Это понятие не сводится к простой отсутствию рецепторов или медиаторов, а охватывает широкий спектр дисфункций, влияющих на регуляторные контуры организма на нейрональном, эндокринном, иммунном и метаболическом уровнях.
Дефицит может проявляться в сниженной активности CB1 или CB2 рецепторов, уменьшении синтеза ключевых эндоканнабиноидов — ананамида (AEA) и 2-арахидоноилглицерола (2-AG), либо в чрезмерной активности ферментов, разрушающих их, прежде всего FAAH и MAGL. Нарушение баланса между продукцией и деградацией этих сигнальных молекул приводит к снижению способности системы адаптировать реакции организма на боль, воспаление, стресс, колебания настроения, нарушения сна и обмена веществ. Поскольку эндоканнабиноидная система охватывает как центральную, так и периферическую регуляцию, ее снижение вызывает одновременно психоэмоциональные и соматические симптомы.
Гипотетическая модель клинического дефицита была впервые сформулирована в 2001 году неврологом Этаном Руссо. Он предложил объединить ряд функциональных расстройств, не имеющих четкой этиологии, но демонстрирующих общие патофизиологические признаки — к ним относят мигрень, синдром раздраженного кишечника (СРК), фибромиалгию, хроническую усталость, некоторые формы тревожных и депрессивных расстройств. Последующие исследования подтвердили снижение уровней ананамида в ликворе пациентов с хронической болью и тревожностью, а также изменения в экспрессии CB1-рецепторов в структурах мозга у больных с депрессивными расстройствами.
Механизмы развития дефицита могут быть как первичными (генетическими), так и вторичными — то есть приобретенными в результате хронического стресса, нейровоспаления, инфекций, токсических поражений, длительного недосыпания или нарушений питания. Также значительную роль играют гормональные факторы, поскольку уровень эндоканнабиноидов изменяется в зависимости от циклических колебаний половых гормонов, кортизола, инсулина и лептина. У женщин, в частности, выявлены колебания тонуса эндоканнабиноидной системы в течение менструального цикла, что потенциально объясняет изменение порога боли, настроения и аппетита в разные фазы.
Патофизиологически дефицитная активность этой системы приводит к чрезмерному возбуждению нейрональных контуров, нестабильности гипоталамических регуляторов, ослаблению противовоспалительных механизмов, нарушению обработки болевых сигналов и синаптической адаптации. Это, в свою очередь, вызывает гиперреактивность центральной нервной системы, нарушения сна, снижение стрессовой толерантности, а также повышенную чувствительность к раздражителям. Системное снижение эндоканнабиноидного тонуса создает условия для хронического субклинического воспаления, что имеет значение в прогрессии метаболического синдрома, атеросклероза и нейродегенеративных заболеваний.
В структуре иммунного ответа дефицит проявляется в снижении модуляторного влияния CB2-рецепторов на макрофаги, микроглию и Т-клетки, что приводит к преобладанию провоспалительных цитокинов — ИЛ-1β, TNF-α, ИЛ-6. Это способствует развитию аутоиммунных и аллергических реакций, нестабильности иммунологического толеранса, особенно на фоне хронических раздражителей.
В контексте психиатрических состояний недостаточная работа эндоканнабиноидной системы коррелирует со снижением дофаминергической активности, нарушением выработки серотонина и подавлением адаптационной функции HPA-оси. Это способствует развитию депрессивной симптоматики, тревожности, эмоциональной лабильности и расстройств сна. При таких условиях мозг теряет способность адекватно обрабатывать как эмоциональные, так и сенсорные сигналы, что увеличивает субъективное ощущение дискомфорта и боли без реального физиологического источника.
Что такое клинический дефицит ЭКС
Клинический дефицит эндоканнабиноидной системы (ЭКС) — это концепция, описывающая нарушение внутренней регуляторной системы организма, которая обычно отвечает за поддержание физиологического равновесия. Ее суть заключается не только в количественном снижении активных соединений, но и в более сложных сбоях в сигнальных путях, охватывающих синтез, высвобождение, транспортировку, связывание и деградацию эндогенных каннабиноидов и связанных рецепторов. В результате таких изменений возникает состояние, когда система теряет способность должным образом регулировать ключевые функции — от передачи болевых сигналов до эмоционального гомеостаза.
В медицинском и нейробиологическом дискурсе понятие клинического дефицита ЭКС впервые было введено для объяснения симптомов заболеваний, которые не имели четкой этиологии, но демонстрировали общие признаки: хроническая боль, нарушения сна, гиперчувствительность к сенсорным раздражителям, пониженная толерантность к стрессу и нестабильный эмоциональный фон. Одним из первых примеров таких состояний стали мигрень, фибромиалгия, синдром раздраженного кишечника (СРК), а позднее и поствирусные синдромы, невропатии неизвестной природы, некоторые психические расстройства.
В клинической практике наблюдается, что часть пациентов с вышеуказанными диагнозами не отвечает на стандартные схемы лечения — анальгетики, противовоспалительные средства, антидепрессанты или анксиолитики. Это наводит на мысль, что первичная проблема может заключаться не в поражении конечных структур, а в системном разбалансировании модуляторного механизма, которым является ЭКС. Известно, что эндоканнабиноиды выполняют функцию ретроградных мессенджеров — они синтезируются «по требованию» в постсинаптических нейронах и обратно влияют на пресинаптическое высвобождение нейромедиаторов. Если этот обратный контроль нарушен, возникает избыточная активность или подавление нейрональных контуров, что приводит к симптомам, которые не укладываются в классические нозологии.
Механистически клинический дефицит ЭКС может быть обусловлен рядом биохимических отклонений. Например, при изучении ликвора у пациентов с хронической болью и посттравматическим стрессовым расстройством выявляют пониженные уровни ананамида. Другие данные свидетельствуют о измененной экспрессии CB1-рецепторов в префронтальной коре при депрессивных состояниях. Снижение плотности рецепторов CB1 в областях, отвечающих за регуляцию эмоций и реакцию на стресс, ведет к неадекватной обработке аффективной информации и нестабильному взаимодействию между мозговыми сетями. Дополнительно, увеличение активности фермента FAAH, разрушающего ананамид, связывали с тревожными расстройствами, особенно в экспериментах на моделях грызунов, где генетическое снижение активности FAAH способствовало уменьшению поведенческой тревоги.
Не менее важной составляющей является нарушение взаимодействия между ЭКС и другими системами — серотонинергической, дофаминергической, HPA-осью (гипоталамус-гипофиз-надпочечники), а также иммунной сетью. Поскольку каннабиноиды влияют на гомеостатические реакции, недостаточность регуляторного контроля с их стороны способствует хроническому воспалению низкой степени, что сегодня рассматривается как одна из ключевых движущих сил для широкого спектра болезней — от нейродегенеративных процессов до нарушений метаболизма.
Феномен клинического дефицита ЭКС не сводится лишь к острому или хроническому снижению эндоканнабиноидной активности. Это — динамическая дисфункция, изменяющаяся в зависимости от среды, возраста, гормонального статуса, воздействия токсинов, психоэмоциональных факторов и даже микробиоты кишечника. Исследования последних лет активно рассматривают микробиом как компонент, опосредованно влияющий на ЭКС, в частности через синтез жирных кислот и короткоцепочечных метаболитов, которые могут модулировать CB1/CB2-рецепторы или активность синтаз и гидролаз.
С клинической точки зрения диагностика такого состояния остается сложной. Отсутствие стандартизированных биомаркеров или референтных значений уровня ананамида или 2-AG в крови или тканях делает невозможным постановку точного диагноза. Оценка проводится преимущественно методом исключения, при наличии типичных симптомов, устойчивых к классическому лечению, и сопутствующих признаков снижения нейропластичности, психоэмоциональной адаптации, нарушений сна, усталости и хронической боли.
Ключевой особенностью состояния, позволяющей отделить его от других патологий, является полиорганная, многосимптомная природа проявлений при отсутствии морфологических поражений. Это — функциональное расстройство, при котором инструментальные методы не дают специфической картины, но качество жизни пациента существенно страдает.
В этом контексте дефицит эндоканнабиноидной системы рассматривается как своеобразная «фоново-причинная» звено, которое не является диагнозом в классическом понимании, но выступает концептуальной рамкой для объединения ряда непонятных, но клинически реальных состояний. Именно поэтому все больше исследователей и клиницистов признают целесообразность применения персонализированных стратегий терапии, предусматривающих модификацию активности ЭКС — через фармакологические, диетические, поведенческие и фитотерапевтические подходы.
Симптомы и заболевания, связанные с дефицитом
Нарушение эндоканнабиноидного тонуса проявляется как многовекторная дисфункция, затрагивающая несколько систем организма одновременно. В клинической практике это приводит к наличию симптомов, которые не вписываются в единую диагностическую категорию, но формируют устойчивый симптомокомплекс, характерный для дефицита эндоканнабиноидной регуляции.
В первую очередь проявляются симптомы со стороны ноцицептивной системы. Характерен хронический, распространённый боль без чёткой локализации, которая не сопровождается структурными поражениями тканей. Это особенно заметно при фибромиалгии — состоянии, где боль носит мышечно-скелетный характер, а лабораторные показатели остаются в пределах нормы. У пациентов с фибромиалгией наблюдается снижение порога боли, гипералгезия и аллодиния, что свидетельствует о нарушении центральной модуляции болевых сигналов.
Другим ключевым симптомом являются циклические головные боли, в частности мигрень. Её особенность заключается во взаимодействии сосудистого компонента с нейровоспалительным. У пациентов с мигренью фиксируют нарушение эндоканнабиноидного метаболизма, проявляющееся снижением уровней ананамида в плазме. Это вызывает недостаточное подавление тригеминальной активности и чрезмерное выделение провоспалительных нейропептидов.
Среди гастроэнтерологических состояний особенно часто выявляется синдром раздражённого кишечника (СРК). Для него характерны переменные нарушения моторики кишечника, чередование диареи и запора, а также хроническая боль в животе. ЭКС в норме обеспечивает тонкую регуляцию кишечной моторики и барьерной функции. Её дефицит приводит к дисбалансу между симпатическим и парасимпатическим контролем, что проявляется вегетативной нестабильностью и гиперреактивностью энтеральной нервной системы.
Интегративным проявлением нарушения эндоканнабиноидной активности является сочетание тревоги, депрессии и расстройств сна. Низкий эндоканнабиноидный тонус связан с гиперактивностью гипоталамо-гипофизарно-надпочечниковой оси и недостатком обратного торможения стрессового ответа. Это вызывает стойкое чувство внутреннего напряжения, ухудшение способности к эмоциональной саморегуляции, тревожные мысли, соматизированные симптомы без чёткой органной локализации.
Часто регистрируется хроническая усталость — необъяснимое истощение, которое не проходит после отдыха, сопровождается когнитивными нарушениями (так называемый «мозговой туман») и физической слабостью. Эти симптомы наблюдаются при миалгическом энцефаломиелите, который некоторые авторы также связывают с дисрегуляцией ЭКС.
Со стороны иммунной системы наблюдается склонность к чрезмерному воспалительному ответу, проявляющемуся в постоянном присутствии системного воспаления низкого уровня. Это не сопровождается острой лихорадкой или классическими воспалительными маркёрами, однако проявляется стойким повышением уровня провоспалительных цитокинов. Со временем такое состояние может стать основой для развития аутоиммунных процессов или вторичного иммунодефицита, в зависимости от индивидуальных реакций организма.
В сфере репродуктивного здоровья отмечаются нарушения менструального цикла, эндометриозоподобные боли и снижение фертильности. Каннабиноиды участвуют в регуляции гонадотропинов и локальных процессов в яичниках и матке. Их дефицит может вызывать дисбаланс половых гормонов, а также повышенную чувствительность к циклическим гормональным изменениям.
В сердечно-сосудистой системе при хроническом дефиците ЭКС регистрируются эпизоды тахикардии, нестабильность артериального давления, склонность к вазоспастическим реакциям. Это обусловлено нарушением автономного контроля тонуса сосудов. Каннабиноиды в физиологических условиях участвуют в регуляции вазодилатации и сокращения, поэтому их недостаточность нарушает динамическое равновесие в гемодинамике.
Симптомы со стороны мочевыделительной системы включают хронические тазовые боли, императивные позывы к мочеиспусканию, нестабильность детрузора, не имеющую морфологической основы. Это характерно для синдрома болезненного мочевого пузыря, который некоторые исследователи считают каннабиноид-чувствительной патологией.
В контексте нейропсихиатрии особое место занимает синдром дефицита внимания и гиперактивности (СДВГ) у взрослых, сопровождающийся импульсивностью, снижением концентрации, эмоциональной нестабильностью. Теоретической основой для его связи с ЭКС является участие каннабиноидов в префронтальной регуляции внимания и реактивности.
Среди кожных проявлений зафиксированы ассоциации между дефицитом ЭКС и такими состояниями, как атопический дерматит, псориаз, себорейный дерматит. Каннабиноидные рецепторы выявлены в кератиноцитах, меланоцитах и волосяных фолликулах, где они участвуют в регуляции пролиферации, воспалительной реакции и секреции кожного сала. Их дисфункция ведёт к гиперреактивности кожи на внешние раздражители.
Необходимо учитывать, что эндоканнабиноидная система человека не функционирует изолированно. Большинство симптомов возникает вследствие нарушенной взаимосвязи между ЭКС и другими регуляторными сетями, особенно при стрессе, гормональных сдвигах или системных нагрузках. Истощение эндоканнабиноидного резерва, накопление метаболических нарушений, дефицит сна и хроническое психоэмоциональное напряжение ведут к закреплению патологической картины, которая без целенаправленного вмешательства не имеет тенденции к спонтанному исчезновению.
Особого внимания заслуживает постинфекционный и поствирусный синдром, характеризующийся сочетанием когорты симптомов: снижением когнитивной продуктивности, нарушением сна, хронической усталостью, болью в мышцах и суставах, ухудшением терморегуляции. В этих состояниях предполагается вторичное истощение эндоканнабиноидного потенциала после перенесённой инфекции с высоким уровнем воспалительной нагрузки.
Современные подходы к коррекции (терапия, изменения образа жизни)
После признания клинического дефицита эндоканнабиноидной системы как отдельного функционального нарушения, интерес к возможным способам его коррекции растёт. Комплексная стратегия предусматривает использование фармакологических средств, нутрицевтических подходов, регуляцию режима сна, физическую активность и модификацию психоэмоциональной нагрузки. Все эти вмешательства направлены не только на стимуляцию эндоканнабиноидной активности, но и на стабилизацию метаболического фона, на котором эта система функционирует.
Фармакологическая терапия базируется на двух ключевых направлениях: прямая стимуляция каннабиноидных рецепторов или ингибирование ферментов, разрушающих эндоканнабиноиды. В первом случае применяются синтетические или фитоканнабиноиды, которые имитируют действие эндогенных лигандов. Наиболее изученным представителем является дельта-9-тетрагидроканнабинол (THC), обладающий высокой аффинностью к CB1-рецепторам. Его действие позволяет временно компенсировать дефицит эндогенной сигнальной активности. Однако использование THC ограничено побочными эффектами, в частности психоактивностью, толерантностью и риском дисфорических реакций при длительном приёме.
Альтернативой является каннабидиол (CBD) — непсихоактивная молекула, влияющая на ЭКС непрямым образом. Она модулирует активность рецепторов TRPV1, GPR55, а также изменяет концентрации эндогенных каннабиноидов за счёт ингибирования обратного захвата анандамида. В клинических исследованиях CBD демонстрирует эффективность при тревожных расстройствах, эпилепсии, хронической боли, что косвенно указывает на способность регулировать эндоканнабиноидный гомеостаз. Применение CBD в форме стандартизированных экстрактов или изолятов требует точного дозирования, поскольку эффективность зависит от индивидуальной чувствительности и сопутствующей патологии.
Второе направление — ингибирование ферментов, отвечающих за деградацию эндоканнабиноидов. Наиболее известен фермент FAAH, расщепляющий анандамид. Его фармакологическое блокирование позволяет увеличить концентрацию эндогенных лигандов в синаптической щели, усиливая физиологическую активацию рецепторов. Препараты этой группы ещё проходят клиническую апробацию, однако предварительные результаты свидетельствуют о их перспективности для лечения боли, тревожности и посттравматических расстройств.
Внепатентованные средства, потенциально влияющие на эндоканнабиноидный тонус, включают препараты омега-3 жирных кислот, магния, куркумина, пиперина, катехинов зелёного чая. Эти вещества влияют на активность ферментов, экспрессию рецепторов или уровень прозапальных медиаторов, что опосредованно улучшает работу эндоканнабиноидной системы. Омега-3, например, необходимы для биосинтеза эндоканнабиноидов с правильным структурным соотношением. Куркумин и пиперин способны снижать экспрессию FAAH, а также влиять на прозапальные каскады, подавляющие эндоканнабиноидную активность.
Физическая активность — один из наиболее эффективных физиологических триггеров для стимуляции эндоканнабиноидов. Аэробные нагрузки средней интенсивности способствуют повышению уровней анандамида и 2-AG в плазме, что, в свою очередь, улучшает настроение, снижает болевое восприятие и уменьшает уровень тревожности. Важна регулярность: ежедневные или минимум 3-4 раза в неделю занятия продолжительностью от 30 минут обеспечивают кумулятивный эффект. Среди оптимальных видов нагрузки — плавание, быстрая ходьба, умеренный бег, танцы или велосипед. Высокоинтенсивные тренировки также стимулируют ЭКС, но при чрезмерной нагрузке возможно истощение системы из-за усиленного стресс-отклика.
Сон регулирует обновление рецепторного поля и баланс между CB1 и CB2-активностью. Дефицит глубокого сна приводит к снижению чувствительности к эндогенным каннабиноидам и уменьшению их секреции. Нормализация циркадных ритмов — ключевой компонент стабилизации ЭКС. Для этого целесообразно регулировать время засыпания и пробуждения, избегать синего света вечером, не использовать электронные устройства перед сном и поддерживать постоянную температуру в спальне. Мелатонин в низких дозах или экстракты валерианы могут применяться как временная поддержка для перехода к более глубоким фазам сна, но не должны заменять полноценные гигиенические привычки.
Психоэмоциональное состояние — ещё один фактор, критически влияющий на тонус ЭКС. Хронический стресс, эмоциональное истощение, информационная перегрузка — все эти факторы приводят к дезорганизации каннабиноидной сигнализации через гиперактивацию кортизольной оси. Техники сознательного расслабления, такие как глубокое дыхание, медитация, телесно-ориентированные практики (например, йога или цигун), показали способность повышать активность CB1-рецепторов и нормализовать взаимодействие между гиппокампом и префронтальной корой. Краткосрочные интервенции могут давать эффект уже после 10-15 минут ежедневной практики, а системное внедрение снижает симптомы тревоги, гипервозбудимости и соматизации.
Рацион играет фундаментальную роль в поддержании эндоканнабиноидного баланса. Чрезмерное потребление омега-6 жирных кислот на фоне дефицита омега-3 способствует образованию неактивных или даже антагонистических метаболитов, вытесняющих эндоканнабиноиды из рецепторов. Продукты с высоким содержанием трансжиров, глутамата натрия, консервантов или простых сахаров подавляют нейромедиаторную пластичность и метаболизм липидов. Рекомендуется увеличить долю растительной пищи с высоким содержанием полифенолов, жирной морской рыбы, семян льна, орехов и снизить потребление промышленно обработанных продуктов. Особое внимание следует уделить микробиоте кишечника, поскольку короткоцепочечные жирные кислоты, образующиеся при ферментации пищевых волокон, способны модулировать каннабиноидную сигнализацию через энтероэндокринные клетки.
Экспериментальные подходы включают применение адаптогенов (родиола, ашваганда), а также селективную стимуляцию определённых типов рецепторов с использованием агонистов нового поколения. В клинической фармакологии исследуется комбинация низких доз фитоканнабиноидов с модуляторами серотониновых, опиоидных или дофаминовых рецепторов — такой мультирецепторный эффект имеет потенциал для индивидуализированной терапии.
Интеграция этих подходов требует индивидуального подбора и динамического мониторинга. Важно не только увеличить эндоканнабиноидную активность, но и создать условия для её устойчивой стабилизации без истощения. Уровень эффективности зависит от комбинации методов, их взаимной поддержки и способности организма адаптироваться к новым условиям регуляции. Системный подход, объединяющий фармакологию, образ жизни и поведенческие вмешательства, является оптимальным путём к восстановлению функционального баланса при эндоканнабиноидном дефиците.
Эндоканнабиноидная система и каннабис
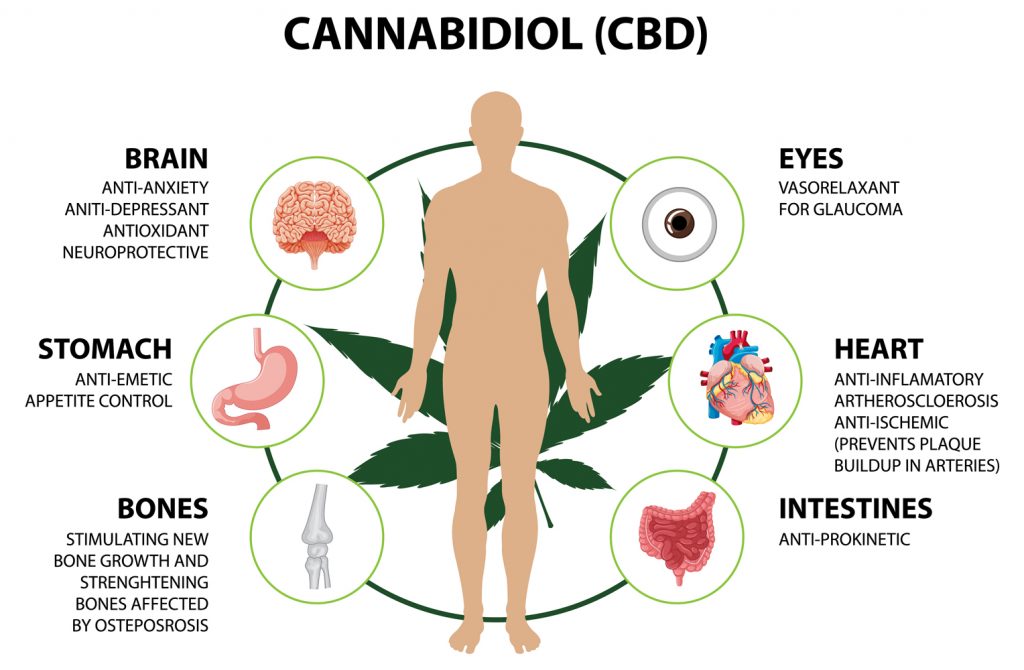
В последние десятилетия каннабис из объекта криминализированной политики превратился в центр внимания фармакологии, нейронаук и клинической медицины. Современная наука всё глубже раскрывает сложное и многовекторное взаимодействие биологически активных соединений этого растения с эндоканнабиноидной системой организма человека. Именно изучение механизмов действия фитоканнабиноидов, в частности Δ9-тетрагидроканнабинола (ТГК) и каннабидиола (КБД), позволило очертить ключевые контуры эндоканнабиноидной регуляции, которая ранее оставалась вне пределов медицинского знания.
Каннабис влияет на центральную и периферическую нервную систему через взаимодействие с двумя основными рецепторными подтипами — CB1 и CB2, которые являются частью эндоканнабиноидного комплекса. CB1-рецепторы преимущественно локализуются в головном мозге, в частности в гиппокампе, базальных ганглиях, мозжечке и префронтальной коре, тогда как CB2-рецепторы сосредоточены в клетках иммунной системы, селезёнке и периферических тканях. Эти рецепторы изначально были открыты именно через попытки понять, через какие рецепторы каннабис взаимодействует с эндоканнабиноидной системой нашего организма, что свидетельствует о тесной исторической и функциональной взаимосвязи между природной биохимией человека и фитогенными лигандами.
Ключевым открытием стало осознание того, что эндоканнабиноидная система не создана для обработки экзогенных каннабиноидов, но имеет собственные эндогенные лиганды — анандамид и 2-AG, которые выполняют роль регуляторов внутриклеточной сигнализации. Каннабис лишь имитирует или модуляторно воздействует на эти процессы, вмешиваясь в тонкий баланс тормозных и возбудительных сигналов. В этом контексте важно не упрощать понимание фитоканнабиноидов до роли «замены» для эндоканнабиноидов: действие каннабиса является вариабельным, дозозависимым, рецепторно-специфичным и во многом контекстуальным — зависящим от физиологического, психоэмоционального и метаболического состояния индивида.
Благодаря своей липофильности ТГК легко проходит через гематоэнцефалический барьер и связывается с CB1-рецепторами, что ведёт к изменениям в высвобождении нейромедиаторов, включая дофамин, глутамат, ГАМК, серотонин. Это объясняет широкий спектр его эффектов: от эйфории и сенсорной гиперчувствительности до изменения временных оценок, моторной координации и аппетита. КБД, напротив, имеет низкую сродственность к каннабиноидным рецепторам, но влияет на систему посредством аллостерической модуляции, подавления обратного захвата ананамида и связывания с рядом неконнабиноидных мишеней: TRPV1, PPARγ, 5-HT1A. Такая взаимосвязь демонстрирует сложную сетевую структуру воздействия каннабиса, охватывающую не только ЭКС, но и многочисленные смежные сигнальные системы.
На основе этих механизмов была выдвинута идея, что контролируемое применение фитоканнабиноидов может служить терапевтическим инструментом для компенсации или модуляции функций эндоканнабиноидной системы. В частности, при гипофункции ЭКС — например, при клиническом дефиците ананамида — фитоканнабиноиды могут временно восстанавливать рецепторную активность и стабилизировать нейрофизиологический гомеостаз. Однако одновременно возникает вопрос рисков: длительная стимуляция CB1-рецепторов может привести к их десенситизации, снижению экспрессии и функциональному истощению системы. Это ставит задачу перед клинической каннабисотерапией — как достичь коррекции без нарушения долгосрочного рецепторного равновесия.
Ещё одним важным аспектом является то, что эффекты каннабиса зависят не только от ТГК или КБД, но и от так называемого «эффекта ансамбля» — совокупного взаимодействия всех биоактивных компонентов растения, включая терпены, флавоноиды, индикаторы окислительного статуса. Например, терпены, придающие сорту аромат, способны модуляторно влиять на проницаемость клеточных мембран и чувствительность к лигандам. Это усиливает или смягчает эффекты основных каннабиноидов, создавая сложную динамическую картину действия.
Региональные различия в генетике растения каннабиса, методах культивации, технологиях экстракции также влияют на фармакологический профиль. Медицинские экстракты могут содержать разное соотношение ТГК и КБД, что определяет спектр клинического применения — например, при эпилепсии, тревожности, хронической боли или расстройствах пищевого поведения. В то же время рекреационные продукты часто имеют повышенное содержание ТГК, что увеличивает риск психиатрических осложнений при отсутствии клинического мониторинга.
С научной точки зрения, каннабис является инструментом для моделирования, тестирования и уточнения представлений о внутренних механизмах человеческой регуляции. ЭКС — это не изолированная система, а интегративная сеть, переплетающаяся с дофаминергической, серотониновой, глутаматной, эндогенно-опиоидной сигнализацией. Благодаря этому изучение эффектов каннабиса позволяет идентифицировать ранее невидимые регуляторные узлы, перекрёстки между физиологией и субъективным опытом. В этом смысле эндоканнабиноидная система и каннабис становятся не только объектом прикладной медицины, но и ключом к междисциплинарному пониманию целостной нейрофизиологии.
Не менее важна этическая и социальная плоскость вопроса. Распространение каннабиса в виде легализованных или медицинских продуктов поднимает дискуссию о границах саморегуляции, роли государства в контроле над психоактивными веществами, а также уровне научной грамотности среди пользователей. Наличие продукта на рынке ещё не гарантирует его безопасность или эффективность для конкретного клинического случая. Безопасность терапии требует диагностической оценки, медицинского надзора, персонализированного подбора формы и дозы.
Взаимодействие фитоканнабиноидов с ЭКС
Фитоканнабиноиды — это группа биологически активных соединений растительного происхождения, которые проявляют сродство к рецепторам эндоканнабиноидной системы, имитируя или модуляторно изменяя действие эндогенных каннабиноидов. В растении каннабис обнаружено более 100 таких веществ, однако наиболее изученными являются Δ9-тетрагидроканнабинол (ТГК), каннабидиол (КБД), каннабигерол (КБГ), каннабихромен (КБХ) и каннабинол (КНБ). Их взаимодействие с рецепторными структурами организма не является унифицированным — каждый фитоканнабиноид обладает уникальной фармакодинамикой, которая определяется типом рецепторного связывания, аллостерическим потенциалом, влиянием на энзиматическую деградацию и транспорт эндогенных лигандов.
Основным рецептором, с которым фитоканнабиноиды активно взаимодействуют, является CB1 — центральный компонент нейрональной регуляции, представленный в глутаматергических, ГАМК-ергических, дофаминергических и серотонинергических структурах мозга. Δ9-ТГК действует как частичный агонист CB1, активируя его в дозозависимой манере. Это вызывает подавление высвобождения нейромедиаторов через механизм ретроградного ингибирования, который реализуется путем влияния на кальциевые каналы и внутриклеточную передачу сигнала через Gi/o-белки. Такой механизм позволяет изменять синаптическую пластичность, лежащую в основе памяти, аффективной реактивности, мотивационного контроля. Однако ТГК не активирует CB1 до максимума его потенциала, в отличие от некоторых синтетических каннабиноидов — эта особенность объясняет сравнительно более низкую токсичность, но большую вариативность ответа.
В отличие от ТГК, КБД не имеет прямого агонистического действия на CB1 или CB2. Его активность реализуется опосредованно: через аллостерическое подавление CB1, ингибирование FAAH (фермента, разлагающего анандамид), связывание с TRPV1, PPARγ и 5-HT1A. Такое многовекторное вмешательство позволяет КБД модуляторно влиять на системы, вовлечённые в регуляцию тревоги, ноцицепции, воспаления, окислительного стресса. Интересно, что КБД способен снижать психоактивные эффекты ТГК при одновременном употреблении, выступая как его функциональный антагонист. Это обусловлено изменением доступности CB1 для ТГК и влиянием на транспорт ананнамида, который конкурирует с фитоканнабиноидами за рецепторное связывание.
Другие соединения, такие как КБГ и КБХ, демонстрируют селективную активность к CB2-рецепторам или взаимодействуют с TRP-каналами, не затрагивая напрямую классические каннабиноидные пути. КБГ, в частности, выступает как слабый агонист CB1 и умеренный антагонист 5-HT1A, а также ингибирует обратный захват норадреналина. Такие свойства придают ему потенциал как противовоспалительной, нейропротекторной и даже антидепрессивной молекулы. КБХ, в свою очередь, проявляет противоотёчное и антиноцицептивное действие через активацию TRPA1, TRPV3 и CB2. Все эти взаимодействия имеют сложный временной профиль, включающий не только прямое связывание, но и транскрипционные изменения в экспрессии рецепторов.
Особое внимание заслуживает механизм взаимодействия фитоканнабиноидов с CB2-рецепторами. Эти рецепторы, которые изначально считались периферическими, теперь идентифицированы также в микроглии, астроцитах, нейронах ствола мозга. CB2-медиация ассоциируется со снижением провоспалительных цитокинов, ингибированием клеточной миграции и стимуляцией апоптоза в иммунных клетках. Фитоканнабиноиды, такие как КБГ и КБХ, а также отдельные производные ТГК, активируют CB2 посредством стабилизации конформации рецептора в противовоспалительной форме, что открывает перспективы для их использования в терапии хронических воспалительных и нейродегенеративных состояний без психоактивного эффекта.
Не менее важным является взаимодействие фитоканнабиноидов с системами ферментов и транспортеров. Так, ТГК и КБД могут ингибировать FAAH и MAGL — ферменты, ответственные за деградацию ананнамида и 2-AG соответственно. Это приводит к повышению тонического уровня эндоканнабиноидов, которые, в свою очередь, воздействуют на CB1 и CB2. Таким образом, фитоканнабиноиды не только имитируют действие эндогенных молекул, но и увеличивают их биодоступность за счёт снижения катаболизма. Кроме того, влияние на транспортные белки, в частности FABP, изменяет клеточную локализацию ананнамида, что также модулирует рецепторную активность.
Каннабиноиды влияют и на ядерные рецепторы, в частности PPARγ, который контролирует экспрессию генов, связанных с воспалением, метаболизмом липидов, окислительным стрессом. КБД и КБГ активируют PPARγ, вызывая изменения в транскрипции генов, обеспечивающих антиоксидантную защиту и улучшение инсулиновой чувствительности. Это открывает возможности для применения в терапии метаболического синдрома, диабета II типа и нейродегенеративных заболеваний.
Взаимодействие фитоканнабиноидов не ограничивается рецепторным действием. Терпеноиды, присутствующие в составе каннабиса, усиливают или изменяют фармакокинетику основных каннабиноидов, изменяя проницаемость гематоэнцефалического барьера, модуляцию P450-ферментов печени и даже чувствительность рецепторов к лигандам. Например, β-кариофиллен действует как селективный агонист CB2, а мирцен потенцирует седативный эффект ТГК. Этот ансамбль, называемый «эффектом окружения», представляет принципиальное отличие действия природного каннабиса от изолированных каннабиноидов или синтетических препаратов.
Интенсивность, продолжительность и специфика эффектов фитоканнабиноидов во многом зависят от дозировки, способа введения, биодоступности и индивидуальных вариаций в рецепторной экспрессии. Внутрииндивидуальная изменчивость, обусловленная генетическими полиморфизмами, состоянием микробиоты, барьерной проницаемостью и активностью метаболических ферментов, влияет на субъективный ответ на одинаковую дозу. Это требует персонализированного подхода при терапевтическом применении каннабиса.
ТГК, КБД и другие активные соединения растения
Химический состав каннабиса не ограничивается только каннабиноидами, однако именно они являются главными биологически активными веществами, которые влияют на физиологию человека. Среди более чем сотни каннабиноидов лучше всего изучены Δ9-тетрагидроканнабинол (ТГК) и каннабидиол (КБД), однако важную роль также играют каннабигерол (КБГ), каннабинол (КНБ), каннахромен (КБХ) и ряд малых соединений, включая терпеноиды и флавоноиды. Все эти компоненты действуют в различных фармакологических векторах и вместе определяют широту биологического действия каннабиса.
ТГК — это психоактивный компонент каннабиса, который проявляет высокое сродство к CB1-рецепторам, расположенным преимущественно в головном мозге. Он является частичным агонистом этого рецептора, что позволяет ему модулировать нейротрансмиттерную активность, включая глутамат, ГАМК, дофамин и серотонин. Молекула ТГК липофильна, легко проходит через гематоэнцефалический барьер и имеет длительный период полувыведения. Его эффекты — эйфория, изменения восприятия, временное снижение когнитивной гибкости, усиление сенсорной интеграции — являются следствием центральной нейромодуляции.
При длительном использовании ТГК запускает ряд компенсаторных изменений в нейрональных сетях, включая снижение чувствительности CB1-рецепторов (десенситизацию), изменение внутриклеточных сигнальных каскадов (особенно через Gi/o-белки) и аллостерическую реорганизацию мембранных доменов. Эти адаптации могут изменять эффективность эндогенных каннабиноидов и приводить к смещению баланса между возбуждением и торможением в нейрональных цепях. Такой механизм имеет значение при формировании зависимости и толерантности.
КБД — второй по популярности, но непсихоактивный каннабиноид. Он не действует напрямую на CB1 или CB2, однако опосредованно влияет на активность обоих через блокаду FAAH (фермента, разрушающего анандамид), аллостерическую модуляцию CB1, стимуляцию PPARγ, TRPV1 и 5-HT1A. Благодаря этому КБД проявляет анксиолитическое, противовоспалительное, противосудорожное действие и стабилизирует электрическую активность мозга при эпилепсии. Его эффект зависит от дозы, индивидуальной фармакокинетики, а также наличия других каннабиноидов.
КБД также модулирует экспрессию генов через взаимодействие с ядерными рецепторами, влияя на клеточную дифференцировку, апоптоз, антиоксидантную защиту. В отличие от ТГК, он не вызывает десенситизации рецепторов и, наоборот, способен восстанавливать рецепторную чувствительность к эндогенным лигандам в условиях их дефицита.
Каннабигерол (КБГ) — предшественник ТГК и КБД в биосинтетическом пути. Его концентрация в зрелых растениях невысока, однако он демонстрирует слабую активность на CB1 и CB2, а также взаимодействует с TRPA1, TRPM8, 5-HT1A. КБГ обладает нейропротекторными и антибактериальными свойствами, подавляет агрегацию MRSA, модуляторно влияет на кишечную перистальтику и проявляет эффект при глаукоме за счет снижения внутриглазного давления. В отличие от ТГК, он не является психоактивным и не вызывает толерантности.
Каннабинол (КНБ) образуется в результате окисления ТГК, особенно в старом или плохо сохранившемся материале. Его сродство к CB1 слабое, однако к CB2 — умеренное. Он проявляет седативные свойства, противовоспалительный эффект и потенциально может быть полезен в терапии инсомнии и нейродегенеративных состояний. КНБ влияет на процессы пролиферации клеток, подавляет выделение провоспалительных цитокинов и имеет селективную активность в тканях с повышенным окислительным стрессом.
Каннахромен (КБХ) — еще один непсихоактивный компонент, проявляющий противовоспалительное, антидепрессивное и нейрогенное действие. Он активирует TRPA1, CB2 и частично PPARγ. Экспериментальные данные демонстрируют его способность стимулировать нейрогенез в гиппокампе, что может быть использовано в терапии депрессии или нейровосстановления. В условиях комбинации с другими каннабиноидами КБХ проявляет синергический эффект, в частности в анальгезии.
Помимо каннабиноидов, каннабис содержит более 200 терпенов, которые в значительной степени влияют на биологическое действие растения. Например, β-кариофиллен является селективным агонистом CB2, мирцен влияет на проницаемость клеточных мембран, линалол модулирует ГАМК-рецепторы. Взаимодействие каннабиноидов с терпенами формирует феномен так называемого «эффекта окружения», при котором действие смеси превышает действие индивидуальных соединений.
К активным компонентам также относятся флавоноиды, обладающие антиоксидантными, нейропротекторными и противовоспалительными свойствами. Например, каннафлавин А подавляет продукцию PGE2 — мощного медиатора воспаления — в 30 раз эффективнее аспирина. Хотя концентрация флавоноидов в каннабисе незначительна, их участие в фармакологическом профиле растения является существенным.
Важно понимать, что каждое из этих веществ имеет не только собственные эффекты, но и изменяет фармакодинамику других компонентов. Например, КБД может снижать психоактивный потенциал ТГК, тогда как КБГ усиливает его анальгезию. В клинической практике такое взаимодействие приобретает значение при разработке композиционных препаратов и подборе терапевтического профиля для индивидуальных потребностей.
Фармакокинетика фитоканнабиноидов зависит от способа введения. При ингаляционном употреблении ТГК достигает максимума в плазме через 5-10 минут, при пероральном — через 1,5-2 часа. КБД обладает более низкой биодоступностью, особенно при приеме внутрь, поэтому для достижения терапевтического эффекта часто требуются более высокие дозы. Метаболизм происходит преимущественно в печени через систему цитохрома P450 с образованием активных метаболитов, которые сами могут обладать фармакологической активностью.
Реакция на каннабиноиды индивидуально варьируется в зависимости от генетических полиморфизмов, метаболического состояния, наличия воспаления, состава микробиоты и общего состояния эндоканнабиноидной системы и каннабиса в организме. Поэтому стандартизированный подход к дозированию или выбору каннабиноидного профиля часто оказывается неэффективным.
Медицинское использование каннабиса и влияние на ЭКС
В клинической практике каннабис рассматривается как многокомпонентный фармакологический инструмент, влияющий на широкий спектр патологических процессов. Его применение не ограничивается только симптоматической терапией, а всё чаще включается в модели патогенетического вмешательства. Благодаря способности каннабиноидов регулировать гомеостатические механизмы, медицинский каннабис используют в лечении хронической боли, эпилепсии, тревожных расстройств, тошноты при химиотерапии, мышечной спастичности при рассеянном склерозе, нарушений сна и потери аппетита при ВИЧ/СПИДе.
Одной из наиболее валидированных областей применения является невропатическая боль, которая слабо поддаётся действию традиционных анальгетиков. Каннабиноиды модулируют передачу болевых сигналов на уровне спинного мозга и таламуса, снижая активность проноцицептивных нейронов и одновременно влияя на эмоциональное восприятие боли через мезолимбическую систему. Комбинация ТГК и КБД в препаратах типа Sativex показала эффективность в контроле хронической боли у пациентов с онкологией, ревматоидным артритом, фибромиалгией.
В лечении фармакорезистентной эпилепсии, в частности при синдромах Леннокса-Гасто и Драве, успешно применяют очищенный каннабидиол. Препарат Epidiolex, зарегистрированный FDA, показал снижение частоты приступов на 30-50% у большинства пациентов. Этот эффект связывают с действием КБД на ионные каналы (особенно Na+ и Ca2+), рецепторы TRPV1, 5-HT1A и с модуляцией синаптической пластичности в зонах эпилептогенеза. Важно, что КБД не оказывает психоактивного действия и обладает благоприятным профилем безопасности даже при высоких дозах.
Мышечная спастичность при рассеянном склерозе — ещё одна патология, где каннабиноиды продемонстрировали клиническую пользу. Снижение тонуса мышц, боли и улучшение качества жизни пациентов связано с действием ТГК через CB1-рецепторы в моторной коре и спинном мозге. Исследования показывают уменьшение спастичности у 40-50% пациентов, не ответивших на другие препараты, при приёме комбинированных экстрактов.
При онкологических заболеваниях каннабис используется не только для контроля боли, но и для уменьшения тошноты и рвоты, вызванных химиотерапией. Синтетические каннабиноиды, такие как дронабинол и набилон, одобрены для лечения химио-индуцированной тошноты у пациентов, не реагирующих на антагонисты 5-HT3. Кроме того, каннабиноиды могут способствовать стабилизации массы тела через стимуляцию аппетита, особенно у пациентов с ВИЧ/СПИДом или тяжёлой кахексией.
В психиатрии исследуется использование каннабиноидов в лечении посттравматического стрессового расстройства (ПТСР), генерализованной тревоги, обсессивно-компульсивного синдрома. Основной терапевтический механизм заключается в способности КБД влиять на сети страха, нейропластичность и ослабление патологических эмоциональных воспоминаний. Клинические наблюдения показывают снижение уровня тревоги, улучшение сна, уменьшение частоты флешбеков у пациентов с ПТСР при использовании КБД в дозах 300-600 мг/сутки.
В нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, Паркинсона, Гентингтона, каннабиноиды демонстрируют антиоксидантное, противовоспалительное и нейропротекторное действие. Эти эффекты связывают с активацией CB2-рецепторов микроглии, снижением нейровоспаления, ингибированием агрегации белков и стабилизацией митохондриальной функции. Хотя пока не существует утверждённых протоколов, экспериментальные данные поддерживают дальнейшие исследования в этом направлении.
Особое внимание привлекает иммуномодулирующий потенциал каннабиноидов. CB2-рецепторы присутствуют на клетках иммунной системы: В-лимфоцитах, макрофагах, нейтрофилах, дендритных клетках. Их активация приводит к снижению продукции провоспалительных цитокинов (TNF-α, IL-1β, IL-6), торможению пролиферации Т-клеток, стимуляции регуляторного фенотипа. Это открывает возможности для использования каннабиноидов при аутоиммунных заболеваниях — системной красной волчанке, ревматоидном артрите, рассеянном склерозе.
В дерматологии каннабиноиды применяют при атопическом дерматите, псориазе, акне. Их действие обусловлено подавлением продукции себума, снижением пролиферации кератиноцитов и модуляцией локального иммунного ответа. Препараты на основе КБД в форме кремов или мазей демонстрируют эффективность в уменьшении воспаления, зуда, гиперкератоза.
Кардиометаболическое влияние каннабиноидов пока исследуется ограниченно. Есть данные о повышении инсулинчувствительности, снижении концентрации С-реактивного белка и некотором уменьшении индекса массы тела при хроническом употреблении КБД. Механизмы этого влияния включают модуляцию PPARγ, AMPK, а также воздействие на жировую ткань через CB1-рецепторы. Но чрезмерное употребление ТГК, наоборот, может ассоциироваться с кардиореспираторными рисками.
Каннабис также используется в паллиативной медицине. Пациенты с терминальными стадиями онкологии, нейродегенеративных болезней или тяжёлой сердечной недостаточности получают пользу от уменьшения боли, тревоги, тошноты, нарушений аппетита. Каннабиноиды улучшают качество жизни, снижают потребность в опиоидах, что особенно важно в контексте риска зависимости.
Интенсивно развивается область персонализированной каннабиноидной терапии. Учитываются генетические варианты ферментов (CYP2C9, CYP3A4), рецепторов CB1, CB2, а также индивидуальный эндотип дефицита или гиперактивности эндоканнабиноидной системы. Такой подход позволяет минимизировать побочные эффекты, избежать нежелательных взаимодействий с другими препаратами и обеспечить эффективную биоиндвидуальную поддержку.
Чтобы понять терапевтический потенциал каннабиса, необходимо осознавать, через какие рецепторы каннабис взаимодействует с эндоканнабиноидной системой нашего организма. Это прежде всего CB1, CB2, а также ряд ванилоидных, серотониновых, аденозиновых, ядерных и транзиторных рецепторов. Благодаря такому спектру мишеней фито-каннабиноиды способны модулировать как центральные, так и периферические механизмы, обеспечивая широкую терапевтическую амплитуду.
Побочные эффекты, риски и перспективы
Несмотря на значительный терапевтический потенциал, применение каннабиса связано с рядом рисков, которые зависят от дозы, химического состава, длительности использования, способа введения и чувствительности конкретного пациента. Изучение побочных эффектов имеет критическое значение, поскольку неправильное дозирование или самостоятельное применение препаратов на основе каннабиса может не только снизить эффективность лечения, но и вызвать нежелательные физиологические или психические реакции. Медицинский каннабис не является универсально безопасным средством и требует четких стандартов фармаконадзора.
Одним из наиболее частых побочных эффектов являются когнитивные нарушения, в частности снижение концентрации, замедление реакций, временное ослабление кратковременной памяти. Эти изменения наиболее выражены при употреблении препаратов, содержащих высокие дозы дельта-9-тетрагидроканнабинола (ТГК), особенно у пациентов без толерантности к психоактивному действию. В подростковом возрасте регулярное использование ТГК ассоциируется с повышенным риском снижения IQ, изменениями в структуре префронтальной коры и нарушением нейроразвития.
Психиатрические осложнения могут проявляться в виде тревожности, панических атак, параноидальных мыслей, иногда — индуцированных психозов. Особенно уязвимы лица с генетической предрасположенностью к шизофрении или биполярному аффективному расстройству. Данные нейровизуализаций показывают, что ТГК влияет на дофаминергические и глутаматергические пути, участвующие в регуляции эмоций и мышления, что объясняет потенциальный риск психотических эпизодов у чувствительных индивидов.
Со стороны сердечно-сосудистой системы наблюдаются тахикардия, колебания артериального давления, вазодилатация. У лиц с латентной ишемической болезнью сердца или аритмиями возможно обострение кардиологических симптомов. Существуют сообщения о случаях инфаркта миокарда, инсульта, сердечных аритмий, ассоциированных с высокими дозами ТГК, особенно у пациентов, которые одновременно употребляют табак или другие психоактивные вещества.
Респираторные эффекты связаны преимущественно с курением каннабиса, а не с фармацевтическими формами. Хроническое вдыхание дыма может вызвать бронхит, кашель, одышку, гиперреактивность бронхов. Дым каннабиса содержит полициклические ароматические углеводороды, сходные с теми, что присутствуют в табаке, что повышает онкологические риски при длительном использовании. Альтернативные способы введения — сублингвальные спреи, капсулы, настойки, ингаляторы — минимизируют эти эффекты, но требуют точного дозирования.
Нарушение моторной координации, замедленная реакция и сонливость повышают риск несчастных случаев. Пациенты, принимающие каннабиноиды, должны воздерживаться от управления транспортом или работы с потенциально опасными механизмами в течение как минимум нескольких часов после приема. Особенно это касается лиц без предыдущего опыта употребления или тех, кто комбинирует каннабис с алкоголем или седативными препаратами.
Формирование зависимости возможно, хотя риск ниже по сравнению с опиоидами, никотином или алкоголем. Около 9-10% лиц, регулярно употребляющих каннабис, развивают зависимость, которая проявляется психоэмоциональным дискомфортом при отмене, раздражительностью, бессонницей, сниженным аппетитом. Синдром отмены менее выражен, чем при опиоидной или бензодиазепиновой зависимости, но может быть клинически значимым у чувствительных пациентов.
Риск лекарственных взаимодействий также требует внимания. Каннабиноиды метаболизируются в основном через изоферменты CYP3A4 и CYP2C9, которые также вовлечены в метаболизм многих других препаратов, в частности антикоагулянтов, антидепрессантов, иммунодепрессантов. Потенциальная ингибиция или индукция этих ферментов может вызвать токсичность или снижение эффективности сопутствующей терапии.
С учетом индивидуальных вариаций в метаболизме, чувствительности рецепторов и реакциях на каннабиноиды важно внедрять персонализированные модели назначения препаратов. Генетическое тестирование, мониторинг фармакокинетики и фармакодинамики, а также точная стратификация пациентов по рискам позволяют повысить безопасность терапии. Особое внимание следует уделять детям, беременным женщинам и лицам пожилого возраста, где риск неблагоприятных эффектов возрастает из-за измененной фармакологической реакции.
В то же время актуален вопрос долгосрочных последствий регулярного использования каннабиноидов. Хотя некоторые данные свидетельствуют о снижении воспаления, нейропротекции и метаболических преимуществах, другие указывают на потенциальную десенсибилизацию рецепторов CB1, что может привести к нарушению работы эндоканнабиноидной системы при длительной чрезмерной нагрузке. Это, в свою очередь, может спровоцировать функциональные сбои в регуляции боли, настроения, сна и иммунитета.
С точки зрения перспектив развития каннабиноидной терапии ожидается появление селективных агонистов и антагонистов рецепторов CB1/CB2, молекул с низким психоактивным потенциалом, синтетических аналогов КБД с повышенной биодоступностью. Также продолжается разработка комбинированных схем с другими лекарственными средствами — анальгетиками, противосудорожными, анксиолитиками — для достижения синергического эффекта с минимизацией дозы каннабиноидов.
Новым направлением является создание рецептур, направленных на воздействие не только на каннабиноидные рецепторы, но и на другие мишени: рецепторы TRP, GPR55, аденозиновые, PPAR. Это позволит расширить терапевтическое действие и уменьшить психоактивные побочные эффекты. Разрабатываются нанотехнологические платформы доставки, обеспечивающие контролируемое высвобождение активных компонентов, точное дозирование и снижение системной токсичности.
Перспективы клинического использования каннабиса также зависят от нормативной среды. Легализация медицинского применения в ряде стран открыла доступ к систематическим клиническим испытаниям, расширению терапевтических показаний, стандартизации производства. Однако во многих регионах каннабис по-прежнему рассматривается исключительно как наркотическое средство, что тормозит научный прогресс и доступность для пациентов.
Еще одним перспективным вектором является интеграция каннабиноидной терапии в комплементарную медицину: сочетание с нутритивной поддержкой, физиотерапией, когнитивно-поведенческой терапией. Такой подход особенно актуален при хронических полиэтиологических состояниях, где требуется многовекторное вмешательство с минимальными побочными эффектами.
Вывод:
Эндоканнабиноидная система (ЭКС) — это сложная, интегративная сигнальная сеть, которая функционально связана с большинством ключевых физиологических процессов организма. Она состоит из эндогенных лигандов (анандамид, 2-АГ), специфических рецепторов (преимущественно CB1 и CB2), транспортных белков и ферментов, регулирующих синтез и деградацию каннабиноидов. Взаимодействие между этими компонентами обеспечивает тонкую настройку межклеточной коммуникации, быструю реакцию на стрессоры, поддержку гомеостаза и динамическую адаптацию к внутренним и внешним изменениям. Ее активность охватывает центральную и периферическую нервную систему, иммунный ответ, метаболизм, гормональную регуляцию, модуляцию боли, сна, терморегуляции и настроения.
ЭКС действует не как изолированная система, а как регуляторная надстройка, влияющая на деятельность других систем организма, в частности нервной, эндокринной, иммунной, пищеварительной и сердечно-сосудистой. Ее специфичность заключается в обратном (ретроградном) механизме сигнализации, при котором эндоканнабиноиды синтезируются «по требованию» постсинаптической клеткой и подавляют активность пресинаптического нейрона. Это позволяет регулировать интенсивность нейрональной активности, подавляя чрезмерную стимуляцию или возбуждение. CB1-рецепторы чрезвычайно плотно представлены в головном мозге, в частности в гиппокампе, базальных ганглиях, мозжечке, что обусловливает их участие в когнитивной, моторной и эмоциональной регуляции. CB2-рецепторы преимущественно экспрессируются в иммунных клетках, модулируя провоспалительные каскады, апоптоз и миграцию клеток.
Одним из ключевых вызовов для физиологии является состояние клинического дефицита ЭКС — дисфункциональное состояние, при котором пониженный уровень эндоканнабиноидов или нарушенная рецепторная реакция приводят к патологическому разбалансированию процессов регуляции. Этот дефицит может быть первичным (генетически обусловленным) или вторичным (приобретённым в результате хронического стресса, нейровоспаления, травм, инфекций, старения). Низкая активность ЭКС связана с развитием целого ряда состояний — от мигрени, фибромиалгии и синдрома раздражённого кишечника до депрессии, тревожных расстройств и нейродегенеративных заболеваний. Эти связи не являются лишь корреляционными — современная экспериментальная база подтверждает причинно-следственное влияние нарушения тонуса ЭКС на возникновение стойкой патологии.
В этом контексте возрастает роль терапевтической модуляции ЭКС. Современные подходы к коррекции дефицита предусматривают как фармакологические вмешательства — применение природных и синтетических каннабиноидов, ингибиторов ферментов FAAH/MAGL, селективных агонистов CB1/CB2, так и нефракмакологические — диетические стратегии, физическую активность, практику стресс-редукции, нормализацию сна. Подход к модуляции ЭКС должен быть персонализированным и базироваться на валидации уровней эндоканнабиноидов и рецепторной активности. Чрезмерная или неконтролируемая стимуляция может, наоборот, ухудшить адаптивные возможности системы за счёт десенсибилизации рецепторов.
Особое место занимает взаимодействие ЭКС с каннабисом. Фитоканнабиноиды, прежде всего ТГК и КБД, обладают потенциалом модуляции активности CB-рецепторов и связанных сигнальных каскадов. ТГК действует как частичный агонист CB1, что обусловливает его психоактивные эффекты, тогда как КБД имеет слабое сродство к классическим каннабиноидным рецепторам, но влияет на аллостерическую модуляцию, обратный захват анандамида, а также на другие сигнальные мишени — PPARγ, TRPV1, GPR55. Фармакологический профиль каннабиса зависит не только от соотношения ТГК/КБД, но и от содержания терпеноидов, флавоноидов, каннабигерола и других неканонических каннабиноидов.
Медицинское применение каннабиса показывает перспективные результаты в лечении боли, эпилепсии, рассеянного склероза, болезни Паркинсона, аутизма, ПТСР и онкопаллиативных состояний. Однако его внедрение сопровождается рисками: когнитивными нарушениями, зависимостью, психотическими эпизодами, кардиоваскулярными осложнениями, негативным влиянием на нейроразвитие у подростков. Безопасность применения требует регламентированных доз, чёткого контроля качества препаратов, врачебного мониторинга и правового регулирования. Научные исследования сосредоточены на поиске селективных каннабиноидов с минимальными побочными эффектами, развитии нетрадиционных форм доставки (наноформуляции, ингаляторы, трансдермальные системы), а также использовании ЭКС как терапевтической мишени для препаратов нового поколения.
В перспективе ЭКС перестаёт рассматриваться только как фармакологическая цель. Она становится системой, интегрированной в клиническую диагностику, скрининг рисков, стратегии профилактики, а также платформой для создания индивидуализированной медицины. Ее уникальная способность координировать функции различных систем организма, реагировать на изменяющиеся условия и поддерживать баланс между процессами активации и торможения делает ее одним из ключевых регуляторов гомеостаза и мишенью будущих мультисистемных терапевтических стратегий.
Источники:
- Endocannabinoid System: Overview and Clinical Implications
Источник: National Center for Biotechnology Information (NCBI), PubMed Central
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3998222/ - The Endocannabinoid System and its Therapeutic Exploitation
Источник: Nature Reviews Drug Discovery
https://www.nature.com/articles/nrd.2015.16 - Endocannabinoid System in Health and Disease: An Overview
Источник: Frontiers in Neuroscience
https://www.frontiersin.org/articles/10.3389/fnins.2018.00025/full - Cannabinoid Receptors and Their Endogenous Ligands
Источник: British Journal of Pharmacology, Wiley Online Library
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/bph.13118 - Clinical Endocannabinoid Deficiency: Can This Concept Explain Therapeutic Benefits of Cannabis in Migraine, Fibromyalgia, Irritable Bowel Syndrome?
Источник: Neuroendocrinology Letters
https://www.nel.edu/userfiles/articlesnew/NEL320509A04.pdf - Pharmacology of Cannabinoids
Источник: Pharmacological Reviews, American Society for Pharmacology and Experimental Therapeutics (ASPET)
https://pharmrev.aspetjournals.org/content/68/4/1103 - Therapeutic Potential of Cannabinoids in Neurological Disorders
Источник: Journal of Neurology, Neurosurgery & Psychiatry, BMJ
https://jnnp.bmj.com/content/89/7/741 - Endocannabinoid System and Immune Regulation: A Role for Cannabinoids in Modulating Immune Response
Источник: Journal of Leukocyte Biology
https://jlb.onlinelibrary.wiley.com/doi/full/10.1189/jlb.3RI0713-379R - Medical Cannabis and Cannabinoids: Evidence and Practice
Источник: Royal Australian College of General Practitioners (RACGP)
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/medical-cannabis - Safety and Side Effects of Cannabinoids
Источник: Drug Safety Journal, SpringerLink
https://link.springer.com/article/10.2165/00002018-200746090-00004