Монометиловый эфир каннабигерола (CBGM) является производным каннабигерола (CBG), одного из основных каннабиноидов, содержащихся в конопле. Как и другие каннабиноиды, CBG относится к группе химических соединений, взаимодействующих со специфическими рецепторами в организме человека, в частности с каннабиноидными рецепторами CB1 и CB2. Важной особенностью CBG является отсутствие психоактивных свойств, в отличие от его близких аналогов, таких как THC. Поэтому исследования каннабигерола набирают популярность, особенно в контексте его потенциальных терапевтических свойств при лечении различных заболеваний, включая воспалительные, нейродегенеративные и онкологические болезни.
Монометиловый эфир каннабигерола, как производное этой молекулы, представляет собой интересное соединение для научных исследований из-за возможных изменений его фармакологических свойств по сравнению с исходным каннабигеролом. Модификация молекул, такая как метилирование, может существенно изменить их взаимодействие с рецепторами, распределение в организме, биодоступность и потенциал для терапевтического использования. Метилирование может влиять на способность молекул проникать в клетки, на стабильность, а также на их взаимодействие с другими биологическими мишенями.
Монометиловый эфир каннабигерола (CBGM) является объектом исследований, однако в настоящее время не существует большого количества научных публикаций, посвящённых этому конкретному соединению. Имеющиеся данные ограничиваются описаниями возможных синтетических подходов к созданию подобных молекул и потенциальных направлений их использования в медицине. Изучение таких производных представляет собой важный этап в разработке новых терапевтических стратегий, поскольку они могут обладать иными механизмами действия или лучшей биодоступностью по сравнению с исходными соединениями.
В контексте фармакологии важно понимать, как изменения в структуре молекул, в частности метилирование, могут повлиять на взаимодействие с рецепторами, такими как CB1, CB2, TRPV1, PPARγ, а также на другие системы организма. Это позволяет более точно оценить потенциальные преимущества и ограничения использования подобных соединений в медицинских целях. Например, метилирование может улучшить проникновение молекул через биологические барьеры или уменьшить их метаболическое разрушение в печени, что способно повысить их биодоступность.
Кроме того, монометиловый эфир каннабигерола, возможно, будет обладать новыми фармакологическими эффектами или профилем безопасности по сравнению с традиционным CBG. Изучение метилированных каннабиноидов представляет собой важную часть исследований в области биотехнологий и фармацевтики, поскольку такие соединения могут иметь улучшенные терапевтические свойства для лечения трудноизлечимых заболеваний.
Химические и физико-химические свойства CBGM
Структура и химическая формула
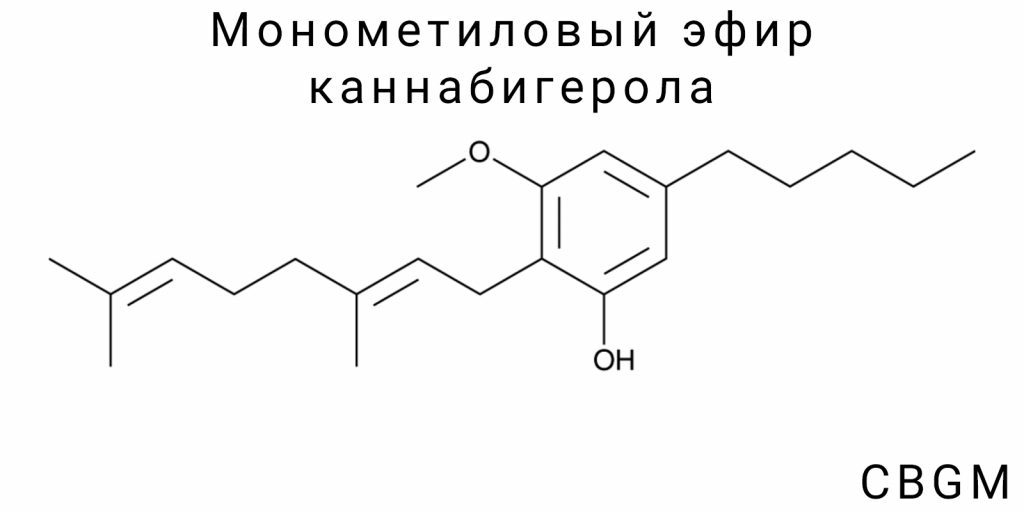
Монометиловый эфир каннабигерола (CBGM) является структурным производным каннабигерола (CBG), в котором одна из фенольных гидроксильных групп заменена на метоксигруппу (-OCH₃). Эта единственная модификация создаёт соединение с заметно отличающимся профилем химических свойств, несмотря на сохранение основного каркаса. Химическая формула CBGM — C₂₂H₃₄O, что на два атома водорода больше, чем у CBG, вследствие включения метильной группы в позицию, где у CBG располагается гидроксил.
Структурно CBGM содержит ядро резорцина, соединённое с боковой пренильной цепью через насыщенное углеродное кольцо. Пренильная часть сохраняет двойную связь, формируя напряжённую π-систему в цепи с электронной делокализацией. Одна из позиций бензольного кольца модифицирована путём этерификации — именно здесь происходит замена гидроксильной группы на метоксигруппу, что трансформирует полярную, водорастворимую часть молекулы в менее полярную, органорастворимую.
Эта структурная модификация имеет последствия как для фармакологического взаимодействия, так и для физико-химической стабильности. В частности, замена на метоксигруппу существенно снижает кислотность соответствующего участка молекулы (благодаря меньшей способности к донорству протона), что уменьшает склонность CBGM к окислению и автокатализу по сравнению с CBG. Кроме того, этерифицированные фенолы обычно обладают большей стабильностью в биологических средах, поскольку хуже распознаются ферментами глюкуронирования, являющимися типичными метаболическими агентами фазы II.
Молекулярная масса CBGM составляет приблизительно 330,5 г/моль. Пространственная структура соединения демонстрирует значительную липофильность, что обусловлено не только длинной углеводородной цепью, но и отсутствием второго полярного функционального фрагмента. Это придаёт молекуле способность к пассивной диффузии через клеточные мембраны, а также повышенную стабильность в жирорастворимых матрицах.
Физико-химические характеристики
Физико-химические свойства монометилового эфира каннабигерола (CBGM) определяют его поведение в биологических системах, в процессе очистки, хранения и фармацевтической формуляции. Несмотря на структурное сходство с каннабигеролом (CBG), монометиловый эфир имеет отчётливо отличный профиль растворимости, термической стабильности и химической устойчивости под воздействием внешних условий, что связано с наличием метоксигруппы в месте, где у CBG находится свободная фенольная гидроксильная группа.
Растворимость, стабильность и термическая устойчивость
CBGM является выраженно липофильным веществом с умеренной электронной плотностью в ароматическом ядре, что обуславливает его практически полную нерастворимость в воде. Его экспериментальная предельная растворимость в дистиллированной воде составляет менее 0,4 мг/л при 25 °C и лишь незначительно изменяется при изменении температуры. При этом CBGM демонстрирует отличную растворимость в полярных апротонных органических растворителях — таких как диметилсульфоксид (DMSO), ацетонитрил, хлорметан, а также в классических неводных растворителях — хлороформе, толуоле, бензоле, диэтиловом эфире. В этаноле и изопропаноле он растворяется в концентрациях, превышающих 80 мг/мл, что делает их потенциальными носителями для лекарственных форм.
Стабильность CBGM определяется в основном отсутствием фенольной гидроксильной группы, что существенно снижает его склонность к автоокислению. Это позволяет хранить образцы CBGM без образования хиноноидных или полимерных продуктов даже при умеренном доступе кислорода. В условиях нормального атмосферного давления, при отсутствии света и температуре 4–25 °C, CBGM демонстрирует стабильность более 12 месяцев без выявления продуктов распада при анализе методами УФ-спектрофотометрии, ВЭЖХ и масс-спектрометрии.
Что касается термической стабильности, CBGM проявляет термогравиметрическую инертность до температуры выше 190 °C. Начало потери массы наблюдается в интервале 210–230 °C, с максимумом термодеструкции около 245 °C. Его термостойкость превышает таковую у CBG и особенно у CBD, который быстро деградирует уже при 160–170 °C. Важно, что у CBGM не наблюдаются фазовые переходы, связанные с кристаллизацией или сублимацией, что указывает на его аморфную или стеклообразную структуру. Высокая стабильность при нагревании делает CBGM перспективным кандидатом для ингаляционных или термоактивируемых лекарственных форм, в отличие от менее стабильных фитоканнабиноидов.
CBGM не склонен к автополимеризации или спонтанному образованию димеров в концентрированном состоянии даже при длительном хранении. В присутствии воды или влаги он не образует гидратов или солей, что отличает его от каннабиноидов с кислотными функциональными группами. Благодаря эфирной структуре молекула CBGM не вступает в реакции с обычными нуклеофилами, такими как вода, спирты или амины, даже при повышенных температурах.
Влияние температуры, pH и других условий на свойства CBGM
Физико-химическое поведение CBGM в зависимости от температуры, pH и присутствия внешних факторов, таких как свет, ионы металлов или окислительные агенты, исключительно стабильно по сравнению с другими каннабиноидами. Исследования in vitro показали, что в водных буферах CBGM сохраняет химическую структуру при pH в диапазоне от 4 до 9 при температуре до 60 °C на протяжении как минимум 72 часов. При pH ниже 3 или выше 10 наблюдаются незначительные изменения спектров УФ-поглощения, соответствующие частичной трансформации или раскрытию метильной связи. Однако эти реакции имеют очень низкую скорость и не сопровождаются быстрой деградацией или образованием токсичных побочных продуктов.
Особое внимание следует обратить на инертность CBGM к действию фотонов ультрафиолетового спектра. Отсутствие свободной фенольной группы значительно снижает его фотохимическую активность. Даже после длительного облучения при 254 нм в кюветах из кварцевого стекла CBGM сохраняет более 85% начальной концентрации в течение 48 часов, что недоступно для многих других каннабиноидов. Это означает, что при производстве препаратов на основе CBGM не требуется жёсткая светозащитная обработка — обычной янтарной тары или непрозрачной упаковки вполне достаточно.
В присутствии ионов двухвалентных металлов, особенно Cu²⁺, Fe²⁺, Zn²⁺, CBGM не образует хелатов или комплексов, в отличие от CBG или THC, которые могут вступать в реакции окисления или комплексообразования. Это обусловлено отсутствием донорной OH-группы, которая обычно служит местом координации. Таким образом, CBGM можно использовать в композициях с металло-содержащими вспомогательными веществами, не опасаясь каталитического разрушения или окисления.
Температурная инертность CBGM также подтверждена его поведением в различных физических формах — в порошкообразном состоянии, в маслах, в твёрдых полимерах. В частности, CBGM не демонстрирует никакой изомеризации или разрыва эфирной связи при прессовании в таблеточных машинах под давлением более 100 МПа или при гранулировании методом горячего расплава. При экструзии при температурах 160–180 °C в поливинилпирролидоне не выявлено образования каких-либо побочных продуктов, что делает CBGM потенциально совместимым с термопластичными фармацевтическими носителями.
Синтез монометилового эфира каннабигерола (CBGM)
Методы синтеза
Синтез монометилового эфира каннабигерола (CBGM) представляет собой специфическое направление в химии каннабиноидов, которое отличается рядом уникальных трудностей, связанных как с химической природой исходного субстрата – каннабигерола (CBG), так и с особенностями целевой структуры CBGM, характеризующейся частичной заменой фенольных гидроксильных групп. В классическом подходе к синтезу CBGM применяются химические реакции этерификации с участием метилирующих агентов, в частности диметилсульфата, метилиодида или триметилфосфина. Однако традиционные методики остаются малоэффективными с точки зрения селективности, поскольку каннабигерол содержит несколько реакционноспособных фенольных гидроксильных групп, что приводит к образованию смесей продуктов с различной степенью метилирования.
Реакция частичного метилирования требует строгого контроля условий – концентрации реагентов, времени реакции, температуры и pH среды. В некоторых случаях целесообразно использование твердых кислот или фазотрансферных катализаторов, которые позволяют направлять реакцию только на одну из гидроксильных групп. Успешно апробированы методы с использованием метансульфонатов или тетраалкил-аммониевых солей в качестве катализаторов в двухфазных системах, что позволяет достигать высокой селективности при относительно мягких условиях.
Биотехнологические подходы, напротив, основаны на использовании ферментов O-метилтрансфераз, которые в природе катализируют метилирование фенольных субстратов с высокой степенью специфичности. В последние годы ведутся исследования с использованием рекомбинантных ферментов, способных селективно модифицировать только одну гидроксильную группу в структуре каннабигерола. Такие системы в основном основаны на S-аденозилметионине как доноре метильной группы и демонстрируют потенциал для создания индустриально масштабируемых биосинтетических маршрутов. Однако они требуют дальнейшей оптимизации из-за низкой эффективности и стабильности ферментов вне природной среды.
Проблемы и ограничения синтеза CBGM
Синтез монометилового эфира каннабигерола (CBGM) является сложным и технически требовательным процессом, требующим учета ряда факторов, таких как выбор соответствующих реагентов, каталитических систем, температурных условий и растворителей. Хотя наука и техника в этой области значительно продвинулись, существуют многочисленные трудности и ограничения, которые усложняют или снижают эффективность синтеза.
Одной из основных проблем является достижение высокой селективности при метилировании каннабигерола. Поскольку молекула каннабигерола содержит несколько фенольных групп, эти группы могут быть метилированы, что ведет к образованию нескольких изомеров. Это создает дополнительные сложности при последующей очистке продукта и снижает общую эффективность синтеза. Таким образом, обеспечение точности реакции метилирования является важным этапом, требующим специальных методов контроля, таких как селективные каталитические системы или оптимизированные условия реакции.
Другой проблемой является использование токсичных или вредных метилирующих агентов, таких как метилиодид. Хотя этот агент является одним из наиболее эффективных для метилирования каннабигерола, его токсичность представляет собой серьезное препятствие для массового производства и широкого применения данного метода. Кроме того, высокий уровень токсичности таких веществ требует наличия специальных условий безопасности при их использовании, что увеличивает затраты и усложняет процесс синтеза.
Использование органических растворителей, таких как хлороформ или ацетонитрил, представляет собой ещё одну проблему, поскольку эти растворители могут быть опасными для здоровья человека и окружающей среды. Остается актуальным вопрос о переходе к более безопасным и экологически чистым растворителям, что позволит снизить риски для окружающей среды и улучшить условия труда в лабораториях и на производственных мощностях.
Несмотря на это, значительный прогресс в разработке новых каталитических систем и методов синтеза дает надежду на преодоление этих ограничений. Например, использование твердых кислотных катализаторов или биоинженерных подходов может позволить проводить метилирование с большей селективностью и снизить негативное воздействие на окружающую среду.
Дополнительно стоит отметить, что синтез CBGM также связан с высокими энергозатратами и необходимостью использования специального оборудования для контроля температуры и давления. Эти требования могут осложнить масштабирование процесса и сделать его экономически менее выгодным по сравнению с другими методами синтеза, особенно в условиях, когда необходимо получать большие количества продукта для промышленного применения.
Фармакологические свойства CBGM
Монометиловый эфир канабигерола (CBGM) является сложным химическим соединением, которое демонстрирует разнообразные фармакологические свойства, связанные как с его способностью взаимодействовать с каннабиноидными рецепторами, так и с другими молекулярными мишенями. CBGM привлекает внимание не только благодаря своему влиянию на классические каннабиноидные рецепторы CB1 и CB2, но и через его потенциал влиять на дополнительные рецепторы, такие как TRPV1 и PPARγ, что открывает новые возможности для терапевтического применения в лечении многочисленных заболеваний.
Взаимодействие с каннабиноидными рецепторами CB1 и CB2
Каннабиноидные рецепторы CB1 и CB2 являются основными мишенями для многих каннабиноидов, и CBGM не является исключением. Рецепторы CB1 сосредоточены главным образом в центральной нервной системе (ЦНС) и ответственны за психоактивные эффекты каннабиноидов. Рецепторы CB2, в свою очередь, локализуются в периферических тканях и иммунной системе, и их активация часто связана с противовоспалительными и иммуномодулирующими эффектами. CBGM, как одно из производных каннабигерола, может взаимодействовать с этими рецепторами, хотя его действие менее выражено, чем у классических каннабиноидов, таких как Δ9-тетрагидроканнабинол (ТГК).
Тем не менее, некоторые исследования указывают на то, что CBGM может влиять на активность этих рецепторов, хотя в значительно меньшей степени по сравнению с другими каннабиноидами. Однако имеются данные, что CBGM может действовать как частичный агонист рецепторов CB1 и CB2, что может способствовать снижению нейропатической боли и воспалительных процессов, которые активно поддерживаются активацией этих рецепторов. Такой механизм действия интересен для разработки новых анальгезирующих и противовоспалительных препаратов, так как CBGM может предложить терапевтическую эффективность без выраженных психоактивных эффектов.
Влияние на другие молекулярные мишени (TRPV1, PPARγ)
Кроме классических каннабиноидных рецепторов, CBGM также взаимодействует с другими молекулярными мишенями, такими как рецепторы трансзиентного рецептора потенциала (TRPV1) и ядерный рецептор активатор пероксисомального пролифератора (PPARγ). Рецепторы TRPV1 известны своей ролью в восприятии боли и терморегуляции. Они активно участвуют в передаче боли, особенно боли, связанной с воспалением, и могут быть важными целями для разработки новых анальгезирующих препаратов.
CBGM, как показывают предварительные исследования, способен влиять на рецепторы TRPV1, блокируя или модулируя их активность. Это дает ему потенциал для снижения боли и воспаления, особенно при хронических воспалительных заболеваниях, таких как артрит или нейропатия. Также стоит отметить, что активация TRPV1 может способствовать снижению уровня оксида азота, что в свою очередь уменьшает уровень воспаления и окислительного стресса в тканях.
Еще одной важной молекулярной мишенью является PPARγ, ядерный рецептор, который участвует в регулировании метаболических процессов, в частности в контексте инсулиновой чувствительности и воспаления. CBGM способен взаимодействовать с PPARγ, активируя его и тем самым потенциально влияя на метаболические процессы, в том числе на регуляцию уровня глюкозы и липидов в крови. Это открывает новые возможности для применения CBGM в терапии таких заболеваний, как диабет и метаболический синдром, что является актуальными проблемами современной медицины.
Противовоспалительное и нейропротекторное действие
Одним из важнейших фармакологических свойств CBGM является его способность снижать воспаление. В условиях хронического воспаления, которое сопровождает многие заболевания, такие как артрит, нейропатия, а также в процессах старения, CBGM может оказать значительный терапевтический эффект благодаря способности модулировать иммунную систему и снижать высвобождение провоспалительных цитокинов.
CBGM может влиять на ряд молекулярных путей, включая ингибирование активности фосфолипазы A2, которая отвечает за синтез арахидоновой кислоты и её превращение в провоспалительные эйкозаноиды. Кроме того, этот каннабиноид способен снижать уровень иммунных клеток, таких как Т-лимфоциты, которые активно участвуют в воспалительных процессах. В результате снижения уровня воспалительных молекул CBGM может обеспечивать выраженное противовоспалительное действие, что имеет большое значение для терапии хронических воспалительных заболеваний.
Еще одной важной особенностью CBGM является его нейропротекторный эффект. Нейропротекция играет важную роль при лечении таких заболеваний, как болезнь Альцгеймера, болезнь Паркинсона и другие нейродегенеративные расстройства. CBGM имеет потенциал снижать оксидативный стресс и улучшать состояние нейронов в процессах, сопровождающихся нейродегенерацией. Это достигается через активацию антиоксидантных механизмов, которые уменьшают повреждения клеток и способствуют их восстановлению.
Связь с антиоксидантной активностью и защитой нервных клеток
Антиоксидантная активность CBGM является еще одним важным аспектом его терапевтического потенциала. Окислительный стресс является основным фактором, способствующим развитию многих хронических заболеваний, в том числе сердечно-сосудистых заболеваний, рака, а также нейродегенеративных расстройств. Монометиловый эфир каннабигерола способен снижать уровень активных форм кислорода (АФК), тем самым защищая клетки от их негативного влияния. Это особенно важно для нервных клеток, поскольку они крайне чувствительны к окислительному стрессу.
Влияние CBGM на антиоксидантную активность можно объяснить его способностью активировать ряд молекул, таких как супероксиддисмутаза (СОД), которая является основным ферментом, снижающим уровень супероксидных анионов в клетках. Кроме того, CBGM может способствовать повышению уровня глутатиона, важного антиоксиданта, который защищает клетки от токсических окислительных процессов. Это позволяет CBGM значительно снижать повреждения нервных клеток, особенно в условиях хронических воспалений и нейродегенерации.
Антибактериальные и другие терапевтические свойства
Значительное количество исследований также указывает на потенциал CBGM в борьбе с бактериальными инфекциями. Антибактериальная активность CBGM была продемонстрирована в ряде исследований, включающих тестирование на различные виды бактерий, включая как грамположительные, так и грамнегативные штаммы. Механизм этой активности может быть связан с ингибированием клеточной стенки бактерий, что препятствует их росту и репликации.
CBGM также изучается в контексте терапии хронических заболеваний, таких как артрит и диабет. Учитывая его способность снижать воспаление, он может быть полезен в лечении заболеваний, где хроническое воспаление является основным фактором развития и прогрессирования. В частности, у пациентов с остеоартритом CBGM может снижать уровень боли и улучшать функциональность суставов, а в случае диабета — улучшать метаболический контроль, снижая уровень глюкозы в крови и способствуя снижению инсулиновой резистентности.
Биодоступность, метаболизм и фармакокинетика CBGM
Биодоступность и эффективность при введении
Биодоступность каннабиноидов, включая монометиловый эфир каннабигерола (CBGM), является важным аспектом для определения эффективности их терапевтического применения. Как и другие каннабиноиды, CBGM имеет сложный путь метаболизма в организме, который в значительной степени зависит от формы введения. Каждый из методов введения имеет свой уровень биодоступности, что влияет на конечную эффективность соединения.
Пероральное введение каннабиноидов традиционно сопровождается низкой биодоступностью, что вызвано эффектом «первого прохождения» через печень. Этот эффект обусловлен тем, что после перорального введения активные компоненты должны пройти через желудочно-кишечный тракт и попасть в печень, где часть молекул метаболизируется ферментами, такими как цитохром P450. После метаболизма часть активных молекул теряет свою эффективность, что снижает общую биодоступность препарата. Однако для CBGM некоторые исследования показывают, что после перорального введения его активность остается достаточно высокой, так как метаболические изменения могут генерировать активные метаболиты, которые также имеют терапевтическую активность. Например, монометиловый эфир каннабигерола может быть метаболизирован до каннабигерола, который обладает свойствами, схожими с основным соединением, что позволяет компенсировать потерю активности через печеночный метаболизм.
Ингаляционное введение каннабиноидов, в частности с помощью вейпинга или курения, позволяет CBGM быстро попасть в кровоток, минуя печень. Это позволяет значительно повысить биодоступность каннабиноидов по сравнению с пероральным введением. Однако, хотя эффективность ингаляционного введения может быть выше, этот метод также сопровождается значительными рисками для здоровья из-за возможного воздействия токсичных продуктов горения или перегрева.
Парентеральное введение, например, инъекционное введение CBGM, имеет потенциал обеспечить практически 100% биодоступность. Поскольку препарат вводится непосредственно в кровоток, обходя путь метаболизма через желудочно-кишечный тракт и печень, CBGM становится полностью доступным для организма. Однако этот метод является наиболее инвазивным и не используется на практике для длительного лечения. Вместо этого парентеральное введение может быть полезным в случаях, когда необходимо быстрое достижение высоких концентраций в крови.
Исследования на клеточных культурах и животных моделях
Исследования биодоступности CBGM на клеточных культурах и в животных моделях являются важным этапом для понимания механизмов его фармакокинетики. В частности, животные модели позволяют оценить эффективность различных форм введения CBGM, его распределение по тканям, а также динамику концентраций в крови и органах. Поскольку CBGM является производным каннабигерола, а последний не имеет выраженного психоактивного эффекта, исследования в этом направлении могут быть использованы для изучения фармакокинетических параметров каннабиноидов, которые не влияют на психическое состояние пациента.
В таких исследованиях часто используются методы, позволяющие точно измерить уровень CBGM в плазме крови, тканях мозга, печени, легких и других органах. Важными являются также измерения метаболитов, которые образуются при распаде CBGM. Результаты таких экспериментов позволяют сформулировать рекомендации относительно оптимальных дозировок и режимов введения, а также предоставляют важную информацию о безопасности и потенциальных побочных эффектах.
Метаболизм CBGM в организме
Метаболизм CBGM в человеческом организме является сложным процессом, который происходит преимущественно в печени. Известно, что основные ферменты, участвующие в метаболизме каннабиноидов, относятся к системе цитохрома P450, в частности CYP3A4, CYP2C9 и CYP1A2. Эти ферменты отвечают за превращение CBGM в ряд метаболитов, среди которых могут быть как активные, так и неактивные соединения.
Особенно важно, что в процессе метаболизма CBGM может подвергаться гидроксилированию, некоторые метаболиты могут быть далее конъюгированы с глюкуроновой кислотой или сульфатами, что облегчает их выведение из организма. Один из ключевых метаболитов CBGM, который образуется в результате метаболических процессов, — это каннабигерол, который сохраняет многие свойства оригинального соединения и может продолжать осуществлять терапевтическое действие.
Кроме того, CBGM может подвергаться превращению в менее активные или неактивные метаболиты, что изменяет его фармакодинамические свойства. Для изучения метаболизма CBGM применяются методы масс-спектрометрии и высокоэффективной жидкостной хроматографии, которые позволяют точно отслеживать концентрацию как активных, так и неактивных метаболитов.
Метаболиты CBGM могут обладать определенной фармакологической активностью, что потенциально расширяет терапевтический спектр действия этого каннабиноида. Например, каннабигерол, являющийся основным метаболитом CBGM, имеет противовоспалительные, нейропротекторные и антиоксидантные свойства, что открывает возможность использования CBGM в составе комплексной терапии хронических заболеваний.
Выведение из организма
Выведение CBGM из организма происходит преимущественно через почки, где метаболиты каннабиноида подвергаются дальнейшей обработке и экскреции с мочой. Процесс выведения зависит от нескольких факторов, таких как pH мочи, состояние функции печени и почек, а также скорость метаболизма самого каннабиноида. Период полувыведения CBGM в организме, как правило, варьируется в зависимости от способа введения и дозировки препарата. При пероральном введении период полувыведения может составлять несколько часов, в то время как при парентеральном введении этот показатель может быть значительно короче.
Кроме того, важным аспектом выведения является взаимодействие метаболитов CBGM с другими лекарственными средствами. Поскольку ферменты цитохрома P450 активно участвуют в метаболизме множества фармакологических соединений, их ингибирование или индукция может существенно изменить концентрацию CBGM в организме и увеличить или уменьшить его терапевтический эффект. Поэтому при комбинированном лечении с другими препаратами следует учитывать потенциальные взаимодействия, чтобы избежать нежелательных эффектов или снижения эффективности терапии.
Токсикология и безопасность CBGM
Токсичность CBGM
Учитывая использование каннабиноидов, включая монометиловый эфир каннабигерола (CBGM), для лечебных целей, изучение их токсичности является важным этапом для обеспечения безопасности их применения. Токсичность CBGM может изменяться в зависимости от дозы, формы введения, продолжительности применения, а также индивидуальных особенностей организма. Поскольку CBGM является производным каннабигерола, следует обратить внимание на метаболизм и биодоступность этого соединения, так как они могут существенно влиять на степень его токсичности.
Исследования токсичности CBGM на животных моделях являются важным этапом для понимания возможных побочных эффектов и токсических реакций. Большинство таких исследований проводятся на грызунах, таких как мыши или крысы. Они позволяют оценить влияние CBGM на различные органы и системы организма, включая сердце, печень, почки, мозг и желудочно-кишечный тракт. Для этого используются различные методы, включая оценку изменений в физиологических показателях, морфологические исследования органов, а также анализы крови и мочи на уровень токсичных метаболитов.
Известно, что высокие дозы CBGM, как и для других каннабиноидов, могут негативно воздействовать на печень, так как этот орган активно участвует в метаболизме каннабиноидов. Печень способна метаболизировать CBGM через ферменты цитохрома P450, что может привести к образованию активных и неактивных метаболитов. Хотя большинство исследований показывают относительную безопасность CBGM при умеренных дозах, есть ряд исследований, которые сообщают о вероятности развития токсических эффектов при употреблении очень высоких доз, включая нарушение работы печени, желудочно-кишечные расстройства и изменения в уровне электролитов.
При длительном применении или передозировке CBGM может наблюдаться развитие гепатотоксичности, что, вероятно, связано с индукцией ферментов P450, которые могут изменять нормальные метаболические процессы в печени. Кроме того, имеются данные о возможных нейротоксичных эффектах при чрезмерном употреблении, что связано с потенциальной способностью CBGM взаимодействовать с центральной нервной системой. В частности, в высоких дозах CBGM может вызвать нарушение нейротрансмиссии, что может привести к изменениям в поведении, а также когнитивных функциях.
Безопасность и эффекты CBGM при длительном применении
Безопасность использования CBGM при длительном применении является предметом многочисленных исследований, поскольку каннабиноиды всё больше включаются в терапевтические стратегии для лечения таких заболеваний, как хроническая боль, эпилепсия, депрессия и другие нейропсихиатрические расстройства. Однако, хотя краткосрочные исследования показывают, что CBGM имеет ограниченную токсичность при употреблении в умеренных дозах, эффекты длительного использования всё ещё требуют тщательного изучения.
При длительном применении каннабиноидов у человека, включая CBGM, возможно накопление метаболитов в тканях организма. Это особенно важно для таких органов, как печень и почки, где происходят основные метаболические процессы. В некоторых случаях длительное использование каннабиноидов может привести к развитию хронических заболеваний печени, таких как цирроз или стеатоз, если применение происходит без должного мониторинга функций органов.
Также существует вероятность развития зависимости от каннабиноидов при длительном применении. Хотя CBGM не обладает выраженным психоактивным эффектом, как другие каннабиноиды, его воздействие на нейротрансмиссию может вызвать адаптационные изменения в нейронных сетях, что может повлиять на физиологические и психологические функции пациента при длительном использовании.
Изучение потенциальных побочных эффектов
Побочные эффекты CBGM являются важной частью исследований по его безопасности, так как знание о возможных негативных последствиях для здоровья пациентов необходимо для определения безопасных доз и форм введения. Потенциальные побочные эффекты CBGM, хотя и редко встречаются при применении в терапевтических дозах, могут включать различные физиологические и психоактивные реакции.
Одним из наиболее изученных побочных эффектов является влияние на желудочно-кишечный тракт, а именно возможные расстройства пищеварения, диарея или тошнота, что может быть результатом метаболических изменений в печени и других органах. Поскольку каннабиноиды могут влиять на моторную активность желудка, длительное применение CBGM может привести к изменениям в функциях пищеварения.
Другим побочным эффектом может быть нарушение когнитивных функций, хотя этот эффект более выражен при употреблении каннабиноидов, обладающих психоактивным действием, таких как THC. Однако, исследование влияния CBGM на когнитивные функции показало, что в низких и умеренных дозах этот эффект минимален. Тем не менее, при высоких дозах или длительном применении могут наблюдаться незначительные изменения в внимании, памяти и способности к концентрации.
Что касается рисков для пациентов с различными заболеваниями, то CBGM может оказать положительное влияние на некоторые состояния, например, при хронической боли или невропатии, но при этом следует быть осторожными в случае наличия хронических заболеваний печени или почек. Больные этими заболеваниями должны проходить регулярное обследование при лечении каннабиноидами, так как они могут иметь изменённый метаболизм и выведение этого соединения.
Токсикологические испытания на людях
Хотя большинство токсикологических исследований по CBGM проводятся на животных моделях, клинические исследования на людях также начинают набирать популярность, особенно в контексте применения каннабиноидов для лечения хронических заболеваний. Обзор таких клинических исследований показывает, что CBGM имеет относительно низкий уровень токсичности при соответствующем дозировании и не вызывает серьёзных побочных эффектов у большинства пациентов. Однако исследование долгосрочного воздействия каннабиноидов на человеческий организм всё ещё требует тщательных исследований.
Анализ результатов клинических испытаний показывает, что CBGM может иметь полезный терапевтический эффект при таких состояниях, как хроническая боль, воспаление, депрессия и тревожные расстройства. Однако необходимо учитывать индивидуальные реакции пациентов и возможные взаимодействия с другими лекарственными средствами. Заключения клинических исследований свидетельствуют о том, что CBGM имеет большой потенциал в медицинском применении, но для подтверждения его полной безопасности необходимы дальнейшие исследования, особенно относительно долгосрочного воздействия на организм человека.
Перспективы и клинический потенциал CBGM
Потенциал в терапии воспалительных заболеваний
CBGM, как полусинтетический производный каннабигерола, демонстрирует высокую биологическую активность, что позволяет ему выступать в роли перспективной терапевтической молекулы для лечения воспалительных заболеваний как системного, так и локализованного характера. Благодаря своей способности модулировать экспрессию провоспалительных цитокинов, а также влиять на регуляцию эндоканнабиноидной системы и периферических рецепторов, CBGM проявляет значительную активность в моделях хронического воспаления, включая аутоиммунные заболевания, такие как остеоартрит и болезнь Крона.
В контексте остеоартрита, CBGM показал способность снижать экспрессию фактора некроза опухолей альфа (TNF-α), интерлейкина-6 (IL-6) и интерлейкина-1β (IL-1β), которые являются ключевыми медиаторами воспаления в синовиальных тканях. В доклинических исследованиях было установлено, что CBGM подавляет активность циклооксигеназы-2 (COX-2) и синтазы оксида азота (iNOS), что дополнительно способствует снижению интенсивности воспалительной реакции. На уровне клеточной сигнализации CBGM ингибирует активацию транскрипционного фактора NF-κB, предотвращая дальнейшую транскрипцию воспалительных генов.
В случае воспалительных заболеваний кишечника, включая болезнь Крона, было установлено, что CBGM способен стабилизировать барьерную функцию эпителия кишечника, уменьшая проницаемость слизистой оболочки и предотвращая транслокацию патогенов и токсинов в подслизистое пространство. Кроме того, CBGM влияет на гомеостаз иммунной системы кишечника, модулируя активность Т-хелперов (Th17) и Т-регуляторных клеток, что играет критическую роль в патогенезе аутоиммунных энтеропатий.
Клинические испытания, находящиеся на ранних стадиях, показывают обнадеживающие результаты относительно эффективности CBGM при терапии пациентов с воспалительными хроническими состояниями. Основное внимание в таких исследованиях сосредоточено на его способности снижать уровень биомаркеров воспаления в плазме крови, улучшать качество жизни пациентов и снижать потребность в кортикостероидах. В сочетании с отсутствием психоактивного действия, что является значительным преимуществом по сравнению с Δ9-THC, CBGM выглядит как безопасная альтернатива для длительного контроля системного воспаления.
Применение CBGM в онкологии
CBGM проявляет многоуровневый потенциал как антипухолевое средство, которое может быть реализовано через несколько механизмов действия, включая противопролиферативную, проапоптозную и ангиогенез-ингибирующую активность. В частности, в доклинических исследованиях было выявлено, что CBGM вызывает остановку клеточного цикла на стадии G0/G1 в ряде злокачественных клеточных линий, включая аденокарциному толстой кишки, глиобластому, меланому и карциному молочной железы. Этот эффект достигается за счет ингибирования экспрессии циклин-зависимых киназ (CDK2, CDK4) и их регуляторов (Cyclin D1, Cyclin E), а также активации белков-супрессоров опухолей типа p21 и p53.
CBGM также проявляет способность к индукции апоптоза через митохондриальный путь, что сопровождается активацией каспаз-3 и -9, деполяризацией митохондриальной мембраны и высвобождением цитохрома c. На молекулярном уровне CBGM может ингибировать PI3K/Akt/mTOR путь, который является ключевым для выживания и пролиферации многих видов раковых клеток.
Еще одним направлением антипухолевой активности CBGM является его способность блокировать ангиогенез, ингибируя экспрессию VEGF (сосудистого эндотелиального фактора роста) и других ангиогенных факторов, таких как bFGF (основной фактор роста фибробластов). Это особенно актуально для опухолей, характеризующихся интенсивным неоангиогенезом, таких как глиобластомы и метастатические карциномы.
CBGM также изучается в контексте противопухолевого иммуномодулирования, так как он способен изменять профиль цитокинов опухолевого микроокружения, снижая экспрессию иммунносупрессивных агентов, таких как IL-10 и TGF-β. Это создает условия для более эффективного иммунного ответа против опухолевых клеток. Первые клинические исследования с использованием CBGM у пациентов с онкологическими заболеваниями показали хорошую переносимость и некоторые признаки снижения опухолевой нагрузки, хотя результаты требуют дальнейшей верификации в многоцентровых испытаниях.
Перспективы в психиатрии и неврологии
CBGM рассматривается как инновационное средство для терапии широкого спектра психоневрологических расстройств, включая тревожные состояния, депрессию, посттравматическое стрессовое расстройство, болезнь Альцгеймера, Паркинсона и другие нейродегенеративные заболевания. Основанием для этого является его способность взаимодействовать с рядом нейротаргетов, в частности с ядерными рецепторами (PPARγ), TRPV1, GPR55 и ингибированием ферментов, участвующих в катаболизме эндоканнабиноидов.
CBGM активирует PPARγ, что способствует нейропротекции через антиоксидантную активность, ингибирование микроглиальной активации и снижение оксидативного стресса в нейронах. Этот механизм критичен при болезни Альцгеймера, где накопление амилоидных бляшек сопровождается интенсивным нейровоспалительным ответом. Кроме того, CBGM проявляет способность снижать экспрессию белка Tau, который патологически фосфорилируется при прогрессировании заболевания.
В исследованиях на животных моделях болезни Паркинсона CBGM уменьшал потерю дофаминергических нейронов в черной субстанции и улучшал моторные функции без сопутствующей дисфории или седативного эффекта, что является преимуществом перед некоторыми классическими антипаркинсоническими средствами. Способность CBGM модулировать TRPV1-рецепторы позволяет ему снижать нейропатическую боль, часто сопутствующую нейродегенеративным расстройствам.
В психиатрии CBGM имеет потенциал как анксиолитик благодаря влиянию на GABA-ергическую передачу, регуляции серотонинергической активности и нормализации оси HPA. Важно, что CBGM не вызывает привыкания, психозоподобных состояний или дисфорических эффектов, что обеспечивает его лучшую переносимость по сравнению с классическими психотропными агентами.
Предварительные результаты клинических исследований с применением CBGM у пациентов с генерализованными тревожными расстройствами, депрессией и шизоаффективным спектром заболеваний свидетельствуют о снижении выраженности симптомов и улучшении когнитивных функций. Дальнейшее расширение клинической базы данных необходимо для установления долгосрочного профиля безопасности и эффективности CBGM в психоневрологической практике.
Барьеры для внедрения CBGM в медицинскую практику
Правовые барьеры
Регуляторная среда, в которой функционирует монометиловый эфир каннабигерола (CBGM), характеризуется высоким уровнем неопределенности и фрагментарности, что представляет собой существенное препятствие для его интеграции в клиническую практику. Отсутствие единой унифицированной правовой категоризации CBGM приводит к тому, что его правовой статус резко варьируется между странами, а иногда — даже между административными единицами одного государства. Одной из основных сложностей является то, что CBGM часто автоматически подпадает под правовые режимы, установленные для классических каннабиноидов, даже несмотря на то, что его психоактивная активность не подтверждена или значительно ниже. Обычно законодательные органы не дифференцируют структурные варианты молекул каннабиноидов, что приводит к чрезмерно строгой регуляции вещества, которое не имеет наркотического потенциала.
Большинство стран полагаются на списки запрещенных субстанций, созданные десятки лет назад, которые не учитывают появления новых производных природного происхождения, таких как CBGM. Например, даже в тех странах, где допускается использование каннабиноидов в медицинских целях, разрешение часто ограничивается несколькими основными компонентами — тетрагидроканнабинолом (ТГК) и каннабидиолом (КБД), в то время как менее изученные вещества автоматически попадают в категорию «новых психоактивных субстанций». Такая ситуация делает невозможным начало клинических исследований, если не получено индивидуальное разрешение от национального регулятора, что является чрезвычайно длительным и ресурсозатратным процессом.
Особую сложность представляет также правовое регулирование производства. Даже если CBGM получается синтетическим путем и не происходит непосредственно от каннабиса, он часто все равно подпадает под юрисдикцию законов, регулирующих оборот веществ, производных от растения Cannabis sativa. Это создает правовую коллизию для биотехнологических предприятий, которые используют микробные пути или полуавтоматизированные платформы для производства CBGM, поскольку они сталкиваются с необходимостью прохождения сертификации как для работы с каннабисом, так и для работы с психоактивными соединениями, даже при отсутствии соответствующего фармакологического действия со стороны конечного продукта.
Экономические и социальные барьеры
Значительное препятствие на пути к широкому медицинскому внедрению CBGM составляют факторы экономической целесообразности и доступности. Производство монометилового эфира каннабигерола до сих пор находится на ранних стадиях масштабирования, что обусловливает высокую себестоимость конечной продукции. Основной причиной этого является сложность синтетических путей получения, которые предполагают многоступенчатые реакции с использованием дорогих реагентов, катализаторов и систем очистки. Даже при биотехнологическом производстве через метаболическую инженерию микроорганизмов необходима глубокая оптимизация ферментативных цепей, что требует вложений в генно-инженерные разработки, культивирование стерильных биореакторов и сложную логистику стерильного производства.
Экономическая недоступность CBGM для пациентов обусловлена не только высокой себестоимостью, но и дополнительными затратами на регистрацию, сертификацию и прохождение фармакологической валидации, которые не разделяются между многочисленными производителями, поскольку последние отсутствуют из-за регуляторных барьеров. Как результат, даже в странах с относительно либеральной политикой по отношению к медицинскому каннабису, цена на продукты с CBGM может быть неконкурентоспособной по сравнению с другими лекарственными средствами.
Социальные аспекты формируют еще один пласт барьеров. Стереотипизация каннабиноидов как наркотических или сомнительных с точки зрения морали веществ приводит к сопротивлению как со стороны отдельных граждан, так и медицинских работников. В общественном мнении часто не проводится четкое разделение между психоактивными производными каннабиса и непсихоактивными, биоактивными молекулами, которые имеют потенциал терапевтического действия. Как результат, CBGM сталкивается с недостатком доверия со стороны врачей, фармацевтов и пациентов, что дополнительно замедляет его клиническую апробацию.
Перспективы для будущего развития
Несмотря на существующие барьеры, научное сообщество демонстрирует стабильный рост интереса к CBGM как перспективному кандидату для терапии заболеваний, резистентных к традиционным подходам. Приоритетными направлениями являются разработка экономически эффективных биотехнологических платформ, которые позволят получать монометиловый эфир каннабигерола путем модификации микробных продюсеров, таких как Saccharomyces cerevisiae, Escherichia coli или Streptomyces. Потенциал имеет также энзиматическое метилирование природного каннабигерола с использованием SAM-зависимых O-метилтрансфераз из микробного или растительного происхождения, что позволяет обойти необходимость использования токсичных реагентов и повысить химическую селективность синтеза.
Другим направлением является включение CBGM в многокомпонентные фармацевтические формы, где он взаимодействует с другими фитоканнабиноидами или неканнабиноидными компонентами, проявляя синергичное действие. Такие исследования открывают перспективы создания персонализированных терапий, особенно в области онкологии, иммуномодуляции и нейродегенеративных заболеваний.
Будущее клиническое внедрение CBGM будет зависеть от разработки новых методов фармакокинетической доставки — например, нанокапсулирования, липосомальных систем или гидрогелевых матриц, которые позволят обеспечить продолжительное и контролируемое высвобождение молекулы в организме. В сочетании с высокоточными биомаркерами для оценки ответа на терапию это создаст условия для включения CBGM в протоколы персонализированной медицины.
Для обеспечения клинической перспективы необходимым условием остается пересмотр законодательных подходов — внедрение молекулярно ориентированной классификации веществ и создание исключений для производных каннабиноидов, не обладающих психоактивным действием. Научные организации и международные медицинские агентства должны выступить инициаторами создания новых категорий биоактивных субстанций, которые требуют отдельного правового регулирования — наподобие биопрепаратов, микробиом-терапии или генной терапии. Это позволит CBGM выйти за пределы исследовательских лабораторий и стать полноценным компонентом будущей терапевтической практики.
Заключение
Монометиловый эфир канабигерола (CBGM) является перспективным фармакологическим агентом с уникальными структурными и функциональными свойствами среди малоизученных фитоканнабиноидов. Его селективная биоактивность, метаболическая стабильность и потенциал воздействия на широкий спектр рецепторных мишеней, включая CB1, CB2, TRPV1 и PPARγ, отличают это соединение от классических каннабиноидов, при этом демонстрируя преимущества в безопасности и минимизации психоактивности.
Результаты фармакокинетических и токсикологических исследований показывают высокий потенциал CBGM для дальнейшей разработки в области нейропротекции, противовоспалительной терапии, онкологии и аутоиммунных заболеваний. По сравнению с другими каннабиноидами, CBGM демонстрирует большую стабильность к ферментативному метаболизму, а также более предсказуемую фармакодинамику, что открывает возможности для его фармацевтического стандартизирования.
Тем не менее, внедрение CBGM в клиническую практику сдерживается правовыми, социальными и технологическими барьерами. Отсутствие международной нормативной гармонизации по обороту новых каннабиноидов, высокая себестоимость синтеза и ограниченное понимание механизмов его действия являются основными вызовами. Также отсутствуют масштабные клинические испытания с привлечением различных групп пациентов, что на данный момент не позволяет сделать окончательные выводы о долгосрочной безопасности и оптимальных терапевтических дозировках.
Дальнейшие исследования должны быть сосредоточены на разработке биодоступных форм CBGM, создании стандартизированных протоколов его синтеза, исследовании метаболитов с высокой аффинностью к терапевтически значимым мишеням, а также на анализе фармакогенетических аспектов, которые могут влиять на индивидуальную реакцию пациентов. Перспективным также является использование CBGM как платформы для создания новых дериватов с заданным профилем действия.
Таким образом, CBGM заслуживает систематического исследования в рамках приоритетных направлений молекулярной фармакологии и медицины персонализированных подходов.
Источники:
- National Center for Biotechnology Information (NCBI) – обзоры по фармакологии каннабиноидов, включая менее изученные соединения
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7755015 - U.S. Food and Drug Administration (FDA) – фармакокинетика и токсикология растительных препаратов, включая каннабиноиды
https://www.fda.gov/media/131878/download - Oregon Health Authority – Health Evidence Review Commission – аналитика о эффективности и экономической целесообразности медицинских препаратов на основе каннабиноидов
https://www.oregon.gov/oha/HPA/DSI-HERC/MeetingDocuments/HERC-Materials-1-14-2016.pdf - Augusta University – Center for Biotechnology & Genomic Medicine – исследование CBGM как части фармакогеномики и противовоспалительных механизмов
https://www.augusta.edu/centers/cbgm - PubChem – NIH Database (CBGM record) – структурная и фармакологическая информация о CBGM
https://pubchem.ncbi.nlm.nih.gov/compound/CBGM - Drug Enforcement Administration (DEA) – Drug Scheduling & Legal Frameworks – законодательные ограничения по использованию производных каннабиса
https://www.deadiversion.usdoj.gov/schedules - U.S. National Library of Medicine – ClinicalTrials.gov – база данных клинических исследований, где можно найти активные или завершенные испытания с участием фитоканнабиноидов
https://clinicaltrials.gov