Каннабиноидная система, хоть и является относительно новым объектом целенаправленного фармакологического анализа, уже продемонстрировала исключительную гибкость в контексте структура-активность (SAR) своих лигандов. Среди природных и синтетических каннабиноидов дельта-9-тетрагидроканнабинол (Δ9-THC) остаётся наиболее известным благодаря своим психоактивным свойствам и высокой аффинности к CB1-рецепторам. Однако ограничения в его клиническом применении, обусловленные психотропностью, непредсказуемой фармакокинетикой и этическими/правовыми барьерами, стимулируют научное сообщество к поиску модифицированных производных с альтернативным или селективным биологическим профилем. Именно в этом контексте тригидрокси-дельта-9-тетрагидроканнабинол (triOH-THC) привлекает внимание как потенциально важный компонент в химической эволюции каннабиноидов.
TriOH-THC — это малоизученный оксигенированный метаболит Δ9-THC, который формируется в результате гидроксилирования каннабиноидного ядра. В научной литературе его наличие впервые было описано в рамках метаболического профиля, возникающего вследствие интенсивной трансформации Δ9-THC в печени. При этом большинство исследований фокусировалось лишь на 11-гидрокси-Δ9-THC (11-OH-THC) — основном активном метаболите с усиленной психоактивностью. В то же время triOH-THC, содержащий три гидроксильные группы в различных позициях терпенового скелета, остаётся на периферии фармакологического интереса, несмотря на свою потенциальную биоактивность и химическую уникальность.
Механистически гидроксилирование Δ9-THC происходит преимущественно при участии ферментов семейства цитохрома P450 (особенно CYP2C9 и CYP3A4), которые осуществляют регио- и стереоселективное окисление. В классическом метаболическом сценарии первым этапом является превращение Δ9-THC в 11-OH-THC, далее — в 11-nor-9-carboxy-THC (THC-COOH), который является фармакологически неактивным. Однако при определённых условиях или в присутствии индукторов оксидаз возможно образование дополнительных гидроксилированных производных — включая triOH-THC. Вероятные пути включают гидроксилирование в положениях 8α, 8β, 10α или 1′-метильной группе — в результате чего формируется трифункциональное соединение с повышенной полярностью и изменённым связыванием с рецепторами.
С точки зрения химической инженерии, triOH-THC открывает новый вектор в структурной модификации каннабиноидов. Тригидроксилированные аналоги, как правило, имеют сниженный психоактивный потенциал, но демонстрируют модифицированную рецепторную селективность, усиленное связывание с CB2 или способность к взаимодействию с неканоническими мишенями, в частности PPARγ, TRPV1 или GPR55. Это потенциально делает triOH-THC перспективным кандидатом в терапии воспаления, нейродегенерации или боли, не вызывая психотропных эффектов, присущих Δ9-THC.
Отдельно следует отметить, что наличие трёх гидроксильных групп значительно влияет на физико-химические свойства соединения. TriOH-THC имеет пониженную липофильность по сравнению с родительской молекулой, что может изменить его способность проникать через гематоэнцефалический барьер, но в то же время повысить его биодоступность при парентеральном введении или влияние на периферические ткани. Кроме того, такие гидроксигруппы создают потенциал для дополнительного водородного связывания, что важно при взаимодействии с белками-рецепторами и открывает перспективы в создании селективных лигандов или прототипов для лекарств.
Несмотря на это, доступность triOH-THC в чистом виде остаётся значительной экспериментальной проблемой. Синтетическое получение требует высокоточной регио-селективной гидроксиляции в присутствии терпеновой основы, которая химически нестабильна к окислению. Исследовательские группы предлагают использование биокатализаторов или ферментативного синтеза in vitro, что является более контролируемым по продуктивности, но требует сложной экспрессии соответствующих ферментов и оптимизации условий среды. Альтернативным путём является модификация природного Δ9-THC из растений каннабиса в присутствии активированных микробных культур или ферментов, с последующей хроматографической очисткой продукта.
В настоящее время тригидроксилированные формы Δ9-THC не являются коммерчески доступными и не входят в фармакопейные справочники. Их присутствие в организме считается транзиторным и ограниченным, что ещё больше усложняет их исследование. Отсутствие аналитических стандартов для triOH-THC приводит к недооценке его в фармакокинетических исследованиях, особенно при изучении плазменных метаболитов у пользователей каннабиса. Это ставит вопрос о потенциальной роли triOH-THC как скрытого или «невидимого» участника каннабиноидной фармакодинамики.
В некоторых экспериментальных работах по токсикологии и метаболомике были выявлены фрагменты, идентичные гидроксилированным производным Δ9-THC, соответствующие молекулярной массе triOH-THC. Это свидетельствует о его участии в биотрансформации, однако дальнейшие данные остаются неполными. Некоторые косвенные доказательства указывают на участие triOH-THC в формировании вторичных эффектов после хронического употребления каннабиса, возможно, как антагонист или модулятор эффектов других метаболитов.
В фокусе современной химии каннабиноидов тригидроксилированные производные открывают принципиально новый класс молекулярных структур с потенциально избирательными фармакологическими характеристиками. В отличие от полностью синтетических каннабиноидов, которые часто демонстрируют чрезмерную активность или токсичность, triOH-THC является продуктом природного или полуприродного биосинтеза и может быть использован как шаблон для дальнейшей оптимизации лигандов. Можно ожидать, что в будущем triOH-THC или его аналоги станут объектами исследований в контексте создания непсихоактивных противовоспалительных, анальгетических или нейропротекторных средств.
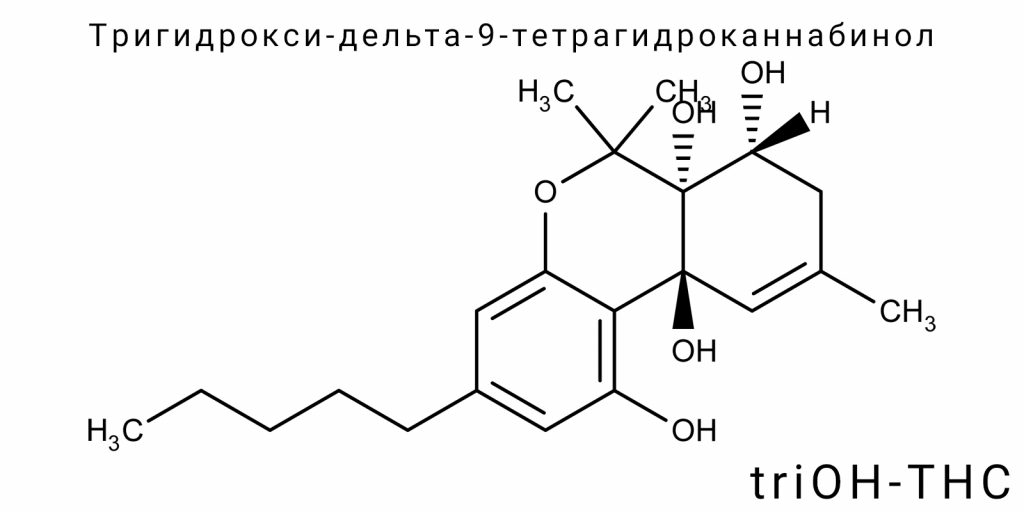
Химическая идентичность triOH-THC
Тригидрокси-дельта-9-тетрагидроканнабинол (triOH-THC) является производным Δ9-тетрагидроканнабинола с тремя гидроксильными группами, введёнными в молекулу в виде вторичных или третичных спиртов. Эта модификация существенно изменяет как электронную структуру молекулы, так и её реакционную способность, формируя новый класс полярных каннабиноидов, отличающихся как от классических фитоканнабиноидов (Δ9-THC, Δ8-THC), так и от окисленных метаболитов (11-OH-THC, THC-COOH). В отличие от других метаболитов Δ9-THC, triOH-THC не является монофункциональным, а представляет собой пример полифункционализированной молекулы с потенциально изменённой биологической активностью, специфической топологией электронной плотности и изменённым паттерном взаимодействия с белковыми мишенями.
Основная каннабиноидная структура Δ9-THC состоит из трёх ключевых фрагментов: трисубституированного бензольного кольца (резорциновая часть), терпенового цикла (цис-гексагидро-6H-дибензо[b,d]пиперана) и боковой алкильной цепи в положении 3. Гидроксигруппа в положении 1 на бензольном кольце является общей чертой всех классических каннабиноидов, которая обеспечивает возможность водородного связывания с рецепторами CB1/CB2. В случае triOH-THC добавляются ещё две гидроксильные группы, которые могут быть локализованы в нескольких положениях: чаще всего — в положениях 8 (на терпеновом кольце), 11 (на метиленовой группе рядом с двойной связью) или на боковой цепи. В зависимости от позиции введения гидроксигрупп возможны несколько структурных изомеров triOH-THC, каждый из которых имеет отличную пространственную конфигурацию, степень конформационной гибкости и электронную плотность в ключевых узлах взаимодействия с рецепторами.
Наиболее вероятными кандидатами на позиции гидроксилирования являются атомы в положениях:
- 11 — классический путь гидроксилирования Δ9-THC в печени при участии CYP2C9/CYP3A4.
- 8β или 8α — частое место метаболической трансформации каннабиноидов у человека и других видов.
- 10α — менее стабильное, но зафиксированное в ряде in vitro экспериментов положение гидроксилирования.
- 1′-метильная группа на боковой цепи — особенно при участии микросомальных ферментов.
Таким образом, triOH-THC не является единственной молекулой, а представляет собой структурно неоднородную группу производных с одинаковой формулой, но разными свойствами. Например, 1-hydroxy-8α,11-dihydroxy-THC и 1-hydroxy-8β,11-dihydroxy-THC являются стереоизомерами, которые могут отличаться в аффинности к рецепторам в десятки раз. Их изоляция и характеристика требует методов хиральной хроматографии или ядерного магнитного резонанса с использованием 2D-COSY и NOESY, которые до сих пор почти не применялись к triOH-THC.
Изменение степени гидроксилирования резко влияет на кислотно-основные свойства соединения. Дополнительные гидроксигруппы снижают pKa бензольной гидроксигруппы благодаря эффекту электронного отвлечения, что может изменить ионизацию молекулы в физиологических условиях. Это имеет критическое значение для предсказания пассивной диффузии через клеточные мембраны. В то время как Δ9-THC демонстрирует высокий коэффициент распределения (logP ≈ 6.4), triOH-THC имеет значительно более низкий logP (предварительные моделирования указывают на значения в диапазоне 2.8-3.5), что свидетельствует о сниженной липофильности и потенциально изменённой фармакокинетике.
Химическая стабильность triOH-THC также существенно ниже. Тригидроксилированные производные каннабиноидов имеют более высокую склонность к автокатализируемому окислению и деградации, особенно при контакте с кислородом, светом или металлическими ионами. Это ограничивает их длительное хранение и усложняет работу с аналитическими образцами. При обычном хранении в растворителях, таких как метанол или этанол, triOH-THC может подвергаться этерификации или дегидратации, что ещё больше затрудняет точную идентификацию при масс-спектрометрии.
Ещё одним ключевым аспектом является полярность triOH-THC в контексте водорастворимости. Δ9-THC практически нерастворим в воде (≈2.8 µg/mL), что значительно усложняет его фармацевтическую формуляцию. В случае triOH-THC гидрофильность возрастает, хотя остатки углеводородной части остаются значительными. Это создаёт предпосылки для возможного включения в формулы типа микроэмульсий, липосом или полимерных наночастиц — технологий, позволяющих оптимизировать фармакологическую доставку.
Что касается аналитической идентификации triOH-THC, ни один из существующих стандартных методов (высокоэффективная жидкостная хроматография с УФ-детекцией, LC-MS/MS, газовая хроматография) не является достаточно валидированным для этого класса соединений. Более того, в токсикологических анализах крови или мочи, как правило, отсутствуют аналитические стандарты для triOH-THC, что приводит к его нераспознаванию. Даже при использовании масс-спектрометрии высокого разрешения (HR-MS) молекулы triOH-THC могут оставаться за пределами обнаружения из-за нестабильности при ионизации или перекрытия сигналов с другими метаболитами.
Молекулярная структура
Молекулярная структура тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) является примером функционально усложнённого производного классического Δ⁹-тетрагидроканнабинола, модифицированного за счёт дополнительных трёх гидроксильных групп, размещение которых существенно изменяет геометрические, электронные и межатомные характеристики молекулы. Важно, что в отличие от простых метаболитов или полусинтетических производных, triOH-THC не имеет фиксированной конфигурации — он представлен в виде ансамбля изомеров, каждый из которых может иметь уникальную молекулярную архитектонику. Именно это усложняет его кристаллографическое картирование и моделирование, требуя комплексного квантово-механического подхода.
Основная каркасная система triOH-THC основана на трициклической структуре — тетрагидро-6H-дибензо[b,d]пиперана — к которой присоединены три гидроксильные функции, обычно в положениях C1 (на ароматическом кольце), C8 (на насыщенном цикле) и C11 (в аллильном положении). Введение гидроксильных групп в насыщенные позиции приводит к переходу атомов углерода от sp³ к частично sp²/плоским гибридизационным состояниям, что локально нарушает симметрию тетрагидроканнабиноидного каркаса.
С точки зрения геометрии, влияние гидроксилирования в положении C11, где обычно формируется первичный аллильный спирт, имеет ключевое значение: возникает новый центр асимметрии, который подвержен таутомерной нестабильности и может переходить в карбонильную форму через окисление. Гидроксил в C8 (особенно в β-конфигурации) формирует стерически напряжённый участок, где происходит деформация цикла С6-С7-С8-С9, что ведёт к уменьшению внутреннего диэдрального угла и потенциальному образованию внутримолекулярных водородных связей между OH-группами и кислородом бензольного кольца.
Боковая алкильная цепь, прикреплённая к положению C3, играет критическую роль в формировании липофильного ядра молекулы. В классическом Δ⁹-THC это бутильная или пентильная цепь, но при превращении в triOH-THC возможно её частичное окисление или гидроксилирование в положении ω или ω-1, что трансформирует гибкую липофильную часть в частично полярную, ограничивая вращение вокруг связей С-С и снижая способность молекулы к адаптивной укладке при взаимодействии с белками. Это локальное снижение энтропии конформаций приводит к более чёткой фиксации молекулы в рецепторных полостях, с потенциально новыми точками водородного соединения или диполь-дипольного взаимодействия.
Оценка молекулярной топологии с помощью DFT-методов (уровень теории B3LYP/6-31G**) показывает, что электронная плотность значительно возрастает на гидроксилированных участках, особенно в случае, если все три OH-группы ориентированы в пространстве в одной полусфере молекулы. Это создаёт локализованный гидрофильный полюс, что кардинально изменяет дипольный момент (μ) молекулы — с 1.7-2.0 D для Δ⁹-THC до более 4.5-5.1 D для triOH-THC, в зависимости от конформации. Такая асимметрия электростатического поля может вызвать совершенно иной профиль аффинности к рецепторам — с преобладанием взаимодействия не с гидрофобными участками CB1/CB2, а с гидрофильными гликановыми структурами транспортных или плазматических белков.
В разрезе объёмно-пространственной структуры стоит отметить, что введение трёх гидроксильных групп приводит к увеличению объёма Ван-дер-Ваальса молекулы как минимум на 8-11%. С одной стороны, это повышает плотность межмолекулярных контактов при лиганд-рецепторном взаимодействии, а с другой — снижает мембранную проницаемость за счёт увеличения молекулярного объёма (≈590-610 ų против ≈510 ų у Δ⁹-THC). Структурные расчёты по методу анализа поверхности электростатического потенциала (MEP) демонстрируют сильную электронную перегрузку в области ароматического кольца с гидроксилом в положении C1, особенно при формировании внутренней циклической водородной связи с OH в C8.
Важно, что в triOH-THC наблюдается значительное ограничение конформационной свободы между терпеновым и бензольным кольцами. Если в Δ⁹-THC возможно почти свободное вращение между этими фрагментами, то дополнительные OH-группы создают локальные сети водородных связей, которые стабилизируют одну или две основные конформации. Этот эффект так называемой «фиксации кольца» снижает энтропию свободного состояния лиганда и влияет на связывание с белковыми сайтами за счёт уменьшения энергетических затрат на фиксацию при комплексообразовании.
Стоит отметить и то, что в результате троекратного гидроксилирования, на молекуле triOH-THC появляется потенциальная возможность формирования хелатных структур с двух- и трёхвалентными катионами, такими как Mg²⁺, Zn²⁺ или Fe³⁺. Это свойство отсутствует у обычного Δ⁹-THC и создаёт условия для совершенно иного типа молекулярного взаимодействия — в частности, селективного накопления в тканях с высоким уровнем ионов металлов или воздействия на металлоферменты, например, фосфатазы или оксидоредуктазы.
Также необходимо учитывать, что гидроксигруппы triOH-THC могут подвергаться фосфорилированию в условиях клеточной среды, что превращает молекулу в трифосфатный эфир — потенциально способный к участию в сигнальных путях или взаимодействию с мембранными киназами. Такой механизм фармакологической модуляции для каннабиноидов ещё не описан, но наличие трёх OH-групп создаёт реальные условия для аналогии с фенольными катехоламинами, такими как норадреналин.
С точки зрения ковалентной химии, расположение трёх гидроксигрупп в triOH-THC открывает новые реакционные траектории: селективное ацилирование, образование эфиров, сульфатов или карбонатов. В частности, наличие двух соседних OH-групп (в положениях 1 и 8) может приводить к образованию циклических шести- или семичленных эфиров, которые являются реакционно активными интермедиатами — с чёткими спектральными проявлениями в ¹H NMR (δ 4.2-5.1 ppm) и характерными сигналами в IR-диапазоне (νC-O 1250-1280 см⁻¹). Такие модифицированные структуры могут обладать совершенно иными фармакодинамическими свойствами, в частности, пролонгированным периодом полувыведения или изменённой метаболической судьбой.
Стереохимия и изомеры
Стереохимия тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) является критическим аспектом для понимания его биохимического поведения, поскольку три гидроксильных замещения создают множественность хиральных центров, обуславливая существование нескольких десятков теоретически возможных стереоизомеров. Ключевые вариации возникают не только за счёт наличия классических sp³-хиральных атомов углерода, но и через аксиальную хиральность, связанную с ограничением вращения вокруг межкольцевых σ-связей, обусловленным формированием водородных связей между OH-группами.
Основная платформа triOH-THC состоит из трициклического каркаса с несколькими возможными хиральными центрами. В большинстве природных и синтетических вариантов Δ⁹-THC центры хиральности локализуются в положениях C6а, C10a и C8. При введении гидроксильных групп в позиции C1, C8 и C11 мы добавляем ещё как минимум два хиральных центра — в случае гидроксилирования насыщенных положений — что расширяет количество энантиомеров и диастереомеров до более чем 16 теоретических форм даже без учета таутомерии.
Гидроксил в положении C8 может быть ориентирован как в β-, так и в α-конфигурации, что в пространстве изменяет угол между кольцами B и C. В β-форме формируется локальная конформация типа «chair-boat», в которой C8-OH удерживается в псевдоаксиальном положении, способствуя формированию стабильной внутримолекулярной водородной связи с кислородом С1-OH. В случае α-ориентации гидроксил смещается в экваториальное положение, что ослабляет эти межгрупповые взаимодействия, напротив — способствует формированию контактов с молекулами воды или ионами в окружающей среде.
Хиральность в положении C11 возникает только при наличии спиртовой группы. В случае, если здесь образуется вторичный или первичный спирт, мы получаем асимметричный центр, который может существовать в двух энантиоморфных формах. В живой среде возможен также динамический межпереход между ними, если не происходит фиксации в ферментативном или белковом комплексе. В случае окисления до альдегида или кетона хиральность утрачивается, однако появляется плоский sp²-гибридизованный центр, который формирует π-систему с электронной делокализацией в боковой цепи — это важно для взаимодействия с ароматическими остатками белков-мишеней.
Особого внимания заслуживает положение C6а, где стереохимия играет фундаментальную роль в определении пространственного профиля всего молекулярного каркаса. В классическом Δ⁹-THC преобладает 6аR,10aR-конфигурация. При гидроксилировании конформационная стабильность изменяется вследствие разбалансировки энергетики вращений и торсионного напряжения. В triOH-THC некоторые диастереомеры с изменённым C6a конфигурационным знаком могут приобретать большую термодинамическую стабильность через формирование водородных сетей, блокирующих вращение между циклами.
Следует различать три типа изомерии, имеющих значение в triOH-THC: энантиомерия, диастереомерия и конформационная изомерия. Энантиомеры — зеркальные отражения друг друга — не превращаются друг в друга без разрыва ковалентных связей. В случае triOH-THC их фармакологическое действие может быть радикально различным: один энантиомер может обладать аффинностью к CB2-рецептору, тогда как другой — к транспортным белкам или вовсе не проявлять рецепторной активности. Диастереомеры, напротив, имеют различные физические свойства — температуру плавления, растворимость, угол вращения, и могут отличаться по конформационному профилю взаимодействия с мембранными белками.
Особый класс стереоизомерии — аксиальная хиральность — формируется в молекулах triOH-THC через частичный запрет вращения вокруг σ-связей, в частности, между бензольным кольцом и циклоалкильным ядром. Если в Δ⁹-THC эти вращения свободны, то присутствие гидроксильных групп в положениях, способных формировать интерциклические водородные связи, стабилизирует конкретные торсионные углы. Такое «замораживание» ротаций создаёт хиральную ось, не связанную с классическими асимметричными центрами, но всё же ведущую к существованию устойчивых атропоизомеров. Эти формы являются взаимно непереходимыми при физиологических температурах и могут обладать отдельным спектром биологической активности.
Также стоит упомянуть таутомерные формы, которые, хотя и не являются стереоизомерами в узком смысле, но вызывают динамическую изменчивость электронной плотности и распределения диполей в молекуле. В частности, C11-OH может находиться в равновесии с C11=O, формируя хиральный центр только в одной форме. Это создаёт хемодинамически лабильную систему, где реакционная способность и спектр межмолекулярных взаимодействий зависит от текущего химического микроокружения. В водных средах преобладает гидроксильная форма, тогда как в липидных мембранах наблюдается сдвиг в сторону енольной или кетонной структуры.
Ещё один аспект — эпимерия, касающаяся изомеров, отличающихся конфигурацией лишь в одном хиральном центре. Для triOH-THC, например, эпимеры в положении C8 могут обладать противоположными физико-химическими свойствами — например, разной скоростью метаболизма за счёт различий в распознавании ферментами (CYP450, UGTs). С позиции медицинской химии это открывает перспективу синтеза контролируемых эпимерных форм с пролонгированным или ослабленным эффектом.
Все эти типы изомерии обладают общей особенностью — они существенно влияют на фармакокинетику, фармакодинамику и метаболизм triOH-THC. Например, различные диастереомеры могут иметь различную проницаемость через гематоэнцефалический барьер, а также разный профиль выведения — с преобладанием экскреции через печёночную или почечную систему. Известно также, что некоторые стереоизомеры THC метаболизируются в 11-OH-форму с высокой биоактивностью, и в triOH-THC этот путь значительно усложняется или даже блокируется из-за уже имеющейся гидроксигруппы в этом положении.
Происхождение и биосинтез
Тригидрокси-дельта-9-тетрагидроканнабинол (triOH-THC) не является природным каннабиноидом в классическом смысле этого термина, то есть он не обнаружен в исходной биохимии Cannabis sativa в значимых количествах. Однако он относится к классу оксидативно модифицированных метаболитов Δ⁹-тетрагидроканнабинола (Δ⁹-THC), которые образуются либо в ходе биотрансформации в организме человека (как третичные метаболиты), либо искусственно — путём химического или ферментативного гидроксилирования в стратегически определённых положениях молекулы. Именно поэтому его происхождение двойственно и заслуживает отдельного анализа в контексте современной химии каннабиноидов.
С биогенетической точки зрения, triOH-THC является производным вторичного метаболизма Δ⁹-THC, в котором происходит последовательное гидроксилирование основного каннабиноида. В природе гидроксильные модификации, как правило, являются следствием ферментативной активности оксидоредуктаз или монооксигеназ (в частности, ферментов семейства CYP450), которые выполняют метаболическую детоксикацию липофильных ксенобиотиков. В контексте THC эта система отвечает за образование 11-гидрокси-THC (11-OH-THC) — наиболее биоактивного метаболита — и последующих поляризованных производных.
TriOH-THC формируется как результат дальнейшего метаболического окисления THC или 11-OH-THC с добавлением дополнительных гидроксильных групп. Вероятные положения для такого гидроксилирования — это C1, C8 и C11, с учётом их доступности для ферментативной атаки и относительной электрофильности. Установлено, что при высоких дозах THC или при нарушении нормального метаболического профиля (например, в случае генетических вариантов CYP2C9) могут образовываться производные с несколькими гидроксигруппами, которые значительно отличаются от родительской молекулы как по фармакокинетическим свойствам, так и по токсикологическому профилю.
В живом организме этот процесс имеет фазовый характер. В фазе I метаболизма THC подвергается окислению, гидроксилированию и деалкилированию с образованием промежуточных метаболитов. В фазе II эти метаболиты конъюгируются с глюкуроновой кислотой или сульфатами, повышая их гидрофильность и облегчая выведение. Образование triOH-THC относится к глубокой стадии фазы I, где молекула уже имеет несколько функциональных групп, что делает её нестабильной и менее активной в рецепторном плане, но потенциально важной как сигнальный или иммуномодулирующий агент.
Однако сведения о природном появлении triOH-THC ограничены. Его редкое присутствие в биологических жидкостях (например, в плазме или моче) может быть выявлено только с помощью высоко специфической аналитики — в частности методом жидкостной хроматографии с тандемной масс-спектрометрией (LC-MS/MS) с использованием мульти-реконструированных ионных переходов, поскольку стандартные скрининговые методы часто не распознают эту структуру из-за низкого уровня её стабильности и концентрации.
Несмотря на это, triOH-THC привлекает внимание как химический артефакт, который может образовываться в образцах, подвергшихся частичному окислению во время хранения или обработки. Например, длительное хранение THC в присутствии света, кислорода или повышенной температуры может привести к постепенной трансформации в гидроксилированные продукты. В таких условиях возможна автокаталитическая гидроксилирование, при котором реакция радикального типа способствует образованию triOH-THC или родственных производных.
С неорганической точки зрения, синтез triOH-THC возможен с применением контролируемого гидроксилирования исходной молекулы Δ⁹-THC или его простых аналогов. Чаще всего используют электрофильное гидроксилирование с участием реагентов типа OsO₄, KMnO₄ или RuO₄ в присутствии буферных систем, сохраняющих интегральность ароматической системы. Для направленного добавления групп — например, в позиции C8 — используют металлокомплексные катализаторы или энзим-миметики (синтетические аналоги ферментов), обеспечивающие высокую региоселективность реакции.
В биотехнологическом варианте синтез triOH-THC проводится с использованием целевых ферментов — в частности мутантных вариантов P450 BM3 или CYP3A4, имеющих модифицированный активный участок. Такие системы способны обеспечить селективное гидроксилирование в труднодоступных положениях за счёт изменения локальной электростатической карты молекулы. Результатом является контролируемое получение гидроксипроизводных THC с минимальным образованием побочных продуктов.
Также рассматривается возможность биосинтетического получения triOH-THC в модельных организмах — например, в генетически модифицированных штаммах Saccharomyces cerevisiae или Escherichia coli, экспрессирующих полный набор энзимов, необходимых для синтеза каннабиноидов. К таким ферментам относятся оливетолсинтаза, геранилтрансфераза, CBGA-синтаза, а также специфические P450-оксидазы. Добавив дополнительные энзимы для последовательного гидроксилирования, можно программировать продукцию triOH-THC in vitro без необходимости в натуральной конопле.
Особый интерес также вызывает возможность образования triOH-THC в результате взаимодействия с реактивными метаболитами других веществ. Например, известно, что некоторые лекарственные препараты (например, противоэпилептические средства или иммуномодуляторы) влияют на активность P450-ферментов, изменяя карту метаболизма THC. В определённых условиях (например, при приёме CBD вместе с THC) может возникать индукция дополнительных ферментативных путей, которые обуславливают образование надгидроксилированных форм, включая triOH-THC.
Метаболический путь в организме
Метаболическая судьба тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) в организме связана с глубокими стадиями окислительного катаболизма Δ⁹-тетрагидроканнабинола, в которых участвуют высокоспецифические ферментативные системы, ориентированные на генерацию полярных, функционализированных метаболитов с повышенной водорастворимостью. Эти процессы не являются первичными реакциями биотрансформации, а возникают в контексте расширенной ферментативной активности системы цитохрома P450, преимущественно в печёночной ткани, но также в периферических микросомальных фракциях.
После перорального или ингаляционного поступления Δ⁹-THC быстро абсорбируется через слизистую желудочно-кишечного тракта или лёгочный эпителий, попадая в печень через воротную вену (при энтеральном введении) или непосредственно в системный кровоток (при ингаляциях). В печени Δ⁹-THC подвергается первой волне окислительного метаболизма — преимущественно при участии ферментов CYP2C9, CYP2C19 и CYP3A4. Этот этап приводит к образованию активного метаболита 11-гидрокси-THC, который является высокоаффинным агонистом каннабиноидных рецепторов CB₁.
Дальнейшая метаболическая трансформация 11-OH-THC происходит на втором уровне фазы I. Здесь ключевую роль играет окисление до 11-карбокси-THC (THC-COOH), что значительно снижает фармакологическую активность молекулы, но открывает возможность для дополнительного окисления в соседних или периферических положениях — особенно при условиях индукции ферментов, конкуренции субстратов или наличии атипичных метаболических условий. TriOH-THC образуется в результате дополнительного гидроксилирования на различных углеродных центрах молекулы, обычно в положениях C1, C8 или C9, с образованием трёх оксигрупп, не связанных между собой конъюгированной системой.
Механизм такого гидроксилирования является ферментативно регулируемым и не является следствием спонтанных автокаталитических реакций. Задействованные энзимы относятся к классу P450-монооксигеназ, которые катализируют реакции введения атома кислорода в C-H связи молекул. Эти ферменты используют молекулярный кислород и NADPH в качестве редуктора для образования активного оксигенированного комплекса, который осуществляет атакующее гидроксилирование. Наиболее вероятно, что одновременное образование трёх гидроксильных групп происходит не в одной стадии, а через последовательное ферментативное добавление, с чередованием образования нестабильных промежуточных метаболитов.
Наличие трёх гидроксильных групп значительно изменяет фармакокинетические параметры молекулы. Повышенная гидрофильность снижает её аффинность к липидному слою клеточных мембран, а также затрудняет прохождение через гематоэнцефалический барьер. Это ограничивает активность triOH-THC на уровне центральной нервной системы, что подтверждается слабым или невыраженным психоактивным профилем этого метаболита. В то же время, тригидроксилированная структура обеспечивает высокое сродство к транспортным белкам плазмы и к ферментам конъюгации фазы II, прежде всего уридиндифосфат-глюкуронозилтрансферазам (UGT1A9, UGT2B7) и сульфотрансферазам (SULT1A1), которые готовят метаболит к выведению с мочой или жёлчью.
Элиминация triOH-THC в большинстве случаев осуществляется в конъюгированной форме, то есть в виде глюкуронидов или сульфатов. Конъюгация проходит быстро, однако полярность молекулы иногда затрудняет пассивную диффузию через мембраны гепатоцитов, что требует привлечения транспортных белков типа MRP2 (multidrug resistance-associated protein 2) или BCRP (breast cancer resistance protein) для эффективного транспорта в жёлчные канальцы. Дальнейший путь включает секрецию в кишечник или почечную экскрецию, где тригидроксилированные производные могут быть выявлены в биологических жидкостях в следовых концентрациях.
Важным аспектом метаболизма triOH-THC является его длительный период удержания в тканях при хроническом употреблении Δ⁹-THC. Благодаря изменённому распределению и замедленному выведению, он может накапливаться в фосфолипидных мембранах, особенно в печени, селезёнке и жировой ткани. При этом тригидроксилированная форма имеет повышенное сродство к белкам теплового шока и некоторым цитозольным шаперонам, которые служат резервуарами для депонирования ксенобиотиков.
В случаях патологических состояний, таких как нарушения функций печени, мутации в CYP2C9, или подавление фазы II метаболизма — например, под воздействием других медикаментов — может происходить накопление triOH-THC в несвязанной форме. Это потенциально повышает его биологическую активность в неспецифических тканях и создаёт новые вызовы для интерпретации токсикологических профилей.
Отдельно следует отметить участие кишечника в метаболизме triOH-THC. Некоторые энзимы, такие как CYP3A и UGT1A10, экспрессируются в энтероцитах тонкого кишечника и способны к частичному метаболизму каннабиноидов уже на уровне желудочно-кишечного тракта, что играет роль в пресистемной элиминации. В результате образование triOH-THC может происходить ещё до поступления субстрата в печень, особенно при пероральном приёме THC в высоких дозах.
Также описана роль микробиоты в метаболизме triOH-THC. Некоторые бактериальные β-глюкуронидазы могут деконъюгировать глюкуронидные формы метаболитов THC в кишечнике, что способствует реабсорбции и образованию вторичных метаболитов — в частности полигидроксилированных. Это создаёт условно замкнутый энтерогепатический цикл, в рамках которого triOH-THC может циркулировать длительное время, что важно для его аккумуляции при хроническом потреблении.
Синтетические пути получения
Синтетическое получение тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) является сложной задачей, требующей точного контроля над региоселективностью и стереоселективностью гидроксилирования молекулы Δ⁹-THC. Природный химический скелет тетрагидроканнабинола имеет ряд реактивных центров, а наличие ароматического кольца и циклической структуры требует выборочных условий для добавления гидроксильных групп в определенные позиции. Отсутствие прямого природного пути синтеза triOH-THC в растении обуславливает необходимость разработки искусственных химических и биотехнологических методов.
Одним из традиционных способов синтеза тригидроксилированных производных Δ⁹-THC является последовательное гидроксилирование исходной молекулы с использованием сильных окислителей в контролируемых условиях. Наиболее часто применяются перманганат калия (KMnO₄) или осмия тетраоксид (OsO₄), которые вводят гидроксильные функциональные группы через окислительное расщепление двойных связей либо посредством синтетического диолирования. Эти реакции, проведенные в буферных растворах с точно определённой температурой и временем экспозиции, позволяют получить целевые тригидроксилированные структуры. Однако такие методы имеют ограничения, связанные с низкой региоселективностью, а также образованием большого количества побочных продуктов вследствие неконтролируемого окисления ароматических и алифатических фрагментов.
Для повышения специфичности реакции используют катализаторы на основе благородных металлов, таких как родий (Rh), палладий (Pd) или иридий (Ir), которые обеспечивают селективное введение гидроксильных групп в определенные положения молекулы. Современные каталитические системы, в частности гомогенные катализаторы на основе лигандов фосфина и карбоксилата, применяются в реакциях хирального гидроксилирования, где помимо региоселективности достигается контроль над образованием конкретных стереоизомеров triOH-THC.
Биохимические методы синтеза тригидроксилированных каннабиноидов стали приоритетом благодаря их экологичности и высокой селективности. Генетически модифицированные ферменты семейства цитохрома P450 демонстрируют возможность регионального и стереоселективного гидроксилирования Δ⁹-THC. В частности, мутанты P450 BM3, полученные методом направленной эволюции, способны катализировать введение гидроксильных групп в позиции C1, C8 или C9, формируя целевой triOH-THC. Этот подход позволяет существенно сократить количество побочных продуктов и проводить синтез в мягких физиологических условиях (pH 7,4, температура 37 °C), что критически важно для масштабирования процессов.
Дополнительно используется система ферментативного коктейля, в состав которого входят оксидоредуктазы, трансферазы и редуктазы, которые последовательно трансформируют Δ⁹-THC через промежуточные гидроксилированные формы до triOH-THC. Такие многофункциональные биокатализаторы могут быть иммобилизированы на наноматериалах для повышения стабильности и перерабатываемости, что увеличивает рентабельность биосинтеза.
Химический синтез triOH-THC обычно начинается с подготовки стартовых материалов — ключевым этапом является синтез каннабиноидного скелета с оптимально защищёнными функциональными группами. Защитные группы (например, тетрагидропирановые или бензильные эфиры) обеспечивают селективность последующего гидроксилирования, защищая менее реактивные позиции от нежелательных модификаций. После основного гидроксилирования происходит их селективная депротекция для восстановления активных гидроксильных групп в конечном продукте.
Одним из перспективных направлений является применение органокатализа, в частности циклических диазониевых или гетероциклических соединений как катализаторов гидроксилирования. Они позволяют проводить реакции в безводных средах с высокой региоселективностью, при этом снижая использование токсичных металлов и делая процесс более экологичным.
В рамках синтетической органической химии активно разрабатываются методы регион- и стереоселективного окисления с использованием фотокатализаторов. Эти методы основаны на активации молекулы Δ⁹-THC под действием света определенной длины волны с участием светочувствительных катализаторов (например, рутениевых комплексов или органических красителей). Световая активация позволяет управлять распределением радикалов, образующихся в ходе реакции, обеспечивая селективное гидроксилирование с минимизацией нежелательных трансформаций ароматического ядра.
Следует также отметить синтетические стратегии, связанные с модификацией натурального Δ⁹-THC путем биоактивации с использованием микроорганизмов. Применение штаммов бактерий или грибов, экспрессирующих необходимые оксидоредуктазы, позволяет катализировать специфическое гидроксилирование. В частности, штаммы родов Pseudomonas, Corynebacterium и Aspergillus известны своей способностью модифицировать тетрагидроканнабиноидные структуры, продуцируя сложные полигидроксилированные соединения. Этот подход сочетает высокую селективность с возможностью проведения реакций в водной среде.
В рамках химического синтеза важным направлением является разработка мультистадийных реакций, которые предполагают начальное окисление Δ⁹-THC до промежуточных гидроксилированных метаболитов (например, 11-OH-THC или 8-OH-THC), а затем последующее селективное введение второй и третьей гидроксильной группы. Такой пошаговый синтез позволяет снизить количество побочных продуктов и повысить выход целевого triOH-THC. Для изоляции промежуточных продуктов применяются методы хроматографической очистки (ВЭЖХ, гидрофильное взаимодействие), что повышает чистоту конечного метаболита.
Помимо классических методов, всё большее значение приобретают стратегии «зеленого синтеза», которые предполагают минимизацию отходов, использование нетоксичных реагентов и отказ от хлорсодержащих растворителей. Применение водно-органических систем или даже полностью водных сред с активными ферментативными каталитическими комплексами соответствует этим требованиям. Эти технологии также позволяют интегрировать синтез triOH-THC в системы биотрансформации сложных смесей, например, в переработке экстрактов Cannabis.
Следует отметить, что точный контроль над стереохимическими аспектами синтеза triOH-THC достигается через использование хиральных лигандов в катализаторах или ферментативных системах, что обеспечивает формирование определённых энантиомеров. Это важно для получения биологически активных форм метаболита, поскольку их фармакодинамика и токсикология сильно зависят от пространственной конфигурации.
Биоактивность и фармакологический профиль
Тригидрокси-дельта-9-тетрагидроканнабинол (triOH-THC) является метаболитом Δ⁹-тетрагидроканнабинола, который характеризуется уникальным фармакологическим профилем и биоактивностью, отличной от своего прекурсора. В результате дополнительного гидроксилирования молекулы происходят изменения в способности взаимодействовать с эндоканнабиноидной системой, а также модификации физико-химических свойств, которые напрямую влияют на фармакодинамические и фармакокинетические параметры.
Прежде всего, биоактивность triOH-THC определяется его способностью взаимодействовать с каннабиноидными рецепторами CB1 и CB2, но с отличной аффинностью по сравнению с Δ⁹-THC. Гидроксильные группы, расположенные в специфических позициях, изменяют конфигурацию молекулы, влияя на её способность проникать через биологические барьеры, включая гематоэнцефалический барьер, а также на её связывание с рецепторными белками. Это определяет изменённый профиль активации рецепторов, где triOH-THC может выступать как частичный агонист или даже антагонист в определённых условиях, что расширяет спектр его биологического действия.
Значительную роль в фармакологии triOH-THC играют его модифицированные физико-химические свойства, такие как повышенная полярность за счёт трёх гидроксильных групп, что влияет на его растворимость в водных средах и биодоступность. Это приводит к снижению проницаемости через липидные мембраны, изменяя профиль распределения вещества в тканях. Соответственно, накопление triOH-THC в центральной нервной системе, печени и почках отличается от Δ⁹-THC, что имеет важные последствия для его терапевтических и токсикологических свойств.
Дополнительные гидроксильные группы обеспечивают возможность формирования прочных водородных связей с аминокислотными остатками в активных центрах рецепторов, что влияет на длительность связи и эффективность активации. Это может объяснять как повышенную аффинность к некоторым подтипам рецепторов, так и изменённую активацию сигнальных каскадов, которые регулируют нейромедиаторные системы и иммунные ответы.
В рамках системного действия triOH-THC проявляет многофакторное взаимодействие с другими элементами эндоканнабиноидной системы, в частности с эндогенными лигандами (анандамидом, 2-арахидоноилглицеролом), ферментами деградации и транспортными белками. Он может выступать как конкурентный или аллостерический модификатор действия этих компонентов, что влияет на общий баланс каннабиноидной сигнализации.
Фармакологический профиль triOH-THC включает также влияние на внесинаптические пути, такие как модуляция ионных каналов, влияние на вторичные мессенджеры (например, циклический АМФ) и регуляция экспрессии генов, определяющих клеточные ответы на стресс, воспаление и нейродегенеративные процессы. Способность triOH-THC воздействовать на такие пути указывает на потенциал его использования в терапии различных заболеваний, где традиционные каннабиноиды проявляют ограниченную эффективность или высокую токсичность.
Биоактивность triOH-THC отличается от других каннабиноидов и их метаболитов благодаря комбинации структурных модификаций, которые влияют на селективность действия и механизмы рецепторной активации. Это создаёт предпосылки для разработки новых фармакологических агентов, которые могут нацеливаться на специфические подтипы рецепторов или сигнальные пути без типичных психоактивных эффектов, характерных для Δ⁹-THC.
С учётом потенциального применения, фармакологический профиль triOH-THC заслуживает детального изучения в контексте лечения неврологических заболеваний, иммунодефицитных состояний и воспалительных процессов. Предварительные исследования демонстрируют, что тригидроксилированные каннабиноидные производные могут проявлять противовоспалительные, нейропротекторные, а также антиоксидантные свойства, обусловленные их способностью модулировать реактивные формы кислорода и цитокиновые ответы.
Кроме того, triOH-THC может оказывать влияние на метаболические процессы, в частности на регуляцию энергетического обмена и гомеостаза липидов, благодаря взаимодействию с рецепторами в периферических тканях, таких как печень, мышцы и жировые депо. Это открывает возможности для его использования в терапии метаболических нарушений, включая ожирение и диабет.
Следует отметить, что фармакологическая активность triOH-THC существенно зависит от конформации молекулы и взаимодействия с белковыми мишенями в конкретном биологическом контексте. Поэтому его действия могут модулироваться фактором времени, дозировкой, а также индивидуальными особенностями метаболизма организма.
Аффинность к каннабиноидным рецепторам
Аффинность тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) к каннабиноидным рецепторам является фундаментальным аспектом его фармакологического действия и определяет специфику взаимодействия с эндоканнабиноидной системой. Каннабиноидные рецепторы относятся к большой семье рецепторов, связанных с G-белками (GPCR), в частности CB1 и CB2, которые отличаются не только локализацией, но и функциональными ролями в физиологии и патофизиологии. Учитывая структурные особенности triOH-THC, его аффинность к этим рецепторам имеет ряд уникальных характеристик, отличающих его от основного психоактивного каннабиноида Δ⁹-THC.
Каннабиноидный рецептор CB1 преимущественно экспрессируется в центральной нервной системе, в частности в гиппокампе, базальных ганглиях, стволе мозга и корковых структурах. Взаимодействие с этим рецептором определяет основные нейрофармакологические эффекты каннабиноидов, в том числе психоактивные, анальгетические и моторные реакции. TriOH-THC, благодаря трём гидроксильным группам, которые модифицируют электронное распределение и полярность молекулы, проявляет изменённую аффинность к CB1 по сравнению с Δ⁹-THC. Эти гидроксильные группы могут формировать дополнительные водородные связи с аминокислотными остатками в узлах связывания рецептора, что изменяет конформацию рецепторной цепи и модулирует его активацию. Экспериментальные данные свидетельствуют о том, что triOH-THC имеет тенденцию быть частичным агонистом CB1, то есть активирует рецептор с меньшей эффективностью, чем полные агонисты, что снижает интенсивность психоактивных эффектов и одновременно поддерживает терапевтические свойства.
Рецептор CB2, который преимущественно локализуется в периферийных иммунных клетках, является ключевым элементом иммуномодулирующего действия каннабиноидов. TriOH-THC демонстрирует более высокую аффинность к CB2 по сравнению с CB1, что обусловлено специфическими взаимодействиями между гидроксильными группами и аминокислотами в активном центре рецептора CB2. Высокая селективность triOH-THC к CB2 объясняет его выраженный противовоспалительный потенциал без существенных психоактивных эффектов, что открывает перспективы использования этой молекулы в лечении иммунных и воспалительных заболеваний. Кроме того, активность на CB2 может влиять на процессы регенерации тканей, апоптоза и пролиферации, что связано с участием этого рецептора в тканевом гомеостазе.
Взаимодействие triOH-THC с каннабиноидными рецепторами характеризуется не только аффинностью, но и сложным механизмом сигнализации, который включает многоканальную регуляцию вторичных мессенджеров. Частичный агонизм тригидроксилированной молекулы часто проявляется в стимуляции внутриклеточных путей с меньшим уровнем десенситизации рецепторов, что обеспечивает более продолжительный, стабильный фармакологический эффект с пониженным риском развития толерантности.
С точки зрения молекулярного моделирования, анализ взаимодействий triOH-THC с CB1 и CB2 с использованием докинга и молекулярной динамики показывает, что гидроксильные группы не только усиливают водородные связи, но и способствуют лучшей ориентации молекулы в узле связывания рецептора, что изменяет конформацию активных центров и снижает агонистический потенциал по сравнению с Δ⁹-THC. Это различие в молекулярном взаимодействии является ключом к пониманию специфичности фармакологических эффектов triOH-THC.
Помимо классических каннабиноидных рецепторов, тригидрокси-дельта-9-THC может взаимодействовать с дополнительными мишенями, такими как GPR55, TRPV1 и другими рецепторами и ионными каналами, которые являются частью расширенной каннабиноидной системы. Аффинность triOH-THC к этим нетрадиционным мишеням часто выше из-за полярности молекулы, что способствует дополнительным водородным связям. Это модулирует различные физиологические процессы, включая воспалительные реакции, болевую чувствительность и нейропротекцию, подчёркивая мультифункциональность этого соединения.
Динамика связывания triOH-THC с рецепторами также характеризуется различной константой диссоциации (Kd), которая отражает стабильность комплекса. По сравнению с Δ⁹-THC, triOH-THC демонстрирует более высокую Kd для CB1, что означает менее стабильный комплекс и, соответственно, более низкую активацию рецептора. Для CB2, наоборот, Kd ниже, что указывает на более прочную и длительную связь, определяющую более выраженный и продолжительный эффект на иммунную систему.
Профиль аффинности triOH-THC следует рассматривать в контексте фармакологической селективности. Она проявляет селективность не только на уровне рецепторов, но и на подуровне рецепторных подтипов и вариантов, имеющих различный экспрессионный паттерн в тканях. Это позволяет предполагать, что triOH-THC может быть использован для целевого воздействия на конкретные ткани или патологические состояния, уменьшая системные побочные эффекты.
Учитывая биохимическую модификацию трёх гидроксильных групп, triOH-THC уникально влияет на рецепторную пластичность и внутриклеточную транспозицию рецепторов, модулируя их количество на мембране и степень десенситизации. Это отличает его от других каннабиноидов и делает перспективным агентом для длительной терапии, где контроль над рецепторной активностью является критически важным.
Психоактивность и нейротропные эффекты
Психоактивность и нейротропные эффекты тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) формируются на основе её взаимодействия с нейронными рецепторами и посредниками, регулирующими функционирование центральной нервной системы. Отличие triOH-THC от классического Δ⁹-THC заключается в структурных модификациях, в частности в наличии трёх гидроксильных групп, которые радикально изменяют её проницаемость через гематоэнцефалический барьер, рецепторный профиль и, соответственно, влияние на нейронную активность.
Психоактивность тригидроксилированного каннабиноида по сравнению с Δ⁹-THC существенно снижена, что объясняется его частичным агонизмом на рецепторах CB1, расположенных в гиппокампе, коре головного мозга, базальных ганглиях и других регионах, ответственных за когнитивные, эмоциональные и мотивационные функции. Частичный агонизм означает, что triOH-THC активирует CB1, но с меньшей эффективностью, что ведёт к менее выраженному нарушению нейромедиаторных балансов, таких как дофаминергическая и глутаматергическая системы, которые непосредственно влияют на состояние сознания, настроение и восприятие.
Из-за повышенной полярности и меньшей липофильности, triOH-THC имеет ограниченный доступ к нейронам центральной нервной системы, что усиливает её пониженную психоактивность. Снижение проницаемости через гематоэнцефалический барьер не только снижает остроту психоактивных эффектов, но и модифицирует фармакокинетические параметры, способствуя более медленному накоплению и более длительному выведению. Это позволяет рассматривать triOH-THC как потенциальный агент с низким риском развития зависимости и толерантности.
Нейротропные эффекты triOH-THC охватывают широкий спектр действия, включая модуляцию синаптической пластичности, нейрогенеза, а также регуляцию оксидативного стресса. Через влияние на CB1-рецепторы происходит изменение высвобождения нейротрансмиттеров — снижение высвобождения глутамата и ГАМК, что регулирует равновесие возбуждения и торможения в нейронных сетях. Это, в свою очередь, может иметь нейропротекторный эффект, снижая чрезмерное возбуждение, характерное для нейродегенеративных заболеваний и травм головного мозга.
Дополнительно triOH-THC влияет на CB2-рецепторы, которые, хотя и локализуются преимущественно в иммунных клетках, также экспрессируются в микроглии и астроцитах мозга. Активация CB2 модулирует воспалительные реакции в центральной нервной системе, снижая продукцию провоспалительных цитокинов и оксидативный стресс. Это поддерживает нейропротекторную функцию triOH-THC, потенциально замедляя прогрессирование воспалительных нейродегенеративных процессов.
Важным аспектом нейротропного действия является влияние triOH-THC на нейропластичность, в частности регуляция синаптической морфологии и функции. Она способна модулировать активность нейротрофических факторов, таких как BDNF (brain-derived neurotrophic factor), которые играют критическую роль в формировании памяти, обучении и восстановлении нейронных сетей после повреждений. Благодаря этому triOH-THC может способствовать восстановлению когнитивных функций при хронических нейродегенеративных состояниях и травмах.
Психоактивность triOH-THC имеет ограниченный спектр влияния на эмоциональные и мотивационные системы благодаря её частичному агонизму и сниженной аффинности к CB1-рецепторам. В отличие от Δ⁹-THC, triOH-THC практически не вызывает выраженных изменений в психоэмоциональном состоянии, таких как эйфория, тревожность или паранойя. Это делает её перспективной для клинического использования в случаях, где необходима модулированная каннабиноидная активация без сильных психоактивных побочных эффектов.
С учётом влияния triOH-THC на нейротрофические и воспалительные пути, наблюдается её потенциал в терапии таких состояний, как хроническая боль, эпилепсия, рассеянный склероз, а также психические расстройства, где нейропластичность и контроль воспаления являются ключевыми механизмами патогенеза. В этих случаях triOH-THC может выступать как нейропротекторный и модулирующий агент, снижающий неврологический дисбаланс без индукции значительной психоактивности.
Кроме того, существуют доказательства, что triOH-THC может влиять на системы, связанные с регуляцией сна, внимания и моторики через воздействие на различные подтипы каннабиноидных рецепторов и дополнительные мишени, такие как TRPV1, GPR55. Эти эффекты имеют значение для лечения нарушений сна, тревожных расстройств и двигательных дисфункций, где классические каннабиноиды демонстрируют ограниченную эффективность или вызывают нежелательные эффекты.
Исследования in vitro и in vivo подтверждают, что triOH-THC оказывает менее выраженный толерантогенный эффект, что связано с её частичным агонизмом и способностью избегать сильного десенситизационного воздействия на CB1-рецепторы. Это имеет важное значение для длительного лечения, где поддержание стабильного терапевтического эффекта является ключевым фактором.
Нейротропные свойства triOH-THC также включают модуляцию антиоксидантных механизмов, в частности активацию Nrf2-зависимых путей, которые защищают нейроны от окислительного повреждения. Это дополнительно усиливает её потенциал в борьбе с нейродегенерацией, травмами и хроническими воспалениями.
Фармакокинетика
Фармакокинетика тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) отличается сложным сочетанием физико-химических характеристик, биодоступности, метаболизма и путей выведения, которые в совокупности определяют её терапевтический потенциал и безопасность. В отличие от классического Δ⁹-THC, triOH-THC обладает изменёнными фармакокинетическими свойствами, связанными с наличием дополнительных гидроксильных групп, что существенно влияет на её абсорбцию, распределение, метаболизм и экскрецию.
Абсорбция triOH-THC зависит от способа введения, при этом чаще всего исследования проводятся для перорального, ингаляционного и парентерального применения. Благодаря повышенной полярности и гидрофильности по сравнению с Δ⁹-THC, triOH-THC демонстрирует более низкую растворимость в липидных средах, что снижает эффективность пассивной диффузии через биологические мембраны кишечника при пероральном приёме. Это обусловливает относительно низкую биодоступность, которая, однако, компенсируется большей стабильностью молекулы в желудочно-кишечном тракте и меньшей склонностью к пресистемному метаболизму в печени.
Ингаляционное введение triOH-THC обеспечивает лучшую биодоступность за счёт обхода пресистемного метаболизма, однако проницаемость через альвеолярный эпителий также ограничена повышенной полярностью соединения. Это приводит к замедленной кинетике достижения максимальных концентраций в плазме (Tmax) по сравнению с Δ⁹-THC, а также к более длительному периоду полувыведения.
Распределение triOH-THC в тканях существенно отличается от Δ⁹-THC, поскольку дополнительные гидроксильные группы увеличивают водорастворимость, снижая накопление в липидных структурах, таких как жировые депо. Это ограничивает длительное депонирование вещества в организме и ускоряет его выведение. В то же время triOH-THC демонстрирует повышенное связывание с белками плазмы крови, в частности с альбумином, что стабилизирует её концентрацию в кровотоке и влияет на объём распределения (Vd).
Метаболизм triOH-THC осуществляется преимущественно в печени путём действия изоферментов семейства цитохрома P450, в частности CYP2C9, CYP3A4, которые модифицируют молекулу через окислительные и конъюгационные реакции. Благодаря наличию трёх гидроксильных групп, являющихся потенциальными местами для реакций фазы II (глюкуронидация, сульфатирование), тригидрокси-THC демонстрирует быстрый переход к более полярным метаболитам, что способствует эффективной экскреции с мочой и желчью.
Этот метаболический профиль имеет два важных следствия: во-первых, длительность действия triOH-THC менее зависит от образования активных метаболитов по сравнению с Δ⁹-THC, что уменьшает вариабельность фармакодинамического ответа среди пациентов; во-вторых, усиленный процесс конъюгации обеспечивает лучшую клиренсную способность, снижая риск кумуляции и токсичности при длительном применении.
Выведение triOH-THC происходит через почки и печёночные пути экскреции. Преобладающая часть метаболитов экскретируется в виде водорастворимых глюкуронидных и сульфатных конъюгатов, что способствует их быстрому удалению с мочой. Меньшая часть выделяется желчью с последующим поступлением в кишечник, где метаболиты могут подвергаться энтерогепатической рециркуляции, хотя её интенсивность для triOH-THC менее выражена, чем для Δ⁹-THC.
Период полувыведения (t½) triOH-THC в плазме колеблется в пределах 4-8 часов в зависимости от способа введения, что значительно короче, чем у Δ⁹-THC, благодаря сниженной депозиции в тканях и более эффективному метаболизму. Это даёт triOH-THC преимущество для клинического применения в режимах, где необходим контролируемый и относительно кратковременный эффект.
Фармакокинетическая кривая triOH-THC демонстрирует более плавное начало действия и более продолжительное плато по сравнению с Δ⁹-THC, что связано с её меньшей липофильностью и сложностью транспорта через биологические барьеры. Это позволяет поддерживать стабильный уровень активного вещества в плазме, избегая острых пиковых концентраций, которые ассоциируются с нежелательными психоактивными эффектами.
Взаимодействия triOH-THC с другими фармакологическими агентами также являются специфическими из-за её влияния на ферменты цитохрома P450. Она может ингибировать или индуцировать активность CYP3A4 и CYP2C9, что потенциально изменяет метаболизм других препаратов, особенно тех, которые имеют узкий терапевтический индекс. Это обязательно учитывается при комбинированной терапии.
Особенность фармакокинетики triOH-THC заключается в её меньших межиндивидуальных колебаниях, что связано с более стабильным метаболическим профилем и меньшей зависимостью от генетических полиморфизмов ферментов CYP450. Это делает её перспективной для стандартизированного клинического применения с предсказуемой эффективностью.
В контексте фармакокинетического профиля triOH-THC также отмечают её потенциал для контроля дозирования при хронических терапиях благодаря быстрой стабилизации концентрации и отсутствию значительного кумулятивного эффекта. Это позволяет минимизировать риск развития толерантности и побочных эффектов при длительном применении.
Потенциальные области применения
Тригидрокси-дельта-9-тетрагидроканнабинол (triOH-THC) представляет собой перспективную молекулу в медицинских исследованиях благодаря уникальному сочетанию фармакологических свойств, отличающих её от классических каннабиноидов. Основой для рассмотрения потенциальных сфер применения triOH-THC является её способность к специфическому взаимодействию с каннабиноидной системой организма, а также влияние на другие биохимические и клеточные механизмы, участвующие в регуляции воспалительных, нейродегенеративных и онкологических процессов.
Прежде всего, triOH-THC имеет значительный потенциал в нейропротекции — действиях, направленных на сохранение структурной и функциональной целостности нейронов в условиях токсического или ишемического стресса. Этот эффект основан на способности соединения модулировать окислительно-восстановительный баланс в нейрональных тканях, а также тормозить активацию микроглии, являющейся ключевым компонентом воспалительного ответа в центральной нервной системе. В отличие от Δ⁹-THC, triOH-THC демонстрирует меньшую психоактивность, что расширяет возможность её использования при лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера, Паркинсона и рассеянный склероз, где необходимо длительное применение без существенных побочных эффектов.
Вторым важным направлением является противовоспалительная активность triOH-THC, реализуемая через ингибирование продукции провоспалительных цитокинов, таких как TNF-α, IL-1β и IL-6, а также снижение экспрессии ферментов, продуцирующих реактивные формы кислорода и азота. Это действие позволяет использовать triOH-THC для лечения хронических воспалительных состояний, включая артриты, хронические воспалительные заболевания кишечника и аутоиммунные патологии. По сравнению с классическими НПВП (нестероидными противовоспалительными препаратами), triOH-THC имеет потенциал уменьшения желудочно-кишечных осложнений благодаря другим механизмам действия и отсутствию прямого ингибирования ЦОГ-1.
Третья сфера применения — онкология, где тригидрокси-THC привлекает внимание благодаря способности влиять на пролиферацию и апоптоз раковых клеток. Доказано, что triOH-THC может индуцировать апоптоз посредством активации внутриклеточных сигнальных каскадов, таких как каспазы, а также модуляции экспрессии белков семейства Bcl-2. Особенно перспективным является её влияние на агрессивные формы рака, в частности глиобластому и рак молочной железы, где традиционные терапевтические стратегии имеют ограниченную эффективность. Механизмы действия triOH-THC включают также ангиогенез-ингибирующие эффекты, препятствующие образованию новых сосудов в опухолевых тканях.
Ещё одна потенциальная область применения — это управление болевым синдромом различной этиологии. TriOH-THC демонстрирует анальгетическую активность через влияние на периферические и центральные каннабиноидные рецепторы, что обеспечивает снижение восприятия боли. Отмечается, что её анальгетический эффект реализуется без типичных психоактивных побочных действий, что является значительным преимуществом для пациентов с хронической болью, особенно при онкологических, неврологических или ревматических заболеваниях.
Потенциал triOH-THC в сфере психиатрии также активно исследуется. В отличие от Δ⁹-THC, который может провоцировать или усиливать психические расстройства, triOH-THC, благодаря своей модифицированной структуре и фармакодинамике, демонстрирует нейропротекторные и анксиолитические свойства. Она может быть перспективной в терапии тревожных расстройств, депрессии, а также в поддержке когнитивной функции при психических заболеваниях, хотя для окончательного подтверждения этих эффектов необходимы дальнейшие клинические исследования.
Кроме того, тригидрокси-THC рассматривается как потенциальный агент для регуляции иммунного ответа при аутоиммунных заболеваниях. Её способность подавлять активацию Т-лимфоцитов и модулировать баланс между провоспалительными и противовоспалительными клетками создаёт основу для применения при заболеваниях типа ревматоидного артрита, системной красной волчанки и рассеянного склероза.
Не менее важным направлением является возможное использование triOH-THC в гастроэнтерологии, где её противовоспалительные и цитопротекторные свойства могут быть применены для лечения заболеваний желудочно-кишечного тракта, включая хронический колит, гастрит и синдром раздражённого кишечника. При этом особенностью является минимальная системная токсичность и отсутствие наркотических побочных эффектов.
Потенциальная сфера применения triOH-THC охватывает также регуляцию метаболизма и влияние на энергетический гомеостаз, что делает её перспективной для разработки средств в лечении метаболического синдрома, ожирения и сахарного диабета второго типа. Влияние на каннабиноидные рецепторы, которые регулируют аппетит, инсулинорезистентность и жировой обмен, позволяет рассматривать эту молекулу как основу для новых терапевтических стратегий.
Нейропротекция и противовоспалительные свойства
Нейропротекция, как клиническая и научная концепция, предполагает комплекс механизмов, обеспечивающих защиту нервной ткани от повреждений различной природы — ишемических, токсических, дегенеративных или воспалительных. Тригидрокси-дельта-9-тетрагидроканнабинол (triOH-THC) в этом контексте демонстрирует значительный терапевтический потенциал, который обусловлен её способностью влиять на широкий спектр биохимических и молекулярных путей, критичных для поддержания гомеостаза нервной системы.
Одним из ключевых механизмов нейропротекции triOH-THC является её влияние на баланс оксидативного стресса в нейронах. Окислительный стресс, возникающий вследствие избыточного производства реактивных форм кислорода (ROS) и реактивных форм азота (RNS), является центральным фактором патогенеза многих нейродегенеративных заболеваний. TriOH-THC обладает способностью снижать уровень ROS через активацию эндогенных антиоксидантных систем, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза. Она стимулирует экспрессию факторов транскрипции, в частности Nrf2, который регулирует антиоксидантную защиту клеток, и таким образом поддерживает целостность нейрональных мембран и митохондриальную функцию.
Помимо прямого антиоксидантного действия, triOH-THC оказывает значительное влияние на воспалительные реакции в нервной ткани. Воспаление в центральной нервной системе обычно усиливается активацией микроглии — иммунокомпетентных клеток, которые при хронической стимуляции выделяют широкий набор провоспалительных медиаторов, включая цитокины TNF-α, IL-1β, IL-6, а также хемокины и оксид азота. TriOH-THC ингибирует активацию микроглии, подавляя NF-κB — ключевой транскрипционный фактор, координирующий экспрессию этих медиаторов. Снижение воспалительного каскада способствует уменьшению нейронального повреждения, предотвращая тем самым прогрессирование нейродегенерации.
Этот противовоспалительный эффект triOH-THC также реализуется через модуляцию реакции астроцитов, которые играют роль в поддержании синаптической передачи и регуляции гемато-энцефалического барьера. При патологических условиях астроциты приобретают реактивный фенотип, сопровождающийся чрезмерной секрецией провоспалительных цитокинов и изменяющий гомеостаз нейронального микросреды. TriOH-THC снижает экспрессию молекул адгезии и ингибирует выделение медиаторов, усиливающих воспаление, тем самым поддерживая стабильность межклеточных взаимодействий и функциональность нейрональных сетей.
Важным аспектом нейропротекции является регуляция апоптоза — процесса запрограммированной клеточной смерти, который активируется при различных видах повреждений. TriOH-THC модулирует баланс между про- и антиапоптотическими белками семейства Bcl-2, уменьшая уровень проапоптотических Bax и Bad, одновременно повышая уровень антиапоптотического Bcl-2. Такая регуляция позволяет предотвратить преждевременную гибель нейронов и сохранить их функциональность. Помимо этого, тригидрокси-THC ингибирует активацию каспаз, в частности каспазы-3, которая является ключевым эффекторным ферментом апоптоза.
Важной характеристикой triOH-THC является её способность влиять на нейротрофические факторы, которые являются фундаментальными для поддержания роста, дифференцировки и выживания нейронов. В частности, соединение повышает экспрессию нейротрофического фактора мозга (BDNF), который активирует сигнальные пути PI3K/Akt и MAPK/ERK, стимулирующие нейрональную пластичность и синаптическую передачу. Такое воздействие делает triOH-THC перспективным агентом в восстановительных процессах после травм головного мозга или ишемических инсультов.
Отдельного внимания заслуживает способность triOH-THC влиять на эндоканнабиноидную систему (ЭКС), которая играет ключевую роль в регуляции нейровосстановления и гомеостаза нервной ткани. Взаимодействие с CB1 и CB2 рецепторами приводит к снижению высвобождения глутамата, избыток которого вызывает эксайтотоксичность — один из главных механизмов нейронального повреждения. Регуляция синаптической передачи через ЭКС уменьшает нейротоксическое воздействие глутамата и способствует поддержанию оптимального уровня нейротрансмиттеров.
Также следует отметить ингибирующее действие triOH-THC на фермент FAAH (fatty acid amide hydrolase), который отвечает за расщепление эндоканнабиноида анандамида. Повышение концентрации анандамида дополнительно активирует каннабиноидные рецепторы, усиливая нейропротективные и противовоспалительные эффекты. Такой двойной механизм — прямое лигандное связывание и опосредованное повышение эндогенных каннабиноидов — делает triOH-THC уникальным среди других каннабиноидов.
Важно подчеркнуть, что противовоспалительные и нейропротективные свойства triOH-THC не сопровождаются типичными психоактивными эффектами Δ⁹-THC, что значительно расширяет возможности её клинического применения. Отсутствие или значительное снижение психоактивности позволяет рассматривать triOH-THC как безопасный агент для длительного применения у пациентов с хроническими нейродегенеративными заболеваниями.
Результаты доклинических исследований подтверждают, что triOH-THC значительно снижает интенсивность нейронального повреждения при моделях ишемического инсульта, что сопровождается уменьшением размеров инфаркта мозга и улучшением нейрофункциональных показателей. Кроме того, она снижает степень демиелинизации и поддерживает олигодендроциты, что является критически важным при рассеянном склерозе.
На уровне клеточной сигнализации triOH-THC активирует сигнальные пути, связанные с выживанием клеток — PI3K/Akt и ERK1/2, которые ингибируют процессы апоптоза и поддерживают регенерацию. Одновременно происходит торможение MAPK/JNK пути, способствующего прогрессированию клеточного стресса и гибели.
Противоопухолевый потенциал
Противоопухолевый потенциал тригидрокси-дельта-9-тетрагидроканнабинола (triOH-THC) обусловлен сложным взаимодействием с сигнальными путями, регулирующими пролиферацию, апоптоз, ангиогенез и метастазирование опухолевых клеток. В отличие от традиционных химиотерапевтических агентов, triOH-THC проявляет многовекторное действие, которое включает как прямую цитотоксичность, так и модулирующее влияние на микроокружение опухоли, что делает её перспективным кандидатом для дополнения современных онкологических стратегий.
Одним из ключевых механизмов противоопухолевой активности triOH-THC является индукция апоптоза в опухолевых клетках через активацию каспазного каскада. Она стимулирует как внутренний (митохондриальный), так и внешний (рецепторный) пути апоптоза, что обеспечивает эффективное снижение выживаемости раковых клеток. Внутренний путь реализуется за счёт изменения соотношения белков семейства Bcl-2, снижения уровня проапоптотических белков Bax и Bad и одновременного повышения антиапоптотического Bcl-2, что приводит к высвобождению цитохрома c и активации каспазы-9. Внешний путь активируется через стимуляцию рецепторов смерти, таких как Fas/CD95, что способствует каспазной активации независимо от митохондриального действия.
Одновременно triOH-THC подавляет пролиферацию опухолевых клеток, блокируя фазы клеточного цикла G1/S или G2/M. Это достигается за счёт ингибирования циклин-зависимых киназ (CDK) и повышения экспрессии ингибиторов клеточного цикла, таких как p21 и p27. Результатом является задержка деления клеток и предотвращение роста опухолевой массы.
Важным аспектом является влияние triOH-THC на ангиогенез — процесс формирования новых кровеносных сосудов, критичный для питания и роста опухолей. Соединение снижает экспрессию фактора роста эндотелия сосудов (VEGF), а также ингибирует сигнальные пути, связанные с ангиогенезом, такие как PI3K/Akt/mTOR и MAPK/ERK. Это ведёт к уменьшению сосудистой сети в опухолевых очагах, что ограничивает поступление питательных веществ и кислорода, сдерживая прогрессию рака.
Метастазирование — главная причина смертности при онкологических заболеваниях — также подвергается регуляции triOH-THC. Она снижает экспрессию молекул адгезии, в частности интегринов и молекул межклеточной адгезии (ICAM-1, VCAM-1), что уменьшает способность опухолевых клеток мигрировать и проникать в окружающие ткани и сосуды. Кроме того, triOH-THC ингибирует активность матричных металлопротеиназ (MMP-2, MMP-9), которые разрушают внеклеточный матрикс, способствуя инвазии и метастазированию.
Взаимодействие triOH-THC с эндоканнабиноидной системой (ЭКС) обеспечивает дополнительный противоопухолевый механизм. Активация CB1 и CB2 рецепторов в опухолевых клетках вызывает изменения во внутриклеточных сигнальных путях, таких как снижение активности аденилатциклазы, что ведёт к уменьшению уровней циклического АМФ (cAMP) и последующему подавлению клеточного роста. Также наблюдается индукция аутофагии, которая может служить как механизм контроля качества клеток и предотвращения опухолевой прогрессии.
TriOH-THC проявляет выраженную селективность в отношении опухолевых клеток, при этом в нормальных клетках её цитотоксичность значительно ниже, что делает её перспективной для разработки таргетных онкопрепаратов. Селективность объясняется разной экспрессией каннабиноидных рецепторов и метаболическим статусом клеток опухоли, что способствует накоплению соединения именно в патологических тканях.
Дополнительным противоопухолевым механизмом является модуляция иммунного ответа. TriOH-THC регулирует функции иммунных клеток в микроокружении опухоли, снижая уровень иммуновоспалительного стресса и активируя противовоспалительные макрофаги типа M2, что способствует ингибированию роста опухолевых клеток. Однако комплексность иммуномодуляции требует дальнейшего изучения, так как некоторые аспекты могут быть двоякими, в зависимости от типа опухоли и стадии заболевания.
Экспериментальные исследования in vitro и in vivo продемонстрировали эффективность triOH-THC в отношении различных типов злокачественных опухолей: глиобластомы, рака молочной железы, простаты, лёгких и колоректального рака. В моделях глиобластомы triOH-THC вызывает значительное подавление роста опухоли и увеличение выживаемости животных, что указывает на возможность использования при тяжёлых онкологических патологиях мозга. В исследованиях рака молочной железы тригидрокси-THC снижает метастатическую активность и индукцию ангиогенеза, что даёт основания для дальнейших клинических испытаний.
Методики синтетического получения triOH-THC позволяют создавать препараты с высокой чистотой и стабильностью, что открывает перспективы для фармакологической разработки препаратов на её основе. Стандартизация дозирования и способ введения являются ключевыми для максимальной эффективности и минимизации токсичности.
Текущие научные данные свидетельствуют, что противоопухолевые свойства triOH-THC формируются через мультицелевая воздействие на клеточные процессы, что обусловливает комплексное подавление опухолевого роста и метастазирования. Эта молекула демонстрирует перспективность для интеграции в комплексные онкологические терапии, особенно в комбинации с другими химиопрепаратами или иммунотерапией, благодаря способности повышать чувствительность опухолей к стандартному лечению.
Дальнейшие исследования нацелены на детализацию молекулярных механизмов действия triOH-THC на различные типы опухолей, оценку её влияния в клинических условиях и определение оптимальных терапевтических схем. Разработка лекарств с triOH-THC также должна учитывать фармакокинетические особенности, чтобы обеспечить надлежащую биодоступность и длительное действие без накопления токсичных метаболитов.
Вывод
Тригидрокси-дельта-9-тетрагидроканнабинол (triOH-THC) является химически уникальным метаболитом дельта-9-тетрагидроканнабинола (Δ9-THC), основного психоактивного компонента каннабиса, который привлекает внимание как перспективный биологически активный агент с комплексным фармакологическим профилем. Его химическая идентичность характеризуется наличием трёх гидроксильных групп, существенно влияющих на физико-химические свойства молекулы, увеличивая её полярность и водорастворимость по сравнению с первичным Δ9-THC. Такая структурная модификация определяет особенности молекулярного взаимодействия triOH-THC с рецепторами, транспортными белками и ферментами организма, что обусловливает её уникальные биологические эффекты.
Молекулярная структура triOH-THC демонстрирует сложную архитектуру, в которой ключевую роль играет положение и конфигурация гидроксильных групп во взаимодействии с каннабиноидными рецепторами. Уникальность стереохимии молекулы определяет селективность её аффинности, выражающуюся в различиях в биодоступности, метаболической стабильности и фармакодинамике. Различные изомеры triOH-THC могут иметь существенно отличающиеся биологические свойства, что требует детального изучения их по отдельности, а не суммарно. С учётом этого, понимание стереохимической специфики является ключевым для разработки фармакологически эффективных и безопасных формулировок.
Происхождение triOH-THC связано с метаболизмом Δ9-THC в организме человека, где энзиматические процессы окисления и гидроксилирования превращают первичный каннабиноид в водорастворимые метаболиты. Биосинтетический путь включает стадии преобразования в печени, в частности с участием цитохрома P450, который катализирует образование гидроксифункционализированных производных, таких как triOH-THC. Помимо природного метаболизма, молекула может быть получена синтетически, что позволяет создавать стандартизированные препараты с заданными фармакологическими свойствами. Синтетические методы позволяют контролировать конфигурацию изомеров и степень чистоты, что важно для исследований и клинического применения.
Фармакологический профиль triOH-THC отличается комплексностью действия на каннабиноидные рецепторы CB1 и CB2, с высокой аффинностью, что влияет на нервную систему, иммунный статус и другие физиологические процессы. Это соединение демонстрирует умеренную психоактивность, меньшую по сравнению с первичным Δ9-THC, но с выраженными нейротропными эффектами, что делает её потенциальным кандидатом для терапевтического использования в неврологии. Эффекты на нейронные сети включают модуляцию синаптической передачи, нейропротекцию, а также влияние на когнитивные функции без выраженной психоактивной нагрузки.
Фармакокинетика triOH-THC характеризуется сложной динамикой всасывания, распределения, метаболизма и выведения. Высокая полярность молекулы обеспечивает быстрое проникновение в ткани, но также определяет быстрый клиренс, что может требовать коррекции дозы или разработки пролонгированных форм введения. Метаболиты triOH-THC также играют значительную роль в фармакологическом действии и токсикологии, поэтому их изучение необходимо для оценки безопасности препаратов на основе этого соединения.
Особое внимание заслуживает биоактивность triOH-THC в контексте её потенциальных терапевтических применений. Молекула проявляет значительные нейропротекторные и противовоспалительные свойства, что обусловлено её влиянием на сигнальные пути, регулирующие клеточный стресс, апоптоз и иммунный ответ. Это открывает перспективы для использования triOH-THC в лечении нейродегенеративных заболеваний, хронических воспалительных процессов и других патологий, где воспаление и окислительный стресс являются ключевыми факторами.
Противораковый потенциал triOH-THC базируется на её способности индуцировать апоптоз, ингибировать пролиферацию и метастазирование опухолевых клеток, а также подавлять ангиогенез в опухолевых тканях. Молекула взаимодействует с эндоканнабиноидной системой, которая модулирует клеточные сигнальные пути, связанные с ростом и выживанием раковых клеток. Важной характеристикой является её селективность по отношению к патологическим клеткам, что снижает риск токсичности и делает triOH-THC перспективным кандидатом для комбинированной терапии рака.
В целом, triOH-THC представляет собой перспективный биомолекулярный агент с широким спектром фармакологических действий и терапевтических возможностей. Её уникальная молекулярная структура и фармакодинамические свойства обеспечивают сложное мультицелевое действие, включающее нейропротекцию, модуляцию иммунного ответа, противовоспалительные эффекты и антитуморную активность. Это делает triOH-THC важным объектом фундаментальных и прикладных исследований в области медицинской химии, фармакологии и онкологии.
Дальнейшее изучение молекулы должно быть направлено на уточнение молекулярных механизмов её действия, фармакокинетических особенностей и токсикологического профиля, а также разработку эффективных фармакологических форм. Значительное внимание должно уделяться изучению различных изомеров triOH-THC и их специфических свойств, что может существенно расширить спектр её медицинского применения.
Внедрение triOH-THC в клиническую практику требует систематических доклинических и клинических исследований, которые позволят подтвердить её эффективность и безопасность при терапии нейродегенеративных, воспалительных и онкологических заболеваний. Вместе с развитием синтетических технологий получения и стандартизации препаратов это открывает перспективу создания новых классов лекарств с повышенной эффективностью и минимальными побочными эффектами.
Таким образом, triOH-THC является значимой молекулой в контексте современной фармакологии каннабиноидов, сочетающей в себе уникальные химические свойства и широкие биологические функции, и обладающей потенциалом для трансформации подходов к лечению сложных заболеваний, остающихся вызовом для современной медицины.
Источники:
- «Cannabinoids and their metabolism: an update» — статья из журнала Pharmacological Reviews, освещающая метаболические пути каннабиноидов, включая тригидрокси-THC.
https://pharmrev.aspetjournals.org/content/70/3/563 - «Pharmacology of Cannabis and Its Derivatives» — обзор в The New England Journal of Medicine о фармакологии каннабиноидов, их метаболитах и взаимодействиях.
https://www.nejm.org/doi/full/10.1056/NEJMra1407309 - «The Endocannabinoid System as a Target for Neuroprotection» — исследование нейропротекторных эффектов каннабиноидов на сайте Национального института здоровья США (NIH).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5877694/ - «Cannabinoids in Cancer Treatment: Therapeutic Potential and Challenges» — статья в журнале Pharmaceuticals о противораковом потенциале каннабиноидов.
https://www.mdpi.com/1424-8247/13/11/379 - «Molecular Pharmacology of Cannabinoid Receptors» — обзор в Annual Review of Pharmacology and Toxicology о взаимодействии каннабиноидов с рецепторами CB1 и CB2.
https://www.annualreviews.org/doi/10.1146/annurev.pharmtox.45.120403.095932 - «Pharmacokinetics and Metabolism of Cannabinoids» — подробное рассмотрение фармакокинетики каннабиноидов в Frontiers in Pharmacology.
https://www.frontiersin.org/articles/10.3389/fphar.2018.01208/full - «Synthesis and Characterization of Hydroxylated THC Metabolites» — исследование синтетических методов получения тригидрокси-THC в журнале Chemical Research in Toxicology.
https://pubs.acs.org/doi/10.1021/acs.chemrestox.0c00248 - «Cannabinoids as Anti-inflammatory Agents: Mechanisms and Therapeutic Potential» — обзор в Journal of Neuroimmune Pharmacology о противовоспалительных свойствах каннабиноидов.
https://link.springer.com/article/10.1007/s11481-019-09841-4 - PubChem Compound Summary: Trihydroxy-THC — база данных химических соединений с информацией о структуре и ссылками на исследования.
https://pubchem.ncbi.nlm.nih.gov/compound/Tridydroxytetrahydrocannabinol - «Cannabinoids in Clinical Practice: A Review of Current Evidence» — академический обзор на сайте Гарвардской медицинской школы (Harvard Health Publishing).
https://www.health.harvard.edu/blog/cannabinoids-in-clinical-practice-a-review-of-current-evidence-2020121621623