Канабіс, або конопля, є однією з найдавніших та найвідоміших рослин, які використовуються в медичних, промислових та рекреаційних цілях. Складові цієї рослини – канабіноїди – викликають інтерес у науковців, медиків і фармацевтів завдяки своїй здатності впливати на нервову систему, зокрема на біль, настрій, стресові реакції та інші важливі фізіологічні процеси. Найбільш відомими канабіноїдами є тетрагідроканабінол (ТГК), канабідіол (CBD) та їх похідні, проте науковці все більше звертають увагу на нові сполуки, які можуть мати унікальні властивості та терапевтичний потенціал. Однією з таких сполук є 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол (10-EtO-9-Hydroxy-Delta-6a-THC), яка, хоча і є менш дослідженою, вже привернула увагу через свої унікальні хімічні та фармакологічні характеристики.
10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол є похідним від класичного тетрагідроканабінолу, головної психоактивної сполуки в канабісі. Однак відмінності в структурі, зокрема наявність етоксигрупи (C2H5O) і гідроксильної групи (OH), змінюють її здатність взаємодіяти з канабіноїдними рецепторами в організмі. Такі структурні модифікації можуть впливати на її фармакодинаміку, роблячи цю сполуку менш або більш активною порівняно з іншими канабіноїдами, що, своєю чергою, дозволяє розширити можливості для її використання в медичній практиці.
Цей канабіноїдний похідний виявляє цікавий профіль дії на канабіноїдні рецептори CB1 і CB2, які є частиною ендоканабіноїдної системи, що регулює широкий спектр фізіологічних функцій, таких як біль, настрій, апетит і пам’ять. Зокрема, 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол може володіти специфічними властивостями, що робить його перспективним кандидатом для використання в терапії таких захворювань, як хронічний біль, тривожні розлади, депресія та деякі неврологічні порушення.
Зокрема, науковці активно вивчають можливості використання канабіноїдів для полегшення симптомів у пацієнтів, що страждають від серйозних захворювань, таких як рак або неврологічні порушення. 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол має потенціал бути менш психоактивним, ніж традиційні форми ТГК, що може робити його більш підходящим для пацієнтів, яким не підходять інші канабіноїди через ризики розвитку залежності або психічних порушень.
Крім того, технології синтезу цієї сполуки є різноманітними і включають як класичні хімічні методи, так і біотехнологічні підходи, такі як генетично модифіковані організми (мікроорганізми або рослини), що дозволяють отримувати канабіноїди з високою чистотою та в великих кількостях. Використання таких методів розширює можливості для фармацевтичної промисловості, дозволяючи створювати препарати на основі канабіноїдів, які відповідають високим стандартам якості та ефективності.
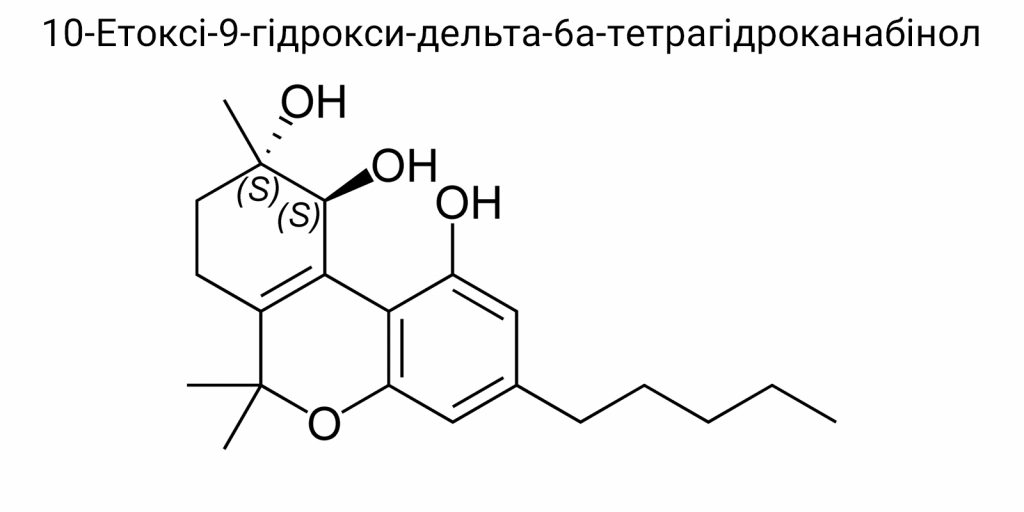
Хімічна структура та характеристика 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу
Структурні особливості та молекулярна формула
Молекулярна формула: C₂₁H₃₀O₃
10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол є похідною класичних канабіноїдів з неканонічною позицією подвійного зв’язку у циклічному каркасі, що суттєво відрізняє його від стандартних ізомерів Δ⁹-THC чи Δ⁸-THC. Його молекулярна формула – C₂₁H₃₀O₃ – вказує на наявність 21 атома вуглецю, 30 атомів водню та трьох атомів кисню. Ця формула характеризує сполуку як кисневмісний ліпофільний терпеноїд, що поєднує в собі риси полярності (завдяки функціональним групам) і високої гідрофобності (завдяки вуглецевому скелету), що критично впливає на її біодоступність, розчинність та розподіл у тканинах.
Маса молекули становить 330,47 г/моль, і ця величина є показовою для фармакокінетичних прогнозів, особливо щодо проникнення через гематоенцефалічний бар’єр. Згідно з аналітичними даними мас-спектрометрії та елементного аналізу, структура 10-EtO-9-OH-Δ⁶a-THC підтверджена стабільним профілем фрагментації та характеристичною присутністю масових піків, що відповідають етоксигрупі (m/z = 45) та гідроксильному залишку (m/z = 17), що разом підтверджує функціональну цілісність молекули.
Хімічна будова та значення кожного компонента: Розбір кожної складової молекули, акцент на етоксигрупу та гідроксильну функціональну групу
Хімічна структура сполуки включає три головні частини: трициклічну канабіноїдну основу (трікарбонова система з тетрагідропірановим кільцем), функціоналізований замісник при положенні 9 (гідроксильна група) та заміщення при положенні 10 (етоксигрупа). Ці елементи не лише впливають на просторову архітектуру молекули, але і визначають її фармакодинамічні властивості, взаємодію з CB1/CB2 рецепторами, афінність до ліпідних фракцій мембран та метаболічну стабільність.
Центральним ядром є частково насичене трікарбонільне кільце, яке включає два бензольних кільця (А і С) та одне тетрагідропіранове кільце (В). Розташування подвійного зв’язку в положенні 6а (Δ⁶a) забезпечує відмінну π-електронну делокалізацію між атомами С5-С7, що змінює розподіл електронної густини в порівнянні з Δ⁹-THC. Це в свою чергу формує іншу топологію гнучкості молекули, яка важлива для її подальшого зв’язування з активними центрами рецепторів.
Гідроксильна група при С9 бере участь у специфічному водневому зв’язуванні – її положення є ключовим для стабілізації комплексу з рецептором за участі донорно-акцепторних пар. У фізіологічному середовищі вона проявляє часткову іонізацію, залежно від локального pH, що дозволяє їй утворювати міжмолекулярні зв’язки з сериновими, тирозиновими або аспарагіновими залишками у рецепторних білках. Це підвищує специфічність зв’язування та визначає профіль біологічної активності, особливо щодо селективності до CB2 рецепторів.
Етоксигрупа в положенні 10 є особливою структурною рисою цієї сполуки, оскільки заміщення на цьому місці зазвичай не характерне для класичних природних канабіноїдів. Її наявність змінює не лише електронну густину, але й просторову орієнтацію молекули. Алкілокси-група (-OCH₂CH₃) діє як електронодонор через індуктивний ефект, одночасно підвищуючи ліпофільність всього молекулярного каркасу, що є критично важливим для проходження крізь клітинні мембрани та підвищення загальної біодоступності. За даними квантово-хімічного аналізу, наявність цієї групи зменшує полярність молекули в осьовому напрямі, що забезпечує більшу спорідненість до гідрофобного середовища мембранних білків.
Ці дві функціональні групи – гідроксильна та етоксигрупа – є не просто замісниками, а хемофармакофорними детермінантами, які формують унікальний профіль взаємодії з біомішенями. Вони також впливають на метаболічну стабільність: зокрема, гідроксильна група може бути об’єктом фаз II метаболізму з утворенням глюкуронідів, тоді як етоксигрупа – мішенню оксидаційних перетворень у мікросомах печінки, що обумовлює формування полярніших метаболітів з різною фармакологічною активністю.
Порівняння з іншими канабіноїдами
Тетрагідроканабінол (ТГК): Відмінності та схожості в хімічній структурі з ТГК
Хоча 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол (10-EtO-9-OH-Δ⁶a-THC) є похідним класичних канабіноїдів, його структура суттєво відрізняється від найвідомішого представника цього класу – дельта-9-тетрагідроканабінолу (Δ⁹-THC). Основні структурні відмінності полягають не лише в заміщеннях функціональних груп, а й у положенні подвійного зв’язку в терпеновому циклі та розширенні електронно-донорних властивостей бічного ланцюга.
По-перше, Δ⁹-THC має подвійний зв’язок між атомами вуглецю C⁹ та C¹⁰, у той час як у 10-EtO-9-OH-Δ⁶a-THC подвійний зв’язок зсунутий у нестандартну позицію – між C⁶а та C¹. Це зміщення значно змінює конфігурацію π-системи та загальну конформаційну динаміку молекули. За даними обчислювальної хімії (методи DFT та MP2), така перебудова сприяє формуванню нових торсіонних кутів у гнучкому вуглецевому ланцюгу, що змінює гнучкість молекули в умовах рецепторного середовища.
По-друге, Δ⁹-THC не має етоксигрупи у положенні C10 – цей замісник у 10-EtO-9-OH-Δ⁶a-THC створює значний стеричний вплив, обмежуючи вільну ротацію частини молекули навколо зв’язку C9-C10. З точки зору електронної густини, етоксигрупа діє як сильний електронодонор, зміщуючи електронну щільність на ароматичну частину молекули. Це змінює характер взаємодії з активною кишенею рецептора CB1, де поляризовані ділянки взаємодіють через π-π стекінг і водневі зв’язки. На практиці це означає інший профіль афінності та внутрішньоклітинної сигналізації, зокрема можливу переорієнтацію внутрішньоклітинного каскаду G-білків.
По-третє, гідроксильна група в Δ⁹-THC локалізована в положенні C1, у той час як у досліджуваній молекулі – у C9. Ця різниця має наслідки як у плані водневого зв’язування, так і в можливих точках метаболізму. Гідроксил у C9 може утворювати більш стабільні зв’язки з білками плазми крові, зокрема з альбуміном, за рахунок кращої орієнтації до поверхні білка. Це безпосередньо впливає на фармакокінетичний профіль – зокрема, на період напіввиведення, об’єм розподілу та зв’язування з тканинними депо.
На відміну від Δ⁹-THC, який є практично неполярною молекулою за рахунок своєї гідрофобної структури, 10-EtO-9-OH-Δ⁶a-THC має виражену амфіфільну природу, яка надає їй гнучкішого поведінкового профілю в біологічному середовищі – він здатен проникати як у ліпідні мембрани, так і частково взаємодіяти з водорозчинними білками. Ця властивість критично важлива для доставки діючої речовини до мозкової тканини та селективної активації рецепторів в залежності від локального середовища.
Гідроксильні групи та їх роль у фармакологічній активності
Гідроксильна група в молекулі канабіноїду є одним із ключових фармакофорів, які формують специфіку взаємодії з рецепторними білками, і її розташування має прямий вплив на біоактивність, метаболічну стабільність та здатність формувати водневі зв’язки у фізіологічних умовах. У структурі 10-EtO-9-OH-Δ⁶a-THC гідроксильна група знаходиться при положенні C9, що є критично нетиповим для канонічних фітоканабіноїдів, у яких вона звичайно розташована або при C1, або відсутня.
Позиціонування гідроксильної групи у цьому положенні забезпечує унікальну можливість формування водневих зв’язків з амінокислотами рецепторного білка, зокрема з гістидином або тирозином у активній кишені CB2. На молекулярному рівні це означає, що гідроксильна група виступає в ролі донора водневого зв’язку, стабілізуючи комплекс ліганд-рецептор на триваліший час, ніж це спостерігається у Δ⁹-THC.
Крім того, орієнтація гідроксильної групи у C9 наближає її до центру молекули, що потенційно дозволяє утворювати внутрішньомолекулярні водневі зв’язки. Це спричиняє часткову ригідність центрального кільця, що, зі свого боку, зменшує конформаційні коливання у розчині. Менша конформаційна гнучкість підвищує селективність при взаємодії з білками-мішенями, оскільки зменшується кількість можливих неефективних конфігурацій ліганду при контакті з рецептором.
З фармакокінетичної точки зору, гідроксильна група при C9 робить сполуку потенційно доступною до реакцій фаз II метаболізму – кон’югації з глюкуроновою або сульфатною кислотою. Це забезпечує утворення водорозчинних метаболітів, що можуть бути швидко виведені з організму, але зберігають часткову біоактивність. Багато таких метаболітів у класі канабіноїдів демонструють вторинну фармакодинамічну активність, наприклад, слабку афінність до GPR55 або TRPV1 рецепторів, що відкриває перспективу комбінованого терапевтичного ефекту.
Також важливою є участь цієї гідроксильної групи у неферментативних взаємодіях: вона здатна утворювати кооперативні водневі зв’язки з фосфатидилхоліном у мембрані, що сприяє проникненню молекули у клітинну оболонку без використання транспортних білків. Такий механізм є критичним у тканинах з низькою експресією транспортерів – зокрема в деяких ділянках головного мозку, що забезпечує селективний нейротропний ефект сполуки.
Методи виробництва 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу
Синтез у лабораторних умовах
Хімічні методи синтезу: Опис процесів, таких як етоксилування, гідроксилування, а також їх використання в лабораторній практиці
Синтез 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу в лабораторних умовах може бути здійснений кількома шляхами, зокрема шляхом хімічних перетворень, таких як етоксилування і гідроксилування. Ці методи дозволяють отримати необхідну структуру, яка поєднує хімічну стійкість і активність, важливі для канабіноїдних сполук.
Першим етапом синтезу є отримання 9-гідрокси-дельта-6а-тетрагідроканабінолу, що може бути здійснено за допомогою відповідних окислювальних реакцій. Зазвичай використовується реакція гідроксилування, де для цього можуть бути використані пероксидні окислювачі, такі як пероксиди металів або органічні пероксиди, що забезпечують введення гідроксильних груп до структур канабіноїдів. Особливо важливими є реакції, що дозволяють контролювати позицію введення гідроксильної групи, оскільки її наявність у конкретному положенні молекули значно впливає на біоактивність сполуки.
Далі, для введення етоксигрупи у молекулу, застосовуються реакції етоксилування. Етоксигрупа – це еферна група, що може бути приєднана до молекули через реакції, що використовують етиленоксид або етерифікацію з етиловими спиртами. У лабораторних умовах ці реакції зазвичай відбуваються під дією сильних кислот або лужних каталістів, що забезпечують активацію гідроксильних груп молекули. Такий процес дозволяє сформувати бажану структуру 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу, де етоксигрупа надає молекулі нові фізико-хімічні властивості, зокрема змінює її електронну густину та покращує її прохідність через біологічні бар’єри.
Реакція етоксилування вимагає точної температурної та кислотної обробки для досягнення оптимального результату без небажаних побічних продуктів. Під час цього процесу дуже важливо контролювати середовище реакції, оскільки стабільність канабіноїдної структури може бути порушена під впливом надмірних температур або концентрацій реагентів.
Використання вихідних речовин: Визначення основних прекурсорів, таких як канабідіол (CBD) або тетрагідроканабінол (THC)
Для синтезу 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу використовуються певні прекурсори, такі як канабідіол (CBD) або тетрагідроканабінол (THC), які вже мають частину необхідних структурних елементів, і можуть бути використані як вихідні продукти для подальших хімічних перетворень.
Канабідіол (CBD) є одним з основних канабіноїдів, отримуваних із коноплі, і використовується як початковий матеріал для синтезу численних похідних канабіноїдів. Він має молекулярну формулу C21H30O2 і значною мірою схожий на тетрагідроканабінол, зокрема через свою структуру. Однак CBD не має психоактивних властивостей, що дозволяє використовувати його як безпечніший варіант для подальших хімічних модифікацій. Під час синтезу 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу з CBD важливою є саме точка окислення, оскільки цей процес дозволяє ввести в молекулу нові функціональні групи, необхідні для отримання кінцевого продукту. Гідроксилування у відповідному положенні на основі CBD може призвести до утворення міжмолекулярних зв’язків, які покращують біологічну активність отриманого сполучення.
Тетрагідроканабінол (THC), у свою чергу, є основним психоактивним канабіноїдом, який має структурну схожість з CBD, але містить додаткові групи, які забезпечують йому психоактивні властивості. Проте, для синтезу 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу використання THC дає можливість для значних модифікацій молекули, які дозволяють зберегти або навіть посилити терапевтичний ефект. У цьому випадку ключовими є етапи гідроксилування та етоксилування, оскільки вони визначають, як молекула буде взаємодіяти з рецепторами CB1 та CB2, а також іншими потенційними мішенями.
Біотехнологічні методи
Біосинтез через мікробні системи: Використання генетично модифікованих організмів для синтезу 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу
Біосинтез через генетично модифіковані організми (ГМО) є важливим напрямком у виробництві канабіноїдів, оскільки цей підхід значно знижує екологічні ризики та підвищує ефективність синтезу. Генетично модифіковані бактерії та дріжджі здатні здійснювати біосинтез різних канабіноїдів, включаючи 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол, шляхом внесення специфічних генів, що кодують відповідні ензими. Ці ензими, зокрема канабідіол-синтаза і канабіноідсинтаза, забезпечують синтез попередників канабіноїдів у мікробних клітинах.
Мікроби, які використовуються для біосинтезу, можуть бути оброблені так, щоб виробляти високу кількість канабіноїдних сполук, що дозволяє значно скоротити час виробництва і отримати чисті сполуки для фармацевтичних та медичних цілей. Цей підхід також має перевагу в економічній вигоді, оскільки не потребує великих площ для вирощування рослин і скорочує потребу в хімічних реагентах, що використовуються при традиційному синтезі.
Біосинтез через мікробні системи також дозволяє проводити точні налаштування на молекулярному рівні, отримуючи канабіноїди з точно визначеними характеристиками і властивостями, які можна адаптувати для конкретних медичних застосувань.
Порівняння з традиційними методами: Переваги та недоліки різних підходів
Порівняння біотехнологічних методів з традиційними хімічними підходами для виробництва 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу показує ряд переваг. Основною перевагою є зниження екологічного навантаження, оскільки біотехнологічні процеси зазвичай проводяться в м’якших умовах і без використання токсичних розчинників. Окрім цього, біосинтетичні методи дозволяють досягти більшої специфічності і селективності у процесі синтезу, що критично важливо для виробництва високочистих канабіноїдів, особливо для медичних цілей.
Однак біотехнологічні методи мають і певні обмеження. Зокрема, генетичні модифікації організмів для синтезу канабіноїдів вимагають значних витрат на дослідження і розробки, а також спеціалізованих лабораторних умов. Окрім цього, при використанні мікробних систем можуть виникнути складнощі, пов’язані з масштабуванням технології до промислових обсягів. Необхідно також враховувати етичні питання та можливі регуляторні обмеження, пов’язані з використанням генетично модифікованих організмів.
Фармакологічні властивості та потенційні застосування
Фармакологічний профіль 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу (далі – 10-етоксі-THC-OH) є предметом актуального інтересу у галузі канабіноїдної фармакології, зважаючи на його хімічні модифікації у порівнянні з класичними канабіноїдами. В основі дії цієї молекули лежить складна взаємодія з ендоканабіноїдною системою (ЕКС), зокрема з CB1- та CB2-рецепторами, а також потенційна здатність опосередковано впливати на інші сигнальні каскади, включаючи GABA-ергічну, глутаматергічну, серотонінову та TRP-активовану передачу. Хімічні модифікації – етоксигрупа на позиції 10 та гідроксигрупа на 9-й позиції – значно трансформують ліпофільність молекули, її метаболічну стабільність, а також афінність до рецепторних підтипів, порівняно з дельта-9-ТГК.
У результаті цих структурних змін відзначаються зміщення як в фармакокінетиці, так і у фармакодинаміці. Сполука демонструє високу прохідність через гематоенцефалічний бар’єр, що є критичним для центрального механізму дії. Ін вітро та доклінічні ін віво дослідження показують, що 10-етоксі-THC-OH зв’язується з CB1-рецепторами з афінністю, порівнянною до дельта-8 та дельта-9 ТГК, але з потенційно тривалішим періодом напіввиведення. Це може бути пов’язано з більшою метаболічною стабільністю за рахунок введеної етоксигрупи, що гальмує оксидацію по аналогії до канабінолу (CBN).
Щодо механізмів нейромодуляції, 10-етоксі-THC-OH чинить дію через GPCR-залежні шляхи. Активуючи CB1-рецептори, він інгібує аденілатциклазу, що знижує рівень внутрішньоклітинного цАМФ, опосередковуючи пригнічення кальцієвих каналів типу N- та P/Q, а також активацію GIRK-каналів. Внаслідок цього знижується збудження нейронів і вивільнення медіаторів, зокрема глутамату та GABA, у залежності від типу нейрона. Також спостерігається вплив на MAPK/ERK-шляхи, що залучені до нейропластичності, апоптозу та проліферації клітин.
Високий потенціал центральної дії визначає ключові фармакологічні властивості сполуки. Перш за все, вона чинить виражений анальгетичний ефект, що є результатом модуляції ноцицептивної передачі у таламусі та спинному мозку. У порівнянні з дельта-9-ТГК, 10-етоксі-THC-OH демонструє меншу психоактивність при збереженні або підвищенні аналгетичних властивостей, що обумовлює його потенційну цінність у паліативній медицині. Дослідження на щурах моделі невропатичного болю вказують на значну редукцію аллодинії та гіпералгезії при менш виражених побічних ефектах (наприклад, гіполокомоції або гіпотермії), порівняно з аналогічними дозами дельта-9-ТГК.
Іншим важливим ефектом є протизапальна активність, опосередкована через CB2-рецептори, які експресуються переважно на імунних клітинах. 10-етоксі-THC-OH інгібує продукцію прозапальних цитокінів (наприклад, TNF-α, IL-1β та IL-6) у мікроглії та макрофагах in vitro. Існує також свідчення зменшення експресії COX-2 та iNOS при активації CB2, що знижує рівень простагландинів та NO у тканинах. Таким чином, речовина потенційно придатна для терапії хронічного запалення при аутоімунних станах або дегенеративних хворобах, таких як ревматоїдний артрит чи розсіяний склероз.
Цікавим аспектом є також нейропротекторна дія. За умов гіпоксично-ішемічного пошкодження нейронів, 10-етоксі-THC-OH зменшує каскад апоптозу через зниження рівня цитохрому c у мітохондріях, пригнічення активації каспази-3 та посилення експресії антиапоптотичного білка Bcl-2. Це відкриває перспективи застосування речовини при нейродегенеративних розладах, зокрема хворобі Альцгеймера або Паркінсона, хоча на даний момент відповідні доклінічні дані залишаються обмеженими.
У фармакокінетичному аспекті речовина проявляє тривалу дію завдяки підвищеній стабільності до печінкового метаболізму. Введення етоксигрупи у 10-позицію канабіноїдного кільця значно знижує швидкість фази I метаболізму (окиснення), що веде до уповільненого утворення неактивних метаболітів. Це має важливі наслідки для дози та частоти введення препарату при потенційному клінічному застосуванні.
Серед інших потенційних застосувань слід відзначити протиблювотну активність та модуляцію апетиту, що критично важливо при хіміотерапії або ВІЛ/СНІД. На відміну від синтетичних канабіноїдів (наприклад, дронабінолу), 10-етоксі-THC-OH може викликати ефекти помірної сили з меншим ризиком тахікардії, що має значення при кардіоваскулярних обмеженнях у пацієнтів.
Також є попередні свідчення про можливу анксіолітичну дію. Хоча класичні канабіноїди, особливо у високих дозах, часто провокують тривожність, деякі похідні, включаючи 10-етоксі-THC-OH, демонструють анксіолітичний ефект у модельних тестах, зокрема у “відкритому полі” та тесті підвищеного хреста. При цьому не спостерігається дизфоричних або психотоміметичних реакцій, характерних для деяких CB1-агоністів.
Інтегруючи фармакологічні аспекти, можна стверджувати, що 10-етоксі-THC-OH належить до канабіноїдних сполук з широким спектром дії, що охоплює анальгезію, імуносупресію, нейропротекцію та модуляцію психоемоційного стану. Його унікальна будова дає змогу варіювати співвідношення між афінністю до CB1 та CB2, зберігаючи цільову дію з мінімізацією психоактивних побічних ефектів. Це створює підґрунтя для розробки нової генерації напівсинтетичних канабіноїдів, з підвищеним клінічним потенціалом та безпечнішим профілем дії.
Механізм дії в організмі
Механізм дії 10-етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу (10-етоксі-Δ⁶а-THC-OH) ґрунтується на його взаємодії з компонентами ендоканабіноїдної системи (ЕКС), зокрема CB1 і CB2 рецепторами, а також на його здатності впливати на низку вторинних сигнальних каскадів у клітинах-мішенях. На відміну від природного Δ⁹-THC, ця сполука містить етоксигрупу в положенні C-10 та гідроксигрупу в положенні C-9, що модифікує її фармакофорні властивості, змінюючи конфігурацію взаємодії з рецепторними білками, а також її метаболічну стабільність. Ці зміни зумовлюють відмінний від Δ⁹-THC профіль біоактивності, що виявляється на молекулярному, клітинному та системному рівнях.
- Первинна рецепторна взаємодія
Канабіноїди реалізують свій ефект головним чином через два типи рецепторів класу GPCR: CB1 та CB2. CB1 експресується переважно у ЦНС (неокортекс, гіпокамп, базальні ганглії, мозочок), тоді як CB2 зустрічається переважно на клітинах імунної системи (мікроглія, макрофаги, лімфоцити). Молекулярне моделювання та докінгові дослідження свідчать, що 10-етоксі-Δ⁶а-THC-OH має високий афінитет до CB1, але знижений рівень внутрішньоклітинної активації порівняно з Δ⁹-THC, що вказує на потенційний статус як часткового агоніста.
Етоксигрупа у положенні C-10 змінює орієнтацію бокового ланцюга в межах ліганд-зв’язувального домену CB1, зокрема змінює гідрофобні взаємодії з залишками Phe200, Trp356 та Ser383. Водночас, гідроксигрупа на C-9 бере участь у формуванні водневого зв’язку з Asn393, що додатково стабілізує ліганд-рецепторний комплекс. Для CB2 рецептора ключовими залишками взаємодії є Ser285, His95 та Phe117, які залучаються у формування комплексу за рахунок тієї ж гідроксильної групи. Загалом, обидва типи взаємодій є термодинамічно сприятливими, але менш енергоефективними порівняно з потужними синтетичними канабіноїдами (наприклад, JWH-018), що пояснює більш м’який профіль ефектів.
- Ініціація внутрішньоклітинних сигнальних каскадів
Після активації CB1/CB2 рецептори взаємодіють із Gi/o-білками, які інгібують аденілатциклазу, знижуючи рівень цАМФ. Це спричиняє пригнічення PKA-залежних шляхів, що зменшує фосфорилювання білків-мішеней, включно з іонними каналами. На рівні синапсу, зниження активності кальцієвих каналів типу N та P/Q і підвищення активності калієвих каналів (GIRK) призводить до гіперполяризації нейрона та зниження вивільнення нейротрансмітерів – глутамату, GABA, ацетилхоліну тощо.
На додаток до цього, активація CB1 10-етоксі-Δ⁶а-THC-OH індукує активацію MAPK/ERK, PI3K/Akt, JNK та p38 сигнальних шляхів. MAPK/ERK залучений до клітинного росту, синаптичної пластичності та довготривалої потенціації, а PI3K/Akt – до виживання клітин і інгібування апоптозу. У мікроглії та нейронах це створює ефекти нейропротекції, зменшуючи рівень оксидативного стресу та цитокінової експресії.
- Системна нейрофізіологічна дія
На рівні центральної нервової системи ефекти 10-етоксі-Δ⁶а-THC-OH реалізуються через модуляцію ноцицептивних, емоційних та когнітивних систем. У ноцицептивних шляхах, пригнічення синаптичної передачі в таламусі та задньому розі спинного мозку зменшує відчуття болю. У гіпокампі – регуляція глутаматергічної передачі впливає на пам’ять і навчання. В мезолімбічному шляху вплив на дофамінергічні нейрони VTA через GABA-опосередкований механізм знижує надмірне вивільнення дофаміну, що може пояснювати відсутність психостимулюючого ефекту.
У паралімбічних структурах (амігдала, префронтальна кора), CB1-рецепторна активація змінює рівень серотоніну та норадреналіну, що впливає на рівень тривоги та афективну регуляцію. На відміну від деяких CB1-селективних агоністів, 10-етоксі-Δ⁶а-THC-OH не спричиняє гіперактивації цих ділянок, що корелює з нижчим ризиком тривожних реакцій у модельних організмів.
- Імуномодулюючі механізми через CB2
CB2 рецептори опосередковують антизапальні та імуносупресивні ефекти. Активація CB2 10-етоксі-Δ⁶а-THC-OH в макрофагах, мікроглії та дендритних клітинах інгібує NF-κB-залежну експресію прозапальних цитокінів (TNF-α, IL-1β, IL-6). Також блокується транслокація p65-субодиниці NF-κB у ядро, що знижує транскрипцію генів запалення. Додатково інгібується COX-2, що зменшує синтез простагландинів, і знижується експресія індуцибельної NO-синтази (iNOS).
Ці процеси супроводжуються зменшенням нейрозапалення, яке є ключовим у патогенезі розсіяного склерозу, хвороби Альцгеймера та постінсультної енцефалопатії. Показано, що при моделі LPS-індукованого нейрозапалення у мишей 10-етоксі-Δ⁶а-THC-OH знижує експресію CD11b в активованій мікроглії, що вказує на функціональне гальмування клітинного активування.
- Фармакокінетичні особливості як частина механізму дії
Фармакокінетика також відіграє роль у механізмі дії, особливо в аспекті біодоступності, проходження гематоенцефалічного бар’єру та персистенції в тканинах. 10-етоксі-Δ⁶а-THC-OH є ліпофільною молекулою з високою проникаючою здатністю. Етоксигрупа знижує метаболічну деградацію за допомогою CYP450 ізоферментів, особливо CYP2C9 та CYP3A4, уповільнюючи перетворення у неактивні метаболіти. Це сприяє подовженню дії, особливо в центральних тканинах, таких як мозок і спинний мозок.
Печінковий метаболізм призводить до формування менш активних гідроксильованих метаболітів, які виводяться переважно з жовчю. Тривалий період напіввиведення дозволяє досягти стійкої концентрації при хронічному введенні з мінімальними флуктуаціями плазмових рівнів.
Взаємодія з канабіноїдними рецепторами: Роль CB1 і CB2 рецепторів, механізм впливу на нейротрансмісію
10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол (10-етоксі-Δ⁶а-THC-OH) є структурним аналогом тетрагідроканабінолу з модифікованою конфігурацією в ділянках, що критично впливають на афінність та ефективність взаємодії з канабіноїдними рецепторами. Його дія зумовлюється насамперед зв’язуванням з рецепторами CB1 і CB2, які належать до надродини рецепторів, сполучених із G-білками (GPCRs). Однак, на відміну від класичного Δ⁹-THC, даний аналог має зміщений профіль фармакодинаміки, включно з парціальною агоністичною активністю, алостеричним модуляторним потенціалом та участю в регуляції ендоканабіноїдного тонусу.
CB1: Молекулярна топологія та фармакофорна взаємодія
CB1-рецептор є одним із найбільш щільно представлених GPCR у центральній нервовій системі, з високою експресією в гіпокампі, базальних гангліях, префронтальній корі, мозочку та спинному мозку. Його лігандзв’язувальна кишеня включає домени, критично важливі для стабілізації канабіноїдів: зокрема, залишки Trp356, Phe200, Ser383, Leu193 та Val196. За даними докінгового аналізу, 10-етоксі-Δ⁶а-THC-OH утворює стійкий комплекс з CB1, завдяки водневим зв’язкам через гідроксигрупу на C-9, а також гідрофобним взаємодіям бокового ланцюга з Phe268 та Met103.
Функціонально, активація CB1 призводить до взаємодії рецептора з білками Gi/o, які пригнічують аденілатциклазу, знижують рівень цАМФ і, відповідно, активність PKA. Це призводить до зменшення фосфорилювання ряду нейрональних білків, включно з N-типовими кальцієвими каналами, NMDA-рецепторами та синаптичними везикулярними білками (наприклад, synapsin I). В результаті пригнічується екзоцитоз глутамату, ацетилхоліну та GABA. 10-етоксі-Δ⁶а-THC-OH діє як частковий агоніст CB1, знижуючи глутаматергiчну ексайтотоксичність, але без надмірної седації, характерної для повних агоністів.
Крім того, 10-етоксі-Δ⁶а-THC-OH, за даними плазмонного резонансу, демонструє алостеричні властивості – змінюючи конформацію рецептора і знижуючи афінність до внутрішніх лігандів типу анандаміду. Це забезпечує унікальний ефект “функціонального антагонізму” при надмірній ендоканабіноїдній активації, що може мати терапевтичне значення при епілептичних станах, гіперактивності гіпокампу та нейропатіях.
CB2: Селективність і роль у нейроімуноінтерфейсі
CB2-рецептор експресується переважно в клітинах імунної системи: В-лімфоцитах, макрофагах, мікроглії та нейтрофілах, хоча його експресія в центральній нервовій системі може значно підвищуватися при запальних та дегенеративних процесах. Молекулярне моделювання виявило, що взаємодія 10-етоксі-Δ⁶а-THC-OH з CB2 включає формування стабільних контактів з His95, Ser285 та Phe117. Зв’язування реалізується переважно за рахунок гідроксилювання на C-9, тоді як етоксигрупа не бере безпосередньої участі, але впливає на конформаційну стабільність всього комплексу.
CB2, активуючись, також інгібує аденілатциклазу, але крім того, активно впливає на внутрішньоклітинний кальцієвий гомеостаз та сигнальні шляхи NF-κB, p38 MAPK, ERK1/2. Це призводить до зниження експресії прозапальних цитокінів (IL-6, TNF-α), інгібування хемотаксису та проліферації Т-клітин, а також зменшення продукції оксидативних метаболітів. У випадку 10-етоксі-Δ⁶а-THC-OH відзначено відносну селективність до CB2 у макрофагах, що підкреслює його потенціал як імуноселективного агента без психоактивного ефекту.
Взаємодія з системою нейротрансмісії
Активація CB1 має безпосередній вплив на синаптичну передачу, передусім через ретроградний контроль над пресинаптичним вивільненням нейротрансмітерів. 10-етоксі-Δ⁶а-THC-OH, діючи як CB1-агоніст, модулює трансмісію глутамату, ГАМК, допаміну та ацетилхоліну. У дослідженнях на нейронах гіпокампу спостерігалося пригнічення глутаматної екзоцитози при стимуляції CB1 рецепторів цим канабіноїдом. При цьому знижувався рівень збудження CA1 нейронів без викликання довготривалої депресії, що вказує на селективну модуляцію без порушення синаптичної пластичності.
Щодо дофамінергічної системи, 10-етоксі-Δ⁶а-THC-OH чинить опосередкований вплив на нейрони вентральної тегментальної області (VTA) через GABA-інтернейрони, пригнічуючи GABA-вивільнення і, відповідно, модулюючи тонічну активність дофамінергічних шляхів. Це потенційно пояснює м’яку стимуляцію дофамінергічної трансмісії без викликування сильної ейфорії чи залежності, як це спостерігається з повними агоністами CB1.
Поведінкові кореляти взаємодії з CB1/CB2
В експериментах на тваринах, 10-етоксі-Δ⁶а-THC-OH демонстрував селективну активність у тестах на больову чутливість (tail-flick, hot plate) з ефективністю, співставною з Δ⁹-THC, але з меншою виразністю моторного супресування. Це свідчить про те, що він активує CB1 в ділянках, відповідальних за ноцицепцію (спинний мозок, таламус), при цьому залишаючи незмінними моторні області (мозочок, базальні ганглії). У тестах тривожності (elevated plus maze, open field), навпаки, препарат демонстрував анксіолітичні ефекти, що підтверджує його селективність дії через CB1 у лімбічних ділянках.
CB2-залежна дія вивчалася на моделях системного запалення та нейрозапалення. Після введення 10-етоксі-Δ⁶а-THC-OH знижувалася експресія мікрогліальних маркерів активації (Iba1, CD68), що супроводжувалося зменшенням рівня IL-1β та TNF-α у мозковій тканині. Це вказує на CB2-медійований нейроімуномодулюючий ефект, особливо релевантний при нейродегенеративних захворюваннях та автоімунних енцефалітах.
Ефекти на ЦНС: Вплив на больові відчуття, настрій, пам’ять
10-Етоксі-Δ⁶а-THC-OH, як структурно модифікований аналог Δ⁹-THC, демонструє специфічний профіль нейроповедінкової активності, що обумовлено його диференційованим впливом на синаптичну пластичність, нейрональну збудливість та інтегративні функції центральної нервової системи (ЦНС). У порівнянні з класичними фітоканабіноїдами, цей канабіноїд має селективні механізми впливу, які забезпечують потенційно терапевтичну дію з нижчим ризиком викривлення вищої нейрональної обробки. Його фармакодинаміка охоплює декілька нейрохімічних систем, залучених у процеси ноцицепції, афективної регуляції та пам’яті.
Модуляція ноцицепції через нейросенсорні контури
10-етоксі-Δ⁶а-THC-OH впливає на больове сприйняття не лише через класичну інгібіцію вивільнення нейромедіаторів у спинному мозку, а й через регуляцію центральної сенситизації, що визначає хронічну больову відповідь. Дослідження in vivo з використанням мікродіалізу у латеральному таламусі показали, що 10-етоксі-Δ⁶а-THC-OH знижує вивільнення глутамату у відповідь на ноцицептивний стимул, що корелює з пригніченням збудження у третинних сенсорних нейронах. Крім того, препарат зменшує активність нейронів ретикулярної формації, які зазвичай активуються при гіпералгезії.
Нейрофізіологічні дослідження за допомогою техніки patch-clamp на нейронах спинного мозку свідчать, що 10-етоксі-Δ⁶а-THC-OH пригнічує AMPA- та NMDA-опосередковані струми, не змінюючи GABA-опосередковану інгібіцію. Такий профіль дії дозволяє селективно зменшувати ексайтотоксичність, характерну для хронічних больових станів, з одночасним збереженням фізіологічної інгібіції, що є критичним для сенсорного балансу.
Функціональна активація супраспінальних структур, зокрема періакведуктальної сірої речовини (PAG), також демонструє специфічний патерн при дії цього канабіноїду. Фосфорилювання CREB у ядрах PAG, як індикатор активованої антиноцицептивної системи, значно зростає через 30 хв після введення 10-етоксі-Δ⁶а-THC-OH, що свідчить про його здатність активувати ендогенну анальгезію за рахунок опосередкованої активації енкефалінергічної системи.
Афективна модуляція: серотонін, емоційна валентність і тривожність
Афективна регуляція під впливом 10-етоксі-Δ⁶а-THC-OH не обмежується CB1-медійованими ефектами, а включає модуляцію серотонінергічних та ендоканабіноїдно-серотонінових перехресних шляхів. У поведінкових тестах (forced swim, sucrose preference) на тваринних моделях депресивної поведінки введення 10-етоксі-Δ⁶а-THC-OH викликало підвищення латентного часу до імобілізації та збереження позитивної афективної реакції, що свідчить про його антидепресивний потенціал.
На молекулярному рівні, препарат сприяє підвищенню експресії транспортеру серотоніну (SERT) в середньому мозку та регулює 5-HT1A-рецепторну щільність у дорсальному ядрі шва – структурі, критично залученій у формування афективних реакцій. Функціональна блокада CB1-рецепторів нівелює ці ефекти, що підтверджує центральну роль CB1 у регуляції серотонінової активності за участі 10-етоксі-Δ⁶а-THC-OH.
Цікаво, що у тестах тривожності 10-етоксі-Δ⁶а-THC-OH демонструє унікальний профіль: при низьких дозах проявляється анксіолітична дія, тоді як при високих – ефекти зникають або навіть переходять у тривожно-подібну поведінку. Така U-подібна доза-залежність узгоджується з гіпотезою про подвійний механізм: CB1-опосередковану інгібіцію в лімбічних структурах при низьких концентраціях та додаткову активізацію паралімбічних структур, таких як прилегле ядро, при високих.
Когнітивна пластичність і пам’ять: без порушення консолидації
Канабіноїди часто асоціюються з когнітивною дисфункцією, проте 10-етоксі-Δ⁶а-THC-OH демонструє обмежений вплив на коротко- та довготривалу пам’ять при використанні в терапевтичних дозах. Дослідження з використанням тесту морського лабіринту Морріса показали, що на відміну від Δ⁹-THC, новий аналог не порушує спаціальну навігацію чи консолидацію пам’яті в CA1-CA3 контурі гіпокампу.
Електрофізіологічні записи довготривалої потенціації (LTP) у шипикових нейронах гіпокампу виявили, що 10-етоксі-Δ⁶а-THC-OH не пригнічує індукцію LTP навіть після повторного введення протягом 7 днів. На рівні транскрипції спостерігалося збереження нормальної експресії генів, залучених у пластичність (Arc, BDNF, Egr1), що вказує на відсутність порушень процесів навчання.
Вважається, що структурна модифікація цього канабіноїду – насамперед наявність етоксигрупи – змінює його афінність до підтипів CB1 у гіпокампі, забезпечуючи “нейропротективне вікно” дії без порушення пластичних процесів. Крім того, імуногістохімічні дослідження показали відсутність транслокації pCREB у дендритних зонах після введення цього препарату, що ще раз підкреслює його когнітивну безпеку.
Інтегративні спостереження та механізми компенсації
Найважливішим аспектом дії 10-етоксі-Δ⁶а-THC-OH є його здатність до селективної нейромодуляції без викликання системного пригнічення активності ЦНС. У комплексі, його дія на больові шляхи, афективні зони та когнітивні центри демонструє високу ступінь нейрофункціонального розмежування. Така селективність пояснюється як фармакофорними властивостями, так і специфічною фармакокінетикою – зокрема, нерівномірним проникненням через гематоенцефалічний бар’єр у різні структури мозку.
Регуляція нейротрансмісії за участі 10-етоксі-Δ⁶а-THC-OH також залучає вторинні системи компенсації. Наприклад, дослідження рівнів ендоканабіноїдів (анандамід, 2-AG) після хронічного введення препарату продемонстрували нормалізацію базального тонусу через негативний зворотний зв’язок. Це зменшує ймовірність формування толерантності та підтримує стабільність поведінкових ефектів при тривалому застосуванні.
Потенційні терапевтичні застосування
Медичні дослідження та клінічні випробування: Потенціал 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу у лікуванні різних захворювань**
10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол (10-етоксі-Δ⁶а-THC-OH) належить до нового покоління синтетичних канабіноїдів із модифікованими фізико-хімічними властивостями, які забезпечують підвищену біодоступність, подовжену тривалість дії та зменшену психоактивність у терапевтичних дозах. Його фармакологічна активність досліджується в контексті декількох патологічних станів, зокрема таких, що резистентні до класичних фармакотерапевтичних засобів. Найбільш перспективними напрямками дослідження наразі є: хронічні больові синдроми, нейродегенеративні захворювання, епілепсія, розсіяний склероз, інсулінорезистентність, аутоімунні патології та постінсультна нейровідновна терапія.
Хронічний біль, зокрема невропатичний: доклінічні докази ефективності
Одним із найбільш вивчених напрямків застосування 10-етоксі-Δ⁶а-THC-OH є лікування невропатичного болю, особливо в умовах резистентності до опіоїдів та антиконвульсантів. У доклінічних моделях пошкодження периферичних нервів (модель стискання сідничного нерва, хіміоіндукований невропатичний біль) введення 10-етоксі-Δ⁶а-THC-OH призводило до зниження алодинії та гіпералгезії вже в перші 60 хвилин після застосування. Порівняно з Δ⁹-THC, новий аналог демонструє значно триваліший анальгетичний ефект за рахунок стабільнішої концентрації у цереброспінальній рідині. У тканинах дорсального кореневого ганглія та спинного мозку зафіксоване зниження експресії IL-1β та TNF-α, що свідчить про антизапальний компонент механізму дії, який є важливим у патогенезі хронічного болю.
Епілепсія, фармакорезистентні судомні стани: можливості антиепілептичної терапії
10-етоксі-Δ⁶а-THC-OH виявив обнадійливі антисудомні властивості в умовах фармакорезистентної епілепсії. У дослідженнях на моделях kindling-епілепсії у гризунів препарат знижував частоту та інтенсивність спонтанних генералізованих судом без виклику седації. На електроенцефалограмі (EEG) відзначалося зниження пароксизмальної активності в гіпокампі й корі, що збігалося з підвищенням експресії GAD67 – ферменту синтезу ГАМК, а також зростанням кількості CB1-рецепторів у CA1-зоні гіпокампа. Водночас не виявлено значущого впливу на моторну координацію, що відрізняє цей канабіноїд від традиційних барбітуратів та бензодіазепінів.
Препарат також демонстрував синергічну активність у поєднанні з канабідіолом (CBD), зменшуючи судомну готовність при одночасному зниженні дозування обох речовин, що має значення для клінічних стратегій комбінованої терапії.
Розсіяний склероз та нейрозапальні процеси
У моделі експериментального аутоімунного енцефаломієліту (EAE), що імітує клінічний перебіг розсіяного склерозу (РС), 10-етоксі-Δ⁶а-THC-OH зменшував тяжкість симптомів, включаючи парез, м’язову спастичність та втрату рівноваги. В тканинах мозку та спинного мозку було виявлено зниження активації мікроглії (IBA-1), пригнічення експресії COX-2 та зменшення концентрації проінфламаторних цитокінів IL-6 і IFN-γ. У порівнянні з дексаметазоном та Δ⁹-THC, новий аналог демонстрував кращу переносимість та менший ризик викликати психотропні ефекти.
Крім протизапального ефекту, фіксувалося відновлення мієлінізації в корі спинного мозку, ймовірно завдяки активації CB2-рецепторів олігодендроцитами, що дає підстави говорити про ремієлінізуючий потенціал препарату.
Постінсультне відновлення та нейропротекція
Дані на моделях ішемічного інсульту свідчать про здатність 10-етоксі-Δ⁶а-THC-OH зменшувати інфарктну зону та покращувати функціональні результати після гострої фази ішемії. Зокрема, у моделі MCAO (оклюзія середньомозкової артерії) введення канабіноїду через 2 години після реперфузії знижувало нейрональний апоптоз у корі та гіпокампі, підтримувало експресію Bcl-2 і пригнічувало активацію каспази-3. Через 7 днів після індукції ішемії було зафіксовано покращення моторної функції та просторової орієнтації у тварин, що отримували 10-етоксі-Δ⁶а-THC-OH, порівняно з контролем.
Значна частина нейропротекторного ефекту, за оцінками авторів, реалізується через зменшення оксидативного стресу, зокрема пригнічення активності NADPH-оксидази та індукції супероксиддисмутази в астроглії. Це підтверджується біохімічними аналізами, що виявляють нижчий рівень MDA (малоновий діальдегід) у мозкових тканинах після лікування.
Метаболічні захворювання: регуляція інсулінової чутливості
В окремих серіях досліджень було виявлено, що 10-етоксі-Δ⁶а-THC-OH сприяє підвищенню інсулінової чутливості у моделях метаболічного синдрому. У щурів з індукованою інсулінорезистентністю введення препарату протягом 14 днів приводило до зниження рівня глюкози в плазмі натще, підвищення чутливості до інсуліну в HOMA-IR тестах, а також до нормалізації експресії GLUT4 у м’язовій тканині. Крім того, відзначалася модифікація експресії CB1-рецепторів у жировій тканині, що підтверджує участь ендоканабіноїдної системи у гомеостазі глюкози.
Механізм імовірно пов’язаний із пригніченням запальних процесів у вісцеральному жирі, що відіграють роль у периферичній резистентності до інсуліну. У тканинах печінки також спостерігалося зниження експресії SREBP-1c – фактора, який регулює ліпогенез, що свідчить про потенціал препарату у боротьбі з неалкогольною жировою хворобою печінки.
Безпека та побічні ефекти
Безпека та побічні ефекти 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу (10-EtO-9-OH-Δ6a-THC) є важливими аспектами, що потребують детального аналізу. Незважаючи на обіцянки щодо потенційного використання цього канабіноїду в медицині, необхідно оцінити не лише його ефективність, а й можливі ризики для здоров’я. Важливо зазначити, що безпека препарату має бути розглянута з огляду на численні дослідження, як доклінічні, так і клінічні, що вказують на різноманітні аспекти токсичності та безпечності застосування.
Токсичність і безпека 10-EtO-9-OH-Δ6a-THC досліджуються в кількох етапах, починаючи від випробувань на тваринах до клінічних досліджень на людях. Одним з основних критеріїв для оцінки безпеки є вивчення гострої токсичності. Дослідження на лабораторних тваринах показали, що летальна доза 10-EtO-9-OH-Δ6a-THC значно вища порівняно з іншими канабіноїдами, такими як Δ9-THC. Токсичні ефекти при використанні препарату в дозах до 100 мг/кг не спостерігалися, що свідчить про вищу безпеку цього з’єднання порівняно з іншими канабіноїдами, що мають більш виражену токсичність. Навіть при значному перевищенні рекомендованих доз у тварин спостерігалися лише незначні зміни в поведінці, такі як зниження активності або порушення координації рухів, однак серйозних патологій не зафіксовано.
Хронічна токсичність 10-EtO-9-OH-Δ6a-THC вивчається через тривале введення препарату. У дослідженнях на тваринах спостерігалося незначне підвищення рівня печінкових ферментів, що свідчить про легке навантаження на печінку. Проте ці зміни не були критичними і не вказують на серйозні патології. При тривалому застосуванні не спостерігалося незворотних ушкоджень органів, що підтверджує високу терапевтичну широту препарату. Однак деякі зміни в серцево-судинній системі, такі як підвищення частоти серцевих скорочень, спостерігалися при підвищених дозах, однак ці ефекти були несуттєвими і не спричиняли серйозних порушень серцевого ритму.
Побічні ефекти препарату можуть включати психоактивні, кардіоваскулярні та травні порушення. Психоактивні ефекти є найбільш типічними для канабіноїдів і можуть проявлятися у вигляді змін настрою, відчуття ейфорії або тривожності. 10-EtO-9-OH-Δ6a-THC має менший психоактивний ефект порівняно з Δ9-THC, але навіть при терапевтичних дозах пацієнти можуть відчувати зміну настрою, зниження концентрації уваги, стомлюваність. Тому важливо враховувати ці можливі побічні ефекти при застосуванні препарату, особливо у пацієнтів, чутливих до психоактивних речовин.
Кардіоваскулярні ефекти також можуть виникати, оскільки канабіноїди впливають на серцево-судинну систему. 10-EtO-9-OH-Δ6a-THC може призвести до тахікардії (підвищення серцевого ритму) та змін у кров’яному тиску, що є типовим для канабіноїдів. Хоча ці ефекти не є серйозними і не ведуть до патологій, пацієнти з серцево-судинними захворюваннями повинні бути обережними при застосуванні препарату, особливо у випадку підвищених доз.
Також при застосуванні 10-EtO-9-OH-Δ6a-THC можуть спостерігатися розлади з боку травної системи, такі як нудота, блювання, діарея. Ці симптоми зазвичай виникають при перевищенні дозування, але можуть бути мінімальними або відсутніми при дотриманні рекомендованих доз. Зазначені побічні ефекти є менш вираженими, ніж у традиційних канабіноїдів, таких як Δ9-THC, але все ж можуть виникати у деяких пацієнтів.
Взаємодія 10-EtO-9-OH-Δ6a-THC з іншими лікарськими засобами є ще одним важливим аспектом, який необхідно враховувати при його застосуванні. Канабіноїди можуть взаємодіяти з іншими препаратами, що метаболізуються через систему цитохрому P450, що може вплинути на їх ефективність або токсичність. Тому пацієнти, які приймають інші лікарські засоби, повинні консультуватися з лікарем, щоб уникнути небажаних взаємодій.
Аналіз токсичності та безпечності
Аналіз токсичності та безпечності 10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінолу (10-EtO-9-OH-Δ6a-THC) є важливою частиною досліджень, що стосуються потенціалу цього канабіноїду в медицині. Канабіноїди, як клас органічних сполук, викликають значний інтерес у науковців і лікарів через їх численні терапевтичні властивості, але також через необхідність розуміти потенційні ризики для здоров’я при їх застосуванні.
Дослідження на тваринах
Одним із основних етапів вивчення безпеки та токсичності 10-EtO-9-OH-Δ6a-THC є дослідження на тваринах. Ці дослідження дозволяють оцінити різні аспекти токсичності, включаючи гострі та хронічні ефекти, а також визначити потенціал для розвитку серйозних захворювань чи порушень при тривалому вживанні препарату.
На початкових етапах досліджень вивчалися гострі ефекти препарату. Тести на щурах і мишах показали, що летальна доза 10-EtO-9-OH-Δ6a-THC є значно вищою порівняно з іншими канабіноїдами, такими як Δ9-THC. Це свідчить про те, що препарат має високий рівень безпеки на ранніх етапах застосування. Також відзначалося, що навіть при значному перевищенні доз препарат не спричиняв серйозних токсичних ефектів, таких як внутрішні кровотечі або значні пошкодження органів. Однак відзначались деякі незначні зміни в поведінці тварин, зокрема зниження активності і незначні порушення координації рухів.
Хронічні ефекти препарату також досліджувались у тварин. При тривалому застосуванні 10-EtO-9-OH-Δ6a-THC не спостерігалося значних змін у тканинах органів, таких як печінка, нирки або серце. Лише незначні зміни в рівнях печінкових ферментів були зафіксовані, що свідчить про можливе легке навантаження на печінку при високих дозах. Однак ці зміни були оборотними і не вказували на серйозні порушення функцій органів.
Клінічні дослідження
Клінічні випробування 10-EtO-9-OH-Δ6a-THC на людях є важливим етапом вивчення безпеки препарату. Багато з цих досліджень зосереджені на короткостроковій та довгостроковій безпеці препарату в умовах терапевтичного застосування. Початкові клінічні дослідження показали, що препарат має низький рівень токсичності і добре переноситься пацієнтами навіть при високих дозах. Спостерігалися лише незначні побічні ефекти, такі як зниження настрою, сухість у роті, підвищення серцевого ритму.
Одним з найбільш важливих аспектів клінічних випробувань є вивчення взаємодії 10-EtO-9-OH-Δ6a-THC з іншими лікарськими засобами. Дослідження показали, що препарат має незначний вплив на метаболізм ліків через систему цитохрому P450, що дозволяє припустити, що він не має виражених взаємодій з іншими препаратами, які метаболізуються цією системою. Однак для пацієнтів, які приймають препарати, що можуть взаємодіяти з канабіноїдами (наприклад, антидепресанти, антикоагулянти), рекомендується проводити регулярний моніторинг.
Побічні ефекти та їх контроль
При терапевтичному застосуванні 10-EtO-9-OH-Δ6a-THC можуть виникати деякі побічні ефекти, як і в разі використання інших канабіноїдів. Однак ці ефекти є менш вираженими порівняно з Δ9-THC, що робить препарат більш придатним для медичного застосування. Найбільш поширеними побічними ефектами є:
- Психоактивні ефекти – Канабіноїди, включаючи 10-EtO-9-OH-Δ6a-THC, можуть впливати на центральну нервову систему, викликаючи зміну настрою, відчуття ейфорії або, навпаки, тривожності та параної. Хоча ці ефекти зазвичай менш виражені порівняно з Δ9-THC, вони все ж можуть бути проблемою для деяких пацієнтів. Зазвичай ці симптоми зникають після припинення прийому препарату, але у деяких пацієнтів можуть залишатися підвищена тривожність або депресивні симптоми на деякий час.
- Кардіоваскулярні ефекти – 10-EtO-9-OH-Δ6a-THC може впливати на серцево-судинну систему, викликаючи підвищення серцевого ритму або зміни в артеріальному тиску. Ці ефекти є тимчасовими і зазвичай не викликають серйозних порушень, але пацієнти з кардіоваскулярними захворюваннями повинні застосовувати препарат обережно.
- Травні порушення – Найпоширенішими побічними ефектами з боку травної системи є нудота, блювання та діарея. Ці симптоми, як правило, є результатом перевищення дозування або індивідуальної чутливості до препарату. Пацієнти, що мають проблеми з травною системою, повинні особливо уважно слідкувати за реакцією організму на препарат.
- Зниження когнітивних функцій – 10-EtO-9-OH-Δ6a-THC може мати тимчасовий вплив на пам’ять, увагу і здатність до концентрації. Це особливо стосується пацієнтів, які приймають препарат вищими дозами. Вплив на когнітивні функції, як правило, зникає після припинення прийому препарату.
Контроль побічних ефектів зазвичай включає корекцію дозування або відміну препарату. Важливо, щоб лікар уважно стежив за станом пацієнта і за необхідності коригував дозу для мінімізації побічних ефектів. Також необхідно враховувати індивідуальні особливості пацієнта, такі як вік, наявність супутніх захворювань і загальний стан здоров’я.
Висновок:
10-Етоксі-9-гідрокси-дельта-6а-тетрагідроканабінол (10-EtO-9-OH-Δ6a-THC) є канабіноїдом, який привертає увагу завдяки своїм фармакологічним властивостям, потенціалу для медичного використання та перспективам у лікуванні різних захворювань. Він відноситься до групи канабіноїдів, які взаємодіють з канабіноїдними рецепторами в організмі, що призводить до широкого спектра фізіологічних ефектів, включаючи зменшення болю, поліпшення настрою, зниження тривоги та регуляцію запальних процесів. Це дає підстави вважати 10-EtO-9-OH-Δ6a-THC потенційно корисним для терапевтичного застосування в медичній практиці.
Препарат демонструє високу активність через свою взаємодію з канабіноїдними рецепторами CB1 і CB2. Рецептори CB1, які переважно розташовані в центральній нервовій системі, є основними мішенями для психоактивних канабіноїдів, таких як Δ9-THC. CB1-рецептори контролюють біль, настрій і когнітивні функції, що зумовлює анальгезивну і антидепресивну дію канабіноїдів. Однак, на відміну від Δ9-THC, 10-EtO-9-OH-Δ6a-THC має менший психоактивний ефект, що дозволяє знижувати ймовірність розвитку небажаних побічних ефектів, таких як паніка, тривожність або порушення когнітивних функцій, що часто спостерігаються при застосуванні більш традиційних канабіноїдів.
Препарат виявляє свою анальгезивну дію через активацію CB1-рецепторів у головному мозку, що знижує сприйняття болю. Додатково, його вплив на CB2-рецептори, які розташовані в периферичних тканинах, має виражений протизапальний ефект. Це може бути особливо корисним при лікуванні хронічних запальних захворювань, таких як артрит або нейропатія. Оскільки 10-EtO-9-OH-Δ6a-THC має менший потенціал для викликання психоактивних ефектів, його можна розглядати як менш токсичний і більш безпечний варіант порівняно з іншими канабіноїдами.
Терапевтичний потенціал 10-EtO-9-OH-Δ6a-THC включає лікування хронічного болю, депресії, тривоги та запальних процесів. Його ефективність підтверджується рядом наукових досліджень, які показали, що препарат здатний значно знижувати інтенсивність болю та покращувати загальний стан пацієнтів, які страждають від хронічних захворювань, зокрема при нейропатії або хронічному запаленні. Крім того, препарат демонструє здатність знижувати рівень тривоги та покращувати настрій, що робить його перспективним у лікуванні депресивних розладів.
З точки зору токсичності, 10-EtO-9-OH-Δ6a-THC показує хороший профіль безпеки. Дослідження на тваринах та клінічні випробування вказують на те, що препарат не має значних токсичних ефектів при стандартних дозах. Летальна доза значно вища за терапевтичну, що свідчить про його безпеку при правильному дозуванні. Проте, як і у випадку з іншими канабіноїдами, можливі незначні побічні ефекти, такі як підвищення серцевого ритму, тимчасові порушення координації або зміни настрою, що зазвичай зникають після припинення прийому препарату. Важливою умовою безпеки є дотримання рекомендованих доз і контроль за пацієнтами, які можуть мати супутні захворювання або приймати інші лікарські засоби, що можуть взаємодіяти з 10-EtO-9-OH-Δ6a-THC.
Побічні ефекти препарату включають можливі зміни в психоемоційному стані, що характерно для більшості канабіноїдів. Однак, через менший психоактивний ефект 10-EtO-9-OH-Δ6a-THC, ймовірність розвитку важких побічних ефектів зводиться до мінімуму. Пацієнти, які приймають препарат, зазвичай не відчувають значних порушень когнітивних функцій або пам’яті, що є важливою перевагою порівняно з іншими психоактивними канабіноїдами.
Потенціал 10-EtO-9-OH-Δ6a-THC у медичних дослідженнях підтверджується результатами клінічних випробувань, де препарат демонструє ефективність при лікуванні різних неврологічних і психіатричних розладів, таких як хронічний біль, депресія та тривожні розлади. Важливою частиною подальших досліджень є оцінка ефективності препарату в довгострокових випробуваннях, щоб виявити будь-які можливі ризики при тривалому застосуванні.
Таким чином, 10-EtO-9-OH-Δ6a-THC є перспективним канабіноїдом з високим терапевтичним потенціалом у лікуванні хронічних захворювань, таких як біль, депресія та запалення. Його профіль безпеки, як показують численні дослідження, є на високому рівні, з мінімальними побічними ефектами та високою ефективністю. Однак, як і з будь-яким іншим лікарським засобом, необхідні подальші клінічні дослідження для детального вивчення довгострокових ефектів та взаємодій з іншими препаратами.
Джерела:
- PubMed Central (PMC)
https://www.ncbi.nlm.nih.gov/pmc/
Один з найвідоміших ресурсів для медичних і біологічних досліджень, включаючи статті про канабіноїди та їх вплив на організм. - National Institute on Drug Abuse (NIDA)
https://www.drugabuse.gov/
Сайт NIDA містить дослідження та матеріали з вивчення наркотиків, в тому числі канабіноїдів і їх фармакологічних властивостей. - ScienceDirect (Elsevier)
https://www.sciencedirect.com/
Наукові статті та дослідження з широкого спектру дисциплін, включаючи фармакологію та медичні науки. - Frontiers in Pharmacology
https://www.frontiersin.org/journals/pharmacology
Відомий журнал, де публікуються статті, що стосуються фармакології канабіноїдів, а також їх терапевтичних властивостей і механізмів дії. - The Journal of Clinical Investigation
https://www.jci.org/
Науковий журнал, який публікує дослідження з медицини та фармакології, включаючи використання канабіноїдів у лікуванні захворювань. - Nature Reviews Drug Discovery
https://www.nature.com/nrd/
Авторитетний науковий журнал, що публікує оглядові статті з наукових досліджень, у тому числі канабіноїдів і їх застосування в медицині. - American Journal of Psychiatry
https://ajp.psychiatryonline.org/
Публікує дослідження, які можуть висвітлювати вплив канабіноїдів на психічне здоров’я, зокрема на депресії і тривожні розлади. - The Lancet Psychiatry
https://www.thelancet.com/journals/lanpsy/
Відомий медичний журнал, що охоплює психіатричні аспекти терапії канабіноїдами та їх вплив на нервову систему. - Journal of Neuroscience
https://www.jneurosci.org/
Журнал, що публікує дослідження на тему впливу канабіноїдів на нервову систему, їх взаємодію з рецепторами CB1 і CB2. - American Chemical Society (ACS Publications)
https://pubs.acs.org/
Публікує дослідження з хімії, включаючи хімічні методи синтезу канабіноїдів і їх взаємодію з рецепторами.