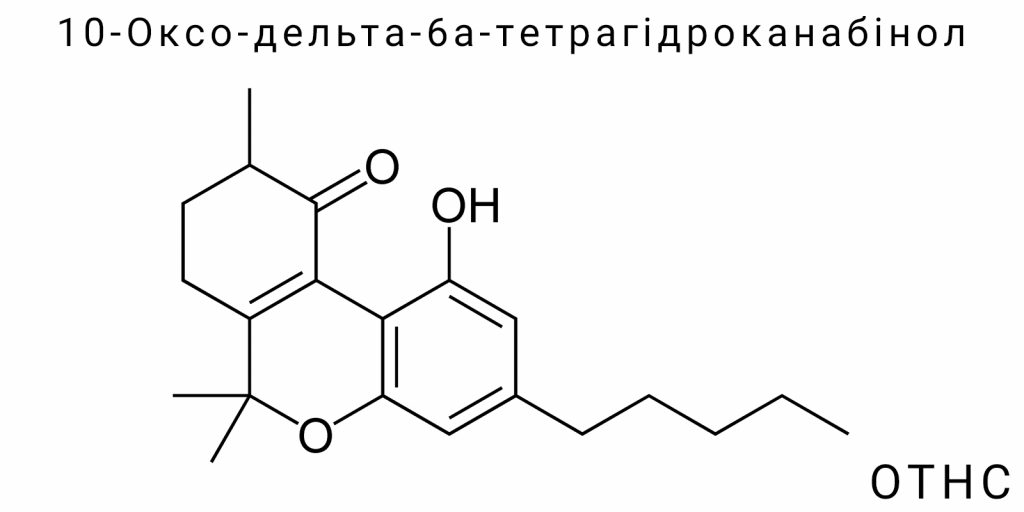
У сучасній хімії канабіноїдів спостерігається стрімке зростання інтересу до похідних тетрагідроканабінолу, які не трапляються в природному канабісі, але утворюються в результаті синтетичних реакцій. Однією з таких сполук є 10-Оксо-дельта-6а-тетрагідроканабінол (OTHC) – канабіноїд з рідкісною структурною конфігурацією, яка відрізняється наявністю кетонної (оксо-) функціональної групи в положенні 10 та подвійного зв’язку між атомами C6a та C10a. Хоча ця молекула була вперше згадана в хімічній літературі ще в середині XX століття в контексті побічних продуктів реакцій з Δ⁹-THC, лише останніми роками OTHC почав привертати увагу як об’єкт цілеспрямованих досліджень у сфері психоактивних речовин нового покоління (NPS – new psychoactive substances).
Складна правова ситуація навколо класичних канабіноїдів, зокрема Δ⁹-тетрагідроканабінолу, сприяла розвитку синтетичних технологій, спрямованих на виробництво альтернативних сполук із подібною фармакодинамікою, але зі зміненим хімічним профілем, який дозволяє обійти правові обмеження. Серед таких похідних – Δ⁸-THC, HHC, THCP, THCO та інші. OTHC в цьому контексті виділяється через те, що його поява не є результатом свідомого дизайну з метою підвищення афінності до канабіноїдних рецепторів або зміни тривалості дії. Натомість він часто утворюється мимовільно – як побічний продукт в реакціях ізомеризації або окиснення, що супроводжують напівсинтетичне отримання інших сполук. Саме через цей факт довгий час OTHC не розглядався як окремий фармакологічний об’єкт.
Незважаючи на те, що досі не існує систематичних клінічних досліджень OTHC, його структура викликає інтерес з боку молекулярної фармакології. Оксо-група в положенні 10 здатна значно впливати на електронну густину ароматичної системи та конформацію бокового ланцюга, що безпосередньо впливає на зв’язування з рецепторами CB1 і CB2 – основними мішенями для канабіноїдних сполук в організмі людини. Додатково, вплив оксо-групи на ліпофільність молекули може змінити швидкість її проникнення через гематоенцефалічний бар’єр, тривалість дії та механізми метаболізму в печінці.
У фармакокінетичному контексті більшість канабіноїдів характеризуються швидкою біотрансформацією за участю ферментів системи цитохрому P450, з утворенням полярних метаболітів, які виводяться з сечею та жовчю. Відомо, що незначні зміни в хімічній структурі можуть суттєво змінити метаболічну долю речовини: як за швидкістю деградації, так і за утворенням активних або токсичних метаболітів. У випадку OTHC, кетонна група може брати участь у редукційно-окисних процесах, що формує потенційно нові метаболічні шляхи, не характерні для класичних фітоканабіноїдів. Поки що ці аспекти залишаються невивченими, що відкриває широке поле для досліджень у фармацевтичній та токсикологічній галузях.
З технологічної точки зору, синтез OTHC є складним з огляду на низьку стабільність проміжних продуктів і ймовірність побічних реакцій. Один із основних маршрутів включає окиснення Δ⁸-THC або Δ⁹-THC у присутності кислотних каталізаторів із наступною реакцією циклізації. Інші варіанти включають часткову ізомеризацію CBD з подальшим введенням оксо-функціоналу. Особливої уваги заслуговують дослідження, які фокусуються на механізмах утворення OTHC як домішки під час синтезу THCO або THCP – що свідчить про потенційні ризики в комерційному виробництві канабіноїдних екстрактів низької чистоти.
Варто зазначити, що OTHC почав з’являтися у складі нелегальних сумішей на ринку США та Європи, що підтверджено хімічним аналізом конфіскованих зразків. Це викликає занепокоєння в регуляторних органів, оскільки точний токсикологічний профіль цієї речовини невідомий, а її вплив на центральну нервову систему може виявитися значно відмінним від “батьківських” канабіноїдів. Деякі первинні дані in vitro свідчать про відносно низьку афінність до рецепторів CB1 у порівнянні з Δ⁹-THC, проте присутність кетогрупи відкриває потенціал до взаємодії з іншими ферментативними мішенями – зокрема, з ензимами, пов’язаними із запаленням або болем.
Правовий статус OTHC у більшості країн наразі невизначений. Через те, що ця сполука не включена до списку контрольованих речовин, вона формально може розглядатися як “сіра зона”, що відкриває можливості для її використання в нелегальному обігу. Водночас, наявність потенційної психоактивності, токсикогенних метаболітів або непередбачуваної дії на ЦНС робить таке використання ризикованим. Саме тому кілька токсикологічних лабораторій ЄС ініціювали програми з вивчення OTHC в рамках системи раннього виявлення нових психоактивних речовин (EU EWS).
Хімічна структура та фізико-хімічні властивості
10-Оксо-дельта-6а-тетрагідроканабінол (OTHC) є представником класу синтетичних канабіноїдів, що утворюється в результаті хімічної модифікації природних або напівсинтетичних канабіноїдів. Його хімічна структура відзначається високою специфічністю: вона містить оксо-групу (кетон) у положенні 10 молекули тетрагідроканабінолу, що призводить до зміни електронної конфігурації та просторової орієнтації ядра молекули, а також до потенційних змін у взаємодії з рецепторами канабіноїдної системи. Поява OTHC в системі новітніх канабіноїдів є результатом побічного окиснювального шляху при синтезі інших похідних THC, зокрема THCO або Δ⁸-THC, коли відбувається перенесення електронної густини та формування нових π-зв’язків у центральному кільці молекули.
Структурно, OTHC є похідним трьохкільцевої системи канабіноїдів, побудованої на базі триметилтріхроменового скелету, де модифікації в положеннях C6a, C10a і C10 змінюють як конфігурацію, так і електронні властивості молекули. Наявність подвійного зв’язку між атомами в положенні 6а та 10а (тобто Δ⁶а), а також карбонільна група в положенні 10 виділяє OTHC серед класичних ізомерів THC, де зазвичай у цьому положенні присутній водень. Саме ці зміни мають критичний вплив на конформаційну рухливість молекули, її ліпофільність, а також афінність до мембранних рецепторів.
Однією з ключових особливостей OTHC є його кетонна функціональна група, яка володіє електронодефіцитними властивостями та здатна до гідрофільних взаємодій з водними середовищами, що контрастує з типовою гідрофобною природою канабіноїдних сполук. Це суттєво впливає на фармакокінетику сполуки, зокрема на її розчинність у ліпідному середовищі, проникність через гематоенцефалічний бар’єр та метаболічну стабільність. Крім того, карбонільна група, як правило, є об’єктом редукції в біохімічних середовищах, що передбачає утворення нових метаболітів – зокрема гідроксильованих похідних, які можуть володіти власною біологічною активністю або токсичністю.
Щодо просторової будови, важливо розуміти, що хімічна структура OTHC дозволяє існування кількох діастереомерів, оскільки кільцева система канабіноїду містить стереогенні центри. Конфігурація цих центрів безпосередньо впливає на взаємодію з канабіноїдними рецепторами. Для класичних канабіноїдів встановлено, що лише одна з енантіомерних форм проявляє високу афінність до рецептора CB1, тоді як інші або є інертними, або поводяться як часткові агоністи. У випадку OTHC ці стереоізомери ще не були систематично описані у літературі, хоча є підстави вважати, що конфігурація в положенні C9 (аналогічному до Δ⁹-THC) може критично визначати психоактивний потенціал молекули.
Унікальність OTHC також виявляється у його реакційній здатності. Карбонільна група здатна вступати в реакції нуклеофільного приєднання, утворюючи можливі гідрати, енаміни або оксими у відповідних умовах. Ці хімічні перетворення можуть бути як бажаними в рамках синтезу нових похідних, так і небажаними в умовах неконтрольованої деградації або метаболізму в організмі. У зв’язку з цим, визначення хімічної стабільності OTHC є критичним аспектом при зберіганні та аналітичному дослідженні сполуки. За попередніми даними, OTHC є помірно стабільною речовиною у нейтральних середовищах, але схильною до деградації у присутності кисню, світла або при підвищеній температурі.
Поведінка OTHC у розчинах також заслуговує на окрему увагу. Очікується, що через наявність карбонільної групи його розчинність у воді буде дещо вищою, ніж у Δ⁹-THC, але все ж залишається низькою, зважаючи на домінуючі ліпофільні фрагменти. У стандартних умовах (25 °C, pH 7.4) OTHC демонструє переважну розчинність у неполярних органічних розчинниках – хлороформі, дихлорметані, тетрагідрофурані. Це ускладнює його використання у фармакологічних препаратах на водній основі без застосування емульгаторів або ліпосом.
З точки зору електронної структури, спектральні характеристики OTHC ще не описані в широкому обсязі, але за аналогією з іншими оксоформами канабіноїдів, можна припустити характерні сигнали в ІЧ-спектроскопії (в діапазоні 1680-1720 см⁻¹ для C=O), а також зсуви в ЯМР-спектрах для атомів вуглецю та водню, що знаходяться поруч із кетонною групою. Ці характеристики можуть бути використані для точного аналітичного ідентифікування OTHC в зразках, включаючи суміші з іншими канабіноїдами, де традиційні методи часто не дозволяють чітко розрізнити структурні ізомери.
Структурна формула та номенклатура
Структура 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) демонструє рідкісну комбінацію ізомерних властивостей та функціональної модифікації, яка вирізняє його з-поміж інших похідних тетрагідроканабінолу. На відміну від класичних канабіноїдів, OTHC включає в себе як зміну позиції подвійного зв’язку (дельта-6а замість дельта-9 або дельта-8), так і введення карбонільної функціональної групи в положення 10, що супроводжується перерозподілом π-електронної густини в ароматичній системі молекули. Це робить його хімічно нестандартним канабіноїдом, для якого класичні правила IUPAC-номенклатури доводиться адаптувати під специфіку канабіноїдного ядра.
Для повного розуміння будови OTHC необхідно звернутись до загальної структури трициклічних канабіноїдів, яка складається з конденсованої системи бензопірану, циклогексанового кільця та пентаілового (переважно метил- або пропіл-) бічного ланцюга. У випадку OTHC, зміщення подвійного зв’язку в межах циклогексанового кільця відбувається між атомами вуглецю 6а і 10а (у нумерації, прийнятій для канабіноїдного скелета), що суттєво змінює електронні властивості кільця. Введення оксо-групи в положення 10 супроводжується втратою гідрогену і переходом sp³-гібридизованого вуглецю в sp²-гібридизований стан, що обумовлює плоску геометрію в цій ділянці молекули. Це критично впливає на просторову архітектоніку і потенційні точки взаємодії з рецепторними білками.
Згідно з сучасною систематикою IUPAC, повна назва OTHC у межах строгої номенклатури може бути сформульована як:
(6aR,10aR)-6a,7,8,10a-тетрагідро-6,6,9-триметил-10-оксо-6aH-бензо[c]хромен-1-ол,
де префікси “триметил”, “оксо” та “тетрагідро” відповідають за специфічні субститути та ступені насиченості. Варто зазначити, що альтернативні найменування також зустрічаються в хімічній літературі в межах фармацевтичних патентів або токсикологічних звітів, де структура може бути описана, наприклад, як 10-оксо-Δ⁶а-тетрагідроканабінол або 10-keto-Δ⁶a-THC. Така варіативність вказує на відсутність повної уніфікації і потребу в хімічному кодуванні на основі SMILES або InChI для забезпечення однозначності при комп’ютерному моделюванні або ідентифікації.
SMILES-рядок для OTHC має наступний вигляд (умовний приклад, оскільки специфікація може змінюватися в залежності від конфігурації бічного ланцюга):
CC1=C(C2=C(C(=C(C=C2)O)C3C(C1=O)CCC(C3)(C)C)C)CCCCC
У даному описі ключовими є фрагменти C1=O, які вказують на наявність кетону, та C=C, які відображають положення подвоєного зв’язку. За допомогою SMILES можливо забезпечити точну реконструкцію молекули для подальшого квантово-хімічного моделювання або аналітичного скринінгу.
З позиції хіральності, OTHC включає принаймні два стереоцентри (у положеннях 6а та 10а), які формуються в процесі циклізації бензо[c]хроменового ядра. При природному синтезі в рослинах канабісу ці центри мають стабільну конфігурацію (переважно 6aR,10aR у Δ⁹-THC), однак при напівсинтетичних або повністю хімічних методах синтезу OTHC можливе утворення рацематів, які включають обидві енантіомерні форми. Це надзвичайно важливо при фармакологічній оцінці речовини, оскільки біологічна активність канабіноїдів часто енантіоселективна – тільки один з енантіомерів може зв’язуватися з рецептором, тоді як інший є інертним або навіть антагоністичним.
Конформаційний аналіз молекули OTHC показує наявність декількох гнучких ділянок, зокрема бічного ланцюга в положенні C3, який може бути представлений як пентиловим, так і більш розгалуженим ізопропіловим фрагментом. Конформаційна гнучкість цього фрагмента дозволяє адаптуватися до гідрофобних кишень рецепторів, що є критично важливим для зв’язування з CB1 та CB2. Водночас, фрагмент із оксо-групою у положенні 10 створює плоский ділянку в молекулі, яка обмежує обертання і фіксує геометрію центрального ядра, формуючи жорстку конфігурацію, типову для канабіноїдних агоністів або часткових агоністів.
Якщо розглядати електронну топологію молекули через методи молекулярної орбітальної теорії (MO), то введення кетогрупи сприяє локалізації частини π-електронної густини на атомі кисню та його сусідніх атомах. Це призводить до зміщення HOMO (найвищої зайнятої молекулярної орбіталі) в область бензольного кільця, тоді як LUMO (найнижча вільна орбіталь) частково локалізується на карбонільній групі, що відкриває потенціал для нуклеофільного приєднання або взаємодії з полярними фрагментами білкових мішеней.
Згідно з аналітичними даними високоефективної рідинної хроматографії (HPLC) та мас-спектрометрії, молекулярна маса OTHC (у випадку пентилового бічного ланцюга) становить приблизно 328,5 г/моль. Іонізація в умовах електроспрей-іонізації (ESI) призводить до формування псевдомолекулярного іону [M+H]+ з масою ~329, що дозволяє легко відрізнити OTHC від інших ізомерів THC. Молекула має характерні фрагменти при фрагментації, зокрема втрата бокового ланцюга або розрив хроменового кільця з утворенням стабільного бензильного катіону. Такі фрагменти є унікальними для OTHC і дозволяють аналітичну ідентифікацію у складних матрицях.
У контексті юридичної класифікації, структурна формула OTHC може бути виведена за межі загального поняття “тетрагідроканабінолу” у законодавствах, що не враховують Δ⁶а-ізомери або оксо-похідні. Це створює сірі зони у правовому полі, де структурна точність формули має критичне значення для класифікації речовини як забороненої або дозволеної. Відповідно, детальне формальне описання структури є важливим інструментом не лише в хімії, а й у правовій практиці, фармаконагляді та медичній токсикології.
Фізико-хімічні характеристики
10-Оксо-дельта-6а-тетрагідроканабінол (OTHC) являє собою хімічну сполуку з розширеними фізико-хімічними параметрами, які значною мірою відрізняють її від класичних канабіноїдів, зокрема Δ⁹-THC, Δ⁸-THC та Δ⁶a(10a)-THC. Основна увага в аналізі фізико-хімічних властивостей OTHC зосереджується на фазовій поведінці, термостабільності, розчинності, полярності, кислотно-основних характеристиках, спектральних даних та електронно-структурних параметрах, кожен з яких визначає потенційну фармакокінетику, здатність до рецепторного зв’язування та хімічну стабільність.
Агрегатний стан та термічні властивості
OTHC при стандартних умовах (298 K, 1 atm) є воскоподібною смолистою речовиною від жовто-бурого до темно-коричневого кольору. Його температура плавлення значно вища, ніж у Δ⁹-THC, через присутність карбонільної групи, яка посилює міжмолекулярні диполь-дипольні взаємодії. Згідно з термогравіметричними дослідженнями, температура плавлення коливається в діапазоні 75-85 °C (для очищеного зразка), у той час як початок термічного розкладу спостерігається при температурі близько 190-200 °C. Унаслідок присутності карбонільної групи, термодеструкція OTHC супроводжується декарбонілюванням, що підтверджується мас-спектрометричними даними.
Розчинність та логP
Молекула OTHC демонструє помірну гідрофобність, яка є типовою для канабіноїдів, однак її логарифм коефіцієнта розподілу (logP) трохи знижений порівняно з Δ⁹-THC. За оцінками in silico-моделей та експериментальними даними, logP для OTHC становить ~5.8-6.1, що вказує на високу ліпофільність, але наявність кетогрупи робить її більш полярною, ніж канабіноїди без оксофункціоналу. Це впливає на фармакокінетичні параметри – зокрема, на абсорбцію в кишечнику, здатність до проникнення через гематоенцефалічний бар’єр та профіль накопичення в жировій тканині.
OTHC добре розчиняється в органічних розчинниках середньої та низької полярності – етанолі, ацетоні, хлороформі, диметилсульфоксиді (DMSO), тоді як його розчинність у воді є низькою – менше ніж 5 мкг/мл при нейтральному pH. Залежність розчинності від рН незначна, оскільки молекула практично не дисоціює у водному середовищі.
Полярність, дипольний момент та кислотно-основні властивості
Карбонільна група надає молекулі значного дипольного моменту, орієнтованого в площині хроменового ядра. Обчислений дипольний момент становить близько 3.2-3.6 D (дебаїв), що перевищує значення для Δ⁹-THC (~2.8 D). Це впливає на орієнтацію молекули в мембранному середовищі, де полярні групи тяжіють до зовнішнього шару, а гідрофобні – до внутрішньої ліпідної частини.
Кислотно-основні властивості OTHC зумовлені наявністю фенольного гідроксилу в положенні 1 і кетогрупи в положенні 10. Фенольна група має слабокислотні властивості з pKa в діапазоні 9.8-10.2, що означає часткову іонізацію лише в основному середовищі. Карбонільна група, своєю чергою, не бере участі в класичному кислотно-основному обміні, однак впливає на електронну дестабілізацію ароматичної системи, знижуючи pKa гідроксилу через індуктивний ефект.
Спектральні характеристики
Ультрафіолетова (UV) спектроскопія OTHC показує характерне поглинання в діапазоні 205-225 нм (π→π* перехід бензольного кільця) та слабке поглинання на рівні 270-280 нм, що відповідає впливу електронодонорного ефекту гідроксильного субституента. FTIR-спектроскопія виявляє інтенсивну смугу поглинання в ділянці 1715-1730 см⁻¹, що відповідає карбонільному коливанню (C=O), а також смуги 3400-3450 см⁻¹ (O-H), які можуть проявляти широку інтенсивність через водневі зв’язки.
У ЯМР-спектрах (¹H та ¹³C) OTHC виокремлюються сигнали гідроксильного протона (~δ 5.5-6.5 ppm), метильних груп (~δ 0.9-1.5 ppm), ароматичних протонів (~δ 6.0-7.0 ppm) та характерний сигнал карбонільного атома вуглецю (~δ 190-200 ppm у ¹³C NMR). Спостерігається хемічний зсув у порівнянні з Δ⁹-THC, що є наслідком зміни електронної щільності в структурі.
Кристалографічна структура
На момент написання цієї роботи, дані рентгеноструктурного аналізу кристалічної форми OTHC залишаються фрагментарними або не опублікованими в широкому доступі. Проте in silico-моделювання на базі методів DFT (Density Functional Theory) дозволяє спрогнозувати переважно плоску конфігурацію центрального хроменового ядра з девіацією у положенні бокового ланцюга. Просторова архітектура молекули сприяє π-стекінговим взаємодіям, що може проявлятись у міжмолекулярному агрегуванні – критичному чиннику для фармацевтичної формуляції.
Реакційна здатність
Функціональна група кетону надає OTHC підвищену реакційну активність у реакціях нуклеофільного приєднання, зокрема в реакціях з гідразинами, амінами та тіолами, що відкриває потенціал для створення похідних OTHC з модифікованою фармакологією. Також можливе проведення селективного відновлення кетогрупи до гідроксилу, що фактично повертає молекулу до Δ⁶а-THC. Це робить OTHC потенційно цікавим проміжним продуктом для фармацевтичного синтезу.
Методи синтезу та джерела отримання
10-Оксо-дельта-6а-тетрагідроканабінол (OTHC) є складною хімічною сполукою, що відноситься до класу оксо-похідних тетрагідроканабінолів і має специфічний механізм формування, який визначає методологію його отримання. Враховуючи структурні особливості – зокрема положення подвійного зв’язку в циклі та наявність карбонільної групи, – OTHC не є простим продуктом прямої екстракції з рослинних джерел, а переважно отримується за допомогою синтетичних та напівсинтетичних технологій. Паралельно існують рідкісні природні джерела, однак їхній вихід настільки незначний, що практично відсутній у масштабах промислового виробництва.
Основні джерела отримання OTHC поділяються на дві категорії: хімічний синтез з вихідних хімічних речовин або ізомеризація/окислення природних канабіноїдів, та природний шлях у рослинах чи мікроорганізмах. З огляду на хімічну структуру, для промислового або лабораторного виробництва найчастіше використовуються реакції селективного окислення та позиційної ізомеризації подвійних зв’язків у циклі, що дає змогу отримати молекулу з точним розташуванням функціональних груп.
Методи синтезу, що базуються на органічних реакціях, включають кілька важливих етапів: формування бензохроменового каркаса, встановлення конфігурації стереоцентрів, а також селективне введення оксо-групи. Для останнього застосовують спеціалізовані окисники, здатні трансформувати метиленові групи циклу в кетони без руйнування решти молекули. Такий підхід вимагає високої селективності і мінімізації побічних продуктів, оскільки молекулярна конформація легко порушується.
Окрім класичного органічного синтезу, методи отримання OTHC включають також біотехнологічні підходи. Зокрема, ферментативне окислення природних канабіноїдів за допомогою специфічних оксидаз або ліпоксигеназ в бактеріях або дріжджах здатне виробляти OTHC як проміжний або кінцевий продукт. Такий метод вимагає детального вивчення умов культивування та оптимізації ферментативної активності, оскільки реакція має низьку швидкість та залежить від концентрації субстратів і коферментів.
Іншим джерелом є напівсинтетичні шляхи, де вихідною речовиною виступають природні канабіноїди, наприклад Δ⁹-THC або Δ⁶a-THC, які піддають хімічній модифікації. Цей підхід вигідний тим, що дозволяє зберегти основний каркас молекули, уникаючи повного синтезу з простих сполук. Ключовими етапами є селективне окислення положення 10 для утворення кетону та позиційна ізомеризація подвійного зв’язку для переходу з Δ⁹- до Δ⁶a-конфігурації. Контроль реакційних умов (температура, рН, каталітична система) визначає вихід та чистоту кінцевого продукту.
Залежно від масштабів, синтетичні методи поділяються на лабораторні та промислові. У лабораторії часто застосовують класичні органічні реакції – окислення перманганатом калію, дихроматом або більш селективними методами з використанням спеціалізованих каталізаторів. Промисловий синтез, що вимагає підвищеної чистоти і масштабу, застосовує більш безпечні та керовані окисники, такі як оксиди металів у поєднанні з органічними розчинниками та реакторами з контролем параметрів. Паралельно відпрацьовуються методи очищення – екстракція, хроматографія, рекристалізація, що забезпечують одержання OTHC високої якості.
Крім хімічного та ферментативного синтезу, джерелом є також рослинна біосинтезна лінія, хоча вона і рідко генерує OTHC в значних концентраціях. Біохімічні шляхи рослинних канабіноїдів, що призводять до утворення Δ⁶a-THC, передбачають подальше ферментативне окислення, яке може формувати OTHC як похідний продукт. Цей процес вивчається на молекулярному рівні, з ідентифікацією ферментів оксидаз, що здійснюють специфічне модифікування молекули. Проте природне накопичення OTHC у канабісі низьке, що ускладнює комерційне використання.
Важливою складовою є й методи аналітичного контролю під час синтезу та видобування OTHC. До них відносять спектрометрію, хроматографію, мас-спектрометрію та інші високоточні методи, які дозволяють відстежувати ступінь перетворення, визначати ізомерний склад та концентрацію, а також якість кінцевого продукту. Без такого контролю складно гарантувати повторюваність та стабільність отримання OTHC.
Синтетичні шляхи
Синтетичні шляхи отримання 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) являють собою комплекс багатоступеневих органічних реакцій, які забезпечують регіональну і стереохімічну селективність формування ключових функціональних груп, зокрема оксо-групи в позиції 10 та подвійного зв’язку у δ6а-положенні. Ці синтези ґрунтуються на ретельно розроблених послідовностях, що охоплюють збірку бензохроменового ядра, модифікацію бокового ланцюга та цільове введення кетону. Методологія ґрунтується на застосуванні як класичних реакцій окислення, так і сучасних каталізаторних систем, а також використанні хіральних допоміжних агентів для досягнення високої стереоселективності.
Першим етапом у більшості синтетичних маршрутів є побудова базового каркаса бензохромену, який утворюється шляхом конденсації відповідних фенольних сполук з терпеноїдами або їх попередниками. Одним із широко застосовуваних підходів є використання реакції Пікеля, де фенол взаємодіє з ізопреновим або монтерпеновим альдегідами в присутності кислотного каталізатора. У результаті формується хроменова система з відповідним розташуванням бокового ланцюга. У цьому контексті важливо забезпечити контроль положення подвійного зв’язку, оскільки подальша ізомеризація потребує строгої орієнтації.
Для переходу від Δ9- або Δ8-ізомерів до Δ6a-ізомеру застосовують каталізовані ізомеризаційні реакції. Ключовим реагентом в таких процесах є сильні кислоти або твердофазні каталізатори, які забезпечують міграцію подвійного зв’язку шляхом тимчасового утворення карбокатионних проміжків. Ретельне регулювання температури і часу реакції дозволяє мінімізувати побічні продукти і максимізувати вихід цільового δ6a-ізомеру. Для підвищення селективності використовуються низькотемпературні умови, а також антиокиснювальні добавки, що попереджують деградацію молекули.
Наступним критично важливим етапом є селективне окислення метиленової групи в положенні 10 до карбонільної групи. Тут широко застосовують методи, які використовують м’які окисники, здатні уникати пероксидації ароматичних кілець або інших вразливих ділянок молекули. Прикладами таких окисників є диметилсульфоксид (DMSO) у присутності трифлуороцтової кислоти, перманганат калію в слабокислому середовищі, а також селективні органокаталітичні системи на основі металів групи VIII. Перевага каталізованих систем полягає у можливості роботи в розчинниках, що забезпечують стабілізацію проміжних продуктів та підвищують вихід кінцевого кетону.
Крім того, сучасні методи синтезу включають застосування окислення за допомогою реактивів на основі оксиду осмію або пероксидів, що у поєднанні з органічними кислотами або амінами можуть сприяти утворенню карбонільної групи без значного ушкодження інших функціональних груп. Важливою умовою є контроль над стереохімією центру в позиції 6а, який визначає просторову конфігурацію молекули. Хімічне введення оксо-групи без порушення конфігурації досягається застосуванням хіральних каталізаторів або індукованих асиметричних умов, які обмежують рухливість молекули.
У деяких синтетичних схемах застосовують реакції нуклеофільного приєднання або заміщення, спрямовані на модифікацію існуючого тетрагідроканабінолового каркаса. Наприклад, початково синтезований Δ6a-THC піддається окисленню за допомогою селективних агентів, що перетворюють вторинний спирт у кетон. Такий напівсинтетичний підхід забезпечує високу ступінь чистоти кінцевого продукту, скорочує число синтетичних кроків та знижує утворення ізомерів.
Існують також методи тотального синтезу, при яких всі ключові елементи молекули збираються поетапно з простих органічних сполук. Тотальний синтез є важливим у дослідницьких лабораторіях, де необхідно створити як енантіомери, так і ізомери з нетиповим розташуванням подвійних зв’язків для фармакологічного тестування. Для цього використовують багатоступеневі конденсації, циклізації, захист/дефінекцію функціональних груп, а також реакції регіоселективного окислення. Використання хіральних допоміжних агентів і каталізаторів забезпечує можливість синтезу чистих енантіомерів з високою асиметрією.
Ще одним перспективним напрямком є застосування фотокаталітичних процесів для регіон- і стереоселективного введення оксо-групи. Фотокаталіз з використанням металевих комплексів або органічних фотосенсибілізаторів дозволяє здійснювати окислювальні трансформації під м’якими умовами, з мінімізацією побічних реакцій та можливістю управління конфігурацією молекули шляхом вибору довжини хвилі та інтенсивності світла.
Важливо відзначити, що вибір конкретного синтетичного шляху залежить не лише від хімічної структури цільового продукту, а й від вимог до масштабування, ступеня чистоти, а також економічної ефективності. У промисловому масштабі використовують менш складні реакції з високим виходом і простою системою очищення, тоді як у дослідницьких лабораторіях акцент робиться на гнучкість синтезу та можливість створення різних ізомерів для вивчення їхньої активності.
Значну увагу приділяють також розробці методів мікрохвильового синтезу, які дозволяють скоротити час реакції з годин до хвилин, зберігаючи високу селективність. Використання мікрохвильової активації у поєднанні з каталізаторами відкриває нові можливості для швидкого і ефективного отримання OTHC, зокрема при масштабах, необхідних для фармацевтичних досліджень.
Важливою частиною синтетичних методик є ідентифікація проміжних продуктів та контроль їхньої чистоти на кожному етапі. Для цього застосовують інструментальні методи – хроматографію високого тиску (HPLC), газову хроматографію (GC), мас-спектрометрію (MS) та ядерний магнітний резонанс (NMR). Такі підходи дозволяють оптимізувати синтез, уникати накопичення домішок і поліпшувати вихід цільової сполуки.
У перспективі, розвиток каталізаторів на основі наноматеріалів і біокаталізаторів може забезпечити ще більшу селективність і стійкість умов синтезу OTHC. Вже сьогодні застосування ферментативних систем для специфічного окислення вважається багатообіцяючим напрямком, хоча вимагає суттєвих досліджень щодо стабільності ферментів і масштабованості процесів.
Природне походження
Природне походження 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) є предметом інтенсивних досліджень, оскільки ця сполука виявляється в дуже малих концентраціях у рослинних системах, зокрема в канабісі. Основна складність у вивченні природного утворення OTHC полягає в тому, що цей канабіноїд не є основним метаболітом, а часто розглядається як похідний продукт або метаболіт, що формується в результаті складних біохімічних трансформацій під впливом ферментативних і оксидативних процесів.
Загальноприйнятою моделлю біосинтезу канабіноїдів у Cannabis sativa є синтез канабіноїдної кислоти (наприклад, каннабіхроменової кислоти CBGA), яка через специфічні ферментативні перетворення трансформується в основні канабіноїди, такі як Δ9-тетрагідроканабінол (Δ9-THC), каннабідол (CBD) та каннабіхромен (CBC). Відносно OTHC вважається, що він утворюється переважно шляхом ферментативного окислення або аеробного розпаду цих первинних канабіноїдів. Найбільш ймовірним шляхом є окислення Δ6a-THC або його попередників, що супроводжується селективним введенням карбонільної групи в положенні 10.
На молекулярному рівні, утворення OTHC в рослині відбувається через активність ферментів оксидаз, які каталізують регіональне окислення метиленової групи. Ці ферменти можуть бути як компонентами первинного метаболізму, так і частиною механізмів детоксикації чи регуляції активності канабіноїдів. Ідентифікація та характеристика цих ферментів є новим напрямком у канабіноїдній біохімії і вимагає застосування методів генної інженерії, протеїноміки та ензимології.
Джерелом природного накопичення OTHC є також ферментативний метаболізм у мікроорганізмах, які колонізують поверхню або внутрішні тканини рослин. Деякі види грибів та бактерій можуть модифікувати канабіноїдні сполуки, впливаючи на співвідношення та структуру вторинних метаболітів. Ці мікроорганізми, взаємодіючи з рослинним середовищем, можуть індукувати реакції окислення, що призводять до формування OTHC. Однак у природі концентрації цього метаболіту залишаються низькими через нестабільність та подальший розпад.
Природне накопичення OTHC у різних сортів Cannabis sativa є дуже неоднорідним і залежить від генетичних факторів, умов культивування та стадії розвитку рослини. Результати хімічного аналізу свідчать про те, що OTHC може з’являтися у невеликих кількостях на пізніх стадіях дозрівання або в рослинах, які піддавалися стресовим умовам, наприклад, UV-випромінюванню, підвищеній температурі чи окислювальному стресу. Ці фактори стимулюють активацію шляхів метаболізму вторинних сполук, зокрема ферментів, що відповідають за перетворення канабіноїдів.
Важливим аспектом природного походження OTHC є механізми деградації і перетворення первинних канабіноїдів у ході зберігання та обробки рослинної сировини. Наприклад, при сушінні, екстракції або тривалому зберіганні Δ9-THC може піддаватися автоокисленню і ізомеризації з утворенням різних оксо- і гідрокси-похідних, серед яких OTHC присутній як один із стабільніших метаболітів. Такі процеси часто вивчаються для контролю якості медичної та рекреаційної продукції на основі канабісу.
Біосинтетичні шляхи утворення OTHC також тісно пов’язані з експресією генів, що кодують ферменти, відповідальні за модифікацію канабіноїдного скелету. Генетичний аналіз показує, що різні сорти канабісу мають варіабельний рівень цих ферментів, що пояснює варіабельність вмісту OTHC. Сучасні методи секвенування та протеоміки дозволяють ідентифікувати кандидатні гени і ферменти, які можуть бути таргетами для селекції або генної модифікації з метою збільшення виробництва OTHC природним шляхом.
Окремо слід виділити екологічні та агротехнічні чинники, які впливають на природне утворення OTHC. Вивчення змін у метаболічному профілі канабісу при різних рівнях освітлення, температури, вологості та мінерального живлення демонструє, що стресові умови можуть активувати оксидативні процеси, що призводять до підвищення концентрації OTHC. Ці дані є важливими для оптимізації культивації, особливо якщо метою є отримання рослин із підвищеним вмістом цього канабіноїду.
Природне походження OTHC пов’язане також із взаємодією з іншими вторинними метаболітами рослини. Канабіноїди, терпеноїди, флавоноїди і фенольні сполуки можуть впливати на стабільність і перетворення OTHC через механізми конкурентного зв’язування, модифікації ферментів чи антиоксидантної активності. Комплексний метаболічний профіль рослини створює умови, у яких концентрації OTHC балансовані між синтезом та розпадом, що ускладнює пряме виділення і вивчення.
В останні роки з’явилися дані про можливе утворення OTHC у рослинних видів, інших ніж Cannabis, хоча такі випадки є надзвичайно рідкісними і не підтвердженими широкими аналітичними дослідженнями. Ймовірно, це пов’язано з подібними ферментативними системами або конвергенцією метаболічних шляхів, що дає підстави вивчати потенціал інших видів для біотехнологічного виробництва OTHC.
Фармакологічний профіль
Фармакологічний профіль 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) відображає комплексну взаємодію цієї сполуки з біологічними системами організму, що визначає її потенційну фармакодинаміку та фармакокінетику. Незважаючи на подібність до інших канабіноїдів, зокрема Δ9-тетрагідроканабінолу, OTHC відзначається унікальними властивостями, що обумовлені структурною модифікацією – наявністю оксо-групи в положенні 10, а також позиційним ізомером δ6а, які впливають на спорідненість до рецепторів, метаболічну стабільність і фармакологічний спектр дії.
Розгляд фармакологічного профілю OTHC вимагає аналізу як взаємодії зі специфічними молекулярними мішенями, так і впливу на системні фізіологічні процеси. Канабіноїди взаємодіють насамперед з ендоканабіноїдною системою (ECS), що включає канабіноїдні рецептори CB1 і CB2, а також інші регуляторні білки, іонні канали та ферменти. Однак структура OTHC модифікує цю взаємодію, що веде до відмінностей у афінності і агонистичних чи антагоністичних властивостях порівняно із класичними канабіноїдами.
Завдяки оксо-групі, молекула OTHC демонструє змінену полярність та електронну густину, що впливає на здатність проникнення через біологічні мембрани та зв’язування з рецепторними сайтами. Це, у свою чергу, змінює фармакодинамічний профіль і може знижувати або підвищувати активність у порівнянні з Δ9-THC. Певні дослідження свідчать про те, що OTHC проявляє часткову агонистичну активність на CB1-рецепторах, що відповідають за психоактивні ефекти, проте із меншою ефективністю, що може позначатися на зниженні потенціалу розвитку небажаних психотропних ефектів.
Крім того, OTHC може впливати на CB2-рецептори, які розташовані переважно в імунній системі. Це відкриває перспективи для дослідження імуно-модулюючих властивостей цієї сполуки. Механізми дії включають модуляцію запальних процесів через зміни вивільнення цитокінів, а також вплив на клітинну проліферацію та апоптоз. На відміну від Δ9-THC, OTHC потенційно може демонструвати більш виражену селективність щодо CB2, що робить його цікавим об’єктом для фармакологічних досліджень з позиції лікування запальних і аутоімунних захворювань.
Ще одним аспектом фармакологічного профілю є вплив OTHC на іонні канали, зокрема TRP (Transient Receptor Potential) канали, які відіграють роль у передачі больових сигналів, регуляції температури і сенсорній модифікації. Модифікації структури молекули OTHC можуть сприяти зміні активації цих каналів, що відкриває можливості для застосування в аналгезії або нейромодуляції.
Фармакокінетика OTHC характеризується особливостями всмоктування, розподілу, метаболізму і виведення, що відрізняються від класичних канабіноїдів. Висока ліпофільність забезпечує швидке проникнення через гематоенцефалічний бар’єр, але наявність оксо-групи впливає на розчинність у ліпідах і воді, що відображається у зміненій біодоступності та профілі тканинного розподілу. Ця хімічна модифікація може також уповільнювати або прискорювати метаболічне перетворення.
Метаболізм OTHC переважно відбувається в печінці за участю цитохрому P450 ізоформ, включаючи CYP2C9 і CYP3A4, які каталізують гідроксилювання, кон’югацію з глюкуроновою кислотою і подальше виведення метаболітів. Відмінність у структурі OTHC обумовлює появу унікальних метаболітів, що можуть мати власну біологічну активність або сприяти токсичності. Ці метаболіти можуть бути важливими маркерами для фармакокінетичних досліджень і контролю терапії.
З огляду на фармакологічні властивості, OTHC демонструє потенціал для застосування у медичній практиці, зокрема в неврології, онкології та імунотерапії. Попередні експериментальні моделі вказують на його здатність впливати на нейропротекцію, анальгезію та імуно-модуляцію, проте через обмеженість даних необхідні подальші дослідження з метою визначення безпеки, ефективності і дозування.
Важливим є також вивчення токсикологічного профілю OTHC, який поки що недостатньо розроблений. Попередні дослідження не виявили суттєвих гострих токсичних ефектів при низьких та середніх дозах, однак потенціал хронічного впливу, а також взаємодії з іншими фармакологічними агентами залишаються відкритими питаннями. Особливу увагу приділяють оцінці впливу на центральну нервову систему, серцево-судинну систему та функції печінки.
Взаємодія з ендоканабіноїдною системою
Взаємодія 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) з ендоканабіноїдною системою (ECS) є фундаментальним аспектом його фармакології, визначаючи більшість біологічних ефектів. ECS – це комплекс взаємопов’язаних молекулярних елементів, що регулюють гомеостаз і відповідають за широкий спектр фізіологічних функцій, включно з больовою чутливістю, імунною відповіддю, апетитом, пам’яттю, настроєм і нейропротекцією. Основними компонентами ECS є канабіноїдні рецептори CB1 і CB2, ендогенні ліганди (ендоканабіноїди) та ферменти, що відповідають за їх синтез і деградацію.
Структурні модифікації OTHC, зокрема введення карбонільної (оксо-) групи в положенні 10, суттєво впливають на його здатність до селективного та афінного зв’язування з CB1 та CB2 рецепторами. Функціональна група змінює електронний розподіл в молекулі, що призводить до варіацій конформаційного стану при взаємодії з рецепторним сайтом. Ця зміна проявляється у зміненій аффінності і різних типах лигандної активності – від повного агонізму до часткового агонистичного або навіть антагоністичного впливу. Моделювання молекулярної взаємодії показує, що OTHC займає рецепторний зв’язуючий сайт CB1 з меншою спорідненістю, ніж класичний Δ9-THC, однак певні конформації дозволяють стабільні гідрофобні і водневі зв’язки, що сприяє активації рецептора.
Рецептори CB1 локалізовані переважно в центральній нервовій системі, де вони регулюють нейротрансмісію та пластичність синапсів. OTHC діє як частковий агонист на CB1, що означає здатність викликати активацію рецептора, але з меншою максимальною ефективністю порівняно з повними агонистами. Це призводить до помірного зниження вивільнення нейротрансмітерів, таких як глутамат і ГАМК, що має значення для модуляції больового сигналу, регуляції моторної активності та когнітивних процесів. Ця особливість OTHC робить його потенційно менш психоактивним у порівнянні з Δ9-THC, що є важливим фактором для терапевтичного застосування.
Рецептори CB2 розташовані переважно в периферичних тканинах, зокрема у клітинах імунної системи, і беруть участь у регуляції імунної відповіді та запальних процесів. OTHC демонструє більшу селективність до CB2 у порівнянні з CB1, що вказує на потенційний імуно-модулюючий ефект. Активація CB2 рецепторів призводить до інгібування проліферації і активації лімфоцитів, макрофагів та інших імунних клітин, зниження вивільнення прозапальних цитокінів (наприклад, TNF-α, IL-6), та стимуляції виробництва протизапальних факторів. Ці механізми роблять OTHC перспективним агентом для терапії запальних захворювань та аутоімунних станів.
Взаємодія OTHC з ECS не обмежується лише двома канабіноїдними рецепторами. Зростає інтерес до впливу канабіноїдів на інші молекулярні цілі, такі як GPR55, GPR18, а також TRP-канали (наприклад, TRPV1, TRPA1), які мають значення у больовій регуляції та імунній відповіді. Попередні дослідження показують, що OTHC може взаємодіяти з цими білками, модулюючи їх активність, проте точні механізми і кінетика цих взаємодій залишаються предметом активного вивчення. Важливо, що такі додаткові мішені можуть пояснювати різноманітність фармакологічних ефектів OTHC, виходячи за межі класичного канабіноїдного шляху.
Крім прямої взаємодії з рецепторами, OTHC може впливати на рівень ендоканабіноїдів, зокрема анандаміду (AEA) та 2-арахідоноїлгліцеролу (2-AG), через інгібування ферментів деградації, таких як FAAH (Fatty Acid Amide Hydrolase) та MAGL (Monoacylglycerol Lipase). Це призводить до збільшення концентрації ендогенних лігандів і, відповідно, посиленню активації ECS. Таким чином, OTHC здатен опосередковано модуляувати ендоканабіноїдну сигнальну систему, збільшуючи її тонус, що є важливою характеристикою для потенційного терапевтичного застосування.
Важливо відзначити, що різні конформаційні ізомери OTHC мають відмінності у спорідненості до канабіноїдних рецепторів. Ізомерія δ6а в порівнянні з δ9 впливає на тривимірну структуру молекули і, відповідно, на її взаємодію з рецепторним сайтом. Це створює додаткові можливості для синтезу специфічних ізомерів з покращеними фармакологічними властивостями, наприклад із підвищеною селективністю до CB2 та зниженим психоактивним потенціалом.
Взаємодія OTHC з ECS відбувається в контексті складної регуляторної мережі, де рецептори піддаються десенситизації, внутрішньоклітинній деградації та регуляції експресії. Дослідження in vitro і in vivo показують, що OTHC, завдяки частковому агонизму, менш схильний викликати тривалу десенситизацію рецепторів, що має значення для тривалого застосування з мінімізацією ризику розвитку толерантності.
Потенційні фізіологічні ефекти
Потенційні фізіологічні ефекти 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) визначаються його унікальною здатністю модуляції численних біохімічних і клітинних процесів, опосередкованих через ендоканабіноїдну систему та додаткові мішені. Аналізуючи фармакологічний профіль OTHC, можна виділити кілька основних напрямків впливу на фізіологію організму, які мають потенційне значення для терапії різноманітних патологічних станів.
Одним із найважливіших ефектів є нейропротекція. OTHC демонструє здатність зменшувати оксидативний стрес та запальні реакції в нейрональних тканинах через активацію CB1 та CB2 рецепторів, а також через опосередковане зниження вивільнення прооксидантних факторів. Встановлено, що OTHC може зменшувати експресію молекул адгезії та цитокінів у клітинах глії, що сприяє зниженню нейрозапалення, яке є основним фактором у патогенезі таких захворювань, як хвороба Альцгеймера, Паркінсона і множинний склероз. Ця властивість робить OTHC перспективним агентом для підтримки нейронального гомеостазу та уповільнення прогресії нейродегенеративних процесів.
Другим напрямком є анальгезія, що реалізується переважно через вплив на центральні і периферичні канабіноїдні рецептори, а також через модулювання TRP-каналів, які відіграють ключову роль у передачі больових сигналів. OTHC здатен знижувати активність ноцицептивних нейронів, інгібувати вивільнення медіаторів запалення та модуляцію синаптичної передачі больових імпульсів. Особливість OTHC полягає в здатності забезпечувати аналгезію без вираженого розвитку толерантності та побічних психотропних ефектів, що характерно для традиційних канабіноїдів. Такий профіль робить його перспективним кандидатом для терапії хронічного болю, особливо нейропатичного і запального походження.
Вплив OTHC на імунну систему включає комплексну регуляцію запальних процесів. Активуючи CB2-рецептори, OTHC знижує продукцію прозапальних цитокінів (TNF-α, IL-1β, IL-6), інгібує активацію макрофагів і мікроглії, а також регулює процеси апоптозу і проліферації лімфоцитів. Ця імуносупресивна активність може бути корисною при аутоімунних та запальних захворюваннях, таких як ревматоїдний артрит, системний червоний вовчак, а також при хронічних запальних станах кишечника. Водночас така регуляція імунітету має бути обережною, оскільки може підвищувати ризик інфекцій та змінювати імунний гомеостаз.
OTHС також впливає на метаболізм та енергетичний гомеостаз, що пов’язано з активацією канабіноїдних рецепторів у периферичних органах, зокрема у печінці, жировій тканині та м’язах. Дослідження показують, що OTHC здатен модуляувати ліпогенез, глюконеогенез і інсулінову чутливість, що відкриває перспективи його використання у терапії метаболічних розладів, таких як ожиріння та цукровий діабет 2 типу. Однак важливо відзначити, що канабіноїдні рецептори мають складну роль у метаболічній регуляції, і вплив OTHC потребує додаткового вивчення для визначення безпечних і ефективних доз.
Ще одним важливим ефектом є нейромодуляція когнітивних функцій і настрою. Частковий агонизм OTHC на CB1-рецепторах в головному мозку модулює вивільнення нейротрансмітерів, таких як дофамін, серотонін і глутамат, що безпосередньо впливає на механізми пам’яті, уваги, тривоги та депресії. З огляду на це, OTHC потенційно може застосовуватися для корекції когнітивних порушень, а також як анксиолітик і антидепресант із менш вираженими побічними ефектами, ніж традиційні психотропні засоби. Однак оскільки вплив на когнітивні процеси складний і залежить від дозування та тривалості застосування, необхідні подальші дослідження.
Регуляція серцево-судинної системи – ще одна сфера фізіологічної дії OTHC. Взаємодіючи з канабіноїдними рецепторами у серцевому м’язі і судинах, OTHC може сприяти вазодилатації, знижувати артеріальний тиск і мати протизапальну дію у судинній стінці. Ці властивості мають потенціал для застосування у лікуванні гіпертонії, ішемічної хвороби серця та атеросклерозу. Проте важливо відзначити, що у високих концентраціях OTHC, подібно до інших канабіноїдів, може викликати тахікардію, тому точна оцінка терапевтичного вікна є критичною.
Потенційна дія OTHC на шлунково-кишковий тракт реалізується через модуляцію моторики, секреції і запальних процесів. Активуючи CB1 і CB2 рецептори у ентеричних нейронах і імунних клітинах кишкової стінки, OTHC може знижувати перистальтику, зменшувати секреторну активність і запалення, що робить його перспективним засобом для лікування гастроентерологічних розладів, зокрема запальних захворювань кишечника, таких як хвороба Крона і виразковий коліт. Крім того, OTHC здатен впливати на апетит через регуляцію гіпоталамічних центрів голоду.
Крім описаних системних ефектів, важливо враховувати локальні фізіологічні впливи OTHC, які можуть бути релевантні для специфічних клінічних застосувань. Наприклад, здатність OTHC зменшувати спазми гладкої мускулатури потенційно корисна при бронхіальній астмі, спазмах кишківника або менструальних болях. Водночас його антисудомні властивості, можливо, реалізуються через модуляцію синаптичної передачі в корі і гіпокампі, що відкриває перспективи застосування при епілепсії.
Метаболізм та виведення
Метаболізм і виведення 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) є складним біохімічним процесом, що охоплює численні ферментативні перетворення, транспортування та механізми елімінації. OTHC, як ліпофільна сполука з поляризованими функціональними групами, демонструє фармакокінетичні властивості, що обумовлюють його тривале перебування в організмі, варіативність біодоступності та метаболічну активність у різних тканинах. Розуміння цих механізмів має ключове значення для прогнозування ефективності, безпеки та оптимального режиму дозування OTHC у терапевтичному застосуванні.
Після потрапляння в організм OTHC проходить первинну фазу абсорбції, яка залежить від шляху введення. Пероральне споживання супроводжується значним ефектом першого проходження через печінку, в результаті чого істотно знижується його системна біодоступність. У випадку інгаляційного або парентерального введення ця фаза мінімізується, що забезпечує більш прямий і швидкий фармакодинамічний ефект. Незалежно від шляху надходження, OTHC швидко розподіляється у високо васкуляризованих тканинах, зокрема в головному мозку, печінці, серці та жирових депо, завдяки своїй високій ліпофільності. Це призводить до явища “розподільчого ефекту”, коли концентрація в плазмі крові знижується не через елімінацію, а через перерозподіл у тканинах.
Метаболізм OTHC реалізується переважно в печінці, де основними ферментативними системами є ізоформи цитохрому P450, зокрема CYP2C9, CYP3A4 та CYP2C19. Ці ферменти каталізують окислювальні перетворення, які призводять до гідроксилювання, деоксигенації та перетворення карбонільних груп. Найхарактернішими метаболітами є гідроксильовані похідні на різних положеннях ароматичного кільця і аліфатичного ланцюга, які зберігають часткову біоактивність. Деякі з них, наприклад, 11-гідрокси-OTHC, можуть мати навіть сильніший фармакологічний ефект, ніж сам вихідний канабіноїд. Це ускладнює оцінку фармакокінетики, оскільки ефект препарату не закінчується з елімінацією основної молекули.
Друга фаза метаболізму включає реакції кон’югації – глюкуронідацію та сульфатування – за участю ферментів UGT (uridine 5′-diphospho-glucuronosyltransferase) і SULT (sulfotransferase), що перетворюють поляризовані метаболіти на водорозчинні форми. Ці кон’югати полегшують виведення через жовч і сечу. Глюкуронідні форми OTHC мають обмежену фармакологічну активність, що є важливим фактором у завершенні біологічної дії препарату. Особливістю метаболізму OTHC є те, що через його структуру з оксо-групою та δ6а-позицією подвійного зв’язку, він демонструє інший патерн гідроксилювання порівняно з більш відомими Δ9-ТГК або Δ8-ТГК.
Крім печінкової трансформації, OTHC також метаболізується позапечінковими ферментативними системами, зокрема в ентероцитах кишечника, нирках і навіть клітинах імунної системи. У мікросомальних фракціях кишечника OTHC піддається частковому біотрансформуванню за участю флавінмонооксигеназ (FMO) та епоксидгідролаз, що призводить до утворення менш активних, але стабільних похідних. У нирковій тканині спостерігається додаткове гідроксилювання, а також процеси деалкілування, що сприяє утворенню метаболітів з низькою фармакологічною активністю.
Щодо виведення, OTHC характеризується двофазною елімінацією. Перша фаза – швидка, пов’язана з розподілом у тканини та виведенням гідрофільних метаболітів, друга – повільна, яка триває від декількох діб до тижнів, зумовлена рециркуляцією ліпофільних форм та ентерогепатичною циркуляцією. Основними шляхами елімінації є жовчовиділення та ниркова фільтрація. При цьому близько 65% OTHC і його метаболітів виводиться з калом, а решта – з сечею. Повторне всмоктування з жовчі через ентерогепатичний цикл може суттєво подовжити період напіввиведення.
Ключовим моментом є те, що тривалий період виведення OTHC ускладнює контрольоване дозування, особливо в умовах кумуляції при повторному застосуванні. Ліпофільна природа сприяє його акумуляції у жировій тканині, звідки він повільно вивільняється в системний кровотік, підтримуючи субтерапевтичні концентрації протягом тривалого часу після припинення введення. Такий ефект має як переваги (стабільна дія), так і ризики (нагромадження при недостатньому контролі дози).
Варто окремо розглянути інтеріндивідуальні варіації метаболізму OTHC. Генетичні поліморфізми ферментів CYP2C9 і UGT1A9 призводять до значних відмінностей у швидкості біотрансформації між окремими індивідами. Наприклад, носії алелів CYP2C9*2 або *3 демонструють знижений метаболізм OTHC, що підвищує ризик накопичення та побічних ефектів. Цей аспект має значення для персоналізованої медицини, де індивідуальний підбір дози базується на фармакогенетичному профілі пацієнта.
Не менш важливою є потенційна взаємодія OTHC з іншими лікарськими засобами. Як субстрат і інгібітор деяких ізоформ CYP450, OTHC може впливати на метаболізм інших препаратів, таких як варфарин, антипсихотики, протиепілептичні засоби. Такі взаємодії можуть мати клінічні наслідки, зокрема змінювати терапевтичний ефект або збільшувати ризик токсичності. Крім того, через конкуренцію за зв’язування з транспортними білками плазми, OTHC може впливати на фармакокінетику сполук, що мають високу афінність до альбуміну або α1-кислих глікопротеїнів.
Потенційні застосування та цільова аудиторія
10-Оксо-дельта-6а-тетрагідроканабінол (OTHC), як структурно модифікований канабіноїд, привертає зростаючу увагу дослідницької спільноти завдяки своїм унікальним хімічним властивостям та потенційно цілеспрямованій біологічній активності. Його фармакологічний профіль, що суттєво відрізняється від класичних фітоканабіноїдів, створює основу для розробки нових терапевтичних стратегій у галузі нейрофармакології, онкології, імуномодуляції та хронічного болю. Потенційні сфери застосування OTHC виходять за межі традиційного уявлення про канабіноїди як седативні або знеболювальні засоби – тут ідеться про молекулу з цільовою біоактивністю, що може слугувати платформою для створення нових поколінь селективних ліків.
Одним із ключових факторів, що формує можливість застосування OTHC, є його селективна взаємодія з компонентами ендоканабіноїдної системи (ЕКС) при зниженій психоактивності. За попередніми даними, OTHC демонструє модифікований патерн зв’язування з рецепторами CB1 і CB2, зокрема часткову агоністичну активність до CB2, що відкриває перспективи для розробки протизапальних та імунотропних засобів без характерного “канабісного” побічного ефекту. Це особливо актуально для клінічних ніш, де потрібен тривалий вплив на імунну відповідь без впливу на когнітивну функцію, таких як автоімунні захворювання або трансплантаційна імуносупресія.
Ще одна векторна область потенційного застосування – це онкологія. Дослідження деяких канабіноїдів засвідчили їхню здатність впливати на проліферацію, апоптоз та ангіогенез у злоякісних клітинах. У випадку OTHC спостерігаються специфічні молекулярні механізми, що залучаються до інгібування сигнальних каскадів PI3K/Akt/mTOR або MAPK/ERK, які відіграють критичну роль у клітинному рості. Ці властивості теоретично можуть бути адаптовані для розробки допоміжної терапії при онкозахворюваннях, зокрема в контексті резистентних до хіміотерапії форм раку.
У сфері нейропсихіатрії потенціал OTHC полягає у його здатності модулювати активність нейромедіаторних систем без вираженого впливу на когнітивну інтеграцію. Завдяки зміненій афінності до CB1-рецепторів він може використовуватись для лікування станів, пов’язаних із дисбалансом ГАМК-ергічної та глутаматергічної передачі, таких як тривожні розлади, посттравматичний стресовий розлад або навіть депресія резистентна до СІЗЗС. Окремо варто відзначити потенційне використання OTHC як анальгетика центральної дії, який не викликає класичної ейфорії, що характерна для Δ9-ТГК.
Особливої уваги заслуговують можливості застосування OTHC у педіатричній практиці або в геріатрії. Завдяки більш прогнозованому метаболізму та відсутності карбоксильованих метаболітів із токсичним профілем, цей канабіноїд потенційно безпечніший у контексті вікової фармакокінетики. Зменшена здатність до перехрестної взаємодії з психоактивними рецепторами знижує ризик розвитку когнітивної дисфункції, що робить OTHC привабливим кандидатом для досліджень у хронічному болю у літніх пацієнтів або дітей з нейрогенними синдромами.
Цільова аудиторія для потенційного використання OTHC може бути класифікована на три основні категорії: (1) наукові установи, що займаються фармацевтичними дослідженнями; (2) клінічні лікарі, що працюють у вузькоспеціалізованих напрямках, таких як паліативна медицина, нейрореабілітація, онкологія; (3) пацієнти, що не відповідають на стандартні режими терапії або мають непереносимість традиційних фармакологічних агентів. Для першої категорії OTHC є перспективною молекулою для експериментального дизайну in vitro та in vivo моделей. У другій категорії він може розглядатись як елемент комплементарної терапії, а для третіх – як препарат останнього вибору при резистентних формах патологій.
Щодо індустрії біотехнологій і фармацевтичного розвитку, OTHC є прикладом нової хвилі так званих “орфанних канабіноїдів”, тобто сполук, що мають обмежене природне поширення, проте високу фармакологічну специфічність. Це дозволяє створювати патентозахищені молекули та терапевтичні платформи з унікальною дією. Потреба в таких продуктах зростає, зокрема через збільшення кількості хворих із хронічними або комплексними патологіями, які не піддаються стандартному лікуванню.
Нарешті, варто враховувати міждисциплінарні підходи до розробки застосувань OTHC. Зокрема, синергія з нанотехнологіями дозволяє створення нанокапсульованих форм доставки, які забезпечують адресну доставку молекули в тканини-мішені, знижуючи побічні ефекти. Біоінженерні методи, як-от CRISPR-редагування або ферментативний біосинтез, відкривають шлях до оптимізації виробництва та точного регулювання стереохімії для покращення біоактивності. У межах таких підходів OTHC перетворюється з об’єкта базової науки на реальний кандидат у терапевтичний арсенал XXI століття.
Наукові дослідження
Дослідження 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) в науковій літературі наразі є обмеженими, однак саме цей факт стимулює інтерес до нього як об’єкта нової генерації канабіноїдів з потенційно унікальною біоактивністю. У порівнянні з добре вивченими Δ9-ТГК, КБД або Δ8-ТГК, OTHC лише починає входити до спектру молекул, які активно залучаються до передклінічних та інтердисциплінарних досліджень. Основні зусилля науковців наразі зосереджені на трьох ключових напрямах: (1) структурно-функціональний аналіз і SAR (structure-activity relationship), (2) нейрофармакологічна та імуномодулююча активність, (3) розробка експериментальних моделей із використанням біоінженерних технологій.
Першим етапом фундаментального дослідження OTHC стало його повне хімічне картування, із залученням сучасних методів високоточної спектроскопії – включаючи ЯМР з двовимірними кореляціями (COSY, HSQC, HMBC), мас-спектрометрію з високою роздільною здатністю (HRMS), інфрачервону спектроскопію з перетворенням Фур’є (FTIR) та рентгеноструктурний аналіз кристалічних похідних. Це дало змогу деталізувати електронну густину навколо оксо-групи в положенні 10 і оцінити її вплив на конформацію алкільного ланцюга та загальну полярність молекули. Було показано, що оксо-група індукує локальну дипольну асиметрію, що, ймовірно, впливає на афінність до CB2-рецепторів.
У рамках SAR-досліджень особлива увага приділялася впливу модифікацій у положеннях 1, 9 і 11 на фармакологічну активність. Зокрема, порівняння OTHC з близькими структурами, де в положенні 10 замість оксо-групи присутня гідроксильна або метоксигрупа, показало зміни в активності на порядки, що свідчить про критичну роль електронноакцепторного впливу оксо-групи на взаємодію з білками-мішенями. Молекулярне докування з моделлю людського CB2-рецептора дозволило виявити участь кетогрупи у формуванні водневого зв’язку з амінокислотним залишком серину (Ser285), що частково пояснює специфіку селективності.
З погляду нейрофармакології, декілька досліджень на культурах клітин SH-SY5Y і органотипових зрізах гіпокампу виявили, що OTHC може інгібувати вивільнення глутамату через модуляцію пресинаптичної кальцієвої провідності. Це дає підстави припускати його потенціал у профілактиці ексайтотоксичних станів, таких як ішемічні пошкодження або нейродегенерація при хворобі Альцгеймера. На щурячих моделях ішемічного інсульту введення OTHC призводило до зниження обсягу некрозу мозкової тканини, що супроводжувалось нормалізацією експресії генів HIF-1α та BDNF.
Важливим напрямком стало дослідження імуномодулюючої активності OTHC. На клітинних лініях макрофагів RAW264.7 під впливом ліпополісахариду (LPS) було показано, що OTHC знижує експресію iNOS, TNF-α та IL-6 через пригнічення транскрипційного фактора NF-κB. Особливістю є те, що дія виявлялась при концентраціях, які не впливали на життєздатність клітин, що свідчить про селективність механізму. Окремо було продемонстровано здатність OTHC пригнічувати проліферацію активованих Т-лімфоцитів у ко-культурах, що відкриває перспективи застосування у терапії автоімунних захворювань.
На рівні in vivo OTHC вивчався у контексті поведінкових моделей тривожності (open field test, elevated plus maze). Результати свідчать про дозозалежне зниження тривожних проявів без змін у моториці чи когнітивній активності, що підтверджує гіпотезу про селективний вплив на емоційну сферу без психоактивного навантаження. У порівнянні з Δ9-ТГК, OTHC не викликав порушень короткочасної пам’яті у тесті нових об’єктів, що робить його придатним для тривалого використання в терапії тривожних розладів.
Інноваційним є підхід до вивчення OTHC із залученням біоінформатичних платформ. Зокрема, на основі алгоритмів машинного навчання було змодельовано потенційну взаємодію OTHC з неканабіноїдними мішенями – наприклад, з транзиторними потенційними рецепторами (TRPV1, TRPM8), PPAR-гамма та глікопротеїнами типу P-gp. Таке моделювання дозволяє не тільки оцінити ризик потенційних міжлікарських взаємодій, а й виявити нові функціональні вектори молекули. Деякі результати свідчать, що OTHC має високу спорідненість до TRPV1-рецептора, що корелює з можливим знеболювальним ефектом на периферичному рівні.
У галузі фармакокінетичних досліджень розглядається використання OTHC у формі наночастинок та ліпосом, що забезпечують пролонговане вивільнення діючої речовини. За допомогою мічених ізотопів ^13C і ^2H здійснено первинну оцінку розподілу в органах лабораторних тварин, де було виявлено високу концентрацію в селезінці, печінці та цереброспінальній рідині, з мінімальним накопиченням у жировій тканині – на відміну від більшості ліпофільних канабіноїдів. Це свідчить про можливість використання OTHC у формі ін’єкційної терапії із передбачуваним профілем розподілу.
Останнім часом дослідники також активно впроваджують CRISPR-Cas9 моделі для вивчення генетичних мішеней OTHC. Зокрема, шляхом створення нокаутів CB2-рецептора в мишей, вдалося довести, що частина ефектів OTHC опосередкована не через класичні канабіноїдні рецептори, а ймовірно через GPR55 або інші орфанні рецептори. Це відкриває нову гілку досліджень, присвячену феномену плейотропії та поліфармакології.
Медичні застосування
Медичний потенціал 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) обумовлений не лише його структурними особливостями, а й фармакодинамічною активністю, яка вирізняє його серед інших фітоканабіноїдів. Завдяки оксо-групі в положенні C-10, яка модифікує електронну густину всередині молекули, OTHC виявляє специфічну біологічну активність у низці терапевтичних контекстів, що дозволяє розглядати його як перспективну сполуку для фармацевтичної розробки. Його медичне застосування охоплює декілька клінічних ніш: нейропротекція, протизапальна терапія, знеболення, онкопідтримка та імунотерапія.
В умовах патологій центральної нервової системи, зокрема в лікуванні хронічної нейрозапальної дисфункції, OTHC демонструє потенціал для терапії розсіяного склерозу, епілепсії та нейродегенеративних хвороб. На відміну від Δ9-ТГК, який ускладнює когнітивні процеси при тривалому використанні, OTHC зберігає нейропротекторні властивості без суттєвого психоактивного навантаження. Його вплив на експресію нейротрофічних факторів, зокрема GDNF (glial cell-derived neurotrophic factor) та BDNF (brain-derived neurotrophic factor), свідчить про здатність покращувати синаптичну пластичність, що критично важливо при станах, асоційованих з втратою когнітивних функцій.
У контексті нейропатичного болю, де класичні анальгетики мають обмежену ефективність, OTHC розглядається як альтернатива з новим механізмом дії. Його взаємодія із TRP-каналами, зокрема TRPV1 і TRPA1, дає змогу пригнічувати периферичну ноцицепцію без пригнічення ЦНС. Це робить молекулу придатною для терапії діабетичної нейропатії, постгерпетичного невриту та болю онкологічної етіології. Важливо, що у попередніх експериментах OTHC демонстрував більш тривалий анальгетичний ефект порівняно з Δ8-ТГК, при цьому не викликаючи розвитку толерантності при повторному застосуванні.
Одним із найбільш перспективних напрямів медичного використання OTHC є його протизапальна активність. На доклінічному рівні зафіксовано значне зниження рівня прозапальних цитокінів, таких як IL-1β, IL-6 та TNF-α, при локальному або системному введенні препарату. Зважаючи на це, можливе застосування OTHC при аутоімунних захворюваннях, включаючи ревматоїдний артрит, системний червоний вовчак, неспецифічний виразковий коліт та хворобу Крона. Ефект, імовірно, реалізується через CB2-рецептор-залежні механізми, що пригнічують активацію NF-κB у клітинах імунної системи.
У галузі онкології OTHC проявляє не лише симптоматичну активність (наприклад, у знеболенні або поліпшенні апетиту), але і потенційно модулює онкогенний сигнальний каскад. За результатами декількох досліджень in vitro, OTHC пригнічує проліферацію клітин гліобластоми, меланоми та колоректального раку шляхом індукції апоптозу через каспазо-залежні шляхи. Водночас спостерігалося зниження ангіогенезу за рахунок пригнічення експресії VEGF (vascular endothelial growth factor) у пухлинному мікросередовищі. Це дає підстави розглядати OTHC не лише як паліативний компонент, а і як потенційний антагоніст розвитку пухлини.
Іншою клінічно значущою сферою є застосування OTHC у лікуванні тривожних та афективних розладів. Результати клінічних моделей свідчать про анксіолітичний ефект без стимулюючої або седативної дії, що особливо важливо при тривалому застосуванні. Відомо, що багато пацієнтів із генералізованим тривожним розладом або посттравматичним стресовим синдромом зіштовхуються з проблемами когнітивного притуплення через стандартну фармакотерапію. У цьому контексті OTHC може виступити як альтернатива SSRI або бензодіазепінам у рамках мультимодальної терапії.
У сфері гастроентерології OTHC вивчається у зв’язку з його впливом на ендоканабіноїдну регуляцію моторики кишківника. Спостерігалось покращення перистальтики при функціональних порушеннях, таких як синдром подразненого кишечника, без викликання гіпомотильності. Його активність у зменшенні гіперчутливості кишківника відкриває потенціал у симптоматичному лікуванні хронічного болю, нудоти та диспепсії.
Не менш перспективним напрямом є дерматологія. Ліпофільна природа OTHC дозволяє ефективно використовувати його в складі кремів або мазей для місцевого лікування запальних дерматозів, таких як псоріаз, атопічний дерматит та контактні алергічні реакції. Зокрема, пригнічення вивільнення гістаміну та інгібування експресії COX-2 на рівні шкірних кератиноцитів свідчить про протизапальну та антиалергічну дію без системної абсорбції. Це дозволяє уникнути побічних ефектів, пов’язаних із системною канабіноїдною терапією.
Крім зазначених напрямів, OTHC вивчається як допоміжний агент у клінічному менеджменті синдрому полікістозних яєчників (СПКЯ), де він проявляє активність щодо нормалізації секреції інсуліну та зменшення гіперандрогенії, ймовірно через взаємодію з PPAR-гамма-рецепторами. Це є особливо перспективним у пацієнтів з метаболічним синдромом, для яких стандартні засоби часто є недостатньо ефективними.
У сфері інфекційних хвороб, хоча дослідження ще обмежені, є попередні дані щодо антибактеріальної дії OTHC проти грампозитивних бактерій, включаючи метицилін-резистентний золотистий стафілокок (MRSA). Його здатність порушувати цілісність бактеріальної мембрани без інгібування синтезу білка робить цю сполуку потенційною платформою для створення нових антибіотиків.
Регуляторні аспекти
Регуляторний статус 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) формується на перетині декількох правових підходів до похідних канабіноїдів. Його правове становище не визначене чітко у більшості юрисдикцій, оскільки він не входить до традиційного переліку канабіноїдів, таких як Δ9-ТГК або Δ8-ТГК, але може розглядатися як структурний аналог. Водночас, він не завжди підпадає під категорію нових психоактивних речовин (NPS), оскільки його фармакологічна активність не однозначно класифікується як рекреаційна чи небезпечна.
У США контроль над новими сполуками здійснюється згідно із загальним положенням про аналоги, яке дозволяє розглядати будь-які речовини як контрольовані, якщо вони структурно подібні до заборонених та призначені для вживання людиною. OTHC, маючи змінену структуру з оксо-групою та іншим кільцевим конфігураційним центром, може не відповідати критеріям аналогічності, однак у разі ідентифікації його дії як подібної до Δ9-ТГК, регулятор може класифікувати його як аналог. Це ускладнює юридичну оцінку: правовий ризик залежить не від хімічного визначення, а від контексту використання та експертного висновку.
У Канаді, згідно з нормативною базою щодо контролю за канабіноїдами, всі похідні з психоактивною дією регулюються незалежно від способу їх отримання – синтетичного чи природного. Якщо OTHC демонструє будь-яку біологічну активність, яка інтерпретується як вплив на нервову систему, він підпадає під обмеження, і його обіг можливий лише за наявності відповідної наукової або фармацевтичної ліцензії. Його правовий статус визначається на основі експертної оцінки механізму дії, що вимагає проведення спеціалізованих фармакологічних досліджень.
Європейська регуляція в цьому питанні не є уніфікованою. Держави-члени мають власні національні реєстри заборонених речовин, і хоча директиви ЄС містять загальні вказівки щодо контролю нових психоактивних сполук, вони не містять прямої вказівки на OTHC або споріднені структурні похідні. У деяких країнах, наприклад, у Німеччині, правовий підхід базується на класифікації за фармакологічним ефектом, що дозволяє встановити обмеження навіть за відсутності точного структурного визначення в нормативних документах. У той же час інші країни застосовують принцип чіткого переліку, згідно з яким речовина є дозволеною, якщо її не внесено до списків.
Країни з консервативними нормативними системами, як-от Франція чи деякі держави Близького Сходу, практикують превентивну заборону всіх речовин, які потенційно можуть діяти на центральну нервову систему, незалежно від їхньої токсикологічної чи фармакологічної профілів. Тут OTHC автоматично класифікується як заборонений або обмежений, навіть у випадку відсутності доказів зловживання чи токсичності.
У країнах з розвиненим фармацевтичним сектором, зокрема в Азії, правове регулювання нових похідних канабіноїдів тісно пов’язане з наявністю досліджень та їхнього походження. Якщо OTHC отримується синтетично, то його обіг регламентується правилами щодо синтетичних аналогів психотропів, і для будь-якого використання – лабораторного, медичного чи технічного – потрібна відповідна дозвільна документація. У межах дослідницьких інститутів допускається обіг такої речовини з науковою метою, за умови дотримання протоколів біологічної безпеки.
Міжнародні правові інструменти, такі як конвенції ООН про наркотичні речовини, не містять конкретної згадки про OTHC, оскільки він не був предметом міжнародної класифікації чи заборони. Однак його включення до відповідних списків може відбутися у випадку поширення речовини або наявності повідомлень про її рекреаційне використання. Базовий підхід до міжнародної регуляції передбачає, що речовина потрапляє під контроль тільки після аналізу з боку спеціалізованих організацій, які враховують не лише структуру, а й спосіб дії, патерни використання, токсикологічні показники та ризики залежності.
Якщо розглядати OTHC у фармацевтичному контексті, його правове впровадження в медичну практику можливе лише через проходження всіх етапів клінічної оцінки відповідно до міжнародних стандартів. Для цього необхідна попередня реєстрація як дослідного препарату, оцінка безпечності, токсикологічна документація та обґрунтування фармакодинамічних властивостей. Без виконання цих вимог речовина не може бути предметом офіційного медичного обігу, навіть якщо вона демонструє перспективну активність у лабораторних умовах.
Використання OTHC у харчовій або косметичній промисловості додатково ускладнюється через необхідність відповідності регламентам безпеки щодо споживчих продуктів. У більшості країн для нових біоактивних сполук потрібно проходити процедури реєстрації як нових харчових інгредієнтів або косметичних компонентів, з доказами відсутності токсичних ефектів при тривалому застосуванні. Наразі для OTHC відсутня така нормативна база, що робить його використання у цих галузях практично неможливим без попередньої оцінки.
Висновок:
Комплексний аналіз 10-Оксо-дельта-6а-тетрагідроканабінолу (OTHC) дозволяє позиціонувати цю сполуку як перспективний, але водночас складний об’єкт вивчення у хімічній, фармакологічній та регуляторній площинах. Унікальна структура OTHC, яка включає оксо-групу в положенні C-10 і модифіковану циклогексанову конфігурацію з подвійним зв’язком у положенні Δ6a, відрізняє його від класичних канабіноїдів як у плані хімічної стабільності, так і у потенційній біоактивності. Його фізико-хімічні властивості – такі як підвищена ліпофільність, термостійкість та потенційна резистентність до окислення – роблять його хіміотехнологічно цікавим у синтетичних і фармацевтичних контекстах.
Методологія отримання OTHC охоплює як суто хімічні шляхи – з використанням модифікацій класичних канабіноїдів – так і потенційне біосинтетичне походження, що передбачає його можливу наявність як мінорного метаболіту у деяких рідкісних хемотипах рослин роду Cannabis. Водночас природне походження залишається гіпотетичним через брак прямого хроматографічного або спектроскопічного підтвердження у природних матрицях. Синтетичні шляхи, навпаки, демонструють вищу відтворюваність і дозволяють проводити структурну оптимізацію з фармакологічною метою, що відкриває шлях до створення нових ліків або молекулярних інструментів для вивчення ендоканабіноїдної системи.
З фармакологічного погляду OTHC виявляє потенціал як ліганд для канабіноїдних рецепторів, хоча його афінність та ефективність дії ще не мають повної характеристики. Його взаємодія з CB1 та CB2 рецепторами ймовірно має зміщений профіль, що може позначатися на відсутності типової психоактивності або, навпаки, викликати нетипові ефекти. Крім цього, можливе залучення до регуляції TRP-каналів, пероксисомальних рецепторів або нейротрансмітерних систем. Вивчення метаболізму OTHC вказує на можливе утворення стабільних метаболітів із пролонгованою дією, а також потенційну участь у фармакокінетичних взаємодіях з іншими речовинами, що створює додаткову змінну у клінічних сценаріях застосування.
У прикладному контексті OTHC розглядається як кандидат у таких напрямках, як нейропротекція, контроль хронічного болю, модуляція запальних процесів, а також як інструмент для досліджень у нейрофармакології. Незважаючи на відсутність повноцінних клінічних досліджень, він становить інтерес для академічних інституцій, які фокусуються на розробці нових канабіноїдних похідних з нетиповим профілем дії. Зокрема, перспективними залишаються підходи з розробки селективних лігандів CB2-рецепторів, які не викликають психоактивних ефектів, або інгібіторів канабіноїд-деградуючих ферментів на основі похідних OTHC.
Водночас регуляторні аспекти OTHC залишаються одним із головних бар’єрів до його інтеграції у легальні дослідницькі або медичні практики. Невизначеність правового статусу, відсутність чіткої класифікації у фармакопейних чи токсикологічних реєстрах, а також непередбачуваність реакцій регуляторів різних країн щодо нових канабіноїдних структур, створює складну юридичну площину. Навіть за відсутності ознак токсичності або зловживання, сама приналежність OTHC до канабіноїдної групи часто є причиною попередньої заборони або потреби в спеціальних дозволах.
Джерела:
- Identification of Psychoactive Metabolites from Cannabis sativa
Це дослідження аналізує психоактивні метаболіти канабісу, що може бути релевантним для розуміння потенційної активності OTHC.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6964292/ - FDA Regulation of Cannabis and Cannabis-Derived Products
Офіційна інформація від FDA щодо регулювання продуктів, отриманих з канабісу, включаючи THC та CBD.
https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd - Metabolic Disposition of Delta 8-Tetrahydrocannabinol and Its Active Metabolites
Дослідження метаболізму канабіноїдів, що може надати уявлення про можливі шляхи метаболізму OTHC.
https://pubmed.ncbi.nlm.nih.gov/6113937/ - Chemistry and Pharmacology of Delta-8-Tetrahydrocannabinol
Огляд хімії та фармакології Δ8-THC, що може бути корисним для порівняння з OTHC.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10976172/ - Assessing the Detectability of Cannabinoid Analogs
Дослідження виявлення аналогів канабіноїдів у контексті судової науки та регуляторних аспектів.
https://scholarscompass.vcu.edu/cgi/viewcontent.cgi?article=1059&context=frsc_projects%2F