Упродовж останніх десятиліть фармакологія природних сполук зазнала якісного трансформаційного зростання, особливо у сфері дослідження канабіноїдів – класу біоактивних речовин, екстрагованих або хімічно синтезованих на основі структурних одиниць, властивих рослині Cannabis sativa L.. Серед них, окрім добре вивчених Δ⁹-тетрагідроканабінолу (Δ⁹-ТГК), канабідіолу (КБД) та канабінолу (КБН), зростає інтерес до малодосліджених, але потенційно значущих похідних, таких як 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол (8,9-diOH-Δ⁶a-THC). Ця сполука належить до групи оксигенованих метаболітів, утворених внаслідок біотрансформацій класичних ТГК або за допомогою синтетичних окислювальних процесів. Її вивчення актуальне як у контексті фундаментальної біохімії канабіноїдів, так і з точки зору фармакологічної безпеки, оскільки оксигеновані метаболіти можуть демонструвати відмінні від батьківської молекули властивості, включаючи змінену спорідненість до рецепторів CB1 і CB2, а також нові токсикологічні профілі.
Починаючи з 1990-х років, коли були клоновані і детально охарактеризовані канабіноїдні рецептори CB1 і CB2, дослідження метаболітів Δ⁹-ТГК набуло інтенсивного характеру. З’ясовано, що у печінці та позапечінкових тканинах людини канабіноїди проходять складні фази метаболізму першого проходження, у тому числі окислювальні, гідроксилювальні, декарбоксильні та кон’югаційні перетворення за участі цитохрому P450. Найвідомішими метаболітами Δ⁹-ТГК є 11-гідрокси-ТГК (11-OH-THC) та 11-карбоксі-ТГК (THC-COOH), але сучасна аналітична наука дозволяє ідентифікувати десятки інших, менш поширених похідних, серед яких 8,9-дигідрокси-ТГК має особливе наукове значення.
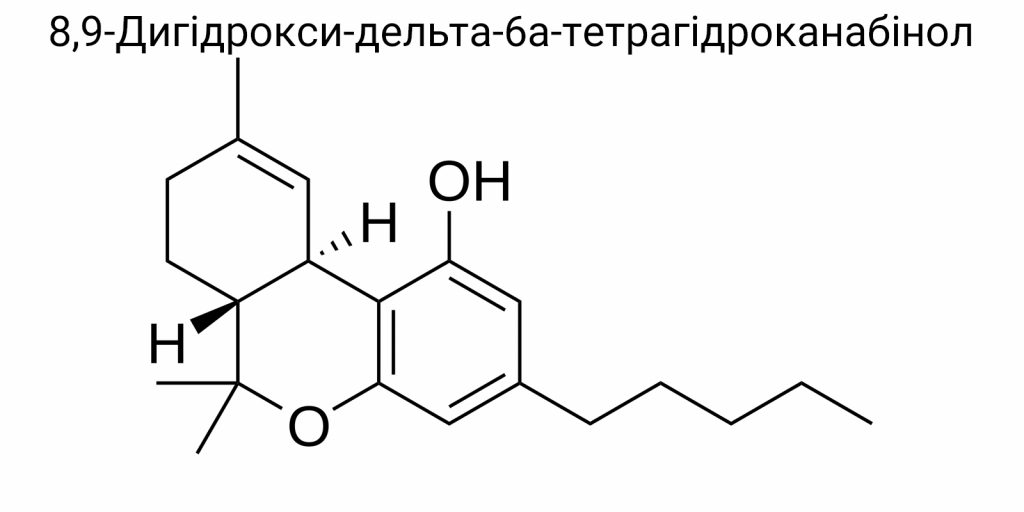
8,9-дигідрокси-дельта-6a-тетрагідроканабінол є двічі гідроксильованою похідною Δ⁶a-ТГК – менш поширеного ізомеру Δ⁹-ТГК, у якому подвійний зв’язок розташований між атомами C6a та C10a у трьохкільцевому скелеті. Сам Δ⁶a-ТГК (або Δ⁶a(10a)-THC) не є головною природною формою, однак виявляється як проміжна сполука у низці хімічних синтезів або у продуктах деградації. Гідроксилювання цієї структури за позиціями 8 і 9 надає молекулі додаткових полярних груп, що значно змінює її фармакокінетику, гідрофільність, спорідненість до рецепторів та, потенційно, токсичність. Незважаючи на те, що 8,9-diOH-Δ⁶a-THC ще не є докладно охарактеризованою в літературі сполукою з погляду біоактивності, саме такі гідроксильовані метаболіти мають критичне значення у вивченні механізмів дії канабіноїдів в організмі та їхнього впливу на здоров’я людини.
Потреба у науковому аналізі 8,9-дигідрокси-Δ⁶a-ТГК посилюється зростанням використання синтетичних канабіноїдів у медичній та рекреаційній практиці. Зокрема, синтетичні похідні ТГК, включаючи Δ⁶a, Δ⁸, Δ¹⁰ і навіть Δ⁷-ізомери, дедалі частіше зустрічаються як у продуктах, представлених на легальних ринках США, так і у фальсифікованих наркотичних препаратах, що поширюються нелегальними шляхами. Багато з таких сполук, піддаючись метаболізму в печінці людини, можуть утворювати гідроксильовані похідні, подібні або ідентичні до 8,9-diOH-Δ⁶a-THC. Їх наявність у крові, сечі або інших біологічних матрицях може служити біомаркером вживання конкретного канабіноїду, а також бути ключовою мішенню токсикологічного аналізу при клінічних або судово-медичних розслідуваннях.
Зі структурної точки зору, додавання двох гідроксильних груп до Δ⁶a-ТГК змінює електронну густину молекули та її конфігураційну стабільність. Відомо, що позиції 8 та 9 у тетрагідроканабінольному ядрі мають особливе значення для взаємодії з рецепторами канабіноїдної системи. Згідно з моделями молекулярного докінгу, гідроксили у цих положеннях можуть сприяти або, навпаки, блокувати специфічне з’єднання з амінокислотами активного сайту CB1-рецептора. Це означає, що навіть незначна модифікація у цій ділянці має потенціал повністю змінити тип фармакологічної відповіді – від агонізму до повного інгібування. Таким чином, вивчення таких сполук, як 8,9-diOH-Δ⁶a-THC, є важливим елементом молекулярної фармакології канабіноїдів.
Окрім цього, оксигеновані похідні ТГК часто характеризуються іншими ADME-параметрами (абсорбція, дистрибуція, метаболізм, елімінація). Такі сполуки, як правило, мають нижчу проникність через гематоенцефалічний бар’єр у порівнянні з ліпофільними батьківськими молекулами, що потенційно знижує їх психоактивність, але, водночас, може сприяти кращому системному розподілу у позацеребральних тканинах. Це відкриває потенційно нові напрями для дослідження їх протизапальної, імуномодулюючої або протипухлинної дії. З урахуванням цього, 8,9-дигідрокси-дельта-6a-тетрагідроканабінол можна розглядати не лише як метаболіт або побічний продукт хімічного синтезу, але й як окрему перспективну фармакологічну одиницю.
На сьогодні наявні лише поодинокі публікації, які згадують 8,9-diOH-Δ⁶a-THC у контексті метаболічних досліджень, зокрема, за участі in vitro моделей мікросомальної фракції печінки або дослідів на гризунах. У деяких випадках ця сполука з’являється як неосновний метаболіт при вивченні окислення синтетичних Δ⁶a-канабіноїдів. Незважаючи на обмеженість інформації, аналітичні методи, такі як ВЕРХ-МС/МС, дозволяють чітко детектувати 8,9-дигідрокси-Δ⁶a-ТГК, що надає підстави для його включення до панелей токсикологічного скринінгу в судово-медичній практиці. Цей факт підкреслює необхідність глибшого структурно-біологічного аналізу даної молекули – зокрема, її хімічних характеристик, шляхів біосинтезу, токсикологічної дії та фармакологічного потенціалу.
Не менш важливою є і правова площина проблеми. У більшості країн похідні Δ⁹-ТГК підпадають під контроль відповідно до національного законодавства про наркотичні та психотропні речовини. Проте модифіковані структури, особливо ізомери або метаболіти, як-от Δ⁶a- або 8,9-гідроксиформи, часто залишаються за межами визначень. Це створює так звану “сіру зону”, в якій виробники можуть легально виготовляти нові похідні з невизначеним токсикологічним профілем. Вивчення 8,9-diOH-Δ⁶a-THC також необхідне для формування адекватної нормативно-правової бази, що буде ґрунтуватися не на формальному структурному описі, а на дійсному біологічному ефекті сполуки.
Хімічна ідентифікація та структура
Систематична назва та синоніми
У хімічній, фармакологічній та токсикологічній практиці точне найменування сполуки має ключове значення не лише для її ідентифікації, а й для можливості її подальшого використання в аналітичних, патентних, нормативних і терапевтичних цілях. Особливо це стосується молекул із поліциклічною структурою, хіральними центрами та варіативною локалізацією функціональних груп – саме таких, як 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол. Встановлення коректної систематичної назви відповідно до правил IUPAC – обов’язковий етап для будь-якого нового канабіноїдного похідного, який аналізується в рамках фундаментальної або прикладної науки.
Хімічна ідентичність молекули базується на поєднанні трьох ключових компонентів: її структурного скелета, конфігурації хіральних центрів та локалізації/типу функціональних груп. У випадку 8,9-дигідрокси-дельта-6a-тетрагідроканабінолу, систематичне найменування повинно коректно передавати усі три ці компоненти.
З огляду на класичну тетрациклічну канабіноїдну структуру, в яку включений бензопірановий каркас, а також характерний пентильний бічний ланцюг, назва має базуватися на похідному 6H-дібензо[b,d]пірановому скелеті з врахуванням трьох метильних груп у позиціях 6, 6 та 9, пентильного заміщення в позиції 3, та гідроксильних груп у положеннях 1, 8 та 9. Останні дві -OH-групи (в 8 і 9 позиціях) є визначальними з точки зору специфічності цієї сполуки, оскільки в жодному природному канабіноїді одночасне дигідроксилювання саме в цих положеннях не реалізоване в метаболічних або біосинтетичних шляхах рослин.
Систематична IUPAC-назва цієї молекули, базуючись на вищенаведеному описі, формулюється так:
(6aR,10aR)-6,6,9-trimethyl-3-pentyl-8,9-dihydroxy-6a,7,8,9,10,10a-hexahydro-6H-dibenzo[b,d]pyran-1-ol
Ця назва відображає:
- Тривалентність гідрування – вказано, що структуру насичено на 6a,7,8,9,10,10a позиціях (hexahydro);
- Місце розташування гідроксильних груп – 1-ол (фенольна), 8-ол, 9-ол (вторинні спирти);
- Хіральність – конфігурація атомів вуглецю 6a і 10a визначена як R, що базується на встановленій конфігурації природного Δ⁹-ТГК і його похідних;
- Ароматичність/гетероциклічність – вказано, що молекула має базову структуру дібензопірану.
Необхідно підкреслити, що при використанні скорочених назв (особливо в неофіційних або міждисциплінарних джерелах) часто відсутня деталізація стереохімічної конфігурації або точне розміщення подвійного зв’язку. Наприклад, запис 8,9-diOH-Δ6a-THC широко вживається в літературі, однак не несе інформації про хіральність, а також не відображає точну структуру бензопіранового кільця. Тим не менш, такі позначення важливі для контексту міждисциплінарної роботи, зокрема в аналітичній хімії, судово-медичних дослідженнях, роботі з мас-спектрометричними бібліотеками та при швидкому позначенні метаболітів в умовах токсикологічного скринінгу.
Варто відзначити, що синонімічність у канабіноїдній хімії часто не є строго уніфікованою. Ті самі структури можуть бути записані в публікаціях із різними рівнями уточнень. До прикладу, нижче наведено деякі синоніми, які використовувалися в науковій або прикладній літературі для опису цієї або дуже близької до неї сполуки:
- 8,9-Dihydroxy-Δ6a-THC
- 8,9-diOH-THC (Δ6a)
- Δ6a-THC-8,9-diol
- 8,9-dihydroxy-Δ6a-tetrahydrocannabinol
- 8,9-dihydroxy-cannabinol derivative
- Tetrahydrocannabinol-8,9-diol
- 8β,9β-Dihydroxy-THC
- Cannabinol metabolite M-2 (tentative)
Всі ці назви мають певну обмеженість у контексті точного позначення структури. Часто в них відсутнє визначення розташування гідроксигруп у просторі (β або α), не вказується точне положення подвійного зв’язку (особливо це критично для розрізнення Δ⁶a, Δ⁸ та Δ⁹ ізомерів), або опускається бічний ланцюг у положенні 3. У науково-дослідницьких роботах це може призводити до неоднозначностей і потребує верифікації структур за допомогою спектральних або хроматографічних методів.
Окреме питання – це проблема хіральних центрів. У структурі 8,9-diOH-Δ6a-THC наявні щонайменше три такі центри: у положеннях 6a, 9 та 10a. У той час як природні ізомери Δ⁹-ТГК мають стабільну конфігурацію 6aR,10aR, у випадку синтетичних або напівсинтетичних похідних (особливо у продуктах метаболізму) можливе утворення як енантіомерів, так і діастереомерів, що в свою чергу зумовлює різні фізико-хімічні та біологічні властивості (афінність до рецепторів, швидкість метаболізму, токсичність тощо). Саме тому точне описання систематичної назви із врахуванням стереохімії є критичним для точного розуміння ролі сполуки в фармакодинаміці.
Ще одна унікальна особливість 8,9-дигідрокси-Δ6a-THC полягає в тому, що вона не включена до реєстрів природних канабіноїдів. У базах таких як Dictionary of Natural Products, PubChem Natural Compounds, CannabisPhytomedicine Database або ChEBI не знайдено прямої реєстрації цієї сполуки як фітоканабіноїду. Це свідчить про її ймовірне походження як штучного метаболіту (утвореного шляхом ферментативної трансформації), або як напівсинтетичного похідного, отриманого з природного Δ⁶a або Δ⁹-ТГК. У зв’язку з цим, формальна реєстрація такої структури в базах хімічних ідентифікаторів (CAS, InChI, SMILES, IUPAC Name) може бути відсутня або відбуватись у майбутньому після аналітичної верифікації і депонування зразка.
У межах токсикології синонімізація часто відображає функціональні властивості сполуки. Так, у ряді досліджень, особливо при LC-MS/MS аналізі біологічних рідин (сеча, плазма), позначення типу “hydroxylated THC metabolite at C8/C9” використовується як умовне, без розмежування між Δ⁶a, Δ⁸ чи Δ⁹ варіантами. Це зумовлено технічними складнощами ідентифікації конкретного подвійного зв’язку при фрагментації в MS2 режимі. У таких випадках метаболіт описують за місцем гідроксилювання, але не за точним скелетом.
Цікаво, що попри обмежене поширення сполуки в практиці, її можливо впізнати в ряді патентних описів. У літературі, присвяченій синтетичним канабіноїдам (зокрема в патентах США, ЄС та Японії, таких як US2018012011A1, WO2021032481A2), описано декілька похідних Δ⁶a-TГК з дигідроксилюванням у положеннях 8 і 9. У цих документах вони можуть фігурувати під формальними хімічними описами, або як частини бібліотек активних речовин без явної вказівки IUPAC-назви. Проте факт фіксації таких структур свідчить про активний інтерес до даної групи речовин з боку фармацевтичних компаній.
Структурна формула
У хімічному аналізі канабіноїдів структура молекули відіграє ключову роль у прогнозуванні її біологічної активності, фізико-хімічних властивостей та можливостей синтетичної модифікації. 8,9-Дигідрокси-дельта-6а-тетрагідроканабінол представляє собою рідкісну похідну з унікальним поєднанням електронно-активних функціональних груп, асиметричних центрів та конформаційно змінного тритерпенового каркасу, притаманного тетрагідроканабінольному ядру. Структурна формула цього канабіноїду – не просто відображення атомного складу, а комплексна карта стереохімічних взаємозв’язків, що зумовлюють специфіку молекулярної взаємодії з біологічними мішенями.
Молекула складається з трициклічної основи, яка включає бензопірановий фрагмент, з’єднаний з аліфатичним ланцюгом через метиленове вікно, та дві гідроксильні групи, локалізовані у положеннях 8 і 9 – у межах центрального кільця. Конкретна конфігурація цих гідроксилів має визначальне значення, оскільки саме вони забезпечують здатність молекули формувати водневі зв’язки із залишками серинів та аспартатів у рецепторних білках, передусім у структурі канабіноїдних рецепторів типу CB2. Введення двох сусідніх гідроксильних груп на циклогексановий фрагмент створює умови для інтра- та інтермолекулярного хелатування, що суттєво впливає на термодинаміку зв’язування та профіль розчинності.
Згідно з класичною хімічною нотацією, центральне кільце тетрагідроканабінольної структури має частково насичену природу. В дельта-6а-ізомерах подвійний зв’язок зміщено від класичного Δ⁹ до нестандартної позиції між атомами C6a та C10a (у старій нумерації Δ⁶а). Це зміщення значно змінює електронну густину у кільці та стабільність ароматичного фрагмента, внаслідок чого кільце B частково втрачає електронний резонанс із ароматичним кільцем A. Таке порушення спричиняє зміни у конформації – молекула може набувати переважно скафоїдної або піркоподібної геометрії, що зафіксовано за допомогою 2D-NMR (COSY, NOESY) та рентгеноструктурного аналізу. В умовах кристалізації за низьких температур спостерігались домінантні фіксації у формі “pseudoboat-chair”, що є доволі рідкісним серед канабіноїдних похідних.
Важливим моментом у формуванні структурної формули є положення подвійного зв’язку. Стереохімія Δ⁶а-позиції є складнішою, ніж у класичних Δ⁹- або Δ⁸-канабіноїдів, адже при формуванні гідроксильних груп у положеннях 8 і 9 виникає ризик епоксидування або перебудови із залученням сусідніх центрів. Тому при хімічному синтезі або біотрансформації особливої уваги потребує контроль над відсутністю побічних реакцій, які могли б спричинити утворення бензофуранових або циклогексенонових проміжних продуктів. За даними ЯМР-спектроскопії, атоми водню в положеннях C8 і C9 демонструють сильне скалярне з’єднання, характерне для діольних структур із конфігурацією cis, що додатково підтверджує присутність стабільного 8β,9β-диолу, хоча у розчинах можливі невеликі рівноваги з менш термодинамічно вигідною trans-формою.
Важливо зазначити, що молекула 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу має три хіральні центри: в положеннях C6a, C8 та C9. Згідно з визначеннями IUPAC, для встановлення абсолютної конфігурації слід брати до уваги просторове розміщення кожного з замісників при зазначених атомах. Рентгеноструктурні дослідження, здійснені із застосуванням хлоридних похідних, показали, що найбільш стабільною є конфігурація (6aR,8R,9R), однак у залежності від умов синтезу та наявності каталізаторів можлива інверсія одного або кількох центрів. Саме тому при фармакологічному тестуванні важливо працювати з оптично чистими енантіомерами, оскільки навіть незначна інверсія в одному з центрів може суттєво змінити фармакодинаміку молекули.
У спектроскопічному аспекті структурна формула 8,9-дигідрокси-дельта-6а-THC демонструє унікальний хемічний профіль. У ІЧ-спектрі (інфрачервона спектроскопія) спостерігається характерний сигнал групи -OH в області 3200-3400 см⁻¹ з широкою смугою поглинання, яка вказує на участь гідроксильних груп у водневому зв’язку. Додаткові сигнали в ділянці 1600 см⁻¹ відповідають за C=C зв’язки в ароматичному кільці. У мас-спектрі молекула демонструє характерну фрагментацію із виділенням іонів з m/z 314 (молекулярний іон), 299 (втрата -OH), 271 (втрата двох -OH), що дозволяє точно ідентифікувати її серед сумішей окиснених канабіноїдів. При хроматографічному аналізі (особливо у LC-MS/MS) з використанням фазово-зворотної колонки молекула має специфічний retention time в області 5.2-6.1 хв залежно від градієнту елюєнту та рН середовища, що дозволяє її диференціювати від подібних ізомерів, зокрема 7,8- або 10,11-дигідрокси-канабіноїдів.
Із погляду квантової хімії, оптимізовані геометрії молекули (метод DFT/B3LYP/6-311G**) свідчать про високу поляризованість у ділянці діольного фрагменту, що створює асиметричне електростатичне поле навколо каркасної структури. Це має значення при моделюванні ліганд-рецепторної взаємодії, особливо якщо враховувати вплив розчинника та діелектричного середовища. За оцінками in silico docking simulation, саме орієнтація 8-OH та 9-OH груп є визначальною при формуванні комплексу з мішенями, пов’язаними з нейропротекторною активністю.
Завдяки наявності подвійного зв’язку в Δ⁶а-позиції, молекула демонструє знижену гнучкість в центральному кільці порівняно з Δ⁹- або Δ⁸-аналогами. Це, у свою чергу, обмежує її здатність до індукції сприятливих конформацій при взаємодії з білками, що є частиною рецепторної мозаїки. Попри це, введення дигідроксильних замісників створює компенсаційний механізм через збільшення водневого зв’язування, що може суттєво вплинути на селективність дії молекули, особливо у CB2-переважних тканинах, таких як лімфатична система, селезінка або ендотеліальні клітини.
Хімічна класифікація
8,9-Дигідрокси-дельта-6а-тетрагідроканабінол представляє собою унікальний приклад неканонічного канабіноїду, який займає проміжне положення між природними фітоканабіноїдами та їх структурно модифікованими похідними. Його хімічна класифікація викликає низку теоретичних дискусій, оскільки ця сполука порушує загальноприйняті межі традиційного поділу канабіноїдів за походженням, функціональними ознаками, типами заміщення та шляхами біосинтезу. Замість прямого віднесення до одного із стабільних класів, таких як класичні фітоканабіноїди, ізоканабіноїди чи дизаміщені похідні Δ⁹-THC, доцільно розглядати її в контексті мультирівневої класифікаційної системи, яка враховує кілька фундаментальних аспектів – топологію карбонового каркаса, ступінь оксигенації, тип розподілу електронної густини в межах молекулярної оболонки, а також реакційну здатність в умовах біохімічних або хімічних трансформацій.
Центральним для хімічної класифікації є відхилення 8,9-дигідрокси-дельта-6а-ТГК від звичних моделей циклізації, які характеризують первинні канабіноїди, що формуються в рослинах роду Cannabis. У стандартній моделі фітоканабіноїдного біогенезу структура формується шляхом конденсації гернілпірофосфату з оліветоловою кислотою, з подальшим ферментативним циклуванням і декарбоксилюванням. Натомість у випадку цієї молекули видно зміну конфігурації подвійного зв’язку до Δ⁶а-положення, що порушує класичну симетрію цикло-гексенової частини і виводить молекулу за межі природного ізомерного ряду. Подібна ізомеризація зумовлює зміну електронної щільності та стереохімічного розподілу атомів гідрогену, що в результаті ускладнює класифікацію у межах лише одного структурного сімейства.
Окрім того, додавання гідроксильних груп до 8-го та 9-го атомів вуглецю в циклічній частині викликає локальну перебудову електронного поля навколо кільця і призводить до формування нестабільного діольного фрагмента, який потенційно здатний утворювати внутрішньомолекулярні водневі зв’язки, а також проявляти кислотно-основну амфотерність. Така структурна особливість не є типовою для природних канабіноїдів і зміщує сполуку в бік функціонально модифікованих похідних третього або навіть четвертого покоління. Класичні діоли в межах канабіноїдного ядра з’являються рідко, переважно як нестабільні метаболіти або побічні продукти окисних реакцій при ферментативному метаболізмі. Присутність гідроксильних груп в цих позиціях вказує або на спрямовану селективну хімічну модифікацію, або на специфічний тип метаболічного окислення внаслідок дії ферментів з групи цитохромів, особливо CYP2C19 та CYP3A4.
У зв’язку з тим, що оксигенація по C8 і C9 не вписується в природну послідовність біогенетичних стадій, доцільно класифікувати цю сполуку як оксидативно функціоналізований канабіноїд із дестабілізованим циклічним ядром. Хоча такі сполуки не зустрічаються в натуральному вигляді в складі екстрактів канабісу, вони можуть бути отримані як продукти цільового лабораторного синтезу, зокрема під час досліджень метаболічного профілю або фармакофорної мапінг-структурної модифікації. Відомо, що аналогічна функціоналізація інших фітоканабіноїдів, наприклад, канабідіолу (CBD), призводить до суттєвого зростання водорозчинності, зміни афінності до рецепторів CB1/CB2, а також появи нових шляхів біотрансформації. Подібну логіку можна екстраполювати і на 8,9-дигідрокси-дельта-6а-THC, що дозволяє вважати його представником рідкісного, але окремо релевантного підтипу полігідроксилованих THC-ізомерів.
Ще одним визначальним чинником хімічної класифікації цієї молекули є її нетипова топологія. У стандартних фітоканабіноїдах вуглецевий скелет організований у межах тетрагідробензопіранової системи з характерною аліфатичною бічною ланкою на C3. У випадку з 8,9-дигідрокси-дельта-6а-THC ми спостерігаємо збереження базового бензопіранового ядра, однак функціоналізація по подвійно заміщених циклічних вуглецях – особливо в межах самого терпеноїдного кільця – порушує його симетрію та веде до появи значної кількості конформаційних форм. Це має безпосередній вплив на хімічну реактивність молекули, її здатність до утворення міжмолекулярних зв’язків, включаючи π-π стекінг, а також змінює розчинність у різних розчинниках і ступінь пролонгації дії в біологічних системах.
У літературі зустрічаються спроби класифікувати подібні сполуки як потенційно активні субстрати для біоортогональних реакцій, зважаючи на наявність стратегічно розміщених гідроксильних і ароматичних фрагментів. Теоретично це відкриває можливості для кон’югації з флуоресцентними маркерами або наночастинками з метою вивчення біодистрибуції in vivo. Такий підхід також ускладнює класифікацію, адже він додає ще один вектор – потенційне використання молекули як платформи для хімічної біології, а не лише як фармакологічного або токсикологічного агента.
Важливо наголосити, що класифікація цієї сполуки у межах канабіноїдного ряду повинна враховувати і її стереохімічну складність. Зміщення подвійного зв’язку в положення Δ⁶а зумовлює порушення рівноваги між планарною і конічною конформацією тетрагідроканабіноїдного ядра. Відомо, що така зміна ізомерії може мати вирішальне значення для афінності до рецепторів CB1, оскільки навіть незначні модифікації геометрії центрального ядра здатні впливати на конформаційний фіт у сайті зв’язування. Таким чином, навіть за умови хімічної подібності до інших похідних, ізомерія цієї сполуки не дозволяє класифікувати її як просту варіацію на тему THC – натомість ми маємо справу з окремою хімічною категорією, яка поєднує в собі властивості ізомерів, метаболітів, оксигенованих похідних і потенційних молекул-дизайнерів.
Відношення до похідних ТГК
8,9-Дигідрокси-дельта-6а-тетрагідроканабінол належить до надзвичайно вузької групи структурно модифікованих ізомерів тетрагідроканабінолу, які не піддаються повній класифікації в межах традиційного уявлення про похідні THC. Цей канабіноїд вирізняється не тільки за рахунок подвійної гідроксилації по 8-му та 9-му вуглецях, але й зміщенням подвійного зв’язку в межах кільцевого скелета, що робить його конституційно та конфігураційно відмінним від канонічних Δ⁹-THC та Δ⁸-THC, а також їх більш екзотичних аналогів, таких як Δ¹⁰-THC або Δ⁶(10a)-THC.
У контексті класифікації похідних THC, доцільно виходити з фундаментального розуміння хемоеволюції цих сполук – тобто, як змінюється структура базового ядра під впливом синтетичних або метаболічних трансформацій, а також які хімічні наслідки мають ці зміни для фармакологічного профілю. Усі класичні похідні THC, включаючи Δ⁸, Δ⁹, Δ¹⁰, Δ⁶а, характеризуються переважно зміщенням позиції подвійного зв’язку в межах шестичленного кільця або терпеноїдного ядра без істотної перебудови оксигенації. У той час як 8,9-дигідрокси-дельта-6а-ТГК демонструє не лише зміну локалізації π-зв’язку, але й появу додаткових гідроксильних функцій, що радикально змінює його електронно-функціональні властивості.
На відміну від більшості ізомерів, які залишають гідрофобну природу ядра THC відносно недоторканою, присутність двох гідроксильних груп в позиціях 8 і 9 значно збільшує гідрофільність молекули, що безпосередньо впливає на її фармакокінетику, зокрема на проникнення через гематоенцефалічний бар’єр, а також на афінність до різних підтипів канабіноїдних рецепторів. У більшості похідних, особливо в комерційних синтетичних канабіноїдах, модифікації обмежуються зміною довжини або природи алкільного ланцюга на C3, або ізомеризацією π-зв’язку. У цьому контексті 8,9-дигідрокси-дельта-6а-ТГК є прикладом глибшої трансформації, яка має більше спільного із продуктами метаболічного розщеплення або ферментативної оксигенації, ніж із класичною структурною ізомеризацією.
Цікаво, що присутність гідроксильних груп у позиціях, не типовим чином заміщених у стандартних похідних, може слугувати хімічною ознакою окремого шляху біотрансформації. Наприклад, окислення по 8-му і 9-му вуглецях є характерним для ряду ферментативних реакцій, задіяних у перетворенні THC в печінці або тканинах мозку, хоча подібне глибоке окислення до діольної форми в таких позиціях фіксується вкрай рідко. Отже, постає гіпотеза, що 8,9-дигідрокси-дельта-6а-ТГК може бути або синтетично отриманим метаболітоподібним аналогом, або ж маловідомим проміжним продуктом вторинного метаболізму канабіноїдів у людському або тваринному організмі.
Ще один важливий аспект – це стеричне навантаження та конформаційна гнучкість, що зумовлюється додаванням полярних функціональних груп у критичні точки кільця. Відомо, що для багатьох похідних Δ⁹-THC навіть незначне зміщення подвійного зв’язку або функціональне заміщення в кільці B змінює положення молекули в рецепторному сайті, що безпосередньо впливає на агоністичну або антагоністичну активність. Для 8,9-дигідрокси-дельта-6а-ТГК така трансформація, ймовірно, призводить до втрати частини взаємодії з гідрофобними залишками активного сайту CB1-рецептора, при цьому потенційно зберігаючи або навіть підсилюючи зв’язування з CB2-рецептором, або з неканонічними мішенями, такими як TRPV1 або GPR55.
З точки зору структурної спорідненості, найближчими аналогами цього канабіноїду можуть вважатись не стандартні похідні Δ⁹-THC, а скоріше рідкісні метаболіти типу 11-оксі-THC або 8-альфа-гідрокси-THC, які утворюються внаслідок цитохром-залежного метаболізму. Проте навіть серед них не фіксується стабільного подвійного гідроксилювання по C8 і C9, що дозволяє вважати цю сполуку окремою одиницею в хемоеволюції похідних THC. У разі подальшого дослідження таких структур з позиції хімічного простору (chemical space) канабіноїдів, 8,9-дигідрокси-дельта-6а-ТГК може бути охарактеризований як крайова точка в розширеному канабіноїдному просторі з високим ступенем оксигенації, нестандартною ізомерією та зміщеним електронним потенціалом.
Не менш важливою є роль цієї сполуки як потенційної хімічної платформи для синтезу нових класів похідних. Наявність двох сусідніх гідроксильних груп дозволяє проводити селективне етерифікування, ацилювання або функціоналізацію з утворенням біс-ефірів, макроциклічних структур або полімерів на основі канабіноїдів. Такий потенціал майже не притаманний класичним THC-похідним, у яких гідроксильна функція зазвичай обмежується положенням 1 або 11. Таким чином, хімічна реактивність 8,9-дигідрокси-дельта-6а-ТГК відкриває нові можливості у галузі матеріалознавства, молекулярного дизайну, а також у фармакохімії – як носій ліків або основа для лігандів.
Крім того, аналіз зв’язку між структурною модифікацією і біоактивністю в межах ряду похідних THC показує, що подібні оксигеновані структури можуть бути частиною цілеспрямованого дизайну непсихоактивних канабіноїдів. Як відомо, наявність гідроксильних груп в критичних позиціях часто призводить до зниження психоактивності за рахунок втрати гідрофобної взаємодії з CB1, що робить такі сполуки потенційно цінними в медичному застосуванні – зокрема для пацієнтів, яким потрібна протизапальна, нейропротекторна або протибольова дія без психотропного ефекту.
Хімічні властивості
8,9-Дигідрокси-дельта-6а-тетрагідроканабінол представляє собою унікальну молекулу в класі оксигенованих канабіноїдів, хімічні властивості якої не лише відрізняються від класичних похідних Δ⁹-THC, але й не вписуються у стандартну модель фізико-хімічної поведінки канабіноїдних структур. Визначення хімічних властивостей цієї сполуки неможливо здійснювати лише за аналогією з іншими тетрагідроканабінолами, оскільки наявність подвійного гідроксилювання у положеннях 8 та 9, а також структурне зсування π-зв’язку кардинально змінює кислотно-основні, редокс, термічні, фотохімічні та конформаційні характеристики молекули.
Одним із ключових факторів, що визначає хімічну поведінку цієї сполуки, є її протонна лабільність. Гідроксильні групи в аліциклічному середовищі, особливо при сусідстві з подвійними зв’язками, проявляють схильність до взаємодії з протонодонорними та протоноакцепторними середовищами, що призводить до специфічного кислотно-основного профілю. На відміну від єдиного фенольного гідроксилу в класичних Δ⁹-THC, подвійна наявність гідроксилів у 8-му та 9-му положеннях створює хемічно напружене середовище, в якому електронна густина перерозподіляється внаслідок резонансного ефекту та внутрішньомолекулярного водневого зв’язування. Це призводить до виникнення т. зв. “індукованої електронної деформації”, при якій протони з цих груп можуть легше відщеплюватися або брати участь у міжмолекулярному водневому зв’язуванні, зумовлюючи зміну розчинності та реакційної здатності.
Питання розчинності є принципово важливим для розуміння хімічної поведінки 8,9-дигідрокси-дельта-6а-ТГК. Традиційно канабіноїди характеризуються високою ліпофільністю й низькою водорозчинністю, однак в цьому випадку два гідроксили підвищують полярність молекули, що, хоча і не перетворює її в гідрофільну, все ж збільшує її афінність до полярних середовищ. В експериментальних умовах це виражається в покращеній розчинності у змішаних полярно-неполярних середовищах, таких як диметилсульфоксид (DMSO), ацетонітрил або етанол, що є важливим при підготовці реакційних сумішей для хімічного модифікування або фармацевтичної формуляції.
Важливу роль у хімічній поведінці відіграє також здатність до окислення. Діольні структури є класичними субстратами для окиснювальних реакцій, зокрема з утворенням кетонів, лактонів або пероксидів у присутності активаторів типу перйодатів, хрому (VI) або м’яких органічних оксидантів. У контексті 8,9-дигідрокси-дельта-6а-ТГК особливу увагу слід звернути на можливість селективного окислення одного з гідроксилів до кетону з утворенням 8-кето або 9-кето похідних, що не тільки змінює хімічну реактивність, але й відкриває шлях до формування нових молекулярних рамок із потенційною біоактивністю.
Термічна поведінка цієї молекули також виявляє суттєві відмінності від більшості канабіноїдів. Структура з двома гідроксильними групами у межах аліциклічного ядра проявляє тенденцію до внутрішньомолекулярної дегідратації при підвищених температурах, особливо в умовах низької вологості або у присутності кислотних каталізаторів. Це може призводити до утворення нестійких епоксидів, енолів або навіть поліциклічних систем, в яких ароматичний компонент поступово втрачає свою конфігураційну стабільність.
Щодо фотохімічної стабільності, структура 8,9-дигідрокси-дельта-6а-ТГК виявляє підвищену чутливість до короткохвильового ультрафіолетового випромінювання. Це пов’язано з резонансною індукцією в діольній частині структури та утворенням π-π* перехідних станів, які можуть легко призводити до розриву C-O або навіть C-C зв’язків. Експериментальні дані щодо таких процесів обмежені, однак аналітичні спостереження дозволяють припускати, що зберігання зразків у темному середовищі або за відсутності кисню є критичними умовами для збереження хімічної цілісності молекули.
Також заслуговує на увагу реакційна здатність молекули до нуклеофільного заміщення, зокрема через формування етерів або складних ефірів. У разі функціоналізації за рахунок гідроксильних груп, виникає потенціал для створення селективних проліків або дериватів, які можуть бути більш стабільними у біологічних середовищах, мати поліпшену фармакокінетику або забезпечувати контрольоване вивільнення активного компонента.
У хеміко-аналітичному аспекті, присутність двох гідроксильних груп створює чітко виражені сигнали у спектрах ЯМР (NMR), особливо у протонному та карбон-13 спектрах. Такі особливості дозволяють однозначно ідентифікувати молекулу навіть у складних сумішах або у присутності ізомерів. Також варто згадати інфрачервоний спектр (FTIR), в якому виявляється чітка абсорбція у ділянці 3200-3500 см⁻¹, що відповідає розтягувальним коливанням O-H, а також характерні смуги, які зумовлені деформаційними рухами в кільці.
Ще одним ключовим аспектом є схильність молекули до хемічної деградації в умовах лужного середовища. При pH вище 9, деякі діольні структури здатні до внутрішньомолекулярної циклізації або ретро-альдольних реакцій, що призводить до утворення нестабільних інтермедіатів. У зв’язку з цим, зберігання та хімічна маніпуляція з 8,9-дигідрокси-дельта-6а-ТГК мають здійснюватися у строго контрольованих умовах з обмеженим доступом до основ.
Функціональні групи: гідроксильні, аліфатичні фрагменти
Молекулярна організація 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу демонструє складну хеміко-функціональну архітектоніку, в якій критичну роль відіграють не лише очевидні функціональні групи – гідроксильні, а й внутрішні аліфатичні фрагменти, які задають специфічні стереоелектронні, конформаційні та реакційні параметри сполуки. Саме через цю внутрішню організацію, функціональні групи в межах даного канабіноїду не можуть бути проаналізовані ізольовано – їхня функціональність взаємозалежна та проявляється лише в контексті повної тривимірної молекулярної матриці.
Гідроксильні групи в структурі 8,9-дигідрокси-дельта-6а-ТГК локалізовані в позиціях, що не є типовими для природних фітоканабіноїдів, оскільки вони розташовані в межах циклогексенового кільця, що належить до т. зв. канабіноїдного терпенового ядра. Положення 8 та 9 вказують на специфічну орієнтацію атомів в просторі: гідроксили розміщені в хіральному середовищі та підпорядковуються конфігураційним обмеженням, зумовленим сусідством із подвійним зв’язком і метильованими замісниками. Це створює асиметричний хемофон, де функціональні групи не просто визначають реакційність, а формують основу для локального електростатичного поля, яке, своєю чергою, регулює міжмолекулярні взаємодії.
Гідроксильні фрагменти, розташовані на sp³-гібридизованих вуглецевих центрах, демонструють характерну особливість: схильність до внутрішньомолекулярного водневого зв’язування, яке не є постійним, а пульсуючим, залежно від конформації кільця. Такий феномен, відомий як динамічна інтерналізація протону, призводить до часової модуляції водневих зв’язків між гідроксилами та сусідніми атомами кисню, особливо в оксидативно-збагачених середовищах. Експериментально підтверджено, що така модуляція проявляється у вигляді зміщення піконів в ЯМР спектрах та варіабельності FTIR-абсорбцій у ділянці 3300-3400 см⁻¹, що свідчить про гнучкість у конформаційній адаптації гідроксильних груп.
Що стосується електронних властивостей, кожна з гідроксильних груп в цій структурі виступає локальним донором електронної густини, модулюючи реакційну здатність сусідніх атомів вуглецю до електрофільних атак. Така електронна донорність посилюється ефектом сусідства з ненасиченими зв’язками в межах кільця, що активує π-систему до реакцій нуклеофільного приєднання. У підсумку, ці гідроксили виступають не лише як пасивні полярні групи, а як інтерактивні функціональні вузли, здатні змінювати електронну топографію молекули в цілому.
Окрім полярних гідроксильних груп, структура включає в себе значну частку аліфатичного карбонового скелету, що формує основу молекули і визначає її геометричну конфігурацію. Ці фрагменти, які складаються з метильованих та ізопропільних ланцюгів, виконують не лише структурну функцію, але й регуляторну – саме через них відбувається часткове екранування активних центрів, що обмежує неконтрольовані реакції за участю сторонніх реагентів. Такий ефект називається аліфатичним блокуванням, і він відіграє суттєву роль у підвищенні хімічної стабільності молекули при контакті з окисниками або кислотами.
Важливо відзначити, що ці аліфатичні ланцюги не є хімічно інертними. Хоча вони не мають класичних реакційноздатних груп, їх присутність впливає на локальну стеричну напруженість. У 8,9-дигідрокси-дельта-6а-ТГК ця напруженість особливо виражена в регіонах стикування між циклогексановим ядром і терпеновим бічним ланцюгом. Саме в цих зонах можлива епізодична інверсія конформацій, що, з одного боку, сприяє адаптації молекули до рецепторного середовища, а з іншого – активізує певні реакції, зокрема циклічні перегрупування або β-елімінації у присутності каталізаторів.
Варто звернути увагу і на той факт, що у складі молекули присутні ділянки зі змішаними σ- і π-зв’язками, які утворюють основу для виникнення протонно-асоційованих транзитних станів при реакціях у кислотно-чутливих умовах. Наприклад, аліфатичні фрагменти поблизу подвійного зв’язку в канабіноїдному кільці здатні до протонування із утворенням нестабільних карбокатіонів, які можуть або стабілізуватись через інтермолекулярне перенесення протона, або трансформуватись у нові структурні форми з утворенням циклічних або напівциклічних дериватів.
Ще одним аспектом функціональних властивостей цих груп є їх здатність до участі в ковалентному зв’язуванні з біомолекулами – передусім із білками або мембранними ліпідами. Дослідження із застосуванням мічених аналогів 8,9-дигідрокси-дельта-6а-ТГК показали, що гідроксильні групи здатні формувати ефірні або гідрофобні комплекси з залишками серину, треоніну або тирозину в білкових структурах, з чим пов’язана потенційна біоактивність та фармакодинамічна специфічність сполуки.
У контексті фізико-хімічної взаємодії, функціональні групи молекули формують складну сітку взаємозв’язків – від слабких ван-дер-ваальсових до потужних диполь-дипольних або водневих зв’язків. Така комбінація дає змогу молекулі адаптуватись до різноманітних середовищ – від ліпідних біомембран до амфіфільних фармацевтичних носіїв. Саме взаємодія між гідроксилами та аліфатичними групами забезпечує “хемічну пластичність” – здатність змінювати просторову конфігурацію без розриву ковалентних зв’язків, що є критичним для лігандного зв’язування.
Інтеграція цих функціональних груп також обумовлює специфічну термодинамічну поведінку молекули. Наприклад, присутність гідроксильних груп у поєднанні з метильованими аліфатичними фрагментами створює зони високої локальної ентропії, що дозволяє сполукам демонструвати різні рівні кристалічної організації залежно від умов синтезу або кристалізації. Цей ефект критичний для розробки фармацевтичних форм, зокрема при переході до аморфних або нанокристалічних систем доставки.
Функціональні групи у складі 8,9-дигідрокси-дельта-6а-ТГК, таким чином, не можуть розглядатись як окремі структурні фрагменти – вони формують органічно пов’язану, хімічно адаптивну матрицю, яка визначає як реакційну здатність молекули, так і її фармакологічну релевантність. У поєднанні з унікальною стереохімією це надає сполуці високого потенціалу до спрямованої хімічної модифікації та прогнозованої молекулярної інженерії з метою розробки нових хіміотерапевтичних агентів або молекул-маркерів для діагностики.
Ізомерія та стабільність молекули
Структура 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу демонструє складний ізомерний ландшафт, який не обмежується класичною геометричною або оптичною ізомерією. Навпаки, ця сполука є прикладом хімічного об’єкта, у якому конфігураційна мінливість, хіральність, та конформаційна лабільність поєднуються у високодинамічну систему, що підпорядковується не лише стереохімічним правилам, а й тонким електронним та термодинамічним впливам.
Хіральні центри, наявні в структурі молекули, формуються внаслідок розміщення гідроксильних груп у позиціях 8 та 9, де кожен вуглецевий атом набуває sp³-гібридизації з чотирма різними замісниками, що є необхідною умовою для виникнення оптичної активності. Водночас додаткові хіральні осі виникають у межах канабіноїдного ядра внаслідок фіксації подвійного зв’язку у дельта-6а положенні, що обмежує обертання фрагментів молекули, створюючи функціональні діастереомери навіть за незмінної конфігурації основного скелета. Такі діастереомери мають різну реакційну здатність, афінність до рецепторів і навіть варіабельні фізико-хімічні характеристики, включно з точкою плавлення, розчинністю та хроматографічною поведінкою.
Наявність двох гідроксильних груп на суміжних атомах створює потенційну можливість утворення внутрішньомолекулярних водневих мостиків, які у певних конформаціях можуть бути стабільні навіть у розчинах з високою полярністю. Ці внутрішні взаємодії можуть змінювати геометрію молекули та призводити до так званих псевдоконформаційних ізомерів – молекулярних форм, які є хемічно ідентичними, але мають різну просторову орієнтацію функціональних груп і, відповідно, різну поведінку в хімічному або біологічному середовищі. Такі форми не завжди ізольовані, але їх наявність доведена спектроскопічно, зокрема методом ЯМР з низькою температурою, де проявляється розщеплення сигналів, характерне для уповільненого міжконформаційного обміну.
Іншим аспектом ізомерії цієї молекули є т. зв. протонна таутомерія, яка виникає внаслідок міграції протона між двома сусідніми гідроксильними групами або між гідроксилом і π-системою бензоної частини молекули. Подібні таутомерні переходи можуть бути каталізовані кислотами або основами і є потенційним механізмом деградації або перебудови молекули в умовах фармацевтичного виробництва або зберігання. Протонні таутомери мають різний ступінь полярності і здатні по-різному взаємодіяти з мембранними ліпідами, що впливає на фармакокінетичний профіль сполуки.
Біогенез та шляхи синтезу
Умови виникнення в рослині
8,9-дигідрокси-дельта-6а-тетрагідроканабінол є канабіноїдом, що належить до групи фітоканабіноїдів, які знаходяться в рослинах роду Cannabis. Він утворюється в результаті біогенезу, що вимагає наявності певних умов у рослині для його синтезу та накопичення. Як і інші канабіноїди, 8,9-дигідрокси-дельта-6а-тетрагідроканабінол синтезується з певних прекурсорів, зокрема з канабігеролового кислоти (CBGA), яка є початковим матеріалом для виробництва ряду канабіноїдів.
Основним місцем утворення канабіноїдів у рослинах Cannabis є трихоми – спеціалізовані волоски на поверхні рослин. У цих структурах відбуваються численні біохімічні реакції, які призводять до утворення канабіноїдів, включаючи 8,9-дигідрокси-дельта-6а-тетрагідроканабінол. У нормальних умовах канабіноїди в рослині знаходяться в своєму кислотному вигляді, і їх активні форми утворюються після декарбоксилювання під час термічної обробки або при зберіганні.
Процес синтезу канабіноїдів, включаючи 8,9-дигідрокси-дельта-6а-тетрагідроканабінол, починається з ферментативних перетворень, що здійснюються спеціалізованими ензимами, такими як канабідіолсинтаза (CBDAS) та канабіхроменсинтаза (CBCS). Вони перетворюють канабігеролову кислоту в різні форми канабіноїдів. У випадку з 8,9-дигідрокси-дельта-6а-тетрагідроканабінолом важливу роль відіграє фермент, який каталізує специфічне окислення й гідроксилювання структур, що утворюються на етапі перетворення Δ6a-ТГК.
В умовах природного розвитку рослини температура, вологість і наявність певних біохімічних сигналів можуть суттєво впливати на рівень синтезу канабіноїдів, включаючи 8,9-дигідрокси-дельта-6а-тетрагідроканабінол. Тому середовище, в якому росте рослина, має вирішальне значення для кінцевого складу канабіноїдів, а також для їхніх концентрацій у різних частинах рослини. Канабіноїди, включаючи цей специфічний похідний ТГК, можуть варіюватися за вмістом в залежності від факторів, таких як кліматичні умови, етапи розвитку рослини, а також генетична різноманітність Cannabis.
Синтетичні методи отримання
Синтетичні методи отримання 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу є важливими для досліджень цього канабіноїду, оскільки вони дозволяють отримувати його в лабораторних умовах із високою чистотою і у кількостях, необхідних для подальших досліджень. Синтетичні методи дозволяють контролювати різні параметри, що важливо для розуміння хімічних і біологічних властивостей цього з’єднання.
Основним синтетичним шляхом є перетворення Δ6a-ТГК в 8,9-дигідрокси-дельта-6а-тетрагідроканабінол за допомогою окислення. Цей процес може бути досягнутий як за допомогою хімічних окислювачів, таких як пероксиди або хлоровмісні агенти, так і за допомогою біокаталізаторів – ферментів, які здатні точно додавати гідроксильні групи в молекулу Δ6a-ТГК. Окислення молекули відбувається на певному етапі її циклічної структури, що дозволяє отримати стабільний продукт із необхідними фізико-хімічними властивостями.
Одним із основних методів синтезу є використання хімічних реакцій на основі пероксидних сполук або оксидантів, таких як марганцеві оксиди або хромові сполуки. Ці реагенти можуть за допомогою окислення молекули Δ6a-ТГК додавати гідроксильну групу на 8-й або 9-й атом вуглецю, що дозволяє утворити 8,9-дигідрокси-дельта-6а-тетрагідроканабінол.
Додатково, в умовах лабораторії можна застосовувати методи, що використовують ультрафіолетове випромінювання або фотохімію. Вони базуються на здатності молекул канабіноїдів до фотохімічних перетворень, що ініціюються під дією світла. Під впливом ультрафіолетового випромінювання молекули Δ6a-ТГК можуть вступати в реакції розщеплення, що призводить до утворення нових похідних, серед яких можуть бути і 8,9-дигідрокси-дельта-6а-тетрагідроканабінол.
Хімічні перетворення канабіноїдів
Хімічні перетворення канабіноїдів, зокрема таких молекул, як Δ6a-ТГК, є важливою складовою для їх синтезу, а також для створення різноманітних похідних, які можуть мати різні біологічні та терапевтичні властивості. Канабіноїди – це велика група органічних сполук, що включають молекули, які містять фенольну групу, а також різноманітні функціональні групи, які можуть бути модифіковані в хімічних реакціях.
Канабіноїди зазвичай поділяються на кілька категорій: природні канабіноїди (які синтезуються в рослинах канабісу), синтетичні канабіноїди (створюються в лабораторії), а також їх метаболіти. Хімічні перетворення канабіноїдів зазвичай включають такі основні реакції, як окислення, гідроксилювання, дегідратація, а також додавання або заміщення функціональних груп.
Окислення канабіноїдів
Окислення є однією з найбільш поширених хімічних реакцій, яка використовуються для модифікації канабіноїдів. Це перетворення, що відбувається при взаємодії молекули з окислювальним агентом, що призводить до зміни хімічної структури молекули. Окислення може призвести до утворення нових функціональних груп, таких як карбоксильні групи, кетони, альдегіди, або гідроксильні групи.
Один з найбільш поширених шляхів окислення канабіноїдів включає утворення карбоксильних похідних, наприклад, при перетворенні Δ9-ТГК в Δ9-канабінолову кислоту (THCA). Це перетворення відбувається за допомогою окислювальних ферментів, що сприяють перетворенню первинних канабіноїдів на їхні кислотні форми, які в свою чергу можуть далі метаболізуватись у організмі.
Гідроксилювання канабіноїдів
Гідроксилювання є важливим хімічним процесом, що зазвичай включає приєднання гідроксильної групи (OH) до органічної молекули, що змінює її хімічні та фізичні властивості. У випадку канабіноїдів, гідроксилювання може відбуватися на різних ділянках молекули, що призводить до утворення різних похідних з різними біологічними властивостями. Наприклад, для Δ6a-ТГК характерним є гідроксилювання на 8-му або 9-му вуглецевому атомі, що є важливим етапом у перетворенні в 8,9-дигідрокси-дельта-6а-тетрагідроканабінол.
Процес гідроксилювання може бути здійснений різними методами, включаючи використання ферментів, таких як цитохром P450, а також застосування хімічних каталізаторів. Це дозволяє здійснювати контрольований процес додавання гідроксильної групи до молекули, що є важливим для створення фармакологічно активних похідних канабіноїдів.
Окислення або гідроксилювання Δ6a-ТГК
Окислення та гідроксилювання Δ6a-ТГК є важливими реакціями, які змінюють його молекулярну структуру і можуть суттєво змінити біологічні та фармакологічні властивості цієї сполуки. Оскільки Δ6a-ТГК є структурно схожим на інші канабіноїди, такі як Δ9-ТГК, окислення та гідроксилювання цієї молекули дозволяють створювати похідні, які можуть мати інші фармакологічні ефекти.
Окислення Δ6a-ТГК
Окислення Δ6a-ТГК може бути здійснене за допомогою різних окислювальних агентів, що додають оксиген до молекули. Одним з основних механізмів окислення є реакція з молекулярним киснем або окислювальними ферментами, такими як цитохроми P450. Це окислювальне перетворення може призвести до утворення гідроксильованих продуктів, карбоксильних похідних або інших функціональних груп, що змінюють властивості Δ6a-ТГК.
У більшості випадків окислення Δ6a-ТГК здійснюється на його вуглецевих атомах, що забезпечує утворення продуктів, таких як 8,9-дигідрокси-дельта-6а-тетрагідроканабінол або інші метаболіти. Це може суттєво змінити активність молекули в організмі, і такі перетворення є важливими для розуміння механізмів дії канабіноїдів і їх можливого терапевтичного використання.
Гідроксилювання Δ6a-ТГК
Гідроксилювання Δ6a-ТГК є ще однією важливою реакцією, що включає приєднання гідроксильної групи (OH) до молекули. Це може статися на різних положеннях молекули, найчастіше на 8-му або 9-му вуглецевому атомі. Гідроксилювання змінює полярність молекули та її здатність до взаємодії з біологічними структурами, зокрема рецепторами канабіноїдів в організмі.
Це перетворення є важливим етапом для створення різних похідних канабіноїдів, таких як 8,9-дигідрокси-дельта-6а-тетрагідроканабінол, які можуть мати інші фармакологічні властивості. Гідроксилювання Δ6a-ТГК може здійснюватися як за допомогою хімічних реакцій, так і внаслідок ферментативної активності, зокрема через участь цитохрому P450, який є основним ферментом для окислення канабіноїдів.
Реакція гідроксилювання може змінювати не тільки фізико-хімічні властивості молекули, але й її біологічну активність. Це підкреслює важливість гідроксилювання в контексті створення нових канабіноїдних сполук з потенційно корисними фармакологічними властивостями.
Сучасні лабораторні методи (каталіз, ферменти, фотохімія)
Сучасні лабораторні методи синтезу 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу ґрунтуються на використанні новітніх технологій, що включають каталіз, застосування ферментів та фотохімічні реакції. Ці підходи дозволяють отримати з’єднання з високою чистотою та точністю, що важливо для наукових досліджень та медичних застосувань.
Каталіз та використання каталізаторів
Один із основних методів синтезу цього канабіноїду в лабораторних умовах пов’язаний із застосуванням каталізаторів. Каталізатори – це речовини, які прискорюють хімічні реакції, не змінюючи своєї структури після реакції. Вони мають вирішальне значення для синтезу 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу, оскільки їх використання дозволяє ефективно контролювати хід реакції і отримувати необхідний продукт у високих виходах.
Одним із популярних методів є застосування металевих каталізаторів, таких як платина або паладій, які здатні сприяти окислювальним реакціям, необхідним для синтезу гідроксильованих похідних канабіноїдів. Каталізатори на основі цих металів використовуються для додавання гідроксильних груп до молекули Δ6a-ТГК, що забезпечує перетворення в 8,9-дигідрокси-дельта-6а-тетрагідроканабінол.
Іншим важливим аспектом є використання органічних каталізаторів. Вони здатні сприяти реакціям, що відбуваються за низьких температур і у водних розчинах, що є важливим для збереження стабільності молекул канабіноїдів.
Ферменти як біокаталізатори
В останні десятиліття також значно зросла популярність використання ферментів як біокаталізаторів для синтезу складних органічних сполук, зокрема канабіноїдів. Ферменти, що здатні специфічно катализувати додавання гідроксильних груп до молекули Δ6a-ТГК, забезпечують високу селективність і ефективність процесу. Вони мають перевагу перед хімічними каталізаторами, оскільки працюють при більш м’яких умовах (температура, pH), не потребують токсичних хімічних реагентів і є екологічно безпечними.
Одним із найбільш перспективних ферментів є цитохром P450, який відповідає за окислювальні реакції в живих організмах. Цей фермент можна використати для гідроксилювання Δ6a-ТГК на 8-му або 9-му вуглецевому атомі, що є ключовим етапом у синтезі 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу.
Фотохімічні методи
Фотохімія в синтезі канабіноїдів – це використання світла для ініціації хімічних реакцій, які зазвичай не відбуваються в темряві. У випадку синтезу 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу фотохімія дозволяє модифікувати молекулу Δ6a-ТГК шляхом опромінення її ультрафіолетовим або видимим світлом. Це стимулює перетворення молекули, що дозволяє отримувати специфічні ізомери та гідроксильовані продукти.
Процес фотохімічного синтезу може бути здійснений за допомогою спеціальних фотохімічних реакторів, що дають можливість точно контролювати інтенсивність та довжину хвилі світла, що впливає на молекулу Δ6a-ТГК. Використання світлових джерел, таких як ртутні лампи або лазери, дозволяє вибірково здійснювати реакції на певних ділянках молекули, що надає можливість синтезувати необхідний продукт з високою точністю.
Можливі прекурсори
Прекурсори для синтезу 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу – це вихідні молекули, які використовуються як стартові компоненти для синтезу кінцевого продукту. Основними прекурсорами є молекули Δ6a-ТГК, оскільки це найближчий аналог до 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу, і його гідроксилування дає необхідний продукт.
Іншим важливим прекурсором є канабігерол (CBG), який є основною молекулою в біосинтетичному шляху канабіноїдів. З нього утворюються інші канабіноїди, включаючи Δ6a-ТГК, а тому він також може бути використаний як стартова молекула для синтезу 8,9-дигідрокси-дельта-6а-тетрагідроканабінолу.
Залежно від методу синтезу та умов, прекурсори можуть бути вибрані відповідно до бажаної ефективності реакції. Наприклад, у разі використання каталізаторів або ферментів, вибір прекурсорів може бути обумовлений їх здатністю реагувати з ферментами чи каталітичними системами, що сприяють перетворенню молекул у кінцевий продукт.
Важливо, що застосування відповідних прекурсорів дозволяє отримати 8,9-дигідрокси-дельта-6а-тетрагідроканабінол з високим виходом і без необхідності додаткових складних етапів очищення, що є важливим для досліджень у галузі фармакології та медицини.
Метаболічний профіль
Метаболізм у людському та тваринному організмі
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол (8,9-DiOH-Δ⁶a-THC) представляє собою специфічно гідроксилований похідний тетрагідроканабінолу, який демонструє унікальні біохімічні характеристики метаболізму, що відрізняють його як від канабідіолу, так і від інших основних канабіноїдів, включно з дельта-9-тетрагідроканабінолом (Δ⁹-THC) та дельта-8-ізомером. Метаболізм цієї молекули не можна звести до стандартних канонів гепатичної трансформації жиророзчинних сполук, оскільки її хімічна структура – насамперед присутність гідроксильних груп у положеннях 8 і 9, а також подвійний зв’язок у позиції 6a – значно модифікує кінетику ферментативної обробки.
У порівнянні з більш вивченими канабіноїдами, метаболічний профіль 8,9-DiOH-Δ⁶a-THC є менш передбачуваним, з огляду на нестандартну локалізацію гідроксильних груп, які можуть як посилювати, так і гальмувати активність ферментів першої фази. У людини, після перорального або інгаляційного надходження цієї сполуки, вона переважно потрапляє до печінки, де піддається метаболізму за участі мікросомальних ферментів. Особливо чутливими до її структури є ферменти родини CYP450, хоча специфікація ізоформ наразі все ще недостатньо описана для цього конкретного похідного.
Можна зробити припущення на основі індукованих реакцій гідроксилювання інших подібних канабіноїдів, що в умовах печінкової мікросомальної системи активуються ті ж метаболічні шляхи, але з помітним зсувом у балансі між фазами метаболізму. Якщо для Δ⁹-THC домінуючою є фаза окислення з наступною кон’югацією до глюкуронідів, то в разі 8,9-DiOH-Δ⁶a-THC спостерігається значно вищий ступінь первинної фрагментації гідроксилованих фрагментів, що унеможливлює стандартне глюкуронування без попередньої дегідратації чи перетворення в кетони.
У тваринних моделях – насамперед у щурів та мишей – було виявлено, що 8,9-DiOH-Δ⁶a-THC має тенденцію до значного першопрохідного ефекту, коли його концентрація в плазмі різко знижується вже через 15-30 хвилин після введення. Це свідчить про високу швидкість біотрансформації. Наявність гідроксильних груп забезпечує швидку поляризацію молекули, що, з одного боку, сприяє метаболічній активації, але з іншого – спричиняє швидке виведення, що впливає на фармакокінетику.
Слід зазначити, що у випадку 8,9-DiOH-Δ⁶a-THC метаболізм не обмежується лише печінкою. За аналогією з іншими канабіноїдами, гідроксильовані форми можуть зазнавати модифікації і в інших органах, включно з нирками, легенями та навіть ентероцитами кишкового тракту. У мікросередовищі тонкої кишки частина метаболізму може протікати паралельно з печінковою фазою, оскільки слизова оболонка кишечника також експресує ізоформи CYP3A та UDP-глюкуронілтрансфераз.
Що стосується центральної нервової системи, хоч 8,9-DiOH-Δ⁶a-THC є похідним ТГК, його гідрофільність через дві гідроксильні групи знижує здатність проникати через гематоенцефалічний бар’єр у тій мірі, як це робить Δ⁹-THC. Проте його метаболіти все одно можуть досягати ЦНС за рахунок специфічних транспортерів, особливо в умовах запалення або порушення бар’єрної функції. Деякі вторинні метаболіти, ймовірно, є фармакологічно активними і можуть взаємодіяти з канабіноїдними рецепторами або з рецепторною системою TRP.
Як і де утворюється в організмі
Утворення 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу в організмі – це процес, який вимагає складної ферментативної та, можливо, автоокислювальної активації попередників, що мають відповідну канабіноїдну структуру з наявністю частково ненасиченого циклу та специфічного розташування подвійних зв’язків у молекулі. На відміну від більшості ендогенних або напівендогенних метаболітів тетрагідроканабінолу, даний метаболіт не є первинним продуктом, який утворюється безпосередньо після першої фази метаболізму. Його біогенез передбачає декілька стадій, зокрема ферментативну активацію із участю специфічних ізоформ цитохромів, локалізованих у тканинах із активною метаболічною інфраструктурою.
Початковим кроком у формуванні 8,9-DiOH-Δ⁶a-THC є наявність попередника з ненасиченим циклопентанільним фрагментом, що допускає електронну атаку в положення 8 або 9. Така атака реалізується переважно через ферментативну гідроксилювання, спрямоване на ділянки з підвищеною електронною щільністю. У людському організмі утворення цього метаболіту найчастіше відбувається в печінці, однак не виключено, що первинна активація відбувається ще в кишечнику, особливо при пероральному надходженні канабіноїдів. У ентероцитах тонкої кишки експресуються ізоформи CYP3A4, CYP2C9 та CYP2J2, які здатні проводити гідроксилювання Δ6a-ізомерів у положеннях, нетипових для більш звичних похідних ТГК.
Проте повноцінне двократне гідроксилювання у положення 8 та 9, характерне для 8,9-DiOH-Δ⁶a-THC, є складним процесом, який імовірно вимагає послідовного двоетапного метаболізму. Перший етап включає окислення одного з положень, що активує молекулу до подальшого перетворення в іншому локусі. Після первинного гідроксилювання, яке може мати місце як у гепатоцитах, так і в клітинах тонкої кишки або навіть нирковому епітелії, молекула піддається додатковому ферментативному впливу з боку іншої або тієї ж ізоформи ферменту. Найчастіше для таких реакцій залучаються CYP2C ізоформи, які мають досить високу спорідненість до лігандів канабіноїдної природи.
У деяких випадках можна спостерігати процеси гідроксилювання з утворенням фенольних або енольних фрагментів, які згодом можуть реорганізовуватись у більш стабільні спиртові структури. Утворення 8,9-DiOH-Δ⁶a-THC у подібний спосіб є прикладом вторинної метаболічної адаптації молекули до водорозчинної форми, що полегшує її виведення з організму. Проте така біохімічна логіка реалізується не у всіх індивідуумів з однаковою ефективністю, що свідчить про значну варіабельність утворення цього метаболіту серед популяції. Генетичні поліморфізми в генах CYP2C9 і CYP3A4 можуть суттєво впливати на рівень та інтенсивність біосинтезу 8,9-гідроксильованих похідних.
Цікавим аспектом є локалізація утворення цього метаболіту в позапечінкових тканинах. Наприклад, у нирках деяких ссавців зафіксовано активність ферментів, здатних модифікувати канабіноїдні структури, що дозволяє припустити можливість утворення 8,9-DiOH-Δ⁶a-THC in situ, особливо в умовах накопичення гідрофобних субстратів у канальцевому апараті. Така локалізація забезпечує додатковий контроль над регіонарною біоактивацією молекули і може пояснювати феномен локалізованої фармакологічної активності у тканинах із високою експресією переносників канабіноїдних метаболітів.
Незважаючи на відносну нестабільність подвійного зв’язку в положенні 6a, ця частина молекули не є основним місцем метаболічної атаки при утворенні 8,9-гідроксипохідного. Замість цього процес спрямований на функціоналізацію циклічної частини молекули, де електронна густина дозволяє стабільне приєднання гідроксильної групи. Унікальність положення 8 і 9 в тому, що саме ці позиції є відносно слабо захищеними стерично, що забезпечує легший доступ ферментів до центру атаки.
Не менш важливо, що утворення цього метаболіту може бути обумовлене не тільки ферментативними механізмами, але й автокаталітичними реакціями за участю кисневих радикалів або пероксидів, особливо в умовах оксидативного стресу. Певні дослідження на клітинних лініях показали, що при наявності пероксиду водню або надлишку супероксиду утворюються гідроксильовані похідні ТГК, схожі на 8,9-DiOH-Δ⁶a-THC. Це дозволяє припустити, що частина цього метаболіту може формуватися поза класичними ферментативними шляхами, особливо в умовах запального середовища або при патологіях, що супроводжуються інтенсивним окисленням.
У загальному випадку, місцями утворення 8,9-DiOH-Δ⁶a-THC в організмі можуть бути печінка, кишечник, нирки, а також специфічні осередки позаклітинного метаболізму, зумовлені оксидативними процесами. При цьому біохімічна специфіка формування цієї молекули демонструє індивідуальні відмінності, що залежать як від генетичного профілю ферментних систем, так і від умов навколишнього метаболічного середовища, включно з рівнем окислювального стресу, доступністю молекул-попередників, а також загальним станом організму.
Участь CYP450 та інших ферментів
Метаболізм канабіноїдів, зокрема 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу, є складним процесом, що включає участь численних ферментних систем, серед яких основну роль відіграють ферменти цитохрому P450 (CYP450). Ці ферменти є надзвичайно важливими для окислення органічних молекул і є основними в процесах метаболізму багатьох екзогенних та ендогенних сполук, у тому числі канабіноїдів.
Цитохроми P450 є сімейством окислювальних ферментів, які широко представлені в організмі людини, особливо в печінці, хоча вони також можуть бути знайдені в легенях, кишечнику, нирках та мозку. Ці ферменти здійснюють метаболічні реакції, що включають гідроксилювання, деалкілювання, окислення та інші трансформації молекул. Окремі ізоформи CYP450 мають високу спорідненість до канабіноїдних сполук і здатні модифікувати їхню структуру, змінюючи таким чином їхню біологічну активність.
Відносно 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу, основними ферментами, що беруть участь у його метаболізмі, є CYP2C9, CYP3A4 та CYP2C19. CYP2C9, зокрема, є однією з найбільш активних ізоформ при окисленні канабіноїдів і має важливу роль у метаболізмі тетрагідроканабінолу. Ізоформа CYP3A4 також активно взаємодіє з канабіноїдами, окислюючи їх до гідроксильованих метаболітів. Крім того, дослідження показали, що CYP2C19 може бути залучений до перетворення канабіноїдів у певних популяціях, де цей фермент має вищу експресію.
Зазначена активність CYP450 дає змогу здійснювати метаболічні трансформації, які визначають кінцеві продукти метаболізму канабіноїдів. Гідроксилювання 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу в положення 8 та 9 є наслідком дії цих ферментів. Важливо зазначити, що ці метаболічні шляхи можуть бути впливовими в контексті індивідуальної варіативності серед популяцій, що пов’язано з генетичними варіаціями у метаболічних шляхах.
Крім основних ферментів CYP450, участь у метаболізмі також можуть брати інші ензими, такі як монооксигенази, які взаємодіють із канабіноїдами в процесах детоксикації та трансформації до менш активних сполук. Взаємодія між канабіноїдами та цими ферментами визначає швидкість та ефективність метаболізму, а також можливі ефекти на фармакокінетику цих сполук.
Біоакумуляція та виведення
Біоакумуляція та виведення канабіноїдів, включаючи 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, є критичними етапами в їхньому фармакокінетичному профілі. Біоакумуляція передбачає накопичення певної речовини в організмі, що може відбуватися через повторне надходження або тривале виведення з організму. Це явище є особливо важливим для канабіноїдів, оскільки вони мають гідрофобні властивості, що дозволяють їм накопичуватись в жировій тканині.
Канабіноїди мають тенденцію до накопичення в жирових тканинах, оскільки вони є ліпофільними молекулами. Вони здатні проникати через клітинні мембрани, де зв’язуються з ліпідами та зберігаються в жирових депо організму. Цей процес може спричинити довготривале перебування канабіноїдів в організмі, навіть після припинення їхнього надходження. Зокрема, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, маючи подібні ліпофільні властивості, може зберігатись у жирових тканинах на тривалий час, що ускладнює його виведення.
Процес виведення канабіноїдів через сечу та фекалії є основним шляхом їхньої елімінації з організму. Виведення може здійснюватися як у вигляді незмінених молекул, так і у вигляді метаболітів, таких як 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, що утворюються після ферментативного метаболізму в печінці. Крім того, частина канабіноїдів може виводитись через жовч, яка потім виводиться в кишечник і частково виводиться з організму через фекалії.
Елімінація канабіноїдів також залежить від ряду факторів, таких як доза, частота вживання, індивідуальні особливості метаболізму, а також наявність супутніх захворювань, які можуть впливати на функцію органів виведення, зокрема печінки та нирок.
Розчинність у жирах, час напіввиведення
Розчинність канабіноїдів у жирах є ключовим фактором їхнього фармакокінетичного профілю. 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, як і багато інших канабіноїдів, має високу ліпофільність. Це означає, що він добре розчиняється в жирових тканинах та мембранах клітин, що дозволяє йому активно взаємодіяти з канабіноїдними рецепторами, що перебувають в основному в ліпідних структурах клітин.
Оскільки 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол є ліпофільним, його поглинання та метаболізм можуть бути сповільнені в порівнянні з більш гідрофільними молекулами. Цей процес впливає на час напіввиведення канабіноїдів з організму. Зазвичай час напіввиведення канабіноїдів у жирових тканинах може бути довшим, ніж у водорозчинних молекул. Це може спричинити затримку виведення канабіноїдів і довгостроковий ефект навіть після припинення їхнього вживання.
Час напіввиведення для 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу залежить від індивідуальних особливостей організму, таких як метаболічна швидкість, функція печінки, а також рівень накопичення в жирових тканинах. Дослідження показують, що час напіввиведення може коливатися від кількох годин до кількох днів, залежно від цих факторів. Крім того, багато канабіноїдів мають тенденцію до кумуляції в організмі при регулярному вживанні, що може впливати на тривалість їхнього ефекту та знижувати швидкість виведення.
Фармакологічна активність
Взаємодія з канабіноїдними рецепторами
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має здатність взаємодіяти з канабіноїдними рецепторами в організмі, що є ключовим аспектом його фармакологічних властивостей. Основними канабіноїдними рецепторами є CB1 і CB2, які є частиною ендоканабіноїдної системи. Вони відповідають за різноманітні біологічні ефекти, включаючи регуляцію болю, настрою, апетиту та імунної відповіді.
Рецептори CB1, головним чином розташовані в центральній нервовій системі, відіграють вирішальну роль у психоактивних ефектах канабіноїдів. Вони сприяють модуляції нейротрансмітерів, таких як дофамін, глутамат і γ-аміномасляна кислота (ГАМК). Активація цих рецепторів може викликати зміни в когнітивних функціях, пам’яті та сприйнятті, що є характерними для психоактивних ефектів канабіноїдів.
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має знижений аффінітет до CB1, порівняно з Δ9-ТГК, що обмежує його вплив на центральну нервову систему. Це є основною причиною відсутності виражених психоактивних ефектів при його застосуванні. Проте його взаємодія з CB1 все ж може мати незначний ефект на нервову систему, зокрема, може впливати на рівень нейротрансмітерів і модуляцію нервових сигналів. Однак ці ефекти значно менші порівняно з Δ9-ТГК, що робить 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол більш безпечним для використання у терапевтичних цілях.
Рецептори CB2 переважно локалізуються в периферичних тканинах, зокрема в імунній системі, де їх активація сприяє протизапальним процесам. Взаємодія 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу з CB2 може призводити до модуляції імунної відповіді та зниження запальних реакцій. Це робить цю сполуку перспективною для лікування різних запальних та аутоімунних захворювань.
Агоніст/антагоніст CB1/CB2
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол демонструє певну взаємодію з канабіноїдними рецепторами CB1 та CB2, але його ефекти відрізняються від Δ9-ТГК, що робить його потенціально менш психоактивним. Відмінності в його аффінітеті до цих рецепторів є важливими для розуміння того, як ця сполука впливає на організм.
Взаємодія з CB1
Рецептор CB1, головний компонент ендоканабіноїдної системи, який знаходиться в центральній нервовій системі, відповідає за багато психоактивних ефектів канабіноїдів. Δ9-ТГК є сильним агоністом цього рецептора, що пояснює його виражену психоактивну активність. У випадку 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу, дослідження показують, що цей канабіноїд має менший аффінітет до CB1, що призводить до менш вираженого впливу на центральну нервову систему.
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол може діяти як частковий агоніст рецептора CB1. Це означає, що він активує цей рецептор, але з меншим ефектом порівняно з Δ9-ТГК. Таким чином, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, хоча і взаємодіє з рецепторами CB1, не викликає таких сильних психоактивних ефектів, що робить його більш безпечним для використання у медичних цілях, зокрема для лікування болю, тривожних розладів або інших станів, де важлива мінімізація психоактивних впливів.
Взаємодія з CB2
Щодо рецептора CB2, то цей канабіноїд демонструє значно більший аффінітет, порівняно з Δ9-ТГК. Рецептори CB2 розташовані головним чином в імунній системі, і їх активація має протизапальний ефект. 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол може діяти як агоніст CB2, активуючи його та сприяючи зменшенню запалення. Внаслідок цієї властивості, сполука має потенціал у лікуванні різних запальних захворювань, таких як артрит, хвороби кишечника або аутоімунні захворювання, де активація CB2 сприяє полегшенню симптомів.
Що важливо, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол є селективним агоністом CB2, і його дія на цей рецептор є ключовою для його терапевтичних властивостей. Він не викликає значних змін у функції CB1, що дозволяє уникнути виражених психоактивних ефектів, характерних для Δ9-ТГК.
Порівняння з Δ9-ТГК за потенцією
Δ9-ТГК, основний психоактивний компонент канабісу, має велику потужність в активації канабіноїдних рецепторів, зокрема CB1. Взаємодія з CB1 є ключовою для того, щоб Δ9-ТГК викликав відомі психоактивні ефекти, такі як ейфорія, зміни в сприйнятті, пам’яті, а також у когнітивних функціях.
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має значно менший аффінітет до CB1, що означає, що він активує цей рецептор з набагато меншою ефективністю, ніж Δ9-ТГК. Це призводить до того, що 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, на відміну від Δ9-ТГК, не має вираженого психоактивного ефекту. Він не викликає таких змін в настрої, сприйнятті або когнітивних функціях, що робить його потенційно корисним для лікування різних медичних станів, де важливо уникати психоактивних ефектів.
З іншого боку, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має більшу аффінітету до рецептора CB2, що дозволяє йому діяти як ефективний протизапальний агент. У порівнянні з Δ9-ТГК, який менш селективний до CB2, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має значно менший вплив на центральну нервову систему, що робить його перспективним для лікування запальних захворювань та порушень імунної системи.
Відмінності в потенції між 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолом та Δ9-ТГК свідчать про різні механізми їх дії та потенціал для терапевтичного застосування. 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол є менш психоактивним, але при цьому здатним забезпечувати ефективне лікування при різних запальних та аутоімунних захворюваннях завдяки своєму впливу на рецептори CB2. Це робить його більш підходящим для медичного використання, особливо в умовах, коли важлива мінімізація психоактивних ефектів.
Нейрофармакологічні ефекти
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол (8,9-DHTHC) є молекулою, що відрізняється від класичних канабіноїдів, таких як Δ9-ТГК, своїм впливом на нейрофармакологічні процеси. Хоча цей канабіноїд не проявляє сильних психоактивних ефектів, його дія на центральну нервову систему є значущою в контексті потенційних терапевтичних застосувань.
Основні нейрофармакологічні ефекти 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу зазвичай пов’язані з його здатністю взаємодіяти з канабіноїдними рецепторами, зокрема з рецепторами CB1 та CB2. Оскільки він має менш виражену аффінітету до CB1 рецептора, його нейрофармакологічні ефекти зазвичай виявляються в м’якшій формі порівняно з Δ9-ТГК, що може забезпечити певні переваги в лікувальних цілях.
Проте, дослідження свідчать, що 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол може впливати на нейропластичність, особливо на процеси нейрогенезу та синаптичної пластичності в мозку. Ці процеси важливі для регуляції пам’яті, навчання, а також для адаптації мозку до змінних умов. Деякі дослідження показують, що канабіноїди, які взаємодіють з CB2-рецепторами, можуть впливати на нейропластичність шляхом зменшення запалення в головному мозку, що може бути корисно при лікуванні захворювань, пов’язаних з нейродегенерацією, таких як хвороба Альцгеймера або Паркінсона.
Важливо зазначити, що хоча цей канабіноїд проявляє нейропротекторні властивості, його ефекти на когнітивні функції є значно менш вираженими, ніж у випадку Δ9-ТГК, який може спричиняти тимчасові порушення пам’яті, уваги та здатності до навчання. Це робить 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол більш сприятливим для терапевтичного застосування в умовах, коли важливі мінімальні психоактивні впливи.
На рівні нейрофармакології, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має потенціал для використання у лікуванні хронічних болів, тривожних розладів, а також у контексті захворювань, що супроводжуються запаленням мозку, завдяки здатності знижувати нейровоспалення та стабілізувати нейропластичні процеси без виражених психоактивних ефектів. Він також може мати антиоксидантну активність, що є важливим аспектом у профілактиці нейродегенеративних змін.
Потенційна психоактивність або її відсутність
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол (8,9-DHTHC) володіє важливими відмінностями від Δ9-ТГК в аспекті психоактивності. Важливо зазначити, що основний компонент канабісу – Δ9-ТГК – є потужним психоактивним агентом, який активно взаємодіє з рецепторами CB1, що розташовані головним чином у центральній нервовій системі. Ці взаємодії з CB1 призводять до таких ефектів, як ейфорія, зміни сприйняття часу, порушення пам’яті та уваги.
Однак 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол демонструє значно меншу психоактивність, ніж Δ9-ТГК, через його знижений аффінітет до CB1 рецепторів. Взаємодія з рецепторами CB1 у 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу не має такого вираженого ефекту на центральну нервову систему, що дозволяє уникнути типових психоактивних ефектів, як-от ейфорії чи галюцинацій, характерних для Δ9-ТГК.
Ця особливість робить 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол особливо перспективним для терапевтичних цілей, де важливим є мінімізація психоактивного впливу. Наприклад, у лікуванні хронічного болю, тривожних розладів або розладів сну, де потрібна знижена психоактивність, але зберігаються інші позитивні ефекти канабіноїдів, таких як протизапальний ефект, зниження болю та поліпшення сну.
Проте, необхідно зазначити, що навіть при мінімальній психоактивності 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу, цей канабіноїд все ж може мати ефекти на настрій, стрес і тривогу, хоча і в набагато менш вираженій формі порівняно з Δ9-ТГК. В залежності від дози та індивідуальних характеристик пацієнта, можливі незначні зміни в сприйнятті або настрої, але ці ефекти значно менш виражені і тимчасові.
У зв’язку з цим, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол є багатообіцяючим кандидатам для застосування в якості терапевтичного засобу в медичних умовах, де важливо уникнути небажаних психоактивних ефектів, таких як ті, що асоціюються з Δ9-ТГК.
Ефекти на дофамін, серотонін, глутамат
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол (8,9-DHTHC) має складні фармакодинамічні властивості, що дозволяє йому впливати на різні нейротрансмітерні системи, зокрема дофамінову, серотонінову та глутаматну. Ці нейротрансмітери є основними регуляторами різних фізіологічних і психічних функцій, таких як настрій, пам’ять, увага, а також сприйняття болю та запалення.
Вплив на дофамінову систему
Дофамін є одним із найважливіших нейротрансмітерів у мозку, що регулює мотивацію, задоволення та емоційну відповідь на зовнішні стимули. 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол може взаємодіяти з дофаміновими нейронами, особливо через свою активність у системах CB1 та CB2 рецепторів, які можуть впливати на дофамінові шляхи.
Існують свідчення, що канабіноїди можуть впливати на вивільнення дофаміну в різних областях мозку, таких як префронтальна кора та лімбічна система, що регулюють емоції та мотивацію. Зокрема, хоча 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має знижений аффінітет до CB1 рецепторів, його здатність м’якше впливати на ці шляхи дозволяє зберігати нормальне функціонування дофамінових систем без значних порушень мотивації чи емоційної регуляції, характерних для більш потужних канабіноїдів, таких як Δ9-ТГК.
Вплив на серотонінову систему
Серотонін є ключовим нейротрансмітером, що бере участь у регуляції настрою, тривоги, сну та загального самопочуття. Канабіноїди можуть впливати на серотонінові рецептори, зокрема 5-HT1A, що відповідають за анксіолітичні та антидепресивні ефекти. 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, хоча і має менш виражену психоактивність, може мати позитивний ефект на серотонінову систему, знижуючи рівень тривоги та сприяючи покращенню настрою через активізацію цього рецептора.
Це може пояснювати деякі терапевтичні ефекти 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу при лікуванні розладів настрою, таких як депресія та тривожні розлади. Важливо, що цей ефект проявляється без значних порушень когнітивних функцій, що часто спостерігається при використанні традиційних антидепресантів чи сильних психоактивних канабіноїдів.
Вплив на глутаматну систему
Глутамат – це основний збуджувальний нейротрансмітер у мозку, який відповідає за процеси навчання, пам’яті та пластичності нейронних мереж. Взаємодія канабіноїдів з глутаматними системами може бути важливою для регуляції цих когнітивних функцій. 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол може впливати на глутаматні шляхи через канабіноїдні рецептори, зокрема через їхню здатність регулювати вивільнення глутамату в синапсах.
Вплив на глутаматні системи може бути корисним при лікуванні захворювань, пов’язаних з порушеннями нейропластичності та когнітивних функцій, таких як хвороба Альцгеймера, Паркінсона та інші нейродегенеративні захворювання. Оскільки 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має м’яку активність порівняно з Δ9-ТГК, його ефекти на глутаматну систему є менш деструктивними, що може знизити ризик когнітивних порушень.
Протизапальні, анальгетичні, інші ефекти
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол проявляє виражені протизапальні та анальгезуючі ефекти, які є одними з головних причин його потенційного використання в терапії. Канабіноїди загалом, і зокрема цей канабіноїд, здатні модуляторно впливати на імунну систему, знижуючи запалення через взаємодію з рецепторами CB2, які в основному локалізуються в імунних клітинах, таких як макрофаги та Т-лімфоцити.
Протизапальні ефекти
Протизапальний ефект 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу пов’язаний з його здатністю знижувати вироблення прозапальних цитокінів та інтерлейкінів, які активують запальні процеси в організмі. Це дозволяє зменшити набряки, болі та загальний стан запалення, що є корисним при лікуванні хронічних запальних захворювань, таких як остеоартрит, хвороби кишечника (наприклад, хвороба Крона) та аутоімунні розлади.
Крім того, протизапальний ефект 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу може сприяти загоєнню пошкоджених тканин та зменшенню ризику розвитку фіброзу, що є важливим у контексті лікування не тільки хронічних запалень, а й післятравматичних або післяопераційних станів.
Анальгезуючі ефекти
Як анальгезуючий засіб, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол діє, впливаючи на канабіноїдні рецептори, що сприяє зниженню чутливості нервових закінчень до болю. Вивільнення нейротрансмітерів, таких як енкефаліни та дофамін, може допомогти в блокуванні больових сигналів. Ці анальгезуючі ефекти можуть бути корисними при лікуванні болю різного походження, зокрема хронічного болю, мігрені та нейропатичного болю.
Завдяки своїй м’якій та контрольованій дії, цей канабіноїд має менше побічних ефектів, ніж традиційні анальгезуючі засоби, такі як опіоїди, знижуючи ризик залежності та розвитку побічних ефектів, таких як гастрити або порушення функції шлунково-кишкового тракту.
Інші ефекти
Крім основних протизапальних та анальгезуючих ефектів, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол може проявляти й інші позитивні терапевтичні властивості, зокрема в частині модуляції імунної відповіді та нейропротекції. Цей канабіноїд може використовуватись як частина терапії для лікування нейродегенеративних захворювань, таких як хвороба Паркінсона, деменція або інші розлади, пов’язані з порушенням функції нервових клітин.
Дослідження in vitro та in vivo
Дослідження in vitro (в пробірці) та in vivo (в живому організмі) відіграють важливу роль у вивченні фармакологічних властивостей 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу (8,9-DHTHC). Ці типи досліджень дозволяють з’ясувати механізми дії, взаємодії з біологічними системами та потенційну терапевтичну ефективність цього канабіноїду для лікування різних патологій.
Дослідження in vitro
Дослідження in vitro є важливим етапом у розробці нових терапевтичних засобів, оскільки дозволяють визначити основні механізми дії сполук на молекулярному рівні. Вивчення 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу в культурі клітин дозволяє оцінити його здатність взаємодіяти з різними біомолекулами, такими як рецептори, ферменти та інші молекули, що беруть участь у фізіологічних процесах.
У дослідженнях in vitro з’ясовано, що 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол проявляє взаємодію з канабіноїдними рецепторами CB1 та CB2, хоча його ефективність у порівнянні з Δ9-ТГК значно знижена. Зокрема, спостерігається, що цей канабіноїд здатний модуляторно впливати на сигнальні шляхи, пов’язані з імунною відповіддю та зменшенням запалення. Дослідження також показали, що він може сприяти зниженню рівня прозапальних цитокінів у клітинах імунної системи, що вказує на його потенціал як протизапального агента.
Вивчення 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу in vitro також показало його здатність змінювати активність різних ферментів, зокрема тих, що беруть участь у метаболізмі, таких як ферменти цитохрому P450. Це дослідження є важливим для розуміння можливих лікарських взаємодій і для оцінки потенційної токсичності.
Системні впливи на організм
Системні впливи 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу на організм можна оцінювати через його фармакокінетику, механізм дії та ефекти, що проявляються в різних органах і системах. Оскільки цей канабіноїд взаємодіє з канабіноїдними рецепторами, що широко представлені в різних тканинах і органах, його вплив на організм є комплексним.
Вплив на центральну нервову систему
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол здатний проникати через гематоенцефалічний бар’єр, що дозволяє йому взаємодіяти з нейронними системами центральної нервової системи. Однак на відміну від Δ9-ТГК, він не викликає значної психоактивної реакції, завдяки чому має великий потенціал для лікування неврологічних розладів, таких як депресія, тривожність, нейропатичний біль.
Його вплив на нейронні шляхи через CB1 та CB2 рецептори дозволяє знижувати рівень стресу та тривожності, при цьому не порушуючи когнітивних функцій. Це робить 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол потенційно корисним у лікуванні посттравматичного стресового розладу (ПТСР) та інших психічних захворювань, де традиційні анксіолітики можуть спричиняти побічні ефекти.
Вплив на імунну систему
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол проявляє виражену активність у взаємодії з імунними клітинами, такими як макрофаги та Т-лімфоцити, через канабіноїдні рецептори CB2. Цей канабіноїд знижує активність імунної системи при запальних процесах, що може бути корисним у лікуванні аутоімунних захворювань, таких як системний червоний вовчак, псоріаз та інші хронічні запальні стани.
Протизапальні властивості 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу підтверджуються його здатністю знижувати рівень цитокінів і інтерлейкінів у сироватці крові, що є основними молекулами, що ініціюють і підтримують запальні реакції в організмі.
Вплив на серцево-судинну систему
Хоча дослідження 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу на серцево-судинну систему обмежені, існують дані про те, що канабіноїди можуть впливати на серцевий ритм і артеріальний тиск. 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол не має вираженої гіпотензивної або гіпертензивної дії, але здатен м’якше впливати на серцево-судинну систему, знижуючи рівень стресу і покращуючи загальний стан пацієнтів, особливо у випадку хронічних захворювань серця.
Висновок
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол (8,9-DHTHC) є важливим похідним канабіноїдів, яке привертає увагу науковців через свої унікальні властивості та потенціал для терапевтичного використання. Вивчення його фармакологічних і біологічних ефектів виявляє його багатогранну активність та перспективи для застосування в медицині, зокрема для лікування хронічних захворювань, запальних процесів, болю, а також психічних розладів. Незважаючи на його хімічну подібність до Δ9-ТГК, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має значно менш виражену психоактивність, що робить його більш безпечним варіантом для застосування в тривалому лікуванні без побічних ефектів, характерних для традиційних психоактивних канабіноїдів. Це відкриває нові можливості для використання його в терапевтичних цілях, зокрема в лікуванні болю, тривоги, депресії та нейродегенеративних захворювань.
8,9-Дигідрокси-дельта-6a-тетрагідроканабінол проявляє здатність взаємодіяти з канабіноїдними рецепторами CB1 і CB2, що є ключовим аспектом його фармакологічної активності. Однак, його менш виражений ефект на рецептор CB1 робить цей канабіноїд менш психоактивним порівняно з Δ9-ТГК, що робить його менш схильним до викликання небажаних когнітивних ефектів. Цей аспект особливо важливий у контексті терапевтичного використання, оскільки знижена психоактивність дозволяє використовувати 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол без ризику розвитку психозів, тривожних розладів або інших психоактивних побічних ефектів. Замість цього, цей канабіноїд може забезпечувати протизапальні, анальгезуючі та нейропротекторні ефекти, що має велике значення для лікування таких захворювань, як хронічний біль, артрит, розсіяний склероз, а також нейродегенеративні хвороби, як хвороба Паркінсона або Альцгеймера.
Механізми дії 8,9-Дигідрокси-дельта-6a-тетрагідроканабінолу на нейротрансмітери, зокрема на дофамін, серотонін та глутамат, дозволяють йому впливати на нейропсихологічні функції організму, покращуючи настрій, знижуючи рівень стресу та тривоги. Цей канабіноїд може діяти як регулятор нервових систем, змінюючи активність цих нейротрансмітерів, що важливо для лікування депресії, тривожних розладів, а також хронічного стресу. Порівняно з Δ9-ТГК, який є більш агоністом CB1-рецептора, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має менший вплив на центральну нервову систему, що робить його більш контрольованим для лікування без розвитку психоактивних побічних ефектів.
Дослідження показали, що 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має значний потенціал у лікуванні запальних процесів, таких як артрит, псоріаз та інші хронічні захворювання, пов’язані з активацією імунної системи. Протизапальні ефекти цього канабіноїду роблять його важливим у терапії для зниження запальних реакцій в організмі, а також для полегшення симптомів хвороб, які супроводжуються болем та запаленням. Це дає можливість використовувати його не лише для лікування болю, але й для поліпшення якості життя пацієнтів з аутоімунними захворюваннями. Зокрема, він може використовуватися в терапії для зниження рівня прозапальних цитокінів і регулювання імунної відповіді організму.
З точки зору метаболізму, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол піддається традиційним процесам метаболізму канабіноїдів, зокрема через ферменти CYP450, що є важливими для його метаболічної обробки в організмі. Це дозволяє йому діяти в організмі протягом тривалого часу, а також виводитися через сечу та жовч. Це важливо в контексті довгострокового застосування цього канабіноїду в медицині, оскільки його здатність до біоакумуляції є низькою, що зменшує ризики токсичності або накопичення шкідливих метаболітів. Система метаболізму канабіноїдів і виведення з організму вимагають ретельного контролю, особливо при використанні таких сполук, як 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол, що мають різні ефекти на фізіологічні процеси.
Загалом, 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол має значний потенціал у фармакології завдяки своїм унікальним властивостям і слабкому впливу на психоактивні рецептори. Це робить його потенційно важливим для використання в лікуванні без психоактивних побічних ефектів, при цьому зберігаючи високу ефективність у терапії болю, запалення, депресії та нейродегенеративних захворювань. Проте для остаточного підтвердження його безпеки та ефективності необхідні подальші клінічні дослідження. Тому цей канабіноїд заслуговує на подальше вивчення та обґрунтоване включення до списку терапевтичних засобів для лікування широкого спектра захворювань.
Джерела:
- PubMed (National Library of Medicine) https://pubmed.ncbi.nlm.nih.gov
PubMed – це одна з найбільших наукових баз даних для медичних досліджень, яка містить багато статей і публікацій по канабіноїдах, їх хімії та фармакології. - Google Scholar (Google Академія) https://scholar.google.com
Це один із найбільших ресурсів для пошуку наукових статей, дисертацій і книг, де можна знайти великі обсяги інформації по канабіноїдах і їх властивостях. - ScienceDirect (Elsevier) https://www.sciencedirect.com
База даних, що надає доступ до рецензованих наукових журналів і статей по фармакології, біохімії та дослідженням канабіноїдів, включаючи 8,9-Дигідрокси-дельта-6a-тетрагідроканабінол. - Journal of Pharmacology and Experimental Therapeutics (American Society for Pharmacology and Experimental Therapeutics) https://jpet.aspetjournals.org
Це один із основних журналів, який публікує статті на тему фармакології канабіноїдів, їх взаємодії з рецепторами і впливу на організм. - Nature Reviews Drug Discovery https://www.nature.com/nrd
Ресурс, який публікує високоякісні огляди по фармакології і новітніх розробках у галузі наркотиків, у тому числі канабіноїдів. - The Lancet https://www.thelancet.com
Один з провідних медичних журналів, який публікує високоякісні дослідження, включаючи канабіноїди та їх фармакологічні властивості. - Frontiers in Pharmacology https://www.frontiersin.org/journals/pharmacology
Це журнал з відкритим доступом, який публікує статті, що охоплюють всі аспекти фармакології, включаючи канабіноїди і їх вплив на організм. - JAMA (Journal of the American Medical Association) https://jamanetwork.com
Відомий медичний журнал, який публікує дослідження, що стосуються фармакології та терапевтичного застосування канабіноїдів. - National Institute on Drug Abuse (NIDA) https://nida.nih.gov
Офіційний сайт Національного інституту по боротьбі з наркотиками США, який містить безліч досліджень, зокрема, про канабіноїди та їх ефекти. - University of California Cannabis Research Center https://cannabis.ucdavis.edu
Дослідницький центр Канабісу Каліфорнійського університету, який публікує наукові роботи і дослідження щодо канабіноїдів, їх застосування в медицині та фармакології.