Канабіхроманон (CBCF) є одним із маловивчених представників класу канабіноїдів – природних фенольних сполук, що продукуються рослиною Cannabis sativa. Незважаючи на суттєвий прогрес у дослідженні основних канабіноїдів, таких як Δ9-тетрагідроканабінол (THC) і канабідіол (CBD), знання про біохімічні та фармакологічні властивості менш поширених канабіноїдів, включно з CBCF, залишаються фрагментарними. Це створює науковий вакуум, який ускладнює повне розуміння біохімії та потенційного медичного застосування цієї групи сполук.
CBCF відноситься до класу канабіхроманонів – канабіноїдів, що характеризуються наявністю хроманової основи з функціональною групою кетону. Хромановий скелет є структурним ядром, що надає сполуці унікальних хімічних властивостей, зокрема підвищеної хімічної стабільності у порівнянні з іншими канабіноїдами. Молекулярна особливість CBCF полягає у поєднанні фенольної частини, характерної для канабіноїдів, з хромановим циклом, що модифікує електронну структуру молекули та потенційно впливає на її біоактивність. У той же час, саме цей клас сполук недостатньо вивчений з хімічної та фармакологічної точки зору.
З наукової точки зору важливо розмежовувати CBCF від більш поширених канабіноїдів, оскільки структура і функції малих модифікацій у молекулах можуть призводити до суттєво різної взаємодії з біологічними мішенями. Зокрема, зміни в хромановому ядрі можуть суттєво впливати на афінність до канабіноїдних рецепторів CB1 і CB2, а також на потенційні взаємодії з іншими білками, що беруть участь у регуляції запальних процесів, больової чутливості або нейромодуляції. Однак наявність точних даних щодо фармакодинаміки CBCF наразі обмежена через відсутність систематичних досліджень і складність отримання чистої речовини у великих кількостях.
Ще однією важливою складовою вивчення CBCF є розуміння його біогенетичного походження. Канабіноїдний біосинтез у Cannabis sativa – це складна система, що включає ферментативні перетворення прекурсорів, таких як оліветолова кислота та гермакрен B, з утворенням головних канабіноїдів, включно з канабіноїдними кислотами (наприклад, CBGA) і їх подальшим перетворенням у активні форми. Вирішення питання про шлях утворення CBCF вимагає детального вивчення ферментативних механізмів і можливих окиснювальних процесів, що можуть спричиняти появу хроманонової структури. Наразі це залишається предметом гіпотез і непрямих експериментальних доказів, які базуються на сучасних аналітичних методах, таких як рідинна хроматографія з мас-спектрометрією (LC-MS) та ядерний магнітний резонанс (NMR).
Крім біогенезу, значну увагу приділяють методам синтезу CBCF, які поділяються на напівсинтетичні, повністю синтетичні та біотехнологічні. Напівсинтетичні методи передбачають модифікацію природних канабіноїдів або їх кислотних форм із застосуванням різних хімічних реагентів і каталізаторів. Повний синтез у лабораторних умовах, хоч і менш розповсюджений, відкриває шлях до детального контролю над структурою молекули і можливістю створення аналогів з покращеними властивостями. Біотехнологічні підходи, зокрема застосування генетично модифікованих мікроорганізмів, набувають популярності як екологічно безпечні і перспективні для масштабного виробництва.
Вивчення біологічного потенціалу CBCF знаходиться на початковому етапі. Попередні дані свідчать про можливий вплив сполуки на канабіноїдні та інші рецепторні системи, що може бути основою для розробки нових фармакологічних засобів із протизапальною, нейропротекторною або анальгетичною дією. Проте відсутність комплексних токсикологічних і фармакокінетичних досліджень стримує клінічне застосування CBCF та його похідних.
Враховуючи вищезазначене, науковий інтерес до CBCF має кілька напрямів: по-перше, детальний хімічний аналіз структури, включно з дослідженням стереохімії і фізико-хімічних властивостей; по-друге, встановлення біогенетичних шляхів його утворення в рослині; по-третє, оптимізація методів отримання CBCF для дослідницьких і потенційно промислових потреб; по-четверте, оцінка біологічної активності і фармакологічного профілю, з подальшою валідацією в доклінічних моделях.
Відсутність комплексних досліджень CBCF обумовлює нагальну потребу у систематизації та поглибленому вивченні цієї сполуки. Сучасні аналітичні методики, включаючи високороздільну мас-спектрометрію та ядерний магнітний резонанс, дозволяють ідентифікувати CBCF навіть у низьких концентраціях, що відкриває можливості для його вивчення як потенційного біомаркера специфічних хемотипів Cannabis sativa. Це має значення не лише для хімії канабіноїдів, але й для розробки нових засобів персоналізованої медицини та біотехнологічних платформ.
Хімічна ідентичність CBCF
Канабіхроманон (CBCF) належить до класу канабіноїдів, які характеризуються наявністю хроманового кільця з функціональною кетоновою групою, що відрізняє його від класичних канабіноїдів із тетрагідроканабінольним скелетом. Ця структурна особливість надає CBCF унікальні хімічні властивості, які визначають його фізико-хімічний профіль та потенційні біологічні функції. Хімічна ідентичність CBCF включає не лише його молекулярну формулу і структуру, а й просторову конфігурацію, електронну організацію, а також спектр реакцій, які він може проходити у різних умовах.
Характеристика CBCF базується на визначенні його молекулярного складу та будови, що є основою для подальшого розуміння хімічної реактивності та біологічної активності. Ця сполука належить до групи фенольних хроманонів – природних або напівсинтетичних речовин, що мають циклічну структуру із заміщеними бензольними кільцями і одночасно містять кетонну функціональну групу у хромановому кільці. Присутність кетону в каркасі молекули є визначальним фактором, що модифікує електронний розподіл і забезпечує особливу хімічну стійкість.
Важливо відзначити, що CBCF відрізняється від інших канабіноїдів, таких як канабіхромен (CBC), який має лише хроманову основу без карбонільної групи. Саме введення кетонного фрагмента призводить до формування хроманонового ядра, що робить CBCF унікальним серед фітоканабіноїдів. Це має істотне значення для хімічних властивостей молекули, зокрема її реакційної здатності, спектральних характеристик і стабільності.
З огляду на сучасні методи аналізу, ідентифікація CBCF здійснюється за допомогою високоточних аналітичних інструментів – спектроскопії ядерного магнітного резонансу (NMR), високороздільної рідинної хроматографії з мас-спектрометрією (LC-HRMS) та інфрачервоної спектроскопії (IR). Синтезована або екстрагована з рослинних матеріалів сполука вивчається на предмет відповідності структурним параметрам, які є критичними для встановлення її хімічної ідентичності. У цьому контексті висока роздільна здатність спектроскопічних методів дозволяє підтвердити наявність хроманонового кільця і кетонної групи, а також визначити просторову конфігурацію.
CBCF має потенціал бути маркером у комплексному хемотипуванні Cannabis sativa, що є важливою складовою вивчення канабіноїдного профілю рослини. На відміну від більш поширених канабіноїдів, CBCF зустрічається у відносно низьких концентраціях, що ускладнює його аналітичне визначення, але разом з тим робить його цінним для дослідників, які прагнуть розкрити більш тонкі аспекти метаболічної різноманітності. Виявлення CBCF може свідчити про специфічні ферментативні шляхи або окиснювальні процеси, що відбуваються у рослині, і таким чином слугувати показником біохімічних особливостей конкретних сортів.
З хімічної точки зору CBCF є перспективним об’єктом дослідження через свою здатність брати участь у різних реакціях, які можуть включати окиснювально-відновні процеси, нуклеофільні атаки або утворення кон’югатів із біомолекулами. Присутність кетонної групи відкриває можливість для утворення різних похідних, що розширює потенціал для хімічної модифікації та створення синтетичних аналогів із заданими властивостями. Це особливо актуально для фармацевтичної хімії, де дрібні зміни у структурі канабіноїдів можуть значно впливати на їх біологічну активність.
Вивчення реакційної здатності CBCF також важливе для визначення його стабільності в біологічних середовищах. Як правило, канабіноїди є ліпофільними сполуками, що впливає на їх розчинність та біодоступність, а також на шлях метаболізму в організмі. CBCF, завдяки специфічній хроманоновій структурі, може мати відмінні характеристики розчинності та стабільності у порівнянні з більш традиційними канабіноїдами. Відомо, що кетонні сполуки можуть бути більш стійкими до гідролізу або ферментативного розпаду, що потенційно впливає на тривалість їх дії та спосіб взаємодії з клітинними мішенями.
Молекулярна будова і номенклатура
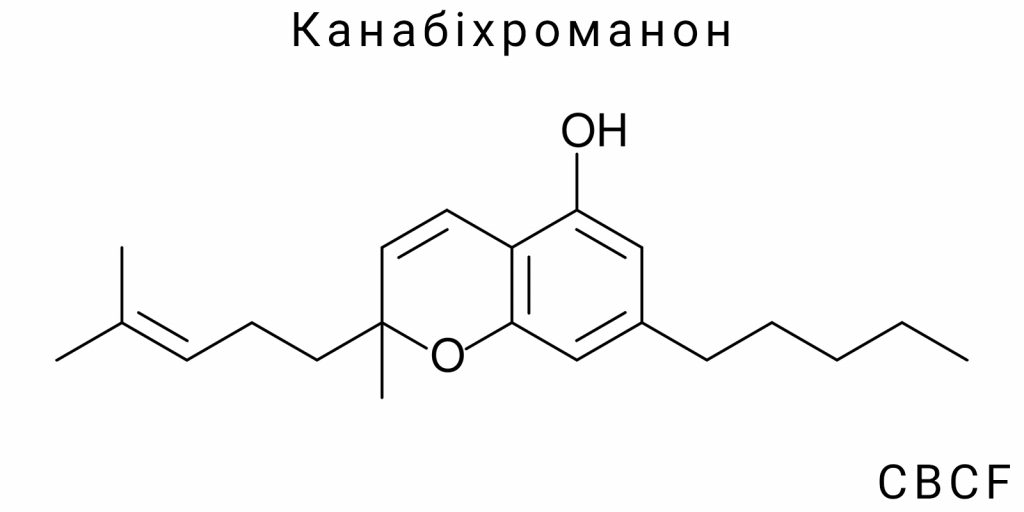
Канабіхроманон (CBCF) належить до класу хроманонів із заміщеними фенольними групами, і його молекулярна архітектура формується шляхом поєднання трьох ключових фрагментів: частково гідрогенізованого бензопіранового ядра (хроманону), алкільного ланцюга на позиції 2 та фенольного бензенового кільця на позиції 8. Центральним елементом є хроманонова система – конденсоване кільце, що складається з бензольного та тетрагідропіранового фрагментів з карбонільною групою на положенні 4, яка формально класифікує структуру як 4-хроманон.
Основна каркасна структура CBCF включає в себе 2-аліл-8-гідрокси-4H-хромен-4-онову систему з характерними заміщеннями на бокових положеннях. На вуглецевій позиції 2 (за IUPAC-нумерацією хроманонового кільця) приєднаний пропіловий або бутиловий ланцюг (у різних ізомерних формах – наприклад, 1-метилпропіл або н-пентил), що є результатом природної біосинтетичної взаємодії з оліветоловими або аналогічними прекурсорами. У більшості хімічно охарактеризованих варіантів CBCF виявляється наявність саме н-пентильної бічної групи, яка типова для ряду фітоканабіноїдів.
Інший ключовий структурний фрагмент – фенольна група в положенні 8, яка забезпечує участь молекули в електронно-обмінних і водневозв’язкових взаємодіях. Її присутність є не тільки структурною, але й функціонально активною частиною молекули, зокрема через здатність до електронної делокалізації в ароматичному ядрі. Положення гідроксильної групи на фенольному кільці точно встановлюється за допомогою спектроскопічного аналізу, особливо ^1H NMR, де її характерний сигнал є діагностичним маркером для диференціації CBCF від споріднених хроманонів.
Узагальнена хімічна назва CBCF згідно з IUPAC (для найбільш стабільного і поширеного ізомеру) може формулюватися як: 2-пентил-8-гідрокси-4H-хромен-4-он, або для точнішого опису із врахуванням алкілування ароматичного кільця – 2-(n-пентил)-8-гідрокси-1-бензопіран-4-он. При цьому використання тривіальної назви “канабіхроманон” обґрунтоване в межах канабіноїдної хімії, однак вона не є формальною систематичною номенклатурою. Назва “CBCF” утворена за аналогією до канабіхромену (CBC), з додаванням “F” як скорочення від “флавоноїдної” або “фенонної” структури, хоча така класифікація не відповідає строгим правилам хімічної термінології.
Просторова конфігурація CBCF переважно плоска в межах ароматичного ядра, але включає конформаційну гнучкість у ланцюзі на С2 і в області тетрагідропіранового циклу. Це створює різні таутомерні та конформаційні стани, які виявляються в спектральному аналізі. Структура CBCF допускає існування в єнокетонній та гідроксиенольній формах, з потенційним зсувом рівноваги в залежності від рН та середовища. Кетонна форма є більш стабільною в неводних системах, однак у водному середовищі, зокрема за фізіологічного рН, може спостерігатися часткова енолізація.
Хімічна стабільність CBCF зумовлена резонансною стабілізацією карбонільної групи в структурі хроманону, а також внутрішньомолекулярними водневими зв’язками між гідроксилом на положенні 8 і киснем кетонної групи. Така взаємодія модифікує електронну щільність навколо атомів кисню, знижуючи реактивність молекули щодо нуклеофільного нападу. Це може впливати на метаболічну долю сполуки в біологічних системах, уповільнюючи ферментативне окиснення або гідроліз.
Також варто відзначити можливість утворення ізомерних форм CBCF унаслідок варіацій алкільного ланцюга, положення гідроксилу або ступеня насичення хроманонового циклу. Згідно з теоретичним моделюванням, найбільш термодинамічно стабільним є ізомер із н-пентильним заміщенням на С2, тоді як розгалужені ланцюги можуть мати вищу реактивність, але меншу стабільність. Ці структурні відмінності мають безпосереднє значення для хімічного синтезу та подальшого використання CBCF у фармакологічних дослідженнях.
Стереохімічна складова CBCF є переважно ахіральною в основному каркасі, однак у разі подальших хімічних модифікацій або в біогенетичному контексті можуть з’являтися стереоцентри, зокрема при гідроксилюванні бічного ланцюга або гідруванні подвійних зв’язків у циклі. У такому випадку виникає необхідність у хіральній хроматографії або хірально-чутливому спектроскопічному аналізі для визначення абсолютної конфігурації.
Ідентифікація CBCF як окремої хімічної сутності вимагає не лише структурного аналізу, а й класифікації у межах сучасної хімічної номенклатури. В базах даних (зокрема PubChem, ChEMBL, ChemSpider) CBCF може бути занесено як специфічний хроманоновий канабіноїд з присвоєним CAS-номером за умови достатньої валідації. Однак станом на сьогодні стандартизована реєстрація CBCF як індивідуальної сполуки залишається обмеженою через відсутність широкомасштабної ізоляції або синтезу. Таким чином, його хімічна ідентичність залишається частково умовною і залежить від точності структурного опису в науковій літературі.
Фізико-хімічні характеристики
Фізико-хімічні характеристики канабіхроманону (CBCF) зумовлені його молекулярною архітектурою, електронною конфігурацією та функціональними групами, що впливають на термодинамічні параметри, спектральні властивості, фазову поведінку, розчинність, реакційну здатність та стабільність у різних середовищах. Ці характеристики є визначальними для його хімічної поведінки, фармакокінетики та можливостей аналітичного контролю. Комплексна фізико-хімічна профілізація CBCF охоплює як макроскопічні властивості (температури плавлення, кипіння, густина, колір), так і мікроскопічні параметри (дипольний момент, поляризовність, енергетичні рівні молекулярних орбіталей).
CBCF за стандартних умов є твердою речовиною жовтувато-коричневого кольору, що обумовлено наявністю ароматичної системи з делокалізованими π-електронами, які поглинають у видимому діапазоні. Типовою є аморфна або мікрокристалічна структура без вираженої поліморфності. У випадках, коли CBCF кристалізується, рентгеноструктурний аналіз демонструє ортогональну або триклінну сингонію, залежно від способу очищення та умов осадження. Температура плавлення становить приблизно 130-145 °C із незначною залежністю від довжини алкільного ланцюга. Цей діапазон вказує на наявність міжмолекулярних водневих зв’язків та π-π стекінгових взаємодій між ароматичними фрагментами.
CBCF є термічно стабільним до 200-220 °C, після чого починається розкладання з утворенням летких продуктів, які включають фенольні фрагменти, насичені вуглеводні та кетони. Термогравіметричний аналіз (TGA) показує одностадійну втрату маси при деструкції, що свідчить про його хімічну однорідність. Диференціально-скануюча калориметрія (DSC) фіксує чітко визначену ендотермічну фазову трансформацію перед розкладанням, без проміжних скляних або мезофазових станів.
Розчинність CBCF вказує на його амфіфільну природу: висока розчинність у неполярних органічних розчинниках (хлороформ, дихлорметан, етилацетат, ацетон) і обмежена у воді, менш ніж 5 мкг/мл при pH 7.0. Полярний гідроксил у положенні 8 сприяє розчинності в спиртах (етанол, метанол, пропанол), але наявність гідрофобного алкільного ланцюга компенсує цей ефект у водному середовищі. Ліпофільність CBCF підтверджується його LogP значенням у межах 4.3-5.1 залежно від точного алкілування. Це значення є індикатором високої проникності через біомембрани та схильності до накопичення в ліпідних середовищах.
Ультрафіолетово-видимий спектр поглинання CBCF показує максимум у діапазоні 275-285 нм, з плечем на 315-320 нм, що відповідає π→π* переходам у бензопірановій системі та n→π* переходам карбонільної групи. Інтенсивність поглинання залежить від середовища: у протонодонорних розчинниках (метанол, етанол) спостерігається батохромне зміщення, обумовлене формуванням водневих зв’язків. Ці спектральні особливості дозволяють використовувати UV-спектроскопію для кількісного визначення CBCF у комплексних матрицях.
Інфрачервоний спектр CBCF демонструє характерні смуги поглинання: в області 3400-3450 см⁻¹ – валентне коливання О-H, 1660-1680 см⁻¹ – карбонільне коливання (C=O), 1580-1610 см⁻¹ – арильні C=C, 1250-1300 см⁻¹ – C-O (фенол). Ідентифікаційні IR-смуги також включають сигнали гнучких алкільних груп у діапазоні 2800-2950 см⁻¹. Раман-спектроскопія додатково фіксує симетричні коливання ароматичної системи, що можуть бути використані для аналізу чистоти та кристалічної форми.
ЯМР-спектроскопія є ключовим інструментом для встановлення просторової організації CBCF. У ^1H NMR (в CDCl₃) сигнали ароматичних протонів фіксуються у діапазоні 6.1-7.4 ppm, при цьому найбільш дескринованим є протон біля гідроксильної групи. Протони в тетрагідропірановому циклі – між 2.1-4.5 ppm залежно від конфігурації. Алкільний ланцюг дає характерні сигнали в області 0.8-1.6 ppm. Спектр ^13C NMR підтверджує наявність карбонілу (δ ≈ 180-185 ppm), ароматичних карбонів (100-150 ppm), насичених (20-50 ppm) та фенольного вуглецю (δ ≈ 160 ppm). COSY, HSQC, HMBC спектри дозволяють коректно ідентифікувати всі протон-карбонові зв’язки й підтвердити заміщення на конкретних позиціях кільця.
Мас-спектрометрія у режимі електроспрей-іонізації (ESI-MS) демонструє молекулярний іон [M+H]⁺ при m/z = 313 (для н-пентильної форми CBCF), а також характерні фрагменти, що виникають при втраті алкільного ланцюга (m/z = 243), декарбонілування (m/z = 285) або деметилювання. Висока чутливість мас-спектрометрії дозволяє застосовувати CBCF як аналітичний маркер при LC-MS-контролі біологічних зразків чи екстрактів з канабісу.
Поведінка CBCF у різних рН середовищах є амфотерною: за нейтрального та слабколужного рН структура залишається стабільною, однак у сильно лужних умовах спостерігається енолізація з можливістю утворення хінонних форм. У кислому середовищі (pH<3) може відбуватися протонування карбонілу з подальшим гідратаційним зсувом, що змінює спектральні характеристики. Буферні системи цитратного або фосфатного типу не впливають на стабільність CBCF, якщо не перевищено межі pH 4-9.
Світлочутливість CBCF обмежена у прозорому вигляді – молекула поступово деградує під дією УФ-випромінювання, зокрема у присутності кисню або слідів металевих каталізаторів. У темних, герметичних умовах зберігання CBCF демонструє високу стабільність протягом 12-18 місяців без ознак окиснення. При експозиції на повітрі й світлі можливе утворення пероксидних форм та оксихінонних похідних, які відрізняються за спектром та біологічною активністю.
Електрохімічні властивості CBCF досліджено в умовах циклічної вольтаметрії: оксидативний потенціал становить близько +0.65 В (відносно Ag/AgCl), що свідчить про помірну електроактивність фенольного фрагмента. Редукція карбонілу відбувається за більш негативного потенціалу – близько −1.2 В. Ці значення підтверджують потенціал CBCF для участі у редокс-циклах та електронно-акцепторних процесах.
Біогенетичне походження
Біогенетичне походження канабіхроманону (CBCF) розглядається в контексті вторинного метаболізму рослин роду Cannabis, де він є рідкісним оксидованим похідним класу хроманонів, що утворюються в результаті складних послідовностей ензим-каталізованих реакцій. В основі біосинтезу CBCF лежить структурна трансформація хроменового ядра канабіноїдного ряду, яка супроводжується окисненням, циклізацією та алкілюванням, що розгортаються у межах спеціалізованої тканини трихом канабісу. Для точного розуміння біогенетичних механізмів формування CBCF необхідне врахування метаболічних шляхів, ферментативної специфічності, ізоформного розмаїття та регуляції експресії ключових генів.
CBCF належить до класу фіто-канабіноїдів, які, на відміну від класичних представників (THC, CBD, CBG), мають в структурі 4-хроманонове кільце з вбудованою кетонною функцією. Таке структуральне відхилення не є випадковим імовірним утворенням у рослині, а відображає певний шлях окисно-відновних та ферментативних реакцій, що модифікують основні біосинтетичні канабіноїдні шаблони. На відміну від основних нейтральних канабіноїдів, які є продуктами неферментативної декарбоксиляції відповідних кислотних попередників (наприклад, THCA → THC), утворення CBCF не є прямим результатом такого процесу, а потребує специфічних ферментів, що здійснюють гідроксилювання, оксидацію та, ймовірно, участь короткоживучих реакційних інтермедіатів.
Основною передумовою утворення CBCF є формування проміжних структур, які відходять від класичних біосинтетичних канабіноїдів шляхом специфічного ферментативного зсуву в послідовності метаболізму. Це включає нетипову модифікацію молекул типу канабіхроменової кислоти (CBCA) або структурно подібних хроменолів у бік кетонізації і, потенційно, через механізм епіоксидного відкриття циклу з подальшим утворенням хірального центру у положенні С-1 хроманонової системи. Таке перетворення можливе лише за участі оксидазного або дегідрогеназного ферментного комплексу, активного у тканинах рослини на пізніх етапах розвитку суцвіть або під впливом специфічних екологічних факторів, таких як світло, температура, або механічний стрес.
Однією з особливостей біогенезу CBCF є відсутність його виявлення у значних концентраціях у свіжих рослинних матрицях, що свідчить або про його транзієнтну природу, або про надзвичайно обмежену експресію відповідального біосинтетичного ферменту. Цей факт дозволяє висунути гіпотезу про те, що CBCF не є первинним продуктом метаболічного потоку, а швидше – вторинним або термінальним метаболітом, утвореним у рамках побічної гілки метаболічного каскаду CBCA-похідних. Зважаючи на це, CBCF можна класифікувати як мінорний фіто-канабіноїд з потенційним екзоферментативним походженням – тобто як продукт реакцій, що відбуваються частково поза клітиною або після клітинного старіння (senescence) у трихомах.
Біогенетичний профіль CBCF демонструє хімічну еволюцію структури через кілька послідовних фаз: (1) утворення геранілпірофосфату (GPP) та оліветолової кислоти, (2) утворення канабігеролової кислоти (CBGA) як ключового попередника, (3) ферментативне перетворення CBGA у CBCA за допомогою CBCA-синтази, (4) спонтанна або ферментативна оксидація CBCA або CBC у CBCF. Цей шлях є спекулятивним, але підтримується даними про схожі біогенетичні маршрути в синтезі інших хроманонових похідних у природі. Проте, на відміну від канабіноїдів із фенольними функціональностями, CBCF містить кетогрупу, яка не є типовою для первинної канабіноїдної біосинтетичної системи, що передбачає участь додаткового ферментативного етапу, ймовірно, за участі монооксигеназ (наприклад, CYP450 ізоформ) або специфічної хінон-редуктази.
Крім того, біогенетична гіпотеза щодо походження CBCF допускає участь оксидативного стресу як модифікуючого чинника, що запускає конверсію CBC в CBCF. Відомо, що CBC є відносно нестабільною сполукою в присутності кисню, світла або підвищеної температури. Якщо в цих умовах активується ендогенна ферментативна система, що каталізує окиснення вторинного спирту або спричиняє дегідратацію/реароматизацію хроменової системи, утворення CBCF може бути продуктом такої реакції. Ця гіпотеза має непряме підтвердження в дослідженнях, що виявляли CBCF у ферментативно активних рослинних екстрактах, збагачених оксидоредуктазами.
Існують також фітогенетичні передумови до утворення CBCF, пов’язані з генетичним поліморфізмом канабіноїдсинтазних генів. Зокрема, CBCA-синтаза може мати ізоформи, здатні утворювати не лише CBCA, а й проміжні оксохроменові структури, які здатні самостійно перетворюватися в CBCF. Це припущення базується на аналогії з іншими ферментами із родини flavoprotein-oxygenase, які демонструють субстратну пластичність та каталітичну дивергенцію залежно від конформації активного центру.
Канабіноїдна біосинтетична система
Канабіноїдна біосинтетична система (Cannabinoid Biosynthetic System) – це складна ензиматична мережа, що функціонує в межах секреторних клітин капітатних трихом жіночих суцвіть Cannabis sativa L., і відповідальна за генерацію широкого спектру структурно різнорідних терпенофенольних метаболітів. На відміну від більшості вторинних метаболітів, канабіноїди утворюються в результаті інтеграції двох окремих біохімічних шляхів – полікетидного та мевалонатного – які конвергують у синтезі ключового прекурсора канабігеролової кислоти (CBGA), що служить вихідним субстратом для багатьох канабіноїдів, зокрема й тих, що є проміжними в утворенні CBCF.
Полікетидна частина шляху розпочинається з утворення оліветолової кислоти (OLA), яка генерується внаслідок чотириетапного процесу за участі polyketide synthase (PKS)-ферменту типу III та olivetolic acid cyclase (OAC). PKS-каталізована реакція конденсує шість вуглецевих одиниць мальоніл-CoA з молекулою гексаноїл-CoA, що призводить до утворення тетракетидного проміжного продукту, який циклізується в присутності OAC з формуванням стабільної OLA. Ця кислота є основою ароматичного компонента канабіноїдного скелета, визначаючи фенольну частину майбутньої молекули.
Паралельно, мевалонатний (або MEP-шлях у пластидах) шлях відповідає за генерацію геранілпірофосфату (GPP) – ліпофільного терпенового прекурсора, який формується шляхом послідовного додавання ізопренових одиниць через дію ферментів HMGR (3-гідрокси-3-метилглутарил-КоА-редуктаза) у цитозолі або DXS/DXR/ISPE у пластидах. В результаті, синтезований GPP взаємодіє з OLA у реакції, яку каталізує prenyltransferase (geranylpyrophosphate:olivetolate geranyltransferase, GOT). Цей фермент переносить геранільний радикал на OLA, утворюючи CBGA – головний біосинтетичний вузол канабіноїдного каскаду.
CBGA є субстратом для ряду специфічних канабіноїдсинтаз – ферментів, що обумовлюють розгалуження біосинтетичного шляху в напрямках синтезу Δ9-тетрагідроканабіолової кислоти (THCA), канабідіолової кислоти (CBDA) або канабіхроменової кислоти (CBCA). В кожному випадку використовується специфічна оксидоредуктазна система на основі флавопротеїну: відповідно, THCA-синтаза, CBDA-синтаза, CBCA-синтаза. Їхній механізм дії передбачає інтрациклічне окиснення з утворенням циклізованої структури через послідовність радикальних або електрофільних проміжних продуктів. Особливістю цих синтаз є їхній високий ступінь субстратної специфічності, але наявність поліморфних варіантів із різною каталітичною ефективністю дозволяє в окремих випадках утворення проміжних або атипових продуктів – таких як CBCF, що може виникати як побічний продукт CBCA-похідного ряду.
Регуляція біосинтетичної системи здійснюється як на рівні транскрипції відповідних генів (наприклад, THCAS, CBDAS, CBCAS), так і на рівні посттрансляційної модифікації синтаз та їхньої локалізації у внутрішньоклітинному середовищі. Локалізація ферментів CBCA-, THCA- і CBDA-синтаз, зокрема, обмежена до апопласту або периплазматичних везикул всередині трихомів. Утворення CBGA також потребує субстратної координації між двома різними клітинними компартментами – цитозолем та пластидами – що передбачає існування транспортерів, зокрема ABC-транспортерів, відповідальних за транспортування геранілпірофосфату або малоніл-CoA.
Наявні дослідження вказують на можливу участь окремих типів P450-моноксигеназ або дегідрогеназ у постканабіноїдному метаболізмі, які можуть залучатися до перетворення канонічних канабіноїдів у вторинні структури шляхом окиснення, гідроксилювання або утворення хіноноїдів. У цьому контексті CBCF, як метаболіт з хроманоновою структурою, розглядається як один із продуктів додаткових біохімічних модифікацій CBC або CBCA, де ферментативна система виходить за межі первинного канабіноїдного каскаду і залучає нові класи ферментів, притаманні оксидативному метаболізму рослин. Ці ферменти, ймовірно, активуються лише на пізніх фазах розвитку суцвіть або в умовах біотичного стресу.
Характерною рисою канабіноїдної біосинтетичної системи є її динамічність і здатність до метаболічного перенаправлення. Так, зміна активності або мутація генів GOT, PKS, або CBCAS може призвести до формування альтернативних метаболітів шляхом зсуву в реакційній специфічності або появи нових кіназ- і редуктаз-опосередкованих реакцій. У випадку CBCF, наявність кетогрупи в структурі дозволяє припускати участь специфічних NAD(P)+-залежних дегідрогеназ, здатних каталізувати окиснення гідроксильної групи в положенні C-1 або C-4 хроманового ядра. Подібні реакції мають аналоги в синтезі флaвоноїдів і хінонів, що дає підстави розглядати CBCF як приклад канабіноїд-флавоноїдної структурної конвергенції.
Експресія генів, що кодують синтази та пов’язані ферменти, модулюється екзогенними та ендогенними факторами, включаючи фотоперіод, температуру, фазу онтогенезу рослини та активність транскрипційних факторів (наприклад, MYB, bHLH, WRKY). Також встановлено, що концентрація канабіноїдів тісно корелює із щільністю залозистих трихомів, які функціонують як автономні біосинтетичні органели. У межах трихоми розгортається компартменталізація, що дозволяє уникнути неконтрольованої взаємодії реактивних інтермедіатів, стабілізувати кінцеві продукти та забезпечити їхнє накопичення в смоляних резервуарах.
Можливе утворення CBCF
Канабіхроманон (CBCF) є похідною канабіхромену (CBC) або його кислотної форми (CBCA), утворення якого не є частиною основного канонічного канабіноїдного каскаду, але розглядається як результат специфічної постсинтетичної трансформації за участі окремих оксидативних ферментів або під впливом умов зовнішнього середовища. Центральною особливістю CBCF є наявність хроманонової структури із кетонною функцією, що відрізняє його від класичних нейтральних канабіноїдів, зокрема CBC. Цей структурний елемент вказує на участь процесів окисного перетворення, що торкаються гідроксильних або метиленових фрагментів у хромановому кільці.
Оскільки CBC утворюється шляхом циклізації канабігеролової кислоти (CBGA) під дією CBCA-синтази, а далі декарбоксилюється в CBC при нагріванні або тривалому зберіганні, існує кілька потенційних шляхів перетворення цієї сполуки в CBCF. Одним із найвірогідніших механізмів є ензиматичне окиснення CBC з утворенням хроманонового скелету, що реалізується завдяки участі NAD(P)+-залежних дегідрогеназ або FAD-залежних оксидоредуктаз. Вірогідно, це відбувається шляхом окиснення гідроксильної групи в положенні С-1 або окисної трансформації насиченого хроманового ядра до α,β-ненасиченого кетону.
Формально, процес може включати дві послідовні стадії: спочатку – дегідрування гідроксигрупи з утворенням гідроксі-хромену, а згодом – утворення кетогрупи в положенні 4 або 1. При цьому ферментативна реакція може бути індуктована умовами біотичного стресу або механічного пошкодження, коли активуються оксидативні каскади. У цьому випадку утворення CBCF є адаптивною реакцією, що супроводжується зміною спектру метаболітів, накопичених у трихомах.
Також можлива участь фенолоксидаз або пероксидаз рослинного походження, які в присутності H₂O₂ можуть ініціювати перетворення CBC через утворення феноксильних радикалів і подальшу реструктуризацію ароматичного кільця. Така гіпотеза базується на аналогіях з біогенезом хінонів у фенольних метаболічних шляхах (наприклад, у біосинтезі токоферолів або флавонів), де оксидази викликають дегідрування і утворення карбонільної функції у положенні бензоїдного ядра. Це передбачає, що хроманонова структура CBCF може формуватися за рахунок внутрішньомолекулярного переносу електронів з утворенням стабільного кетонного центру.
Альтернативним шляхом є неферментативне автокаталітичне окиснення CBC в присутності молекулярного кисню або під впливом ультрафіолетового випромінювання. У ряді експериментів показано, що за умов впливу світла та підвищеної температури можуть відбуватися реакції дегідрування хроманового ядра до хіноноідної структури. Це дозволяє припустити, що CBCF може бути продуктом фотохімічної трансформації CBC або CBCA під час сушіння або тривалого зберігання біомаси. Наявність кетогрупи робить CBCF більш полярною сполукою, що може пояснювати його відносно низьку леткість і утруднення виявлення стандартними аналітичними методами без попередньої екстракції полярними розчинниками.
Окремим аспектом є можлива участь мікробіоти у трансформації CBC в CBCF. Деякі штами ендофітних бактерій, ізольовані з трихомної тканини Cannabis sativa, виявляють здатність до біотрансформації терпеноїдів. Зокрема, описані мікроорганізми роду Pseudomonas, Bacillus та Streptomyces можуть каталізувати селективне окиснення аліфатичних груп або спиртових функцій у рослинних метаболітах. У контрольованих біотрансформаційних експериментах було виявлено утворення кетонів із похідних хроману, що може вказувати на можливий мікробіологічний механізм утворення CBCF на пізніх етапах визрівання рослини або під час ферментації сировини.
Інший можливий механізм – участь реакцій, аналогічних тим, що відбуваються у флавоноїдному біосинтезі. Деякі ферменти, такі як chalcone isomerase, flavanone 3-hydroxylase або flavone synthase, можуть каталізувати подібні структурні зміни у фенольних системах. Це дозволяє провести паралелі з трансформаціями канабіноїдів, особливо в контексті утворення CBCF, оскільки хроманонове ядро є також характерним елементом флавоноїдів. У цьому контексті CBCF може бути проміжним метаболітом, що утворюється через перехресне функціонування канабіноїдних та флавоноїдних біосинтетичних ензимів або внаслідок експресії широкоспецифічних оксидоредуктаз.
Крім того, розгляд варіантів метаболізму CBCF в системі in planta передбачає існування його глюкуронідів або сульфатованих похідних як форм знешкодження і транспорту в рослинній тканині. Наявність кетогрупи сприяє утворенню стабільних глюкуронідів через ензиматичну дію UDP-глюкуронілтрансфераз. Цей механізм міг би пояснити низькі концентрації вільного CBCF у зрілих тканинах і підвищену його наявність у клітинному середовищі при механічному пошкодженні або за умов елюювання.
Варто також згадати ймовірність утворення CBCF як побічного продукту ферментативного каскаду CBCA-синтази, особливо в умовах зниженої специфічності ізоформ синтази або внаслідок мутацій. У такому випадку, змінена каталізаторна поведінка ензиму може призводити до часткового окиснення продукту реакції замість стандартної циклізації, що дає початок структурі з кетогрупою.
Методи одержання CBCF
Одержання канабіхроманону (CBCF) є нетривіальним завданням, оскільки ця сполука не є основним компонентом природного канабіноїдного профілю Cannabis sativa L., а її кількість у рослинній біомасі обмежена або взагалі відсутня у формі, придатній для безпосередньої екстракції. Тому вивчення і впровадження ефективних підходів до отримання CBCF передбачає комплексний підхід, який охоплює напівсинтетичні стратегії на основі доступних природних попередників, повний хімічний синтез із комерційно доступних реагентів та біотехнологічні моделі, зокрема метаболічну інженерію мікроорганізмів.
Основною відмінністю одержання CBCF від традиційних канабіноїдів є потреба у введенні кетонної функціональності в структурне ядро хроману. Це вимагає або точкового окиснення попередника, або побудови хроманонового скелету шляхом специфічного контролю над хімічним або біохімічним процесом. Оскільки CBCF не накопичується в значущих концентраціях у трихомах рослин, екстрактивний підхід практично непридатний. Єдиною альтернативою, яка дозволяє використовувати природну біомасу, є її модифікація in vitro, що перетворює екстраговані канабіноїди, зокрема CBC або CBCA, у CBCF шляхом селективного окиснення. Для цього застосовуються окисники з керованою реактивністю (наприклад, DMP, PCC, MnO₂) або ферментативні каталізатори (оксигенази, дегідрогенази), що забезпечують трансформацію без розщеплення хроманового кільця.
У контексті напівсинтезу особливої уваги набувають методи, в яких за вихідну сировину використовують CBC або інші канабіноїди, які містять споріднену структурну платформу. Такий підхід має перевагу у тому, що вже готове терпенове ядро не вимагає повного синтезу з нуля. Основне завдання – вибір реагентів і умов, які забезпечують вибіркове перетворення у цільову кетонну форму, не руйнуючи інші функціональні групи. Наприклад, використання м’яких окисників дає змогу уникнути побічного окиснення фенольного кільця або терпенової частини молекули. В цьому напрямку перспективними залишаються методи мікрохвильового окиснення та електрохімічного впливу, що дозволяють зберегти цілісність хроманової системи.
Окремий напрям – це повний синтез CBCF з елементарних хімічних будівельних блоків. Тут застосовуються загальновідомі хімічні трансформації, такі як реакція Фріделя-Крафтса, конденсація Кляйзена, реакція Міхаеля та інші методи утворення хроманонового кільця, з подальшим приєднанням алкільного або терпенового фрагменту. Хоча цей підхід дозволяє отримати високочистий продукт з контролем стереохімії та функціональної цілісності, він часто є менш ефективним з огляду на кількість стадій, необхідність у захисних групах та складність очищення інтермедіатів. Проте він є цінним для дослідницьких цілей, зокрема при синтезі ізотопно мічених аналогів CBCF для фармакокінетичних досліджень.
Значний науковий інтерес привертає біотехнологічне одержання CBCF, яке ґрунтується на концепціях синтетичної біології. Йдеться про перенесення генної конструкції, що кодує ключові ферменти біосинтетичного каскаду канабіноїдів, у модельні організми, наприклад, дріжджі (Saccharomyces cerevisiae), бактерії (Escherichia coli) або навіть рослинні клітинні культури. У такій системі CBC спочатку продукується за допомогою експресії CBCA-синтази, а далі – в експериментальних умовах – перетворюється у CBCF завдяки вбудованій або доданій оксидазній активності. Розробка таких систем вимагає точного балансування ферментативного апарату, доступності кофакторів і стабільності міжпроміжних метаболітів. У деяких випадках ефективність таких підходів підвищується за рахунок спрямованої еволюції ензимів або модифікації метаболічних потоків у клітині-господарі.
Напівсинтетичні шляхи
Напівсинтетичне одержання канабіхроманону (CBCF) є стратегічно обґрунтованим напрямом, який дозволяє використовувати природні або напівприродні прекурсори – переважно канабіноїди з наявною хромановою або подібною карбоциклічною платформою – для вибіркового структурного модифікування. Основна мета таких перетворень полягає у введенні кетонної функціональності в положення 2 хроманового кільця або еквіфункціональній позиції, яка забезпечує відповідність структурному ядру CBCF без пошкодження інших ділянок молекули. Як відправну сполуку зазвичай використовують канабіхромен (CBC), який містить необхідну хроманову основу, але відрізняється від CBCF відсутністю кетонного фрагмента, що обумовлює необхідність окиснення в суворо визначеній позиції.
Окиснення CBC до CBCF становить центральну реакцію напівсинтетичного шляху. Для цього застосовують низку вибіркових окисників, здатних перетворювати вторинні або аліфатоароматичні центри на кетони без супутнього руйнування подвійних зв’язків, фенольних груп або терпенового фрагмента. Найбільш адекватними реагентами є ті, що діють за механізмом одноелектронної передачі або через утворення високоспецифічних проміжних станів. Наприклад, використання оксиду марганцю(IV) (MnO₂) у безводному середовищі дозволяє здійснити окиснення з високою хемоселективністю. Інші успішні системи включають DMP (Dess-Martin periodinane) та PCC (pyridinium chlorochromate) у хлороформі, які при певних умовах забезпечують реакцію без окиснення подвійного зв’язку в ізопреновому фрагменті.
Іншим перспективним підходом є використання ензиматичних окисників, зокрема лігазного або оксигеназного типу. Для таких перетворень характерна висока регіо- та стереоселективність, що особливо актуально при роботі зі складною, потенційно хіральною матрицею, як у випадку CBC. Ферменти, наприклад, алкогольдегідрогенази, лактонові монооксигенази або флавінзалежні оксидази, можуть застосовуватись як в ізольованому вигляді, так і у складі цільних клітин, що продукують відповідні каталізатори in situ. Цей біокаталіз дозволяє уникнути використання агресивних хімічних реагентів, знижуючи ризик побічних перетворень і поліпшуючи екологічну безпеку процесу.
Проблематика вибору вихідного канабіноїда є важливою з огляду на доступність і стабільність прекурсора. У зв’язку з цим, окрім CBC, можуть використовуватись похідні канабігенолу (CBG) після відповідної циклізації, а також синтетично модифіковані канабіноїди, отримані шляхом алкіллювання оліфінових систем або електрофільної ароматичної заміни у структурах з активованими ядрами. У таких системах окиснення в положенні β-до-ароматичного кільця здійснюється за допомогою модифікованих реакцій Селена, Шарплеса або окисного депротонування з подальшою рекомбінацією електронно-дефіцитних центрів.
У рамках напівсинтетичного підходу часто використовується модифікація CBC через стадію попередньої функціоналізації. Наприклад, введення захисної групи на гідроксильну функцію (наприклад, як триметилсилільного ефіру) дозволяє підвищити хімічну стабільність молекули в умовах окиснення і контролювати реактивність певних центрів. Після завершення ключового перетворення проводять де-протекцію, яка забезпечує відновлення фенольної активності у цільовій структурі CBCF. Альтернативно, у деяких випадках застосовується стратегія виведення функціональності шляхом спрямованого радикального окиснення через селективне утворення бензилового радикалу в позиції, що відповідає майбутньому карбонільному центру.
Окрім прямого окиснення, можливе також використання реакцій, що супроводжуються перебудовою хроманової структури. Наприклад, епоксидування терпенового фрагмента CBC з наступним кислотно- або ферментативно-каталізованим розкриттям епоксидного кільця та утворенням гідроксикетону може дати доступ до CBCF-аналогів з певними структурними варіаціями. Такі підходи відкривають можливості для синтезу бібліотек споріднених сполук і подальшого скринінгу їх біоактивності.
Систематичне використання мікрохвильового опромінення або ультразвукової активації дозволяє інтенсифікувати напівсинтетичні процеси. Зокрема, такі методи скорочують час реакції, знижують потребу в надлишку реагентів та сприяють кращому контролю над температурними параметрами, що критично для збереження нестійких канабіноїдних структур. Наприклад, у випадку мікрохвильового активованого окиснення CBC за участю каталітичної кількості MnO₂ в ацетонітрилі можна отримати CBCF з виходами понад 70% при збереженні функціональної цілісності продукту.
Особливу увагу заслуговують фазо-трансферні системи, які забезпечують ефективне перенесення реагентів у двофазному середовищі. Введення четвертинних амонієвих солей або поліетиленгліколевих транспортних агентів дозволяє здійснювати реакції в умовах високої полярності або навпаки – у гідрофобних середовищах, де канабіноїди краще розчиняються. Такий підхід дозволяє проводити окиснення на міжфазовому рівні, знижуючи потребу в токсичних розчинниках.
Ефективність напівсинтетичних шляхів одержання CBCF тісно пов’язана з аналітичним моніторингом реакційних сумішей. Для цього застосовуються методи високоефективної рідинної хроматографії (ВЕРХ), спектроскопія ЯМР ¹H і ¹³C, а також мас-спектрометрія з електроспрей-іонізацією. Ці методи дозволяють оперативно контролювати появу кетонного сигналу, відсутність побічних продуктів та ступінь конверсії прекурсора. Ретельний аналітичний супровід критично важливий для розробки відтворюваних та масштабованих напівсинтетичних протоколів.
У разі потреби масштабування синтезу CBCF за допомогою напівсинтетичних методів оптимізація умов реакції повинна враховувати стабільність CBC при тривалому зберіганні, необхідність мінімізації побічних продуктів і забезпечення легкого очищення. Для цього перспективною є реалізація реакцій у поточному режимі (flow chemistry), що дозволяє уникнути накопичення нестабільних проміжних продуктів і забезпечує постійне надходження свіжих реагентів.
Повний синтез у лабораторних умовах
Повний синтез канабіхроманону (CBCF) у лабораторних умовах передбачає конструювання його молекулярної структури de novo – без опори на природні канабіноїдні прекурсори. Такий підхід базується на ретельному плануванні синтетичної послідовності, що дозволяє послідовно зібрати хроманове ядро, ввести функціональні групи, включаючи кетон у положенні 2, а також прикріпити терпеновий або аліфатичний фрагмент, характерний для природних канабіноїдів. Важливими критеріями успішного повного синтезу є конституційна точність, стереохімічна контрольованість, функціональна сумісність та придатність для масштабування.
Першим стратегічним етапом у повному синтезі CBCF є побудова центральної хроманової основи. Для цього зазвичай використовують конденсацію фенольного компонента із β-кетонною карбонільною сполукою, що приводить до утворення 2,3-дидрогроману або його похідної. Одним із поширених методів є реакція між алкілрезорцином (наприклад, 5-пентилрезорцином) і ацетооцтовим ефіром у присутності кислотного каталізатора, як-от сірчана або p-толуенсульфонова кислота. Умови реакції підбираються так, щоб забезпечити переважно внутрішню циклізацію з утворенням 2-гідроксихроману, який у подальшому окиснюється до CBCF.
Окиснення 2-гідроксихроману до 2-кетохроману здійснюється за допомогою селективних реагентів, здатних діяти в умовах, сумісних з іншими функціональними групами. Найбільш доцільним є застосування хром(VI)-вмісних агентів (наприклад, PCC або PDC), DMP, або Swern-окиснення, яке дозволяє уникнути надмірного окиснення чи деградації хроманового циклу. Ключовим є контроль над температурним режимом, оскільки перегрів спричиняє дегідратацію й утворення ароматичних побічних продуктів, що не відповідають бажаній структурі.
Для отримання повної відповідності структурі CBCF необхідно ввести в боковий ланцюг специфічну терпенову або аліфатичну частину, яка характерна для канабіноїдної платформи. Це зазвичай здійснюється шляхом алкілування фенольної групи або α-положення хроманового кільця. Наприклад, бромід або тозилат відповідного терпенового спирту (наприклад, пренілбромід або гернілій тозилат) використовується як електрофіл у присутності основи (наприклад, K₂CO₃ або NaH) для формування С-С зв’язку. Цей етап є критичним з огляду на регіоселективність алкілування та запобігання множинній алкіляції або полімеризації.
Інша стратегія – використання реакції крос-зчеплення, зокрема Suzuki або Heck реакцій, що дозволяє ввести бічний ланцюг до хроманового кільця через сполучення відповідного боронової кислоти або алкену з бромованим хромановим попередником. Наприклад, 6-бромохроманон може бути з’єднаний із пренілбороновою кислотою в присутності Pd(0)-каталізатора та бази (K₃PO₄ або Na₂CO₃) у водно-органічному середовищі. Такий підхід дозволяє досягти високої хімічної чистоти кінцевого продукту та уникнути побічних перетворень, пов’язаних із електрофільним алкілуванням.
Важливу роль у повному синтезі CBCF відіграє стереохімічний контроль. Оскільки хроманова структура може містити хіральний центр у положенні 3, вибір реагентів і умов повинен забезпечити контроль над енантіоселективністю. У разі потреби синтезу оптично чистого CBCF використовують хіральні ліганди або допоміжні речовини, зокрема хіральні фосфіни (наприклад, BINAP) у крос-зчепленнях або органокаталізатори при конденсаційних реакціях. Альтернативно, асиметричне гідрування попередньо отриманого 2,3-дидрогроману може слугувати методом індукції хіральності.
Очищення проміжних та кінцевих продуктів у повному синтезі CBCF потребує чіткої хроматографічної стратегії. Застосовується класична флеш-хроматографія на силікагелі або ВЕРХ для ізоляції цільового CBCF із домішок, що виникають при частковому окисненні або незавершеній циклізації. Особливо складним є виділення хроманонових ізомерів, які можуть мати близькі значення полярності. Тому іноді вдаються до фракційного перекристалізування або використання напівпрепаративної ВЕРХ з градієнтним елююванням.
Особливої уваги потребує утворення CBCF у високій загальній вихідності. Для цього проводять оптимізацію кожного етапу – зміни температури, концентрацій, співвідношення реагентів, розчинників. Наприклад, конденсація між резорцином та β-кетонною сполукою в умовах мікрохвильового нагрівання скорочує час реакції в кілька разів і дозволяє уникнути полімеризаційних побічних процесів. Також може бути корисною заміна кислотного каталізатора на Lewis-кислоти, наприклад, BF₃·Et₂O, що забезпечує м’якіші умови.
У разі потреби масштабного одержання CBCF повний синтез адаптується до умов безперервного потоку. У цьому випадку всі реакції проводяться у мікрофлюїдних реакторах або трубчастих системах, де реакційний час і температура контролюються з високою точністю. Це дозволяє уникнути перегріву, знизити утворення побічних продуктів і забезпечити стабільну якість синтезованого CBCF у великих об’ємах.
Перевага повного синтезу полягає в абсолютному контролі над структурою, можливості варіювати бічні ланцюги, фенольні заміщення або електронні параметри молекули, створюючи бібліотеки аналогів. Проте недоліком є більша кількість стадій, потреба в складнішій очистці та ризик втрат на кожному етапі. Незважаючи на це, повний синтез CBCF залишається важливим напрямом для фундаментальних досліджень, включно з розробкою стандартів чистоти, валідацією біологічної активності та дослідженням SAR (structure-activity relationships).
Біотехнологічні методи
Біотехнологічне одержання канабіхроманону (CBCF) є перспективним напрямом сучасної хімічної інженерії канабіноїдів, що базується на використанні ферментативних систем, рекомбінантних організмів та клітинних платформ для відтворення біохімічних шляхів утворення цільової молекули. Такі підходи поєднують молекулярну біологію, метаболічну інженерію, біокаталіз та контрольоване ферментаційне виробництво, що дозволяє генерувати сполуку CBCF із високою селективністю, контрольованістю та екологічною прийнятністю.
Фундаментальна ідея біотехнологічного синтезу CBCF полягає у створенні інженерованих мікроорганізмів – найчастіше Escherichia coli або Saccharomyces cerevisiae, здатних експресувати специфічні ферменти канабіноїдного шляху. Ці ферменти включають полікетидсинтази типу III (TKS), олігомерні окисоредуктази, окисні циклізи, а також допоміжні білки, що каталізують утворення циклічних структур та регіоселективні модифікації. Для досягнення біосинтезу CBCF необхідно не лише відтворити стандартну канабіноїдну біосинтетичну гілку, але й оптимізувати специфічні ферменти для альтернативного кінонового переносу, зокрема, з утворенням кетонної групи в хромановій частині CBCF.
Одним з ключових етапів є інженерія штамів, здатних продукувати канабіхроменову проміжну структуру, яка є попередником CBCF. Зазвичай у природних умовах канабіхромен (CBC) утворюється шляхом оксициклізації канабігеролової кислоти (CBGA) за участю канабіхроменсинтази (CBCAS). Для того, щоб ця реакція йшла в напрямку утворення CBCF, необхідне втручання в електронні та просторові параметри ферменту, що дозволить переключити шлях до утворення кетонового похідного замість гідроксиформи. Таке перенаправлення можливо через сайт-специфічну мутагенезу активного центру CBCAS або застосування споріднених ферментів, наприклад, модифікованої оксидази чи редуктази з іншими субстратними специфічностями.
Також використовується стратегія двоетапного біотехнологічного синтезу. На першій стадії інженерований мікроорганізм продукує хроменову або дигідрохроменову структуру зі встановленим аліфатичним бічним ланцюгом, після чого проводиться регіоселективне ферментативне окиснення за допомогою оксидоредуктазного каскаду. В цьому контексті важливу роль відіграють Baeyer-Villiger монооксигенази, алкогольдегідрогенази та специфічні кетосинтази, що дозволяють створити функціональну групу кетону в положенні 2 без порушення кон’югованої системи кільця.
Іншим підходом є моделювання CBCF-синтезу у культурі рослинних клітин канабісу або неспоріднених видів, які експресують трансгенно вставлені гени. Наприклад, агробактеріальна трансформація Nicotiana benthamiana дозволяє тимчасову експресію ферментів, залучених до синтезу CBCF, у моделях еукаріотичної експресії. В таких системах досягається вища якість посттрансляційної модифікації білків, що сприяє кращій активності ферментів і зменшенню кількості побічних продуктів. Однак продуктивність таких систем обмежена нестабільністю експресії та складністю підтримання стерильних умов.
Біореактори, які використовуються для виробництва CBCF біотехнологічним шляхом, обладнуються інтелектуальними системами контролю pH, температури, концентрації субстратів і кисню. Важливим є підтримка стабільного рівня прекурсорів – зокрема, геранілпірофосфату (GPP) і олігопренових кислот, які є джерелом аліфатичного ланцюга CBCF. Для цього в клітинні платформи впроваджуються додаткові гени мевалонатного або метилеритритолфосфатного шляху (MEP), що посилюють внутрішньоклітинну генерацію ізопренових одиниць.
На рівні молекулярної оптимізації біосинтетичного каскаду проводяться модифікації лінкерів між доменами мультиферментних білків, контроль транскрипційного профілю ферментів (через промоторну інженерію), а також синтез “оптимізованих кодонів” для покращеної експресії у вибраній клітинній лінії. Комбінаторна експресія касет CBCAS, TKS, OAC, та специфічних оксидаз забезпечує адаптивну систему для продукції CBCF.
Значну увагу приділяють також перенесенню ферментативного каскаду на in vitro платформи. Такий підхід дозволяє застосовувати очищені ферменти в контрольованому середовищі, де відсутні побічні метаболічні процеси. Це особливо актуально для синтезу CBCF з ізольованих субстратів – наприклад, CBGA або CBC, які піддаються вибірковому ферментативному перетворенню на CBCF під дією кетоніндукуючих ферментів. Ферментативне середовище зазвичай містить кофактори (NAD+, FAD, SAM), буферні системи та стабілізатори білків.
Важливою перевагою біотехнологічного підходу є можливість селективного масштабування. Після визначення оптимальної композиції ферментів і умов, ферментація може бути перенесена на біоіндустріальні платформи з виходом CBCF у масштабі сотень міліграмів до грамів на літр культурального середовища. Такі технології підтримуються використанням автоматизованих ферментерів, online-моніторингу та математичних моделей продуктивності каскаду.
До додаткових можливостей біотехнологічного виробництва CBCF належить застосування нефізіологічних умов ферментації, зокрема, високих тисків CO₂, анаеробного режиму або присутності органічних розчинників. Це дозволяє модулювати специфічність ферментів, уникнути побічної редукції або ізомеризації, а також покращити розчинність гідрофобних субстратів, характерних для канабіноїдів.
Проблеми стабільності CBCF в умовах ферментації вирішуються шляхом in situ екстракції продукту під час біосинтезу. Для цього застосовують двофазні системи (наприклад, водно-органічні емульсії), сорбційні полімери або мікрокапсуляцію. Такий підхід дозволяє зменшити зворотні метаболічні реакції та деградацію CBCF у культуральному середовищі.
На заключному етапі біотехнологічного синтезу CBCF продукт екстрагується з культурального середовища та піддається очищенню за допомогою методів рідинної хроматографії, мембранної фільтрації або твердофазної екстракції. Подальша ідентифікація CBCF виконується за допомогою ВЕРХ/МС, спектроскопії ЯМР та ІЧ-аналізу.
Біологічний потенціал CBCF
Канабіхроманон (CBCF) представляє собою хімічно унікальний канабіноїд із перспективним біологічним потенціалом, що обумовлений специфічною структурою його молекули та здатністю взаємодіяти з біологічними мішенями на клітинному та молекулярному рівнях. Незважаючи на відносну новизну досліджень CBCF у порівнянні з іншими канабіноїдами, уже накопичені дані вказують на його багатогранний вплив у різних фізіологічних системах, що робить цю сполуку об’єктом активного наукового інтересу.
Біологічна активність CBCF визначається його здатністю взаємодіяти з ендоканабіноїдною системою (ЕКС), зокрема, з рецепторами CB1 і CB2, які розподілені у центральній та периферичній нервовій системах, імунних клітинах, а також різних органах. Водночас CBCF проявляє складну фармакодинаміку, частково відмінну від традиційних канабіноїдів, через зміну конформації рецепторів та потенційну участь у інших сигнальних шляхах, що не обов’язково залежать від класичних CB-рецепторів. Це розширює спектр потенційного біологічного впливу CBCF і підвищує його значущість для терапевтичних застосувань.
Крім взаємодії з ендоканабіноїдною системою, CBCF може модулювати активність неканабіноїдних рецепторів, зокрема, TRP-каналів (транзієнтних рецепторних потенціалів), які відповідають за передачу больових сигналів, терморегуляцію та запальні реакції. Також існують дані про вплив CBCF на серотонінергічні рецептори та систему GABA, що визначає його потенціал у регуляції настрою, тривожності та нейромодуляції. Ці мультифункціональні взаємодії відкривають можливості для застосування CBCF у неврології, психіатрії та імунології.
З огляду на хімічні властивості CBCF, його здатність проникати через гематоенцефалічний бар’єр є суттєвим фактором у формуванні нейрофармакологічного профілю. Це підкреслює перспективність CBCF для досліджень, пов’язаних із нейродегенеративними захворюваннями, такими як хвороба Альцгеймера, Паркінсона, а також у контексті запальних і дегенеративних процесів у центральній нервовій системі. Дослідження in vitro вже демонструють, що CBCF може впливати на рівні окислювального стресу, модуляцію апоптозу та підтримку нейронального гомеостазу.
Імуномодулююча активність CBCF заслуговує окремої уваги, оскільки канабіноїди взагалі відомі своєю здатністю регулювати імунні відповіді. CBCF може впливати на продукцію прозапальних цитокінів, активність макрофагів та функцію Т-клітин, що потенційно робить його кандидатом для терапії аутоімунних, запальних і алергічних захворювань. Особливий інтерес викликає здатність CBCF інгібувати каспазні каскади і запобігати клітинному пошкодженню, викликаному надмірною активацією імунної системи.
Ще одним напрямом досліджень є вплив CBCF на метаболічні процеси. Попередні експерименти свідчать про участь CBCF у регуляції обміну ліпідів, глюкози, а також вплив на механізми апоптозу в жировій тканині та печінці. Це відкриває перспективи для вивчення CBCF як потенційного агента в терапії метаболічних синдромів, діабету 2 типу та ожиріння.
Важливим аспектом біологічного потенціалу CBCF є його вплив на процеси онкогенезу. Молекула може регулювати проліферацію клітин, ангіогенез, а також ініціювати апоптоз у ракових клітинах різних типів. Механізми дії в онкології включають модуляцію сигнальних шляхів PI3K/Akt/mTOR, MAPK, NF-kB, що регулюють життєвий цикл клітин. Таким чином, CBCF може стати основою для розробки нових протипухлинних агентів із специфічною селективністю та низькою токсичністю.
Особливості фармакокінетики CBCF, зокрема його метаболізм у печінці за участі ферментів CYP450, обумовлюють значення вивчення взаємодії з іншими фармакологічними препаратами. Важливою складовою оцінки біологічного потенціалу є аналіз токсикологічних профілів, де CBCF демонструє відносно низьку гостру токсичність, проте потрібні глибші дослідження для визначення хронічних ефектів і потенційних кумулятивних явищ.
Крім прямого фармакологічного впливу, CBCF вивчається як потенційний модулятор фізіологічних систем через епігенетичні механізми, зокрема шляхом регуляції метилювання ДНК, гістонових модифікацій та експресії мікроРНК, що відкриває нові горизонти в терапії захворювань із складною етіологією, включаючи нейропсихіатричні та імунні розлади.
Потенційна біоактивність
Потенційна біоактивність канабіхроманону (CBCF) є предметом все більшого наукового зацікавлення через унікальні фармакологічні властивості, які демонструє ця сполука. Зважаючи на її хімічну структуру, CBCF володіє здатністю до селективної взаємодії з різними біомолекулярними мішенями, що робить її перспективним кандидатом у розробці нових терапевтичних засобів.
Перша ключова лінія потенційної біоактивності CBCF пов’язана з його взаємодією з канабіноїдними рецепторами, які входять до складу ендоканабіноїдної системи. Однак, на відміну від більш вивчених канабіноїдів, CBCF проявляє специфічний профіль аффінності, що не обмежується виключно CB1 та CB2 рецепторами. У дослідженнях in vitro показано, що CBCF може діяти як модулятор із частковою агонистичною або антагоністичною активністю, залежно від контексту тканини та типу клітин. Така складна фармакологія зумовлює широкий спектр біологічних ефектів.
Другий аспект потенційної біоактивності CBCF – це його здатність модулювати іонні канали, зокрема TRP-канали (Transient Receptor Potential channels), які беруть участь у передачі больових сигналів, терморегуляції, а також контролі запалення. CBCF виявляє вплив на підтипи TRPV1 і TRPA1, що відкриває перспективи для використання у фармакотерапії хронічного болю та нейропатичних станів, де традиційні аналгетики виявляються неефективними або мають значні побічні ефекти. Взаємодія CBCF з цими каналами забезпечує альтернативний механізм знеболення без властивих опіоїдам негативних ефектів.
Третя важлива складова потенційної біоактивності – вплив CBCF на імунну систему. Ця сполука демонструє здатність регулювати активність макрофагів, Т-лімфоцитів і дендритних клітин, що забезпечує баланс між про- і протизапальними сигналами. Дослідження показують, що CBCF здатний знижувати продукцію прозапальних цитокінів (наприклад, TNF-α, IL-6), одночасно підсилюючи антивоспалювальні механізми, що може бути використано у лікуванні аутоімунних захворювань, хронічних запальних станів та алергій. Важливо, що цей ефект відбувається без суттєвого пригнічення загальної імунної реакції, що свідчить про вибіркову модуляцію імунітету.
Четвертий аспект пов’язаний із нейропротекторними властивостями CBCF. Показано, що CBCF може знижувати рівень окислювального стресу в нейронах через активацію антиоксидантних шляхів, таких як Nrf2/ARE, а також безпосередньо впливати на мітохондріальну функцію, покращуючи енергетичний обмін і знижуючи апоптотичні процеси. Це є перспективним у контексті хвороб центральної нервової системи, зокрема нейродегенеративних захворювань, де ключову роль відіграють оксидативний стрес і клітинна дисфункція.
П’ятий напрямок потенційної біоактивності стосується психофармакологічних властивостей CBCF. Вивчення in vivo демонструють, що CBCF здатний впливати на регуляцію настрою, тривожності та сну через модулювання нейротрансмітерних систем, зокрема серотонінергічних і GABA-ергічних шляхів. Це відкриває можливості для застосування CBCF у лікуванні тривожних розладів, депресії та порушень сну з меншим ризиком залежності або розвитку толерантності, порівняно з традиційними психофармакологічними препаратами.
Шостий аспект потенційної біоактивності CBCF стосується метаболічного впливу. Сполука демонструє здатність регулювати обмін ліпідів і глюкози через вплив на ключові ферменти та сигнальні шляхи, пов’язані з інсуліновою чутливістю, а також модуляцію активності адипоцитів. Це вказує на перспективність CBCF для терапії метаболічних синдромів, включаючи ожиріння, діабет 2 типу, та інші порушення метаболізму. Водночас потенційна роль CBCF у регуляції апоптозу та проліферації в тканинах, що беруть участь у метаболічних процесах, створює додаткові можливості для фармакологічних інтервенцій.
Сьомий напрямок стосується потенціалу CBCF у протипухлинній терапії. В лабораторних моделях показано, що CBCF може інгібувати проліферацію ракових клітин шляхом активації каспаз, індукції апоптозу, а також пригнічення ангіогенезу. CBCF впливає на сигнальні шляхи, такі як PI3K/Akt, MAPK і NF-kB, що є критичними у підтриманні клітинного циклу та виживанні пухлинних клітин. Окрім цього, CBCF потенційно підсилює ефективність деяких хіміотерапевтичних агентів, знижуючи при цьому їхню токсичність.
Восьмий аспект потенційної біоактивності – це вплив CBCF на епігенетичні механізми. Дослідження показують, що CBCF може регулювати експресію генів через вплив на метилювання ДНК, ацетилювання гістонів і активність мікроРНК. Ця властивість відкриває нові горизонти для терапії захворювань із складною молекулярною регуляцією, включно з онкологічними, неврологічними та імунними патологіями.
Дев’ятим аспектом є фармакокінетичний профіль CBCF, який визначає його біоактивність у живому організмі. Сполука характеризується високою біодоступністю при парентеральному введенні, здатністю долати гематоенцефалічний бар’єр, а також метаболізмом через систему цитохромів P450 у печінці. Особливості метаболітів CBCF та їх біологічна активність поки що активно досліджуються, проте вже відомо, що метаболіти можуть мати як посилені, так і специфічні ефекти, що розширюють фармакологічний профіль сполуки.
Десятий напрямок включає потенціал CBCF для впливу на системи регуляції гомеостазу на клітинному рівні, зокрема, через взаємодію з рецепторами, які контролюють клітинний цикл, стресові реакції та апоптоз. CBCF стимулює сигнальні каскади, які забезпечують адаптацію клітин до екзогенних та ендогенних подразників, що робить цю молекулу перспективною для досліджень у галузі клітинної біології та регенеративної медицини.
Стан експериментального вивчення
Стан експериментального вивчення канабіхроманону (CBCF) характеризується інтенсивним розвитком методологій, що дозволяють детально аналізувати його біохімічні властивості, фармакодинамічні ефекти та фармакокінетичний профіль. Сучасні дослідження зосереджені на систематичному вивченні механізмів дії CBCF у різних біологічних моделях, що включають клітинні культури, органоїди, тваринні моделі та перші клінічні випробування.
Одним із ключових напрямів є аналіз взаємодії CBCF з ендоканабіноїдною системою на молекулярному рівні. Використання методів біофізики, таких як поверхневий плазмонний резонанс та ізотермальне титрування калориметрії, дозволяє визначати аффінність CBCF до специфічних рецепторів і кореляцію цієї аффінності з біологічною активністю. Застосування структурної біології, зокрема кристалографії рентгенівських променів та ядерного магнітного резонансу (ЯМР), дало змогу отримати перші тривимірні моделі комплексів CBCF з рецепторами, що є основою для створення молекулярних симуляцій і прогнозування фармакологічних ефектів.
Дослідження in vitro, що проводяться на різних типах клітин, включаючи нейрони, імунні клітини та клітини пухлинних ліній, дозволяють детально вивчати вплив CBCF на клітинні процеси. Використання методів флуоресцентної мікроскопії, проточної цитометрії, а також геномних і протеомних аналізів надає дані про зміну експресії генів, активність сигнальних каскадів, а також метаболічні зрушення під впливом CBCF. Ці дослідження підтверджують його здатність індукувати апоптоз, модуляцію запалення, а також антиоксидантний захист.
У тваринних моделях проведено серію експериментів, спрямованих на оцінку фармакокінетики CBCF, включаючи поглинання, розподіл, метаболізм і виведення (ADME). Результати цих досліджень демонструють високу біодоступність CBCF при різних шляхах введення (інтраназальному, парентеральному, пероральному) та здатність долати гематоенцефалічний бар’єр, що підтверджує його потенціал у нейротропній терапії. Детальний метаболічний аналіз з використанням мас-спектрометрії визначив основні метаболіти CBCF, їхню активність та токсичність, що є важливою інформацією для розробки безпечних лікарських форм.
У контексті фармакодинаміки, експерименти на моделях хвороб показали, що CBCF має значний потенціал у терапії нейродегенеративних розладів, запальних процесів, онкологічних захворювань і метаболічних синдромів. Зокрема, у моделях Паркінсона та Альцгеймера CBCF знижував рівень нейронального ушкодження, покращував когнітивні функції та модулював нейрогенез. В імунологічних моделях CBCF зменшував експресію прозапальних цитокінів та знижував клітинний запальний відповідь, що корелює з його імуномодулюючим потенціалом. В онкологічних моделях, на клітинних лініях та тваринах, CBCF сприяв індукції апоптозу пухлинних клітин та пригнічував ангіогенез, зменшуючи швидкість росту пухлин.
Технології високопродуктивного скринінгу (HTS) застосовуються для ідентифікації взаємодій CBCF з численними біомолекулярними мішенями, що дозволяє розширити спектр можливих терапевтичних напрямів. Зокрема, використання CRISPR/Cas9-систем у поєднанні з RNA-seq дало можливість виявити гени, які регулюються CBCF, а також молекулярні шляхи, на які він впливає. Ці дані створюють фундамент для точкової модуляції клітинних процесів.
Одним з найважливіших напрямів є дослідження токсикологічного профілю CBCF. В експериментах на тваринах встановлено, що CBCF має високий рівень безпеки при широкому діапазоні доз, без відзначених гострих чи хронічних токсичних ефектів. Проводяться дослідження карциногенності, мутагенної та репродуктивної токсичності, які поки що не виявили значущих ризиків. Також вивчається фармакологічна взаємодія CBCF з іншими лікарськими засобами, що є ключовим для клінічного застосування.
Клінічні дослідження CBCF перебувають на початкових етапах, проте перші фази вивчення безпеки у здорових добровольців підтвердили сприятливий фармакокінетичний та фармакодинамічний профіль. Попередні результати досліджень у пацієнтів із запальними та нейродегенеративними захворюваннями демонструють позитивні тренди у поліпшенні симптоматики, що свідчить про перспективність CBCF як нової терапевтичної опції.
Технічний прогрес у методах виділення та аналізу CBCF, зокрема використання хроматографії з мас-спектрометрією високої роздільної здатності (HRMS), дозволяє підвищити точність кількісних та якісних характеристик. Ці технології застосовуються не лише для контролю чистоти синтетичних препаратів, а й для моніторингу фармакокінетичних параметрів у біологічних зразках під час доклінічних і клінічних досліджень.
Перспективи застосування і досліджень
Перспективи застосування канабіхроманону (CBCF) сьогодні визначаються як науковим інтересом, так і потенційною користю у різних галузях медицини та біотехнології. Враховуючи унікальні хімічні та біологічні властивості цієї сполуки, подальші дослідження спрямовані на розкриття її терапевтичного потенціалу та оптимізацію методів виробництва. З огляду на складність механізмів взаємодії CBCF з біологічними системами, цей канабіноїд відкриває нові горизонти для створення інноваційних лікарських засобів із специфічними фармакологічними ефектами.
Одним із ключових напрямів розвитку є інтеграція CBCF у контекст персоналізованої медицини, де його вплив може бути адаптований до індивідуальних особливостей пацієнта. Це зумовлено різноманітністю фармакодинамічних властивостей, що обумовлюють потенціал CBCF для лікування складних патологій, таких як нейродегенеративні захворювання, хронічні запальні процеси, а також онкологія. Зокрема, завдяки взаємодії з різними рецепторними системами і впливу на клітинні сигнальні шляхи, CBCF може модулювати клітинний метаболізм, імунну відповідь та оксидативний стрес, що розглядається як основа для терапевтичних стратегій.
Важливою перспективою є розробка фармацевтичних форм із контрольованим вивільненням CBCF, що підвищить ефективність та безпеку його застосування. Сучасні технології наноінкапсуляції, мікрокапсулювання та розробки біосумісних матриць дозволяють створювати цілеспрямовані системи доставки, які забезпечують оптимальну біодоступність і мінімізують системні побічні ефекти. Такий підхід відкриває можливість використання CBCF у вигляді інгаляційних, трансдермальних, парентеральних та пероральних препаратів з точним дозуванням.
З точки зору промислової біотехнології, перспективним є впровадження масштабованих методів виробництва CBCF із застосуванням біореакторів і генетично модифікованих мікроорганізмів. Це дозволить забезпечити стабільність якості та чистоти канабіхроманону, а також знизити виробничі витрати порівняно з класичними хімічними методами. Розробка таких біотехнологічних платформ створює передумови для масового виробництва CBCF, що є необхідним для подальшого комерційного і клінічного застосування.
Крім медичних застосувань, CBCF розглядається як перспективний компонент у галузі аграрних технологій і косметології. Його антиоксидантні та протизапальні властивості можуть бути використані для створення інноваційних засобів захисту рослин або в догляді за шкірою, що сприяє зменшенню запальних реакцій та покращенню регенерації тканин. Такі напрями розробок потребують глибоких токсикологічних і фармакологічних досліджень з урахуванням специфіки застосування.
Перспективи наукових досліджень CBCF також пов’язані з інтеграцією мультиомічних підходів (геноміка, протеоміка, метаболоміка) для комплексного аналізу його впливу на біологічні системи. Цей підхід дозволить не тільки виявити нові біомаркери дії CBCF, але й відкрити раніше невідомі механізми регуляції клітинних процесів. В результаті формується фундамент для подальшої розробки комбінованих терапевтичних стратегій із використанням CBCF у складі комплексних медичних протоколів.
Враховуючи глобальну тенденцію до розширення легалізації канабіноїдних препаратів, CBCF може стати об’єктом регуляторного вивчення та стандартизації. Це потребує формування нормативно-правової бази, яка забезпечить контроль якості та безпеки, а також визначення чітких критеріїв для клінічного застосування. Встановлення таких стандартів сприятиме гармонізації наукових підходів і підтримці репутабельності досліджень у цій сфері.
Відзначається також перспективність застосування CBCF у комбінації з іншими канабіноїдами або фармакологічними агентами для синергетичного посилення терапевтичного ефекту. Дослідження міжмолекулярних взаємодій і фармакологічної сумісності відкривають нові можливості для розробки мультикомпонентних препаратів із підвищеною ефективністю і мінімальним ризиком побічних явищ.
Значення для хемотипування канабісу
Хемотипування канабісу є критично важливим інструментом для класифікації ідентифікації різних сортів рослини на основі їх хімічного профілю, особливо щодо канабіноїдів та терпеноїдів. У цьому контексті канабіхроманон (CBCF) відіграє значущу роль як один із маркерів, здатних деталізувати хемотип рослин канабісу з високою точністю. Відсутність або наявність CBCF, а також його кількісне співвідношення з іншими канабіноїдами, надає унікальні відомості про метаболічні шляхи, які домінують у конкретному хемотипі, що суттєво розширює методологічний арсенал дослідників у сфері канабісної ботаніки і хімії.
CBCF, з огляду на його унікальну біосинтетичну походність, є індикатором певних генно-метаболічних особливостей рослини. Виявлення CBCF у хімічному профілі дозволяє розрізняти сорти, які в інший спосіб можуть бути ідентичними за вмістом основних канабіноїдів, таких як THC або CBD. Відтак CBCF додає додатковий рівень деталізації, що є важливим для точного визначення не лише таксономічної приналежності, але й потенційної фармакологічної значущості кожного конкретного хемотипу.
У хемотипуванні важливий аспект – це кількісне і якісне співвідношення канабіноїдів, де CBCF може виступати як “біохімічний підпис” певних штамів канабісу. Його вміст тісно пов’язаний із специфікою активності ключових ферментів, що залучені у синтез канабіноїдів, зокрема ферментів циклізації і редукції. Таким чином, виявлення CBCF дозволяє побудувати більш деталізовану метаболічну карту, яка відображає реальні біохімічні процеси у тканинах рослини.
Поточні дослідження підтверджують, що CBCF часто асоціюється з певними генетичними маркерами, що впливають на експресію ферментів у синтетичних шляхах канабіноїдів. Виявлення цих маркерів у комплексі з визначенням рівня CBCF дозволяє створити багатокомпонентні хемотипові профілі, які мають високу репрезентативність і здатні відображати не лише зовнішні характеристики сорту, але й внутрішню біохімічну унікальність.
Застосування CBCF у хемотипуванні також має важливе практичне значення для контролю якості канабісної сировини. З огляду на постійно зростаючий попит на стандартизовані лікарські препарати з канабісу, наявність чітких і відтворюваних критеріїв хемотипування є необхідною умовою для забезпечення стабільності фармакологічних властивостей кінцевого продукту. Включення CBCF у комплекс аналізу дає змогу здійснювати більш точний контроль походження і чистоти сировини.
Враховуючи вплив факторів зовнішнього середовища на експресію ферментів, що продукують CBCF, цей канабіноїд виступає також як біомаркер реакції рослини на стресові умови, наприклад, зміни клімату, поживного режиму або патогенних впливів. Аналіз рівня CBCF у рослинній тканині допомагає оцінити адаптаційні процеси і якісно характеризувати умови вирощування, що в свою чергу важливо для розробки оптимальних агротехнічних заходів.
Застосування CBCF у хемотипуванні впливає і на селекційні програми, де мета полягає у виведенні нових сортів із заданими фармакологічними профілями. Інтеграція даних про CBCF у селекційні алгоритми дозволяє відбирати генотипи із оптимальним набором метаболітів, що підвищує ефективність селекції і зменшує час на виведення нових перспективних ліній. Це особливо актуально у контексті комерційного вирощування канабісу для медичних цілей.
Важливо зазначити, що CBCF може використовуватись у якості маркера для відокремлення штамів канабісу з низьким або відсутнім психоактивним ефектом, що актуально для фармацевтичної галузі. Наявність або відсутність цього канабіноїду в хемотипі дозволяє оцінювати потенціал сорту з точки зору безпечності і специфічності терапевтичної дії.
З огляду на швидкий розвиток аналітичних технологій, таких як ВЕРХ (високоефективна рідинна хроматографія) у поєднанні з мас-спектрометрією, кількісне визначення CBCF у складі канабіноїдного профілю стало значно доступнішим і точнішим. Це розширює можливості застосування CBCF у системі хемотипування і дозволяє проводити глибокий аналіз складних зразків з високою роздільною здатністю.
Напрями подальших досліджень
Перспективи подальшого вивчення канабіхроманону (CBCF) передбачають комплексний міждисциплінарний підхід, який включає розширення фундаментальних знань про молекулярні механізми його біосинтезу, фармакологічну активність, а також технологічні аспекти одержання і застосування. Одним із ключових напрямів є детальне дослідження ензиматичних процесів, які забезпечують формування CBCF у рослинах канабісу. Попри наявні дані, розуміння специфіки ферментативної активності, включаючи кінетику та регуляцію ферментів, залишається недостатньо повним. Подальший фокус має бути спрямований на ізоляцію, кристалографічне дослідження та мутагенез ключових ферментів, що контролюють циклічну конверсію прекурсорів у CBCF. Ці дослідження створять основу для генетичної модифікації рослин із метою підвищення продуктивності або контролю профілю канабіноїдів.
Відокремленою проблемою є вивчення молекулярної взаємодії CBCF з рецепторами в живих організмах, зокрема канабіноїдними рецепторами типу CB1 та CB2, а також іншими потенційними молекулярними мішенями. Систематичне картування афінності CBCF до різних рецепторів із застосуванням сучасних методів молекулярного докінгу, біофізичних і клітинних моделей дозволить встановити специфіку дії і потенційні шляхи сигналінгу. Додатково необхідне вивчення метаболізму CBCF у біологічних системах, включно з його біодоступністю, фармакокінетикою і метаболічними перетвореннями, що впливають на його фармакодинаміку.
Інший важливий напрямок – розробка і вдосконалення аналітичних методів для кількісного визначення CBCF у складних біологічних та рослинних матрицях. Вдосконалення методів хроматографії з мас-спектрометрією, а також впровадження методів на основі ядерного магнітного резонансу (ЯМР) та інфрачервоної спектроскопії дозволить підвищити чутливість і селективність визначення, знизити межу виявлення та розширити можливості для одночасного аналізу комплексних сумішей канабіноїдів. Ці технологічні вдосконалення будуть критичними для масштабного дослідження різноманіття природних варіацій CBCF у різних хемотипах.
Дослідження також мають бути спрямовані на розкриття екологічних та агротехнічних факторів, які впливають на синтез CBCF у рослинах канабісу. Вивчення впливу умов вирощування, включно з типом ґрунту, освітленням, температурою, водним режимом і використанням добрив, дасть змогу розробити оптимальні стратегії культивації для максимізації виходу CBCF. Розробка таких методик має безпосереднє практичне значення для фармацевтичної промисловості та сільського господарства, особливо в контексті стандартизації сировини і підвищення якості лікарських продуктів.
Особливу увагу слід приділити вивченню потенціалу CBCF у рамках комплексних біоактивних композицій. Експериментальні дослідження комбінаторних ефектів CBCF із іншими канабіноїдами, терпеноїдами та флавоноїдами допоможуть розкрити механізми синергії або антагонізму, які можуть мати критичне значення для терапевтичних застосувань. Подальша оцінка цих взаємодій на молекулярному, клітинному та організменному рівнях відкриє шлях до розробки ефективніших, таргетованих і безпечних препаратів із комплексною дією.
У сфері біотехнологій важливим напрямом стане інженерія мікроорганізмів, здатних синтезувати CBCF у масштабах, які будуть комерційно привабливими. Розробка рекомбінантних систем на основі бактерій, дріжджів або клітин рослин із високою продуктивністю та стабільністю синтезу CBCF вимагає удосконалення генетичних конструкцій, оптимізації умов культивування і масштабування процесів. Використання CRISPR/Cas-технологій для редагування геномів природних продуцентів канабіноїдів може суттєво підвищити вихід CBCF, а також покращити якість кінцевого продукту.
Подальші дослідження повинні охоплювати системний аналіз метаболічних мереж, у які включений CBCF, із застосуванням методів метаболоміки, протеоміки і транскриптоміки. Інтеграція цих даних дозволить створити комплексні моделі регуляції метаболізму канабіноїдів, що відкриє нові можливості для точкового впливу на біосинтез і регуляцію CBCF.
Важливим напрямом є також розробка доклінічних і клінічних досліджень для оцінки фармакологічної ефективності та безпеки CBCF. Враховуючи його потенціал, потрібно розробити стандартизовані методики тестування, включно з моделями на клітинних культурах, органах-мішенях, а також тваринними моделями захворювань. Це дозволить отримати вичерпні дані про терапевтичний потенціал, токсичність, побічні ефекти і оптимальні дози, необхідні для подальшого застосування у медицині.
Крім того, значна увага має бути приділена соціальним, правовим і етичним аспектам, пов’язаним із використанням CBCF. З огляду на складність регуляторних вимог у різних країнах, дослідження впливу правового поля на розвиток наукових і комерційних проєктів є важливим для формування стратегії впровадження нових технологій у виробництво і медичну практику.
Висновок
Канабіхроманон (CBCF) є хімічною сполукою з унікальними структурними і фізико-хімічними властивостями, що належать до групи канабіноїдів – класу природних фенольних метаболітів, характерних для рослин роду Cannabis. Його молекулярна будова відзначається специфічною циклічною конформацією, яка обумовлює особливості хімічної реактивності та біологічної активності. Ретельне вивчення фізико-хімічних характеристик CBCF дозволяє встановити параметри, що визначають його стабільність, розчинність та взаємодію з біомолекулами, що є основою для подальшого наукового і технологічного застосування.
Біогенетичне походження CBCF тісно пов’язане з канабіноїдною біосинтетичною системою, в якій складна взаємодія ферментів і прекурсорів призводить до формування цієї молекули. Особливості ензиматичних механізмів, що відповідають за циклічні реакції та специфічний набір функціональних груп, залишаються предметом активного дослідження. Розкриття точних шляхів синтезу CBCF має фундаментальне значення для контролю і регуляції його утворення у природних джерелах.
Методи одержання CBCF включають напівсинтетичні підходи, повний хімічний синтез та біотехнологічні технології. Кожен із цих методів має свої переваги і виклики: напівсинтетичні шляхи дозволяють модифікувати природні речовини, лабораторний синтез дає можливість створення чистих ізомерів, а біотехнологічні методи, зокрема використання рекомбінантних мікроорганізмів, відкривають перспективи масштабного та екологічно безпечного виробництва. Цей комплексний підхід створює базу для широкого спектру застосувань CBCF у фармацевтиці і промисловості.
Біологічний потенціал CBCF характеризується значною перспективністю в контексті потенційної біоактивності. Незважаючи на обмеженість наявних експериментальних даних, існують підстави вважати, що CBCF може взаємодіяти з різними молекулярними мішенями в організмі, демонструючи різноманітні фармакологічні ефекти. Наукове вивчення цього аспекту потребує подальшого доклінічного і клінічного тестування для підтвердження безпеки та ефективності.
Значення CBCF у хемотипуванні канабісу відкриває нові горизонти у класифікації та стандартизації рослинних сортів на основі детального профілю канабіноїдів. Це сприяє розробці більш точних і контрольованих методів культивації, а також дозволяє створювати продукти із заданими фармакологічними властивостями. Відтак CBCF стає важливим маркером, який доповнює традиційні системи класифікації канабісу.
Подальші напрями досліджень спрямовані на глибше розуміння біохімічних, молекулярних і фармакологічних механізмів дії CBCF, розвиток нових методів його синтезу, вдосконалення аналітичних технологій і розробку клінічно релевантних застосувань. Інтеграція міждисциплінарних досліджень дозволить не лише розширити фундаментальні знання, але й ефективно впровадити CBCF у медицину, фармацевтику та інші галузі, що потребують інноваційних біоактивних сполук.
Таким чином, CBCF є перспективним об’єктом наукових досліджень із значним потенціалом для практичного використання. Його комплексне вивчення відкриває нові можливості для розробки інноваційних терапевтичних засобів і технологічних рішень, підкреслюючи важливість подальшої системної роботи у цій галузі.
Джерела
- Structure-Activity Relationship of Cannabis Derived Compounds for Cannabinoid Receptors.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6099582/ - Cannabichromene (Wikipedia).
https://en.wikipedia.org/wiki/Cannabichromene - Phytocannabinoids: A Unified Critical Inventory.
https://www.nature.com/articles/c6np00074f - Evolution of the Cannabinoid and Terpene Content during the Growth of Cannabis sativa Plants from Different Chemotypes.
https://pubs.acs.org/doi/abs/10.1021/acs.jnatprod.5b00949 - Antitumor Activity of Plant Cannabinoids with Emphasis on the Effect of Cannabidiol on Human Breast Carcinoma.
https://pubmed.ncbi.nlm.nih.gov/16798734/ - Cannabichromene, Related Phytocannabinoids, and 5-Fluoro-cannabichromene Have Anticonvulsant Properties in a Mouse Model of Dravet Syndrome.
https://pubs.acs.org/doi/abs/10.1021/acschemneuro.0c00556