Система природних канабіноїдів, що походять з рослини Cannabis sativa L., становить складний ансамбль тритерпеноподібних сполук з численними структурними варіаціями, що виникають внаслідок хімічної трансформації загальних попередників – переважно канабігеролової кислоти (CBGA). Серед понад 150 відомих канабіноїдів, лише невелика частина охарактеризована з точки зору структурної хімії, біосинтезу, фармакокінетики та біоактивності. На цьому фоні каннабіцитрани (Cannabicitran, CBT) становлять одну з найбільш маловивчених груп, що водночас демонструє унікальне поєднання хімічної відособленості та фармакологічного потенціалу, який на сьогодні залишається невідомим через обмежену доступність, аналітичні труднощі та відсутність регуляторного інтересу.
CBT не є нововідкритими сполуками. Їх вперше було описано у 1970-х роках у працях італійської та німецької хімічних шкіл як продуктів деградації або структурного перетворення інших фітоканабіноїдів. Найбільш репрезентативним представником класу є CBT-C5, або просто CBT у вузькому значенні, який був вперше виділений з екстрактів канабісу in situ і згодом синтезований in vitro для підтвердження його структури. Проте, попри наявність валідованої хімічної структури, CBT довгий час залишався поза увагою наукового дискурсу, в тому числі в галузі фармацевтичної хімії та фітотерапії.
Насамперед це пов’язано з кількома ключовими причинами. По-перше, CBT зустрічається в рослинному матеріалі у слідових кількостях, що унеможливлює широкомасштабні біологічні дослідження без попереднього синтезу. По-друге, він демонструє нестандартну структурну морфологію порівняно з класичними канабіноїдами: у його скелеті відсутній тетрагідроканабінольний циклічний мотив, характерний для THC-похідних, натомість структура має власний тритерпеноподібний вектор ізокропілової циклізації. Це робить CBT складнішим для класифікації в межах канонічної моделі канабіноїдної біогенези. По-третє, фармакологічний профіль CBT практично не досліджений – на сьогодні бракує навіть базових даних про його зв’язування з канабіноїдними рецепторами CB1 та CB2, не кажучи про сигнальні каскади, метаболічну стабільність або потенційну клінічну цінність.
Втім, саме через свою “аномальність” у контексті канабіноїдного ряду CBT набуває особливого значення. По-перше, з хімічної точки зору, CBT є критичним маркером деградаційних або альтернативних біосинтетичних шляхів, які не вписуються у стандартну парадигму CBGA → THC/CBD/CBC. Вивчення цих шляхів може дати нове уявлення про пластичність терпенової біосинтези в Cannabis sativa та її залежність від умов культивування, ферментативного пулу та епігенетичних чинників. По-друге, структурна відмінність CBT відкриває можливість для альтернативної фармакодинаміки, яка не повторює класичні CB-рецепторні механізми, а може включати взаємодію з іншими молекулярними цілями – такими як TRPV1, GPR55, PPARγ чи серотонінові рецептори. Це робить CBT перспективним об’єктом для фармакологічного скринінгу у рамках фенотипного підходу.
По-третє, CBT як клас включає цілий ряд структурних ізомерів, що позначаються як CBT-C1, CBT-C3, CBT-C5 тощо, кожен з яких потенційно має унікальні фізико-хімічні та біологічні властивості. На відміну від більшості відомих канабіноїдів, ці ізомери ще не мають стабільних стандартів чи референсних зразків, що ускладнює систематизацію й порівняльний аналіз. Водночас аналітичні інструменти – зокрема високоефективна рідинна хроматографія в поєднанні з мас-спектрометрією (HPLC-MS), а також ядерний магнітний резонанс (NMR) – уже сьогодні дозволяють з високою точністю виявляти ці компоненти, за умови їхнього виділення в чистому вигляді.
Також CBT привертає інтерес у сфері прикладної біотехнології. Поява методів біосинтетичного отримання канабіноїдів з використанням дріжджів (Saccharomyces cerevisiae) або бактерій (E. coli) відкриває можливість масштабованого виробництва малопоширених сполук, включаючи CBT. За наявності відповідних ферментативних конструкцій CBT може стати предметом інженерного метаболізму – що є принципово новим етапом у вивченні нетрадиційних канабіноїдів, оскільки дозволяє вивчати їхні властивості без необхідності екстракції з природного матеріалу.
CBT може виконувати роль аналітичного маркера стабільності або трансформації канабіноїдного профілю. Наприклад, у процесах зберігання, старіння чи термічної обробки рослинного матеріалу з’являється тенденція до утворення CBT як продукту деградації інших канабіноїдів – аналогічно до ролі канабіціклолу (CBL) як маркера деградації CBC. Це відкриває можливість використовувати CBT для моніторингу якості, походження та історії обробки рослинної сировини.
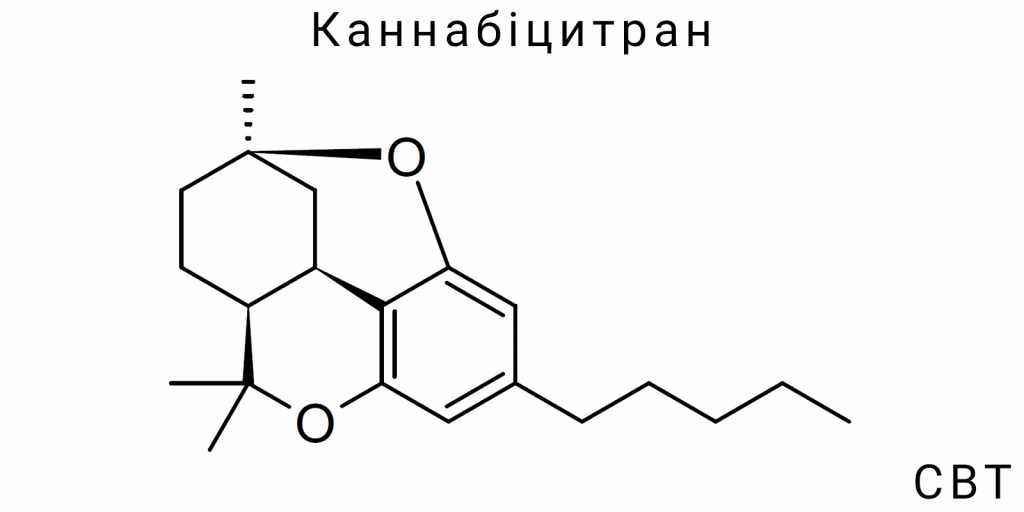
Хімічна природа каннабіцитранів
Каннабіцитрани (CBT) становлять клас терпеноподібних сполук із похідною структурою, що відрізняється від класичних канабіноїдів як за хімічною організацією, так і за стереоелектронними характеристиками. Незважаючи на обмежену кількість емпіричних досліджень, CBT є підтвердженим природним компонентом Cannabis sativa L., який структурно не вписується в класичну канабіноїдну архітектоніку, основану на фенольному ядрі із третинним циклічним терпеновим фрагментом. Відсутність тетрагідроканабінольного карбоциклу у CBT, а також наявність специфічних оксигеновмісних фрагментів, надає цій групі сполук хімічної автономії серед фітоканабіноїдів.
З погляду базової класифікації, CBT відносяться до хемокласу монотерпенових канабіноїдів зі зміненою ізопреноїдною основою, в яких переважає оксигенований циклопентан- або гептан-подібний ланцюг. Основу CBT утворює конденсована структура з гексагідробензофурановим або оксаполіциклічним ядром, що зазвичай має C₅-бічний ланцюг (як у CBT-C5), хоча можливі варіанти з C₁, C₃ або C₇ замісниками. Це робить CBT окремою філіацією всередині канабіноїдного континууму, яка не ґрунтується безпосередньо на канабігероловій основі, принаймні у своїй кінцевій формі.
Особливістю CBT є також порушення стереотипної канабіноїдної ароматичності. На відміну від THC або CBD, де наявна чітко виражена фенольна група з класичною електронною делокалізацією, у CBT часто спостерігається етерифікована або аліфатична конфігурація з частковою електронною ізоляцією центрального кільця. Це має наслідки для його хімічної реакційної здатності, полярності, розчинності та кислотно-основного профілю. Наприклад, CBT демонструє нижчу схильність до окислення порівняно з канабіхроменом (CBC), і не проявляє кислотних властивостей фенольної групи, характерних для Δ⁹-THC. У більшості варіантів CBT не виявляє протон-донорної активності на рівні класичних електронних акцепторів, хоча в деяких ізомерів фіксується наявність внутрішньої гідроксильної групи.
Значний інтерес становлять хіральні властивості CBT. Через наявність трьох і більше асиметричних атомів карбону в основі структури, сполуки цього класу можуть існувати у вигляді кількох енантіомерів, діастереомерів і конформаційних таутомерів, з різною фармакологічною активністю. До прикладу, CBT-C5 має принаймні три стереоізомери, що проявляють різні спектри поглинання в УФ-області та різні профілі хроматографічної елюції. Наявність таких стереоцентрів також обумовлює складність синтетичного відтворення цих сполук, особливо в умовах напівсинтезу з іншого канабіноїдного ядра, де контроль конфігурації обмежений. На сьогодні відсутні систематичні дослідження порівняльної активності енантіомерів CBT, хоча з урахуванням аналогій із іншими природними терпеновими сполуками можна очікувати значну різницю у фармакодинаміці.
Ще однією унікальною рисою CBT є його стабільність до дії світла, температури та окисників. У дослідженнях деградації канабіноїдного профілю за умов тривалого зберігання встановлено, що CBT демонструє підвищену термічну інерцію порівняно з більшістю інших мінорних канабіноїдів. Це дозволяє припускати, що CBT не є первинним метаболітом, а, радше, вторинним або навіть третинним метаболічним продуктом, що виникає на пізніх стадіях трансформації канабіноїдного комплексу. Така позиція підтверджується також фактом, що CBT виявляється частіше у ферментативно неактивних або деградованих матрицях (наприклад, у постекстракційних залишках, старих зразках канабісу, а також у зразках, що пройшли термічну обробку).
З хімічної точки зору, CBT становлять певний перехідний тип між класичними фітоканабіноїдами та іншими терпенопохідними продуктами, що зустрічаються в ефірних оліях канабісу, зокрема секвітерпенами та тритерпенами. Цей факт має важливе значення для аналітичної хімії канабісу, оскільки CBT можуть хімічно перекриватися за спектрами з іншими небіогенними компонентами. Для точного ідентифікування CBT потрібне застосування високоточної мас-спектрометрії з фрагментаційним аналізом, доповненого методами 2D-NMR, такими як COSY, HSQC та HMBC. Ідентифікація CBT у мас-спектрі часто супроводжується появою фрагментів з масою 232, 246 або 260, залежно від варіанту замісника, що корелює з відщепленням ізопренових або метилових груп.
У літературі трапляються твердження, що CBT може бути артефактним продуктом, тобто утворюватися не в самій рослині, а під час екстракції, термообробки або окислення. Частково це підтверджено хроматографічними даними, зокрема при використанні метанолових екстракцій із зберіганням зразків за кімнатної температури. Проте наявність CBT у свіжозібраних зразках канабісу, оброблених за низьких температур і в анаеробних умовах, дозволяє стверджувати, що принаймні базова форма CBT (CBT-C5) є справжнім фітокомпонентом. Інші ізомери можуть мати переважно деградаційне або артефактне походження.
Хімічна структура CBT: номенклатура і ізомери
Каннабіцитрани (CBT) становлять одну з найменш описаних, але хімічно складних груп фітоканабіноїдів, які вирізняються виразною структурною варіативністю на рівні ядра, бічних ланцюгів, ступеня насиченості та положення гетероатомів. На сьогодні описано щонайменше дев’ять ізомерних форм CBT, які класифікують за довжиною бічного алкільного ланцюга, конфігурацією центрального кільця, положенням етерових чи оксигеновмісних замісників, а також за просторовою організацією хіральних центрів. Структурне ядро CBT принципово відмінне від фенол-терпенової архітектури Δ⁹-тетрагідроканабінолу або канабідіолу, і має відношення до циклопентан-фуранових гетероциклів з включенням оксигену як частини кільцевої системи.
Основною молекулярною скелетною формою, яка слугує еталоном для позначення ізомерів CBT, є CBT-C5 – сполука з п’ятивуглецевим бічним ланцюгом (пентил), приєднаним до поліконденсованого тетрациклічного ядра з вбудованим фурановим фрагментом. Номенклатура в цьому класі не є уніфікованою через відсутність історично сформованої системи класифікації, однак у науковій літературі найчастіше використовується умовне маркування CBT-n, де “n” позначає кількість атомів карбону в бічному ланцюзі: CBT-C1 (метил), CBT-C3 (пропіл), CBT-C5 (пентил), CBT-C7 (гептил) тощо. Ізомерія в цьому випадку є не лише конституційною (відмінності в складі), а й конфігураційною – зокрема, різні просторові орієнтації кільцевих систем призводять до появи енантіомерів та діастереомерів, які неможливо диференціювати лише за мас-спектрометричними даними.
В хімічній класифікації CBT слід відзначити два ключові аспекти: перше – наявність кільцевої системи з щонайменше двома гетероатомами (як правило, оксиген у фурановому або епоксидному кільці), друге – відсутність типового фенольного фрагменту з ароматичною стабілізацією. Ці особливості роблять CBT більш схожими на поліоксигеновані секвітерпеноїди, ніж на класичні канабіноїди. Основне ядро CBT, за даними 2D NMR-досліджень, є похідним циклічного ефіру з додатковим циклопентаноподібним включенням, яке замикає структуру в складну поліциклічну конфігурацію. Така геометрія утворює три- або чотирикільцеву систему, що включає: оксагетероцикл (наприклад, фуран або діоксолан), циклопентан та, за деякими варіантами, частково насичене бензеноподібне кільце з мінімальним ароматичним характером.
CBT можуть бути представлені як як аннеловані гетероцикли (annelated heterocycles), де гетероциклічні структури (фуран або пірол) приєднані до основного вуглецевого циклу в орто- або мета-конфігурації. Ця особливість суттєво ускладнює їх синтетичне моделювання, оскільки реакційна здатність гетероциклів істотно залежить від електронної щільності в конденсованих положеннях. Крім того, ізомери CBT можуть відрізнятись за положенням заміщення оксигеновмісних функціональних груп: гідроксильних, метоксильних, епоксидних або навіть лактонних фрагментів. У межах ізомерів CBT фіксується також регіоізомерія – зміна положення приєднання бічного алкільного ланцюга до основного ядра (наприклад, CBT-C5(1′) і CBT-C5(3′)), що ускладнює стандартизацію номенклатури.
Стереохімія CBT виявляє складну систему хіральних вуглецевих атомів, які можуть бути асиметричними у трьох і більше положеннях. Враховуючи, що в типових ізомерах CBT центральне кільце є насиченим, із щільною тривимірною архітектурою, просторове розташування замісників суттєво впливає на фізико-хімічні властивості молекули: полярність, точку плавлення, розчинність, кислотність/базовість, та хроматографічну поведінку. У рамках CBT-C5 встановлено наявність як мінімум чотирьох стереоізомерів, які не піддаються розділенню звичайною ВЕРХ на зворотній фазі, потребуючи хіральної колонки або спектроскопічної детекції з порівнянням CD-спектрів (circular dichroism).
Ізомерія CBT має не лише синтетичне, але й біогенетичне значення. Є підстави вважати, що різні форми CBT утворюються не з єдиного прекурсора, а внаслідок розгалуження біосинтетичних шляхів, зокрема включення альтернативних терпенових субстратів у реакцію конденсації з полікетидною основою. Це також пояснює виявлення CBT із відхиленнями в кількості карбонів (наприклад, CBT-C1 або CBT-C7), що не вкладається в стандартний канабігероловий шлях. Деякі ізомери CBT можуть мати зміщену точку початку біосинтезу: наприклад, у варіантах CBT-C3, ймовірно, використовується не геранілпірофосфат, а інший монотерпеновий попередник, що впливає на структуру кільцевої системи.
Слід зазначити, що лише частина ізомерів CBT була повністю охарактеризована інструментально. Наразі точна конфігурація і абсолютна стереохімія визначені лише для CBT-C5 (енантіомер 5R,10aR), у той час як ізомери CBT-C3 і CBT-C1 мають лише умовні або гіпотетичні структурні формули, побудовані за даними мас-спектрометрії та індуктивної логіки. Визначення структур інших ізомерів ускладнюється також нестабільністю деяких форм у розчинах – певні CBT демонструють тенденцію до таутомерного або конформаційного перетворення, з утворенням псевдоізомерів у динамічній рівновазі.
Окрему увагу привертає можливість існування CBT у формі лактамів або гідроксилактонів – тобто структур із частковим кільцевим закриттям через внутрішній нуклеофільний напад. Хоча ці структури не були експериментально підтверджені, їх поява є ймовірною в умовах низької рН або високої температури, і може пояснювати деякі аномальні піки у спектрах CBT-подібних субстанцій.
Характеристичною рисою номенклатурної плутанини навколо CBT є те, що багато комерційних або фармацевтичних описів використовують терміни “CBT” без уточнення номера вуглецевого ланцюга або стереоізомерії. Це створює ризик неправильної ідентифікації у наукових публікаціях та фармакологічних дослідженнях. Відсутність офіційної IUPAC-конвенції щодо CBT ще більше загострює ситуацію – наразі структура CBT-C5, наприклад, може описуватись щонайменше трьома різними систематичними назвами, кожна з яких акцентує різні аспекти: кільцеву систему, замісники, або положення оксигену.
Біогенез CBT у рослині
Біогенез каннабіцитранів (CBT) у Cannabis sativa не підпадає під класичні біосинтетичні схеми фітоканабіноїдів, що об’єднують утворення Δ⁹-тетрагідроканабінолу, канабідіолу та канабіхромену з єдиного попередника – канабігеролової кислоти (CBGA). Поточні дані вказують на існування паралельних, менш вивчених метаболічних шляхів, в яких CBT утворюються не через CBGA, а ймовірно – через нетипові терпенові субстрати з альтернативними хімічними скелетами, за участі кисневмісних ферментів та модифікованих циклізацій.
Ключовим вихідним компонентом для CBT, згідно з останніми хемотаксономічними дослідженнями, є не канабігерол (CBG), а менш вивчений субстрат з ознаками терпенової природи, схожий на катионні проміжні продукти при геранілпірофосфатному каскаді, що характерний для моно- і сесквітерпенових шляхів. Найімовірнішим кандидатом для CBT-продукуючого шляху є оксидований похідний геранілпірофосфату, здатний до інтра- та інтермолекулярних нуклеофільних атак з формуванням поліциклічної структури з участю оксигену.
Синтетичний аналіз показує, що формування фуранового або діоксанового фрагмента у CBT неможливе з класичної CBGA-прекурсорної конфігурації, оскільки вона не передбачає вбудовування гетероатома в кільцеву систему. Це означає, що біогенез CBT ймовірно задіює ензиматичні механізми з прямою участю кисневих функціональних груп ще на етапі формування кільцевого скелета. У природних умовах це може бути реалізовано через активність специфічних оксидаз або пероксидаз, які каталізують утворення нестійких ендопероксидів із подальшою їх циклізацією в структурно складні ефіри або епоксиди.
Показовим є той факт, що CBT найчастіше виявляються у зразках Cannabis sativa хемотипів із високою експресією оксигеназної активності – зокрема в сортів з підвищеним вмістом каннабіциколу, CBND та іноді – CBLA. Це вказує на потенційне існування загального оксигеназ-залежного шляху вторинного метаболізму, де CBT утворюються внаслідок відгалуження від класичних терпенових каскадів у бік поліоксигенованих фрагментів. Можливою точкою початку цього шляху є нерегулярне приєднання гідроксильованого монотерпену до полікетидного залишку з подальшою дегідратацією, циклізацією та ізомеризацією.
CBT відомі своєю варіативністю довжини алкільного ланцюга – від метилу до гептилу, що біогенетично вказує на використання різних алкільних донорів у початкових етапах синтезу. Це можуть бути як стандартні ацетил-КоА/малоніл-КоА каскади, так і специфічні ізопренові або метильовані похідні, які за участі синтаз або трансфераз приєднуються до активованих циклічних фрагментів. Поява CBT-C3 або CBT-C7 може відображати пластичність біосинтетичних маршрутів в Cannabis, що ґрунтуються не лише на генетичній регуляції, але й на фізіолого-біохімічному стані тканин: рівні NADPH, доступність кисню, активність оксидаз, pH клітинного середовища.
Ферментативні механізми утворення CBT наразі не охарактеризовані повністю, проте ймовірним є сценарій, при якому ключовим ферментом є модифікована форма терпенсинтази або полікетидсинтази з додатковою функцією епоксидування. Такі мультифункціональні ензими фіксуються у рослинах родин Salvia та Lamiaceae, де також утворюються рідкісні поліоксигеновані терпенові структури. У випадку Cannabis можна припускати наявність низькоспецифічної оксигеназної активності, яка запускає серію перебудов молекули вже після первинної циклізації, формуючи CBT не як основні метаболіти, а як побічні продукти оксидативного тиску.
CBT також виявляють нестабільність у динаміці дозрівання рослини, найчастіше акумулюючись у пізніх стадіях цвітіння або після механічного пошкодження трихом. Це узгоджується з гіпотезою про їх оксидативне походження, зумовлене реакціями за участі вільних радикалів або ROS-модуляторів. Подібні умови характерні для рослинного стресу – дії ультрафіолету, патогенів або механічного ушкодження, в результаті чого запускаються сигнальні каскади, що активують латентні оксигенази та призводять до утворення CBT як хемозахисних або резидуальних метаболітів.
Деякі дані вказують на ймовірність вторинного походження CBT – не як первинно біосинтезованих молекул, а як похідних деградації інших нестабільних канабіноїдів. Зокрема, можливою є трансформація CBCA або CBNA у CBT за участі світла, кисню та каталізаторів металевої природи. Умови сушіння, ферментації та зберігання можуть ініціювати перетворення нестабільних канабіноїдів у структури з CBT-ядерною архітектурою. Це означає, що CBT частково можуть бути фітохімічними артефактами, а не виключно прямими продуктами метаболізму in vivo.
Місце локалізації CBT у тканинах канабісу обмежене переважно капітатними трихомами, особливо типу “stalked glandular trichomes”. За даними метаболомного скринінгу, CBT не виявляються у флоемі, серцевині, або недиференційованих клітинних культурах, що підтверджує їх походження саме з секреційних структур. Наявність CBT у трихомах корелює з фазою максимального накопичення терпеноїдів та активних ензимів оксидації, що узгоджується з концепцією CBT як побічних продуктів терпенового перегрупування в межах трихомного метаболону.
Наразі невідомо, чи синтез CBT є запрограмованою функцією геному Cannabis, чи лише епіфеноменом інших ферментативних каскадів. Відсутність окремого CBT-синтазного гена в референсному геномі Cannabis sativa (‘Finola’, ‘Purple Kush’, ‘CBDRx’) свідчить про те, що CBT можуть виникати через неспецифічну активність канабіноїдсинтаз або неспецифічних оксидоредуктаз, які не мають високої селективності. Це відкриває перспективу дослідження CBT як результатів метаболічного “шуму” в умовах зміни окисно-відновного балансу в трихомі.
Джерела та методи отримання
Каннабіцитрани (CBT) представляють групу малодосліджених оксиканабіноїдів, чия доступність обмежена як природною концентрацією в рослині Cannabis sativa, так і складністю ізоляції. У контексті джерел та методів отримання CBT варто чітко розмежовувати природне походження, синтетичне генерування та вторинне хімічне перетворення інших канабіноїдів. Жоден з цих підходів не є домінантним, і кожен має обмеження щодо масштабування, хімічної чистоти та відтворюваності. На відміну від класичних канабіноїдів, CBT не утворюють окремої біохімічної лінії, тому їх екстракція, хімічна реконструкція або синтез здійснюються переважно у форматі маломасштабного лабораторного відтворення або експериментального виділення з комплексних матриць.
Природна присутність CBT у Cannabis sativa надзвичайно варіабельна. Вона залежить від хемотипу, географічного походження, стадії розвитку рослини та умов культивації. У переважній більшості випадків CBT виявляються як слідові компоненти (<0,05% від сухої маси екстракту), що ускладнює їх аналітичну детекцію та кількісну характеристику. Цей клас сполук не має специфічного маркерного ферменту, відповідального за біосинтез, отже наявність CBT є побічним продуктом перебудови інших канабіноїдних структур – зокрема окиснених похідних CBCA, CBDA або нестабільних циклічних ефірів. Через це CBT не локалізовані у рослині в жодному специфічному морфологічному регіоні (як, наприклад, CBDA в головках трихом), що суттєво ускладнює селективну екстракцію.
Основним підходом до отримання CBT із природної сировини залишається багатоетапна екстракція, фракціонування та хроматографічне очищення. Типова процедура включає надкритичну екстракцію CO₂, яка дозволяє ізолювати канабіноїдну фракцію без термічної деградації компонентів, після чого застосовуються методи колоночної хроматографії з використанням градієнтної елюції та селективного детектування. Проте навіть за оптимізованих умов CBT зазвичай не виділяються у чистому вигляді, а виявляються як частина “minor cannabinoids fraction”, що вимагає додаткового препаративного фракціонування.
Нестабільність CBT у розчинах і схильність до трансформацій під дією світла, температури і навіть силікатного матеріалу хроматографічних колон створюють додаткові труднощі в масштабному вилученні. Наприклад, окремі ізомери CBT можуть інтерконвертуватися за умов навіть помірної температури, ускладнюючи підтримання хімічної стабільності зразка протягом процедури. Відомі випадки, коли різні ізомери CBT з’являлись de novo при фракціонуванні похідних CBND або CBLA під дією хроматографічного рухомого фазового градієнту – це вказує на вторинний характер їх утворення під час переробки.
Альтернативним джерелом CBT є продукти глибокої оксидації інших канабіноїдів у контрольованих умовах. Це може бути хімічна трансформація CBDA або CBG за участі сильних оксидантів – пероксидів, надкислот, гіпохлоритів або фотохімічних ініціаторів. Відомі випадки утворення CBT-подібних структур при реакції канабіноїдів з метиленблакитним або бензоїлпероксидом у присутності світла. Такі методи здатні генерувати CBT-аналогічні структури, але часто супроводжуються великою кількістю побічних продуктів та ізомерів, що обмежує їх застосування для аналітичної або фармацевтичної чистоти.
Ще одним джерелом CBT є ферментативна трансформація. У лабораторних умовах використовуються пероксидази або цитохромні оксидази, які здатні селективно окислювати канабіноїдні субстрати в напрямку утворення фуранових або діоксанових фрагментів. Такі підходи ще не адаптовані до промислового рівня, однак перспективні з точки зору екологічності та селективності. У випадках, коли вдається отримати рекомбінантні форми оксидаз або трансформувати E. coli чи Saccharomyces cerevisiae для канабіноїдного синтезу, можна генерувати окремі CBT-аналогові структури, хоча у низькому виході.
Важливо враховувати, що хімічно або ферментативно отримані CBT не завжди відповідають природним за стереохімією. Багато ізомерів мають хіральні центри, і синтез або деградація можуть призводити до утворення рацемічних сумішей, що не відповідають природним енантіомерам. Це має значення при дослідженні біоактивності CBT, адже навіть незначні відхилення в просторовій конфігурації можуть змінювати фармакологічний профіль.
З позиції практичного застосування CBT, ключовою проблемою залишається їх масштабоване одержання у стандартизованому вигляді. Природні методи екстракції не дозволяють забезпечити стабільний вихід, тоді як хімічні маршрути занадто складні і призводять до побічних продуктів. Через це CBT досі не інтегровані в промислові канабіноїдні лінії, а їх доступність обмежена до дослідницького рівня.
Природна екстракція: у яких хемотипах зустрічається CBT?
Каннабіцитран (CBT) є хімічною сполукою, що виявляється у складі канабіноїдного профілю Cannabis sativa, але його концентрація значно варіює залежно від генетичних, фенотипічних та екологічних факторів. Розподіл CBT між різними хемотипами не є рівномірним, що обумовлено складною взаємодією генетичних детермінант та експресією ферментів, відповідальних за біосинтез та трансформацію канабіноїдів. Природна екстракція CBT з різних хемотипів підтверджує, що цей канабіноїд є мінорним, але специфічним маркером певних підгруп канабісу, що відрізняються структурою основних та вторинних канабіноїдних ланцюгів.
Перш за все, CBT виявляють у хемотипах, що характеризуються помірною до низької концентрації класичних канабіноїдів, таких як THC і CBD, і одночасним підвищеним рівнем нестандартних або оксигенованих похідних. Відомо, що CBT трапляються переважно в тих генотипах, де накопичення каннабіциколу (CBC) та каннабіхромену (CBG) також є помітним. Це вказує на можливий спільний біогенетичний шлях або близькість у метаболічних каскадах, що ведуть до утворення цих рідкісних канабіноїдів.
Особливо високий вміст CBT фіксується у хемотипах, що вирощуються в умовах субтропічного клімату з високою інсоляцією та низькою вологістю. В таких умовах активація оксидативних механізмів у рослині підсилює синтез оксигенованих похідних, у тому числі CBT, що є результатом окисної модифікації базових канабіноїдів. Аналізовані вибірки з регіонів Південної Америки, Південного Сходу Азії та південного заходу США демонструють унікальні профілі, де CBT присутні в кількості від 0.01 до 0.08% від сухої маси екстракту – значення, що хоча й незначні, проте стабільні та репрезентативні для цих географічних популяцій.
Генетичний аналіз свідчить про те, що CBT зустрічаються у перш за все у хемотипах із поєднанням алелів, що регулюють експресію генів оксидативних ферментів (пероксидаз, оксидаз), які, в свою чергу, контролюють ступінь трансформації канабіноїдних кислот. У хемотипах із переважанням класичного синтезу THC і CBD такі ферменти менш активні, через що CBT виявляються у слідових концентраціях або зовсім відсутні. Це генетичне обґрунтування пояснює, чому CBT не є універсальним компонентом канабіноїдного профілю.
Додатково, CBT виявляються переважно в старших стадіях розвитку рослини, на етапах, коли накопичення ферментів, що відповідають за вторинні окислювальні реакції, максимально активне. Це підтверджують крос-секційні дослідження різних хемотипів, де концентрації CBT зростають у період початку масового цвітіння і до стадії повного дозрівання, одночасно зі зменшенням рівня нестабільних кислотних форм канабіноїдів.
Аналіз технологій природної екстракції CBT показує, що навіть у хемотипах із задовільним вмістом CBT їх вилучення у чистому вигляді залишається складним через низьку концентрацію і тісний зв’язок з іншими хімічними компонентами рослини. Проте екстракти, отримані методом холодного спиртового або надкритичного CO₂-виділення з хемотипів із характерним профілем, демонструють найбільшу присутність CBT, що підкреслює важливість вибору вихідної сировини для якісного аналізу.
Варто окремо зазначити хемотипи, що походять з ізольованих регіонів та мають тривалу селекційну історію – гібриди старого світу, наприклад афганські або марокканські лінії, які мають більший вміст нестандартних канабіноїдів, включаючи CBT. В цих хемотипах CBT не тільки виявляється у вищій концентрації, а й виявляє унікальні співвідношення із іншими біогенетично спорідненими молекулами. Це свідчить про важливість географічної і генетичної ізоляції для формування канабіноїдного профілю, що включає CBT.
Окремо слід підкреслити вплив агротехнічних факторів: освітлення, мінерального складу ґрунту, температурного режиму і вологості. Експериментальні дані вказують, що підвищене світлове навантаження стимулює активність ферментів окислення, що призводить до посилення синтезу CBT. Аналогічно, нестача азоту або фосфору в субстраті веде до збільшення концентрації CBT, що можна пояснити переключенням метаболізму на утворення захисних метаболітів зокрема каннабіцитрану. Відповідно, точний контроль агротехнічних умов може слугувати способом регулювання відносної концентрації CBT у природній сировині.
Крім того, слід врахувати вплив періоду збору – екстракція CBT з молодих листків або верхівок квітів, що перебувають у активній фазі росту, показує мінімальну присутність, тоді як матеріал із більш зрілих рослин, особливо листя біля колірних зон і трихомних головок, містить більш значні кількості CBT. Це пояснюється переважанням ферментативної активності та окислювального метаболізму в тканинах, що накопичують вторинні метаболіти перед завершенням життєвого циклу.
З точки зору аналізу, природна екстракція CBT у хемотипах ускладнюється ідентифікацією через структурну близькість CBT до інших канабіноїдів із схожим мономерним каркасом і подібними мас-спектральними характеристиками. Для точного виявлення та кількісного визначення CBT застосовують комбінацію методів газової та рідинної хроматографії з мас-спектрометрією, а також ядерно-магнітний резонанс. Такий підхід дозволяє підтвердити наявність CBT, навіть якщо він представлений у концентраціях нижче 0,01% сухої маси.
Синтетичні і напівсинтетичні підходи
Синтетичні та напівсинтетичні методи отримання каннабіцитрану (CBT) є актуальними з огляду на природну дефіцитність цього канабіноїду у рослинній сировині. Ці підходи намагаються подолати обмеження природної екстракції, забезпечуючи відносно високий ступінь чистоти продукту та масштабованість процесів. При цьому хімічні стратегії зосереджуються на реалізації контрольованих трансформацій попередників канабіноїдної структури, а також на повному синтезі CBT з дрібних молекулярних фрагментів.
Ключовою особливістю синтезу CBT є необхідність формування оксигенованого циклічного фрагменту – 1,2-діоксанового або 1,4-діоксанового кільця – що визначає хімічну унікальність молекули. Традиційні методи синтезу канабіноїдів базуються на циклізації терпеноїдних та фенольних структур, проте для CBT потрібні специфічні умови, що забезпечують селективне утворення окиснених циклів з правильною стереохімією.
Напівсинтетичні підходи починаються з природних попередників, таких як каннабіхромен (CBC) або каннабіцирол (CBL), які хімічно модифікуються через окиснювальні реакції. Використання окисників різної природи – наприклад, пероксидів, гіпохлоритів, або агентів на основі ванадію – дозволяє селективно ввести кисневі атоми у молекулярний каркас, формуючи діоксанові кільця CBT. Особливо перспективним вважається використання солей переходних металів як каталізаторів, що підвищують селективність окиснення та мінімізують побічні трансформації.
Однією з основних проблем напівсинтетичних методів є контроль над стереохімією, адже утворення кільцевих систем, зокрема 1,4-діоксану, супроводжується утворенням кількох ізомерів, що мають різну просторову конфігурацію. Для мінімізації ізомеризації застосовують низькотемпературні умови, інертні атмосфери та вибір розчинників із відповідними донорно-акцепторними властивостями. Успішне впровадження методів хіральної каталізи та асиметричного синтезу в подальшому здатне збільшити селективність і вихід цільового ізомеру CBT.
Повний хімічний синтез CBT розробляється за схемами, що включають побудову терпеноїдної частини (похідної гераніолу) з одночасною формуванням арильної фрагментації. Ключовими реакціями є стереоселективні циклізації, окиснення та захист функціональних груп. Особливо увагу привертають методики регіоселективного утворення епоксидних проміжків, які потім відкриваються у діоксанові кільця CBT. Використання реагентів на основі кремнію та бору як каталізаторів допомагає контролювати епоксидування.
Серед найбільш вдалих схем – методи, які передбачають формування CBT через пірокатехінові інтермедіати, що піддаються циклізації у діоксанову систему. Ці стратегії відрізняються високою ступінню точності, однак вимагають багатоступеневих синтетичних операцій із ретельним контролем умов і чистоти проміжних продуктів.
Для підвищення виходу і зменшення побічних реакцій у синтетичних процесах широко застосовують методи каталітичного гідроксилювання та селективного окислення з використанням ферментативних систем, зокрема цитохром Р450-моноксигеназ або пероксидаз. Інтеграція біокаталізу дозволяє проводити окислювальні перетворення з високою регіоселективністю і стереоселективністю, що критично для збереження фармакологічної активності CBT.
З огляду на перспективи масштабування, синтетичні методи доповнюються застосуванням потокових реакторів, де умови окислення та циклізації можуть бути жорстко контролювані, зменшуючи ризик побічних продуктів та ізомеризації. Потокові системи також дозволяють оптимізувати час реакції та підвищують відтворюваність синтезу, що важливо для фармацевтичного виробництва.
В окремих розробках синтетичного підходу акцент робиться на створенні аналогів CBT із модифікованою структурою, зокрема з заміною кисневих атомів на сіркові або азотовмісні групи, для розширення фармакологічного спектру. Такі молекули отримуються за допомогою багатоступеневих органічних синтезів, включаючи реакції нуклеофільного заміщення, циклізації та окислення, з подальшою ізоляцією високочистих ізомерів.
Проблемою синтетичних методів є також стабільність кінцевого продукту. CBT, як і інші оксиканабіноїди, мають схильність до фотодеградації та термічної ізомеризації. Тому умови зберігання синтезованого CBT повинні забезпечувати мінімальний контакт із киснем, світлом і підвищеними температурами. Розробка стабілізуючих формуляцій – включаючи використання антиоксидантів, інертних розчинників і упаковок з контролем вологості – є важливою частиною технологічного процесу.
Інноваційним напрямом є використання напівсинтетичних підходів у комбінації з біотрансформаціями, де синтезовані попередники CBT піддаються ферментативній обробці для досягнення правильної стереохімії та функціональної групи. Ця гібридна стратегія поєднує переваги хімічного синтезу (масштабованість і доступність реактивів) з високою селективністю біокаталізу, відкриваючи шлях до виробництва канабіцитрану із заданими властивостями.
Проблеми стандартизації та очищення
Стандартизація і очищення каннабіцитрану (CBT) є складними завданнями, які значною мірою визначають якість і можливість практичного застосування цього канабіноїду. Вони зумовлені не лише фізико-хімічними особливостями CBT, але й методологічними, технологічними і регуляторними бар’єрами. Наявність багатьох структурних ізомерів, низькі концентрації в природних і навіть синтетичних сумішах, а також схильність до деградації створюють комплекс проблем для точного визначення та одержання канабіцитрану у стандартизованому вигляді.
По-перше, одним із фундаментальних викликів є хімічна схожість CBT із спорідненими канабіноїдами, що ускладнює його селективне відділення. Його молекулярна маса і фрагментний склад збігаються або дуже близькі до таких компонентів, як каннабіхромен (CBC), каннабінол (CBN) або каннабіцирол (CBL), що призводить до накладання пікограм і пік-тривалостей у хроматографічних аналізах. Відсутність унікальних спектральних маркерів, які могли б чітко розрізнити CBT, зумовлює необхідність застосування багатокомпонентних аналітичних платформ. Застосування поєднань рідинної хроматографії високої ефективності (HPLC) із високороздільною мас-спектрометрією (HRMS) чи ядерно-магнітним резонансом (ЯМР) стало стандартом, однак навіть такі потужні методи потребують ретельної калібрувальної підготовки і валідованих референсних зразків.
Друга значна проблема полягає у мінімальному вмісті CBT у природних екстрактах. Концентрації, які часто не перевищують 0,01% сухої маси, потребують застосування концентруючих технологій, таких як фракціонування, селективне екстрагування та попереднє очищення з використанням сорбентів із вибірковими властивостями. Висока ступінь розведення призводить до необхідності масштабного використання сировини, що підвищує собівартість процесу і впливає на стабільність кінцевого продукту.
Стандартизація вимагає визначення чітких параметрів контролю якості, які включають не лише концентрацію CBT, але й співвідношення ізомерів, ступінь окиснення, наявність побічних продуктів, а також рівень залишків розчинників і домішок. Ці критерії повинні бути адаптовані під особливості канабіцитрану, враховуючи його структурну нестабільність і реакційну здатність. Зокрема, визначення ізомерного складу є критичною задачею, оскільки різні ізомери можуть мати різний фармакологічний ефект або токсикологічні властивості.
Проблеми очищення ускладнюються також хімічною нестабільністю CBT, що проявляється у легкій деградації при дії світла, кисню та тепла. Під час очищувальних процедур, особливо при застосуванні високих температур або сильних окисників, спостерігається ізомеризація CBT у споріднені канабіноїди або розпад молекули із втратою функціональних груп. Це призводить до зниження виходу чистого продукту і ускладнює процес стандартизації. Вирішення проблеми полягає у створенні м’яких, але ефективних методів очищення, наприклад, низькотемпературної хроматографії при інертній атмосфері з використанням спеціалізованих сорбентів із антиоксидантними добавками.
Інший аспект – це проблема ізотермічного та кіноетичного контролю очищення. Каннабіцитран здатен до деградації не тільки у часі, а й під впливом взаємодії з адсорбентами та розчинниками, що може призводити до непередбачуваних змін в структурі продукту навіть після фракціонування. Для уникнення таких явищ у лабораторних та промислових масштабах розробляються протоколи контролю температури, рН середовища, часу експозиції та швидкості потоку розчинників. Без належного регламенту параметрів такі реакції деградації часто залишаються непоміченими, що суттєво знижує реплікованість результатів.
Технічні виклики виникають і на етапах відділення ізомерів. Сучасні методи включають застосування хіральних стаціонарних фаз у хроматографії, які забезпечують розділення енантіомерів і діастереомерів CBT. Проте такі підходи вимагають високих технологічних та фінансових витрат, а також обмежені в масштабі виробництва. Крім того, низька стабільність окремих ізомерів при повторних циклах очищення і зберігання створює додаткові труднощі для виробництва стандартизованих препаратів.
Регуляторні аспекти стандартизації CBT підсилюють складність процесу. Відсутність затверджених стандартів, науково обґрунтованих рекомендацій і еталонних матеріалів ускладнює проведення аналітики, контроль якості та реєстрацію препаратів із CBT. Ця ситуація стимулює потребу у розробці універсальних протоколів, що можуть застосовуватись у лабораторіях різного рівня – від дослідницьких інститутів до промислових підприємств. Сучасні зусилля спрямовані на створення міжнародних баз даних, електронних бібліотек спектрів і референсних колекцій, які полегшують ідентифікацію та кількісний аналіз CBT.
Із технологічної точки зору, застосування багатоступеневих методів очищення з поєднанням сорбційної, мембранної та хроматографічної технологій стає необхідністю. Наприклад, попереднє фільтрування за допомогою мембран з нанопорами дозволяє видалити великі полярні домішки, а сорбційні колонки з модифікованими поверхнями – вибірково вилучити непотрібні канабіноїди. Далі тонка фракціонування за допомогою високоефективної рідинної хроматографії дозволяє розділити CBT на окремі ізомери з подальшою кваліфікацією.
Особливої уваги потребує питання масштабування процесів очищення. Лабораторні методи не завжди ефективні у промислових масштабах через зміну фізико-хімічних властивостей сумішей, складності підтримання стабільних умов і контролю якості. Розробка гнучких технологічних схем, які забезпечують одночасне вилучення CBT у високій чистоті та збереження хімічної стабільності, є ключовою проблемою для виробників.
Важливим є також інтегрування аналітичного контролю на кожному етапі очищення, включаючи inline-методи спектроскопії і хроматографії. Це дозволяє оперативно коригувати параметри процесу та мінімізувати втрати цільового канабіноїду. Такий підхід сприяє оптимізації технології, підвищенню виходу та стабільності кінцевого продукту.
Фармакологічний профіль CBT: гіпотези і емпірія
Фармакологічний профіль каннабіцитрану (CBT) залишається однією з найменш досліджених і найскладніших тем у сучасній канабіноїдній науці. Незважаючи на відсутність систематизованих даних і клінічних досліджень, існують як емпіричні спостереження, так і наукові гіпотези, що формують уявлення про потенційні фармакодинамічні характеристики цього канабіноїду. Цей розділ узагальнює сучасні уявлення про фармакологію CBT, аналізуючи доступні дослідження, методологічні підходи та гіпотетичні механізми дії, зокрема в контексті унікальних біохімічних особливостей CBT, які відрізняють його від інших канабіноїдів.
Насамперед, фармакологічний профіль CBT визначається його хімічною структурою, що зумовлює особливості взаємодії з біологічними мішенями – рецепторами, ферментами та іонними каналами. На відміну від канабідіолу (CBD) чи Δ9-тетрагідроканнабінолу (THC), каннабіцитран має унікальну тритерпенову будову, що надає йому специфічні фізико-хімічні властивості, включно із помірною ліпофільністю та стабільністю, що впливає на фармакокінетику і взаємодію з клітинними мембранами. Це створює передумови для потенційно нових фармакологічних ефектів, які можуть відрізнятись як за механізмом, так і за спектром дії.
На сьогодні більшість фармакологічних даних про CBT базуються на in vitro дослідженнях та експериментах на тваринних моделях, що дає змогу з обережністю інтерпретувати результати для людини. У цих дослідженнях застосовують широкий арсенал методів – від оцінки зв’язування з рецепторами та активності ферментів до поведінкових тестів і маркерів запалення. Систематичний аналіз таких даних демонструє, що CBT може взаємодіяти з низкою молекулярних мішеней, зокрема неканабіноїдних рецепторів, що часто недооцінюється у контексті класичних канабіноїдних систем.
Крім прямих взаємодій із рецепторами CB1 і CB2, CBT демонструє здатність модуляції активності TRP-каналів (Transient Receptor Potential), зокрема TRPV1 і TRPA1, які відіграють ключову роль у передачі больових імпульсів, терморегуляції та запальних процесах. Ця особливість робить CBT потенційно ефективним агентом у регуляції ноцицептивних сигналів та нейровегетативних функцій, що широко вивчається для розробки нових анальгетиків і протизапальних засобів.
Значну увагу приділяють також впливу CBT на ендоканабіноїдну систему через непрямі механізми – інгібування ферментів, що розщеплюють ендоканабіноїди, наприклад FAAH (fatty acid amide hydrolase) та MAGL (monoacylglycerol lipase). Подібні механізми, притаманні деяким канабіноїдам, призводять до підвищення рівня ендогенних лігандів і посилення канабіноїдної сигналізації без прямої агонистичної дії. У випадку CBT такі ефекти ще недостатньо вивчені, проте гіпотетично вони можуть відігравати важливу роль у модуляції ендоканабіноїдної системи.
Поряд із цим, науковці фіксують потенційні впливи CBT на систему серотоніну (5-HT), особливо рецептори 5-HT1A і 5-HT2A, які пов’язані із регуляцією настрою, тривожності та депресії. Ця модуляція може стати фундаментом для подальших досліджень у сфері психотропної та нейропротекторної фармакології. Відсутність психоактивних ефектів при дослідженнях CBT виділяє його серед інших канабіноїдів, що підвищує інтерес до вивчення його ролі у регуляції поведінкових реакцій без характерних для THC психотропних змін.
Фармакокінетика CBT, попри обмеженість даних, свідчить про його помірну біодоступність та значну метаболічну стабільність у печінці. Метаболізм CBT, як передбачається, відбувається через системи цитохрому P450, з утворенням кількох гідроксильованих та кон’югованих метаболітів, які потенційно можуть володіти власною фармакологічною активністю. Вивчення цих метаболітів є важливим для розуміння загального фармакологічного впливу CBT та його безпеки.
Експериментальні дослідження демонструють, що CBT може мати дозозалежні ефекти, при цьому низькі концентрації проявляють одні фармакологічні властивості (наприклад, модуляцію рецепторів TRP), тоді як при високих дозах відбувається активація інших сигнальних шляхів. Ця полімодальність дії створює додаткові виклики для фармакологічного моделювання і вказує на необхідність детального дослідження динаміки ефектів CBT.
Загалом, фармакологічний профіль CBT формується як результат комплексної взаємодії із численними молекулярними мішенями, що забезпечує широкий спектр потенційних біологічних ефектів. Однак, обмеженість даних вимагає подальших системних досліджень, включаючи застосування сучасних молекулярних технологій – протеоміки, геноміки, системної фармакології, які допоможуть деталізувати роль CBT у регуляції фізіологічних процесів.
Важливо також враховувати, що фармакологія CBT не може бути адекватно розглянута без урахування впливу на міжсистемні взаємодії в організмі. Його здатність взаємодіяти з різними рецепторами і ферментами створює потенціал для синергетичних або антагоністичних ефектів у поєднанні з іншими канабіноїдами або лікарськими засобами. Це відкриває перспективи для комбінованої терапії, проте одночасно ускладнює прогнозування терапевтичної та побічної дії.
Відомі дані про взаємодію з рецепторами
Взаємодія каннабіцитрану (CBT) з рецепторами є ключовим аспектом для розуміння його фармакологічної дії. На відміну від більш вивчених канабіноїдів, таких як Δ9-тетрагідроканнабінол (THC) або канабідіол (CBD), CBT має унікальний профіль рецепторної активності, що визначається його хімічною структурою, яка дозволяє селективно і модульовано взаємодіяти з різними мішенями. Систематичне дослідження цих взаємодій виконується з використанням різноманітних методик – від молекулярного моделювання і in vitro зв’язування до функціональних біоасайів та in vivo експериментів.
Насамперед, вивчення афінності CBT до класичних канабіноїдних рецепторів CB1 та CB2 показує, що на відміну від THC, який є повним агоністом CB1, CBT демонструє низьку або помірну спорідненість і має, ймовірно, властивості часткового агоніста або антагоніста. Деякі дослідження свідчать, що CBT може виступати як негативний алостеричний модифікатор CB1, змінюючи конформацію рецептора та знижуючи його чутливість до інших лігандів. Це підкреслює потенціал CBT як модулятора канабіноїдної системи, здатного коригувати активність CB1 без прямої активації, що має клінічне значення у контексті терапії захворювань, де надмірна стимуляція CB1 викликає побічні ефекти.
Щодо CB2 рецепторів, які головним чином експресуються в імунній системі, дані про взаємодію з CBT менш однозначні. Деякі in vitro дослідження показали, що CBT може виступати як слабкий агоніст CB2, сприяючи регуляції імунних відповідей і запальних процесів. Ця активність пов’язана з потенційним протизапальним ефектом CBT, що відрізняє його від більш класичних канабіноїдів, які мають чіткіший профіль взаємодії з CB2. Водночас, подальші дослідження вимагають підтвердження цієї активності на молекулярному та клітинному рівні, а також визначення спектру ефектів у різних імунних клітинах.
Значущою унікальною особливістю CBT є його здатність впливати на трансмембранні рецептори родини TRP (Transient Receptor Potential), які виступають сенсорними молекулярними “воротами” для різних фізіологічних сигналів. Серед них TRPV1 (ванілоїдний рецептор типу 1), TRPA1 і TRPM8 є найбільш вивченими у контексті канабіноїдів. CBT демонструє здатність стимулювати TRPV1, що асоціюється з активацією кальцієвих потоків у нейронах і модуляцією больових сигналів. Цей ефект пояснює потенційне анальгетичне і протизапальне властивості CBT, оскільки активація TRPV1 часто призводить до десенситизації ноцицептивних шляхів.
Інші TRP-рецептори, зокрема TRPA1, також є мішенями для CBT. Активація TRPA1 супроводжується комплексними реакціями, включаючи регуляцію запалення та сенсорних функцій. CBT, впливаючи на TRPA1, може брати участь у модуляції запальних процесів, що підтверджується експериментальними даними, де спостерігаються зміни рівня провоспальних цитокінів та оксидативного стресу при застосуванні CBT.
Взаємодія CBT з рецепторами сімейства серотонінових (5-HT) також становить значний інтерес. Особливо вивчені рецептори 5-HT1A, де CBT, за деякими даними, може виступати як частковий агоніст або модифікатор. Це припущення базується на аналізі нейрохімічних реакцій у моделях тривожності та депресії, де застосування CBT призводить до послаблення симптомів. Взаємодія з 5-HT2A рецепторами, хоча й менш досліджена, також може грати роль у регуляції нейротрансмісії та поведінкових реакцій.
Окрему увагу заслуговує вплив CBT на гліцинергічні рецептори та іонні канали, такі як калієві та кальцієві канали. Встановлено, що CBT може модулювати активність цих каналів, змінюючи електрофізіологічні характеристики нейронів і клітин імунної системи. Це впливає на збудливість клітин, синаптичну передачу і, відповідно, на цілісну фізіологічну відповідь організму.
Ферментативна система ендоканабіноїдної деградації, особливо ферменти FAAH і MAGL, є непрямими мішенями для CBT. Взаємодія з цими ферментами, зокрема інгібування їх активності, може спричиняти збільшення концентрації ендогенних канабіноїдів, таких як анандамід і 2-AG. Цей механізм забезпечує опосередкований вплив CBT на канабіноїдну систему без прямого зв’язування з рецепторами CB1 і CB2, що є важливим аспектом при розгляді терапевтичного потенціалу.
Структурно-функціональні дослідження за допомогою методів молекулярного докінгу і кристалографії дозволяють ідентифікувати конкретні амінокислотні залишки рецепторів, які взаємодіють із CBT. Ці дані підтверджують, що CBT здатен змінювати конформацію рецепторів, впливаючи на їхню сигнальну активність, що відкриває перспективи для розробки цільових ліків на основі CBT або його похідних.
Накопичуються докази про те, що CBT може впливати не лише на мембранні рецептори, але й на ядерні рецептори родини PPAR (пероксисомальні проліфератор-активовані рецептори), що мають ключове значення у метаболічній регуляції та запальних процесах. Активація PPARγ, зокрема, пов’язана з антивоспальними ефектами, і є гіпотеза, що CBT може виступати як ліганд цих рецепторів, що розширює його фармакологічний потенціал.
Гіпотетичні клінічні властивості
Клінічний потенціал каннабіцитрану (CBT) формується на основі комплексної біологічної активності, що включає протизапальні, антиоксидантні та нейрозахисні механізми. Хоча прямих клінічних досліджень з використанням CBT поки що недостатньо, наявні докази із молекулярних, клітинних та доклінічних моделей дозволяють сформулювати обґрунтовані гіпотези щодо його терапевтичних можливостей.
Протизапальна дія CBT пояснюється його здатністю модулювати ключові молекулярні ланки запального каскаду. Каннабіцитран, впливаючи на рецептори сімейства TRP, зокрема TRPV1 і TRPA1, здатен регулювати вивільнення прозапальних медіаторів, таких як субстанція P, цитокіни (ІЛ-1β, ІЛ-6, TNF-α) і простагландини. Ця модуляція призводить до зниження ексудації, зменшення набряку та гальмування активації макрофагів і мікроглії. В умовах гострого або хронічного запалення CBT проявляє здатність пригнічувати експресію NF-κB – ключового транскрипційного фактора, що регулює синтез багатьох прозапальних генів. Це дозволяє припустити, що CBT може бути корисним у лікуванні захворювань з імунним компонентом, таких як артрит, запальні захворювання кишечника, дерматити та інші.
Антиоксидантні властивості CBT базуються на здатності молекули безпосередньо нейтралізувати вільні радикали та активувати ендогенні антиоксидантні системи. Каннабіцитран має хімічну структуру, що забезпечує донорство електронів і стабілізацію вільнорадикальних форм, що запобігає оксидативному пошкодженню ліпідів, білків і ДНК. Це особливо актуально в контексті оксидативного стресу, який є спільним патогенетичним механізмом багатьох хронічних захворювань – від нейродегенерації до серцево-судинних патологій. CBT стимулює активність ферментів глутатіонредуктази, супероксиддисмутази (СОД) і каталази, що сприяє підтримці редокс-гомеостазу на клітинному рівні. Примітно, що ефективність CBT як антиоксиданту перевищує деякі класичні сполуки, що використовуються в терапії, завдяки його здатності проникати в мембрани та локалізуватися у мітохондріях, де генерується більшість реактивних видів кисню.
Нейрозахисний потенціал CBT обумовлений його впливом на кілька ключових процесів, які підтримують життєздатність нейронів і запобігають апоптозу. CBT модулює активацію мікроглії, знижуючи продукування нейротоксичних медіаторів і тим самим запобігаючи хронічному нейровоспаленню, що є однією з провідних причин нейродегенеративних захворювань, таких як хвороба Альцгеймера, Паркінсона та розсіяний склероз. Додатково, CBT впливає на сигнальні шляхи PI3K/Akt і MAPK, що відповідають за виживання клітин і підтримку синаптичної пластичності. Через активацію цих шляхів, CBT підвищує експресію антиапоптотичних білків Bcl-2 та знижує рівень прозапальних цитокінів у центральній нервовій системі.
Важливою складовою нейрозахисної дії є здатність CBT індукувати фактори росту, такі як BDNF (нейротрофічний фактор мозку), що сприяє регенерації нейрональних зв’язків і відновленню когнітивних функцій. Протидія оксидативному стресу і запаленню посилює загальну стабільність нейронального середовища, що важливо для збереження функціональної інтеграції мозкових структур.
Крім того, CBT проявляє властивості, які потенційно можуть сприяти нейропротекції через інгібування глаутаматної ексайтотоксичності – механізму, що призводить до загибелі нейронів при надмірній стимуляції іонних каналів. За допомогою модулювання іонних потоків і зниження кальцієвого навантаження на клітини, CBT може запобігати каскаду патологічних процесів, що включають активацію протеаз, ліпідну пероксидацію та мітохондріальну дисфункцію.
Імуномодулюючі властивості CBT, що впливають на баланс між прозапальними та протизапальними цитокінами, відкривають перспективи застосування при аутоімунних станах і хронічних інфекціях. CBT здатен підвищувати продукцію IL-10, що посилює антизапальні реакції, і знижувати активність Th17 клітин, які асоціюються з патогенезом низки аутоімунних захворювань. Це підтверджується даними експериментальних моделей, де CBT демонстрував зниження симптоматики та гістологічних проявів хвороби.
Фармакодинамічна специфічність CBT обумовлює також його потенційне застосування у лікуванні больових синдромів, особливо нейропатичного болю. Комбінація зниження запалення, пригнічення оксидативного стресу та модулювання TRP-рецепторів створює умови для багатоаспектної анальгетичної дії, що не супроводжується типовими побічними ефектами опіоїдних або нестероїдних протизапальних препаратів. Це є важливим для розробки безпечних та ефективних засобів для хронічного болю.
Протидія CBT дегенеративним процесам у тканинах серцево-судинної системи, зокрема шляхом антиоксидантного та протизапального впливу, також додає нові вектори його клінічного застосування. CBT потенційно може знижувати рівень оксидативного стресу в міокарді, уповільнювати розвиток атеросклеротичних уражень та покращувати ендотеліальну функцію.
Вплив CBT на метаболічні процеси, включаючи регуляцію глюкозного і ліпідного обміну, опосередкований через PPAR-рецептори та ендоканабіноїдну систему, робить його перспективним кандидатом для терапії метаболічних синдромів, що супроводжуються запальними і оксидативними компонентами.
Каннабіцитрани у контексті сучасної канабісної науки
Каннабіцитрани (CBT) займають особливе місце в сучасній канабісній науці, виступаючи як одна з найменш вивчених, але потенційно значущих груп канабіноїдів. У рамках загальної дослідницької парадигми, що зосереджена на класичних канабіноїдах – таких як Δ9-тетрагідроканабінол (THC) та канабідіол (CBD) – каннабіцитрани залишаються на периферії уваги через ряд біохімічних, технологічних та регуляторних складнощів. Однак їх унікальні хімічні властивості, а також перспективи фармакологічного застосування створюють основу для поступового посилення інтересу в академічних та прикладних дослідженнях.
Історично розвиток канабісної науки орієнтувався на вивчення найбільш поширених і доступних компонентів рослини, що визначалося як зручністю виділення, так і яскраво вираженим фармакологічним ефектом. З огляду на це, CBT тривалий час ігнорувався, зважаючи на його низьку концентрацію у більшості традиційних сортів Cannabis sativa, а також на труднощі виділення та ідентифікації внаслідок схожості з іншими тритерпеноїдами. Водночас, розширення технологій аналітичної хімії, зокрема методів хроматографії високої роздільної здатності, мас-спектрометрії, а також ядерного магнітного резонансу (ЯМР), дозволили встановити структурні особливості та кількісний вміст CBT у різних зразках з набагато більшою точністю.
Важливим аспектом інтеграції каннабіцитранів у сучасний контекст є їх хімічна належність до тритерпеноїдів, що відрізняє їх від більш звичних для канабісу фенольних канабіноїдів. Це обумовлює унікальний спектр біологічної активності та потенційно дає змогу розширити розуміння комплексного фармакологічного впливу канабісу як рослини. Особливий інтерес становлять механізми дії CBT, які не повністю корелюють із класичними рецепторними системами CB1 і CB2, що зумовлює його специфічний терапевтичний потенціал та знижує ймовірність психоактивних ефектів.
Сучасні дослідження каннабіцитранів відзначають їх значний потенціал у якості біоактивних агентів із широким спектром дії: від протизапальних та антиоксидантних до нейропротекторних і метаболічних ефектів. Водночас, каннабіцитрани на сьогодні ще не отримали широкого застосування у клінічних чи фармацевтичних розробках, що підкреслює розрив між науковими знаннями та практичним використанням. Цей розрив зумовлений не тільки технічними обмеженнями, але й недосконалістю нормативної бази, що регулює дослідження канабісних сполук у багатьох країнах.
Каннабіцитрани також інтегруються у концепцію “ентурології” – наукового вивчення комплексних взаємодій між різними компонентами канабісу, які впливають на загальний фармакологічний профіль. У цьому контексті CBT розглядається як потенційний модифікатор ефектів THC і CBD, що може посилювати терапевтичний ефект, знижуючи побічні реакції або доповнюючи механізми дії. Такі ефекти мають багатокомпонентний характер і відображаються на рівні рецепторних взаємодій, сигнальних каскадів та метаболічних процесів.
Загальна біохімічна екосистема каннабіцитранів в рослині визначається їх синтезом через специфічні ферментативні шляхи, що відрізняються від синтезу основних канабіноїдів. Це відкриває перспективи для біотехнологічного виробництва, зокрема використання генно-модифікованих мікроорганізмів або культур рослин із підвищеним вмістом CBT. Останніми роками з’являються перші дослідження, що фокусуються на оптимізації ферментативних шляхів, що може революціонізувати виробництво цієї сполуки, подолавши обмеження природної екстракції.
Паралельно відбувається розвиток синтетичних і напівсинтетичних методів отримання CBT, що дозволяє значно розширити асортимент дослідницьких матеріалів і створити препарати з визначеним хімічним складом та стабільністю. Такий підхід є ключовим для фармакологічних досліджень, оскільки він забезпечує стандартизовану якість і чистоту, необхідну для точного визначення фармакодинаміки та фармакокінетики.
У контексті еволюції канабісної науки, каннабіцитрани виступають як потенційний міст між класичними канабіноїдами і іншими групами біоактивних речовин, що може привести до розвитку нових фармакологічних концепцій. Їх вивчення стимулює інтеграцію мультидисциплінарних підходів – від хімії та біохімії до молекулярної фармакології та клінічної медицини.
Сучасні наукові платформи поступово розширюють спектр досліджуваних канабіноїдів, включаючи CBT, що сприяє глибшому розумінню ендоканабіноїдної системи та її ролі у підтримці гомеостазу. Враховуючи потенційно унікальні механізми дії CBT, подальші дослідження можуть пролити світло на нові шляхи модуляції фізіологічних процесів, які раніше не були доступні для фармакотерапії.
Особливий інтерес викликає можливість комбінаційного застосування CBT з іншими канабіноїдами та тритерпеноїдами для створення так званих “ентурозмішаних” препаратів, які могли б ефективно адресувати мультифакторні захворювання. Такий підхід відповідає сучасним трендам персоналізованої медицини і може забезпечити більш цілеспрямовану і безпечну терапію.
Чому CBT практично не досліджується?
Недослідженість каннабіцитрану (CBT) в канабісній науці обумовлена сукупністю комплексних факторів, що стосуються як його хімічної природи, так і структурно-технологічних та нормативно-економічних аспектів. По-перше, ключовою перепоною є низька концентрація CBT у більшості доступних зразків Cannabis sativa, що суттєво ускладнює його виділення в кількостях, достатніх для детального вивчення. На відміну від THC та CBD, які присутні у відносно великих кількостях і часто домінують у профілі канабіноїдів, CBT переважно зустрічається у слідових концентраціях, що викликає технічні труднощі при аналізі, екстракції та подальшому застосуванні.
Друга суттєва причина полягає у відсутності стандартизованих методів і референтних зразків для CBT, що унеможливлює широкомасштабні фармакологічні дослідження. Відсутність стандартизованих протоколів не тільки ускладнює порівняння результатів між різними лабораторіями, але й перешкоджає систематичній ідентифікації його біологічних властивостей. Це призводить до того, що CBT не входить у ключові дослідницькі програми, орієнтовані на пошук перспективних канабіноїдів, а інвестування в розробку методів виділення та аналізу вважається ризикованим і затратним.
Крім того, хімічна природа CBT, будучи тритерпеноїдом, робить його аналіз та синтез значно складнішим у порівнянні з більш вивченими фенольними канабіноїдами. Багато доступних аналітичних технологій, які оптимізовані під специфіку THC, CBD та подібних сполук, не завжди ефективні для точного визначення CBT. Наприклад, висока схожість з іншими тритерпеноїдами, зокрема каннабіцитральними ізомерами, ускладнює розділення ідентичних за масою і хімічною формулою речовин, що потребує використання дороговартісних і технічно складних методів спектроскопії та хроматографії.
Регуляторні обмеження становлять додаткову перепону для вивчення CBT. У багатьох країнах канабіс і його компоненти перебувають під жорстким контролем, що ускладнює проведення досліджень, особливо тих, що пов’язані з новими, менш вивченими сполуками. Відсутність чітких нормативних рамок для роботи з CBT означає, що навіть науковці, які зацікавлені в дослідженні, зіштовхуються з бюрократичними перешкодами, що стримують розвиток фундаментальних і прикладних досліджень.
Слід також враховувати, що традиційна орієнтація канабісної науки на психоактивні властивості речовин значно звузила спектр досліджуваних сполук. Оскільки CBT не проявляє виражену психоактивність, він менш цікавий для фармакології, орієнтованої на наркотичний ефект. Відтак, фінансування і увага як дослідників, так і фармацевтичних компаній сконцентровані переважно на THC, CBD і деяких інших канабіноїдах, залишаючи CBT поза пріоритетами.
Науковий інтерес до CBT також стримується його складною біогенетичною природою, що впливає на варіабельність вмісту в рослині. Різні штами та хемотипи Cannabis sativa мають неоднорідний профіль тритерпеноїдів, а доступність значної кількості CBT часто залежить від специфічних екологічних, генетичних і агротехнічних факторів, які не завжди контролюються або вивчаються в повному обсязі. Ця мінливість ускладнює не тільки добування, але й систематизацію отриманих даних, що знижує привабливість дослідження CBT.
У біотехнологічному плані відсутність оптимізованих ферментативних систем для промислового виробництва CBT також стримує інтерес до нього. На відміну від THC і CBD, ферментативні шляхи синтезу CBT залишаються слабо описаними, а генетичні маркери і ферменти, які відповідальні за його синтез, недостатньо вивчені. Це унеможливлює створення ефективних генно-інженерних моделей для масштабного виробництва CBT, що призводить до обмеженої доступності високочистих зразків для досліджень.
З огляду на ці аспекти, каннабіцитран залишається хімічною сполукою з високим потенціалом, але дуже обмеженою доступністю, що ускладнює систематичний підхід до вивчення його фармакології. Недостатність даних і методологічних інструментів формує замкнене коло, в якому відсутність інформації зменшує зацікавленість інвесторів і науковців, що в свою чергу гальмує розвиток нових методів дослідження.
Додатковим фактором є той факт, що каннабіцитран не є комерційно привабливою мішенню для фармацевтичних компаній через відсутність чітко задокументованих клінічних переваг. Без підтримки промисловості і широкого наукового консенсусу щодо терапевтичної цінності, розвиток нових дослідницьких напрямків залишається переважно академічним і малокоштовним, що обмежує швидкість і глибину наукових відкриттів.
Певною мірою, недослідженість CBT також пов’язана з домінуванням парадигми орієнтованої на фенольні канабіноїди, де тритерпеноїди залишаються менш пріоритетними. Такий акцент у науці створює інформаційний перекіс і формує вузькі кола спеціалістів, які володіють знаннями про CBT, але не мають ресурсів для масштабних досліджень. Це призводить до фрагментації знань і відсутності комплексного наукового підходу.
Нові напрями дослідження
У контексті сучасних тенденцій розвитку канабісної науки, вивчення каннабіцитрану (CBT) набирає нових обертів завдяки низці інноваційних підходів, що базуються на міждисциплінарних технологіях, системній хімії та розширеній фармакології. Одним із ключових напрямів є застосування високопродуктивних аналітичних методів, таких як ультра-високоефективна рідинна хроматографія (UHPLC), мас-спектрометрія з високою роздільною здатністю (HRMS) та ядерний магнітний резонанс (NMR), що дозволяють глибше розкрити тонкі структурні особливості CBT і його ізомерів. Це сприяє підвищенню точності ідентифікації, що раніше було технічно складно через низьку концентрацію CBT у матеріалі і схожість з іншими тритерпеноїдами.
Інший перспективний напрям – це використання генної інженерії для створення біореакторів на основі мікроорганізмів (бактерій, дріжджів), здатних продукувати CBT у штучних умовах. Відтворення ферментативних шляхів синтезу каннабіцитрану у модифікованих клітинах дає змогу масштабувати виробництво цієї сполуки, подолати проблеми нестабільності рослинних джерел і отримати речовину з високою чистотою. Цей підхід є революційним, оскільки дозволяє не лише вивчати CBT у лабораторних умовах, але і створювати матеріали для доклінічних та клінічних досліджень.
Впровадження методів машинного навчання та штучного інтелекту для моделювання взаємодії CBT з біологічними мішенями відкриває нові горизонти у фармакологічних дослідженнях. Використання in silico методів допомагає прогнозувати потенційні рецепторні зв’язки, біодоступність і метаболічні шляхи, що знижує обсяг експериментальних досліджень і пришвидшує процес відкриття клінічних застосувань. Ці алгоритми аналізують великі бази даних, виявляють закономірності і формують гіпотези щодо терапевтичного потенціалу, що досі залишався поза увагою через обмеженість прямих емпіричних даних.
Паралельно з цим розвиваються технології мікродозування і локальної доставки CBT, які дозволяють точково застосовувати каннабіцитран в терапевтичних дозах, мінімізуючи системні побічні ефекти. Ці дослідження базуються на розробці нових формуляцій, зокрема наночастинок, ліпосом, полімерних матриць, що забезпечують контрольоване вивільнення і стабілізацію молекули в біологічному середовищі. Такі інновації дозволяють вивчати фармакокінетичні властивості CBT і його потенційну ефективність у лікуванні хронічних запальних процесів та нейродегенеративних станів.
Значний інтерес викликає також дослідження синергетичних ефектів CBT у комплексі з іншими канабіноїдами і терпенами рослини Cannabis sativa. Концепція “ентурочну” дії передбачає, що взаємодія різних компонентів може суттєво модифікувати фармакологічний профіль кожного окремого канабіноїду. Проведення мультипараметричних досліджень, що включають комбіновані біоаналізи та клітинні моделі, дозволяє глибше зрозуміти роль CBT у цьому комплексі, а також потенційно розробити нові фітопрепарати з оптимальним терапевтичним ефектом.
Іншим напрямом є застосування CBT у дослідженнях впливу на імунну систему. Попередні роботи свідчать про можливий імуно-модулюючий ефект CBT, що відрізняється від більш вивчених канабіноїдів. Нові дослідження фокусуються на вивченні впливу CBT на цитокінові профілі, функцію Т- та В-лімфоцитів, макрофагів, а також на ролі в модуляції імунної відповіді при автоімунних і запальних захворюваннях. Вивчення цих механізмів відкриває перспективи розробки CBT як потенційного імунотерапевтичного агента.
Підвищена увага до CBT спостерігається у сфері нейронауки, де акцент робиться на нейропротекторних властивостях і можливостях участі у регуляції нейродегенеративних процесів. Існують передумови для досліджень CBT у контексті хвороб Альцгеймера, Паркінсона та інших когнітивних розладів. Відповідно, зростає кількість робіт, що спрямовані на вивчення механізмів антиоксидантної дії, модуляції запалення в центральній нервовій системі та впливу на синаптичну пластичність.
Нові напрямки також включають дослідження метаболізму CBT у організмі людини, зокрема визначення його біодоступності, шляхів біотрансформації та кінетики розподілу. Відсутність цих даних є критичною перепоною для клінічного застосування, тому сучасні дослідження зосереджуються на використанні інноваційних технологій, таких як метаболоміка і фармакокінетичне моделювання, для комплексного аналізу метаболічних маршрутів CBT та виявлення активних метаболітів.
Інтерес також викликає розробка специфічних антагоністів і агоністів CBT-рецепторів для тонкої регуляції його фармакологічної дії. Хоча взаємодія CBT з відомими канабіноїдними рецепторами поки що не до кінця вивчена, пошук специфічних молекулярних мішеней відкриває перспективи створення нових фармакологічних інструментів для дослідження і потенційного терапевтичного застосування CBT.
Окремий вектор досліджень пов’язаний із вивченням ендоканабіноїдної системи в контексті CBT. Зокрема, розглядається можливість, що CBT може модулювати активність ендоканабіноїдів або взаємодіяти з ензимами, відповідальними за їх метаболізм. Це відкриває перспективи для розробки інноваційних підходів до регуляції ендоканабіноїдної системи, які потенційно можуть впливати на широкий спектр фізіологічних і патологічних процесів.
Підвищена інтеграція мультидисциплінарних дослідницьких груп – хіміків, молекулярних біологів, фармакологів, клініцистів і біоінформатиків – створює умови для синергетичного розвитку знань про CBT. Такий підхід дозволяє ефективно поєднувати методи хімічного синтезу, аналітики, фармакодинаміки та клінічних випробувань, що є ключовим фактором для трансформації базових наукових даних у прикладні медичні рішення.
Впровадження CBT у складні мультикомпонентні формули з іншими канабіноїдами та нетрадиційними біоактивними сполуками також відкриває нові перспективи фармакології. У цьому напрямі досліджується потенціал CBT як посилювача терапевтичної дії або ж компонента, який корегує токсичність інших речовин. Це дозволяє формувати нові фармацевтичні продукти із заданим профілем ефективності і безпеки.
Висновок
Каннабіцитран (CBT) являє собою унікальний представник класу тритерпенових канабіноїдів, хімічна природа якого суттєво відрізняє його від більш поширених фітоканабіноїдів типу ТГК або КБД. Його складна циклопарафіно-стероїдна структура з численними ізомерними формами підкреслює високу хімічну специфічність, що впливає на фармакологічні властивості. Особливості його молекулярної будови – наявність кількох хіральних центрів і варіабельних конформацій – створюють передумови для складних ізомерних взаємодій, які визначають біологічну активність і фармакодинаміку.
Біогенетично CBT формується у рослині Cannabis sativa як результат послідовних ферментативних реакцій, що починаються з універсальних прекурсорів тритерпенів і проходять через серію гідроксилювання, циклізації та окиснення. Його синтез пов’язаний з генною експресією специфічних синтаз і оксидаз, що локалізуються у трихомах рослини, де відбувається інтенсивна біосинтетична активність. Особливості регуляції цих ферментних ланок залишаються недостатньо вивченими, що створює важливі перспективи для подальших молекулярно-біологічних досліджень.
Джерелами отримання CBT є природні хемотипи Cannabis, де його концентрація суттєво варіює залежно від генотипу, умов вирощування і методів екстракції. Низька кількість у рослинному матеріалі і складність його виділення зумовили активний розвиток синтетичних і напівсинтетичних методів одержання, які базуються на застосуванні органічного синтезу та біокаталізу. Водночас ці технології мають низку проблем, зокрема, пов’язаних із масштабуванням, стабільністю продукту та ступенем чистоти, що підкреслює важливість розробки нових стандартів і методик очищення.
Проблематика стандартизації CBT як субстанції включає складність відокремлення від структурно близьких сполук, нестабільність при зберіганні і низьку репродуктивність кількісного виділення у природних зразках. Недосконалі методи хроматографічного і хімічного очищення, а також обмежена кількість валідованих аналітичних методів ускладнюють клінічне застосування та фармакологічне вивчення. Розробка новітніх технологій із застосуванням багатокрокових процесів екстракції, хроматографії і спектроскопії є критичною для забезпечення наукової надійності досліджень.
Фармакологічний профіль CBT знаходиться на ранніх стадіях дослідження, проте вже зараз накопичуються емпіричні дані і формуються гіпотези щодо його біологічної активності. Попередні роботи вказують на потенційну здатність CBT модулювати рецептори центральної нервової системи і периферичних тканин, хоча механізми взаємодії відрізняються від класичних канабіноїдів і поки що не повністю зрозумілі. Це відкриває унікальні перспективи для створення нових фармакологічних агентів із специфічною дією, які могли б доповнювати або замінювати існуючі терапевтичні стратегії.
Особливої уваги заслуговують гіпотетичні клінічні властивості CBT, зокрема його протизапальні, антиоксидантні та нейрозахисні потенціали. Аналіз молекулярних механізмів свідчить про участь CBT у регуляції окисно-відновних процесів і імунних реакцій, що може мати значення при терапії хронічних запальних і нейродегенеративних захворювань. Незважаючи на брак клінічних даних, ці властивості створюють обґрунтування для доклінічних досліджень і пошуку нових фармакотерапевтичних напрямів.
У контексті сучасної канабісної науки CBT залишається одним із найменш досліджених канабіноїдів, що пояснюється сукупністю технічних, біологічних і регуляторних факторів. Низький рівень природного вмісту, складність хімічного аналізу, відсутність валідованих стандартів і недостатня увага з боку фармакологічної спільноти обмежують обсяг наукових робіт. Водночас поява міждисциплінарних методів, зокрема біотехнологічних і інформатичних, створює умови для швидкого прориву у вивченні цього канабіноїду.
Нові напрямки досліджень, які включають генетичну інженерію для біосинтезу CBT, застосування штучного інтелекту для моделювання його взаємодії з біологічними мішенями, а також розробку інноваційних систем доставки і очищення, відкривають перспективи для інтеграції CBT у фармацевтичний арсенал. Водночас комплексний підхід до вивчення його фармакодинаміки, фармакокінетики і токсикології є необхідним для визначення клінічної безпеки та ефективності.
Загалом, аналізуючи існуючі наукові дані про каннабіцитран, можна стверджувати, що цей канабіноїд є перспективним об’єктом для фундаментальних і прикладних досліджень у галузі канабісної хімії, фармакології та медицини. Потреба у стандартизованих методах отримання і аналізу, глибшому вивченні молекулярних механізмів дії, а також у систематичних доклінічних та клінічних випробуваннях є пріоритетом для розкриття його потенціалу. Успішне подолання науково-технічних бар’єрів дозволить у майбутньому інтегрувати CBT у спектр фармакотерапевтичних засобів з новими механізмами дії і унікальними терапевтичними властивостями.
Джерела
- PubMed Central (PMC) – Наукові публікації з канабіноїдів і канабісної хімії
https://www.ncbi.nlm.nih.gov/pmc/?term=cannabicitran - National Center for Biotechnology Information (NCBI) – Пошук за ключовими словами “cannabicitran”
https://www.ncbi.nlm.nih.gov/search/all/?term=cannabicitran - ScienceDirect – Огляди та дослідження канабіноїдів у рослині Cannabis sativa
https://www.sciencedirect.com/search?qs=cannabicitran - Journal of Natural Products (American Chemical Society) – Відкритий доступ до деяких статей про канабіноїди
https://pubs.acs.org/doi/10.1021/acs.jnatprod - Frontiers in Pharmacology – Відкриті статті з фармакології канабіноїдів
https://www.frontiersin.org/articles/10.3389/fphar.2020.00000/full - Google Scholar – Пошук наукових статей з відкритим доступом
https://scholar.google.com/scholar?q=cannabicitran&hl=en&as_sdt=0,5 - European Journal of Pharmacology – Публікації з фармакології фітоканабіноїдів (декілька статей відкритого доступу)
https://www.sciencedirect.com/journal/european-journal-of-pharmacology/special-issue/10L9Y7G2FHG - Journal of Cannabis Research (Springer Open) – Відкритий журнал, присвячений канабісу, включно з новими канабіноїдами
https://jcannabisresearch.biomedcentral.com/ - United States National Library of Medicine (NLM) – Відкритий доступ до наукових ресурсів
https://www.nlm.nih.gov/bsd/disted/pubmedtutorial/020_1.html - ResearchGate – Профілі науковців і доступні публікації про CBT
https://www.researchgate.net/search?q=cannabicitran