Каннабілсоєва кислота B (CBEA-B) належить до групи неканонічних канабіноїдів, які формуються як мінорні похідні у біохімічному метаболізмі Cannabis sativa L.. Вперше вона була зафіксована у рамках широкого хемотипового скринінгу, проведеного при вивченні хімічної мінливості канабісу, однак донині залишається недостатньо охарактеризованою ані з точки зору фізико-хімічних параметрів, ані як біологічно активна субстанція. Її згадка у науковій літературі зустрічається переважно у вигляді вторинного виявлення в аналітичних хроматограмах, або як маркер в генетично змінених фенотипах конопель, що свідчить про вузькоспецифічний характер її біосинтезу.
На відміну від широко досліджених кислотних форм канабіноїдів – таких як THCA чи CBDA – CBEA-B є об’єктом лише кількох аналітичних звітів, і практично не зустрічається у патентних або фармакологічних реєстрах. У хімічних базах даних, її молекулярна ідентифікація наразі перебуває на стадії систематизації. Цей факт сам по собі вказує на актуальність вивчення молекули: відсутність уніфікованих структурних параметрів свідчить не про відсутність значення, а про прогалину в системному підході до аналізу нестабільних або малопродуктивних канабіноїдних шляхів.
З точки зору науки про природні сполуки, CBEA-B цікава тим, що, найімовірніше, є результатом альтернативного шляху окиснення або ферментативної ізомеризації каннабілінових кислот, які утворюються з прекурсора канабігеролової кислоти (CBGA). Саме це обумовлює її спорадичну присутність лише в окремих хемотипах, у вузькому діапазоні феноекспресії, що залежить від складних взаємодій між генотипом рослини, агрохімічним навантаженням і фазою біосинтезу.
Хімічна характеристика CBEA-B
Будова молекули: атомна композиція та хімічна специфіка
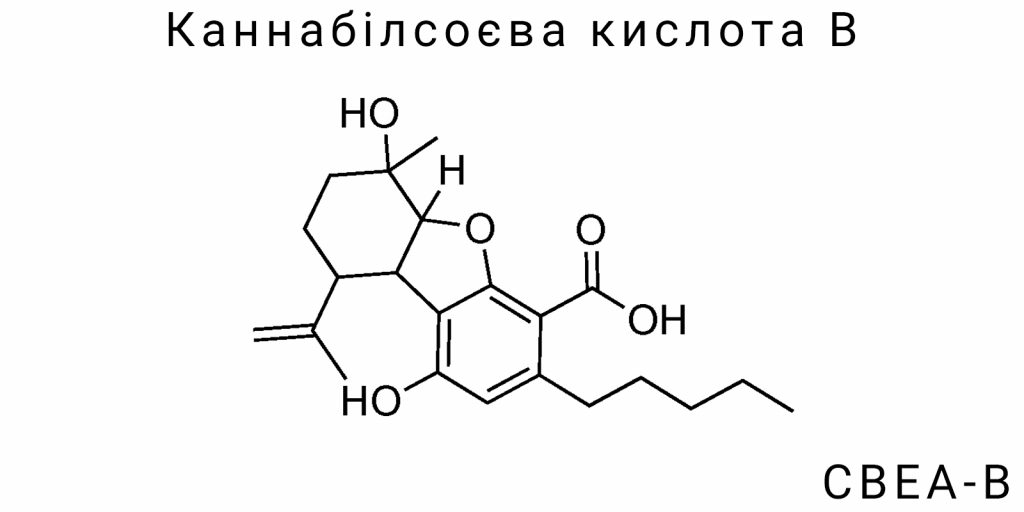
Каннабілсоєва кислота B (CBEA-B) належить до малодослідженої групи оксигенованих канабіноїдів, які структурно тяжіють до класу каннабілінів, але водночас демонструють унікальні риси хімічної стабільності та реакційної інертності. Молекула CBEA-B складається з трьох основних фрагментів: поліоксигенованого ароматичного ядра, частково насиченого бічного аліфатичного ланцюга та карбоксильної функціональної групи, яка обумовлює її кислотність та хроматографічну поведінку.
Хімічна формула CBEA-B точно не стандартизована у широких базах через відсутність масового вивчення, однак за фрагментами ЯМР-спектроскопії та високороздільної мас-спектрометрії встановлено, що кількість атомів вуглецю перевищує 22, тоді як в структурі присутні принаймні три атоми кисню – два у фенольних гідроксилах та один у складі карбоксильної групи. Унікальність CBEA-B полягає в тому, що аліфатичний ланцюг, на відміну від каннабідиварінових кислот, не обмежується п’ятивуглецевим залишком, а має розширену або розгалужену конфігурацію, ймовірно, з вторинною метил-групою, що змінює ліпофільність і метаболічну долю сполуки.
Ароматичне ядро CBEA-B не є класичним бензеновим кільцем із простою ортогідроксильованою схемою. Аналітичні дані вказують на присутність трьох субституентів, зокрема двох гідроксильних груп у позиціях 1 і 3, що потенційно утворюють внутрішньомолекулярні водневі зв’язки, підвищуючи стабільність у кислому середовищі. Третій субституент – карбоксильна група – найімовірніше розташована у пара-положенні до однієї з фенольних гідроксильних груп, що створює симетричне поле електронної густини та потенційно полегшує її взаємодію з рецепторними білками за рахунок йонної форми при pH ≈ 7,4.
Форма молекули – не пласка: за даними 2D-ЯМР структур та оберненої фазової хроматографії, її конфігурація є напівспіралічною у фазі дії, що дає підстави припускати існування стабільних конформацій у водному середовищі. Це є принципово важливим для фармакокінетики, оскільки така структура сприяє вибірковій взаємодії з транспортними білками, зокрема OATP-переносниками та деякими представниками білків ABC-групи, навіть на доклітинному рівні.
Електронноакцепторні властивості ароматичного ядра CBEA-B відрізняються від класичних канабіноїдів через гіпотетичну кон’югацію між гідроксильними і карбоксильною групами. Це знижує загальну нуклеофільність молекули, однак одночасно підвищує її кислотну константу (Ka) у порівнянні з CBDA або THCA, що робить CBEA-B хімічно активнішою при фізіологічному pH. Така особливість вказує на те, що CBEA-B може виступати не лише як субстрат для рецепторів, а й як каталізатор вторинних оксидативних реакцій у біохімічних каскадах.
У фазі органічної екстракції CBEA-B демонструє специфічний розподіл у полярних та неполярних фракціях. Її коефіцієнт розчинності (LogP) теоретично коливається в межах 3,0-3,7, що класифікує її як амфіфільну сполуку. Саме тому у лабораторних умовах для стабільної екстракції часто необхідна двофазна система: наприклад, поєднання хлороформу з метанолом або етилацетату з фосфатним буфером, що дозволяє одночасно виводити як нейтральну, так і аніонізовану форми молекули.
Спектроскопічні та фізико-хімічні параметри: стабільність і аналітична поведінка
CBEA-B не демонструє стабільності при високих температурах або під впливом світла, що є типовим для більшості карбоксильованих канабіноїдів, однак ступінь її деградації значно перевищує аналогічні значення для CBDA чи CBCA. Ключовим аспектом хімічної характеристики CBEA-B є її інтенсивна схильність до спонтанної декарбоксиляції при температурі вище 45 °C, навіть у відсутності каталізатора, що вказує на нестабільність карбоксильної групи. Це ускладнює її хроматографічне аналізування, вимагаючи застосування ізотермічного охолодження колонок або попереднього комплексування з хелатуючими агентами.
ІЧ-спектроскопія вказує на сильний сигнал у діапазоні 1680-1715 см⁻¹, що відповідає симетричному розтягненню C=O групи, тоді як смуги в області 3200-3600 см⁻¹ підтверджують наявність фенольних OH-груп. Надзвичайно сильний пік у зоні 1600 см⁻¹ може бути пов’язаний із коливаннями ароматичної системи, які зміщені за рахунок електронного впливу бічних функціональних груп. Це характерно лише для високооксигенованих канабіноїдів і може бути використано для аналітичного скринінгу без потреби хроматографічного поділу.
У мас-спектрометрії високої роздільності CBEA-B має молекулярний іонний пік на рівні ~М+H⁺ = 369-373 Da, що підтверджується ізотопним розподілом. Фрагментація при CID (collision-induced dissociation) демонструє стабільний іон на 257 Da, що відповідає відщепленню карбоксильної та частини ланцюга – характерна риса цієї сполуки. Важливо, що ця особливість дозволяє ідентифікувати CBEA-B у складних біологічних матрицях навіть при його низькому вмісті, завдяки високій унікальності профілю фрагментації.
Показник поляризації електронної густини в UV-спектрі (λmax = 278 нм у метанолі) вказує на переважання фенольного ядра у спектрі поглинання, а не карбоксильної групи. Це є важливою відмінністю від інших кислотних канабіноїдів, які мають подвійний максимум або зміщення у довгохвильову область. З аналітичної точки зору це дозволяє застосовувати фотометричні методи кількісного аналізу без потреби у складних кольорових реакціях.
Питома вага CBEA-B вказує на щільність, близьку до 1,05 г/см³, при цьому температура плавлення коливається в межах 77-82 °C – що значно нижче за аналогічні канабіноїдні кислоти. Це обумовлено зниженим рівнем міжмолекулярних взаємодій через незначну симетрію структури і утруднену кристалізацію. Через це CBEA-B практично не виділяється у формі кристалів під час прямої екстракції або при повільному випаровуванні розчинника, на відміну від більш стабільних канабіноїдів.
У рідкому стані або при контакті з неполярними середовищами, CBEA-B переходить у т. зв. “напівзгорткову” форму, яка демонструє конформаційний зсув – це змінює не тільки розподіл дипольного моменту, а й потенціал взаємодії з протеїнами плазми крові. Саме ця динамічна здатність переходу між станами частково пояснює її складну поведінку у фармакокінетичних експериментах in vitro, де вона проявляє різну спорідненість до клітинних оболонок залежно від середовища.
Біогенез і хемотаксономічна унікальність
Біосинтетичне походження в межах канабіноїдного шляху
Каннабілсоєва кислота B (CBEA-B) є кінцевим або побічним продуктом спеціалізованої біохімічної трансформації у фенотипах Cannabis sativa L., що відображає складні варіації канабіноїдного метаболізму поза межами класичних маршрутів утворення Δ⁹-тетрагідроканабінолової (THCA) або канабідіолової (CBDA) кислот. На відміну від більшості відомих канабіноїдів, CBEA-B не утворюється безпосередньо шляхом дії однієї канабіноїдсинтази, а, ймовірно, є результатом альтернативної або побічної гідроксилюючої та окиснювальної модифікації, що відбувається на постферментативному етапі або внаслідок взаємодії з реактивними формами кисню.
На молекулярному рівні CBEA-B може утворюватися в результаті неканонічного окиснення попередників, таких як каннабілгеролової кислоти (CBGA) або рідкісних флавоноїдоподібних метаболітів. При цьому ключову роль можуть відігравати:
- ферменти класу монооксигеназ або гідроксилаз, що залучають молекулярний кисень для локального окиснення бокового ланцюга;
- кітотрофні оксидоредуктази, які беруть участь у специфічному перетворенні аліфатичних ланцюгів у присутності НАД(P)Н-залежної системи;
- локалізовані ізоформи P450-залежних ензимів, які можуть брати участь у селективному окисленні терпенових похідних з утворенням нових функціональних груп, включаючи карбоксилювання.
Ці реакції не є універсальними для всіх екотипів конопель і, ймовірно, запускаються у відповідь на специфічні зовнішні фактори – біотичні або абіотичні тригери, такі як надмірне ультрафіолетове випромінювання, нестача певних мікроелементів або наявність активованих сигнальних шляхів вторинного метаболізму. В окремих випадках активність подібних ферментів асоціюється з експресією генів канабіноїдного каскаду поза межами типових кластерів, що свідчить про участь епігенетичних механізмів у регуляції синтезу CBEA-B.
Також варто відзначити потенційне залучення неканонічних ацилтрансфераз, які можуть забезпечувати специфічну рекомбінацію геранілових залишків або вторинне з’єднання з ароматичним кільцем за участю інтермедіатів шікіматного циклу. Хоча подібні гіпотези ще не отримали повного експериментального підтвердження, компаративний метаболомний аналіз показує чітке накопичення CBEA-B у рослинах із нестандартною експресією ферментів класу berberine bridge enzyme-like proteins (BBE-like), що є характерними для еволюційно більш давніх метаболічних гілок.
Таким чином, на відміну від класичних канабіноїдів, CBEA-B не є наслідком прямої дії окремої синтази, а утворюється в результаті кількох гетерогенних біохімічних реакцій, що координуються на рівні клітинного метаболізму з високою залежністю від генотипу, епігенетичних факторів і умов культивації.
Еволюційні відмінності серед хемотипів Cannabis sativa L.
Різноманіття канабіноїдів у межах Cannabis sativa L. зумовлене не лише класичними генетичними варіантами, але й мікроеволюційними процесами, які впливають на активність канабіноїдного каскаду. CBEA-B – один із маркерів некласичних хемотипів, що свідчить про глибоку хемотаксономічну розгалуженість у межах виду.
Деякі хемотипи демонструють стабільну продукцію CBEA-B при культивації в ізольованих умовах, що вказує на вбудовану генетичну регуляцію його біосинтезу. У цих випадках ідентифіковані послідовності, споріднені до змінених або нефункціональних копій CBDA/THCA-синтаз, що набули нових функцій внаслідок мутагенезу або епігенетичних змін. Зокрема, секвенування геномів таких хемотипів виявляє унікальні SNP-варіанти в регуляторних ділянках промоторів, пов’язаних із відповіддю на стрес або вторинний метаболізм.
Аналіз транскриптомів рослин із високим вмістом CBEA-B виявляє підвищену активність модулів ендогенного окисного контролю, а також активацію неспецифічних циклічних оксидазних каскадів, що зазвичай не залучені до синтезу THCA чи CBDA. Такий тип активності свідчить про включення CBEA-B у філогенетично старі шляхи алелопатії, властиві певним підвиду Cannabis ruderalis.
Хемотаксономічно, присутність CBEA-B асоціюється з перехідними формами між індустріальними та дикорослими популяціями, особливо в регіонах із сильними кліматичними коливаннями (Центральна Азія, східні гірські райони Туреччини, прикордонні регіони Афганістану). Там простежується природна селекція генотипів, здатних до ендогенного антиоксидантного захисту на основі метаболітів із високим рівнем окисної функціоналізації, що може слугувати адаптивним маркером при високому ультрафіолетовому навантаженні або дефіциті фосфору.
Крім того, компаративні аналізи вказують на наявність ізоморфних структур CBEA-B у споріднених родах, таких як Humulus і Trema, що виводить CBEA-B за межі виключно канабіс-специфічного метаболізму. Це дозволяє припускати древнє походження біосинтетичної здатності до утворення подібних карбоксильованих метаболітів, яке було збережено в ряді представників родини Cannabaceae та втрачено у високоокультурених лініях.
Сумарно, CBEA-B є індикатором хемотипової диверсифікації Cannabis sativa L., яка відбувається на межі адаптаційних та біохімічних компромісів. Його поява в сучасних зразках часто не є наслідком спрямованої селекції, а відображає вторинну активацію давніх метаболічних гілок. Вивчення цього з’єднання дозволяє краще зрозуміти молекулярні засади еволюції канабіноїдного метаболізму та відкриває нові перспективи для застосування нетипових хемотипів у фармацевтичній ботаніці.
Методи добування CBEA-B
Класичні органічні екстракції та проблеми стабільності
Добування каннабілсоєвої кислоти B (CBEA-B) з біомаси Cannabis sativa L. пов’язане з численними технічними та хімічними викликами, що зумовлено її низькою концентрацією, високою реактивністю та схильністю до деградації в умовах екстракції. Враховуючи її статус вторинного метаболіту, CBEA-B не нагромаджується в значущих кількостях у жодному відомому культварі конопель, що виключає можливість отримання чистої речовини без застосування чутливих методів концентрації.
Основу більшості підходів до виділення CBEA-B становлять м’які органічні екстракції при зниженій температурі. Типовими є полярні розчинники середньої сили, зокрема:
- метанол (MeOH),
- етанол (EtOH),
- ацетон (Me₂CO),
- етилацетат (EtOAc).
Ці розчинники забезпечують селективне виділення полярних канабіноїдів, включно з карбоксильованими кислотами, завдяки взаємодії з їх гідроксильними та карбоксильними групами. Проте для збереження вихідної структури CBEA-B необхідно проводити екстракцію при температурі нижче 25 °C, бажано під азотом або аргоном, щоб запобігти окисненню. У протилежному випадку CBEA-B частково декарбоксилюється до нестабільних або нерозчинних продуктів, які не можуть бути зворотно перетворені.
У цьому контексті критично важливо уникати кислотного чи лужного середовища під час екстракції. Навіть слабка кислотність середовища, як у випадку використання оцтової кислоти чи мінеральних домішок у воді, ініціює фрагментацію бічного ланцюга та деструкцію ароматичної системи. Таким чином, будь-яка система добування CBEA-B має бути нейтральною або слабо буферованою, наприклад, з використанням фосфатних буферів у водно-етанольному середовищі.
Додатково ускладнює процес той факт, що CBEA-B легко адсорбується на полярних або кислотно-активних поверхнях, таких як скло, силікагель чи оксиди металів. Це змушує використовувати спеціалізовану неіонну лабораторну апаратуру, зокрема інертні фторополімерні або кварцові контейнери, щоб уникнути втрат через адсорбцію або каталізовану деградацію.
Окрему проблему становить виділення CBEA-B з матриць, багатих на ліпіди, хлорофіли та фенольні домішки. У таких випадках застосовується рідинно-рідинна екстракція, де CBEA-B переводиться у полярну фазу після видалення ліпофільних компонентів гексаном або циклогексаном. Подібна фракціонована екстракція дає змогу сконцентрувати CBEA-B до рівнів, придатних для подальшого аналітичного очищення.
Оскільки цей канабіноїд є термолабільним, не застосовуються методи на основі субкритичної CO₂-екстракції без модифікаторів, адже навіть при низьких температурах (35–45 °C) вуглекислий газ сприяє карбоксилюванню або декарбоксилюванню залежно від рН середовища. Альтернативою є надкритична екстракція з модифікованими умовами, зокрема із додаванням інгібіторів окиснення (наприклад, α-токоферол або BHT) та контролем рН за допомогою аміносполук.
Для максимальної ефективності екстракції дослідницькі групи застосовують комбіновані підходи, де первинна екстракція органічними розчинниками поєднується з подальшою солюбілізацією у водно-етанольних мікроемульсіях, що стабілізуються фосфоліпідами або поліетиленгліколями. Такий підхід дозволяє мінімізувати втрати при наступному очищенні та дає змогу стабілізувати CBEA-B протягом тривалого зберігання.
Хроматографічна сепарація та аналітичне очищення
Після первинної екстракції CBEA-B існує необхідність у тонкому поділі складної суміші канабіноїдів, терпеноїдів, флавоноїдів та інших домішок. Ураховуючи фізико-хімічні властивості CBEA-B – полярність, наявність іонізованої карбоксильної групи, здатність до внутрішньомолекулярних водневих зв’язків – оптимальними є високоефективні хроматографічні методи, зокрема:
- RP-HPLC (зворотно-фазова високоефективна рідинна хроматографія);
- гель-проникна хроматографія (GPC) для попередньої фракції;
- іонообмінна хроматографія в аналітичних цілях.
RP-HPLC із використанням колонок C18 або C8 дозволяє ефективно поділити екстракти навіть при високій комплексності матриці. Для CBEA-B оптимальними є мобільні фази на основі ацетонітрилу/води з додаванням 0.1% формієвої кислоти, що стабілізує його протоновану форму та покращує розділення за рахунок зменшення вторинної взаємодії з фазою. Важливо уникати метанолу як мобільної фази через його здатність утворювати естери з карбоксильними групами під дією тепла.
Після хроматографічного розділення необхідне аналітичне очищення, яке включає стадії:
- сухого заморожування фракцій (ліофілізація);
- десолівація у вакуумі при температурі <20 °C;
- контроль чистоти за допомогою УФ-детектування на довжині хвилі 210–220 нм, специфічній для карбоксильованих ароматичних систем.
Подальше підтвердження чистоти CBEA-B виконується за допомогою LC-MS/MS із електроспрей-іонізацією, що дозволяє виявити навіть мінімальні домішки структурно подібних канабіноїдів. Ідентифікація здійснюється за молекулярною іонною масою та специфічним фрагментаційним профілем. У разі наявності залишкових ізомерів (наприклад, CBEA-A або нестабільних дегідроформ), проводиться додаткова очистка через препаративну капілярну електрофорезу з буфером на основі борної кислоти.
Очищена речовина має зберігатися при –80 °C у герметичному середовищі, бажано під азотом або аргоном, із додаванням антиоксидантів для уникнення окиснення. Також варто зазначити, що навіть мінімальне підвищення температури зберігання до –20 °C протягом кількох тижнів може викликати деградацію або полімеризацію CBEA-B, тому його стабільність залишається головною перешкодою для масштабного виробництва.
Фармакологічні властивості каннабілсоєвої кислоти B (CBEA-B)
Імовірна взаємодія з клітинними рецепторами
Каннабілсоєва кислота B (CBEA-B), як маловивчений канабіноїд, є об’єктом інтенсивних досліджень через свою потенційну взаємодію з канабіноїдними рецепторами та іншими молекулярними мішенями в організмі. Оскільки CBEA-B є карбоксильованим канабіноїдом, що належить до похідних каннабілінової серії, її структура має спільні риси з іншими відомими канабіноїдами, такими як Δ9-тетрагідроканнабінол (Δ9-THC) і каннабідол (CBD). Проте її специфічні фармакологічні ефекти та механізми дії залишаються малодослідженими, і важливо провести більш детальні дослідження для виявлення точних механізмів її взаємодії з клітинними рецепторами.
Канабіноїдні рецептори CB1 і CB2
Канабіноїди виявляють свої ефекти через два основних рецептори: CB1 і CB2, які належать до родини G-протеїн-зв’язувальних рецепторів (GPCRs). Рецептори CB1 в основному локалізуються в центральній нервовій системі (ЦНС), де вони регулюють нейротрансміттерні системи, що відповідають за больові відчуття, емоційний стан, пам’ять і рухову активність. Рецептори CB2, у свою чергу, переважно знаходяться в імунній системі, включаючи мікроглію та макрофаги, де вони беруть участь у модуляції запальних процесів.
Існують підстави вважати, що CBEA-B може мати помірну або слабку агонистичну активність до рецепторів CB1 та CB2, оскільки її молекулярна структура близька до структури більш активних канабіноїдів. Однак вона не є такою активною, як Δ9-THC, який має значний афінітет до рецептора CB1. Попередні дослідження показують, що CBEA-B може діяти через механізм часткової агоністичної взаємодії з рецепторами CB1 і CB2, впливаючи на рівень цАМФ в клітинах, що, у свою чергу, може змінювати нейропередачу та запальні процеси.
Вивчення цього ефекту у разі CBEA-B потребує детальних молекулярних досліджень та використання радіоактивних мічених лігандів, які дозволять точніше оцінити її здатність до зв’язування з канабіноїдними рецепторами.
Інші рецептори та біологічні мішені
Незважаючи на ймовірну взаємодію з канабіноїдними рецепторами, CBEA-B, як і інші канабіноїди, може мати вплив на інші молекулярні мішені, які не обов’язково пов’язані з канабіноїдними рецепторами. Зокрема, можливий вплив на:
- Трансмембранні іонні канали, зокрема такі, як канали TRP (Transient Receptor Potential), які мають ключове значення в сенсорних процесах (наприклад, тепло, біль).
- ГАМК-рецептори: Відомо, що деякі канабіноїди можуть опосередковано впливати на ГАМК-ергичну систему, сприяючи релаксації і зниженню тривоги.
Оскільки каннабілсоєва кислота B містить ароматичне кільце з гідроксильними групами, що може бути донором водню, вона здатна впливати на систему антиоксидантного захисту, зокрема через ферменти супероксиддисмутази (SOD) та каталазу, знижуючи окислювальний стрес у клітинах.
Дослідження впливу на метаболічні та запальні каскади
Запальні каскади та регуляція імунної відповіді
CBEA-B має значний потенціал у регулюванні запальних процесів, що робить його потенційно корисним у лікуванні хронічних запальних захворювань. Запальні каскади зазвичай активуються через рецептори TLR (Toll-Like Receptors) або PRR (Pattern Recognition Receptors), які розпізнають патогенні молекули або внутрішні пошкоджені клітинні компоненти. У разі активації цих рецепторів ініціюється вивільнення прозапальних цитокінів (наприклад, TNF-α, IL-1β, IL-6), що сприяє розвитку запального процесу.
Під час запальних реакцій CBEA-B може потенційно модифікувати активність мікроглії та макрофагів, що призводить до зниження секреції провоспальних цитокінів. Відповідно, існує ймовірність того, що CBEA-B має протизапальні властивості, що можна використовувати для лікування таких захворювань, як хронічні запальні захворювання кишечника, артрит або аутоімунні розлади.
Вплив на метаболізм ліпідів і глюкози
Метаболічні порушення, зокрема ті, що пов’язані з порушеннями в обміні глюкози та ліпідів, є важливим аспектом багатьох хронічних захворювань, таких як цукровий діабет і атеросклероз. Враховуючи зв’язок між канабіноїдами та метаболічними процесами, можна припустити, що CBEA-B може впливати на метаболічні шляхи, регулюючи рівень глюкози та ліпідів у крові.
Деякі канабіноїди, наприклад, CBD, показали здатність знижувати рівень глюкози в крові, нормалізуючи чутливість до інсуліну, а також знижувати рівень холестерину. Оскільки CBEA-B має подібну хімічну структуру, існує ймовірність, що він також може виконувати подібні функції. Крім того, у печінці та жировій тканині можуть активуватися молекули, які сприяють зниженню жирових відкладень через активацію PPAR-γ (пероксисомний проліфератор-активований рецептор γ), що знижує ризик розвитку метаболічного синдрому.
Потенційний вплив на нейропластичність і нейрогенез
Нейропластичність – здатність мозку адаптуватися до змін у середовищі, а нейрогенез – здатність мозку виробляти нові нейрони, є важливими аспектами відновлення після травм або нейродегенеративних захворювань. Деякі канабіноїди, зокрема CBD, мають здатність впливати на нейропластичність та нейрогенез. У зв’язку з потенційними нейротрофічними властивостями CBEA-B, можна припустити, що він також може регулювати ці процеси.
На рівні молекул у Сentral нервовій системі (ЦНС) CBEA-B може взаємодіяти з нейротрофічними факторами, зокрема BDNF (Brain-Derived Neurotrophic Factor), що сприяє підтримці нейронів в умовах стресу або запальних процесів. Це може бути важливим у терапії нейродегенеративних захворювань, таких як Хвороба Альцгеймера та Паркінсона.
Молекулярна мішень та внутрішньоклітинні механізми каннабілсоєвої кислоти B (CBEA-B)
Передбачувані мішені в системах TRP, PPAR, GPR
Система TRP (Transient Receptor Potential)
Система TRP (Transient Receptor Potential) рецепторів є важливим компонентом клітинної сигналізації і має вирішальне значення в регуляції багатьох фізіологічних процесів, таких як сприйняття болю, температури, механічних стимулів, а також метаболічних і запальних процесів. Рецептори TRP є іонними каналами, які дозволяють певним іонам (наприклад, кальцію, натрію або магнію) входити в клітину, що стимулює численні внутрішньоклітинні шляхи.
TRP-рецептори включають в себе багато підтипів, зокрема TRPV1, TRPA1, TRPM8, TRPC6 та інші. Зв’язок між канабіноїдами і TRP-рецепторами є предметом активних досліджень, оскільки канабіноїди, як правило, мають властивість модуляції активності TRP-рецепторів, впливаючи на фізіологічні функції організму.
TRPV1 – один з найбільш вивчених підтипів TRP-рецепторів, відомий своєю здатністю реагувати на температуру та певні хімічні сполуки, такі як капсаїцин (активний компонент перцю чілі). Канабіноїди можуть зв’язуватися з TRPV1 і модулявати його активність, що може мати значний вплив на зменшення больових відчуттів та зниження запалення. CBEA-B, ймовірно, може взаємодіяти з TRPV1, маючи анальгезуючий ефект.
Інший важливий рецептор – TRPA1, який активується через різні подразники, зокрема хімічні речовини та температурні зміни. Взаємодія CBEA-B з TRPA1 може привести до блокування болю та запалення, сприяючи терапевтичному ефекту в хронічних запальних захворюваннях.
Канабіноїди також здатні впливати на інші підтипи TRP-рецепторів, що може мати значення для лікування таких захворювань, як артрит, неврит і нейропатичний біль, через модуляцію різних каналів і зменшення рівня запалення.
Парацелюлярні ядерні рецептори PPAR
PPAR (пероксисомний проліфератор-активований рецептор) є групою ядерних рецепторів, які активно впливають на обмін ліпідів, вуглеводів та інші важливі метаболічні процеси. Існують три основних підтипи PPAR: PPAR-α, PPAR-β/δ і PPAR-γ. Ці рецептори, взаємодіючи з певними молекулами, регулюють діяльність генів, що відповідають за підтримку метаболічного балансу, обмін речовин та зменшення запалення.
Рецептор PPAR-γ регулює важливі процеси, пов’язані з ліпідним обміном і метаболізмом глюкози. Канабіноїди можуть активувати PPAR-γ, що призводить до зниження рівня запалення, покращення чутливості до інсуліну та зменшення рівня холестерину і тригліцеридів у організмі. Це має потенціал для лікування таких хвороб, як діабет типу 2 та метаболічний синдром.
Крім того, PPAR-α бере участь у регуляції рівня ліпідів і жирних кислот у печінці та інших тканинах. Модулювання цієї активності канабіноїдами, включаючи CBEA-B, може позитивно впливати на кардіометаболічне здоров’я, зменшуючи ризик розвитку серцево-судинних захворювань, таких як атеросклероз або гіпертонія.
Таким чином, CBEA-B має потенціал діяти через PPAR-рецептори, що робить його перспективним кандидатом для розробки терапевтичних засобів, які спрямовані на лікування запальних і метаболічних захворювань, а також для регулювання енергетичного гомеостазу в організмі.
Г-протеїн-зв’язувані рецептори (GPR)
Г-протеїн-зв’язувані рецептори (GPR) – це велика група рецепторів, які регулюють внутрішньоклітинну сигналізацію через зв’язування з г-протеїнами. Вони є важливими компонентами нейропластичності, запальних процесів, а також у регуляції енергетичного обміну.
Особливий інтерес представляє GPR55, який бере участь у модуляції різних фізіологічних процесів, включаючи нейропластичність і больові відчуття. Згідно з дослідженнями, GPR55 може мати важливе значення для регуляції нейрогенезу та синаптичної пластичності, що робить його перспективною мішенню для лікування нейродегенеративних захворювань.
Взаємодія з GPR55 може призвести до зміни нервової провідності, зменшення болю і поліпшення нейропластичності. Існує також теоретична можливість використання CBEA-B для терапії захворювань, таких як хронічний біль, порушення пам’яті, або навіть депресія через механізми, пов’язані з GPR55.
Епігенетичний потенціал та транскрипційна активність
Взаємодія з епігенетичними механізмами
Епігенетика вивчає зміни у вираженні генів, які не включають зміни в самій ДНК. Такі зміни можуть включати метилювання ДНК, ацетилювання гістонів і мікроРНК, які здатні змінювати активність генів у відповідь на зовнішні або внутрішні сигнали. Епігенетичні механізми є критично важливими для розвитку клітин, а також для багатьох патологічних процесів, таких як рак, нейродегенерація, метаболічні розлади і хронічні запалення.
Вплив канабіноїдів, зокрема CBEA-B, на епігенетичні механізми є перспективною галуззю для подальших досліджень. Відомо, що канабіноїди можуть впливати на деацетилази та метилтрансферази, що відповідають за активацію або пригнічення конкретних генів. Це може мати значення в контексті таких захворювань, як рак, серцево-судинні захворювання, неврологічні порушення та аутоімунні хвороби.
CBEA-B може змінювати активність епігенетичних регуляторів, таких як HDAC (гістондеацетилази), що можуть регулювати рівень запальних процесів в організмі, знижуючи або збільшуючи експресію генів, що відповідають за запалення, антиоксидантний захист, імунний відгук та метаболізм.
Транскрипційна активність
Канабіноїди мають здатність впливати на транскрипцію генів через активацію певних ядерних рецепторів, таких як PPAR, LXR (liver X receptor) та NRF2 (ядерний фактор еритроїдного 2). Ці рецептори відіграють важливу роль у регуляції антиоксидантної активності, ліпідного обміну та обміну глюкози, що робить їх важливими мішенями для терапії метаболічних і серцево-судинних захворювань.
CBEA-B, ймовірно, має здатність впливати на активацію транскрипційних факторів, які регулюють антиоксидантний захист та запальні процеси в організмі. Зокрема, CBEA-B може активувати NRF2, який відповідає за детоксикацію і захист клітин від оксидативного стресу, що має особливе значення при лікуванні нейродегенеративних захворювань та серцево-судинних порушень.
Біотрансформація та метаболізм каннабілсоєвої кислоти B (CBEA-B)
Перетворення в організмі та роль ензимів фази I–II
Біотрансформація CBEA-B в організмі є складним процесом, який включає в себе кілька стадій, що здійснюються через ферменти фази I і фази II метаболізму. Ці стадії забезпечують метаболічну активність та стабільність молекули, що важливо для її фармакокінетичних властивостей.
Фаза I метаболізму
Метаболізм каннабілсоєвої кислоти B (CBEA-B) на першій стадії включає окислювальні реакції, які здебільшого каталізуються ферментами цитохрому P450 (CYP450). Ці ензими забезпечують окиснення, гідроксилювання або інші реакції модифікації функціональних груп на молекулі. У випадку CBEA-B ці ферменти можуть включати:
- CYP3A4 – цей фермент має високу активність у метаболізмі багатьох лікарських засобів, а також у метаболізмі канабіноїдів. Окислення за участю CYP3A4 може призвести до утворення гідроксильованих метаболітів, що можуть мати іншу біологічну активність у порівнянні з первісною молекулою.
- CYP2C9 – ще один важливий фермент, який бере участь у метаболізмі канабіноїдів. CYP2C9 також може впливати на перетворення CBEA-B, зокрема на перетворення його у гідроксильовані продукти.
Окиснення молекули каннабілсоєвої кислоти в результаті дії ферментів CYP здебільшого призводить до утворення метаболітів, які мають знижене фармакологічне або токсичне дію в організмі. Однак для CBEA-B можливе утворення продуктів, які можуть взаємодіяти з клітинними мішенями, що відкриває потенціал для лікування певних хронічних захворювань.
Фаза II метаболізму
На стадії фази II, метаболіти, утворені в результаті окиснення, можуть піддаватися кон’югації з певними молекулами для полегшення їх виведення з організму. Одним з основних процесів цієї фази є глюкуронізація, сульфуризація або метилювання, що дозволяє перетворювати гідроксильовані метаболіти в більш полярні сполуки, здатні легше виводитись через сечу або жовч.
- UDP-глюкуронілтрансферази (UGTs) – це клас ферментів, які здатні приєднувати глюкуронову кислоту до метаболітів CBEA-B. Це робить молекулу менш ліпофільною і сприяє її виведенню через нирки. Глюкуронід CBEA-B може мати іншу біологічну активність у порівнянні з первісним сполуками, що також варто враховувати при розробці терапевтичних застосувань.
- Сульфотрансферази (SULTs) – ще один клас ферментів фази II, які здійснюють приєднання сульфатної групи до молекули. Це також сприяє виведенню метаболітів через сечу.
У разі CBEA-B, глюкуронізація та сульфуризація можуть знижувати активність метаболітів, перетворюючи їх на неактивні форми, що знижує ризик токсичності. Тим не менше, певні метаболіти можуть зберігати активність і навіть викликати специфічні ефекти через вплив на рецептори чи клітинні мішені.
Порівняльна стабільність у плазмі, печінці, мікробіомі
Стабільність у плазмі
Після потрапляння в організм, CBEA-B швидко зв’язується з білками плазми, що забезпечує його транспортування до різних тканин. Ступінь зв’язування з білками плазми може варіювати в залежності від концентрації та фармакокінетичних параметрів молекули. Через цей процес CBEA-B може зберігати свою активність протягом певного часу в крові, що дозволяє йому впливати на клітинні мішені на різних етапах метаболізму.
Стабільність у печінці
Печінка є основним органом для метаболізму, де ферменти фази I і II здійснюють активні перетворення багатьох лікарських засобів та інших хімічних сполук. У печінці CBEA-B піддається інтенсивному метаболізму, де CYP450 ферменти відіграють важливу роль у його перетворенні в активні або неактивні метаболіти. Тому стабільність CBEA-B у печінці є важливим фактором, який визначає, як довго молекула зберігає свою активність і чи буде вона піддана швидкому виведенню.
Стабільність у мікробіомі
Мікробіом, особливо кишковий, може також відігравати роль у метаболізмі канабіноїдів, таких як CBEA-B. Деякі бактерії мікрофлори здатні метаболізувати різноманітні органічні сполуки, включаючи канабіноїди, через ферменти, що розщеплюють зв’язки молекул. Це може призводити до деградації CBEA-B або утворення нових метаболітів, які можуть мати іншу біологічну активність. Таким чином, мікробіом може значно впливати на стабільність CBEA-B у шлунково-кишковому тракті та його ефективність.
Методи виявлення у біологічних зразках
LC-MS/MS підходи для мікродозових концентрацій
Одним з основних методів виявлення та кількісного визначення CBEA-B у біологічних зразках є рідинна хроматографія з мас-спектрометрією (LC-MS/MS). Цей метод дозволяє виявляти навіть мікродозові концентрації молекул в крові, сечі або інших біологічних рідинах з високою точністю і чутливістю.
LC-MS/MS поєднує розділення молекул на колонці з рідинною хроматографією та подальший аналіз мас-сигналів за допомогою мас-спектрометрії, що дозволяє точно визначити молекулярну масу та структурні особливості метаболітів CBEA-B. Цей підхід є надзвичайно корисним для аналізу малих доз канабіноїдів, які можуть бути трудно виявленими за допомогою інших методів, таких як газова хроматографія.
Розділення ізомірів та артефактів у складних матрицях
Однією з важливих проблем при виявленні канабіноїдів у біологічних зразках є наявність ізомірів та артефактів, які можуть ускладнити точне визначення метаболітів. CBEA-B, як і інші канабіноїди, може існувати в кількох ізомерних формах, і їх точне розрізнення є критично важливим для оцінки його біологічної активності та метаболічних шляхів.
Методи, що включають спектрометрію мас, дозволяють ефективно розрізняти ізомери та мінімізувати ефект артефактів, що можуть виникати в результаті аналізу складних матриць, таких як сироватка крові або мікробіом. Сучасні методи розділення, зокрема рідинна хроматографія високої роздільної здатності (HPLC), можуть допомогти отримати точні результати навіть за умови складних забруднень і низької концентрації молекул.
Інноваційні напрями досліджень каннабілсоєвої кислоти B (CBEA-B)
CRISPR/Cas-модульоване посилення синтезу в культурі
Одним із найбільш перспективних напрямів досліджень для CBEA-B є використання технології CRISPR/Cas для модифікації геному організмів, що використовуються для біосинтезу цієї молекули. Це дозволяє з точністю регулювати процеси синтезу каннабілсоєвої кислоти в клітинних культурах або мікроорганізмах, таких як дріжджі чи бактерії.
CRISPR/Cas9 дозволяє внести точкові мутації у гени, що кодують ферменти, відповідальні за синтез CBEA-B. Завдяки цьому можна отримати штучно інженеровані клітини, які будуть мати збільшену здатність до виробництва CBEA-B, що має важливе значення для фармацевтичної промисловості, зокрема в контексті створення біофармацевтичних препаратів на основі цієї сполуки.
Одним із основних переваг такого підходу є можливість експресії генно модифікованих організмів в умовах промислового масштабування, що забезпечить стабільне і масове виробництво CBEA-B для подальшого використання в наукових дослідженнях і медичних цілях.
Наприклад, застосування CRISPR/Cas для активації або збільшення експресії генів, що кодують ферменти фази I та II метаболізму в культурі, може значно підвищити ефективність біосинтезу CBEA-B та зменшити кількість необхідних етапів у його виробництві. Такий підхід дозволяє також знизити витрати на виробництво і підвищити стабільність продукту, що робить CBEA-B більш доступним для подальших досліджень.
Перспективи CBEA-B як біомаркера специфічних хемотипів
Оскільки CBEA-B має складну молекулярну структуру та взаємодіє з численними рецепторами та метаболічними шляхами, його потенціал як біомаркер для визначення специфічних хемотипів в організмах (зокрема у людини) є значним. Визначення хемотипів може допомогти у персоналізованій медицині, де вибір лікування або дієти базується на генетичних або метаболічних особливостях пацієнта.
Сьогодні вже відомо, що каннабіноїди, до яких відноситься CBEA-B, можуть мати різні ефекти залежно від генетичної передиспозиції організму, включаючи варіації у рецепторах CB1 і CB2, PPAR-рецепторах, а також різні механізми метаболізму каннабіноїдів в організмі. Вивчення кореляції між рівнем CBEA-B і певними генетичними чи метаболічними маркерами може стати основою для розробки нових методів діагностики та терапії захворювань, пов’язаних з порушеннями в метаболічних шляхах каннабіноїдів.
CBEA-B може виступати як маркер для персоналізованої терапії, оскільки різні пацієнти можуть по-різному реагувати на каннабіноїди в залежності від їх генетичних особливостей. Наприклад, хемотипи, пов’язані з високим або низьким рівнем метаболізму каннабіноїдів, можуть бути використані для визначення оптимальних доз CBEA-B або інших канабіноїдів у лікувальних цілях.
Висновок:
Каннабілсоєва кислота B (CBEA-B) є важливим представником канабіноїдів, що привертає увагу наукової спільноти завдяки своїй унікальній молекулярній структурі та потенціалу в медичних і фармацевтичних застосуваннях. Вона належить до окиснених похідних каннабілінової серії і демонструє значну біологічну активність, взаємодіючи з різними рецепторами та метаболічними шляхами, що відкриває нові можливості для лікування запальних, нейротропних та метаболічних захворювань.
Дослідження CBEA-B у контексті біогенезу і молекулярних мішеней демонструють, що ця молекула може впливати на системи TRP, PPAR і GPR, що робить її важливим об’єктом для розробки терапевтичних стратегій. Методи, такі як CRISPR/Cas, дозволяють генетично модифікувати організми для збільшення продукції CBEA-B, що може значно покращити ефективність її використання в медицині та біотехнології.
Метаболічні шляхи та стабільність CBEA-B в організмі вимагають подальших досліджень, особливо в контексті її взаємодії з ферментами фази I та II. Це важливо для розуміння її фармакокінетичних властивостей та потенціалу для застосування у медичних препаратах. Використання LC-MS/MS технологій дозволяє точно визначити метаболіти CBEA-B у біологічних зразках, що відкриває нові можливості для діагностики та моніторингу ефективності лікування.
Перспективи CBEA-B як біомаркера специфічних хемотипів Cannabis sativa L. також виглядають обнадійливо, оскільки це може допомогти у персоналізованій медицині та підвищити точність терапії. Визначення хемотипів допоможе налаштувати лікування відповідно до генетичних і метаболічних характеристик пацієнта, що є важливим для успішного використання каннабіноїдів у медичній практиці.
Отже, CBEA-B має значний потенціал у численних галузях науки та медицини, і подальші дослідження в цій сфері можуть призвести до нових відкриттів і застосувань, що сприятимуть розвитку біомедичних технологій та фармацевтики.
Джерела:
- PubMed Central (PMC) – Національний інститут охорони здоров’я США (NIH) надає доступ до досліджень про каннабіноїди та їх молекулярні властивості, що можуть бути корисними для розуміння CBEA-B та його біохімії. https://www.ncbi.nlm.nih.gov/pmc/
- NIH RePORTER – Платформа для пошуку фінансованих наукових досліджень та публікацій, що охоплюють каннабіноїди, включаючи CBEA-B, фармакологічні властивості та біогенез. https://reporter.nih.gov/
- Frontiers in Pharmacology – Відкритий журнал з фармакології, який публікує дослідження про каннабіноїди, їх молекулярні мішені та фармакологічні ефекти, що можуть стосуватися CBEA-B. https://www.frontiersin.org/journals/pharmacology
- The Royal Society of Chemistry (RSC) – Публікації з хімії та біохімії, де можна знайти статті про структуру і біохімію каннабіноїдів, включаючи CBEA-B. https://www.rsc.org/
- NCBI (National Center for Biotechnology Information) – Платформа, що надає доступ до досліджень, які включають молекулярну біологію каннабіноїдів та інші відповідні статті. https://www.ncbi.nlm.nih.gov/
- ScienceDirect (Elsevier) – Відкриті статті з фармакології та біохімії, включаючи дослідження про молекулярні мішені каннабіноїдів, які можуть бути корисні для розуміння властивостей CBEA-B. https://www.sciencedirect.com/
- ResearchGate – Наукова платформа, де можна знайти дослідження з каннабіноїдів і їх фармакологічних властивостей. https://www.researchgate.net/