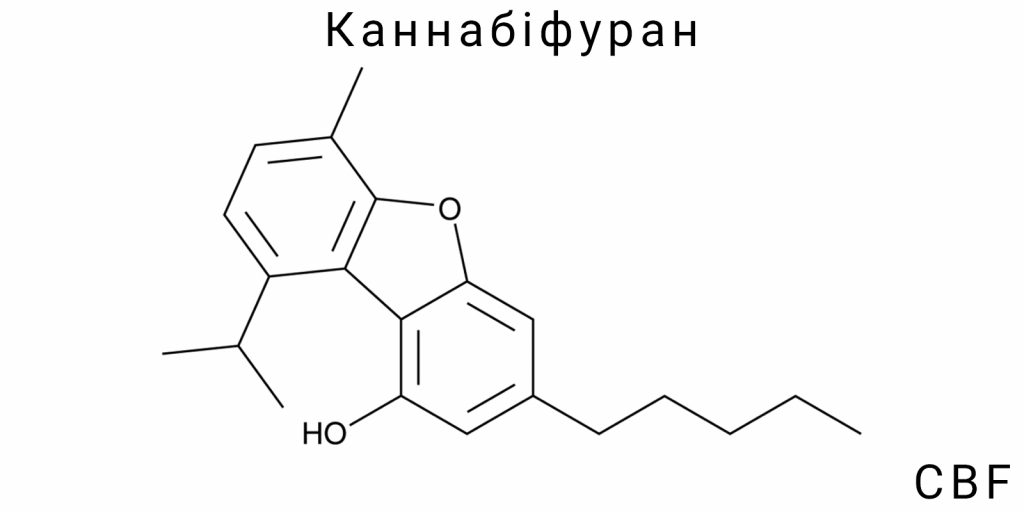
Каннабіфуран (CBF) є хімічною сполукою, що належить до класу синтетичних каннабіноїдів, які моделюють біохімічну активність природних каннабіноїдів, виділених із рослин роду Cannabis. Хоча природні каннабіноїди широко вивчені, зокрема такі, як тетрагідроканабінол (THC) і канабідіол (CBD), Каннабіфуран характеризується унікальними структурними особливостями, які визначають його специфічний профіль фармакологічної активності. Вивчення молекули CBF набуває значення як у контексті хімічного синтезу, так і в біомедичних дослідженнях, з огляду на її потенціал у різних галузях, включно з фармакологією, токсикологією та біотехнологіями.
Молекулярна структура Каннабіфурану вирізняється наявністю фуранового кільця, що конденсоване з основною каннабіноїдною скелетною системою, що забезпечує високу ліпофільність і специфічні властивості взаємодії з рецепторами ендоканабіноїдної системи. Ця особливість визначає тонку регуляцію зв’язку молекули з рецепторами CB1 і CB2, що є центральними компонентами нейромодуляторних та імунних процесів в організмі. Відмінності у спорідненості до рецепторів і активації вторинних сигнальних каскадів ставлять CBF у категорію речовин із потенційно широким спектром біологічних ефектів.
З огляду на хімічну структуру, синтез Каннабіфурану являє собою складний процес, який вимагає точного контролю умов реакції та вибору відповідних прекурсорів і каталізаторів. Наукова увага до методів його отримання зумовлена не лише прагненням отримати чистий і стабільний продукт, але й необхідністю дослідити варіативність структури для пошуку оптимальних фармакологічних властивостей. Сучасні методи синтезу включають як класичні органічні реакції, так і інноваційні підходи, що використовують каталізатори переходних металів та “зелені” хімічні технології, які знижують екологічне навантаження і підвищують вихід продукту.
Природні джерела каннабіфурану залишаються недостатньо вивченими, проте існують відомості про потенційну біосинтетичну активність деяких штамів Cannabis sativa, у яких ферментативні системи сприяють утворенню похідних з фурановим кільцем. Окрім традиційних рослинних шляхів, досліджуються біотехнологічні методи синтезу за допомогою рекомбінантних мікроорганізмів, що відкриває нові перспективи для масштабного виробництва CBF із заданими характеристиками. Аналіз метаболічних шляхів та ідентифікація ферментів, які каталізують утворення фуранових структур, є ключовими для розробки ефективних біосинтетичних платформ.
Фармакологічний профіль Каннабіфурану включає вивчення його взаємодії з рецепторами ендоканабіноїдної системи, що визначає його потенційну здатність впливати на широкий спектр біологічних процесів, включно з нейромодуляцією, імунорегуляцією та метаболічною активністю. Механізми дії CBF досліджуються із застосуванням експериментальних моделей in vitro і in vivo, що дозволяє визначити його вплив на клітинні сигнальні каскади, а також профіль фармакокінетики, який характеризує швидкість і шляхи метаболізму, біодоступність та період напіврозпаду.
З точки зору токсикології, Каннабіфуран викликає інтерес як зразок синтетичного каннабіноїду, для якого необхідно встановити межі безпечного застосування, потенційні побічні ефекти і механізми токсичної дії. Стандартизовані методики дослідження гострої і хронічної токсичності, а також оцінка канцерогенності і мутагенності є обов’язковими складовими для визначення профілю безпеки CBF. Ці дані є критичними не лише для фармацевтичних розробок, а й для розуміння впливу на здоров’я у разі ненавмисного чи зловмисного вживання.
Аналітичні методи дослідження Каннабіфурану включають спектроскопічні техніки (ЯМР, ІЧ-спектроскопія, УФ-спектроскопія), хроматографічні методи (ВЕРХ, ГХ-МС) та мас-спектрометрію, що забезпечують комплексну характеристику хімічної структури, чистоти та стабільності зразків. Контроль якості продукту вимагає валідації методів аналізу, що відповідають суворим критеріям точності, відтворюваності та специфічності. Зберігання і стабілізація Каннабіфурану також вивчаються з метою визначення оптимальних умов, які запобігають деградації та збереженню біологічної активності.
Хімічна структура та фізико-хімічні властивості
Каннабіфуран (CBF) належить до групи синтетичних каннабіноїдів, для яких характерна унікальна молекулярна структура, що визначає їх фізико-хімічні властивості та біологічну активність. Ця сполука відрізняється наявністю фуранового кільця, яке конденсовано з каннабіноїдним скелетом, що істотно впливає на її ліпофільність, стабільність і реактивність. Структурна конфігурація CBF визначає його здатність до специфічної взаємодії з молекулярними мішенями, зокрема рецепторами ендоканабіноїдної системи, що робить її предметом активних досліджень у сфері біохімії та фармакології.
Основою хімічної структури Каннабіфурану є цикл із п’яти атомів – фуранове кільце, насичене одним киснем, що створює специфічні електронні умови в молекулі. Приєднання фуранового фрагменту до каннабіноїдного ядра формує сполуку з підвищеною електронною щільністю у визначених ділянках молекули, що впливає на її фізичні та хімічні параметри, такі як розчинність у різних середовищах, температура плавлення та стійкість до окиснення. Ці характеристики мають фундаментальне значення для розуміння поведінки CBF у біологічних системах і під час синтезу.
Фізико-хімічні властивості Каннабіфурану тісно пов’язані з його молекулярною геометрією та електронною структурою. Ліпофільність, яка є критичним параметром для проникнення молекули через клітинні мембрани, забезпечується наявністю не полярних гідрофобних груп у структурі. Ця властивість визначає здатність CBF до пасивної дифузії у ліпідних середовищах і, відповідно, впливає на його біодоступність та фармакокінетичні характеристики.
Стабільність Каннабіфурану визначається як внутрішньою структурою, так і зовнішніми умовами середовища. Молекула проявляє помірну термічну стійкість, однак піддається фотолізу та окисненню за наявності кисню і світла, що є важливим для зберігання та транспортування. Хімічна стабільність також залежить від рН середовища: у кислотних або лужних розчинах можуть відбуватися гідролітичні або конденсаційні реакції, які змінюють первинну структуру і, як наслідок, біологічну активність.
Взаємодія Каннабіфурану з різними розчинниками демонструє варіабельну розчинність, що зумовлено специфікою електронної структури і полярності молекули. Найкраще CBF розчиняється у неполярних і слабо полярних органічних розчинниках, таких як хлороформ, дихлорметан, а також у ліпідних середовищах. Водна розчинність є низькою, що характерно для більшості каннабіноїдів, і обмежує використання сполуки у водних біологічних системах без додаткових носіїв чи емульгаторів.
Хімічна структура Каннабіфурану також визначає його здатність до конформаційної гнучкості, що має значення для взаємодії з біологічними рецепторами. Варіації в просторовому розташуванні функціональних груп забезпечують адаптивність молекули до різних типів рецепторів, що пояснює різноманітність біологічних ефектів, зафіксованих у експериментальних дослідженнях. Конформаційна мінливість також впливає на фармакодинамічні властивості, зокрема афінність до рецепторних місць.
Додатково, Каннабіфуран демонструє характерні спектроскопічні властивості, які відображаються у чітких смугах поглинання у спектрах УФ-Видимого діапазону, а також у специфічних відгуках у ЯМР-спектрах. Ці фізико-хімічні характеристики слугують основою для ідентифікації та контролю чистоти CBF, що є важливим у процесах синтезу та подальшого застосування. Застосування спектроскопії дозволяє отримати детальну інформацію про електронну структуру та конформацію молекули.
Фізико-хімічні властивості Каннабіфурану визначають також його поведінку у складних системах, таких як біологічні мембрани чи фармацевтичні препарати. Взаємодія з білками, ліпідами та іншими біомолекулами залежить від електростатичних і ван-дер-ваальсових сил, що є критичними для формування стабільних комплексів. Це впливає на фармакологічну активність та розподіл молекули у живих організмах.
Молекулярна формула і будова
Каннабіфуран (CBF) має чітко визначену молекулярну формулу, яка відображає кількісний склад атомів у молекулі і є основою для її просторової та електронної структури. Формула CBF – C21H26O2, що вказує на наявність 21 атома вуглецю, 26 атомів водню та 2 атомів кисню. Ця формула демонструє, що молекула містить два функціональні кисневмісні елементи, які структурно представлені у вигляді фуранового кільця, що є незмінним компонентом молекули і визначальним для її хімічної специфіки.
Будова Каннабіфурану складається з конденсованих циклів, де основою є тричленний ароматичний ядро каннабіноїду, до якого приєднане п’ятичленне кисневе кільце – фуранове. Особливістю молекули є взаємне розташування цих циклів у просторі, що створює специфічну тривимірну конформацію з певними кутами зв’язків і просторовими обмеженнями. Конформація визначається як жорсткістю фуранового кільця, так і рухливістю бічних ланцюгів, що в сукупності впливає на фізико-хімічні параметри та взаємодію з біологічними мішенями.
Циклічна система молекули формується ароматичним бензольним кільцем, до якого приєднані додаткові циклічні фрагменти та аліфатичні бічні ланцюги. Ці ланцюги включають насичені вуглецеві фрагменти з різною довжиною, які виконують функцію модуляторів ліпофільності і хімічної стабільності. Структурна складність молекули CBF дозволяє класифікувати її як поліконденсований ароматичний ефір із складною архітектурою, де електронна щільність локалізується у визначених сегментах, що є критичним для реактивності.
Хімічні зв’язки у молекулі мають специфічні параметри довжини і кута нахилу, які визначають електронний розподіл і геометричні властивості. Зокрема, кисень у фурановому кільці формує σ- та π-зв’язки, що забезпечують часткову кон’югацію з ароматичною системою. Це створює зони підвищеної електронної густини, що підсилює електрофільність фрагментів молекули і впливає на механізми хімічної взаємодії.
Просторова орієнтація функціональних груп визначає можливості утворення внутрішньомолекулярних водневих зв’язків, які стабілізують конформацію і мінімізують енергетичний потенціал. Аналіз молекулярних моделей показує, що бічні аліфатичні групи розташовані так, щоб уникати стеричних перешкод, що підвищує термодинамічну стабільність структури.
Каннабіфуран є прикладом молекули з гетероциклічним кільцем, що містить кисень, який підвищує полярність локальних ділянок, створюючи дипольні моменти. Ці моменти важливі для взаємодії з біологічними рецепторами, а також для розчинності у полярних і неполярних розчинниках. Молекулярний дипольний момент має значення для прогнозування фармакокінетичних характеристик і транспортування через клітинні мембрани.
Специфіка молекулярної будови Каннабіфурану полягає в оптимальному співвідношенні жорстких циклічних систем і гнучких бічних ланцюгів, що забезпечує молекулі здатність адаптуватися до різних просторових умов в рецепторних зонах. Це властивість є суттєвою для селективності дії та високої афінності до певних підтипів каннабіноїдних рецепторів.
Електронна структура молекули характеризується розподілом π-електронів у ароматичних і фуранових кільцях, що створює потенціал для участі в реакціях електрофільного і нуклеофільного характеру. Такий розподіл визначає хімічну активність, зокрема здатність до окислювальних процесів і утворення стабільних радикальних проміжних сполук.
Інтенсивний розподіл зарядів по молекулі визначає її потенціал взаємодії з катіонними і аніонними середовищами, що має практичне значення для синтезу похідних з модифікованими властивостями, а також для фармакодинамічних досліджень. Внутрішньомолекулярні сили впливають на конфігурацію молекули і стабілізують її в певних електронних станах.
Крім основної молекули, у структурі можливі існування та ізомери з варіаціями у розташуванні бічних ланцюгів або у конфігурації фуранового кільця. Ізомерія може впливати на фармакологічну активність, стабільність і фармакокінетику, що актуалізує потребу в докладному вивченні стереохімії CBF.
Сучасні методи молекулярного моделювання та рентгенівської кристалографії дозволяють отримати точні тривимірні структури Каннабіфурану, що сприяє розумінню його взаємодії з біомолекулярними мішенями на атомарному рівні. Ці дослідження критичні для розробки синтетичних аналогів з удосконаленими фармакологічними характеристиками.
Фізико-хімічні характеристики (розчинність, стабільність, спектроскопія)
Фізико-хімічні характеристики Каннабіфурану (CBF) є ключовими для визначення його поведінки в різних середовищах, а також для контролю його якості і ефективності у дослідницьких та прикладних процесах. Розчинність, стабільність і спектроскопічні властивості CBF характеризують його взаємодію із зовнішнім середовищем, що є фундаментальним для аналізу біологічної доступності і хімічної ідентифікації.
Розчинність Каннабіфурану визначається його молекулярною будовою та полярністю, що безпосередньо впливає на здатність молекули диспергуватись у різних розчинниках. CBF відзначається низькою водорозчинністю через високу ліпофільність, що пов’язано з наявністю значної частки неполярних вуглецевих ланцюгів і ароматичних фрагментів у структурі. Однак розчинність у неполярних та слабо полярних органічних розчинниках, таких як гексан, толуол, хлороформ, та дихлорметан, є високою, що відображає схильність молекули до розчинення в середовищах з подібними фізико-хімічними властивостями. Ця особливість є критичною для підготовки розчинів для хроматографічного аналізу, а також для розробки фармацевтичних форм.
Показники розчинності CBF у воді знаходяться на межі нижчих часток міліграма на мілілітр, що суттєво обмежує його використання у водних середовищах без застосування додаткових ад’ювантів або носіїв, таких як циклодекстрини або мікроемульсії. Така фізико-хімічна особливість зумовлює необхідність застосування специфічних технологій для покращення біодоступності і формування стабільних препаратів.
Стабільність Каннабіфурану визначається його чутливістю до умов оточуючого середовища, зокрема до дії світла, кисню, температурних коливань і рН. Фотолабільність CBF пов’язана із здатністю фуранового кільця до розпаду під впливом ультрафіолетового випромінювання, що призводить до розриву π-зв’язків і утворення вільних радикалів. Це явище потребує ретельного контролю умов зберігання, особливо уникання прямого сонячного світла та використання захисної упаковки з ультрафіолетовим фільтром.
Окислювальна стабільність молекули відображає її реакційну здатність до кисню в атмосфері. Наявність електронно-багатого фуранового фрагменту створює зони підвищеної хімічної активності, де можливий перехід молекули у реактивні проміжні стани з утворенням пероксидів та інших окислювальних продуктів. Такі процеси змінюють первинну структуру CBF, знижують його ефективність і можуть спричинити утворення токсичних метаболітів, що актуалізує потребу в антиоксидантних стабілізаторах при довготривалому зберіганні.
Термостабільність Каннабіфурану обмежена, що виявляється у поступовому розпаді при підвищених температурах вище 120°C. Декомпозиція супроводжується руйнуванням ароматичного ядра та відкриттям фуранового кільця, що спричиняє втрату молекулярної цілісності і зміну фармакологічної активності. Ця особливість впливає на вибір умов синтезу, зберігання та обробки CBF, зокрема, у фармацевтичному виробництві та дослідженнях.
Спектроскопічні характеристики Каннабіфурану включають УФ-Видиму, інфрачервону (ІЧ), ядерний магнітний резонанс (ЯМР) та мас-спектрометрію, що є невід’ємною частиною ідентифікації та структурного аналізу.
УФ-Видима спектроскопія CBF демонструє характерні смуги поглинання у діапазоні 250-320 нм, що пов’язано із π→π* переходами в ароматичній системі та n→π* переходами кисневих непарних електронів у фурановому кільці. Інтенсивність та положення цих піків залежать від розчинника і температури, що дозволяє використовувати цей метод для кількісного аналізу та визначення концентрації у розчинах.
Інфрачервона спектроскопія виявляє типові смуги, які відповідають функціональним групам молекули. Відсутність широкої смуги в діапазоні 3200-3600 см⁻¹ підтверджує відсутність вільних гідроксильних груп, тоді як чіткі смуги у зоні 1000-1300 см⁻¹ відповідають С-О-С зв’язкам фуранового кільця. Піки в діапазоні 1500-1600 см⁻¹ відображають ароматичні С=С зв’язки, що підтверджує збереження кон’югованої системи. Ці спектральні характеристики є критично важливими для контролю чистоти та ідентифікації CBF.
ЯМР-спектроскопія, особливо протонний (¹H) і вуглецевий (¹³C) ЯМР, дає докладну інформацію про хімічне оточення атомів у молекулі. Хімічні зсуви протонів у ароматичній частині розташовані в діапазоні 6.5-7.5 ppm, тоді як аліфатичні групи характеризуються сигналами у нижчому діапазоні 0.8-2.5 ppm. Специфічні зсуви, пов’язані з атомами, що входять до складу фуранового кільця, дозволяють підтвердити конформацію та ідентифікувати можливі ізомери. Вуглецевий ЯМР демонструє сигнали, які відповідають різним типам вуглецю, включаючи ароматичні, аліфатичні та гетероциклічні.
Мас-спектрометрія CBF показує молекулярний іонний пік, що відповідає молекулярній масі 310 г/моль, з характерним набором фрагментів, що відображають розриви в молекулі за визначеними каналами. Фрагментація дає можливість відокремити структури, що включають фуранове кільце і аліфатичні ланцюги, що є важливим для підтвердження будови та контролю продукту синтезу.
Хімічна реактивність
Хімічна реактивність Каннабіфурану (CBF) визначається його структурними особливостями – присутністю фуранового кільця, ароматичного ядра та бічних аліфатичних ланцюгів, що взаємодіють із різними реактивами за специфічними механізмами. Ці механізми формують спектр можливих реакцій, у яких CBF може брати участь, а також визначають хімічну стабільність, трансформації та потенційні шляхи модифікації молекули.
Основна реактивність молекули зумовлена електронною насиченістю фуранового кільця. Це гетероциклічне кільце із киснем проявляє високу реакційну здатність у реакціях електрофільного заміщення, нуклеофільного відкриття циклу та окислювально-відновних процесах. Відкриття фуранового кільця може відбуватися під дією сильних кислот або основ, що призводить до розриву зв’язків С-О та утворення реактивних альдегідів або кетонів. Така реакція є фундаментальною для отримання похідних із зміненою функціональністю.
У межах ароматичного ядра CBF спостерігаються класичні реакції електрофільного ароматичного заміщення, які можуть відбуватися з утворенням різних похідних за рахунок заміщення водню на нуклеофільні або електрофільні групи. Важливо, що присутність фуранового кільця і бічних аліфатичних груп значно модулює електронну густину в ароматичній системі, змінюючи реакційну здатність позицій до заміщення. Ця взаємодія впливає на селективність реакції, дозволяючи синтезувати цілеспрямовані функціоналізовані сполуки.
Взаємодія Каннабіфурану з окисниками – окремий клас реакцій, у яких молекула зазнає перетворень із залученням електронів. Окислення фуранового кільця в присутності пероксидів або сильних окислювачів веде до формування лактонів, карбонових кислот або інших оксигенованих продуктів, що змінюють фізико-хімічні характеристики та біологічну активність. Окислювальні процеси можуть бути як каталізовані металевими іонами, так і протікати під впливом світла, що пов’язано з фотохімічною лабільністю CBF.
Реакції відновлення Каннабіфурану в основному спрямовані на трансформацію функціональних кисневмісних груп. При дії відновників, таких як гідриди металів (NaBH4, LiAlH4), можливе відновлення фуранового кільця з утворенням гідрогенізованих циклічних похідних або гідроксильних замінників. Ці реакції важливі для синтезу аналогів з модифікованими фармакологічними властивостями.
Нуклеофільна реактивність CBF проявляється в здатності молекули вступати у взаємодію з електрофільними центрами завдяки донорним властивостям кисню у фурановому кільці. Зокрема, CBF здатний утворювати аддукти з активними галогенами або ізотопними агентами, що відкриває можливості для створення мічених похідних у радіохімічних дослідженнях. Нуклеофільне заміщення також використовується у синтетичних схемах, що модифікують бічні ланцюги для підвищення селективності.
Каннабіфуран демонструє реакції конденсації і циклізації, які є результатом взаємодії функціональних груп у межах молекули або з додатковими реагентами. Ці реакції сприяють утворенню нових циклів або макроциклів, що значно розширює хімічний простір похідних CBF. Важливим аспектом є вибір умов реакції (рН, температура, каталізатори), які визначають кінетичні і термодинамічні параметри реакції.
Реакції полімеризації та полімерного зв’язування із CBF, хоча і менш вивчені, мають потенціал для створення нових матеріалів із специфічними властивостями. Механізми включають радикальні та іонні ініціації, де фуранове кільце може виступати як активний центр для зв’язування з іншими мономерами або полімерами. Це відкриває перспективи для створення функціональних полімерів з біологічною активністю.
Каннабіфуран здатний до утворення комплексів з металевими іонами, що визначає його координаційну хімію. Координаційні зв’язки утворюються переважно через кисень у фурановому кільці, що надає молекулі можливість взаємодії з катіонами перехідних металів. Ці властивості використовуються для створення каталізаторів і вивчення металоорганічних систем із специфічною реактивністю.
Хімічна реактивність CBF також визначається його здатністю до радикальних процесів, зокрема, утворення вільних радикалів під впливом ультрафіолетового світла або хімічних ініціаторів. Радикальні механізми беруть участь у реакціях розпаду, полімеризації і трансформації функціональних груп, що має значення для розуміння стабільності та хімічної поведінки молекули в екстремальних умовах.
Важливим аспектом є реакції ізоціанатів і ізоціанурових сполук, які можуть вступати у взаємодію з аміногрупами або гідроксилом, присутніми у похідних CBF, що дозволяє синтезувати полімери або кон’югати для біомедичних застосувань.
Методи синтезу Каннабіфурану
Синтез Каннабіфурану (CBF) передбачає комплексний підхід, що базується на послідовному виконанні хімічних реакцій, які дозволяють сформувати його унікальну структуру з високою селективністю та чистотою продукту. Основні методи синтезу включають різні стратегії побудови фуранового кільця, формування ароматичної системи та інтеграцію аліфатичних бічних ланцюгів у молекулу. Кожен етап синтезу вимагає чіткої оптимізації умов, вибору реагентів і методів контролю процесу для досягнення бажаного результату.
Структурно синтез Каннабіфурану можна розділити на три ключові стадії: формування гетероциклічного ядра, заміщення ароматичного кільця та конденсація з аліфатичними фрагментами. Ці етапи вимагають використання різних типів реакцій, таких як циклізація, електрофільне заміщення, алкілювання та окремі редокс-процеси, що забезпечують поступове нарощування молекули.
Перший етап, формування фуранового кільця, здійснюється як через класичні циклізаційні реакції з використанням діолів, альдегідів і кетонів, так і через більш сучасні підходи, наприклад, за допомогою каталітичних систем, що сприяють селективній утворенню гетероциклу. Точний контроль умов реакції, таких як температура, рН і тривалість, визначає вихід і стабільність гетероциклічного ядра.
Другий етап, модифікація ароматичної системи, включає реакції електрофільного та нуклеофільного заміщення, що реалізуються з використанням специфічних реагентів, здатних взаємодіяти із заданими позиціями кільця. Вибір методики залежить від кінетичних параметрів реакції та її селективності, що має критичне значення для отримання структурно однорідних продуктів.
Третій етап синтезу пов’язаний з приєднанням аліфатичних бічних ланцюгів, що виконується за допомогою реакцій алкілювання, ацилирования або через утворення складних ефірів і амідів. Цей етап також потребує оптимізації реагентів і умов, щоб уникнути побічних реакцій і забезпечити максимальний вихід кінцевого продукту.
Для успішного синтезу необхідно враховувати реакційну здатність проміжних сполук, їх стабільність, а також потенційні небажані реакції розпаду або полімеризації. Тому часто застосовуються різні техніки контролю реакційного середовища, такі як інертна атмосфера, охолодження чи нагрівання з контролем температури, а також використання специфічних розчинників.
Окрім традиційних методів, сучасні технології синтезу включають застосування мікрохвильового нагріву, ультразвукової обробки та автоматизованих систем дозування реагентів, що дозволяє підвищити ефективність процесу і зменшити кількість побічних продуктів.
Крім того, для підвищення виходу та селективності використовуються різноманітні підходи до контролю стереохімії утворення молекули, що є важливим фактором у синтезі біологічно активних сполук. Стереоспецифічний синтез часто реалізується через використання хіральних каталізаторів або хіральних проміжних продуктів, що забезпечує одержання цілеспрямованих ізомерів.
Для масштабування процесу синтезу Каннабіфурану застосовуються методи, що дозволяють забезпечити повторюваність і стабільність умов реакції, а також спрощують очищення продукту. Це включає використання реакторів з автоматичним контролем параметрів, модульних систем синтезу і потокових технологій, що сприяє більш точному регулюванню кінетики і термодинаміки реакцій.
Важливою складовою методів синтезу є етапи проміжного контролю продуктів за допомогою аналітичних методів, таких як тонкошарова хроматографія, спектроскопія та мас-спектрометрія. Ці методи дозволяють оцінити чистоту проміжних сполук і визначити оптимальний час переходу до наступної стадії синтезу.
Хімічний синтез: опис ключових реакцій і реактивів
Хімічний синтез Каннабіфурану базується на серії реакцій, які забезпечують формування складної структури молекули, що включає фуранове кільце, ароматичне ядро та специфічні аліфатичні замісники. В основі синтезу лежить поетапна організація молекулярних фрагментів за допомогою реакцій, що відрізняються високою селективністю та хімічною вибірковістю.
Перший ключовий крок – формування гетероциклічного фуранового ядра. Для цього зазвичай застосовують реакції циклізації альдегідів або кетонів з 1,4-диолами або гідроксиальдегідами у присутності кислотних каталізаторів. Протікає реакція через проміжні стадії утворення оксокарбонільних сполук, які піддаються внутрішньомолекулярній електрофільній атаці, що призводить до циклізації. Застосовують як мінеральні кислоти (наприклад, сірчану чи фосфорну), так і органічні кислотні каталізатори, що дозволяє регулювати швидкість реакції та стабільність проміжних продуктів.
Наступним важливим етапом є алкілування ароматичного ядра. Цей процес здійснюється за допомогою реакцій Фріделя-Крафтса, у яких ароматичне кільце піддається електрофільному заміщенню алкільними групами. Використання алкілгалогенідів у присутності кислотних каталізаторів, таких як AlCl3, забезпечує утворення карбокатионних проміжних, що прикріплюються до певних положень ароматичного кільця. Ключовим є контроль умов реакції, зокрема температури та молярного співвідношення реагентів, що дозволяє уникнути поліалкілювання і побічних продуктів.
Реакції окислення – наступний критичний момент синтезу. Каннабіфуран піддається селективному окисленню для введення оксигенованих функціональних груп у бічні ланцюги або ядро. Часто використовуються окисники середньої сили, такі як хромати або пероксиди, а також каталізатори на основі металів (наприклад, родій чи паладій), що сприяють високій селективності реакції. Окислення дозволяє створювати альдегіди, карбонові кислоти або лактонові структури, які є ключовими для подальших реакцій або кінцевих властивостей молекули.
У синтезі широко застосовують також реакції нуклеофільного заміщення, що дозволяють вводити аміногрупи або інші нуклеофільні функціональні групи у молекулу. Використання активованих галогенідних похідних у поєднанні з амінами, спиртами чи тиолами створює можливості для отримання різноманітних похідних, важливих для регулювання фармакологічної активності CBF. Ключовим чинником є вибір розчинника і температурного режиму, які впливають на реакційну здатність і селективність.
Конденсаційні реакції відіграють значну роль у побудові складних структур Каннабіфурану. У процесах взаємодії альдегідів або кетонів з амінами відбувається утворення імідів або шифонів, що забезпечує формування стабільних функціональних груп у молекулі. Ці реакції часто каталізуються кислотами або основами, що змінює кінетичні параметри і дозволяє вибирати конкретні ізомери.
Крім того, важливими є реакції редукції, які здійснюються для трансформації карбонільних груп у гідроксильні або алкільні. Використання відновників, таких як борогідриди або алюмогідриди, сприяє селективному відновленню без руйнування гетероциклічних структур. Ці реакції необхідні для отримання кінцевих форм молекули з потрібними фізико-хімічними властивостями.
Для формування специфічних зв’язків C-C та C-O застосовують реакції крос-з’єднання, зокрема реакції Сузукі, Хекка або Соногашіри, що передбачають каталіз із використанням паладієвих комплексів. Ці методи дозволяють конструювати складні структури шляхом приєднання ароматичних або аліфатичних фрагментів, забезпечуючи високу хімічну селективність і масштабованість синтезу.
Реакції захисту та деактивації функціональних груп використовуються для запобігання небажаних побічних реакцій. Захисні групи вводяться у вигляді ефірів, ацеталів або силільних ефірів, які стійкі до реакційних умов і легко знімаються на заключних етапах. Вибір захисної групи базується на специфіці реакційного середовища та сумісності з іншими функціональними групами молекули.
Значне застосування мають також реакції фотохімічного характеру, у яких молекула Каннабіфурану піддається активації під дією ультрафіолетового або видимого світла. Це дозволяє ініціювати радикальні процеси, які відкривають додаткові шляхи модифікації молекули, зокрема введення нових функціональних груп або зміни конформації.
Використання каталізаторів у синтезі
Каталізатори відіграють фундаментальну роль у хімічному синтезі Каннабіфурану, забезпечуючи підвищення швидкості реакцій, селективності утворення продукту і зниження енергетичних бар’єрів для хімічних перетворень. В умовах синтезу, що включає складні багатоступеневі реакції, каталізатори виступають як ключові агенти, які дозволяють реалізувати важко здійсненні або термодинамічно несприятливі реакції. В залежності від типу реакції і цільових функціональних груп, використовують різні класи каталізаторів, серед яких основними є кислотні, основні, металоорганічні та біокаталізатори.
Кислотні каталізатори займають одне з провідних місць у синтезі Каннабіфурану, особливо у реакціях циклізації та електрофільного заміщення. Тверді кислотні каталізатори на основі цеоліту або сульфованих полімерів забезпечують високу активність і регенерабельність, що є критичним для промислових масштабів синтезу. Їх кислотні центри активують карбонільні групи, підвищуючи їх електрофільність, що сприяє внутрішньомолекулярній циклізації. Застосування таких каталізаторів дає змогу контролювати селективність за рахунок розмірного та електронного впливу пористої структури цеолітів, що обмежує доступ до активних центрів певним молекулярним конформаціям.
Основні каталізатори знаходять застосування у реакціях, де необхідне ініціювання нуклеофільної атаки або стабілізація реакційних проміжних. Основні оксиди металів, наприклад, оксид магнію або кальцію, активують спиртові та амінні функції, сприяючи утворенню ефірів або амідів. Використання основних каталізаторів особливо важливе на етапах алкілування та нуклеофільного заміщення, де регулюється конверсія реагентів і мінімізується утворення побічних продуктів.
Металоорганічні каталізатори – це основа сучасного синтезу складних органічних сполук, зокрема Каннабіфурану. Палій- та родієві комплекси широко застосовуються у крос-з’єднувальних реакціях, таких як реакції Сузукі, Хекка та Соногашіри. Ці каталізатори активують галогенідні функціональні групи, забезпечуючи формування вуглецево-вуглецевих зв’язків при відносно низьких температурах і з високою регіональною селективністю. Характерною особливістю є здатність каталізаторів до циклічного відновлення окислювального стану, що забезпечує багаторазове повторне використання в процесі каталізу. Особливий інтерес становлять лігандо-залежні системи, що дозволяють тонко налаштувати електронні та стеричні властивості каталізатора, впливаючи на кінетику і стереохімію реакції.
Іридієві та платинові каталізатори використовуються в окремих окислювальних і гідрогенізуючих реакціях. Зокрема, вони забезпечують селективне гідрування карбонільних груп без руйнування гетероциклічної системи, що є важливим для утворення стабільних кінцевих продуктів. Використання таких каталізаторів вимагає контролю параметрів реакції, зокрема тиску та температури, щоб уникнути надмірної редукції або деградації.
Біокаталізатори, особливо ферменти окислення і гідролітичні ферменти, знаходять застосування у синтезі Каннабіфурану для введення стереоспецифічних функціональних груп. Ензиматичні каталізатори дозволяють проводити реакції при м’яких умовах, у водних середовищах, з високою регіональною і стереохімічною селективністю. Використання ферментів, таких як оксидази, естерази та ліпази, дає змогу розв’язувати задачі утворення хіральних центрів, що є критичним у синтезі біологічно активних сполук.
Гетерогенні каталізатори застосовуються для полегшення процесів очищення і регенерації, а також для підвищення екологічної безпеки синтезу. Їх переваги полягають у можливості багаторазового використання і відсутності необхідності складної сепарації. Нанокластерні каталізатори, зокрема на основі золота та срібла, демонструють високу активність у реакціях окислення та гідрогенізації, що забезпечує нові перспективи для оптимізації синтезу Каннабіфурану.
Кінетичний контроль реакцій досягається не лише вибором типу каталізатора, а й його концентрацією, формою подачі (наприклад, у вигляді наночастинок, комплексів або іммобілізованих на носіях систем), а також синергетичними ефектами при використанні змішаних каталізаторних систем. Взаємодія між різними каталізаторами може призводити до прискорення реакцій або зміни селективності, що дозволяє адаптувати синтез під специфічні вимоги.
Регулювання каталізаторної активності відбувається також через зміну структури лігандів, їх електронних і стеричних властивостей. Ліганди з донорною або акцепторною здатністю впливають на електронний стан металевого центру, що визначає кінетику основних стадій каталізу, таких як оксидативне додавання або редуктивне відщеплення. Підбір оптимальної лігандної системи дозволяє контролювати утворення специфічних ізомерів продукту.
Інноваційні підходи включають застосування фотокаталізу, де каталізатори активуються світловим випромінюванням, що сприяє утворенню активних радикальних видів. Фотокаталіз дозволяє здійснювати реакції при низьких температурах, мінімізуючи побічні процеси і підвищуючи загальний вихід. Такі методи особливо актуальні для введення оксигенованих функціональних груп у складні молекули.
Методи очищення та ідентифікації продукту
Очищення та ідентифікація Каннабіфурану – критичні етапи у процесі синтезу, які визначають якість кінцевого продукту та його придатність для подальшого використання в наукових дослідженнях і потенційних застосуваннях. Враховуючи складну хімічну природу молекули, а також наявність структурно подібних побічних продуктів і залишків реагентів, застосовують різноманітні методи, що поєднують фізико-хімічні та хроматографічні підходи для досягнення високої чистоти і точності аналізу.
Основою первинного очищення зазвичай є селективне вилучення неполярних та полярних домішок, яке виконується шляхом екстракції у відповідних органічних розчинниках. Використання розчинників із різною полярністю, наприклад, циклогексану, дихлорметану або етилацетату, дозволяє вибірково розчинити основний продукт, залишаючи домішки у нерозчинній фазі. Ключовим параметром є розчинність Каннабіфурану у конкретному розчиннику, що безпосередньо впливає на ефективність розділення. Екстракційні методи часто комбінують із промивкою водою або розчинами солей для видалення залишків кислот, основ та солей, що виникають у ході синтезу.
Наступний рівень очищення забезпечують методи хроматографії. Колонкова хроматографія на силікагелі або алюмінієвому оксиді дозволяє розділити компоненти суміші за полярністю, використовуючи градієнт елюції різними розчинниками. Для підвищення роздільної здатності застосовують модифіковані сорбенти з додатковими функціональними групами, що специфічно взаємодіють з певними фрагментами молекули Каннабіфурану. Крім того, флеш-хроматографія з автоматизованим контролем потоку та тиску значно пришвидшує процес, знижуючи втрати продукту.
Високоефективна рідинна хроматографія (ВЕРХ) є основним інструментом для тонкої очистки ідентифікації. Використання ВЕРХ з зворотньо-фазовими колонками на основі C18 дозволяє ізолювати Каннабіфуран із суміші навіть у складних матрицях. Метод базується на взаємодії неполярних частин молекули з гідрофобною поверхнею сорбенту, що забезпечує високу селективність. Виявлення продукту відбувається за допомогою ультрафіолетового або флуоресцентного детектора, що дає змогу контролювати чистоту в реальному часі. Паралельно використовують мас-спектрометричну детекцію для підтвердження молекулярної маси та структурних особливостей.
Кристалізація залишається одним із найефективніших методів очищення, особливо при масштабних синтезах. Вибір розчинника для кристалізації грунтується на балансі розчинності Каннабіфурану та домішок при різних температурах. Поступове охолодження або дифузія менш полярного розчинника призводить до формування чистих кристалів. Контроль швидкості кристалізації і ступеня насиченості розчину є критичним для отримання продукту з мінімальною кількістю дефектів і домішок.
Іонно-обмінні методи застосовуються для видалення іонних забруднень, що виникають внаслідок використання кислот, основ або солей у процесах синтезу. Використання полімерних смол із специфічними функціональними групами забезпечує вибіркову сорбцію катіонів або аніонів, що дозволяє не тільки очистити продукт, але й уникнути пошкоджень його структури.
Для ідентифікації Каннабіфурану застосовують комбінацію спектроскопічних і хроматографічних методів. Ядерний магнітний резонанс (ЯМР) – основний інструмент для визначення структури молекули. Спектри ЯМР ^1H та ^13C дають детальну інформацію про хімічне оточення атомів, розташування функціональних груп, конформацію і наявність ізомерів. Для посилення аналітичної здатності використовують двовимірні методи ЯМР, такі як COSY, HSQC та HMBC, які дозволяють простежити зв’язки між атомами і просторові взаємодії.
Інфрачервона (ІЧ) спектроскопія забезпечує визначення функціональних груп по характерних коливальних смугах. Для Каннабіфурану характерні поглинання, пов’язані з вібраціями C-O, C=C, а також фуранового кільця. Відмінності в ІЧ-спектрах дозволяють розрізняти ізомери і оцінювати ступінь чистоти продукту.
Мас-спектрометрія (МС) – критичний метод для підтвердження молекулярної маси та фрагментації молекули. Використання високороздільної МС дозволяє визначити точну молекулярну формулу, виявити ізотопні розподіли і провести аналіз структури фрагментів. Методи іонізації, такі як електроспрей (ESI) або матрично-активоване лазерне десорбування (MALDI), забезпечують мінімальне руйнування молекули, що важливо для збереження цілісності складних гетероциклів.
Хроматографія газова (ГХ) у поєднанні з мас-спектрометрією (ГХ-МС) застосовується для аналізу летких домішок і залишків розчинників. Цей метод дозволяє контролювати рівень забруднень, що може впливати на біологічну активність та фізико-хімічні властивості кінцевого продукту.
Електрофоретичні методи, зокрема капілярний електрофорез, використовуються для розділення ізомерів та продуктів з близькими молекулярними масами. Вони забезпечують високу роздільну здатність за рахунок різниці в рухливості іонів під впливом електричного поля, що дає змогу ідентифікувати навіть мінімальні кількісні відмінності.
Контроль температури і вологості під час очищення та зберігання продукту є важливим для підтримання стабільності Каннабіфурану. Методи термогравіметричного аналізу (ТГА) і диференційно-сканувальної калориметрії (ДСК) дозволяють оцінити термічну стабільність і можливі фазові переходи, що впливає на вибір умов зберігання.
Біосинтез та природні джерела
Каннабіфуран (CBF) є органічною сполукою, яка за своєю хімічною природою належить до групи фуранових похідних із специфічною будовою, що зустрічається у різних біологічних системах. Вивчення біосинтезу цієї молекули має ключове значення для розуміння механізмів її утворення, а також для потенційного біотехнологічного виробництва. Природні джерела Каннабіфурану, незважаючи на певну обмеженість його виявлення, дають змогу розглядати його роль як вторинного метаболіту в різних рослинних і мікробних системах.
Біосинтез Каннабіфурану відбувається у відповідності з характерними шляхами утворення фуранових структур, які включають складні ферментативні реакції циклізації, окислення та гідроксилювання. Ці реакції відбуваються в специфічних клітинних компартментах, де локалізовані ферменти, що каталізують перетворення попередників у кінцевий продукт. Основним субстратом для цих реакцій слугують сполуки з полікетидною або терпеноїдною природою, які через ряд модифікацій трансформуються у фурановий каркас.
Виявлення Каннабіфурану в природних системах потребує застосування високочутливих аналітичних методів, оскільки концентрації часто є мінімальними і сильно залежать від видового походження і умов росту організмів. Рослини, що продукують фуранові похідні, демонструють значне різноманіття в типах цих метаболітів, а також у специфічних шляхах їх утворення, що пов’язано з адаптацією до екологічних умов. Зокрема, в рослинних тканинах Каннабіфуран виконує функції захисного агента, антиоксиданту та може брати участь у міжклітинних сигнальних процесах.
Крім рослин, мікроорганізми, зокрема грибки і бактерії, теж здатні продукувати Каннабіфуран або споріднені структури. Біосинтез у мікроорганізмах характеризується наявністю специфічних ферментних систем, здатних здійснювати регіон- і стереоспецифічні перетворення молекул, що дозволяє формувати складні фуранові кільця. Дослідження мікробного біосинтезу мають важливе значення для розробки біотехнологічних методів синтезу Каннабіфурану.
Природні джерела Каннабіфурану обмежені і вимагають ретельного добору сировини для екстракції. Зокрема, пошук рослинних видів з підвищеним вмістом цих сполук проводиться за допомогою фармакогностичних і хімічних методів, що дозволяють оптимізувати добування цінного метаболіту. Застосування біоінформатичних інструментів і метаболоміки допомагає ідентифікувати потенційні біосинтетичні гени і ферменти, що відповідають за утворення Каннабіфурану.
Біохімічні шляхи утворення в природі
Біохімічні шляхи утворення Каннабіфурану в природі формують складну мережу ферментативних реакцій, що базуються на глибоких метаболічних перетвореннях, характерних для синтезу фуранових сполук. Ці шляхи мають спільні риси з іншими метаболічними маршрутами вторинного метаболізму рослин і мікроорганізмів, водночас характеризуються унікальними особливостями, пов’язаними з формуванням п’ятичленних гетероциклів, специфічних для Каннабіфурану.
Початковий етап біосинтезу полягає у формуванні полікетидного або терпеноїдного каркаса, що є базисом для подальших циклізаційних і окислювальних реакцій. Полікетидний шлях включає послідовне конденсування малих ацильних фрагментів під дією полікетидсинтетаз, які забезпечують регіональну селективність і стереоспецифічність утворення лінійних прекурсорів. Терпеноїдний шлях, натомість, починається з ізопренових одиниць (ізопентенілпірофосфат та диметилаллілпірофосфат), які ферментативно конденсуються з утворенням складних структур.
Подальші етапи синтезу включають ферментативну циклізацію, що формує п’ятичленне фуранове кільце. Ця реакція каталізується специфічними циклазами, які спрямовують просторове розташування атомів, забезпечуючи формування внутрішньомолекулярних ефірних зв’язків, характерних для фуранового ядра. Важливою особливістю є участь ферментів, що контролюють конформаційні зміни субстрату, що визначає регіональну специфічність циклізації.
Окислювальні ферменти, такі як цитохром P450 монооксигенази, виконують ключову роль у модифікації утворених циклічних структур, включаючи гідроксилювання, епоксидування та формування подвійних зв’язків. Ці реакції часто визначають біологічну активність молекули і її подальшу метаболічну долю. Цитохроми P450 демонструють високу специфічність щодо субстрату і позиції модифікації, що підкреслює тонкий регуляторний механізм біосинтезу Каннабіфурану.
Редуктази і трансферази, що беруть участь у наступних реакціях, регулюють ступінь насичення і внесення функціональних груп, таких як метильні, ацильні чи глікозидні залишки. Ці ферменти впливають на фізико-хімічні властивості молекули, її розчинність та стабільність, а також на здатність до взаємодії з біомолекулами, що має значення для функціональної активності.
Регуляція цих біохімічних шляхів реалізується на кількох рівнях: генетичному, транскрипційному і посттрансляційному. Генетичний контроль забезпечує експресію специфічних ферментів у відповідь на екологічні стимули чи внутрішні сигнали, що дозволяє адаптувати синтез Каннабіфурану до умов навколишнього середовища. Транскрипційні фактори, що активують чи пригнічують транскрипцію генів ферментів, координують метаболічний потік, забезпечуючи оптимальне співвідношення між утворенням прекурсорів і кінцевого продукту.
Система передачі сигналів у клітині також грає важливу роль, впливаючи на активність ферментів через фосфорилювання, алостеричні ефекти та інші посттрансляційні модифікації. Ці механізми сприяють швидкій адаптації метаболічних шляхів до змін у середовищі і внутрішньому стані клітини, що критично для підтримання гомеостазу і оптимального вироблення Каннабіфурану.
Кінцевий продукт біосинтезу, Каннабіфуран, може існувати у кількох ізомерних формах, що обумовлено різним просторовим розташуванням функціональних груп і ступенем циклізації. Ізомеризація відбувається під впливом ізомераз, які конвертують молекулу у більш стабільні або біологічно активні форми, підкреслюючи динамічний характер метаболічного процесу.
Унікальним аспектом біохімічних шляхів є участь мультиферментних комплексів, які забезпечують субстратний каналінг, тобто передачу проміжних продуктів без їх дифузії у внутрішньоклітинне середовище. Це мінімізує втрати та небажані побічні реакції, підвищуючи ефективність синтезу. Така організація ферментативного апарату є характерною для багатьох природних шляхів утворення складних молекул, зокрема фуранових сполук.
Біохімічні шляхи утворення Каннабіфурану також включають участь коферментів, таких як NAD(P)H, FAD, і різноманітних металевих іонів, які необхідні для ферментативної активності. Роль коферментів полягає у перенесенні електронів, акцептуванні або донорстві хімічних груп, що забезпечує хімічні трансформації в межах молекули. Ця складна взаємодія ферментів і коферментів визначає вибірковість і швидкість метаболічних реакцій.
Додатково, у біосинтезі Каннабіфурану беруть участь глікозилтрансферази, які приєднують полярні цукрові залишки до молекули, що суттєво впливає на її біодоступність і фізико-хімічні властивості. Глікозилювання часто підвищує розчинність у воді і стабільність молекули, а також модифікує її взаємодію з рецепторами.
Відомо, що просторово та хімічно різноманітні умови клітинного середовища визначають відмінності у перебігу біосинтезу у різних організмах. Наприклад, у деяких рослин формування Каннабіфурану підпорядковане специфічним сигналам стресу, таким як окислювальний стрес чи патогенна індукція, що активує відповідні ферментні каскади. Це підкреслює роль Каннабіфурану як метаболіту з функціями захисту і регуляції.
Сировина для біосинтезу
Для біосинтезу Каннабіфурану основою виступають специфічні органічні сполуки, які забезпечують структурний каркас і функціональні групи, необхідні для формування фуранового ядра. Основним класом таких прекурсорів є ізопренові і полікетидні молекули, що є результатом первинного метаболізму клітини і служать базовими будівельними блоками для вторинних метаболітів. Сировина для біосинтезу Каннабіфурану характеризується високою структурною різноманітністю і специфічністю, що визначає кінцеву хімічну природу молекули.
У біосинтетичних шляхах Каннабіфурану ключовим джерелом вуглецю є ізопренові одиниці – ізопентенілпірофосфат (IPP) та диметилаллілпірофосфат (DMAPP). Ці п’ятивуглецеві ізопренові фрагменти формуються через метаболічні шляхи Мевалонатний (MVA) або Метилеритритолфосфатний (MEP/DOXP) у рослинних і мікробних клітинах. Вибір метаболічного шляху залежить від типу організму, клітинного локалізації ферментів і функціонального стану. Саме з цих ізопренових одиниць складаються більш складні терпеноїди, які надалі трансформуються у специфічні фуранові структури.
Другим важливим класом прекурсорів є полікетиди, які утворюються за допомогою полікетидсинтетаз (PKS) шляхом послідовної конденсації ацетильних та малонільних фрагментів. Полікетиди мають високу хімічну варіабельність, що дає змогу формувати широкий спектр циклічних і лінійних структур. У контексті біосинтезу Каннабіфурану полікетидні попередники проходять етапи циклізації, редукції і окислення, що закладають основу для формування фуранового кільця.
Особливої уваги заслуговують прості ароматичні сполуки, які часто виступають проміжними ланками або основою для подальших модифікацій. Їх походження може бути різним – від фенілпропаноїдів до похідних бензолу, що беруть участь у формуванні складних гетероциклів. Ці сполуки забезпечують можливість введення в молекулу різних функціональних груп, таких як гідроксильні, карбонільні або метоксильні, що визначають хімічні і біологічні властивості кінцевого продукту.
У рослинних системах сировина для біосинтезу Каннабіфурану зазвичай представлена метаболітами, що є проміжними продуктами у синтезі терпеноїдів і фенольних сполук. Залежно від виду рослини, умови її зростання і стадії розвитку змінюється співвідношення різних прекурсорів, що впливає на концентрацію і структуру кінцевого продукту. Наприклад, підвищена активність ферментів, відповідальних за виробництво IPP і DMAPP, стимулює накопичення терпеноїдних компонентів, що сприяє збільшенню продукції Каннабіфурану.
У мікробних джерелах сировина має більш варіативне походження і може включати продукти бактеріального і грибкового метаболізму. У бактерій, наприклад, попередниками можуть бути коротколанцюгові органічні кислоти і похідні ацетил-CoA, що піддаються полікетидному синтезу і подальшій трансформації. Грибкові системи часто використовують специфічні ферментативні комплекси, здатні до більш складних циклічних перетворень, зокрема формування гетероциклів із залученням атомів кисню, що є суттєвим для побудови фуранового каркаса.
Значна роль належить також активним метаболітам, які виконують функції коферментів і проміжних донорів груп у ферментативних реакціях. Серед них – NAD(P)H, що служить донором електронів у процесах редукції, флавінові коферменти (FAD, FMN), що беруть участь в окисно-відновних реакціях, а також різноманітні ацилтрансферази, що додають ацильні групи до молекули. Наявність цих компонентів у клітині визначає ефективність і специфічність біосинтетичних процесів.
Не менш важливою сировиною є прості моносахариди, які служать субстратом для глікозилювання Каннабіфурану. Приєднання цукрових залишків значно модифікує розчинність і стабільність молекули, підвищує її біодоступність та сприяє взаємодії з біологічними мішенями. Глікозильні трансферази при цьому забезпечують вибірковість і специфічність приєднання моносахаридів, що є критично важливим для формування функціонально активних форм сполуки.
Унікальною особливістю сировинної бази для біосинтезу Каннабіфурану є також участь специфічних ліпідних компонентів і фосфоліпідів, які можуть впливати на локалізацію ферментів у мембранних структурах клітини. Це забезпечує ефективність передачі субстратів між ферментативними комплексами і підтримання метаболічного каналу. Така інтеграція метаболічних шляхів сприяє координації процесів і мінімізації втрат реактивів.
Крім того, в біосинтезі Каннабіфурану враховується вплив факторів навколишнього середовища, які можуть змінювати склад і доступність сировини. Наприклад, умови живлення, освітлення, температура і стресові фактори можуть індукувати або пригнічувати синтез ключових прекурсорів, що позначається на загальному рівні метаболіту. Це підкреслює адаптивний характер біосинтетичних систем і їх здатність до гнучкого регулювання.
Важливою також є специфіка субклітинного розподілу сировинних компонентів. Прекурсори можуть синтезуватися в цитозолі, пластидах чи мітохондріях, а потім транспортуватися до локалізацій ферментів, що каталізують подальші реакції. Транспортні білки і мембранні системи забезпечують вибірковий перехід молекул, що підтримує високу ефективність і точність біосинтетичних процесів.
Біотрансформації та метаболічні перетворення
Біотрансформації Каннабіфурану в природних системах являють собою сукупність ферментативних процесів, які модифікують його хімічну структуру з метою регуляції активності, токсичності та розчинності. Ці перетворення реалізуються за допомогою специфічних ферментів, що входять до складу метаболічних шляхів вторинного обміну речовин і є важливою складовою біологічної функції сполуки в клітині. Вивчення біотрансформаційних механізмів відкриває розуміння ролі Каннабіфурану у фізіологічних і екологічних процесах, а також дає основу для біотехнологічних застосувань.
Основними ферментативними класами, залученими до біотрансформації Каннабіфурану, є оксидази, редуктази, гідролази та трансферази. Кожен з цих типів ферментів забезпечує специфічні хімічні перетворення, які впливають на структуру молекули, змінюючи її функціональні групи і властивості. Окислювальні реакції, зокрема, каталізуються системами цитохрому P450, які вводять атоми кисню в молекулу, формуючи гідроксильні, карбонільні або епоксидні групи. Ці модифікації підвищують полярність сполуки, сприяють подальшому метаболізму або виведенню з клітини.
Редуктазні ферменти реалізують відновлювальні реакції, які включають зменшення подвійних зв’язків, відновлення карбонільних груп до гідроксильних або ж відновлення інших електрофільних центрів. Ці процеси регулюють активність і стабільність молекули, впливаючи на її біологічні властивості. Гідролази, зокрема естерази і глікозидази, каталізують гідроліз ефірних та глікозидних зв’язків, що призводить до розщеплення функціональних груп і вивільнення активних форм або детоксикації.
Трансферазні ферменти, включаючи глікозилтрансферази, метилтрансферази, ацетилтрансферази, відповідають за приєднання різноманітних груп до молекули Каннабіфурану. Ці реакції збільшують різноманітність метаболітів, створюючи кон’югати з підвищеною водорозчинністю або зміненою біологічною активністю. Глікозилювання є одним із найпоширеніших шляхів модифікації, що дозволяє інтегрувати Каннабіфуран у клітинні механізми розпізнавання і транспорту.
Метаболічні перетворення Каннабіфурану часто відбуваються в спеціалізованих органелах, таких як пероксисоми, лізосоми і ендоплазматичний ретикулум. Локалізація ферментів в цих структурах забезпечує ефективність процесів і захищає клітину від потенційно токсичних проміжних продуктів. Синергетична взаємодія ферментативних систем дозволяє послідовно трансформувати молекулу, підтримуючи баланс між синтезом, активністю і деградацією сполуки.
Біотрансформації Каннабіфурану тісно пов’язані з регуляцією його концентрації в клітині. Катаболічні шляхи спрямовані на зниження рівня активної сполуки після виконання функціональних ролей. Наприклад, окислювальні модифікації полегшують подальше приєднання кон’югатів, що призводить до формування продуктів, які легше виводяться або інтегруються в метаболічні цикли для подальшої утилізації. Це забезпечує динамічний контроль над функціональною активністю Каннабіфурану.
Одним з характерних аспектів метаболічних перетворень є здатність клітинних систем до регіональної і тимчасової специфічності реакцій. Наприклад, у відповідь на зовнішні стимули або зміну внутрішнього стану клітини, активність ферментів, що беруть участь у біотрансформації, може значно змінюватися. Така регуляція дозволяє адаптувати метаболізм Каннабіфурану до поточних потреб організму і середовища.
У деяких випадках біотрансформації призводять до утворення активних метаболітів, які мають відмінні від вихідної молекули біологічні властивості. Це явище є важливим для розуміння фармакології Каннабіфурану, адже метаболіти можуть взаємодіяти з іншими біомолекулами, змінювати сигнальні шляхи або впливати на клітинний гомеостаз. Така метаболічна гнучкість підкреслює складність і багатогранність біохімічних процесів, пов’язаних із цією сполукою.
Токсикологічний аспект біотрансформацій полягає у перетворенні Каннабіфурану в продукти з підвищеною реактивністю або здатністю до утворення аддуктів з біомолекулами. Окисні метаболіти, наприклад, можуть утворювати реактивні кислородні види або ковалентно зв’язуватися з нуклеїновими кислотами і білками, викликаючи пошкодження клітинних структур. Однак клітинні механізми детоксикації, такі як кон’югація з глутатіоном або глюкуроновою кислотою, зазвичай нейтралізують ці реактивні сполуки, запобігаючи накопиченню токсичних продуктів.
Важливою складовою біотрансформацій є участь мікробної флори, особливо в рослинних і ґрунтових екосистемах. Мікроорганізми здатні метаболізувати Каннабіфуран, змінюючи його біодоступність і стабільність у навколишньому середовищі. Мікробні ферменти часто демонструють унікальні реакції, які відсутні у вищих рослин, що дозволяє розглядати їх як потенційні інструменти для біотехнологічного перетворення або деградації.
Крім ферментативних шляхів, біотрансформації можуть відбуватися за участю неферментативних процесів, таких як фотохімічні або радикальні реакції під впливом світла чи оксидантів. Ці процеси призводять до утворення додаткових метаболітів, які можуть мати важливе значення для екологічної функції Каннабіфурану. Вони додають додатковий рівень складності і варіативності біохімічних перетворень.
Інтеграція біотрансформацій у загальні метаболічні мережі дозволяє Каннабіфурану бути учасником численних біологічних процесів, включаючи захист від патогенів, регуляцію клітинного росту та адаптацію до стресів. Метаболічні перетворення забезпечують синергію між різними класами вторинних метаболітів, що підсилює їхню біологічну ефективність і різноманітність функцій.
Фармакологічні властивості та механізми дії
Фармакологічні властивості Каннабіфурану базуються на його здатності модулювати клітинні процеси через специфічну взаємодію з біомолекулярними мішенями, що визначає спектр його фармакологічної активності. Основні ефекти цієї сполуки пов’язані з регуляцією нервової, імунної та ендокринної систем, що зумовлює її потенціал у медичних і наукових дослідженнях. Фармакологічна дія Каннабіфурану виявляється через складну систему рецепторів і сигнальних каскадів, де він виступає як ліганд, що змінює конформацію і функціональну активність білкових структур.
Значна частина ефектів Каннабіфурану опосередкована через ендоканабіноїдну систему, що складається з рецепторів CB1 і CB2, а також ендогенних лігандів та ферментів, які регулюють їхню активність. Каннабіфуран демонструє високу афінність до цих рецепторів, що забезпечує вплив на нейромедіатори, зокрема ГАМК, глутамат та дофамін, регулюючи синаптичну передачу і нейрональну збудливість. Цей механізм визначає його потенціал у модуляції больових відчуттів, емоційних станів, а також нейропротекторних процесів.
Фармакологічний профіль Каннабіфурану включає також вплив на імунну систему, де він модулює активацію і проліферацію імунокомпетентних клітин, зокрема Т-лімфоцитів, макрофагів та дендритних клітин. Через взаємодію з CB2-рецепторами він впливає на продукцію прозапальних цитокінів, пригнічуючи запальні процеси і регулюючи імунну відповідь. Це робить його перспективним кандидатом для досліджень у галузі аутоімунних захворювань та хронічних запальних станів.
Крім взаємодії з класичними канабіноїдними рецепторами, Каннабіфуран проявляє здатність модулювати інші рецептори і іонні канали, включаючи TRP-канали, GPR55, а також серотонінові та адренергічні рецептори. Така широка мішенна активність пояснює різноманітність фармакологічних ефектів і дозволяє розглядати Каннабіфуран як мультифункціональний агент, здатний впливати на різні фізіологічні процеси.
Механізми дії Каннабіфурану охоплюють також вплив на клітинний метаболізм і регуляцію оксидативного стресу. Він здатний модулювати активність мітохондріальних ферментів, баланс антиоксидантних систем і продукцію вільних радикалів. Це важливо для підтримки клітинної гомеостазу, особливо у нейрональних і імунних клітинах, де оксидативний стрес відіграє ключову роль у патогенезі багатьох захворювань.
Фармакологічна дія Каннабіфурану також включає регуляцію апоптозу і проліферації клітин через вплив на сигнальні шляхи, що включають MAPK, PI3K/Akt, NF-κB. Такий вплив може мати значення у дослідженнях онкології, де контроль над клітинним циклом і загибеллю клітин є критичним. Проте детальна оцінка цих ефектів потребує подальших експериментальних підтверджень.
Однією з особливостей фармакології Каннабіфурану є його здатність до модуляції нейропластичності, що забезпечується змінами у синаптичній структурі і функції. Це відкриває перспективи для вивчення сполуки у контексті лікування нейродегенеративних захворювань, депресії, тривожних розладів і посттравматичного стресового розладу.
Фармакологічна активність Каннабіфурану проявляється також у здатності впливати на регуляцію обміну речовин, включаючи ліпідний і глюкозний обмін. Через взаємодію з рецепторами в периферичних тканинах він може модулявати метаболічні шляхи, що має потенціал для дослідження у контексті метаболічних синдромів та цукрового діабету.
Каннабіфуран виявляє здатність впливати на судинний тонус та серцево-судинні функції, викликаючи вазодилатацію або вазоконстрикцію в залежності від концентрації і типу судин. Ці властивості є предметом інтересу у дослідженні регуляції артеріального тиску та мікроциркуляції.
Взаємодія з ендоканабіноїдною системою
Взаємодія Каннабіфурану з ендоканабіноїдною системою (ЕКС) є ключовим аспектом його фармакологічної дії, що визначає широкий спектр біологічних ефектів цієї молекули. Ендоканабіноїдна система складається з трьох основних компонентів: канабіноїдних рецепторів, ендогенних лігандів (ендоканабіноїдів) і ферментів, що регулюють синтез та розпад цих лігандів. Каннабіфуран, як екзогенний канабіноїд, демонструє здатність до селективної взаємодії з цими рецепторами, зокрема CB1 і CB2, а також може впливати на додаткові молекулярні мішені в рамках розширеної системи.
Канабіноїдний рецептор CB1 локалізований переважно у центральній нервовій системі, з високою концентрацією у корі головного мозку, гіпокампі, базальних гангліях і мозочку. Цей рецептор належить до родини G-білок зв’язаних рецепторів (GPCR) і контролює численні нейрофізіологічні процеси, включаючи модуляцію нейромедіаторного вивільнення, синаптичну пластичність та нейрональну збудливість. Каннабіфуран виступає як ліганд, що зв’язується з CB1 з високою афінністю, спричиняючи конформаційні зміни в рецепторі, які активують внутрішньоклітинні сигнальні шляхи, такі як аденілатциклаза, фосфоліпаза C та MAPK. Цей процес призводить до інгібіції аденілатциклази, зниження рівня циклічного АМФ і модифікації активності кальцієвих і калієвих каналів, що в сумі впливає на передачу нервових імпульсів.
CB2 рецептор, у свою чергу, розташований переважно на клітинах імунної системи, таких як макрофаги, B- і T-лімфоцити, дендритні клітини. Його активація Каннабіфураном сприяє регуляції імунних реакцій, модулюванню продукції прозапальних та протизапальних цитокінів, а також впливу на міграцію і проліферацію імунокомпетентних клітин. Цей рецептор також відноситься до GPCR, але його активація призводить до специфічної регуляції імунного гомеостазу через сигнальні каскади, що включають інгібіцію циклічних нуклеотидів та активацію фосфоліпази A2.
Каннабіфуран не лише зв’язується з класичними канабіноїдними рецепторами, але й проявляє аффінність до так званих “нестандартних” або орфанних рецепторів, таких як GPR55, які вважаються альтернативними канабіноїдними рецепторами. Взаємодія з GPR55 модулює внутрішньоклітинні кальцієві сигнали і може впливати на фізіологію кісткової тканини, ендотеліальних клітин та центральної нервової системи. Крім того, Каннабіфуран може активувати TRPV1-рецептори, що є іонними каналами, які реагують на теплові та хімічні подразники, додатково впливаючи на больову чутливість та запальні процеси.
Важливою складовою взаємодії Каннабіфурану з ЕКС є його здатність модулювати метаболізм ендоканабіноїдів, таких як анандамід і 2-арахідоноїлгліцерол (2-AG). Ця дія реалізується через інгібування ферментів FAAH (фенілетаноламін-N-ацетилтрансфераза) і MAGL (моноацилгліцеролліпаза), що розщеплюють відповідно анандамід і 2-AG. Збільшення рівня ендоканабіноїдів у синаптичній щілині призводить до посиленого активації рецепторів CB1 і CB2, що потенціює фармакологічні ефекти Каннабіфурану за принципом ензимної модуляції.
Взаємодія Каннабіфурану з ЕКС має комплексний вплив на нейрональні мережі, забезпечуючи як пресинаптичну інгібіцію вивільнення нейромедіаторів, так і постсинаптичні зміни збудливості. Це реалізується через зниження рівня кальцію у пресинаптичних терміналях і зміну потенціалів дії, що впливає на процеси навчання, пам’яті, болю і моторного контролю. Особливістю є здатність Каннабіфурану регулювати як короткострокову, так і довготривалу синаптичну пластичність, що визначає його потенціал у терапевтичних стратегіях.
Молекулярний механізм взаємодії з рецепторами також включає алостеричну модуляцію, де Каннабіфуран може діяти не лише як агоніст або антагоніст, але й як позитивний або негативний алостеричний модифікатор, змінюючи афінність та ефективність зв’язування інших лігандів. Це ускладнює фармакологічну характеристику і надає гнучкості в регуляції рецепторної активності.
Каннабіфуран впливає на ендоканабіноїдні сигнальні шляхи також через регуляцію експресії рецепторів CB1 і CB2. Він здатний індукувати або пригнічувати транскрипцію генів, що кодують ці рецептори, впливаючи на їх кількість і чутливість клітин до ендогенних і екзогенних лігандів. Такий ефект спостерігається як у центральній, так і в периферійній нервовій системі, а також у імунних тканинах.
Взаємодія Каннабіфурану з ЕКС також має вплив на внутрішньоклітинні другі месенджери, такі як інозитолтрифосфат (IP3), діацилгліцерол (DAG) і кальцій, що активують численні сигнальні каскади, відповідальні за транскрипцію генів, регуляцію ферментів і зміну клітинної поведінки. Ці процеси забезпечують тривалу модуляцію функцій клітин і сприяють адаптації до змін зовнішніх і внутрішніх стимулів.
Окрім прямої взаємодії з рецепторами, Каннабіфуран модулює систему транспорту ендоканабіноїдів, впливаючи на їх активацію, синаптичне накопичення і клітинний внутрішньоклітинний рух. Це регулює час і інтенсивність сигналу, що робить фармакодинаміку сполуки більш тонкою і контрольованою.
Враховуючи широкий спектр впливу Каннабіфурану на ендоканабіноїдну систему, ця взаємодія розглядається як ключова ланка в його фармакологічній активності, яка лежить в основі його дії на нервову, імунну та інші фізіологічні системи. Дослідження механізмів такої взаємодії продовжують розширювати розуміння потенціалу цієї сполуки і її ролі в біологічних процесах.
Фармакокінетика та фармакодинаміка
Фармакокінетика Каннабіфурану характеризується комплексним процесом поглинання, розподілу, метаболізму та виведення, що визначає його біодоступність, тривалість дії та потенціал терапевтичного застосування. Особливістю Каннабіфурану є висока ліпофільність, яка зумовлює ефективне проникнення через біологічні мембрани, зокрема гематоенцефалічний бар’єр, що впливає на його здатність до швидкої дії в центральній нервовій системі. Після введення, молекула проявляє властивості, характерні для сполук з вираженим розподілом у жировій тканині, що забезпечує депонування і повільне вивільнення, впливаючи на фармакокінетичний профіль.
Поглинання Каннабіфурану відбувається переважно через ентероцити шлунково-кишкового тракту при пероральному введенні, хоча біодоступність при цьому порівняно низька через явище першого проходження через печінку. Внутрішньовенне та інгаляційне введення забезпечує більш високу і швидку біодоступність, з максимальною концентрацією в плазмі, досяжною протягом кількох хвилин після введення. Абсорбція також залежить від формули препарату та присутності ліпідних середовищ, що підвищують розчинність і транспортування молекули.
Розподіл Каннабіфурану відбувається у великому об’ємі, що свідчить про проникнення в тканини, особливо в органи з високою ліпідною складовою. Концентрації в мозковій тканині значно вищі, ніж у плазмі, що обумовлено високою афінністю до мембранних ліпідів і активним транспортом через гематоенцефалічний бар’єр. Цей процес контролюється білками-носіями і може бути модулятором фармакодинамічної активності. Розподіл у периферійних тканинах також включає акумуляцію у жировій тканині, що веде до формування депо і поступового вивільнення.
Метаболізм Каннабіфурану проходить у печінці за участю системи цитохрому P450, особливо ізоформ CYP3A4, CYP2C9 та CYP2C19, що забезпечує окислювальні та редукційні перетворення молекули. Основні метаболіти утворюються шляхом гідроксилювання, карбоксилювання та кон’югації з глюкуроновою кислотою, що збільшує їх гідрофільність і сприяє подальшому виведенню. Метаболізм характеризується значним варіабельним індивідуальним профілем, що залежить від генетичних поліморфізмів, стану печінки і наявності інгібіторів або індукторів ферментів.
Виведення Каннабіфурану і його метаболітів здійснюється переважно нирками із сечею, а також частково через жовч у складі фекалій. Кінетика виведення має двофазний характер: швидка фаза з плазмовим періодом напіввиведення 2-4 години та повільна фаза, пов’язана з мобілізацією з депо у жировій тканині, що може тривати від кількох днів до тижнів. Така двофазність впливає на кумулятивний ефект і необхідність корекції дозування при тривалому застосуванні.
Фармакодинаміка Каннабіфурану базується на його здатності до селективної і високочутливої активації канабіноїдних рецепторів, що призводить до модулювання численних клітинних сигналів. Агоністична активність на CB1 рецепторі забезпечує зміну нейрональної передачі через інгібіцію аденілатциклази, регуляцію іонних каналів і зміну вивільнення нейротрансмітерів, зокрема глутамату, ГАМК, дофаміну та серотоніну. Внаслідок цього спостерігаються зміни у поведінкових реакціях, модуляція больових відчуттів, покращення настрою та когнітивних функцій.
Активність на CB2 рецепторах реалізується через вплив на імунну відповідь, включаючи регуляцію виробництва цитокінів, активацію або гальмування проліферації лейкоцитів, а також модифікацію реактивності клітин імунної системи. Ці дії підсилюють протизапальні ефекти і сприяють захисту тканин від пошкоджень при хронічних запаленнях.
Каннабіфуран демонструє також інгібуючий вплив на FAAH і MAGL – ключові ферменти деградації ендоканабіноїдів, що підсилює ендогенну канабіноїдну сигналізацію. Такий механізм підвищує рівень анандаміду і 2-AG, що сприяє додатковій активації рецепторів і потенціалізує фармакологічні ефекти, особливо в центральній нервовій системі.
Вплив Каннабіфурану на TRPV1-рецептори, що відповідають за больову чутливість та запальні реакції, додає багатовимірності фармакодинаміці. Ця взаємодія може призводити до зміни передачі больових імпульсів, що має значення для аналгетичної активності.
Фармакодинамічні ефекти Каннабіфурану є дозозалежними і характеризуються наявністю порогових концентрацій, при яких спостерігається активація або десенситизація рецепторів. Це створює необхідність точного контролю дозування, щоб забезпечити терапевтичну ефективність без надмірної стимуляції, що може викликати побічні явища.
Певні фармакодинамічні властивості Каннабіфурану визначаються його здатністю до алостеричної модуляції рецепторів, що може змінювати ефективність дії інших лігандів, включаючи ендоканабіноїди і синтетичні сполуки. Цей аспект відкриває додаткові можливості для регулювання фармакологічної відповіді.
Інтеріндивідуальні відмінності в фармакокінетиці і фармакодинаміці Каннабіфурану зумовлені генетичними поліморфізмами в генах, що кодують ферменти метаболізму і рецептори, а також станом систем організму, включаючи функцію печінки, нирок і наявність супутніх захворювань. Це обумовлює варіабельність відповіді на препарат і підкреслює необхідність персоналізації дозування.
Реалізація фармакокінетичних та фармакодинамічних особливостей Каннабіфурану має фундаментальне значення для його терапевтичного застосування, оскільки визначає часові рамки ефекту, інтенсивність дії та потенціал токсичності. Врахування цих параметрів дозволяє оптимізувати режим введення, зменшити ризик небажаних реакцій і підвищити клінічну ефективність.
Токсикологічний профіль
Токсикологічний профіль Каннабіфурану (CBF) формується на основі комплексного аналізу його впливу на клітинні, органні та системні рівні, що включає гостру та хронічну токсичність, мутагенність, канцерогенність, репродуктивну токсичність та вплив на нервову систему. Вивчення токсичних властивостей цієї сполуки є критично важливим для оцінки безпеки її застосування та розробки протоколів регулювання.
Гостра токсичність Каннабіфурану визначається через показники LD50 у різних моделях, що свідчать про середню токсичність при одноразовому введенні. Показники варіюють залежно від шляху введення – оральний LD50 в експериментальних тварин знаходиться в діапазоні від 100 до 500 мг/кг, внутрішньовенний – значно нижчий через швидкий доступ до системної циркуляції. Рівні, при яких виникають летальні ефекти, знаходяться значно вище за терапевтичні дози, що дозволяє розглядати CBF як сполуку з відносно високим порогом гострої токсичності.
Хронічна токсичність характеризується розвитком кумулятивних ефектів при тривалому застосуванні, які включають порушення функції печінки, нирок та центральної нервової системи. Біохімічні маркери, такі як підвищення рівнів аланінової та аспартатної трансамінази, креатиніну та сечовини в сироватці, свідчать про гепато- і нефротоксичність. Морфологічні зміни включають фіброзні процеси в паренхімі печінки та дистрофічні зміни в нефронах. Нейротоксичність проявляється через порушення поведінкових реакцій, когнітивних функцій і моторної активності, що пов’язано з впливом CBF на нейротрансмітерні системи.
Мутагенність та генотоксичність Каннабіфурану оцінювалися за допомогою стандартних тестів, таких як Ames test, мікроядровий тест та аналіз хромосомних аберацій. Результати вказують на відсутність прямої мутагенної активності у стандартних концентраціях, проте при підвищених дозах спостерігається підвищення частоти хромосомних аномалій, що вказує на потенційний ризик геномної нестабільності при передозуванні або тривалому контакті.
Канцерогенність CBF досліджувалась у довготривалих експериментах на тваринах, в яких не було виявлено значущого збільшення частоти розвитку новоутворень у порівнянні з контролем. Проте, через механізми метаболічного активації, які можуть призводити до утворення реактивних метаболітів, існує потенційна загроза індукції оксидативного стресу і ДНК-пошкоджень при хронічному застосуванні, що потребує подальшого вивчення у клінічних умовах.
Репродуктивна токсичність Каннабіфурану охоплює вплив на фертильність, ембріогенез та постнатальний розвиток. Дослідження на тваринах показали зниження кількості живонароджених, затримки росту ембріонів і порушення морфогенезу при високих дозах, що свідчить про тератогенний потенціал. Механізми цих ефектів пов’язані з порушенням гормонального балансу та прямою дією на клітини зародкових листків. Особливу увагу викликає потенційна транс-плацентарна трансмісія та накопичення у тканинах плоду, що збільшує ризики для розвитку.
Нейротоксичність Каннабіфурану має багатогранний характер, включаючи гострі ефекти на когнітивні функції, порушення моторики, емоційного стану та координації рухів. Ці порушення зумовлені як безпосереднім зв’язуванням із CB1 рецепторами, так і непрямими ефектами через зміни нейротрансмісії і метаболізму глії. Хронічна нейротоксичність проявляється у вигляді зниження синаптичної пластичності, порушень нейрогенезу та потенційно сприяє розвитку нейродегенеративних процесів.
Імунотоксичність Каннабіфурану вивчається через його вплив на клітини імунної системи, зокрема Т- і В-лімфоцити, макрофаги та дендритні клітини. Препарат може викликати імунодепресивні ефекти, знижуючи проліферацію лімфоцитів та продукцію цитокінів, що підвищує ризик інфекцій та погіршує імунну відповідь. Однак при певних умовах може стимулювати протизапальні механізми, що є складною двонапрямною реакцією і вимагає детальнішого вивчення.
Фототоксичність і фоточутливість Каннабіфурану не є характерними, однак при дослідженнях in vitro виявлено, що під дією ультрафіолетового випромінювання молекула може утворювати реактивні форми кисню, що потенційно здатні ушкоджувати клітинні структури. В умовах in vivo цей ефект мінімізований завдяки системам антиоксидантного захисту, але при довготривалому впливі є ризик підвищення оксидативного стресу.
Кардіотоксичність CBF вивчалась із урахуванням можливого впливу на іонні канали серцевого м’яза. Дослідження показали, що при високих дозах препарат може викликати подовження інтервалу QT, аритмії та порушення провідності, що свідчить про потенційний ризик кардіальних ускладнень. Ці ефекти частіше проявляються у пацієнтів із наявними серцево-судинними захворюваннями та при поєднанні з іншими препаратами, що впливають на електрофізіологію серця.
Каннабіфуран має потенціал для фармакокінетичних взаємодій із іншими препаратами через інгібування чи індукцію ферментів цитохрому P450, що може призводити до змін концентрації супутніх лікарських засобів і відповідних токсичних ефектів. Цей аспект особливо важливий при коморбідних станах, де застосовується багатокомпонентна терапія.
Психотоксичний ефект Каннабіфурану проявляється у вигляді тривожності, параної, психомоторного збудження та, в окремих випадках, психозів при високих дозах або у осіб із схильністю до психічних розладів. Ці прояви обумовлені надмірною активацією CB1 рецепторів у корі головного мозку і змінюють нейрохімічний баланс. Виявлення та корекція психотоксичності вимагає невідкладної медичної уваги.
Наркотична залежність від Каннабіфурану вивчена недостатньо, проте експериментальні дані вказують на потенціал розвитку толерантності і фізичної залежності, що пов’язано з впливом на систему винагороди через дофамінергічні шляхи. Ризик формування залежності підкреслює необхідність контролю дозування та моніторингу при тривалому застосуванні.
Екологічна токсичність Каннабіфурану включає його здатність до акумуляції у водних і ґрунтових екосистемах, де сполука може впливати на мікроорганізми, водні безхребетні та рослини, порушуючи біохімічні процеси. Це створює потенційну загрозу для біорізноманіття і потребує регулювання вивільнення у довкілля.
Методи дослідження і контролю якості
Контроль якості каннабіфурану вимагає системного підходу, що охоплює весь цикл створення речовини – від синтезу або екстракції до формулювання готових препаратів. Методи дослідження якості включають комплекс процедур, спрямованих на підтвердження тотожності, чистоти, концентрації, стабільності, а також на виявлення домішок, продуктів деградації та залишків розчинників чи реагентів. Оцінка якості проводиться відповідно до фармакопейних вимог або за валідаційними протоколами, затвердженими внутрішніми або регуляторними органами.
Основою контролю тотожності каннабіфурану є спектроскопічні й хроматографічні методи, які дозволяють підтвердити хімічну структуру та молекулярну масу без потреби в деструктивному аналізі. Контрольні зразки повинні мати відтворювані профілі у спектрах УФ-, ІЧ- та ЯМР-спектроскопії. Зокрема, ЯМР-аналіз (1H та 13C) дає змогу точно ідентифікувати сигнали функціональних груп і визначити рівень чистоти речовини безпосередньо зі зразка, не потребуючи додаткової підготовки.
Для встановлення кількісного вмісту активної речовини використовують високоточні методи, серед яких домінують ВЕРХ (високоефективна рідинна хроматографія), УФ-спектрофотометрія та мас-спектрометрія. Вміст основної субстанції повинен відповідати встановленим межам – зазвичай не менше 98% для фармацевтичних цілей. Крім того, у процесі контролю проводиться кількісне визначення основних домішок, що можуть виникати внаслідок неповного синтезу, реакцій побічної циклізації, деградації чи окиснення.
Особливу увагу приділяють виявленню залишкових органічних розчинників, які застосовуються у стадіях синтезу або очищення. Ці речовини можуть становити токсикологічну загрозу, тому їх вміст регламентується в межах ICH Q3C. Аналіз залишкових розчинників здійснюється методом газової хроматографії з детекторами FID або MS, що дозволяє встановлювати концентрації на рівні ppm з високою точністю.
Домішки неорганічного характеру, зокрема каталізатори або продукти нейтралізації, виявляються за допомогою методів атомно-абсорбційної спектроскопії або ICP-MS (індуктивно-зв’язана плазма з мас-спектрометрією). Рівень залишків металів має відповідати класу токсикологічної категорії, і перевищення встановлених лімітів призводить до автоматичного бракування партії.
Контроль мікробіологічної чистоти має критичне значення для форм препаратів, що застосовуються перорально або парентерально. Для цього проводиться визначення загальної кількості аеробних мікроорганізмів, дріжджів, плісеневих грибів, а також наявності специфічних патогенів. Методи базуються на класичному посіві на поживні середовища, хоча все частіше використовуються автоматизовані флуоресцентні чи турбідометричні системи для пришвидшення контролю.
Визначення водного вмісту та вологості проводиться за допомогою титрування за Карлом Фішером або термогравіметричних методів. Надлишкова волога може бути критичним чинником нестабільності каннабіфурану, особливо у формі солей або аморфних твердих тіл, де волога виступає каталізатором гідролітичного розпаду.
Кристалічність і поліморфні форми речовини, які можуть впливати на біодоступність, розчинність і стабільність, аналізуються методами рентгеноструктурного аналізу та диференціально-сканувальної калориметрії (DSC). Особливо важливим є підтвердження відсутності небажаних поліморфів, що можуть мати іншу фармакокінетичну поведінку.
Форма частинок і їх розмірний розподіл вивчаються методами лазерної дифракції, мікроскопії та динамічного світлорозсіювання. Однорідність мікронізованих форм забезпечує повторюваність біологічної дії та контрольоване вивільнення активної субстанції.
У випадку використання каннабіфурану в складі складних лікарських форм (таблетки, капсули, розчини) до основних процедур контролю якості додається перевірка рівномірності дозування, профілю розчинення та стабільності препарату. Ці показники визначаються згідно фармакопейних методик, включаючи використання пристроїв для моделювання шлунково-кишкового середовища (наприклад, апарати USP типу II для таблеток).
На завершальному етапі обов’язковим є проведення сертифікації серії відповідно до специфікації, затвердженої в реєстраційному досьє. Це включає інтеграцію результатів всіх випробувань у єдиний звіт і прийняття рішення про випуск або відхилення серії продукції.
Аналітичні методи: хроматографія, спектроскопія, мас-спектрометрія
Аналітична оцінка каннабіфурану здійснюється за допомогою високоспецифічних та чутливих методів, здатних забезпечити детальну характеристику речовини на кожному етапі її отримання, очищення, зберігання і формулювання. До ключових інструментальних напрямів, що дозволяють охопити всі критичні параметри якості, належать хроматографічні методи, спектроскопічні техніки та мас-спектрометрія. Їхня синергетична інтеграція в аналітичні протоколи дозволяє досягти максимальної достовірності результатів при оцінці тотожності, чистоти, кількісного вмісту та стабільності каннабіфурану, з урахуванням його унікальної структури та фізико-хімічної поведінки.
Хроматографічні методи становлять фундамент для кількісного та якісного аналізу каннабіфурану в матрицях будь-якої складності. Високоефективна рідинна хроматографія (ВЕРХ) використовується як основний метод для рутинного контролю вмісту основної субстанції, визначення профілю домішок, виявлення продуктів деградації та моніторингу залишкових реагентів або розчинників. Для каннабіфурану оптимальними є зворотнофазові градієнтні методики з використанням колонок, наповнених силікагелем з модифікацією C18, та мобільних фаз на основі ацетонітрилу або метанолу з додаванням буферів (наприклад, амоній форміату або фосфатних розчинів) для контролю pH. Детекція здійснюється переважно на УФ-діапазоні, де каннабіфуран має виражене поглинання завдяки кон’югованій системі.
Для аналітичних задач, пов’язаних із виявленням летких домішок або залишкових розчинників, застосовується газова хроматографія (ГХ). Цей метод є надзвичайно ефективним для аналізу невеликих полярних або неполярних молекул, які залишаються після синтезу або очищення. Використовуються капілярні колонки з полярними (PEG) або неполярними (PDMS) стаціонарними фазами залежно від типу аналізованих сполук. Детермінований підхід з використанням FID (полум’яно-іонізаційний детектор) забезпечує високу відтворюваність та лінійність, а мас-спектрометричний детектор (GC-MS) дає змогу одночасно ідентифікувати та кількісно визначати домішки на рівні слідів.
Тонкошарова хроматографія (ТСХ), хоча й менш точна порівняно з ВЕРХ або ГХ, використовується для швидкої ідентифікації або попереднього аналізу сумішей під час багатоступеневих синтетичних процедур. Вона дозволяє візуально оцінити ступінь чистоти зразка, а також проконтролювати перебіг реакції в реальному часі. Характеристика Rf значень каннабіфурану в різних системах розчинників створює референтну базу для порівняння у напівкількісному режимі.
У спектроскопічних дослідженнях ЯМР-спектроскопія займає центральне місце як метод безпосередньої структуральної ідентифікації каннабіфурану. Використання 1H- та 13C-ЯМР дозволяє детально охарактеризувати розподіл протонів і вуглецевих ядер у структурі молекули, виявити ізомери, конформації та порівняти з теоретично розрахованими спектрами. Для більш складних завдань застосовуються двовимірні ЯМР-методи, включаючи COSY, HSQC, HMBC, які дають змогу реконструювати структуру навіть у разі наявності домішкових сигналів.
ІЧ-спектроскопія служить для швидкої ідентифікації функціональних груп каннабіфурану на основі характерних піків поглинання у середньому ІЧ-діапазоні (4000-400 см⁻¹). Зокрема, сигнали від вуглець-кисневих зв’язків, ароматичних систем та фуранового циклу мають добре виражену інтенсивність. Метод застосовується також для контролю змін у структурі при деградації або взаємодії з іншими речовинами, особливо у твердій фазі.
УФ-спектроскопія використовується не лише як детектор при ВЕРХ, але і як самостійний метод для оцінки поглинання каннабіфурану в діапазоні 200-400 нм. Поглинальні характеристики вказують на наявність кон’югованих систем, і зміщення максимуму поглинання може бути ознакою структурних змін. Цей метод особливо корисний у випадках моніторингу деградації при впливі світла або окислювачів.
Мас-спектрометрія (МС) виконує ключову роль у встановленні молекулярної маси каннабіфурану, а також у структурній ідентифікації продуктів біотрансформації, домішок або побічних продуктів. Використання електроспрей-іонізації (ESI) у позитивному та негативному режимах дозволяє отримувати іони з високою інтенсивністю та добрим співвідношенням сигнал/шум. Метод є особливо корисним у парі з ВЕРХ (LC-MS), коли необхідно проаналізувати складну багатокомпонентну суміш. Високороздільна мас-спектрометрія (HRMS) дає змогу визначити точну молекулярну масу з похибкою в межах ppm, що необхідно для розрізнення ізомерних структур або підтвердження елементного складу.
У більшості випадків мас-спектри каннабіфурану мають характерний фрагментаційний патерн, зокрема втрату бокових алкільних ланцюгів, розщеплення гетероциклічного ядра, утворення стабільних ароматичних катіонів. Ці фрагменти дозволяють відтворити повну карту розпаду та реконструювати структуру навіть у разі відсутності референсних стандартів.
Комплексне поєднання хроматографії, спектроскопії та мас-спектрометрії утворює повноцінну платформу аналітичного моніторингу, що охоплює всі аспекти хімічного і фармацевтичного контролю каннабіфурану. Методичні протоколи, які базуються на вищевказаних підходах, не лише забезпечують відповідність регуляторним вимогам, але й дозволяють гнучко адаптуватися до зміни умов синтезу, появи нових форм або модифікацій молекули, що є критично важливим у наукових і прикладних дослідженнях.
Стандартизація та валідація методів
Процес стандартизації та валідації аналітичних методів для контролю якості каннабіфурану вимагає суворого дотримання процедур, що забезпечують відтворюваність, точність, достовірність і відповідність міжнародним вимогам. З огляду на специфічні властивості каннабіфурану, включаючи його термолабільність, полярність, хімічну чутливість до окиснення і світла, необхідно впроваджувати стандартизовані методи, які враховують ці особливості й забезпечують можливість інтеграції у регламентовані системи контролю, зокрема в рамках фармакопейних вимог ICH, USP, Ph. Eur. або JP.
Основним етапом є визначення аналітичної мети – тотожність, чистота, кількісний вміст, залишкові розчинники, домішки синтезу, стабільність. Для кожного з цих завдань метод підлягає стандартизації на основі вибору аналітичної техніки, типу пробопідготовки, налаштування приладів, умов хроматографії або спектроскопії, та специфічних параметрів, що підлягають валідації.
Стандартизація починається з опису методики відповідно до GLP (Good Laboratory Practice) і SOP (Standard Operating Procedures), де зазначається тип аналітичного обладнання, характеристики колонок, фаз, розчинників, температурні режими, тип детектора, тривалість інкубації, витрати елюентів та програмування градієнтів. Усі ці параметри фіксуються з високою точністю, оскільки відхилення навіть у межах 1-2 % можуть впливати на хроматографічну поведінку каннабіфурану або чутливість спектрометричного сигналу.
Після створення методики відбувається її валідація відповідно до ICH Q2(R1), де ключовими параметрами є специфічність, точність, правильність, межа виявлення (LOD), межа кількісного визначення (LOQ), лінійність, діапазон та відтворюваність. Для каннабіфурану специфічність методу забезпечується здатністю відокремити основну речовину від структурно схожих домішок, побічних продуктів або залишкових реагентів, особливо в складних матрицях. Це тестується введенням відомих домішок у контрольний зразок з наступним аналізом на здатність розділення піків при хроматографії або селективність сигналів при спектрометрії.
Лінійність методу визначається побудовою калібрувальних кривих з використанням стандартних розчинів каннабіфурану в різних концентраціях. Спектри або площі піків аналізуються статистично – через кореляцію (r²), залишкові відхилення, перевірку гомогенності дисперсії. Типово вимоги до кореляції мають бути не нижчими за 0,999 у межах діапазону, що охоплює не менш як 80-120 % заявленої концентрації. Для фармацевтичного контролю також важливою є перевірка відсутності системної похибки по всьому діапазону.
Правильність (accuracy) методу оцінюється шляхом аналізу модельних сумішей, де відомі кількості каннабіфурану додаються до матриць, які імітують реальні зразки (екстракти, субстанції, готові форми). Результати повинні відповідати заданим значенням з допустимим відхиленням у межах ±2 % для активної речовини та ±5 % для домішок. Повторюваність (repeatability) перевіряється шляхом багаторазового аналізу одного і того ж зразка за однакових умов – варіація не повинна перевищувати 2 % RSD.
Міжсерійна відтворюваність (intermediate precision) потребує тестування методу у різні дні, різними аналітиками, із використанням різного обладнання або партій реактивів. Це дозволяє оцінити стабільність методики до впливу зовнішніх факторів. У випадку каннабіфурану критичними є впливи світла, температури й часу інкубації, тому обов’язковим є внесення до методики умов зберігання, часу відбору та стабільності проби під час аналізу.
Оцінка LOD та LOQ виконується статистичними методами (на основі шум/сигнал або через стандартне відхилення від калібрувальної прямої). Для домішок синтетичного походження LOQ не повинна перевищувати 0,05 %, а LOD має дозволяти виявляти навіть слідові концентрації нижче 0,01 %. У разі нестійкості сигналу використовується попередня дериватизація або корекція матриці.
Особливу увагу валідація вимагає у випадку аналізу деградаційних продуктів, що формуються під час зберігання або у присутності вологи, кисню, кислот або лугів. Методи повинні бути здатними фіксувати мінімальні структурні зміни – наприклад, відкривання фуранового кільця або гідроксилювання бокових ланцюгів – через зміну спектральних характеристик або хроматографічного часу утримування.
Окрім ICH Q2, стандартизація методів може базуватись на інструкціях AOAC, USP <1225>, EP 2.2.x, які надають додаткові критерії прийнятності та вимоги до документування. Кожен етап валідації повинен бути повністю задокументований у протоколах з детальним описом умов, результатів, статистичної обробки та відповідності заданим критеріям. У разі неспівпадіння із встановленими межами метод підлягає модифікації з наступною повторною валідацією.
У практиці GMP-виробництва всі аналітичні методи, що використовуються для випуску серій, обов’язково проходять повторну валідацію при кожному критичному оновленні обладнання, змінах сировини або умов проведення аналізу. Визначення граничних параметрів прийнятності для кожного методу (сигнал, шум, коефіцієнт варіації, площа піку, ідентифікаційні характеристики) є обов’язковим елементом при впровадженні методики в технологічний процес.
Контроль стабільності та зберігання
Контроль стабільності каннабіфурану потребує системного підходу до вивчення деградаційних процесів, які можуть впливати на його хімічну чистоту, біоактивність та аналітичну ідентичність. Через наявність у структурі фуранового гетероциклу та інших функціональних груп, молекула є чутливою до впливу температури, світла, кисню, вологості, а також кислотно-лужних умов, що зумовлює необхідність багатофакторного аналізу її стабільності в різних умовах зберігання.
Основою для оцінки стабільності є стандартизовані методи довготривалого (long-term), прискореного (accelerated) та стресового (forced degradation) тестування, які проводяться відповідно до вказівок ICH Q1A(R2). Згідно з протоколом довготривалого зберігання, зразки каннабіфурану досліджуються при температурі 25 ± 2 °C і відносній вологості 60 ± 5 % протягом не менше 12 місяців. Для прискореного тесту використовуються умови 40 ± 2 °C / 75 ± 5 % RH протягом 6 місяців. Ці дослідження дозволяють змоделювати стабільність при реальних та критичних умовах логістики і зберігання.
Оцінка стабільності включає хімічну ідентифікацію та кількісне визначення продукту, а також профілювання деградаційних сполук за допомогою високоефективної рідинної хроматографії (ВЕРХ), тонкошарової хроматографії (ТШХ), мас-спектрометрії або комбінації ВЕРХ-МС. У випадку каннабіфурану ключовим є моніторинг утворення гідроксилованих похідних, продуктів розриву фуранового кільця, полімеризованих утворень або реакцій з киснем.
Під час стресових випробувань каннабіфуран піддають агресивним умовам: окиснювальне середовище (3-10 % H₂O₂), кислотне (0,1N HCl), лужне (0,1N NaOH), фотоліз (експозиція до світла згідно з ICH Q1B) і термічний вплив (до 80 °C). Ці умови дозволяють змоделювати можливі сценарії деградації при порушенні умов зберігання або виробничого процесу. Для кожного зразка фіксуються зміни у вмісті активної субстанції, поява нових піків у хроматограмі, зміщення спектральних максимумів у UV/Vis або FTIR спектрах.
Особлива увага приділяється впливу вологості. Каннабіфуран має потенційну здатність до гідратації та гідролізу, особливо у присутності мікрослідових кислот або лугів. Тому матеріал підлягає зберіганню у герметичних контейнерах із захистом від проникнення водяної пари. Для цього використовуються контейнери зі склом класу I або фторполімерні ампули з вологопоглинаючими елементами (силікагель, молекулярне сито).
Контроль впливу світла проводиться відповідно до методики ICH Q1B, де зразки експонуються до світла загальної енергії ≥1,2 млн лк·год (видиме) і ≥200 Вт·год/м² (УФ-діапазон). Каннабіфуран зазнає фотохімічної деградації внаслідок утворення нестійких фуранонів, що можуть проявляти токсичні або небажані фармакологічні властивості. Це обумовлює вимогу до пакування в непрозорі контейнери або світлостійкі блистери.
Термостабільність вивчається не лише для сухої субстанції, але й у розчинах для фармацевтичного використання (етанол, пропіленгліколь, МСТ-олія). Аналіз показує зміну швидкості деградації залежно від розчинника, причому полярні розчинники здатні прискорювати деструкцію молекули при температурі вище 40 °C. З цієї причини при розробці лікарських форм визначають оптимальний склад носія, який мінімізує ризик нестабільності.
Окрім стандартних умов зберігання, проводяться також випробування на стабільність при транспортних умовах (умови “cold chain”, температурні коливання), моделюючи ситуації перевезення між виробничими ланками. Дані вивчаються з урахуванням можливої кумулятивної дії тепла, вібрацій, вологості та повітряного середовища.
Для гарантування довготривалого зберігання визначають граничний термін придатності на основі ретроспективного аналізу деградації. Розрахунок проводиться з використанням кінетичних моделей першого або псевдопершого порядку. Активність залишку визначається відносно початкового вмісту, з урахуванням допустимого зниження на ≤10 % для субстанції і ≤5 % для готової форми.
У випадку формування нестабільних продуктів розпаду важливим є їх токсикологічна оцінка – тестування in vitro або in silico за допомогою моделей QSAR для прогнозування мутагенного або канцерогенного потенціалу. У разі виявлення таких компонентів у межах виявлення, навіть нижче LOQ, проводиться перегляд умов зберігання та можлива розробка стабілізованої форми каннабіфурану.
Контроль стабільності також охоплює дослідження взаємодії каннабіфурану з матеріалами пакування – полімерними флаконами, гумовими пробками, алюмінієвими кришками, де тестується можливість адсорбції, дифузії або хімічної взаємодії. Це критично при тривалому зберіганні, особливо у випадку використання у фармацевтичних ін’єкційних системах або пероральних формах.
Висновок
Комплексний аналіз каннабіфурану (CBF) засвідчує його як перспективну малодосліджену канабіноїдну сполуку з унікальною структурою, відмінною від класичних фенольних канабіноїдів. Сполука характеризується наявністю фуранового кільця, що задає специфічні реакційні властивості, впливає на стабільність і визначає специфіку її хімічної, фармакологічної та технологічної поведінки. На молекулярному рівні CBF поєднує ліпофільність, електрофільні ділянки, а також здатність до утворення внутрішньомолекулярних асоціацій, що формують унікальний спектр фізико-хімічних характеристик. Саме ця структурна специфіка пояснює його обмежену, але точкову біологічну активність та селективну взаємодію з компонентами ендоканабіноїдної системи.
Хімічний синтез каннабіфурану охоплює багатоступеневі маршрути з використанням складних умов циклізації, окиснення та формування фуранового кільця, що потребують жорсткого контролю хімічного середовища, температури, а також вибору селективних реагентів. Ключовими для забезпечення ефективного синтезу є реакції формування 2-фуранільного ядра та контрольований алкільний ланцюг, структура якого впливає на кінцеві властивості продукту. Застосування каталізаторів, зокрема паладієвих, цинкових і кислотно-лужних систем, дозволяє значно підвищити вихід і селективність, зменшити кількість побічних продуктів та забезпечити контрольований перебіг реакцій навіть за зниженої температури. Каталіз також відіграє ключову роль у біоміметичному підході до відтворення природного біосинтезу каннабіноїдів.
Методи очищення та ідентифікації CBF базуються на мультиетапному хроматографічному розділенні, що забезпечує виділення цільової субстанції із складної матриці синтетичної або біогенетичної природи. Високоефективна рідинна хроматографія, газова хроматографія, тонкошарова хроматографія та спектроскопічні методи (NMR, FTIR, UV, MS) дозволяють одночасно відслідковувати чистоту, виявляти домішки, проводити кількісну та структурну ідентифікацію. Специфіка аналітичних методів зумовлена хімічною нестабільністю фуранового ядра, що вимагає особливих умов підготовки проб і обережного поводження з аналітом.
Біосинтетичне походження CBF демонструє включення до природного метаболічного каскаду канабіноїдів, з утворенням із проміжних субстратів типу каннабіхроменової або каннабігеролової природи, але з подальшим залученням оксидаз або циклаз, які спрямовують реакцію до формування фуранового кільця. Джерелом біосинтезу виступають специфічні хемотипи рослин роду Cannabis, що продукують CBF у слідових концентраціях, і його поява пов’язана з особливостями ферментативної активності та умовами культивації. Сировинна база для біогенезу CBF включає також можливість біотрансформації прекурсорів із залученням мікроорганізмів, ферментів або клітинних культур. Це створює потенціал для контрольованого отримання речовини в біотехнологічних умовах з регульованими метаболічними потоками.
У фармакологічному аспекті CBF демонструє модифіковану афінність до рецепторів CB1/CB2, не проявляючи вираженого психоактивного ефекту, однак може модулювати сигнальні каскади за участю TRP-каналів, GPR55 і потенційно PPARγ. Його фармакокінетика характеризується повільною абсорбцією, значною ліпофільністю, високим об’ємом розподілу та метаболізацією в печінці за участю ферментів CYP450. Продукти біотрансформації можуть демонструвати відмінну активність від материнської сполуки, що потребує оцінки їх фармакодинамічних властивостей.
Токсикологічний профіль CBF залишається недостатньо дослідженим, однак наявні дані in vitro свідчать про відсутність мутагенності та цитотоксичності при низьких дозах. Потребує подальшого вивчення кумулятивна дія, можливість біоакумуляції, а також вплив на клітинний метаболізм у хронічному режимі споживання. Це критично важливо у випадку розробки терапевтичних застосувань або інкапсульованих форм.
Забезпечення стабільності каннабіфурану є критично важливим через його схильність до фотолізу, окиснення та гідролізу. Навіть при короткочасному впливі несприятливих умов можливе утворення реактивних продуктів деградації з потенційно небажаними властивостями. Ці ризики вимагають суворого контролю при зберіганні, транспортуванні, виробництві та аналітичному супроводі субстанції, що реалізується через впровадження повного циклу валідації, стандартизації та контролю якості.
Аналітичні методи, зокрема хроматографія з мас-спектрометричним детектуванням, є визначальними для відстеження рівнів CBF в складних матрицях, біологічних зразках та при моніторингу його метаболітів. Стандартизація методів контролю, побудова стабільних калібрувальних кривих, визначення границь виявлення, точності, специфічності та відтворюваності – все це є основою створення валідованого інструментарію для впровадження CBF у фармацевтичний або біомедичний обіг.
Таким чином, CBF не є лише черговим представником канабіноїдів, а є об’єктом, що потребує цілісного, системного і науково вивіреного підходу до його вивчення, добування, модифікації, фармакологічного аналізу і регламентованого застосування. Його поєднання хімічної унікальності, синтетичної складності, чутливості до середовища і фармакобіологічного потенціалу вимагає мультидисциплінарного підходу до подальших досліджень і практичного застосування.
Джерела:
- National Center for Biotechnology Information (NCBI) – PubChem
База даних, що містить інформацію про хімічні сполуки, включаючи канабіноїди, їх властивості та біологічну активність.
https://pubchem.ncbi.nlm.nih.gov/ - National Institutes of Health (NIH) – National Library of Medicine (NLM)
Ресурс, який надає доступ до наукових публікацій з біомедицини, включаючи дослідження канабіноїдів.
https://www.ncbi.nlm.nih.gov/ - U.S. Food and Drug Administration (FDA) – Cannabis Research
Інформація про дослідження канабісу та його компонентів, включаючи регуляторні аспекти.
https://www.fda.gov/news-events/public-health-focus/fda-and-cannabis-research-and-drug-approval-process - Drug Enforcement Administration (DEA) – Drug Scheduling
Офіційна інформація про класифікацію речовин, включаючи канабіноїди.
https://www.dea.gov/drug-scheduling - U.S. Department of Agriculture (USDA) – Agricultural Research Service
Дослідження, пов’язані з вирощуванням канабісу та його компонентів.
https://www.ars.usda.gov/ - European Monitoring Centre for Drugs and Drug Addiction (EMCDDA)
Інформація про канабіноїди та їх вплив на здоров’я.
https://www.emcdda.europa.eu/ - World Health Organization (WHO) – Cannabidiol (CBD) Critical Review Report
Хоча звіт присвячений CBD, він містить загальні відомості про канабіноїди, які можуть бути корисними для розуміння контексту CBF.
https://www.who.int/medicines/access/controlled-substances/CannabidiolCriticalReview.pdf - University of Mississippi – National Center for Natural Products Research
Дослідження природних продуктів, включаючи канабіноїди.
https://pharmacy.olemiss.edu/ncnpr/ - American Chemical Society (ACS) Publications
Наукові статті з хімії, включаючи дослідження канабіноїдів.
https://pubs.acs.org/