Упродовж останніх десятиліть канабіноїди, біологічно активні сполуки, що природно містяться в Cannabis sativa L., стали об’єктом широкомасштабного наукового дослідження. Основна увага зосереджувалася на Δ⁹-тетрагідроканабінолі (THC) та канабідіолі (CBD), які мають добре вивчений фармакологічний профіль. Проте в рослині присутні й інші, менш поширені канабіноїди, які демонструють унікальні біологічні властивості. Одним із таких є канабігерол (CBG) – непсихоактивна сполука, що слугує метаболічним попередником THC, CBD та CBC у біосинтетичному каскаді канабіноїдів.
CBG синтезується у вигляді кислоти-попередника – канабігеролової кислоти (CBGA), яка за участю ферментів циклізується в інші основні канабіноїди. Через це в зрілих рослинах концентрація вільного CBG, як правило, не перевищує 1%, що історично ускладнювало його вивчення. Однак сучасні біотехнологічні підходи дозволяють отримувати CBG у достатніх кількостях, відкриваючи нові перспективи для дослідження його протизапального, нейропротекторного, антибактеріального та потенційно протипухлинного ефекту.
Наразі інтерес до CBG зумовлений не лише його унікальним фармакологічним профілем, а й низькою психоактивністю, що робить його перспективним кандидатом для клінічного застосування у сферах, де традиційні канабіноїди мають обмеження.
Походження та хімічна характеристика канабігеролу (CBG)
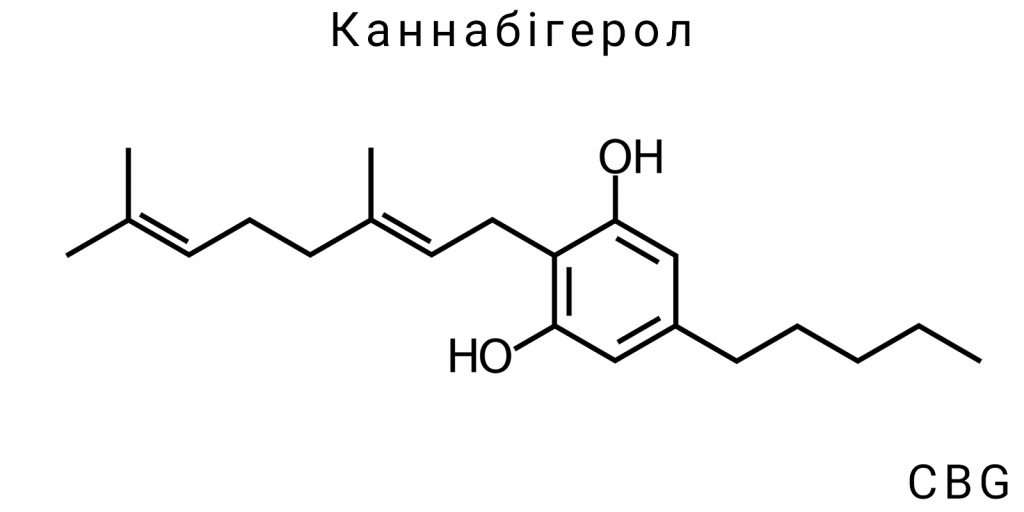
Канабігерол (CBG) є одним із первинних канабіноїдів, що зустрічаються в рослинах Cannabis sativa. Це молекула, яка є частиною складного біохімічного шляху в метаболізмі канабісу, в якому канабігерол відіграє роль попередника для більшості інших канабіноїдів, таких як Δ⁹-THC та CBD. Важливою особливістю CBG є його здатність діяти як матриця для подальших перетворень, що відбуваються в рослині. Це надає CBG ключове значення для розуміння як канабіноїди, що мають важливі терапевтичні властивості, утворюються в рослині.
Що стосується його хімічної структури, CBG має молекулу з 21 атомом вуглецю, 30 атомами водню і одним атомом кисню, що дозволяє йому належати до класу фітоканабіноїдів, які зазвичай складаються з фенольного кільця та гідрофобного алкільного ланцюга. Відмінною рисою CBG є наявність гідроксильної групи (-OH) на певній позиції в молекулі, що робить його більш полярним порівняно з іншими канабіноїдами, такими як THC чи CBD. Це має суттєве значення для його біологічної активності і взаємодії з різними рецепторами в організмі.
Однією з важливих характеристик CBG є його біологічна активність на рівні молекул, що дозволяє йому мати потенціал для лікування широкого спектра захворювань, від нейродегенеративних розладів до запальних процесів. Однак його вміст у канабісових рослинах зазвичай дуже низький, що обмежує можливості для масового застосування. Для підвищення концентрації CBG в рослинах, застосовують спеціальні методи селекції та генної інженерії.
Біосинтез CBG: перехід від CBGA до CBG
Біосинтез CBG в рослинах канабісу починається з утворення канабігеролової кислоти (CBGA), яка є попередником усіх основних канабіноїдів, таких як THC, CBD та CBC. CBGA синтезується шляхом поєднання двох молекул: оліветолової кислоти та геранілдифосфату (GPP), які є попередниками канабіноїдної структури. Цей етап відбувається завдяки дії ферменту канабігеролової синтази, що каталізує їх з’єднання.
Після того, як утворюється CBGA, він далі перетворюється в CBG. Це відбувається через процес декарбоксилювання, який забирає від молекули CBGA карбоксильну групу (-COOH). Для цього необхідний фермент канабігеролової кислоти декарбоксилаза (CBGA-DC). Результатом цього процесу є нейтральний канабіноїд CBG, який має важливу роль у фармакології.
Варто зазначити, що після утворення CBG, цей канабіноїд може трансформуватися у THC або CBD в залежності від дії інших специфічних ферментів, таких як Δ⁹-THC-синтаза чи CBD-синтаза. Це робить CBG унікальним за своєю ролью, оскільки саме через нього проходить синтез основних канабіноїдів. Однак CBG також може діяти незалежно від перетворення на інші канабіноїди, надаючи власні терапевтичні властивості.
Структурні особливості CBG
Молекула канабігеролу складається з фенольного кільця, що є спільною структурною одиницею для всіх канабіноїдів. Це кільце забезпечує здатність молекули взаємодіяти з рецепторами канабіноїдів в організмі, зокрема з рецепторами CB1 та CB2, які є частиною ендоканабіноїдної системи. Ще однією характерною особливістю є наявність довгого ланцюга вуглецю, який дозволяє молекулі проникати через біологічні мембрани і взаємодіяти з клітинами.
Молекула CBG містить гідроксильну групу (-OH), що додає молекулі полярність. Це дозволяє CBG бути менш гідрофобним порівняно з іншими канабіноїдами, такими як THC, що має значення для його здатності розчинятись у водних середовищах і взаємодіяти з водними компонентами клітин. Гідроксильна група також може сприяти стабільності молекули та впливати на її реакції з іншими біологічними молекулами.
Канабігерол не є на 100% стабільним в рослині. Він може розкладатись або перетворюватись на інші канабіноїди під впливом температури, світла або певних ферментів. Це важливо для його потенційного використання в медичних цілях, оскільки умови зберігання і виробництва CBG можуть значно впливати на його ефективність.
Порівняння з іншими фітоканабіноїдами
Порівняння CBG з іншими канабіноїдами, такими як THC та CBD, є важливим для розуміння його унікальних властивостей та терапевтичних можливостей. CBG відрізняється від THC тим, що є непсихоактивним канабіноїдом. Це означає, що він не викликає характерного для THC ефекту “висоти”, а тому може бути більш безпечним для широкого медичного використання, особливо в лікуванні хронічних запальних захворювань, нейродегенеративних розладів, а також деяких видів раку.
CBD, хоча і не є психоактивним, має інші механізми дії порівняно з CBG. Наприклад, CBD взаємодіє з рецепторами серотоніну, що надає йому заспокійливі властивості, у той час як CBG має більш безпосередній вплив на канабіноїдні рецептори CB1 і CB2, що дозволяє йому мати сильніші протизапальні та антиоксидантні властивості.
CBG також має більший потенціал для лікування інфекцій, оскільки виявляється ефективним у боротьбі з бактеріями, зокрема деякими стійкими до антибіотиків штамами. Це робить його перспективним для використання в лікуванні інфекційних захворювань, особливо в умовах антибіотикорезистентності.
Методи отримання CBG
Отримання канабігеролу (CBG) є критичним етапом у фармацевтичному, біотехнологічному та аграрному секторах, оскільки ця сполука демонструє широкий спектр потенційних біологічних активностей. Незважаючи на порівняно невисоку популярність у порівнянні з тетрагідроканабінолом (THC) чи канабідіолом (CBD), CBG вважається перспективним терапевтичним агентом, а також важливою сировиною для подальшого хімічного синтезу канабіноїдів. Його низька концентрація у природних джерелах вимагає застосування високотехнологічних підходів до видобування або синтезу. У цьому розділі будуть розглянуті та проаналізовані основні методи отримання CBG: природна екстракція, синтетичні технології, ферментативні методи, а також біоінженерні підходи, включно з порівняльною ефективністю, якістю кінцевого продукту, витратами та екологічним впливом.
Природна екстракція
Найбільш традиційним і водночас технологічно складним методом отримання CBG є його видобуток з рослинної сировини. Важливою особливістю тут є вибір культури: для отримання CBG перевага надається спеціально виведеним сортам Cannabis sativa з підвищеним вмістом канабігеролової кислоти (CBGA), які згодом піддаються біохімічній або термічній декарбоксиляції для утворення активної форми – CBG. Це передбачає ретельний підхід до культивації, збору та зберігання рослин.
Одним із найефективніших способів натуральної екстракції CBG є метод надкритичної флюїдної екстракції з використанням вуглекислого газу. Цей метод забезпечує виняткову селективність щодо неполярних молекул, таких як канабіноїди, і дає змогу добувати CBG без залишків органічних розчинників. Надкритичний CO₂ у стані між рідиною та газом проникає в матрицю рослини, розчиняючи цільові компоненти. Результатом цього процесу є екстракт високої чистоти, придатний для подальшого очищення та фракціонування. Однак цей метод потребує використання дорогого обладнання, зокрема екстракторів високого тиску, що працюють при температурі 35-45 °C та тиску до 350 бар.
Іншим способом є екстракція за допомогою органічних розчинників, зокрема етанолу, гексану або ізопропілового спирту. Етанол, як розчинник, має високу полярність, що дозволяє ефективно витягати канабіноїди, але водночас спричиняє видобування небажаних компонентів, зокрема хлорофілу. Для мінімізації домішок застосовують низькотемпературну екстракцію з подальшим зимуванням (winterization), яка дозволяє осадити воски, ліпіди та інші високомолекулярні речовини. Наступний етап – дистиляція або хроматографія – забезпечує високий ступінь очищення CBG. Проте ці процедури суттєво впливають на собівартість кінцевого продукту.
У ряді досліджень описано застосування фракційної перегонки в умовах вакууму, що дає змогу зберігати термолабільні канабіноїди й підвищити концентрацію CBG без втрати активності. Цей підхід, однак, рідко застосовується у промислових масштабах через складність масштабування і необхідність високої точності температурного контролю. Додаткові методи, зокрема ультразвукова екстракція, використовуються переважно в лабораторних умовах і дають можливість знизити температуру процесу, проте їхня ефективність щодо CBG залишається предметом дискусій у науковій спільноті.
Біотехнологічні та синтетичні підходи
У світлі проблем масштабованості природної екстракції, все більшої уваги набувають синтетичні та біоінженерні підходи. Особливе значення має біосинтез CBG із використанням мікроорганізмів, здатних продукувати канабіноїди за допомогою вбудованих метаболічних шляхів. Найбільш поширеними об’єктами для цього є дріжджі (Saccharomyces cerevisiae) та кишкова паличка (E. coli), генетично модифіковані для синтезу попередників канабіноїдів – геранілпірофосфату (GPP) та оливітолу, які надалі ферментуються у CBGA, а потім перетворюються у CBG шляхом термічної або ферментативної декарбоксиляції.
Інноваційні дослідження у цій галузі продемонстрували можливість отримання до 100 мг/L CBG у ферментативних культурах, що свідчить про реалістичність масштабування цих процесів. Наприклад, згідно з публікаціями у журналах Nature Biotechnology та ACS Synthetic Biology, застосування модульних синтетичних каскадів дозволило оптимізувати продуктивність і підвищити стабільність мікроорганізмів до рівня, достатнього для промислової реалізації. Основна перевага цього підходу полягає у відсутності залежності від умов культивації рослин, сезонності та фітосанітарних загроз. Крім того, мікробні біофабрики значно знижують екологічне навантаження завдяки замкнутим циклам виробництва.
Ферментативні методи, що застосовуються ex vivo, також демонструють значний потенціал. За цією технологією використовують очищені ферменти, такі як канабігеролова синтаза, у реакціях з ізольованими попередниками (оливітолом та геранілпірофосфатом). Ферментативні реакції проводяться у буферних середовищах з регульованими параметрами pH та температури, що забезпечує високу селективність і вихід. Одним з викликів тут є стабільність ферментів та їх вартість, однак синтетична біологія й протеоміка активно працюють над отриманням більш стабільних та дешевших варіантів каталітичних білків.
Щодо повністю хімічного синтезу, то він базується на реакції алкілування оливітолу геранілом або його похідними у присутності кислотних або лужних каталізаторів, з подальшою циклізацією та стабілізацією отриманої структури. Проблемою цього підходу є низька хімічна селективність і наявність значної кількості побічних продуктів. До того ж, синтетичний CBG може мати неідентичну стереохімію порівняно з природною молекулою, що потенційно впливає на його біоактивність.
Порівняльна оцінка технологій
При виборі методу отримання CBG критично важливо враховувати кінцеву мету використання сполуки. Якщо йдеться про фармацевтичне застосування, ключовими чинниками є чистота, репродуктивність та відповідність стандартам GMP. У такому випадку біотехнологічні та ферментативні підходи мають перевагу через можливість контролю на молекулярному рівні та зниження ризику контамінації сторонніми речовинами.
Для промислових цілей, зокрема у косметичній чи харчовій промисловості, екстракція з рослинної сировини залишається економічно доцільною, особливо за умов використання спеціалізованих сортів з високим вмістом CBGA. З іншого боку, методи хімічного синтезу можуть застосовуватись для отримання дослідних зразків або у випадках, коли доступ до сировини обмежений через регуляторні чи логістичні бар’єри.
Фармакологічні властивості канабігеролу (CBG)
Взаємодія з рецепторами: CB1, CB2, TRPV1, PPARγ та інші молекулярні мішені
CBG, як непсихоактивний фітоканабіноїд, демонструє широкий спектр фармакологічних властивостей, завдяки здатності взаємодіяти з численними молекулярними мішенями в організмі людини та тварин. Найдослідженішими з них є канабіноїдні рецептори першого (CB1) і другого (CB2) типу, транзиторний рецептор потенціалу ванілоїдного типу 1 (TRPV1), а також ядерний рецептор активатора проліферації пероксисом γ (PPARγ).
На відміну від THC, CBG має відносно низьку афінність до CB1-рецепторів, що пояснює відсутність психоактивної дії. Проте він діє як частковий агоніст CB1 та CB2, демонструючи модуляторний ефект, що може бути значущим при регуляції нейротрансмісії, зокрема у випадках нейродегенеративних порушень. В експериментальних моделях доведено, що CBG пригнічує зворотне захоплення анадаміду – ендогеного канабіноїду – тим самим підсилюючи тонус ендоканабіноїдної системи.
TRPV1, кальційзалежний іонний канал, відомий також як капсаїциновий рецептор, модулюється CBG з активаційним ефектом. Це відкриває потенційні шляхи для аналгетичної дії, зменшення нейропатичного болю, а також регуляції запальних реакцій. Багатообіцяючим є і вплив на PPARγ – транскрипційний фактор, залучений до регуляції глюкозного обміну, запалення та клітинної диференціації. CBG активує цей рецептор, що може пояснити його антидіабетичний та нейрозахисний потенціал.
CBG також демонструє здатність інгібувати активність ензиму 5-альфа-редуктази, що має значення у терапії гіперплазії передміхурової залози та андрогенетичної алопеції. Інші мішені включають адренергічні, серотонінергічні та простагландинові рецептори, проте ці взаємодії наразі залишаються предметом активних досліджень.
Протизапальна, нейропротекторна та антибактеріальна дія
CBG демонструє виражені протизапальні властивості, що підтверджено як in vitro, так і in vivo. В експериментах на клітинних культурах макрофагів та мікроглії, CBG знижує експресію прозапальних цитокінів – інтерлейкіну-6 (IL-6), фактора некрозу пухлин альфа (TNF-α) та інтерлейкіну-1β (IL-1β). Подібні ефекти спостерігались також на тваринних моделях коліту, що свідчить про потенціал CBG у лікуванні запальних захворювань кишківника.
Нейропротекторні властивості CBG вивчалися в контексті хвороб Гантінгтона, Паркінсона та Альцгеймера. На моделях нейродегенерації було показано, що CBG зменшує окислювальний стрес, інгібує апоптоз і сприяє виживанню нейронів, імовірно через вплив на PPARγ та інгібування мікрогліальної активації. Цікаво, що CBG проявив ефективність у зменшенні втрати моторики та запалення в корі головного мозку у мишей з модельованою хворобою Гантінгтона.
Антибактеріальні властивості CBG є предметом зростаючої уваги, особливо у контексті антибіотикорезистентних інфекцій. CBG ефективно пригнічує ріст метицилін-резистентного золотистого стафілокока (MRSA), а також руйнує біоплівки – структури, які забезпечують бактеріям захист від дії антибіотиків. Передбачається, що механізм полягає в порушенні функціонування клітинної мембрани мікроорганізмів.
Перспективи застосування в онкології та гастроентерології
CBG демонструє значний потенціал як супутній або ад’ювантний засіб у терапії деяких форм раку. Його цитотоксична дія щодо ракових клітин, зокрема колоректального, грудного та простатичного раку, підтверджена в декількох доклінічних дослідженнях. У роботі, опублікованій в Carcinogenesis (2014), було показано, що CBG інгібує проліферацію колоректальних клітин людини, індукує апоптоз і зменшує ангіогенез у пухлинах у мишей.
Ключовим механізмом протипухлинної дії CBG є інгібування сигнальних шляхів, пов’язаних із клітинним ростом, зокрема ERK/MAPK та PI3K/AKT, а також модуляція експресії генів, залучених до регуляції клітинного циклу. Окрім цього, CBG знижує рівень VEGF (фактора росту ендотелію судин), що обмежує кровопостачання пухлин.
У сфері гастроентерології, особливий інтерес становить потенціал CBG при лікуванні запальних захворювань кишківника (ЗЗК), включно з хворобою Крона та виразковим колітом. CBG зменшує інфільтрацію нейтрофілів у слизову оболонку кишки, нормалізує бар’єрну функцію епітелію, а також знижує оксидативний стрес. У тваринних моделях спостерігалось відновлення морфології кишківника після введення CBG у дозах 5-10 мг/кг.
Потенційно CBG може бути використаний також у терапії функціональних порушень ШКТ, таких як синдром подразненого кишківника (СПК), завдяки своїм спазмолітичним, протизапальним та анальгезуючим властивостям. Проте необхідні додаткові клінічні дослідження для підтвердження ефективності та безпечності цих застосувань у людській популяції.
Фармакокінетика та безпека канабігеролу (CBG)
Біодоступність, метаболізм та виведення канабігеролу
Канабігерол (CBG), незважаючи на свою низьку афінність до основних канабіноїдних рецепторів (CB1 і CB2), володіє значним терапевтичним потенціалом завдяки своїй здатності взаємодіяти з іншими рецепторами та сигнальними шляхами в організмі. Для розуміння потенціалу канабігеролу, важливим аспектом є вивчення його фармакокінетики, яка включає біодоступність, метаболізм та виведення.
- Біодоступність
Біодоступність канабігеролу визначається шляхом, яким препарат потрапляє в загальний кровотік після введення. При пероральному застосуванні канабігеролу біодоступність є відносно низькою, що обумовлено високим рівнем метаболізму при першому проходженні через печінку. Цей ефект може знижувати кількість активної молекули, що досягає кровообігу. Існують дані про те, що при пероральному введенні біодоступність може становити лише 6-10%, що значно обмежує ефективність застосування канабігеролу через рот.
Проте, при інших способах введення, таких як інгаляція або сублінгвальне введення, біодоступність підвищується, оскільки речовина не зазнає метаболічних змін в печінці на першому етапі. Це дозволяє більш ефективно доставляти CBG в організм, досягати високих концентрацій в крові та забезпечувати швидший терапевтичний ефект.
- Метаболізм канабігеролу
Канабігерол метаболізується в печінці за допомогою ферментів цитохрому P450, зокрема CYP3A4 та CYP2C9. Ці ферменти катализують процеси гідроксилювання молекули канабігеролу, що призводить до утворення активних та неактивних метаболітів. Відомо, що основний метаболіт CBG – це 7-гідроксіканабігерол, який має значно меншу фармакологічну активність порівняно з материнською молекулою, проте він може мати певний терапевтичний потенціал, зокрема у взаємодії з іншими молекулярними мішенями в організмі.
Оскільки метаболізм CBG здійснюється через систему цитохрому P450, існує потенціал для фармакокінетичних взаємодій з іншими лікарськими засобами, які використовують ці ж ферменти. Наприклад, одночасне застосування канабігеролу з ліками, що інгібують CYP3A4, може призвести до підвищення концентрацій CBG в крові, що, в свою чергу, може змінити ефективність і безпеку його застосування. Такі взаємодії є важливими при складанні терапевтичних схем для пацієнтів, що використовують комбінацію препаратів.
- Виведення канабігеролу з організму
Виведення канабігеролу відбувається переважно через нирки, оскільки більшість метаболітів виводяться з сечею. Однак частина канабігеролу і його метаболітів може виводитися через жовч, а отже, через фекалії. Це важливо при розробці схем дозування та оцінці потенціалу накопичення канабігеролу в організмі при тривалому застосуванні. Як і в разі багатьох інших канабіноїдів, у осіб з порушеннями функції нирок або печінки можуть бути зміни в метаболізмі та виведенні канабігеролу, що потребує корекції дозувань.
Початкові дані токсикології канабігеролу
- Оцінка гострої токсичності
Канабігерол демонструє низьку гостру токсичність. Тваринні моделі показують, що навіть при введенні високих доз CBG не спостерігається серйозних летальних наслідків. Підвищення дози в сотні разів вище терапевтичної не призводить до важких порушень у функціонуванні організму. Дослідження гострої токсичності показали, що навіть у випадку передозування CBG не спостерігаються тяжкі порушення серцево-судинної чи нервової системи. Однак можливі незначні побічні ефекти, такі як тимчасова дезорієнтація, сонливість, незначне зниження моторної активності.
- Хронічна токсичність
На сьогоднішній день відсутні значущі дані, які б свідчили про хронічну токсичність CBG. Важливо зазначити, що при довготривалому застосуванні канабігеролу в терапевтичних дозах у тварин не було виявлено серйозних побічних ефектів. Результати досліджень показують, що CBG не має токсичного впливу на печінку, нирки чи серце в довгостроковій перспективі. Проте, оскільки клінічні дослідження на людині тривали коротший період, повна картина можливих довготривалих побічних ефектів поки не сформована.
Одним з найбільших викликів є те, що канабігерол може викликати зміни в функціях органів, пов’язаних з метаболізмом, таких як печінка і нирки, в разі значного перевищення доз. Це вимагає ретельного контролю дозувань у клінічних випробуваннях і при застосуванні CBG в медичній практиці.
- Вплив на органи
Канабігерол може надавати вплив на різні органи, включаючи печінку, нирки і серцево-судинну систему. Однак на сьогоднішній день не виявлено серйозних токсичних ефектів при використанні канабігеролу в рекомендованих дозах. Випадки токсичності обмежуються лише легкими симптомами на рівні шлунково-кишкового тракту, такими як диспепсія або незначне зниження апетиту. Проте у разі передозування може виникнути тимчасове зниження функції нирок чи печінки, що обов’язково вимагає корекції дозування або тимчасової зупинки прийому препарату.
Переносимість канабігеролу при різних формах введення
- Пероральне введення
Пероральне введення канабігеролу забезпечує стабільний ефект при тривалому застосуванні, але низька біодоступність залишає його менш ефективним. Цей метод введення є найбільш зручним, оскільки дозволяє зручно дозувати канабігерол у вигляді капсул або олії, а також дозволяє пацієнтам зберігати контроль над дозуванням. Проте необхідно враховувати, що пероральне введення супроводжується ефектом першого проходження через печінку, що знижує кількість активної молекули в крові.
- Інгаляція
Інгаляція канабігеролу через пар чи спеціальні пристрої дозволяє швидко досягти високих концентрацій в крові, оскільки речовина не зазнає метаболічних змін у печінці. Цей метод також дозволяє мінімізувати вплив на травну систему, що робить його більш ефективним при швидкому лікуванні симптомів. Однак через відсутність довготривалих досліджень щодо впливу інгаляції канабігеролу, цей метод вимагає додаткових досліджень.
- Сублігвальне введення
Сублігвальне введення канабігеролу забезпечує швидке всмоктування та високі концентрації в крові. Канабігерол, потрапляючи безпосередньо в кровообіг через слизову оболонку порожнини рота, минає печінку, що дозволяє забезпечити високу біодоступність і швидкий ефект. Цей метод є зручним для пацієнтів, що потребують швидкої терапевтичної дії, але також вимагає точного дозування для уникнення передозування.
Поточні дослідження та клінічний потенціал канабігеролу (CBG)
Канабігерол (CBG), як один із основних канабіноїдів, привертає все більше уваги в контексті його медичного потенціалу. Завдяки своїм фармакологічним властивостям, таким як протизапальна, нейропротекторна, антибактеріальна та антидіабетична дія, CBG демонструє можливості в лікуванні широкого спектру захворювань. Зростаюча кількість наукових досліджень дає обґрунтування для подальших клінічних випробувань, що мають на меті підтвердити безпеку і ефективність цього канабіноїду в медичній практиці.
Результати доклінічних моделей
Доклінічні дослідження канабігеролу показали його значний терапевтичний потенціал у різних модельних системах. Випробування на тваринах і клітинних культурах дозволили виявити багатообіцяючі результати щодо лікування низки захворювань, зокрема неврологічних, запальних, онкологічних і бактеріальних.
Одним з основних напрямків досліджень є вивчення впливу CBG на нейродегенеративні захворювання, такі як хвороба Гантінгтона, Паркінсона та Альцгеймера. У доклінічних моделях показано, що CBG здатен знижувати рівень окислювального стресу, зменшувати активацію мікроглії (клітин, що відповідають за запалення в мозку) та сприяти збереженню нейронів, що дає підстави для подальшого вивчення CBG як потенційного нейропротектора.
Крім того, CBG продемонстрував обнадійливі результати в боротьбі з інфекціями, особливо бактеріальними. Дослідження показали його здатність інгібувати ріст метицилін-резистентного золотистого стафілокока (MRSA), а також ефективність проти інших патогенних мікроорганізмів, таких як Escherichia coli та Pseudomonas aeruginosa. Крім того, були зафіксовані позитивні ефекти CBG в боротьбі з біоплівками бактерій, що є значним досягненням в контексті антибіотикорезистентності.
Ще однією перспективною областю є використання канабігеролу для лікування запальних захворювань кишківника, таких як хвороба Крона та виразковий коліт. Дослідження на тваринах показали, що CBG здатен знижувати рівень прозапальних цитокінів, покращувати бар’єрну функцію кишківника і зменшувати інфільтрацію нейтрофілів у слизову оболонку кишки. Це відкриває нові можливості для використання канабігеролу в терапії запальних захворювань ШКТ.
Доклінічні моделі також показали, що CBG має анальгезуючі властивості, що відкриває перспективи для його застосування в лікуванні хронічного болю, зокрема нейропатичного та запального болю. В експериментах на тваринах було показано, що CBG може знижувати рівень болю через активацію рецепторів TRPV1, що відповідають за сприйняття болю та температури.
Одним з найбільш цікавих напрямків досліджень є використання CBG у боротьбі з онкологічними захворюваннями. Ряд доклінічних досліджень показали, що CBG має потенціал для інгібування проліферації ракових клітин, зокрема у колоректальному, грудному та простатичному раку. Механізм протипухлинної дії CBG включає блокування сигнальних шляхів, які сприяють росту та розвитку пухлин, таких як ERK/MAPK та PI3K/AKT. Це робить CBG багатообіцяючим кандидатом для подальшого вивчення як доповнення до стандартної терапії раку.
Клінічні випробування: короткий огляд
Клінічні випробування канабігеролу знаходяться на ранніх етапах, але вже наявні попередні дані, які підтверджують його безпеку та ефективність в лікуванні деяких захворювань. Важливо зазначити, що більшість клінічних досліджень канабігеролу досі є маломасштабними і відносяться до фази 1 і 2, що робить висновки щодо його терапевтичного потенціалу попередніми.
Одне з перших клінічних досліджень CBG стосувалося його застосування у пацієнтів з хронічним болем, зокрема нейропатичним болем. Результати показали, що застосування CBG має позитивний вплив на зменшення інтенсивності болю та поліпшення якості життя пацієнтів. Однак, хоча ці результати обнадійливі, дослідження не виявили значних відмінностей порівняно з плацебо, що вказує на необхідність додаткових клінічних досліджень для підтвердження цих результатів.
Інше клінічне дослідження вивчало використання CBG у пацієнтів з запальними захворюваннями кишківника. Застосування CBG показало зниження рівня запалення і покращення симптомів у пацієнтів з хворобою Крона. Проте ці результати також потребують подальшої перевірки у більшій популяції пацієнтів та в умовах тривалого застосування.
Ще один напрямок клінічних досліджень пов’язаний із потенційним використанням CBG для лікування нейродегенеративних захворювань, таких як хвороба Паркінсона та Альцгеймера. На цей момент проведено декілька невеликих клінічних досліджень, які вказують на поліпшення моторних функцій у пацієнтів з Паркінсоном після застосування CBG, однак ефективність і безпека потребують подальших масштабних досліджень.
Водночас, клінічні дослідження в галузі онкології, що вивчають вплив CBG на ракові клітини, знаходяться на стадії первинних випробувань. За попередніми даними, CBG може бути корисним як додаткове лікування для деяких видів раку, таких як колоректальний рак. Однак, як і у випадку з іншими напрямками, необхідно більше клінічних випробувань для підтвердження цієї гіпотези.
Бар’єри для впровадження CBG в медичну практику
Існують кілька суттєвих бар’єрів для впровадження канабігеролу в медичну практику, зокрема правові, економічні та наукові. Хоча канабігерол має значний терапевтичний потенціал, деякі з цих бар’єрів можуть затримати або ускладнити його широке застосування.
- Правові бар’єри
Один із найбільших бар’єрів на шляху до впровадження CBG у медичну практику – це правові обмеження, пов’язані з канабіноїдами загалом. У багатьох країнах канабіноїди, навіть у не психоактивних формах, таких як CBG, досі класифікуються як контрольовані речовини. Це ускладнює проведення клінічних випробувань, а також обмежує можливість широкого застосування CBG в медичній практиці.
Поки що лише в деяких країнах канабігерол має статус дозволеного препарату, що значно обмежує можливості для досліджень і клінічного застосування. Однак з поступовим зм’якшенням законодавства щодо канабіноїдів у світі, ситуація може змінюватися на користь більшого визнання CBG як терапевтичного засобу.
- Економічні бар’єри
Створення і виробництво лікарських засобів на основі CBG потребує значних інвестицій у наукові дослідження та клінічні випробування. Терапевтичні препарати на основі канабігеролу вимагають високих витрат на розробку, тестування та отримання необхідних ліцензій для комерційного виробництва. Крім того, на виробництво таких препаратів може бути накладено податки та обмеження, що збільшують їхню вартість для кінцевих споживачів.
- Наукові бар’єри
Хоча дослідження CBG виявили його перспективи у лікуванні різних захворювань, існує потреба в подальших клінічних випробуваннях для точнішого розуміння механізмів його дії, оптимальних доз та тривалості лікування. Тільки після проведення великих, багатократних та довготривалих досліджень можна буде остаточно оцінити, чи дійсно CBG може стати ефективним та безпечним ліками для широкої аудиторії пацієнтів.
Висновок
Канабігерол (CBG) являє собою один з найбільш перспективних канабіноїдів, який набуває значної уваги в контексті сучасних медичних досліджень завдяки своїм широким фармакологічним властивостям. Його потенціал у лікуванні різноманітних захворювань, таких як нейродегенеративні хвороби, інфекційні захворювання, запальні процеси та онкологічні захворювання, на основі доклінічних досліджень виглядає обнадійливим. Проте, хоча попередні результати є багатообіцяючими, канабігерол все ще потребує проведення додаткових клінічних випробувань для підтвердження його ефективності та безпеки в реальних умовах.
Важливою проблемою залишається правове регулювання та економічні бар’єри, які стримують широке впровадження CBG в медичну практику. Однак, з урахуванням змін у законодавчому полі щодо канабіноїдів і поступового розширення досліджень, є реальна можливість для більшого визнання цього канабіноїду як терапевтичного засобу в найближчому майбутньому.
На основі поточних досліджень можна зробити висновок, що канабігерол має великий клінічний потенціал, але для його повного застосування в медицині необхідно вирішити ще низку проблем, пов’язаних з правовим статусом, економічними аспектами виробництва та розширенням наукових досліджень. Тому для того, щоб канабігерол зміг реалізувати свій повний медичний потенціал, потрібно продовжувати наукові дослідження, долати бар’єри для його впровадження та уважно моніторити результати клінічних випробувань, що допоможе зробити цей канабіноїд важливим компонентом сучасної терапії.
Джерела:
- PubMed (NCBI) – наукові дослідження, рецензовані статті, клінічні випробування: https://pubmed.ncbi.nlm.nih.gov/
Це одна з найбільших баз даних, що містить статті та дослідження з медичної, біологічної та фармакологічної тематики. - Google Scholar – наукові статті, рецензовані журнали та дисертації: https://scholar.google.com/
Платформа, де ви можете знайти наукові публікації та дослідження з різних галузей, у тому числі фармакології та хімії канабіноїдів. - Frontiers in Pharmacology – відкриті наукові журнали з фармакології: https://www.frontiersin.org/journals/pharmacology
Журнал надає доступ до статей з різних напрямків фармакології, зокрема канабіноїдів і їх терапевтичних властивостей. - Cannabis and Cannabinoid Research – журнал, який публікує статті та дослідження про канабіс і канабіноїди: https://www.liebertpub.com/can
Спеціалізований журнал, що фокусується на наукових і клінічних дослідженнях канабіноїдів. - National Institute on Drug Abuse (NIDA) – офіційний ресурс, який публікує дослідження про канабіс і його складові: https://www.drugabuse.gov/
Наукові статті та дослідження з розділу канабіноїдів та їх впливу на здоров’я. - World Health Organization (WHO) – звіти та огляди про канабіноїди: https://www.who.int/
Офіційний сайт ВООЗ, де публікуються звіти та наукові огляди, зокрема про медичне використання канабіноїдів. - ScienceDirect – наукові статті та огляди на тему фармакології канабіноїдів: https://www.sciencedirect.com/
Платформа для доступу до наукових статей і рецензованих журналів, що охоплюють різні аспекти медицини і фармакології.