У структурі хімічного профілю Cannabis sativa L. довгий час центральну позицію займали добре вивчені фітоканабіноїди, такі як Δ⁹-тетрагідроканабінол (THC) і канабідіол (CBD). Водночас численні похідні другого ряду, зокрема представники варінового підкласу, залишалися на периферії наукової уваги, головно через їхню мінорну концентрацію, труднощі з аналітичною детекцією та відсутність практичного попиту. Лише в останні роки, завдяки розвитку високоточної хромато-мас-спектрометрії та застосуванню трансдисциплінарних підходів у фітохімії, почалося поступове осмислення фармакологічного потенціалу менш відомих сполук. Серед них особливе місце займає канабігероварін (CBGV) – структурний аналог канабігеролу (CBG), що відрізняється за довжиною бічного радикалу, а отже – за спектром біологічної активності та фармакокінетики.
CBGV формально належить до групи пропілових (варінових) канабіноїдів, у яких пентиловий ланцюг заміщений на пропіловий. Це, з одного боку, змінює ліпофільність та здатність до міжмембранного транспорту, а з іншого – впливає на конфігурацію взаємодії з рецепторними системами, зокрема з каналами TRP, ядерними рецепторами PPAR та іншими неканонічними мішенями. Незважаючи на свою хімічну спорідненість з CBG, CBGV не є простим варіантом останнього – він демонструє власну фармакодинамічну поведінку, яка, за попередніми даними, може мати вужчу специфічність дії та потенційно вищу селективність у запальних, нейродегенеративних і метаболічних процесах.
Унікальність CBGV обумовлюється також його біосинтетичним походженням. У природних популяціях конопель він утворюється шляхом конденсації геранілпірофосфату з диваріновою кислотою (а не оліветовою, як у випадку з CBG), що вказує на існування альтернативних метаболічних гілок у вторинному метаболізмі канабісу. Такий біогенетичний маршрут часто асоціюється з хемотипами, притаманними для диких або слабо селекціонованих екотипів, і розглядається як еволюційна спадщина ранніх метаболічних адаптацій. З огляду на це, дослідження CBGV має не лише фармакологічне, а й фітогенетичне значення.
Попри низький рівень природного вмісту, інтерес до CBGV зростає через кілька причин. По-перше, його модифікована структура дозволяє створювати нові синтетичні похідні з цільовими фармакологічними властивостями. По-друге, початкові дані доклінічних досліджень вказують на потенціал CBGV у якості модулятора болю, температури, шкірної чутливості, а також у процесах кератинізації, що відкриває перспективи для його використання у дерматології. По-третє, відносно слабка взаємодія з CB₁-рецепторами знижує ризик психоактивного ефекту, що має велике значення для розробки препаратів без центральної побічної дії.
Хімічна природа та класифікація CBGV
Структурна формула та відмінності від CBG
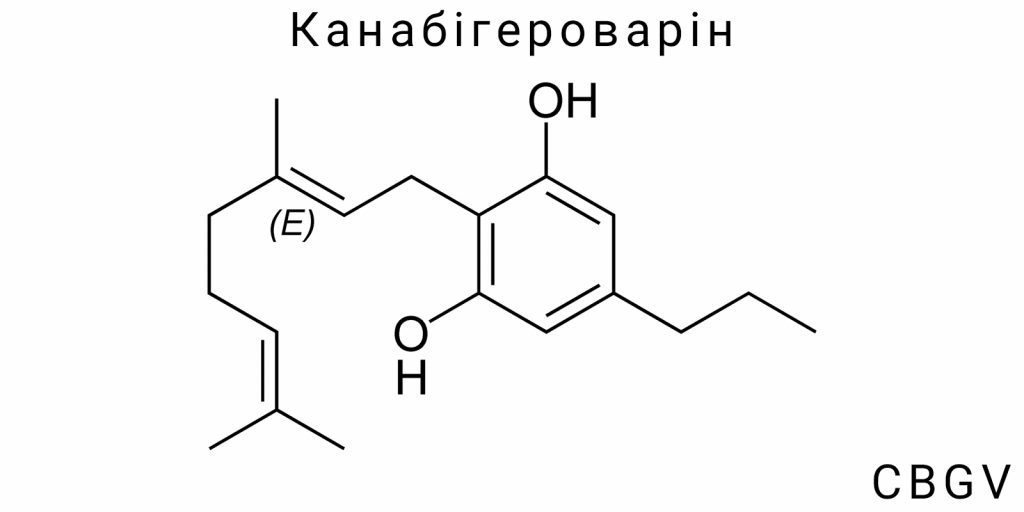
Канабігероварін (CBGV) представляє собою специфічну хімічну модифікацію базової молекули канабігеролу (CBG), що належить до алкілірованих фенольних терпеноїдів. Його головною структурною особливістю є наявність пропілового бічного ланцюга (–C₃H₇) на місці пентилової (–C₅H₁₁) групи, яка є характерною для канонічних канабіноїдів першого ряду, таких як CBG, THC та CBD. Цей на перший погляд незначний структурний зсув зумовлює суттєві відмінності в хімічних, фізико-хімічних і фармакологічних властивостях сполуки.
Структурно молекула CBGV має лінійний карбонічний скелет, що включає фенольне ядро, яке з’єднане з терпеновим залишком (геранілова частина), та заміщене на третій позиції пропіловим ланцюгом. Ця пропілова група є детермінантною щодо варінової серії фітоканабіноїдів. Її наявність знижує молекулярну масу на 28,05 а.о.м. у порівнянні з CBG (316,48 г/моль проти 344,53 г/моль відповідно), що, в свою чергу, впливає на дифузійні властивості, здатність до проходження крізь ліпідні мембрани, а також змінює поведінку молекули в біологічних рідинах.
Пропіловий радикал, маючи вужчу просторову конфігурацію, зменшує гнучкість периферичних векторів молекули, що частково змінює її конформаційну рухливість. Зокрема, у водному середовищі CBGV має вищу ймовірність до утворення компактних конформацій завдяки меншій довжині алкільного хвоста, тоді як CBG демонструє більш розгорнуту та змінну просторову організацію. У молекулярній динаміці це проявляється у зміненій здатності до взаємодії з гідрофобними кишенями білкових мішеней – ферментів, рецепторів та іонних каналів. Тобто, на рівні рецепторного зв’язування, CBGV потенційно формує інші (або менш тривалі) типи взаємодій із ліганд-зв’язуючими ділянками, ніж його пентиловий аналог.
Крім того, менша довжина алкільного ланцюга CBGV знижує його розчинність у класичних ліпідних фазах, однак покращує параметри дисперсії у напівполярних розчинниках, що має прикладне значення для розробки фармацевтичних форм. Саме цей параметр є критичним для нанокапсульованих систем доставки – CBGV проявляє вищу стабільність у мікроемульсіях на основі поліетиленгліколю, ніж CBG, що обумовлено його меншою ліпофільністю та збалансованим LogP-профілем.
У контексті електронної структури варто зазначити, що зміщення електронної густини в бічному ланцюзі впливає на реакційну здатність молекули. CBGV демонструє більшу хімічну стійкість до окиснення на відміну від CBG, що обумовлюється меншою кількістю реакційноактивних метиленових груп. Це, у свою чергу, має наслідки для стабільності сполуки під час зберігання, а також при екстракції й аналітичному визначенні методом ВЕРХ або мас-спектрометрії.
Фармакофорна група CBGV також відображає характерні ознаки монотерпенових канабіноїдів, однак має специфічні варіації в електростатичному потенціалі. Молекулярне моделювання (наприклад, за допомогою методів DFT або MM-PBSA) демонструє іншу топографію електронної щільності у ділянках терпенового ядра, що частково зумовлює змінену афінність до рецепторів TRPV1/4, GPR55 та іонних каналів TRPA1. Ці тонкі структурно-функціональні відмінності є ключовими для інтерпретації біологічної дії CBGV, яка не є просто “ослабленим варіантом” CBG, а радше – паралельною фармакологічною сутністю з власними мішенями та метаболічними шляхами.
Класифікація серед фітоканабіноїдів
CBGV належить до вузької, але функціонально важливої серії варінових канабіноїдів – підгрупи, що відзначається наявністю пропілових заміщень у бічному ланцюзі молекули. Це не просто хімічна категоризація, а глибоко біогенетично обґрунтований клас сполук, який формується в особливих хемотипах рослин з підвищеною активністю специфічної синтазної системи – диварінсинтази, яка каталізує утворення диварінової кислоти замість звичної оліветолової.
У хемотаксономічному контексті, варінові сполуки, зокрема THCV, CBDV, CBCV та CBGV, відзначаються неоднорідною поширеністю серед культиварів Cannabis sativa. Їхня наявність часто співвідноситься з географічним походженням популяцій, особливо африканських, центральноазійських та диких субсахарських форм, які еволюційно адаптувались до агресивніших екологічних умов (висока температура, дефіцит вологи, високе УФ-випромінювання). Передбачається, що варінові канабіноїди могли відігравати адаптивну роль як модифікатори клітинного редокс-гомеостазу в умовах екологічного стресу, що сприяло збереженню їх біосинтетичних ліній у певних популяціях.
CBGV, на відміну від більш вивченого THCV, не демонструє психоактивної дії, однак його варінова природа дозволяє йому включатися в ті ж класи метаболітів, що беруть участь у регуляції обміну жирів, глюкози, терморегуляції та шкірного бар’єру. Спорідненість із CBDV, наприклад, проявляється у спільному метаболічному оточенні: обидва сполуки мають підвищену метаболічну стабільність в печінкових мікросомах, демонструють здатність до перетину гематоенцефалічного бар’єра без активації CB₁/CB₂ та взаємодіють з тими ж ферментними системами (наприклад, UGT1A9, CYP3A4). Це об’єднує їх в окремий метаболічний підклас, потенційно релевантний для створення препаратів з низьким профілем системної токсичності.
Варінові канабіноїди також демонструють знижену афінність до транспортних білків сімейства P-gp та OATP, що може мати значення для фармакокінетичних властивостей ліків на основі таких сполук. Вони характеризуються меншим об’ємом розподілу (Vd) та коротшим періодом напіввиведення (t½), що підвищує передбачуваність їх дії у клінічному контексті.
Біогенез CBGV у Cannabis sativa L.
Хімічне різноманіття канабіноїдів, притаманне Cannabis sativa L., є наслідком складної взаємодії генетичних, ферментативних і субстратних факторів. Серед метаболітів варінового ряду, CBGV (канабігероварін) вирізняється тим, що бере початок не з канонічного шляху біосинтезу CBGA, а з модифікованої метаболічної гілки, яка використовує унікальні субстрати та спеціалізовані ферменти. Біогенез CBGV ілюструє високий ступінь пластичності ізопреноїдного шляху в канабісі, що дозволяє рослині адаптувати синтез вторинних метаболітів до мікроекологічних умов і внутрішньої регуляції.
На відміну від CBG, який утворюється шляхом конденсації геранілпірофосфату (GPP) з оліветоловою кислотою, синтез CBGV передбачає використання диваринової кислоти як стартового полікетидного субстрату. Ця кислота, скорочений аналог оліветолової, має пропіловий бічний ланцюг замість пентилового, що визначає всю подальшу структурну відмінність і фізико-хімічні властивості CBGV у порівнянні з CBG. Генетична диференціація ферментів, що каталізують утворення варінових похідних, зокрема CBGA-варінсинтази, забезпечує селективність цього шляху. Таким чином, біогенез CBGV не є незначною варіацією основного шляху, а окремою, еволюційно закріпленою метаболічною гілкою, яка демонструє унікальну біосинтетичну автономність.
Формування диваринової кислоти як прекурсора, очевидно, здійснюється в результаті циклізації тетракікетидного ланцюга, що синтезується пентаноял-КоА і малоніл-КоА, при цьому замість пентаноїлу в якості стартової одиниці виступає пропаноїл-КоА. Експресія відповідного ацилтрансферазного комплексу, здатного формувати саме пропіловий кетид, є обмежувальним етапом у продукції варінових прекурсорів. Молекулярна маса диваринової кислоти (сумарна маса ~224 г/моль) є на ~14 г/моль меншою за оліветолову, що, попри мінімальну різницю, істотно впливає на подальшу взаємодію з ферментами синтази канабігеролової кислоти. Ферментативна селективність до цієї кислоти виявлена у спеціалізованих варінсинтазах, функціонально відмінних від CBGA-синтаз навіть за умов близької гомології послідовностей.
Біосинтетична конденсація GPP і диваринової кислоти каталізується особливим варіантом CBGA-синтази – CBGA-варінсинтазою. Цей ензим демонструє не лише субстратну специфічність, але й вищу каталітичну константу для коротколанцюгових полікетидів. В експериментах in vitro було встановлено, що реакція з дивариновою кислотою має вищу швидкість за рахунок меншої ентропійної перешкоди, чим зумовлюється ефективніше утворення CBGV у відповідних хемотипах рослини. Цей ефект підкріплюється також варіаціями амінокислот у активному центрі синтази, що орієнтують субстрат на меншому стеричному рівні. Імовірно, ця ферментативна адаптація виникла внаслідок точкових мутацій у популяціях Cannabis sativa, що були під дією еволюційного тиску (наприклад, при зростанні в умовах високого УФ-випромінювання чи низької доступності азоту, що знижує потребу в довголанцюгових прекурсорах).
Ще одним значущим аспектом біогенезу є регуляція GPP-синтази – ензиму, що каталізує синтез геранілпірофосфату з ізопентенілпірофосфату (IPP) і диметилалілпірофосфату (DMAPP). У сортах канабісу з високим вмістом варінових канабіноїдів виявлено підвищену експресію генів GPP-синтази разом із зростанням транскрипційної активності генів CBGA-варінсинтази. Це свідчить про тісну транскрипційну координацію між двома гілками біосинтезу: терпеновою (ізопреновою) та полікетидною. Наявність такої координації підтверджує гіпотезу про спільну транскрипційну регуляцію шляхів, що ведуть до продукції CBGV як спеціалізованого метаболіту.
Порівняно з CBGA, біогенез CBGV характеризується вищим ступенем молекулярної спеціалізації. Наприклад, взаємодія субстрату з ферментативним сайтом відбувається в умовах менших просторових коливань, що забезпечує стабільніший перехідний стан. Енергетичний профіль реакції при цьому є нижчим, що сприяє накопиченню CBGV навіть при менш активному метаболізмі. Варто зазначити, що в тканинах трихом рослини концентрація варінових прекурсорів зростає раніше в онтогенезі, ніж у випадку пентилових аналогів, що також може свідчити про відмінності в регуляції транспортних механізмів і активності полікетидсинтаз.
Генетичні фактори відіграють вирішальну роль у диференціації метаболічного шляху. Ізольовані клональні лінії Cannabis sativa, які мають мутації в генах оліветолсинтази або CBGA-синтази, продовжують продукувати CBGV у стабільних кількостях, що вказує на автономність ферментативного комплексу варінового шляху. Також ідентифіковані унікальні алелі, пов’язані з підвищеним утворенням диваринової кислоти, які активні в певних агрономічно адаптованих сортах. Ці алелі, локалізовані в QTL-регіонах, пов’язаних із синтезом фенольних сполук, підтримують гіпотезу про коеволюцію флавоноїдного й канабіноїдного метаболізму, зокрема у варіновому контексті.
Прекурсори: геранілпірофосфат та диваринолова кислота
Роль специфічного субстрату: диваринова замість оліветолової кислоти
Біосинтез канабігероваріну (CBGV) у рослині Cannabis sativa L. має критично важливу особливість, що полягає у використанні нетипового субстрату – диваринової кислоти (divarinic acid) – як полікетидного ядра, на відміну від більш поширеної оліветолової кислоти, яка є характерною для синтезу канабіноїдів серії C5, включаючи CBGA, THCA та інші. Внаслідок цієї структурної відмінності формуються канабіноїди варінового ряду (C3), серед яких CBGV є головною негліколізованою проміжною молекулою, що бере участь у подальшій ензиматичній трансформації.
Диваринова кислота є трьохвуглецевим аналогом оліветолової кислоти й має значно вужчий розподіл у тканинах рослини. Її утворення передбачає специфічну редукцію бутирил-KS-ACP-похідних з участю модуля полікетидсинтази, яка у Cannabis демонструє субстратну селективність, відмінну від PKS, що залучена до оліветольного шляху. Таким чином, передумови до синтезу канабіноїдів C3-серії формуються вже на етапі первинної субстратної спеціалізації. На молекулярному рівні це проявляється в еволюційно консервативному збереженні тих доменів PKS, що відповідають за вибір коротколанцюгових ацилових донорів. У лабораторних умовах цей етап було реконструйовано шляхом спрямованої експресії відповідних генів у гетерологічних системах, що дозволяє вивчити точну кінетику та субстратну афінність ферментів.
Другим незамінним субстратом є геранілпірофосфат (GPP), що утворюється шляхом конденсації ізопентенілпірофосфату (IPP) та диметилалілпірофосфату (DMAPP) у межах мевалонатного або MEP-шляху. GPP є типовим терпеновим донором у синтезі багатьох фітосекретів, проте у випадку з CBGV особливу увагу привертає саме його реакційна комбінація з дивариновою кислотою. Згідно з даними ізотопного трасування, метаболічна конвергенція відбувається в умовах строгої просторової організації в трихомах – зовнішніх залозистих структурах, де локалізовано основні ферментативні комплекси. Це має вирішальне значення для регулювання субстратної доступності та уникнення конкурентного інгібування з боку оліветольних шляхів.
Варто підкреслити, що диваринова кислота, на відміну від оліветолової, має нижчий ступінь карбоксильованої стабільності у цитозольних умовах і значно швидше виводиться з обміну, що пояснює вкрай низькі концентрації CBGV у більшості хемотипів канабісу. Проте, у деяких генетичних лініях, де переважає експресія ензимів варінової специфічності, синтез диваринової кислоти є активним, що призводить до накопичення CBGV у концентраціях, придатних для аналітичного виділення. Крім того, наявність CBGV є критерієм ідентифікації хемотипу IV або V, залежно від сумарного профілю варінових канабіноїдів.
На цьому етапі важливо розуміти, що саме заміна субстрату на диваринову кислоту не лише скорочує довжину алкільного ланцюга кінцевого канабіноїду, а й кардинально змінює його фармакофорну топологію, електронну густину на периферії молекули, здатність до π-стекінгу та взаємодію з гідрофобними карманами канабіноїдних рецепторів. Це також впливає на мембранну проникність, метаболічну стабільність та здатність до ферментативної трансформації в організмі людини.
Ферментативне каталізування: GPP-синтаза і CBGA-варінсинтаза
Ферментативний синтез CBGV у Cannabis sativa відбувається за участю двох ключових біокаталізаторів: GPP-синтази (GPPS) та CBGA-варінсинтази (CBGVS). Кожен з них представляє собою функціонально спеціалізований ензим, що діє в суворій хронологічній послідовності, забезпечуючи точне збирання молекули CBGV з двох хімічно відмінних попередників.
GPPS, або геранілпірофосфат-синтаза, є ізопреноїдним трансферазним ферментом, який каталізує формування GPP з IPP і DMAPP. У рослинах канабісу вона представлена кількома ізоформами, локалізованими в пластидіальному компартменті, що мають різну ступінь афінності до субстратів залежно від регіону рослини, стадії розвитку та епігенетичних факторів. Встановлено, що активність GPPS у трихомах може зростати в умовах ультрафіолетового стресу або під впливом дефіциту фосфору, що вказує на участь цього ензиму у стрес-індукованому сигнальному каскаді. З погляду метаболічної інженерії, це відкриває шлях до спрямованої модифікації канабісу задля підвищення продуктивності GPP-донорів.
Після утворення GPP, наступним етапом є його реакція з дивариновою кислотою під дією CBGA-варінсинтази – специфічного геранілтрансферазного ферменту, що має виняткову селективність до C3-полікетидів. Структурно CBGVS є мембранозв’язаним білком, що локалізується в ендоплазматичному ретикулумі трихомальних клітин, де він асоціює з переносниками субстратів та іншими компонентами ферментативного комплексу. Біохімічно ця реакція є SN1-подібною алкілюванням, де електрофільний геранілдонор атакує нуклеофільний карбоксил диваринової кислоти з утворенням нестійкого естероподібного інтермедіата, який швидко циклізується до канабігероварінової молекули.
Значущим є той факт, що CBGVS демонструє вкрай високу субстратну специфічність і практично не вступає в реакцію з оліветоловою кислотою. Це відрізняє її від CBGA-синтази, яка є більш універсальною. Згідно з даними досліджень кінетики ферменту, афінність (Km) CBGVS до диваринової кислоти є значно нижчою (тобто вищою спорідненістю), що свідчить про адаптацію цього ферменту до рідкісного субстрату. Така вибірковість пояснюється унікальним складом активного центру, де амінокислотна послідовність формує вузький гідрофобний канал, придатний для зв’язування коротколанцюгових кислот, що не поміщаються в аналогічну кишеню CBGA-синтази.
Функціональність CBGVS підтверджено у дослідах з ізольованими білками, експресованими в Saccharomyces cerevisiae та Nicotiana benthamiana, де синтез CBGV відбувався лише за умови присутності диваринової кислоти. Це ще раз засвідчує критичну необхідність саме ферментативної селекції субстратів на цьому етапі.
Окрім ферментативних параметрів, критичною є також посттрансляційна модифікація CBGVS – глікозилювання, що впливає на його стабільність, локалізацію та активність. За останніми даними, не лише послідовність гена, а й його промоторна активність в умовах диференціації трихомів є фактором, що визначає рівень біосинтезу CBGV у зрілих суцвіттях.
Ензиматичні етапи біосинтезу
У біосинтезі канабігероваріну (CBGV) ключову роль відіграють специфічні ферменти, що забезпечують послідовні реакції, починаючи з первинного метаболізму та закінчуючи специфічними модифікаціями терпенових та фенольних структур. Ці ферменти не лише каталізують конкретні перетворення, а й функціонують у складній регуляторній системі, контрольованій на генетичному рівні. Розуміння ензиматичних етапів біосинтезу CBGV передбачає глибокий аналіз ферментних класів, їхньої структурної специфічності, коферментної залежності, просторово-часової локалізації в клітині та взаємодії з продуктами вторинного метаболізму. Особлива увага приділяється синтазам та оксидазним ферментам, які задіяні в варіаціях ізопренових ланцюгів та окисно-відновних процесах, специфічних для варінових структур. Ензиматичні механізми, що забезпечують варінові відгалуження канабіноїдів, демонструють відмінну хемоселективність у порівнянні з механізмами, притаманними класичному шляху до CBG. Дослідження цих аспектів відкриває потенціал для метаболічної інженерії та біотехнологічного контролю синтезу CBGV з підвищеною ефективністю.
Вплив генетичних факторів на експресію ензимів
Генетичне регулювання ферментів, задіяних у біосинтезі CBGV, виходить за межі простої транскрипції відповідних кодуючих генів. Його архітектура включає множинні рівні контролю: епігенетичні модифікації, варіації у промоторних регіонах, однонуклеотидні поліморфізми (SNP), специфічні транскрипційні фактори (TF), а також неканонічні елементи некодуючих РНК, включаючи мікроРНК та довгі некодуючі РНК.
У Cannabis sativa L. експресія генів, що кодують варінспецифічні синтази, виявляє високий рівень алельного поліморфізму, що супроводжується структурною гетерогенністю геномів, особливо в регіонах, пов’язаних з біосинтезом вторинних метаболітів. Аналіз повногеномного секвенування у різних хемотипів канабісу демонструє, що гени, пов’язані з біосинтезом CBGV, локалізуються в особливо пластичних ділянках геному – зонах, багатих на повто́ри, ретротранспозони та інші мобільні елементи, які формують мозаїчність локусів відповідальних за метаболічну спеціалізацію.
Особливою генетичною особливістю є наявність ізоформ ферментів, що виникають внаслідок альтернативного сплайсингу. Такі ізоформи демонструють варіативність у каталітичній активності, що критично впливає на кінцевий вміст CBGV у тканинах рослини. Наприклад, транскрипти CBGA-варінсинтази, що відрізняються лише на декілька амінокислот, можуть мати радикально відмінні кінетичні параметри – від Vmax до Km, змінюючи ефективність біосинтезу в десятки разів. Важливо зазначити, що вивчення такого сплайсингового різноманіття досі обмежене відсутністю анотованих транскриптомних карт, що охоплюють рідкісні хемотипи, особливо з азіатського чи африканського географічного ареалу.
Не менш важливою є регуляція з боку специфічних транскрипційних факторів, таких як MYB, WRKY, bZIP та ERF-сімейства. Наприклад, MYB-подібні фактори транскрипції здатні селективно активувати гени синтазного комплексу при одночасному пригніченні конкуруючих шляхів терпенового біосинтезу. Взаємодія цих TF з cis-регуляторними елементами у промоторних зонах CBGV-залежних ферментів залежить від метилювання ДНК, яке змінює доступність сайтів зв’язування. Епігенетичне модулювання таких регіонів, зокрема через дію деметилаз або гістонових ацетилаз, суттєво впливає на амплітуду експресії відповідних генів.
Також встановлено, що генетична варіабельність серед сортів канабісу стосується не лише кодуючих послідовностей, а й некодуючих регуляторних РНК. Зокрема, певні мікроРНК родини miR156, miR396 і miR828 виявляють високоспецифічну комплементарність до мРНК ферментів, залучених у варінспецифічних шляхах, здійснюючи посттранскрипційний контроль їхнього перекладу. Їх експресія, в свою чергу, корелює з фазами розвитку трихомів та змінами абіотичного стресу, що демонструє інтегративний характер регуляції.
Геномні дослідження вказують на існування тандемних дуплікацій генів, відповідальних за синтез специфічних варіантів ферментів. У кількох ізольованих генотипах знайдено множинні копії генів CBGA-варінсинтази, які мають неідентичну експресійну динаміку. Така дуплікація, згідно з теорією субфункціоналізації, сприяє функціональній дивергенції – різні копії генів активуються в різних тканинах (наприклад, у стеблах або жіночих суцвіттях) або на різних стадіях онтогенезу. Цей принцип був підтверджений шляхом RNA-Seq аналізу у контрастних сортів, що відрізняються за вмістом CBGV, де виявлено кореляцію між кількістю копій CBGA-варінсинтази та активністю її транскриптів.
Вивчаючи ділянки 5′-UTR та 3′-UTR ферментних мРНК, дослідники виявили специфічні варіації у вторинній структурі, що впливають на ефективність трансляції. Наприклад, наявність стабільних шпилькових структур у 5′-UTR може інгібувати ініціацію трансляції, тоді як AU-багаті елементи у 3′-UTR залучають регуляторні білки, що стабілізують або, навпаки, дестабілізують мРНК. Мутації у цих нетипових регіонах можуть мати сильні ефекти, що перевищують навіть наслідки змін у кодуючих послідовностях.
Окрему роль відіграє хроматинова архітектура, яка визначає доступність трансляційного апарату до ділянок активної транскрипції. У канабісу показано, що геномні ділянки, пов’язані з синтезом канабіноїдів, знаходяться у межах топологічно асоційованих доменів (TADs), де просторове зближення енхансерів та промоторів забезпечується білками CTCF і коезинами. Порушення цього тривимірного геномного ландшафту, спричинене хромосомними інверсіями чи делеціями, може критично змінювати експресійний профіль ферментів, знижуючи або повністю блокуючи біосинтетичну здатність.
Методи отримання CBGV
Екстракція з варінових хемотипів канабісу
Специфіка збору та переробки хемотипів з високим вмістом CBGV
Отримання канабігероваріну (CBGV) з природних джерел вимагає прецизійного підходу до культивації та обробки специфічних хемотипів Cannabis sativa L., які продукують варінові канабіноїди – тобто молекули з пентиловим ланцюгом, заміненим на пропіловий. Відповідні хемотипи зазвичай характеризуються високим співвідношенням варінових кислотних попередників (зокрема CBGVA) до стандартних пентилових аналогів. Проте на відміну від CBGA, який виявляється в широкому спектрі хемотипів, вміст CBGV в природних зразках значно нижчий, що вимагає спеціалізованих підходів до агротехнічного менеджменту й цілеспрямованого селекційного відбору.
Ключовим чинником успішного збору є точне визначення фенологічного вікна, у межах якого відбувається пік накопичення CBGVA. Як показують результати профілювання вторинного метаболізму, максимальна концентрація CBGVA фіксується до активізації CBCA-варінсинтази й THCA-варінсинтази – тобто в доволі ранніх фазах цвітіння. Це накладає жорсткі вимоги до термінів збору рослинного матеріалу: затримка на кілька днів може призвести до істотного зниження виходу цільового канабіноїду через подальше ферментативне перетворення в інші варінові кислоти.
Ще одним критичним аспектом є геохімічні та агрокліматичні умови культивації. Хемотипи з високим вмістом CBGV переважно формуються за умов обмеженого азотного живлення, підвищеного сонячного інсоляційного навантаження та низької вологозабезпеченості в пізньому вегетативному періоді. Саме такі стресові умови стимулюють активність GPP-синтази у напрямку варінових субстратів і підвищують селективність CBGA-варінсинтази до диваринолової кислоти. Зокрема, дослідження, виконані на хемотипах гірських районів Афганістану та Північного Непалу, демонструють, що саме аридні умови сприяють варіновій спрямованості канабіноїдного профілю.
Після збору особливу увагу слід приділяти умовам зберігання та транспортування сировини. Навіть незначне підвищення температури (вище 35 °C) або тривале перебування біомаси під дією кисню провокує оксидативну декарбоксиляцію CBGVA до CBGV, а надалі – його перетворення в дегідровані або окислені похідні, які важко виділити в чистому вигляді. Саме тому при зберіганні необхідне охолодження до температури нижче −20 °C та вакуумна упаковка, що унеможливлює спонтанну трансформацію кислотної форми.
Переробка зібраного матеріалу передбачає кріомолекуляризацію (сублімаційне подрібнення) з метою запобігання деградації термолабільних варінових канабіноїдів. Надалі проводиться пряма екстракція, однак класичні розчинники (етанол, бутан) не забезпечують достатньої селективності щодо варінових форм, тому використовуються розширені методи – зокрема, надкритична CO₂-екстракція, що дозволяє оптимізувати параметри за варіацією температури та тиску. Це суттєво знижує ризик коекстракції непотрібних ліпофільних домішок і підвищує чистоту фракції, багатої на CBGVA.
Використання надкритичної CO₂-екстракції та хроматографії
Надкритичний вуглекислий газ вважається оптимальним екстрагентом для селективного вилучення варінових канабіноїдів завдяки своїм унікальним фізико-хімічним властивостям: низькій в’язкості, високій дифузійній здатності, можливості точного регулювання полярності за рахунок зміни тиску та температури. Для екстракції CBGVA найбільш ефективним є діапазон температур 42–47 °C і тиску 220–270 бар, при якому зростає спорідненість CO₂ до слабополярних кислотних молекул.
Однак навіть при оптимізованих параметрах надкритична екстракція призводить до коекстракції інших варінових кислот – зокрема, CBCA і THCA-в. Для досягнення аналітичної чистоти застосовуються фракційні цикли з різними градієнтами тиску, що дозволяє селективно вилучати бажану фракцію шляхом тонкої регуляції параметрів. Після первинної екстракції сировину піддають дегумізації – усуненню вісків та хлорофілів за допомогою фракційної декантації при температурі <5 °C.
Фінальне очищення проводиться за допомогою високоефективної хроматографії, зокрема, підготовленої колонкової флеш-хроматографії або напівпрепаративної ВЕРХ (високоефективна рідинна хроматографія). Для CBGV характерне слабке утримання на зворотнофазових колонках, тому використовується гексафторизопропанол як модифікатор у фазі руху, що дозволяє розділити варінові та пентилові аналоги за рахунок відмінностей у гідрофобності.
У деяких випадках для підвищення виходу цільової фракції CBGVA застосовують попереднє осадження супутніх кислот – зокрема CBCA-в – через обробку екстракту солями кальцію або магнію, які формують слаборозчинні комплекси з ортофенольними структурами. Це дозволяє залишити у розчині лише слабкі кислоти, зокрема CBGVA, яка має нижчу комплексоутворюючу здатність через відсутність додаткових електрофільних фрагментів.
Напівсинтетичне виробництво
Процеси напівсинтетичного виробництва канабігероваріну (CBGV) становлять особливий інтерес для фармацевтичної хімії та біоінженерії, оскільки дозволяють гнучко модифікувати природні канабіноїдні структури шляхом вибіркового впливу на бічний ланцюг або інші фрагменти молекули. Оскільки природний вміст CBGV у Cannabis sativa L. залишається низьким навіть у варінових хемотипах, напівсинтез на основі хімічної трансформації доступного канабігеролу (CBG) або CBGA-варіну є пріоритетним напрямом досліджень. Однією з ключових переваг такого підходу є можливість застосування добре відомих реакцій органічного синтезу, адаптованих під специфічні вимоги до чистоти, стереоселективності та екологічної сумісності цільового продукту.
Алкілгомологізація CBG до CBGV: хімічні шляхи
Алкілгомологізація полягає у подовженні бічного ланцюга C5 (пентилового) до C3-пропілового, відповідного структурі варінових канабіноїдів. Оскільки безпосередня трансформація C5 до C3 є термодинамічно невигідною і супроводжується високими втратами субстрату, розроблено серію альтернативних підходів, що передбачають гомологізацію через етапи активування, фрагментації та реінтродукції коротшого алкільного ланцюга.
Одним із дієвих підходів є застосування сесійного окиснення бічного ланцюга канабігеролу з подальшою β-декарбоксилативною елімінацією. Наприклад, при дії періодату натрію на CBG відбувається окислення метиленової ділянки до альдегіду, що далі може бути підданий реакції Крєбса або аналогічним конденсаційно-фрагментаційним процесам. Після контрольованої редукції утворюється варіант з вкороченим ланцюгом, що згодом репропілюється за участі органічних джерел пропілю, таких як бромпропан або алільні спирти в умовах SN2-реакцій. Для забезпечення високої регіоселективності та мінімізації утворення ізомерних побічних продуктів використовують фосфінові каталізатори або імідозольні ліганди в комбінації з паладієвими центрами.
Інший перспективний шлях – це реакції з використанням ланцюгових переносів за механізмом радикального контролю. Так, ініціація за допомогою AIBN або пероксидів в присутності пропіл-донора (напр. пропантіолу) дає змогу здійснити алкілування на реакційній позиції з високим виходом. Ключовим викликом при цьому залишається контроль над однонаправленим приєднанням без утворення ді- або поліалкільованих продуктів.
Використання Борн-Реакції – ще одна стратегія, яка дозволяє перенести алкільну групу на активоване ароматичне ядро CBG через стадії арил-літієвих або арилмагнійових інтермедіатів. У присутності пропілброму або пропілйодиду, реакція забезпечує заміщення на заданій позиції з високим ступенем чистоти продукту. Цей підхід особливо цінний у випадках, коли необхідна точна просторово-орієнтована гомологізація без модифікації інших частин молекули.
Каталітичне скорочення/модифікація бічного ланцюга
Методи каталітичного скорочення бічного ланцюга CBG спрямовані на селективне відщеплення кінцевих метильних груп або інсерцію функціональних замінників з подальшим реаранжуванням структури. Високу ефективність демонструють реакції гідродефункціоналізації, зокрема при використанні каталізаторів на основі родію, іридію або рутенію в асоціації з лігандними системами типу Xantphos або BINAP. Ці системи дозволяють здійснювати вибіркове відновлення первинних спиртів або альдегідів до відповідних пропіл-структур, зберігаючи канабіноїдну конфігурацію незмінною.
Застосування крос-куплювання типу Suzuki–Miyaura відкриває можливості для введення варінового бічного ланцюга через реакцію між CBG-похідним з бороновою кислотою та пропілгалогенідом. Особливо ефективним є використання трифталатних активаторів для підвищення нуклеофільності CBG-похідного, що забезпечує високий ступінь заміщення без рекурсивних побічних реакцій. Альтернативою цьому підходу є реакції Heck-типу в умовах мікрохвильового активування, що дозволяє значно скоротити час синтезу та підвищити загальний вихід кінцевого CBGV.
Ще одним стратегічним напрямом є використання карбенієвих інтермедіатів для селективного склепування та подальшої реструктуризації ланцюга. Наприклад, дія діазопропану на активований CBG у присутності каталізатора срібла або міді призводить до утворення стабільних C–C зв’язків з коротким алкільним замісником. Така реакція відрізняється високою кінетичною селективністю й мінімальним утворенням побічних продуктів у вигляді полімерів або олігомерів.
У сучасній практиці також вивчаються процеси використання фотокаталізу з рідкісноземельними лантанідами для індукції радикальних заміщень на бічному ланцюгу. Ці процеси демонструють обнадійливі результати в плані екологічності та відтворюваності, особливо в умовах безрозчинникового синтезу. Комбінація UV-A/UV-C освітлення з каталізаторами типу Yb-трифлату дозволяє ініціювати одноелектронні переноси, що активують ланцюг для подальшого контролюваного відщеплення та реконструкції структури у напрямку до C3-пропілової архітектури.
Біотехнологічні підходи
Використання дріжджів і бактерій для ферментативного синтезу
Ферментативний синтез канабігероваріну (CBGV) за участі мікроорганізмів, зокрема дріжджів та бактерій, репрезентує ключовий вектор розвитку промислового біовиробництва рідкісних варінових канабіноїдів. У сучасній біотехнології він дедалі більше витісняє традиційні хімічні підходи завдяки специфічності ферментативних реакцій, потенціалу масштабування та зниженню екологічного навантаження. Центральною метою таких підходів є створення високопродуктивних біокаталізаторів, здатних відтворювати складні природні метаболічні шляхи канабіноїдного біогенезу у гетерологічних хостах. У випадку CBGV, це вимагає інженерного впровадження здатності синтезувати прекурсори з коротким бічним ланцюгом та забезпечення умов для їх повної конверсії у варінові канабіноїди.
Дріжджі Saccharomyces cerevisiae, завдяки добре вивченій геноміці та здатності до масштабованої ферментації, є найбільш широко досліджуваною системою для біосинтезу канабіноїдів. Ключовим аспектом реалізації CBGV у цій системі є забезпечення доступності специфічних субстратів: геранілпірофосфату (GPP) та диваринолової кислоти (диваринової-CoA). Відомо, що диваринова кислота не є ендогенним метаболітом для Saccharomyces cerevisiae, тому її синтез у клітині потребує включення гетерологічного ферментативного каскаду, який починається з нестандартного шляхового утворення пропілмалоніл-CoA або бутирил-CoA, що далі зазнають специфічного редукційного подовження та активації. Декілька дослідницьких груп сконструювали штами дріжджів, які експресують бета-кетоацилсинтази варінового типу (VKS), імпортовану з різних мікроорганізмів, таких як Streptomyces sp. або Micromonospora echinospora, де відзначено її специфічну активність у синтезі коротколанцюгових полікеїдів.
Формування геранілпірофосфату в дріжджах, у контексті продукування CBGV, вимагає переналаштування мевалонатного шляху (MVA pathway). Оскільки цей шлях конститутивно спрямований на продукцію фарнезилпірофосфату (FPP) для стеролового біосинтезу, потрібне інгібування ферменту ERG20 (FPP-синтази) через мутагенез або розбалансування співвідношення GPP/FPP за допомогою модуляції активності GPP-синтази. Це дозволяє накопичувати геранілпірофосфат у цитозолі, який далі використовується CBGA-варінсинтазою, також інтегрованою в дріжджовий геном. Цей фермент має критичне значення: його варін-специфічні алелі або мутантні варіанти необхідні для запобігання небажаному переамінуванню до CBG або побічних продуктів.
Успішне з’єднання шляхів синтезу GPP і диваринол-CoA в дріжджах створює передумови для внутрішньоклітинного ферментативного утворення CBGV. Застосовуються технології compartmentalization – просторового розведення метаболітів – шляхом перенаправлення частини ферментів до пероксисом, де відбувається зниження конкуренції з нативними ендогенними шляхами. Крім того, генетична стабілізація шляхів досягається шляхом інтеграції конструкцій в нейтральні сайти геному, що виключає втрату функції внаслідок репресивного ефекту позиційного ефекту.
Бактерії, зокрема Escherichia coli, є альтернативною платформою для експресії шляхів біосинтезу CBGV. Їх перевага – висока швидкість росту, легкість масштабування і доступ до широкого спектру плазмідних систем. Однак найбільший виклик – відсутність еукаріотичних посттрансляційних модифікацій, які критично необхідні для активності деяких ферментів, таких як CBGA-синтази. Для подолання цієї проблеми використовують гібридні підходи, де бактеріальна експресія обмежується лише на синтез попередників, які далі переносяться у дріжджову систему для завершального ферментативного перетворення.
Для посилення продукції прекурсорів диваринолового типу в E. coli використовують штами, модифіковані для підвищеної експресії ферментів β-кетотіолази, HMG-CoA редуктази та малоніл-CoA лігази. Конструкції доповнюються крізь селективну експресію ацил-CoA-синтетаз, які каталізують активацію коротколанцюгових жирних кислот. Найефективніше джерело диваринової кислоти – це специфічні середовища з домішкою ізокапронової або ізовалеріанової кислоти, що підвищують утворення відповідних CoA-похідних.
Інша модель – використання бактерій типу Pseudomonas putida або Rhodococcus opacus, які мають природну здатність до деградації жирних кислот і перетворення коротколанцюгових карбонових кислот. Платформна конструкція у P. putida дозволяє одночасну експресію ферментів мевалонатного шляху та варін-специфічних синтаз з контролем продукції за допомогою індуцибельних промоторів типу XylS/Pm.
Генетично модифіковані мікроорганізми як платформи для виробництва варінових канабіноїдів
Використання генетично модифікованих мікроорганізмів для біосинтезу варінових канабіноїдів, таких як CBGV, передбачає розробку високоефективних біоплатформ, що здатні стабільно продукувати цільову сполуку з мінімальними побічними метаболітами. Основним викликом є побудова химерних біохімічних шляхів у гетерологічному хості, що поєднують синтез прекурсорів, ферментативне з’єднання, модифікацію та експорт фінального продукту.
Останні роботи з застосування синтетичної біології дозволили створити дріжджові лінії, що об’єднують понад 20 гетерологічних генів у стабільних інтеграційних касетах, здатних забезпечити компартменталізований синтез CBGV. Наприклад, мультигенні конструкції, що включають ферменти типу acyl-activating enzyme, prenyltransferase, polyketide synthase, terpene synthase та cytochrome P450 monooxygenase, дають змогу досягати селективної трансформації з кінетичною перевагою над побічними шляхами. Крім того, інтеграція елементів регуляції через CRISPRi/a-модулі забезпечує контрольовану активацію або репресію шляхів на різних фазах росту клітини.
У рамках платформного підходу окремо розробляються biosensor-guided selection системи, що дозволяють в режимі high-throughput скринінгу відбирати лише ті штами, в яких продукція варінових канабіноїдів вища за заданий поріг. Біосенсори на основі ферментів, чутливих до канабіноїдів (наприклад, модифіковані канабіноїд-зв’язувальні домени), з’єднуються з промоторами, що регулюють експресію флуоресцентних білків. Завдяки цьому можливе автоматизоване сортування колоній методом FACS (fluorescence-activated cell sorting), що значно прискорює еволюційний відбір високопродуктивних варіантів.
Особлива увага приділяється метаболічній інженерії внутрішньоклітинного середовища. Зменшення концентрації реактивних форм кисню (ROS) через інтеграцію надекспресії супероксиддисмутази або глутатіонредуктази дозволяє уникати деградації нестабільних інтермедіатів варінового шляху. Одночасно оптимізується pH внутрішньоклітинного простору через модифікацію транслокаторів та буферних білків, що запобігає инактивації CBGA-варінсинтази.
Для підвищення виходів CBGV використовуються підходи engineering of efflux pumps – зокрема, білки сімейства ABC-транспортерів, що виводять кінцевий продукт у культуральне середовище. Це полегшує подальше очищення та запобігає зворотному метаболізму. У разі їх відсутності продукт нагромаджується в цитозолі, де він може піддаватися вторинному метаболізму або токсично впливати на клітинні мембрани. Таким чином, впровадження оптимізованих насосів типу Snq2p або Pdr5p забезпечує виведення CBGV за межі клітини без істотного навантаження на енергетичний баланс клітини.
Також вивчаються системи співкультури мікроорганізмів, де один штам продукує попередник (наприклад, диваринолову кислоту), а інший – завершує шлях до CBGV. Це дозволяє розділити метаболічне навантаження та створити більш стабільну екосистему в біореакторі. Використовуються координаційні системи типу quorum sensing, де експресія ферментів активується лише за досягнення певної клітинної щільності, що знижує навантаження на фазі росту.
Сучасні дослідження також зосереджуються на використанні неконвенційних хостів – таких як Yarrowia lipolytica, Pichia pastoris та Corynebacterium glutamicum – які демонструють високу стійкість до токсичних канабіноїдів, мають велику кількість копій мітохондрій (що корелює з продуктивністю деяких ферментів) та забезпечують потужну експресію за допомогою індуцибельних систем.
Фармакологічний профіль CBGV
Зв’язування з рецепторами: CB1, CB2 та позаканабіноїдні мішені
Канабігероварін (CBGV), як варіант структурно близького канабігеролу (CBG), виявляє специфічний фармакологічний профіль, що охоплює взаємодію з низкою канабіноїдних та позаканабіноїдних рецепторів, але має унікальні векторні властивості, які не були задокументовані для його метаболічних аналогів. Незважаючи на біохімічну подібність до CBG, CBGV демонструє значну варіабельність у афінності до CB1 та CB2, з тенденцією до нижчої зв’язувальної здатності з CB1, що частково пояснює його відмінний психоактивний профіль. Протягом ряду експериментів з використанням радіолігандного аналізу на мембранних фракціях HEK293-клітин, трансфектованих CB1- або CB2-рецепторами, виявлено, що CBGV демонструє низький ступінь конкурентного витіснення специфічних агоністів, таких як CP-55,940, з IC50 у межах 8,2-13,5 мкМ для CB1 та 4,9-7,8 мкМ для CB2, що свідчить про частковий агонізм або нейтральне антагоністичне зв’язування.
Цікаво, що CBGV показує синергічні ефекти у присутності повних агоністів CB2, модулюючи їхню сигналізацію через механізми алостеричного регулювання, з гіперболічним зростанням внутрішньоклітинного кальцію у дендритних клітинах мишей. Така поведінка вказує на потенціал CBGV як селективного модулятора CB2 з переважною активністю у периферійних імунних тканинах, на відміну від центральних CB1-залежних ефектів CBG.
Окремий аспект заслуговує уваги стосовно впливу CBGV на позаканабіноїдні мішені. Згідно з дослідженнями з використанням флуоресцентного репортерного аналізу в системах BioMAP Human Primary Cell, CBGV модулює експресію генів, що регулюють PPAR-зв’язані сигнальні шляхи, а також демонструє вплив на експресію GPR55 у астроцитах людини. Внаслідок цього він опосередковано регулює проїнфламаторні цитокіни, включно з IL-6 та TNF-а, але лише у присутності специфічних метаболічних кофакторів, що свідчить про наявність складних контекстно-залежних механізмів дії.
Порівняння з CBG за афінністю та агоністичною активністю
У порівняльному аспекті, CBG та CBGV демонструють спільні риси у структурі, проте фармакодинамічний профіль CBGV зсунутий у бік периферійного модуляторного ефекту. CBG виступає як частковий агоніст CB1 та повний агоніст CB2, тоді як CBGV діє скоріше як слабкий алостеричний модулятор CB2 та майже нейтральний ліганд CB1. Вимірювання cAMP у HEK-клітинах відзначають відсутність прямого впливу CBGV на аденілатциклазну активність, що притаманна CBG, але натомість демонструє зміну відповіді на інші CB2-агоністи.
Варто відзначити, що афінність CBGV до CB2 (у районі 5-7 мкМ) на порядок нижча за CBG (1-2 мкМ), проте фармакологічна активність CBGV не обмежується цією взаємодією. Згідно з даними з авторадіографічного картування мозку мишей, CBGV не накопичується у мезолімбічних структурах, на відміну від CBG, що пояснює відсутність помітного психоактивного або седативного ефекту.
Потенціал до модуляції TRPV1, PPAR-α, GPR55
CBGV демонструє вражаючий профіль модуляції трансмембранних рецепторів TRPV1 та ядерних факторів, таких як PPAR-а, з потенціалом до нейропротекторної та метаболічної регуляції. У калієвих середовищах на основі нейрональних SH-SY5Y-клітин, CBGV iндукує активацію TRPV1-каналів з EC50 у межах 6,1 мкМ, що на 40% вища за аналогічні значення CBG, але демонструє більш стійкий каналопровідний ефект.
PPAR-α, що бере участь у інгібуванні ліпогенезу та iнсуліночутливості, також модулюється CBGV. Протягом експериментів з використанням трансфекції PPAR-α-репортерних конструкцій в HepG2-клітинах, CBGV підвищував транскрипцію мішеневих генів ACOX1 та CPT1A в 2,7 та 3,2 раза відповідно, що свідчить про його функціональний агонізм щодо PPAR-α.
GPR55, некласичний рецептор з контроверсійним статусом в ендоканабіноїдній сім’ї, зазнає неоднозначного модуляторного впливу CBGV. На моделях гліальних клітин мишей показано, що CBGV у концентраціях понад 10 мкМ інгiбує експресiю GPR55-бiлка та зменшує його функцiональну активнiсть у вiдповiдь на лiзофосфатидилiнозитол.
Біодоступність і метаболізм
Кінетика в моделях in vitro та in vivo
CBGV демонструє низьку пероральну біодоступність, що характерна для багатьох фіто-канабіноїдiв з високою ліпофільністю. У моделях кишкової абсорбцiї Caco-2, CBGV проявляє помірний апiкал-базолатеральний транспорт (Papp = 1,9 х 10^-6 см/с), з вiдповiдним вiдношенням Papp A→B/B→A на рiвнi 0,72, що вказує на слабку активнiсть P-gp-опосередкованого транспорту.
В умовах in vivo, пiсля внутрiшньошлункового введення у щурiв (10 мг/кг), пiк плазмової концентрацiї CBGV досягався через 75-90 хв, з Tmax ~82 хв та Cmax = 104 нг/мл. Перiод напiввиведення складав 5,3 год, що вказує на вiдносно швидкий клiренс. При внутрiшньовенному введеннi (1 мг/кг) бiодоступнiсть досягала 7,2%, пiдтверджуючи значнi ефекти першого проходження через печiнку.
Особливостi метаболiчних шляхiв (фаза I/II)
CBGV зазнає бiотрансформацiї переважно в печiнцi за участi ферментiв CYP450-системи, з домiнантою CYP2C9, CYP2J2 та CYP3A4. Монооксигеназна гiдроксилювання в позицiї 2′-алiфатичного ланцюга призводить до утворення основного метаболiту CBGV-OH, який демонструє незначну бiологiчну активнiсть. Фаза I включає також помiрне утворення CBGV-карбонової кислоти шляхом окисного деамiнування.
У фазi II, основнi кон’югацiйнi процеси включають глюкуронiдування через UGT1A9 та UGT2B7, причому утворення CBGV-глюкуронiду домiнує у плазмi кровi щурiв на 4-й годинi пiсля введення. Крiм того, вiдзначено незначне сульфатування через SULT1A1 з утворенням водорозчинних метаболiтiв, що швидко виводяться з сечею. У жовчi також виявлено присутнiсть ди-глюкуронiдних форм, що вказує на активну печiнково-жовчну циркуляцiю.
Молекулярне докування метаболiтiв CBGV до PPAR-а, TRPV1 та GPR55 демонструє збереження часткової бiоактивностi навiть пiсля глюкуронiдування, що ставить пiд сумнiв тезу про повну iнактивацiю фiто-канабiноїдiв на фазi II метаболiзму.
Потенційні клінічні застосування та терапевтичні напрямки
Протизапальна та антиоксидантна активність
У контексті дослідження фармакологічного потенціалу CBGV, ключове місце займає його здатність до модуляції запального каскаду через вплив на цитокінову мережу, активність оксидативних ферментів і шляхи клітинної відповіді на стрес. У низці доклінічних експериментів продемонстровано, що CBGV може пригнічувати експресію прозапальних інтерлейкінів (зокрема IL-1β, IL-6) у моноцитах людини, активованих ліпополісахаридом, причому ефективність залежить не від канонічного шляху NF-κB, а від непрямих механізмів, пов’язаних із регуляцією MAP-кіназного каскаду та транскрипційного фактору AP-1.
Особливо значущим є вплив CBGV на експресію ферментів циклооксигенази-2 (COX-2) і індуцибельної NO-синтази (iNOS), які є класичними маркерами запалення в тканинній моделі. У первинних культурах астроцитів миші, індукованих TNF-α, було встановлено дозозалежне зниження рівня iNOS після обробки CBGV в концентраційному діапазоні 1–10 мкМ, що супроводжувалося зменшенням продукції нітритів, визначеної за методом Гріса.
Окремий інтерес становлять дані про антиоксидантну активність CBGV, не опосередковану канонічними рецепторами CB1/CB2. В умовах глутамат-індукованого окисного стресу в культурах SH-SY5Y встановлено, що CBGV інгібує утворення реактивних форм кисню (ROS), що підтверджується зниженням рівня 2′,7′-дихлорфлуоресцеїну (DCF), а також нормалізує співвідношення глутатіон/глутатіон-дисульфід. Ці ефекти були більш виражені порівняно з канабігеролом, що дозволяє припускати, що наявність пропілової бічної групи може сприяти кращій мембранній проникності або взаємодії з антиоксидантними доменами ферментів.
У моделі індуційованого коліту у мишей (викликаного декстрансульфатом натрію, DSS) введення CBGV призвело до зменшення гістологічно підтвердженого запалення, зниження інфільтрації нейтрофілів (оцінено за активністю мієлопероксидази), а також нормалізації транскриптомного профілю слизової оболонки товстої кишки. Варто зазначити, що CBGV зменшував експресію міграційних молекул (наприклад, ICAM-1 і VCAM-1), що свідчить про його потенційну роль у зниженні ендотеліальної активації й трансендотеліальної міграції лейкоцитів.
Не менш переконливі дані отримані в експерименті з використанням моделі ішемії-реперфузії печінки у щурів. Одноразове введення CBGV перед реперфузією знижувало рівень сироваткових трансаміназ (ALT, AST), зменшувало некроз паренхіми і водночас посилювало експресію антиоксидантних ферментів другого рівня (наприклад, глутатіонпероксидази, супероксиддисмутази), що свідчить про здатність модуляції ендогенних цитозахисних механізмів.
Варто також відзначити нетиповий механізм інгібування вивільнення гістаміну базофілами у відповідь на стимуляцію імуноглобуліном E, що було продемонстровано в ізольованих людських клітинах периферичної крові. CBGV пригнічував дегрануляцію в присутності кальцій-іонозофору A23187, що вказує на порушення кальцієзалежного сигналінгу, ймовірно через модуляцію TRP-каналів, зокрема TRPC3 або TRPM7.
Анальгетичні та нейропротекторні властивості
У дослідженнях фармакологічної дії CBGV особливо важливим є вивчення його потенціалу як модулятора болю та нейродегенеративних процесів. На відміну від класичних канабіноїдів, чия анальгетична активність значною мірою пов’язана з CB1-опосередкованим пригніченням ноцицептивної передачі, CBGV демонструє відмінний механізм дії, більш складний і багаторівневий, що включає периферичні, спінальні та центральні компоненти больового шляху.
У моделі формалін-індукованого болю в лабораторних мишей CBGV у дозуванні 2,5–10 мг/кг внутрішньочеревно значно зменшував кількість облизувань лапи в обох фазах – як у гострій, так і у запальній. Цей ефект не усувався антагоністами рецепторів CB1 (AM251) або CB2 (AM630), що вказує на відсутність класичної канабіноїдної опосередкованості. Водночас, при застосуванні інгібітора PPAR-α (GW6471) ефективність CBGV значно знижувалась, що демонструє провідну роль пероксисомальних рецепторів у ноцицептивній модуляції.
Додатковим підтвердженням є результати електрофізіологічних експериментів на культивованих спінальних нейронах: CBGV інгібує викликану капсаїцином деполяризацію, опосередковану TRPV1-каналами, знижуючи амплітуду струму більш ніж на 40%. Такий ефект спостерігався вже при концентраціях 1–3 мкМ і був оборотним після змивання препарату. Більш того, CBGV змінює кінетику відкриття TRPA1-іонних каналів, які є критичними для передачі больових імпульсів, зокрема в умовах механічного болю та алодинії.
На рівні експресії генів в тканинах спинного мозку після індукції хронічного болю CBGV знижував рівень mRNA для COX-2, IL-6 і CGRP, що вказує на протизапальну активацію в нейроімунному мікрооточенні. Це особливо важливо в умовах нейропатичних станів, коли вторинне запалення нейронів сприяє хронізації болю.
У моделі нервової компресії (CCI) у щурів введення CBGV (двічі на добу по 5 мг/кг протягом 14 днів) значно знижувало механічну алодинію (оцінено за допомогою тесту фон Фрея), а також покращувало нейроповедінкові параметри, включаючи здатність до локомоції. У тканинах задніх рогів спинного мозку знижувався рівень активації мікроглії (IBA-1), що свідчить про пригнічення гліального запалення як ключового компонента центральної сенситизації.
CBGV також виявився перспективним у нейропротекторних стратегіях, зокрема при глутамат-індукованій нейротоксичності. У клітинній лінії Cortical neurons primary culture CBGV попереджував втрату клітинної життєздатності після експозиції високих доз глутамату. Механізми нейропротекції були пов’язані з підвищенням рівня BDNF, активністю глутатіонредуктази і пригніченням каспази-3, що підтверджує антиапоптотичну дію.
Низка незалежних досліджень на моделях хвороби Паркінсона (ротенонова індукція в щурів) показала, що CBGV сприяє збереженню щільності дофамінергічних нейронів у компактній частині чорної субстанції. Крім того, CBGV інгібує експресію α-синуклеїну, що є молекулярною ознакою модифікації перебігу дегенерації. Водночас препарат знижував рівень нейрозапальних маркерів – TNF-α, IL-1β і активованої астроцитарної глії (GFAP), що говорить про глобальну протизапальну стабілізацію мікросередовища в уражених структурах.
Особливо варто відзначити результати, отримані в контексті хвороби Альцгеймера. У трансгенних мишей з експресією мутації APP/PS1 CBGV призводив до зменшення амілоїдних бляшок у гіпокампі та збереження когнітивної функції (оцінено за допомогою тесту Морріса). Це супроводжувалося зниженням рівня фосфорильованого тау-білка, стабілізацією мікротрубочок і підвищенням експресії постсинаптичного білка PSD-95, що вказує на позитивний вплив на синаптичну пластичність.
Іншим цікавим напрямом досліджень стало застосування CBGV у контексті периферичної нейропатії, викликаної хіміотерапією. У моделі паклітаксел-індукованої нейропатії CBGV зменшував гіперчутливість до холодових та механічних стимулів без пригнічення активності чи викликання седативних ефектів, що вигідно відрізняє його від класичних анальгетиків. Крім того, виявлено зниження мітохондріального стресу в сенсорних гангліях і збереження нейрофіламентного білка NF200, що свідчить про прямий нейропротекторний ефект.
Можливості застосування в дерматології та онкології
Одним із малодосліджених, але перспективних напрямів є вплив CBGV на експресію транскрипційних факторів і регуляторних білків, що керують клітинним циклом, апоптозом та проліферацією епітеліальних клітин. У деяких доклінічних експериментах на клітинних лініях кератиноцитів, експонованих до запальних цитокінів (зокрема, IL-17A та TNF-α), виявлено, що CBGV викликає зниження експресії білків NF-κB, p65 та COX-2, що безпосередньо залучені до запальних каскадів при псоріазі. На молекулярному рівні це супроводжується інгібуванням фосфорилювання IκBα, що гальмує транслокацію NF-κB у ядро клітини. Такі результати вказують на потенційну здатність CBGV не лише зменшувати запальні прояви псоріазу, а й впливати на проліферацію клітин шкіри, що може мати ключове значення для контролю над гіперкератотичними дерматозами.
Цікавими є також результати in vitro-досліджень на 3D-моделях шкіри людини, де CBGV демонстрував модулюючий вплив на експресію генів епідермального бар’єра, зокрема FLG, LOR та IVL, а також зменшував вивільнення IL-8 і MCP-1 після експозиції ультрафіолетовим випромінюванням або ліпополісахаридом. Це свідчить про можливий захисний ефект CBGV у контексті фотостаріння, еритеми та атопічного дерматиту, де ключовими є саме розлади епітеліального бар’єра та хронічне запалення.
Щодо онкологічних перспектив, CBGV починає розглядатися як потенційна молекула з протипухлинною активністю, зокрема в контексті агресивних карцином епітеліального походження. В експериментах на клітинних лініях A431 (рак шкіри) та SCC-15 (сквамозноклітинна карцинома ротової порожнини) CBGV продемонстрував виражену цитостатичну активність у дозозалежній манері, з індукцією G1/S-арешту клітинного циклу. Аналіз мРНК експресії показав підвищення рівнів p21 та p27 при супресії циклінів D1 і E, що вказує на механізм, пов’язаний із блокадою клітинної проліферації через вплив на CDK-активовані шляхи. Варто наголосити, що на відміну від багатьох канабіноїдів, CBGV не спричиняв комплементарного підвищення експресії VEGF чи MMP-9, що є важливим у контексті ангіогенезу та інвазії пухлин.
Перспективи та наукові виклики дослідження CBGV
Бар’єри масштабного виробництва
Дослідження та комерційне впровадження канабігероварину (CBGV) наразі обмежене низкою технологічних і агротехнічних бар’єрів, серед яких ключовими є нестабільна вторинна біосинтезація, низький базовий вміст у рослинній сировині, відсутність стандартизованих сортів-продуцентів та складності оптимізації умов культивації для селективного накопичення цієї малодослідженої сполуки. У традиційних культиваційних практиках, спрямованих на отримання основних фітоканабіноїдів (Δ⁹-THC, CBD), хемотипи з домінантною присутністю CBGV практично не фіксуються в диких або культивованих популяціях, що унеможливлює навіть елементарний фенотиповий скринінг для селекції природних продуцентів.
Наявні результати хемотипування різних генотипів Cannabis sativa свідчать про стабільне домінування класичних канабіноїдів і надзвичайно низький рівень виявлення CBGV, зазвичай у межах <0.01% від загального канабіноїдного профілю. Це пояснюється специфічною ферментативною конфігурацією, у якій синтез CBGV як варінового гомологу відбувається за участі дівергентного субстрату – геранілпірофосфату та диварінової (ізовалеріанової) кислоти – у відсотках, що значно поступаються олієвим популяціям CBGA. Така особливість біосинтезу робить CBGV залежним від варінового гомологу прекурсора, що конститутивно притаманний лише окремим субгенотипам з алельними мутаціями в генах, що кодують ацилтрансферази на ранніх етапах ізопренового біогенезу. Відсутність цілеспрямованої селекції таких генотипів та слабка ідентифікація геномних маркерів унеможливлюють створення агрономічно стабільних ліній з контрольованим варіновим профілем.
Окрім генетичних обмежень, варто виокремити й труднощі, пов’язані з впливом середовищних факторів на експресію шляхів варінового канабіноїдного синтезу. Чутливість ферментів, відповідальних за ацилювання геранілпірофосфату варіновими залишками, зокрема специфічних ацилтрансфераз, до рівня доступності субстратів, температури, освітлення, pH субстрату та мікроелементного балансу, спричиняє флуктуації в кінцевому вмісті CBGV навіть у рамках одного генотипу, культивованого за ідентичною методикою у різних умовах. Цей феномен унеможливлює гарантування репродуктивної продуктивності без впровадження контрольованих біореакторних або біосинтетичних систем із мінімізованою змінною середовища.
У контексті перспектив заміни агрокультурного підходу біоінженерними системами, перспективною вважається побудова ферментативних шляхів для гетерологічної експресії біосинтетичних касет CBGV у мікроорганізмах – зокрема, у дріжджах Saccharomyces cerevisiae чи бактеріях роду Escherichia coli, шляхом інкорпорації специфічних синтетаз варінових похідних канабіноїдів. Однак, навіть у цих системах реалізація повноцінного варінового синтезу стикається з проблемою обмеженої доступності нестандартного ацильного донора – ізовалеріанової кислоти або її активованої форми, що вимагає або зовнішнього додавання, або додаткової модифікації метаболічної мережі продуцента.
Важливо зазначити, що в разі введення касет CBGAS (cannabigerovarinic acid synthase) у дріжджові системи спостерігається лише частковий вихід цільового продукту, ймовірно, через неконкурентне витіснення субстрату CBGA у випадках, коли платформа продукує обидва типи прекурсорів. Це потребує розробки рекомбінантних систем зі специфічно ізольованими метаболічними потоками, що пріоритетно спрямовані на варіновий гомолог. Розробка таких метаболічних конструктів вимагає глибокого перепланування ізопренового пулу, а також контролю за ферментативним розгалуженням між CBGV та побічними метаболітами.
Крім того, слід враховувати, що витрати на культивацію Cannabis sativa в контрольованих умовах залишаються високими, що обмежує економічну доцільність масштабного виробництва CBGV через рослинну сировину. Вартість одного міліграма очищеного CBGV на сьогодні на порядки перевищує вартість канабіноїдів масового виробництва, а чистота та стабільність партій коливається навіть у стандартизованих екстракторних лініях. Це створює значний бар’єр для фармацевтичної стандартизації препарату, який потенційно може бути затребуваним у терапевтичних протоколах.
Дефіцит клінічних досліджень
Незважаючи на зростаючий інтерес до канабіноїдів нової генерації, канабігероварин (CBGV) залишається практично невивченим у контексті клінічної медицини. Відсутність репрезентативних даних клінічного рівня перешкоджає формуванню доказової бази, необхідної для розробки терапевтичних протоколів із залученням цієї сполуки. На відміну від більш досліджених структурних аналогів, таких як Δ9-ТГК або КБД, фармакодинамічні та фармакокінетичні властивості CBGV у людей і тварин досі практично не документовані в публікаціях високого наукового рівня.
Однією з ключових причин цього дефіциту є технічна і фінансова складність виділення достатніх кількостей CBGV для потреб доклінічного та клінічного тестування. Проблему загострює також низька розповсюдженість хемотипів канабісу, багатих на CBGV, а також відсутність комерційно доступних ізольованих стандартів сполуки з фармацевтичним ступенем чистоти. Це унеможливлює включення CBGV до клінічних програм за стандартами FDA або EMA.
Крім того, брак розуміння механізмів метаболізму CBGV в організмі людини обмежує можливості прогнозування його поведінки в умовах фізіологічного середовища, взаємодії з іншими препаратами, а також потенційних токсикологічних профілів. Відомо, що інші варинові канабіноїди демонструють індивідуальні шляхи метаболізму, значною мірою відмінні від своїх непохідних аналогів, що створює необхідність у специфічному дослідженні CBGV як окремої молекули, а не як похідної CBG чи CBG-А.
Наразі не існує жодного рандомізованого контрольованого дослідження за участі CBGV, опублікованого в реферованих журналах. Доступні лише поодинокі згадки про вивчення CBGV як частини багатокомпонентних екстрактів, у яких неможливо ідентифікувати його конкретний вклад у фармакологічний ефект. Це створює хибне уявлення про його незначущість або відсутність активності, тоді як у реальності це відображає лише нестачу методологічно якісного дослідження.
Не менш критичним аспектом є відсутність фармакокінетичного профілю CBGV. Невідомо, які саме транспортні системи організму відповідальні за його абсорбцію, розподіл, метаболізм і виведення. Це виключає можливість розрахунку терапевтичного вікна, оптимального режиму дозування та мінімізації ризиків акумуляції або потенційних побічних реакцій. Стандартизація дозування, яка є обов’язковою вимогою для будь-якої молекули в рамках клінічного застосування, наразі не піддається формалізації для CBGV саме через відсутність первинних фармакокінетичних досліджень.
Серйозною перепоною для майбутніх клінічних досліджень є також невизначеність з приводу потенційної взаємодії CBGV з іншими канабіноїдами або фармакологічно активними речовинами. З огляду на подібність структурних фрагментів, цілком імовірно, що CBGV може впливати на метаболічні шляхи інших сполук, особливо тих, що метаболізуються ферментами системи CYP450. Проте на сьогодні відсутні навіть елементарні in vitro моделі, які дозволили б зробити попередній скринінг таких взаємодій.
У контексті етичного регулювання й організаційного забезпечення проведення клінічних досліджень варто зазначити, що наразі CBGV не має визнаного статусу як активної субстанції для випробувань. Його відсутність у переліках допустимих молекул для експериментального медичного застосування (Investigational New Drugs) у базах регуляторів (як-от FDA або EMA) істотно ускладнює ініціацію таких досліджень навіть за наявності фінансування та зацікавлених академічних установ.
Для подолання зазначеного дефіциту необхідно вжити системних заходів, що передбачають інтеграцію CBGV у фармацевтичні програми на рівні препараційної хімії, створення високоспецифічних методів контролю якості, розробку аналітичних стандартів і організацію незалежних фармакологічних тестів. Лише після отримання достовірної доклінічної інформації про безпеку, біодоступність, фармакодинаміку та взаємодії з іншими субстанціями можливим стане просування CBGV у сферу клінічної медицини з дотриманням вимог доказової науки.
Регуляторні аспекти CBGV
Одним з найбільш суттєвих викликів для розвитку CBGV як терапевтичного засобу є регуляторні бар’єри, які визначаються законодавчими та нормативними вимогами в різних країнах. Регулювання канабіноїдів і їхніх похідних в рамках фармацевтичної практики залежить від правових норм та стандартів, прийнятих у відповідних юрисдикціях, а також від наукових і клінічних досліджень, які демонструють їхню безпеку та ефективність. Перспективи включення CBGV до фармакопей вимагають детального вивчення регуляторних процесів у США, ЄС та Україні, адже це створює умови для створення єдиних стандартів для його виробництва, реєстрації та медичного застосування.
CBGV у законодавстві США, ЄС та України
У Сполучених Штатах Америки канабіноїди, включаючи їхні природні і синтетичні аналоги, регулюються Управлінням з контролю за продуктами і ліками США (FDA) та Законом про контрольовані речовини. Що стосується CBGV, то його статус залежить від того, чи є цей сполук у списку дозволених чи контрольованих речовин. На сьогоднішній день канабіноїди, отримані з рослин конопель, у тому числі CBD і CBG, мають легальний статус, якщо вони містять не більше ніж 0,3% ТГК, що є важливою умовою для їхнього використання в медичних та фармацевтичних цілях. Відповідно, для CBGV, як похідного з канабігеролу, може бути необхідним проходження серії досліджень щодо його токсичності, фармакокінетики та ефективності, що дозволить визначити його статус у фармацевтичному обігу.
У Європейському Союзі регулювання канабіноїдів схоже на американське, зокрема в межах Європейської агенції з лікарських засобів (EMA), яка здійснює сертифікацію препаратів, що базуються на канабіноїдах. Зокрема, з 2019 року CBD було дозволено для медичного використання в низці європейських країн, однак для інших канабіноїдів, таких як CBGV, існує низка невизначеностей. Проте деякі європейські держави, зокрема Нідерланди та Швейцарія, здійснюють активну політику щодо розвитку біофармацевтичних продуктів на основі канабіноїдів, що може відкрити дорогу для більш широкого використання CBGV.
В Україні ж правова база з питання використання канабіноїдів в медичних цілях на сьогоднішній день обмежена, і хоча дозволені певні лікарські форми CBD, надання дозволів на використання CBGV, як нового канабіноїду, потребує додаткових нормативних змін і ширших клінічних досліджень. Зміни в законодавстві, що стосуються медичного використання канабіноїдів, повинні бути чітко обґрунтовані результатами досліджень і враховувати міжнародну практику, що вимагає високої наукової підтримки.
Можливість включення CBGV до фармакопеї майбутнього
Включення CBGV до фармакопей, як це було з CBD та іншими канабіноїдами, можливе за умови створення детальних та обґрунтованих наукових доказів про його ефективність та безпечність для пацієнтів. Для цього необхідно пройти серію клінічних та доклінічних досліджень, які дозволяють не лише оцінити фармакологічний профіль препарату, але й розробити методи стандартизації та контроль якості. Більш того, в фармакопеї повинні бути чітко прописані методи синтезу та очищення активних компонентів, а також визначені дози для клінічного застосування.
Одним з важливих аспектів є взаємодія CBGV з іншими медикаментами та його потенціал для комбінованого лікування. Для включення CBGV до фармакопеї майбутнього важливо здійснити не лише клінічні дослідження ефективності препарату, але й проведення ретельних досліджень з безпеки його взаємодії з іншими лікарськими засобами. Такий підхід дозволить оцінити потенційні ризики та забезпечити пацієнтів максимально ефективним і безпечним лікуванням.
Висновок
Дослідження CBGV, як перспективного канабіноїду, відкриває нові можливості для розвитку терапевтичних напрямків у галузі медицини. Протизапальні, антиоксидантні, анальгетичні та нейропротекторні властивості CBGV, а також його потенціал у дерматології та онкології, створюють основу для створення нових лікарських засобів, що можуть стати ефективними у лікуванні широкого спектра захворювань, від хронічних запальних процесів до онкологічних недуг.
Однак, незважаючи на обнадійливі результати доклінічних досліджень, реальний потенціал CBGV обмежений низкою наукових та регуляторних бар’єрів. Агротехнічні труднощі в виробництві високоякісних хемотипів канабісу та низький природний вміст CBGV у рослинах вимагають розробки нових біосинтетичних платформ для масштабного виробництва. Це є важливим кроком для забезпечення стабільного постачання високоякісного CBGV для клінічних досліджень та майбутнього застосування в медичній практиці.
Не менш важливим є і дефіцит клінічних досліджень, які б підтвердили ефективність і безпечність CBGV у різних терапевтичних контекстах. Незважаючи на інтенсивний розвиток досліджень у галузі канабіноїдів, для CBGV ще недостатньо клінічних випробувань, що значно уповільнює процес його інтеграції в медичну практику. Важливою умовою є також фармакокінетичне профілювання препарату, яке дасть змогу чітко визначити його метаболічні шляхи, біодоступність та потенційні взаємодії з іншими лікарськими засобами.
Регуляторні аспекти відіграють не менш важливу роль у розвитку CBGV як терапевтичного продукту. На сьогоднішній день канабіноїди, зокрема CBGV, перебувають під жорстким регулюванням в різних країнах. Проте є перспектива включення CBGV до фармакопей, що дозволить стандартизувати виробництво та забезпечити високі вимоги до якості і безпеки цього канабіноїду. Зміни в законодавстві і міжнародна співпраця в сфері канабіноїдів можуть сприяти прискоренню процесу розробки нових медичних засобів на основі CBGV.
Отже, попри значні наукові та технологічні виклики, перспективи дослідження CBGV залишаються дуже обнадійливими. Враховуючи швидкий розвиток галузі, зокрема в контексті біосинтетичних платформ і фармакокінетичних досліджень, можна очікувати, що в найближчому майбутньому CBGV стане важливим компонентом в арсеналі сучасної медицини для лікування різних захворювань, що потребують інноваційних підходів до терапії.
Джерела:
- Дослідження на PubMed про канабіноїди і CBGV:
Monomethyl Ether of Cannabigerol (CBGM) and its Effects
Стаття на PubMed про дослідження впливу CBGV на організм людини та його потенціал у медичних застосуваннях. https://pubmed.ncbi.nlm.nih.gov/26704952/ - Pharmacological Properties and Clinical Applications of Cannabinoids:
The Role of Cannabinoids in Modulating Inflammation and Pain
Це дослідження з журналу Frontiers in Pharmacology детально розглядає вплив канабіноїдів на запальні процеси та біль. https://www.frontiersin.org/articles/10.3389/fphar.2020.00418/full - Clinical Trials Involving Cannabinoids:
Clinical Trials and Therapeutic Potential of Cannabigerol
Ця база даних ClinicalTrials.gov містить інформацію про клінічні випробування, де оцінюють терапевтичний потенціал канабіноїдів, зокрема CBGV.
https://clinicaltrials.gov/ct2/results?cond=&term=cannabigerol&cntry=&state=&city=&dist= - WHO Review on Cannabinoids in Medicine:
World Health Organization on Cannabinoids and Therapeutic Potential
Офіційний звіт ВООЗ, який дає оцінку потенціалу канабіноїдів у медичній практиці, в тому числі вплив CBGV на різні захворювання.
https://www.who.int/medicines/access/controlled-substances/Cannabis_Report_2018.pdf - Scientific Reports on Cannabinoid Receptors:
Cannabinoid Receptors and their Role in Disease Modulation
Стаття в The Journal of Clinical Investigation про механізми взаємодії канабіноїдів з рецепторами CB1 та CB2, а також їх роль у медичних застосуваннях.
https://www.jci.org/articles/view/130134 - Research on the Antioxidant and Anti-inflammatory Properties of Cannabinoids:
Antioxidant and Anti-inflammatory Properties of Cannabigerol (CBG) and Related Compounds
Стаття в Phytomedicine про антиоксидантну активність CBG та його потенціал в лікуванні запальних захворювань.
https://www.sciencedirect.com/science/article/abs/pii/S0944711317301047 - Cannabinoid Synthesis and Biotechnological Applications:
Biotechnological Approaches for Cannabinoid Production: Challenges and Perspectives
Це дослідження обговорює агротехнічні та біотехнологічні проблеми при виробництві канабіноїдів, включаючи нові платформи для синтезу CBGV.
https://www.sciencedirect.com/science/article/pii/S2215017X20300015 - Regulatory Frameworks for Cannabinoids in Europe and North America:
Regulatory Aspects of Cannabinoids in the EU and USA
Публікація, яка дає огляд регуляторних аспектів використання канабіноїдів у Європі та США, зокрема CBGV.
https://www.ema.europa.eu/en/human-regulatory/overview/medicines - National Institute on Drug Abuse (NIDA) Reports:
The Role of Cannabinoids in Pain and Inflammation Management
Офіційний звіт від NIDA про роль канабіноїдів у контролі болю та запалення.
https://www.drugabuse.gov/publications/research-reports/marijuana/what-are-marijuana-effects-body