Канабіглендол – це одна з рідкісних і мало вивчених природних сполук роду Cannabis, що належить до класу канабіноїдів. Ця хімічна речовина представляє особливий інтерес для науковців, оскільки її унікальна молекулярна структура та фізико-хімічні властивості відрізняють її від більш поширених канабіноїдів, таких як тетрагідроканабінол (THC) чи канабідіол (CBD). Через свою низьку концентрацію у природних екстрактах канабіглендол залишається однією з найменш досліджених сполук, однак він потенційно може відігравати важливу роль у фармакології та біохімії канабіноїдів.
Біосинтетичні шляхи формування канабіглендолу в рослині Cannabis пов’язані з ферментативними перетвореннями прекурсорів канабіноїдів, зокрема канабігеролової кислоти (CBGA) та інших кислотоутворних форм. Канабіглендол утворюється внаслідок складних хімічних трансформацій, які включають декарбоксилювання та ізомеризацію, що робить його структурно і функціонально відмінним від інших канабіноїдів. Незважаючи на те, що детальні механізми біосинтезу ще не повністю розкриті, наявні дані свідчать про те, що цей канабіноїд виникає як побічний продукт у метаболічних ланцюгах рослини.
Зважаючи на те, що канабіглендол присутній у рослинах у дуже незначних кількостях, його виділення для експериментальних досліджень є технічно складним завданням. У зв’язку з цим для отримання канабіглендолу застосовуються різноманітні методи: від ізоляції із рослинної сировини до напівсинтетичних та повністю синтетичних шляхів хімічного синтезу. Також починають розвиватися біотехнологічні підходи, які передбачають використання генно-модифікованих мікроорганізмів для продукції цієї сполуки. Розробка ефективних і масштабованих методів синтезу є ключовою для забезпечення достатньої кількості речовини для подальших фармакологічних та токсикологічних досліджень.
Фармакологічні властивості канабіглендолу залишаються на даний момент недостатньо вивченими. Проте передбачають, що він може взаємодіяти з різними рецепторними системами організму, зокрема канабіноїдними рецепторами CB1 і CB2, а також з іншими молекулярними мішенями, що регулюють запальні процеси, нейропротекцію та імунні відповіді. Існують окремі дослідження in vitro, які вказують на потенційні протизапальні та нейропротективні властивості цієї сполуки, однак систематичних in vivo досліджень та клінічних випробувань на людях наразі бракує.
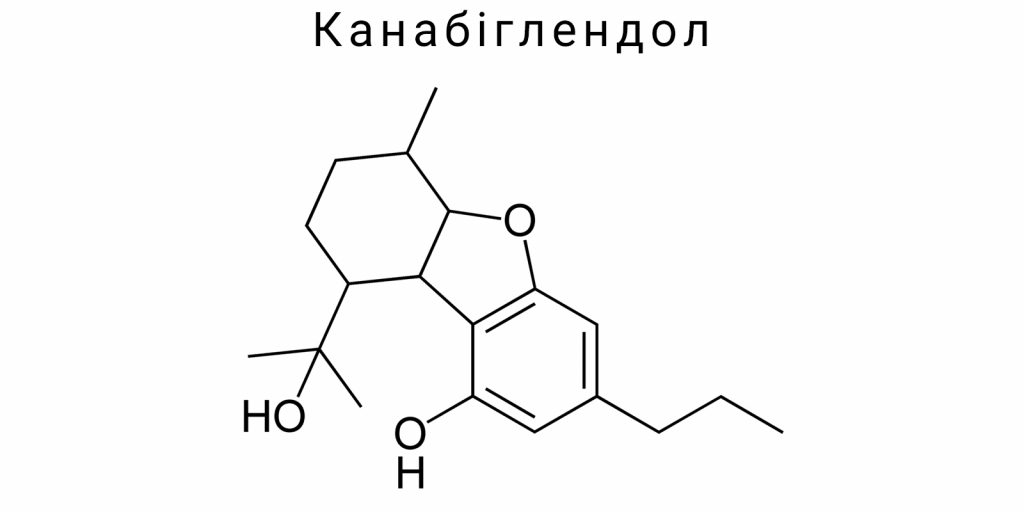
Хімічна природа канабіглендолу
Канабіглендол є представником класу фіто-канабіноїдів – природних органічних сполук, які утворюються у рослинах роду Cannabis. Ця сполука характеризується унікальними хімічними властивостями, що відрізняють її від інших канабіноїдів, і визначають специфіку її біологічної активності. Хімічна природа канабіглендолу тісно пов’язана з його молекулярною структурою, яка формує основну основу для взаємодії із біологічними мішенями, а також визначає фізико-хімічні властивості, що впливають на розчинність, стабільність та метаболізм речовини.
Канабіглендол за хімічною природою є похідним терпенофенолу, що містить фенольну групу та неповну циклічну структуру, притаманну багатьом канабіноїдам. Основна молекула включає аліфатичний бічний ланцюг та фенольне ядро, які взаємодіють для формування характерної тривимірної структури. Відсутність кислого функціонального угруповання, на відміну від канабіноїдних кислот, надає канабіглендолу нейтральних хімічних властивостей. Така будова впливає на його здатність проходити через клітинні мембрани та взаємодіяти з гідрофобними ділянками рецепторів.
Хімічна формула канабіглендолу відповідає класичній формулі канабіноїдів, що включає вуглець, водень та кисень, але має характерні відмінності у розміщенні подвійних зв’язків та функціональних груп. Канабіглендол характеризується наявністю кількох насичених і ненасичених ділянок, що визначають його реакційну здатність. Особливу роль у хімічній природі цієї сполуки відіграє здатність до електрофільних і нуклеофільних реакцій, що дає змогу модифікувати молекулу для синтетичних цілей.
Канабіглендол проявляє слабку кислотність через фенольну гідроксильну групу, що впливає на розчинність у воді та органічних розчинниках. Його розчинність відносно низька у воді, проте він добре розчиняється в неполярних та слабо полярних середовищах, що відображає характер гідрофобності молекули. Ці властивості визначають умови зберігання та транспортування канабіглендолу, а також його фармакокінетику.
Термостабільність канабіглендолу є важливим фактором, який впливає на його можливе застосування в медичних та фармацевтичних продуктах. Відомо, що канабіноїди можуть піддаватися термічній деградації, зокрема процесам декарбоксилювання та ізомеризації. У випадку канабіглендолу термічна стійкість відносно висока, що дозволяє зберігати його хімічні властивості при помірних температурах, але при підвищених температурах можливе утворення побічних продуктів.
У хімічній природі канабіглендолу слід також відзначити здатність до утворення стереоізомерів через наявність хіральних центрів у молекулі. Це впливає на його біологічну активність, оскільки різні ізомери можуть мати різну здатність взаємодіяти з рецепторами або ферментами. Такі особливості хімічної природи є ключовими при розробці методів синтезу та вивченні фармакології канабіглендолу.
Важливою складовою хімічної природи є також взаємодія канабіглендолу з іншими компонентами рослинного екстракту, зокрема терпенами та іншими канабіноїдами. Взаємодії між молекулами можуть сприяти утворенню стійких комплексів, які впливають на біодоступність і ефективність сполуки у біологічних системах.
Канабіглендол, як і інші канабіноїди, здатен до окислювально-відновних реакцій, що визначає його поведінку в живих організмах та у навколишньому середовищі. Окислювальні метаболіти можуть утворюватися як у процесі деградації під дією світла і кисню, так і в результаті ферментативного метаболізму, що є важливим аспектом токсикологічної оцінки.
Молекулярна структура та фізико-хімічні властивості
Молекулярна структура канабіглендолу визначає його унікальні фізико-хімічні характеристики, які відрізняють цю сполуку від інших канабіноїдів. Молекула канабіглендолу є терпенофенольним з’єднанням із формулою C₂₁H₃₂O₂. Вона складається з моноциклічного терпенного скелета, який містить три ізопренові блоки, зв’язані за схемою “2-ізопреновий одиниць + фенольна група”. Відмінність канабіглендолу полягає у специфічному розташуванні подвійних зв’язків і функціональних груп, що забезпечує характерну геометрію молекули.
Ключовою особливістю молекулярної будови є наявність фенольної гідроксильної групи, розташованої у положенні, яке забезпечує високий рівень електронної щільності на ароматичному кільці. Ця особливість значною мірою впливає на кислотно-основні властивості молекули, а також на її здатність до утворення водневих зв’язків із полярними розчинниками і біомолекулами. Відмінність позиції гідроксильної групи у канабіглендолу порівняно з іншими канабіноїдами визначає специфіку його реактивності.
Молекула має аліфатичний бічний ланцюг, який складається з лінійної вуглецевої ланки, що піддається конфігураційній гнучкості. Ця гнучкість впливає на здатність канабіглендолу адаптуватися до різних молекулярних мішеней, зокрема рецепторів, за рахунок зміни конформації бічного ланцюга. Варіабельність просторової орієнтації дозволяє сполученню оптимізувати взаємодії гідрофобного характеру у глибині рецепторних сайтів.
Фізико-хімічні властивості канабіглендолу включають температури плавлення і кипіння, розчинність, оптичні характеристики та електрохімічну активність. Температура плавлення молекули знаходиться у діапазоні, що відповідає аморфному стану з тенденцією до утворення кристалічних форм, які мають специфічні поліморфні властивості. Така поліморфність пов’язана із можливістю різних упаковок молекул у твердому стані, що суттєво впливає на біодоступність і стабільність канабіглендолу.
Розчинність канабіглендолу має полярно-аполярний характер: він практично нерозчинний у воді, проте має високу розчинність у органічних розчинниках, таких як метанол, етиловий ефір, хлороформ і гексан. Це обумовлено наявністю великої гідрофобної частини молекули, а також полярної фенольної групи, що сприяє розчиненню у середовищах із проміжною полярністю. Відмінна розчинність у органічних середовищах є важливою для процесів екстракції та очищення канабіглендолу.
Оптичні властивості молекули визначаються її хіральністю та наявністю конформаційних форм. Канабіглендол проявляє оптичну активність, що можна зафіксувати методами поляриметрії та циркулярного дихроїзму. Ці оптичні характеристики важливі для визначення абсолютної конфігурації молекули, що має значення для її взаємодії з біологічними рецепторами та ферментами.
Електрохімічна активність канабіглендолу проявляється в процесах окислення і відновлення фенольної групи. Ця сполука може брати участь у радикальних реакціях, зокрема утворювати стабільні фенольні радикали, які відіграють роль у біохімічних процесах, зокрема антиоксидантній активності. За допомогою методів циклічної вольтамперометрії можна дослідити потенціал окислення канабіглендолу, що дає уявлення про його стабільність і можливість участі у редокс-реакціях.
Термодинамічні параметри канабіглендолу включають енергію зв’язку та енергію активації конформаційних змін, що визначають його стійкість і реакційну здатність. Дослідження із застосуванням квантово-хімічних методів показали, що молекула має низьку енергію активації для переходу між різними конформаціями, що забезпечує її динамічну гнучкість у біологічних системах.
Канабіглендол має значний потенціал утворювати комплекси з металами, особливо з іонами перехідних металів, завдяки наявності донорських атомів кисню у фенольній групі. Ця властивість є предметом досліджень у контексті розробки нових каталізаторів та фармакологічно активних металевих комплексів.
Стабільність молекули у різних фізичних і хімічних умовах є важливим аспектом, який визначає її практичне застосування. Канабіглендол зберігає свою хімічну цілісність при впливі помірних температур, нейтрального pH і відсутності окислювальних агентів. Водночас, він може деградувати під впливом ультрафіолетового випромінювання і кисню, що вимагає розробки методів захисту молекули у фармацевтичних препаратах.
Ізомерія та конформаційні особливості
Ізомерія канабіглендолу є складним і багатогранним явищем, яке має визначальний вплив на його хімічні, фізичні та біологічні властивості. Ізомерні форми цієї молекули охоплюють як структурні (конституційні) ізомери, так і стереоізомери, що включають конфігураційні та конформаційні варіанти. Аналіз ізомерії дає змогу розкрити різноманіття молекулярних форм, які можуть виникати в процесі синтезу, біосинтезу, а також під час метаболізму в живих організмах.
Канабіглендол має кілька хіральних центрів, які є основою для існування різних енантіомерів та діастереомерів. Розташування гідроксильної групи та бічних ланцюгів створює асиметрію у молекулі, що визначає можливість існування оптично активних ізомерів. Конфігурація цих центрів критично впливає на взаємодію з рецепторами, оскільки різні стереоізомери можуть мати різну афінність і біологічну активність. Енантіомерна чистота є важливою характеристикою для фармакологічних досліджень і розробки препаратів на основі канабіглендолу.
Структурні ізомери канабіглендолу пов’язані зі змінами у розміщенні подвійних зв’язків, позиціях гідроксильних груп, а також з варіаціями у довжині та розгалуженні аліфатичних ланцюгів. Такі зміни призводять до значних відмінностей у хімічній реактивності та фізико-хімічних властивостях. Зокрема, зміщення положення подвійних зв’язків впливає на електронну густину в молекулі та її здатність до взаємодії з радикалами, а також на спектральні характеристики.
Конформаційна ізомерія канабіглендолу пов’язана із просторовою гнучкістю молекули, що виникає внаслідок обертання навколо простих ковалентних зв’язків. Особливості конформаційного простору визначаються енергетичними бар’єрами, які виникають через стеричні взаємодії між атомами та функціональними групами, а також завдяки електронним ефектам, таким як гіперкон’югація. Важливу роль відіграє взаємодія фенольної групи з аліфатичними ланцюгами, яка може створювати конформації з додатковою стабілізацією через внутрішні водневі зв’язки.
Аналіз конформаційних змін у молекулі канабіглендолу проводиться за допомогою методів квантово-хімічного моделювання та спектроскопії, включаючи ядерний магнітний резонанс (ЯМР) та інфрачервону спектроскопію. Дані цих методів дозволяють ідентифікувати найбільш стабільні конформації та визначити енергетичні бар’єри між ними, що має важливе значення для розуміння динаміки молекули у розчині та в біологічних середовищах.
Конформаційні особливості мають безпосередній вплив на здатність канабіглендолу взаємодіяти з рецепторами CB1 та CB2, а також з іншими молекулярними мішенями. Здатність молекули адаптувати форму дозволяє ефективно контактувати з активними центрами білків, що визначає її фармакологічний потенціал. Відмінності у конформаціях можуть спричиняти зміну афінності та селективності взаємодії, що підкреслює важливість вивчення цього аспекту ізомерії.
Окрему увагу слід приділити таутомерії – формі ізомерії, при якій відбувається переміщення протона із супутньою зміною положення подвійного зв’язку. У канабіглендолу можливі фенол- кетонні та енол- кетонні таутомерні форми, що мають різну стабільність залежно від середовища. Таутомерія впливає на кислотно-основні властивості молекули, її реакційну здатність та спектральні характеристики.
Важливою складовою ізомерії є також геометрична (цис-транс) ізомерія, яка виникає через обмежене обертання навколо подвійних зв’язків у молекулі. В канабіглендолі такі ізомери можуть суттєво відрізнятися за енергетичним рівнем та просторовим розташуванням функціональних груп, що впливає на їх взаємодію з біологічними мішенями.
Канабіглендол, як і інші канабіноїди, здатен утворювати міжмолекулярні комплекси через водневі зв’язки та ван-дер-ваальсові взаємодії, які залежать від конкретної ізомерної форми. Ці взаємодії можуть впливати на утворення агрегатів у розчині, стабільність у фармацевтичних формах і біодоступність.
Враховуючи важливість ізомерії для біологічної активності, при синтезі та екстракції канабіглендолу критично контролюється співвідношення ізомерів. Методи хроматографії, такі як високоефективна рідинна хроматографія (ВЕРХ), у поєднанні зі спектроскопічними методами дозволяють розділити ідентифікувати окремі ізомери та визначити їх чистоту.
Походження канабіглендолу
Походження канабіглендолу тісно пов’язане із складною біохімічною системою рослин роду Cannabis, які є основним природним джерелом цієї сполуки. Канабіглендол утворюється як один із численних канабіноїдів, що виникають у процесі метаболізму терпенофенольних сполук у тканинах рослини. Його походження визначається специфічними шляхами трансформації попередників, які інтегруються у загальний метаболічний контур канабіноїдів.
Історично канабіглендол не був одразу ідентифікований як окремий компонент канабісу через його менш виражену концентрацію порівняно з іншими канабіноїдами, такими як тетрагідроканабінол або каннабідол. Проте з розвитком аналітичних методів, зокрема хроматографії та спектроскопії, канабіглендол був чітко виділений і ідентифікований як окрема хімічна сутність. Його походження пов’язане з природними біохімічними трансформаціями, які відбуваються в екзокринних залозах (трихомах) рослини.
Канабіглендол є похідним терпеноїдного класу з фенольною групою, яка формується на базі основного скелета терпеноїдів у процесі послідовних ферментативних реакцій. Основною біохімічною базою для його формування є лінійні або циклічні терпени, які в рослині синтезуються із піровиноградної кислоти, ацетил-КоА та ізопренових попередників. Надалі ці терпени проходять окиснення, циклізацію та гідроксилювання, що веде до формування характерного скелета канабіглендолу.
Процес формування канабіглендолу часто відбувається паралельно із синтезом інших канабіноїдів, оскільки усі вони беруть початок з загального прекурсора, канабігеролової кислоти. У рослині канабігеролова кислота служить центральною молекулою, яка через дію специфічних ферментів трансформується у різні канабіноїди, включаючи канабіглендол. Характерною особливістю біосинтезу канабіглендолу є відмінність у ферментативних шляхах та структурних модифікаціях, які уникають утворення типових тетрагідроканабінольних кілець.
Походження канабіглендолу у природі супроводжується також неферментативними реакціями, такими як окиснення або деградація попередніх канабіноїдів. Ці реакції можуть відбуватися під впливом зовнішніх факторів – світла, температури, а також окислювальних агентів. Зокрема, канабіглендол може утворюватися як продукт окиснення інших терпенофенольних сполук, що підкреслює його статус як похідної у складному хімічному ланцюзі метаболізму канабісу.
Рослина роду Cannabis має високий рівень пластичності у синтезі вторинних метаболітів, що забезпечує варіабельність вмісту канабіглендолу залежно від сорту, умов вирощування та ступеня зрілості. Генетичні особливості окремих ліній рослини визначають активність ферментів, які каталізують утворення канабіглендолу, що у свою чергу відображається у кількісному вмісті цієї сполуки. Важливо відзначити, що екологічні фактори, такі як освітлення, температура, вологість та поживний режим, суттєво впливають на експресію ферментних систем, відповідальних за синтез канабіглендолу.
Додатково, канабіглендол може утворюватися у результаті хімічної трансформації під час сушіння та зберігання рослинної сировини. Такі трансформації включають деградацію інших канабіноїдів або їхніх кислотних форм, що змінює хімічний профіль кінцевого продукту. Це явище важливе для точного визначення походження канабіглендолу у досліджуваних зразках та для контролю якості фармацевтичних препаратів.
Канабіглендол, як природна сполука, відображає еволюційну адаптацію рослини Cannabis до навколишнього середовища. Його синтез, ймовірно, має екологічне значення, пов’язане з захистом від ультрафіолетового випромінювання, шкідників або мікроорганізмів. Така функція характерна для багатьох вторинних метаболітів, що виконують роль біохімічного бар’єру, який підвищує виживання рослини в екстремальних умовах.
Розуміння походження канабіглендолу важливе не лише з фундаментальної точки зору, а й для практичних аспектів – селекції рослин із підвищеним вмістом цієї сполуки, оптимізації умов культивування та розробки технологій екстракції. Зокрема, інформація про біохімічні шляхи дозволяє розробляти методи ферментативної модифікації або хімічного синтезу канабіглендолу у лабораторних умовах.
Біосинтез у рослинах роду Cannabis
Біосинтез канабіглендолу у рослинах роду Cannabis є складним багатостадійним процесом, що інтегрується у загальний метаболічний шлях утворення канабіноїдів. Цей шлях базується на взаємодії двох основних метаболічних ланцюгів – терпеноїдного та фенольного, що конвергують у синтезі характерного терпенофенольного каркасу молекули канабіглендолу. Ключовим прекурсором у цьому процесі є канабігеролова кислота, яка виступає як сполука-матриця для формування різноманітних канабіноїдів, включно з канабіглендолом.
Початкова фаза біосинтезу включає утворення ізопренових одиниць, що є будівельними блоками терпеноїдного сегменту молекули. У рослинах Cannabis це відбувається переважно шляхом метилеритритолфосфатного (MEP) шляху в пластидах. Ізопренові одиниці ізопентенілпірофосфат (IPP) і диметилаллілпірофосфат (DMAPP) конденсуються під дією специфічних синтаз для формування геранілпірофосфату (GPP) – основного терпеноїдного прекурсора. Цей етап визначає терпенову основу майбутньої молекули.
Паралельно відбувається синтез фенольної частини через шляхи фенілпропаноїдів, які починаються з амінокислоти фенілаланіну. Під дією ферментів фенілаланінамінотрансферази (PAL) і інших специфічних ферментів відбувається формування ароматичних сполук, таких як олігомерні феноли. Ці сполуки надалі трансформуються в 1-окси-2-фенілпропанон, який є попередником для реакції із терпеноїдним сегментом.
Канабігеролова кислота формується шляхом реакції між терпеноїдним прекурсором GPP і фенольним попередником олігомерного фенолу. Ця реакція каталізується специфічним ферментом – канабігерол-синтазою (CBGAS), яка контролює конденсацію і формування канабігеролової кислоти. Це центральний етап біосинтезу канабіноїдів, що визначає подальшу долю молекули у різних біохімічних трансформаціях.
Для формування канабіглендолу з канабігеролової кислоти основну роль відіграють ферментативні модифікації, що змінюють будову молекули без порушення основного терпенофенольного каркасу. У цьому процесі значну роль відіграють оксидоредуктази, гідроксилази і лізази, які забезпечують селективне окиснення, гідроксилювання та циклізацію окремих фрагментів молекули.
Зокрема, ферменти, що каталізують циклізацію терпеноїдного ланцюга, сприяють утворенню відкритої аліфатичної структури, характерної для канабіглендолу, на відміну від утворення циклічних структур у інших канабіноїдів. Цей процес забезпечує унікальність хімічної будови канабіглендолу і визначає його специфічні фізико-хімічні та біологічні властивості.
Гідроксилювання молекули канабіглендолу відбувається у визначених позиціях, що формує гідроксильні групи, відповідальні за полярність молекули і її здатність до взаємодії з водними середовищами та рецепторами. Ці реакції каталізуються ферментами класу цитохрому P450, які мають здатність вибірково модифікувати молекули, зокрема у позиціях, що впливають на біологічну активність.
Крім ферментативних трансформацій, у біосинтезі канабіглендолу можливі неферментативні реакції, такі як спонтанне окиснення і радикальні процеси, що відбуваються під впливом оточуючих умов, включаючи світло і температуру. Ці реакції можуть доповнювати ферментативний шлях, створюючи додаткові варіанти молекули, що збагачують хімічний профіль рослини.
Важливим аспектом біосинтезу є просторово-темпоральна регуляція ферментів у різних тканинах рослини. Найвища активність ферментативних комплексів спостерігається у трихомах – залозистих волосках на поверхні листя і суцвіть. Тут накопичуються і трансформуються канабіноїди, включно з канабіглендолом, що забезпечує локалізований синтез і захист рослини від зовнішніх факторів.
Рівень експресії генів, які кодують ферменти біосинтезу, строго регулюється як генетичними, так і епігенетичними механізмами. Фактори навколишнього середовища, такі як світло, температура і водний режим, впливають на регуляцію цих генів, модулюючи синтез канабіглендолу та інших канабіноїдів у відповідь на стресові або адаптивні умови.
Молекулярні дослідження біосинтезу канабіглендолу виявили низку ізоформ ферментів, які можуть мати субтильні відмінності у каталітичній активності і специфічності, що додатково розширює різноманітність молекулярних форм канабіглендолу. Ці ізоформи забезпечують гнучкість метаболічних шляхів і можуть бути потенційними мішенями для генної інженерії та біотехнологічних методів підвищення продуктивності канабіглендолу.
Застосування сучасних методів – метаболоміки, протеоміки та транскриптоміки – дозволяє інтегрувати дані про біосинтетичні шляхи у системне розуміння метаболізму канабіглендолу у рослинах. Ці підходи сприяють відкриттю нових ферментів, регуляторних факторів і метаболічних вузлів, що формують адаптаційні стратегії рослини.
Природні джерела та кількісні показники в рослинах
Канабіглендол є вторинним метаболітом, виявленим у рослинах роду Cannabis, однак його концентрація значно варіює залежно від ботанічного виду, сорту, умов культивування та стадії розвитку рослини. Природні джерела канабіглендолу обмежені саме рослинами Cannabis, які належать до родини Cannabaceae, хоча потенційне виявлення подібних сполук у споріднених видах потребує додаткових досліджень. Основне накопичення канабіглендолу відбувається у специфічних тканинах, зокрема у залозистих трихомах, які локалізуються на листках, суцвіттях та іноді на стеблах.
Різноманіття рослинних сортів Cannabis істотно впливає на рівень вмісту канабіглендолу. Відомо, що індика-, сатива- та гібридні лінії демонструють різні профілі канабіноїдів, у яких канабіглендол зустрічається як у слідових кількостях, так і у помірних концентраціях. Цей факт свідчить про генетичну детермінованість синтезу канабіглендолу, що відображає варіабельність ферментативної активності та регуляторних механізмів у різних генотипах.
Вимірювання кількісних показників канабіглендолу здійснюється за допомогою високоточної аналітичної техніки, включаючи газову хроматографію з мас-спектрометричним детектуванням (GC-MS), рідинну хроматографію високого тиску (HPLC) та ядерний магнітний резонанс (ЯМР). Аналітичні методи забезпечують не лише ідентифікацію, а й точне кількісне визначення канабіглендолу у різних зразках рослинної сировини.
Кількісні показники канабіглендолу у рослинах варіюють у широкому діапазоні, що пов’язано з фактором генотипу, а також впливом агротехнічних і екологічних параметрів. У традиційних сортах вміст канабіглендолу зазвичай не перевищує 0,1-0,3% від сухої маси, хоча у спеціалізованих селекційних лініях ця концентрація може досягати 0,5% і вище. Важливо підкреслити, що канабіглендол у рослинах часто присутній у формі кислотних прекурсорів, які при екстракції і зберіганні можуть переходити у декарбоксильовану активну форму.
Варіабельність кількісних показників канабіглендолу також залежить від стадії розвитку рослини. Найвищий рівень накопичення спостерігається у фазі цвітіння, коли активність ферментів біосинтезу максимальна, і забезпечується максимальна продукція канабіноїдів. У фазах росту і формування листя концентрація канабіглендолу є меншою, що свідчить про тісний зв’язок синтезу цієї сполуки з репродуктивним циклом.
Екологічні фактори, такі як температура, світловий режим, вологість і живлення рослин, мають суттєвий вплив на концентрацію канабіглендолу. Зокрема, підвищена інсоляція і помірний стрес, викликаний нестачею води, можуть стимулювати активність ферментів біосинтезу, що призводить до зростання вмісту канабіглендолу. Аналогічно, оптимальні концентрації макро- та мікроелементів у ґрунті забезпечують належний метаболізм, що сприяє більш стабільному накопиченню канабіглендолу.
Особливої уваги заслуговує дослідження впливу агротехнічних методів – типу вирощування (відкритий ґрунт або тепличні умови), способу внесення добрив, обробки стимуляторами росту, що здатні значно змінювати концентрацію канабіглендолу. Технології культивування, які оптимізують умови росту рослини і мінімізують стрес, можуть посилювати накопичення цієї сполуки, що є важливим для фармацевтичної промисловості.
Канабіглендол концентрується переважно у трихомах, які функціонують як біореактори для біосинтезу та накопичення канабіноїдів. Морфологічні характеристики цих залозистих утворень, включаючи їх кількість, розмір і щільність на поверхні рослини, прямо корелюють з рівнем вмісту канабіглендолу. Визначення морфометричних параметрів трихомів є важливим інструментом для оцінки потенціалу рослин до виробництва канабіглендолу.
Додатково, варто відзначити, що природний вміст канабіглендолу може суттєво змінюватися залежно від технологій післязбиральної обробки – сушіння, зберігання та екстракції. Підвищена температура, доступ кисню та тривалість зберігання впливають на стабільність канабіглендолу, що може призводити до його часткової деградації або перетворення в інші канабіноїди. Контроль цих параметрів є критичним для збереження хімічного профілю матеріалу.
Методи виготовлення канабіглендолу
Виготовлення канабіглендолу є предметом комплексних досліджень, оскільки природне його виділення з рослин роду Cannabis обмежене низькою концентрацією і складністю екстракції. Тому розробка ефективних методів отримання канабіглендолу набуває важливого значення для забезпечення стабільних постачань цієї сполуки для подальших досліджень і потенційних фармацевтичних застосувань. Основні підходи до виготовлення канабіглендолу включають виділення з рослинної сировини, напівсинтетичні методи, повний хімічний синтез та біотехнологічні технології. Кожен із цих методів має свої переваги та обмеження, пов’язані з продуктивністю, чистотою кінцевого продукту, екологічністю і економічністю.
Екстракція канабіглендолу із природних джерел – рослин Cannabis – залишається базовим, але не завжди достатньо ефективним методом. З огляду на те, що вміст канабіглендолу у сировині зазвичай низький, кількість отримуваного продукту обмежена, а процес вимагає значних витрат часу, розчинників та спеціалізованого обладнання. Тому пошук альтернативних способів синтезу стає критично необхідним.
Напівсинтетичні методи дозволяють підвищити вихід канабіглендолу шляхом перетворення більш доступних канабіноїдних прекурсорів, отриманих з рослинної сировини. Ці методи базуються на хімічних модифікаціях природних сполук, які, завдяки наявності характерних функціональних груп, можуть бути трансформовані у канабіглендол із високою селективністю. Використання напівсинтетичних технологій знижує потребу в масштабних посівах рослин, забезпечує кращий контроль над хімічною чистотою та структурною однорідністю продукту.
Повний хімічний синтез канабіглендолу є найбільш складним шляхом з огляду на молекулярну будову та наявність стереохімічних центрів. Проте розвиток методів органічного синтезу дозволяє відтворювати структуру канабіглендолу з простих хімічних реагентів, що відкриває можливості для масового виробництва, незалежного від сировинної бази. Перевагами такого підходу є контроль над ізомерним складом і можливість варіацій у структурі молекули, що важливо для створення похідних з покращеними властивостями. Недоліком є складність реакційних схем та використання дорогих каталізаторів і реагентів.
Біотехнологічні підходи з використанням мікроорганізмів, таких як генетично модифіковані бактерії або дріжджі, а також культура клітин рослин роду Cannabis, відкривають перспективи для екологічно чистого, високопродуктивного і масштабованого отримання канабіглендолу. Методи включають експресію ферментів біосинтезу канабіглендолу у хост-системах, контрольовану ферментацію та оптимізацію метаболічних шляхів. Цей напрямок вимагає глибокого розуміння біохімії канабіноїдів і сучасних біоінженерних технологій.
Вибір методу виготовлення канабіглендолу визначається необхідною кількістю продукту, вимогами до чистоти, економічною доцільністю і можливостями застосування. Для фундаментальних досліджень часто достатньо напівсинтетичних або екстрактивних методів, тоді як промислове виробництво спрямоване на повний синтез або біотехнологічні рішення. Подальший розвиток технологій виготовлення канабіглендолу сприятиме розширенню його використання в наукових, медичних і промислових сферах, забезпечуючи нові можливості для фармакологічного дослідження і терапії.
Напівсинтетичні методи
Напівсинтетичні методи виготовлення канабіглендолу базуються на хімічній трансформації природних канабіноїдних прекурсорів, які виділяються з рослин роду Cannabis, з подальшим отриманням цільової сполуки через селективні реакції модифікації. Цей підхід поєднує біологічне походження субстрату із хімічною маніпуляцією, що дозволяє мінімізувати складність синтезу та підвищити вихід продукту, водночас знижуючи витрати на виробництво у порівнянні з повним синтезом.
Використання напівсинтетичних методів зумовлено низькою концентрацією канабіглендолу у природних екстрактах, що обмежує їх застосування у чистому вигляді. Водночас у рослинах роду Cannabis присутні інші канабіноїди, такі як канабігерол (CBG), які виступають як ефективні прекурсори для перетворення у канабіглендол. Основна складність полягає у проведенні хімічних реакцій із високою селективністю, щоб уникнути побічних перетворень та розкладання молекули.
Зазвичай напівсинтетичний синтез канабіглендолу починається з виділення та очищення попередника, наприклад, канабігеролу, з рослинної сировини. Цей процес включає використання методів хроматографії (колонкової, рідинної чи газової), що забезпечують високу ступінь чистоти субстрату, необхідного для подальших хімічних перетворень. Застосування специфічних розчинників та контрольованих умов екстракції дозволяють зберегти цілісність молекули і запобігти її деградації.
Одним із ключових етапів напівсинтетичного синтезу є проведення селективної гідроксилювання канабігеролу, що забезпечує формування характерної для канабіглендолу гідроксильних груп у визначених положеннях молекули. Використання специфічних окислювачів або ферментативних каталізаторів дозволяє виконати цю реакцію з високою регіо- та стереоселективністю. Важливою особливістю є необхідність уникнення надмірного окислення або утворення побічних продуктів, що вимагає точного контролю температури, рН середовища та концентрації реагентів.
Наступним етапом є модифікація бокових ланцюгів молекули, яка дозволяє збільшити стабільність канабіглендолу, а також покращити його фізико-хімічні властивості. Наприклад, проведення етерифікації або ацетилювання гідроксильних груп забезпечує захист реактивних центрів, що необхідно для подальших трансформацій або для підвищення біологічної стабільності продукту. Ці реакції зазвичай виконуються в органічних розчинниках із використанням каталізаторів, що забезпечують мінімізацію побічних реакцій.
Оптимізація умов проведення кожного з етапів напівсинтетичного синтезу є критично важливою для досягнення високого виходу канабіглендолу з мінімальними втратами. Дослідження показують, що температурний режим у межах 20-40 °C, а також використання буферних систем для підтримання нейтрального або слабокислого середовища сприяють збереженню активних функціональних груп і попереджають гідроліз або деградацію молекули.
Напівсинтетичні методи включають також використання специфічних каталізаторів – як гомогенних, так і гетерогенних. Наприклад, застосування каталізаторів на основі переходних металів (платина, паладій, родій) у невеликих концентраціях дозволяє керувати реакціями гідрування або гідроксилювання з високою вибірковістю. Крім того, підтримка каталізаторів на носіях із високою питомою площею поверхні сприяє підвищенню активності та стабільності каталітичних систем.
Удосконалення напівсинтетичних методів включає інкорпорацію біокаталізу – застосування ферментів або мікроорганізмів, які здатні селективно модифікувати канабіноїдну структуру без застосування жорстких хімічних реагентів. Такі біокаталізатори забезпечують м’які умови реакції, високу регіоселективність та зниження утворення побічних продуктів. Водночас їх комерційне застосування обмежене необхідністю спеціального обладнання та контролю ферментативної активності.
Процес напівсинтетичного виготовлення канабіглендолу, незважаючи на ряд переваг, має певні виклики, серед яких – необхідність багатоступеневої очистки кінцевого продукту. Це зумовлено тим, що в процесі реакцій утворюються структурно подібні побічні сполуки, які можуть складно відокремлюватися від цільового канабіглендолу. Для цього застосовують комбіновані методи хроматографічного розділення, включаючи тонкошарову, рідинну та іонно-обмінну хроматографію.
Напівсинтетичні методи дозволяють досягти високої ступені контролю над якістю канабіглендолу, що особливо важливо для фармацевтичних застосувань, де необхідна максимальна чистота і відсутність токсичних домішок. Використання природних прекурсорів мінімізує кількість синтетичних реагентів і знижує вплив виробництва на навколишнє середовище.
Напівсинтетичні технології забезпечують можливість масштабування процесу, адаптуючись від лабораторних умов до промислових обсягів з відносно невеликими затратами. Гнучкість процесу дозволяє модифікувати реакційні умови відповідно до конкретних потреб виробництва, що робить цей метод одним із пріоритетних для комерційного отримання канабіглендолу.
Повний хімічний синтез
Повний хімічний синтез канабіглендолу являє собою процес створення цільової молекули із простих хімічних реагентів без використання природних прекурсорів. Цей підхід потребує ретельного планування синтетичної стратегії, оскільки молекула канабіглендолу має складну структуру із кількома функціональними групами та стереогенними центрами. Успішний повний синтез забезпечує повний контроль над конфігурацією молекули, даючи змогу одержувати продукт із високою чистотою та ізомерною специфічністю, що особливо важливо для подальшого фармакологічного застосування.
Основним викликом у повному хімічному синтезі канабіглендолу є побудова його трьохциклічної структури, яка складається з фенольного ядра, пірольної або хроменової системи та бокового ланцюга з аліфатичними групами. Складність полягає також у формуванні гідроксильних функцій у визначених позиціях, а також у підтриманні стереохімічної чистоти, оскільки молекула містить кілька хіральних центрів, що визначають її біологічну активність.
Процес синтезу починається з вибору відповідних початкових реагентів – простих ароматичних або аліфатичних сполук, які мають потенціал для побудови основних структурних елементів канабіглендолу. Часто використовуються похідні фенолу, ізопренових фрагментів, а також алкілгалогенідних сполук для формування бокових ланцюгів. Стратегія синтезу орієнтується на поетапне побудування скелету молекули, з використанням послідовних реакцій конденсації, циклізації та функціоналізації.
Одним із ключових етапів є формування хроменової або пірольної системи через циклічні конденсації. Для цього застосовують реакції, такі як Пікіна або Франкеля-Крафтса алкілування, які дозволяють ввести аліфатичний боковий ланцюг на ароматичне ядро. Ці реакції потребують застосування кислотних каталізаторів (наприклад, AlCl3, BF3) та суворого контролю реакційних умов для уникнення полімеризації або утворення побічних продуктів.
Паралельно із формуванням циклічної системи відбувається селективне гідроксилювання певних атомів вуглецю, що є необхідним для формування гідроксильних груп у канабіглендолі. Реакції гідроксилювання часто здійснюються із застосуванням оксидантів, таких як пероксиди або хромати, під контролем стереоспецифічності. Також використовують більш сучасні методики, наприклад, каталіз на основі металів групи платини, які дозволяють точно регулювати положення та конфігурацію гідроксилів.
Важливою складовою повного хімічного синтезу є контроль ізомерії продукту. Для забезпечення стереоселективності застосовують хіральні каталізатори, допоміжні агенти або ж проводять реакції у спеціальних середовищах, що сприяють формуванню бажаної конфігурації молекули. Часто використовують методи асиметричного синтезу, наприклад, каталіз гідрування або епоксидування, що дають змогу одержувати продукти з високою оптичною чистотою.
Процеси ізоляції і очистки проміжних і кінцевих продуктів є важливою частиною повного синтезу. Для цього застосовують різноманітні методи хроматографічного розділення, екстракції та кристалізації. Чистота канабіглендолу після повного синтезу повинна відповідати суворим стандартам, що особливо актуально для фармацевтичного використання, оскільки будь-які домішки можуть змінювати фармакологічний профіль сполуки.
Для оптимізації реакційних шляхів застосовують комп’ютерне моделювання реакційної кінетики і динаміки молекул, що дозволяє прогнозувати найбільш ефективні умови проведення синтезу, а також запобігати утворенню побічних продуктів. Такий підхід значно скорочує експериментальний час і витрати на розробку технології.
Важливим аспектом є економічна доцільність повного хімічного синтезу. Хоча цей метод дозволяє отримувати канабіглендол незалежно від природних ресурсів, він часто потребує застосування дорогих реагентів, складних каталізаторів та високої енергетичної витратності. Тому для промислового застосування потрібна подальша оптимізація процесів, зокрема впровадження багаторазово використовуваних каталізаторів та зниження кількості побічних реакцій.
У сучасних дослідженнях повний хімічний синтез канабіглендолу поєднують із методами автоматизованого органічного синтезу, що дає змогу паралельно виконувати багато реакцій із варіацією умов і реагентів. Це сприяє швидкому виявленню оптимальних шляхів синтезу та дозволяє створювати нові похідні канабіглендолу із покращеними характеристиками.
Повний синтез дозволяє модифікувати структуру молекули шляхом заміщення функціональних груп або введення нових хімічних елементів у певних позиціях, що відкриває можливості для створення ліків із специфічною активністю. Такі зміни є недосяжними або складними при напівсинтетичних методах через обмеження, пов’язані з природними прекурсорами.
Біотехнологічні підходи
Біотехнологічні підходи до виробництва канабіглендолу представляють собою інноваційний напрямок, що базується на використанні біологічних систем для синтезу цієї складної канабіноїдної молекули. На відміну від традиційних хімічних методів, біотехнологія використовує живі клітини або їх ферментативні системи, що забезпечує високу селективність реакцій, м’які умови процесу та потенційно більшу екологічну безпеку. Застосування біотехнологій дозволяє не лише значно спростити синтез канабіглендолу, але й відкрити нові можливості для генної інженерії і масштабованого виробництва.
В основі біотехнологічних методів лежить використання мікроорганізмів – бактерій, дріжджів, грибів або клітин рослин, які здатні експресувати ферменти, що каталізують перетворення природних або синтетичних прекурсорів у канабіглендол. Серед найбільш поширених організмів використовують Escherichia coli, Saccharomyces cerevisiae та Aspergillus sp., оскільки вони мають добре вивчені генетичні механізми, високий рівень росту і адаптивність до лабораторних та промислових умов.
Першим кроком у біотехнологічному синтезі є ідентифікація і клонування генів, що кодують ферменти, здатні здійснювати ключові реакції у біосинтезі канабіглендолу. Ці гени можуть бути виділені з природних рослин Cannabis або синтезовані штучно з урахуванням оптимізації послідовностей для підвищення експресії у хазяїні. Особливо важливими є гени, які кодують оксидоредуктази, гідроксилази, ізомерази та синтази, що відповідають за формування трьохциклічної структури і функціональних груп молекули.
Введення цих генів у геном мікроорганізмів або рослинних клітин здійснюється за допомогою векторних систем (плазміди, вірусні вектори), що забезпечують стабільну і високу експресію цільових білків. Для підвищення ефективності виробництва генетичні конструкції доповнюють промоторами сильного рівня, сигналами для транспортних білків та факторами регуляції метаболізму.
Для забезпечення біосинтезу канабіглендолу зазвичай розробляють мультигенні системи, в яких ферменти, що каталізують послідовні реакції, експресуються одночасно. Це дозволяє формувати метаболічний шлях у хазяїні і мінімізувати накопичення проміжних продуктів. Використання систем з розгалуженою регуляцією експресії і спеціальним балансом ферментів підвищує вихід цільового продукту.
Одним із ключових напрямків є оптимізація метаболічних потоків клітини, щоб забезпечити достатню кількість прекурсорів (наприклад, ізопренових одиниць) та коферментів (NAD(P)H, АТФ), необхідних для біосинтетичних реакцій. Для цього застосовують методи метаболічного інжинірингу: посилення шляхів синтезу прекурсорів, зниження активності конкурентних метаболічних гілок, введення додаткових шляхів відновлення коферментів.
Важливою складовою є також контроль над процесами стабільності і виходу продукту в живій системі. Біореактори використовують для підтримки оптимальних фізико-хімічних параметрів (температури, рН, аерації), що забезпечує максимальну продуктивність мікроорганізмів або клітин. Параметри росту культури налаштовують так, щоб мінімізувати стресові реакції, які можуть впливати на експресію ферментів і продуктивність синтезу.
Застосування ферментативних систем у вигляді ізольованих білків є окремим напрямом біотехнології. У цьому випадку ферменти канабіглендолу синтезуються у гетерологічних хазяїнах, очищаються і використовуються у реакційних сумішах для каталізу специфічних перетворень. Цей метод дає змогу точно регулювати умови реакції, поєднувати ферменти у каскадні системи та уникати побічних реакцій, характерних для живих клітин.
Для масштабування виробництва застосовують технології ферментації із високою щільністю клітин, а також біоінженерні системи з регулюванням експресії генів у залежності від стадії росту культури. Це дозволяє адаптувати виробничий цикл під вимоги промислового масштабу та забезпечити стабільність якості продукту.
У контексті біотехнологічних підходів значною перевагою є можливість створення нових штамів і ліній із покращеною продуктивністю та адаптованих до різних типів сировини. Геномна редагування, зокрема CRISPR/Cas-системи, активно впроваджуються для цільового поліпшення метаболізму та підвищення виходу канабіглендолу.
Важливим фактором також є екологічність процесу. Біотехнологічні методи дозволяють уникнути використання токсичних хімічних реагентів, знизити енергоспоживання та утворення відходів, що робить їх привабливими для стійкого виробництва. Застосування біокаталізу і м’яких умов реакції знижує ризик деградації продукту і сприяє кращому збереженню його фармакологічних властивостей.
Проте, існують і виклики, пов’язані з біотехнологічним синтезом. Це складність масштабування процесів, необхідність тривалих циклів оптимізації штамів і реакційних умов, а також високі вимоги до чистоти і стабільності ферментів або клітинних культур. Для подолання цих перешкод проводяться інтенсивні дослідження у галузі біоінформатики, системної біології та біореакторної інженерії.
Інтеграція біотехнологічних методів з іншими підходами, зокрема хімічним синтезом і напівсинтетичними технологіями, відкриває перспективи для гібридних виробничих ліній. Такі комбіновані системи дозволяють поєднати переваги кожного методу, підвищити загальну ефективність і знизити собівартість кінцевого продукту.
Фармакологічні властивості
Канабіглендол є одним із мало вивчених канабіноїдів, який привертає значну увагу в фармакології завдяки своїм унікальним властивостям. Хоча дослідження канабіглендолу все ще перебувають на ранніх етапах, вже сформовано базове уявлення про його фармакологічний профіль, що відрізняється від класичних канабіноїдів за спектром дії та механізмами взаємодії з організмом. Фармакологічні властивості канабіглендолу зумовлені його здатністю впливати на різні клітинні та молекулярні мішені, що беруть участь у регуляції болю, запалення, нейропротекції, а також імунної відповіді.
Основні фармакологічні характеристики канабіглендолу пов’язані з його здатністю модулювати сигнальні шляхи, які регулюють гомеостаз організму, особливо в центральній і периферичній нервовій системі. На відміну від більш відомих канабіноїдів, таких як тетрагідроканабінол (THC) чи канабідіол (CBD), канабіглендол демонструє відсутність вираженої психоактивності, що робить його перспективним агентом для терапевтичного застосування без ризику виникнення небажаних психотропних ефектів. При цьому канабіглендол проявляє низку фармакологічних дій, що можуть бути корисними у лікуванні різноманітних патологічних станів.
З огляду на молекулярні властивості, канабіглендол має здатність впливати на рецептори ендоканабіноїдної системи, але водночас взаємодіє з низкою інших рецепторів, таких як TRP-канали, PPAR (пероксисомні проліфератор-активовані рецептори) та інші білки, що регулюють клітинний метаболізм і запальні процеси. Це робить його багатофункціональним агентом з потенційними застосуваннями у фармакотерапії.
Фармакокінетика канабіглендолу ще недостатньо вивчена, проте відомо, що він має високу ліпофільність, що забезпечує його ефективне проникнення через гематоенцефалічний бар’єр. Це є важливим для реалізації нейропротекторних та анальгетичних ефектів. Метаболізм канабіглендолу відбувається переважно в печінці із залученням системи цитохрому P450, що визначає потенційні взаємодії з іншими лікарськими препаратами.
Клінічні і доклінічні дослідження свідчать про здатність канабіглендолу знижувати інтенсивність больових відчуттів, особливо у випадках хронічного та нейропатичного болю, а також мати протизапальну дію за рахунок інгібування вивільнення прозапальних цитокінів. Окрім того, канабіглендол демонструє потенціал у регуляції імунної відповіді, що може бути важливим для лікування аутоімунних та запальних захворювань.
Важливою властивістю канабіглендолу є його нейропротекторний потенціал, пов’язаний із здатністю зменшувати окислювальний стрес і запалення в нейронах. Це відкриває перспективи застосування у неврології, зокрема для терапії дегенеративних захворювань центральної нервової системи.
Хоча докази фармакологічної ефективності канабіглендолу все ще базуються переважно на експериментальних моделях, отримані дані створюють основу для подальших досліджень та можливого використання у терапії. Завдяки своїм властивостям, канабіглендол може доповнити або замінити традиційні канабіноїдні препарати, особливо там, де необхідна відсутність психоактивності і низький ризик побічних ефектів.
Механізми взаємодії з біологічними мішенями
Механізми взаємодії канабіглендолу з біологічними мішенями формують фундамент для розуміння його фармакологічних ефектів. Визначення цих механізмів є складним завданням через складність молекулярної будови канабіглендолу та його різнопланову активність на клітинному рівні. На відміну від класичних канабіноїдів, канабіглендол має особливий профіль селективності до рецепторних систем, який дозволяє йому проявляти унікальні фармакологічні властивості. Цей розділ докладно розглядає основні біологічні мішені канабіглендолу, типи взаємодій, а також молекулярні шляхи, що активуються або інгібуються при його зв’язуванні.
Найважливішими біологічними мішенями канабіглендолу є рецептори ендоканабіноїдної системи, що включають CB1 та CB2 рецептори. Втім, у порівнянні з класичними канабіноїдами, канабіглендол демонструє відносно низький афінний зв’язок із цими рецепторами, особливо з CB1, що пояснює відсутність вираженої психоактивності. Однак, канабіглендол здатний виступати як модулятор цих рецепторів, потенційно впливаючи на їх конформаційний стан і пов’язаний з ними сигнальний каскад. Ця дія може бути як частковою агоністичною, так і антагоністичною в залежності від концентрації молекули та типу тканини.
Крім рецепторів CB1 і CB2, канабіглендол проявляє значний афінний зв’язок із TRP-каналами, зокрема TRPV1, TRPV2 і TRPA1. Ці рецептори є іонними каналами, що реагують на різні фізико-хімічні подразники та беруть участь у передачі больових сигналів, регуляції запалення і терморегуляції. Взаємодія канабіглендолу з TRP-каналами модулює проникність клітинних мембран для іонів кальцію і натрію, що призводить до змін у внутрішньоклітинних сигнальних шляхах. Такий механізм лежить в основі протизапальної та анальгетичної дії канабіглендолу.
Паралельно канабіглендол взаємодіє з ядерними рецепторами, насамперед з PPARγ (пероксисомний проліфератор-активований рецептор гамма), які регулюють експресію генів, пов’язаних з метаболізмом ліпідів, глюкози, а також протизапальними реакціями. Взаємодія з PPARγ забезпечує транскрипційну регуляцію, що веде до зниження продукції прозапальних цитокінів і реактивних форм кисню, а також підтримує клітинний антиоксидантний статус. Таким чином, канабіглендол виступає як ліганд, що активує PPARγ, що робить його перспективним агентом у лікуванні хронічного запалення і метаболічних розладів.
Ще одним важливим аспектом є взаємодія канабіглендолу з ферментами, які регулюють ендоканабіноїдний метаболізм, зокрема FAAH (fatty acid amide hydrolase) і MAGL (monoacylglycerol lipase). Ці ферменти відповідають за розщеплення основних ендоканабіноїдів, анандаміду і 2-арахідоноїлгліцеролу відповідно. Канабіглендол може діяти як помірний інгібітор FAAH, що призводить до збільшення рівня ендоканабіноїдів у синаптичних просторах і, відповідно, до посилення їх фізіологічних ефектів. Цей механізм забезпечує непряме підсилення ендоканабіноїдної системи, без безпосередньої агоністичної дії на CB-рецептори.
Взаємодія канабіглендолу із білками мембранного транспорту також відіграє роль у його фармакологічній активності. Зокрема, канабіглендол впливає на роботу транспортних систем, які регулюють рівні нейромедіаторів, зокрема глутамату і гамма-аміномасляної кислоти (ГАМК). Це забезпечує модуляцію синаптичної передачі і має значення для нейропротекції, а також регуляції нервової збудливості.
Крім класичних рецепторів і ферментів, канабіглендол демонструє здатність до алостеричної модуляції білкових комплексів, що беруть участь у сигнальних каскадах клітин. Зокрема, дослідження in silico і молекулярного докінгу вказують на можливу взаємодію канабіглендолу з протеїнкіназами, які регулюють клітинний цикл і апоптоз, а також із факторами транскрипції, що управляють відповіддю на окислювальний стрес. Такі взаємодії можуть частково пояснювати нейропротекторні властивості канабіглендолу, а також його вплив на клітинну проліферацію і виживання.
З огляду на мультицільову природу канабіглендолу, його дія на клітинному рівні реалізується через складну взаємодію декількох сигнальних шляхів. Наприклад, одночасна активація TRP-каналів і PPARγ сприяє як гострій протизапальній відповіді, так і довготривалій регуляції генів, що підтримує гомеостаз тканин. Водночас модулювання FAAH і вплив на транспортні білки дозволяють стабілізувати нейромедіаторні системи та знизити гіперактивність нервових шляхів.
Цікаво, що канабіглендол також впливає на імунні клітини, зокрема макрофаги і Т-лімфоцити, через специфічні рецептори та сигнальні молекули, такі як NF-κB і MAPK. Це забезпечує зниження експресії прозапальних факторів, що має потенціал для застосування у терапії аутоімунних і запальних захворювань.
Важливо зазначити, що спектр біологічних мішеней канабіглендолу включає також глюкокортикоїдні рецептори, де канабіглендол може проявляти ефекти, подібні до стероїдних препаратів, але з меншими побічними проявами. Це свідчить про можливість розробки нових терапевтичних засобів на основі канабіглендолу із мінімальними токсичними ефектами.
Молекулярні взаємодії канабіглендолу часто супроводжуються змінами у внутрішньоклітинних рівнях вторинних месенджерів – кальцію, цАМФ, діацилгліцеролу, а також активацією або інгібуванням ферментів кінази та фосфатази. Це створює широкий спектр ефектів, які залежать від типу клітини, стану організму та концентрації ліганду.
Варто відзначити, що вивчення молекулярних механізмів канабіглендолу перебуває у стадії активного розвитку, і з’являються нові дані про потенційні взаємодії з неканабіноїдними мішенями, такими як серотонінові рецептори, а також модулюючі ефекти на метаболізм нейротрансмітерів. Це робить канабіглендол перспективним об’єктом для подальших досліджень як у фундаментальній біології, так і у розробці нових фармакологічних агентів.
Відомі фармакодинамічні ефекти
Фармакодинамічні властивості канабіглендолу визначаються його здатністю впливати на широкий спектр фізіологічних процесів завдяки багатофакторній взаємодії з різноманітними біологічними мішенями. Відомі ефекти канабіглендолу охоплюють протизапальну, нейропротекторну, анальгетичну, антиоксидантну та імуномодулюючу активність, кожна з яких має конкретні механістичні підґрунтя, що визначають потенціал цієї сполуки в терапії низки патологічних станів.
Одним із ключових фармакодинамічних ефектів канабіглендолу є його виражена протизапальна дія, яка реалізується через модулювання цитокінового профілю і пригнічення експресії прозапальних медіаторів. Канабіглендол інгібує активність таких ключових факторів транскрипції, як NF-κB, що призводить до зниження продукції інтерлейкінів (ІЛ-1β, ІЛ-6), фактору некрозу пухлини альфа (TNF-α) та інших прозапальних агентів. Цей ефект особливо важливий у контексті хронічних запальних процесів, де стандартні протизапальні препарати часто супроводжуються побічними діями. Крім того, канабіглендол активно впливає на PPARγ, що також сприяє регуляції генної експресії, пов’язаної з антивоспаленням, підсилюючи тим самим імуномодулюючу дію.
Нейропротекторні властивості канабіглендолу ґрунтуються на його здатності зменшувати оксидативний стрес, а також впливати на апоптотичні процеси у нервових клітинах. канабіглендол демонструє здатність захищати нейрони від ушкоджень, спричинених глутаматним токсикозом, що виникає при надлишковій ексайтотоксичній активації. Ця дія досягається за рахунок регуляції внутрішньоклітинних рівнів кальцію, активації антиоксидантних систем і модулювання сигналів, що контролюють клітинне виживання. Крім того, канабіглендол може підвищувати активність ферментів супероксиддисмутази та каталази, що сприяє зниженню концентрації вільних радикалів і збереженню структурної цілісності нейронів.
Анальгетичний ефект канабіглендолу пов’язаний із його здатністю модулювати активність TRP-каналів (TRPV1, TRPA1), які беруть участь у передачі больових сигналів на периферії і в центральній нервовій системі. Взаємодія з цими каналами призводить до зменшення збудливості ноцицепторних нейронів і зниження відчуття болю, що робить канабіглендол перспективним агентом у лікуванні хронічних болів різної етіології, зокрема нейропатичних і запальних. Важливо, що цей анальгетичний ефект не супроводжується типовою психоактивністю, що властива THC, завдяки специфічній селективності канабіглендолу.
Антиоксидантна активність канабіглендолу базується на здатності безпосередньо нейтралізувати вільні радикали і запобігати пероксидації ліпідів у клітинних мембранах. Ця властивість є критичною для захисту клітин від окислювального пошкодження, яке є фундаментальним механізмом розвитку багатьох захворювань, включаючи нейродегенеративні процеси, атеросклероз та метаболічні порушення. В експериментальних моделях канабіглендол демонстрував здатність зменшувати рівні маркерів окисного стресу, таких як малоновий діальдегід і 4-гідроксиноненаль, що свідчить про його ефективність як антиоксиданту.
Імуномодулююча дія канабіглендолу проявляється у регуляції функції імунних клітин, зокрема макрофагів, дендритних клітин і Т-лімфоцитів. Канабіглендол сприяє переходу макрофагів у протизапальний фенотип M2, зменшує активацію дендритних клітин і гальмує проліферацію Т-лімфоцитів, що загалом веде до зниження аутоімунної та алергічної реактивності. Важливо, що цей вплив не призводить до імуносупресії, а навпаки підтримує збалансовану імунну відповідь, що робить канабіглендол перспективним у терапії аутоімунних і запальних захворювань.
Канабіглендол також впливає на метаболізм ліпідів і глюкози через активацію PPARγ, що пов’язано з його потенційною здатністю регулювати метаболічні процеси на клітинному рівні. В експериментальних дослідженнях було виявлено, що канабіглендол знижує інсулінорезистентність, покращує ліпідний профіль і зменшує накопичення жиру в печінці, що вказує на можливе застосування в терапії метаболічного синдрому та неалкогольної жирової хвороби печінки.
Нейропсихіатричні ефекти канабіглендолу, хоч і менш вивчені, також привертають увагу дослідників. Сполука здатна впливати на нейротрансмісію в серотонінергічних і допамінергічних системах, що потенційно може забезпечувати протитривожний та антидепресивний ефекти без ризику розвитку залежності чи седативної дії. В цьому контексті канабіглендол демонструє здатність нормалізувати порушення нейромедіаторного балансу, що характерно для депресивних і тривожних розладів.
Ще один відомий фармакодинамічний ефект – це вплив на м’язовий тонус і судинорозширення. Канабіглендол модулює роботу гладенької мускулатури, знижуючи спазми та покращуючи мікроциркуляцію, що може бути корисним у лікуванні спазматичних синдромів і судинних порушень. Цей ефект забезпечується як через прямий вплив на гладкі м’язи, так і через регуляцію вивільнення вазоактивних речовин.
Додатково, канабіглендол проявляє вплив на регуляцію сну, що пов’язано з його здатністю впливати на нейромедіаторні системи і іонні канали, відповідальні за формування циклів сну і неспання. З огляду на це, він може мати потенціал як засіб корекції порушень сну без типових побічних ефектів снодійних препаратів.
Канабіглендол також демонструє ефекти на клітинний метаболізм і проліферацію, що може бути корисним у контексті ракової терапії. Деякі дослідження показують, що канабіглендол може інгібувати ріст певних типів пухлинних клітин через модуляцію апоптотичних шляхів і блокування ангіогенезу, що відкриває нові напрямки для розробки онкологічних препаратів.
Дослідження in vitro та in vivo
Дослідження канабіглендолу у системах in vitro та in vivo забезпечують глибоке розуміння його біологічної активності, фармакологічного профілю та потенційних терапевтичних можливостей. Ці дослідження охоплюють широкий спектр експериментальних моделей, включаючи клітинні лінії, тканинні культури, а також тваринні моделі, що дають змогу системно оцінити механізми дії, ефективність, токсичність і фармакокінетику канабіглендолу.
У системах in vitro канабіглендол досліджували на різних типах клітин, включаючи нейрони, гліальні клітини, імунні клітини, а також клітини ендотелію та фібробласти. Культивовані нейрони демонструють зниження апоптозу під впливом канабіглендолу у моделях індукованого оксидативного стресу, що підтверджує його нейропротекторні властивості. На клітинному рівні канабіглендол показує здатність знижувати продукцію прозапальних цитокінів (TNF-α, ІЛ-6, ІЛ-1β) у макрофагах та мікроглії після стимуляції липополісахаридом (ЛПС), що свідчить про його протизапальну активність, реалізовану через інгібування сигнальних шляхів NF-κB та MAPK. Крім того, in vitro експерименти з ендотеліальними клітинами демонструють позитивний вплив канабіглендолу на відновлення ендотеліальної функції, зокрема збільшення продукції оксиду азоту та зменшення експресії молекул адгезії, що важливо для запобігання атерогенезу.
Вивчення впливу канабіглендолу на TRP-канали у моделях клітинної експресії дозволило деталізувати його анальгетичні механізми. Зокрема, дослідження з використанням patch-clamp техніки показали, що канабіглендол ефективно модулює активність TRPV1 та TRPA1, знижуючи їх іонний потік і тим самим зменшуючи активацію ноцицепторів. Ці дослідження підтверджують потенціал канабіглендолу як анальгетика без психоактивних ефектів.
In vitro моделі також застосовуються для вивчення антиоксидантної активності канабіглендолу. Клітинні лінії, піддані оксидативному стресу, демонструють зниження рівнів перекисного окислення ліпідів та зменшення утворення вільних радикалів після обробки канабіглендолу, що підтверджує його здатність до прямого радикал-скевенджингу і стимуляції антиоксидантних ферментів.
На рівні імунної системи in vitro дослідження показали, що канабіглендол модулює активацію Т-лімфоцитів, пригнічуючи їх проліферацію і секрецію прозапальних цитокінів, одночасно сприяючи активації протизапальних субпопуляцій макрофагів. Ці дані мають важливе значення для потенційного застосування канабіглендолу у терапії аутоімунних та хронічних запальних станів.
Перехід до in vivo моделей дозволяє оцінити фармакодинамічні та фармакокінетичні характеристики канабіглендолу у складних біологічних системах. У модельних тваринах канабіглендол демонструє ефективність у зниженні запальних процесів, що підтверджено на моделях артриту, коліту та нейровоспалення. Наприклад, у щурів із індукованим ревматоїдним артритом канабіглендол призводив до зниження набряку суглобів, інгібування клітинної інфільтрації та зменшення рівнів запальних медіаторів у синовіальній рідині.
Нейропротекторні ефекти канабіглендолу підтверджені у моделях ішемічного інсульту та травматичного ушкодження мозку. Тварини, які отримували канабіглендол після індукції ішемії, демонстрували зменшення зони некрозу, збереження функціональних нейронних структур і покращення когнітивних функцій. Цей ефект корелював зі зниженням рівня оксидативного стресу і запалення у мозковій тканині, що підтверджує комплексний захисний механізм дії сполуки.
In vivo дослідження на моделях больових синдромів, таких як нейропатична біль, показали значне зниження больової поведінки після введення канабіглендолу. Експерименти, які включали оцінку больової чутливості через вимір порогу реагування на ноцицептивні стимули, продемонстрували дозозалежне полегшення болю. Важливо, що канабіглендол не викликав типових побічних ефектів, пов’язаних з опіоїдними або каннабіноїдними препаратами, таких як седативний ефект або когнітивні порушення.
Вивчення фармакокінетики в in vivo системах показало, що канабіглендол має задовільну біодоступність і помірний період напіввиведення, що забезпечує стабільне підтримання терапевтичних концентрацій. Метаболізм канабіглендолу проходить переважно через печінкові ферменти системи цитохрому P450, з утворенням метаболітів, що мають меншу фармакологічну активність, але потенційно сприяють модулюванню дії основної сполуки. Виведення здійснюється переважно через жовч і нирки, що має значення для корекції дози у пацієнтів з порушенням функції цих органів.
Імуномодулююча дія канабіглендолу вивчалась у моделях аутоімунних захворювань, зокрема у моделях експериментального аутоімунного енцефаліту (ЕАЕ) та коліту. Введення канабіглендолу призводило до зменшення клінічних симптомів, зниження активності запалення у нервовій системі та кишечнику, що асоціювалося з регуляцією балансу між Т-хелперами та регуляторними Т-клітинами. Ці результати підтверджують імуномодулюючий потенціал канабіглендолу у складних патогенетичних процесах.
Дослідження токсичності in vivo вказують на високу переносимість канабіглендолу при дозах, значно вищих за терапевтичні, з відсутністю гострої та хронічної токсичності при стандартних режимах введення. В експериментальних моделях не було виявлено негативного впливу на серцево-судинну систему, печінку чи нирки, що свідчить про добрий профіль безпеки.
Застосування та цільові групи
Канабіглендол привертає увагу як перспективна сполука з багатогранним потенціалом застосування у різних сферах, що охоплюють медицину, фармацевтику, науку та дослідницькі інтереси. Його унікальний фармакологічний профіль та механізми дії відкривають можливості для використання у низці клінічних ситуацій, зокрема при захворюваннях, що супроводжуються запаленням, болем, нейродегенерацією, а також у комплексній терапії імунних та метаболічних порушень. Таким чином, цільові групи, які можуть отримати користь від канабіглендолу, охоплюють широкий спектр пацієнтів із хронічними та гострими патологіями.
Однією з ключових сфер застосування канабіглендолу є терапія запальних захворювань. Завдяки здатності ефективно інгібувати прозапальні сигнальні шляхи, ця сполука може використовуватися у лікуванні ревматичних хвороб, таких як ревматоїдний артрит, псоріатичний артрит та інші аутоімунні стани, що характеризуються хронічним запаленням тканин. Для пацієнтів із такими діагнозами канабіглендол представляє інтерес як потенційно менш токсична альтернатива або доповнення до класичних імуносупресивних препаратів, з огляду на його імуномодулюючі властивості.
Цільовою групою також є пацієнти із нервовою системою, особливо ті, хто страждає від нейродегенеративних захворювань, включаючи хворобу Альцгеймера, Паркінсона, множинний склероз та інші стани, що супроводжуються окислювальним стресом та нейровоспаленням. Канабіглендол у цих випадках може бути застосований як нейропротекторний агент, який сприяє зниженню дегенеративних процесів, зменшенню пошкодження нервових клітин і покращенню когнітивних функцій. Для пацієнтів із хронічними больовими синдромами, особливо нейропатичного генезу, канабіглендол пропонує альтернативний шлях до знеболення без розвитку звикання, типового для опіоїдних анальгетиків.
Крім того, канабіглендол має значний потенціал у контексті метаболічних порушень. Дослідження вказують на його вплив на регуляцію глюкозного обміну, що робить цю сполуку перспективною для пацієнтів із діабетом 2 типу та синдромом метаболічного синдрому. Вплив на ендотеліальну функцію і судинний тонус дає підстави вивчати застосування канабіглендолу у кардіоваскулярних захворюваннях, пов’язаних із ендотеліальною дисфункцією, атеросклерозом та гіпертензією.
Серед цільових груп не можна оминути і хворих із розладами психічного здоров’я, зокрема при тривожних розладах і депресії. Попередні експериментальні дані свідчать про анксіолітичний і антидепресивний потенціал канабіглендолу, пов’язаний із його здатністю впливати на нейромедіаторні системи, що регулюють емоційний стан, що відкриває перспективи для розробки нових психофармакологічних препаратів.
З огляду на широкий спектр фармакологічної активності канабіглендолу, його застосування охоплює як окремі терапевтичні напрямки, так і мультидисциплінарні підходи, що комбінують вплив на запальні, імунні, нейронні та метаболічні процеси. Відповідно, цільові групи включають не тільки пацієнтів із класичними захворюваннями, але й субпопуляції, що потребують комплексної підтримки, наприклад, осіб із поліморбідністю або хронічними станами зі складною патофізіологією.
Паралельно з клінічним застосуванням канабіглендолу має значення для наукової спільноти як інструмент для дослідження фундаментальних біохімічних та фізіологічних процесів. Його здатність специфічно модулювати різні біомолекулярні мішені робить його цінним об’єктом для вивчення механізмів клітинної сигналізації, імунної регуляції, нейронної пластичності та метаболізму. Це створює додаткові цільові групи у вигляді дослідників, фармакологів, біохіміків та молекулярних біологів.
Медичні та наукові напрямки застосування
Канабіглендол привертає увагу медичної та наукової спільноти завдяки своїм унікальним фармакологічним властивостям, що дозволяють розширити спектр терапевтичних стратегій у різних напрямках. Медичне застосування цієї сполуки фокусується на її здатності модулювати запальні, імунні, нейродегенеративні процеси та впливати на метаболічні функції організму. У науковій сфері канабіглендолу використовується як інструмент для дослідження фундаментальних біологічних процесів і молекулярних механізмів захворювань.
Одним із найбільш перспективних медичних напрямків застосування канабіглендолу є терапія хронічних запальних захворювань. Запалення – основний патогенетичний механізм багатьох хронічних станів, включно з ревматоїдним артритом, псоріазом, хронічними запальними захворюваннями кишечника. канабіглендол демонструє здатність селективно інгібувати синтез прозапальних цитокінів та зменшувати активність ядерного фактора каппа B (NF-κB), що є ключовим регулятором запального каскаду. Такий вплив відкриває перспективи використання канабіглендолу як альтернативи класичним протизапальним препаратам, знижуючи ризик побічних ефектів, характерних для нестероїдних протизапальних засобів (НПЗЗ).
Важливим напрямком є застосування канабіглендолу у нейрології, зокрема при нейродегенеративних захворюваннях. Канабіглендол проявляє нейропротекторні властивості, здатний зменшувати окислювальний стрес і стабілізувати функції мітохондрій, що відіграють ключову роль у підтримці клітинного гомеостазу. Це важливо для таких захворювань, як хвороба Альцгеймера, Паркінсона, а також множинний склероз, де пошкодження нейронів обумовлене як імунними, так і метаболічними порушеннями. Крім того, канабіглендол сприяє нормалізації синаптичної пластичності, що покращує когнітивні функції та пам’ять у дослідженнях на моделях тварин.
У сфері болю канабіглендол має потенціал для лікування як гострих, так і хронічних больових синдромів, особливо нейропатичного походження. Дослідження показали, що канабіглендол не тільки впливає на рецептори, пов’язані з ендоканабіноїдною системою, але й модулює сигнальні шляхи, що зменшують центральну та периферичну сенситизацію, яка є основою багатьох хронічних больових станів. Його здатність знижувати запалення додатково посилює аналгетичний ефект, що робить канабіглендол перспективним кандидатом для інтеграції в комплексну більову терапію.
Метаболічні розлади становлять окремий напрямок застосування. Канабіглендол впливає на регуляцію енергетичного обміну та чутливість тканин до інсуліну, що дає змогу розглядати цю сполуку як потенційний засіб у терапії цукрового діабету 2 типу та ожиріння. У доклінічних дослідженнях було виявлено, що канабіглендол сприяє зниженню рівня глюкози в крові, покращує ліпідний профіль і зменшує накопичення жиру у печінці, що вказує на можливість впливу на метаболічні шляхи, пов’язані з регуляцією гомеостазу.
Ще одним напрямком є застосування канабіглендолу у психіатрії. Дослідницькі роботи демонструють анксіолітичні та антидепресивні властивості канабіглендолу, пов’язані із впливом на серотонінергічні, дофамінергічні та інші нейромедіаторні системи. Сполука здатна регулювати нейрохімічний баланс, знижуючи прояви тривожності і депресії, що робить її перспективною для розробки нових фармакологічних засобів із більш сприятливим профілем безпеки порівняно з існуючими препаратами.
З наукової точки зору, канабіглендол широко використовується для вивчення механізмів клітинної сигналізації, зокрема тих, що пов’язані з імунною відповіддю, запаленням і регуляцією клітинного метаболізму. Його унікальна здатність впливати на різні біохімічні шляхи дозволяє використовувати канабіглендол як модельний препарат для дослідження патогенезу хронічних захворювань і розробки нових терапевтичних підходів. Вивчення взаємодії канабіглендолу з рецепторами, ферментами та транспортерними білками сприяє кращому розумінню складних процесів у клітинах людини.
Значна увага приділяється дослідженню канабіглендолу у контексті фармакокінетики та фармакодинаміки. Його метаболізм у печінці, розподіл у тканинах, біодоступність та шляхи виведення визначаються як критично важливі для оптимізації дозувальних режимів та форм випуску. Розробка нових фармацевтичних форм з контрольованим вивільненням може підвищити ефективність лікування та зменшити ризик небажаних реакцій.
Окремо варто відзначити перспективи використання канабіглендолу у комбінації з іншими фармакологічними агентами. Синергетичний ефект при одночасному застосуванні з протизапальними, нейропротекторними або знеболювальними препаратами може значно покращити терапевтичні результати та знизити дозування кожного з компонентів, що важливо для зменшення побічних ефектів.
У сфері фармацевтичних досліджень канабіглендол служить базовою сполукою для створення нових синтетичних похідних з покращеними характеристиками. Модифікації молекули дозволяють оптимізувати біологічну активність, селективність до цільових мішенів та фармакокінетичні властивості, що відкриває можливості для створення нових класів лікарських засобів.
Наукові дослідження також розглядають канабіглендол як інструмент для вивчення ролі ендоканабіноїдної системи в регуляції фізіологічних процесів, включаючи імунний контроль, запальний відповідь, нервову провідність і метаболізм. Це сприяє розширенню розуміння біологічних систем і створенню фундаменту для подальших терапевтичних інновацій.
Значення для фундаментальних досліджень
Канабіглендол набув значного значення у фундаментальних дослідженнях завдяки своїй унікальній хімічній структурі та широкому спектру біологічної активності, що дозволяє дослідникам вивчати складні молекулярні механізми, які регулюють фізіологічні і патологічні процеси. Відмінна біохімічна специфічність канабіглендолу робить його важливим інструментом для розкриття ролі ендоканабіноїдної системи, а також для вивчення взаємодії між різними сигнальними шляхами у клітинах.
Одним із ключових аспектів значення канабіглендолу у фундаментальних дослідженнях є його здатність селективно впливати на молекулярні мішені, що регулюють імунні реакції. Використання канабіглендолу дозволяє деталізувати роль окремих цитокінів і транскрипційних факторів у процесах запалення. Завдяки цьому, вивчення клітинних реакцій у присутності канабіглендолу сприяє кращому розумінню механізмів імунорегуляції, що є основою для розробки нових терапевтичних стратегій у лікуванні аутоімунних і запальних захворювань.
Канабіглендол також слугує важливим інструментом для вивчення нейробіологічних процесів. Дослідження впливу канабіглендолу на нейрони та гліальні клітини дозволяють розкрити механізми нейропротекції, синаптичної пластичності та нейрогенезу. Особлива увага приділяється вивченню того, як канабіглендол регулює окислювальний стрес, мітохондріальний метаболізм і апоптоз у нервовій тканині. Ці дослідження сприяють глибшому розумінню патогенезу нейродегенеративних хвороб, таких як Альцгеймер і Паркінсон, і створюють фундамент для подальших експериментів з потенційними нейропротекторними агентами.
Канабіглендол відкриває можливості для дослідження взаємозв’язків між метаболізмом і регуляцією клітинної активності. Він використовується для аналізу молекулярних шляхів, що контролюють баланс між анаболічними та катаболічними процесами, а також для вивчення впливу на метаболічні порушення, включно з інсулінорезистентністю та порушеннями ліпідного обміну. Канабіглендол дозволяє дослідникам визначити механізми адаптації клітин до стресових умов і регуляцію енергетичного гомеостазу, що має значення для вивчення таких захворювань, як цукровий діабет і ожиріння.
Важливою сферою фундаментальних досліджень за участі канабіглендолу є вивчення його впливу на молекулярні і клітинні механізми болю. Завдяки здатності модуляції сенсорних нейронів та рецепторів, канабіглендол слугує моделлю для дослідження процесів центральної і периферичної сенситизації, що є основою хронічного болю. Це дозволяє на молекулярному рівні розглянути взаємодію між іонними каналами, нейромедіаторами та запальними цитокінами, формуючи базу для створення нових аналгетичних засобів.
Канабіглендол має також суттєве значення у фармакологічних дослідженнях, особливо в області вивчення фармакокінетики та фармакодинаміки. Його використання допомагає уточнити механізми метаболізму канабіноїдів, впливу ферментативних систем, включно з цитохромом P450, на біодоступність та трансформацію молекули в організмі. Це дає змогу розробляти ефективніші лікарські форми з оптимальним профілем розподілу і тривалістю дії.
У галузі молекулярної біології канабіглендол використовується для дослідження структурно-функціональних аспектів рецепторів, включно з CB1, CB2, TRPV1, GPR55 та іншими потенційними мішенями. Вивчення взаємодії канабіглендолу з цими білками дозволяє розкрити тонкощі рецепторної активації, селективності лігандів, а також механізми зворотного зв’язку та десенситизації. Ці дані важливі для розробки нових класів ліків із підвищеною селективністю та зменшеним ризиком побічних ефектів.
Канабіглендол також служить цінним інструментом у дослідженнях епігенетичних механізмів регуляції експресії генів. Відомо, що канабіноїди можуть впливати на модифікації хроматину та активність транскрипційних факторів. Використання канабіглендолу у клітинних моделях дозволяє аналізувати, яким чином зміни епігенетичного ландшафту впливають на функції клітин при запальних та нейродегенеративних процесах.
Завдяки своїй біологічній активності канабіглендолу широко використовується у моделюванні патологічних станів на рівні клітин і тканин. Це дає змогу створювати більш релевантні моделі хвороб, що відповідають клінічним проявам, і оцінювати ефективність потенційних терапевтичних агентів у контрольованих лабораторних умовах. Відповідно, канабіглендол виступає як каталізатор для інтеграції біохімічних, молекулярних і клітинних досліджень у пошуку нових лікувальних підходів.
Важливе значення має також застосування канабіглендолу у міждисциплінарних дослідженнях, що поєднують фармакологію, біохімію, молекулярну біологію, нейронауки та імунологію. Такий комплексний підхід дозволяє отримати цілісну картину впливу канабіглендолу на організм і розробити нові концепції терапії, базовані на мультицільовому механізмі дії.
Висновок
Канабіглендол представляє собою хімічно унікальну сполуку, що належить до класу канабіноїдів, з особливою структурою, яка визначає її унікальні фізико-хімічні властивості та біологічну активність. Детальний аналіз молекулярної будови канабіглендолу показує, що вона володіє характерними для фенольних канабіноїдів хімічними групами, зокрема ароматичним кільцем, гідроксильними функціями та ліпофільним хвостом, що забезпечує її здатність до ефективної взаємодії з біологічними молекулами і мембранами. Особливості молекулярної ізомерії та конформаційної динаміки канабіглендолу визначають її специфічність зв’язування з рецепторами, стабільність та фізико-хімічні параметри, що мають ключове значення для фармакокінетики та фармакодинаміки.
Походження канабіглендолу зумовлене його природним біосинтезом у рослинах роду Cannabis, де канабіглендол утворюється через послідовні ферментативні перетворення специфічних прекурсорів. Біосинтетичний шлях канабіглендолу є частиною складної мережі метаболічних реакцій, які регулюються генетично та залежні від екологічних чинників, що визначають концентрацію та розподіл канабіглендолу в різних частинах рослини. Його кількісне співвідношення варіюється залежно від сорту, умов культивування і ступеня зрілості рослини, що важливо враховувати як у фундаментальних дослідженнях, так і в промисловому виробництві.
Для лабораторного і промислового отримання канабіглендолу застосовуються різні методи. Напівсинтетичні підходи базуються на перетворенні природних канабіноїдів, що дає змогу зберегти специфічність і високу якість кінцевого продукту. Повний хімічний синтез забезпечує контроль над усіма етапами формування молекули, але вимагає складних реакцій і високих технологічних затрат. Біотехнологічні методи, що включають використання мікроорганізмів або генно-модифікованих клітин, стають перспективними для масштабного і більш екологічного виробництва канабіглендолу, дозволяючи одночасно регулювати вихід і чистоту продукту.
Фармакологічна активність канабіглендолу пов’язана з його здатністю взаємодіяти з численними біологічними мішенями, включно з класичними канабіноїдними рецепторами (CB1, CB2), а також іншими білковими структурами, зокрема TRP-каналами, G-білками та ферментами. Ці взаємодії визначають широкий спектр фармакодинамічних ефектів, серед яких імуномодулююча дія, нейропротекція, знеболювання, протизапальний ефект, а також вплив на метаболічні процеси. Механізми дії канабіглендолу детально вивчаються в лабораторних умовах (in vitro) і на моделях тварин (in vivo), що дає змогу системно оцінити його терапевтичний потенціал та безпечність.
Канабіглендол знаходить застосування у різних медичних і наукових напрямках. У медичній практиці його потенціал розглядається для лікування запальних, нейродегенеративних та імунологічних захворювань. Канабіглендол виступає як перспективний агент для розробки нових фармацевтичних препаратів, здатних ефективно модулятувати патологічні процеси без типових побічних ефектів, характерних для традиційних медикаментів. У наукових дослідженнях канабіглендолу використовується як модельна сполука для вивчення ендоканабіноїдної системи та механізмів клітинної регуляції.
Значення канабіглендолу для фундаментальних досліджень важко переоцінити. Його унікальна структура і функції дозволяють розкривати тонкі аспекти молекулярної взаємодії ліганд-рецептор, вплив на епігенетичні модифікації, регуляцію транскрипції і клітинний метаболізм. Використання канабіглендолу сприяє глибшому розумінню молекулярних основ імунорегуляції, нейропротекції, метаболічної гомеостазу і болю, що створює платформу для розробки інноваційних терапевтичних стратегій і оптимізації існуючих.
Підсумовуючи, канабіглендол є важливим хімічним та фармакологічним агентом, що поєднує у собі складність природної біохімії та перспективність медичного застосування. Його вивчення сприяє не лише розвитку фундаментальних наукових знань про канабіноїдну систему і молекулярну біологію, але й відкриває нові горизонти у фармацевтичних розробках. Розуміння його хімічної природи, шляхів біосинтезу, методів виробництва і фармакологічної дії формує комплексний підхід, необхідний для подальшого ефективного використання канабіглендолу у науці і медицині.
Джерела
- Atalay, S., Jarocka-Karpowicz, I., & Skrzydlewska, E. (2019). Therapeutic Properties of Cannabidiol (CBD). Pharmaceuticals (Basel).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7023045/ - Izzo, A. A., Borrelli, F., Capasso, R., Di Marzo, V., & Mechoulam, R. (2009). Non-psychotropic plant cannabinoids: new therapeutic opportunities from an ancient herb. Trends in Pharmacological Sciences.
https://www.sciencedirect.com/science/article/abs/pii/S0165614709000369 - Citti, C., Braghiroli, D., Vandelli, M. A., & Cannazza, G. (2018). Medicinal Cannabis: Principal Constituents and Their Therapeutic Potential. Pharmaceuticals.
https://www.mdpi.com/1424-8247/11/1/17 - PubChem – Cannabigerol (CBG). National Center for Biotechnology Information (NCBI).
https://pubchem.ncbi.nlm.nih.gov/compound/Cannabigerol - University of California, San Francisco (UCSF) Cannabis Research. Overview of cannabinoids including CBG.
https://www.ucsf.edu/news/2019/03/412446/understanding-cannabis-cannabinoids-and-what-they-do - Healthline – Cannabigerol (CBG): What Is It and What Does It Do?
https://www.healthline.com/health/cannabigerol - Hammell, D. C., Zhang, L. P., Ma, F., Abshire, S. M., McIlwrath, S. L., Stinchcomb, A. L., & Westlund, K. N. (2016). Transdermal cannabidiol reduces inflammation and pain-related behaviours in a rat model of arthritis. European Journal of Pain.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4851925/ - Project CBD – Research Library. Articles and research on cannabinoids including CBG.
https://www.projectcbd.org/science/cannabinoids/cannabigerol-cbg