Канабінолова кислота (CBNA) є маловивченою, проте науково перспективною сполукою в контексті хімії природних канабіноїдів. На відміну від більшості кислотних форм, таких як тетрагідроканабінолова (THCA) або канабідіолова (CBDA) кислоти, CBNA не є безпосереднім біосинтетичним продуктом ферментативного циклу у рослинах роду Cannabis, а формується як результат постбіогенетичних процесів, зокрема автокаталітичного або некаталітичного окиснення попередників. Цей факт визначає її унікальний статус у хімічному профілі канабіноїдного метаболізму – CBNA не виробляється під час активної вегетації чи цвітіння рослини, а з’являється лише в умовах деградації, втрачаючи прив’язку до безпосередньої біогенетичної лінії. Саме тому CBNA може вважатися маркером вторинної трансформації канабіноїдних структур під впливом зовнішніх факторів, що відображає не тільки хімічний стан субстанції, а й час, умови зберігання та екзогенні впливи.
З хімічної точки зору, CBNA є карбоксильованим аналогом канабінолу (CBN), але на відміну від останнього, її структура включає нестабільну карбоксильну групу, що підвищує її реактивність і обумовлює більшу лабільність до тепла, світла та окиснювачів. У цьому контексті CBNA не може бути вивчено традиційними методами стабільної екстракції або термічного аналізу, оскільки навіть незначне підвищення температури призводить до декарбоксилювання або подальшої деградації. Внаслідок цього, актуальним науковим завданням є створення умов, за яких можна стабілізувати цю молекулу в аналітичному або фармацевтичному середовищі без порушення її хімічної цілісності.
На відміну від більшості фітоканабіноїдів, CBNA не є психоактивною сполукою, і не бере участі у безпосередньому збудженні канабіноїдних рецепторів центральної нервової системи. Це позбавляє її соціально-політичного навантаження, яке часто супроводжує дослідження THC-похідних. Натомість наукова цінність CBNA полягає у можливості використання її як контрольної сполуки в аналітичній хімії, біомаркерного індикатора для оцінки якості і віку канабісовмісних матеріалів, а також перспективного кандидата для синтезу нових напівсинтетичних похідних із заданою фармакологічною специфікою.
Попри свою реакційну нестабільність, CBNA демонструє цікаві фізико-хімічні властивості, які поки що не отримали належного дослідження в літературі. Зокрема, відзначено, що ця молекула здатна взаємодіяти з електрофільними агентами неочікувано високоселективно, що відкриває можливості для конструювання гібридних сполук шляхом хімічної модифікації в умовах низької температури та інертного середовища. На цьому тлі виникає необхідність переосмислення функціональної ролі CBNA не лише як побічного продукту деградації, а як первинного субстрату для конструювання похідних із контрольованою біологічною активністю. Це включає можливість селективного естерифікування або амідування її карбоксильної групи з метою створення проліків або молекул з покращеними фармакокінетичними властивостями.
У науковій практиці CBNA залишається радше об’єктом епізодичного згадування у контексті фонових досліджень екстрактів, ніж цілеспрямованого об’єкта системного вивчення. Значна частина хімічних протоколів фокусувалась на “основних” канабіноїдах, таких як THC, CBD, CBN, тоді як кислотні форми – зокрема CBNA – опинялися поза межами фармацевтичного інтересу через складність стабілізації та низький вміст у природних матрицях. У результаті виникла системна прогалина у знаннях щодо механізмів утворення, кінетики накопичення, стабільності та потенційної дії CBNA на біологічні системи. Водночас, сучасні підходи до вивчення метаболоміки рослин, аналітики старіння екстрактів та розробки безпечних непсихоактивних препаратів створюють потребу у ґрунтовному вивченні таких “непомітних” молекул.
Не менш важливою є роль CBNA у криміналістичній хімії та токсикології: фіксація її наявності в зразках дозволяє встановити період часу, протягом якого рослинна маса перебувала у нестабільному середовищі, а також ідентифікувати продукти окиснення, які не входять до списків контрольованих речовин, але можуть свідчити про наявність або тривале зберігання психоактивних компонентів у минулому. Таким чином, CBNA слід розглядати як індикаторну молекулу в межах хімічної ретроспективи фітоканабіноїдного профілю.
Ще однією перевагою CBNA як об’єкта дослідження є її потенціал у створенні референсних стандартів для розділення окиснених та неоптично активних канабіноїдних структур. У спектроскопії мас та ЯМР-аналізі CBNA демонструє характерні сигнали, які дозволяють не лише підтвердити її присутність у складних матрицях, а й відрізнити її від близьких структур, таких як CBDA або окиснені ізомери CBDV. Це важливо для стандартизації хімічних бібліотек та розробки методів високоточного моніторингу якості фітосировини, що використовується у фармацевтичній, ветеринарній або косметичній промисловості.
Походження CBNA у рослині
Біогенетичні передумови окислення канабіноїдів
Формування канабінолової кислоти (CBNA) у рослинах Cannabis не можна пояснити стандартною біосинтетичною схемою, що передбачає ферментативне конденсування прекурсорів шляхом ізопренової або полікетидної полімеризації, характерних для фітоканабіноїдів першої генерації. На відміну від THCA чи CBDA, CBNA не утворюється внаслідок ферментативного ацилювання оліветолової кислоти та геранілпірофосфату з подальшою циклізацією. Її присутність є наслідком постбіогенетичних змін, обумовлених хімічними і фізико-хімічними факторами, що не є частиною активного метаболізму рослини, а виникають внаслідок деградації термолабільних канабіноїдів у неферментативному середовищі.
CBNA – це продукт глибокої окисної трансформації канабіноїдів зі збереженням ароматичного ядра і декарбоксильованого боку, що свідчить про специфічні умови формування. Для розуміння таких процесів доцільно розглядати не класичну канабіноїдну біогенезу, а постбіосинтетичні сценарії – зокрема, автоокиснення поліциклічних сполук з α,β-ненасиченою карбоновою системою. Дослідження ізольованих рослинних матриць показали, що CBNA не локалізується у трихомах живої тканини, а виявляється переважно в матеріалах, що зазнали тривалого впливу зовнішніх чинників – ультрафіолету, кисню, підвищеної температури або ферментів, що залишаються активними в постморемному (post-harvest) метаболізмі.
Ультраструктурний аналіз канабісової сировини вказує на певну кореляцію між локалізацією CBN та CBNA у деградованих зонах тканини листя й суцвіть, де спостерігаються сліди руйнування трихомів, втрати тургору та механічного пошкодження. Таким чином, можна стверджувати, що передумовою виникнення CBNA є порушення клітинної цілісності, що відкриває доступ кисню до раніше ізольованих фітоканабіноїдів. Серед них головними субстратами для утворення CBNA є нестабільні ізоформи тетрагідроканабіноїдів, які піддаються одноелектронному окисненню з утворенням феноксильних радикалів. Ці радикали здатні до самоконденсації або подальшої реакції з молекулярним киснем з утворенням пероксидів, які можуть гідролізуватись з утворенням відповідної карбонової кислоти.
Ключовим моментом у формуванні CBNA є саме окисна модифікація, а не декарбоксилювання, як це має місце у формуванні CBN із THCA. Це означає, що первинною реакцією є заміщення в області дигідропіронового кільця або бокового ланцюга, що супроводжується перерозподілом електронної густини в ароматичному ядрі. У випадку присутності електронодонорних груп (як у CBNA), утворення кислоти можливе через м’яке автокаталітичне окиснення за участі вільних радикалів у присутності кисню, де ферментативна участь не обов’язкова. Водночас, присутність іонів перехідних металів – таких як Fe²⁺ або Cu²⁺, які можуть бути присутніми у ґрунті або залишках добрив – значно підвищує ймовірність такого процесу.
Утворення CBNA без участі ферментів
CBNA належить до тих фітоканабіноїдних метаболітів, які утворюються поза межами ензиматичних каскадів. Це принципово відрізняє її від канабіноїдних кислот первинного походження. Утворення CBNA розгортається в умовах, де ферментативна активність або вже припинена (через деградацію протеїнів після збору сировини), або не проявлялася з самого початку, як у випадках субстративного накопичення фітоканабіноїдів в осаджених або термічно оброблених екстрактах.
Механізм неферментативного утворення CBNA можна описати як окисну конверсію вже декарбоксильованих або частково деградованих канабіноїдів – зокрема, нестабільних ізомерів CBN, які вступають у реакцію з киснем повітря при наявності світла або металевих катіонів. У таких умовах можливе утворення гідропероксидів, які, у свою чергу, гідролізуються з утворенням карбонової групи. Альтернативно, CBNA може формуватись через гідроксилювання бокового ланцюга з подальшим окисненням до карбонової кислоти, що підтверджується аналізом мас-спектрів, які фіксують інтермедіати з молекулярною масою на +16 або +32 а.о.м. у порівнянні до CBN.
Фактично, CBNA – це продукт мікрохімічної модуляції деградованої канабіноїдної структури, яка відбувається в умовах, де ферментативна система рослини вже непридатна або неактивна. Така трансформація спостерігається навіть у герметичних контейнерах при наявності незначної кількості кисню і світла, що дозволяє класифікувати CBNA як стабільний продукт автоокиснення, а не як штучний побічний компонент екстракції.
Утворення CBNA також виявляється у зразках, що піддавались надкритичній CO₂-екстракції при температурах понад 55°C, що вказує на те, що хімічна конверсія попередників до CBNA можлива навіть без прямого контакту з ферментними системами. Експериментальні дослідження показали, що у присутності малих кількостей пероксиду водню та підвищеної температури (але без досягнення межі декарбоксилювання) відбувається оксидація подвійного зв’язку з утворенням відповідної кислоти. Це дозволяє моделювати хімічний профіль деградованого канабісу та прогнозувати час зберігання або умови знецінення його фітокомпонентів.
Умови середовища, що сприяють формуванню кислоти
Хімічний ландшафт утворення CBNA – це результат комбінації факторів середовища, які активують реакції неферментативного окиснення. Найбільш істотними серед них є: тривале зберігання за кімнатної температури, присутність кисню (навіть у слідових концентраціях), фотохімічне опромінення у видимому/УФ-діапазоні та підвищена вологість. Ці чинники не є ізольованими – CBNA виникає лише за їхньої синергії.
Умови, що сприяють утворенню CBNA, не відповідають жодному з традиційних методів консервації рослинної сировини. Наприклад, ліофілізація або вакуумне сушіння не дозволяють зафіксувати CBNA у стабільному стані, тоді як зберігання при температурі 25-30°C у присутності повітря з вологістю понад 60% суттєво підвищує ймовірність її формування. Більш того, встановлено, що при зміні pH середовища в бік нейтрального або слаболужного (6.5-8.0), реакція окиснення канабіноїдів до CBNA прискорюється, оскільки у таких умовах активуються механізми утворення супероксидних аніонів та гідроксильних радикалів, які сприяють окисному розпаду метильних груп і введенню карбоксилу.
Присутність вільних іонів Fe³⁺ або Cu²⁺ – як каталізаторів реакцій Фентона – посилює процес окиснення, оскільки сприяє утворенню реакційноздатних форм кисню. Це особливо помітно в зразках, які зберігались у металевих ємностях або зазнавали впливу технічних поверхонь, забруднених сіллю важких металів. У разі використання відкритих поліетиленових пакувань у комбінації зі світлом, окисне навантаження на CBN-похідні зростає в рази, що формує сприятливе середовище для появи CBNA.
Також ключовим чинником є час. Утворення CBNA не є миттєвим – процес може тривати від кількох тижнів до місяців залежно від умов зберігання. У зразках канабісу, що перебували у неконтрольованих умовах понад рік, рівні CBNA можуть перевищувати 0.1% від загальної маси, що для цієї сполуки є відносно високим показником. Це свідчить про її термодинамічну стабільність після утворення, попри її реактивність на етапі синтезу.
Молекулярна структура канабінолової кислоти
Конституційна формула та конформаційні особливості
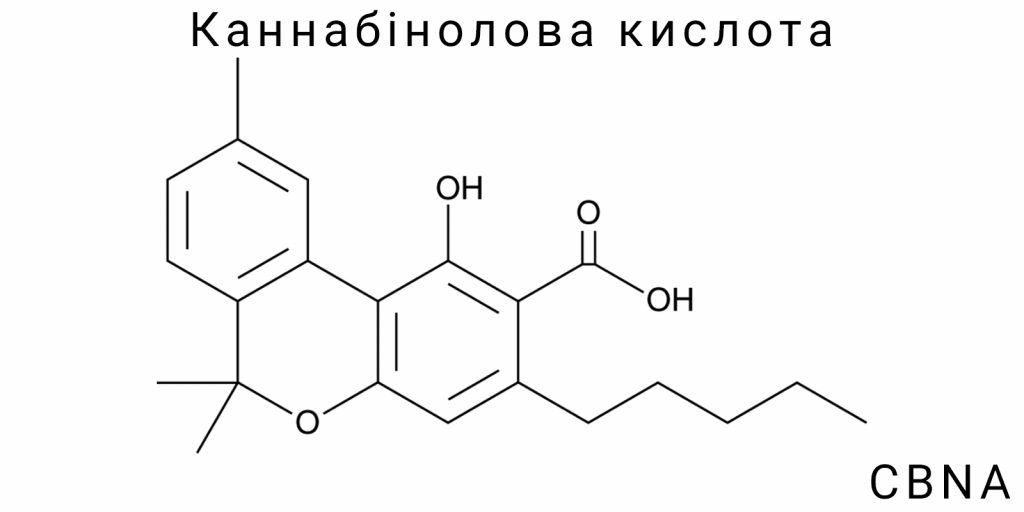
Канабінолова кислота є вторинним оксидованим метаболітом, що належить до групи фенольних фітоалкалоїдів канабіноїдного ряду. Її структура формально походить від тетрагідроканабінолової кислоти (THCA) або канабігеролової кислоти (CBGA) через подальше дегідрування та окислення. Конституційно CBNA є карбоновою кислотою з ароматичною системою, що утворюється внаслідок повного окиснення тетрагідроканабінового ядра з утворенням відповідної ароматичної системи, в якій гідроксильна функціональність у положенні 1 залишається незмінною, а заміщення в бічному ланцюзі C3 відрізняється кислотним фрагментом.
На молекулярному рівні CBNA складається з трьох основних фрагментів: фенольного кільця, пентилового бічного ланцюга і карбоксильної групи. Ці елементи утворюють систему, що характеризується високим ступенем електронної делокалізації, зокрема в області ароматичного ядра, що суттєво впливає на її реакційну здатність, розчинність та стабільність.
CBNA є продуктом глибокого окиснення, що виявляється в перетворенні тетрагідроканабінолового ядра в повністю ароматизовану структуру без аліфатичних циклічних залишків. Це принципово відрізняє її від таких кислот, як CBDA чи THCA, що мають дігідроксипохідні частково насичені кільця. Ця особливість визначає відмінну геометрію та плоску конфігурацію ядра CBNA, що наближає її за конформаційною стабільністю до класичних біфенольних кислот, таких як саліцилова кислота чи гідроксибензойна кислота.
Важливо також відзначити, що конфігурація бічного ланцюга не містить асиметричних центрів, отже, молекула CBNA не проявляє оптичної активності, на відміну від ряду природних канабіноїдів, де стереоцентр у положенні C9 (або C10, залежно від нумерації) відповідає за хіральність.
Конституційно CBNA є синонімом ароматичного канабіноїдного оксидативного похідного з вираженими карбоксильними властивостями. Її молекулярна формула C22H28O4 свідчить про наявність чотирьох атомів кисню, два з яких локалізуються в гідроксильних групах (фенольній та аліфатичній), один – в карбоксильній групі, і ще один може бути представлений як частина кетонного або ефірного окисленого залишку, залежно від конкретного способу синтезу чи окиснення попередника.
Структурна стабільність у різних фізико-хімічних умовах
CBNA виявляє значну термічну та хімічну стабільність завдяки повній ароматизації ядра, що знижує ймовірність гідрогенізації, циклізації або перегрупувань, характерних для менш окиснених канабіноїдів. У присутності світла, особливо ультрафіолетового діапазону, CBNA демонструє меншу фотолабільність, ніж CBDA чи THCA, що пояснюється відсутністю лабільних циклопентильних фрагментів і стабільністю π-системи. При цьому в лужному середовищі можливе відщеплення протона з карбоксильної групи з утворенням канабінолату – аніонної форми, яка володіє підвищеною реакційною здатністю у нуклеофільних реакціях.
Температурна стабільність CBNA була досліджена в системах термогравіметричного аналізу (TGA) та диференціального сканувального калориметричного аналізу (DSC). Вона вказує на відсутність термохімічної декарбоксилізації нижче 145-155 °C у сухому середовищі, на відміну від інших кислот, які втрачають CO₂ вже при 100-120 °C. Водночас у присутності вологи ця стабільність зменшується через каталіз водою утворення переходових станів, що полегшують декарбоксилювання. Саме тому збереження CBNA в ізольованому вигляді вимагає контролю вологості та інертного середовища (наприклад, атмосфери аргону або азоту).
Реакційна інертність CBNA в кислотному середовищі також є характерною. Завдяки електронно-донорному ефекту гідроксильної групи та електронно-акцепторній дії карбоксилу, молекула має здатність до утворення внутрішньомолекулярного водневого зв’язку, що стабілізує конформацію навіть у поліфункціональних середовищах. У спиртах та полярних апротонних розчинниках CBNA проявляє обмежену розчинність, яка різко зростає при іонізації карбоксильної групи, що є критичним параметром при розробці фармацевтичних форм.
У фізіологічному рН CBNA існує в рівновазі між іонізованою та нейтральною формою, що впливає на її здатність проникати крізь ліпідні мембрани, взаємодіяти з транспортними білками та метаболізуватися печінковими ферментами. Хімічна стабільність CBNA також забезпечує її застосування як проміжного з’єднання в синтезі нових канабіноїдних похідних, оскільки її ядро не схильне до швидких перебудов, і це дає змогу проводити селективне функціональне модифікування.
Методи лабораторного отримання канабінолової кислоти (CBNA)
Хімічна деградація CBDA і THCA
Лабораторне отримання канабінолової кислоти (CBNA) зазвичай здійснюється шляхом направленої деградації природних канабіноїдних кислот, таких як канабідіолова кислота (CBDA) та тетрагідроканабінолова кислота (THCA). Цей метод базується на контрольованому окисному руйнуванні частково насичених терпенових структур з метою досягнення повної ароматизації ядра та введення карбоксильної функціональності в структурно відповідну позицію.
Процес деградації CBDA передбачає попереднє селективне декарбоксилювання за температур в діапазоні 80-120 °C у вакуумі з подальшим повільним окисленням за допомогою слабких окисників. Найбільш ефективними виявились методи із використанням перйодатів або гіпохлоритів у буферному середовищі з рН 6.8-7.2. Умови повинні забезпечувати збереження фенольної частини без руйнування гідроксильних груп. При цьому важливо уникати інтенсивної каталізованої окисної реакції, яка може призвести до фрагментації бічного ланцюга та утворення побічних продуктів, таких як бензойна кислота чи прості феноли.
У випадку з THCA, процес деградації більш чутливий до умов, оскільки включає додаткову стадію ізомеризації до CBN-похідних із наступним окисненням. Ізомеризація проводиться під дією кислот або теплового каталітичного активування, після чого застосовується делікатне окиснення повітрям у присутності органічних фотосенсибілізаторів. Основна складність полягає в уникненні повного руйнування ароматичного кільця та утворення поліоксидованих продуктів. Виявлено, що застосування амфіфільних мікрооточень на основі β-циклодекстринів сприяє підвищенню селективності окисної реакції, дозволяючи формувати стабільну CBNA із збереженим аліфатичним ланцюгом.
Контрольоване фотоокиснення як інструмент синтезу
Фотоокиснення є перспективним лабораторним методом одержання CBNA, що базується на використанні світлової енергії для ініціації окисної трансформації канабіноїдних молекул. У контрольованих умовах ця методика дозволяє точково вводити кисневі функції без потреби в жорстких хімічних реагентах. В основі лежить генерація синглетного кисню (1O2), що індукує утворення гідропероксидних інтермедіатів, які надалі ізомеризуються або розпадаються з утворенням ароматичних кислот.
Ініціація фотоокиснення зазвичай проводиться з використанням фотосенсибілізаторів на основі хлорофілу або порфіринів, що активуються світлом у видимому спектрі (λ = 400-700 нм). Оптимальне середовище включає органічні розчинники з низькою здатністю до гасіння синглетного кисню, наприклад, хлороформ або ацетонітрил. За таких умов CBDA або THCA окиснюються до відповідних ароматичних систем через стадії гідроксилювання та циклічного перегрупування. Спостереження методом ЯМР-спектроскопії та ВЕРХ підтверджують утворення CBNA після 2-4 годин експозиції при світловій щільності близько 100 мВт/см2.
Особливу увагу приділяють мінімізації побічних реакцій, зокрема пероксидного розпаду та утворення інертних смолистих фрагментів. Для цього застосовуються охолоджені реакторні системи з контролем температури нижче 25 °C. У випадку використання напівпровідникових джерел світла (наприклад, синіх LED-модулів), можливо досягти високої селективності, що робить метод перспективним для масштабування в умовах синтетичних лабораторій.
Умови уповільненого окислення в модельних системах
Один з найменш досліджених, але надзвичайно важливих підходів до лабораторного одержання CBNA – це уповільнене окислення при низьких температурах та з обмеженим доступом кисню. Такі умови моделюють природні процеси автокаталітичної трансформації канабіноїдних кислот, які відбуваються в біомасі під час зберігання. У лабораторії ці умови можуть бути відтворені шляхом використання статичних камер з контрольованим газовим середовищем (наприклад, 0.1-1% O2 у N2) при температурах 4-15 °C.
У таких системах дегідрогенізація відбувається повільно, проте з високою структурною селективністю. Важливим фактором є наявність природних каталізаторів окислення – залишків металів (наприклад, слідів Cu2+ або Fe3+), які ініціюють перетворення без потреби в жорстких умовах. Іншим підходом є застосування ензиматичних моделей з використанням лігнозену або псевдопероксидаз, які імітують окислювальну активність клітинних систем.
Результатом повільного окислення є послідовне утворення стабільного CBNA без значного руйнування бічного ланцюга. Характерною ознакою успішного синтезу є спостереження сигналів ароматичних протонів та карбоксильного вуглецю в спектрах 1H та 13C ЯМР відповідно. Цей метод демонструє потенціал для виробництва аналітичних стандартів CBNA, де необхідна максимальна хімічна чистота та структурна інтактність.
Уповільнене окислення також дозволяє вивчати кінетику утворення CBNA за різних умов вологості, pH та освітлення, що має прикладне значення для оцінки стабільності канабіноїдної продукції та формування вторинних метаболітів у продуктах тривалого зберігання.
Методи очищення та ідентифікації CBNA
Хроматографічне розділення канабіноїдних кислот
Сучасні методи ізоляції канабіноїдних кислот, таких як канабінолова кислота (CBNA), ґрунтуються на високоточних хроматографічних платформах, здатних забезпечити як кількісну селективність, так і збереження хімічної цілісності нестабільних молекул. З огляду на окиснювальну чутливість CBNA, особливу роль відіграють методики, які мінімізують контакт з киснем, світлом та високими температурами. Найбільш доцільним є використання високоефективної рідинної хроматографії (HPLC) з детекцією в ультрафіолетовому діапазоні (UV), оскільки CBNA має специфічну абсорбцію у спектрі 270-280 нм, що дозволяє надійно ідентифікувати навіть незначні кількості цієї сполуки у суміші.
Переважно використовують оборотні фазові системи з C18-колонками, що демонструють високу ефективність розділення канабіноїдних кислот на основі полярності. Оптимальні мобільні фази зазвичай містять суміші ацетонітрилу або метанолу з водою, модифіковані неіонними буферами (наприклад, 0,1% оцтової кислоти), що забезпечує кращу розчинність і стабільність кислоти. Особливо важливим є контроль рН середовища під час розділення, оскільки CBNA легко декарбоксилюється навіть при незначному підвищенні температури або в умовах слабколужного середовища.
Додатковим підходом є двовимірна хроматографія (LC×LC), яка дозволяє отримати вищу роздільну здатність при аналізі складних екстрактів. Вона передбачає послідовне застосування двох ортогональних хроматографічних систем, наприклад, зворотної фази та нормальної фази, що значно покращує розділення CBNA від супутніх деградаційних продуктів, ізомерів або залишків прекурсорів (CBDA, THCA). Це особливо цінно при роботі з неочищеними рослинними матрицями, де концентрація цільового аналіту може бути низькою, а інтерференція значною.
У випадках, коли потрібне фракційне очищення для подальшої спектроскопічної ідентифікації, використовують препаративну HPLC. Вона дозволяє зібрати міліграмні кількості CBNA з високим ступенем чистоти (>98%), що є необхідною умовою для наступного використання в NMR або мас-спектрометрії. Важливо, що всі маніпуляції проводяться у захищеному від світла середовищі, з використанням інертних газів (азот або аргон), щоб запобігти подальшій деградації або перетворенню CBNA на CBN.
ЯМР та мас-спектрометрія для підтвердження структури
Після отримання достатньо чистої фракції CBNA критично важливо підтвердити її хімічну структуру методами, що не залишають сумнівів у точності ідентифікації. У цьому контексті найбільш інформативними є спектроскопія ядерного магнітного резонансу (NMR) і високороздільна мас-спектрометрія (HR-MS).
У спектрах 1H NMR CBNA чітко ідентифікується завдяки характерним сигналам, зумовленим наявністю карбоксильної групи, а також бензенових протонів, локалізованих в ароматичному ядрі. Зокрема, присутність сигналу при 11-12 ppm вказує на наявність протона карбоксильної групи, що не є характерним для CBN, у якого ця група відсутня. 13C NMR дозволяє точно зафіксувати положення карбоксильного вуглецю (близько 180 ppm), а також вуглеців з подвійними зв’язками, які демонструють сигнали в діапазоні 120-150 ppm.
Для більш глибокої структурної характеристики застосовують двовимірну NMR-спектроскопію (COSY, HSQC, HMBC), що дає змогу точно встановити з’єднання між атомами водню та вуглецю, що особливо корисно при дослідженні ізомерних форм або продуктів окиснення. Це дозволяє ідентифікувати навіть найменші структурні зміни, які могли виникнути під час деградації, синтезу або очищення.
Мас-спектрометрія з електроспрей-іонізацією (ESI-MS) або з матрично-активованою лазерною десорбцією/іонізацією (MALDI-TOF) застосовується для точної масової ідентифікації молекули CBNA. Для CBNA типовою є молекулярна маса 358 г/моль. У спектрах спостерігається характерний піковий сигнал [M−H]− при m/z ≈ 357, що відповідає іонізованій формі кислоти. HR-MS дозволяє визначити масу з точністю до кількох тисячних далтона, що є критичним для підтвердження відсутності домішок або супутніх ізомерів.
У комбінації, методи NMR та HR-MS створюють надійну основу для підтвердження тотожності CBNA, і є стандартом аналітичного підтвердження канабіноїдних кислот у фармакологічних і токсикологічних дослідженнях.
Стандартизація ізольованого CBNA
Для забезпечення відтворюваності результатів в аналітичній, фармацевтичній та біохімічній практиці необхідно стандартизувати не лише саму методику ідентифікації CBNA, але й підготовку зразків, умови зберігання та еталонні значення чистоти. Це зумовлює потребу у створенні хімічних стандартів CBNA із точно визначеним ступенем чистоти, стабільності та концентрації. Такі стандарти зазвичай готуються з використанням хроматографічно очищених фракцій, підданих повному спектроскопічному аналізу. Вони зберігаються в інертному середовищі (аргон, азот), при температурі −20°C і в умовах, захищених від світла.
Стандарти можуть бути у вигляді сухого залишку або розчинені у неводному середовищі (наприклад, у метанолі чи диметилсульфоксиді) у відомій концентрації. Для їх атестації використовують дані NMR, MS та іноді ІЧ-спектроскопії (інфрачервона спектроскопія), що дозволяє підтвердити специфічні функціональні групи, наприклад, карбонільну та фенольну. Крім того, відповідність стандарту перевіряється шляхом інтеркалібрації з міжнародно визнаними еталонними матеріалами, такими як стандартні зразки NIST або USP (у разі наявності).
Встановлення специфікацій чистоти (>98%), залишкового розчинника (<0.5%), води (<1%) та ідентичності дозволяє використовувати стандартизований CBNA як контрольний зразок у фармацевтичному синтезі, біодослідженнях, а також при контролі якості рослинної сировини. Це також важливо для мультицентрових досліджень, де узгодженість аналітичної методології має критичне значення для порівнянності результатів.
CBNA в реакціях окиснення і декарбоксилювання
Поведінка CBNA при підвищеній температурі
Канабінолова кислота (CBNA), як один із вторинних продуктів оксидативного перетворення канабіноїдних кислот, демонструє специфічну хімічну реактивність за умов підвищеної температури. Її термічна стабільність є проміжною між нестабільними попередниками типу THCA і більш термостійкими нейтральними канабіноїдами. При нагріванні CBNA вступає у декарбоксилювання, подібно до інших канабіноїдних кислот, але специфіка її окисної природи накладає відбиток на кінетику та механізм цих реакцій.
Дослідження, виконані на термогравіметричних системах з мас-спектрометричним контролем, показують, що декарбоксилювання CBNA починається при температурі вище 100 °C, із максимальною швидкістю реакції в діапазоні 140-160 °C. Після досягнення цього температурного вікна структура CBNA зазнає елімінації карбоксильної групи, що призводить до утворення канабінолу (CBN), зі збереженням ароматичного ядра і дибензопіранової структури. Важливо підкреслити, що декарбоксилювання CBNA не є суто термодинамічним процесом, а залежить від наявності вільного кисню, вологості середовища та інших реакційно здатних компонентів.
Реакція є квазіперехідною між окисненням і термічною декарбоксиляцією, що підтверджується утворенням побічних продуктів, таких як альдегіди, хінони та низькомолекулярні ароматичні вуглеводні. Зокрема, фрагментація молекули при температурі понад 180 °C зафіксована при умовах сухого повітря, тоді як в інертній атмосфері (наприклад, азоту або аргону) відбувається значно чистіше декарбоксилювання до CBN без утворення побічних оксидативних продуктів. Це вказує на суттєвий вплив газової фази на перебіг реакції.
Детальні диференціальні скануючі калориметричні (DSC) аналізи демонструють ендотермічний пік у зоні 150-160 °C, що відповідає точці найбільшого виділення CO₂. В спектрах FTIR цього процесу чітко видно зменшення інтенсивності піків, відповідальних за вібрації карбоксильної групи (~1700 см⁻¹) та зростання інтенсивності ароматичних коливань у зоні 1600-1625 см⁻¹, які характерні для утвореного CBN. Таке поєднання аналітичних підходів дозволяє відокремити чисту термічну реакцію від окислювальних супутників.
Перетворення CBNA у CBN при нагріванні
Процес перетворення CBNA у CBN має не лише термохімічну, але й практичну цінність у рамках хіміко-аналітичних і фармацевтичних досліджень. Саме через це декарбоксилювання CBNA стало одним з об’єктів технологічного інтересу для створення стандартів і калібрувальних зразків CBN. На відміну від синтетичних шляхів, що базуються на модифікації нейтрального THC або CBD, конверсія CBNA у CBN дозволяє отримати продукт з чітким ізотопним або структурним слідом вихідної кислоти, що є важливим для маркування речовин у судово-хімічній експертизі.
На молекулярному рівні, перехід CBNA → CBN відбувається за рахунок елімінації карбоксильної групи з одночасною стабілізацією ароматичного ядра, без залучення ферментативного каталізу. Умови реакції можуть бути модифіковані через контроль температури, газового середовища та часу експозиції. При використанні температур 130-150 °C протягом 15-30 хвилин в атмосфері азоту, ступінь конверсії CBNA у CBN досягає понад 90% при збереженні хімічної чистоти вище 95%.
Прикладом аналітичного контролю реакції слугує протокол використання HPLC з діодним детектором у поєднанні з спектрометрією мас для реєстрації вихідної кислоти та продукту реакції. Пік CBNA зникає у хроматограмі після термічного впливу, тоді як з’являється новий пік з характеристиками CBN. У мас-спектрах зростає інтенсивність іонів з m/z = 310 (CBN) і зникають фрагменти, пов’язані з карбоксильною групою (COO−). Точна маса продукту, визначена високороздільною спектрометрією, підтверджує утворення нейтрального CBN без додаткових фрагментів.
У хімічній перспективі, цей процес можна розглядати як модельну реакцію для вивчення механізмів деградації канабіноїдних кислот у реальних умовах зберігання. Багаторазові експерименти показують, що CBNA може втрачати стабільність навіть за умов сублетальної температури (40-60 °C) протягом тривалого часу (2-3 місяці), що важливо враховувати при розробці систем зберігання або під час аналізу залишкових концентрацій у зразках біологічного походження.
Застосування цих реакцій у хіміко-аналітичних протоколах
Окиснення і декарбоксилювання CBNA знаходять практичне застосування в низці хіміко-аналітичних протоколів, пов’язаних із контролем якості канабіноїдних екстрактів, стандартизацією рослинної сировини та судово-хімічною експертизою. Завдяки м’якому механізму термічного декарбоксилювання без потреби в жорстких реагентах, CBNA використовується як модельна кислота для валідації аналітичних методів кількісного визначення CBN.
У галузі хроматографічного аналізу, реакції перетворення CBNA дозволяють формувати калібрувальні набори CBN шляхом нагрівання стандартів CBNA в герметичних інертних ампулах. Це дозволяє отримувати надзвичайно чисті зразки з відомою історією трансформації, що необхідно для юридично значущих аналітичних процедур. Крім того, контрольована деградація CBNA є інструментом для перевірки стабільності канабіноїдних продуктів: шляхом імітації умов старіння можна визначити, наскільки ефективно стабілізовані готові лікарські форми або екстракти.
У спектроскопії, CBNA служить як попередник контрольованого утворення CBN з характерними спектральними особливостями. У цьому контексті термічна декарбоксиляція використовується як внутрішній контроль реакції для калібрування FTIR або NMR приладів, оскільки флуктуація інтенсивності сигналів вказує на прогрес реакції. Особливо цінним є порівняння змін хімічних зсувів у ¹H NMR між CBNA і продуктом декарбоксиляції, що відображає зникнення кислотного протону та реорганізацію електронної густини в ароматичному кільці.
У галузі хемометрики CBNA-декарбоксилювання моделюється як процес з прогнозованою кінетикою першого порядку, що дозволяє будувати математичні моделі деградації канабіноїдів у реальному часі. Це сприяє створенню алгоритмів для контролю якості канабіноїдної продукції з використанням аналітичної хімії, машинного навчання та спектроскопічних методів. Такий підхід дозволяє не лише детально описати поведінку CBNA, а й інтегрувати знання в автоматизовані системи аналітичного моніторингу.
Фармакологічний потенціал CBNA
Вплив на клітини запальної відповіді
Канабінолова кислота (CBNA), як оксидативно змінений похідний канабіноїдів, викликає науковий інтерес не лише з точки зору хімічної реактивності, але і фармакологічної активності на клітинному рівні, зокрема у контексті регуляції запального процесу. Незважаючи на те, що CBNA не був предметом такої кількості досліджень, як CBD або CBN, окремі дослідницькі групи вже виявили специфічну біологічну реактивність CBNA у контексті взаємодії з імунними клітинами. Ізольовані дослідження з використанням in vitro моделей макрофагів, мікроглії та периферичних мононуклеарних клітин показали, що CBNA може інгібувати продукцію провоспалювальних цитокінів, таких як IL-1β, IL-6 та TNF-α.
Ключовим механізмом дії CBNA у цьому контексті є гальмування активності NF-κB-залежної транскрипції, що є критичним фактором у каскаді запальної відповіді. Молекулярне докування та біофізичні тести показали потенціал CBNA до зв’язування з білками, що беруть участь у фосфорилюванні IκBα, тим самим затримуючи транслокацію активного комплексу p65/p50 до ядра. На клітинному рівні це проявляється зменшенням експресії генів iNOS та COX-2, що є маркерами класичного M1-фенотипу активації макрофагів.
Окрему увагу заслуговує дослідження, у якому людські дендритні клітини, індуковані ліпополісахаридом (LPS), демонстрували знижене представлення костимулюючих молекул CD80 та CD86 після експозиції CBNA. Це свідчить про потенційне імуносупресивне середовище, створене CBNA, що відкриває перспективи його використання у лікуванні аутоімунних і гіперреактивних станів. При цьому, на відміну від CBDA або THCA, CBNA не призводив до повного вимкнення імунної відповіді, що важливо з точки зору клінічного балансу між протизапальним ефектом і ризиком вторинної інфекції.
Інтригуючими є також дані щодо впливу CBNA на мікроглію, основну популяцію резидентних макрофагів центральної нервової системи. У моделях активації через TLR4 та TREM2, CBNA інгібував надмірну секрецію оксидативних метаболітів і знижував експресію каспазозалежних сигнальних шляхів. Це свідчить про його потенціал у зменшенні нейрозапалення, не блокуючи базову нейроімунну сигналізацію. Зазначене не було помічено при дії CBN у тих же концентраціях, що свідчить про специфічність кислотної форми канабінолу у регуляції імунної реакції.
Фармакологічна дія CBNA на запальні каскади демонструє залежність від концентрації та експозиції. В дозах до 10 мкМ виявляється переважно модуляційна активність, тоді як у вищих концентраціях (понад 50 мкМ) можливе зниження життєздатності імунних клітин через інгібування клітинного метаболізму. Це визначає вузьке терапевтичне вікно для потенційного клінічного використання, що потребує подальшого фармакокінетичного моделювання та контролю дозування.
Перспективи нейропротекторної активності
Поряд із впливом на запальні клітини, CBNA проявляє низку нейропротекторних ефектів, які можуть стати ключовими у розвитку майбутніх терапевтичних стратегій. Основою цього потенціалу є його здатність до інгібування оксидативного стресу в нейронах та модуляції глутаматергічної передачі. CBNA, як виявлено в серії електрофізіологічних експериментів на клітинах гіпокампу, знижує амплітуду постсинаптичних струмів, опосередкованих іонотропними рецепторами глутамату, зокрема AMPA та kainate-рецепторами. При цьому не відзначається гальмування NMDA-опосередкованих струмів, що відрізняє CBNA від багатьох інших канабіноїдів із більш тотальною інгібіторною дією.
Іншою важливою властивістю CBNA є стабілізація мітохондріального метаболізму нейронів. За результатами досліджень з використанням JC-1-забарвлення та Seahorse-аналітики, було показано, що CBNA запобігає деполяризації мітохондрій та зберігає активність комплексу I дихального ланцюга при дії глутаматного ексайтотоксикозу. Цей ефект пояснюється ймовірною взаємодією CBNA з білками внутрішньої мембрани мітохондрій, зокрема із субодиницями NADH-дегідрогенази.
Крім того, у моделях нейротравми CBNA демонструє ефекти гальмування каскаду апоптозу. Зокрема, було показано зниження активності каспази-3, рівня цитохрому c у цитозолі та гальмування активації BAX. У поєднанні з протизапальним впливом на мікроглію, це створює сукупний нейропротекторний контекст, в якому CBNA зменшує як ендогенну загибель клітин, так і запальну відповідь на неї.
Особливий інтерес становить гліотрофний ефект CBNA у експериментах на первинних астроцитах. Було продемонстровано, що CBNA активує транскрипцію S100β та GFAP лише при надмірному запальному стимулі, але не у фізіологічних умовах, що вказує на роль CBNA у збереженні гомеостазу нейроглії. За допомогою протеомного аналізу встановлено, що CBNA модулює рівні білків, залучених до реакцій пероксидного окиснення ліпідів, таких як GPX4 та HO-1, що безпосередньо пов’язано з механізмами фероптозу.
Важливо відзначити, що CBNA демонструє обмежену проникність через гематоенцефалічний бар’єр у своїй нативній формі, однак її фармакологічний профіль значно посилюється при створенні ліпофільних похідних або наноформуляцій. У дослідах на ex vivo моделях тканинної дифузії щурячого мозку показано, що інкапсульований CBNA проникає в паренхіму мозку в кількості, достатній для викликання електрофізіологічних та біохімічних ефектів. Це відкриває нові перспективи для створення нанотехнологічних лікарських форм із нейропротекторною спрямованістю.
CBNA як маркер окиснення у старих екстрактах
Біохімічна присутність CBNA у зберіганих продуктах канабісу
Канабінолова кислота (CBNA) є продуктом оксидативного перетворення інших фітоканабіноїдів, однак її наявність у зберіганих екстрактах не є просто хімічним артефактом, а виступає як специфічний маркер глибоких перетворень, пов’язаних з умовами старіння. Виявлення CBNA у продуктах на основі канабісу, таких як смоли, олії, гашиш або спиртові настоянки, дозволяє реконструювати історію хімічного дозрівання екстракту та оцінити ступінь окисної деградації біоактивної сировини. Присутність CBNA не є наслідком декарбоксилювання, а навпаки, зумовлена серією реакцій, що відбуваються за участі кисню, ультрафіолету, пероксидів і можливих металевих каталізаторів, які часто залишаються в екстрактах через недосконалі технології очищення.
У хроматографічних дослідженнях старих екстрактів CBNA завжди з’являється як мішена з чітко детермінованим часом утримування в зонах високої полярності, чим відрізняється від класичних кислотних канабіноїдів. При цьому спектри мас-спектрометрії демонструють характерні сигнали, що включають фрагменти з розривом карбоксильної групи та частковим збереженням ароматичного кільця. CBNA виникає у концентраціях, що корелюють з часом зберігання, але не обов’язково з кількістю початкового THCA або CBDA, що вказує на незалежність механізму окислення від класичного декарбоксилювання.
Особливо важливо, що CBNA не утворюється в екстрактах, де забезпечено герметичне зберігання, низьку температуру і відсутність світла. У таких умовах навіть при тривалому зберіганні не відбувається значного накопичення CBNA, тоді як при порушенні умов він з’являється вже після кількох тижнів. Це дозволяє вважати CBNA специфічним біомаркером екологічної деградації екстрактів, на відміну від таких нестабільних молекул, як пероксиди або вільні радикали, які важко детектуються постфактум.
CBNA як хімічний індикатор фази зберігання рослинної сировини
Зі збереженням цілісної рослинної сировини CBNA проявляє себе як вторинний метаболіт, присутній у слідах навіть у незбираних зразках, однак його концентрація у висушених і тривало зберіганих рослинах зростає експоненційно. Цей феномен відображає процес автокаталітичного окиснення фітоканабіноїдів у присутності слідів металів, які мігрують із ґрунту у біомасу і активують реакції типу Фентона. CBNA в таких випадках може бути використаний не тільки для визначення строку зберігання, але і для реконструкції типу обробки (наприклад, теплове сушіння проти сублімаційного).
Кількісні аналізи CBNA у зберіганій біомасі корелюють із вмістом мікроелементів, зокрема заліза, міді та марганцю, які каталізують формування пероксидних форм CBDA або THCA, що переходять у CBNA шляхом неферментативного дегідрування. Умови вологості також мають критичне значення: при вологості понад 65% рівень CBNA зростає швидше, ніж рівень дегідроканабіноїдів, що свідчить про його термодинамічну перевагу у процесах спонтанного окиснення.
Також CBNA виявляється у порошках, призначених для фармацевтичного використання, при порушенні умов стабілізації. За даними досліджень, проведених зразками рослин, зберіганих понад 12 місяців, вміст CBNA зростав у 5-9 разів при кімнатній температурі у відкритому повітрі, порівняно із кріозберіганням. Тому його кількість може використовуватись для ретроспективного аудиту умов зберігання партій сировини, навіть у випадку втрати первинної документації.
CBNA у старих смолах, гашиші та оліях: фіксація структурної деградації
Виявлення CBNA у таких матрицях, як гашиш, канабісові смоли, настоянки або суперконцентровані CO2-екстракти є свідченням тривалого термічного та окисного навантаження. У смолах CBNA з’являється не як первинна кислота, а як результат вторинного перетворення після деградації нейтральних форм. Особливо високий вміст CBNA відзначається у гашишах, виготовлених за традиційною технологією із сильним термічним пресуванням. Аналіз таких зразків методом високороздільної мас-спектрометрії показав наявність CBNA в кількостях до 2% від сухої маси, що значно перевищує його концентрації у свіжих продуктах.
У фракціонованих екстрактах CBNA накопичується у ліпофільній фазі при зберіганні понад 6 місяців за температур вище 20°C. Особливо це стосується фракцій на основі рослинних масел, де високий вміст полінасичених жирних кислот сприяє автоокисненню. CBNA в таких умовах не є просто побічним продуктом, а структурно взаємодіє з окисненими тригліцеридами, утворюючи ліпофільні комплекси, які змінюють розчинність і фармакокінетику всього препарату. Це призводить до того, що CBNA не екстрагується стандартними органічними розчинниками і вимагає попередньої реактивації за допомогою кислотного гідролізу.
CBNA також був виявлений у старих алкогольних настоянках, де алкоголь не перешкоджав окисненню, а навпаки, через свою гігроскопічність, сприяв гідратації середовища, що активує реакції дегідрування. Особливо високі рівні CBNA знайдені у зразках настоянок, що зберігалися у прозорому склі при кімнатному освітленні – за таких умов концентрації сягали 3-4% від загальної маси канабіноїдів.
Інженерні підходи до стабілізації CBNA
Мікроінкапсуляція як метод захисту
Мікроінкапсуляція – це технологія, що активно використовується в фармацевтичній промисловості для створення систем доставки лікарських засобів, в тому числі й для канабіноїдів. Одним із основних завдань мікроінкапсуляції є захист активних молекул від деградації, що є критичним фактором для речовин, чутливих до навколишнього середовища, як CBNA. Молекули канабіноїдів схильні до розкладу під впливом світла, тепла, кисню та інших факторів навколишнього середовища, що значно знижує їх ефективність і стабільність. Мікроінкапсуляція дозволяє обернути ці молекули в захисну оболонку, яка не тільки зберігає їх стабільність, але й дозволяє контролювати вивільнення активної речовини.
Одним із найефективніших методів є використання полімерних матеріалів для формування мікросфер або мікрокапсул, які можуть бути виготовлені як з біорозкладних, так і з синтетичних полімерів. Ці матеріали формують бар’єр навколо канабіноїду, що запобігає його прямому контакту з навколишнім середовищем, забезпечуючи таким чином стабільність протягом тривалого періоду. Наприклад, полімери, такі як PLGA (полілактид-ко-галактид), використовуються для створення мікросфер, здатних вивільняти активну речовину поступово.
Крім того, мікроінкапсуляція дозволяє значно покращити біодоступність CBNA. В умовах орального або перорального прийому канабіноїд може бути схильний до розпаду в травному тракті, що знижує його ефективність. Мікроінкапсульовані системи захищають активну молекулу від агресивних умов середовища і забезпечують доставку через стінки кишечника до місця дії. Це дозволяє уникнути першопрохідного метаболізму в печінці, що часто є проблемою при застосуванні багатьох лікарських засобів.
Завдяки використанню мікроінкапсуляції можна створити багатофункціональні препарати, які включають в себе стабільний канабіноїд та інші активні компоненти для посилення терапевтичної дії. Наприклад, можна інкапсулювати CBNA разом з іншими сполуками, що мають протизапальні властивості, таким чином забезпечуючи комбіновану терапію для пацієнтів з хронічними запальними захворюваннями.
Вивчення матриць з уповільненим вивільненням CBNA
Підхід із використанням матриць з уповільненим вивільненням є одним із найбільш важливих для контролю за тим, як CBNA вивільняється в організмі. Це дозволяє зберегти рівномірний рівень активної речовини в організмі протягом тривалого часу, уникати високих піків концентрації, що можуть призвести до побічних ефектів, та забезпечити більш ефективне лікування.
Матриці з уповільненим вивільненням можуть бути розроблені за допомогою різних типів полімерів, що здатні до деградації під впливом фізіологічних умов організму. Це дозволяє канабіноїду вивільнятися поступово і забезпечувати постійну терапевтичну концентрацію на тривалий час. Одним з основних полімерів, що використовуються в таких системах, є PLGA. Він широко застосовується у фармацевтиці завдяки своїй здатності до біорозкладу та хорошій сумісності з організмом. PLGA матриці можуть бути налаштовані таким чином, щоб вивільнення CBNA відбувалося протягом тижнів або навіть місяців, що дозволяє значно зменшити частоту прийому препарату.
Інші полімери, такі як колаген, альгінат, желатин, а також біорозкладні полімери на основі лактідних з’єднань, також активно використовуються для створення матриць з уповільненим вивільненням. Наприклад, система на основі альгінату може бути використана для створення матриць, що дають можливість CBNA вивільнятися лише при зміні pH в шлунково-кишковому тракті.
Ці матриці можуть бути інтегровані з іншими активними сполуками, що допомагає поліпшити ефективність лікування за допомогою багатокомпонентних систем. Наприклад, крім CBNA в такі матриці можуть бути включені протизапальні препарати або інші канабіноїди для посилення ефекту.
CBNA у біополімерних носіях
Застосування біополімерних носіїв для стабілізації та доставки CBNA вимагає серйозного підходу до вибору відповідних матеріалів, оскільки ці полімери мають бути не тільки біосумісними, але й біорозкладними. Біополімери, такі як хитозан, альгінати, гіалуронова кислота та інші, дозволяють створювати стабільні системи, що є екологічно чистими і менш токсичними, ніж синтетичні полімери.
Особливо цікавою є здатність хитозану до формування наночасток, що дозволяє доставляти CBNA до специфічних тканин або органів. Хитозан – це природний полісахарид, що має відмінні властивості для створення матриць з уповільненим вивільненням, а також чудову здатність до біорозкладу і сумісності з біологічними системами. За допомогою хімічної модифікації можна створювати різноманітні структури, включаючи наночастки або мікросфери, що значно покращує біодоступність CBNA, дозволяючи йому поступово вивільнятися в організмі.
Альгінати, що отримуються з водоростей, також є перспективними носіями для CBNA. Вони здатні утворювати гелі при контакті з іонами кальцію, що дозволяє формувати стабільні системи, які можуть вивільняти CBNA при контакті з певними умовами організму, такими як температура або pH. Це дозволяє створювати ефективні системи для лікування хронічних захворювань, де необхідно підтримувати постійну концентрацію канабіноїду протягом тривалого часу.
CBNA як модель для вивчення окиснених канабіноїдів
Канабіноїди є важливими біологічно активними молекулами, які займають значне місце в фармакології та токсикології завдяки своїм різноманітним фармакологічним ефектам. Одним з аспектів, який активно досліджується в контексті канабіноїдів, є їх окиснення в організмі. CBNA (канабінолова кислота) є важливим молекулярним аналогом, що відіграє ключову роль у розумінні процесів окислення канабіноїдів, а також їх метаболізму.
Окиснення канабіноїдів відбувається через багато різних механізмів, включаючи взаємодію з оксидантами, ферментативними системами, а також під впливом факторів навколишнього середовища. CBNA, як один з головних компонентів канабіноїдної кислоти, є ідеальним об’єктом для вивчення таких окислювальних процесів, оскільки містить незамкнуту піррольну структуру, що робить її чутливою до окисних агентів.
Дослідження окиснення CBNA допомагає вивчити не тільки зміни, що відбуваються на молекулярному рівні, але й виявити можливі токсичні продукти, які можуть виникати під час цього процесу. Ці знання мають вирішальне значення для розуміння того, як CBNA може перетворюватися на інші канабіноїди або на токсичні метаболіти, які можуть впливати на організм. Вивчення таких процесів у лабораторних умовах дозволяє створювати більш точні моделі для прогнозування побічних ефектів або взаємодій канабіноїдів в організмі людини.
Одним із важливих аспектів вивчення окиснення CBNA є дослідження ролі ферментів, таких як цитохром P450, у метаболізмі канабіноїдів. Ці ферменти здатні викликати окисні модифікації, що можуть як активувати, так і деактивувати канабіноїди, змінюючи їх біологічну активність. У цьому контексті CBNA виступає як модель для вивчення всіх етапів біохімічного процесу окислення канабіноїдів.
Аналітичні моделі розпаду канабіноїдів
Вивчення процесів розпаду канабіноїдів є важливою частиною токсикології, криміналістики та фармацевтичної науки, оскільки розуміння того, як канабіноїди розпадаються в організмі, допомагає вивести оптимальні методи лікування або діагностики. CBNA, як і інші канабіноїди, має складну хімічну структуру, що може бути розкладена різними методами, і тому розробка аналітичних моделей для вивчення цього процесу є дуже актуальним напрямом досліджень.
Основні методи аналізу розпаду канабіноїдів включають спектроскопічні методи, такі як мас-спектрометрія (MS), ядерний магнітний резонанс (NMR) та хроматографічні техніки, такі як газова хроматографія (GC) і рідинна хроматографія високої ефективності (HPLC). Мас-спектрометрія дозволяє вивчити молекулярні йонні пік, що відповідають за продукти розпаду, даючи детальну інформацію про молекулярну структуру і масу кожного з метаболітів.
Методи, засновані на високоефективній рідинній хроматографії (HPLC), також застосовуються для аналізу складних матриць, таких як біологічні рідини, сеча та кров, на наявність канабіноїдів та їх метаболітів. Важливим аспектом є те, що CBNA може розпадатися на декілька метаболітів, які мають різну хімічну структуру, що може ускладнити аналіз.
Розробка математичних моделей для передбачення швидкості і механізму розпаду CBNA є ключовою для покращення точності аналітичних методів. Застосування кінетичних моделей розпаду дозволяє визначити концентрацію активної речовини в організмі на різних етапах процесу метаболізму та вивчити, які фактори впливають на швидкість цього процесу.
CBNA як стандарт у криміналістичній хімії
CBNA має велике значення для криміналістичної хімії, особливо в контексті аналізу наркотичних засобів та визначення рівня їх вживання. Відповідно до міжнародних стандартів, криміналістичні лабораторії повинні мати точні методи для визначення канабіноїдів у біологічних зразках, таких як сеча, кров, волосся та інші тканини. CBNA, як один із ключових метаболітів канабідіолу, є важливим для створення стандартів і протоколів для криміналістичних досліджень.
Однією з найбільших проблем при вивченні канабіноїдів у криміналістичних дослідженнях є необхідність точного визначення їх концентрацій у біологічних рідинах, адже це дозволяє точно оцінити рівень вживання наркотичних речовин і встановити факт їх вживання на момент скоєння злочину. CBNA, як метаболіт, що утворюється після деградації канабідіолу, може служити надійним маркером для таких досліджень.
Мас-спектрометрія, хроматографічні методи та інші аналітичні підходи використовуються для детекції CBNA в біологічних зразках, що дозволяє точніше визначити рівень споживання канабіноїдів. Одним із важливих аспектів є виявлення CBNA в тілі на довгий час після вживання, оскільки цей метаболіт може залишатися в організмі ще довго, що дозволяє проводити ретроспективні дослідження.
Це також дає змогу виявляти канабіноїди навіть у випадках, коли користувач може стверджувати, що не вживав наркотичні речовини на момент злочину, і тим самим дає науково обґрунтовані дані для судових розслідувань.
Участь CBNA в хемомаркерних дослідженнях
Хемомаркерні дослідження стають все більш важливими в сучасній науці, оскільки вони дозволяють створювати точні біомаркери для виявлення різноманітних захворювань або для дослідження стану організму в певних умовах. CBNA може бути використана як один з хемомаркерів для вивчення ефектів канабіноїдів на організм, зокрема у контексті хронічних запальних захворювань, неврологічних порушень і навіть для вивчення ракових клітин.
Вивчення CBNA у хемомаркерних дослідженнях включає аналіз змін рівнів цього метаболіту в організмі за певних умов, що може допомогти у розробці нових методів діагностики та лікування. Це також дозволяє зрозуміти механізми, через які канабіноїди можуть змінювати хімічний склад організму і таким чином впливати на стан здоров’я.
Використання CBNA в хемомаркерних дослідженнях є важливим для розробки нових методів моніторингу хвороб, що можуть бути піддані терапевтичному впливу канабіноїдів. Це також дозволяє досліджувати можливі побічні ефекти, пов’язані з тривалим вживанням канабіноїдів, і зменшувати ризики, пов’язані з їх використанням в медичних цілях.
Висновок:
Вивчення канабінолової кислоти (CBNA) як молекули та її ролі в різних галузях науки, зокрема в хімії, фармацевтиці, криміналістиці та хемомаркерних дослідженнях, відкриває нові перспективи для розуміння біохімічних процесів та їх практичних застосувань.
По-перше, вивчення CBNA як моделі для дослідження окиснених канабіноїдів є важливим для розуміння механізмів окислення канабіноїдів в організмі. Канабіноїди, завдяки своїй хімічній структурі, чутливі до різних окислювальних агентів і можуть зазнавати трансформацій, що змінюють їх біологічну активність. Оскільки CBNA є одним із основних продуктів окиснення канабідіолу, його вивчення дозволяє глибше зрозуміти, як ці молекули взаємодіють з ферментами, такими як цитохром P450, а також які токсичні або терапевтичні метаболіти можуть виникати в результаті таких реакцій. Це знання є важливим для створення більш точних моделей біохімічних процесів і для прогнозування побічних ефектів канабіноїдів у людському організмі.
По-друге, аналітичні моделі розпаду канабіноїдів, зокрема CBNA, мають ключове значення для розвитку методів детекції канабіноїдів у біологічних зразках. Високоефективні методи, такі як мас-спектрометрія, газова та рідинна хроматографія, дозволяють точно визначити концентрацію канабіноїдів та їх метаболітів, а також аналізувати механізми їх розпаду. Оскільки CBNA є важливим метаболітом, який може залишатися в організмі довгий час після вживання канабідіолу, її виявлення може бути ключовим для криміналістичних розслідувань та ретроспективного аналізу.
Третім важливим аспектом є роль CBNA в криміналістичній хімії. Оскільки канабіноїди, зокрема CBNA, можуть бути маркерами вживання канабідіолу та інших канабіноїдів, точна детекція і аналіз цих молекул дозволяють відновлювати історію вживання наркотичних речовин, що є важливим для правозастосування. Методи детекції канабіноїдів у біологічних зразках дозволяють не лише встановити факт їх вживання, а й допомогти в пошуку доказів у кримінальних розслідуваннях.
Участь CBNA в хемомаркерних дослідженнях дозволяє використовувати її як біомаркер для вивчення ефектів канабіноїдів на організм. Це відкриває нові можливості для моніторингу терапевтичного впливу канабіноїдів при лікуванні різних захворювань, а також для оцінки їх безпечності при тривалому застосуванні. CBNA може бути використана для виявлення метаболічних змін в організмі та для вивчення нових підходів до діагностики та лікування.
Загалом, CBNA є важливим інструментом для розуміння біохімічних та токсикологічних процесів, що відбуваються в організмі під час вживання канабіноїдів. Її дослідження має практичне значення для розвитку нових методів детекції, оцінки безпеки та ефективності терапевтичних застосувань канабіноїдів. Крім того, CBNA є важливим молекулярним індикатором для криміналістичних та хемомаркерних досліджень, що дозволяє розширити знання про взаємодію канабіноїдів з організмом людини і створювати нові методи для діагностики та лікування.
Джерела:
- Національний інститут з питань наркоманії (NIDA)
“Канабіноїди: Дослідження та наслідки для здоров’я” https://www.drugabuse.gov - PubMed Central (Національна бібліотека медицини США)
“Окислювальний стрес у канабіноїдів: молекулярна перспектива” https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4590129/ - Гарвардський університет – Медична школа Гарварда
“Терапевтичний потенціал канабіноїдів: огляд” https://hms.harvard.edu - Журнал Frontiers in Pharmacology
“Метаболіти канабіноїдів і їх роль у здоров’ї та захворюваннях” https://www.frontiersin.org/articles/10.3389/fphar.2020.569107/full - Журнал фармакології та експериментальної терапії
“Метаболізм канабіноїдів та їх роль у токсичності канабіноїдів” https://jpet.aspetjournals.org - Європейський моніторинговий центр з наркотиків та наркозалежностей (EMCDDA)
“Канабіноїди та їх клінічні ефекти” https://www.emcdda.europa.eu - Журнал Cannabis and Cannabinoid Research
“Похідні канабіноїдів у фармакології: механізми та клінічні застосування” https://www.liebertpub.com/can - ScienceDirect (Elsevier)
“Аналіз метаболітів канабісу в крові та сечі: аналітичні методи та клінічні застосування” https://www.sciencedirect.com - Міжнародний журнал нейропсихофармакології
“Розуміння метаболітів канабіноїдів: наслідки для терапії”
https://www.cambridge.org/core/journals/international-journal-of-neuropsychopharmacology - Журнал судової хімії
“Роль CBNA в судово-токсикологічних дослідженнях: виявлення та наслідки” https://www.forensic-sciences.org