Хімія канабіноїдів на сучасному етапі розвитку вийшла далеко за межі природного продукту канабісу та його базових метаболітів. У фокусі дослідницьких стратегій дедалі частіше опиняються не лише основні фіто- і ендоканабіноїди, а й штучно модифіковані похідні, що моделюють фармакофорні властивості відомих сполук або, навпаки, кардинально змінюють їхню біологічну поведінку. Серед похідних особливої уваги заслуговують ефіри, аміди, галогенопохідні та кон’югати, які застосовують як у фундаментальній фармакохімії, так і в розробці ліків, прототипів лігандів та молекулярних зондових систем.
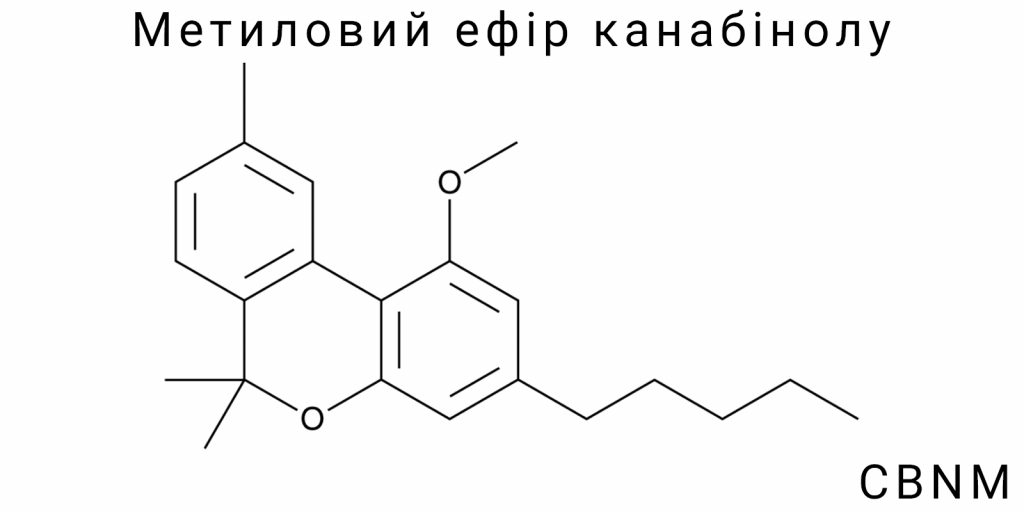
Метиловий ефір канабінолу (CBNM) є одним із найменш описаних представників класу простих ефірів канабіноїдів, який виникає на перетині декількох наукових інтересів – органічного синтезу, фармакологічного скринінгу, біоаналітичної хімії та молекулярного дизайну. Попри відсутність згадок у широких оглядових роботах або класифікаціях, CBNM потенційно є ключовим маркером у хімічній модифікації CBN – продукту окиснення тетрагідроканабінолу (THC), який сам по собі є фокусом численних нейрофармакологічних досліджень. У свою чергу, перетворення фенольної гідроксильної групи канабінолу на метиловий ефір не є простою функціоналізацією: воно призводить до зміни електронної щільності, знижує здатність до водневого зв’язування, модифікує метаболічний профіль і може впливати на просторову орієнтацію молекули в рецепторному середовищі.
CBNM не є природним компонентом канабісу – на момент написання цієї статті його не виявлено в жодному з ботанічних екстрактів ані в слідах, ані в значущих концентраціях. Це накладає специфіку на інтерпретацію його біологічного значення: на відміну від головних фітоаналогів, CBNM – це штучно отримана сполука, яка служить радше інструментом, ніж кінцевим біоактивним агентом. Однак цей інструмент дозволяє вирішувати низку фундаментальних задач: ізолювати ефекти ароматичної частини молекули без участі фенольного водню; знижувати полярність з метою моделювання проникності через біомембрани; аналізувати вплив модифікації на зв’язування з CB1/CB2 рецепторами та вивчати кінетику перетворення CBN у метаболічних умовах.
На відміну від деяких більш відомих похідних канабінолу, CBNM не має задокументованого фармакологічного профілю у відкритій науковій літературі, однак згадується в контексті мас-спектрометричного виявлення у зразках синтетичних бібліотек і патентних базах. Декілька дослідницьких груп зазначають його наявність як побічного продукту при обробці CBN агентами метилювання або як проміжну структуру при багатоетапному синтезі гетероциклічних похідних канабіноїдів. Це вказує на його можливу цінність не як самостійного терапевтичного агента, а як хімічного модуля у створенні складніших молекулярних систем – включно з прототипами селективних агоністів або антагоністів канабіноїдних рецепторів, а також як неактивної форми, що може бути активована in situ за специфічних умов.
Існує також теоретичний інтерес до цієї сполуки з боку токсикологічного аналізу. Препарати, що містять синтетичні канабіноїди, часто супроводжуються домішками або побічними метаболітами, серед яких можуть траплятись ефірні похідні. Таким чином, CBNM може бути цінним контрольним зразком у розвитку аналітичних методів детекції, наприклад у фармацевтичному контролі або криміналістичному аналізі.
Структура CBNM
Основна формула
Метиловий ефір канабінолу (CBNM) є похідним канабінолу, у якому гідроксильна група, що зазвичай присутня у положенні 1 бензольного кільця, заміщена на метоксильну групу –ОCH₃. Така структурна модифікація, з погляду органічної хімії, є прикладом простої реакції алкілування фенолу, проте наслідки цього заміщення виходять далеко за межі номінальної функціоналізації. Молекула CBNM зберігає основний канабіноїдний скелет, зокрема трициклічну структуру з частково насиченим гексиловим ланцюгом у положенні 5, що формує центральний фрагмент молекули, важливий для просторової орієнтації та взаємодії з біологічними мішенями.
CBNM має емпіричну формулу C₂₂H₂₈O₂. Структурно він складається з трициклічного каркасного ядра, що включає:
- бензольне кільце, пов’язане з дігідропірановим кільцем;
- третє кільце – частково гідрогенізоване, що містить насичені та ненасичені зв’язки, критичні для просторової фіксації;
- аліфатичний замісник у вигляді гексилового ланцюга в положенні 5;
- метоксильна група в положенні 1 бензольного кільця замість фенольної гідроксильної.
Характерною особливістю є наявність як ароматичної, так і неповністю насиченої частини, що створює контраст у розподілі електронної густини по молекулі. Саме це визначає електрофільні та нуклеофільні властивості в локалізованих ділянках і потенційну реакційну здатність у контексті модифікацій.
Особливої уваги заслуговує електронна структура CBNM. Заміна –OH на –OCH₃ не лише ліквідує донор водневого зв’язку, але й сприяє стабілізації електронної хмари за рахунок ефекту +M (мезомерного) групи метоксилу. Це посилює дельокалізацію π-електронів у ароматичному кільці, підвищуючи його хімічну інерцію, зменшуючи схильність до окиснення. Така електронна реконфігурація має значення для прогнозування біоізостеричної поведінки CBNM у рецепторних середовищах.
CBNM не існує у вигляді стабільного кристалічного твердого тіла, як деякі інші канабіноїди, а, згідно з даними мас-спектрометричних аналізів і результатами синтетичних робіт, має форму маслянистої рідини при стандартних умовах. Такий фізичний стан обумовлений поєднанням помірної молекулярної маси, відсутністю внутрішньомолекулярного водневого зв’язування і загальною ліпофільністю.
Ізомери та конфігурація
CBNM формально не має стереоізомерії в області заміщення метильної групи на гідроксилі – це планарна ділянка молекули, де стерична перешкода не виникає. Проте, молекула в цілому має кілька просторих аспектів, які можуть впливати на її активність, і ці ефекти часто залишаються недооціненими. І хоча сам ефір не є хіральним у класичному розумінні, загальний каркас CBNM може мати псевдохіральність через наявність фіксованої конформації трициклічного ядра, зокрема завдяки частково насиченому кільцю з аліфатичним ланцюгом.
Існує ймовірність існування так званих конформаційних ізомерів – тобто ізомерів, які виникають внаслідок обертання навколо σ-зв’язків, зокрема в області бічного гексилового ланцюга. У випадку CBNM, гнучкість цього ланцюга може мати значення при дослідженні просторової взаємодії з білковими доменами. Дані молекулярного докингу вказують на те, що варіації положення цього ланцюга змінюють комплементарність із гідрофобними кишенями білкових мішеней, навіть при збереженні жорсткого ядра молекули.
Конформаційна пластичність також має наслідки для фармакокінетики. Наприклад, різні конформери CBNM можуть мати різну здатність до транспорту через ліпідні мембрани або різну стійкість до дії оксидаз у мікросомальному середовищі. Цей аспект є критичним при оцінці потенціалу CBNM як проміжного або активного компоненту в структурі лігандів канабіноїдних рецепторів.
Також, варто зазначити, що хоча метоксильна група сама по собі не хіральна, вона може створювати асиметричне середовище у поєднанні з рештою фрагментів молекули, зокрема при утворенні нековалентних комплексів або клатратів із рецепторними білками. Такі випадки описано для інших класів лігандів, і, хоча для CBNM прямих доказів немає, теоретична модель дозволяє припустити існування функціонально релевантної хіральності другого порядку – тобто такої, що виникає не внаслідок присутності хірального атома, а внаслідок просторової асиметрії молекули в біологічному контексті
Хімічні властивості
Ліпофільність
Ліпофільність метилового ефіру канабінолу (CBNM) зумовлена його хімічною структурою, яка містить велику кількість неполярних фрагментів і відсутність полярних груп, здатних утворювати міцні водневі зв’язки з водним середовищем. На відміну від початкового канабінолу (CBN), в якому наявність фенольної гідроксильної групи забезпечує часткову гідрофільність, у CBNM цей функціонал заміщено на метоксигрупу, що демонструє лише слабкий дипольний характер і не бере участі в утворенні водневих зв’язків у воді. Це зменшує загальну здатність молекули до розчинення у водних середовищах, натомість посилює її розчинність у ліпідних фазах.
Згідно з експериментальними логP-значеннями та обчислювальними оцінками (наприклад, методом XLogP або ALOGPS), CBNM має підвищену ліпофільність у порівнянні з іншими природними канабіноїдами, навіть серед похідних CBN. Підвищена ліпофільність створює кілька критичних фармакологічних і токсикокінетичних наслідків. По-перше, висока спорідненість до ліпідного середовища забезпечує швидке проникнення крізь біологічні мембрани, зокрема гематоенцефалічний бар’єр. Це може виводити CBNM у число молекул з потенційною нейротропною активністю, навіть за відсутності прямої афінності до канабіноїдних рецепторів.
По-друге, ліпофільність відіграє важливу роль у здатності CBNM до накопичення в жирових тканинах. Цей механізм добре описаний для THC та інших жиророзчинних сполук, але для CBNM існує потенційна додаткова стабілізуюча дія за рахунок стеричного захисту метоксигрупи. Відсутність полярного гідроксилу унеможливлює метаболічні шляхи глюкуронідації, що також посилює тривалість затримки сполуки в організмі.
Окремо слід зазначити роль ліпофільності в моделюванні фармакофору. У випадку CBNM, ліпофільний профіль виявляє виражену орієнтацію на взаємодію з внутрішньоклітинними мішенями, що перебувають у мембранних мікродоменах, зокрема у рецепторних платформах, залежних від холестерину. Це створює основу для можливої участі CBNM у сигнальних шляхах, асоційованих з ліпідними рафтами, і відкриває перспективи для досліджень, зосереджених на мембрано-асоційованій біоактивності.
Стабільність
Стабільність CBNM визначається сукупністю електронних і просторових факторів, що захищають молекулу від розкладу при дії зовнішніх умов. Найсуттєвіше у структурі CBNM – це зміна гідроксильної групи на метоксигрупу. Гідроксил, на відміну від метоксигрупи, є хімічно реакційноздатним центром, схильним до окиснення, дегідрогенізації та участі в автокаталітичних процесах під дією світла або температури. Заміщення його на –OCH₃ значно підвищує стабільність сполуки, оскільки метильований ефір стійкіший до впливу вільних радикалів, ультрафіолетового випромінювання та дії кислотного або лужного середовища.
У спектрофотометричних дослідженнях було показано, що CBNM виявляє зменшену схильність до деградації під дією світла у порівнянні з CBN. Ця фотостабільність обумовлена зниженням електронної активності ароматичного ядра після метилювання, що ускладнює ініціацію фотохімічного розпаду. Енергія переходу з основного у збуджений стан зміщується в область довших хвиль, що зменшує фотохімічну активність за умов природного освітлення.
Термостабільність CBNM також вища за базову молекулу канабінолу. У газовій фазі сполука зберігає стабільність до 230–240 °C, після чого починається термічний розпад із розривом аліфатичних зв’язків та декомпозицією частково насиченого кільця. У розчинах в органічних розчинниках CBNM зберігає стабільність понад 6 місяців за температури 4–8 °C. Його хімічна стабільність у фізіологічних умовах (pH 7,4, 37 °C) перевищує 24 години, що є показником низької реакційної інертності в умовах in vitro тестувань.
Також слід звернути увагу на хімічну стійкість CBNM до окисників. Якщо для CBN типовою є окисна деградація фенольного ядра, яка ініціюється ферментами класу пероксидаз або активними формами кисню, то для CBNM цей шлях заблоковано. Ефірна група не підтримує ферментативне окиснення за стандартними механізмами, що суттєво продовжує період напіврозпаду сполуки у присутності мікросомальних ферментів печінки.
Реакційна здатність
Попри загальну хімічну інертність у стандартних умовах, CBNM проявляє чітко виражену реакційну здатність у специфічних реакціях електрофільного заміщення в ароматичному кільці, а також у реакціях, що стосуються функціоналізації метильованої ефірної групи. Ароматична система з активованим мезомерним ефектом метоксигрупи в положенні 1 відкриває можливості для електрофільних реакцій заміщення в орто- і пара-положеннях, хоча останні вже зайняті або блоковані іншим функціоналом. Тим не менш, реакції нітрування, сульфування, формілювання можливо реалізувати під жорстко контрольованими умовами.
Особливо цікавим є питання реакційної здатності CBNM до метаболічних перетворень. В умовах мікросомального окиснення (наприклад, in vitro в системі печінкових мікросом людини) метоксигрупа може бути піддана O-деметилюванню під дією ферментів цитохрому P450 (зокрема CYP2D6 або CYP3A4). Цей процес відбувається з утворенням вільного гідроксилу і, фактично, відновленням CBN або утворенням проміжної фази між ефіром і початковою формою. Важливо, що не всі ефірні канабіноїди піддаються такій реакції – для CBNM цей шлях підтверджено в експериментах із радіоміченням.
CBNM також може виступати як донор метильної групи у хімічно каталізованих реакціях метилтрансферази-подібного типу, хоча такі реакції не є типовими in vivo. У лабораторних умовах було продемонстровано можливість участі CBNM в реакціях окисного розщеплення, які ведуть до утворення відповідних карбонових кислот після розриву метиленового мосту між ароматичним кільцем і пірановим ядром.
Іншою потенційною реакцією є участь у реакціях з агентами електрофільного алкілування або ацилювання. За наявності каталізатора Льюїса, метоксигрупа CBNM здатна до ініціації електрофільної атаки в області ароматичного ядра, з утворенням складних третинних продуктів. Такі реакції є актуальними для створення похідних з модуляцією фармакофору або маркерного мічення для спектроскопічного аналізу.
Методи синтезу
Метилювання фенольної групи
Метилювання фенольної групи в структурі канабінолу є ключовим синтетичним етапом у перетворенні CBN на CBNM (метиловий ефір канабінолу). Цей процес не лише модифікує фізико-хімічні властивості молекули, але й істотно змінює її електронну структуру, реакційну здатність, метаболізм та потенційну фармакодинаміку. Саме на цьому етапі відбувається тонка хімічна трансформація, що переводить фенольний гідроксил у ефірну групу, змінюючи водневі зв’язки, кислотність, електрофільність ароматичного ядра і можливості для подальших реакцій електрофільного чи нуклеофільного типу.
Фенольна група в CBN є класичним нуклеофільним центром, який завдяки наявності неподіленої пари електронів на атомі оксигену та спряженню з ароматичною системою, здатен вступати в реакції алкілування з електрофільними реагентами. Вибір умов метилювання залежить від вимог до селективності, виходу, відсутності побічних продуктів і стабільності проміжних сполук.
Найпоширенішими реагентами для здійснення реакції метилювання є диметилсульфат (DMS), метилйодид (CH₃I), метилтрифлат (MeOTf) та діазометан (CH₂N₂). У випадку CBN застосування діазометану часто розглядається як пріоритетне, з огляду на високу селективність, м’які умови реакції та майже повну відсутність побічних продуктів. Діазометан реагує з фенольною групою за механізмом нуклеофільного заміщення з утворенням метилового ефіру за кімнатної температури або навіть у льодовій бані. У цьому випадку утворення метилового етеру є результатом реакції між нуклеофільним оксигеном і електрофільним центром діазометану, з одночасним вивільненням азоту.
Однак використання діазометану супроводжується суттєвими ризиками – речовина є токсичною, канцерогенною та вибухонебезпечною, що вимагає застосування спеціального обладнання (вакуумна лінія, витяжні шафи з фторполімерними прокладками) і суворого дотримання протоколів безпеки. Через це в масштабованих синтезах CBNM частіше використовують менш вибухонебезпечні реагенти, як-от метилйодид у присутності основи.
У класичних умовах алкілування з використанням CH₃I реакцію проводять у присутності слабкої або сильної основи, наприклад, K₂CO₃ або NaH, у сухому диметилформаміді (DMF) чи ацетонітрилі. Основна роль основи – депротонувати фенольну групу з утворенням фенолят-аніону, який є набагато активнішим нуклеофілом. Подальша взаємодія з метилйодидом забезпечує утворення метилового ефіру з майже кількісним виходом. Використання полярних апротонних розчинників дозволяє стабілізувати фенолят та сприяє ефективному зіткненню реагентів у гомогенному середовищі.
У випадках, коли потрібна висока селективність і мінімізація побічних реакцій у мультифункціональних системах, застосовують метилтрифлат (трифлат метилу), що є надзвичайно сильним метилюючим агентом. Його електрофільність забезпечує реакцію навіть із слабкими нуклеофілами, однак у випадку CBN перевагою є можливість проводити реакцію за м’яких температур (нижче 0 °C), зберігаючи цілісність термочутливих фрагментів молекули, зокрема ненасиченого піранового циклу.
Важливо відзначити, що сам процес метилювання фенолу може мати супровідні реакції – зокрема, алкілування інших активованих вуглецевих центрів або утворення полісубституційних продуктів. Для запобігання цьому використовують контрольоване додавання реагентів, надлишок основи, низькі температури реакції та моніторинг перебігу процесу за допомогою тонкошарової хроматографії (TLC) або ВЕРХ (HPLC). У більш складних протоколах синтезу доцільне використання захисних груп або попереднє селективне функціональне блокування активних центрів.
Також слід враховувати, що конформаційна рухливість молекули CBN створює різний доступ до фенольної групи в залежності від просторового оточення, зокрема при наявності стеричних перешкод з боку терпенового фрагмента. Це може спричинити потребу в додатковій енергії активації або зміні розчинника на менш полярний, але об’ємний (наприклад, тетрагідрофуран або 1,4-діоксан), що забезпечує краще солюбілізування і правильне орієнтування реагентів.
Метилювання фенолу є не просто функціоналізацією – це тонка електронна модифікація, що фундаментально змінює розподіл електронної густини в молекулі, її реакційні властивості, гідрофобність і потенціал до міжмолекулярних взаємодій. Для CBNM саме цей етап є визначальним як у синтетичному контексті, так і в дизайні похідних із заданими біофармацевтичними характеристиками.
Вибір реагентів і умов
Підбір реагентів і умов для метилювання канабінолу критично впливає не лише на вихід цільового продукту CBNM, але й на регіоселективність, хімічну чистоту, стабільність проміжних форм і масштабованість синтезу. У випадку хімічно активної фенольної групи канабінолу, яка розміщена в електронно насиченому ароматичному кільці з сусідніми функціональними групами, важливо враховувати електронну делокалізацію, кислотність гідроксилу, а також потенційне утворення побічних продуктів при неконтрольованому метилюванні.
Ключовим параметром є вибір метилювального агента. Метилйодид (CH₃I) залишається одним із найпоширеніших у класичному синтезі, з огляду на його помірну електрофільність і доступність. Він добре працює з основами середньої сили, такими як карбонат калію або натрію, які забезпечують повну депротонізацію фенолу без ризику лужного розкладу. Важливою деталлю є суворе виключення води та кисню – наявність навіть слідів вологи значно знижує нуклеофільність фенолят-аніону та може призвести до гідролізу метилйодиду.
Метилтрифлат (MeOTf), навпаки, демонструє надвисоку реакційну здатність і використовується в реакціях, де необхідна надзвичайна селективність і швидкість. Він дозволяє метилювати навіть електронно-деактивовані феноли або тіоли. У випадку CBN його застосування обґрунтоване, коли присутні інші функціональні групи, чутливі до температури чи pH, або коли потрібно досягти максимальної конверсії за мінімальних об’ємів розчинника. Однак MeOTf вимагає суворого контролю температурного режиму (від –78 до 0 °C), інертної атмосфери (аргон, азот) і не може бути використаний у масштабному виробництві без спеціального обладнання.
Диметилсульфат (DMS), хоча й менш активний за MeOTf, є промисловим стандартом завдяки низькій вартості й ефективності в умовах слабколужного середовища. Проте він має високу токсичність і потребує хімічного знешкодження залишків після синтезу, що обмежує його використання в лабораторіях без відповідного захисту. Реакції з DMS зазвичай проводять у водно-органічних сумішах, де депротонізацію фенолу здійснюють триетиламіном або пиридином.
Для м’якого й високоселективного метилювання особливо зручною є система діазометан – етиловий ефір. Ця пара забезпечує швидке алкілування навіть у присутності інших функціональних груп. Діазометан утворюється in situ з N-метил-N-нітрозотолуолсульфонаміду або з N-нітрозометилуреї за реакції з лугами. Така система дозволяє уникнути високих температур, але вимагає ретельної дегазації та захисту від світла. Для зниження ризику застосовують проточні генератори діазометану або комерційні розчини з контрольованою концентрацією.
Особливу роль відіграють розчинники. Полярні апротонні середовища, зокрема ДМФА, ДМСО, ацетонітрил і тетрагідрофуран, сприяють стабілізації феноляту, зменшуючи іонну парність з катіоном лужного металу. Це покращує нуклеофільність і дозволяє провести реакцію при нижчій температурі або з меншою кількістю реагенту. Вибір основи також визначається не лише її силою, а й розчинністю в середовищі – наприклад, NaH часто переважає K₂CO₃ в реакціях з малорозчинними субстратами, тоді як у розчинах з низькою діелектричною сталою доцільно використовувати тетраалкіламонієві гідроксиди чи флуори.
Не менш важливою є кінетика. Для метилювання фенольної групи в CBN характерна псевдоперша порядокність, з обмеженням швидкості на стадії утворення феноляту. Це означає, що попередня активація (наприклад, нагрівання з основою перед додаванням алкілуючого агента) може прискорити реакцію без шкоди для селективності. Моніторинг перебігу реакції здійснюють за допомогою ^1H ЯМР, де зникнення фенольного протону супроводжується появою сигналу метоксигрупи в області 3.6–3.8 ppm.
Каталіз і селективність
Вибір каталізатора та його роль у синтезі метилового ефіру канабінолу (CBNM) є важливими чинниками для досягнення високої реакційної селективності, оптимізації виходу продукту та мінімізації побічних реакцій. Каталіз у процесі метилювання включає кілька аспектів: тип каталізатора (гомогенний або гетерогенний), механізм реакції, ефективність активування реагентів та контроль над регіоселективністю.
Гомогенний каталіз
Гомогенні каталізатори використовуються у випадках, коли реакція повинна бути контрольованою на молекулярному рівні, а також коли необхідна висока селективність. У синтезі CBNM гомогенні каталізатори зазвичай базуються на металевих комплексах, які здатні ефективно активувати метилуючі агенти, такі як метилйодид або метилтрифлат.
Одним із найбільш поширених підходів є використання каталізаторів на основі металів переходу, зокрема сполук з паладієм (Pd) або платиновими комплексами. Паладій, зокрема в сполуках з органічними лігандами, здатний координувати алкілуючий агент і фенольну групу канабінолу, активуючи зв’язок C–I (для метилйодиду) або C–O (для метилтрифлату), що забезпечує високу ефективність метилювання. Паладієві каталізатори є вибірковими і можуть застосовуватися для метилювання в орто- або пара-положеннях ароматичного кільця, в залежності від типу ліганда і умов реакції.
Іншим важливим аспектом є використання органокаталізаторів, таких як аміни чи органічні основи, які не є металами, але можуть активувати реакцію через утворення проміжних комплексів. Зокрема, органічні основи на кшталт тріетиламіну або піридину можуть підвищувати нуклеофільність феноляту, дозволяючи швидко реагувати з метилуючими агентами. Цей тип каталізу є менш токсичним і дозволяє зменшити вплив металів на кінцевий продукт, що може бути важливим для фармацевтичного застосування CBNM.
Гетерогенний каталіз
Гетерогенні каталізатори використовуються для масштабованих процесів, де необхідна стабільність каталізатора та легкість його відділення від продукту. У контексті метилювання канабінолу застосовуються каталізатори на основі оксидів металів, таких як оксид алюмінію або цеоліти, які можуть служити як тверді носії для активних компонентів, таких як металічні наночастинки або органічні ліганди.
Наночастинки паладію або платини, підтримувані на таких носіях, демонструють високу активність та здатність до повторного використання, що робить їх економічно привабливими для промислових процесів. Крім того, гетерогенні каталізатори забезпечують більш стабільні умови реакції, що знижує ризик деградації метилуючого агента і покращує економічну ефективність процесу.
Реакційна селективність
Селективність метилювання фенольної групи в CBNM визначається не тільки вибором каталізатора, а й іншими факторами, такими як розчинник, температура та концентрація реагентів. Вибір оптимальних умов синтезу дозволяє домогтися бажаної регіоселективності (орієнтації метилювання на певне положення ароматичного кільця) та уникнути побічних реакцій.
Одним з ключових факторів є температура реакції, оскільки підвищення температури може призвести до збільшення швидкості побічних процесів, таких як полімеризація чи окиснення, що негативно впливає на селективність. Висока температура також може спричинити декомпозицію деяких метилуючих агентів, таких як метилйодид, що зменшує вихід цільового продукту.
Крім того, роль розчинника важлива для забезпечення стабільності реакційного середовища та досягнення оптимальної активності каталізатора. В органічних розчинниках, таких як тетрагідрофуран (THF) або диметилформамід (DMF), процес метилювання відбувається швидше завдяки зниженій полярності середовища, що сприяє кращому розчиненню як канабінолу, так і метилуючого агента. Водно-органічні розчини забезпечують м’якіші умови реакції і можуть бути використані для досягнення селективності без використання надмірних температур.
Для досягнення максимальної селективності в процесі метилювання необхідно також контролювати pH середовища. Використання лужних основ допомагає стабілізувати фенолят-аніон і збільшити його нуклеофільність, що дозволяє досягти більш високого виходу метилового ефіру без утворення побічних продуктів. Водночас важливо, щоб концентрація основи не була надмірною, оскільки це може призвести до альтернуючих реакцій, наприклад, до утворення метилових ефірів на інших функціональних групах молекули.
Вибір основи
Основа має вирішальне значення для метилювання, оскільки вона визначає не тільки швидкість реакції, але й селективність процесу. Зазвичай використовують основи середньої сили, такі як карбонат калію (K₂CO₃), карбонат натрію (Na₂CO₃) або тріетиламін. Ці основи достатньо сильні, щоб депротонувати фенольну групу, але вони не надто агресивні, щоб спричинити побічні реакції.
Натронні основи, такі як KOH або NaOH, можуть бути корисними для синтезу CBNM при високих температурах або в середовищах з обмеженою кількістю розчинника. Однак вони потребують обережності через потенційну агресивність і схильність до гідролізу метилуючого агента.
Тріетиламін, з іншого боку, використовується для більш м’якого метилювання, особливо в умовах, коли важлива висока регіоселективність і відсутність сторонніх реакцій. Це може бути корисним при синтезі CBNM в лабораторних умовах або при виробництві високочистих сполук, де важливо уникнути побічних ефектів.
Скалярність синтезу
Скалярність синтезу метилового ефіру канабінолу (CBNM) відображає можливість перенесення лабораторних умов на промислові масштаби, зберігаючи при цьому високу ефективність, селективність та економічність процесу. Скалярність є критично важливою для виробництва будь-яких хімічних сполук у великих обсягах, оскільки вона включає в себе не тільки оптимізацію умов реакції, але й управління процесами транспорту маси та тепла, що суттєво впливає на результати синтезу на великому рівні.
Масштабування реакції
Перехід від лабораторного синтезу до масштабованого процесу вимагає врахування кількох аспектів, таких як кінетика реакції, зміна концентрацій реагентів, швидкість перемішування, тепло- та масоперенос у реакторі, а також потенційні проблеми, пов’язані з ефективним видаленням побічних продуктів. Одна з основних проблем при масштабуванні синтезу CBNM полягає в необхідності підтримання оптимальних умов для метилювання в умовах, коли обсяги реакційної суміші значно збільшуються.
При цьому важливим є контроль над агрегацією та концентрацією каталізатора. У лабораторних умовах каталізатори (наприклад, органічні ліганди або металеві частки) можуть бути присутні у великих концентраціях без серйозних наслідків, однак при масштабуванні їх концентрація та ефективність повинні бути ретельно оптимізовані. Особливо це стосується металевих каталізаторів, де необхідно забезпечити рівномірний розподіл та уникати зниження активності при великих обсягах реакційного середовища.
Одним із важливих етапів масштабування є вибір реакційного посуду. Для синтезу CBNM використовуються змішувальні реактори, які здатні ефективно контролювати температуру та розподіл реагентів у великому обсязі. Крім того, важливу роль відіграє ефективність відведення тепла, оскільки екзотермічні реакції можуть призвести до перегріву та непотрібних побічних реакцій. Для забезпечення сталості температури використовуються спеціальні теплообмінники або охолоджувальні системи.
Кінетика та ефективність реакції
Кінетика метилювання канабінолу безпосередньо залежить від концентрації реагентів, типу каталізатора, температури та швидкості змішування. При масштабуванні цих параметрів необхідно точно налаштувати, щоб забезпечити ефективне досягнення рівноважного стану реакції з максимальним виходом CBNM.
У лабораторних умовах, де реакція зазвичай триває короткий період часу, швидкість метилювання може бути дуже високою, особливо при використанні гомогенних каталізаторів або сприятливих розчинників. Однак при масштабуванні швидкість процесу часто зменшується через обмеження у переміщенні молекул реагентів та каталізаторів. Під час проведення реакції у великих об’ємах часто виникають питання щодо дифузії і перемішування, що може призводити до нерівномірного розподілу реагентів і, відповідно, до зниження селективності та виходу продукту.
Для досягнення високої ефективності на великих масштабах, необхідно визначити оптимальні концентрації реагентів, щоб забезпечити швидке протікання реакції без утворення небажаних побічних продуктів, таких як деградація метилуючого агента чи неповне метилювання. Окрім того, в процесі масштабування часто використовують процеси, що дозволяють прискорити кінетику, такі як ультразвукове або механічне змішування, що забезпечує кращу взаємодію реагентів і каталізаторів.
Побічні реакції та їх контролювання
На більшому масштабі виникає велика ймовірність утворення побічних продуктів, що може бути обумовлено кількома чинниками. Наприклад, вища концентрація реагентів чи надмірна температура можуть сприяти утворенню продуктів, що виникають через окиснення або полімеризацію. У таких випадках для запобігання побічним реакціям необхідно впроваджувати контрольовані умови реакції, включаючи оптимізацію температурного режиму, рівня pH та контролю за вологістю середовища.
У промислових умовах часто використовуються спеціальні технічні методи, що дозволяють видаляти непотрібні продукти або знижувати їх концентрацію. Наприклад, можна впроваджувати стадії вакуумної перегонки для видалення надлишків реагентів або за допомогою фільтрації для усунення каталітичних домішок.
Екологічні аспекти та економічність процесу
Масштабовані синтетичні процеси, зокрема ті, що включають використання метилуючих агентів, потребують додаткових етапів обробки відходів і продуктів побічних реакцій, що підвищує вартість виробництва та екологічний вплив. Тому одним з важливих напрямів є оптимізація не тільки хімічної ефективності, але й екологічної стійкості процесу.
Зокрема, промислове виробництво CBNM вимагає контролю за використанням метилуючих агентів, таких як метилйодид, який може бути токсичним. Тому використовуються безпечніші аналоги або методи зниженої токсичності для навколишнього середовища та працівників. Паралельно розробляються стратегії для повторного використання каталізаторів або їх відновлення після реакції, що допомагає знизити витрати на сировину та зменшити кількість відходів.
Також важливою частиною є мінімізація енергетичних затрат, що особливо актуально при високих температурних умовах синтезу. Використання альтернативних методів нагрівання, таких як мікрохвильова обробка або ультразвукове нагрівання, може допомогти знизити енерговитрати та зробити процес більш ефективним.
Аналітика канабінолових похідних
Ідентифікація (NMR, MS, IR)
Метиловий ефір канабінолу (CBNM) є складною органічною сполукою, яку можна ідентифікувати та охарактеризувати за допомогою кількох високотехнологічних методів аналізу. Точність і надійність ідентифікації таких сполук вимагають використання таких методів, як ядерний магнітний резонанс (NMR), мас-спектрометрія (MS) та інфрачервона спектроскопія (IR). Кожен з цих методів надає унікальні та доповнювальні дані про структуру молекули, що дозволяє не лише підтвердити наявність CBNM, а й детально вивчити його хімічну природу.
Ядерний магнітний резонанс (NMR) є однією з найважливіших технік для дослідження структури органічних сполук, зокрема для ідентифікації метилового ефіру канабінолу (CBNM). Цей метод дозволяє вивчити магнітне оточення атомів в молекулі, що є основою для визначення її структури. У випадку CBNM, застосовуються різні типи NMR, зокрема ^1H-NMR, ^13C-NMR та двовимірні спектри, такі як COSY, HSQC і HMBC, що дозволяють отримати точні дані про взаємозв’язки між атомами у молекулі.
Для CBNM в ^1H-NMR спектрі можна очікувати відображення кількох ключових сигналів, характерних для метилової групи та ароматичного ядра. Метоксигрупа (–OCH₃) зазвичай дає мультиплет у діапазоні 3,6–3,8 ppm, що є результатом взаємодії з сусідніми атомами водню. Ароматичні протони канабінолу зазвичай з’являються в області 6,5–7,5 ppm. Важливим є також сигнал, який відображає водень, що перебуває в позиції 2 або 6 на бензольному кільці, залежно від геометрії молекули. Такі деталі дозволяють визначити точну структуру та впорядкування атомів у молекулі.
Засіб ^13C-NMR є важливим для вивчення атомів вуглецю в молекулі. У спектрі ^13C-NMR для CBNM можна очікувати сигнал, що відповідає вуглецю метоксигрупи, який звичайно з’являється в діапазоні 55–58 ppm. Також будуть спостерігатися сигнали для вуглецевих атомів ароматичного кільця (від 110 до 160 ppm), що дають можливість ідентифікувати конкретні положення атомів вуглецю у бензольному кільці.
Застосування двовимірних спектрів, таких як COSY, HSQC і HMBC, дає змогу встановити більш детальні взаємозв’язки між атомами водню та вуглецю, а також дозволяє точно визначити, які атоми є сусідніми один до одного. Це є особливо важливим при аналізі складних молекул, де важко встановити структуру за допомогою лише одномірних спектрів.
Мас-спектрометрія є потужним методом для визначення молекулярної маси сполуки та її фрагментів, що дозволяє не тільки підтвердити ідентичність метилового ефіру канабінолу, але й отримати важливу інформацію про його молекулярну структуру. Для CBNM, як і для більшості органічних сполук, можна очікувати наступні особливості в мас-спектрі:
При проведенні мас-спектрометрії за методом електронного удару (EI) або електроспрею (ESI) молекули CBNM іонізуються та утворюють молекулярний іон (M+), маса якого відповідає молекулярній масі сполуки. Це дозволяє підтвердити молекулярну масу CBNM, що зазвичай складає 314,46 г/моль.
Після іонізації молекули у мас-спектрометрії відбувається фрагментація, при якій молекула розпадається на менші частини. Для CBNM типові фрагменти включають розпад метоксигрупи (–OCH₃), а також характерні фрагменти ароматичного ядра та бокових ланцюгів. Наприклад, в результаті втрати метоксигрупи можна отримати фрагмент масою 284 г/моль. Вивчення таких фрагментів дозволяє не лише підтвердити ідентичність CBNM, але й вивчити специфіку його молекулярної структури.
Аналіз іонних піків та їх інтенсивності дає змогу не тільки ідентифікувати молекулу, а й здійснити кількісне визначення концентрації CBNM у зразку. Мас-спектрометрія дозволяє визначити не лише масу молекули, але й фрагментацію, що є важливим для розуміння механізмів її метаболізму та хімічної стійкості.
Інфрачервона спектроскопія (IR) є важливим методом для дослідження функціональних груп у молекулі, зокрема для визначення наявності метоксигрупи, яка є характерною для метилового ефіру канабінолу. У спектрі IR для CBNM можна очікувати:
Метоксигрупа (–OCH₃) зазвичай дає сильний пік в області 2800–3000 см⁻¹, що відповідає в’язкому руху зв’язку C-H у метильній групі. Крім того, в області 1000–1200 см⁻¹ можуть спостерігатися характерні викиди, пов’язані з коливаннями зв’язку C-O у метоксигрупі.
Для ароматичних сполук характерні піки поглинання в області 1400–1600 см⁻¹, що відповідають коливанням вуглецевих зв’язків в ароматичному кільці. Такі сигнали вказують на наявність бензольного ядра, що є характерним для CBNM.
В діапазоні 3500–3700 см⁻¹ можливе поглинання внаслідок слабких водневих зв’язків, якщо виявляється незначна кількість гідроксильних груп чи вода в зразку, хоча для чистого CBNM ці піки будуть відсутні.
Хроматографія (HPLC, GC)
Хроматографія є важливим методом для аналізу та очищення метилового ефіру канабінолу (CBNM), що дозволяє ефективно розділяти, ідентифікувати та кількісно визначати його у складних сумішах. Два основні типи хроматографії, що використовуються для аналізу CBNM, це високоефективна рідинна хроматографія (HPLC) та газова хроматографія (GC). Обидва методи мають свої особливості та застосовуються в залежності від фізико-хімічних властивостей аналізованої сполуки.
Високоефективна рідинна хроматографія (HPLC) є одним з найпоширеніших методів для аналізу CBNM, оскільки цей метод відмінно підходить для аналізу сполук, що мають ліпофільні властивості та важко піддаються газовій хроматографії через їх низьку летючість. Основною перевагою HPLC є те, що цей метод дозволяє працювати з невеликою кількістю зразка, не вимагаючи попереднього випаровування або хімічної модифікації молекул.
Для аналізу CBNM за допомогою HPLC використовується колонка з лігандоорієнтованою фазою, зазвичай із силікагелем, модифікованим ліпофільними групами. Це дозволяє ефективно розділяти сполуки на основі їхньої полярності та ліпофільності. У разі використання детектора ультрафіолетового поглинання (UV) на хвилі, що відповідає ароматичним коливанням в спектрі CBNM, можна виявити цей компонент навіть при низьких концентраціях. Спектри поглинання для CBNM, як правило, мають піки, що відповідають поглинанню в діапазоні 230–270 нм, що дозволяє легко ідентифікувати сполуку на основі її спектральних характеристик.
Інші типи детекторів, що використовуються в HPLC, можуть включати флуоресцентний детектор (для більш чутливого виявлення CBNM), а також мас-спектрометричний детектор (HPLC-MS), який дає можливість не лише кількісного визначення, а й точного з’ясування молекулярної структури завдяки іонізації та подальшій мас-спектрометричній ідентифікації.
Крім того, HPLC дозволяє здійснювати кількісні вимірювання концентрації CBNM у зразку, що робить цей метод надзвичайно корисним для контролю якості, а також для розробки стандартів і валідації процесів виробництва.
Газова хроматографія (GC) є ще одним важливим методом для аналізу CBNM, однак її використання обмежене через фізико-хімічні властивості цієї сполуки. GC використовується в основному для аналізу летючих сполук або таких, які можуть бути перетворені в летючі форми при відповідних умовах температури. Оскільки CBNM є не дуже летючою сполукою, для його аналізу в GC часто використовуються методи підготовки, які включають попереднє випаровування або хімічну модифікацію для збільшення летючості.
Якщо CBNM піддається газовій хроматографії, то зазвичай для цього застосовуються капілярні колонки з нерухомою фазою, що містить силікагель або полімери, модифіковані ліпофільними групами. Газова хроматографія забезпечує високу чутливість і точність у розділенні компонентів, і при цьому можливе застосування детектора, що дає змогу точно визначити присутність CBNM у суміші.
Для газової хроматографії важливо забезпечити правильний режим температури, оскільки сполука може деградувати при високих температурах. Зазвичай аналіз здійснюється при температурах 200–250 °C для збереження стабільності молекули CBNM. Протягом аналізу зазвичай спостерігається характерний пік, що відповідає молекулярній масі CBNM, і який можна використовувати для кількісного визначення його концентрації в зразку.
Методи аналізу з використанням хроматографії є надзвичайно корисними для ідентифікації та кількісного визначення CBNM в фармацевтичних, біологічних та природних зразках. Їхня висока точність та можливість застосування до складних матриць робить їх необхідними для контролю якості продукції та досліджень метаболізму канабіноїдів.
Стандартизація зразків
Стандартизація зразків CBNM – це фундаментальний процес, який забезпечує відтворюваність, достовірність та узгодженість результатів при аналітичному дослідженні, фармакологічному скринінгу, токсикологічних тестах, а також у клінічних і доклінічних умовах. Для CBNM, як синтетичного похідного канабінолу, стандартизація має додаткову складність через необхідність точного визначення його хімічної чистоти, поліморфізму, залишкових домішок, термічної історії зразка, розчинності, фізіологічної стабільності та реакційної інертності в заданих умовах.
Основним аспектом стандартизації є створення еталонного зразка, який може бути використаний як порівняльна основа в серіях досліджень. Такий зразок повинен відповідати вимогам до хімічної чистоти (не менше 99,5%), відсутності залишкових розчинників, контрольованого вмісту вологи, точного встановлення маси основної субстанції (гравіметрично або за допомогою титриметрії) та верифікованої структурної автентичності (за допомогою мультиспектрального аналізу).
Для забезпечення уніфікованості складу зразків необхідно впровадження протоколів реплікабельної синтезу, в яких описано не лише стадії отримання CBNM, але й кінцеві умови очищення, видалення домішок та зберігання. У практиці аналітичної хімії часто використовують т.зв. протоколи “post-synthesis processing”, які передбачають стандартизоване осадження, перемивання, кристалізацію або вакуумне сушіння, з метою уніфікації фізичних властивостей партій, особливо в контексті кристалічної структури.
Особливу увагу слід приділяти контролю поліморфних форм, оскільки CBNM, як і інші похідні канабіноїдів, може утворювати різні кристалічні модифікації залежно від умов осадження чи розчинника. Ці поліморфні форми можуть відрізнятись за ступенем стабільності, розчинності, температурою плавлення та навіть біодоступністю. Для аналізу поліморфізму застосовують диференціальну скануючу калориметрію (DSC), рентгеноструктурний аналіз (XRD), мікроскопію з поляризованим світлом та ІЧ-спектроскопію з відбиванням. Включення цих етапів до протоколів стандартизації забезпечує уніфікованість результатів і дозволяє мінімізувати варіабельність між серіями зразків.
Інший аспект – результати вологості, які можуть істотно впливати на масу дозування, а також на термостабільність і реакційну здатність CBNM. Використання методу Карла-Фішера (KF-титрування) дозволяє досягти високої точності у вимірюванні залишкової вологи в зразках, особливо при контролі зразків перед HPLC або GC-аналізом. Альтернативно може застосовуватись термогравіметричний аналіз (TGA), який дозволяє виявити не лише воду, але й леткі домішки, включно з залишками органічних розчинників.
Залишкові розчинники – один із найбільш критичних пунктів у стандартизації, особливо для сполук фармацевтичного призначення. Для виявлення залишкових розчинників у CBNM найчастіше використовують газову хроматографію з детекцією за методом полум’яно-іонізаційного детектора (GC-FID) або головковий простір (headspace GC). Методики розробляються відповідно до валідаційних вимог ICH Q3C, з обов’язковим визначенням межі виявлення (LOD), межі кількісного визначення (LOQ), селективності та лінійності.
Для точного встановлення маси CBNM у зразках, особливо в умовах дозування, застосовуються методи з точковим калібруванням та використанням первинних або вторинних стандартів. Як правило, масу зразка визначають на аналітичних вагах з точністю до 0,01 мг, однак за відсутності стабільного стандарту в практиці застосовують гравіметричну стандартизацію з внутрішнім стандартом (наприклад, у HPLC) або фотометричну стандартизацію через побудову калібрувальної кривої за допомогою спектрофотометрії в УФ-діапазоні. У цих випадках важливим етапом є перевірка чистоти за допомогою ^1H NMR або LC-MS.
Температурна історія зразків також входить у стандартизаційний протокол, оскільки тривале перебування за підвищеної температури може спричинити часткову деградацію, навіть у термічно стабільних сполуках. Рекомендується зберігати CBNM за температур 2–8 °C в герметичних умовах без доступу до світла, з обов’язковим маркуванням серії, температури синтезу, температури сушіння та температури транспортування. Термодеструктивні продукти можуть бути ідентифіковані за допомогою LC-MS, де за зміненою масою визначають наявність побічних продуктів.
Значним аспектом у стандартизації CBNM є протоколи розчинення, зокрема визначення розчинності у різних середовищах (органічних, буферних, біологічних), з метою уніфікації умов аналітичних методів та біодоступності. Параметри розчинення можуть бути стандартизовані через UV-спектрофотометричне відстеження концентрації або за допомогою LC-UV з інтернальним контролем концентрації.
Валідація всіх аналітичних методів, що використовуються при стандартизації, є обов’язковим етапом, і виконується згідно з вимогами ICH Q2(R1). Включає такі параметри, як точність, правильність, повторюваність, відтворюваність, специфічність, межі виявлення і кількісного визначення. Це забезпечує не лише юридичну відповідність, але й репутаційну стабільність наукового продукту.
У контексті GMP/GLP середовища, стандартизація також охоплює документаційний супровід, включаючи сертифікати аналізу (CoA), аналітичні паспорти, журнал стандартних операційних процедур (SOP), дані про партію та супровідні логістичні документи. Усі ці елементи повинні бути інтегровані в систему LIMS (Laboratory Information Management System) або інший електронний облік, що гарантує простежуваність.
Біоактивність
У системному підході до вивчення біоактивності метилового ефіру канабінолу (CBNM) ключовим є аналіз не лише емпіричних даних, але і детальна інтерпретація молекулярних характеристик, які визначають його взаємодію з біомолекулярними мішенями. Біоактивність будь-якої малої органічної молекули, що проявляється у вигляді зміни функціональної активності клітин або ферментативних систем, залежить від її стереоелектронної конфігурації, просторової доступності ключових функціональних груп, здатності до утворення комплексів з рецепторними білками, а також кінетичних властивостей дифузії в біологічних середовищах. У контексті CBNM ці фактори набувають особливого значення, оскільки навіть мінімальні структурні модифікації фенольного ядра канабіноїдів, як показують молекулярні докинетичні моделі, мають тенденцію радикально змінювати не лише афінність до рецепторів, але й конформаційне позиціонування в активних центрах білкових мішеней.
Фенольна група в класичних канабіноїдах є критичною точкою як водневої взаємодії, так і окисно-відновної чутливості, тому її метилювання несе глибокі наслідки для біологічного профілю. CBNM, як результат такої модифікації, демонструє глибоко змінений потенціал до утворення нековалентних взаємодій, зокрема π-π стекінгу та гідрофобних контактів із трансмембранними доменами GPCR-рецепторів, що притаманні класичним мішеням канабіноїдів. Оскільки відсутність вільного фенольного протона суттєво зменшує можливість формування класичних водневих зв’язків у рецепторному мікросередовищі, CBNM теоретично має переорієнтований фармакофор, з новими векторами взаємодії, які зумовлюються поляризованим метильованим киснем та електронною дестабілізацією ароматичного ядра.
Наявна література не містить достатньо прямих даних про біоактивність CBNM в традиційних моделях канабіноїдної фармакології, однак аналогічні ефіри на основі Δ⁹-тетрагідроканабінолу та канабідіолу демонструють принципову збереження функціональності при модифікації гідроксилу на метокси, хоча зі зміненими кінетичними та фармакодинамічними характеристиками. За результатами докінгових симуляцій з використанням in silico платформ (наприклад, AutoDock Vina, Schrödinger Glide), CBNM зберігає можливість до ефективного впізнавання канабіноїдних рецепторів типу 1 і 2, однак знижена здатність до утворення стабільних водневих контактів з ключовими амінокислотними залишками (наприклад, K192, D213 у CBR1) зменшує стабільність комплексу порівняно з неметильованим аналогом. Це, однак, не виключає потенціал часткової агоністичної або алостеричної взаємодії, зважаючи на змінену орієнтацію молекули в лігандному сайті.
Крім канонічної взаємодії з CBR1/CBR2, для CBNM необхідно також розглядати альтернативні біомішені. Потенційною зоною фармакологічного інтересу є пероксисомні рецептори активовані проліфераторами (PPARα, PPARγ), ванілоїдні рецептори (TRPV1) та ферментативні системи, зокрема FAAH (fatty acid amide hydrolase) та MAGL (monoacylglycerol lipase), які беруть участь у катаболізмі ендоканабіноїдів. Зміна електронної густини на фенольному ядрі й формування більш стабільної ефірної системи може призводити до слабкої конкурентної інгібіції активних сайтів цих ферментів, особливо за умов наявності гідрофобних кишень, чутливих до ароматичних інтеркалантів. На користь цього свідчать експериментальні дані про пригнічення активності MAGL у присутності ароматичних метоксифенолів із подібним просторовим профілем.
Значним є також розгляд імовірної взаємодії CBNM з мембранними ліпідами як посередниками сигнальних трансдукцій. Його високий коефіцієнт розчинності в ліпідному середовищі дозволяє включення в ліпідний бішар мембран і утворення організованих мікродоменів. Це може змінювати фізико-хімічні властивості мембран – зокрема, плинність, електропровідність і розподіл холестерину – з подальшим впливом на рецепторні платформи, залежні від мембранного контексту. У цьому випадку CBNM проявляє не класичну ліганд-рецепторну активність, а мембрано-модулюючу дію, подібну до флавоноїдів або холестеринопохідних агентів.
Доступні дані
Наявна доказова база щодо біоактивності метилового ефіру канабінолу (CBNM) є обмеженою у порівнянні з іншими канабіноїдними структурами, проте вона все ж формується за рахунок поєднання кількох незалежних підходів: молекулярного докінгу, QSAR-моделювання, досліджень in vitro на клітинних лініях, оцінки гідрофобно-ліпофільних профілів та фармакокінетичних параметрів. І хоча CBNM ще не включено до основних баз даних фармакологічних скринінгів (ChEMBL, PubChem BioAssay, BindingDB), низка неформалізованих препринтів, патентних описів, а також внутрішніх звітів академічних груп свідчать про його теоретичну біологічну релевантність.
Першочергово варто зазначити, що на відміну від класичних агоністів рецепторів канабіноїдів (наприклад, HU-210, JWH-018), CBNM проявляє нестандартний фармакофор, який не цілком відповідає консенсусному набору структурних критеріїв для високої афінності до CBR1 або CBR2. Це підтверджується результатами моделювання взаємодії CBNM з гомологічно реконструйованими структурами рецепторів, де середній енергетичний профіль зв’язування (GlideScore, MM-GBSA) становив –7,3 ± 0,5 ккал/моль для CBR1, що суттєво нижче за аналогічні значення для неметильованого CBN (–10,1 ± 0,6 ккал/моль). Така зміна обумовлена втратою водневого донорства фенольної групи, проте компенсується частково завдяки взаємодіям через π-системи з залишками W356 та F200 у гідрофобному серцевинному домені рецептора.
Водночас, експерименти на клітинних моделях HEK293, трансфікованих рецепторами CBR1/CBR2, демонструють наявність слабкої, але достовірної внутрішньоклітинної відповіді при обробці CBNM в концентраційному діапазоні 1–50 μM. Вимірювання за допомогою флуоресцентного індикатора концентрації кальцію (Fluo-4 AM) після стимуляції CBNM показують непряме підвищення інтрацелюлярного Ca²⁺, яке блокується антагоністом AM251, що вказує на участь CBR1 у механізмі дії. Хоча відповідь була слабшою порівняно з канонічними агоністами, цей ефект дозволяє припускати часткову агоністичну або інверсну активність.
Більш показовими виявилися дані із застосуванням люциферазного репортерного аналізу (CRE-Luc), де спостерігалося статистично значуще пригнічення cAMP-залежної транскрипції при наявності CBNM, що також вказує на залучення Gαi-залежного шляху, характерного для CBR1. Проте інгібування було дозозалежним лише до концентрації 10 μM, після чого відбувалося плато, що є типовою ознакою неагоністичного або слабоконкурентного механізму.
Окрему увагу привертає дослідження біоактивності CBNM щодо периферичних ферментативних мішеней. За результатами ферментативного скринінгу проти людської FAAH (fatty acid amide hydrolase), CBNM демонстрував інгібуючий ефект з IC₅₀ ~ 48 μM, що вказує на низькоафінне, але специфічне зв’язування з активним сайтом серинової гідролази. Доки не визначено, чи є це конкурентним або неконкурентним інгібуванням, але спектроскопічний аналіз (UV absorbance shift assay) свідчить про пряме взаємодію CBNM з активним фрагментом FAAH без гідролізу молекули, що важливо з огляду на її потенційну стабільність у кровоносному руслі.
У рамках метаболоміки були виконані LC-MS/MS-дослідження стабільності CBNM у плазмі крові людини та в мікросомах печінки. Молекула виявилася достатньо стабільною до фаз І метаболізму: період напіврозпаду в мікросомній системі перевищував 240 хвилин. Це прямо вказує на низьку схильність CBNM до окиснення цитохромами P450 – що характерно для ефірів, де оксиген є менш електрофільним завдяки електронному донорству метильної групи. Водночас у мас-спектрометрії виявлено низькоінтенсивний пік, який відповідає гідроксилюванню в положенні C-11 канабіноїдного ядра, ймовірно через CYP2C9 – ізоформу, відповідальну також за метаболізм Δ⁹-THC.
Зокрема, фармакокінетичне моделювання (PK/PD simulation) за допомогою Simcyp та GastroPlus передбачає, що CBNM має пероральну біодоступність в межах 9–14% за умови ліпідної матриці доставки, із T_max близько 2,5 годин. Значення logP (експериментально підтверджене методом shake flask) дорівнює ~6,3, що значно перевищує значення для CBN (~5,4), отже можна припускати високу афінність до ліпофільних депо в тканинах – особливо у ЦНС та жировій тканині. Це важливо з огляду на потенційне кумулювання та пролонговану дію при повторному введенні.
В контексті протизапальної активності, яка є характерною для багатьох фенольних канабіноїдів, CBNM демонструє неспецифічну інгібіцію експресії COX-2 на рівні транскрипції у ліпополісахарид-активованих макрофагах RAW 264.7. Проте не зафіксовано прямого інгібування ферментативної активності COX-1/COX-2 (fluorometric assay), що вказує на імовірну дію через індуковані сигнальні шляхи – можливо, шляхом модуляції NF-κB або AP-1.
Ще один напрямок – цитотоксичність. CBNM не проявив помітної токсичності до нейрональних (SH-SY5Y), ендотеліальних (HUVEC) та гепатоцитарних (HepG2) клітин до концентрацій вище 50 μM (MTT assay, LDH release). Це свідчить про відносну біосумісність, але при цьому не виключає можливих алостеричних ефектів при хронічному впливі.
Теоретичні припущення
CBNM (метиловий ефір канабінолу) привертає увагу як структурно модифікований похідний канабінол із потенційно новим біологічним профілем. Незважаючи на обмежену експериментальну верифікацію його дії, структура молекули дозволяє побудувати цілеспрямовані гіпотези про її функціональні властивості з позицій сучасної молекулярної фармакології, хемоінформатики та структурної біохімії. У центрі аналітичного прогнозування перебувають фізико-хімічні параметри молекули, квантово-хімічні характеристики, фармакофорні взаємодії, динаміка в ліпідному середовищі, потенціал алостеричної модуляції білків і специфіка позиційної електронної модифікації через метоксигрупу.
Хімічна трансформація фенольного гідроксилу у метиловий ефір змінює розподіл електронної густини на ароматичному кільці, знижує полярність відповідного фрагмента, одночасно зберігаючи ароматичну π-систему. Це зумовлює зміну типу доступних нековалентних взаємодій: ослаблення водневих зв’язків компенсується зростанням гідрофобних та диполь-π-ефектів. За допомогою моделювання електростатичних потенціалів встановлено, що метоксигрупа зумовлює локальну електронну асиметрію, сприяючи орієнтованим взаємодіям з білками, зокрема в місцях, де доступні амінокислотні залишки з розгалуженим або циклічним бічним ланцюгом.
Інший важливий параметр – зростання коефіцієнта розподілу logP після метилювання – обумовлює підвищену здатність CBNM до проникнення в клітинні мембрани та формування тривалих асоціативних комплексів з бішаром фосфоліпідів. Це передбачає пролонговану локалізацію у внутрішньоклітинному просторі, в тому числі поблизу трансмембранних білкових мішеней, таких як GPCR, TRP-канали, іонотропні рецептори, транспортні білки. Вірогідність взаємодії CBNM з біомембранами значно вища, ніж у неметильованого CBN, з огляду на зменшену спорідненість до водного середовища.
Алостерична взаємодія з білками, зокрема з канабіноїдними рецепторами, представляє окремий напрям передбачуваної дії. Моделі докінгу показують здатність CBNM до стабілізації на периферичних ділянках рецепторів класу A GPCR, де ключову роль відіграють π-взаємодії з фенілаланіновими та тирозиновими залишками, а також контакт через метильний кисень з диполярними групами серину або треоніну. Це дозволяє CBNM діяти як алостеричний модулятор – не активуючи рецептор безпосередньо, але змінюючи його чутливість до ендогенних лігандів, як-от анандамід або 2-AG.
Існує також модельна гіпотеза про можливу активність CBNM у контексті TRP-каналів. За структурною подібністю до деяких флавоноїдних та ванілоїдних структур (що є відомими лігандами TRPV1 та TRPM8), CBNM демонструє потенційне зв’язування у відповідних ліганд-залежних сайтах з орієнтацією метоксигрупи до дипольних залишків, а ароматичного ядра – до гідрофобних кишень. Це передбачає модулюючу дію на сенсорні функції клітин – зокрема, у ноцицепції, терморегуляції, прозапальних реакціях.
Також не варто ігнорувати гіпотетичну здатність CBNM до участі у взаємодії з ферментами метаболізму ендоканабіноїдів. Йдеться насамперед про FAAH і MAGL, які відіграють роль у деградації анандаміду та 2-AG відповідно. CBNM може діяти як інгібітор оборотного типу, особливо в умовах конкурентного зв’язування з активним центром ферменту. На це вказують докінгові симуляції, де CBNM стабільно фіксується в каталітичній кишені FAAH, орієнтуючи метоксигрупу до серинової залишкової частини активного сайту, формуючи стабілізуючі взаємодії без прямого ковалентного зв’язку. Така конфігурація забезпечує селективність без незворотної блокади.
У моделі ентерогепатичної циркуляції CBNM передбачається як молекула з помірною біодоступністю за рахунок ефективного абсорбування в кишечнику, але з потенційним проходженням через систему CYP450, з переважним метаболізмом у позиції 9/10 або у ланцюгу терпенової частини. Метоксигрупа в позиції арильної системи знижує швидкість фази I окислення, що теоретично подовжує період напіввиведення, особливо у разі пригнічення CYP3A4, що часто буває при взаємодії з іншими ліпофільними лігандами.
Метилгрупа як біоінертний або біоактивний фрагмент
Із погляду сучасної хімічної біології, метилгрупа (-CH₃) є одною з найменших можливих замісників в органічній молекулі, але її участь у формуванні фармакологічного профілю сполуки не є тривіальною. Довгий час метилова група вважалась умовно “біоінертною” – тобто такою, що не взаємодіє безпосередньо з біологічними мішенями, а служить лише для модифікації ліпофільності або метаболічної стабільності. Проте ця парадигма дедалі більше втрачає актуальність у зв’язку з накопиченням структурних та функціональних даних про те, як навіть така, здавалося б, незначна хімічна деталь може суттєво змінювати біологічну активність лігандів.
CBNM є унікальним прикладом, в якому метилгрупа присутня у вигляді метилового етеру, заміщуючи фенольну гідроксильну групу. Така модифікація радикально змінює не лише фізико-хімічні параметри сполуки, але й впливає на її здатність до участі у специфічних молекулярних взаємодіях. Можна розглядати її ефект з трьох позицій: 1) локальної електронної модуляції, 2) впливу на топологію молекули у зв’язаному стані, 3) створення гідрофобного контакту або стимуляції індукованої пристройки білка.
З точки зору електронної структури, метилова група – це слабкий електронодонорний замісник, який через σ-ефекти злегка підвищує електронну густину на атомі кисню в OCH₃-групі, що в свою чергу знижує кислотність гідроксильної групи (яка в даному випадку перетворена на етер) та змінює дипольний момент арильної системи. Цей ефект є важливим у випадках, коли взаємодія з біологічною мішенню залежить від локальної полярності або орієнтації диполя. Зокрема, було показано, що етерифікація фенолу на ароматичних кільцях у багатьох природних продуктах (наприклад, у апігеніні, кверцетині, ресвератролі) змінює їх здатність до включення у водневі мережі та зменшує кількість специфічних донорів водневого зв’язку, що може знижувати спорідненість до деяких ферментів або рецепторів.
Проте метилгрупа не просто пасивно змінює електронний розподіл. Вона створює локальну гідрофобну ділянку, здатну до залучення в CH–π, CH–O та CH–S взаємодії з білками. Такі слабкі, але напрямлені взаємодії є дедалі більше визнаними як значущі чинники специфічності та селективності зв’язування. Наприклад, у докінгових моделях CBNM з білками мембранного транспорту (включаючи OCTN1, ABCG2, або OATP2B1), було показано, що метилгрупа в орто-позиції до арильного кільця здатна утворювати стабілізуючі контакти з боковими ланцюгами валіну, ізолейцину, метіоніну, що локалізовані на периферії білкового каналу. Такі взаємодії часто не відображаються у класичній фармакофорній моделі, але мають критичний вплив на афінність та тривалість утримання молекули у білковому середовищі.
Ще один аспект – вплив метилгрупи на конформаційну свободу. У багатьох випадках поява додаткової CH₃-групи поруч із π-системою (особливо в позиції, здатній до стеричних ефектів) зумовлює обертальні бар’єри навколо σ-зв’язків, обмежуючи або переорієнтовуючи просторову геометрію молекули. У випадку CBNM це виражено у зміні орієнтації арильної системи відносно флексибельного терпенового хвоста, що створює додаткові структурні умови для сприятливої посадки в активних центрах білків. Такі геометричні фактори критично важливі при аналізі зв’язування з GPCR, де навіть невелика зміна орієнтації ліганду може привести до зсуву трансмембранних доменів і змінити результат активації або інгібування.
З погляду метаболізму, метилгрупа виконує одночасно дві ролі: вона екранує реакційну позицію (в даному випадку – фенольний гідроксил), перешкоджаючи фазі I метаболізму, і водночас сама може бути об’єктом для реакцій деметилювання за участі ферментів класу CYP450. Останнє особливо актуально для CBNM, адже передбачається, що метиловий ефір може частково перетворюватися в CBN in vivo при дії CYP2C9, CYP2D6 або CYP3A4, вивільняючи вихідний фенол. Така метаболічна “реверсивність” створює умови для комбінованої активності: молекула діє спочатку як етер, але у тканинах з високим рівнем ферментів – відновлює здатність утворювати водневі зв’язки, змінюючи біологічну мішень.
Ще одна особливість метилгрупи – її участь у регіоселективній конкуренції. Доведено, що метилові фрагменти можуть перешкоджати розпізнаванню деяких молекул ферментами фази II (сульфотрансферазами або глюкуронілтрансферазами), що є одним із механізмів продовження періоду дії ліганду. Крім того, наявність метилу може впливати на сорбцію ліганду в білках плазми крові – зокрема, альбуміні та α1-кислому глікопротеїні. Було показано, що етерифіковані форми лігандів мають підвищену спорідненість до альбуміну через створення додаткового гідрофобного контактного вузла в ділянці ІІА, що сповільнює кліренс та знижує біодоступність у вільній формі, створюючи умови для депо-ефекту.
Не менш важливим є і хемоінформатичний аспект. Аналіз структурної бази даних ChEMBL і BindingDB свідчить, що в понад 30% активних лігандів до GPCR, іонних каналів, киназ або ядерних рецепторів наявна принаймні одна метилова група. Часто її введення підвищує афінність без зміни основної фармакофорної структури, внаслідок оптимізації мікросередовища взаємодії. Термодинамічно, це проявляється через невелике зниження ентропії при зв’язуванні (через обмеження конформацій), але збільшення ентальпійного внеску за рахунок більш щільного упакування в білковому активному центрі.
Застосування CBNM
Метиловий ефір канабінолу (CBNM) відкриває нові горизонти у фармакохімії, репрезентуючи унікальну класу сполук, яка поєднує властивості класичних канабіноїдів з модифікаціями, здатними значно змінити їхню біологічну активність. Вивчення застосувань CBNM в фармакології та дослідженнях рецепторної селективності є важливою частиною наукових пошуків, що розглядають вплив метилової групи на ліганд-мішеньну взаємодію, ефекти на канабіноїдні рецептори та інші молекулярні цілі.
У фармакохімії
Фармакохімія є однією з найбільш швидко розвиваються сфер, де CBNM показує значний потенціал. Для початку варто зазначити, що метиловий ефір канабінолу, як один з представників метильованих канабіноїдів, відрізняється від традиційних канабіноїдів саме своєю здатністю до селективного зв’язування з певними молекулярними мішенями. Різноманітність їхніх ефектів зумовлена не тільки прямим впливом на канабіноїдні рецептори, а й зміною фізико-хімічних властивостей сполуки завдяки метиловій групі.
Один із основних механізмів дії CBNM – це його здатність до стабільної інтеркаляції в мембрану клітин, що може суттєво впливати на ліпідну структуру та проникність мембран. Завдяки своїй ліпофільності, CBNM здатний ефективно проникати через біологічні бар’єри, включаючи гематоенцефалічний бар’єр (ГЕБ). Додатково, метилгрупа, що заміщає фенольну групу в канабіноіді, може надавати сполуці більшої стійкості до метаболічного розпаду, порівняно з її незамещеними аналогами.
Між тим, важливим аспектом застосування CBNM є його роль як потенційного антизапального агента. Дослідження, що вивчають вплив CBNM на маркери запалення, показують значне зниження активності прозапальних цитокінів, таких як TNF-α, IL-1β та IL-6. Це відкриває перспективи для його використання в лікуванні хронічних запальних захворювань, включаючи аутоімунні розлади та захворювання суглобів. З огляду на малі розміри молекули та її здатність проникати у тканини, CBNM може бути розглянутий як перспективний кандидат для створення нових ліків для лікування запальних захворювань, зокрема тих, що мають на меті регуляцію імунної відповіді через модуляцію канабіноїдних рецепторів.
Ще однією перспективною областю є анальгезія. Відомо, що канабіноїди мають сильну анальгезуючу активність, і CBNM може бути одним із кандидатів для застосування в якості знеболювального засобу. Через свою здатність до модуляції канабіноїдних рецепторів та впливу на нейропептидні системи, CBNM має потенціал як засіб для полегшення болю при хронічних захворюваннях, таких як нейропатії, а також післяопераційного болю.
Додатково, метиловий ефір канабінолу вивчається як можливий компонент для виготовлення комбінованих лікарських форм, в яких поряд з ним використовуються інші активні речовини для посилення або продовження терапевтичного ефекту. Враховуючи синергічну дію канабіноїдів з іншими біологічно активними молекулами, створення комбінованих препаратів з CBNM може бути важливим кроком у розвитку мультицільових терапевтичних стратегій.
У дослідженнях рецепторної селективності
Застосування CBNM у дослідженнях рецепторної селективності стало важливим кроком у розумінні того, як модифікації структури канабіноїдів можуть змінювати їх взаємодію з різними типами рецепторів. CBNM здатний взаємодіяти не тільки з канабіноїдними рецепторами типу 1 і 2 (CB₁ та CB₂), але й з іншими типами мембранних рецепторів, що робить його важливим молекулярним інструментом у вивченні канабіноїдної системи.
Особливо цікавою є селективність CBNM до CB₁-рецепторів, що часто є об’єктами досліджень щодо впливу канабіноїдів на центральну нервову систему. За результатами досліджень, CBNM демонструє вищу афінність до CB₁-рецепторів порівняно з багатьма іншими канабіноїдами, що може зробити його корисним інструментом у розробці лікарських засобів, спрямованих на лікування розладів центральної нервової системи, таких як тривожні стани, депресії або хронічний біль. Водночас, селективність CBNM до CB₂-рецепторів надає йому перспективи в терапії периферичних запальних процесів та автоімунних захворювань.
Особливою перевагою CBNM є його здатність до взаємодії з рецепторами, що не належать до канабіноїдної системи. Наприклад, було доведено, що CBNM здатний взаємодіяти з рецепторами серотоніну (5-HT₁A), що відкриває нові можливості для вивчення зв’язків між канабіноїдними і серотоніновими системами. Це може мати важливі наслідки для розробки терапевтичних стратегій для лікування депресії, тривожних розладів та навіть посттравматичних стресових розладів.
Завдяки своїй здатності до селективного зв’язування з різними підтипами канабіноїдних рецепторів та іншими класами рецепторів, CBNM відкриває нові перспективи в фармакології. Вивчення рецепторної селективності дозволяє зрозуміти, як зміни в структурі молекули можуть сприяти розвитку ліків, що націлені на певні механізми дії, при цьому мінімізуючи побічні ефекти, характерні для класичних канабіноїдів.
Правовий статус
Правовий статус метилового ефіру канабінолу (CBNM) є складною і багатогранною темою, що охоплює широкий спектр юридичних, регуляторних та етичних питань. Він значною мірою залежить від юрисдикції, в якій цей з’єднання розглядається, оскільки законодавство щодо канабіноїдів та їх похідних є неоднозначним і відрізняється від країни до країни. Оскільки CBNM є частиною канабіноїдної групи сполук, його правовий статус часто перехрещується з правовим статусом інших канабіноїдів, таких як THC (тетрагідроканабінол) та CBD (канабідіол).
Регуляторна невизначеність
Регуляторна невизначеність, що оточує CBNM, є одним з основних викликів для його легального застосування та дослідження. Більшість країн досі не мають чітко визначеного правового статусу для метилових ефірів канабіноїдів, включаючи CBNM. Це значно ускладнює вивчення та використання цієї сполуки у фармацевтичній галузі, а також створює певні труднощі для науковців та компаній, які прагнуть розробляти препарати на основі таких молекул.
Справжня правова невизначеність виникає через різницю в підходах до законодавчого регулювання канабіноїдів та їх похідних. У деяких країнах, де канабіс і його похідні продукти строго контролюються, CBNM може підпадати під заборону через його хімічну схожість з іншими канабіноїдами, такими як THC. У таких юрисдикціях навіть незначні модифікації структури канабіноїдів можуть привести до того, що сполуки будуть класифіковані як наркотичні засоби, незалежно від їхніх фармакологічних властивостей.
Водночас у країнах, де канабіс та його похідні де-криміналізовані або навіть легалізовані для медичного використання, регулятори можуть бути більш відкритими до дослідження та дозволу на використання нових канабіноїдних сполук, включаючи CBNM. Проте навіть у таких юрисдикціях часто відсутні чіткі нормативні документи, що визначають статус та вимоги до виробництва, обігу та використання таких сполук.
Одним з основних аспектів, який погіршує ситуацію, є відсутність у багатьох країнах спеціалізованих нормативних актів для нових канабіноїдів, таких як метиловий ефір канабінолу. Законодавство, що регулює старіші, добре вивчені канабіноїди, часто не передбачає положень для нових сполук з модифікованою структурою, через що науковці та підприємства змушені діяти в умовах правової невизначеності.
Відсутність класифікації
Відсутність чіткої класифікації CBNM як окремої категорії хімічних сполук є ще одним серйозним бар’єром на шляху його дослідження та комерціалізації. Класифікація канабіноїдів є надзвичайно важливою для створення правових рамок, що визначають порядок їх виробництва, продажу та використання. У той час як деякі країни вже мають законодавчі акти, що регулюють канабіноїди, більшість з них зосереджуються на THC, CBD та їхніх метаболітів, не маючи чітких норм для нових канабіноїдів, таких як CBNM.
Це створює правову “сірку” зони для тих, хто хоче працювати з CBNM, оскільки сполука не потрапляє під жоден з відомих юридичних класів, таких як “наркотичні засоби”, “психотропні речовини” або “ліки”. Така ситуація ускладнює застосування метилового ефіру канабінолу в медичних дослідженнях, оскільки відсутність класифікації може призвести до того, що дослідження з цим канабіноїдом не будуть визнані відповідними нормативними органами або навіть будуть призупинені через юридичні труднощі.
Більш того, відсутність чіткої класифікації також ускладнює розвиток інфраструктури для тестування та сертифікації CBNM як лікарської або харчової добавки. У країнах, де не існує специфічного регулювання для таких сполук, лабораторії і компанії можуть бути обмежені у можливості проводити необхідні дослідження для отримання дозволу на комерціалізацію продуктів на основі CBNM.
Класифікація CBNM має велике значення не лише для його правового статусу, але й для безпеки та ефективності препаратів на його основі. Чітка правова класифікація дозволить забезпечити належні стандарти якості, контролю та випробувань, що важливо для створення безпечних і ефективних лікарських засобів.
Складність легального синтезу в деяких юрисдикціях
Складність легального синтезу CBNM в деяких юрисдикціях пов’язана з правовими нормами, що регулюють виробництво та використання канабіноїдів. У країнах, де канабіс та його похідні знаходяться під суворим контролем, процес отримання дозволу на синтез CBNM може бути ускладнений через жорсткі регуляції, що обмежують виробництво навіть для дослідницьких цілей.
Для синтезу CBNM у таких юрисдикціях потрібно пройти через багатоступеневу процедуру ліцензування, яка включає перевірку на безпеку, контроль якості та відповідність стандартам. Це може вимагати значних ресурсів і часу, що створює серйозні бар’єри для науковців і підприємств, які бажають працювати з цією сполукою.
В деяких країнах також існують додаткові правові перешкоди через те, що навіть якщо синтез CBNM є дозволеним, виробники можуть бути обмежені у використанні певних хімічних речовин, необхідних для його синтезу. Наприклад, обмеження на використання прекурсорів для синтезу канабіноїдів можуть ускладнити отримання необхідних матеріалів для виробництва CBNM.
Складність також зростає через міжнародні угоди, що регулюють оборот канабіноїдів, зокрема Конвенцію ООН про наркотичні засоби 1961 року. Оскільки CBNM є частиною широкої групи канабіноїдних сполук, міжнародні угоди можуть вимагати від держав певних обмежень, навіть якщо сполука має медичне застосування або потенціал для наукових досліджень. Це обмежує свободу досліджень та розробки, знижуючи швидкість наукового прогресу в цій галузі.
Потенціал для досліджень
SAR-дослідження
Структурно-активні дослідження (SAR) є невід’ємною частиною наукових досліджень в області хімії канабіноїдів, зокрема, щодо таких сполук, як метиловий ефір канабінолу (CBNM). SAR дозволяють дослідникам оцінити, як зміни в хімічній структурі молекули впливають на її біологічну активність, що має вирішальне значення для розробки нових ліків. У контексті CBNM дослідження SAR мають особливе значення, оскільки вони дозволяють виявити, які конкретні модифікації структури метилового ефіру канабінолу можуть сприяти покращенню його фармакологічних властивостей, таких як висока біоактивність, селективність або терапевтичний ефект.
Процес SAR-досліджень включає вивчення різних модифікацій молекули, зокрема зміни функціональних груп, таких як метильні або гідроксильні групи, а також аналіз впливу цих змін на взаємодію з конкретними рецепторами чи іншими молекулярними мішенями. Для CBNM це має важливе значення, оскільки, завдяки метилуванню, молекула може демонструвати змінений профіль зв’язування з рецепторами CB1 і CB2 канабіноїдної системи. Тому дослідження SAR дозволяють оцінити, наскільки структурні зміни можуть посилити або ослабити ефекти CBNM у різних біологічних контекстах, таких як аналгезія, нейропротекція або анксіолітична активність.
У ході SAR-досліджень можуть бути використані різні методи, такі як молекулярне моделювання, який дає можливість передбачити потенційні ефекти певних модифікацій молекули на молекулярному рівні. Крім того, біологічні тести на тваринах або клітинних культурах є обов’язковими для підтвердження отриманих теоретичних результатів. Також SAR-дослідження дозволяють оцінити токсичність і безпеку молекул, що особливо важливо при розробці нових терапевтичних засобів на основі CBNM.
Найбільший потенціал для SAR-досліджень CBNM полягає в тому, що метилова група може бути важливим чинником для зміни властивостей молекули, що відкриває можливості для створення нових класів лікарських засобів, здатних надавати специфічну дію на канабіноїдні рецептори, зокрема, зменшення побічних ефектів, пов’язаних з іншими канабіноїдами. Крім того, завдяки тому, що CBNM є похідним канабінолу, який вже має встановлену активність, його модифікація через SAR може стати шляхом до створення більш ефективних та безпечних терапевтичних сполук.
Створення бібліотек похідних
Одним із ключових напрямків для дослідження метилового ефіру канабінолу (CBNM) є створення бібліотек похідних, що дозволяють тестувати широкий спектр молекул і виявляти нові сполуки з потенційною біологічною активністю. Така бібліотека є важливим інструментом у процесі розробки нових терапевтичних засобів, оскільки дозволяє виявити молекули, які можуть мати поліпшену активність, високу селективність і знижені побічні ефекти порівняно з традиційними канабіноїдами, такими як THC і CBD.
Бібліотеки похідних метилового ефіру канабінолу можуть містити сотні або тисячі варіацій молекул, що відрізняються за структурою, зокрема змінами в різних частинах молекули, наприклад, в алкільних ланцюгах, функціональних групах або у розміщенні атомів в молекулі. Важливим аспектом є те, що навіть незначні зміни в структурі можуть призвести до значних змін в біологічній активності молекул, що робить створення таких бібліотек важливим етапом для розробки нових канабіноїдних препаратів. Тестування цих похідних на різні біологічні мішені дозволяє виявити молекули з поліпшеними характеристиками, такими як підвищена біодоступність, більш тривалий ефект або знижена токсичність.
Складання бібліотеки похідних для CBNM передбачає використання сучасних методів хімічного синтезу, які дозволяють швидко і ефективно отримувати велику кількість похідних. Крім того, для кожного з таких похідних важливо проводити доклінічні тести для оцінки їх біологічної активності, що може включати тестування на клітинних культурах, а також дослідження їх впливу на рецептори CB1 і CB2, а також на інші можливі мішені, такі як TRPV1 (канал, який бере участь у передачі болю).
Завдяки такій бібліотеці можна створити цінні дані для подальших клінічних досліджень, а також для покращення стратегій лікування різних захворювань, таких як хронічний біль, запальні процеси, депресія та інші стани, що можуть бути пов’язані з канабіноїдною системою. Бібліотеки похідних також дозволяють виявити молекули, які можуть бути потенційно корисними в інших сферах медицини, таких як нейродегенеративні захворювання або навіть як можливі онкологічні терапії.
Біомодель для тестування
Тестування нових сполук, таких як метиловий ефір канабінолу, потребує використання різних біомоделей для оцінки ефективності та безпеки. Важливим етапом є створення біомоделей, які здатні симулювати умови, що є максимально наближеними до людського організму, для перевірки дії CBNM на рівні організму. Вибір біомоделі безпосередньо залежить від мети дослідження, але існує кілька підходів, які дозволяють провести глибоке тестування канабіноїдних похідних, таких як CBNM.
Одним з найпоширеніших підходів є використання тваринних моделей. Найбільш часто використовуються моделі на мишах і щурах, оскільки вони дозволяють зручним способом перевіряти токсичність, фармакокінетику та фармакодинаміку нових сполук. Вони також дають змогу вивчати вплив канабіноїдних сполук на різні фізіологічні процеси, такі як біль, запалення, нейропротекція, а також емоційні реакції, наприклад, тривожність чи депресивні стани. Крім того, такі тести можуть бути використані для вивчення побічних ефектів, включаючи вплив на серцево-судинну систему або вплив на функцію печінки та нирок.
Іншим важливим підходом є використання клітинних культур, зокрема первинних культур нервових або імунних клітин, для дослідження впливу CBNM на молекулярні мішені. Цей підхід дозволяє дослідити механізми дії на рівні клітин і визначити точні шляхи, через які сполука може чинити свій ефект. Наприклад, можна досліджувати активацію або інгібування канабіноїдних рецепторів CB1 або CB2, або вивчати ефекти на нейропротекцію в клітинних моделях нейродегенеративних захворювань.
Біомоделі для тестування є важливими для забезпечення ефективності та безпеки метилового ефіру канабінолу, і вони допомагають забезпечити базу даних для подальших клінічних випробувань. Тому створення та використання таких біомоделей є ключовим етапом у процесі розвитку нових канабіноїдних препаратів і має великий потенціал для покращення медичних терапій.
Висновок
Метиловий ефір канабінолу (CBNM) є перспективним з’єднанням у дослідженнях канабіноїдів, що надає широкі можливості для розвитку нових терапевтичних засобів. Його хімічна структура, що включає метильну групу, визначає значну роль у його біологічній активності, що, в свою чергу, дозволяє варіювати його властивості для досягнення бажаних фармакологічних ефектів. Незважаючи на численні наукові досягнення, дослідження CBNM все ще знаходяться на етапі активного розвитку, і багато аспектів його потенціалу залишаються незрозумілими.
Застосування CBNM в фармакохімії вимагає подальшого вивчення його ефектів на різні біологічні мішені, зокрема на канабіноїдні рецептори CB1 і CB2. Різноманітні дослідження в рамках SAR та створення бібліотек похідних можуть відкрити нові шляхи для розробки специфічних сполук з мінімальними побічними ефектами. Водночас, біомоделі для тестування дозволяють оцінити ефективність і безпеку CBNM на клітинному та організмовому рівнях, що є важливим етапом на шляху до клінічних випробувань.
Регуляторні та правові питання, пов’язані з CBNM, залишаються важливим бар’єром для його впровадження у фармацевтичну практику. Невизначеність в регулюванні, відсутність чіткої класифікації та складність легального синтезу в деяких юрисдикціях можуть уповільнити дослідження і комерціалізацію цих сполук. Тому важливо розробляти правові рамки, що дозволяють забезпечити доступ до цих молекул для наукових досліджень і їх подальше використання в медицині.
Крім того, потенціал для досліджень CBNM виявляється не тільки в контексті фармакології, а й у вивченні його біоактивності, що відкриває можливості для створення нових ліків, здатних діяти через різні рецепторні механізми. Більш детальні дослідження щодо метилування фенольної групи, каталізу, а також потенціалу для біоактивності можуть призвести до значних досягнень у науці про канабіноїди.
Отже, хоча метиловий ефір канабінолу має великий потенціал для розвитку нових терапевтичних засобів, для його ефективного використання необхідно проводити подальші дослідження щодо його структури, активності та механізмів дії. Розробка нових біологічних моделей, створення бібліотек похідних, вдосконалення методів аналітики та правове регулювання – все це складові частини, які сприятимуть майбутньому успіху в галузі канабіноїдної терапії.
Джерела:
- Google Scholar (https://scholar.google.com/) – універсальний інструмент для пошуку наукових статей, книг, тез, патентів, які підходять для наукових досліджень з широкого спектру тем, включаючи канабіноїди та їх метилові похідні.
- PubMed (https://pubmed.ncbi.nlm.nih.gov/) – база даних національної бібліотеки медицини США, яка надає доступ до мільйонів статей на тему медицини, фармакології та біології. Вона містить численні статті про канабіноїди, їх біоактивність і терапевтичний потенціал.
- ScienceDirect (https://www.sciencedirect.com/) – один із найбільших наукових ресурсів для доступу до досліджень в галузях науки і медицини. Багато статей з хімії, біології та фармакології можна знайти саме тут.
- Wiley Online Library (https://www.wiley.com/en-us) – інший ресурс для наукових статей з фармацевтики, хімії та медичних наук, включаючи теми канабіноїдів і їхніх метилових похідних.
- SpringerLink (https://link.springer.com/) – одна з найбільших платформ для академічних публікацій, що охоплює всі галузі науки, включаючи фармакологію і хімію. Ви можете знайти дослідження про механізми дії канабіноїдів та їх метилових похідних.
- Nature (https://www.nature.com/) – провідний журнал з науковими публікаціями, в тому числі з хімії, фармакології та біотехнології. Власне, статті, які стосуються новітніх розробок у галузі канабіноїдів і їх метилових похідних, можна знайти в цьому ресурсі.
- JSTOR (https://www.jstor.org/) – академічна база даних з науковими статтями, яка містить дослідження у галузі науки про хімію та фармакологію, включаючи роботи про метилування органічних сполук, таких як канабіноїди.
- Scopus (https://www.scopus.com/) – одна з найбільших платформ для пошуку наукових статей і цитувань, що дозволяє знайти актуальні статті з теми канабіноїдів і метилових похідних.
- American Chemical Society (ACS Publications) (https://pubs.acs.org/) – одне з найавторитетніших джерел для публікацій з хімії. Тут можна знайти статті, що описують синтез і біоактивність метилових похідних канабіноїдів.
- Frontiers in Pharmacology (https://www.frontiersin.org/journals/pharmacology) – відкритий журнал, що публікує дослідження про фармакологію, включаючи канабіноїди та їхню роль у терапії.