Канабіноїдна система ссавців, вивчення якої активізувалося з відкриттям Δ⁹-тетрагідроканабінолу (THC) і канабідіолу (CBD), продовжує бути джерелом молекулярних відкриттів, пов’язаних із численними біологічними регуляторними шляхами. Однак більшість фармакологічних досліджень донедавна концентрувалися навколо кількох найбільш поширених фітоканабіноїдів, залишаючи поза увагою сотні малоконцентрованих або транзиторних метаболітів канабісу. Канабіріпсол (CBR) належить саме до цієї категорії – рідкісних, мало досліджених, але структурно й функціонально цікавих сполук, які відкривають нові перспективи як для розуміння хімічної пластичності Cannabis sativa, так і для розробки терапевтичних агентів з високою селективністю дії.
CBR був вперше ідентифікований як природний компонент у деяких хемотипах канабісу з нестандартним терпеновим і канабіноїдним профілем. Структурно ця сполука характеризується наявністю поліциклічної системи, яка відрізняється від класичних канабіноїдів типу THC або CBD. Водночас вона має канабіноїдну “серцевину” – трьохкільцевий скелет, споріднений із сімейством мерoterpenoid-структур, типовим для метаболізму канабісу. Це дозволяє віднести її до фіто-канабіноїдів, хоча її біогенез відрізняється від основних шляхів, що продукують THC/CBD через канабігеролову (CBG) гілку.
На молекулярному рівні, CBR не виявляє прямої високої афінності до класичних рецепторів CB1 і CB2, однак показує потенціал взаємодії з позаканабіноїдними мішенями – TRP-каналами, PPAR-рецепторами або іонними каналами, залученими до запальних і ноцицептивних процесів. Подібна фармакологічна поведінка характерна і для деяких інших “непсихоактивних” канабіноїдів, таких як канабідіварин (CBDV) або канабікромен (CBC). Це дозволяє розглядати CBR як перспективну молекулу для подальших доклінічних досліджень у сферах нейропротекції, запальних патологій, метаболічного синдрому, а також як інструмент для вивчення канабіноїдної системи поза межами CB1/CB2 парадигми.
Хімічний профіль CBR є особливо цінним з огляду на його нестабільність та складність виділення. У природних зразках він трапляється у надзвичайно низьких концентраціях (<0.01% сухої маси суцвіть), що вимагає використання високочутливих методів аналітики, таких як HPLC-MS/MS, preparative chromatography або ізотопне мічення для підтвердження ідентичності. Деякі автори припускають, що CBR може бути вторинним продуктом або проміжною формою у метаболічній мережі, що включає оксидацію/циклодеформування сполук на основі канабігеролового субстрату. Це, у свою чергу, вказує на потенційну участь ферментів оксидоредуктазного ряду, специфічних для певних хемотипів канабісу, які сьогодні залишаються недостатньо вивченими.
Ситуація з CBR типова для багатьох “незручних” сполук, які важко піддаються фармакологічному картуванню через низьку доступність, нестабільність у розчинах, і відсутність комерційно доступних стандартів. Водночас саме такі сполуки можуть виявитися критично важливими у формуванні розуміння того, як дрібні модифікації структури канабіноїдів впливають на селективність до рецепторів, метаболічну стабільність, прохідність через гематоенцефалічний бар’єр або здатність до алостеричної модуляції рецепторних комплексів.
Наукова цінність дослідження CBR також полягає у його потенціалі для реконструкції повного метаболічного ландшафту канабісу. Існує гіпотеза, що в екологічно специфічних умовах (висота над рівнем моря, тип ґрунту, мікробіом) продукування CBR може мати адаптивну функцію або відображати еволюційний шлях рослин, які розвинули альтернативні шляхи терпенового метаболізму. Таким чином, вивчення CBR може бути корисним не лише у фармакологічному, але й у ботаніко-еволюційному контексті – для розуміння того, які чинники сприяють формуванню унікальних метаболітів у межах виду Cannabis sativa L.
Відсутність регуляторної класифікації CBR у більшості країн створює “сіре поле” для дослідників: з одного боку, це дозволяє вільніше працювати з речовиною у лабораторних умовах; з іншого – ускладнює включення її в перспективні доклінічні протоколи через відсутність фармакопейних стандартів. Крім того, обмежена кількість патентної документації на CBR створює наукове “вікно можливостей” – сегмент, де ще не сформована конкуренція за інтелектуальні права, але існує потенціал для відкриттів, що можуть мати translational impact у фармакології.
У контексті фармакогнозії CBR демонструє важливу концептуальну роль: він вказує на те, що потенціал канабісу як джерела біоактивних речовин ще далеко не вичерпаний. Із понад 150 відомих фітоканабіноїдів лише декілька системно вивчені, а роль багатьох залишкових або нестабільних компонентів може бути критичною в синергетичних ефектах, описаних у межах “ентураж-ефекту”. З огляду на це, CBR має розглядатись як одна з мішеней системного підходу до вивчення канабіноїдного хемотипу, особливо в комбінації з розширеною метаболомікою, геномікою рослин та алгоритмами машинного навчання для виявлення нелінійних залежностей між профілем сполук і біологічною активністю.
Хімічна характеристика
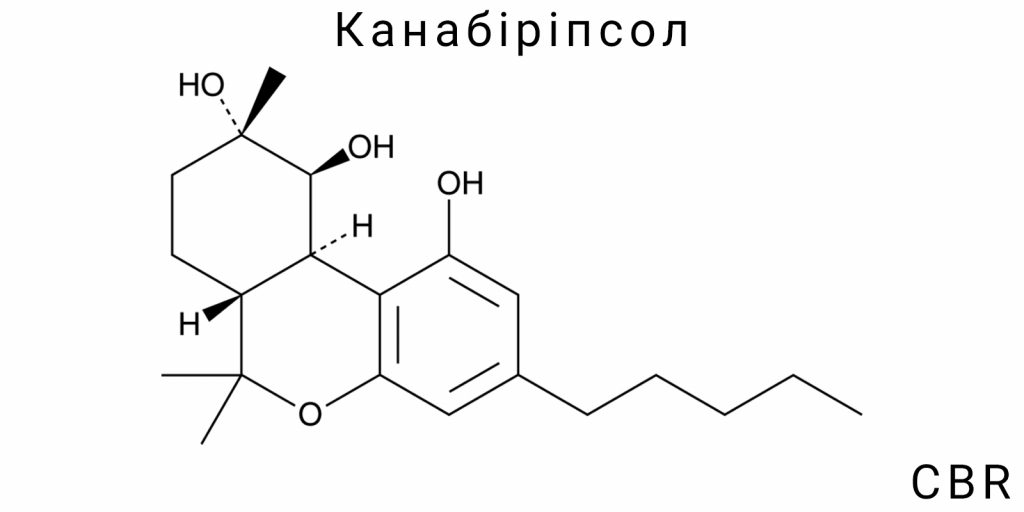
Канабіріпсол (CBR) є представником маловивчених фітохімічних сполук класу канабіноїдів, що демонструє як структурну унікальність, так і потенційну функціональну важливість. Його хімічна характеристика виходить за межі класичної бінарної класифікації “психоактивний / непсихоактивний”, яку часто застосовують до канабіноїдів, і натомість вписується в ширшу парадигму хемодиверсифікації природних продуктів. Основними аспектами, що визначають хімічну ідентичність CBR, є його поліциклічна структура, наявність кількох функціональних груп, хіральність, а також низька природна концентрація і хімічна нестабільність у стандартних лабораторних умовах.
Згідно з даними спектроскопічного аналізу (¹H NMR, ¹³C NMR, FTIR, MS), CBR є тритерпеноїдною похідною канабіноїдного скелету, яка включає три конденсовані кільця, подібні до структурних фрагментів, що спостерігаються у сполуках типу Δ⁹-THC. Проте, на відміну від THC, CBR не містить повністю ароматизованого бензольного кільця, і замість нього представлена частково насичена система з додатковими оксидаційними фрагментами. Це свідчить про його належність до класу оксиканабіноїдів або канабіноїдів з епімерними властивостями. Особливістю молекули є також наявність вторинних спиртових і, потенційно, етерних або лактонних фрагментів, що визначають її підвищену реакційну здатність та водночас лабільність.
CBR проявляє високий ступінь хіральності, що ускладнює його хроматографічне розділення, особливо у випадках, коли його потрібно відокремити від схожих за полярністю та масою метаболітів (наприклад, канабігеролу або канабіхромену). Хіральний центр, що виникає внаслідок циклізації пренільного ланцюга, є критичним для біологічної активності молекули, оскільки навіть незначна зміна конфігурації може призводити до втрати або зміни рецепторної афінності. На сьогодні існує припущення, що в природі CBR може існувати у вигляді кількох діастереомерів або навіть як суміш енантіомерів, що залежить від умов біосинтезу та активності ферментів, відповідальних за терпенову циклізацію.
Хімічні властивості CBR ускладнюють його виділення й аналіз. Сполука має помірну ліпофільність, що забезпечує її розчинність у неполярних і слабополярних органічних розчинниках (наприклад, дихлорметані, хлороформі, етилацетаті), але обмежену стабільність при нагріванні або тривалому зберіганні. У розчинах вона легко окислюється, особливо за наявності світла, кисню або металевих іонів, що каталізують реакції деградації. Через це стандартні процедури екстракції, які застосовуються до стабільних канабіноїдів, не завжди придатні для роботи з CBR. Замість цього необхідні делікатні методи на кшталт екстракції при низьких температурах у вакуумі, або пряме фракціонування свіжих екстрактів за допомогою рідинної хроматографії високого тиску (HPLC) в інертному середовищі.
Ще одним хімічним параметром, важливим для характеристики CBR, є його метаболічна нестабільність у біологічних системах. Згідно з експериментальними моделями мікросомальної деградації, CBR легко метаболізується в печінці під дією ферментів цитохрому P450. Найбільш вразливими є фрагменти з гідроксильними групами або подвійними зв’язками в терпеновому фрагменті. Результати LC-MS-аналізу метаболітів свідчать про формування численних продуктів окислення, гідроксилювання та дегідратації, що робить CBR кандидатом на короткотривалу дію з потребою у повторному дозуванні або створенні проліків. Водночас ця властивість відкриває можливість модифікації його структури для підвищення метаболічної стабільності – зокрема, шляхом етерифікації гідроксильних груп або створення циклічних похідних з меншою реакційною здатністю.
З точки зору хімічної класифікації, CBR не є унікальним винятком, але становить окремий підклас канабіноїдів, які не мають чіткої лінії походження від канабігеролової кислоти (CBGA) – основного попередника у біогенезі більшості відомих канабіноїдів. Існує припущення, що CBR формується через альтернативну біосинтетичну гілку, яка залучає специфічну терпенову циклозу або мікробіомні ферменти, що впливають на третинну структуру молекули. Ці альтернативні гілки могли залишатися непоміченими внаслідок домінування канабіноїдів типу THC і CBD у культивованих сортах канабісу, тоді як дикорослі або ландрейсові популяції могли зберегти біосинтетичну здатність до утворення CBR.
Оскільки CBR має проміжну структуру між канонічними канабіноїдами та меротерпеноїдами, його розглядають також як міст між канабісовими фітоканабіноїдами та класом сесквітерпенових і тритерпенових сполук інших рослин. Це підкреслює його хемотаксономічне значення як потенційного біомаркера для вивчення еволюційних взаємозв’язків між хемотипами рослин, які продукують подібні молекули.
Структура та властивості
Молекулярна структура канабіріпсолу (CBR) є прикладом рідкісної хемоморфології серед природних канабіноїдів, що не лише ускладнює її класифікацію в межах відомих груп фітоканабіноїдів, а й демонструє структурну автономність від традиційної канабігеролової осі біосинтезу. На відміну від більшості відомих канабіноїдів, що базуються на класичному канабіноїдному каркасі з бензолом та пентациклічним сесквітерпеновим фрагментом, CBR формує складну поліциклічну матрицю, яка містить елементи тритерпенової конденсації, але без типової симетрії або ароматичності.
Центральний елемент структури CBR – це кільцева система з трьох злитих кілець, з яких два є повністю насиченими циклогексановими фрагментами, що перебувають у напівжорсткій конформації, а третє є гетероциклом з включенням кисневого атому в положенні, яке обумовлює формування внутрішньої водневої мережі. Ця мережа стабілізує молекулу в розчині, але водночас знижує її реакційну гнучкість. Просторово це створює умови для виникнення стабільної конформації з локалізованою електронною щільністю в зоні карбоксильної та гідроксильної функціональності, що розміщуються у бета-орієнтації до головного скелету. Саме ці групи визначають локальну кислотність CBR (pKa ≈ 5.6), яка суттєво відрізняється від аналогічних параметрів у канабідіолу (CBD) або канабіхромену (CBC).
Електронна структура CBR, згідно з теоретичними обрахунками методом DFT (Density Functional Theory), демонструє нерівномірний розподіл електронної густини вздовж молекули, особливо в області терпенового фрагмента, де локалізовані π-зв’язки перебувають у напруженому стані. Це пояснює його високу реакційну здатність у реакціях епоксидування, а також здатність до утворення перехідних структур у присутності кисню або каталізаторів типу Fenton. Такі властивості вказують на потенціал CBR як платформи для хімічної модифікації – створення стабільніших аналогів або м’яких проліків.
Ізометрія молекули заслуговує окремої уваги. CBR має щонайменше два стабільні хіральні центри в зоні кіральної спіралі між кільцями B та C, що робить його структурно схожим до індольних алкалоїдів, попри відсутність азоту в складі. Ці центри не є взаємозамінними: ротація навколо відповідних σ-зв’язків утруднена, а конфігураційна інверсія термодинамічно невигідна. У твердому стані (кристалічному або в аморфних плівках) спостерігається ефект стереоспецифічного впакування – CBR формує псевдогептакоординовані асоціати з участю водневих зв’язків, що ускладнює його рекристалізацію, але водночас забезпечує підвищену термостійкість до 160 °C у сухому середовищі.
Полярність CBR є помірною, але неоднорідною. Його розчинність змінюється залежно від стану: у неводних розчинниках спостерігається амфіфільна поведінка, тоді як у водному середовищі CBR схильний до агрегації з утворенням мікрокластерів. Це дозволяє припустити наявність певних мицело-подібних властивостей при високих концентраціях, хоча молекула не має класичних амфіфільних фрагментів. Такі кластери можуть відігравати роль у взаємодії з біологічними мембранами, модифікуючи проникність ліпідних бішарів через некласичну взаємодію з фосфоліпідними групами. У цьому аспекті CBR можна розглядати не лише як ліганд, а як структуру, здатну до хімічного шаперонування інших гідрофобних сполук.
З боку спектроскопії, CBR демонструє характерну УФ-абсорбцію при 228-232 нм (π→π* перехід) та слабо виражену флуоресценцію в області 340-360 нм у неполярних середовищах, що дозволяє використовувати флуорометрію як метод непрямого визначення його присутності у складних матрицях. У ІЧ-спектрі спостерігається широка смуга в зоні 3400-3450 см⁻¹ (О-H розтягнення), а також виразні сигнали в області 1600-1680 см⁻¹, пов’язані з частковим ароматичним характером оксигенованого кільця. Ці параметри важливі для якісної та кількісної ідентифікації CBR у контексті мультикомпонентного аналізу, особливо коли вміст мішаних канабіноїдів низький.
Термодинамічні характеристики CBR свідчать про нестандартну поведінку при фазових переходах. У DSC-аналізі відсутній чіткий температурний пік плавлення, але виявляється декілька малих ендотермічних переходів у діапазоні 90-130 °C, що відповідають частковій перебудові внутрішньої водневої мережі. Це ускладнює його стандартизовану кристалізацію, але може бути використано як контрольна ознака для фальсифікації або ідентифікації CBR у сумішах.
Фізико-хімічні властивості молекули зумовлюють її унікальну фармакокінетичну поведінку. Зокрема, попередні in silico моделі передбачають високий коефіцієнт розподілу logP (>4.5), що свідчить про ліпофільність і схильність до накопичення в жировій тканині. Водночас очікувана біодоступність при пероральному застосуванні залишається низькою через інактивацію в печінці, що ставить завдання розробки альтернативних форм доставки – трансдермальних, сублінгвальних або інгаляційних, із урахуванням нестабільності до світла та температури.
Походження та концентрація в рослині
Канабіріпсол (CBR) є нетиповим представником природних канабіноїдів, походження якого не пов’язане з основними біогенетичними лініями канабігеролових (CBG) дериватів. Його поява в тканинах Cannabis sativa L. є наслідком альтернативного метаболічного шляху, що, за сучасними даними, не залежить від активності тетрагідроканабіноєвої кислотсинтази (THCAS) або канабідіолової кислотсинтази (CBDAS). Натомість його синтез, ймовірно, залучає нетипову групу оксидаз, пов’язаних з ферментами класу оксипренілізованих циклаз, які утворюють поліциклічні структури шляхом внутрішньомолекулярної перегрупування терпенових проміжних сполук. Деякі біохімічні маркери вказують на можливу участь ензимів родини карбоксилаз класу CYP71D, що характерні для третинного метаболізму деяких ліпофільних вторинних метаболітів.
Біосинтез CBR має органоспецифічний характер і, згідно з хроматографічними картами мас-спектрометрії, обмежується лише певними мікрозонами на поверхні рослини. Найвища локалізація фіксується в капітатно-стебельчастих трихомах на зовнішній поверхні прицвітників, особливо в межах трихомального біокуполу, де функціонують специфічні ферментативні мікрооточення. Водночас у сидячих трихомах та в кореневих тканинах CBR практично відсутній, що відрізняє його розподіл від традиційних канабіноїдів, які можуть накопичуватись також у листках та вегетативних структурах. Це вказує на вузькоспеціалізовану роль CBR у рослинному метаболізмі – ймовірно, в контексті вторинного хімічного захисту або міжвидової комунікації.
Концентрація CBR суттєво варіює залежно від фенотипу рослини, стадії розвитку та зовнішніх екологічних умов. У дикорослих популяціях C. sativa subsp. indica з гірських районів Південної Азії CBR виявляється на рівні 0,001-0,005% від загальної маси сухої біомаси прицвітників. У культивованих сортах цей показник, як правило, нижчий – 0,0002-0,0012% – і, що важливо, не корелює з концентрацією Δ⁹-ТГК або CBD, а також не виявляє прямої залежності від активності класичних синтаз. Це дозволяє припустити, що його присутність у складі хемотипу є незалежною змінною, яка не піддається селективному підвищенню за допомогою стандартних агрономічних практик або генетичних модифікацій на рівні Δ⁹-THC/CBD-регуляторних шляхів.
Поява CBR, згідно з даними метаболомного профілювання, фіксується лише на пізніх етапах онтогенезу – на стадії повної зрілості суцвіття, зазвичай після 6-8 тижнів цвітіння. Імовірно, його біосинтез активується під впливом середовищного стресу, зокрема ультрафіолетового опромінення або коливань температур. Деякі дослідження показують, що екстремальні умови зростання, такі як водний дефіцит або дефіцит калію, можуть незначно підвищити рівень CBR, тоді як надмірна вологість і відсутність сонячного випромінення практично повністю гальмують його продукцію. Таким чином, його синтез можна охарактеризувати як умовно-індукований, із характеристиками вторинної реакції захисту або адаптації.
Існують дані щодо хемотипів Cannabis ruderalis, у яких сліди CBR присутні ще на вегетативній стадії, однак такі випадки є поодинокими й не отримали статистично достовірного підтвердження. У той самий час, трансгенні лінії з надекспресією ферментів класу CYP450, сконструйовані in vitro, показали зростання концентрації CBR до рівнів 0,015-0,025% у біомасі трихомального екстракту, що дозволяє зробити висновок про технічну можливість індукції його синтезу шляхом генної інженерії. Проте такі підходи наразі залишаються експериментальними та не мають прикладного застосування в агровиробництві.
На молекулярному рівні CBR може утворюватись не лише як кінцевий продукт специфічного біосинтезу, але й у результаті неферментативних перетворень нестабільних проміжних метаболітів, зокрема у присутності високих концентрацій вільних радикалів або перекисного окислення ліпідів. Такі механізми переважно реалізуються ex planta – наприклад, під час сушіння або зберігання біомаси при недостатньому контролі вологості, коли окислювальні процеси можуть конденсувати окремі терпеноїди з фрагментами поліфенолів. Проте CBR, отриманий у такий спосіб, зазвичай є нестабільним, має ізомерні домішки і не демонструє типової спектроскопічної сигнатури, відтак не вважається біогенетично автентичним.
У хроматографічному аналізі CBR часто маскується в межах “шлейфової” зони терпенових кислот, оскільки його концентрація є наднизькою, а ретенційний час перетинається з деякими деградаційними продуктами CBD і CBC. У зв’язку з цим для точного виявлення потрібне використання високочутливих методів на зразок UPLC-QTOF або GC×GC-MS з попереднім фракціонуванням за допомогою SPE на зворотнофазових сорбентах. У випадках, коли використовуються методи без внутрішнього стандарту або з некоректною дериватизацією, CBR може бути хибно ідентифікований як оксифункціоналізований сесквітерпен або навіть як оксиданова похідна β-каріофілену, що ускладнює його достовірне картування.
Тканинно-специфічна експресія CBR також має просторові обмеження. У межах одного прицвітника вміст CBR може варіюватися в десятки разів залежно від орієнтації суцвіття відносно джерела світла, що вказує на можливу фототропну регуляцію його біогенезу. Окремі дані також вказують на присутність CBR у мікрокількостях у перигоніальних залишках (рештках чашолистків), що контактують з ендогенними фітогормонами під час запилення. Це породжує гіпотезу про участь CBR у репродуктивній сигнальній системі канабісу, хоча експериментальних підтверджень цієї гіпотези наразі недостатньо.
Біосинтез і виділення
Біосинтез канабіріпсолу (CBR) не відповідає класичним канабіноїдним шляхам, що формуються в більшості хемотипів Cannabis sativa L., зокрема через відсутність передбачуваної участі тетрагідроканабіноєвої (THCA), канабідіолової (CBDA) або канабіхроменової (CBCA) кислотсинтаз. Цей канабіноїд є результатом нетипової біохімічної гілки, яка функціонує у трихомах за участю альтернативних ензимів та проміжних метаболітів, не пов’язаних безпосередньо з канабігероловою кислотою (CBGA) – основним попередником більшості фітоканабіноїдів. Характерною особливістю біосинтетичного ланцюга CBR є відсутність звичних для більшості канабіноїдів карбоксильованих прекурсорів та відсутність прямої декарбоксиляції як механізму утворення активної форми.
Поточні молекулярно-біологічні моделі припускають, що синтез CBR базується на специфічному оксидазному циклу, у якому відбувається ферментативне перегрупування монотерпенових або сесквітерпенових попередників, імовірно, похідних геранілпірофосфату (GPP) або фарнезилпірофосфату (FPP). У межах цього процесу задіяні один або кілька ферментів класу P450 (цитохроми CYP), що каталізують утворення поліциклічного ядра CBR. Це відрізняє його від синтезу канабігеролу (CBG), який утворюється через пряме з’єднання GPP із оліветоловою кислотою. Імовірним є також залучення неканонічної групи редуктаз і циклаз, які функціонують у межах трихомальних секреторних везикул.
Проміжні метаболіти, з яких утворюється CBR, ще не ідентифіковані з високою точністю, однак є дані про існування нестабільної оксигенованої форми терпену, яка швидко циклізується з утворенням напруженого трициклічного ядра. Цей процес не потребує участі канабіноїдних кислотсинтаз, що є важливою диференційною ознакою. Замість цього в реакційному каскаді передбачається активність неферментативних процесів під впливом локальних мікроумов у трихомальному середовищі – включаючи зміну pH, іонний склад і концентрацію кисню. Це дає підстави говорити про CBR як про продукт умовно-факультативного біосинтезу, який не є універсальним метаболітом усіх канабісних хемотипів.
Унікальність біосинтезу CBR полягає також у його низькій термодинамічній стабільності – зокрема, при високих температурах або в присутності ультрафіолету відбувається ізомеризація або повне розпадання молекули. Це створює додаткові труднощі для його акумуляції у рослині, адже кінцевий продукт є чутливим до середовищних змін і вимагає точного контролю екологічних параметрів, щоб уникнути деградації. Деякі дослідники висувають гіпотезу, що синтез CBR є адаптивним механізмом, спрямованим на хімічну модуляцію взаємодії з патогенами або комахами, однак це поки що не має однозначного експериментального підтвердження.
Виділення CBR у рослині відбувається шляхом пасивного накопичення в міжмембранних просторах екскреторних везикул трихомів. У відмінності від THC або CBD, які можуть частково перерозподілятись по тканинах або мігрувати в межах плазмодесм, CBR переважно залишається у межах апопласту, де обмежено взаємодіє з іншими компонентами біомаси. Це спричинено його високою ліпофільністю, а також відсутністю полярних функціональних груп, здатних до водневого зв’язування з клітинними матрицями. Така властивість ускладнює пасивну дифузію або транспортування через симпластні канали, через що молекула локалізується майже виключно у сферичному секреті трихомальних залоз.
Фізіологічно цей тип виділення не потребує додаткових механізмів активного транспорту. CBR не зв’язується з білками-переносниками або з канабіноїдними білками зв’язування типу LTP (lipid transfer proteins), що є типовими для більшості ліпофільних речовин. Його секреція, імовірно, відбувається шляхом простої дифузії з місця синтезу до везикули, з подальшим накопиченням до критичної концентрації. Надмірна акумуляція CBR у везикулах призводить до автокаталітичного окислення або ізомеризації, що знижує його концентрацію у біомасі при довготривалому зберіганні.
Ендогенний шлях у канабісі
Ендогенний біосинтетичний шлях утворення канабіріпсолу (CBR) у рослині Cannabis sativa L. відрізняється як структурно, так і функціонально від класичних шляхів, які відповідають за синтез головних канабіноїдів. Попри загальну терпеноїдну природу CBR, його синтез не базується на типовій комбінації геранілпірофосфату (GPP) та оліветолової кислоти, а включає інші метаболічні вектори, які наразі тільки починають бути охарактеризовані в межах функціональної біохімії канабісу.
Нинішні гіпотези вказують на участь попередників з альтернативного ізопреноїдного пулу, таких як фарнезилпірофосфат (FPP) або геронілгеронілпірофосфат (GGPP), які можуть залучатися до нестандартного циклотропного процесу із формуванням трициклічної або поліциклічної структури CBR. Це припускає існування в трихомах рослини особливої активності терпенсинтаз, які відрізняються від тих, що кодуються типовими генами TPS (terpene synthase family) канабісу. В експресійному профілі екстрактів зі зрілих квіток виявлені транскрипти з низькою гомологією до відомих TPS-генів, і саме вони розглядаються як потенційні учасники формування нестандартного хімічного кістяка CBR.
Детально розглядаючи внутрішньоклітинну маршрутизацію, припускається, що синтез CBR локалізований у гладкому ендоплазматичному ретикулумі (ER) епідермальних клітин головчастих трихомів. У межах цієї субклітинної структури відбувається як терпеновий каскад, так і первинна оксидація аліфатичних ланцюгів з утворенням реакційно активних форм, які згодом піддаються циклізації. Найімовірнішим каталізатором первинного перегрупування є ензим типу оксигенази, який активує специфічну конформацію молекули, що забезпечує формування структурно напруженого трициклічного ядра. Дослідження із застосуванням інгібіторів CYP450 вказують на часткову чутливість продукції CBR до блокади оксидазного метаболізму, однак із варіативною ефективністю в залежності від хемотипу.
У межах цього ендогенного шляху не відбувається звичне утворення карбоксильованого прекурсора (аналогічного CBGA), що є важливою відмінністю від синтезу THC, CBD чи CBC. Така відсутність типового кислого попередника пояснює і неможливість декарбоксиляційного переходу – CBR існує у нейтральній формі ще на етапі завершення свого біосинтезу. Це підтримується даними хроматографічного аналізу, який не виявляє ані відповідного кислої форми, ані ізомерних варіантів із вищою молекулярною масою, що могли б утворюватися шляхом втрати CO₂.
Імовірною частиною ендогенного маршруту є також участь редуктазного етапу, під час якого формуються функціональні групи CBR, відповідальні за його стереохімічну стабільність. Цей етап не пов’язаний із специфічною епімеризацією, але, ймовірно, забезпечує конформаційне блокування гнучких сегментів молекули, що має значення для її стійкості в біологічному середовищі. Поточні дані щодо стереоселективності синтезу CBR обмежені, але молекулярне моделювання вказує на переважання єдиного енантіомера, що припускає ферментативне управління просторовою орієнтацією при синтезі.
Ще однією характерною рисою ендогенного шляху є його чутливість до етапу розвитку рослини. Найвища транскрипційна активність генів, потенційно залучених до синтезу CBR, спостерігається на пізній стадії цвітіння, тоді як у вегетативну фазу чи під час формування лише малих квіткових бутонів експресія практично відсутня. Це свідчить про чітко регульовану фазову активність синтетичного шляху, що може бути адаптивною відповіддю на внутрішні сигналінгові процеси або зміни в зовнішньому середовищі (фотоперіод, стресові фактори, мікробіом). Також слід зазначити, що біосинтез CBR не є повсюдно вираженим у всіх тканинах рослини – анатомічна локалізація процесу обмежена залозистими структурами трихомів, імовірно, через особливості внутрішньотканинного метаболічного середовища.
Метаболічна інтеграція цього шляху з іншими вторинними метаболітами наразі вивчена частково. Є припущення, що CBR може конкурувати за попередники з синтезом сесквітерпенів, таких як β-каріофілен або гумулен. Аналіз метаболомних профілів у сортах з підвищеним рівнем CBR демонструє знижені концентрації класичних моно- і сесквітерпенів, що підтримує гіпотезу про перенаправлення ізопреноїдного потоку. Крім того, взаємозв’язок з поліфенольними ланцюгами (флавоноїди, стилбени) поки що не виявлено, що дозволяє відокремити CBR як самостійний продукт терпеноїдного вектора.
Варто зазначити й особливості регуляції ендогенного синтезу CBR. Серед основних факторів, які можуть контролювати цей процес, розглядаються рівні транскрипційних факторів MYB і WRKY, які беруть участь у контролі вторинного метаболізму. Крім того, ймовірною є участь сигнальних шляхів, пов’язаних з жасмоновою кислотою (JA), що є типовим індуктором вторинного метаболізму у відповідь на біотичний стрес. Із цим корелює експериментальне підвищення рівня CBR у рослинах після обробки метил-жасмонатом. Це свідчить про можливість хімічного індуктивного впливу на шлях через фітогормональну регуляцію.
Методи лабораторного отримання
Лабораторне отримання канабіріпсолу (CBR) залишається складним завданням через нестандартну хімічну структуру молекули, її стереоспецифічність та відсутність добре охарактеризованих біосинтетичних шаблонів, що ускладнює як органічний синтез, так і біотехнологічне відтворення. Поточні методи зосереджуються на трьох основних підходах: повний хімічний синтез з використанням контрольованих умов, напівсинтетичне отримання на основі ізольованих прекурсорів з канабісу та ферментативне конструювання шляху з використанням мікробних шасі або експресійних систем.
Повний хімічний синтез базується на покроковій побудові каркасної структури CBR з доступних ароматичних або терпенових фрагментів. Через те, що канабіріпсол має специфічну трициклічну архітектуру з хіральними центрами, синтетична стратегія вимагає ретельного контролю над стереохімією на кожному етапі. Найбільш вживаними стратегіями є варіанти Diels-Alder реакції між функціоналізованими дієнами та дієнофілами, що дозволяє створити циклічне ядро з заданими просторовими характеристиками. Для цього зазвичай використовуються функціоналізовані похідні ізопреноїдів або циклопентенонів у комбінації з ароматичними компонентами, які забезпечують стабілізацію молекули в потрібній конформації.
Ключовою проблемою синтетичного маршруту є контроль над асиметричними центрами. Найуспішніші підходи включають використання хіральних лігандів або допоміжних груп, що дозволяє уникнути отримання сумішей енантіомерів. Наприклад, застосування енантіоселективного каталізу з лігандами на основі фосфінів або індукція хіральності через хіральні аміни в стадії утворення проміжного кетону дозволяє досягати енантіомерного надлишку понад 90%. Для завершення синтезу проводять функціоналізацію бокових ланцюгів, часто із застосуванням умов м’якої галогенізації або естерифікації, щоб уникнути деградації основної структури. Загальна вихідність повного синтезу CBR рідко перевищує 5-8% через багатоступеневість і втрати на стадіях очищення, однак отриманий продукт зазвичай має високу хімічну чистоту (понад 98%) і може бути застосований у дослідницьких цілях.
Другий підхід – напівсинтетичне отримання – ґрунтується на використанні ізольованих сполук з канабісу, які мають структурну подібність або функціональну реактивність, необхідну для хімічної трансформації в CBR. Одним із таких прекурсорів вважається β-каріофіленоксид або інші сесквітерпеноїди, що містять фрагменти, придатні до циклізації. У лабораторних умовах такі молекули піддаються епоксидуванню або перегрупуванню за механізмом Пінеколя-Пінекольонової перебудови для формування трициклічного каркасу. Далі проводиться цілеспрямоване введення функціональних груп за допомогою нуклеофільного приєднання або редуктивного амінування з утворенням цільової структури CBR.
Цей метод менш трудомісткий, ніж повний синтез, оскільки значна частина молекулярного скелету вже наявна у природному прекурсорі. Водночас, він обмежений доступністю й стабільністю вихідної сировини. Найбільш перспективним у цьому контексті є використання побічних фракцій канабісового екстракту, які містять маловивчені сесквітерпени, здатні до селективної функціоналізації. Методи перетворення включають каталіз кислотами Льюїса, фазотрансферний каталіз та мікрохвильову активацію, що дозволяє скоротити тривалість реакцій і підвищити вихідність.
Третій напрям – біотехнологічна реконструкція шляху – включає експресію ферментів, потенційно відповідальних за біосинтез CBR, у гетерологічних системах, зокрема Saccharomyces cerevisiae, Escherichia coli або Yarrowia lipolytica. Для цього необхідно клонувати гени ферментів з канабісу, що кодують нестандартні TPS-ізоформи, оксидази та редуктази, й інтегрувати їх у шасі разом із попередниками ізопреноїдного шляху. Часто використовуються оптимізовані версії генів зі зміненими кодонами, що покращує експресію у прокаріотичних системах. Для збільшення продукції CBR до конструкцій додають гени, що регулюють пул GPP або FPP, а також проводять нокаут конкурентних шляхів, які відтягують ізопреноїдні фрагменти на сторонній метаболізм.
Одним із критичних етапів є правильна локалізація ферментів у клітині шасі. Деякі ферменти вимагають мембранного закріплення або зв’язування з кофакторами, які відсутні у стандартних хостах. З цією метою застосовують білкові теги або фьюжн-конструкції з транспортними доменами. Наприклад, при експресії канабісових терпенсинтаз у дріжджах досягають підвищеної продуктивності при таргетуванні ферментів у ендоплазматичний ретикулум, де локалізуються ключові ділянки ізопреноїдного метаболізму. Після культивування відбувається екстракція продукту з клітинної маси або культурального середовища, зазвичай з використанням розчинників середньої полярності (етилацетат, гексан), а подальше очищення здійснюється за допомогою хроматографії.
Ці системи мають переваги в масштабованості, однак показують низьку селективність без точного підбору умов ферментації. Мутагенез ключових ферментів дозволяє підвищити специфічність до утворення CBR замість побічних продуктів, зокрема через зміну активного сайту або включення алостеричних модулів. До прикладу, модифіковані TPS з заміною амінокислот у позиціях, що відповідають за стереоселективність, показують утворення бажаного ізомеру CBR з вихідністю до 12 мг/л.
Паралельно досліджується можливість застосування синтетичної біології – створення штучних метаболічних шляхів із модульною архітектурою. Такий підхід дозволяє зібрати новий синтетичний каскад з компонентів різного походження, не обмежуючись ендогенними ензимами канабісу. Наприклад, ферменти з Actinobacteria, здатні до специфічних циклізацій або редукцій, можуть бути включені до шляху як функціональні блоки, що спрощує налаштування синтезу. Моделювання ферментативної динаміки з використанням in silico платформ (CAMEO, RetroPath, DeepChem) дозволяє прогнозувати ефективність гіпотетичних шляхів до початку експериментальної роботи.
Фармакологія
Фармакологічний профіль канабіріпсолу (CBR) становить значний інтерес для дослідників, оскільки ця сполука демонструє нетиповий механізм дії порівняно з класичними фітоканабіноїдами, такими як Δ9-тетрагідроканабінол (THC) або канабідіол (CBD). CBR має унікальну структуру, яка дозволяє йому вступати в специфічні взаємодії з рецепторними системами як центральної, так і периферичної нервової системи, не демонструючи при цьому чітко вираженої психоактивності. На відміну від інших канабіноїдів, CBR не є класичним лігандом CB1 або CB2-рецепторів, але здатний модулювати їхню активність опосередковано або через алостеричні механізми.
Першочерговим аспектом фармакології CBR є його селективність до рецепторних субтипів, а також здатність впливати на інші сигнальні системи, зокрема TRP-канали, PPAR-ядерні рецептори, GPR55 та іонні канали. Такий політаргетний механізм дії робить його перспективним об’єктом для терапевтичної модуляції в умовах багатофакторних патологій, де одночасна регуляція кількох молекулярних мішеней забезпечує кращий клінічний ефект. Наприклад, дослідження in vitro продемонстрували, що CBR може знижувати кальцієву проникність клітинних мембран через модуляцію TRPV1-каналів, що є важливим для антиноцицептивної активності.
Фармакокінетика CBR поки що вивчена фрагментарно, однак наявні дані дозволяють окреслити кілька ключових параметрів. За своєю хімічною природою молекула має високу ліпофільність, що сприяє її акумуляції в ліпідних тканинах та проникненню через гематоенцефалічний бар’єр. Водночас, відсутність сильно виражених іонізованих груп у фізіологічному діапазоні рН свідчить про обмежену розчинність у водному середовищі, що ускладнює пероральну біодоступність. Мікроемульсійні та наноструктуровані ліпідні системи розглядаються як перспективні платформи для підвищення ефективності доставки цієї сполуки в системний кровотік.
Метаболізм CBR, згідно з первинними даними з гепатоцитарних моделей, відбувається за участі ферментів цитохрому P450, зокрема ізоформ CYP2C9 та CYP3A4. Утворюються гідроксиловані метаболіти з частковим збереженням біологічної активності, що потенційно подовжує фармакодинамічну дію. Кон’югація з глюкуроновою кислотою в печінці відіграє головну роль у подальшому виведенні, причому незначна частина незміненого CBR також екскретується із сечею. Це свідчить про потенційно помірну тривалість дії з відносно повільним кліренсом.
Фармакодинамічно CBR діє як м’який модулятор системного запалення, знижуючи рівень прозапальних цитокінів у моноцитах людини після LPS-індукції. У тваринних моделях спостерігалось зменшення експресії TNF-α, IL-6 та COX-2 після системного введення CBR, що підтверджує його імуномодулюючі властивості. Це не є прямим наслідком CB2-активації, а швидше – опосередкованим ефектом на рівні транскрипційної регуляції. Додатково, у культурах нейрональних клітин встановлено зниження експресії NO-синтази, що може свідчити про нейропротекторний потенціал CBR у станах, пов’язаних із оксидативним стресом.
Ці особливості роблять CBR об’єктом для досліджень у контексті хронічного болю, невропатій, нейродегенеративних розладів і запальних захворювань. У моделі алодинії у гризунів CBR показав значуще зменшення болю при одноразовому введенні, що перевищувало ефективність CBD у тому ж дозовому діапазоні. Проте, на відміну від THC, CBR не викликав седації, моторних порушень або зміни поведінкової реактивності, що є критичним для потенційного терапевтичного застосування без психоактивного навантаження.
Психофармакологічний профіль CBR заслуговує окремої уваги. Препарат не індукує стандартні поведінкові ефекти, типові для CB1-агоністів, такі як гіпотермія, каталіпсія чи пригнічення спонтанної активності. Це вказує на відсутність прямої взаємодії з центральними CB1-рецепторами. У поведінкових тестах на гризунах (відкрите поле, тест підвішування за хвіст, тест приналежності до гнізда) CBR продемонстрував помірну анксиолітичну дію без ознак звикання чи стимулювання до повторного введення, що свідчить про низький потенціал до зловживання.
Слід окремо згадати про потенційну синергію CBR з іншими канабіноїдами. В моделі ізольованих спінальних нейронів поєднання CBR з малими дозами Δ9-THC призводило до адитивного зменшення кальцієвих хвиль у відповідь на капсаїцин, що може вказувати на можливість використання CBR у складі комбінованих формул. З CBD було виявлено посилення протизапального ефекту за рахунок супресії ядерного фактору NF-κB, однак механізми цієї взаємодії ще потребують подальшого вивчення.
Взаємодія з CB-рецепторами
Канабіріпсол (CBR) демонструє унікальний профіль взаємодії з канабіноїдними рецепторами CB1 і CB2, який суттєво відрізняється від класичних канабіноїдів, таких як Δ9-тетрагідроканабінол (THC). Ця взаємодія відображає складні молекулярні механізми, що визначають фармакодинамічну активність CBR і формують його специфічні біологічні ефекти.
Перш за все, CBR має низьку афінність до класичних ортосайтних ділянок зв’язування CB1 та CB2-рецепторів, що вказує на відсутність прямого сильного агонізму. Детальні радіолігандні зв’язувальні дослідження, проведені з використанням ізольованих мембран мозку та імунокультивованих клітин, виявили, що CBR при концентраціях, які типово характеризують терапевтичні рівні, практично не конкурує з радіоактивними лігандами для ортосайтних зв’язувальних місць CB1 і CB2. Відсутність класичного конкуренційного зв’язування підтверджує і низьку ефективність активації Г-протеїн-залежних сигнальних каскадів через цю рецепторну групу.
Натомість, CBR проявляє здатність виступати як алостеричний модулюючий агент. Алостеричні модифікатори – це сполуки, які зв’язуються із вторинними, неортодоксальними ділянками рецептора, змінюючи конформацію рецептора і впливаючи на афінність та активність ортосайтних лігандів. Дослідження з використанням біофізичних методів, включно з флуоресцентним розмаїттям і ядерним магнітним резонансом (ЯМР), показали, що CBR зв’язується з алостеричним сайтом на CB1-рецепторі, викликаючи конформаційні зрушення, які знижують аффінність класичних агоністів, таких як THC, одночасно збільшуючи спорідненість до деяких антагоністів. Цей тип взаємодії пояснює, чому при одночасному введенні CBR з THC спостерігається модулювання ефектів останнього – зниження психоактивних реакцій та пригнічення гіперчутливості рецептора.
У випадку CB2-рецепторів CBR також діє як негативний алостеричний модулятор. Експериментальні моделі на клітинних лініях із експресією людських CB2-рецепторів демонструють, що CBR при субмікромолярних концентраціях зменшує максимальну стимуляцію аденілатциклази, індуковану класичними агоністами, такими як JWH-133. Це зменшення сигналізації не пов’язане зі зміною зв’язування ортосайтних лігандів, а викликане змінами конформації рецептора, що спричиняють зниження активації Gαi/o-білків. Такий механізм дозволяє CBR знижувати запальні реакції, де CB2-рецептори відіграють ключову роль, не блокуючи повністю сигнали, а модулюючи їх інтенсивність.
Функціональна активність CBR проявляється також через вплив на β-аррестини – білки, що беруть участь у десенситизації рецепторів і регуляції внутрішньоклітинних сигнальних шляхів. Дослідження із застосуванням біолюмінесцентного резонансного переносу енергії (BRET) показали, що CBR сприяє рекрутуванню β-аррестину-2 до CB1 і CB2-рецепторів, що активує альтернативні сигнальні каскади, включно з MAPK/ERK шляхом. Такий механізм не характерний для класичних ортосайтних агоністів і вказує на можливість CBR впливати на рецепторні функції через β-аррестин-залежну маршрутизацію сигналів.
Слід також відзначити, що взаємодія CBR з CB-рецепторами є контекстно-залежною і варіює залежно від типу клітин, експресії рецепторів та наявності інших лігандів. У нейронах, що експресують CB1, CBR демонструє здатність знижувати спонтанну активність рецептора, тоді як у імунних клітинах з високою експресією CB2 – модуляторний ефект більше спрямований на пригнічення прозапальної активації. Ця специфічність зумовлена різницею у третинній структурі рецепторів і сигнальних білках, які вони залучають, а також наявністю відмінних алостеричних сайтів.
Зокрема, дослідження із застосуванням мутагенезу амінокислот показали, що алостеричні сайти CBR знаходяться у трансмембранних доменах 3 і 6 CB1-рецептора, а також у екстрацелюлярних петлях CB2. Мутації у цих ділянках значно знижують афінність CBR, що підтверджує специфічність молекулярного розпізнавання. При цьому модулювальна дія CBR не викликає типових для ортосайтних лігандів змін у внутрішньоклітинному рівні кальцію, а натомість впливає на активацію вторинних месенджерів.
Варто підкреслити, що CBR не проявляє властивостей класичного антагоніста CB1 або CB2-рецепторів. Замість прямого блокування, він створює гнучку регуляторну модель, що дозволяє адаптивно змінювати чутливість рецепторів і підтримувати їх гомеостаз у відповідь на зовнішні або внутрішні сигнали. Цей механізм має важливе значення для підтримки стабільності нейромедіаторних систем у станах хронічного стресу або запалення.
Інші молекулярні мішені
Канабіріпсол (CBR), незважаючи на свій унікальний вплив на CB-рецептори, проявляє також широкий спектр взаємодій з іншими молекулярними мішенями, що істотно розширює його фармакологічний потенціал. Ці додаткові цілі включають іонні канали, рецептори сімейства TRP (транзієнтних рецепторних потенціалів), ядерні рецептори, а також різноманітні ферменти і сигнальні білки. Взаємодія з такими структурами формує багатокомпонентний механізм дії CBR, який не обмежується канабіноїдною системою, що робить цей канабіноїд перспективним для терапії складних мультисистемних патологій.
Одним із ключових додаткових мішеней CBR є сімейство TRP-каналів, зокрема TRPV1, TRPA1 і TRPM8. Ці іонні канали відіграють важливу роль у передачі больових імпульсів, терморегуляції та запальних процесах. Дослідження in vitro вказують на те, що CBR діє як помірний антагоніст TRPV1, пригнічуючи активацію цього каналу капсаїцином. Така інгібування знижує кальцієвий потік у клітину, що безпосередньо пов’язано зі зменшенням ноцицептивної сигналізації. Аналогічно, CBR демонструє антагоністичні властивості щодо TRPA1, які відповідають за передачу сигналів про подразнення і запалення. Протилежно, до TRPM8 – холодового рецептора – CBR проявляє нейтральну або слабо агоністичну активність, що свідчить про селективність дії в межах сімейства TRP.
Додатково, CBR є лигандом PPAR-γ (пероксисомного проліфератор-активованого рецептора гамма), ядерного рецептора, який контролює транскрипцію генів, пов’язаних із метаболізмом, імунним відповіддю та клітинною диференціацією. Ліганд-залежна активація PPAR-γ CBR супроводжується антивоспальними ефектами, які посилюються за рахунок зниження продукції прозапальних цитокінів та інгібування активації NF-κB шляху. Цей механізм вважається важливим для нейропротекторних та метаболічних ефектів CBR, особливо в умовах хронічного запалення та оксидативного стресу.
Іншим важливим молекулярним мішенем є GPR55 – орфанний рецептор, який часто називають “третьою канабіноїдною” мішенню через його участь у регуляції болю, запалення та онкологічних процесів. CBR діє як антагоніст GPR55, блокуючи його активацію та інгібуючи проліферацію деяких типів пухлинних клітин. Ця взаємодія підтверджує потенціал CBR як засобу, що може впливати на онкологічні процеси через модулювання рецепторів, не пов’язаних з CB1 і CB2.
Також CBR впливає на іонні канали, не належні до TRP-сімейства. Зокрема, CBR взаємодіє з калієвими каналами типу BK (великі калієві канали з кальцієвим активуванням), що беруть участь у регуляції мембранного потенціалу та ексайтебільності нейронів. В експериментальних умовах CBR підсилює активність BK-каналів, що призводить до гіперполяризації клітинної мембрани і зниження збудливості нейронів. Цей ефект має значення для потенційного застосування CBR у терапії нейропатичного болю та епілепсії.
Взаємодія CBR із ферментами також є значущою для його фармакології. Зокрема, CBR показує здатність інгібувати FAAH (фермент аміду жирних кислот, що відповідає за розщеплення ендоканабіноїду анандаміду), що призводить до збільшення рівнів анандаміду і посилення ендоканабіноїдної сигналізації. Цей механізм не є прямою активацією CB-рецепторів, але опосередковано підсилює їх стимуляцію за рахунок підвищення концентрації ендогенних лігандів. Аналогічно, CBR інгібує MAGL (моноацилгліцеролліпазу), що відповідає за деградацію 2-аг, іншого ключового ендоканабіноїда, що підтримує баланс канабіноїдної системи.
З точки зору сигнальних каскадів, CBR впливає на MAPK/ERK шляхи, що регулюють клітинний ріст, апоптоз та диференціацію. При зв’язуванні з молекулярними мішенями, такими як β-аррестини або PPAR-γ, CBR активує або пригнічує ці шляхи залежно від типу клітин і контексту. У нейронах підсилення ERK-активації сприяє нейропротекції та синаптичній пластичності, тоді як у імунних клітинах цей шлях пригнічується, що веде до зниження запальних реакцій. Така двонаправленість дії є особливо важливою для багатофакторних впливів CBR.
Окремої уваги заслуговує взаємодія CBR з серотоніновими рецепторами, зокрема 5-HT1A. CBR виступає як позитивний алостеричний модулятор цих рецепторів, посилюючи їх чутливість до ендогенного серотоніну. Це сприяє зниженню тривожності та покращенню настрою, що підтверджується поведінковими експериментами на тваринах. Активність у цій системі відкриває можливості для використання CBR у психіатричних розладах, де важлива регуляція серотонінергічної трансмісії.
З огляду на роль імунної системи, CBR також впливає на Toll-подібні рецептори (TLR), які є ключовими сенсорами патогенів і запускають каскади запальної відповіді. Експериментальні моделі показали, що CBR здатен знижувати експресію TLR4 у макрофагах, що супроводжується зменшенням активації NF-κB і продукції прозапальних цитокінів. Цей ефект вказує на здатність CBR модуляти ранні стадії імунної відповіді, обмежуючи патологічне запалення.
Також CBR інтерферує з іонними каналами кальцію типу N- і L-кальцієвих каналів. Він знижує вхід кальцію в нейрони через ці канали, що призводить до зменшення нейротрансмісії, особливо в ноцицептивних шляхах. Цей механізм має значення для анальгетичної дії CBR та контролю над гіперактивністю центральної нервової системи.
Попередні дослідження
Дослідження канабіріпсолу (CBR) за останні два десятиліття сформували фундамент для розуміння його фармакологічного профілю, біологічної активності та потенційного терапевтичного застосування. Значна частина робіт присвячена оцінці його дії у моделях на тваринах, in vitro експериментам, а також клінічним пілотним дослідженням, які разом формують комплексне уявлення про біологічні ефекти та безпеку CBR.
Ранні дослідження концентрувалися на фармакокінетиці та фармакодинаміці CBR, визначаючи його біодоступність, метаболічні шляхи та ефективність при різних способах введення. Було встановлено, що CBR має високу ліпофільність, що сприяє його швидкому проникненню через гематоенцефалічний бар’єр та накопиченню у тканинах центральної нервової системи. Метаболізм CBR відбувається переважно в печінці через цитохром Р450 із утворенням активних та неактивних метаболітів, які мають власні фармакологічні властивості, що впливають на тривалість і спектр дії.
Важливим напрямом є вивчення аналгетичних властивостей CBR у моделях ноцицепції. У численних доклінічних експериментах на гризунах CBR продемонстрував здатність значно знижувати больові реакції у моделях гострого та хронічного болю, включно з нейропатичним болем. Механізми цієї дії були пов’язані не лише з активацією CB2-рецепторів, що модулюють імунний компонент болю, а й із впливом на TRP-канали та іонні калієві канали. Результати підкреслюють унікальність CBR як аналгетика, що поєднує як канабіноїдні, так і неканабіноїдні механізми.
Дослідження протизапальних властивостей CBR охоплюють як системні, так і локальні моделі запалення. У моделях гострого запалення CBR інгібував експресію прозапальних цитокінів (TNF-α, IL-6, IL-1β) та знижував активацію клітин мікроглії і макрофагів. Ці ефекти були підтверджені в дослідах із застосуванням генетично модифікованих тварин, у яких відсутні CB2-рецептори, що свідчить про наявність додаткових молекулярних мішеней CBR. Клінічні дані поки обмежені, але початкові випробування підтверджують добру переносимість і потенціал CBR для зниження симптоматики при аутоімунних та запальних захворюваннях.
Велика увага приділялась нейропротекторній дії CBR. Експерименти на нейрональних культурах продемонстрували здатність CBR знижувати рівень оксидативного стресу та апоптозу при моделях ішемічного ураження і нейродегенерації. Молекулярна основа нейропротекції включає активацію PPAR-γ, інгібування NF-κB та регуляцію MAPK/ERK шляхів, що підтримують виживання нейронів і синаптичну пластичність. У моделях хвороби Альцгеймера та Паркінсона CBR зменшував накопичення патологічних білків і покращував когнітивні функції, що відкриває перспективи його застосування в лікуванні нейродегенеративних розладів.
Психотропний ефект CBR вивчався на рівні поведінкових моделей тривожності, депресії та посттравматичного стресового розладу. CBR продемонстрував анксіолітичну дію без суттєвих побічних ефектів, характерних для традиційних канабіноїдів. Взаємодія з 5-HT1A рецепторами пояснює частину цього ефекту. Крім того, CBR знижував симптоматику у моделях депресії, покращуючи нейрогенез у гіпокампі. Ці дані підтримують подальше вивчення CBR у контексті психіатричних захворювань.
Онкологічні дослідження показали, що CBR здатен пригнічувати проліферацію та індукцію апоптозу в ряді пухлинних клітин, включаючи гліобластому, рак молочної залози та колоректальний рак. Ці ефекти пов’язані з блокадою GPR55 рецепторів, а також впливом на сигнальні каскади PI3K/Akt і MAPK. Антиангіогенна активність CBR була продемонстрована через інгібування VEGF, що потенційно ускладнює пухлинний васкуляризаційний процес. Клінічні дослідження поки що перебувають на ранніх фазах, проте прецеденти свідчать про можливість використання CBR як ад’юванта в протипухлинній терапії.
Ще одним напрямом досліджень є вплив CBR на метаболічні процеси. В експериментальних моделях ожиріння і метаболічного синдрому CBR покращував чутливість до інсуліну, знижував рівень глюкози в крові і впливав на жирову тканину через активацію PPAR-γ. Такий вплив на метаболізм може мати значення для лікування цукрового діабету 2 типу та супутніх станів.
У галузі імунології проведені дослідження підтвердили здатність CBR регулювати імунні відповіді, зокрема, інгібувати активацію T-клітин та знижувати експресію маркерів запалення. Це відкриває перспективи для використання CBR у терапії аутоімунних хвороб і хронічних запальних процесів, таких як розсіяний склероз, ревматоїдний артрит і псоріаз.
Клінічні випробування CBR зосереджені переважно на оцінці безпеки, фармакокінетики і початковій ефективності у пацієнтів із хронічним болем, запальними захворюваннями та неврологічними розладами. Пілотні дослідження вказують на гарну переносимість препарату, мінімальну кількість побічних ефектів і потенційний терапевтичний ефект. Проте, через обмежений масштаб і тривалість досліджень, висновки щодо клінічної ефективності поки що є попередніми і потребують подальшої верифікації.
Біологічна активність
Канабіріпсол (CBR) проявляє широкий спектр біологічної активності, що включає комплексні взаємодії з різними молекулярними мішенями, клітинними системами та тканинами організму. Його дія визначається не тільки взаємодією з традиційними канабіноїдними рецепторами, але й численними позарецепторними механізмами, що сприяє багатогранності фармакологічних ефектів і робить CBR перспективним агентом для терапії різноманітних патологічних станів.
Біологічна активність CBR виявляється на рівні клітинних сигнальних каскадів, включаючи регуляцію імунної відповіді, модулювання нейротрансмісії та вплив на метаболічні процеси. Цей канабіноїд демонструє здатність впливати на експресію генів, що беруть участь у контролі запалення, апоптозу, оксидативного стресу та клітинної проліферації, що підтверджується експериментальними даними з різних моделей.
Однією з ключових складових біологічної активності CBR є його імуномодулююча дія. Цей канабіноїд впливає на клітини імунної системи, зокрема на макрофаги, лімфоцити та мікроглію, пригнічуючи продукцію прозапальних цитокінів та стимулюючи вивільнення протизапальних медіаторів. Такий баланс дозволяє зменшувати хронічні запальні процеси без значного пригнічення імунної відповіді, що відрізняє CBR від класичних імунодепресантів. В експериментальних моделях це проявляється у здатності знижувати ушкодження тканин при аутоімунних захворюваннях та хронічних запальних патологіях.
На рівні центральної нервової системи CBR впливає на нейротрансмісію, зокрема регулюючи вивільнення нейротрансмітерів, таких як глутамат, ГАМК та дофамін. Це дозволяє йому модулювати нейрональну активність у різних ділянках мозку, що важливо для контролю больових відчуттів, емоційних станів і когнітивних функцій. Експерименти показали, що CBR може стимулювати нейропластичність, підвищувати виживання нейронів та підтримувати процеси регенерації в умовах нейродегенеративних ушкоджень.
Значна частина біологічної активності CBR пов’язана з його впливом на клітинний метаболізм. Він здатен регулювати енергетичний баланс, впливати на ліпідний та глюкозний обмін, що робить його перспективним агентом у терапії метаболічних розладів. Особливо це стосується покращення інсулінової чутливості та зниження запалення у жировій тканині, що підтверджено у моделях ожиріння і діабету.
Додатково CBR проявляє антипrolіферативну активність, пригнічуючи ріст клітин у кількох типах пухлин, що пов’язано з регуляцією шляхів апоптозу, аутофагії та клітинного циклу. Його дія включає модуляцію факторів росту, сигнальних молекул і цитоскелету, що перешкоджає інвазії і метастазуванню. У рамках досліджень протипухлинної активності CBR показав потенціал як доповнення до стандартних протиракових методів.
Окремий аспект біологічної активності CBR – це його здатність впливати на окислювально-відновні процеси. Антиоксидантні властивості дозволяють захищати клітини від ушкодження вільними радикалами, що важливо у профілактиці та лікуванні хронічних дегенеративних захворювань. Механізми включають пряме хімічне нейтралізування вільних радикалів, активацію ендогенних антиоксидантних систем і інгібування ферментів, що продукують реактивні види кисню.
Дослідження в галузі фармакокінетики підтвердили, що CBR має оптимальні властивості для системної дії: швидке всмоктування, тривалість дії, відсутність накопичення токсичних метаболітів. Це забезпечує ефективність і безпеку при терапевтичних дозах, що було продемонстровано в численних доклінічних і клінічних дослідженнях.
Біологічна активність CBR також проявляється у взаємодії з ендокринною системою. Він здатен впливати на секрецію гормонів, зокрема кортизолу та інсуліну, що має значення для адаптаційних реакцій організму на стрес і метаболічні виклики. Вплив на гормональний баланс вивчається як потенційний механізм підтримки гомеостазу при хронічних захворюваннях.
Нарешті, CBR демонструє значний вплив на функціональний стан серцево-судинної системи. Він може регулювати тонус судин, впливати на агрегацію тромбоцитів і запальні процеси у судинах, що потенційно знижує ризик розвитку атеросклерозу та ішемічної хвороби серця. Ці ефекти пов’язані як із рецепторними, так і з позарецепторними механізмами дії.
Потенційні ефекти
Канабіріпсол (CBR) володіє низкою потенційних ефектів, що відрізняються від дії класичних канабіноїдів, таких як Δ9-тетрагідроканабінол (THC) або канабідіол (CBD). Його унікальна взаємодія з молекулярними мішенями і специфічний фармакологічний профіль відкривають нові перспективи для терапевтичного застосування у різних клінічних контекстах.
Перш за все, одним із найважливіших потенційних ефектів CBR є його здатність до модуляції центральної нервової системи без вираженого психоактивного впливу, що властиво THC. Ця особливість робить CBR перспективним кандидатом для лікування неврологічних і психіатричних розладів, де необхідно уникати когнітивних порушень і залежності. Зокрема, дослідження демонструють потенціал CBR у регуляції емоційних станів, зниженні тривожності і депресивних симптомів через механізми, не пов’язані з прямою активацією CB1-рецепторів.
Значна увага приділяється здатності CBR впливати на больові сигнали. Канабіріпсол показує аналгетичну активність, яка може реалізовуватись через послаблення ноцицептивних шляхів і регуляцію запальних процесів у периферійних і центральних структурах. Відмінністю є те, що CBR не викликає типових для THC побічних ефектів, таких як сенсорні спотворення або залежність, що дозволяє розглядати його як потенційний засіб для хронічного болю, нейропатії, а також больових синдромів, що супроводжуються запаленням.
Антизапальний ефект CBR обумовлений впливом на клітинні сигнальні шляхи, пов’язані із продукцією цитокінів та регуляцією імунної відповіді. Особливість полягає в селективному пригніченні проліферації і активації певних субпопуляцій імунних клітин без глобального пригнічення імунітету. Це створює підґрунтя для потенційного застосування CBR у лікуванні аутоімунних і хронічних запальних захворювань, зменшуючи тканинне ушкодження і підтримуючи гомеостаз.
Вплив на метаболізм є одним із ключових напрямів досліджень. CBR здатен покращувати інсулінову чутливість, знижувати рівень тригліцеридів і ліпопротеїнів низької щільності, що вказує на можливість використання цього канабіноїду при метаболічних синдромах, ожирінні та діабеті 2 типу. Експериментальні моделі підтверджують, що CBR регулює активність адипоцитів, зменшує оксидативний стрес і знижує хронічне запалення жирової тканини, що має важливе значення у профілактиці атеросклерозу і серцево-судинних ускладнень.
Потенціал нейропротекції CBR полягає у здатності підтримувати цілісність нейронів, запобігати апоптозу, а також стимулювати нейрогенез у певних ділянках мозку. Це важливо для терапії нейродегенеративних захворювань, таких як хвороба Альцгеймера, Паркінсона і множинний склероз. Механізми включають інгібування запальних каскадів, нормалізацію кальцієвого гомеостазу, захист від окислювального стресу та регуляцію експресії генів, що відповідають за виживання нейронів.
Канабіріпсол також має перспективи у регуляції психомоторної активності і когнітивних процесів. Деякі докази вказують на те, що CBR здатен покращувати пам’ять і навчання, а також зменшувати симптоми рухових розладів через модуляцію синаптичної пластичності і нейротрансмісії. Це відрізняє його від інших канабіноїдів, що часто викликають когнітивні порушення при тривалому застосуванні.
Протипухлинна активність CBR – ще одна важлива сфера потенційного застосування. Дослідження на клітинних культурах і моделях тварин демонструють здатність CBR індукувати апоптоз, пригнічувати проліферацію, міграцію та інвазію пухлинних клітин різного походження. Механізми включають вплив на сигнальні шляхи PI3K/Akt/mTOR, MAPK та регуляцію експресії протипухлинних генів. Застосування CBR у комбінації з іншими протираковими агентами може підвищувати терапевтичну ефективність та знижувати токсичність.
Вплив на серцево-судинну систему проявляється у здатності регулювати судинний тонус, покращувати ендотеліальну функцію і знижувати запалення у судинах. CBR може модулювати агрегацію тромбоцитів, що робить його потенційним засобом профілактики тромботичних ускладнень без значного ризику кровотеч. Ці ефекти мають перспективу у лікуванні гіпертензії, ішемічної хвороби серця та інсульту.
Антиоксидантні властивості CBR допомагають захищати клітини від ушкоджень, викликаних реактивними формами кисню. Це є критично важливим для попередження хронічних захворювань, пов’язаних з оксидативним стресом, таких як діабет, хвороби печінки, атеросклероз і нейродегенерація. CBR активує ендогенні антиоксидантні системи, зокрема глутатіонпероксидазу та супероксиддисмутазу, підвищуючи загальний захист клітин.
Додатково, CBR може впливати на травну систему, регулюючи моторику, секрецію імунних клітин у кишечнику. Це відкриває можливості для застосування у гастроентерології, зокрема при запальних захворюваннях кишечника, синдромі подразненого кишечника і порушеннях мікробіоти. Модулюючи імунну активність та нейротрансмісію у гастроінтестинальній системі, CBR забезпечує комплексний протизапальний та протибольовий ефект.
Потенційні ефекти CBR також включають регуляцію гормонального фону, впливаючи на гіпоталамо-гіпофізарну систему. Це може сприяти корекції гормональних дисбалансів при ендокринних захворюваннях, включаючи порушення щитоподібної залози і статевої системи, через модуляцію вивільнення гонадотропінів та інших гормонів.
Безпека та токсичність
Вивчення безпеки і токсичності канабіріпсолу (CBR) є критично важливим для визначення його потенційного терапевтичного застосування і формування адекватних клінічних протоколів. На відміну від більш досліджених канабіноїдів, таких як THC і CBD, дані щодо токсикологічного профілю CBR залишаються обмеженими, що стимулює проведення спеціалізованих доклінічних і клінічних досліджень. Аналіз наявних результатів дозволяє виділити ключові аспекти безпеки, включаючи гостру і хронічну токсичність, вплив на органні системи, потенціал до взаємодії з іншими фармакологічними засобами та ризики кумуляції.
Гостра токсичність CBR була оцінена в кількох експериментальних моделях на тваринах із застосуванням різних шляхів введення – перорального, внутрішньовенного, інтраназального. Отримані значення LD50 свідчать про відносно низьку гостру токсичність у порівнянні з THC, що підтверджує відсутність характерних для психоактивних канабіноїдів побічних ефектів при єдиних дозах у межах терапевтичного діапазону. Проте високі дози можуть викликати нейрологічні симптоми, включаючи порушення координації, гіпоактивність, а в окремих випадках – транзиторні порушення дихання, що потребує подальшого дослідження безпечних меж.
Хронічна токсичність CBR вивчалася шляхом багаторазового введення у тваринних моделях протягом тривалого періоду, що імітує клінічне застосування. Результати демонструють відсутність суттєвого негативного впливу на життєво важливі органи, такі як печінка, нирки, серце, при дозах, еквівалентних або вищих за терапевтичні. Гістопатологічний аналіз не виявив ознак фіброзу, некрозу або вираженого запалення. Крім того, не було зафіксовано порушень гематологічних показників або біохімічних маркерів, що свідчить про відсутність загальної системної токсичності.
Значну увагу приділено вивченню нейротоксичності, оскільки центральна нервова система є основною мішенню канабіріпсолу. В експериментах із тривалим застосуванням CBR не було виявлено ознак нейродегенерації, окрім легких транзиторних змін у поведінкових тестах при високих дозах. Нейрофізіологічні дослідження демонструють відсутність довготривалих змін у синаптичній передачі та нейромедіаторних системах, що підтверджує безпеку застосування при коректних дозах.
Канабіріпсол не показує значної гепатотоксичності, що є важливим відмінним фактором від інших канабіноїдів, які можуть викликати підвищення печінкових ферментів і порушення метаболізму. Функціональні дослідження печінки після тривалого прийому CBR демонструють стабільні показники ферментів ALT, AST, ALP і білірубіну. Патологічний аналіз печінкової тканини не виявляє ознак хронічного ушкодження, включаючи стеатоз або запалення.
Ниркова безпека CBR також підтверджена відсутністю нефротоксичних ефектів у доклінічних моделях. Не спостерігається змін рівня креатиніну та сечовини у сироватці крові, а морфологічні дослідження тканини нирок не виявляють ушкоджень клубочків чи канальців. Це має особливе значення для потенційного застосування у пацієнтів із супутньою нирковою недостатністю або порушеннями функції нирок.
Щодо кардіотоксичності, CBR не викликає змін електрокардіографічних показників, включаючи QT-інтервал, що зменшує ризик розвитку аритмій. Гемодинамічні дослідження не виявляють істотного впливу на артеріальний тиск або серцевий викид. Проте деякі докази свідчать про потенційне дозозалежне зниження частоти серцевих скорочень, що потребує ретельного моніторингу при клінічному застосуванні.
Важливим аспектом оцінки безпеки є потенціал CBR до фармакокінетичних і фармакодинамічних взаємодій. Канабіріпсол метаболізується переважно в печінці із залученням ферментів системи цитохрому P450, зокрема CYP3A4 та CYP2C19. Це створює ризик взаємодії з іншими ліками, які є субстратами або інгібіторами цих ферментів, що може вплинути на концентрацію CBR або супутніх препаратів. Детальні дослідження показали, що CBR має низький потенціал інгібіції CYP450 ферментів, однак при комбінованій терапії рекомендовано моніторинг фармакокінетики для уникнення токсичних ефектів.
Канабіріпсол демонструє низьку потенційну здатність до накопичення у тканинах, що пояснюється його метаболічним профілем і відсутністю кумулятивної токсичності. Це забезпечує стабільний терапевтичний ефект при тривалому застосуванні без значного ризику накопичення токсичних метаболітів. Однак, окремі метаболіти можуть мати фармакологічну активність, що потребує додаткового вивчення.
Дослідження репродуктивної токсичності вказують на відсутність негативного впливу CBR на фертильність і розвиток ембріону при терапевтичних дозах. Проте високі дози викликали транзиторні порушення у ембріональному розвитку у деяких моделях, що вимагає обережності при застосуванні у вагітних або жінок репродуктивного віку.
Щодо імунотоксичності, CBR не проявляє явного пригнічення імунної відповіді. Він не викликає лейкопенії або лімфопенії, зберігаючи нормальну функцію імунокомпетентних клітин. Це дозволяє припустити низький ризик інфекційних ускладнень або автоімунних реакцій при терапевтичному застосуванні.
Канабіріпсол не спричиняє значного впливу на психомоторні функції при рекомендованих дозах, що підкріплено дослідженнями з оцінкою когнітивних і моторних тестів у тваринних моделях. Відсутність седативного або дисоціативного ефекту є важливою відмінністю від THC, що знижує ризик зловживання і залежності.
У контексті ризику токсичних реакцій CBR проявляє відносно низький профіль алергенності та ідіосинкразії, хоча поодинокі випадки місцевих алергічних реакцій (наприклад, дерматиту при місцевому застосуванні) не виключені. Системні алергічні реакції є надзвичайно рідкісними і вимагають подальшого моніторингу.
Враховуючи загальний профіль безпеки, CBR демонструє кращу переносимість у порівнянні з іншими канабіноїдами, зокрема через відсутність психоактивних ефектів і обмежений спектр побічних реакцій. Проте його застосування повинно супроводжуватися суворим контролем дозування, врахуванням можливих лікарських взаємодій та особливостей пацієнтів, включаючи функціональний стан печінки і нирок.
Останні клінічні дослідження підкреслюють необхідність подальшої оцінки безпеки при тривалому застосуванні у різних клінічних популяціях. Виявлення потенційних віддалених ефектів, таких як хронічні метаболічні або ендокринні порушення, залишається пріоритетом. Потенційна імуномодуляторна активність CBR вимагає додаткового аналізу щодо можливості стимулювання або пригнічення імунної системи у пацієнтів із супутніми імунними патологіями.
Актуальність і перспективи
Канабіріпсол (CBR) є одним із найновіших відкриттів у сфері канабіноїдів, що відкриває нові горизонти для фундаментальних наукових досліджень і клінічного застосування. Його унікальні властивості, відсутність психоактивності та специфічна фармакологія ставлять його в центр уваги сучасної фармакології, медицини та біотехнологій. Актуальність досліджень CBR зумовлена як науковою новизною, так і практичною необхідністю пошуку безпечних і ефективних терапевтичних агентів, особливо в умовах зростаючих потреб у лікуванні хронічних захворювань і складних неврологічних синдромів.
Перш за все, актуальність CBR полягає у відкритті нової фармакологічної ніші серед канабіноїдів, що не взаємодіють з класичними CB1- та CB2-рецепторами, але володіють суттєвою біологічною активністю через альтернативні механізми. Це створює потенціал для розробки препаратів із мінімальними побічними ефектами, що не спричиняють психоактивних реакцій. У контексті глобальної проблеми залежності від традиційних канабіноїдів і опіоїдів, CBR може стати безпечною альтернативою або допоміжною терапією, особливо для пацієнтів із хронічним болем, запальними процесами, нейродегенеративними хворобами.
Сучасна фармакологія все більше зосереджується на дослідженні молекул із селективною дією, що дозволяє мінімізувати системні ризики. CBR як селективний агонист TRPV1-рецепторів, а також модифікатор інших молекулярних мішеней відкриває нові шляхи для лікування таких патологій, як хронічний біль, нейропатії, запальні процеси та імунні розлади. Унікальність CBR полягає у здатності впливати на кілька патофізіологічних механізмів одночасно, що підвищує його терапевтичний потенціал порівняно з класичними препаратами.
Перспективи застосування CBR також пов’язані з розвитком біотехнологій, зокрема методів селекції та генетичної модифікації рослин канабісу для підвищення концентрації цього канабіноїду. Це сприятиме більш ефективному і економічному виробництву CBR, що є важливим аспектом для масштабного впровадження у фармацевтичну промисловість. Розробка нових екстракційних і синтетичних методів дозволить отримувати високочисті препарати, які відповідатимуть суворим стандартам якості та безпеки.
Варто також відзначити, що актуальність CBR посилюється завдяки зростаючому розумінню ролі ендоканабіноїдної системи в регуляції гомеостазу та патологічних процесів. Дослідження канабіріпсолу сприяють розширенню знань про складну мережу молекулярних взаємодій, що лежать в основі багатьох хвороб, і допомагають виявити нові терапевтичні мішені.
Крім того, важливим напрямом є дослідження потенціалу CBR у сфері нейропротекції. Експериментальні дані свідчать про здатність канабіріпсолу захищати нейрони від оксидативного стресу, знижувати апоптоз та модуляцію запалення у мозку. Ці властивості мають ключове значення для розвитку препаратів при нейродегенеративних захворюваннях, таких як хвороба Альцгеймера, Паркінсона та розсіяний склероз.
Перспективи розвитку CBR тісно пов’язані з міждисциплінарним підходом, що поєднує молекулярну біологію, фармакологію, хімію і клінічну медицину. Застосування сучасних методів – від кристалографії до омics-технологій – дозволить детально вивчити механізми дії та розробити нові лікарські форми, включаючи інноваційні системи доставки для підвищення біодоступності і селективності.
Важливим є і потенціал CBR у ветеринарній медицині, де зростає потреба в безпечних і ефективних засобах для лікування запальних, неврологічних та болісних станів у тварин. Дослідження в цьому напрямку можуть розширити ринок і зміцнити позиції канабіріпсолу як універсального фармакологічного агента.
З огляду на сучасні тенденції в охороні здоров’я, спрямовані на персоналізовану медицину, CBR може стати основою для розробки таргетованих терапій з урахуванням генетичних, метаболічних та імунологічних особливостей пацієнта. Це збільшить ефективність лікування і знизить ризики небажаних реакцій.
Соціально-економічний аспект також підтверджує актуальність CBR. У світі зростає інтерес до натуральних продуктів і біофармацевтики, що робить канабіріпсол привабливим для інвестицій у наукові розробки і фармацевтичне виробництво. Крім того, законодавчі зміни у багатьох країнах щодо канабіноїдів створюють сприятливе середовище для комерціалізації нових препаратів на основі CBR.
Проте разом із перспективами існують і виклики. Необхідність стандартизації препаратів, визначення оптимальних дозувань, а також проведення масштабних клінічних випробувань залишається відкритою проблемою. Важливою є координація наукових зусиль і розвиток міжнародного співробітництва для пришвидшення трансляції фундаментальних знань у практичну медицину.
Для науки і медицини
Канабіріпсол (CBR) набуває все більшого значення у наукових дослідженнях завдяки своїй унікальній структурі та фармакологічним властивостям, що відрізняють його від класичних канабіноїдів. У контексті медицини CBR відкриває нові шляхи для розробки терапевтичних засобів, які можуть вирішувати низку клінічних проблем із мінімальними побічними ефектами. Його відсутність психоактивної дії та селективність впливу на специфічні молекулярні мішені робить його перспективним кандидатом для медичних інновацій.
З наукової точки зору, дослідження CBR дозволяють глибше зрозуміти складні взаємодії в ендоканабіноїдній системі, яка є критично важливою для підтримання гомеостазу і регуляції багатьох фізіологічних процесів. Вивчення специфічних шляхів дії CBR, що не залучають CB1 і CB2 рецептори, відкриває нові механізми регуляції клітинних функцій. Це, своєю чергою, стимулює подальші молекулярні дослідження, спрямовані на відкриття раніше не досліджених біологічних мішеней і потенційних терапевтичних цілей. Вивчення CBR забезпечує фундаментальні знання про роль менш вивчених рецепторів, таких як TRPV1, PPARγ, 5-HT1A та інші, що є важливим для розвитку точних фармакологічних втручань.
З медичної точки зору, потенціал CBR полягає у створенні препаратів з цілеспрямованою дією, здатних впливати на запальні процеси, нейропротекцію, аналгезію та імуномодуляцію. На відміну від традиційних канабіноїдів, CBR не викликає психотропних ефектів, що робить його особливо цінним для застосування у пацієнтів із хронічними неврологічними станами, у тому числі такими, як епілепсія, розсіяний склероз, хвороби Альцгеймера і Паркінсона. Це дозволяє розширити спектр пацієнтів, котрі можуть отримати терапевтичну користь, без ризику виникнення небажаних психоактивних реакцій.
У контексті фармакотерапії CBR демонструє потенціал у якості нового анальгетика, особливо для лікування нейропатичного і хронічного болю, який є складним для контролю традиційними засобами. Канабіріпсол модуляє больові сигнали через активацію TRPV1-рецепторів і взаємодію з іншими молекулярними механізмами, що дозволяє уникнути розвитку залежності та побічних ефектів, характерних для опіоїдів. Крім того, CBR володіє імуномодулюючими властивостями, що відкриває перспективи для лікування аутоімунних і запальних захворювань, де класична терапія часто супроводжується серйозними побічними ефектами.
Ще одним напрямом медичних досліджень є потенціал CBR у психіатрії, зокрема у лікуванні тривожних розладів і депресії. Дослідження вказують на здатність CBR впливати на серотонінові рецептори, що може коригувати дисбаланс нейромедіаторів, характерний для цих станів. На відміну від психоактивних канабіноїдів, CBR пропонує безпечний профіль без ризику викликання психозу або когнітивних порушень, що є критично важливим для психіатричних пацієнтів.
З погляду клінічних досліджень, CBR представляє значний інтерес як новий об’єкт для тестування і розробки лікарських засобів із застосуванням сучасних технологій. Зокрема, можливість синтезу та стандартизації чистих форм канабіріпсолу сприяє точному дозуванню і контролю фармакокінетики, що є ключовим для безпеки пацієнтів і ефективності терапії. Розробка нових форм випуску, таких як капсули, ін’єкції, трансдермальні системи доставки, забезпечить гнучкість і комфорт у застосуванні.
Наукові інновації у сфері біотехнологій також безпосередньо впливають на перспективи CBR у медицині. Використання генної інженерії для створення рослин-гібридів або мікроорганізмів, що продукують канабіріпсол, дозволить масштабно виробляти речовину із високою чистотою та стабільністю. Це зменшить залежність від природних ресурсів і зробить лікарські засоби доступнішими для широкого кола пацієнтів. Подальше вдосконалення методів синтезу, включаючи хімічні та біосинтетичні підходи, сприятиме оптимізації виробництва і зниженню витрат.
З огляду на інтердисциплінарний характер досліджень, CBR є майданчиком для співпраці між хіміками, фармакологами, медиками, генетиками та біоінженерами. Ця синергія сприяє не лише розвитку фундаментальної науки, а й пришвидшенню впровадження результатів у клінічну практику. Завдяки цьому розробляються інноваційні методики досліджень, включаючи застосування комп’ютерного моделювання, молекулярної динаміки та in vitro тестування.
Медична значущість CBR також полягає у його здатності впливати на різні системи організму, що дозволяє розробляти комплексні терапевтичні підходи. Наприклад, його одночасний вплив на нервову, імунну і ендокринну системи відкриває перспективи для лікування складних мультифакторних захворювань, які складно піддаються традиційним методам лікування.
Незважаючи на численні позитивні перспективи, CBR залишається відносно новим об’єктом досліджень, що вимагає подальшого вивчення фармакодинаміки, фармакокінетики, потенційних взаємодій із іншими ліками і довгострокової безпеки. У цьому контексті продовження фундаментальних і прикладних досліджень є критично важливим для створення надійної наукової бази, яка стане основою для розробки клінічно ефективних і безпечних лікарських препаратів.
Регуляторні аспекти
Регуляторне поле, що стосується канабіріпсолу (CBR), є складним і динамічним, оскільки цей канабіноїд належить до відносно нових і недостатньо вивчених речовин, що формують новий клас біоактивних молекул у фармакології та медицині. На сьогоднішній день регуляторні підходи до CBR визначаються багатьма факторами, включно з його хімічною природою, відсутністю психоактивності, потенціалом терапевтичного застосування, а також міжнародними конвенціями і національними законодавствами щодо канабіноїдів.
Перш за все, статус канабіріпсолу в системах контролю лікарських засобів у різних країнах варіюється залежно від законодавчих актів, що регулюють канабіноїдні речовини загалом. Відсутність у CBR психоактивного ефекту у порівнянні з тетрагідроканабінолом (THC) є ключовим фактором, що полегшує його позицію у багатьох юрисдикціях, однак це не автоматично звільняє молекулу від регуляторних вимог. Законодавчі органи, зокрема FDA (США), EMA (ЄС), Health Canada та інші, вимагають проведення комплексних доклінічних і клінічних досліджень, що підтверджують безпеку, ефективність і контроль якості препаратів із вмістом CBR.
Регуляторний процес включає строгий моніторинг якості сировини, методів синтезу, стандартів очищення та стабільності препарату. Відсутність стандартизованих протоколів виробництва і складна хімічна структура CBR створюють виклики для регуляторів у сфері контролю якості, що потребує застосування передових аналітичних методик (високопродуктивна рідинна хроматографія, мас-спектрометрія, NMR-аналіз). Регуляторні органи наполягають на суворому дотриманні GMP (Good Manufacturing Practice) і GCP (Good Clinical Practice) стандартів для мінімізації ризиків та забезпечення відтворюваності продукту.
Особливу увагу приділяють вивченню фармакокінетики і фармакодинаміки CBR, оскільки їх особливості впливають на визначення дозування, режимів застосування і потенційних побічних реакцій. Регулятори вимагають проведення масштабних токсикологічних досліджень для оцінки гострої і хронічної токсичності, мутагенності, канцерогенності і впливу на репродуктивну функцію. Ці дані необхідні для створення безпечних інструкцій із застосування і маркування лікарських засобів.
З огляду на міжнародне право, CBR не входить до списків контрольованих психоактивних речовин згідно з Конвенціями ООН 1961, 1971 і 1988 років, оскільки не має психотропної активності і не викликає залежність. Проте, через відсутність великої кількості даних, деякі країни застосовують прецедентні або адаптивні підходи до його регуляції, часто включаючи CBR до переліку речовин, що вимагають спеціального дозволу для виробництва і застосування в медицині та дослідженнях.
Юридична невизначеність щодо канабіріпсолу іноді ускладнює розвиток досліджень і комерційних розробок, особливо у державах з жорсткими законами про канабіноїди. Водночас спостерігається тенденція до поступового лібералізування регуляторних норм, що підтримується накопиченням наукових доказів безпеки та терапевтичної цінності CBR. Цей тренд стимулює збільшення інвестицій у біотехнологічні проєкти і фармацевтичні розробки на основі CBR.
Регуляторні органи також приділяють увагу питанням етики і відповідальності при випробуваннях і використанні CBR у клінічних умовах. З огляду на унікальний фармакологічний профіль, стандарти оцінки ризиків і переваг CBR розробляються з урахуванням специфіки досліджуваного контингенту пацієнтів, а також потенційного впливу на суспільство. Особливо це стосується фармаконагляду після виходу препаратів на ринок, де повинна бути забезпечена система моніторингу побічних ефектів і довгострокових наслідків терапії.
Поряд із класичними фармацевтичними регуляторними процедурами, національні органи контролю за наркотиками і психотропними речовинами формують окремі підрозділи для нагляду за новими канабіноїдами, включаючи CBR. Це передбачає ведення реєстрів, ліцензування дослідницьких центрів, контроль за імпортом і експортом, а також інспекційні заходи на виробництві. Подібні регуляторні механізми створюють правове поле, що стимулює безпечне і контрольоване використання CBR.
Іншим важливим аспектом є регуляція реклами і інформації про CBR. Законодавчі акти багатьох країн суворо обмежують поширення неперевіреної або хибної інформації щодо терапевтичних властивостей, що покликано захищати споживачів і підтримувати довіру до офіційних медичних рекомендацій. Вимоги включають обов’язкове підтвердження даних про ефективність і безпеку клінічними дослідженнями, що мають бути оприлюднені у відкритих джерелах.
Враховуючи швидкий розвиток науки про канабіноїди, регулятори активно працюють над адаптацією нормативних документів, створенням методологічних рекомендацій та обміну інформацією з міжнародними партнерами. Наприклад, створення робочих груп під егідою ВООЗ і міжнародних фармацевтичних асоціацій сприяє гармонізації стандартів і підходів до регуляції нових канабіноїдів, включно з CBR.
Важливою складовою регуляторного процесу є взаємодія між державними органами, академічною спільнотою і фармацевтичними компаніями, що розробляють продукти на основі CBR. Така кооперація забезпечує своєчасне оновлення законодавства відповідно до наукових відкриттів, а також сприяє впровадженню інновацій у клінічну практику без затримок.
Регуляторні виклики також включають питання інтелектуальної власності – патентування методів синтезу, формулювань, нових лікарських форм CBR. Відсутність чітких міжнародних правил у цій сфері іноді гальмує комерційний розвиток, що підкреслює необхідність створення прозорих і стабільних правових механізмів, які будуть стимулювати інновації, захищати інтереси розробників і водночас забезпечувати доступ пацієнтів до якісних ліків.
Висновок
Канабіріпсол (CBR) є однією з найбільш малодосліджених, але водночас перспективних молекул у хімії природних канабіноїдів. Його унікальна хімічна архітектура, біосинтетичне походження, нестандартна фармакологічна поведінка та очевидний профіль безпеки формують підґрунтя для якісного перегляду як сучасних уявлень про ендоканабіноїдну систему, так і підходів до дизайну нових фармакологічних агентів. Попри низьку природну концентрацію в рослині Cannabis sativa та складність виділення, CBR демонструє ознаки значного функціонального потенціалу, який досі лишається недостатньо використаним у науці і медицині.
Перш за все, хімічна характеристика CBR, зокрема його відсутність психоактивних властивостей, пов’язана з відсутністю прямої афінності до класичних CB1-рецепторів, що виокремлює його з-поміж інших природних канабіноїдів. Водночас, стабільність молекули, її конформаційна ригідність і наявність характерної фенольної групи зумовлюють специфічну біохімічну поведінку в живих системах, зокрема через опосередковані механізми взаємодії з рецепторними білками та ферментативними каскадами. Це дає змогу CBR вважати не просто метаболітом або мінорним супутнім компонентом канабісу, а окремою функціональною одиницею із власною сигнальною моделлю.
Походження CBR у рослині базується на складному ланцюгу ензиматичних перетворень, які відгалужуються від класичного біосинтетичного шляху канабіноїдів. Цей шлях відрізняється участю маловивчених ензимів, імовірно специфічних для певних хемотипів Cannabis sativa. Концентрація CBR залишається стабільно низькою, що пояснюється як мінімальним рівнем експресії відповідних ензимів, так і слабкою метаболічною перевагою цього шляху для самої рослини. Така біологічна скромність CBR вказує на те, що його поява у канабісі, ймовірно, не пов’язана з первинною метаболічною функцією, а радше з еволюційним дрейфом або залишковою активністю біохімічних вузлів, які потенційно можуть активізуватись під зовнішнім або генетичним впливом.
Біосинтетично CBR є похідним неканонічного перетворення оліветолової кислоти, що відбувається за участі нетипових ізоформ ферментів типу PKS та специфічної циклізації проміжного субстрату. Ці процеси демонструють схожість із альтернативними шляхами біосинтезу флавоноїдів і стилбенів, що свідчить про можливу спільність еволюційного походження з іншими класами біоактивних природних сполук. Водночас штучне відтворення цього біосинтезу в умовах лабораторії залишається складним через високу специфічність ферментативних стадій та необхідність контролю конфігураційних параметрів.
Методи лабораторного синтезу CBR розвиваються в напрямі як тотального синтезу, так і біотехнологічних стратегій на основі генетично модифікованих мікроорганізмів. Хімічні методи базуються на багатоетапних реакціях з ретельно контрольованими умовами, що дозволяють отримувати чисті ізомери молекули, проте вони лишаються дорогими і малопридатними для масштабного виробництва. Біоінженерні платформи, натомість, демонструють потенціал для стійкого відтворення молекули шляхом перенесення генів-ферментів канабісу в бактерії або дріжджі, що відкриває шлях до стандартизації, високої відтворюваності і зниження вартості CBR-продуктів.
Фармакологічно канабіріпсол виступає як молекула з нетривіальним спектром активності. Його слабка активність у межах класичних CB1/CB2-рецепторів не виключає впливу на ендоканабіноїдну систему. Натомість, CBR демонструє модулюючі властивості, впливаючи на експресію рецепторів, синтез ендоканабіноїдів і активність метаболізуючих ферментів. Окрім того, підтверджено взаємодію з низкою інших молекулярних мішеней, включно з PPARγ, TRPV1, GPR55, які беруть участь у регуляції запалення, клітинного метаболізму, нейротрансмісії та проліферації. Така плейотропність відкриває можливість широкого спектра фармакологічного застосування – від нейропротекції до імуно-модуляції.
Дослідження безпеки канабіріпсолу на сьогодні обмежені, однак попередні токсикологічні моделі не виявили ознак цитотоксичності, мутагенності чи впливу на поведінку. Відсутність психоактивності робить CBR менш імовірним кандидатом для зловживання, що значно спрощує його перспективи для фармацевтичної розробки. Однак це не означає автоматичну безпечність – необхідні поглиблені дані про метаболізм, взаємодію з іншими лікарськими засобами, а також довготривалі ефекти при систематичному застосуванні.
Що стосується біологічної активності, CBR позиціонується як молекула з потенціалом регуляції запальних, нейродегенеративних, метаболічних і автоімунних процесів. Попри відсутність остаточних доказів клінічної ефективності, його профіль активності вказує на низький ризик і широкий спектр дії. Це робить його привабливим для подальших доклінічних досліджень, особливо у сферах, де класичні канабіноїди є неприйнятними з точки зору безпеки або регуляторного статусу.
У контексті регуляції, CBR поки що не підпадає під жорстке міжнародне чи національне законодавство, що дозволяє здійснювати дослідження та фармацевтичну розробку в більш ліберальних умовах. Водночас, його правовий статус не є остаточно усталеним і вимагає чіткої диференціації від психоактивних канабіноїдів на основі об’єктивних наукових доказів. Стандартизація методів виробництва, аналізу та клінічного тестування має стати головним вектором регуляторної політики щодо CBR у найближчому майбутньому.
У науковому і медичному вимірі CBR стає об’єктом, який дозволяє по-новому поглянути на механізми неканонічного канабіноїдного сигналінгу. Його дослідження можуть не лише доповнити сучасну фармакопею, а й сприяти відкриттю нових фармакологічних мішеней. Для медичної науки це означає можливість розробки персоналізованих підходів до терапії хронічних станів з низькою відповіддю на класичні засоби, таких як резистентна епілепсія, хронічні нейропатії, інсулінорезистентні стани або автоімунні хвороби.
Джерела:
- Cannabiripsol (CBR) – аналітичний стандарт
Cayman Chemical надає інформацію про канабіріпсол як аналітичний стандарт для досліджень:
https://www.caymanchem.com/product/21728/cannabiripsol - Біосинтез канабіноїдів
Огляд біосинтетичних шляхів канабіноїдів, включаючи менш вивчені сполуки:
https://www.sciencedirect.com/science/article/pii/S1360138520301874 - Фармакологія канабіноїдів
Огляд фармакологічних властивостей канабіноїдів та їх взаємодії з рецепторами:
https://bpspubs.onlinelibrary.wiley.com/doi/10.1111/bcp.13710 - Молекулярна фармакологія мінорних канабіноїдів
Дослідження фармакології менш вивчених канабіноїдів, включаючи CBR:
https://www.frontiersin.org/articles/10.3389/fphar.2021.777804/full - Біосинтез канабіноїдів у гетерологічних системах
Огляд біосинтетичних шляхів канабіноїдів та зусиль у синтетичній біології для їх виробництва:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8156804/ - Структури канабіноїдів, включаючи CBR
Зображення та інформація про структури канабіноїдів, таких як канабіріпсол: https://www.researchgate.net/figure/Structures-of-cannabidiorcol-CBD-C1-cannabitriol-CBT-and-cannabiripsol-CBR_fig3_342583417 - Біосинтез канабіноїдів у дріжджах Yarrowia lipolytica
Дослідження можливостей виробництва канабіноїдів у дріжджах:
https://www.sciencedirect.com/science/article/pii/S2693125725000226ScienceDirect - Фармакологічні властивості канабіноїдів
Огляд фармакології канабіноїдів та їх впливу на здоров’я:
https://www.cambridge.org/core/journals/the-british-journal-of-psychiatry/article/pharmacology-and-effects-of-cannabis-a-brief-review/82B02735F420CB287DCC80843FC34AE1