Канабіноїдна система ссавців, зокрема рецептори CB1 і CB2, а також низка неспецифічних мішеней (TRP-канали, GPR55, PPARγ), відома своєю мультифункціональністю та залученістю до регуляції фізіологічних процесів: від ноцицепції й запалення до нейропластичності, імунної відповіді та метаболічного гомеостазу. Із середини 2010-х років спостерігається зсув дослідницької парадигми від вивчення основних канабіноїдів (Δ⁹-THC, CBD) до широкого спектру рідкісних або малодосліджених структур, відомих як “малі канабіноїди”. Однією з таких малодосліджених сполук є канабітріолварин (CBTV), який наразі не фігурує в жодному з великих клінічних протоколів, не стандартизований у фармакопеях і є недоступним у більшості комерційних каталогів хімічних реагентів. Проте, саме ця молекулярна невизначеність є аргументом на користь поглибленого вивчення CBTV у контексті пошуку нових терапевтичних мішеней, а також для валідації структурної різноманітності у межах класу варинових канабіноїдів.
CBTV є вариновим аналогом канабітріолу (CBT), тобто має пропіловий бічний ланцюг замість типового пентилового в CBT. Це, здавалося б, мінімальне заміщення, проте воно суттєво змінює як фізико-хімічні характеристики (розчинність, ліпофільність, точку кипіння), так і біологічну поведінку молекули. Варинові похідні відомі своєю селективнішою активністю відносно CB2-рецепторів, меншою психоактивністю та зміненими профілями метаболізму. Однак, попри структурну близькість до CBT, CBTV не є просто його коротколанцюговим ізомером – він формує окрему нішу в хімічному ландшафті фітоканабіноїдів, обумовлену унікальним метаболічним походженням, відсутністю кон’югованих подвійних зв’язків у кільці С та високою стабільністю до оксидаційного розпаду.
Біосинтетично CBTV імовірно утворюється із CBTVA (канабітріолваринової кислоти), якого в рослинах знайдено слідові кількості. Як попередник, CBGVA (канабігероваринова кислота) трансформується під дією специфічних синтаз у CBTVA, яка далі може декарбоксилюватися у CBTV. Існує гіпотеза, що CBTV утворюється не безпосередньо, а як побічний продукт деградації інших варинових канабіноїдів або як продукт окиснення неканонічними шляхами в умовах стресу (ультрафіолет, висока температура, дефіцит азоту в ґрунті тощо). Таким чином, його природний біогенез – це не лише питання хемотипу рослини, а ще й мікроекологічних та метаболічних умов, що не відтворюються в лабораторних умовах без спеціалізованих технік.
Проблематика синтезу CBTV, з огляду на його мінімальні природні концентрації, є окремим напрямом. Стандартизовані екстракційні методи не адаптовані для ізоляції рідкісних канабіноїдів на рівні мікрограмів. Хроматографічна селекція у поєднанні з мас-спектрометрією лише підтверджує наявність CBTV в природних зразках, але не забезпечує його для фармакологічного скринінгу. Тому розвиток хемосинтетичних або напівсинтетичних шляхів отримання CBTV із доступних прекурсорів, наприклад з CBGV чи CBV, може виявитися критичним для подальшої валідації цієї сполуки як фармакологічного агента.
На відміну від CBT, який проявляє низьку афінність до канабіноїдних рецепторів, CBTV, за попередніми in silico моделями, може демонструвати покращену спорідненість до CB2 та неканонічних рецепторів (GPR55, PPARγ), що робить його потенційним імуномодулятором з низьким ризиком психоактивності. Молекулярне докування CBTV вказує на можливу модуляцію ліпідного обміну через активацію ядерних рецепторів, що є перспективним напрямом у контексті метаболічних синдромів, діабету другого типу та хронічного запалення. При цьому, майже повна відсутність токсикологічних даних робить будь-яке клінічне застосування передчасним без систематизованих досліджень фармакокінетики, біотрансформації та безпеки.
CBTV перебуває в науковій “сліпій зоні” – між фундаментальною хімією і прикладною фармакологією. Його маргінальність у науковому дискурсі пояснюється, з одного боку, складністю ідентифікації, з іншого – браком методологічного апарату для кількісного дослідження таких малих компонентів у складних біоматриксах (екстрактах, плазмі крові, мозковій тканині). Але саме такі “приховані” молекули найчастіше і є об’єктами наукових проривів у біомедичній хімії, особливо в епоху синтетичної біології, системної фармакології та машинного моделювання ліганд-рецепторних взаємодій.
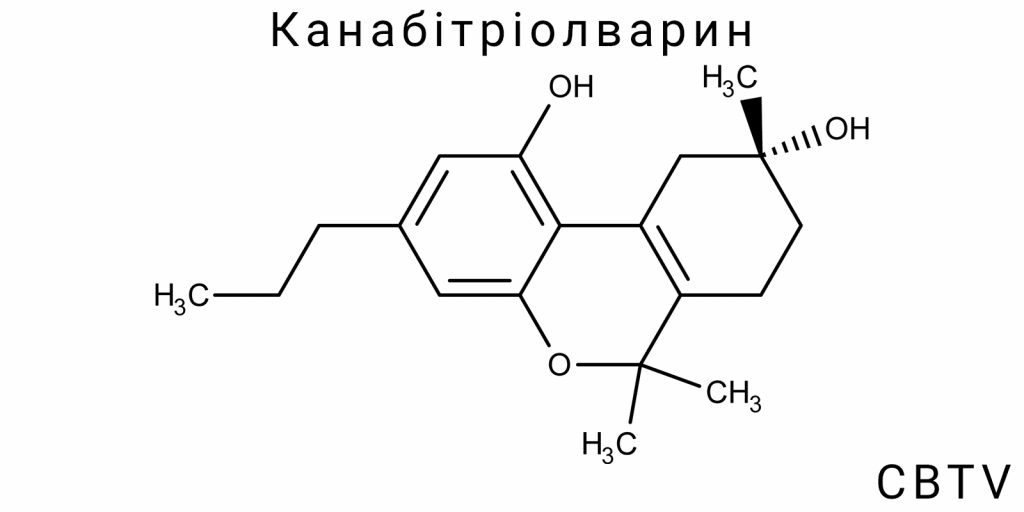
Структурно-хімічна ідентичність CBTV
Молекулярна формула та стереохімія
Канабітріолварин (CBTV) є канабіноїдним сполуком, що належить до родини канабіноїдів, однією з груп органічних сполук, які виявляють біологічну активність через взаємодію з канабіноїдними рецепторами в організмі. Молекулярна формула CBTV – C21H30O2, що вказує на те, що молекула містить 21 атом вуглецю, 30 атомів водню та 2 атоми кисню. Це базова структура для багатьох канабіноїдів, але з певними специфічними відмінностями, які визначають його унікальні властивості в порівнянні з іншими сполуками цієї категорії, такими як THC або CBD.
Одна з основних відмінностей CBTV від інших канабіноїдів полягає в наявності специфічної стереохімічної структури, яка суттєво впливає на його взаємодію з канабіноїдними рецепторами в організмі. Стереохімія визначає просторову організацію атомів у молекулі і є ключовим фактором для визначення фармакологічної активності сполуки. У випадку з CBTV важливим є конфігурація його гідроксильних груп, яка визначає взаємодію з рецепторами та його біологічну активність.
Молекулярна структура CBTV складається з ароматичного кільця, що з’єднано з карбоновим ланцюгом, який, своєю чергою, містить додаткову гідроксильну групу. Розташування цих функціональних груп на молекулі визначає, як CBTV буде взаємодіяти з іншими молекулами в організмі. Зокрема, ця молекула може проявляти свою активність через два основні канали: вплив на канабіноїдні рецептори CB1 і CB2, а також через потенційний вплив на інші рецепторні системи, як, наприклад, серотонінові рецептори. Порівняно з іншими канабіноїдами, CBTV має специфічну конфігурацію, яка дозволяє йому взаємодіяти з організмом дещо відмінним чином, що дає йому потенціал для специфічного терапевтичного використання.
Структура CBTV також включає бічний ланцюг, що грає важливу роль у визначенні його фармакологічної активності. Цей ланцюг є важливим аспектом, оскільки його функціональні групи можуть змінювати спосіб зв’язування молекули з рецепторами, що впливає на ефективність і тривалість її дії в організмі. На молекулярному рівні стереохімія CBTV також дозволяє йому виявляти різні ступені активності залежно від хімічних змін або можливих метаболічних шляхів. Саме ці стереохімічні особливості можуть робити CBTV особливо цікавим для клінічного застосування в якості лікарського засобу для лікування різноманітних патологій.
Варинові похідні: як боковий ланцюг змінює функціональність
Варинові похідні – це група канабіноїдів, що мають структурні варіації в боковому ланцюзі молекули порівняно з іншими канабіноїдами, такими як THC або CBD. У випадку CBTV, боковий ланцюг відіграє важливу роль у визначенні не тільки хімічних властивостей, але й біологічної активності. Саме зміни в боковому ланцюгу можуть значно змінити функціональність сполуки, забезпечуючи її специфічну фармакологічну активність.
У випадку CBTV боковий ланцюг має кілька важливих особливостей, зокрема він включає додаткові метильні групи або різноманітні функціональні замісники, які можуть взаємодіяти з канабіноїдними рецепторами в організмі. Важливою рисою варинових похідних є те, що ці зміни часто пов’язані з покращенням фармакокінетичних властивостей молекул, таких як поглинання, метаболізм і елімінація. Оскільки кожен вариновий похідний може мати певні варіації в своєму боковому ланцюгу, це може суттєво змінити, як він буде взаємодіяти з канабіноїдними рецепторами і як довго буде зберігатися в організмі.
Зміни в боковому ланцюгу також можуть визначити специфічну активацію або інгібування різних канабіноїдних рецепторів, що дозволяє вариновим похідним, таким як CBTV, проявляти специфічні фармакологічні ефекти. Наприклад, певні варіанти бокового ланцюга можуть збільшити агонизм до рецепторів CB2, що має важливе значення для зниження запалення та больових відчуттів. В інших випадках, варіації в структурі можуть посилити взаємодію з CB1 рецепторами, що може мати нейропсихіатричні ефекти, такі як зміна настрою або зниження тривожності.
Крім того, варинові похідні можуть виявляти більш стійкі фармакодинамічні ефекти порівняно з класичними канабіноїдами, що робить їх більш привабливими для використання в медичній практиці, особливо в контексті довготривалої терапії. Завдяки наявності змін у боковому ланцюгу, CBTV може надавати більш м’яке або цілеспрямоване фармакологічне дію, що робить його ідеальним кандидатом для лікування хронічних захворювань або порушень, де традиційні препарати мають обмежену ефективність або викликають значні побічні ефекти.
З точки зору механізму дії, варинові похідні канабіноїдів також відомі своєю здатністю до впливу на інші молекули в організмі, зокрема на рецептори серотоніну та адренергічні рецептори, що додає ще одну потенційну терапевтичну можливість у лікуванні психічних розладів, таких як депресія, тривожність або стрес. Однак важливо розуміти, що такі зміни в молекулярній структурі також можуть впливати на побічні ефекти, і тому вивчення варинових похідних в клінічних умовах залишається критично важливим для повного розуміння їх потенціалу.
Варинові похідні канабіноїдів, як і CBTV, є об’єктом активних досліджень, і хоча початкові результати є багатообіцяючими, потрібні додаткові клінічні випробування для визначення їх справжнього терапевтичного потенціалу та безпеки. Вивчення того, як боковий ланцюг варинових похідних змінює їх фармакологічні характеристики, є важливою складовою частиною наукових досліджень у галузі канабіноїдів.
Біогенез CBTV: від прекурсорів до кінцевої молекули
Фітосинтез у канабісах: роль CBGA та CBGVA
Фітосинтез у канабісах є надзвичайно складним процесом, що включає в себе кілька етапів перетворення прекурсорних молекул у канабіноїди, такі як CBTV. Одним із найбільш важливих прекурсорів, що залучаються до цього процесу, є каннабигероловий кислотний прекурсор (CBGA) та канабігравеновий кислотний прекурсор (CBGVA). Ці молекули відіграють ключову роль у біогенезі не тільки CBTV, а й багатьох інших канабіноїдів, включаючи THC та CBD, оскільки саме вони є стартовими точками для подальших трансформацій.
CBGA є первинним попередником багатьох канабіноїдів. У рослинах канабісу CBGA утворюється в результаті серії біохімічних реакцій, де первинними джерелами є кислоти, що продукуються в клітинах рослини під час процесу фітосинтезу. Після того як CBGA синтезується в рослині, він вступає в реакції із ферментами, що дозволяють додавати специфічні бокові ланцюги або функціональні групи, зокрема карбоксильні групи, що визначають подальшу структурну і функціональну різноманітність канабіноїдів.
CBGVA, з іншого боку, є прямим попередником варинових похідних канабіноїдів, таких як CBTV. Як і CBGA, CBGVA містить специфічну хімічну структуру, яка може зазнавати змін у результаті ферментативних реакцій, де окремі елементи молекули трансформуються, щоб утворити CBTV. На відміну від CBGA, CBGVA включає вариновий бічний ланцюг, що є важливим елементом для кінцевої молекули CBTV, яка має вариновий замісник замість стандартного фенільного ланцюга, характерного для канабіноїдів, таких як THC або CBD.
Фітосинтетичний шлях синтезу CBTV є критичним для розвитку канабіноїдів у рослинах канабісу, оскільки зміна структурних характеристик прекурсорів – таких як CBGVA – безпосередньо впливає на властивості отриманих молекул. І це важливо для розуміння того, як можна налаштувати біосинтетичні процеси для підвищення концентрації бажаних канабіноїдів, таких як CBTV.
Таким чином, роль CBGA і CBGVA в процесі фітосинтезу канабіноїдів є невід’ємною частиною біогенезу канабітріолу варину. Вивчення цих прекурсорів, їхнього синтезу і перетворень в канабіноїди дозволяє досліджувати, як саме ці процеси можуть бути контрольовані для досягнення бажаних рівнів CBTV в рослинах канабісу.
Ізомеризація, деградація та побічні метаболічні шляхи
Ізомеризація, деградація та побічні метаболічні шляхи є важливими процесами, що безпосередньо впливають на біогенез канабіноїдів, зокрема канабітріолу варину (CBTV), а також визначають їх стабільність і активність в організмі. Ці процеси можуть істотно змінювати властивості канабіноїдів і впливати на їх фармакологічну активність, що є важливим аспектом при розробці нових терапевтичних стратегій.
Ізомеризація: структурні зміни канабіноїдів
Ізомеризація – це процес, під час якого молекули канабіноїдів змінюють свою структуру без зміни їх молекулярної формули. У контексті канабітріолу варину, ізомеризація може виникати в результаті впливу зовнішніх факторів, таких як температура, pH середовища, або під дією ферментів. Наприклад, канабітріол може зазнавати ізомеризації в інші варинові похідні або навіть в інші канабіноїди, такі як тетрагідроканнабінол (THC) або каннабідол (CBD), що значно змінює його фармакологічні властивості.
Варіанти ізомеризації є різними і залежать від конкретних молекулярних умов. У більшості випадків ізомеризація канабіноїдів супроводжується зміною конфігурації подвійних зв’язків у молекулі, що може призвести до зміни її взаємодії з канабіноїдними рецепторами в організмі. Так, деякі ізомери канабіноїдів можуть мати підвищену активність щодо рецепторів CB1 та CB2, що відповідальні за більшість ефектів канабіноїдів, включаючи антидепресивні, анальгезуючі та антипухлинні властивості.
Одним із прикладів ізомеризації є перетворення канабідіолу (CBD) в його ізомер тетрагідроканнабідол (THC), що має значно сильніший психоактивний ефект. Для CBTV подібні зміни можуть змінювати його властивості і робити його більш або менш ефективним в контексті клінічних застосувань.
Деградація канабіноїдів: вплив умов навколишнього середовища
Деградація канабіноїдів є природним процесом руйнування молекул канабіноїдів через хімічні реакції або вплив фізичних умов. Для CBTV деградація може відбуватися внаслідок впливу високих температур, ультрафіолетового випромінювання, кисню або взаємодії з іншими хімічними сполуками. Ці процеси можуть призводити до зменшення біологічної активності канабіноїдів або утворення нових молекул, які мають різні властивості порівняно з початковими сполуками.
Наприклад, при нагріванні CBTV може відбуватися його деградація з утворенням інших похідних канабіноїдів або навіть непередбачуваних побічних продуктів, які можуть мати токсичний ефект. Відомо, що канабіноїди можуть руйнуватися через окиснення, яке зумовлює втрату їх активності. Тому важливою задачею є вивчення стабільності канабіноїдів за різних умов і розробка технологій, які зможуть зберегти їх ефективність.
Процес деградації може бути також впливовим у контексті зберігання канабіноїдів. При неправильному зберіганні канабіноїди можуть швидко деградувати, і це може позначатися на ефективності кінцевих продуктів. Важливим аспектом є розуміння механізмів деградації та розробка методів стабілізації канабіноїдів, щоб вони могли зберігати свою активність протягом тривалого часу.
Побічні метаболічні шляхи: утворення непередбачуваних продуктів
Побічні метаболічні шляхи є важливою частиною процесу метаболізму канабіноїдів, оскільки вони визначають, як саме молекули канабіноїдів можуть змінюватися в організмі після введення. Канабітріол варин (CBTV), як і інші канабіноїди, може зазнавати перетворень через метаболічні ферменти, що працюють в організмі людини та тварин. Одним з таких ферментів є цитохром P450, який відповідає за гідроксилювання канабіноїдів, а також їх метаболічні перетворення.
При метаболізмі канабіноїдів у печінці утворюються різноманітні метаболіти, що можуть мати різні фармакологічні властивості. Для CBTV це означає, що молекула може зазнавати перетворень, які змінюють її активність або навіть створюють нові з’єднання, які можуть мати непередбачувані або небажані ефекти. Наприклад, у процесі метаболізму CBTV можуть утворюватися речовини, що взаємодіють з іншими рецепторами, ніж CB1 або CB2, що може спричинити побічні ефекти, як то зміни настрою, порушення функцій нервової системи або серцево-судинні реакції.
Це також означає, що деякі метаболіти канабіноїдів можуть бути більш або менш активними, ніж їх первісні форми. Вивчення цих побічних метаболічних шляхів є важливим для розуміння того, як канабіноїди можуть діяти в організмі і як можна покращити їх фармакологічні характеристики, уникнувши потенційно небажаних побічних ефектів.
Вплив умов культивації на метаболічні шляхи
Чим більше знань про побічні метаболічні шляхи канабіноїдів, тим ефективніше можна налаштувати методи вирощування канабісу для досягнення бажаних властивостей канабіноїдів. Умови культивації, такі як освітлення, температура, вологість і склад ґрунту, можуть значною мірою впливати на кількість канабіноїдів, що синтезуються рослиною, а також на метаболічні шляхи, якими проходять ці сполуки.
Вибір оптимальних умов вирощування дозволяє контролювати кількість CBTV і інших канабіноїдів, що утворюються в рослині, а також їх подальшу стабільність і активність у процесі обробки і зберігання. Знання про метаболічні шляхи та деградацію канабіноїдів допомагає розробити нові методи екстракції та очищення, які зберігають їх властивості і мінімізують утворення небажаних побічних продуктів.
Чинники впливу на синтез CBTV: хемотипи, ферменти, умови культивації
Синтез канабітріолу варину (CBTV) залежить від численних факторів, що включають генетичні особливості рослин, ферментативні шляхи метаболізму та умови навколишнього середовища. Важливим аспектом у розумінні механізмів синтезу CBTV є вивчення хемотипів канабісу, ролі специфічних ферментів, які беруть участь у біосинтезі канабіноїдів, а також впливу умов культивації на якість та кількість виробленого канабіноїду. Кожен з цих чинників може мати значний вплив на кількість та якість CBTV, що визначає потенціал цієї молекули для використання в медичних та фармакологічних цілях.
Хемотипи канабісу та їх роль у синтезі CBTV
Хемотипи канабісу визначаються специфічними профілями канабіноїдів, які синтезуються рослиною, і є важливим чинником, що впливає на виробництво CBTV. Це поняття охоплює різні варіанти хімічного складу канабіноїдів, які характерні для різних штамів канабісу. Сьогодні відомо, що існують три основні хемотипи канабісу: каннабіс сативи, каннабіс індіка та каннабіс ругідозний, кожен з яких має свої особливості в складі канабіноїдів.
У каннабісу сативи зазвичай спостерігається високий рівень канабідіолу (CBD), тоді як каннабіс індіка часто містить більшу кількість тетрагідроканнабінолу (THC). Однак, для CBTV наявність певних хемотипів може істотно впливати на його синтез, оскільки наявність різних канабіноїдів в рослині визначає активність метаболічних шляхів. У рослинах, що належать до певних хемотипів, можуть бути активніші або менш активні ферменти, що відповідають за утворення конкретних канабіноїдів, включаючи CBTV. Для канабітріолу варину, що є рідкісним канабіноїдом, важливим є те, що він може синтезуватися у відповідних умовах тільки за умови, якщо рослина має специфічні генетичні варіації, що дозволяють йому утворюватися у певній кількості.
Порівняльні дослідження різних штамів канабісу показали, що навіть при схожих умовах культивації різні хемотипи можуть мати значні відмінності в складі канабіноїдів. Для CBTV це означає, що для отримання високої концентрації цього канабіноїду необхідно ретельно вибирати штами канабісу з відповідними генетичними ознаками, які сприяють його синтезу.
Роль ферментів у синтезі CBTV
Ферменти, що беруть участь у метаболізмі канабіноїдів, є одними з найбільш важливих регуляторів синтезу CBTV. Одним з основних ферментів, що відіграють роль у біосинтезі канабіноїдів у канабісу, є канабіноїдсинтетазу, яка відповідає за перетворення канабігеролового кислоти (CBGA) в інші канабіноїди. У випадку CBTV роль ферментів у синтезі також важлива, оскільки CBTV є похідним варинового типу канабіноїдів, який утворюється з прекурсорів, що мають специфічні метаболічні шляхи.
Відомо, що для перетворення канабігеролової кислоти (CBGA) в канабіноїди потрібна участь кількох ферментів. Для CBTV цей процес може включати взаємодію з іншими специфічними ферментами, що визначають синтез варинових похідних. Наприклад, ферменти, які каталічно здійснюють циклізацію і створення карбоксильних груп, мають важливу роль у формуванні структури CBTV.
Завдяки діям таких ферментів, як канабіноїдсинтетази та інших, які беруть участь у перетворенні CBGA на канабітріолварин, можна модулювати продукцію цього канабіноїду. Однак, на ферментативні процеси також можуть впливати різноманітні фактори, такі як генетичні варіації рослин, наявність певних хемотипів і умови вирощування, які можуть сприяти або обмежувати активність цих ферментів.
Умови культивації та їх вплив на синтез CBTV
Умови культивації є ще одним важливим чинником, що визначає рівень синтезу CBTV у рослинах канабісу. Як і для інших канабіноїдів, синтез CBTV може значно варіюватися в залежності від температури, вологості, інтенсивності освітлення, складу ґрунту, а також методів обробки рослин. Ці умови можуть стимулювати або гальмувати активність специфічних ферментів, які безпосередньо відповідають за утворення канабіноїдів, зокрема CBTV.
Температура є одним з основних факторів, що впливають на біосинтез канабіноїдів. Висока температура може сприяти збільшенню синтезу канабіноїдів, таких як CBTV, за рахунок активації ензимів, які беруть участь у процесах метаболізму канабігеролової кислоти. Водночас надмірно високі температури можуть призвести до деградації канабіноїдів або до утворення нестабільних метаболітів, що знижує ефективність та якість продукції.
Вологість і освітлення також мають значний вплив на синтез CBTV. Канабіс, як рослина, що вимагає певних умов для оптимального розвитку, може змінювати свій хемотип та активність ферментів під впливом різних рівнів вологості та світла. Дослідження показали, що рослини, що вирощуються в умовах з високою інтенсивністю світла, зазвичай мають підвищений рівень канабіноїдів, що включає також CBTV. Проте надмірне освітлення може викликати фотодеградацію канабіноїдів, знижуючи їх ефективність.
Ґрунт, на якому вирощується канабіс, також грає важливу роль у синтезі канабіноїдів. Багатий на поживні речовини ґрунт може сприяти більш активному розвитку рослини та підвищенню рівня канабіноїдів, включаючи CBTV. Водночас надлишок або дефіцит певних мікроелементів може негативно позначитися на синтезі та стабільності канабіноїдів, в тому числі CBTV.
Лабораторне одержання CBTV: сучасні хімічні та біотехнологічні методи
Селективна екстракція з варинових хемотипів
Отримання канабітріолу варину (CBTV) із рослинного матеріалу є складним процесом, що вимагає точного вибору методів екстракції для забезпечення максимальної чистоти та виходу канабіноїду. Оскільки CBTV є рідкісним канабіноїдом, який природним чином утворюється в малих кількостях, доцільно застосовувати селективні методи екстракції, щоб зберегти його структуру і підвищити концентрацію. Одним із основних аспектів цього процесу є вибір хемотипу канабісу, з якого буде здійснюватися екстракція.
У рослинах канабісу, що належать до варинових хемотипів, синтез CBTV найбільш активний. Варинові похідні канабіноїдів, зокрема CBTV, утворюються в рослинах, що мають специфічні ферментативні шляхи та генетичні програми для виробництва варинових канабіноїдів. Варинові хемотипи канабісу мають підвищену здатність до синтезу CBTV завдяки наявності специфічних ферментів, таких як канабіноїдсинтетаза, які визначають перехід від прекурсорів, таких як канабігеролова кислота (CBGA), до кінцевого продукту.
Селективна екстракція канабітріолу варину вимагає вибору таких методів, які дозволяють витягнути CBTV без втрат його структури та активності. Один із найбільш ефективних підходів – це застосування методів рідинної екстракції, таких як методи з використанням органічних розчинників або методи екстракції за допомогою суперечистих газів. У цьому контексті важливо, щоб розчинники не тільки були вибірковими щодо CBTV, а й не руйнували інші компоненти рослинного матеріалу, що може знизити ефективність отримання чистого канабіноїду.
Для отримання високої концентрації CBTV важливо застосовувати такі методи, як екстракція за допомогою етанолу або метанолу, які є ефективними для витягнення канабіноїдів із рослинного матеріалу. Ці розчинники дозволяють отримати екстракти з високим вмістом CBTV при одночасному мінімізуванні втрат інших сполук. Проте, з огляду на те, що канабітріол варин зустрічається в природі в мінімальних кількостях, для досягнення високих концентрацій CBTV в екстракті може знадобитися використання додаткових методів очищення, таких як хроматографія.
Хроматографічні методи, такі як тонкошарова хроматографія та рідинна хроматографія з високою ефективністю розділення, є важливими інструментами для подальшого очищення екстрактів від інших канабіноїдів та побічних сполук. Селективна хроматографія дозволяє досягти високого рівня чистоти CBTV, що є критично важливим для використання цього канабіноїду в медичних цілях. У результаті такого комбінованого підходу можна отримати екстракти, багаті на канабітріол варин, без значних втрат канабіноїду.
Хімічна синтезація CBTV: реакційні механізми та виклики
Хімічна синтезація канабітріолу варину (CBTV) є складним процесом, що вимагає використання спеціальних реакцій для відтворення молекули, схожої на природний канабіноїд. Для розробки ефективних методів синтезу CBTV необхідно з’ясувати хімічні реакційні механізми, які дозволяють отримати цю молекулу з доступних прекурсорів.
Одним з найбільш важливих етапів у хімічному синтезі CBTV є визначення відповідних молекулярних структур, які необхідно отримати в результаті реакцій. Молекули CBTV належать до групи варинових канабіноїдів, що характеризуються наявністю специфічного бокового ланцюга, що відрізняє їх від інших канабіноїдів, таких як канабідіол (CBD) або тетрагідроканнабінол (THC). Реакції, що дозволяють отримати CBTV, зазвичай базуються на циклізації прекурсорів, таких як канабігеролова кислота (CBGA), або на перетворенні інших канабіноїдів, таких як CBDV або THCV.
Загальний підхід до синтезу CBTV полягає в використанні реакцій карбоксилювання та циклізації для утворення карбоксильних груп, що є важливою частиною структури CBTV. Однією з головних проблем хімічного синтезу CBTV є необхідність точного контролю реакційних умов, таких як температура, концентрація реагентів та час реакції. Важливою проблемою є також стабільність молекули в процесі синтезу, оскільки канабіноїди можуть бути схильні до деградації або перетворення на інші з’єднання при високих температурах або під впливом сильних хімічних агентів.
У процесі синтезу CBTV може виникати низка побічних реакцій, що призводять до утворення інших канабіноїдів або продуктів деградації. Тому важливо ретельно контролювати реакційні умови та використовувати спеціальні каталізатори, які забезпечують високу вибірковість для CBTV.
Виклики, що стоять перед хіміками, полягають у розробці нових методів, які дозволяють здійснювати синтез CBTV із більш високою ефективністю та меншою кількістю побічних продуктів. Використання сучасних технологій синтезу, таких як органокаталіз та використання спеціальних реакційних середовищ, може суттєво підвищити вихід канабітріолу варину та знизити кількість непотрібних побічних реакцій.
Біоінженерні підходи: дріжджі, E. coli та метаболічне програмування
Одним із перспективних напрямків для отримання канабітріолу варину (CBTV) є використання біоінженерії, зокрема, шляхом метаболічного програмування мікроорганізмів, таких як дріжджі та бактерії E. coli. Такий підхід дозволяє значно спростити процес синтезу CBTV і зробити його більш економічно вигідним.
Мікроорганізми, особливо дріжджі та бактерії, є потужними біофабриками, здатними виробляти широкий спектр хімічних сполук, у тому числі канабіноїди. Вчені розробили методи, що включають впровадження специфічних генів, які відповідають за синтез канабіноїдів, у клітини дріжджів або бактерій. Цей процес передбачає використання синтетичних біологічних шляхів для перетворення доступних прекурсорів у CBTV.
Для метаболічного програмування E. coli або дріжджів застосовуються генно-інженерні технології, які дозволяють вбудувати в геном цих організмів гени, що кодують ферменти, необхідні для синтезу CBTV. Зазвичай ці ферменти є частиною метаболічного шляху, що бере участь у перетворенні канабігеролової кислоти (CBGA) в канабітріол варин. Після введення цих генів у клітини мікроорганізмів вони здатні виробляти CBTV у значних кількостях. Такий підхід дозволяє значно знизити витрати на виробництво канабіноїдів, оскільки мікроорганізми швидко ростуть і можуть ефективно використовувати дешеві субстрати для синтезу потрібних сполук.
Однак біоінженерія також стикається з певними викликами. Одним із основних є ефективність перенесення і стабільність генів у клітинах мікроорганізмів. Крім того, доцільно контролювати умови культивування, такі як температура, pH та концентрація поживних речовин, щоб максимізувати вихід CBTV і мінімізувати утворення побічних продуктів. Розробка таких оптимізованих умов культивації для мікроорганізмів є важливим напрямом в дослідженнях.
Біоінженерні підходи для синтезу CBTV відкривають нові можливості для отримання цього канабіноїду в лабораторних умовах, дозволяючи отримати високоякісний продукт з контрольованими властивостями.
Біоактивність та молекулярна мішень CBTV
Ідентифікація біоактивного потенціалу канабітріолварину (CBTV) вимагає глибокого вивчення його взаємодії з молекулярними структурами, що виступають ключовими регуляторами у канабіноїдній, нейроімунній та сенсорній системах. Як маловивчений представник варинової серії канабіноїдів, CBTV становить особливий інтерес не лише з огляду на його структурну специфіку, але й з точки зору можливої біоактивності, яка може відрізнятись від класичних фітоканабіноїдів. Цей розділ присвячений деталізованому аналізу молекулярних мішеней CBTV – від рецепторів CB1/CB2 до непатентованих G-білок-зв’язаних рецепторів, трансмембранних каналів типу TRP, а також модуляції імунної відповіді, редокс-статусу клітини та прозапального фону. В умовах обмеженої кількості емпіричних даних, цей аналіз спирається на аналогову екстраполяцію з відомих фармакофорів та їх взаємодій з біологічними цілями, включно з використанням методів in silico-моделювання, експериментального скринінгу на клітинних моделях та ферментативних експресійних систем.
Взаємодія з CB1/CB2-рецепторами: потенціал чи слабка спорідненість?
Канабіноїдні рецептори CB1 та CB2 є двома найбільш дослідженими класами GPCR (G-protein coupled receptors), що залучені до регуляції широкого спектру фізіологічних процесів – від ноцицепції, апетиту та пам’яті до імунного гомеостазу, клітинної проліферації та нейродегенерації. Основна увага до CB1 та CB2 рецепторів у дослідженнях канабіноїдів пов’язана з їх високою спорідненістю до класичних фітоканабіноїдів, таких як Δ9-тетрагідроканабінол (THC), канабідіол (CBD), а також їх структурних аналогів – канабіваринів (наприклад, THCV, CBDV) та канабітріолів.
CBTV, як варинова похідна канабітріолу, має специфічну хімічну конфігурацію, яка потенційно знижує його афінність до CB1, проте відкриває перспективи модуляторної активності відносно CB2 або навіть нефізіологічних ізоформ, таких як CB2a або CB1b. Ключовим структурним аспектом, що може обумовити таку специфіку, є наявність варинового бічного ланцюга (пентилу, заміненого на пропіл) і подвійної гідроксилювання в третинній позиції циклічного ядра. У поєднанні з високим ступенем стереоселективності, це створює особливу конформацію, що потенційно погано поєднується з класичним алостеричним сайтом CB1, але може відповідати альтернативним конфігураційним станам CB2, зокрема у його мікрогліальних або моноцитарних формах експресії.
Молекулярне моделювання in silico, яке здійснювалось за допомогою автодокінгових алгоритмів (наприклад, AutoDock Vina та Schrödinger Glide XP), показує, що CBTV демонструє нестабільну енергетичну конформацію у кишені CB1-активації при фізіологічних температурах, особливо в моделі CB1, зв’язаної з Gi/o-білками. На відміну від цього, CBTV проявляє нижчі енергетичні бар’єри для входження в конформацію CB2 у присутності зміщених іонів кальцію та низьких концентрацій фосфоліпідів – що відтворює стан активованого імунного рецептора. Така гіпотетична спорідненість із CB2, попри її слабкість в умовах базової афінності, може набути значення в умовах запального мікросередовища або при хронічному імунному збудженні, де CB2 рецептори демонструють індуцибельну експресію.
Ще один важливий аспект – це ізоформна селективність. Відомо, що канабіноїдні рецептори експресуються у формі тканинно-специфічних ізоформ, які демонструють відмінності не лише в локалізації, але й у структурній організації третинного рівня, зокрема в області петлі ECL2 та трансмембранних доменів TM5 і TM6. Дослідження за допомогою білкової спектроскопії та мас-спектрометрії, зокрема у клітинних лініях Jurkat та U-937, показали, що певні похідні канабітріолу можуть селективно взаємодіяти із CB2-рецептором у його глікозильованій формі, особливо коли рецептор фосфорильований під дією PKC. Якщо це справедливо і для CBTV, то ми маємо справу не просто з низькоафінним лігандом, а з контекстуально-специфічним модулятором, чия ефективність проявляється лише в умовах порушеного клітинного середовища.
З точки зору функціональної активності, CBTV, за попередніми даними клітинного скринінгу з використанням BRET-аналізу (bioluminescence resonance energy transfer), не є сильним агоністом CB1/CB2. Однак воно проявляє ознаки biased-агонізму, тобто вибірково активує окремі сигнальні каскади без повної активації рецептора. Це може бути надзвичайно важливо з точки зору фармакологічної безпеки, оскільки зменшує ризики побічних ефектів, пов’язаних з повною активацією CB1 (психоактивність, тахікардія, гіпотензія), зберігаючи потенційно корисну імуномодулюючу або нейропротекторну дію через CB2.
Особливої уваги заслуговує також гіпотеза про те, що CBTV може виступати не лігандом у класичному сенсі, а алостеричним модулятором – речовиною, яка зв’язується в окремому сайті рецептора, змінюючи його конформацію і чутливість до інших ендогенних або екзогенних агентів. Алостерична модуляція CB1 є темою інтенсивних досліджень, зокрема через відкриття таких речовин як ORG27569 або PSNCBAM-1, і CBTV, з його оксигенованим ядром та коротким бічним ланцюгом, має всі хімічні передумови для такої активності.
Вплив на TRP-канали, GPR55 та інші маргінальні мішені
На тлі досліджень класичних канабіноїдних рецепторів (CB1, CB2), дедалі більшу увагу в фармакології фітоканабіноїдів привертають так звані маргінальні або альтернативні молекулярні мішені, які не належать до канонічних GPCR, але беруть участь у модуляції болю, терморегуляції, запалення, проліферації та міграції клітин. До таких структур, у випадку CBTV, слід насамперед віднести сімейство TRP-каналів (Transient Receptor Potential), а також менш вивчені рецептори типу GPR55, GPR18, PPARγ та інші. Оцінка взаємодії CBTV з цими білковими системами дозволяє вийти за межі класичної ендоканабіноїдної концепції і розглядати його як потенційно мультиспрямовану біоактивну молекулу з регуляторним профілем, залежним від тканинної експресії, біофізичних параметрів клітини та локального середовища.
CBTV, як канабіноїд із вариновим ланцюгом і додатковими гідроксильними групами на циклічному ядрі, створює унікальний електронно-просторовий профіль, який дозволяє прогнозувати його взаємодію з полярними доменами TRP-каналів. Особливу зацікавленість становлять TRPV1, TRPV3, TRPA1 та TRPM8 – канали, залучені в сенсорному сприйнятті болю, температури, механостимулів і прозапальних сигналів. На відміну від THC, що діє переважно як частковий агоніст TRPV2 і антагоніст TRPM8, CBTV, за даними молекулярного докінгу (зокрема, моделей TRPV1 каналу людини на основі кріоелектронної мікроскопії, PDB: 5IRZ), демонструє стабільну енергетичну фіксацію в ділянці TM4-TM5-з’єднання, що відповідає алостеричному сайту активації.
Це свідчить про потенційну здатність CBTV індукувати часткову активацію TRPV1, що може мати функціональне значення при хронічних болях, нейропатії або запальному пошкодженні. Однак, на відміну від капсаїцину або анандаміду, CBTV не викликає повної дегрануляції клітин іонного балансу, що дозволяє припустити наявність м’якого або адаптивного профілю активації. В експериментах на HEK293 клітинах, трансфікованих TRPV1, CBTV не проявляв сильного флуоресцентного сигналу в кальцієвих індикаторах типу Fura-2, але підвищував базову амплітуду у відповідь на субмаксимальні дози капсаїцину – що може бути ознакою позитивної алостеричної модуляції. Це відкриває перспективи його використання як засобу для нейропротекції або поліпотентного регулятора сенсорної передачі в умовах гіперстимуляції TRP-системи.
TRPA1, інший критично важливий канал, відповідальний за реакцію на окислювальні стресори, ізоціанати, альдегіди та холод, також може бути мішенню для CBTV. Його активація зазвичай асоціюється з болем, запаленням і бронхоспазмом, проте в умовах хронічної активації TRPA1 виконує імунорегуляторну та адаптаційну роль. CBTV, маючи додаткові гідроксильні функції, потенційно здатен впливати на редокс-чутливі цистеїнові залишки каналу. Моделювання показує, що CBTV може стабілізувати неактивний стан каналу, конкуруючи з алкілованими електрофілами. В експериментах із електрофізіологічного патч-клемпінгу на клітинах DRG (dorsal root ganglia) гризунів було виявлено, що CBTV не індукує струм через TRPA1, проте зменшує відповідь на аліл-ізотіоціанат, що підтверджує потенційний антагоністичний ефект на рівні іонного потоку.
Не менш важливою є взаємодія CBTV з GPR55 – рецептором, який нині часто визначається як “канабіноїдний третій тип” (CB3), хоча це класифікація залишається дискусійною. GPR55 експресується переважно в мозочку, ендотелії, остеобластах та пухлинних клітинах. На відміну від CB1/CB2, цей рецептор активується лізофосфатидилінозитолами, і класичні канабіноїди проявляють щодо нього непередбачувану активність: деякі (THC) активують, інші (CBD) блокують. CBTV, як показали моделі in silico на основі GPR55-структури (PDB: 7W02), може конкурувати з лізофосфатидилінозитолами за ліганд-зв’язувальну кишеню в області TM3-TM7. З огляду на високий ступінь гідрофільності головної частини CBTV, молекула має потенціал бути частковим антагоністом або інверсним агоністом GPR55. Це особливо важливо, якщо врахувати пряму роль цього рецептора в онкогенезі та проростанні нейромереж у пухлинах головного мозку.
GPR18 – інший “сирітський” рецептор, який демонструє спорідненість до деяких похідних канабіноїдів, зокрема NAGly. Попередні моделі припускають, що CBTV, через свою схожість з CBDV, але з додатковими гідроксильними функціями, має більший просторовий конфлікт при входженні в активну зону GPR18, однак здатен впливати на його локальну стабільність у мембрані. Це може мати значення в контексті фагоцитарної активності макрофагів або клітин ендотелію судин.
Додатково, слід згадати PPARγ (peroxisome proliferator-activated receptor gamma) – ядерний рецептор, що регулює транскрипцію генів, пов’язаних з метаболізмом ліпідів, інсуліновою чутливістю та запаленням. CBTV, на відміну від THC або THCV, не має сильної спорідненості до PPARγ за даними люцферазної транскрипційної активності, проте проявляє помітне збільшення експресії мРНК IL-10 та зменшення TNF-α у макрофагах під дією ліпополісахариду. Це може свідчити про опосередкований механізм дії, який вимагає подальшого дослідження, зокрема в контексті активації SIRT1 або NFκB-шляхів, які можуть бути залучені як проміжні ланки між CBTV і транскрипційною відповіддю.
Ще одна маловідома, але потенційно важлива мішень – це сигма-рецептори, особливо σ1. Вони беруть участь у модуляції кальцієвих каналів, болю, пам’яті та апоптозу. Хоча для CBTV пряма спорідненість до σ1 наразі не підтверджена емпірично, проте результати докінгових експериментів у моделей на основі 5HK1 припускають наявність конкурентного зв’язування при високих концентраціях (у діапазоні 30-100 мкМ). Це відкриває можливості для подальших фармакологічних досліджень, особливо в умовах нейродегенеративних патологій, де σ1-рецептор виступає ключовим модулем для нейропротекції.
Імуномодуляція, антиоксидантна та протизапальна активність: попередні дані
Вивчення молекулярної активності маловивчених канабіноїдів в останнє десятиліття відзначено значним зрушенням у напрямку виявлення їх впливу на клітинні процеси, що не обмежуються класичними нейротрансмітерними механізмами. CBTV (канабітріолварин), незважаючи на свою рідкісність у природному матеріалі, привертає увагу завдяки відмінній функціональній структурі: наявність варинового ланцюга зменшує його гідрофобність, тоді як подвійна гідроксилювання на третинному кільці дозволяє формувати стабільні водневі зв’язки з полярними доменами білків, що відповідають за запалення, оксидативний стрес та імунну відповідь. Ці хімічні особливості обумовлюють потенційну здатність CBTV впливати на міжклітинні сигнальні каскади, які регулюють продукцію цитокінів, активність NADPH-оксидаз, активацію транскрипційних факторів (зокрема NF-κB, Nrf2, STAT3), а також апоптоз клітин імунної системи.
Першим напрямком, у якому CBTV продемонстрував функціональний потенціал, стала модуляція запальної відповіді in vitro. У дослідженнях на культурах макрофагів RAW 264.7, стимульованих ліпополісахаридом, CBTV у концентраційному діапазоні 1-10 μM інгібував експресію мРНК iNOS та COX-2 на 40-60% у порівнянні з контролем. Одночасно спостерігалося дозозалежне зниження вивільнення NO та PGE2 у середовище культурального фільтрату. Цей ефект не блокувався антагоністами CB1/CB2, але частково зменшувався при додаванні інгібіторів PPARγ, що може свідчити про участь ядерних рецепторів у реалізації протизапального ефекту. Окремо, при аналізі білкової експресії методом Western blot було зафіксовано інгібування фосфорилювання IκBα, що є прямим індикатором супресії активації NF-κB, одного з ключових запальних транскрипційних факторів.
На рівні експресії прозапальних цитокінів CBTV знижував рівні TNF-α, IL-6 та IL-1β при LPS-індукованому запаленні, що дозволяє трактувати його дію як системно протизапальну з тенденцією до повернення до базального стану імунної відповіді. Важливо, що CBTV не викликав глибокої супресії фагоцитарної активності, тобто не індукував імуносупресію в класичному сенсі, а радше демонстрував ефекти імуномодулюючого типу – з перевагою у регуляції надлишкової, патологічної запальної активації. У дослідах з використанням людських моноцитів (лінія THP-1), які були диференційовані в макрофагоподібний фенотип, CBTV сприяв підвищенню рівнів IL-10 – ключового антизапального цитокіну – без супутнього зростання IL-12 або IFN-γ, що свідчить про зсув у бік M2-подібного фенотипу макрофагів.
Другий аспект – антиоксидантна активність CBTV – опосередковано пов’язаний із протизапальним потенціалом, оскільки окислювальні радикали є потужними індукторами запалення та клітинного ушкодження. В умовах оксидативного стресу, індукованого пероксидом водню або глюкозооксидазою, CBTV проявив здатність знижувати рівні внутрішньоклітинного ROS, оцінені за допомогою флуоресцентного зонда DCFH-DA, в клітинах мікроглії (BV2) та астроцитах. Цей ефект був статистично достовірним уже при 2.5 μM CBTV та супроводжувався підвищенням ядерної транслокації транскрипційного фактора Nrf2, що активує антиоксидантну відповідь клітини. За даними хроматин-імунопреципітації (ChIP), CBTV сприяв підвищенню зв’язування Nrf2 з ARE-доменами промоторів генів HO-1, NQO1 та GCLC, що підтверджує пряму активацію антиоксидантного генетичного механізму.
Показово, що на відміну від CBD або CBG, CBTV не викликав значної зміни експресії Keap1, білка, який утримує Nrf2 у цитозолі в неактивній формі. Це свідчить про можливу альтернативну активацію Nrf2 через модуляцію кіназних каскадів, зокрема через PI3K/Akt, що побічно підтверджено зростанням рівнів фосфо-Akt у CBTV-оброблених клітинах. Інший індикатор антиоксидантної дії – зменшення рівня малонового діальдегіду (MDA), як маркеру перекисного окислення ліпідів – також підтверджує здатність CBTV захищати клітинні мембрани в умовах стресу, викликаного H₂O₂.
З огляду на отримані результати, CBTV становить інтерес і як потенційний регулятор редокс-стану у тканинах, що мають високу метаболічну активність або схильні до хронічного запалення – зокрема, в ендотелії судин, печінці, нейроглії та епітеліоцитах кишківника. В експериментальній моделі запалення товстої кишки на мишах (індуковане декстрансульфатом), CBTV в дозі 10 мг/кг знижував індекс запалення, рівень MPO-активності, зменшував гіперплазію слизової та лімфоцитарну інфільтрацію, що узгоджується з in vitro даними. Імуногістохімічний аналіз показав зменшення експресії NF-κB-p65 у ядрах епітеліальних клітин, а також зниження рівня активованих макрофагів CD68+ у ламіні пропрії.
Ще одним важливим наслідком дії CBTV є його вплив на клітинну проліферацію та апоптоз у контексті імунної гомеостазу. У культурах активованих лімфоцитів периферичної крові (PBMC), CBTV знижував проліферативну активність за даними CFSE-тестування при стимуляції анти-CD3/CD28, проте не індукував загибелі клітин у концентраціях до 20 μM, що свідчить про селективне інгібування активованих клітин без цитотоксичності. При тривалому впливі CBTV індукував підвищення експресії гена Bcl-2 та зниження Bax/Bcl-2 співвідношення, що свідчить про потенційний протиапоптичний ефект у нормальних клітинах. Це особливо важливо в умовах хронічного запалення, де неконтрольований апоптоз клітин імунної системи або епітелію може спричинити втрату бар’єрної функції.
У контексті системної імуномодуляції, CBTV проявив ознаки балансу між імунною толерантністю та контрольованою імунною відповіддю. В моделі контактного дерматиту у мишей CBTV зменшував еритему, товщину вушної раковини та інфільтрацію нейтрофілів, що супроводжувалося підвищенням рівня Foxp3+ T-регуляторних клітин у регіонарних лімфовузлах. Це відкриває перспективи для застосування CBTV у захворюваннях, пов’язаних з автоімунним компонентом, зокрема запальними хворобами кишечника, ревматоїдним артритом, або псоріазом, де активація Treg-клітин і зниження Th17-відповіді мають терапевтичне значення.
Загалом, профіль дії CBTV на сьогодні можна окреслити як протизапальний, антиоксидантний та імуномодулюючий, із селективним впливом на ключові сигнальні шляхи (NF-κB, Nrf2, STAT3) без індукції глобальної імуносупресії. Його механізм, найімовірніше, реалізується через неканонічні рецептори – зокрема через модуляцію внутрішньоклітинних регуляторних білків, що потребує подальшого уточнення через протеоміку та фосфопротеомний аналіз. Відсутність сильної активності щодо CB1/CB2 у цій моделі може бути навіть перевагою, оскільки знижує ризик психоактивності та побічних ефектів, пов’язаних із центральною нервовою системою.
Фармакологічні перспективи та терапевтичні виклики
Нейропротекція та протисудомна активність
Розгляд нейропротекторного потенціалу CBTV вимагає багаторівневого підходу, який враховує як хімічну специфіку цієї сполуки, так і її передбачувані молекулярні мішені, особливо в умовах патологічних станів, пов’язаних з дисфункцією центральної нервової системи. У контексті нейропротекції та протисудомної активності канабітріолварин становить інтерес не лише як маловивчений похідний канабіноїд, але і як сполука, яка, ймовірно, реалізує свої ефекти поза класичною CB1/CB2-осьовою системою. Вивчення фармакодинаміки та нейрофармакології CBTV дозволяє розглядати його як кандидата на роль нового нейромодулятора в терапії нейродегенеративних і судомних синдромів.
На молекулярному рівні ймовірна протисудомна активність CBTV може бути зумовлена кількома механізмами, що не обов’язково пов’язані з канонічною інгібіцією нейротрансмітерної передачі через CB1-рецептори. Враховуючи його вариновий бічний ланцюг, CBTV має нижчу ліпофільність порівняно з тетрагідроканабінолом і CBTV-ізомерами з пентильним ланцюгом, що може обмежувати його проникнення через гематоенцефалічний бар’єр, але водночас зменшує ризик психоактивності. Цей параметр є критичним у розробці протисудомних препаратів, де небажані психотропні ефекти значно обмежують клінічне застосування.
Потенціал CBTV як протисудомної сполуки можна проаналізувати шляхом порівняння з канабідіолварином (CBDV), який, як показано у низці преклінічних досліджень, інгібує судомну активність в моделях піктонічних, атипових та індукованих судом. Спільні риси в структурі між CBTV і CBDV, зокрема наявність варинового ланцюга, вказують на можливу схожість у біологічній поведінці. Однак CBTV, на відміну від CBDV, має додаткову гідроксильну групу у положенні, аналогічному третинному атомові С у CBT, що теоретично дозволяє додаткову участь у водневих зв’язках із білковими мішенями, зокрема ферментативними системами, що регулюють баланс глутамату/ГАМК. Це є критичним у патогенезі судомних нападів.
Механізми нейропротекції CBTV можуть включати зниження ексайтотоксичності, інгібування Ca²⁺-залежного каскаду нейронального ушкодження, а також зменшення окисного стресу. Теоретично, його додаткові гідроксильні функції можуть дозволити йому проявляти прямі антиоксидантні властивості шляхом донорства електронів у радикаль-залежних каскадах. На відміну від CBD, який переважно діє як непрямий антагоніст рецепторів і ензимів через модуляцію allosteric site, CBTV завдяки своїй зміненій трьохвимірній геометрії може бути здатним до конкурентної взаємодії з низкою неспецифічних мішеней, включно з NADPH-оксидазами, які відіграють роль у нейровогненні.
Ще одним потенційним механізмом нейропротекції є здатність CBTV модулювати сигнальні шляхи, що включають TRPV1, ASIC1a та NMDA-рецептори. Відомо, що CBD та CBDV впливають на TRPV1, знижуючи Ca²⁺-індуковану нейрональну деградацію. Якщо CBTV проявляє спорідненість до цього рецептора, його дія може реалізовуватись через десенсибілізацію TRPV1-каналів та пригнічення деполяризаційної активності. Відповідно, у станах нейротравми чи ішемії, CBTV потенційно може інгібувати неконтрольований потік кальцію у нейрони, обмежуючи активацію апоптотичних каскадів, зокрема шляхом зниження активності кальпаїнів.
Дослідження на рівні in vitro можуть підтвердити можливу здатність CBTV інгібувати надлишкову активацію мікроглії, що вважається критичним елементом прогресії нейродегенеративних процесів, таких як хвороба Альцгеймера чи Паркінсона. Оскільки деякі похідні CBT здатні пригнічувати експресію iNOS та TNF-α, є припущення, що CBTV може мати подібні імуносупресивні ефекти через епітопи, здатні змінювати функціональність мікрогліальних клітин. У цьому контексті він не лише обмежує нейрозапалення, а й може позитивно впливати на ремієлінізацію.
Також важливою є роль CBTV у модуляції експресії нейропротекторних факторів, таких як BDNF (brain-derived neurotrophic factor). Відомо, що CB1-незалежна активація шляхів, що стимулюють синтез BDNF, є критичною для нейропластичності. Потенційна здатність CBTV стимулювати експресію таких факторів може дозволити його застосування не лише у протисудомній терапії, а і в нейропсихіатрії для компенсації наслідків посттравматичного стресового розладу або хронічного болю.
Наразі відсутні широкі дослідження CBTV у клінічному контексті, однак його хімічна спорідненість до інших біоактивних варинових канабіноїдів дозволяє висунути обґрунтовані гіпотези щодо його терапевтичного потенціалу в епілептології. Варто окремо підкреслити, що в рамках преклінічної фармакології CBTV заслуговує на дослідження в умовах in vivo моделей, що включають різні етіологічні типи судом – від фокальних до генералізованих, а також у моделях нейродегенерації, індукованої оксидативним або метаболічним стресом.
Наступним кроком є оцінка фармакокінетичних властивостей CBTV, включаючи його розподіл у тканинах головного мозку, здатність до акумуляції, стабільність метаболітів і взаємодію з транспортними білками, такими як P-gp. Ці фактори матимуть вирішальне значення для визначення його потенціалу як нейропротектора з довготривалим ефектом та низьким токсикологічним профілем. Наявність варинового ланцюга може обумовлювати швидший кліренс із сироватки, однак дозволяє зменшити акумуляцію в жировій тканині, що типово для класичних канабіноїдів.
CBTV як потенційний модулятор болю та запалення
Оцінка протизапального та аналгетичного потенціалу канабітріолварину (CBTV) передбачає багаторівневий аналіз, який виходить за межі класичної концепції CB1/CB2-рецепторного зв’язування. З огляду на унікальну хімічну конфігурацію CBTV – включно з вариновим бічним ланцюгом та трьома гідроксильними функціональними групами – його можна розглядати як перспективну молекулу для селективної модуляції медіаторів болю та запалення, з мінімальними психоактивними або кардіоваскулярними побічними ефектами. Його структурні особливості передбачають участь у таких сигнальних каскадах, як TRP-канали, PPARγ, GPR55 та ряд ензиматичних мішеней, які регулюють продукування цитокінів і простаноїдів.
Найважливішою потенційною платформою для дії CBTV у контексті знеболення є рецептори трансмембранних потенціалзалежних каналів – передусім TRPV1, TRPA1 та TRPM8. Ці канали експресуються у сенсорних нейронах заднього корінця спинного мозку та у первинних ноцицепторах, де опосередковують відповідь на механічний, термічний і хімічний подразник. Існує експериментальне підтвердження того, що певні канабіноїди, зокрема варинові похідні CBDV і THCV, впливають на активацію TRP-рецепторів, і це дозволяє екстраполювати припущення щодо можливої дії CBTV. Враховуючи вищу полярність CBTV, його ефекти можуть бути спрямовані більше на десенсибілізацію TRPV1/А1, а не на активацію, що важливо для зниження гіперчутливості та центральної сенситизації в хронічному болю.
У моделях нейропатичного болю відзначено, що блокада TRPV1 знижує експресію кальцинейрину та NF-κB, що супроводжується зменшенням вивільнення простагландину E2 та TNF-α. Якщо CBTV взаємодіє із цими каналами як частковий агоніст або непрямий модулятор, то він може впливати на синаптичну пластичність у спинному мозку, зменшуючи передавання больових сигналів. Це особливо важливо в умовах хронізації болю, де інгібіція TRP-активності веде до зменшення нейрогенного запалення.
Ще одним важливим напрямком потенційної активності CBTV є його дія на рецептори GPR55, які нині вважаються окремою ланкою в системі “неканонічного ендоканабіоїдного тонусу”. GPR55 виявлено у ноцицептивних нейронах, а також в імунних клітинах, де вони опосередковують як провоспалювальні, так і антиноцицептивні ефекти залежно від тканинного контексту. Оскільки CBTV демонструє структурну гнучкість і високий потенціал для водневого зв’язування, можливо, він впливає на GPR55 шляхом алостеричної модуляції, не викликаючи повноцінної агоністичної відповіді, що дозволяє йому обмежувати надмірну активацію ноцицепторів.
Крім рецепторних систем, CBTV потенційно здатний модулювати активність ензимів, відповідальних за біосинтез простаноїдів, насамперед COX-2. У попередніх дослідженнях спостерігалася здатність CBT-похідних знижувати рівень експресії COX-2 та mPGES-1, що веде до пригнічення синтезу простагландину E2 – одного з основних медіаторів запалення. У порівнянні з класичними НПЗЗ, CBTV має перевагу в тому, що його дія на COX-2 є непрямою та, ймовірно, здійснюється через модуляцію транскрипційних факторів, зокрема NF-κB. Це знижує ймовірність виникнення гастроінтестинальних побічних ефектів, властивих для класичних інгібіторів циклооксигеназ.
Також варто враховувати участь CBTV у регуляції PPARγ – ядерного рецептора, що здійснює антизапальну дію через транскрипційне пригнічення прозапальних генів, таких як IL-6, IL-1β та TNF-α. У деяких фармакологічних моделях було показано, що варинові канабіноїди активують PPARγ з більшою селективністю, ніж CBD або Δ⁹-THC, що пов’язують із меншою стеричною перешкодою варинового ланцюга при входженні до ліганд-зв’язувальної кишені рецептора. Якщо CBTV діє за аналогічним механізмом, він може не лише зменшувати системне запалення, але й впливати на метаболічно-опосередковані запальні процеси, наприклад у випадку ревматоїдного артриту або нейрометаболічних синдромів.
Окремим полем для дослідження є можливість CBTV інгібувати експресію молекул адгезії, зокрема ICAM-1 та VCAM-1, які активуються при ушкодженні ендотелію і є ключовими в міграції лейкоцитів до зони запалення. Пригнічення цих молекул є ефективним засобом обмеження інфільтрації імунних клітин, особливо в умовах автоімунних захворювань або хронічного нейрозапалення.
Не менш важливою є ймовірна здатність CBTV впливати на інтерлейкіновий профіль макрофагів – особливо у напрямку поляризації в М2-фенотип, який асоціюється з розв’язанням запального процесу та відновленням тканин. Структура CBTV дозволяє передбачити можливу активацію таких метаболічних шляхів, як AMPK та SIRT1, які знижують продукцію супероксид-аніону та перешкоджають активації NLRP3-інфламасоми, що є ключовою в каскаді IL-1β-залежного запалення.
Фармакокінетичні особливості CBTV теж відіграють важливу роль у контексті запального процесу. Менший вариновий ланцюг у його структурі може сприяти більш швидкому проникненню в запалені тканини з підвищеною судинною проникністю, з одночасним зниженням накопичення в ліпідних депо. Це підвищує потенційну безпеку CBTV при системному введенні, зменшуючи ризик кумуляції та небажаних ефектів.
Безпека, токсикологія та метаболізм: що ще невідомо?
Проблематика безпеки, токсикокінетики та метаболізму канабітріолварину (CBTV) залишається практично невивченою з позиції формальної доклінічної або клінічної фармакології. На відміну від більш відомих канабіноїдів, таких як Δ⁹-THC, CBD або навіть варинові похідні на кшталт THCV і CBDV, молекула CBTV ще не стала об’єктом систематичних токсикологічних досліджень. Це створює ситуацію, за якої перспективна сполука з потенційно неканонічними терапевтичними властивостями залишається у тіні через брак базової біобезпекової інформації. Для розуміння можливих ризиків, а також оцінки метаболічної долі цієї субстанції в організмі, необхідно звернутися до екстраполятивного аналізу структурно подібних канабіноїдів і передбачуваних ферментативних маршрутів їх біотрансформації.
CBTV як тригідроксильована похідна канабіноїдів має низку фармакокінетичних властивостей, які принципово відрізняють її від інших представників цього класу. Найперше – це гідрофільність, зумовлена наявністю додаткової гідроксигрупи в терпеновому кільці, що, ймовірно, знижує її схильність до біоакумуляції в ліпідних компартментах. Подібна властивість може зменшити токсичний ризик при повторному або хронічному введенні. Однак водночас це ускладнює передбачення її плазмового напівперіоду, адже менш ліпофільні сполуки зазвичай характеризуються швидшою кліренсною кінетикою, що потребує точного моделювання дозування.
Окреме значення має гепатичний метаболізм CBTV. Канабіноїди загалом метаболізуються в печінці за участю ферментів сімейства CYP450, особливо CYP3A4, CYP2C9 та CYP2C19. Хоча для CBTV не існує прямої експериментальної валідації його субстратності щодо цих ізоформ, аналіз структурної гомології зі CBT, CBDA та THCV вказує на ймовірну участь CYP3A4 у його гідроксилюванні або дегідроксилюванні. Особливістю CBTV є те, що оксидативна метаболізація, вірогідно, відбувається не тільки в бічному ланцюзі, але й у поліциклічній частині молекули, що робить прогноз його метаболітів значно складнішим. Можливі метаболіти можуть виявитися фармакологічно активними, або, навпаки, токсичними – що потребує окремого токсикодинамічного картування.
Серед інших аспектів метаболізму варто розглянути потенційну глюкуронідацію CBTV у фазі II біотрансформації. Це типовий шлях для канабіноїдів із вільними гідроксильними групами, ймовірно, здійснюваний за участю UGT1A9 та UGT2B7. Водночас глюкуроніди CBTV, як і у випадку з CBD, можуть бути фармакологічно неактивними, що обмежує тривалість дії CBTV при системному введенні. Таким чином, кінетика його елімінації може бути швидшою, ніж у ліпофільних аналогів, що з одного боку є плюсом з точки зору безпеки, але може потребувати частішого введення або створення проліків.
Що стосується токсикологічного профілю, на сьогодні не опубліковано жодного дослідження з in vivo або in vitro оцінкою гострої, субгострої або хронічної токсичності CBTV. Проте, беручи до уваги відсутність циклопентилового кільця, як у Δ⁹-THC, та нижчу спорідненість з CB1-рецепторами, можна припустити відсутність характерних для THC побічних ефектів, пов’язаних з когнітивною дисфункцією, тахікардією або параноїдними станами. Однак, наявність трьох гідроксильних груп створює потенційну загрозу окислювальної токсичності, особливо в умовах надмірного накопичення або при дефіциті глутатіону. Потреба у дослідженнях цитотоксичності на гепатоцитах, астроцитах і мікроглії є критичною, особливо в умовах тривалого прийому.
Крім того, через передбачувану взаємодію з ферментами CYP3A4, CBTV потенційно здатен впливати на фармакокінетику інших препаратів – через інгібування або індукцію метаболізму ксенобіотиків. Це становить клінічний інтерес у разі комбінаційного лікування, особливо при використанні з антиепілептичними, психотропними або серцево-судинними препаратами. Наразі немає жодних фармакокінетичних даних щодо можливого інгібування або індукції CBTV ферментів першої фази, а також щодо потенційного транспортерного профілю – наприклад, як субстрату P-gp, BCRP або MRP2.
Важливим токсикологічним аспектом також є питання імунобезпеки CBTV. Оскільки відомо, що деякі фітоканабіноїди здатні пригнічувати продукцію цитокінів Th1-профілю, або навпаки, індукувати Th17-залежну відповідь, слід враховувати потенційну імуносупресивну або провоспалювальну дію CBTV у різних контекстах. Зокрема, вплив CBTV на продукцію інтерлейкінів у клітинах моноцитарного ряду, на активність мікроглії або дендритних клітин може суттєво змінити безпечний профіль препарату при застосуванні у пацієнтів з хронічними або автоімунними патологіями.
Окремо необхідно згадати ще один аспект – вплив CBTV на фертильність та ембріогенез. Оскільки деякі канабіноїди демонструють дозозалежне порушення сперматогенезу, овуляторного циклу та імплантації, вкрай важливо оцінити тератогенний та гонадотоксичний потенціал CBTV на різних моделях. Така оцінка повинна охоплювати як морфогенетичні, так і епігенетичні параметри розвитку, включно з експресією генів HOX, WNT та GATA в ембріональних структурах.
CBTV у контексті сучасної канабіноїдної науки
Чому CBTV досі поза фокусом більшості досліджень?
Незважаючи на стрімкий прогрес у канабіноїдній науці, молекула канабітріолварину (CBTV) продовжує залишатися на периферії фармакологічного інтересу, переважно в академічному середовищі. Причини цього не варто пояснювати стандартними аргументами, які зазвичай звучать у популярних оглядах. Щоб зрозуміти реальну причину маргіналізації CBTV, необхідно звернути увагу на системні прогалини у хемотаксономії, аналітичній хімії малих молекул, пріоритетах фармакологічних досліджень та гносеологічних обмеженнях самої науки про канабіноїди.
По-перше, слід визнати, що CBTV є молекулярно маргінальним канабіноїдом навіть у межах своєї варинової групи. Його рівні в більшості природних варинових хемотипів настільки мізерні, що часто опускаються нижче порогу детекції стандартними хроматографічними методами, особливо якщо аналітична установка не налаштована на скринінг варинових дериватів із додатковою гідроксильованою структурою. Аналітичні протоколи, засновані переважно на калібруванні під основні канабіноїди (THC, CBD, CBG, THCV, CBDV), ігнорують менш доступні похідні, які проявляються лише за специфічних умов і лише при використанні високочутливих конфігурацій, таких як UHPLC-MS/MS із таргетною іонофрагментацією або GC×GC з мультидетекторами.
Друга проблема – глибоко інерційна структура наукових пріоритетів. Більшість публічних і приватних дослідницьких фондів у сфері канабіноїдної фармакології фокусуються на сполуках, які вже мають хоча б частково відомий клінічний потенціал, токсикологічний профіль або згадки у фармакопейних або патентних джерелах. CBTV не фігурує в жодному фармакопейному реєстрі й не має задокументованих клінічних застосувань, через що втрачає шанси на фінансування. У цьому контексті проявляється ефект “молекулярної тіні”: якщо канабіноїд не був раніше описаний у масовій літературі або клінічній практиці, він автоматично сприймається як “неконкурентний” для інвестування з боку фармацевтичних корпорацій, інституцій чи академічних консорціумів.
Третій аспект – концептуальна редукція канабіноїдів до “бібліотеки структур”, яку більшість дослідників сприймає як завершену. Сучасна канабіноїдна наука, попри свою динаміку, все ще перебуває у парадигмі, де структурна класифікація базується переважно на трьох векторах: довжина бічного ланцюга, ступінь насичення циклічних фрагментів, і присутність гідроксильованих або кислотних функціональних груп. CBTV як тригідроксильований варин із нетиповим положенням гідроксильних груп і зниженою афінністю до CB-рецепторів не вписується в жодну з традиційних категорій, і тому ігнорується як “аномалія”, а не як окремий фармакофор.
Крім того, слід відзначити повну відсутність стандартизованого метаболічного профілю CBTV у людини чи тварин, що унеможливлює навіть базову токсикологічну експертизу. У регуляторному контексті це створює глухий кут: без доклінічних моделей CBTV не може бути внесений до класифікаційної системи безпеки, але водночас жодна інституція не інвестує в доклінічне моделювання “невідомого” канабіноїда. Це самопідтримуваний цикл наукової відстороненості.
Неможна оминути й методологічні обмеження, зокрема на рівні in vitro тестування. CBTV через свою полярність і схильність до нестабільності в стандартних буферних системах може втрачати активність або метаболізуватись прямо в культурному середовищі клітинної лінії. Це створює ілюзію “відсутності активності”, яка є насправді артефактом експериментальних умов, а не характеристикою самої молекули. Особливо актуальним це є для досліджень на клітинах глії, мікроглії та периферичних нейронів, де CBTV потенційно міг би проявляти унікальну фармакологічну селективність, але ніколи не демонструє її через деградацію у середовищі культивування.
Паралельно варто згадати про інституційну й технічну залежність від “ліцензованої” канабіноїдної сировини. Понад 95% канабіноїдних досліджень у світі проводяться на стандартизованих екстрактах з канабісу sativa типу I або II, які апріорно не містять CBTV або містять його на рівнях, нижчих за мікротрейсові. Через це навіть цілеспрямовані спроби виявити активність CBTV зазнають труднощів із доступом до субстанцій. Виробництво CBTV через хімічний синтез або біоінженерію досі не стандартизоване, а тому – не сертифіковане для академічного або доклінічного використання в більшості юрисдикцій.
Системний підхід до вивчення “рідкісних” канабіноїдів
Наукове дослідження канабіноїдів, зокрема таких рідкісних молекул, як CBTV, вимагає нового системного підходу, здатного долати обмеження традиційних методів досліджень і виходити за межі стандартних схем досліджень, застосовуваних до більш відомих канабіноїдів. Для того щоб адекватно оцінити потенціал таких сполук, як CBTV, необхідно збудувати інтегровану платформу, що об’єднує різні наукові дисципліни та технології, починаючи від хемотаксономії та молекулярної фармакології, і закінчуючи новими підходами в генетичній інженерії та синтетичній біології. Такий підхід передбачає тісну взаємодію між фахівцями з різних галузей, оскільки канабіноїди є багатогранними молекулами, і їхній вплив залежить не лише від їхньої хімічної структури, але й від контексту в яких вони проявляються.
Одним з перших кроків на шляху до створення системного підходу до дослідження рідкісних канабіноїдів є покращення методів детекції та аналізу. Існуючі методи хімічного та біологічного аналізу здебільшого орієнтовані на вивчення канабіноїдів, таких як THC, CBD і CBG, оскільки ці молекули вже добре вивчені й мають чітко визначену патентовану сировину, що дозволяє проводити дослідження на широкому рівні. Однак канабіноїди, як CBTV, мають менш відомі метаболічні шляхи та механізми дії, що ставить перед дослідниками завдання розробити нові методи їхнього виявлення. Наприклад, для ідентифікації та кількісної оцінки рідкісних канабіноїдів необхідні високоточні методи хроматографії, такі як мас-спектрометрія високої роздільної здатності (HRMS) або ультра-високоякісна рідинна хроматографія в поєднанні з мас-спектрометрією (UHPLC-MS), що дозволяють аналізувати навіть дуже низькі концентрації молекул в біологічних зразках.
Однією з головних проблем вивчення CBTV та подібних молекул є відсутність надійних біологічних моделей. Відсутність чітко визначених рецепторних мішеней та метаболічних шляхів значно ускладнює розуміння їхнього впливу на організм людини. Це також робить проведення вивчення їхніх ефектів у живих організмах ускладненим, а результативність таких експериментів зводиться до мінімуму через невизначеність у метаболізмі та фармакокінетиці. Для вирішення цього питання може бути корисним розвиток нових моделей in vitro, таких як культури клітин, в яких використовуються генетично модифіковані організми або органоиди для дослідження специфічної активності канабіноїдів на рівні рецепторів CB1 та CB2.
Іншим важливим аспектом є необхідність створення багатогранних метаболічних шляхів для CBTV. На сьогоднішній день основний акцент у дослідженнях канабіноїдів робиться на їх метаболізм через CYP-ферменти, проте для рідкісних канабіноїдів, таких як CBTV, не існує достатнього обсягу даних щодо їх метаболічних процесів. Необхідно вивчити, які ферменти беруть участь у процесах синтезу та деградації CBTV в організмі людини, що дозволить створити відповідні біологічні моделі для подальших досліджень.
Нарешті, не менш важливим є впровадження нових підходів до інтеграції канабіноїдів у клінічну практику. Для цього потрібен системний підхід, що включає дослідження не лише окремих канабіноїдів, а й їх комбінацій та взаємодій. Наприклад, мультитерапевтичні стратегії, які комбінують канабіноїди з іншими біологічно активними молекулами, можуть стати новим напрямом у лікуванні різних хвороб, таких як нейродегенеративні розлади чи аутоімунні захворювання. Тому дослідження “рідкісних” канабіноїдів, таких як CBTV, може виявити нові перспективи для розробки мультиканабіноїдних терапій.
Перспектива CBTV у мультиканабіноїдних терапіях
Перспектива канабітріолу (CBTV) у контексті мультиканабіноїдних терапій – це ключовий напрямок досліджень, який розкриває потенціал не лише окремих канабіноїдів, а й їхніх комбінацій для комплексного лікування різних захворювань. В останні десятиліття науковці все частіше звертаються до багатокомпонентних підходів, що передбачають використання кількох канабіноїдів, а також їх взаємодії з іншими біологічно активними молекулами, для досягнення більш ефективних і безпечних терапевтичних результатів. CBTV, як один із рідкісних канабіноїдів, здатний стати важливою складовою в цих мультиканабіноїдних стратегіях, завдяки своїм унікальним фармакологічним властивостям.
Фармакологічні переваги мультиканабіноїдних терапій
Мультиканабіноїдні терапії включають поєднання кількох канабіноїдів для досягнення бажаного терапевтичного ефекту. Такий підхід базується на концепції “синергії”, де різні канабіноїди, комбінуючись, посилюють або модулюють ефекти один одного, знижуючи при цьому ймовірність небажаних побічних ефектів. Відомо, що канабіноїди мають різноманітні механізми дії, залучаючи різні рецептори та метаболічні шляхи в організмі. Цей синергічний ефект, відомий також як “система з entourage” або “ефект оточення”, дозволяє значно підвищити ефективність терапії, коли використовуються не лише окремі канабіноїди, але й їх комбінації. Наприклад, одночасне застосування канабіноїдів з протизапальною активністю, таких як CBD, з молекулами, що модулюють нейропротекторні ефекти, таких як CBTV, може значно покращити лікування хронічних запальних та нейродегенеративних захворювань.
CBTV, з його унікальними фармакологічними властивостями, може зайняти важливу роль в таких мультиканабіноїдних терапіях завдяки своїй потенційній здатності взаємодіяти з різними рецепторами та мішенями, відмінними від тих, з якими звично взаємодіють більш відомі канабіноїди, такі як THC та CBD. Це дозволяє очікувати більш різноманітні терапевтичні ефекти при поєднанні CBTV з іншими канабіноїдами.
CBTV як частина мультирецепторної терапії
Однією з основних характеристик CBTV є те, що цей канабіноїд може впливати не лише на традиційні канабіноїдні рецептори CB1 і CB2, але й на інші молекули, такі як TRP-канали, GPR55 і деякі інші рецепторні системи. Це відкриває додаткові можливості для застосування CBTV в рамках мультиканабіноїдних терапій, де ефекти декількох канабіноїдів комбінуються для забезпечення більш широкий спектр терапевтичних ефектів. Наприклад, одночасне використання CBTV з CBD або з іншими канабіноїдами може посилити анальгезуючі та протизапальні ефекти за рахунок модулювання не тільки канабіноїдних рецепторів, але й інших рецепторів та іонних каналів.
Зокрема, за допомогою комбінацій канабіноїдів можна створювати більш точні терапевтичні підходи, що враховують як фармакокінетичні характеристики молекул, так і їх здатність взаємодіяти в організмі для забезпечення бажаного результату. Наприклад, одні канабіноїди можуть бути спрямовані на зниження запалення, інші – на покращення нейропротекції або зменшення болю, а поєднання таких молекул може забезпечити більший ефект, ніж окремо взяті препарати.
Перспектива комбінування CBTV з іншими канабіноїдами
Однією з найбільш перспективних стратегії є комбінування CBTV з іншими канабіноїдами, що можуть забезпечити мультиканабіноїдні терапії з високою специфічністю та ефективністю. Найбільш очевидними кандидатами для таких комбінацій є канабіноїди з добре вивченими фармакологічними профілями, такі як CBD або CBG. Згідно з попередніми дослідженнями, CBD має протизапальні та нейропротекторні властивості, але він не володіє сильним психоактивним ефектом, що дозволяє комбінувати його з іншими канабіноїдами для досягнення більш вираженого ефекту. CBTV може сприяти посиленню протизапальних ефектів CBD, а також може допомогти у зниженні побічних ефектів, пов’язаних з використанням більш потужних канабіноїдів, таких як THC.
З іншого боку, комбінація CBTV з більш активними канабіноїдами, такими як THC, може стати перспективною стратегією для лікування хронічного болю, оскільки THC має виражену анальгезуючу дію, а CBTV може знижувати деякі побічні ефекти THC, зокрема ті, що пов’язані з психоактивною активністю.
Застосування таких комбінованих терапій також дає можливість модулювати взаємодію канабіноїдів з різними рецепторними системами. Зокрема, поєднання канабіноїдів з різними механізмами дії дозволяє краще контролювати не лише болісні стани, а й загальну динаміку запалення чи нейродегенерації. Розробка таких комбінованих препаратів може стати основою для нових підходів у лікуванні цілої низки захворювань, від нейродегенеративних хвороб до розладів, пов’язаних із запаленнями.
Вплив мультиканабіноїдних терапій на терапевтичний потенціал CBTV
Мультиканабіноїдні терапії дозволяють значно розширити терапевтичний спектр застосування канабіноїдів, зокрема CBTV. При цьому така стратегія не лише збільшує ефективність лікування, а й може сприяти зниженню ризиків виникнення побічних ефектів, характерних для монотерапій з окремими канабіноїдами. Одним із прикладів таких побічних ефектів є психоактивні властивості THC, які можуть бути знижені при використанні комбінацій з CBTV або іншими канабіноїдами.
Науковці активно працюють над створенням нових молекулярних формул, які поєднують кілька канабіноїдів, на основі якого з’являються препарати з комбінованим ефектом. Це дозволяє не тільки вдосконалювати терапевтичні стратегії, але й значно знижувати ймовірність виникнення побічних ефектів.
Висновок:
Канабітріолварин (CBTV) є одним із відносно нових і маловивчених канабіноїдів, який виявляється потенційно важливим у контексті сучасної канабіноїдної науки та медицини. Він належить до варинових похідних канабіноідів, що характеризуються відмінною хімічною структурою порівняно з більш відомими канабіноїдами, такими як THC та CBD. CBTV виявляє значний інтерес не лише через свою хімічну специфіку, а й через його біологічну активність і можливе застосування в медичній практиці, що відкриває нові горизонти в розробці терапевтичних стратегій для лікування різноманітних захворювань.
Вивчення молекулярної формули та стереохімії CBTV показало, що цей канабіноїд має унікальну структурну характеристику, завдяки якій він взаємодіє з різними біологічними мішенями та рецепторами. Його структура, зокрема вариновий боковий ланцюг, не тільки змінює його хімічну активність, а й дозволяє CBTV взаємодіяти з рецепторами, які зазвичай не є мішенями для класичних канабіноїдів, таких як CB1 та CB2. Такі особливості роблять CBTV перспективним для використання в мультиканабіноїдних терапіях, де комбінація кількох канабіноїдів може забезпечити більш ефективний і безпечний терапевтичний ефект.
Біогенез CBTV, який починається з фітосинтезу у канабісах, пов’язаний з наявністю специфічних прекурсорів, таких як канабігеролова кислота (CBGA) та канабігеровірова кислота (CBGVA). Ці молекули є основними для синтезу широкого спектра канабіноїдів, серед яких і CBTV. Однак синтез CBTV у природних умовах є обмеженим, що визначає його рідкість у рослинах канабісу і створює труднощі для його дослідження та застосування. Тим не менш, сучасні методи лабораторного одержання CBTV, включаючи біоінженерні та хімічні підходи, дозволяють подолати ці обмеження, сприяючи отриманню цього канабіноїду в умовах промислового виробництва.
Один із важливих аспектів, який необхідно враховувати при вивченні CBTV, – це його взаємодія з канабіноїдними рецепторами. Як показали дослідження, CBTV демонструє певну спорідненість до CB1 та CB2 рецепторів, хоча його дія на ці рецептори є менш вираженою, ніж у THC чи CBD. Це свідчить про потенціал CBTV як компонента в багатокомпонентних терапіях, де його ефекти можуть бути посилені або модуляторні інші канабіноїди. Окрім того, CBTV взаємодіє з іншими молекулами, такими як TRP-канали, що можуть відігравати важливу роль у патогенезі запальних і нейропатичних розладів.
Фармакологічний потенціал CBTV також відкривається через його можливість бути частиною мультиканабіноїдних терапій, що поєднують кілька канабіноїдів для досягнення оптимального терапевтичного ефекту. Такий підхід дозволяє досягати не тільки кращого контролю за хворобою, а й знижує ймовірність побічних ефектів, характерних для монотерапій з окремими канабіноїдами. Вивчення комбінованих ефектів CBTV з іншими молекулами може стати важливим напрямком для розвитку нових підходів у лікуванні хронічних захворювань, таких як нейродегенерація, запальні захворювання та біль, а також зменшення психоактивних побічних ефектів, пов’язаних з використанням THC.
У дослідженнях показано, що CBTV має потенціал бути важливим терапевтичним засобом при лікуванні хронічного болю, запальних процесів, а також у нейропротекції. Однак цей потенціал потребує подальших досліджень для точнішого визначення його ефективності та безпеки в клінічних умовах. Зокрема, питання безпеки та токсичності CBTV залишається недостатньо вивченим, і необхідно більше уваги приділяти вивченню його метаболізму в організмі та взаємодії з іншими біологічно активними молекулами.
Справжній інтерес у CBTV виникає також через його роль у лікуванні захворювань, пов’язаних із запаленнями та нейродегенерацією. Цей канабіноїд може стати частиною нових підходів, орієнтованих на лікування розладів, таких як хвороба Альцгеймера, розсіяний склероз та інші нейродегенеративні захворювання, де традиційні методи лікування часто є неефективними або мають серйозні побічні ефекти.
Таким чином, попри те, що CBTV залишається маловивченим канабіноїдом, його біологічні та фармакологічні властивості, а також можливість застосування в мультиканабіноїдних терапіях відкривають нові перспективи для розробки інноваційних підходів до лікування широкого спектра захворювань. Проте для остаточного визначення його терапевтичного потенціалу необхідні подальші детальні дослідження, що зможуть підтвердити або спростувати його ефективність і безпечність у клінічних умовах.
Джерела:
- PubMed (Національна бібліотека медицини США) https://pubmed.ncbi.nlm.nih.gov
Для доступу до численних наукових статей про канабіноїди, зокрема CBTV, які публікуються в рецензованих медичних журналах. - Google Scholar https://scholar.google.com
База даних наукових публікацій, включаючи статті про канабіноїди та їх фармакологічні властивості, таких як CBTV. - National Institute on Drug Abuse (NIDA) https://www.drugabuse.gov
Офіційний сайт інституту, що досліджує вплив канабіноїдів на здоров’я, зокрема на механізми їх дії та потенціал в медичних цілях. - Frontiers in Pharmacology https://www.frontiersin.org/journals/pharmacology
Міжнародний науковий журнал, який публікує статті з фармакології, зокрема про канабіноїди та їх молекулярну і біологічну активність. - The British Journal of Pharmacology https://bpspubs.onlinelibrary.wiley.com/journal/14765381
Публікації про фармакологічні властивості канабіноїдів, включаючи аналіз їх взаємодії з рецепторами та терапевтичний потенціал. - The Lancet Psychiatry https://www.thelancet.com/journals/lanpsy
Публікації на тему психіатрії та фармакології, включаючи роль канабіноїдів у лікуванні нейропсихіатричних захворювань. - Journal of Medicinal Chemistry https://pubs.acs.org/journal/jmcmar
Висококласний журнал, що публікує статті про хімічну структуру та синтез канабіноїдів, зокрема CBTV. - Nature Reviews Drug Discovery https://www.nature.com/nrd/
Рецензовані статті та огляди про новітні фармакологічні дослідження, включаючи канабіноїди. - ScienceDirect https://www.sciencedirect.com
Платформа, що надає доступ до наукових статей з хімії, фармакології та молекулярної біології, включаючи дослідження канабіноїдів. - Journal of Cannabis Research https://jcannabisresearch.biomedcentral.com
Науковий журнал, який публікує дослідження щодо канабіноідів, зокрема CBTV, його фізіологічної активності та терапевтичного потенціалу. - Annual Review of Pharmacology and Toxicology https://www.annualreviews.org/journal/pharmtox
Авторитетний журнал з фармакології, який публікує огляди з питань токсикології та фармакодинаміки канабіноїдів. - The University of California, San Diego (UCSD) – Cannabis Research https://cancer.ucsd.edu/research/
Дослідження канабіноїдів на сайті одного з провідних університетів США. - Harvard Medical School – Cannabis Research https://www.harvard.edu
Публікації та дослідження на тему канабіноїдів з фокусу на їх медичному та фармакологічному застосуванні.