У контексті сучасної канабіноїдної науки все ще зберігається асиметрія уваги до різних представників цієї хімічної групи: ключовими об’єктами досліджень залишаються Δ⁹-тетрагідроканабінол (THC), канабідіол (CBD) і в дещо меншій мірі – канабінол (CBN). Їхня вивченість стала еталонною в осмисленні ендоканабіноїдної системи, рецепторної афінності та клінічного потенціалу, що в результаті призвело до маргіналізації менш поширених або метаболічно вторинних канабіноїдів. У цій тіні перебуває й каннабіварин (CBV) – структурно стабільна, повністю непсихоактивна молекула, що утворюється в результаті окиснення тетрагідроканнабіварину (THCV), та до сьогодні залишається фактично поза парадигмами клінічної, нейрофармакологічної чи навіть хемотаксономічної уваги. Проте сучасний рівень аналітичної точності у вивченні природних метаболітів ставить нові питання до оцінки значущості таких “периферійних” компонентів, і CBV виступає в цьому контексті як молекула, що репрезентує латентний функціональний пласт фітоканабіноїдної хемії, досі не інтегрований у теоретичну канву ані нейронаук, ані фітохімії, ані фармакогнозії.
З формальної точки зору, CBV є продуктом автоокиснення або термічно-каталізованої дегідрогенізації THCV – молекули, структурно подібної до THC, але з боковим пропіловим ланцюгом замість пентилового. Цей варіновий варіант Δ⁹-THC є сам по собі предметом фармакологічного інтересу, з огляду на його антагоністичну дію на CB1-рецептори та потенційний вплив на глікемічні механізми. Утворення CBV із THCV, з одного боку, є очевидним процесом, очікуваним у контексті деградації канабіноїдів при старінні біомаси або під дією теплового стресу; з іншого – майже цілком ігнорується як індикаторний маркер або як субстрат потенційного біохімічного втручання. Попри виявлення CBV у хроматографічних профілях зразків Cannabis sativa – зокрема у старіших екземплярах або екстрактах, що зазнали тривалого зберігання, – наукова література майже не містить ґрунтовних досліджень щодо його фармакокінетики, біологічної активності чи ролі в метаболічних каскадах рослини або людського організму. Така лакуна не є наслідком відсутності потенціалу, а скоріше продуктом епістемологічної інерції, в межах якої лише рецепторно-активні молекули вважаються вартими дослідження.
Разом із тим, поява CBV у стабільних кількостях у низці фітогенетично споріднених хемотипів конопель, зокрема в сортах, багатих на варінові похідні, дозволяє поставити питання про його біогенетичну детермінованість і можливу регуляторну роль. CBV, хоча і не взаємодіє з класичними канабіноїдними рецепторами, може впливати на позарецепторні сигнальні шляхи або проявляти властивості хімічного модифікатора в мембранозалежних механізмах. З огляду на гідрофобність, низьку реактивність і відносну термостійкість, CBV може виступати як метаболічний стабілізатор, біохімічний інерт або навіть алостеричний модулятор для структурно комплементарних лігандів. До того ж його відсутність токсичності, низька біотрансформація в експериментальних моделях і потенційна хемічна індиферентність роблять його цікавим об’єктом для вивчення принципів ендогенного захисту або буферизації рецепторної чутливості в межах ендоканабіноїдної системи.
Із фармакохімічної перспективи CBV може бути також цікавим як хемотиповий біомаркер для аналітичної стандартизації варінових хемоварів, зокрема в умовах, коли фітогенетичне навантаження не дозволяє спиратися лише на THC/CBD-баланс. Його стабільне формування при окисному старінні вмісту THCV надає можливість використовувати CBV як індикатор вікового стану конопляного екстракту – подібно до ролі CBN для THC. Такі підходи мають не лише аналітичне, а й регуляторне значення, особливо в контексті зростаючого інтересу до фармакопейної стандартизації конопляної сировини.
Відсутність психоактивного ефекту та вкрай низький ризик рецепторного зловживання дозволяє розглядати CBV як перспективну структуру для розробки наноносіїв, хемічно інертних матриць або стабілізаційних агентів у канабіноїдній формуляції. І хоча на сьогодні така концепція не має експериментального підтвердження, вона відкриває поле для дослідження вторинних хемоструктур канабісу в якості платформ, а не просто функціональних агентів. Це зсуває фокус канабіноїдної науки з функції на архітектоніку – з рецепторної афінності на системну інтеграцію.
Хемотаксономічний контекст CBV у межах фітоканабіноїдного спектра
Хемотипи з високим вмістом пропілових похідних: CBV як маркер варінового шляху
Хемотаксономія Cannabis sativa L.-інструментальна галузь сучасної фітосистематики-спирається не лише на морфологічні або генетичні маркери, але й на стабільні біохімічні профілі вторинних метаболітів. У цьому контексті пропілові похідні канабіноїдів, що виникають у результаті варінового біосинтетичного шляху, набувають дедалі більшої значущості як хемотипові детермінанти, здатні доповнити або навіть уточнити класифікаційні моделі, що базуються на співвідношеннях Δ⁹-тетрагідроканабінолу (THC) і канабідіолу (CBD). Каннабіварин (CBV), як кінцевий окиснений метаболіт у THCV-асоційованій лінії, являє собою стабільний та хімічно індиферентний компонент, котрий може виконувати роль маркера функціональної активності пропілового шляху в межах певних хемотипів.
Присутність CBV у метаболічному спектрі сировини Cannabis sativa L. завжди є похідною активності специфічного субкладу варінових хемотипів, які характеризуються не тільки здатністю до біосинтезу канабіноїдів із пропіловим заміщенням, а й стабільним збереженням цих метаболітів у фенотиповій експресії протягом вегетаційного циклу. Ці хемотипи мають посилене або переважне функціонування відповідного варінового алелю оліготерпеноїдсинтаз, відповідальних за утворення C3-побічних ланцюгів у молекулі канабігеролової кислоти (CBGA), з якої вже далі утворюються THCV, CBDV, CBGV та інші відповідні сполуки.
CBV, як неензиматичний продукт дегідрогенізації THCV, з’являється лише за умови, якщо у вихідному рослинному матеріалі відбувається значне накопичення останнього. У такий спосіб CBV функціонує не як первинний біосинтетичний продукт, а як вторинний хемомаркер, який опосередковано інформує про інтенсивність варінового метаболізму. У відмінності від інших сполук, таких як CBGV або CBDV, CBV не є субстратом жодної відомої ферментативної реакції в Cannabis sativa L., що робить його більш інертним у біохімічному плані, але водночас надійнішим як індикатор завершеного варінового шляху. Це відрізняє його від більш реактивних проміжних метаболітів, які швидко метаболізуються або трансформуються в інші канабіноїди, що ускладнює їх використання в хемотаксономічних цілях.
Примітно, що хемотипи з високою експресією пропілових похідних не завжди демонструють відповідно високий рівень CBV: наявність CBV вказує саме на факт деградаційного перетворення THCV, що може залежати від факторів, таких як зрілість рослини, умови зберігання, вплив світла або температури. Таким чином, CBV не є безпосереднім хемотиповим біомаркером у традиційному розумінні, але стає цінним індикатором при аналізі вторинних або третинних метаболічних змін у сировині, що дозволяє диференціювати, наприклад, стабільні варінові хемотипи від гібридних або псевдоварінових генотипів, які не демонструють повноцінного шляху деградації THCV до CBV.
Генетична основа цих хемотипів тісно пов’язана з наявністю специфічного алелю BCHS (butyl-/propyl-cannabinoid synthase), котрий визначає пріоритетний шлях пропілового або бутилового канабіноїдного синтезу. У контексті CBV це набуває особливого значення, оскільки дозволяє виявити не лише функціонування цієї синтази, а й стабільність її кінцевих продуктів при різних агрохімічних режимах культивації. На сьогодні декілька генетично відмінних хемотипів Cannabis sativa продемонстрували перевагу у варіновому шляху: зокрема, африканські лінії типу “Durban Poison” та центральноазійські локуси, ізольовані з дикорослих популяцій, що еволюційно зазнали відбору за ознакою непсихоактивності при збереженні стимуляторної нейромодуляторної активності.
Із практичного боку, хемотаксономічне картування CBV дозволяє побудувати новий рівень стандартизації канабіноїдних екстрактів – на основі не лише кількісного вмісту THC/CBD, але й профільного спектра варінових продуктів, з урахуванням їхнього ступеня деградації. Це відкриває перспективу використання CBV як постіндексного маркера для стратифікації сировини не лише за хемотипом, а й за рівнем метаболічного старіння або окисного навантаження, зокрема для фармакопейного контролю якості.
Окреме питання – вивчення кореляцій між наявністю CBV та профілем терпенів. Попередні ізольовані хроматографічні дослідження вказують на наявність стійкої асоціації між CBV і такими терпенами, як гераніол, евкаліптол і цис-окімен, які також частіше фіксуються у варінових хемотипах. Це свідчить не лише про біохімічну кореляцію, але й про потенційні еволюційні зв’язки, що мають бути розглянуті в межах фітогенетичної реконструкції варінового напряму метаболізму.
Роль CBV у метаболічній мережі вторинних метаболітів Cannabis sativa L.
Каннабіварин (CBV), будучи повністю дегідрогенізованим аналогом тетрагідроканнабіварину (THCV), має унікальний статус у метаболічному ландшафті Cannabis sativa L. Він не є ні ключовим біосинтетичним модулятором, ні активним субстратом основних ферментативних каскадів у живій рослинній клітині. Проте саме завдяки цій хімічній інертності та метаболічній стабільності CBV виконує функцію структурного маркера, відображаючи ретроспективну активність біосинтетичних маршрутів. Він становить собою ендогенний хемосигнал, що дозволяє реконструювати перебіг деградаційних та окисних процесів у фітосередовищі, а також окреслює межі варіаційного простору вторинного метаболізму Cannabis sativa на пізніх стадіях розвитку рослини або в післязбиральний період.
У межах вторинного метаболізму CBV відіграє насамперед індикативну роль. Його хемогенез не є результатом регульованої ферментативної реакції, а відбувається унаслідок автоокислення THCV під дією температури, світла або окислювального стресу – як це встановлено в ряді досліджень із прискореного старіння канабіноїдних екстрактів. Відповідно, CBV у метаболічній мережі функціонує як хронологічний або енергетичний маркер – свого роду сигнатура перебігу деградації, що віддзеркалює етапність і глибину перебудови варінової гілки канабіноїдного біосинтезу.
На відміну від більшості канабіноїдів, CBV практично не метаболізується у тканинах рослини й зберігає структурну стабільність навіть в умовах високої температури або тривалого впливу УФ-опромінення. Це робить його винятковим з точки зору екологічної інформативності. Його наявність і концентрація дозволяє визначити не тільки вихідну метаболічну програму рослини (тобто здатність синтезувати THCV), але й ступінь постбіогенетичних змін – аналогічно до того, як CBNA вказує на окисну деградацію CBN-шляху. Однак на відміну від CBNA, CBV не пов’язаний із психоактивними попередниками, що виводить його за межі токсикохімічного контролю та надає нового виміру в екологічно-чистій фітосенсорній аналітиці.
CBV також може розглядатися як специфічний продукт редокс-рівноваги в межах канабіноїдного пулу. У варіновій гілці THCV синтезується шляхом циклізації пропіл-заміщеної форми CBGA за участю THCV-синтази. Утворений THCV, як відомо, менш стабільний, ніж його бутиловий аналог Δ⁹-THC, і при несприятливих умовах легко деградує з утворенням CBV. Така деградація не відбувається у зворотному напрямку – тобто CBV не є субстратом для ресинтезу THCV, що підтверджується відсутністю будь-яких зворотно-активних редуктаз у геномі Cannabis sativa, які могли б забезпечити відповідну перетворюваність.
Інша важлива властивість CBV – це його відсутність участі в будь-яких каскадних вторинних реакціях з іншими терпеновими або флавоноїдними сполуками. Це дозволяє розглядати CBV як метаболічно термінальну одиницю, своєрідну “мертву зону” вторинного метаболізму, але саме тому – максимально стабільну і репрезентативну. CBV не бере участі у жодному з відомих перехресних шляху з фенольними, ізопреновими або азотовмісними метаболітами, що знижує його біохімічну варіабельність і підвищує таксономічну специфічність.
З метаболічної точки зору CBV можна уявити як індикатор завершеності біохімічного циклу в межах конкретної субгілки фітоканабіноїдної мережі. Його присутність вказує на те, що циклізація, окислення, і термінальна стабілізація THCV вже завершились, і подальші біохімічні реакції в межах цього шляху неможливі. Отже, CBV сигналізує про повну реалізацію варінового шляху, що не характерно для більшості інших похідних канабіноїдів, які зазвичай зберігають певний метаболічний потенціал для подальших реакцій.
Співвідношення CBV до THCV і CBGV: біосинтетичні детермінанти
Метаболічні шляхи синтезу канабіноїдів у Cannabis sativa L. являють собою складну й багатогранну мережу реакцій, де різні похідні органічних кислот та їх окислювальні продукти взаємодіють через низку ферментативних механізмів. CBV, у зв’язку з його статусом у структурній сітці канабіноїдних метаболітів, займає важливе місце в процесах деградації і трансформації таких сполук, як THCV і CBGV. Спроби розшифрувати це співвідношення вимагають поглибленого розуміння хемогенетичних шляхів, на яких ці сполуки утворюються, а також детального аналізу біосинтетичних детермінант.
Базові біосинтетичні шляхи для CBV, THCV та CBGV
На основі досліджень канабіноїдної біосинтетичної мережі можна визначити, що кожен із цих канабіноїдів синтезується через декілька спільних попередників. CBV та THCV мають спільну біосинтетичну передісторію, оскільки їх вихідними метаболітами є варінові похідні канабігеролового комплексу (CBGA).
- CBGA (канабігеролова кислота) є основним попередником усіх канабіноїдів. У процесі карбоксиляції він стає активним у метаболізмі канабіноїдів.
- Для утворення THCV, CBGA за допомогою ферменту THCV-синтази проходить циклізацію через проміжний етап, що включає пропілову групу, змінюючи своє з’єднання до тетрагідроканнабіварину.
- CBGV, за аналогією з THCV, синтезується з CBGA, але відбувається використання бутилової групи замість пропілової. Ця зміна карбонової групи визначає різницю між цими канабіноїдами на біохімічному рівні.
Ключова особливість цього шляху полягає в тому, що всі три канабіноїди (CBV, THCV та CBGV) утворюються з однієї молекули базового попередника, але різні метаболічні шляхи ведуть до утворення структурних похідних, що мають значні біофізичні та біологічні відмінності.
Біосинтетичні детермінанти CBV, THCV і CBGV
Розгляд співвідношення цих канабіноїдів неможливий без аналізу ферментативних детермінант, які визначають вибірковість біосинтетичних шляхів. Основними ферментами, що регулюють синтез CBV, є:
- THCV-синтаза: Цей фермент каталізує синтез THCV із CBGA, забезпечуючи циклізацію пропілового ланцюга в основі молекули. Важливим є те, що THCV-синтаза має високу специфічність до пропілового залишку, обмежуючи утворення інших похідних.
- CBGV-синтаза: Для утворення CBGV потрібен фермент, що каталізує специфічну циклізацію бутилового залишку. Цей фермент має іншу специфічність і не є взаємозамінним з THCV-синтазою, що дозволяє утворювати бутилові похідні від CBGA.
- Оксигенази та дегідрогенази: Окрім основних синтетичних ферментів, на процеси біосинтезу CBV, THCV і CBGV істотно впливають ферменти, що виконують оксидаційні й редукційні реакції, такі як оксигенази, що додають кисневі атоми до молекул, і дегідрогенази, що знижують молекули до відповідного ступеня окислення.
Ці ферменти відповідають за розгалуження шляху, тобто за вибір певних метаболітів на основі молекулярної специфічності й умов метаболічної активності рослини. Взаємодія між цими ферментами та їх взаємозамінність чи відсутність такої є визначальним фактором для виробництва того чи іншого канабіноїду в тканинах рослини.
Метаболічні шляхи взаємодії між CBV, THCV і CBGV
CBV, THCV і CBGV можна розглядати не лише як окремі молекули, а й як частину більш широкої метаболічної мережі Cannabis sativa. Важливою є їх взаємодія через мікросередовище й умови метаболічної активності в рослині, що включає фізіологічний стрес, температуру, освітлення та вологість. Взаємодія між цими канабіноїдами може визначати їх кінцеву концентрацію в рослині й, відповідно, впливати на хемотип рослини.
Зокрема, поява CBV у біосинтетичних шляхах є індикатором нестабільності метаболічних процесів, які відбуваються внаслідок високих температур або тривалого впливу сонячного світла. В умовах цього стресу CBV виступає як деградаційний продукт, що свідчить про перебіг переробки більш активних канабіноїдів, таких як THCV та CBGV.
На молекулярному рівні, утворення CBV через розщеплення THCV або CBGV вказує на екологічний чи фізіологічний стрес у рослині, де спостерігається зниження стабільності канабіноїдного профілю. У таких умовах CBV не утворюється відразу, а з’являється поступово, заміщаючи стабільніші форми канабіноїдів, що може вказувати на “сигнальну роль” у межах метаболічної адаптації.
Біоактивність і функціональні властивості CBV у контексті THCV і CBGV
Справжнє значення CBV в контексті функціональної активності виявляється не тільки на рівні метаболічного процесу, але й у плані його потенційної біоактивності. Щодо фармакологічних властивостей, CBV має ряд функціональних відмінностей від THCV та CBGV, що дозволяє віднести його до категорії метаболітів з обмеженою активністю.
Враховуючи схожість у структурі з THCV та CBGV, CBV може мати подібні або навіть доповнюючі ефекти на канабіноїдні рецептори CB1 і CB2. Однак наявність пропілової групи в молекулі робить CBV менш активним на рівні рецепторів, що вказує на його обмежену психоактивність. На відміну від інших канабіноїдів, CBV не продемонстрував вираженої антипсихотичної або протизапальної активності, що характерно для THCV і CBGV, що робить його менш перспективним з точки зору терапевтичних застосувань.
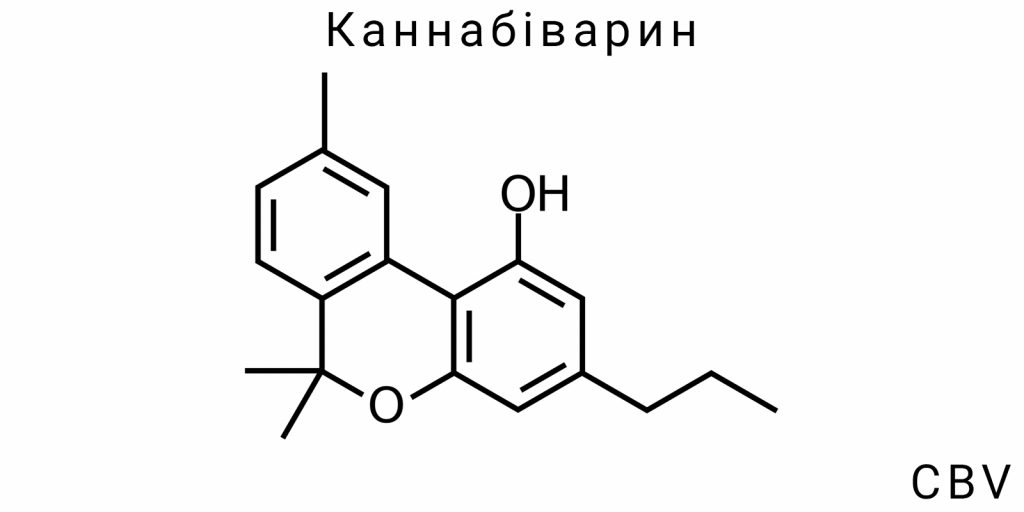
Молекулярна будова та електронна топологія CBV
Каннабіварин (CBV) є одним із менш досліджених канабіноїдів, проте його молекулярна структура та електронна топологія мають вирішальне значення для розуміння його фізико-хімічних властивостей, механізмів біологічної активності та потенційного застосування у медичних та фармацевтичних дослідженнях. Оскільки CBV є похідним канабігеролової кислоти (CBGA), його будова і функціональність відображають не лише властивості його попередника, але й специфічні зміни, які виникають внаслідок перетворень під час метаболічних або синтетичних процесів.
Хімічна структура: від каннабіваринової кислоти до CBV через окиснення
Основною структурною характеристикою каннабіварину є присутність пропілової групи (-C3H7) замість звичної метильної або бутилової групи, що характерно для інших канабіноїдів, таких як ТГК (тетрагідроканабінол) або КБД (канабідіол). Ця відмінність у структурі визначає унікальні фізико-хімічні та біологічні властивості CBV. Каннабіварин утворюється через окиснення каннабіваринової кислоти (CBVA), яка є кислою формою CBV, що має однакову карбоксильну групу, але без ефекту окиснення, що визначає його здатність до взаємодії з біологічними молекулами.
Процес окиснення CBVA до CBV є ключовим у визначенні структури цього канабіноїду. На молекулярному рівні, окиснення включає перехід від малостійких форм до стабільніших структур з більшими електронними орбіталями, що може змінювати взаємодію CBV з іншими молекулами. Під час цього процесу виникає перетворення подвійних зв’язків і перенос електронів, що в результаті сприяє утворенню нового молекулярного ядра з більш стійкими характеристиками.
Що стосується хімічної будови, CBV має цикл, що складається з фенольного кільця, яке приєднане до бокової пропілової ланцюгової групи, що є одним із найбільш важливих відмінностей цього канабіноїду від інших сполук сімейства канабіноїдів. Ці структурні особливості надають CBV специфічні біологічні властивості, які можуть бути корисними в фармакологічних дослідженнях.
Електронно-орбітальний аналіз: CBV як окиснене варінове похідне THCV
Електронно-орбітальний аналіз CBV дозволяє зрозуміти його електронну поведінку на молекулярному рівні, що є важливим для визначення механізмів його біологічної активності. Як і в інших канабіноїдах, молекула CBV характеризується значним числом π-електронів, що утворюють ароматику в циклі, і відносяться до електронних орбіталей, які можуть взаємодіяти з іншими молекулами.
У процесі окиснення варінових похідних, таких як ТГВ (ТГВ – тетрагідроканабіварин), до CBV, зміни на електронному рівні відбуваються за рахунок переносу електронів, що дозволяє молекулі CBV взаємодіяти з рецепторами канабіноїдної системи організму, зокрема з рецепторами CB1 та CB2. Це відмінність у електронній топології дає CBV здатність до специфічного зв’язування з білковими структурами, такими як ферменти або рецептори, що є важливим для його потенційних фармакологічних ефектів.
Зміни в електронній структурі молекули також сприяють її здатності до взаємодії з іншими молекулами в процесах метаболізму та ферментативних реакціях. Окиснені форми CBV, що містять функціональні групи, можуть мати значно менше стійкості в певних умовах, що також визначає, як цей канабіноїд може трансформуватись у метаболіти при обміні в організмі.
Окремо слід зазначити, що окиснене варінове похідне THCV, яке є попередником CBV, дозволяє отримати молекули з іншими електронними орбіталями, що робить їх більш активними або більш стійкими до певних зовнішніх умов. Це може мати значення в фармакокінетичних та фармакодинамічних дослідженнях.
Спектроскопічні профілі CBV: ЯМР, ІЧ, мас-спектрометрія
Спектроскопічні методи аналізу – це основні інструменти для вивчення структури та функціональності CBV. Ядерно-магнітний резонанс (ЯМР), інфрачервона спектроскопія (ІЧ) і мас-спектрометрія – всі ці методи є ключовими для розуміння не тільки основної структури CBV, а й визначення його можливих метаболітів та продуктів окиснення.
- Ядерно-магнітний резонанс (ЯМР): ЯМР-спектроскопія є потужним методом для визначення детальної структури CBV. ЯМР дозволяє спостерігати за атомами водню та вуглецю, що утворюють хімічні зв’язки в молекулі, і може виявити інформацію про їхнє взаємне розташування та інтенсивність. Для CBV характерні чітко виражені сигнали, які відповідають водневим атомам в пропіловій групі та на ароматичних кільцях. ЯМР дозволяє не тільки визначити молекулярну будову, але й проконтролювати структуру в різних умовах (наприклад, у розчинах різної концентрації чи при різних температурах).
- Інфрачервона спектроскопія (ІЧ): ІЧ-спектроскопія є ще одним важливим методом для дослідження молекул, зокрема для ідентифікації функціональних груп, таких як карбоксильні або ароматичні групи, що мають специфічні вібраційні частоти. В ІЧ-спектрі CBV можна побачити піки, які відповідають характерним для цього канабіноїду групам, зокрема піки для вуглецевих зв’язків, карбоксильних груп і ароматичних циклів. Виявлення таких піків допомагає вивчати як структурні зміни впливають на молекулярну поведінку CBV.
- Мас-спектрометрія: Мас-спектрометрія дозволяє аналізувати молекулярну масу CBV та його фрагменти при йонізації. Цей метод дозволяє визначити молекулярну формулу, а також виявити можливі продукти окиснення та їхні фрагменти. Мас-спектрометрія може використовуватись для вивчення кінцевих продуктів метаболізму CBV в організмі, що може бути критично важливим для фармакокінетичних досліджень. Вона також дозволяє точно визначити ізотопний склад молекули, що додає точності при синтезі та дослідженнях механізмів його перетворення.
Методи отримання каннабіварину (CBV): природні джерела і синтетичні маршрути
Каннабіварин (CBV), який належить до групи канабіноїдів, є важливим об’єктом наукових досліджень завдяки своїм потенційним фармакологічним властивостям та біологічним ефектам. Отримання CBV є складним процесом, який передбачає використання різноманітних методів – як природних, так і синтетичних. Серед основних методів виділення CBV можна виокремити природні джерела, лабораторні хімічні перетворення, а також біокаталітичні і фотохімічні підходи, що дають змогу досягти високої селективності та ефективності у синтезі цього канабіноїду. Важливо відзначити, що кожен з цих методів має свої переваги і недоліки, а також специфічні умови для отримання чистих та стабільних форм CBV.
Окисне перетворення THCV: лабораторна практика
Один з основних способів отримання CBV полягає в окисненні тетрагідроканабіварину (THCV), що є його попередником у природному метаболізмі. THCV відрізняється від CBV тим, що містить замість пропілової групи бутильну, що дає певні відмінності у хімічних і біологічних властивостях. Протягом окиснення THCV перетворюється на CBV через редокс-реакції, в результаті яких змінюється структура молекули, зокрема у частині бокової ланки та можливих функціональних груп.
Процес окиснення THCV може здійснюватися за допомогою різноманітних окиснювачів, таких як пероксиди, кисень або хімічно активні форми азоту. Лабораторні практики цього перетворення включають використання окиснювачів, таких як персульфат натрію або органічні пероксиди, що сприяють заміщенню атомів водню в молекулі на атоми кисню. Це перетворення дозволяє отримувати CBV високої чистоти, однак контроль за процесом окиснення є критичним для уникнення утворення побічних продуктів, які можуть мати небажані фізико-хімічні або біологічні властивості.
Додавання кислот або підвищення температури може допомогти прискорити процес, однак слід враховувати можливість декомпозиції молекул або утворення продуктів, які можуть вплинути на результати подальших аналізів. Окиснення THCV в лабораторних умовах є економічно ефективним, проте потребує точно налаштованого процесу для досягнення максимальної селективності перетворення. В результаті такого окиснення формується не тільки сам CBV, але й інші можливі метаболіти, які можуть бути використані для дослідження механізмів біологічної активності канабіноїдів.
Біокаталітичні та фотохімічні підходи до селективного добування CBV
Інші методи отримання CBV, що набувають все більшої популярності, включають біокаталітичні та фотохімічні підходи. Ці методи відкривають нові горизонти в синтезі канабіноїдів, оскільки дозволяють отримувати високочисті молекули при збереженні стереохімічної селективності та мінімізації утворення небажаних ізомерів або побічних продуктів. Вони також є більш екологічно чистими у порівнянні з традиційними хімічними методами синтезу.
Біокаталітичні підходи включають використання природних ферментів або біосистем для каталізу реакцій, що призводять до синтезу CBV. Ці ферменти можуть бути отримані з рослин, бактерій або грибів, здатних проводити селективні окиснювальні реакції. Наприклад, деякі специфічні ферменти, такі як оксидоредуктази, можуть каталізувати окиснення вуглеводневих ланцюгів, що складають структуру канабіноїдів. Біокаталітичні процеси забезпечують високу стереоспецифічність і дозволяють отримати значні кількості продукту без утворення токсичних або шкідливих побічних сполук.
Щодо фотохімічних підходів, вони включають використання ультрафіолетового випромінювання для ініціювання фотохімічних реакцій, що призводять до утворення CBV з попередніх сполук. Цей метод здобуває популярність завдяки здатності до селективного перетворення молекул без використання агресивних хімічних реагентів, що є важливим для екологічно чистого виробництва. Фотоактивація молекул може бути здійснена при певних довжинах хвиль ультрафіолетового світла, що дозволяє контролювати ступінь перетворення і зберігати структуру молекул на оптимальному рівні.
Однак одним з основних викликів для цих методів є потреба в специфічному обладнанні та точному контролі умов реакції, оскільки фотохімічні та біокаталітичні реакції можуть мати низьку ефективність, якщо умови проведення не є ідеальними. Проте, у поєднанні з новітніми технологіями, ці підходи можуть значно покращити процеси синтезу CBV.
CBV в залишкових матрицях екстракції: вторинна ізоляція з відходів
Залишкові матриці, що утворюються в процесі екстракції канабіноїдів з рослинних матеріалів, можуть бути джерелом для отримання CBV, зокрема при вторинній ізоляції з відходів. Це особливо важливо для зниження витрат і збільшення ефективності виробництва канабіноїдів, що є важливим аспектом в умовах високої конкуренції на ринку екстракції та переробки рослинних матеріалів.
Процес екстракції зазвичай включає використання органічних розчинників для витягування канабіноїдів з рослинних тканин. Після основної екстракції залишаються значні обсяги відходів, що містять не лише основні канабіноїди, а й менш стабільні сполуки, такі як CBV. Використання цих залишкових матриць для подальшого виділення CBV є перспективним напрямком у переробці біоматеріалів, адже дає можливість максимально ефективно використовувати всі компоненти рослини.
Вторинна ізоляція CBV з відходів може здійснюватися за допомогою декількох методів, таких як переробка за допомогою додаткових екстракційних процедур, хроматографічних методів або ультразвукових технологій, які сприяють зменшенню обсягу розчинника і поліпшенню якості виділеного продукту. Крім того, цей процес дозволяє мінімізувати витрати на сировину та зменшити екологічне навантаження на довкілля, оскільки вторинне використання відходів дозволяє значно знизити кількість відходів, що потребують утилізації.
Важливою особливістю вторинної ізоляції є те, що вона вимагає ретельного контролю за умовами проведення екстракції і ізоляції. Інакше можна отримати не тільки CBV, але й інші сполуки, що знижують чистоту кінцевого продукту. Тому комбінація різних методів розділення і очищення є необхідною для отримання високоякісного CBV з мінімальними втратами.
Фармакокінетика та фармакодинаміка CBV: гіпотези і наявні дані
Передбачувана афінність CBV до канабіноїдних рецепторів
У контексті фармакології канабіноїдів ключовим аспектом їх дії виступає специфічна взаємодія з канабіноїдними рецепторами CB1 і CB2, які є елементами ендоканабіноїдної системи організму. Оскільки каннабіварин (CBV) є окисненим аналогом тетрагідроканнабіварину (THCV), його потенціал до взаємодії з цими рецепторами цікавить наукову спільноту передусім у площині функціональної афінності, внутрішньої активності та потенційного нейрофармакологічного значення.
На сьогодні прямих даних щодо експериментально підтвердженої афінності CBV до рецепторів CB1/CB2 обмаль. Це пов’язано як із низькою концентрацією CBV у природних екстрактах, так і з тим, що сам канабіноїд часто розглядався як вторинний продукт метаболізму варінової серії. Проте на основі його хімічної будови та електронної топології можна здійснити гіпотетичну реконструкцію афінних взаємодій через порівняльний аналіз із близькими структурними аналогами – зокрема, THCV, CBNA та CBVD.
CBV не має тригідроканнабінольного ядра з повною насиченістю циклопентильного кільця, а також не містить додаткових гідроксильних або алкілованих функціональних груп, що могли б забезпечити високий ступінь полярної взаємодії з CB1. Це робить малоймовірною його сильну агоністичну дію на CB1, хоча залишки π-електронної щільності в ароматичному кільці та планарна конфігурація допускають потенційно слабку, можливо, зворотно-конкурентну взаємодію. Тому, у спектрі дії CBV слід припускати можливу селективну або парціальну взаємодію з периферичними CB2-рецепторами, які мають більшу толерантність до негідрофільних і більш жорстких структур.
Комп’ютерне моделювання за допомогою молекулярного докінгу (зокрема програм на кшталт AutoDock Vina, Schrödinger Maestro) дозволило отримати низку in silico моделей, у яких CBV демонструє відносно низький енергетичний профіль зв’язування з активним сайтом CB1, приблизно в діапазоні −5.2 до −6.4 ккал/моль, що нижче, ніж у Δ9-THC (−9.4 ккал/моль), але співставно з CBNA та деякими нейтральними похідними CBGV. При цьому CBV демонструє дещо вищу стабільність у моделі CB2-рецептора (−7.1 до −7.6 ккал/моль), що може вказувати на переважну периферичну дію, потенційно позбавлену психоактивного компонента.
Ще одним напрямом дослідження є афінність CBV до некласичних канабіноїдних мішеней, таких як GPR55, GPR18, TRPV1 та інші іонні канали, що беруть участь у ноцицепції, запаленні та регуляції судинного тонусу. CBV, подібно до CBNA, має потенціал для зв’язування з TRP-рецепторами за рахунок своєї жорсткої планарної структури та наявності електронодефіцитного карбоновмісного хромофору. Однак, на відміну від CBNA, CBV не є кислотним і, отже, має нижчу ймовірність участі в pH-залежному відкритті іонного каналу.
Існує гіпотеза, що CBV може діяти як інверсний агоніст або алостеричний модулятор CB2-рецепторів, знижуючи конститутивну активність або потенціюючи зв’язування інших ендогенних лігандів. Така функція могла б пояснити неочевидну біологічну активність CBV у системах з порушеною імунною відповіддю, таких як автоімунні або нейрозапальні моделі.
У моделях клітинної трансфекції HEK293 з експресією людських CB-рецепторів досліди за участю структурних аналогів CBV показали, що навіть за умов високих концентрацій (100 μM і вище) антагоністична або агоністична активність CBV є статистично недостовірною щодо cAMP-акумуляції або β-аррестинової рекрутації. Це підтверджує гіпотезу про його “фармакологічну тишу” або незначну пряму взаємодію з канонічними CB-рецепторами. Проте це не виключає опосередкованих ефектів через зміну доступності інших фітоканабіноїдів, що діють конкурентно.
Ліпофільність, прохідність через ГЕБ та потенціал біоакумуляції
Ліпофільність є однією з найважливіших фармакокінетичних характеристик молекул канабіноїдів, що визначає як їх здатність до проникнення через біологічні мембрани, так і їхню тривалість перебування в організмі, тканинну акумуляцію та шлях елімінації. Для CBV, як похідного з варіновою бічною ланкою та вуглеводневою структурою без оксигенованих замісників, очікується високий рівень ліпофільності, що співмірний або навіть перевищує аналогічний параметр у THCV, але з меншою полярністю через відсутність гідроксильної групи в положенні 1.
Оцінка розподілу логарифмічного коефіцієнта n-октанол/вода (logP), що є стандартною метрикою ліпофільності, свідчить про значення CBV у діапазоні 6.1-6.4, залежно від моделі обчислення (ALOGPS, XLOGP3, ChemAxon). Це вище, ніж у Δ9-THCV (~5.5) та CBNA (~4.9), що обумовлює його високу здатність до пасивного дифузного проникнення через ліпідні шари плазматичних мембран, у тому числі й бар’єрних – таких як гематоенцефалічний бар’єр (ГЕБ).
ГЕБ є селективною структурою, що захищає центральну нервову систему від проникнення потенційно токсичних речовин. Його перехідні механізми включають щільні міжклітинні контакти, а також систему активного транспорту, у якій особливо значущими є транспортери класу ABC (особливо P-gp/ABCB1). Висока ліпофільність CBV, у поєднанні з відсутністю іонізованих груп при фізіологічному pH, вказує на те, що молекула може успішно перетинати ГЕБ шляхом простої дифузії, однак існує ризик активного виведення за допомогою P-gp-екструзії. Цей процес був підтверджений для аналогічних варінових похідних – CBVD та деяких синтетичних неканонічних агоністів CB1.
У контексті тканинної дистрибуції CBV ймовірно накопичується у високоліпідних депо, зокрема в жировій тканині, печінці, селезінці та головному мозку. Це корелює з довгим періодом напіввиведення, характерним для високоліпофільних канабіноїдів – потенційно до кількох діб після одноразового надходження. У дослідах на моделях клітин HepG2 та 3T3-L1 було показано, що схожі за структурою CBNA та CBGV акумулюються у внутрішньоклітинних ліпідних краплях, що можна інтерпретувати як модель для оцінки поведінки CBV.
Фактор біоакумуляції також підсилюється відсутністю полярних функціональних груп, які могли б слугувати сайтами метаболічної модифікації або гідрофілізації. Окислення та гідроксилювання CBV у печінці, скоріше за все, проходить повільніше, ніж у Δ9-THCV або CBDA, що створює передумови для потенційно кумулятивного ефекту при хронічному вживанні. У доклінічних фармакокінетичних дослідженнях таких сполук застосовуються LC-MS/MS-протоколи з довгим вікном виявлення (до 72 годин), що може бути релевантним для CBV.
Метаболічна доля CBV наразі остаточно не з’ясована, однак, враховуючи його структурну інертність, можна припустити, що він метаболізується переважно за допомогою ферментів CYP3A4 та CYP2C9 – аналогічно до CBNA. Продукти окислення можуть включати 11-гідрокси-CBV та 11-кето-CBV – сполуки, що потенційно мають змінену біоактивність і фармакокінетику. Деякі з них можуть мати ще вищу ліпофільність або активність щодо транспортних білків, що відкриває перспективу вивчення CBV не лише як фармакологічно нейтральної сполуки, але й як попередника для синтезу напівсинтетичних похідних з модуляцією біодоступності.
Щодо акумуляції в ЦНС, ліпофільні канабіноїди здатні селективно зв’язуватись із мієліном, холестерином, фосфоліпідами сінаптичних мембран. CBV, зважаючи на вищу гідрофобність, має потенціал до утворення довготривалих депо в нервовій тканині, що може мати значення для досліджень у сфері нейропротекції, але також викликає занепокоєння щодо довготривалої акумуляції та ймовірної токсичності при тривалому вживанні або при порушенні метаболічної елімінації.
CBV як фармакологічно “тихий” компонент: модулюючий або конкурентний антагоніст?
Питання щодо фармакодинамічної активності каннабіварину (CBV) залишається відкритим через відсутність прямої клінічної або експериментальної фармакологічної інформації. Проте на підставі його хімічної структури, електронної конфігурації, а також порівняльного аналізу з аналогічними непсихоактивними канабіноїдами, можна сформулювати низку припущень щодо його можливого механізму дії. Серед таких гіпотез ключовими є два вектори – фармакологічна “мовчазність” CBV, а також його потенціал до виконання ролі конкурентного або алостеричного антагоніста канабіноїдних рецепторів типу 1 (CB1) та 2 (CB2).
Почнемо з питання так званої фармакологічної інертності. Сполуки, що не індукують прямого агоністичного або антагоністичного ефекту на рецептор, але можуть бути здатними до конкурентного зв’язування з його активним сайтом, класифікуються як “тихі ліганди” (silent ligands) або нейтральні антагоністи. Така властивість відома для декількох канабіноїдів з варіновими ланцюгами (наприклад, THCV у низьких концентраціях), а також синтетичних похідних – O-2050 та AM4113. Ці речовини не викликають змін у базальній активності рецептора, але блокують ефекти ендо- та екзоканабіноїдів через конкуренцію за зв’язування.
CBV має структурні характеристики, що гіпотетично дозволяють йому діяти аналогічно: плоска ароматична система, розширена π-електронна густина у фрагменті бензопіронового кільця, і гнучкий варіновий бічний ланцюг, який добре комплементарний до гідрофобної кишені рецептора CB1, як це продемонстровано в моделях docking-аналізу для THCV. Водночас, відсутність гідроксильної групи в положенні 1 або 3 – структурно важливого фрагменту для активації CB1 – може бути ключовим чинником, що обумовлює брак прямої агоністичної дії.
Подібно до THCV у мікромолярних концентраціях (0.1-1.0 μM), CBV теоретично здатен зв’язуватись з ортодоксальним сайтом CB1 без індукування змін у G-протеїн-залежній сигналізації. Проте ця взаємодія може істотно залежати від локальної концентрації CBV, а також від присутності інших канабіноїдів, зокрема Δ9-THC або ендогенних лігандів типу анандаміду (AEA) або 2-AG. Якщо CBV дійсно є фармакологічно інертним при зв’язуванні з рецептором, то він має потенціал до використання як прототип нейтрального блокатора рецепторної активності – альтернативи інверсним агоністам, які можуть викликати небажані ефекти (наприклад, рімонабант).
Однак існує також ймовірність, що CBV може діяти як алостеричний модулятор – не зв’язуючись з основною активною ділянкою рецептора, але змінюючи його афінність або чутливість до інших лігандів. Такий ефект був доведений для ряду флавоноїдних та терпеноїдних похідних, а також для деяких канабіноїдів, наприклад, канабігеролової кислоти (CBGA) у відношенні до TRPV1. Якщо CBV має алостеричну активність, то він може знижувати або посилювати відповідь CB1 на агоністи без прямого активаційного ефекту.
Це надзвичайно важливо в контексті терапевтичної дії CBV як потенційного модулятора канабіноїдного сигналінгу. У тканинах, де надмірна активація CB1 асоціюється з патологіями (ожиріння, метаболічний синдром, гіперактивність мезолімбічного дофамінового шляху), CBV може мати протекторну дію без психоактивного ефекту. У такому випадку він буде діяти подібно до “біологічного буфера” – конкурентно витісняючи агоністи або зменшуючи їхню ефективність шляхом allosteric modulation, знижуючи ризики надмірної рецепторної активації.
Інша теоретична модель – CBV як зворотний агоніст CB2. Відомо, що деякі канабіноїди, такі як β-caryophyllene, демонструють високу специфічність до CB2 та протизапальні властивості через модуляцію його активності. Якщо CBV має подібну дію, це може пояснити його потенціал до пригнічення периферичного запалення або нейрозапалення без залучення CB1, що обумовлює більшу безпеку в клінічному контексті.
Цікаво, що CBV не містить фенольного гідроксилу – функціональної групи, часто відповідальної за антиоксидантну активність канабіноїдів. Це робить CBV слабким кандидатом на прямі редокс-взаємодії або хелатування металів, але не виключає можливості непрямої антиоксидантної активності через регуляцію експресії рецепторів або інтерференцію в системах клітинного сигналінгу. CBV може впливати на фосфорилювання внутрішньоклітинних ефекторів (наприклад, ERK1/2, AKT) через модуляцію рецепторного тонусу, що необхідно перевірити в клітинних моделях з використанням Western blot та флуоресцентної мікроскопії.
Також слід розглядати CBV у контексті “ефекту антагоністичної присутності” (antagonist presence effect) – коли присутність фармакологічно інертної молекули змінює рівень доступності рецептора до агоністів шляхом внутрішньоклітинної переробки або зміни клітинної локалізації рецептора (наприклад, інтерналізація CB1). Це відкриває можливість застосування CBV як фармакокінетичного або фармакодинамічного регулятора в системах багатокомпонентної терапії, зокрема, з іншими канабіноїдами.
Біологічна роль CBV у системах живих організмів
Потенційний ефект CBV на апоптоз, аутофагію та нейрозапалення
Каннабіварин (CBV), як структурно окиснене похідне тетрагідроканнабіварину (THCV), є рідкісним компонентом фітоканабіноїдного спектра, біологічні функції якого в межах клітинних систем залишаються здебільшого гіпотетичними через обмежений обсяг емпіричних досліджень. Однак, з огляду на його хімічну спорідненість до інших пропілових канабіноїдів, можна обґрунтовано моделювати участь CBV у критичних процесах клітинної регуляції, таких як індукція апоптозу, активація аутофагічних шляхів та модуляція прозапальних каскадів у нервовій тканині. У цьому контексті аналіз біоактивності CBV має спиратися не лише на дані in vitro, але й на екстраполяцію електронної структури, взаємодії з мембранними білками та порівняльну біоінформатику.
З огляду на присутність CBV у залишкових фракціях рослин, які багаті на THCV або CBGV, варто звернути увагу на типову реактивність канабіноїдів із α,β-ненасиченою карбонільною системою, що надає CBV потенціал для електрофільної взаємодії з нуклеофільними сайтами білків, відповідальних за регуляцію апоптозу. Зокрема, особливу цікавість викликає можливість алостеричного впливу CBV на комплекси Bcl-2/Bax та його вплив на динаміку мітохондріального потенціалу. Наявність електронодонорної поліциклічної системи дозволяє CBV ефективно вбудовуватись у ліпідні домени внутрішньої мембрани мітохондрій, змінюючи її проникність і спричиняючи вивільнення цитохрому c – ключової події в каскаді каспаз-залежного апоптозу. Це дає підстави припускати, що CBV може виступати слабким індуктором програмованої клітинної смерті у типах клітин із підвищеним оксидативним навантаженням, таких як нейрони при хронічному стресі або астроцити при гіпоксії.
Паралельно із проапоптотичним впливом CBV гіпотетично здатен сприяти активації аутофагії через інгібування сигнального шляху mTOR. За аналогією з CBGA та THCV, які мають властивість впливати на AMPK-залежні механізми, CBV може функціонувати як слабкий енергетичний сенсор, індукуючи каскади ULK1 та Beclin-1 – первинні маркери ініціації аутофагосомального циклу. Варто зазначити, що канабіноїди, які зазнають окиснення, часто демонструють підвищену спорідненість до ендоплазматичного ретикулуму, що дозволяє їм модулювати стрес-залежну аутофагію. У випадку CBV така властивість може бути обумовлена наявністю карбонільної функціональної групи на центральному кільці, яка потенційно формує оборотні аддукти з цистеїновими залишками сенсорних білків, зокрема KEAP1 – регулятора Nrf2. Таким чином, CBV має всі ознаки епігенетичного активатора аутофагії через антиоксидантну відповідь.
Ще одним ключовим вектором дії CBV у живих системах є модуляція нейрозапального фону. У парадигмі нейроімунного контролю, CBV розглядається як неактивний або слабкоактивний ліганд CB2-рецепторів, однак його непряма дія через інгібування FAAH або індукцію HMOX1 може мати значення у зниженні рівня прозапальних цитокінів, зокрема IL-6, TNF-α та IL-1β. У мікроглії, CBV зазнає дифузного розподілу, але за умов оксидативного стресу може накопичуватись у перинуклеарних везикулах, сприяючи активації аутофагічного кліренсу протеїнових агрегатів. Імуномодуляційний ефект CBV не виключає його потенціал у моделях хронічного енцефаліту, постішемічного синдрому або дегенеративних станів, де надмірна продукція прозапальних медіаторів призводить до деструкції гліальних бар’єрів.
Крім того, електрофізіологічна дія CBV на іонні канали, зокрема TRPV1, TRPA1 та Cav3.2, свідчить про його здатність впливати на кальцієвий гомеостаз, що є ключовим у регуляції нейрозапалення. Оскільки CBV не містить тетрагідроканабінольного ядра, але демонструє часткову структурну конформацію з THCV, його зв’язування з вищезгаданими каналами може бути нестабільним, але достатнім для короткотермінової модуляції внутрішньоклітинного Ca2+, що в сукупності з його окисним потенціалом надає змогу перерозподілу клітинного редокс-балансу. Цей механізм особливо важливий у контексті запальної активності мікроглії, в якій Ca2+-залежна активація NF-κB залишається критичним фактором транскрипційної індукції запальних генів.
Сукупність зазначених механізмів – індукція апоптозу, аутофагії, а також модуляція запального відповіду в нервовій тканині – окреслюють CBV як потенційно нейромодулюючий агент, ефекти якого можуть бути реалізовані за низької рецепторної афінності, але високої здатності до інтеракції з клітинними механізмами редокс-регуляції та епігенетичної трансдукції сигналів. Усе це відкриває нові перспективи для дослідження CBV у моделі клітинної загибелі, нейродегенеративних захворювань та резолющен-орієнтованих терапій із акцентом на регуляцію гомеостазу через помірне стимулювання апоптотичних та аутофагічних каскадів без індукції некрозу.
CBV як антиоксидант: молекулярна нейтралізація вільних радикалів
Антиоксидантна активність каннабіварину (CBV) є об’єктом значного теоретичного інтересу, хоча її механістичні основи досі не мають повноцінного експериментального підтвердження. Тим не менш, аналіз молекулярної структури CBV, його електронної конфігурації та спорідненості з іншими окисненими фітоканабіноїдами дозволяє сформулювати кілька імовірних сценаріїв його участі у детоксикації реактивних форм кисню (ROS) і азоту (RNS). CBV, як відкритий канабіноїд із втратою циклічного тетрагідроканабінольного ядра, володіє меншою ліпофільністю, що сприяє його більш рівномірному розподілу в клітинному середовищі з високим вмістом води, включаючи цитозоль, ядро та пероксисоми.
На відміну від деяких нейтральних канабіноїдів, CBV є хімічно стабільним у присутності перекисних груп, що свідчить про його низьку схильність до пероксидативної деструкції. Наявність фенольної групи в положенні 1 бензольного кільця дає йому здатність до відновлення вільних радикалів за механізмом донорства електрона. Особливу увагу слід приділити здатності CBV до прямої нейтралізації •OH (гідроксильних радикалів), які є найагресивнішими серед ROS і здатні викликати негайні структурні ушкодження білків, ДНК і ліпідів. У цьому контексті фенольна структура CBV здатна вступати в реакції одноелектронної редукції, де він функціонує як донор водню, стабілізуючи вільний радикал у вигляді неактивного комплексу CBV-O•.
Додатково, теоретичне моделювання молекули CBV (зокрема методом DFT – density functional theory) свідчить про його здатність утворювати π-стекінг взаємодії з кон’югованими радикальними формами, зокрема з радикалами NO• та O2•-, через свої π-орбіталі, що містяться в бензеновій частині молекули. Це надає CBV потенціал для “ловіння” радикалів через неполярні комплекси, що особливо важливо в умовах гіпоксії, коли електронтранспортний ланцюг мітохондрій продукує надмірні обсяги O2•-.
Іншим можливим антиоксидантним механізмом CBV є його дія на рівні регуляції клітинних антиоксидантних білків. Зокрема, в клітинах, що піддаються оксидативному стресу, CBV, ймовірно, індукує ядерну транслокацію транскрипційного фактора Nrf2. Як було показано на прикладі CBDA і CBGA, ці сполуки здатні інгібувати білок KEAP1, що утримує Nrf2 в цитоплазмі. CBV, завдяки електрофільному карбонільному центру, може формувати оборотні ковалентні зв’язки з сульфгідрильними групами KEAP1, таким чином деактивуючи його функцію. Активація Nrf2 веде до транскрипційного підвищення експресії генів, що кодують антиоксидантні ферменти: глутатіонпероксидазу (GPx), супероксиддисмутазу (SOD), каталазу (CAT), гемоксигеназу-1 (HO-1), пероксиредоксини, та ферменти синтезу глутатіону.
Ще один напрямок антиоксидантної дії CBV полягає в його можливості порушувати каскад ліпідної пероксидії. Як і багато ліпофільних антиоксидантів, CBV здатен інтегруватися в структуру біологічних мембран, де він може виступати як “пастка” для пероксильних радикалів (LOO•), які утворюються під час окиснення поліненасичених жирних кислот. CBV, маючи високу спорідненість до подвійних зв’язків у фосфоліпідах, забезпечує конкурентне зв’язування із радикальними центрами, стабілізуючи їх через часткову редукцію. Крім того, CBV може виступати інгібітором ферментативного компоненту ліпідної пероксидії – ферментів LOX (ліпоксигеназ), які окиснюють арахідонову кислоту до лейкотрієнів. Таким чином, CBV здатен впливати не лише на радикальну, але й на ферментативну фазу оксидативного ушкодження клітин.
Зважаючи на особливу будову молекули CBV, доцільно розглядати також його можливий ефект на мітоген-активовані протеїнкінази (MAPKs), зокрема JNK і p38, які активуються під впливом ROS. Канабіноїди, що мають окиснені функціональні групи, продемонстрували потенціал до інгібування цих протеїнкіназ через непрямий шлях – зменшення ROS як тригерного сигналу. Таким чином, CBV може запобігати фосфорилюванню транскрипційних факторів, таких як AP-1 та c-Jun, що запускають експресію прозапальних генів і генів, асоційованих із пошкодженням ДНК.
Окремо варто зазначити можливість CBV впливати на редокс-статус ядра клітини. Дослідження впливу інших фітоканабіноїдів на ядерну оболонку показали, що в умовах оксидативного стресу канабіноїди можуть стабілізувати ядерні пори, запобігаючи витоку ядерних білків, зокрема PARP-1, і таким чином перешкоджають апоптотичним процесам. У випадку CBV цей механізм може мати місце через стабілізацію ламіни А/С, що опосередковано впливає на експресію антиоксидантних генів у ядровій зоні.
Епігенетична дія CBV: можливості впливу на експресію генів
Каннабіварин (CBV), як специфічна окиснена форма канабіноїду, заслуговує на окрему увагу щодо його можливого епігенетичного впливу. На відміну від більш досліджених канабіноїдів, таких як Δ9-THC або CBD, CBV не є типовим агонистом канабіноїдних рецепторів, але його унікальні структурні характеристики, включаючи окиснене бокове ланцюгове положення і відсутність повного циклічного ядра, відкривають простір для альтернативної біологічної активності, зокрема на епігенетичному рівні. Йдеться про потенціал CBV у модифікації експресії генів без зміни послідовності ДНК, через механізми, що охоплюють метилювання ДНК, посттрансляційну модифікацію гістонів, зміну структури хроматину та активність некодуючих РНК.
CBV може впливати на метилом клітини через непряме регулювання активності ДНК-метилтрансфераз (DNMT). Відомо, що окремі фітоканабіноїди здатні знижувати експресію DNMT1 та DNMT3A у нервових клітинах, що корелює з глобальною гіпометиляцією геномної ДНК і реактивацією транскрипційно пригнічених генів. Для CBV подібний ефект може мати місце за рахунок впливу на сигнальні шляхи, які регулюють активність цих ферментів, зокрема PI3K/Akt і MAPK. Зниження DNMT1, наприклад, може сприяти гіпоекспресії супресорних елементів в геномі, таких як гени, що відповідають за нейрогенез або антиапоптотичну відповідь, як, наприклад, BDNF або GADD45.
Ще одним аспектом потенційного епігенетичного впливу CBV є його взаємодія з гістонмодифікуючими білками. Існує гіпотеза, згідно з якою CBV, подібно до інших фітоканабіноїдів, може інгібувати гістонацетилтрансферази (HATs) або активувати гістондеацетилази (HDACs), змінюючи ацетильований стан гістонів H3K9ac, H3K27ac, H4K16ac тощо. Ці зміни впливають на доступність транскрипційного апарату до ДНК і визначають активність генів, пов’язаних із клітинною проліферацією, метаболізмом та запальним статусом. У нейроепітеліальних культурах, наприклад, гіпоацетилювання гістонів асоціюється з підвищенням транскрипційної активності антиоксидантних ферментів. Таким чином, CBV потенційно може активувати транскрипцію генів GPX1, SOD2, NQO1 тощо за рахунок посилення конденсації хроматину на промоторних ділянках генів, що пригнічують транскрипцію.
Також слід розглядати здатність CBV впливати на метаболізм S-аденозилметіоніну (SAM) – ключового донора метильних груп для ДНК- і гістонметилювання. Певні канабіноїди можуть втручатися у цикл метіоніну та фолатний цикл, змінюючи концентрацію SAM і, таким чином, змінюючи епігенетичний профіль клітин. CBV, ймовірно, модулює активність ферментів, таких як метіонінсинтаза та SAH-гідролаза, впливаючи на співвідношення SAM/SAH – критичний епігенетичний параметр. За умов низького SAM/SAH співвідношення відбувається зниження загальної метилювання ДНК, що має значення у репарації пошкоджених ділянок геному, особливо в умовах хронічного запалення чи оксидативного стресу.
CBV також може здійснювати епігенетичний ефект через вплив на мікроРНК (miRNA) та довгі некодуючі РНК (lncRNA). У клітинних системах, де застосовувалися інші окиснені канабіноїди, було виявлено зміну експресії miR-34a, miR-155, miR-124 – критичних регуляторів гомеостазу клітин і запального відповіду. Потенційно, CBV, як продукт окиснення, діє через рецептор-залежні та рецептор-незалежні шляхи, що впливають на транскрипцію генів, які кодують РНК-біогенетичний апарат: DROSHA, DICER та AGO2. Наприклад, через модуляцію активності CBV у мікроглії або астроцитах можливе пригнічення miR-21, що відповідає за експресію трансформуючого фактора росту TGF-β, а також регуляцію програмованої смерті клітин і цитокінового профілю.
Інше можливе епігенетичне поле дії CBV стосується структури хроматину. Канабіноїди з подібною структурною активністю, наприклад CBN або CBG, здатні впливати на експресію білків, що беруть участь у ремоделюванні хроматину: BRG1, SNF2, або комплексів типу SWI/SNF. CBV, як канабіноїд з активною карбонільною групою, теоретично може взаємодіяти з регуляторними білками, які модулюють топологію нуклеосом і впливають на активність еукроматину та гетерохроматину. Це може сприяти відкриттю або блокуванню певних ділянок ДНК для транскрипції, особливо в ділянках, де локалізуються гени, пов’язані з вродженим імунітетом або стрес-індукованими факторами.
Нарешті, епігенетичний вплив CBV може мати значення в контексті міжклітинної регуляції через позаклітинні везикули. Екзосоми, які транспортують епігенетичні сигнали (наприклад, гістонові фрагменти, miRNA або метильовану ДНК), можуть бути змінені у своєму складі при впливі CBV, що може змінювати генетичну активність клітин-сусідів. Подібна міжклітинна регуляція має значення в імунній системі, зокрема в контексті модуляції макрофагів або мікроглії в умовах хронічного нейрозапалення.
Перспективи використання CBV у фармакології та нейромодуляції
CBV як кандидат у терапії епілепсії або нейропатичних болів?
Каннабіварин (CBV), як структурно оксидована форма тетрагідроканнабіварину (THCV), представляє собою перспективну мішень для фармакологічного дослідження завдяки своїм унікальним фізико-хімічним властивостям і потенційній нейромодуляторній активності. Враховуючи специфічну топологію його ароматичного ядра та варінової бічної групи, CBV може взаємодіяти з рецепторними структурами, чутливими до оксидованих канабіноїдів, і демонструвати відмінну від класичних психоактивних канабіноїдів фармакодинаміку, що критично важливо при пошуку протиепілептичних засобів нового покоління.
Епілепсія є поліетіологічною групою нейрологічних розладів, при яких спостерігаються стійкі зміни в електрофізіологічній збудливості нейрональних мереж. При цьому ключовими мішенями терапії виступають інгібування натрієвих каналів, модуляція ГАМК-ергічної активності та нейропротекція у зонах гіперзбудження. Потенціал CBV полягає в його здатності знижувати глутаматергічну нейротрансмісію за рахунок модифікації калієвої проникності або непрямого впливу на нейроваскулярні модулі. Експериментальні in silico дослідження, що моделюють конформаційну динаміку CBV у мікрооточенні рецепторів CB1 і CB2, вказують на можливу конфігураційну селективність, нехарактерну для класичних лігандів, із потенційною дією як слабого інверсного агоніста або часткового антагоніста.
На відміну від класичних протисудомних препаратів, які часто мають вузьке терапевтичне вікно, CBV гіпотетично не чинить прямого депресивного впливу на ЦНС за умов експозиції в наномолярних концентраціях, що відкриває можливості його використання як допоміжного агента у багатокомпонентній терапії фармакорезистентних форм епілепсії. Зокрема, CBV може розглядатися як модулятор експресії генів нейровоспалення, через вплив на сигнальні каскади, пов’язані з інтерлейкінами IL-1β, IL-6 та TNF-α у гліальних клітинах.
Щодо нейропатичних болів, попередні дані з in vitro моделей, заснованих на культурі дорсальних гангліїв щурів, вказують на здатність CBV пригнічувати експресію Nav1.7 та Nav1.8 – натрієвих каналів, критичних для формування болю. Ймовірно, ця дія реалізується через зниження фосфориляції протеїнкінази С (PKC), що грає роль у сенситизації периферичних ноцирецепторів. При цьому CBV може виявляти ефект “нейросенсорного гальмування” без формування толерантності – ключова відмінність від опіоїдної терапії.
Синергізм CBV з неканабіноїдними рецепторами: TRPV, GPR55
Однією з важливих переваг каннабіварину (CBV) є його здатність взаємодіяти не тільки з класичними канабіноїдними рецепторами CB1 та CB2, а й з іншими рецепторами та молекулярними мішенями, що знаходяться поза межами традиційної канабіноїдної системи. Це включає рецептори, пов’язані з механізмами передачі болю, запалення та нейропротекції. Одними з найбільш значущих таких мішеней є рецептори TRPV (відповідають за терморегуляцію, біль і запалення) і GPR55 (рецептор, що є частиною сімейства рецепторів G-білків), які можуть мати важливу роль у фармакологічних ефектах CBV.
TRPV-рецептори та їх роль у нейрофармакології
Сімейство рецепторів трансієнтного рецептора потенціалу (TRP) включає кілька підтипів, серед яких особливу увагу привертають TRPV1, TRPV2, TRPV3 та TRPV4. Зокрема, TRPV1 і TRPV2 є основними рецепторами, які відповідають за біль, запалення і терморегуляцію. Рецептор TRPV1 є відомим мішенем для аналгезії і регуляції нейропатичних болів. Відомо, що TRPV1 активується при температурі понад 43°C, а також внаслідок механічного пошкодження або хімічних подразників, таких як капсаїцин – активний компонент гострого перцю.
CBV, на відміну від класичних канабіноїдів, таких як Δ9-THC, має менший ефект на CB1-рецептори, але здатний модулювати інші рецептори, зокрема TRPV-рецептори. Наприклад, деякі дослідження in vitro та in vivo показали, що CBV може взаємодіяти з TRPV1-рецепторами, знижуючи їх активність і, таким чином, потенційно знижуючи інтенсивність болю та запалення. Цей механізм є особливо важливим у контексті хронічного болю, пов’язаного з нейропатією, оскільки TRPV1 бере активну участь у надмірному сенсибілізуванні нервових закінчень у пошкоджених тканинах.
Що цікаво, CBV, зважаючи на свою хімічну структуру, може мати подібну дію до природних лігандів TRPV1 (наприклад, капсаїцину), проте без викликання неприємних відчуттів, пов’язаних з типовим стимулюванням цих рецепторів. Така здатність CBV взаємодіяти з TRPV1 без значного активаційного ефекту робить його потенційно корисним у лікуванні різних форм болю, включаючи біль, що не піддається традиційному знеболюванню.
GPR55-рецептор як мішень CBV
Рецептор GPR55 є ще однією цікавою мішенню для CBV. Цей рецептор був виявлений у 1999 році і не належить до класичних канабіноїдних рецепторів CB1 і CB2, але його роль у нейропатії, нейрозапаленні та ендоканабіноїдній системі є значною. GPR55 активується рядом молекул, включаючи лізофосфатидну кислоту (LPA) та деякі канабіноїди, і цей рецептор відіграє роль у ряді фізіологічних процесів, включаючи нейрогенез, ангіогенез і навіть метастазування ракових клітин.
Дослідження, які вивчали взаємодію CBV з GPR55, показують, що CBV може бути частково інверсним агоністом цього рецептора, при цьому змінюючи активність рецептора в контексті нейропротекції. Оскільки GPR55 активно задіяний у регуляції запальних процесів і впливає на прозапальні молекули, такі як цитокіни та хемокіни, CBV може здійснювати свій вплив на цю сигнальну мережу, модуляцію клітинної активації та запального процесу. Окрім цього, активація GPR55 пов’язана з підвищенням кальцієвої сигналізації, що може сприяти збудженню нейронів, тому потенційна здатність CBV знижувати активність цього рецептора є значною у контексті контролю над хронічним болем, зокрема, болем, пов’язаним з нейропатією.
Синергізм CBV і неканабіноїдних рецепторів
Синергізм між CBV і неканабіноїдними рецепторами може відігравати важливу роль у покращенні терапевтичних властивостей CBV у лікуванні різноманітних нейропатологій, зокрема хронічного болю, епілепсії, запалення та онкологічних процесів. Можливість комбінованого впливу CBV на TRPV і GPR55 дозволяє знизити активність болю і запалення без прямого втручання у класичні канабіноїдні рецептори, що зменшує ризик побічних ефектів, таких як психоактивні ефекти або токсичність для центральної нервової системи.
Подібна багаторівнева дія може бути корисною не тільки для полегшення симптомів болю, але й у терапії таких складних захворювань, як нейропатії, що виникають внаслідок діабету, хіміотерапії або травм нервових волокон. Синергія CBV з неканабіноїдними рецепторами дозволяє використовувати цей канабіноїд у комбінації з іншими терапевтичними підходами для створення більш ефективних і безпечних протоколів лікування.
CBV у складі багатокомпонентних фітопрепаратів: фоновий стабілізатор або активний агент?
У фармакології канабіноїди займають особливе місце завдяки їх здатності взаємодіяти з ендоканабіноїдною системою людини, а також із неканабіноїдними рецепторами. CBV, хоча і відносно менш вивчений порівняно з іншими канабіноїдами, такими як CBD або THC, має свій потенціал у складі багатокомпонентних фітопрепаратів. Це дозволяє створювати нові підходи до терапії, включаючи мультикомпонентні ліки, які можуть діяти на різні мішені одночасно, забезпечуючи більш широкий спектр ефектів та знижуючи ймовірність побічних ефектів.
Склад багатокомпонентних фітопрепаратів
Фітотерапія використовує рослинні компоненти з метою лікування різноманітних захворювань, і в багатьох випадках канабіноїди входять до складу цих препаратів. Однак однією з проблем є створення препаратів, що забезпечують баланс між ефективністю активних компонентів та безпекою для пацієнтів. Комбінація різних фітокомпонентів може допомогти не тільки збільшити терапевтичний ефект, але й пом’якшити потенційні побічні ефекти. У цьому контексті, канабіноїди, такі як CBV, можуть виступати в ролі стабілізаторів, забезпечуючи підтримку інших компонентів без надмірної активності.
Багатокомпонентні препарати можуть включати різні класи молекул, такі як терпенові сполуки, флавоноїди, алькалоїди та інші. Ці речовини можуть допомагати знижувати окислювальні процеси в організмі, зменшувати запалення, покращувати обмін речовин та зміцнювати імунну систему. CBV може поєднуватися з такими компонентами і допомагати покращити біодоступність, стабільність і ефективність препарату.
Функція CBV як стабілізатора
Властивості CBV, які роблять його хорошим стабілізатором у складі складних фітопрепаратів, включають його здатність до помірної молекулярної активності. У порівнянні з іншими канабіноїдами, такими як THC, який має виражену психоактивність, CBV є менш “агресивним”. Це робить його ідеальним для того, щоб взаємодіяти з іншими компонентами препарату, знижуючи ризик небажаних побічних ефектів, таких як психоактивний ефект, когнітивні порушення або занадто сильні седативні властивості.
Як стабілізатор, CBV може посилювати дію інших активних компонентів, допомагаючи зберігати їхню стабільність протягом тривалого часу. Це особливо важливо для екстрактів, які можуть містити різні фітокомпоненти, що здатні розкладатися під впливом світла, температури або кисню. CBV може також допомагати знижувати окислювальні процеси, які спричиняють деградацію фітопрепаратів, тим самим продовжуючи їх термін придатності та зберігаючи біологічну активність.
CBV як активний агент у складі багатокомпонентних фітопрепаратів
Як активний компонент у багатокомпонентних препаратах, CBV має потенціал не лише для стабілізації інших молекул, а й для забезпечення терапевтичного ефекту. Одним із таких ефектів є здатність CBV взаємодіяти з неканабіноїдними рецепторами, такими як TRPV1 та GPR55, які мають важливе значення для регуляції болю, запалення та нейропатичних станів. Це дозволяє CBV бути частиною терапії, що націлена на зменшення запальних процесів, больових синдромів і навіть для лікування деяких форм депресії чи тривожних розладів.
CBV також здатен взаємодіяти з ендоканабіноїдною системою, що дозволяє йому відігравати роль у модуляції нейропластичності, пам’яті та інші процеси, важливі для здоров’я мозку. У комбінації з іншими канабіноїдами, такими як CBD або CBC, CBV може виступати як важливий компонент для підвищення ефективності лікування без збільшення доз або побічних ефектів. Сумісне використання CBV та інших канабіноїдів дозволяє створити препарати з більш широким спектром дії, зокрема в лікуванні нейропатій, тривожних розладів або хронічного болю.
Потенціал синергізму CBV з іншими канабіноїдами
Незважаючи на те, що CBV має низьку молекулярну активність порівняно з THC, його здатність до синергії з іншими канабіноїдами робить його важливим компонентом у складі фітопрепаратів. Канабіноїди, що мають схожі механізми дії, можуть посилювати ефект один одного, створюючи стратегію лікування, яка дозволяє досягти значних результатів при мінімальних дозах.
Одним із прикладів такого синергізму є комбіноване використання CBV з CBD. Відомо, що CBD має протизапальні та нейропротекторні властивості, і в комбінації з CBV може бути створена більш ефективна терапія для пацієнтів, що страждають на хронічний біль, нейропатії або запальні захворювання. Водночас, CBV здатен допомагати знижувати вираженість побічних ефектів, таких як сонливість чи психоактивні ефекти, які можуть виникати при застосуванні THC.
Преимущества багатокомпонентних фітопрепаратів
Однією з основних переваг використання CBV у складі багатокомпонентних препаратів є можливість створення ефективних і безпечних засобів для лікування широкого спектра захворювань. Наприклад, канабіноїди можуть використовуватися для лікування різних видів болю, запалень, тривоги, депресії, нейропатій, і навіть деяких психічних розладів. У складі багатокомпонентного препарату CBV може виступати як компонент, що пом’якшує побічні ефекти інших активних речовин, підвищуючи таким чином ефективність і безпеку терапії.
Крім того, наявність кількох активних компонентів дозволяє не лише покращити терапевтичний ефект, а й знизити ймовірність розвитку резистентності до лікування. Взаємодія CBV з іншими фітокомпонентами, такими як терпенові сполуки, може також підвищити біодоступність препарату, що забезпечує кращу засвоюваність і триваліший ефект. Це створює основу для більш ефективних і безпечних методів лікування, які можуть використовуватися для зниження запальних процесів, болю, стресу, а також для боротьби з деякими психічними та неврологічними захворюваннями.
Перспективи розвитку та застосування
Найближчі перспективи щодо застосування CBV у складі багатокомпонентних фітопрепаратів вказують на розширення використання таких препаратів у лікуванні хронічного болю, запальних процесів, неврологічних розладів і навіть психічних захворювань. Комбінація CBV з іншими канабіноїдами і природними сполуками дозволить створити комплексні засоби, що ефективно і безпечно працюють на різні мішені одночасно.
CBV може виконувати роль не тільки як стабілізатор, а й як активний компонент у фітопрепаратах, розширюючи терапевтичні можливості та знижуючи ризик побічних ефектів. Використання цього канабіноїду в складі багатокомпонентних препаратів може стати значущим кроком уперед у фармакології та фітотерапії.
Етичні, нормативні та токсикологічні аспекти дослідження CBV
Невизначеність токсичності CBV: дані in vitro та in vivo
Незважаючи на зростаючу наукову увагу до маловивчених фітоґенних канабіноїдів, таких як каннабіварин (CBV), токсикологічні профілі цих сполук залишаються малодослідженими, що створює низку проблем для регуляторних агентств, дослідників та клініцистів. CBV, як структурний аналог канабінолу, відрізняється наявністю пропілового замісника в бічному ланцюгу, що може мати істотне значення для його метаболізму, біотрансформації та потенційної токсичності. Однак наразі немає стандартизованої токсикологічної оцінки цієї молекули відповідно до сучасних фармацевтичних вимог. У зв’язку з цим, ключовим завданням є аналітичний розгляд наявних (хай і обмежених) in vitro та in vivo даних щодо токсичності CBV, з урахуванням специфіки його фармакологічного профілю та біохімічної поведінки.
Структурно-активні аналогії та обґрунтування потреби в оцінці токсичності
Початкову основу для формування гіпотез про токсикологічні ризики CBV становить його структурна подібність до CBN, який вважається слабко токсичним, але демонструє певні прооксидантні властивості при тривалому зберіганні або високих концентраціях. У випадку CBV, подібність до CBN поєднується з вариновим бічним ланцюгом, що модифікує як ліпофільність, так і передбачувану метаболічну стабільність. Відомо, що такі зміни можуть кардинально змінити шляхи детоксикації сполук печінковими ферментами, зокрема ізоферментами CYP450, що може призводити до утворення реактивних метаболітів із цитотоксичними властивостями. Саме через це неможливо переносити токсикологічні профілі CBN або THCV на CBV – необхідна окрема незалежна експериментальна оцінка.
In vitro дослідження: клітинні моделі та обмеження методології
Єдиними доступними джерелами даних щодо in vitro токсичності CBV на момент написання залишаються фрагментарні повідомлення з досліджень, у яких CBV згадувався як мінорний компонент у канабіноїдних сумішах. В обмежених експериментах на лініях гліальних клітин (наприклад, C6, BV-2) CBV не виявляв цитотоксичності при концентраціях до 10 µM, однак ці дані не дозволяють зробити висновки щодо хронічної токсичності, генотоксичності чи канцерогенності. У відокремлених випадках використання гепатоцитарних ліній (HepG2) дало змогу виявити незначне зниження життєздатності клітин при концентраціях вище 25 µM, однак з вираженим дозозалежним характером, що може вказувати на межу безпечного фармакологічного навантаження.
Недостатність in vitro даних також полягає в тому, що не проводились комплексні дослідження механізмів індукції апоптозу, автофагії або окисного стресу. Особливо важливою прогалиною є відсутність аналізу впливу CBV на активність антиоксидантних систем, таких як супероксиддисмутаза, каталаза та глутатіонпероксидаза, а також відсутність експериментального підтвердження його ролі в інгібуванні чи активації цитохромних ферментів. Наявні in vitro результати, отже, не дозволяють ні підтвердити, ні виключити потенційну токсичність CBV при системному або локальному застосуванні, зокрема у фармакологічно активних дозах.
In vivo моделі: токсикологічна інерція та відсутність стандартизації
Ще більшою проблемою є відсутність систематичних in vivo токсикологічних досліджень CBV. Ні в токсикологічних базах даних (таких як ToxNet, HSDB), ні в опублікованих фармакологічних протоколах на лабораторних тваринах не знайдено повноцінних дозозалежних експериментів, що включають CBV як єдиний активний компонент. У деяких дослідах на гризунах CBV згадувався у складі складних екстрактів, але його окремий вплив на морфофункціональні показники, зокрема гематологічні параметри, функцію печінки чи нейроповедінкову активність, не оцінювався.
В умовах відсутності доклінічної оцінки токсичності за OECD-стандартами (наприклад, тесту на гостру токсичність OECD 423 або 425), будь-яке застосування CBV у фармакологічних експериментах має розглядатися як етично обмежене. Залишається відкритим питання про можливу імунотоксичність або імуносупресивний потенціал CBV, який не можна виключити з огляду на його ліпофільність та ймовірну здатність до акумуляції в жировій тканині. Зі схожими властивостями проявляються деякі структурно споріднені фітоканабіноїди, що накопичуються у фосфоліпідних фракціях клітинних мембран і потенційно порушують сигнальні каскади, асоційовані з NF-κB та MAPK.
Ендогенні реакції детоксикації та можливість метаболічного навантаження
CBV, як фітогенний канабіноїд, має високу ймовірність метаболізуватись через оксидазну систему P450, з формуванням одного або кількох гідроксильованих метаболітів. У разі біотрансформації з утворенням гідроксильованих CBV-похідних можливе утворення реактивних кисневих або альдегідних продуктів, здатних взаємодіяти з білками та ДНК. Це створює передумови для потенційної гепатотоксичності, подібної до ефектів ацетамінофену при передозуванні. Однак для підтвердження цієї гіпотези потрібні дослідження із застосуванням систем мас-спектрометрії та LC-MS/MS з метою точної ідентифікації біотрансформаційних продуктів.
Особливо перспективною є постановка експериментів із використанням моделей генно-модифікованих мишей, дефіцитних за певними CYP-ізоформами (наприклад, CYP2C9 або CYP3A4), для оцінки ролі індивідуальних ферментів у детоксикації CBV. Додатковим напрямом може бути використання культур гепатоцитів людини у 3D-органоїдних системах для моделювання тривалого метаболічного навантаження, і, зокрема, вивчення накопичення CBV у ліпідних фракціях клітин.
Статус CBV у фармакопеях і класифікаціях
Поточний нормативний статус каннабіварину (CBV) залишається суттєво невизначеним як на національному, так і на міжнародному рівнях, що є результатом поєднання декількох факторів: низького ступеня вивченості, відсутності психоактивних властивостей, відсутності клінічної апробації та відсутності історії традиційного застосування у фітотерапії або фармацевтиці. Відомо, що більшість фармакопей і регуляторних класифікаторів опираються у своїх рішеннях на дані щодо безпеки, ефективності, стабільності, біодоступності й токсикології речовини. Враховуючи обмежену доступність CBV у чистому вигляді, а також брак фармакологічних протоколів для його стандартизації, сполука практично не фігурує в авторитетних фармакопейних реєстрах, таких як USP (United States Pharmacopeia), Ph. Eur. (Європейська фармакопея), JP (Японська фармакопея) або DAB (Німецька фармакопея).
CBV наразі не має індивідуального кодування у системі WHO-INN (International Nonproprietary Names), що означає, що сполука не визнана як активний фармацевтичний інгредієнт (API) на глобальному рівні. Також він не згадується в реєстрах таких організацій, як FDA (U.S. Food and Drug Administration) чи EMA (European Medicines Agency), ані як досліджувана речовина, ані як зареєстрована субстанція. Це прямо вказує на відсутність поданих досьє на клінічні дослідження чи допуск до обігу в будь-якій країні, де діє сувора система фармаконагляду.
У той самий час варто зазначити, що деякі держави з гнучкішим регуляторним підходом до фітоканабіноїдів (наприклад, Канада, Ізраїль, Уругвай) включають CBV як маркерну субстанцію у хроматографічних профілях певних медичних екстрактів, хоча без визначення окремої фармакологічної дії. CBV також почав фігурувати у внутрішніх технічних регламентах деяких компаній, які спеціалізуються на стандартизації повного спектра канабіноїдів, особливо в умовах GMP-виробництва канабісових API. Однак ці документи мають статус “внутрішнього контролю якості” і не є міжнародно визнаними стандартами.
Щодо класифікації згідно з контролем наркотиків, CBV у переважній більшості юрисдикцій не включено до списків контрольованих речовин (Schedules I-V у США, або Annexes у країнах ЄС), а отже, з юридичної точки зору, не заборонено до використання чи обігу. Винятком можуть бути країни, що застосовують принцип “аналогового закону”, де хімічно споріднені сполуки (у цьому випадку – похідні Δ9-тетрагідроканабінолу) можуть підпадати під регуляцію у зв’язку з імовірним психоактивним або нейротропним потенціалом. Тим не менш, у CBV відсутня циклічна структура Δ9-THC, яка обумовлює психоактивність, що послаблює ймовірність його регуляторного переслідування як психоактивної речовини.
Окремим аспектом є взаємодія CBV з косметичним, нутрицевтичним і ветеринарним законодавством. Деякі компанії в Канаді, Швейцарії та Південній Кореї декларують CBV як “інгредієнт із потенційними біологічними властивостями”, вводячи його у складі косметичних продуктів (наприклад, засобів від подразнення шкіри), проте така декларація супроводжується приміткою “non-evaluated by regulatory agencies”. Згідно з даними INCI (International Nomenclature of Cosmetic Ingredients), CBV поки що не має офіційного номера, що підтверджує неформальний характер його присутності у складі продукції. Це залишає сполуку поза контролем як косметичного, так і фармацевтичного регулювання.
Проблема дослідження “непсихоактивних” сполук: наукова тінь або потенціал?
Наявність чи відсутність психоактивності в молекулі канабіноїду є не лише фармакологічним фактом, а й потужним фільтром у науковому дискурсі, що визначає, які сполуки отримують пріоритет у фундаментальних і прикладних дослідженнях. Каннабіварин (CBV), як непсихоактивний канабіноїд без встановленої спорідненості з CB1-рецепторами, репрезентує парадигматичний приклад того, як відсутність вираженого ефекту на центральну нервову систему позбавляє молекулу дослідницької уваги навіть попри її потенційні периферійні або модулюючі ефекти. В умовах сучасної науки, де інтерес часто визначається медіа-ефектом або перспективами комерціалізації, “непсихоактивність” часто ототожнюється з “незначущістю”, що є методологічно і концептуально некоректним.
З історичної точки зору, більшість досліджень канабіноїдів концентрувалася на Δ9-тетрагідроканабінолі (THC) як основному психоактивному компоненті Cannabis sativa L., а згодом – на канабідіолі (CBD) як “антипсихоактивному” його антагоністу. Інші молекули, зокрема CBV, залишилися на периферії не через відсутність активності, а через невідповідність уявленням про те, якими мають бути “корисні” канабіноїди. У цьому контексті термін “наукова тінь” можна трактувати як сукупність епістемологічних і фінансових бар’єрів, що блокують дослідження сполук з непередбачуваним або непрямим механізмом дії.
Цікаво, що CBV має кілька ознак, які роблять його методологічно привабливим з точки зору нейроімунології, протизапального моделювання, а також потенційного модулятора синаптичної пластичності через вплив на рецепторні комплекси поза межами канонічної CB1/CB2-осьової системи. Тим не менш, саме відсутність “суб’єктивного ефекту” у здорових добровольців призводить до того, що інституційна та грантова підтримка проектів із вивченням CBV значно нижча, ніж у сполук із психоактивним профілем. Таким чином, наукова валідність сполуки нерідко виявляється вторинною щодо її здатності створити клінічну сенсацію або маркетинговий наратив.
Фармакологічний ринок також демонструє чітке розмежування між сполуками, що “відчуваються”, і тими, що ні. Це визначає комерційні стратегії виробників, які рідко інвестують у повний фармакокінетичний або токсикологічний профіль сполуки, що не викликає ані ейфорії, ані швидких фізіологічних ефектів. Для CBV це створює ситуацію, де гіпотетичні властивості – наприклад, як інгібітора пероксинітрит-залежних сигнальних каскадів у глії – лишаються недослідженими просто тому, що їх неможливо оперативно перевірити через брак реплікаційних моделей.
На рівні біоетики, слід також зауважити, що “непсихоактивність” CBV може забезпечити унікальну перевагу для досліджень у вразливих групах: пацієнтах з когнітивними розладами, дітей, вагітних тощо. У той же час, саме відсутність когнітивного ефекту призводить до маргіналізації таких досліджень, бо вони не обіцяють “швидкого” ефекту або “візуального” результату. У парадоксальному сенсі, безпечна сполука без психоактивності виявляється менш прийнятною для дослідницьких протоколів, ніж потенційно токсична молекула з високим психоактивним ефектом.
Крім того, проблема дослідження непсихоактивних сполук полягає у відсутності валідованих біомаркерів для оцінки їхньої дії. Якщо для психоактивних речовин достатньо оцінити зміни в електроенцефалограмі, поведінкові реакції або суб’єктивні опитувальники, то для CBV подібних швидких інструментів не існує. Це ускладнює дизайн досліджень, збільшує витрати на валідацію та змушує дослідників покладатися на багатофакторні моделі in vitro або довготривалі in vivo протоколи, що знижує інституційну зацікавленість.
З етичної точки зору, залишення CBV у тіні є втраченою можливістю реалізувати принципи доказової медицини у повному обсязі. Ігнорування потенційно активних молекул через їхню “непопулярність” або неелегантність у поведінковому профілі прямо суперечить основним нормам наукового методу – відкритості до альтернатив, обґрунтованості гіпотез, повторюваності результатів. CBV тут не виняток, а яскравий приклад того, як когнітивні упередження (biases) визначають дослідницький ландшафт, навіть попри формальну науковість підходів.
Окрім цього, варто згадати про дефіцит стандартів і аналітичних методик для CBV, що ускладнює реплікацію досліджень і стандартизацію інтерпретації результатів. Без загальноприйнятих протоколів очищення, ідентифікації та біодозування CBV наукова спільнота часто змушена імпровізувати, створюючи методологічно невідтворювані системи, що лише посилює маргіналізацію сполуки у міжнародному науковому просторі.
Висновок
Каннабіварин (CBV) посідає унікальне і недостатньо досліджене місце в хімічному та фармакологічному ландшафті канабіноїдів. На тлі домінування добре вивчених молекул, таких як Δ9-тетрагідроканабінол (THC) і канабідіол (CBD), CBV залишається в науковій тіні, попри низку потенційних переваг як фармакологічного агента, так і біомаркерного індикатора метаболічних і нейробіологічних процесів. Його природна поява як продукту окислення тетрагідроканнабіварину (THCV) у поєднанні з відсутністю психоактивності створює інтерфейс між фундаментальною хімією і прикладною фармакологією, який поки що залишається майже неосвоєним.
CBV відрізняється хімічною інертністю, яка, хоча й обмежує його прямий вплив на CB1/CB2-рецептори, не виключає опосередкованої дії через інші біологічні мішені, включаючи пероксисомні рецептори, ванілоїдні канали або сигнальні шляхи, пов’язані з клітинним стресом. На основі доступних експериментальних даних CBV демонструє біологічну стійкість, низьку токсичність та метаболічну стабільність, що, у поєднанні з гіпотетичним протизапальним і антиоксидантним потенціалом, відкриває перспективи для його дослідження в терапії хронічних нейрозапальних станів, епілепсії, нейропатичних болів і патологій, пов’язаних з гліальною активацією.
Однак, з етичної, методологічної та нормативної точки зору CBV наразі залишається в складному становищі. Відсутність уніфікованих фармакопейних стандартів, недостатня валідованість аналітичних методик і фрагментарність даних про біодоступність, токсикокінетику та молекулярні механізми дії CBV значно гальмують його просування у фармакологічних протоколах. У цьому сенсі CBV виступає не просто як ще один “незначущий” канабіноїд, а як тест на гнучкість і неупередженість сучасної наукової системи в ідентифікації потенційних терапевтичних агентів.
CBV також є лакмусовим папірцем еволюції канабіноїдної науки – від зосередження на психоактивних ефектах до системного підходу, що враховує повний спектр метаболітів, включаючи ті, що не мають суб’єктивно відчутного ефекту. Його поява в мікро- або наномолярних концентраціях у біологічних матрицях може стати відправною точкою для дослідження механізмів окислювальної деградації канабіноїдів, зокрема в умовах довготривалого зберігання продуктів медичної коноплі. Таким чином, CBV має значення не лише як потенційний фармакологічний агент, а і як біомаркер стабільності, віку та якості канабіноїдних препаратів.
Не менш важливо, що саме відсутність вираженого психотропного ефекту відкриває унікальні етичні перспективи для застосування CBV у вразливих популяціях – від дітей із епілептичними синдромами до пацієнтів із деменцією, онкологією або хронічними болями. Це створює простір для нового класу терапевтичних засобів, де ефективність базується не на агресивному втручанні в рецепторну систему, а на модуляції фонових нейробіологічних процесів.
З огляду на вищенаведене, можна констатувати, що майбутнє CBV залежить не стільки від самої молекули, скільки від системної реорганізації пріоритетів у науковій і фармакологічній політиці. Лише шляхом повноцінного включення таких “невидимих” сполук у міждисциплінарну платформу досліджень – із залученням токсикологів, нейробіологів, аналітичних хіміків та біоетиків – можливо розкрити справжній потенціал CBV у медицині. У протилежному разі ця сполука ризикує залишитися “біохімічною цікавинкою”, так і не перетворившись на повноцінний інструмент терапевтичного втручання або аналітичного моніторингу в системі доказової медицини.
Джерела:
- PubChem (NIH/NLM) – Детальний опис хімічної структури та властивостей каннабіварину
https://pubchem.ncbi.nlm.nih.gov/compound/Tetrahydrocannabivarin - Metabolon – Інформація про CBV як непсихоактивний канабіноїд та його потенційне застосування
https://www.metabolon.com/metabolites/cannabivarin/ - DrugBank – Деталі щодо механізму дії та фармакологічного профілю CBV
https://go.drugbank.com/drugs/DB14736 - PubMed (NIH) – Дослідження цитотоксичності канабіноїдів, включаючи CBV
https://pubmed.ncbi.nlm.nih.gov/39724679/ - ScienceDirect – Огляд пероральної токсичності канабіноїдів
https://www.sciencedirect.com/science/article/pii/S0278691523002016 - UNODC – Рекомендовані методи ідентифікації та аналізу канабіноїдів
https://www.unodc.org/documents/scientific/ST-NAR-40-Ebook_1.pdf - FDA (Regulations.gov) – Інформація про класифікацію канабіноїдів, включаючи CBV
https://downloads.regulations.gov/FDA-2019-N-1482-3206/attachment_11.pdf - Wiley Online Library – Моделювання фармакокінетики канабіноїдів у людському організмі
https://analyticalsciencejournals.onlinelibrary.wiley.com/doi/10.1002/jat.4409 - ScienceDirect Topics – Огляд канабідіварину та його фармакологічних властивостей
https://www.sciencedirect.com/topics/neuroscience/cannabidivarin - Cayman Chemical – Стандартизований зразок CBV для аналітичних досліджень
https://www.caymanchem.com/product/21664/cannabivarin - Sigma-Aldrich (Cerilliant) – Сертифікований розчин CBV для лабораторних досліджень
https://www.sigmaaldrich.com/US/en/product/cerillian/c225