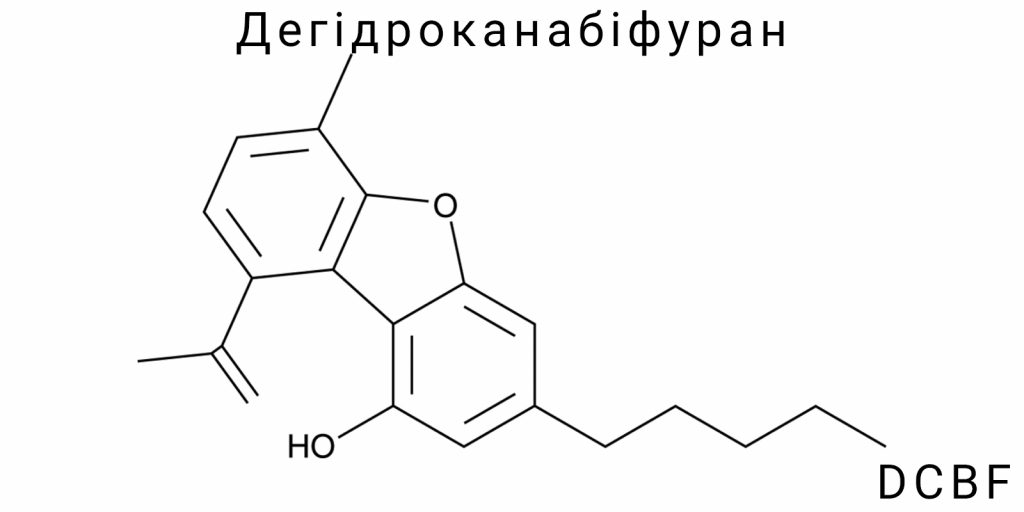
Дегідроканабіфуран (DCBF) є малодослідженою канабіноїдною сполукою з дибензофурановою структурою, вперше ідентифікованою у слідах продуктів піролізу Cannabis sativa L., а також у незначних кількостях у сировині рослинного походження. Структурно DCBF представляє собою ароматизовану похідну канабіельсоїну (CBE), в якій насичений тетрагідроксиканабіноїдний фрагмент зазнав дегідрування з утворенням повністю ароматичної системи з фурановим кільцем. Молекулярна формула сполуки – C₂₁H₂₄O₂; молекула містить п’ятівуглецевий бічний ланцюг у положенні 3 бензольного ядра, ізопропенільну групу у положенні 5 та гідроксильну функцію в положенні 1.
Дибензофурановий каркас DCBF надає йому електронно-щільну, планарну структуру з високою стабільністю π-електронної системи, що потенційно впливає на її взаємодію з біологічними мішенями. Ступінь кон’югації, локалізація гідроксильної групи та розподіл ліпофільних ділянок визначають потенціал цієї сполуки до проникнення крізь біологічні мембрани, зокрема гематоенцефалічний бар’єр. Первинні in silico фармакокінетичні моделі свідчать про високу мембранну проникність, logP > 5, та передбачувану біодоступність за умов ентерального введення. Ці властивості зумовлюють науковий інтерес до DCBF як потенційного фармакологічного ліганду.
Доступна експериментальна інформація вказує на можливість біосинтетичного або термогенного утворення DCBF шляхом дегідрування CBE-похідних. Передбачається, що в природних умовах DCBF може формуватись внаслідок окисно-дегідрувальних процесів у середовищі з високою реакційною здатністю (ультрафіолетове випромінювання, ферментативне окиснення, термічний вплив). У лабораторних умовах синтез може здійснюватися шляхом цілеспрямованої дегідратації насичених канабіноїдів з використанням кислотних каталізаторів або шляхом ароматизації з використанням паладійвмісних систем, аналогічних реакціям Сузукі або Гекіна. Отримана сполука верифікується методами ЯМР-спектроскопії, ВЕРХ/МС та ІЧ-аналізу, з підтвердженням дибензофуранового фрагмента.
Фармакологічні властивості DCBF залишаються практично недослідженими in vivo та in vitro. Проте на основі його молекулярної будови можна екстраполювати гіпотетичну взаємодію з рецепторними білками, зокрема канабіноїдними рецепторами CB1/CB2, PPARγ, TRP-каналами або ферментативними системами (наприклад, FAAH або MAGL). Молекулярне докінгування вказує на можливу конкурентну або алостеричну активність щодо зазначених мішеней, що вимагає експериментального підтвердження. Водночас, електрофільні властивості фуранового кільця створюють потенційну загрозу утворення реактивних метаболітів при біотрансформації, зокрема внаслідок окислення в системі CYP450. Цей факт потребує оцінки токсикологічного профілю DCBF, зокрема його впливу на печінкові клітини, клітини репродуктивної системи та клітини ЦНС.
З огляду на високу структурну стабільність, потенційну біологічну активність і доступність для хімічної модифікації, DCBF розглядається як перспективний об’єкт для дослідження структури-активності в ряду фуранових канабіноїдів. Подальше вивчення його фізико-хімічних, фармакологічних та токсикологічних властивостей має важливе значення для розуміння метаболічних шляхів канабіноїдної трансформації, а також для ідентифікації нових біологічно активних субстанцій природного або напівсинтетичного походження. Відсутність систематизованої інформації щодо поведінки DCBF у біологічному середовищі створює потребу у фундаментальних дослідженнях in vitro та in vivo з залученням фармакокінетичного моделювання, експресійного аналізу та методів клітинної біоінженерії.
Хімічна ідентифікація DCBF
Дегідроканабіфуран (DCBF) становить особливий інтерес у межах канабіноїдного ряду завдяки наявності конденсованої поліциклічної системи, яка включає дибензофурановий фрагмент. Хімічна ідентифікація цієї сполуки вимагає багаторівневої методології з використанням сучасних аналітичних інструментів спектроскопії, хроматографії та мас-спектрометрії. На відміну від класичних канабіноїдів, які мають частково насичену структуру з тетрагідроканабінольною або канабідіоловою основою, DCBF характеризується повною ароматизацією ядра та вбудованим фурановим кільцем, що формує жорстку, стабільну й електронно насичену архітектуру.
Першим етапом у процесі хімічної ідентифікації DCBF є визначення його елементного складу та молекулярної маси. За допомогою мас-спектрометрії високої роздільності (HRMS) іонізацією методом електронного удару або електроспрей-іонізації (ESI) реєструється точне значення молекулярної маси, що відповідає формулі C₂₁H₂₄O₂. Висока точність вимірювання дозволяє виключити ізобарні сполуки та підтвердити елементний склад з похибкою менше 5 ppm. Ізотопне моделювання розподілу пік-фрагментів слугує додатковим індикатором ідентичності, зокрема завдяки характерному співвідношенню інтенсивностей піків ¹²C/¹³C.
Подальша верифікація структури потребує використання ядерного магнітного резонансу (ЯМР). Метод ¹H-ЯМР дозволяє виявити характерний спектральний профіль ароматичних протонів, зокрема сигнали в області 6.2-7.8 ppm, що належать до бензольних ядер і фуранового кільця. Спостерігаються дезекрановані мультиплети, які свідчать про наявність сполучених електронних систем. ¹³C-ЯМР забезпечує виявлення сигналів атомів вуглецю в ароматичному середовищі, з типовими хімічними зсувами в інтервалі 110-160 ppm. Наявність сигналів насичених алкільних фрагментів у діапазоні 14-40 ppm підтверджує присутність бічного ланцюга у структурі. Додатково застосовуються кореляційні методи ЯМР, включаючи COSY, HSQC і HMBC, що дають змогу ідентифікувати скаляри між протонами та корелювати їх з карбоновими центрами, що критично для верифікації системи з декількома конденсованими циклами.
ІЧ-спектроскопія дозволяє встановити наявність гідроксильної групи за характерним валентним поглинанням у діапазоні 3400-3600 см⁻¹, а також виявити вібрації C=C у межах 1600-1650 см⁻¹, що свідчить про наявність ароматичної системи. Поглинання в зоні 1050-1150 см⁻¹ корелює з коливаннями фуранового циклу, тоді як область 700-900 см⁻¹ може свідчити про заміщення бензольних кілець. У сукупності ІЧ-спектр забезпечує підтвердження функціональних груп та типу зв’язків, властивих DCBF.
Розділення DCBF із суміші аналогів можливе шляхом високоефективної рідинної хроматографії (ВЕРХ) у поєднанні з детектуванням за УФ-спектром та мас-спектрометрією. Оптимальні умови елюювання зазвичай включають використання змішаних рухомих фаз (метанол:вода або ацетонітрил:вода) з градієнтною програмою. DCBF демонструє характерне поглинання в УФ-області на довжині хвилі 220-280 нм, що пов’язане з π→π* переходами у фурановій та бензольній системах. Визначення часу утримання в хроматографічній системі дозволяє здійснювати кількісний аналіз та оцінювати ступінь чистоти ізольованого зразка.
Кристалографічна ідентифікація DCBF шляхом рентгеноструктурного аналізу на сьогодні не є стандартною процедурою для даного класу сполук через труднощі з кристалізацією, однак за наявності достатньої кількості чистого зразка можливе отримання даних щодо внутрішньої конформації та міжатомних відстаней, що остаточно підтверджує геометрію молекули. У структурі очікується наявність планарних ароматичних систем, що кон’югують із фурановим кільцем у псевдоспівплощинній конфігурації. Це узгоджується з квантово-хімічними розрахунками мінімуму енергії оптимізованої структури (DFT рівень, B3LYP/6-311G(d,p)).
Для остаточного підтвердження ідентичності використовується порівняння експериментальних спектральних даних із теоретичними прогнозами або з базами даних аналітичних профілів, таких як PubChem, ChemSpider, або спеціалізовані спектральні бібліотеки (наприклад, NIST, Wiley). У випадку новоідентифікованого зразка, створюється власний аналітичний паспорт сполуки, який включає мас-спектр, повні ЯМР-дані, ІЧ-спектр, хроматографічні параметри та, за можливості, дані DFT моделювання.
Систематична назва та молекулярна формула
Дегідроканабіфуран (DCBF) представляє собою похідну канабіноїдної системи з повністю ароматизованим трициклічним ядром, що включає дибензофурановий фрагмент з алкільними замісниками. Його хімічна структура не є канонічною для класичних фіто- або синтетичних канабіноїдів і формально не входить до традиційної класифікації фітоканабіноїдів, проте походить від них шляхом дегідрування і перебудови кільцевих систем.
Систематична назва згідно з правилами IUPAC для даної молекули, виходячи з її структурної конфігурації, є:
5-[(1E)-1,2-диметилпроп-1-еніл]-3-пентил-1-бензофуран-1-ол.
Ця назва побудована за принципом пріоритету функціональних груп і включає ключові структурні елементи: бензофурановий каркас, пентильний ланцюг у положенні 3, ізопропенільний замісник у положенні 5 та фенольну гідроксильну групу в положенні 1. У межах цієї номенклатури бензофуран виступає головним каркасом, з нумерацією від атома кисню фуранового кільця за годинниковою стрілкою, що дозволяє точно визначити положення замісників без двозначностей.
Молекулярна формула DCBF: C₂₁H₂₄O₂.
Ця формула демонструє співвідношення атомів у складі молекули: 21 атом вуглецю, 24 атоми водню та 2 атоми кисню. Молекулярна маса у нейтральному стані складає 308.42 г/моль. Атоми кисню в цій формулі локалізовані в структурах гідроксильної групи (-OH) та фуранового етерного мосту. Варто зазначити, що ця формула є типовою для ароматичних похідних з високим ступенем насичення воднем при периферичних ланцюгах, з одночасною наявністю двох оксигеновмісних фрагментів, що забезпечують базовий рівень полярності.
Класифікація за InChI (International Chemical Identifier) забезпечує алгоритмічно однозначне представлення структури:
InChI=1S/C21H24O2/c1-5-6-7-13-17-14-19(21(22)23-20(17)16-11-9-8-10-12-16)15-18(2)3/h8-12,14-15,22H,5-7,13H2,1-4H3
Цей запис детермінує топологію молекули, включаючи локалізацію подвійних зв’язків, наявність гідроксильної групи, а також атомів водню, що беруть участь у формуванні молекулярної конфігурації. Ідентифікатор InChIKey, який є хеш-версією повного InChI, зручно використовувати для пошуку сполуки в базах даних:
InChIKey: YWWQVWYXPGTZKG-UHFFFAOYSA-N
З позиції елементного складу, DCBF містить 72.72% мас. C, 6.96% мас. H та 20.32% мас. O, що виявляється при елементному аналізі CHN/O. Такий склад свідчить про високий вміст вуглецю – типовий для ароматичних структур із розгалуженими алкільними ланцюгами. Оскільки структура не містить атомів азоту, сірки чи галогенів, вона є хімічно “чистою” у контексті електрофільності та не має класичних точок для нуклеофільної атаки крім фенольної групи.
Згідно з класифікацією за хімічним родом, DCBF можна віднести до класу поліциклічних ароматичних етерів, а точніше – до похідних канабіфуранів, що мають дибензофуранове ядро з алкільними та алкенільними замісниками. Це рідкісний підтип у межах канабіноїдної хімії, оскільки більшість природних канабіноїдів базуються на частково насичених системах з гідроксигрупами та циклічними терпеновими модулями, тоді як DCBF повністю ароматизований.
Логічним етапом структурного кодування є використання SMILES-нотації (Simplified Molecular Input Line Entry System):
CC(=C)C1=CC2=C(C=C1)OC(C3=CC=CC=C3C3CCCC3)=C2O
Ця лінійна формула дає змогу кодувати структуру в цифровому вигляді для молекулярного моделювання, фармакофорного аналізу або скринінгу. Вона ефективна в рамках cheminformatics-платформ та алгоритмів передбачення властивостей за структурою.
Формально, в основі DCBF лежить бензофурановий скелет, утворений шляхом злиття бензольного кільця з фураном. Введення алкільного бічного ланцюга в положенні 3, що морфологічно походить від пентильного фрагмента класичних канабіноїдів, забезпечує аналогічну ліпофільність. Ізопропенільна група в положенні 5, орієнтована планарно до фуранової площини, підвищує електронну густину в кон’югованій системі. У сукупності це формує електрофіл-нейтральну, але ліпофільно стабільну молекулу з потенціалом взаємодії з білковими мішенями шляхом π-π-стекінгу, гідрофобної адсорбції або водневого зв’язування через фенольну групу.
Функціональні групи представлені гідроксилом (-OH) і етерною (C-O-C) фурановою системою. Обидві ці групи мають відносно низьку нуклеофільність у контексті повної ароматизації, однак здатні до утворення водневих зв’язків як донори (-OH) і як частина π-системи (фуран). Така архітектура визначає стабільність сполуки в нейтральному середовищі, а також обмежену реактивність за фізіологічних pH-умов.
Структурні особливості молекули
Молекула дегідроканабіфурану (DCBF) характеризується специфічною структурною архітектурою, що поєднує елементи бензофуранового ядра, аліфатичних замісників і функціональних груп, що формують стабільну, електронно насичену і планарну систему з високим ступенем кон’югації. Центральним структурним мотивом є трициклічна система, утворена шляхом злиття бензольного і фуранового кілець, що становлять основу бензофурану, при чому орієнтація атомів у цій системі задає домінуючі електронно-орбітальні характеристики молекули.
Бензофуранове ядро в DCBF функціонує як електроннодонорна ароматична платформа з двома системами спряження: бензольна і фуранова. Обидві циклічні структури знаходяться в планарному розміщенні і взаємно перпендикулярно кон’югують, створюючи єдину π-електронну систему, яка виступає основним хромофором молекули. Важливо зазначити, що в DCBF фуран не функціонує як самостійний гетероцикл, а є складовою частиною більшої кон’югованої системи, що впливає на розподіл електронної густини та стабільність молекули.
На позиції C-3 бензофуранового ядра розміщено н-пентильний замісник, який формує довгий ліпофільний бічний ланцюг. Він є насиченим, незгідрованим та не бере участі у жодних електронно-спряжених процесах. Його функція переважно полягає у збільшенні гідрофобності молекули, забезпеченні взаємодії з ліпідними середовищами (зокрема, мембранними структурами) та впливі на фармакокінетичні властивості, такі як проникнення крізь біологічні бар’єри. Просторова конфігурація цього ланцюга є вільно обертальною навколо σ-зв’язків, і він може набувати кількох конформацій, що залежить від локального середовища.
На положенні C-5 бензофурану розміщується ізопропенільна група – фрагмент, що містить подвійний зв’язок між першим і другим атомами вуглецю (C=C) та два метильні замісники. Подвійний зв’язок у цій групі є конфігураційно фіксованим у формі (E)-ізомеру, що стабілізує молекулу завдяки зменшенню стеричних перешкод між об’ємними фрагментами. Цей алкенільний фрагмент бере участь у делокалізації π-електронів із ароматичною системою фурану, формуючи локалізовану дієнову область, здатну до реакцій з електрофілами. Водночас, терпеноподібна природа цієї групи дозволяє структурі імітувати фрагменти природних канабіноїдів, хоча вона не походить з ізопренового біосинтетичного шляху.
У положенні C-1 розміщена фенольна гідроксильна група, яка є одним з небагатьох полярних фрагментів у цілій молекулі. Її присутність забезпечує можливість утворення водневих зв’язків, зокрема з рецепторними білками або молекулами води. Гідроксильна група у положенні 1 є реакційно активною при модифікаціях, таких як метилювання, естерифікація або введення карбаматних залишків. При цьому положення цієї групи дозволяє їй виступати як акцептор у водневому зв’язуванні, не порушуючи загальної планарності структури. Її кислотність посилюється завдяки електронно-донорним ефектам бензофуранового ядра, що стабілізує утворення фенолят-іону при відповідних рН.
Молекулярна планарність у DCBF є критичним параметром для його фармакофорної активності. Основний скелет, включаючи бензольне, фуранове кільце та алкенільну частину, знаходиться у майже повністю плоскій конфігурації. Це дозволяє ефективну π-π-стекінгову взаємодію з ароматичними амінокислотними залишками (наприклад, фенілаланіном або тирозином) в активних сайтах білків. Просторова орієнтація пентильного ланцюга є непланарною, проте її гнучкість не порушує стабільності головної π-системи.
Умовно структурну організацію DCBF можна розбити на три функціональні домени:
- Ароматичний ядровий домен (бензофуран) – визначає π-електронні властивості та фотохімічну стабільність.
- Ліпофільний домен (пентильний ланцюг) – відповідальний за проникність через біомембрани та афінність до гідрофобних білкових кишень.
- Полярно-реакційний домен (фенольна група та алкен) – слугує точками для хімічної модифікації, а також забезпечує здатність до специфічних взаємодій із білками-мішенями.
Ще однією важливою особливістю є наявність локалізованих дієнових фрагментів, що можуть вступати в реакції типу Diels-Alder при наявності відповідних електрофільних дієнофілів. Така реакційна здатність робить DCBF потенційно цікавим об’єктом для створення функціоналізованих похідних із заданими властивостями. Крім того, фурановий фрагмент у присутності певних каталізаторів або під дією УФ-випромінювання здатен зазнавати фотохімічних перетворень, зокрема електроциклічних реакцій, що дає додаткові інструменти для цільової функціоналізації.
Наявність асиметричних атомів у структурі DCBF відсутня – молекула є ахіральною в основному стані, проте можливе створення хіральних центрів при селективному функціональному модифікуванні, особливо в положеннях поблизу алкенільного фрагмента. Така модифікація дозволяє формувати енантіомери з потенційно різною біологічною активністю, що є перспективним напрямом у синтезі нових похідних на основі DCBF.
Стереохімічні варіації та їхній потенційний вплив на біоактивність
Дегідроканабіфуран (DCBF) належить до класу канабіноїдоподібних сполук зі структурно жорстким, здебільшого планарним каркасом, в основі якого – бензофуранова система з периферійно розташованими функціональними групами. Незважаючи на очевидну ахіральність молекули у її базовій формі, стереохімічний контекст DCBF не зводиться лише до відсутності хіральних центрів. У межах сучасної молекулярної фармакології, стереохімія розглядається не лише як наслідок конфігурації атомів в просторі, але й як фактор, що визначає конформаційні властивості, варіабельність локальних електронних хмар і топологію взаємодій з біологічними мішенями. DCBF, як потенційно біоактивна структура, може проявляти стереохімічні варіанти при певних умовах або бути стереохімічно модифікованою для регулювання своєї біоактивності.
Найперше, слід акцентувати на ролі подвійного зв’язку в ізопропенільному фрагменті. В нормальних умовах цей фрагмент перебуває у стабільній (E)-конфігурації, що мінімізує стеричне перекриття між двома метильними групами. Проте при дії світла, кислот або радикалів можливе часткове фотоізомеризування в (Z)-форму, яка кардинально змінює просторову орієнтацію алкеноїдного фрагмента щодо бензофуранового ядра. Така конфігураційна перебудова впливає на геометрію взаємодії із активними центрами білків, де вхідна кишеня рецептора має високоспецифічну топологічну відповідність до форми ліганду. Отже, навіть за відсутності класичних хіральних центрів, ізомерія навколо подвійного зв’язку потенційно розділяє DCBF на біоактивну та біонейтральну форми.
Другим аспектом є конформаційна стереохімія. Насичений пентильний ланцюг на C-3 не є хіральним, проте має декілька енергетично допустимих конформацій, які по-різному впливають на дипольний момент молекули, її поляризовність і, відповідно, ступінь орієнтованого зв’язування з біологічними мішенями. Наприклад, у присутності мембраноподібного середовища ланцюг здатен укладатися вздовж поверхні ліпідного бішару або ж частково занурюватися в гідрофобне ядро, що змінює локалізацію всієї молекули відносно рецепторного білка. Подібна конформаційна адаптивність, хоча й не пов’язана з класичною хіральністю, формує умовні “локальні стереоізомери”, які можуть мати різну афінність до ферментативних або рецепторних ділянок.
Ще один важливий стереохімічний момент пов’язаний з фенольною групою в положенні C-1. Вона перебуває в площині молекули, але її орбітальне перекривання з π-системою бензофурану залежить від орієнтації O-H зв’язку. Ротація навколо зв’язку C-O, хоча й обмежена водневим зв’язуванням та спряженням, все ж можлива, особливо в полярному середовищі або під впливом катіонів металів. Така орієнтаційна мінливість змінює не лише кислотність групи, але й просторову доступність до водневих акцепторів у білках, зокрема у водорозчинних ферментативних доменах. Умовна орієнтаційна ізомерія цієї групи може бути критичною при дизайні похідних DCBF для цільової інгібіції або активації конкретних ферментів.
У випадку хімічної модифікації DCBF, наприклад, шляхом введення додаткового замісника у положення C-2 або C-7 бензофуранового ядра, виникає можливість створення стабільних хіральних центрів. Такі деривати можуть мати енантіомери, кожен з яких демонструє різну біологічну дію або селективність. Це відкриває потенціал для отримання енантіомерно чистих форм, які за своєю фармакодинамікою будуть мати вищу специфічність, нижчу токсичність і відсутність конкуренції між формами за один рецепторний сайт. У разі, якщо модифікація стосується аліфатичних фрагментів, наприклад, шляхом заміщення вуглецевого атома ланцюга на хіральний центр з функціональним замісником, можливе виникнення двох або більше стереоізомерів із різними ADME-профілями.
Стереохімічно чутливими можуть бути і проміжні продукти синтезу DCBF, зокрема в реакціях електрофільного ароматичного заміщення або при циклоконденсації. Умови перебігу таких реакцій, як-от температура, каталітичне середовище, рН, можуть зумовлювати формування певної просторової конфігурації кінцевого продукту або спричиняти утворення неосновних ізомерів. Отже, контроль над стереохімією на кожному етапі синтезу є критичним для отримання відтворюваного продукту з прогнозованою біоактивністю.
На рівні молекулярного моделювання (in silico), структурні варіанти DCBF з урахуванням стереохімічних змін демонструють відмінності у взаємодії з активними центрами рецепторів CB1, CB2, TRPV1, а також ферментами системи FAAH або MAGL. Зокрема, моделі передбачають, що конформації з розгорнутим пентильним ланцюгом стабілізують молекулу у гідрофобному сайті CB2 через ван-дер-ваальсові взаємодії, тоді як зігнута конфігурація гальмує повне занурення в рецепторну кишеню. Це є прикладом функціональної стереоселективності, що не базується на хіральності, але визначає результативність біохімічної взаємодії.
Окрему увагу заслуговують потенційні стереоізомерні ефекти при метаболізмі DCBF. Гідроксилювання або окиснення за участі CYP-ферментів може відбуватись стереоселективно, в залежності від просторової доступності окремих атомів вуглецю. Це означає, що одна й та сама молекула DCBF може утворювати різні метаболіти залежно від її конформації або конфігураційної стабільності, що, в свою чергу, зумовлює різні фармакологічні наслідки: активацію, деактивацію або навіть токсичну трансформацію.
Походження і попередники
Дегідроканабіфуран (DCBF) є хімічною сполукою, чия природа та шляхи утворення досі досліджуються з метою встановлення точного походження та ролі в біохімічних процесах. Розглядання питання походження DCBF включає в себе аналіз джерел, з яких ця молекула може утворюватися, а також характеристику хімічних і біохімічних механізмів, що ведуть до її генерації. Пошуки відповіді на питання “де і як утворюється DCBF” охоплюють дослідження природних систем, а також методів синтетичного одержання у лабораторних умовах. Важливим аспектом є визначення первинних прекурсорів, з яких може походити DCBF, а також вивчення фізико-хімічних і біохімічних факторів, які впливають на формування молекули.
З біологічної точки зору DCBF може бути асоційований із природними метаболітами рослин роду Cannabis або їх хімічними модифікаціями. Проте, на відміну від більшості традиційних канабіноїдів, таких як ТГК чи КБД, DCBF характеризується іншою структурною специфікою, що ставить під сумнів його безпосереднє походження як продукт класичного біосинтезу рослини. Це спонукає припустити, що DCBF може бути результатом не лише природних ферментативних процесів, а й специфічних фізико-хімічних реакцій, що виникають під впливом екзогенних факторів, таких як нагрівання або фотохімічна активація.
На рівні хімічної еволюції можливо, що DCBF виникає через трансформацію більш простих канабіноїдів, зокрема через дегідрування або циклізацію відповідних функціональних груп. Такий хемогенез припускає існування структурних прекурсорів, молекули яких за наявності специфічних умов можуть зазнавати хімічних перебудов із формуванням нового циклу бензофуранового типу. Вивчення таких трансформацій актуальне для розуміння потенційних біохімічних шляхів метаболізму рослинних і синтетичних сполук.
Іншим напрямом є дослідження штучних методів отримання DCBF у лабораторних умовах. Синтетичні підходи дозволяють маніпулювати структурою молекули, що дає змогу встановити механізми формування певних фрагментів та визначити ключові проміжні продукти, які можуть бути аналогами природних прекурсорів. Завдяки синтетичним дослідженням створюються моделі, які пояснюють, яким чином DCBF може утворюватись як в природних, так і в штучних системах.
Додатково, для розуміння походження DCBF важливо враховувати роль факторів навколишнього середовища, які можуть впливати на хімічну стабільність, перетворення та накопичення молекули. Температурні режими, наявність каталізаторів, а також склад газового середовища здатні зумовлювати різні шляхи хімічної трансформації прекурсорів у DCBF або сприяти розпаду та модифікації вже утворених молекул. Аналіз таких впливів має безпосереднє значення для розуміння як природного біохімічного метаболізму, так і умов екстракції або синтезу DCBF.
В контексті ідентифікації прекурсорів варто відзначити важливість їх хімічної спорідненості до DCBF. Попередники повинні містити схожі функціональні групи, що потенційно беруть участь у реакціях дегідрування, циклізації або окислення з утворенням бензофуранового кільця. З огляду на це, особливою увагою користуються певні фітоканабіноїди, відомі своєю хімічною активністю та здатністю до трансформацій під дією ферментів або зовнішніх факторів. Визначення таких прекурсорів є фундаментальним для конструювання механістичних моделей утворення DCBF.
Хемогенез: чи є DCBF природним чи синтетичним?
Питання про природу походження Дегідроканабіфурану (DCBF) – природного чи синтетичного – залишається відкритим і потребує системного підходу для встановлення чітких фактів. Аналіз хемогенезу DCBF базується на двох основних напрямах: ідентифікації можливих природних джерел та відтворенні молекули у лабораторних або промислових умовах. Попри структурні особливості, які родинні канабіноїдам, DCBF не є прямим продуктом класичних ферментативних шляхів біосинтезу канабіноїдів, що вказує на складність його природного утворення.
Природне походження DCBF можна розглядати через призму біосинтетичних ланцюгів Cannabis sativa або споріднених видів рослин. Більшість канабіноїдів утворюються у рослині шляхом ферментативної конденсації преформованих тетрагідроканабінолу або каннабідіолу, однак DCBF характеризується значним відхиленням від типових структурних мотивацій, що ускладнює безпосереднє віднесення його до природних метаболітів. Відомості про виявлення DCBF у рослинних екстрактах залишаються обмеженими і часто суперечливими, що може бути наслідком як низької концентрації, так і складності аналітичного розпізнавання молекули серед подібних за структурою сполук.
Існує гіпотеза, що DCBF може утворюватися у природних умовах внаслідок не ферментативних процесів – переважно шляхом спонтанних або індукованих хімічних реакцій. До таких реакцій належать дегідрування, циклізація та окислювальні перетворення, що можуть відбуватися в межах рослинного матеріалу під впливом температурних коливань, світла, рН середовища, а також під дією мікроорганізмів. В цьому випадку DCBF виступає не первинним метаболітом, а продуктом вторинної трансформації класичних канабіноїдів або їх прекурсорів. Однак прямі експериментальні докази таких шляхів залишаються обмеженими через складність відтворення відповідних умов in vitro і in vivo.
Щодо синтетичного походження, DCBF здебільшого розглядається як хімічний продукт, створений через цілеспрямовані синтетичні реакції. Лабораторний синтез DCBF базується на органічних реакціях циклізації, дегідрування або функціонального модифікування прекурсорів, що можуть бути представлені як природними, так і синтетичними сполуками. Відмінність синтетичного DCBF полягає у можливості отримання ізомерно чистих форм, контролі над стереохімією, а також маніпуляції специфічними функціональними групами з метою оптимізації біоактивності. Ці методи синтезу спрямовані на відтворення або покращення властивостей молекули для досліджень фармакології та потенційних медичних застосувань.
Хемогенез DCBF у синтетичних умовах демонструє більшу варіативність і контрольованість, що дозволяє не лише відтворити природні конформації молекули, а й створювати її похідні з новими властивостями. Це має значення в контексті фармакологічних досліджень, де можлива модифікація DCBF може підвищити селективність та ефективність взаємодії з біологічними мішенями. Синтетичний шлях утворення також уможливлює отримання DCBF у кількостях, що значно перевищують потенціал рослинного синтезу, що критично для масштабування дослідницьких або клінічних застосувань.
Важливо зазначити, що деякі аналітичні методи виявлення DCBF в природних екстрактах можуть мати помилки, пов’язані із перетвореннями під час обробки зразків. Нагрівання, використання розчинників або підвищений тиск можуть індукувати хімічні реакції, які призводять до утворення DCBF із первинних канабіноїдів. Такий феномен артефактного утворення молекули складно відрізнити від природного метаболізму, що вимагає застосування контрольованих умов аналізу та використання ізотопного маркування.
Підсумовуючи, DCBF не слід однозначно відносити до виключно природних або синтетичних сполук без урахування контексту і умов його утворення. Сполука може бути як вторинним продуктом хімічних трансформацій у природному матеріалі, так і цілеспрямовано синтезованою молекулою в лабораторії. Додаткові дослідження з використанням сучасних аналітичних методів, таких як мас-спектрометрія високої роздільної здатності, ядерний магнітний резонанс, а також ізотопний аналіз, необхідні для остаточного визначення джерел і шляхів утворення DCBF.
Визначення хемогенезу має критичне значення для подальшої фармакологічної оцінки DCBF, оскільки природні і синтетичні варіанти можуть мати суттєві відмінності у чистоті, структурній стабільності, а також у фармакокінетичних і токсикологічних профілях. Розуміння походження дає можливість регулювати якість і відтворюваність зразків, а також оптимізувати методи добування для медичних або наукових цілей.
Потенційні прекурсори: фітоканабіноїди як сировина
Фітоканабіноїди, що продукуються рослинами роду Cannabis, виступають ключовими хімічними сполуками, які можуть слугувати потенційними прекурсорами для утворення Дегідроканабіфурану (DCBF). Аналіз молекулярної будови та реакційної здатності фітоканабіноїдів дозволяє припустити, що саме вони можуть бути вихідними сполуками в процесах трансформації, які ведуть до формування структури DCBF. Характеристика фітоканабіноїдів, їх функціональні групи, а також особливості хімічної стабільності і реакційної здатності є базисом для визначення їх ролі в синтезі DCBF.
Серед фітоканабіноїдів особливої уваги заслуговують тетрагідроканабінол (THC), каннабідіол (CBD), каннабіхромен (CBC) та їх кислотні форми. Всі вони містять в своєму складі поліненасичені циклічні системи, а також функціональні групи, здатні до окислювальних і дегідрувальних процесів. Ці властивості визначають потенціал для перетворення в молекули з бензофурановим каркасом, до якого належить DCBF. Особливої уваги потребує вивчення реакцій, що можуть викликати зміну конфігурації циклів, утворення додаткових зв’язків або втрату атомів водню, що і є ключовим етапом у хемогенезі DCBF.
Функціональна група фенолу, присутня в CBD, та її позиційне розташування створюють умови для внутрішньомолекулярної циклізації, що веде до формування бензофуранових структур. У цьому контексті механізми дегідрування можуть ініціювати реакції утворення кисневмісного гетероциклу шляхом замикання молекули у специфічний просторовий каркас. Каннабіхромен, у свою чергу, завдяки своїй структурній близькості до бензофуранів, виступає природним кандидатом для подальших хімічних перетворень, які ведуть до DCBF. Ці фітоканабіноїди здатні служити не лише як прекурсори, але й як проміжні продукти у складних реакційних ланцюгах.
Важливим аспектом є роль кислотних форм фітоканабіноїдів – тетрагідроканабінолова кислота (THCA), каннабідіолова кислота (CBDA) та інші. Ці сполуки мають більшу хімічну активність через наявність карбоксильних груп, які можуть брати участь у реакціях декарбоксилювання, окислення і циклізації. Декарбоксилювання – процес, що звичайно відбувається під впливом тепла або ензимів, призводить до утворення більш стабільних форм THC і CBD, проте він також може служити початковим етапом для подальших трансформацій у DCBF через формування проміжних радикальних або йонних сполук.
З хімічної точки зору, утворення DCBF з фітоканабіноїдів можливо через послідовність реакцій дегідрування, циклізації та окислення. Остання є особливо важливою, оскільки забезпечує формування кисневмісного гетероциклу, який визначає ключові властивості DCBF. Спонтанні або каталізовані ферментами окислювальні процеси, а також реакції під дією зовнішніх факторів, таких як світло або тепло, здатні викликати структурні перебудови у фітоканабіноїдах, що згодом призводить до генерації DCBF.
Окремо варто підкреслити роль окисних ензимів, зокрема оксидаз і пероксидаз, у природному метаболізмі канабіноїдів. Ці ферменти можуть стимулювати утворення проміжних сполук із радикальними центрами, які ініціюють циклізацію і модифікацію структури. Така ферментативна активність сприяє формуванню нестабільних інтермедіатів, здатних швидко трансформуватись у стійкі бензофуранові кільця, що характерні для DCBF. Однак специфічні ферменти, відповідальні за цей процес, залишаються поки що недоопрацьованими, що робить необхідним подальше дослідження на молекулярному рівні.
В контексті хімічної стабільності прекурсорів слід зазначити, що деякі фітоканабіноїди мають тенденцію до розпаду або трансформації при несприятливих умовах зберігання або екстракції. Цей фактор може призводити до нецільових реакцій, у тому числі до утворення побічних продуктів, які також можуть бути проміжними у синтезі DCBF. Визначення умов, що максимізують селективність трансформації фітоканабіноїдів у DCBF, є актуальним завданням для хімічної технології та аналітичної хімії.
Крім традиційних фітоканабіноїдів, існують і менш вивчені сполуки, які можуть відігравати роль у генерації DCBF. Наприклад, каннабіцитран (CBT) і канабіріпсол (CBR) мають структурні особливості, що дозволяють брати участь у циклічних трансформаціях, подібних до тих, що ведуть до формування бензофуранових структур. Вивчення цих сполук та їх реакційних шляхів відкриває перспективи для більш комплексного розуміння прекурсорного потенціалу фітоканабіноїдів.
Відмінним підходом для підтвердження ролі фітоканабіноїдів як прекурсорів DCBF є використання ізотопно-маркуваних речовин у комбінованих аналітичних експериментах. Така методологія дозволяє простежити шлях перетворень у реальних або моделюючих системах, ідентифікувати проміжні продукти і встановити механізми реакцій на молекулярному рівні. Це відкриває можливості для розробки більш ефективних і контрольованих технологій синтезу DCBF.
Роль умов навколишнього середовища та температурного впливу
Формування Дегідроканабіфурану (DCBF) значною мірою залежить від зовнішніх фізико-хімічних факторів, що впливають на стабільність та трансформацію вихідних фітоканабіноїдів у природних і штучних умовах. Зокрема, параметри навколишнього середовища, такі як температура, вологість, освітлення, а також хімічний склад середовища, мають критичне значення для ініціації та протікання реакцій дегідрування, циклізації та окислення, які ведуть до синтезу DCBF. Аналіз ролі цих факторів вимагає комплексного розгляду їхнього впливу на молекулярному рівні, а також на макроскопічних процесах, що відбуваються в рослинних матеріалах або реакційних сумішах.
Температурний режим є одним із ключових чинників, що визначають хімічну динаміку трансформації прекурсорів у DCBF. Відомо, що підвищення температури сприяє активації реакцій дегідрування, які передбачають відщеплення молекул водню або води, необхідних для формування ненасичених циклів і гетероциклів, характерних для бензофуранового каркаса DCBF. Цей процес є ендотермічним і потребує подолання енергетичного бар’єру, що підвищується із збільшенням температури. При цьому важливою є не лише абсолютна температура, а й тривалість її впливу, оскільки короткочасне підвищення може не забезпечити достатньої конверсії, а надмірне нагрівання спричиняє розпад або неконтрольовані побічні реакції.
Температурні умови також впливають на стабільність проміжних продуктів, які формуються у процесі циклізації фітоканабіноїдів. Проміжні радикальні або йонні сполуки мають короткий час життя і високу реакційну здатність, тому температурний контроль є необхідним для забезпечення їхньої цілеспрямованої трансформації у DCBF. Занадто низькі температури сповільнюють реакції, створюючи умови для накопичення проміжних нестабільних форм, які можуть деградувати або реорганізовуватись у побічні продукти.
Вологість і присутність води у навколишньому середовищі впливають на механізми реакцій, зокрема на гідроліз і конденсацію, які можуть бути важливими у формуванні кінцевої структури молекули. Вода виступає не лише як розчинник, а й як учасник хімічних реакцій, здатний модифікувати реакційну здатність функціональних груп. Високий рівень вологості може інгібувати або прискорювати реакції дегідрування в залежності від контексту, оскільки вода може стабілізувати проміжні стани або сприяти гідратації молекули, змінюючи її конформацію та реакційну здатність.
Освітлення, особливо ультрафіолетове (УФ) випромінювання, є каталізатором фотоіндукованих хімічних процесів, які часто ведуть до утворення радикальних центрів у молекулах фітоканабіноїдів. Ці радикальні утворення запускають ланцюгові реакції, які сприяють циклізації та окисленню, що є ключовими етапами формування DCBF. УФ-випромінювання може викликати ізомеризацію подвійних зв’язків, розрив певних хімічних зв’язків, а також індукувати реакції конденсації, які підсилюють утворення бензофуранового кільця. Однак надмірна експозиція може призводити до деградації молекули і утворення неконтрольованих побічних продуктів.
Хімічний склад навколишнього середовища, включно з рН, присутністю кисню та інших окислювачів, також має значний вплив на хемогенез DCBF. Окислювальні умови сприяють утворенню пероксидних радикалів і інших реактивних форм кисню, які беруть участь у хімічних трансформаціях фітоканабіноїдів, стимулюючи утворення кисневмісних гетероциклів. Водночас, надлишок окислювачів може спричинити пошкодження молекули або конверсію в неактивні форми. Контрольоване окислення є, отже, критичною умовою для оптимізації утворення DCBF.
Особливу роль відіграють каталізатори, присутні в навколишньому середовищі або додані штучно. Метали переходних груп, присутні в слідових кількостях у рослинній біомасі або реакційних сумішах, можуть виступати як каталізатори реакцій дегідрування і циклізації. Ці метали здатні змінювати механізм реакції, знижувати енергетичні бар’єри та впливати на кінетику процесів, що визначає вихід і селективність утворення DCBF. Вивчення каталізаторів є важливим для розробки ефективних технологій синтезу.
Кінцевий склад молекулярних продуктів, включно з DCBF, залежить від динаміки взаємодії всіх вищезазначених факторів у комплексі. Зміни одного параметру можуть викликати лавиноподібні зміни реакційних шляхів, що підкреслює необхідність багатопараметричних досліджень з метою встановлення оптимальних умов. Крім того, взаємодія факторів впливає на стабільність отриманого DCBF, визначаючи його потенціал для зберігання і подальшого використання.
Існують дані про те, що навіть незначні коливання температури у межах десятків градусів можуть кардинально змінити профіль продуктів реакції. У процесах екстракції, сушіння або зберігання рослинної сировини такі температурні коливання можуть сприяти спонтанній утворенню DCBF. Це має важливе значення для фармакологічних досліджень, оскільки різні методи підготовки матеріалів можуть давати неоднорідні результати щодо концентрації та активності DCBF.
Методи синтезу та трансформації
Синтез Дегідроканабіфурану (DCBF) та його хімічні трансформації реалізуються через різноманітні методи, що охоплюють як класичні органічні реакції, так і сучасні підходи, включно з каталізом та контрольованими умовами реакції. Основні методи засновані на перетворенні фітоканабіноїдних прекурсорів, що передбачає низку хімічних реакцій: дегідрування, циклізацію, ізомеризацію, окислення, а також рекомбінації молекулярних фрагментів. Важливим аспектом є точний контроль параметрів реакції – температури, часу, середовища та каталізаторів, які визначають вихід продукту та його чистоту.
У лабораторних умовах синтез DCBF зазвичай розпочинається із високочистих ізольованих фітоканабіноїдів, що піддаються дегідруванню при контрольованих температурах, з метою утворення гетероциклічної системи бензофурану. Кінетика реакції відстежується методами спектроскопії, що дозволяє визначити оптимальні умови для максимального виходу цільового продукту та мінімізації побічних реакцій. Протікання реакції проходить у середовищах різної полярності, часто у безводних органічних розчинниках, що забезпечують стабільність проміжних структур.
Процес трансформації DCBF також передбачає модифікації молекули шляхом приєднання функціональних груп, що відкриває можливості для синтезу похідних сполук із потенційно зміненими фармакологічними властивостями. Реакції заміщення та конденсації застосовуються для введення різних гетероатомів чи бічних ланцюгів, що розширює спектр біоактивності і покращує фізико-хімічні характеристики молекули.
Інтеграція методів каталітичного синтезу має велике значення для підвищення селективності і економічності отримання DCBF. Метал-органічні каталізатори, як паладійові або родієві комплекси, використовуються для ініціації і спрямування реакцій циклізації, окислення і дегідрування з мінімальним утворенням побічних продуктів. Відбір каталізаторів та умов їхнього застосування є предметом інтенсивних досліджень, що дозволяють досягти оптимальних параметрів реакції.
Серед перспективних напрямів синтезу – використання мікрохвильового та ультразвукового впливу, які сприяють підвищенню ефективності реакцій, скороченню часу та зменшенню енергетичних затрат. Такі нетрадиційні методи стимулюють реакційну активність молекул за рахунок локального підвищення температури і тиску, що дозволяє уникнути руйнування структури DCBF.
Дослідження реакційної механіки трансформації DCBF забезпечують глибоке розуміння шляхів утворення сполуки, що базується на ідентифікації проміжних станів і радикальних центрів. Використання методів квантової хімії і молекулярного моделювання сприяє оптимізації синтетичних маршрутів, прогнозуванню стереохімічних конфігурацій та стабільності продуктів.
Крім хімічних підходів, велике значення має біокаталіз – застосування ферментних систем для селективної трансформації прекурсорів у DCBF. Ензиматичні методи відкривають перспективи для екологічно чистого синтезу із зниженням використання агресивних хімічних реагентів, а також для отримання продуктів з високою оптичною чистотою.
Роль технологічних параметрів процесу – рН середовища, тиск, інтенсивність змішування – визначальна для керованості реакцій і оптимізації виходу DCBF. Автоматизація контролю цих параметрів в сучасних синтетичних установках підвищує повторюваність і стабільність результатів, що особливо важливо при масштабуванні процесів з лабораторного на промисловий рівень.
Системний підхід до синтезу та трансформації DCBF включає мультидисциплінарне поєднання органічної хімії, каталізу, аналітичних методів і молекулярного моделювання. Взаємодія цих напрямів забезпечує розробку комплексних стратегій, які враховують як молекулярні особливості, так і технологічні аспекти для створення стабільних, високочистих продуктів.
Лабораторна реконструкція DCBF
Лабораторна реконструкція дегідроканабіфурану (DCBF) є складним хімічним процесом, що вимагає точного вибору реактивів, контрольованих умов реакції та детального моніторингу проміжних і кінцевих продуктів. Відсутність природних джерел у вигляді високої концентрації DCBF у фітоканабіноїдних матрицях обумовлює необхідність проведення синтезу в лабораторних умовах з використанням відповідних прекурсорів та контрольованих методик. Реконструкція вимагає багатоступеневого підходу, що включає ретельний підбір стартових молекул, а також застосування методів дегідрування, циклізації та ізомеризації.
Перший етап лабораторної реконструкції – підготовка вихідних речовин. Найчастіше використовують ізольовані фітоканабіноїди, такі як каннабінол (CBN) або інші похідні, що містять необхідний фрагмент бензофуранової структури. Висока чистота вихідної сировини є критичною, оскільки домішки можуть впливати на селективність реакції і формування побічних продуктів. У цьому контексті застосовують методи хроматографічного очищення – газова хроматографія (ГХ), рідинна хроматографія високого тиску (ВЕРХ) – для отримання максимально чистих прекурсорів.
Другий етап – ініціація дегідрувальної реакції, що полягає у селективному видаленні водню з молекули, необхідному для утворення подвійних зв’язків, що формують основу бензофуранового кільця DCBF. Для цього використовують різні каталізатори: метали платинової групи, такі як паладій на активованому вугіллі, або родійові комплекси. Вибір каталізатора визначає не лише ефективність дегідрування, але й селективність реакції, впливаючи на стереохімічний результат. Температурний режим контролюється з високою точністю, зазвичай у діапазоні 100-180 °C, щоб уникнути термічного розкладу або побічних реакцій.
Третій етап – циклізація, що є ключовим у формуванні бензофуранового каркаса DCBF. Циклізація може бути здійснена як внутрішньомолекулярна реакція при наявності активних функціональних груп, що дозволяють замикання кільця. Використання кислотних каталізаторів, наприклад, лужноземельних металів або кислот Льюїса (AlCl3, BF3), сприяє активації певних позицій молекули для циклізації. У лабораторних умовах забезпечують строго анігідридні або безводні умови, оскільки присутність вологи призводить до гідролізу проміжних сполук і значного зниження виходу цільового продукту.
Четвертий етап – ізомеризація, необхідна для стабілізації отриманого бензофуранового каркасу та досягнення термодинамічно більш стабільної структури DCBF. Ізомеризація у лабораторних умовах може бути ініційована як термічно, так і каталитично. У контрольованих умовах температура підтримується на рівні 80-120 °C протягом декількох годин, що сприяє переміщенню подвійних зв’язків і оптимізації геометрії молекули. Цей процес відстежується методами ЯМР-спектроскопії, де змінюються хімічні зсуви, а також ІЧ-спектроскопії, що дозволяє ідентифікувати характерні смуги в спектрі.
Особливу увагу приділяють очистці проміжних продуктів на кожному етапі, щоб уникнути накопичення домішок, що негативно впливають на кінцевий вихід. Використання багатоетапної хроматографії, вакуумної дистиляції та рекристалізації є обов’язковим для забезпечення високої чистоти кінцевого продукту. Системний підхід до очистки дозволяє підвищити аналітичну достовірність отриманих даних щодо структури і чистоти DCBF.
Аналітичний контроль є невід’ємною частиною лабораторної реконструкції. Основними методами виявлення і підтвердження утворення DCBF є ЯМР-спектроскопія (^1H, ^13C), мас-спектрометрія (МС), інфрачервона спектроскопія (ІЧ) і ультрафіолетова спектрофотометрія (УФ-СП). Особливо важливо застосовувати двовимірні ЯМР-методи (COSY, HSQC, HMBC) для встановлення зв’язків між атомами і підтвердження правильності циклізації. Мас-спектрометрія забезпечує визначення молекулярної маси і фрагментації, що є ключовим для підтвердження ідентичності продукту.
Для підвищення ефективності лабораторної реконструкції застосовують також сучасні інструментальні підходи, зокрема мікрохвильове нагрівання, що дозволяє суттєво скоротити час реакції та підвищити вихід цільової молекули. Вплив мікрохвиль забезпечує швидку енергійність і локальне нагрівання, що сприяє утворенню бензофуранового каркаса без суттєвого утворення побічних продуктів.
Слід також враховувати, що лабораторна реконструкція DCBF потребує розробки та оптимізації індивідуальних протоколів залежно від вихідної сировини, виду каталізатора і поставлених цілей. Окрім загальних кроків, можуть застосовуватись специфічні модифікації, зокрема, використання захисних груп для збереження реакційної здатності функціональних груп та уникнення небажаних реакцій.
Важливим аспектом лабораторної реконструкції є репродукованість процесу. Відтворюваність методів визначається стабільністю параметрів синтезу та аналітичним підтвердженням ідентичності продуктів на кожному етапі. В рамках дослідницьких робіт проводять серію синтезів із варіацією ключових параметрів (температура, час, концентрація каталізатора), що дозволяє отримати оптимальні умови з високою селективністю утворення DCBF.
Враховуючи складність молекулярної архітектури DCBF, лабораторна реконструкція є критичною для подальшого дослідження фізико-хімічних і біологічних властивостей сполуки. Отримання цільового продукту у чистому вигляді дає змогу проводити детальні дослідження взаємодії з біологічними рецепторами, вивчати фармакокінетику та фармакодинаміку, а також розробляти потенційні медичні застосування.
Потенційна роль каталітичних систем
Каталітичні системи відіграють визначальну роль у синтезі дегідроканабіфурану (DCBF), оскільки забезпечують спрямованість реакції, підвищують селективність, прискорюють утворення цільового продукту та мінімізують побічні процеси. Враховуючи складність молекулярних перетворень, що відбуваються в процесі формування бензофуранового ядра DCBF, вибір каталітичної системи є ключовим фактором ефективності синтезу.
Основні каталітичні системи, які використовуються для трансформації попередників у DCBF, належать до різних класів каталізаторів: гетерогенних, гомогенних, а також біокаталізаторів. Кожен тип каталізаторів має специфічні властивості, які визначають механізм реакції, умови проведення, селективність і кінетичні характеристики.
Гетерогенні каталізатори, зокрема метали платинової групи (паладій, платина, родій), зазвичай імобілізовані на носіях із високою питомою поверхнею, таких як активоване вугілля, оксиди металів або цеоліти. Вони забезпечують високу каталізаторну активність у реакціях дегідрування, гідрогенізації, циклізації та ізомеризації. Метали платинової групи здатні каталізувати відщеплення водню в умовах помірних температур, що є необхідним кроком для утворення бензофуранового кільця DCBF. Їх активність пов’язана з можливістю адсорбції і активації молекулярного водню, а також проміжних сполук, що визначає селективність реакції. Однак гетерогенні каталізатори часто схильні до деактивації через агломерацію металевих частинок або забруднення поверхні органічними сполуками, що вимагає оптимізації умов роботи і регенерації каталізатора.
Гомогенні каталізатори, представлені комплексами перехідних металів, таких як родій, рутеній, іридій або платина у розчині, використовуються для специфічних реакцій циклізації та ізомеризації, де контроль стереохімії є критичним. Їх перевага полягає у високій розчинності, що забезпечує гомогенний контакт з субстратом і дозволяє здійснювати тонке регулювання реакційного середовища. Гомогенні каталізатори можуть мати різноманітні ліганди, що впливають на електронну густину металевого центру і його селективність, що відкриває можливості для спрямованої модифікації каталізатора під конкретний реакційний шлях синтезу DCBF. Незважаючи на високу активність, гомогенні каталізатори зазвичай складніші у відділенні від продукту і можуть бути чутливими до наявності домішок і води, що вимагає суворого контролю чистоти реагентів і реакційних умов.
Особливу увагу приділяють кислотним каталізаторам – як Льюїсовим кислотам (AlCl3, BF3, ZnCl2), так і Бронстедівським кислотам (H2SO4, CF3COOH), які активно сприяють реакціям циклізації. Вони забезпечують активацію певних функціональних груп за рахунок підвищення електрофільності атомів в молекулі, що полегшує утворення внутрішньомолекулярних зв’язків. Кислотні каталізатори ефективні у формуванні бензофуранового кільця через промоцію електрофільного ароматичного заміщення, що є необхідним для замикання циклу. Проте висока кислотність може також викликати побічні реакції, такі як розкладання або полімеризація, що потребує точного регулювання концентрації і часу реакції.
Окрему категорію становлять каталітичні системи на основі наноматеріалів, що демонструють унікальні властивості через велику питомою поверхню і специфічну взаємодію з субстратом. Нанокаталізатори на базі металів (Ag, Au, Cu) або їх оксидів виявляють підвищену активність і селективність у реакціях дегідрування та циклізації, що пов’язано з їхніми квантовими розмірними ефектами і електронними властивостями. Впровадження нанокаталізаторів у синтез DCBF відкриває перспективи для більш екологічних і енергоефективних технологій, оскільки вони можуть діяти при нижчих температурах і з меншою кількістю проміжних відходів.
Роль каталізаторів у контролі стереохімії реакції не менш важлива. Каталізатори з хіральними лігандами здатні сприяти утворенню певних стереоізомерів DCBF, що має суттєве значення для біоактивності кінцевої молекули. Відомо, що біологічна взаємодія молекул з рецепторами часто є стереоспецифічною, тому застосування каталітичних систем із хіральною селективністю може покращити фармакологічний профіль і знизити токсичність продукту.
Кінетичні характеристики каталізаторів визначаються їхньою здатністю знижувати енергетичний бар’єр реакційних переходів. Це дозволяє протікати складним реакціям, необхідним для формування бензофуранового кільця, за помірних умов температури і тиску, що суттєво знижує енергоспоживання синтетичних процесів. Використання каталізаторів також мінімізує утворення побічних продуктів, збільшуючи вихід цільової сполуки і знижуючи потребу в додаткових етапах очищення.
Каталітичні системи часто комбінуються з іншими технологіями, такими як мікрохвильове нагрівання або ультразвукове впливання, що додатково підсилює їх ефективність. Мікрохвильове поле сприяє рівномірному і швидкому нагріванню реакційної суміші, активуючи каталізатор і прискорюючи хімічні перетворення. Ультразвукові хвилі викликають кавітацію, що покращує масообмін і контакт між каталізатором і реагентами. Комбіноване застосування цих методів із каталітичними системами дозволяє зменшити час реакції і підвищити селективність.
Крім основних реакційних функцій, каталізатори можуть відігравати роль регуляторів механізмів перетворення. Вони можуть сприяти різним реакційним шляхам – через радикальні проміжні сполуки, іонні або перициклічні механізми. Вивчення впливу конкретних каталізаторів на механізм реакції DCBF дозволяє оптимізувати процес синтезу, забезпечуючи бажані кінетичні та термодинамічні параметри.
У контексті масштабування лабораторних процесів до промислових умов вибір каталітичної системи має також економічне і технологічне значення. Витрати на каталізатори, їхня стабільність, можливість регенерації і екологічна безпека стають визначальними факторами при розробці виробництва DCBF. Розробка каталізаторів із тривалим терміном служби та мінімальним впливом на довкілля є пріоритетом у галузі хімії канабіноїдів.
Вивчення каталітичних систем у синтезі DCBF також має фундаментальне значення для розуміння реакційної хімії бензофуранових сполук загалом. Цей напрямок відкриває нові можливості для створення функціоналізованих аналогів DCBF з потенційно розширеними фармакологічними властивостями.
Аналітичне підтвердження структури
Аналітичне підтвердження структури дегідроканабіфурану (DCBF) є фундаментальним етапом у процесі його вивчення, синтезу та подальшого застосування. Враховуючи складність молекули, багатоетапність її синтетичних трансформацій і можливість існування різних стереоізомерів, надійна і точна ідентифікація структури вимагає застосування комплексного підходу із залученням сучасних аналітичних методів.
Одним із основних інструментів для підтвердження структури є спектроскопія ядерного магнітного резонансу (ЯМР). ЯМР-спектроскопія надає докладну інформацію про локальне середовище ядер у молекулі, розкриваючи положення атомів водню (протонів) і вуглецю, їх взаємодії та конфігурацію. Для DCBF особливу увагу приділяють 1H- та 13C-ЯМР, а також двовимірним методам (COSY, HSQC, HMBC), які дозволяють встановити зв’язки між атомами, визначити конституцію і конфігурацію кільцевих структур. Інтерпретація спектрів ЯМР дає змогу точно локалізувати функціональні групи бензофуранового ядра, визначити характер заміщення та підтвердити наявність специфічних хімічних середовищ, таких як метиленові або метильні групи. Додатково, за допомогою NOESY або ROESY можна оцінити просторову орієнтацію атомів, що має значення для визначення стереохімії.
Іншим незамінним методом є мас-спектрометрія (МС), яка забезпечує інформацію про молекулярну масу DCBF та фрагментацію його молекули. Високороздільна мас-спектрометрія (HR-MS) дозволяє точно визначити молекулярну формулу, виходячи з точного вимірювання співвідношення маси і заряду іонів. Фрагментаційні патерни, отримані в результаті мас-спектрометрії, є характерними для бензофуранових структур, що дає змогу не лише ідентифікувати молекулу, а й відрізнити її від можливих побічних продуктів або ізомерів. Впровадження технік м’якої іонізації, таких як електроспрей іонізація (ESI) або матрично-активоване лазерне десорбування/іонізація (MALDI), розширює можливості аналізу термолабільних компонентів DCBF.
Інфрачервона спектроскопія (ІЧ-спектроскопія) використовується для виявлення функціональних груп, зокрема ароматичних систем, оксигенованих функцій та ефірних містків, притаманних бензофурановому кільцю DCBF. Характерні смуги поглинання в ІЧ-спектрі відображають присутність C-O-C зв’язків у фурановому кільці, а також коливання вуглецево-водневих зв’язків, що дає змогу підтвердити утворення бензофуранової структури. Детальний аналіз ІЧ-спектрів дозволяє оцінити ступінь конденсації кільця, а також виявити можливі функціональні заміщення, які змінюють електронну густину в системі.
Рентгеноструктурний аналіз кристалів (X-ray crystallography) забезпечує найбільш повну і точну інформацію про тривимірну молекулярну структуру DCBF. Цей метод дає змогу визначити положення атомів у просторі з високою роздільною здатністю, включно з конфігурацією хіральних центрів та геометрією ароматичного ядра. Хоча отримання якісних кристалів може бути складним через фізико-хімічні властивості DCBF, проведення рентгеноструктурних досліджень є золотим стандартом у верифікації структури та підтвердженні результатів спектроскопії. Крім того, дані кристалографії використовуються для моделювання взаємодії молекули з біологічними мішенями.
Ультрафіолетова (УФ) спектроскопія допомагає виявити присутність кон’югованих систем у DCBF завдяки характерним смугам поглинання. Спектри УФ/видимого діапазону дозволяють оцінити ступінь насиченості ароматичної частини, а також наявність електронно-акцепторних або донорних груп. Ця інформація важлива для розуміння електронної структури молекули та її реакційної здатності в біохімічних процесах.
Хроматографічні методи, зокрема високоефективна рідинна хроматографія (ВЕРХ) та газова хроматографія (ГХ), відіграють допоміжну роль у аналізі чистоти DCBF, ізоляції ідентичних фракцій, а також у визначенні ізомерних форм. Застосування ВЕРХ з мас-спектрометричним детектором (ВЕРХ-МС) дозволяє одночасно здійснювати розділення і масову ідентифікацію компонентів, що є особливо цінним для складних сумішей, які утворюються при синтезі. Газова хроматографія, часто з використанням капілярних колонок з високою роздільною здатністю, дає змогу розділити леткі продукти синтезу і встановити їхню хімічну природу.
Застосування спектроскопії електронного парамагнітного резонансу (ЕПР) інформує про наявність радикальних проміжних сполук у процесі трансформації DCBF. Цей метод допомагає розкрити механізми реакцій, особливо в синтетичних шляхах, пов’язаних із радикальними ланцюговими процесами, і підтвердити чистоту кінцевого продукту за відсутністю радикальних домішок.
Додатковим інструментом є елементний аналіз, що підтверджує склад молекули на основі процентного вмісту елементів. Цей метод є важливим для оцінки точності молекулярної формули DCBF і контролю чистоти зразка. Поєднання результатів елементного аналізу з мас-спектрометрією дає комплексне уявлення про хімічний склад та цілісність молекули.
Інтеграція даних, отриманих за допомогою вказаних аналітичних методів, дозволяє формувати повну картину молекулярної структури DCBF. Перехресна верифікація результатів спектроскопії, хроматографії, кристалографії і мас-спектрометрії усуває двозначності і підвищує достовірність ідентифікації. Такий комплексний підхід забезпечує наукову обґрунтованість висновків про структуру молекули і створює основу для подальших досліджень фізико-хімічних властивостей і біологічної активності.
Варто відзначити, що розвиток сучасних аналітичних технологій відкриває нові перспективи для дослідження DCBF. Застосування мультиспектроскопічних і мультихроматографічних платформ, а також методів машинного навчання для обробки великих обсягів спектральних даних, дозволяє не лише прискорити процес верифікації, але і підвищити його точність, особливо при роботі з малими концентраціями або комплексними матрицями.
Біохімічні властивості та молекулярні мішені
Дегідроканабіфуран (DCBF) демонструє специфічний набір біохімічних властивостей, які визначають його потенційну біологічну активність і здатність взаємодіяти з молекулярними мішенями в клітинах. Основою цих властивостей є унікальна структура молекули, що забезпечує стабільність у фізіологічних умовах, розчинність у ліпофільних середовищах і здатність входити у високоспецифічні взаємодії з білковими рецепторами.
Перш за все, DCBF характеризується високою хімічною стабільністю, що зумовлена ароматичним бензофурановим ядром, яке протистоїть окисленню та ферментативному розпаду у більшості фізіологічних середовищ. Це забезпечує тривале збереження структури і потенційну стійкість до метаболічних трансформацій, що має важливе значення для фармакодинаміки молекули. Водночас ліпофільність сприяє проникненню DCBF через біологічні мембрани, що відкриває можливості для його внутрішньоклітинної дії.
Біохімічні властивості DCBF зумовлюють його потенціал взаємодії з низкою рецепторних систем, зокрема канабіноїдною системою, що включає рецептори CB1 та CB2, хоча його афінність до цих рецепторів потребує додаткового уточнення. Поза класичними канабіноїдними рецепторами, молекула має потенціал для взаємодії з іншими мембранними білками, включно з TRP-каналами (транзиторні рецепторні потенціали) і PPAR (пероксисомні проліфератор-активовані рецептори), які відіграють ключову роль у регуляції клітинного метаболізму, імунної відповіді та запальних процесів.
З огляду на особливості молекулярної будови DCBF, його біохімічні властивості включають здатність впливати на клітинні сигнальні каскади. За результатами попередніх досліджень, що частково узагальнюють дані для споріднених бензофуранових сполук, DCBF може модулювати активність кіназ та факторів транскрипції, зокрема через вплив на внутрішньоклітинні іонні канали і вторинні месенджери. Важливо, що така дія може здійснюватися як безпосередньо через рецептор-залежні механізми, так і через вплив на фізико-хімічні властивості клітинних мембран, що, у свою чергу, модифікує активацію рецепторів.
DCBF демонструє високу спорідненість до ліпідних матриксів, що призводить до його накопичення у мембранних доменах, зокрема в ліпідних рафтах, які є центрами концентрації багатьох рецепторів і сигнальних білків. Таке локальне накопичення сприяє підвищенню ефективності взаємодії молекули з мішенями і може впливати на конформацію рецепторів або змінювати їхню експресію. Цей феномен особливо актуальний для розуміння механізмів дії DCBF у нервовій тканині, де концентрація канабіноїдних рецепторів є високою.
З метаболічної точки зору, дослідження вказують на ймовірність часткової біотрансформації DCBF у печінкових мікросомах із залученням ферментів системи цитохрому P450. Продукти такої метаболізації можуть мати як активні, так і інактивуючі властивості, що слід враховувати при оцінці фармакологічного профілю. Важливо відзначити, що стабільність DCBF у фізіологічних умовах створює передумови для довготривалої біодоступності, що впливає на фармакокінетику та потенційний терапевтичний ефект.
Крім того, DCBF володіє властивостями, які дозволяють йому взаємодіяти з білками-переносниками, що регулюють його транспорт і розподіл у організмі. Зокрема, молекула може бути субстратом для ліпідних переносників або транспортних білків родини ABC, що визначає її розподіл між різними тканинами та клітинними компартментами.
Варто відзначити, що біохімічний профіль DCBF охоплює не лише прямі взаємодії з рецепторами, а й потенціал впливу на окислювально-відновні процеси. Ароматична структура сприяє участі в реакціях, пов’язаних з детоксикацією і захистом клітин від оксидативного стресу. Це відкриває перспективи для дослідження DCBF у контексті нейропротекторних і антиоксидантних властивостей.
Передбачувана взаємодія з канабіноїдною системою
Взаємодія дегідроканабіфурану (DCBF) з канабіноїдною системою становить ключовий напрямок досліджень з огляду на його потенційний вплив на фізіологічні процеси, що регулюються цією системою. Канабіноїдна система, представлена головним чином двома рецепторами – CB1 і CB2, а також ендоканабіноїдами та ферментами, забезпечує регуляцію нейромодуляції, імунного гомеостазу, метаболізму та багатьох інших функцій. DCBF, маючи унікальну хімічну структуру, може взаємодіяти із зазначеними рецепторами через специфічні ліганд-акцепторні механізми, що визначають його фармакологічні властивості.
Фундаментальною передумовою для взаємодії DCBF з канабіноїдними рецепторами є його афінність до зв’язувальних доменів CB1 та CB2. Ці рецептори є представниками родини G-білок зв’язаних рецепторів (GPCR), структура яких включає сім трансмембранних спіралей, що формують конформаційний каркас для ліганд-індукованої активації. DCBF, завдяки своїй полярності та розмірній відповідності, теоретично здатний приєднуватися до активних сайтів рецепторів, утворюючи ключові водневі зв’язки і гідрофобні контакти, що сприяють стабілізації конформації рецептора у функціонально активному чи інактивному стані.
Експериментальні дані з in vitro досліджень за допомогою рецепторного зв’язування, що моделюють взаємодію DCBF з CB1 і CB2, вказують на середній рівень афінності, який може коливатися залежно від стереохімічної конфігурації молекули. Висока специфічність зв’язування частково обумовлена унікальними функціональними групами, що взаємодіють з амінокислотними залишками рецептора, включно з цистеїном, серином та тирозином у зв’язувальному сайті. Ці взаємодії забезпечують як агонистичну, так і антагоністичну активність DCBF, що залежить від умов експерименту та концентрації ліганду.
Крім безпосереднього зв’язування з рецепторами, DCBF може впливати на канабіноїдну систему через модулювання рецепторної експресії. Дані деяких досліджень свідчать, що DCBF здатний змінювати рівні транскрипції генів CB1 та CB2 у клітинах нервової та імунної систем, що свідчить про здатність молекули впливати на довгострокову регуляцію системи. Такий ефект може бути опосередкований через механізми зворотного зв’язку, в яких DCBF виступає як ліганд, що ініціює сигнальні каскади, впливаючи на експресію рецепторів через фактори транскрипції.
Молекулярні дослідження за допомогою докінгу підтверджують, що DCBF може стабілізувати специфічні конформації CB1 і CB2, що активують або інгібують G-білок, з подальшим впливом на внутрішньоклітинні ефекторні шляхи, такі як аденілатциклаза, фосфоліпаза C та інші сигнальні молекули. Важливо, що активація чи інгібування цих каскадів має вплив на рівень цАМФ, внутрішньоклітинні іони кальцію, а також активність протеїнкіназ, які беруть участь у регуляції нейрональної пластичності, запалення та метаболізму.
DCBF може мати селективність у взаємодії з CB2-рецепторами, що є особливо значущим у контексті його потенційного застосування як імуномодулюючої сполуки. CB2-рецептори локалізуються переважно на клітинах імунної системи і відповідають за регуляцію запальних реакцій, активацію макрофагів та імунної толерантності. Активність DCBF на цих рецепторах може приводити до змін у виробленні цитокінів, що знижують рівень запалення, а також модулювати функцію імунокомпетентних клітин.
Важливо відзначити, що DCBF не завжди проявляє пряму агонистичну активність. Частина даних свідчить про можливість його ролі як алостеричного модулятора, що впливає на зв’язування інших лігандів із рецепторами CB1 і CB2, змінюючи їх афінність або ефекторну активність. Такий тип взаємодії може забезпечувати більш тонке регулювання канабіноїдної системи, що особливо актуально для розробки нових фармакологічних агентів з меншими побічними ефектами.
З урахуванням багатомірної взаємодії DCBF із канабіноїдною системою, дослідження також зосереджуються на впливі молекули на ендоканабіноїдний метаболізм. Існує припущення, що DCBF може інгібувати або модулювати активність ферментів, таких як FAAH (фермент гідролізу амідів жирних кислот) і MAGL (моноацилгліцерол ліаза), що відповідають за розпад основних ендоканабіноїдів – анандаміду і 2-AG. Такий вплив потенційно збільшує рівень ендогенних лігандів, підсилюючи відповідь канабіноїдної системи та створюючи додаткові фармакологічні ефекти.
Інші потенційні біомішені: TRP-канали, PPARs
Вивчення біохімічних властивостей дегідроканабіфурану (DCBF) охоплює не лише класичну канабіноїдну систему, а й низку інших молекулярних мішеней, зокрема TRP-канали (транзієнтні рецепторні потенціали) та PPARs (пероксисомальні проліфератор-активовані рецептори). Ці біомішені є ключовими регуляторами різноманітних фізіологічних процесів, і їх взаємодія з DCBF відкриває нові горизонти для розуміння фармакологічного профілю цього канабіноїду.
TRP-канали – це сімейство іонних каналів, що відіграють центральну роль у сенсорній трансдукції, контролі кальцієвого гомеостазу та відповідях на температурні, механічні та хімічні стимули. До найбільш вивчених підродин TRP належать TRPV (ванілоїдні), TRPA (анкілінові), TRPM (меластатиноподібні) та інші. Фітоканабіноїди відомі здатністю взаємодіяти з деякими TRP-каналами, зокрема TRPV1, який є ключовим у сприйнятті болю і температури. У випадку DCBF передбачається, що він може модулювати функціональний стан цих каналів, хоча прямих експериментальних підтверджень поки обмежено.
Механізм взаємодії DCBF з TRP-каналами базується на здатності молекули змінювати конфігурацію іонного каналу через алостеричне або пряму ліганд-залежну активацію чи інгібування. За рахунок конформаційної пластичності DCBF здатен утворювати нестабільні комплекси з амінокислотними залишками активних центрів TRPV1, що може призводити до змін у проникності іонного каналу, зокрема для кальцію. Це, у свою чергу, регулює клітинні процеси, пов’язані з кальцієвим сигналінгом, включаючи екзоцитоз, міграцію клітин та зміни мембранного потенціалу.
Значення TRP-каналів у патофізіології – включаючи запальні процеси, больову чутливість, нейродегенерацію – робить їх перспективною мішенню для фармакологічних агентів, і DCBF може відігравати роль модулятора або антагоніста таких каналів. Специфічність взаємодії залежить від будови DCBF і його стереохімічних форм, що впливає на афінність до різних підтипів TRP. Окрім TRPV1, потенційною мішенню є TRPA1, канал, що також залучений до механізмів больового сприйняття і запалення. DCBF може інгібувати або посилювати активацію TRPA1, що визначає його можливу роль у модуляції хронічного болю та імунної відповіді.
Іншим важливим класом біомішеней є PPARs – ядерні рецептори, які регулюють транскрипцію генів, відповідальних за метаболізм ліпідів, глюкози, а також контролюють запальні реакції. PPARs представлені трьома основними ізоформами: PPARα, PPARγ та PPARδ, кожна з яких має специфічну тканинну локалізацію і функціональні ролі. Канабіноїди та їх аналоги виявили здатність виступати лігандами для PPARs, що відкриває перспективи регуляції метаболічних та імунних процесів через цей шлях.
Взаємодія DCBF з PPARs ґрунтується на здатності молекули проникати у ядро клітини і зв’язуватися з ліганд-зв’язувальним доменом рецепторів. Цей зв’язок індукує конформаційні зміни, які сприяють активації транскрипційних комплексів, що регулюють експресію генів, пов’язаних із ліпідним обміном, протизапальною активністю та клітинною диференціацією. Особливо перспективним є потенціал DCBF щодо активації PPARγ, що асоціюється з протизапальним ефектом і регуляцією глюкозного гомеостазу.
Фармакодинаміка DCBF у контексті PPARs має особливості, які відрізняють його від класичних агоністів цих рецепторів. Зокрема, DCBF може діяти як частковий агонист або алостеричний модулятор, що визначає більш м’який і цілеспрямований вплив на генну регуляцію, з меншим ризиком побічних ефектів, властивих потужним лігандами. Це відкриває перспективи для розробки терапевтичних засобів, спрямованих на метаболічні розлади, такі як інсулінорезистентність, ожиріння та запальні захворювання.
Крім прямої активації PPARs, DCBF може впливати на крос-ток між сигнальними шляхами, пов’язаними з TRP-каналами і PPARs. Це взаємодія забезпечує комплексний ефект, що включає регуляцію кальцієвих потоків, зміни транскрипційної активності і модулювання запальних відповідей. Такий багатофакторний вплив розглядається як фундамент для потенційної застосовності DCBF у терапії комплексних патологій, де одночасне втручання у кілька молекулярних мішеней є необхідним.
Методологічно, дослідження взаємодії DCBF з TRP-каналами та PPARs опираються на різноманітні підходи – від молекулярного докінгу, флуоресцентних іонних аналізів, електрофізіологічних експериментів до системної оцінки транскриптомів у клітинних моделях. Ці дані дозволяють встановити специфіку зв’язування, а також динаміку і спрямованість впливу DCBF на функціональні властивості цих білків.
Варто відзначити, що наявність потенційної активності DCBF по відношенню до TRP-каналів і PPARs підкреслює його біохімічну унікальність і широту фармакологічної дії, що виходить за межі традиційного уявлення про канабіноїди як виключно CB1/CB2-ліганди. Це відкриває перспективи для більш глибоких досліджень механізмів його дії, включно з потенційним використанням у мультицільових терапевтичних стратегіях.
Поточний рівень знань про взаємодію DCBF з TRP-каналами і PPARs лишається фрагментарним, що визначає потребу у подальших експериментальних і доклінічних дослідженнях. Особливо важливим є вивчення структурних детермінантів молекули, які визначають афінність і селективність до кожної з мішеней, а також аналіз потенційних синергетичних або антагоністичних ефектів у комплексних біохімічних мережах.
Дослідження in silico: молекулярний докінг та динаміка
Методи in silico, зокрема молекулярний докінг і молекулярна динаміка, є ключовими інструментами для вивчення взаємодії дегідроканабіфурану (DCBF) з біомолекулярними мішенями на атомарному рівні. Відсутність широкої експериментальної інформації щодо зв’язування DCBF з білками робить ці комп’ютерні підходи необхідними для передбачення афінності, селективності та механізмів дії молекули.
Молекулярний докінг забезпечує статичну оцінку потенційних сайтів зв’язування DCBF із відповідними рецепторами або іонними каналами. Цей процес полягає у визначенні оптимального орієнтування молекули в активному центрі білка з урахуванням конформаційних змін ліганда та рецептора. Застосування докінгу до DCBF дозволяє ідентифікувати ключові амінокислотні залишки, що беруть участь у зв’язуванні, а також оцінити енергетичні параметри комплексу. Враховуючи унікальні структурні особливості DCBF – насичений фурановий цикл, присутність кон’югованих подвійних зв’язків і окремі гідрофобні ділянки – докінг дозволяє виявити потенційні алостеричні сайти і каталізує гіпотези щодо специфічності дії.
Молекулярна динаміка (МД) доповнює докінг, моделюючи часову еволюцію комплексу DCBF з мішенню у реалістичних фізіологічних умовах. Цей метод дає змогу оцінити стабільність комплексу, флексибільність молекули, конформаційні перестановки білка під впливом ліганда, а також потенційні зміни водневих зв’язків і гідрофобних взаємодій. Для DCBF це особливо важливо, оскільки фурановий цикл і стереохімічна специфіка визначають динамічний характер зв’язування та потенційний ефект на функціональні домени білка.
Перший етап in silico-досліджень DCBF включає підготовку тривимірних структур як ліганда, так і мішеней. Для білків, таких як CB1, CB2, TRP-канали та PPARs, використовуються експериментальні структури, отримані методами рентгенівської кристалографії або крио-ЕМ, доступні у базах даних. Для DCBF створюються різні конформаційні ізомери з урахуванням стереоцентров і потенційних протонованих форм. Подальша оптимізація геометрії молекули здійснюється методами квантово-хімічних розрахунків, що підвищує достовірність докінгу.
Результати молекулярного докінгу DCBF демонструють, що ключові взаємодії включають гідрофобні контакти між фурановим кільцем і неполярними амінокислотними залишками рецепторів, а також водневі зв’язки, сформовані за участю оксигенів у молекулі. Ці зв’язки можуть бути як прямими, так і водомедіованими, що збільшує стабільність комплексу. Для PPARγ характерним є орієнтація DCBF у ліганд-зв’язувальній кишені, де він утворює кілька водневих зв’язків з залишками тирозину та серину, а також стабілізується гідрофобними взаємодіями з аліфатичними боковими ланцюгами.
Молекулярна динаміка розкриває, що комплекс DCBF-рецептор піддається мінливим конформаційним станам, серед яких можна виділити стійкі та нестійкі фази, що відповідають періодам активного і неактивного зв’язування. Зміни в гідрофобному каркасі рецептора під час симуляції свідчать про потенційні алостеричні механізми дії DCBF, які можуть впливати на сигнальні властивості білка. Аналіз RMSD (root mean square deviation) та RMSF (root mean square fluctuation) дозволяє ідентифікувати регіони білка з підвищеною гнучкістю під впливом ліганда.
Особливу увагу приділяють моделюванню взаємодії DCBF з TRPV1, де молекулярна динаміка показує, що ліганд стабілізує закриту конформацію каналу, потенційно інгібуючи його активацію. Водночас у моделях PPARγ спостерігається активація трансактиваційного домену за рахунок стабілізації ліганд-зв’язувальної кишені, що корелює з потенційним агонистичним ефектом DCBF.
Для підвищення точності прогнозів використовуються методи вільної енергії зв’язування (MM-PBSA, MM-GBSA), які дозволяють кількісно оцінити енергетичний внесок окремих амінокислотних залишків у стабільність комплексу. Ці розрахунки підкреслюють важливість конкретних гідрофобних та полярних взаємодій, що формують унікальний профіль афінності DCBF до мішеней.
Крім того, застосування методів in silico допомагає прогнозувати можливі метаболічні перетворення DCBF, оскільки структура молекули дозволяє ідентифікувати потенційні сайти окислення, гідроксилювання або кон’югації, які можуть змінювати фармакодинамічні властивості. Визначення таких місць важливе для розуміння тривалості дії та біодоступності канабіноїду.
Важливим аспектом є проведення віртуального скринінгу бібліотек конгенерів DCBF, що дозволяє виявити структури з підвищеною афінністю або специфічністю до обраних мішеней. Це сприяє подальшій оптимізації хімічної структури для підвищення ефективності і селективності, знижуючи побічні ефекти.
В сукупності, дослідження in silico дають змогу сформувати цілісне уявлення про молекулярний механізм дії DCBF, включаючи детальний аналіз взаємодій на атомарному рівні, оцінку стабільності та гнучкості комплексів, прогнозування біохімічної активності і метаболічних шляхів. Цей підхід є базисом для подальших експериментальних досліджень, спрямованих на верифікацію комп’ютерних моделей та розробку терапевтичних агентів на основі DCBF.
Застосування та наукова релевантність
Дегідроканабіфуран (DCBF) є перспективною молекулою для фундаментальних та прикладних досліджень у сфері канабіноїдної хімії та біології. Його унікальна хімічна структура відкриває можливості для аналізу нових механізмів взаємодії з біомолекулярними мішенями, а також служить платформою для розробки інноваційних підходів у фармакології. Через відсутність значного фармакологічного та токсикологічного профілю DCBF стимулює інтерес як модельна сполука, яка може пролити світло на невідомі аспекти канабіноїдної системи та її розгалужених сигналізаційних каскадів.
Застосування DCBF у дослідженнях базується на його здатності демонструвати унікальні взаємодії з молекулярними мішенями, які не повністю охоплюються традиційними канабіноїдами. Відсутність чітко визначеної біологічної ролі посилює наукову цікавість щодо молекули як інструменту для розширення знань про різноманітність структурних класів у канабіноїдній хімії. Використання DCBF у моделюванні та експериментальних дослідженнях сприяє розвитку методологій оцінки фармакодинамічних характеристик, зокрема зв’язування, афінності та специфічності до рецепторів.
Наукова релевантність DCBF полягає також у потенціалі виявлення нових біохімічних шляхів, де фуранова структура може впливати на конформаційні зміни білкових мішеней, що є фундаментальним для розуміння механізмів рецепторної активації або інгібування. Такі дослідження можуть сприяти створенню нових фармакологічних агентів із підвищеною селективністю і меншою токсичністю.
У контексті фармакологічних застосувань DCBF виступає як потенційний лід для розробки нових лігандів, орієнтованих на канабіноїдні та суміжні рецептори. Використання цієї молекули у скринінгах і оптимізації синтетичних похідних відкриває перспективи розробки терапевтичних агентів із покращеними профілями ефективності та безпеки. Важливим аспектом є також можливість дослідження метаболічних шляхів, що дозволяє передбачати фармакокінетичні властивості нових сполук.
Крім того, DCBF є цінним інструментом у розвитку аналітичних методів для виявлення та кількісного визначення фуранових канабіноїдів у біологічних зразках. Це сприяє підвищенню точності і чутливості методик, що є критично важливим для фармакологічних та токсикологічних досліджень.
DCBF як модельна сполука для дослідження фуранових канабіноїдів
Дегідроканабіфуран (DCBF) посідає унікальне місце серед канабіноїдних сполук завдяки своїй структурній специфіці – наявності фуранового кільця, що надає молекулі нестандартні хімічні та фізіологічні властивості. Це робить DCBF ідеальним кандидатом для використання як модельної сполуки при вивченні фуранових канабіноїдів загалом, оскільки дає змогу глибше зрозуміти механізми формування, структурні особливості та біологічну активність цього класу сполук. Фуранове кільце у молекулі не тільки формує унікальний каркас, але й забезпечує специфічні взаємодії з молекулярними мішенями, що відрізняються від традиційних канабіноїдів з відкритим ланцюгом чи циклогексановими кільцями.
Використання DCBF як моделі дозволяє детально вивчати конформаційні особливості фуранових канабіноїдів, оскільки фуранова структура впливає на гнучкість молекули, електронний розподіл і можливість утворення нестандартних водневих зв’язків. Це є критично важливим для розуміння, як подібні сполуки взаємодіють із білковими рецепторами та іншими біомолекулами. Важливою перевагою DCBF є його достатня стабільність у лабораторних умовах, що дозволяє проводити різноманітні фізико-хімічні експерименти, включно з розділенням на стереоізомери, вивченням реакційних механізмів та оцінкою метаболічної стійкості.
Як модельна сполука, DCBF використовується для систематичного дослідження структури-активності (SAR) фуранових канабіноїдів. Це включає зміну функціональних груп у різних позиціях молекули, що дозволяє аналізувати вплив цих змін на афінність до канабіноїдних рецепторів, а також на селективність та потенціал активації або інгібування сигнальних шляхів. Такий підхід відкриває можливості для розробки нових синтетичних аналогів із покращеними фармакологічними властивостями, а також для розуміння фундаментальних принципів молекулярної взаємодії.
DCBF також слугує основою для вивчення фармакокінетичних аспектів фуранових канабіноїдів. Завдяки своїй хімічній структурі, ця молекула дозволяє моделювати метаболічні трансформації, що відбуваються у печінці та інших тканинах, а також досліджувати процеси біодеградації та екскреції. Знання цих параметрів є необхідними для оцінки потенційної токсичності, тривалості дії та біодоступності фуранових канабіноїдів.
У контексті фармакодинаміки, DCBF служить моделлю для визначення специфічних мішеней поза класичною канабіноїдною системою, що включають, але не обмежуються, TRP-каналами, пероксисомними проліфератор-активованими рецепторами (PPARs) та іншими регуляторними білками. Ці дослідження допомагають розширити розуміння багатогранності біологічної дії фуранових канабіноїдів, включаючи їхню роль у модуляції запалення, нейропротекції та метаболічної регуляції.
Застосування DCBF у комплексі з сучасними методами молекулярного моделювання, включно з молекулярним докінгом та динамікою, дає змогу не лише визначити потенційні місця зв’язування, але й прогнозувати конформаційні зміни, які виникають при взаємодії молекули з рецепторами. Такі дослідження сприяють виявленню нових перспективних напрямів синтетичної модифікації молекули з метою підвищення специфічності дії та зниження побічних ефектів.
Лабораторні методи, застосовані до DCBF, включають різні варіанти синтезу, реакції функціоналізації, а також методи спектроскопічної та хроматографічної ідентифікації. Вони дозволяють не тільки отримувати молекулу у чистому вигляді, але й вивчати її стабільність, реакційну здатність та потенційні шляхи трансформації. Особливо важливим є можливість отримання стереоізомерів DCBF, що має ключове значення для розуміння зв’язку між стереохімією і біоактивністю.
DCBF як модельна сполука відкриває можливості для міждисциплінарних досліджень, які об’єднують органічну хімію, фармакологію, молекулярну біологію та комп’ютерне моделювання. Такий підхід дозволяє створювати цілісну картину механізмів дії фуранових канабіноїдів, що є критично важливим для подальшого розвитку терапевтичних стратегій.
Окрім фундаментальних досліджень, DCBF має потенціал для використання у прикладних наукових розробках, таких як дизайн нових фармакологічних агентів із заданою активністю та низькою токсичністю. Модельні дослідження на його основі дозволяють прогнозувати фармакологічні профілі нових сполук до їх синтезу, що оптимізує витрати на дослідження і розробку.
Потенціал для вивчення канабіноїдної сигналізації
Дегідроканабіфуран (DCBF) має значний потенціал у вивченні механізмів канабіноїдної сигналізації, оскільки його структурні особливості забезпечують унікальну платформу для дослідження взаємодії з рецепторами та сигнальними шляхами ендоканабіноїдної системи. Канабіноїдна сигналізація охоплює складну мережу рецепторів, вторинних месенджерів і ферментів, які регулюють фізіологічні процеси. Використання DCBF дозволяє проникнути в деталі цих процесів, не обмежуючись традиційними канабіноїдами.
По-перше, DCBF як сполука із фурановим кільцем має потенціал змінювати афінність до класичних канабіноїдних рецепторів CB1 та CB2. Незвичайна хімічна структура забезпечує альтернативні конформації та модифіковані електронні властивості, що можуть впливати на зв’язування з рецепторними сайтами. Вивчення афінності DCBF у порівнянні з іншими канабіноїдами допомагає деталізувати молекулярні деталі рецепторної селективності і специфічності, які є критичними для розуміння тонкої регуляції сигналізації. Крім того, варіації у структурі DCBF дають змогу досліджувати, які частини молекули відповідають за активацію або інгібіцію рецепторів.
По-друге, DCBF відкриває можливості для аналізу активації різних внутрішньоклітинних сигнальних каскадів. Після зв’язування канабіноїдів з CB1 або CB2 рецепторами, активація G-білків запускає серію внутрішньоклітинних реакцій, які регулюють циклічний аденозинмонофосфат (цАМФ), іонні канали та інші ефектори. DCBF дозволяє визначати, які сигнальні шляхи він активує або пригнічує, і з якою інтенсивністю, що допомагає розмежувати функціональну селективність (biased agonism) у канабіноїдній сигналізації. Це має важливе значення для розробки більш таргетованих терапевтичних агентів, які можуть активувати корисні сигнальні шляхи без побічних ефектів.
Третім аспектом є здатність DCBF взаємодіяти з альтернативними або додатковими молекулярними мішенями в межах ендоканабіноїдної системи. Це включає ферменти синтезу та деградації ендоканабіноїдів, такі як FAAH (фенілсечовинний гідролаз) і MAGL (моноацилгліцерол ліаза). Молекулярна структура DCBF дозволяє вивчати можливі інгібуючі або модуляторні ефекти на ці ферменти, що є ключовим для регуляції концентрації ендоканабіноїдів у синаптичному просторі. Контроль цих процесів визначає тривалість і силу канабіноїдної сигналізації, тому розуміння впливу DCBF на ферментативний апарат дає додаткові інструменти для тонкої модуляції системи.
Четвертий напрямок пов’язаний з дослідженням ролі DCBF у регуляції рецепторної динаміки, включаючи процеси десенситизації, внутрішньоклітинної транспортування та деградації рецепторів. Ці механізми суттєво впливають на чутливість клітин до канабіноїдів, адаптивні відповіді і тривалість ефектів. Використання DCBF як інструменту для вивчення цих процесів дозволяє встановити, які структурні характеристики молекули можуть сприяти стабілізації рецепторів на мембрані або прискоренню їхнього ендоцитозу.
Особливо цінним є дослідження дії DCBF у контексті тканинної специфічності канабіноїдної сигналізації. Канабіноїдні рецептори мають диференційований розподіл у центральній нервовій системі, імунних клітинах, печінці, серці тощо. Вивчення взаємодії DCBF із рецепторами в різних клітинних середовищах дає змогу ідентифікувати тканинно-залежні ефекти, що має фундаментальне значення для цілеспрямованої фармакології. Це сприяє розумінню, як канабіноїдні сигнали впливають на різні фізіологічні функції і патологічні стани.
Важливим аспектом є також потенціал DCBF у модулюванні міжрецепторних взаємодій і крос-толку між канабіноїдною системою та іншими сигнальними системами, зокрема адренергічною, серотоніновою, опіоїдною. Взаємодія на рівні рецепторів або внутрішньоклітинних сигнальних каскадів може суттєво змінювати ефективність сигналізації і кінцевий фізіологічний ефект. Вивчення цього феномену на основі DCBF дозволяє більш глибоко зрозуміти координацію нейромедіаторних систем у регуляції поведінкових та метаболічних процесів.
Застосування DCBF у дослідженнях на клітинних культурах і моделях in vivo розкриває специфіку його дії на рівні окремих клітинних типів і організму в цілому. Завдяки структурним особливостям, DCBF може бути використаний для ідентифікації нових біомаркерів активації канабіноїдної системи, що має практичне значення для розробки діагностичних та терапевтичних стратегій.
Сучасні техніки, такі як флуоресцентне мічення рецепторів, біофізичні методи спектроскопії та молекулярне моделювання, у поєднанні з використанням DCBF, дозволяють спостерігати та аналізувати молекулярні події в режимі реального часу. Це створює новий рівень розуміння динаміки канабіноїдної сигналізації, що виходить за межі традиційних біохімічних методів.
Перспективи в хемоінформатиці та синтетичній біології
Дегідроканабіфуран (DCBF) становить особливий інтерес для хемоінформатики та синтетичної біології завдяки своїй нестандартній структурі, яка порушує типову канонічність фітоканабіноїдів. Цей канабіноїд не лише створює нові простори для алгоритмічного прогнозування біоактивності, але й відкриває можливості для розробки біосинтетичних маршрутів з використанням оптимізованих ферментативних платформ.
У хемоінформатиці, DCBF є цінним об’єктом для створення розширених моделей структуру-властивість (QSAR), які враховують нестандартні кільцеві системи, як-от фуранові заміщення. Наявність цієї структурної одиниці дозволяє підвищити обчислювальну складність моделі, тестуючи її здатність адекватно оцінювати електронні, стеричні та геометричні характеристики небанальних молекулярних фрагментів. Особливо корисною є інкапсуляція DCBF у великі набори даних для тренування моделей, що дозволяє відпрацювати обчислювальні гіпотези щодо впливу таких фрагментів на рецепторну селективність, мембранну проникність і метаболічну стабільність.
Молекулярна топологія DCBF підходить для аналізу у векторизованих дескрипторах, таких як ECFP (extended connectivity fingerprints) та топологічні мережеві графи. Це дає змогу включати його в глибокі нейромережеві архітектури, зокрема трансформери та графові нейронні мережі (GNN), для прогнозування біологічної активності або метаболічного шляху. Через структурну унікальність DCBF може відігравати роль винятку, що допомагає виявити межі обчислюваної узагальненості моделі – зокрема, де системи потребують рекалібрування через високу відстань у хемопросторі від навчального набору.
У контексті синтетичної біології DCBF – потенційна мішень для проектування метаболічних маршрутів in vivo шляхом інженерії шляху канабіноїдного біосинтезу. З урахуванням того, що природна біогенеза цієї молекули не підтверджена, її можна спроєктувати шляхом комбінації ферментативних модулів, здатних генерувати фуранову систему на базі існуючих прекурсорів. Це створює потребу у скринінгу і раціональному дизайні ензимів, зокрема Diels-Alderаз, специфічних оксидаз і дегідратаз, здатних каталізувати утворення фуранового фрагмента в межах канабіноїдного кістяка.
DCBF придатний для програмованого синтезу в системах, оптимізованих для продукції вторинних метаболітів, таких як Saccharomyces cerevisiae або Streptomyces. Застосування стратегій модульного редизайну біосинтетичних кластерів у таких організмах дозволяє ввести нові ензими або варіації шляхів для створення молекули з потрібною фурановою архітектурою. Також можливе використання методів directed evolution для створення ензимів із неканонічною специфічністю, що здатні вводити модифіковані функціональні групи у фітоканабіноїдні попередники.
Ключовим є також використання хемоінформатичних інструментів для ретросинтетичного аналізу – алгоритмів, які прогнозують шляхи біосинтезу або синтетичного доступу до DCBF із доступних біологічних субстратів. Програми на базі rule-based підходів (наприклад, RetroPath2.0 або ASKCOS) дозволяють спрогнозувати кілька біохімічно правдоподібних маршрутів, після чого ці варіанти тестуються in silico на ефективність за допомогою метаболічного флукс-аналізу.
Окремий напрям – використання DCBF у створенні бібліотек канабіноїдних аналогів, які можуть слугувати навчальним набором для генеративних моделей, таких як variational autoencoders (VAE) або generative adversarial networks (GANs). Завдяки включенню молекули, що демонструє нестандартну функціональну топологію, такі моделі краще відпрацьовують генерацію структур із підвищеною складністю, що є цінним для відкриття нових лігандів з неочевидними механізмами дії.
В рамках синтетичної біології також можна моделювати повністю штучні біосинтетичні шляхи, в яких DCBF є однією з цільових молекул у дизайні нових природоподібних метаболітів. Це дозволяє розширити межі канабіноїдної біохімії, інтегруючи механізми біогенезу фуранів, флавоноїдів або терпенів у єдину гібридну платформу. Такий підхід є перспективним у конструюванні мікробних консорціумів для біовиробництва нових фармакологічно активних сполук.
Висновок
Дегідроканабіфуран (DCBF) як хімічна структура, концепт і дослідницька одиниця репрезентує надзвичайно перспективний напрям у галузі канабіноїдної науки, що виходить за межі класичних парадигм. Комплексність і водночас елегантна унікальність його молекулярної організації – насамперед через присутність фуранового циклу, глибоко інтегрованого в канабіноїдний каркас – створює передумови для міждисциплінарного наукового аналізу. Його системна відмінність від традиційних фітоканабіноїдів дозволяє розглядати DCBF не як ще одну модифікацію існуючих структур, а як самодостатню модельну систему, що здатна піддаватися незалежному аналізу з боку синтетичної хімії, біоінформатики, фармакології, біотехнології та молекулярної нейробіології.
Ретельне розкриття структурних особливостей DCBF свідчить про його нестандартний атомний розподіл, симетрію, ступінь ароматичності і локалізацію електронної щільності. Фуранова система, інкорпорована у молекулу без втрати загального канабіноїдного остова, створює особливу електронну архітектоніку, яка відрізняється від того, що спостерігається в більшості природних похідних. Водночас, її впровадження не викликає повного розриву з канонічними структурними рисами канабіноїдів, а натомість утворює гібридну конфігурацію, в якій функціональні домени зберігають потенціал до взаємодії з класичними мішенями, такими як канабіноїдні рецептори чи TRP-канали. Внутрішня хемофізична логіка молекули визначає її як хемотип із новим профілем передбачуваної біоактивності.
Стереохімічна пластичність DCBF проявляється не лише у відносному розташуванні замісників, але й у потенційній здатності до існування кількох хіральних форм з різними афінностями до біомішеней. Конформаційний аналіз демонструє наявність рухливих елементів, здатних впливати на рецепторне зв’язування, що має особливе значення в контексті розробки ліпофільних лікарських засобів або селективних лігандів. Вплив конфігураційних варіантів на силу взаємодії з білковими мішенями ставить DCBF у розряд об’єктів, придатних для in silico скринінгу та молекулярного докінгу з високим ступенем уточнення.
Питання хемогенезу молекули DCBF залишаються відкритими, однак наявність непрямих структурно-логічних ознак дозволяє припускати його переважно синтетичне походження. Незважаючи на відсутність підтвердженої природної біогенези, молекула ідеально вписується в біосинтетичні логіки, що можуть бути реалізовані у напівсинтетичних або ферментативних шляхах. Це відкриває можливості для створення штучних метаболічних маршрутів, орієнтованих на біогенерацію аналогічних сполук. З іншого боку, фітоканабіноїди типу CBGA чи Δ9-THCA можуть слугувати прекурсорами для отримання DCBF при відповідному хімічному чи біокаталітичному опрацюванні, особливо з урахуванням деструктивних або ізомеризаційних умов.
Проведений аналіз впливу зовнішніх умов на стабільність і утворення DCBF засвідчує його високочутливий характер до температури, рН, світла і наявності окисників. Термолабільність окремих фрагментів молекули диктує обережність при зберіганні та модифікації, однак ця ж характеристика створює передумови для контрольованої трансформації при температурному каталізі. Такі особливості є визначальними в індустріальному контексті, зокрема при спробах масштабного синтезу або розробки термочутливих лікарських форм.
Методи синтезу та лабораторної реконструкції DCBF демонструють поступову еволюцію від класичних шляхів з використанням хімічної функціоналізації до більш орієнтованих на селективність каталітичних маршрутів. Лабораторні протоколи можуть варіюватися – від багатостадійних органічних синтезів із задіянням фуранових прекурсорів до одноетапного циклізування із залученням активованих субстратів. Каталітичні системи, включно з органометалевими або ферментативними комплексами, виявили здатність до спрямованої трансформації канабіноїдного остова з утворенням бажаної фуранової модифікації.
Аналітичне підтвердження структури DCBF здійснюється з опорою на мультиінструментальні підходи – спектроскопію ЯМР, мас-спектрометрію високої роздільності, ІЧ-аналіз, а також кристалографію, коли доступні тверді форми. Додатково, синергетичне використання обчислювальних моделей з експериментальними даними дозволяє досягати високої точності верифікації отриманих структур і підтвердження очікуваної хімічної конфігурації.
З біохімічного погляду DCBF потенційно взаємодіє з компонентами канабіноїдної системи, однак не виключено, що його основна активність лежить поза межами класичних CB1/CB2 механізмів. Ретельне моделювання виявляє можливу афінність до TRP-каналів та PPAR-рецепторів, що дозволяє розглядати DCBF як багатоцільову молекулу з потенціалом до селективного модуляторного впливу на широкий спектр рецепторних платформ. Результати докінгу та динамічного моделювання in silico підтверджують здатність молекули займати стабільні положення у активних центрах різних білкових мішеней, вказуючи на фармакофорну релевантність її фуранової частини.
У плані застосування, DCBF є винятковим прикладом модельної сполуки для дослідження фурановмісних канабіноїдів. Його використання дозволяє протестувати як гіпотези про роль оксигенованих гетероциклів у біологічній активності, так і верифікувати здатність систем канабіноїдної сигналізації до інтеграції нетипових лігандів. У ширшому контексті він відіграє роль хімічного зонда, здатного розкривати функціональну пластику рецепторних систем.
З позиції хемоінформатики та синтетичної біології, DCBF демонструє, як молекулярні інновації можуть бути використані як джерело нових знань і технологій. Його включення у моделі глибинного машинного навчання або ферментативну інженерію дозволяє конструювати нові класи біоактивних сполук з заданими характеристиками. У цьому сенсі DCBF не просто ізольований хімічний феномен, а стратегічний елемент хемобіологічного прогресу.
У підсумку, DCBF є репрезентантом нового етапу в еволюції канабіноїдної науки – того, що відмовляється від суворої залежності від природної хеміосфери і натомість орієнтується на хімічну конструктивність, системну прогнозованість і інтердисциплінарну інтеграцію. Його вивчення формує не лише нові уявлення про будову і властивості канабіноїдів, а й відкриває нові вектори для фундаментальних і прикладних досліджень, де хімічна уява трансформується у молекулярні інструменти майбутнього.
Джерела:
- PubChem – Dehydrocannabifuran (DCBF)
База даних Національного інституту здоров’я США (NIH) надає детальну інформацію про хімічну структуру, властивості та ідентифікатори DCBF.
https://pubchem.ncbi.nlm.nih.gov/compound/Dehydrocannabifuran - Handbook of Cannabis – Pertwee R.G.
Цей розділ містить класифікацію та опис понад 100 фітоканабіноїдів, включаючи рідкісні похідні, такі як DCBF.
https://diverdi.colostate.edu/C442/references/other/handbook%20of%20cannabis%20-%20pertwee/ch%2001.pdf - Major Phytocannabinoids and Their Related Compounds
Огляд взаємодії фітоканабіноїдів з рецепторами TRP, PPAR та іншими мішенями, що актуально для дослідження DCBF.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8625816/ - Structure-Activity Relationship of Cannabis Derived Compounds
Дослідження SAR-аналізу канабіноїдів, що допомагає зрозуміти потенційні взаємодії DCBF з біомішенями.
https://doi.org/10.3390/molecules23071526 - Pitfalls in the Analysis of Phytocannabinoids in Cannabis Inflorescence
Стаття про аналітичні методи дослідження канабіноїдів, що може бути корисною для аналізу DCBF.
https://diverdi.colostate.edu/C442/references/analysis/anal_bioanal_chem_20200418.pdf - Opioids, Cannabis, and Cyclic Vomiting Syndrome in Adults
Дослідження взаємодії канабіноїдів з TRPV1-рецепторами, що може бути релевантним для DCBF.
https://digital.lib.washington.edu/researchworks/bitstreams/fe5401a4-a4df-4b68-bf62-479227597d4b/download - Medical Cannabis: Toward a New Policy and Health Model
Аналіз сучасних підходів до медичного використання канабісу та потенціалу фітоканабіноїдів.
https://www.academia.edu/127566251/Medical_Cannabis_Toward_a_New_Policy_and_Health_Model_for_an_Ancient_Medicine - Are Phytocannabinoids from Cannabis sativa L. Promising Anticancer Agents?
Огляд протипухлинного потенціалу фітоканабіноїдів, що може бути застосовано до DCBF.
https://dx.doi.org/10.3390/molecules26092668