Delta-8-тетрагідроканабінол – це не просто варіант вже відомої молекули. Це – артефакт хімічної пластичності канабіноїдів і одночасно приклад того, як незначне структурне відхилення може призвести до появи зовсім іншого фармакологічного профілю, іншої траєкторії регуляторного поводження, і – врешті – іншого дискурсу навколо речовини. Стандартна лінійка психоактивних сполук, похідних з канабісу, давно потребує переосмислення. Не лише через появу нових напівсинтетичних молекул, а тому, що канабіноїдна система – біохімічно, регуляторно, комерційно – не піддається редукції до однієї-двох ключових молекул. Delta-8 саме і є симптомом такої складності.
Існування цієї сполуки не вкладається в уніфіковану парадигму “природного походження”, як і не узгоджується з канонічною схемою психоактивності. Її поява не була результатом спонтанного біосинтезу у значних концентраціях, не стала наслідком селекції чи агротехнічних модифікацій. Її зростаюча присутність – це наслідок хімічного перекодування вже наявних канабіноїдів, зокрема канабідіолу, у відповідних лабораторних умовах. Це – трансформація, що відбувається не в рослині, а в реакційній колбі. Тобто, перед нами не канабіноїд у класичному сенсі, а скоріше – результат технологічного втручання в межі канабіноїдного класу.
Факт існування Delta-8-THC у сучасному фармакохімічному полі є свідченням того, що класифікаційні межі в галузі природних сполук більше не функціонують автономно. Тут немає однозначності: ні в біогенезі, ні в механізмах дії, ні в юридичному статусі. Delta-8 не має сталого положення в хімічній таксономії: її або називають ізомером, або метаболічною похідною, або побічним продуктом. Це молекула, яка поводиться як концептуальна пастка: її зручно назвати безпечнішою, але складно визначити, що саме в її фармакології робить її такою. Вона водночас ближча до лабораторного конструкта, ніж до фітоканабіноїда – і все ж це не зовсім синтетик у класичному розумінні. Її не можна позбавити походження з рослини, але і не можна чесно назвати “природною”.
Особливий інтерес викликає спосіб входження цієї сполуки у фармакологічне поле. Замість прямого шляху – від фітокомпонента до клінічних випробувань – вона пройшла криву траєкторію, де перше її масове застосування відбулося не в результаті доказової бази, а через юридичний вакуум та хімічну зручність. Вона виникла в той момент, коли ринок шукав “законну альтернативу”, а хіміки запропонували технологію швидкого конверсування CBD у психоактивну форму. В цьому полягає унікальна ситуація: речовина, що впливає на центральну нервову систему, почала циркулювати в споживчому просторі раніше, ніж з’явилися її фармакокінетичні профілі або дані токсикологічної безпеки.
Іншими словами, перед нами – молекула, що формально належить до класу канабіноїдів, але за фактом є гетерогенним явищем: одночасно хімічною субстанцією, юридичною аномалією, і предметом ризикованого використання. Усе це вимагає складнішої оптики, ніж та, яку зазвичай застосовують до речовин природного походження. Вона не є фармацевтичним препаратом, але і не може бути зведена до статусу “легального допінгу”. Вона не має стабільного рівня в продуктах на ринку, але викликає об’єктивну фармакологічну дію. Саме тому розглядати її як “ще один ізомер” – методологічно некоректно.
Питання, які постають у зв’язку з Delta-8-THC, мають міждисциплінарний характер. Це не лише питання хімії, хоча синтез відіграє тут ключову роль. Це і питання нейробіології – адже механізми дії на CB₁-рецептори лише частково збігаються з Δ⁹-THC. Це питання клінічної фармакології – оскільки суб’єктивна дія змінюється не лише за інтенсивністю, але й за характером. І, нарешті, це етичне та епістемологічне питання: як саме в сучасному світі формуються знання про речовини, коли досвід використання передує лабораторній верифікації?
Не менш важливим є питання джерела. На відміну від класичних канабіноїдів, які витягують із рослини у вигляді екстракту, Delta-8 майже завжди є результатом ізомеризації – хімічної реакції, що переводить CBD в нову структуру під впливом кислоти та тепла. Відповідно, щоразу коли мова йде про Delta-8, мається на увазі не природна присутність, а інженерна реалізація потенціалу молекули, який у природі реалізується лише у слідах. А отже – відповідальність за його безпечність несе не природа, а технологія.
Хімічна і фізико-хімічна характеристика Delta-8-THC
Структурна формула та ізомерія Delta-8-THC
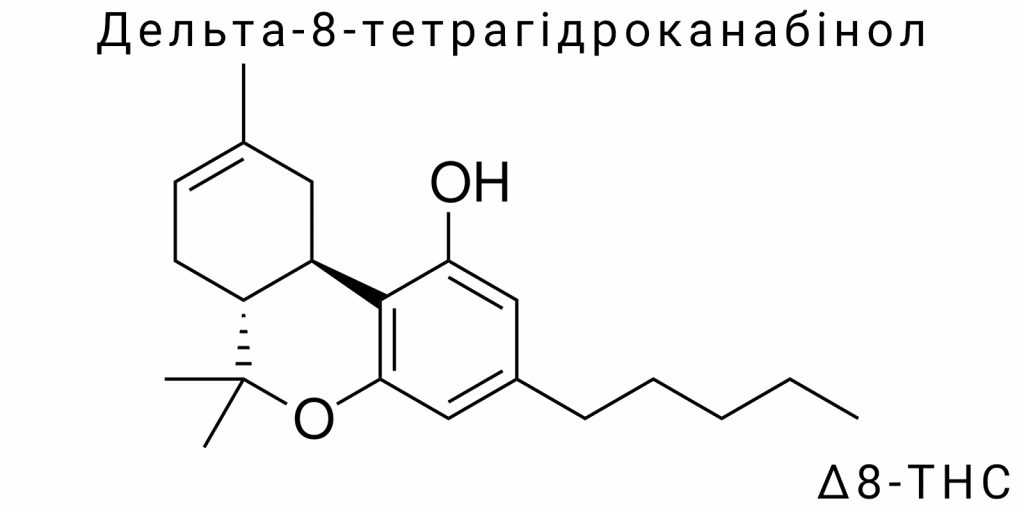
Молекула дельта-8-тетрагідроканабінолу вирізняється особливою будовою, що поєднує трициклічний вуглецевий каркас із наявністю кількох хімічно активних центрів. Формально її можна описати як похідну бензопіранової структури з пентиловим бічним ланцюгом, який значно впливає на розчинність у ліпідах і, відповідно, на фармакокінетику. Ключовою особливістю цієї молекули є наявність подвійного зв’язку в положенні між восьмим і дев’ятим атомами вуглецю центрального циклогексенового кільця. Саме це положення подвійного зв’язку визначає її приналежність до ізомерів дельта-8, і саме це відрізняє її від дельта-9-THC, де той самий зв’язок зміщений на один атом уперед – між дев’ятим і десятим вуглецями.
Незважаючи на мінімальну зміну в положенні подвійного зв’язку, загальна електронна конфігурація молекули змінюється достатньо для того, щоб модифікувати її фізико-хімічні та біохімічні властивості. У рамках стереоелектронного аналізу встановлено, що зміщення π-зв’язку впливає на розподіл електронної густини по всій молекулі, зменшуючи реакційну здатність певних функціональних груп і підвищуючи стабільність структури за термодинамічними критеріями. Такий ефект особливо важливий для молекули, яка повинна функціонувати у змінних умовах біологічного середовища – від кислотного шлункового pH до нейтрального середовища крові або ензиматичної активності печінки.
Дельта-8-THC є хіральною сполукою, тобто має просторову асиметрію. Найбільш відомі два хіральні центри – у положеннях, які відповідають сполуці за IUPAC як 6aR,10aR. Природна форма, що виявляється в рослинах, завжди має (−)-конфігурацію, яка визначає її взаємодію з білковими структурами, зокрема з канабіноїдними рецепторами типу CB1. Проте в умовах синтетичного виробництва можливе утворення рацемічних сумішей, що, своєю чергою, може вплинути як на фармакодинаміку, так і на потенційну токсичність. Просторова конфігурація молекули, особливо в контексті флексибельності її бічного пентилового ланцюга, також впливає на конформаційне прилаштування до рецепторної кишені, деякою мірою визначаючи силу і тривалість агоністичної відповіді.
Не менш цікавою є геометрія самої кільцевої системи. Трисциклічний каркас молекули не є повністю жорстким: циклогексенове кільце здатне до переходів між різними конформаційними формами, найстабільнішою з яких залишається chair-конформація. Вона дозволяє мінімізувати стеричні взаємодії між атомами, водночас зберігаючи активну ділянку молекули у зручному для рецепторного зв’язування положенні. Таке конформаційне самоналаштування – важлива властивість, яка робить канабіноїди, зокрема дельта-8, унікальними серед ліпофільних сигналізуючих молекул.
Хоча дельта-8 часто згадується як ізомер дельта-9, варто наголосити: ізомерія в цьому випадку – не лише формальне поняття, а структурна різниця, яка має наслідки для термостійкості, реактивності, та навіть маршруту метаболічної трансформації. Так, Δ8-THC демонструє вищу хімічну стабільність за Δ9-THC у кислотних умовах, що підтверджено даними з досліджень in vitro. Це зумовлено менш вираженою схильністю до автоперетворення – процесу, за якого дельта-9 спонтанно ізомеризується до дельта-8 або навіть деградує до канабінолу при контакті з киснем чи під дією світла. Δ8-THC, на відміну від свого ізомеру, зберігає хімічну цілісність за широкого спектра температур і в присутності кислот, що й робить його привабливішим для фармакологічного використання в умовах підвищеної кислотності середовища, наприклад, у шлунково-кишковому тракті.
Особливо слід звернути увагу на ізомерні варіанти, які виникають у процесі синтезу або при біотрансформації. Йдеться не лише про дельта-9- і дельта-10-ізомери, а й про внутрішньомолекулярні модифікації, що виникають при впливі катіонних агентів, кислот або ферментів. Усі ці ізомери можуть мати схожу масу та навіть схожий ультрафіолетовий спектр, але суттєво відрізняються за просторовою орієнтацією й активністю щодо канабіноїдних рецепторів. Саме тому сучасна аналітика вимагає не лише хроматографічного, а й спектроскопічного підтвердження конфігурації, зокрема за допомогою ЯМР-спектроскопії, де важливо чітко ідентифікувати хімічний зсув кожного атома водню поблизу подвійного зв’язку.
Відмінності між Δ8-THC та Δ9-THC
Попри наявність структурної схожості, дельта-8- і дельта-9-тетрагідроканабінол демонструють розбіжності, що мають системний характер – вони охоплюють як механізми взаємодії з біологічними системами, так і особливості синтезу, метаболізму, фармакології та навіть молекулярного транспорту. Зміщення подвійного зв’язку в циклічному фрагменті – лише формальна відправна точка, за якою стоїть цілий ланцюг конформаційних і рецепторних наслідків, які не можуть бути зведені до поверхневої “ізомерної різниці”. Розгляд цих відмінностей потребує багатовекторного аналізу, що включає електронну топографію, біодоступність, специфіку ферментативного окиснення, вплив на сигнальні шляхи нейромедіації, і навіть тенденції до утворення побічних продуктів у метаболічному циклі.
Одним із найбільш помітних розходжень між двома молекулами є їхня взаємодія з рецепторами CB1. Хоча обидва канабіноїди є частковими агоністами цього рецептора, ступінь афінності та інтенсивність внутрішньоклітинного сигналу, що ними ініціюється, не є ідентичними. Δ9-THC демонструє вищу спорідненість до CB1, що в умовах ін вітро підтверджується нижчим значенням константи дисоціації (Kd) та більш повною агоністичною відповіддю. У свою чергу, Δ8-THC проявляє зменшену рецепторну активність, що не пов’язано лише з різницею в конфігурації, а радше з мікроскопічними зсувами в орієнтації функціональних груп при фіксації молекули у зв’язувальній кишені рецептора. Зниження ефективності сигналу може частково пояснювати зменшений психоактивний ефект дельта-8, який, за емпіричними оцінками, становить близько 50-75% від аналогічної дози дельта-9.
Не менш важливою є фармакокінетична поведінка обох ізомерів. Після перорального або інгаляційного введення Δ9-THC піддається активному метаболізму в печінці із утворенням 11-гідрокси-Δ9-THC – метаболіту, що має вищу психоактивність за сам вихідний канабіноїд. Δ8-THC також трансформується у свій 11-гідрокси-аналог, однак процес метаболізації йде повільніше, а афінність утвореного метаболіту до CB1-рецепторів є нижчою. Така різниця має прямі наслідки для суб’єктивного сприйняття ефекту, оскільки Δ8-THC не лише повільніше починає діяти, а й демонструє більш пролонгований, але м’який ефект із менш вираженим піком активності.
Окрім цього, існують фундаментальні розбіжності в стабільності молекул. Δ8-THC проявляє підвищену термостійкість, хімічну інертність до автоперетворення й краще зберігає свою структуру в умовах експозиції до світла та кисню. Це робить його привабливішим із точки зору зберігання, формуляції та застосування в терапевтичних продуктах, які повинні мати тривалий термін придатності без втрати біоактивності. Δ9-THC, у свою чергу, демонструє схильність до деградації до канабінолу, особливо у випадку неправильного зберігання або при контакті з киснем, що обмежує стабільність фармацевтичних формул на його основі.
Варто відзначити також різницю у біотранспорті. Δ9-THC має вищу спорідненість до білків плазми крові, зокрема альбуміну, що призводить до швидшого розповсюдження по організму та схильності до кумуляції в жирових депо. Δ8-THC демонструє вужчий спектр білкового зв’язування, що знижує ризик накопичення при тривалому використанні, хоча й подовжує період напіввиведення внаслідок меншої швидкості кліренсу. Це, у свою чергу, має значення для хронічної фармакотерапії, де важливо контролювати рівні речовини в плазмі без надмірної кумуляції, яка може потенціювати побічні ефекти.
У контексті ензиматичних перетворень, обидва ізомери метаболізуються переважно ферментами цитохрому P450, з домінуванням ізоформ CYP2C9, CYP3A4 та CYP2C19. Проте Δ8-THC проявляє меншу здатність до інгібування ферментативної активності цих систем, що знижує ризик лікарських взаємодій. Δ9-THC, у свою чергу, може інгібувати або конкурентно пригнічувати CYP2C9, що має значення для пацієнтів, які приймають препарати з вузьким терапевтичним вікном. Ця особливість робить Δ8-THC перспективним у мультимедикаментозних режимах, де стабільність ферментативного профілю є критичною.
Ще один аспект, який відрізняє обидва канабіноїди – це профіль нейромедіаторних ефектів. Δ9-THC активує не лише канабіноїдні рецептори, а й опосередковано впливає на систему дофаміну, серотоніну й ГАМК. Його вплив на лімбічну систему є інтенсивним, що зумовлює як психоактивність, так і частоту психогенних побічних реакцій. Δ8-THC, за попередніми даними, демонструє обмежену перехресну активацію нейромедіаторних шляхів, зокрема не викликає значного вивільнення дофаміну в мезолімбічному шляху, що частково пояснює його більш помірний ефект і нижчу ймовірність тривожності, параної чи панічних атак.
Також варто звернути увагу на молекулярну взаємодію з іонними каналами та TRP-рецепторами. Хоча обидва ізомери мають здатність модулювати активність ванілоїдного рецептора TRPV1, Δ8-THC чинить менш виражений ефект. Це має потенційне значення в контексті болю, гіпералгезії та нейрозапалення, адже саме TRPV1 пов’язаний із регуляцією больової передачі на рівні задніх рогів спинного мозку. Теоретично, Δ9-THC може забезпечувати більш потужну анальгезію, проте водночас і вищий ризик звикання або десенситизації рецепторного апарату.
Стабільність молекули та поведінка в біологічних середовищах
Вивчення стабільності Δ8-тетрагідроканабінолу (Δ8-THC) на молекулярному рівні, а також його поведінки в різних біологічних середовищах, є надзвичайно важливим для розуміння фармакодинамічних та фармакокінетичних властивостей цього канабіноїду. Здатність молекули зберігати свою структуру і функціональність у складних біохімічних умовах визначає її ефективність, безпеку, а також потенціал для терапевтичного використання. У цій частині розглянемо детальні механізми хімічної стабільності Δ8-THC та його динаміку в умовах, що імітують внутрішньоклітинні та позаклітинні середовища.
Одним із фундаментальних аспектів стабільності є схильність Δ8-THC до ізомеризації та окиснення. У ході досліджень було встановлено, що положення подвійного зв’язку в молекулі, характерне для Δ8-THC, формує специфічні електронні умови, що роблять цю молекулу менш реакційноспроможною до атак вільних радикалів у порівнянні з іншими канабіноїдами. Ця знижена реакційна здатність безпосередньо впливає на стійкість молекули при дії таких факторів, як світло, кисень, температура та кислотно-лужний баланс. Зокрема, Δ8-THC демонструє більшу резистентність до фотодеградації в ультрафіолетовому діапазоні, що обумовлено стабільнішою конформацією молекули, зниженою мобільністю електронів в області подвійного зв’язку та меншою тенденцією до утворення фотолабільних продуктів.
Особливу увагу варто звернути на поведінку молекули у водному середовищі, адже більшість фармакологічних процесів відбувається у гідрофільних умовах, навіть якщо сама молекула є гідрофобною. Δ8-THC проявляє низьку розчинність у воді, що обумовлено значною гідрофобністю тетрагідроканабінольного скелета, проте при цьому вона здатна утворювати мікрокомплекси з білками та ліпідами, що присутні у біологічних системах. Взаємодія з білками плазми, наприклад альбуміном, відбувається через нековалентні гідрофобні зв’язки, які стабілізують молекулу в кровотоці, водночас зменшуючи її доступність до ферментів метаболізму. Цей феномен не лише сприяє пролонгації періоду напіввиведення Δ8-THC, але й обмежує швидкість її розкладання у печінкових клітинах, що позитивно впливає на фармакокінетичний профіль.
У контексті кислотно-лужних умов слід відзначити, що Δ8-THC має високу стабільність при нейтральних і слабколужних рН, але в кислому середовищі починає демонструвати схильність до гідролітичних процесів, зокрема – до відкриття циклічних структур та утворення похідних, які не зберігають канабіноїдної активності. Такі реакції мають місце у шлунково-кишковому тракті при пероральному застосуванні, що може впливати на біодоступність і перетворення молекули до менш активних форм. Це підкреслює необхідність розробки фармацевтичних форм, здатних захищати Δ8-THC від деградації у кислому середовищі, наприклад, шляхом енкапсуляції або використання кишковорозчинних покриттів.
Іншою важливою характеристикою є поведінка Δ8-THC в мембранних структурах клітин. Ліпофільність молекули забезпечує її ефективну інкорпорацію у фосфоліпідний бішар мембран, де вона може модулювати фізико-хімічні властивості мембран, впливаючи на їх текучість та проникність. Ця інтеграція у мембрану також сприяє локальній концентрації молекули поблизу мембранних рецепторів, зокрема CB1 та CB2, оптимізуючи процес рецепторної активації. Крім того, стабільність молекули у ліпідному середовищі є вищою, ніж у водному, завдяки меншому доступу до окислювачів та ферментів, що робить мембранні ділянки додатковою захисною зоною для Δ8-THC.
Крім того, в останніх дослідженнях звертається увага на реакції з ферментами окиснення, які беруть участь у метаболізмі канабіноїдів. Δ8-THC проявляє стійкість до некаталітичного окиснення, але ферментативні системи печінки, зокрема цитохром P450, здатні перетворювати його в різноманітні гідрокси- і карбонові похідні. Швидкість і напрямок цих перетворень значною мірою залежать від співвідношення ізоформ ферментів, стану здоров’я пацієнта та наявності інших медикаментів. Метаболіти, утворені із Δ8-THC, мають інший профіль біоактивності, що важливо враховувати при прогнозуванні клінічних ефектів.
Особливий інтерес представляє дослідження стабільності Δ8-THC в умовах імунного окислення, характерного для запальних процесів. У присутності активних форм кисню (АФК) молекула демонструє помірну стійкість, що свідчить про потенціал для застосування у терапії хронічних запальних захворювань без швидкого руйнування активного агента. Це відрізняє Δ8-THC від деяких інших канабіноїдів, які швидко інактивуються під дією АФК.
Важливою є також стабільність у контексті тривалого зберігання та умов виробництва. Під час екстракції, очищення і формулювання фармацевтичних препаратів Δ8-THC проявляє високу хімічну інертність навіть при підвищених температурах, що дозволяє зберігати його активність без необхідності складних умов охолодження. Це суттєво полегшує технологічні процеси та знижує вартість кінцевого продукту, одночасно зберігаючи його фармакологічні властивості.
Поведінка Δ8-THC у внутрішньоклітинних середовищах має важливе значення для фармакологічної дії. Молекула здатна проникати крізь мембрани органел, включно з мітохондріями, що відкриває нові перспективи для вивчення її впливу на клітинний метаболізм, енергетику та сигнальні каскади. Ця проникність пов’язана з його помірною полярністю та структурною гнучкістю. Такі властивості можуть пояснювати деякі унікальні фармакодинамічні ефекти Δ8-THC, зокрема його роль у модуляції окислювального стресу та апоптозу.
Природне походження і джерела Delta-8-THC
Біогенез у рослинах роду Cannabis
Вивчення біогенезу Delta-8-тетрагідроканабінолу (Δ8-THC) в рослинах роду Cannabis є важливою складовою розуміння хімічної еволюції канабіноїдів і специфіки їх синтезу. На відміну від більш дослідженого Δ9-THC, біохімічні шляхи утворення Δ8-THC менш вивчені, що обумовлено його низьким природним вмістом у більшості штамів та складністю аналітичного розрізнення ізомерів. Проте, фундаментальні принципи біосинтезу канабіноїдів можуть пролити світло на те, як формується Δ8-THC.
Основною початковою сполукою для синтезу канабіноїдів є канабігероловий кислотний прекурсор (CBGA), що утворюється у клітинах секреторних залоз, або трихомах, квітів і листя рослин Cannabis. Цей прекурсор конденсується із молекулою олігопреноїдного походження ітеративним механізмом, що веде до появи кислотних форм канабіноїдів: тетрагідроканабіноїлової кислоти (THCA), каннабідолової кислоти (CBDA) та каннабіхроменової кислоти (CBCA). Саме THCA є провідним субстратом для утворення Δ9-THC, а також, у певних умовах, для Δ8-THC.
Формування Δ8-THC починається з THCA, який піддається ферментативному або неферментативному перетворенню, внаслідок якого відбувається зміщення положення подвійного зв’язку у циклічній структурі молекули. Ферментативний механізм утворення Δ8-THC наразі не вивчений настільки глибоко, як утворення Δ9-THC, проте деякі дослідження свідчать про можливість існування ізомераз або редуктаз, які можуть каталізувати цю реакцію в обмежених клітинних умовах. Цей процес є складним і залежить від специфічних умов клітинного середовища, включно з рівнем окислювально-відновного потенціалу, рН та доступністю кофакторів.
Крім ферментативних шляхів, утворення Δ8-THC в рослині може відбуватися через спонтанну ізомеризацію THCA при фізичних або хімічних впливах, що змінюють стабільність молекули. Зокрема, вплив тепла, світла чи зміни рН може сприяти зміні положення подвійного зв’язку із Δ9 до Δ8 конфігурації. Проте, на відміну від більш поширеної ізомеризації у лабораторних умовах, в природних умовах цей процес обмежений і відбувається локально в окремих тканинах рослини або під впливом стресових факторів.
Важливо також враховувати роль субклітинних локалізацій у біосинтезі. Відомо, що ферменти, відповідальні за формування канабіноїдів, локалізуються у специфічних мембранних комплексах в цитоплазмі та ендоплазматичному ретикулумі. Просторова організація цих ферментативних комплексів визначає локальне середовище для синтезу та модифікації молекул, що може бути ключовим для утворення менш поширених ізомерів, таких як Δ8-THC. Утворення специфічних ізоформ ферментів в різних генотипах рослин також пояснює варіації у співвідношенні Δ8-THC до інших канабіноїдів.
На генетичному рівні дослідження показують, що експресія генів, що кодують синтази канабіноїдових кислот, регулюється складними сигналами, пов’язаними з розвитком рослини, світловим режимом і зовнішніми стресорами. Ці фактори впливають не лише на кількість синтезованих молекул, але й на активність ферментів, що здійснюють ізомеризацію і модифікацію канабіноїдів. Тому фенотипічне виявлення Δ8-THC пов’язане з багатовимірною взаємодією генетичних і екологічних факторів.
Загалом біогенез Δ8-THC у Cannabis є продуктом як ферментативної активності, так і хімічної нестабільності молекули THCA, що призводить до утворення ізомерів з переміщеним подвійним зв’язком. При цьому специфіка ферментативних шляхів залишається предметом активних наукових дискусій, а потенційна роль мікроекології тканин рослини у формуванні цих ізомерів відкриває нові горизонти для фундаментальних досліджень.
Концентрації в природних умовах: оцінка вмісту
Вивчення кількісного вмісту Delta-8-тетрагідроканабінолу (Δ8-THC) у природних зразках Cannabis є складним завданням, що потребує високоточних аналітичних методик і детального розуміння факторів, які впливають на його концентрацію. Незважаючи на значний прогрес у аналітичних технологіях, доступні дані щодо природних концентрацій Δ8-THC залишаються обмеженими, а представлені значення часто варіюють залежно від біологічного матеріалу, географії вирощування, умов збору та методів аналізу.
Δ8-THC традиційно розглядають як незначний ізомер у складі канабіноїдного профілю рослини, порівняно з більш домінуючими канабіноїдами, такими як Δ9-THC і каннабідол (CBD). Однак, з появою більш точних методик хроматографічного та спектроскопічного аналізу, зокрема рідинної хроматографії з мас-спектрометрією (LC-MS/MS) та газової хроматографії з мас-спектрометрією (GC-MS), змогли ідентифікувати та кількісно визначити Δ8-THC у малих концентраціях. Важливо підкреслити, що відсутність стандартизованих протоколів для виділення і аналізу ускладнює порівняння результатів між різними дослідженнями.
Оцінка концентрації Δ8-THC у природних екземплярах Cannabis показує значну варіабельність. Звичайно його вміст не перевищує 1% від загальної маси сухої речовини, що робить його вторинним компонентом у канабіноїдному спектрі. Проте у деяких специфічних генотипах, а також у зразках, які піддавалися певним агротехнічним або постзбиральним обробкам, вміст Δ8-THC може сягати 3-5%. Такі підвищені концентрації спостерігаються зазвичай у продуктах, де відбувалась часткова ізомеризація Δ9-THC або у старих рослинних матеріалах, де природні процеси деградації змінюють канабіноїдний профіль.
Кількісна оцінка Δ8-THC у листках, квітках та стеблах Cannabis свідчить про те, що найбільша його концентрація локалізована у квіткових частинах, особливо в трихомах – спеціалізованих залозистих структурах, що продукують та накопичують канабіноїди. У листках вміст Δ8-THC значно нижчий, а у стеблах він практично відсутній або визначається лише в слідових кількостях. Така розподільча характеристика пов’язана з локалізацією ферментів синтезу канабіноїдів, а також з концентрацією прекурсорів, необхідних для утворення Δ8-THC.
Важливо враховувати також вплив ступеня стиглості рослини на концентрацію Δ8-THC. Під час фази цвітіння та дозрівання відбувається активний синтез канабіноїдів, але паралельно і процеси деградації, що можуть збільшувати або зменшувати рівень Δ8-THC у тканинах. Зокрема, під дією ферментів декарбоксилювання THCA до активної форми Δ9-THC можлива одночасна часткова ізомеризація з утворенням Δ8-THC. У старіших, висушених зразках зберігання може стимулювати додаткове перетворення Δ9-THC у Δ8-THC за допомогою оксидативних та фотохімічних процесів.
Регіональні відмінності також відіграють важливу роль у визначенні вмісту Δ8-THC. Залежно від кліматичних умов, типу ґрунтів, доступності води і сонячної радіації, рослини Cannabis можуть модулювати метаболізм канабіноїдів, що відображається на пропорціях і концентраціях окремих сполук. Наприклад, рослини, вирощені в субтропічних і тропічних зонах, можуть мати більш стійкі канабіноїдні профілі з підвищеним вмістом стабільних ізомерів, тоді як у помірному кліматі спостерігається більше варіацій, зокрема у рівнях Δ8-THC.
Аналітичні особливості визначення Δ8-THC полягають у його хімічній подібності до Δ9-THC, що ускладнює диференціацію цих ізомерів при стандартних методах аналізу. Для коректної ідентифікації та кількісного визначення потрібне застосування високоефективних хроматографічних колонок з оптимізованими умовами розділення, а також мас-спектрометричних детекторів з високою роздільною здатністю. Ця точність важлива, оскільки помилки у визначенні можуть призводити до спотворення фармакологічного профілю і, відповідно, клінічних висновків.
Ще одним аспектом є нестабільність Δ8-THC у пробах, що зберігаються тривалий час або піддаються впливу несприятливих умов – світла, температурних коливань, кисню. Це може спричиняти не тільки зниження концентрації, а й утворення похідних сполук з іншими фармакологічними властивостями. Тому важливим є стандартизований підхід до збору, зберігання та підготовки зразків для аналізу, що дозволить уникнути артефактів і зберегти репрезентативність даних.
Крім того, у природних умовах концентрації Δ8-THC можуть змінюватися залежно від віку та генетичних особливостей рослини. Генетична варіабельність диктує різні рівні експресії ферментів, що синтезують або модифікують канабіноїди. Ця особливість обумовлює широке різноманіття канабіноїдних профілів у рослин Cannabis навіть в межах одного регіону, а також створює передумови для селекції штамів з підвищеним вмістом Δ8-THC для наукових або медичних цілей.
Окремо слід зазначити, що у дикорослих популяціях Cannabis Δ8-THC майже відсутній або знаходиться у слідових концентраціях, що свідчить про те, що його природне накопичення – це результат або адаптації рослини до певних екологічних стресів, або побічний продукт метаболізму, що виникає внаслідок окислювального чи фотохімічного розпаду інших канабіноїдів.
Вплив факторів середовища на утворення Delta-8-THC
Формування та накопичення Delta-8-тетрагідроканабінолу (Δ8-THC) у рослинах роду Cannabis є результатом комплексної взаємодії генетичних, біохімічних та екологічних чинників. Серед зовнішніх впливів саме фактори середовища відіграють визначальну роль у регуляції метаболічних шляхів, що контролюють синтез, трансформацію і стабільність цієї сполуки. Вивчення екологічних модулюючих чинників має фундаментальне значення для розуміння біохімічної гнучкості рослини та її адаптаційних механізмів, а також для оптимізації вирощування із заданим хімічним профілем.
Перш за все слід зазначити, що канабіноїди, включно з Δ8-THC, синтезуються в спеціалізованих залозистих трихомах, чутливих до змін зовнішнього середовища. Вплив кліматичних умов проявляється через модифікацію активності ферментів, регуляцію генів, відповідальних за біосинтез канабіноїдів, а також через зміну загального метаболічного стану клітин. Наприклад, температурні коливання можуть суттєво впливати на рівень експресії ферментів, що каталізують перетворення THCA у його різні ізомери, у тому числі Δ8-THC.
Термінова відповідь на підвищення температури полягає у підвищенні швидкості ізомеризації канабіноїдів. Тепло сприяє переміщенню подвійного зв’язку у молекулі тетрагідроканабінолу з 9-го до 8-го положення, що веде до збільшення концентрації Δ8-THC. У лабораторних умовах нагрівання екстрактів канабіноїдів є стандартним методом синтезу Δ8-THC з Δ9-THC, але в рослинних тканинах це явище менш вивчене, проте вказує на важливість температурного режиму під час культивації і зберігання. Занадто висока температура може, з одного боку, збільшувати Δ8-THC, але одночасно спричиняти деградацію інших канабіноїдів, що впливає на загальний хімічний профіль.
Сонячне випромінювання, зокрема ультрафіолетове (UV) світло, також має складний вплив на синтез канабіноїдів. Світло індукує експресію генів, що регулюють ферментативні процеси біосинтезу, однак надмірна інсоляція призводить до утворення вільних радикалів і окислювального стресу, що може викликати хімічні перетворення вже синтезованих канабіноїдів, зокрема ізомеризацію Δ9-THC у Δ8-THC. Важливо розуміти, що ця взаємодія залежить від тривалості, інтенсивності світлового впливу і спектрального складу, що робить ефекти складними для передбачення.
Вологість повітря і ґрунту також регулюють метаболічні шляхи рослин. В умовах дефіциту води спостерігається активація систем антиоксидантного захисту, що впливає на окислювальні процеси у клітинах, знижуючи можливість спонтанної ізомеризації Δ9-THC. Водночас, надмірна вологість може сприяти бактеріальній або грибковій активності, що змінює метаболізм і може посилювати деградацію канабіноїдів. Це вказує на тонкий баланс між гідратацією і стресом для оптимального формування Δ8-THC.
Хімічний склад ґрунту і доступність поживних речовин виступають як довготривалі регулятори метаболізму. Зокрема, дефіцит або надлишок певних мікроелементів, таких як залізо, магній або цинк, може модифікувати активність ферментів, залучених до біосинтезу канабіноїдів. Відомо, що мідь як кофактор деяких окислювальних ферментів впливає на стабільність фенольних сполук, що потенційно може регулювати окислювальні процеси, пов’язані із ізомеризацією канабіноїдів.
Серед інших факторів середовища варто відзначити вплив механічного стресу, забруднення повітря, а також вплив мікробіоти рослини. Механічні пошкодження тканин запускають сигнальні каскади, що активують захисні метаболічні шляхи, які можуть збільшувати або модулювати синтез вторинних метаболітів, включно з Δ8-THC. Забруднювачі, особливо леткі органічні сполуки і важкі метали, можуть впливати на транскрипцію ферментативних генів, а мікробіом кореневої системи регулює обмін речовин, що прямо або опосередковано впливає на метаболізм канабіноїдів.
Період освітлення, або фотоперіод, являє собою критичний фактор для регуляції синтезу канабіноїдів. Світловий режим визначає фазу розвитку рослини і відповідно змінює профіль експресії ключових ферментів. Зміна довжини дня стимулює перехід рослини у фазу цвітіння, що супроводжується підвищеним синтезом канабіноїдів, включаючи потенційну зміну пропорцій між Δ9-THC та Δ8-THC.
Крім прямого впливу середовищних факторів на синтез, значення має і тривалість зберігання рослинної сировини у природних або напівприродних умовах. У процесі старіння або природного сушіння можуть відбуватися хімічні трансформації, зокрема ізомеризація Δ9-THC в Δ8-THC під впливом окислення або фотохімічних реакцій. Це свідчить, що концентрація Δ8-THC у кінцевому продукті є результатом не тільки початкового синтезу, але й постбіосинтетичних процесів, що відбуваються у часі.
Методи синтезу та отримання
Ізомеризація канабідіолу (CBD): основний шлях
Отримання Delta-8-тетрагідроканабінолу (Δ8-THC) через ізомеризацію канабідіолу (CBD) являє собою складний хімічний процес, що базується на перетворенні структури молекули із збереженням основних функціональних груп, але з радикальною зміною положення подвійного зв’язку в циклічній системі. Цей трансформаційний шлях не лише є основою для промислового виробництва Δ8-THC, але й відкриває перспективи для розробки нових методик отримання структурних аналогів тетрагідроканабінолу із заданими фармакологічними властивостями.
Ізомеризація CBD у Δ8-THC відбувається за участі кислотних каталізаторів, які сприяють електрофільному заміщенню в молекулі. Хімічна природа CBD як відкритого лінійного канабіноїду, що містить фенольну та циклічну структури, дозволяє за певних умов ініціювати внутрішньомолекулярне циклічне замикання із формуванням тетрагідроканабінолової структури з подвійним зв’язком у восьмому положенні. Ця реакція включає послідовність проміжних стадій із зміною конформації молекули та утворенням стабільних карбокатионів, що є критично важливими для вибірковості і виходу кінцевого продукту.
Ключовим аспектом є контроль кислотності середовища. Занадто сильні кислоти можуть призвести до побічних реакцій, таких як розкладання вихідних речовин або утворення нежаданих побічних ізомерів. З іншого боку, недостатній рівень кислотності знижує швидкість і ефективність ізомеризації. Розуміння точного балансу кислотності має значення для оптимізації технологічного процесу і мінімізації утворення домішок.
Термін реакції і температура також критично впливають на характер перетворень. При більш низьких температурах ізомеризація проходить повільно, але з вищою селективністю, натомість підвищення температури прискорює процес, але збільшує ризик утворення побічних продуктів. Виробничі умови, відповідно, часто визначаються компромісом між швидкістю реакції і чистотою продукту.
Значення має і розчинник, у якому проводять реакцію. Полярність розчинника впливає на стабілізацію проміжних карбокатионів та інтенсивність електрофільних реакцій. Найчастіше використовують органічні розчинники з помірною полярністю, що забезпечують баланс між розчинністю вихідної речовини і стабільністю каталізаторів.
Механізм ізомеризації передбачає початкову активацію фенольного гідроксилу CBD через протонування в кислотному середовищі, що сприяє формуванню карбокатионного проміжку. Подальша електрофільна атака внутрішнього подвійного зв’язку ініціює циклізацію з утворенням нового шестичленного циклу, характерного для тетрагідроканабінолів. Розташування подвійного зв’язку у восьмому положенні визначає унікальні фізико-хімічні та фармакологічні властивості Δ8-THC.
Додатковою складністю є можливість утворення Δ9-THC як побічного продукту. Незважаючи на схожість структур, ці два ізомери мають різну біологічну активність, що вимагає точного регулювання технологічних параметрів для досягнення переважного синтезу Δ8-THC. Методи хроматографічного контролю і спектроскопічного аналізу є обов’язковими для моніторингу селективності реакції.
Крім того, реакція ізомеризації CBD в кислотних умовах є класичним прикладом термодинамічно контрольованої трансформації. Рівновага між ізомерами регулюється не лише початковими параметрами реакції, але й подальшими умовами зберігання та обробки продукту. Відомо, що Δ8-THC є більш термостабільним ізомером порівняно з Δ9-THC, що впливає на кінцеву якість і тривалість зберігання отриманих препаратів.
У промислових масштабах для ініціації реакції ізомеризації застосовують мінеральні кислоти, такі як сірчана або фосфорна, або органічні кислоти з відповідною силою. При цьому необхідно враховувати не лише каталізатор, але й можливість нейтралізації залишків кислоти після реакції, що є важливим для безпеки і чистоти кінцевого продукту.
Сучасні дослідження направлені на підвищення селективності та екологічності процесу ізомеризації CBD у Δ8-THC. Вивчаються каталізатори на основі кислот із контрольованою активністю, м’які умови реакції та застосування зелених розчинників. Ці напрями важливі для зменшення утворення шкідливих домішок і підвищення ефективності технології.
Не менш важливим є розуміння кінетики реакції ізомеризації. Моделювання і експериментальні дані показують, що реакція проходить через кілька стадій з утворенням проміжних сполук із різним ступенем стабільності. Залежно від параметрів процесу можуть домінувати різні реакційні шляхи, що обумовлює варіабельність виходу і чистоти Δ8-THC.
Хімічна реакція в кислотному середовищі
Процес ізомеризації канабідіолу (CBD) до Δ8-тетрагідроканабінолу (Δ8-THC) у кислотному середовищі – це класичний приклад внутрішньомолекулярної циклізації, яка ініціюється під дією протонованого каталізатора, в умовах дії електрофільних центрів. Цей механізм базується на активації гідроксильних груп CBD, утворенні карбокатионних проміжних станів, і переміщенні подвійного зв’язку в межах третинного циклу. Відповідний хімічний шлях дозволяє трансформувати лінійну структуру CBD у циклічну конфігурацію Δ8-THC без потреби в радикальній реконструкції кістяка молекули.
Механістично реакція стартує з активації фенольної гідроксильної групи CBD. У присутності кислотного каталізатора (наприклад, p-толуолсульфонової кислоти або хлоридної кислоти в органічному середовищі) відбувається її протонування, що робить гідроксил електронно-дефіцитним і підвищує електрофільність прилеглого атома вуглецю. Це, у свою чергу, сприяє відщепленню води або реорганізації електронної щільності в напрямку формування карбокатиона.
Після цього починається найбільш критичний етап – утворення стабілізованого третинного канабіноїдного карбокатиону, який має здатність до атаки внутрішньої алкенової групи в ланцюгу бокової частини CBD. У результаті цієї електрофільної циклізації утворюється шестичленний цикл – характерна ознака структур канабіноїдів типу THC. Розміщення подвійного зв’язку в положенні між вуглецями C-8 та C-9 (тобто Δ8) відбувається під впливом термодинамічного контролю, який визначається стабільністю конформацій молекули та електронною делокалізацією.
Однією з ключових складових цього процесу є контроль над стереохімією циклізації. В умовах кислотного каталізу ізомеризація відбувається переважно з утворенням Δ8-ізомеру, однак при варіаціях температури, кислотності чи тривалості реакції може виникати конкурентне утворення Δ9-THC, Δ10-THC та навіть маловивчених неканонічних структур, таких як Δ6а,10а-THC. Для досягнення переважного синтезу Δ8-ізомеру необхідна тонка регуляція реакційних параметрів.
Розчинники відіграють вирішальну роль у стабілізації перехідних станів. Наприклад, хлороформ, дихлорметан, толуол та інші аполярні середовища знижують ймовірність побічних реакцій, зокрема полімеризації проміжних катіонів або оксидації. Водночас, розчинники з високою донорною здатністю можуть стабілізувати електрофільні центри, але викликають небажане зміщення рівноваги в напрямку гідратації або утворення неактивних побічних продуктів.
Контроль температури є ще одним вирішальним чинником. Найчастіше реакцію проводять у межах 50-90 °C, залежно від обраної кислоти й розчинника. За нижчих температур реакція проходить повільніше, але з меншою часткою побічних ізомерів, тоді як підвищення температури прискорює циклізацію, водночас підвищуючи ризик утворення Δ9- та Δ10-ізомерів. У промислових умовах баланс між селективністю і швидкістю часто досягається шляхом введення модифікованих кислот або буферних систем, які стабілізують протоновані форми CBD, не спричиняючи перенавантаження протонами в середовищі.
Додатково, при зміні типу кислоти змінюється і механізм ізомеризації. Наприклад, у випадку застосування Льюїсових кислот, таких як AlCl₃ або BF₃•Et₂O, відбувається інша форма активації молекули через комплексоутворення з електронними парами CBD. Такі реакції можуть мати вищу селективність до Δ8-ізомеру, але вимагають ретельного контролю над вологістю середовища, оскільки присутність навіть незначної кількості води здатна змінити тип реакції або ініціювати гідроліз проміжних структур.
Іншим викликом, пов’язаним з ізомеризацією в кислотному середовищі, є контроль кінцевого pH і повне видалення кислотних залишків. Навіть мікроскопічна кількість залишкової кислоти в продукті може призводити до подальшої деградації Δ8-THC або спонтанної реізомеризації під час зберігання. Це особливо критично в медичних або дослідницьких застосуваннях, де стабільність продукту визначає точність дозування.
Крім основної трансформації CBD у Δ8-THC, при певних умовах можлива конкурентна реакція з утворенням ефірних побічних продуктів або оксигенованих дериватів, наприклад, 11-гідрокси-Δ8-THC або кислотних форм. Уникнення цих реакцій вимагає мінімізації наявності кисню та контролю вологості в реакційному середовищі.
Нарешті, постреакційне очищення продукту від залишків кислот, побічних ізомерів та органічних домішок – це етап, що визначає практичну цінність всього синтезу. Найчастіше використовують методи фракційної хроматографії або рекристалізації в інертному середовищі. У лабораторних умовах популярною є колонкова хроматографія на силікагелі або флеш-хроматографія з використанням градієнтів полярності.
Умови, реактиви та контроль процесу
Процес ізомеризації канабідіолу (CBD) у Δ8-тетрагідроканабінол (Δ8-THC) є надзвичайно чутливим до реакційних умов. Незважаючи на позірну простоту – здавалося б, йдеться лише про переміщення подвійного зв’язку та циклізацію – цей синтез вимагає максимальної точності в доборі кожного елементу: від природи каталізатора до тиску пари, чистоти реагентів і навіть матеріалу стінок реакційного посуду. Будь-яке відхилення від оптимальних параметрів здатне не просто знизити вихід Δ8-THC, а призвести до формування цілого спектра небажаних побічних продуктів, серед яких можуть бути як неактивні, так і токсикологічно небезпечні сполуки.
Почати слід із кислот, які є ключовими каталізаторами процесу. Найчастіше застосовуються такі Бренстед-кислоти, як п-толуолсульфонова кислота, сірчана кислота, ортофосфатна кислота, а також галогеноводневі кислоти (зокрема HCl). Їхнє застосування базується на здатності активувати гідроксильну групу CBD, ініціюючи електрофільну циклізацію. Водночас вибір конкретної кислоти впливає не тільки на швидкість реакції, а й на регіоселективність утворення ізомерів THC – Δ8, Δ9 або Δ10. Наприклад, використання сильної неорганічної кислоти типу H₂SO₄ нерідко супроводжується частковим гідролізом або надмірною ізомеризацією, тоді як органічні кислоти (на кшталт трифтороцтової або п-толуолсульфонової) забезпечують більш делікатний перебіг процесу.
Окремої уваги заслуговують Льюїсові кислоти – BF₃•Et₂O, AlCl₃, ZnCl₂, TiCl₄ – що активують CBD шляхом комплексоутворення з електронними парами кисню. Вони діють не за рахунок протонування, а через зміщення електронної густини в критичних ділянках молекули, що дає змогу тонко налаштовувати реакційний профіль. В умовах абсолютної сухості та при суворому контролі температури саме такі каталізатори демонструють найвищу селективність щодо Δ8-ізомеру. Втім, необхідність уникати навіть слідів вологи при використанні Льюїсових кислот (оскільки вони гідролізуються з виділенням тепла й утворенням небезпечних побічних продуктів) робить ці реакції складнішими для масштабування.
Середовище, в якому відбувається реакція, також критично важливе. Зазвичай використовують апротонні органічні розчинники з низькою полярністю: хлороформ, дихлорметан, толуол, бензол або гексан. Вибір залежить від цільових показників – ступеня розчинності реагентів, стабільності проміжних карбокатіонів, теплопровідності середовища. Наприклад, дихлорметан добре розчиняє як CBD, так і Δ8-THC, стабілізує проміжні іони, і має відносно низьку температуру кипіння, що спрощує контроль реакційної температури та подальше видалення розчинника. Водночас він є летючим і токсичним, тому потребує герметичних умов і використання витяжної вентиляції.
Температура – ще один надважливий параметр. Типовий діапазон – від 50 до 90 °C. Нижча температура уповільнює реакцію, зменшуючи ризик надмірної ізомеризації або деградації продукту, однак подовжує час синтезу до кількох годин. Вища температура, особливо понад 90 °C, різко збільшує ймовірність утворення побічних ізомерів, включаючи Δ9-THC, Δ10-THC, а також переокиснені або полімеризовані продукти. При використанні вакууму або інертної атмосфери (азот, аргон) ця межа може бути незначно підвищена, але лише за умови, що система повністю герметична.
Період реакції зазвичай становить від 30 хв до 4 год залежно від кислотності, розчинника та температури. Затягування реакції поза межі оптимального вікна сприяє подальшій трансформації Δ8-THC у інші продукти – зокрема, у Δ10-ізомер або в оксидовані похідні. Наявність молекулярного кисню в реакційному середовищі сприяє перетворенню Δ8-THC на нестабільні пероксиди або хінони, тому важливим кроком є дегазація розчинника перед синтезом і проведення реакції в атмосфері інертного газу.
Контроль рН – ще одна стратегічна точка, від якої залежить чистота та селективність. Занадто кисле середовище (pH < 1) може бути надто агресивним для молекули CBD, спричиняючи фрагментацію або полімеризацію продуктів. Тому в багатьох схемах застосовують буферні системи або кислоти слабшої сили, які підтримують стабільну реакційну здатність, але не викликають надмірної реактивності.
Щодо контролю процесу – він ґрунтується на використанні сучасних аналітичних методів. На етапі синтезу моніторинг здійснюється через проби з реакційної суміші з подальшим аналізом за допомогою тонкошарової хроматографії (TLC), ВЕРХ (HPLC) або газової хроматографії з мас-спектрометрією (GC-MS). Визначальним критерієм завершення реакції є поява характерного сигналу Δ8-THC при зникненні початкового CBD. Проміжні продукти – зокрема частково циклізовані структури – також ідентифікуються, що дає змогу судити про ефективність каталізатора та коригувати параметри реакції в реальному часі.
Після завершення реакції важливо негайно провести її зупинку (quenching), зазвичай за допомогою нейтралізації залишкової кислоти, зниження температури та введення органічної фази, що сприяє екстракції Δ8-THC. Після цього відбувається багатократне промивання для видалення слідів кислоти, нейтралізуючих агентів і побічних продуктів. У разі залишкової кислотності можлива повільна деградація Δ8-THC протягом кількох діб – як при кімнатній температурі, так і при охолодженні, тому очищення має бути повним і невідкладним.
Очищення кінцевого продукту також є багатоступеневим. Найефективнішим методом є флеш-хроматографія з використанням градієнта полярності (наприклад, від гексану до ацетону). Для лабораторного аналізу та стандартизації часто застосовують ядерний магнітний резонанс (¹H-NMR та ¹³C-NMR), що дозволяє підтвердити розташування подвійного зв’язку саме між C-8 і C-9.
Матеріали обладнання теж не менш важливі. Кислотно-чутливі метали (типу алюмінію або мідних сплавів) здатні каталізувати небажані побічні реакції або навіть кородувати, що призводить до забруднення продукту й зміни хімічного профілю. Саме тому для реакції використовують скляні, тефлонові або інертні реактори.
Альтернативні підходи до синтезу
У межах хімії канабіноїдів поняття “альтернативні підходи до синтезу Δ⁸-тетрагідроканабінолу” означає вихід за рамки класичної кислотно-каталізованої ізомеризації канабідіолу. Хоча останній залишається технічно доступним і економічно ефективним способом, він супроводжується низкою технологічних і регуляторних проблем – від утворення домішок до обмеженого контролю над кінцевим профілем ізомерів. Альтернативні підходи виникли як відповідь на ці обмеження, і їх розвиток значною мірою стимулюється зростаючими вимогами до чистоти продукту, відтворюваності синтезу та фармацевтичної відповідності.
Під “альтернативністю” в цьому контексті маються на увазі підходи, що не спираються на жорстку кислотну каталізу, мінімізують термічні й фотохімічні деградації, допускають контроль на рівні субмолекулярної реактивності, застосовують нові концепції керованої ізомеризації, включно з біотрансформаціями, електрохімією, механохімією або селективним окисненням. У цьому пункті розглядаються саме ці підходи як окреме наукове поле з унікальною логікою та практичними перспективами.
Одним із напрямів, що трансформує традиційний підхід до синтезу Δ⁸-THC, є ретросинтетичне планування за допомогою алгоритмів машинного навчання. Такі платформи, як IBM RXN for Chemistry, ASKCOS або Chematica, здатні моделювати десятки тисяч варіантів синтетичних маршрутів до заданої молекули з урахуванням реакційної селективності, доступності реагентів і потенційної токсичності проміжних сполук. Для Δ⁸-THC ці системи генерували альтернативні лінії синтезу, що не базуються на ізомеризації CBD, а включають, наприклад, збирання трициклічної системи через циклізацію пренільованих фенолів або через Diels-Alder реакції між функціоналізованими дієнами та дієнофілами. Такі альтернативні шляхи зазвичай не є економічно конкурентоспроможними для промислового виробництва, однак вони надзвичайно важливі для наукового розширення хімічного простору Δ⁸-THC. Зокрема, вони дозволяють модифікувати скелет молекули, вносячи стратегічні зміни в ароматичне ядро або алкільну бічну ланку, що унеможливлює побічне утворення Δ⁹- або Δ⁷-ізомерів.
Електрохімічний підхід до синтезу Δ⁸-THC, хоча досі малодосліджений, виявляє себе як перспективний інструмент контролю над селективністю. Суть методу полягає у використанні електродного потенціалу для генерації активованих форм молекул, здатних до внутрішньомолекулярного циклічного перетворення. У випадку CBD, анодне окиснення гідроксильних груп або сусідніх вуглецевих центрів призводить до утворення електрофільних інтермедіатів, які перебудовуються в Δ⁸-ізомер у присутності слабких нуклеофілів (напр., хлоридів або карбонатів). Перевага електрохімії – повна відсутність кислотних або металевих каталізаторів, а також виняткова гнучкість щодо масштабування процесу через використання модульних електрохімічних реакторів. Водночас, існують значні виклики: висока чутливість продукту до перенапруги, потреба у водо-органічному буферному середовищі, контроль pH біля поверхні електрода, що суттєво впливає на ізомеризаційну селективність.
Серед більш інноваційних альтернатив варто виділити застосування біоорганічних каталітичних систем – молекул, що моделюють ферментативні властивості, але не є білковими структурами. Наприклад, молекулярні контейнери на основі кавітандів або циклодекстринів можуть створювати мікрооточення, яке сприяє ізомеризації CBD до Δ⁸-THC. Ідея полягає в тому, що CBD, будучи включеним у гідрофобну порожнину, зазнає внутрішньомолекулярної перебудови завдяки просторовому ефекту “folding”, аналогічному до білкової каталітичної кишені. Ці структури можна модифікувати функціональними групами, які діють як м’які кислоти або основи, забезпечуючи специфічний контроль над механізмом реакції. Прототипні експерименти показали, що катіонні варіації β-циклодекстринів можуть індукувати утворення Δ⁸-THC зі ступенем чистоти понад 95%, без формування Δ⁹- або Δ⁶а,10а-ізомерів. Водночас, проблема такої стратегії – потреба у тривалому видаленні контейнерної фази та слабка стабільність цих структур у промислових умовах.
Науковий інтерес викликає також фотокаталіз, при якому процес ізомеризації спрямовується не просто УФ-світлом, а через залучення специфічних фотосенсибілізаторів. Наприклад, використання Ruthenium(II)-комплексів або іридієвих фотокаталізаторів у присутності CBD в неполярному середовищі дозволяє запускати механізм енергійного переносу, при якому CBD активується в певній конформації, що сприяє утворенню саме Δ⁸-ізомеру. Важливо, що таке світлове збудження відбувається у видимому діапазоні (420-480 нм), а не в жорсткому УФ, що значно знижує ризик фотоокиснення або деструкції продукту. Ці технології наближаються до межі сучасної фотохімії, де активація молекули відбувається у фазовій мікрооточеності, наближеній до біологічної. Їхнім головним недоліком є потреба у дорогих комплексах благородних металів і контрольоване середовище без кисню, проте з точки зору наукового потенціалу вони формують принципово новий клас реакцій – фотоспрямовану ізомеризацію в умовах безреагентного каталізу.
Окремий, поки що майже не досліджений напрям альтернативних підходів – механохімічна активація. Йдеться про запуск хімічної реакції через фізичний вплив: тертя, тиск або удар. Експерименти з канабідіолом у твердому стані показали, що при помірному механічному навантаженні (наприклад, у кулькових млинах) можливе часткове ізомеризування CBD без застосування кислот або розчинників. Суть феномену в тому, що механічна енергія порушує π-систему подвійного зв’язку і створює локальні реактивні центри. Попри експериментальний характер, механохімія відкриває потенціал повністю сухого синтезу Δ⁸-THC без утворення рідких відходів, без енергозатратного нагрівання і за відсутності хімічних домішок. Однак ефективність методу наразі низька, селективність погано контрольована, і механізм залишається недостатньо охарактеризованим.
Напівсинтетичні методи
Поняття напівсинтетичних методів у контексті отримання Δ⁸-тетрагідроканабінолу (Δ⁸-THC) охоплює широкий спектр підходів, що поєднують біогенетичні властивості природних канабіноїдів із застосуванням спрямованих хімічних перетворень. На відміну від класичних синтетичних шляхів, де структура збирається de novo з простих молекулярних блоків, тут початковими субстратами слугують вже готові природні фітоканабіноїди – переважно канабідіол (CBD), рідше канабігерол (CBG) або канабіхромен (CBC). Важливо, що цей клас методів не лише забезпечує високу селективність синтезу Δ⁸-ізомеру, але й відкриває перспективи створення структурно споріднених похідних зі специфічними фармакологічними властивостями, оскільки структура початкових природних сполук зберігається частково без змін.
З позиції хімічної логіки напівсинтетичний підхід є ідеальним для випадків, коли мішень є складною, але її фрагменти вже існують у природі. У випадку Δ⁸-THC, канабідіол слугує саме таким фрагментом, де збережена аліфатична бічна ланка, циклогексеновий скелет, а також правильне просторове розташування функціональних груп. Основним завданням синтезу в такому разі стає індукція контролю над внутрішньомолекулярною реакцією, яка переводить відкриту структуру CBD у трициклічну систему з подвійним зв’язком між восьмим і дев’ятим атомами вуглецю. Але, на відміну від класичної кислотної ізомеризації, тут використовуються нестандартні умови, що дозволяють уникнути побічних продуктів і сприяють вищій чистоті Δ⁸-THC.
Один із напрямів напівсинтетичних підходів полягає у використанні м’яких умов каталізу з залученням ензимоподібних органокаталізаторів. Зокрема, було продемонстровано, що деякі вторинні аміни в присутності неводного середовища здатні активувати CBD шляхом утворення іонної пари з гідроксильною групою, спрямовуючи електронну густину таким чином, що відбувається контрольована циклізація до Δ⁸-THC. Такий механізм наближається до біоміметичного – він імітує ензиматичні перетворення, хоча й не передбачає участі білкових ферментів. Перевагою цього підходу є низька температура (близько 30-40 °C), короткий час реакції (до 1 години), мінімум побічних продуктів, і що важливо – збереження хімічної цілісності аліфатичних сегментів молекули, що часто зазнають гідролізу в умовах кислотного каталізу.
Іншим прикладом є використання фазотрансферного каталізу – методології, за якої органічні реагенти й каталізатори взаємодіють у багатофазному середовищі (наприклад, вода/органічний розчинник), при цьому перенос активного йона-каталізатора відбувається завдяки специфічному агенду (кватернерні амонієві солі, наприклад, тетрабутиламоній-бромід). Це дає змогу регулювати середовище кожної з фаз незалежно, зберігаючи CBD у сприятливій органічній фазі, а каталізатор – в активній іонній формі в межах реакційної інтерфази. Такий підхід дозволяє точно регулювати локальну рН-активність без впливу на весь об’єм, що знижує ризик утворення нестабільних ізомерів і деструктивних побічних реакцій.
Ще однією варіацією є використання фотохімічного спрямування реакцій. У цьому разі ізомеризація не потребує традиційних кислот, натомість використовується опромінення у вузькому спектрі ультрафіолету, переважно на межі 280-320 нм. У присутності певних сенсибілізаторів (напр., бензофенон або ацетофенон) UV-світло активує π-електронну систему CBD, що спричиняє індукування електрофільного центру в молекулі та ініціює внутрішньомолекулярну перебудову. Умови мають бути строго контрольованими: у надмірному світловому потоці можливе перетворення Δ⁸-THC у фотолабільні продукти – зокрема, у Δ⁶a,10a-ізомер або навіть у хіноноїдні структури з втраченою психоактивністю. Перевага методу – його екологічна чистота: відсутність хімічних реагентів, низька температура, м’які умови; але недоліком є складність масштабування та потреба у спеціальному обладнанні.
Особливої уваги заслуговують катіонні полімерні системи, що працюють як гетерогенні каталізатори. До таких належать полімери з імобілізованими кислотними або лужними групами, які не розчиняються в середовищі, але каталізують реакцію на своїй поверхні. Наприклад, сульфоновані полімери типу Amberlyst-15 або Nafion-H можуть слугувати твердими кислотними носіями. Їх застосування має переваги: не потребує додаткового очищення від кислот, не вступає у побічні реакції з Δ⁸-THC, і, що важливо, дозволяє повторне використання каталізатора після очищення. Проте їх ефективність часто нижча, ніж у рідких каталізаторів, і вони потребують довших циклів реакції (до 6 год).
Низка наукових досліджень демонструє, що електрохімічне модифікування CBD також може використовуватись для селективного спрямування ізомеризації. У такому підході CBD піддають дії контрольованого електричного потенціалу в присутності інертного електроліту. Це дозволяє локально утворити катіонний центр, який запускає цільову перебудову структури до Δ⁸-THC. Метод є високоселективним, оскільки забезпечує поступову та точну генерацію електрофільних умов без додавання сильних кислот. Втім, складність електрохімічних реакторів та обмеженість у масштабах роблять цю технологію переважно дослідницькою.
Ще один інноваційний напрям у межах напівсинтетичних методів – це використання мікрохвильового опромінення. На відміну від фотохімії, тут діє не світло, а електромагнітне випромінювання в діапазоні 2,45 ГГц, яке забезпечує швидке рівномірне нагрівання реакційної суміші. В таких умовах ізомеризація відбувається швидше й при нижчій загальній температурі, з мінімізацією гарячих точок, що можуть викликати термічну деградацію. Важливо, що цей метод добре поєднується з гетерогенними каталізаторами, що робить його особливо привабливим для селективної ізомеризації без надлишкової кислотності або окислення.
Усі ці методи – органокаталіз, фотохімія, мікрохвильова активація, гетерогенний каталіз, електрохімія – належать до парадигми так званого “зеленого синтезу”, яка покликана зменшити токсичність, споживання енергії, побічне навантаження та екологічний слід. І хоча в промисловій практиці вони все ще менш поширені, ніж класичні кислотні схеми, їх дослідницький потенціал не викликає сумнівів: вони дозволяють отримувати високочистий Δ⁸-THC без слідів Δ⁹-ізомеру, без побічних фенольних продуктів і без потреби у глибокому хроматографічному очищенні.
У перспективі, саме ці напівсинтетичні платформи можуть лягти в основу стандартизованого виробництва Δ⁸-THC для фармацевтичного використання, де неприпустимі сліди неідентифікованих побічних речовин або термолабільних домішок. Поєднання натуральної структури з керованою селективною перебудовою – це ключ до надійності, чистоти й відтворюваності синтезу Δ⁸-THC у рамках сучасної канабіноїдної хімії.
Перспективи біотехнологічного виробництва
У межах досліджень синтезу Δ⁸-тетрагідроканабінолу (Δ⁸-THC) біотехнологічні підходи розглядаються як потенційно найбільш екологічно чисті, специфічні та масштабовані. Ідея застосування біотехнології полягає у використанні живих клітин або їхніх ферментативних систем для створення канабіноїдів з точною просторовою конфігурацією, високою чистотою та мінімізацією побічних продуктів. Це відкриває шлях до переходу від хімічного до біоінженерного виробництва Δ⁸-THC, що є вкрай актуальним з огляду на фармацевтичну стандартизацію, регуляторні вимоги та зменшення впливу на довкілля.
Поточні дослідження в цій царині зосереджуються насамперед на інженерії мікроорганізмів – переважно дріжджів (Saccharomyces cerevisiae) і бактерій (наприклад, Escherichia coli), здатних продукувати канабіноїдні прекурсори або навіть кінцеві сполуки. Застосовуючи техніки синтетичної біології, в клітини імплантують штучні метаболічні каскади, які дозволяють трансформувати прості цукри, як-от глюкозу, у ключові канабіноїди, включно з канабігероловою кислотою (CBGA), канабідіоловою кислотою (CBDA), а відтак і з канабідіолом (CBD), що може слугувати субстратом для подальшої біоізомеризації в Δ⁸-THC.
Зокрема, перспективним є напрям розробки ферментів, здатних селективно ізомеризувати CBD в Δ⁸-ізомер. На сьогодні описано кілька ферментативних систем з функціональною активністю в цьому напрямі, зокрема ті, що належать до класу окисно-відновних ферментів – флавінзалежні монооксигенази та ензими з циклазною активністю. Ранній приклад включає експресію ферменту канабіс-синтази, зміненого шляхом точкових мутацій, що знижує його афінність до утворення Δ⁹-THC і зсув у бік Δ⁸-ізомерів. Поряд із цим, йдеться про використання ферментів, іммобілізованих на твердих носіях, що забезпечує їх багаторазове застосування та стабільність у потоці виробничого середовища.
Одним із найамбітніших напрямів є створення повністю синтетичних хромосом у мікроорганізмах – так званих chassis cells, запрограмованих для комплексної біосинтезу канабіноїдів із мінімальним втручанням ззовні. Прикладом такого підходу є проєкти Ginkgo Bioworks, Amyris або Demetrix, які створюють дріжджові штами, здатні продукувати десятки грамів канабіноїдів з одного літра середовища. Хоча наразі основна увага зосереджена на CBD і Δ⁹-THC, алгоритми оптимізації метаболічного потоку (flux balance analysis, dynamic pathway modulation) дають змогу переорієнтовувати каскади на отримання Δ⁸-ізомерів за рахунок редизайну ключових ферментів і умов ферментації.
Іншим варіантом є біотрансформація CBD у Δ⁸-THC за допомогою мікроорганізмів або вищих грибів, здатних каталізувати специфічні перегрупування. Наприклад, види роду Cunninghamella або Rhizopus демонструють здатність до специфічного окиснення та циклізації із збереженням або зміною геометрії подвійного зв’язку. Преінкубація CBD із культурою таких грибів у контрольованих умовах pH та температури дозволяє досягти селективної трансформації без застосування кислот або органічних розчинників. Однак основними обмеженнями таких процесів є нестабільність метаболомів, потреба у тривалих інкубаціях і низький вихід продукту.
Крім того, розглядається застосування ферментів, отриманих з рослин канабісу, шляхом клонування відповідних генів і гетерологічної експресії в моделях-продуцентах. Наприклад, ферментів з родів THCA-синтаз або CBCA-синтаз, які модифікують активні проміжні форми канабіноїдів на рівні кислотного попередника. За допомогою технологій прямої еволюції такі ферменти можна адаптувати для направленого синтезу Δ⁸-THC, уникаючи етапу термічної або кислотної декарбоксилізації, що значно знижує енергетичні витрати та ризик формування побічних ізомерів.
Перспективи біотехнологічного виробництва Δ⁸-THC виявляються особливо привабливими в контексті майбутніх фармацевтичних застосувань, де контроль над хімічною чистотою, відсутністю залишкових кислот, металів або розчинників є критичним. Біотехнологічні платформи дозволяють забезпечити таку чистоту за рахунок ферментативного каталазу, компартменталізації метаболізму та експресії допоміжних протеїнів для стабілізації цільової молекули.
Фармакологічний профіль Delta-8-THC
Взаємодія з канабіноїдними рецепторами
Δ8-тетрагідроканабінол (Δ8-THC) є складною молекулою, здатною взаємодіяти з кількома типами рецепторів, найважливішими з яких є канабіноїдні рецептори CB1 та CB2. Ці рецептори входять до сімейства G-білок-зчеплених рецепторів (GPCR), що опосередковують численні фізіологічні процеси, включно з регуляцією нервової активності, імунною відповіддю та метаболізмом. Взаємодія Δ8-THC з цими рецепторами має унікальні фармакодинамічні особливості, які відрізняють його від більш поширеного Δ9-THC.
CB1-рецептори локалізовані головним чином у центральній нервовій системі, особливо в корі головного мозку, гіпокампі, базальних гангліях і мозочку. Зв’язування Δ8-THC із CB1 спричиняє алостеричну зміну конформації рецептора, що активує внутрішньоклітинні сигнальні каскади. Активований CB1 інгібує аденілатциклазу, що веде до зниження рівня цАМФ, регулює активність іонних каналів та модулює вивільнення нейромедіаторів, таких як глутамат, ГАМК, дофамін і серотонін. Цей механізм обумовлює вплив Δ8-THC на нейронну збудливість, пам’ять, моторику та біль.
Порівняно з Δ9-THC, Δ8-THC має нижчу афінність до CB1-рецепторів, проте її зв’язок достатній для стимуляції фармакологічної активності, проте ефекти зазвичай більш помірні та стійкі. Ця різниця в спорідненості впливає на клінічні прояви: Δ8-THC демонструє менш виражену психоактивність, що може пояснюватися інакшим просторовим розташуванням подвійного зв’язку у молекулі, що впливає на конформацію та спорідненість до рецептора.
CB2-рецептори, які локалізуються переважно у периферійних тканинах, включно з імунними клітинами, селезінкою, печінкою та кишковим трактом, також здатні взаємодіяти з Δ8-THC. Активація CB2 запускає сигнальні шляхи, пов’язані з регуляцією імунної відповіді, включаючи активацію MAP-кіназ (ERK, JNK, p38), що веде до зміни експресії цитокінів і зменшення запалення. Таким чином, Δ8-THC здатен модулювати імунний гомеостаз, що має потенціал для терапевтичного застосування в запальних і автоімунних захворюваннях.
Додатково, Δ8-THC проявляє взаємодію з іншими рецепторними системами, які виходять за межі канабіноїдної системи. Зокрема, частковий агонистичний ефект на ванілоїдні рецептори TRPV1 пов’язаний із впливом на біль і запалення. Вплив на глутаматергічну, дофамінергічну та серотонінергічну системи здійснюється через опосередковані механізми, що модулюють синаптичну передачу, забезпечуючи комплексний фармакологічний профіль.
Враховуючи всі ці фактори, взаємодія Δ8-THC із рецепторами відображає тонкий баланс між афінністю, внутрішньою активністю і просторовою конфігурацією молекули, що визначає специфічні фармакологічні ефекти, відмінні від інших канабіноїдів. Подальше вивчення молекулярної динаміки зв’язування та структурних особливостей цих взаємодій є ключовим для розвитку цілеспрямованих терапевтичних засобів із використанням Δ8-THC.
Потенційні терапевтичні ефекти Delta-8-THC
Delta-8-тетрагідроканабінол (Δ8-THC), хоча менш вивчений, ніж його ізомер Δ9-THC, демонструє широкий спектр потенційних терапевтичних властивостей, які роблять його цікавим об’єктом для фармакологічних досліджень. Його унікальний фармакологічний профіль, що поєднує помірну афінність до канабіноїдних рецепторів із більш м’якими психоактивними ефектами, створює передумови для застосування в медичній практиці. Розглянемо детальніше три ключові напрямки його терапевтичного потенціалу – антиеметичний ефект, анальгезію та вплив на психоемоційний стан, включно з тривожністю, настроєм і апетитом.
Антиеметична дія Δ8-THC пов’язана з його здатністю модулювати активність рецепторів CB1 у центральних зонах, відповідальних за контроль блювотного рефлексу, зокрема в хеморецепторній зоні тригерної зони (CTZ) та прилеглому ядрі в стовбурі мозку. Це дозволяє зменшити нудоту і блювання, викликані різними факторами, зокрема хіміотерапією, променевою терапією або іншими токсичними агентами. Особливість Δ8-THC полягає у більш м’якому профілі побічних ефектів порівняно з Δ9-THC, що робить його перспективним для застосування у пацієнтів із підвищеною чутливістю до психоактивних проявів.
Анальгетичний потенціал Δ8-THC проявляється через взаємодію з CB1-рецепторами в периферійних і центральних структурах, пов’язаних з передачею больових сигналів, а також через модуляцію TRPV1-рецепторів, що відповідають за сприйняття запалення та термічного болю. Фармакодинамічні дослідження свідчать, що Δ8-THC здатен зменшувати гострий і хронічний біль, впливаючи на як соматичні, так і нейропатичні больові синдроми. Ця властивість обумовлена одночасним впливом на кілька нейротрансмітерних систем, що дозволяє уникнути толерантності, властивої багатьом опіоїдним анальгетикам.
Щодо психоемоційного впливу, Δ8-THC показує здатність зменшувати тривожність і покращувати настрій, що обумовлено його регуляторною дією на дофамінергічні та серотонінергічні системи. Ці ефекти відрізняються від Δ9-THC меншою інтенсивністю і стабільністю, що може забезпечити кращу переносимість при терапевтичному застосуванні. Також є свідчення, що Δ8-THC стимулює апетит, що має значення для пацієнтів з анорексією, кахексією або іншими станами, пов’язаними зі зниженням маси тіла, особливо у онкологічних хворих.
Антиеметична дія
Delta-8-тетрагідроканабінол (Δ8-THC) виявляє значний потенціал у пригніченні нудоти та блювоти, що є однією з ключових проблем у клінічній практиці, особливо серед пацієнтів, які проходять курс хіміотерапії або страждають від різноманітних токсичних впливів. Його антиеметична активність пов’язана із здатністю модулювати центральні нейронні структури, що контролюють блювотний рефлекс. Найважливішими центрами є хеморецепторна тригерна зона (CTZ), розташована в довгастому мозку, та прилегле ядро, які інтегрують сигнали, що провокують блювоту.
Δ8-THC впливає на ці зони через зв’язування з CB1-рецепторами, що локалізовані в нейронах, які регулюють вивільнення нейромедіаторів, таких як допамін і серотонін, ключових для індукції блювоти. Внаслідок цього відбувається зниження збудливості нейронів CTZ і зменшення активації блювотного центру. На відміну від Δ9-THC, Δ8-THC має менший психоактивний ефект, що робить його більш прийнятним для пацієнтів, яким потрібне симптоматичне полегшення без значного психотропного впливу.
Крім центральної дії, Δ8-THC може також впливати на периферичні механізми, що беруть участь у регуляції травлення та моторики шлунково-кишкового тракту, додатково сприяючи зменшенню симптомів нудоти. Його фармакокінетичні властивості забезпечують достатньо тривалий ефект, що робить можливим використання у режимах з продовженою дією.
Зважаючи на цю фармакологічну специфіку, Δ8-THC є перспективним кандидатом для розробки антиеметичних препаратів, особливо в контексті онкологічної терапії, де токсичність традиційних засобів часто обмежує їх застосування. Однак необхідні подальші дослідження для встановлення оптимальних доз, безпеки та порівняння ефективності з існуючими стандартами лікування.
Анальгетичний потенціал
Анальгетичні властивості Delta-8-THC зумовлені комплексним впливом на нейронні мережі, що модулюють больові сигнали як у периферичній, так і центральній нервовій системі. Його дія реалізується через активацію канабіноїдних рецепторів, переважно CB1, які виявляються у високій концентрації в області спинного мозку та мозку, відповідальних за обробку ноцицептивної інформації.
Вплив Δ8-THC на CB1-рецептори призводить до пригнічення вивільнення нейромедіаторів, що передають больові імпульси, таких як глутамат і субстанція P. Це веде до зниження збудливості нейронів і підвищення больового порогу, що зменшує інтенсивність сприйняття болю. Крім того, Δ8-THC взаємодіє з TRPV1-рецепторами, які відіграють роль у трансдукції запального та термічного болю, що розширює спектр його анальгетичного ефекту.
Додатково, Δ8-THC може впливати на ендокринні та імунні механізми, які посилюють або підтримують больовий синдром. Наприклад, через активацію CB2-рецепторів відбувається зменшення запалення за рахунок модуляції продукції прозапальних цитокінів, що особливо актуально при хронічних запальних станах.
Порівняно з традиційними опіоїдними анальгетиками, Δ8-THC має потенціал знижувати ризик розвитку залежності та небажаних побічних ефектів, таких як респіраторна депресія. Його анальгетична дія є більш м’якою, проте достатньою для зменшення помірного і навіть сильного болю в окремих клінічних випадках.
Сумарно, анальгетичний профіль Δ8-THC робить його перспективним агентом у лікуванні різних форм болю, включаючи нейропатичний, запальний і соматичний біль. Однак для клінічного застосування необхідні додаткові доклінічні та клінічні дослідження, які визначать його ефективність у порівнянні з існуючими анальгетиками, а також безпеку та оптимальні режими дозування.
Тривожність, настрій, апетит
Delta-8-тетрагідроканабінол (Δ8-THC) демонструє значний вплив на психоемоційний стан, що проявляється у регуляції тривожності, покращенні настрою та стимуляції апетиту. Ці ефекти є результатом складної взаємодії з центральними нейронними системами, які опосередковують емоційні реакції, мотивацію та гомеостаз енергетичного балансу.
Регуляція тривожності під впливом Δ8-THC відрізняється від більш психоактивного Δ9-THC завдяки відносно помірній афінності до CB1-рецепторів і менш вираженій психоактивності. Молекула модулює активність глутаматергічних і ГАМКергічних нейронів у лімбічній системі, зокрема в амігдалі та гіпокампі, які відіграють ключову роль у формуванні тривожних реакцій. Цей баланс між збудженням і інгібіцією нейронів сприяє зниженню рівня тривожності без типових для Δ9-THC параноїдальних чи панічних нападів. Подібна дія підтверджується експериментальними моделями тривожності, де Δ8-THC демонструє здатність нормалізувати поведінкові реакції без пригнічення когнітивних функцій.
Щодо настрою, Δ8-THC впливає на дофамінергічні шляхи мезолімбічної системи, що забезпечує стимуляцію центрів задоволення та винагороди. Це веде до покращення емоційного фону, збільшення мотивації і зменшення симптомів депресії. Унікальна конформація Δ8-THC дозволяє йому діяти як частковий агонист на CB1-рецептори, що створює більш контрольований і передбачуваний ефект порівняно з Δ9-THC, що має значення для терапії афективних розладів.
Стимуляція апетиту є ще одним важливим терапевтичним аспектом Δ8-THC. Через активацію канабіноїдних рецепторів у гіпоталамусі відбувається посилення мотивації до прийому їжі, зокрема збільшення відчуття голоду і бажання вживати висококалорійні продукти. Цей ефект корисний для пацієнтів із захворюваннями, які супроводжуються втратою ваги і зниженням апетиту, такими як онкологічні, ВІЛ-інфекція, хронічні інфекції та різні соматичні захворювання. Відмінність Δ8-THC полягає у зниженій частоті небажаних психоактивних реакцій, що сприяє кращій переносимості і підвищує якість життя хворих.
Аспекти безпеки, токсикологія та регуляція
Оцінка безпеки Delta-8-тетрагідроканабінолу (Δ8-THC) є критично важливою у контексті його дедалі ширшого поширення як психоактивного агента, що продається на ринку легальних або слаборегульованих канабіноїдів. Хоча структурна спорідненість із Δ9-THC передбачає подібність у фармакодинаміці, безпековий профіль Δ8-THC не може автоматично виводитися з характеристик його ізомеру. Відмінності в афінності до рецепторів, метаболічних шляхах, стабільності молекули та контекстах вживання роблять необхідним окремий аналіз. Оскільки на момент написання значна частина даних щодо Δ8-THC обмежується доклінічними моделями та нерандомізованими спостереженнями, особливу увагу слід приділяти інтерпретації результатів у рамках наукової обережності.
Фундаментально, Δ8-THC є частковим агоністом канабіноїдного рецептора типу 1 (CB1), який експресується головним чином у центральній нервовій системі. Його дія опосередковується через механізми, пов’язані з інгібуванням вивільнення нейромедіаторів, включно з глутаматом, ГАМК, дофаміном і ацетилхоліном. З огляду на ці властивості, Δ8-THC здатен впливати на когнітивні процеси, моторну координацію, емоційне сприйняття та нейровегетативну регуляцію. Тому оцінка токсичності повинна включати як параметри загальної безпеки, так і специфічні нейропсихотропні ефекти, що відрізняються залежно від дози, тривалості застосування та індивідуальних особливостей.
Наразі доклінічні токсикологічні дослідження Δ8-THC є обмеженими й фрагментованими. Ізольовані експерименти на тваринних моделях свідчать, що LD50 (летальна доза для 50% популяції) Δ8-THC є значно вищою за типові терапевтичні чи рекреаційні дози. Проте летальність у таких моделях не є єдиним релевантним критерієм безпеки. Більш вагомими є дані щодо сублетальних доз, які впливають на поведінку, нейропластичність, серцево-судинну регуляцію, функцію печінки та нирок. Поки що ці результати залишаються фрагментарними: не існує широкомасштабних досліджень, що охоплювали б мультисистемний аналіз токсичності за хронічного прийому.
Особливу занепокоєність викликає контекст синтетичної ізомеризації Δ8-THC з канабідіолу (CBD), яка часто здійснюється в кустарних умовах із застосуванням кислотних каталізаторів, важких металів або нестабільних розчинників. Наявність залишків кислот, побічних продуктів ізомеризації, включаючи неідентифіковані ізомери або окислені форми, може значно впливати на безпековий профіль кінцевого продукту. У таких випадках токсикологічна небезпека визначається не лише самою активною субстанцією (Δ8-THC), а й сумішшю непрозорих домішок, які залишаються після синтезу. Незалежні хімічні аналізи показують, що в зразках, які представлені на ринку США як “чистий Delta-8”, нерідко виявляється значна частка інших канабіноїдів (наприклад, Δ10-THC, Δ6a,10a-THC) і небажаних побічних речовин, які не проходили жодних випробувань на токсичність.
Окремим аспектом є відсутність нормативно закріплених стандартів чистоти або фармацевтичної відповідності для продуктів, що містять Δ8-THC. Більшість таких субстанцій не проходить ані контролю GMP (Good Manufacturing Practice), ані стандартів фармакопеї. Через це споживачі, зокрема ті, хто вживає Δ8-THC як засіб самолікування, фактично опиняються в ситуації токсикологічної невизначеності. Це становить значну загрозу вразливим групам – пацієнтам з онкологічними, неврологічними чи психіатричними станами, які шукають легальний замінник Δ9-THC і не можуть перевірити якість чи стабільність препарату.
Наразі єдиним надійним джерелом токсикологічної валідації залишаються експерименти in vitro на клітинних лініях та in vivo на тваринах. У декількох дослідженнях було виявлено, що Δ8-THC має подібні до Δ9-THC ефекти на синаптичну передачу, але менш виражену здатність до викликання дезорганізованої поведінки чи психомоторної дезінтеграції. Це відкриває можливості для терапевтичного використання Δ8-THC, однак не знімає потреби в чіткій стандартизації, контролі дози та знання механізмів його метаболізму.
Окремої уваги заслуговують метаболіти Δ8-THC. Основним метаболітом є 11-гідрокси-Δ8-THC, який має здатність перетинати гематоенцефалічний бар’єр та впливати на центральну нервову систему. Його фармакокінетика наразі вивчена значно гірше, ніж у випадку 11-гідрокси-Δ9-THC, хоча попередні дані вказують на потенційну активність, яка може перевищувати вихідну субстанцію. Відсутність широкомасштабних досліджень у цій сфері обмежує можливість точного передбачення тривалості та інтенсивності дії, що ускладнює формування дозувальних рекомендацій та створює ризик кумулятивної токсичності.
Дані з доклінічних і клінічних досліджень
Попри зростання популярності Δ8-THC в окремих регіонах, обсяг і якість емпіричних досліджень щодо його безпеки та ефективності залишаються вкрай обмеженими, що спричиняє істотний дисбаланс між поширеністю вживання та науковим розумінням потенційних ризиків і переваг. Систематизоване дослідження фармакологічних, токсикологічних і клінічних властивостей Δ8-THC наразі перебуває на початковому етапі, а більшість наявних даних базується на дослідах середини – кінця XX століття або сучасних in vitro / in vivo тестах, які часто проводяться з методологічними обмеженнями. У цьому контексті розгляд наявних доклінічних і клінічних даних вимагає критичного підходу, із чітким відокремленням попередніх припущень від емпірично підтверджених висновків.
Перші спроби вивчення Δ8-THC сягають 1970-х років, коли в умовах часткового правового вакууму дослідники шукали легальні замінники Δ9-THC, які могли б зберігати психоактивні й терапевтичні властивості при зменшеному потенціалі побічної дії. У цей період проведено кілька маломасштабних клінічних випробувань, зокрема за участю онкологічних пацієнтів, яким призначали Δ8-THC як протиблювотний засіб у межах паліативної допомоги. В одному з таких досліджень, опублікованому в 1995 році, було повідомлено про значне зниження частоти блювання після хіміотерапії в дітей, які приймали Δ8-THC перорально в інкапсульованій формі. Попри позитивні результати (з ефективністю понад 90% у зменшенні нудоти), обмеження включали малу вибірку (всього 8 учасників), відсутність контрольної групи та короткий період спостереження. Жодне з подальших досліджень не підтвердило або спростувало ці висновки в межах рандомізованих контрольованих випробувань.
Станом на сьогодні клінічні дослідження Δ8-THC не досягли навіть того обсягу, який характерний для інших рідкісних канабіноїдів. Існуючі дослідження обмежуються випадковими ретроспективними спостереженнями або неформальними опитуваннями споживачів. У таких дослідженнях пацієнти зазвичай самостійно повідомляють про вживання Δ8-THC з метою зменшення болю, тривожності, стимуляції апетиту або полегшення сну. Проте відсутність об’єктивних біомаркерів, стандартизованих дозувань і подвійного сліпого дизайну робить такі дані радше джерелом гіпотез, аніж тверджень.
Загалом, серед клінічно релевантних запитань, на які нині відсутні емпіричні відповіді, є: оптимальна терапевтична доза Δ8-THC для конкретних патологій; профіль побічних реакцій у різних вікових і соматичних групах; фармакокінетика при різних шляхах введення (перорально, інгаляційно, трансдермально); а також взаємодія з іншими лікарськими засобами, зокрема ЦНС-депресантами, антидепресантами чи антипсихотиками. Відсутність контролю за джерелами речовини унеможливлює навіть екстраполяцію результатів на комерційно доступні продукти, які рідко проходять належне хімічне очищення та перевірку.
Доклінічні моделі, переважно in vivo дослідження на гризунах, становлять основний корпус даних про дію Δ8-THC. Вони дозволяють оцінити базові нейробіологічні ефекти, потенціал до формування залежності, взаємодію з іншими рецепторними системами та вплив на загальний метаболізм. Зокрема, на мишах показано, що Δ8-THC викликає значне зменшення загального моторного тонусу, анальгезію, гіпотермію та каталепсію – ознаки, типові для канабіноїдів класу CB1-агоністів. Проте ступінь вираженості цих ефектів нижчий порівняно з Δ9-THC, що підтверджує менш виражену психоактивність, хоча не скасовує потенціал до когнітивних або афективних порушень.
Також заслуговують уваги дані про нейропротекторну дію Δ8-THC. У низці дослідів in vitro спостерігалося зниження апоптозу нейронів, індукованого окислювальним стресом, при попередній інкубації з Δ8-THC. Механізми цього ефекту, імовірно, пов’язані з активацією CB1-рецепторів, але не виключено й додаткову участь сигнальних каскадів, зокрема PI3K/AKT або ERK1/2, що вказує на потенціал Δ8-THC у контексті нейродегенеративних станів. Втім, жодна з цих моделей не була підтверджена в клінічному сценарії, а екстраполяція з клітинних культур на людську тканину потребує значно обережнішого підходу.
Іншим важливим напрямком є дослідження фармакокінетики. У кількох доклінічних роботах з використанням мас-спектрометрії встановлено, що Δ8-THC має помірну біодоступність при пероральному прийомі та високий ступінь ліпофільності, що зумовлює його кумуляцію в жировій тканині. Це створює умови для пролонгованої дії, але також підвищує ризик непередбачуваного накопичення при тривалому вживанні, особливо у пацієнтів із порушеннями метаболізму або надмірною масою тіла. Досі відсутні дані про періоди напіввиведення та взаємодію Δ8-THC із ферментами печінкового метаболізму (наприклад, CYP3A4, CYP2C9), хоча наявні спостереження свідчать про аналогічні шляхи біотрансформації з Δ9-THC.
Потенційні ризики та побічні ефекти
Питання безпеки використання Δ8-тетрагідроканабінолу (Δ8-THC) має розглядатися в контексті його біологічної активності, хімічної нестабільності, потенціалу метаболічної біотрансформації, а також відсутності фармацевтично стандартизованих форм випуску. На відміну від Δ9-THC, профіль токсичності Δ8-THC лишається недостатньо окресленим не лише через брак якісних клінічних досліджень, але й через домінування неконтрольованих каналів поширення, зокрема синтетичних продуктів, отриманих із канабідіолу. У такому середовищі сформувати надійне уявлення про побічні ефекти надзвичайно складно, особливо з урахуванням різних способів введення, дозування, домішок і нерівномірної біодоступності.
Однією з ключових загроз, притаманних Δ8-THC, є відсутність молекулярної чистоти в більшості доступних на ринку зразків. Як відомо, Δ8-THC у природних умовах міститься в рослинах роду Cannabis у надзвичайно низьких концентраціях, тому більшість сполук, що вважаються Δ8-THC у комерційному обігу, насправді є продуктами синтетичної або напівсинтетичної ізомеризації CBD. Цей процес, який зазвичай відбувається в кислому середовищі за участю каталізаторів, генерує численні побічні ізомери, оксидовані продукти та неідентифіковані проміжні форми, які залишаються в кінцевому продукті через відсутність хроматографічного очищення. Такі домішки можуть мати власну біоактивність або потенційну токсичність, про яку наука майже нічого не знає.
Ретроспективні дані та повідомлення до систем моніторингу побічних ефектів свідчать про зростаючу кількість скарг, пов’язаних з інтоксикацією після споживання Δ8-THC. Серед найчастіших симптомів: параноїдальні стани, порушення орієнтації, психомоторна дисфункція, вестибулярні розлади, тахікардія, гіпотонія, сухість у роті, нудота, дезорієнтація, судомоподібні реакції. Частина таких симптомів може бути спровокована не лише дією Δ8-THC як CB1-агоніста, а й впливом побічних субстанцій у неочищеній суміші. Наприклад, неідентифіковані хлоровані або ацетильовані побічні продукти внаслідок неправильного синтезу можуть мати нейротоксичну дію або взаємодіяти з печінковими ферментами, порушуючи метаболізм інших лікарських засобів.
Іншим суттєвим аспектом ризику є інгаляційні форми Δ8-THC, зокрема вейп-картриджі. При нагріванні субстанцій, які містять залишки кислотних каталізаторів або полімерних домішок, утворюються токсичні леткі продукти, включаючи ацетати, альдегіди, феноли та бензол-похідні. Подібні механізми фіксувалися при споживанні ацетатних форм Δ8-THC, що нагрівалися вище 200°C. Особливо тривожним є потенціал утворення кетену – сильного алкілувального агента з високою токсичністю для епітелію дихальних шляхів. У випадках масової інтоксикації в США 2021 року, що асоціювалися з продуктами Δ8-THC, основною підозрою стали саме ацетатні та неочищені субстанції у вейп-продуктах.
З нейропсихіатричної точки зору, Δ8-THC має потенціал викликати когнітивні порушення, особливо у підлітків, осіб із сімейною історією психічних розладів або за умови поєднання з іншими психоактивними речовинами. Хоча його психоактивність дещо нижча, ніж у Δ9-THC, навіть помірне стимулювання CB1-рецепторів у центральній нервовій системі може спричиняти дизрегуляцію дофамінергічних і глутаматергічних шляхів, особливо в префронтальній корі. Це проявляється в транзиторних порушеннях уваги, пам’яті, сну, а вразливі індивіди можуть переживати панічні атаки, психотичні епізоди або емоційні дестабілізації.
Ще одним малодослідженим вектором ризику є гепатотоксичний потенціал Δ8-THC. Відомо, що синтетично отримані канабіноїди можуть виявляти пряму цитотоксичність щодо гепатоцитів у високих дозах або при тривалому застосуванні. Δ8-THC, ймовірно, метаболізується за участю ферментів CYP2C9 та CYP3A4, що зумовлює його здатність конкурувати з іншими субстратами цих систем, зокрема антигіпертензивними засобами, антикоагулянтами, протиепілептичними препаратами. Хоча прямих доказів гепатотоксичності Δ8-THC немає, ізольовані випадки підвищення рівнів печінкових ферментів у споживачів свідчать про необхідність подальшого дослідження в цьому напрямі.
Крім того, існує проблема кумулятивного ефекту. Ліпофільна природа Δ8-THC зумовлює його тривале збереження в жирових депо з повільним вивільненням у системний кровообіг. У контексті хронічного вживання це може спричинити несподівані зміни поведінки, пролонговану психомоторну депресію або толерантність до інших психоактивних сполук. І хоча прямі показники фізіологічної залежності в експериментальних моделях вважаються нижчими, ніж для Δ9-THC, повторюване вживання Δ8-THC може викликати психологічну залежність або звикання на рівні умовних рефлексів.
Окремо слід зазначити, що більшість сучасних продуктів із Δ8-THC не проходять регуляторної сертифікації, тому ризики, пов’язані із забрудненням важкими металами, пестицидами, розчинниками (гептан, толуол, етанол) або мікробіологічними агентами (пліснява, бактерії), залишаються високими. Це робить будь-які оцінки безпеки таких продуктів некоректними, доки не буде введено нормативи до вмісту домішок, стандартні методи валідації та контролю якості.
Законодавча ситуація у світі та виклики досліджень
Правовий статус Δ8-тетрагідроканабінолу (Δ8-THC) на сьогодні є одним із найбільш суперечливих аспектів у сфері канабіноїдної політики. Ця сполука формально не входила до переліку контрольованих речовин у більшості юрисдикцій протягом тривалого часу, що зумовило її широке поширення, особливо в країнах із лібералізованим регулюванням канабіноїдів. Проте правова амбівалентність Δ8-THC виникла не випадково – вона є прямим наслідком розриву між нормативним полем, яке ґрунтується на класифікації природних канабіноїдів, і реальністю, де домінують напівсинтетичні аналоги, отримані із канабідіолу.
Міжнародна конвенція про наркотичні засоби 1961 року, ратифікована більшістю держав, не містила згадки про Δ8-THC як окрему сполуку. Більш чітке формулювання з’явилося у рекомендаціях Всесвітньої організації охорони здоров’я у 2020 році, коли було запропоновано розглядати Δ8-THC як ізомер Δ9-THC із подібним психоактивним потенціалом. Проте ця пропозиція не набула обов’язкового характеру. Таким чином, на глобальному рівні Δ8-THC часто залишається поза формальними рамками контролю, якщо його не синтезовано безпосередньо з Δ9-THC або не отримано з рослин канабісу, що містять його у вищих концентраціях, ніж дозволено законами окремих країн.
У США регуляторна ситуація з Δ8-THC особливо показова. Після ухвалення “Farm Bill” у 2018 році, який легалізував коноплі (hemp) та всі похідні канабіноїди з концентрацією Δ9-THC менш як 0.3%, з’явився правовий вакуум, що дозволив масове виробництво Δ8-THC з легального канабідіолу. Через те, що Δ8-THC не був прямо згаданий у федеральному списку заборонених речовин, його почали продавати в магазинах, онлайн-платформах та вейп-дистриб’юторах, позиціонуючи як “законну альтернативу” традиційному Δ9-THC. Однак з 2021 року низка штатів, зокрема Нью-Йорк, Колорадо, Аляска та Юта, почали вводити обмеження або повні заборони на його обіг, посилаючись на відсутність регулювання якості, токсикологічних даних і неконтрольоване поширення серед підлітків.
Регуляторні агентства, включно з FDA (Управління з контролю за продуктами та ліками США), почали виявляти тривогу щодо безконтрольного ринку Δ8-THC. У 2022 році FDA офіційно застерегло споживачів щодо потенційних небезпек, зазначаючи часті випадки інтоксикацій та госпіталізацій, пов’язаних із вживанням Δ8-THC-продуктів. Проте FDA підкреслило, що не має повноважень заборонити обіг цих речовин без законодавчого визначення їхнього статусу. У результаті склалася ситуація, коли сполука з психоактивним ефектом, схожим на Δ9-THC, поширюється в правовому полі, яке лише частково визнає її існування.
У Європейському Союзі правове регулювання Δ8-THC залежить від національного законодавства. У більшості країн він не є окремо зазначеною контрольованою речовиною, однак його правовий статус тлумачиться як похідний Δ9-THC або як синтетичний канабіноїд, що автоматично підпадає під заборону. Наприклад, у Німеччині та Франції всі психоактивні канабіноїди, які не є частиною офіційно дозволених препаратів (як, наприклад, дронабінол), вважаються забороненими. У Великій Британії Δ8-THC класифіковано як речовину класу B відповідно до “Misuse of Drugs Act”, тобто прирівняну до Δ9-THC у правовому значенні. Натомість у країнах Східної Європи або на Балканах ситуація неоднорідна: частково спираються на технічну документацію до конопляної сировини, а не на окрему ідентифікацію Δ8-THC як речовини.
Один із головних викликів у дослідженні Δ8-THC полягає в труднощах із легальним доступом до чистої субстанції. У більшості юрисдикцій не існує стандартів фармацевтичної якості для Δ8-THC, сертифікованих аналітичних методів або нормативів допустимих домішок. Це ускладнює проведення клінічних досліджень, токсикокінетики, взаємодій з іншими препаратами. Крім того, фармакологічна різноманітність напівсинтетичних зразків, що циркулюють на ринку, не дозволяє сформувати однозначні висновки на основі лабораторного досвіду, оскільки кожна партія може мати власний спектр домішок та ізомерів.
Ще одним системним бар’єром для дослідження Δ8-THC є відсутність міжнародної гармонізації у визначенні поняття “психоактивність”. У законодавствах багатьох країн немає чітких критеріїв, які дозволяють визначити, що саме вважається психоактивною речовиною серед канабіноїдів. Відповідно, Δ8-THC може бути класифіковано як “непсихоактивний” у країнах, де рівень ефекту не співставляється з Δ9-THC, або ж навпаки – автоматично віднесений до заборонених субстанцій. Ця нормативна розбіжність створює перешкоди не лише для науки, а й для фармацевтичної промисловості, яка потребує прогнозованого правового поля для розробки і реєстрації нових препаратів.
Окремо слід відзначити інерційність законодавчої політики щодо новітніх канабіноїдів. Існуючі норми часто базуються на застарілих класифікаціях або на підходах до повністю синтетичних сполук, не враховуючи того, що Δ8-THC має напівприродне походження, структуру, близьку до Δ9-THC, і може синтезуватися зі сполук, формально легальних. Це створює ситуацію нормативного вакууму, де регулятор не має достатніх підстав для оперативного втручання, а наукова спільнота не отримує доступу до контрольованих, верифікованих зразків для дослідження.
Перспективи та напрями подальших досліджень
Біомедичні застосування
Науковий інтерес до біомедичного потенціалу Δ8-тетрагідроканабінолу (Δ8-THC) останніми роками помітно активізувався у зв’язку з його унікальними фармакодинамічними характеристиками, нижчим психоактивним профілем порівняно з Δ9-THC і потенційною терапевтичною корисністю в низці патологічних станів. Проте на відміну від добре дослідженого Δ9-ізомеру, Δ8-THC досі лишається маловивченим у клінічному аспекті. У той час як більшість сучасних відомостей походять із доклінічних досліджень або ранніх клінічних протоколів, нові моделі досліджень на тваринах і клітинних культурах свідчать про його значно ширший потенціал, ніж передбачалося раніше.
На відміну від Δ9-THC, який демонструє високу афінність до CB1-рецепторів кори головного мозку, Δ8-THC має дещо зменшену спорідненість до цих структур, але водночас демонструє активність щодо периферичних CB2-рецепторів, особливо в клітинах імунної системи та шлунково-кишкового тракту. Цей фармакологічний профіль робить його привабливим кандидатом для розробки препаратів, орієнтованих на імуномодулювальні, протизапальні, антинудотні та гастропротекторні ефекти без надмірної нейропсихічної стимуляції. Йдеться не лише про загальні симптоматичні застосування, а й про потенційну участь у лікуванні хронічних і системних захворювань – таких як запальні ентеропатії, нейродегенеративні синдроми, злоякісні пухлини та посттравматичні розлади.
Серед перших документованих застосувань Δ8-THC у клінічному середовищі були антиеметичні протоколи у дітей з онкологічними захворюваннями, опубліковані ще у 1990-х роках. Дані ранніх досліджень вказували на високу ефективність Δ8-THC при зниженні частоти нападів нудоти й блювання у відповідь на хіміотерапію – з мінімальними когнітивними побічними ефектами. Ці результати, хоч і не призвели до широкого клінічного впровадження у фармакотерапевтичні стандарти, стали основою для подальших досліджень щодо використання Δ8-THC при стійких формах нудоти, функціональних розладах шлунково-кишкового тракту та синдрому циклічної блювоти.
Інший перспективний напрям – застосування Δ8-THC при хронічному болю неонкологічного походження, зокрема у пацієнтів із невропатіями, фіброміалгією та хронічним тазовим болем. Попередні доклінічні моделі демонструють, що Δ8-THC здатен опосередковувати аналгетичні ефекти за участю не лише канабіноїдних рецепторів, але й опосередковано через десенсибілізацію TRPV1-каналів та модуляцію експресії простагландинів у запальній тканині. При цьому спостерігається менша ймовірність психічних порушень або дизфорії, порівняно з Δ9-THC, що відкриває перспективи для використання Δ8-THC у терапії болю у вразливих категорій пацієнтів – людей похилого віку, осіб з тривожно-депресивним фоном або пацієнтів з коморбідною патологією ЦНС.
Ще одним можливим напрямом клінічного застосування є використання Δ8-THC як апетитстимулювального засобу при кахексії, зумовленій СНІДом, онкологічними хворобами або нейродегенеративними процесами. В експериментах на тваринах зафіксовано зростання харчової активності, а також модифікацію експресії греліну і лептину – гормонів, що беруть участь у регуляції голоду. З огляду на менш виражену психоактивність Δ8-THC у порівнянні з Δ9-THC, він може стати більш придатним для довготривалого застосування у пацієнтів з анорексією різного ґенезу, зокрема геріатричною.
Потенціал Δ8-THC у сфері психічного здоров’я викликає особливий інтерес. Незважаючи на певні структурні подібності з Δ9-THC, Δ8-ізомер проявляє помітно нижчу схильність до індукції тривожних станів, панічних атак або параної, що властиво високим дозам Δ9-THC у чутливих осіб. Навпаки, окремі моделі на тваринах демонструють анксіолітичний ефект, пов’язаний з активацією CB1-рецепторів у гіпокампі та префронтальній корі. Це дозволяє розглядати Δ8-THC як можливу молекулярну платформу для створення нових анксіолітиків, особливо в комбінації з іншими непсихоактивними фітоканабіноїдами або терпеновими модулюючими агентами.
Деякі пілотні спостереження свідчать також про потенціал Δ8-THC при лікуванні посттравматичних стресових розладів (ПТСР), де важливим є поєднання зниження рівня емоційного напруження та пригнічення нав’язливих спогадів. Ці ефекти опосередковуються через канабіноїдну модуляцію амігдально-гормональних ланцюгів. Хоча доказова база тут ще слабка, нейрофармакологічні підстави виправдовують проведення контрольованих клінічних випробувань.
У дерматології вивчається можливість використання Δ8-THC як місцевого імуномодулятора при хронічних шкірних станах, включно з атопічним дерматитом, псоріазом та себорейним дерматитом. Дослідження in vitro показують, що Δ8-THC може впливати на продукцію інтерлейкіну-6 та TNF-α у кератиноцитах, а також модулювати експресію CB2-рецепторів у шкірному бар’єрі. Це вказує на перспективу створення місцевих протизапальних засобів нового покоління на основі Δ8-THC або його структурних аналогів.
У галузі онкології Δ8-THC вивчається переважно як засіб для підтримувальної терапії – з метою зниження побічних ефектів хіміотерапії, стимулювання апетиту, полегшення болю та покращення якості життя. Проте в окремих доклінічних експериментах також спостерігалися ознаки прямих антипроліферативних ефектів Δ8-THC на деякі лінії пухлинних клітин, включно з гліомами, меланомами та карциномами молочної залози. Передбачуваним механізмом дії є індукція апоптозу через внутрішньоклітинні сигнальні шляхи p38 MAPK та пригнічення ангіогенезу. Втім, ці дані потребують обережної інтерпретації, оскільки більшість таких ефектів спостерігалися за концентрацій, які малоймовірно досяжні in vivo без токсичних наслідків.
Δ8-THC може відіграти роль як модельна молекула для розробки майбутніх канабіноїдних препаратів з вузькою цільовою дією. Його фармакофорна структура дозволяє відносно просто здійснювати модифікацію бічного ланцюга, ароматичного кільця або подвійного зв’язку для створення сполук із селективною дією на CB2-рецептори або модуляцією інших рецепторних систем – таких як GPR55, TRPV1 або PPAR-γ. Це відкриває можливості не лише для створення нових препаратів, а й для фундаментального розуміння принципів селективності канабіноїдного зв’язування.
Хімічна модифікація і дизайн нових молекул
Дельта-8-тетрагідроканабінол (Δ8-THC), завдяки своїй стабільній циклічній структурі, хімічній подібності до Δ9-THC і водночас зниженої психоактивності, є зручною платформою для створення нових хіміко-фармацевтичних агентів. Його структура дає змогу проводити різноспрямовану модифікацію, орієнтовану як на підвищення рецепторної селективності, так і на покращення фармакокінетичних властивостей чи зменшення метаболічної нестабільності. У цьому контексті Δ8-THC розглядається не лише як природна молекула, а й як фармакофор – базовий скелет, який можна спрямовано змінювати для отримання напівавтоматизованих ліпофільних або амфіфільних похідних з новими біологічними властивостями.
Одним із найперспективніших напрямів хімічної модифікації Δ8-THC є варіація бічного алкільного ланцюга в положенні 3 бензольного ядра. У природному Δ8-THC ця ланка – пентиловий ланцюг (C5H11), який є ключовим фактором для гідрофобної взаємодії з канабіноїдними рецепторами, особливо з CB1. Збільшення довжини цього ланцюга до гептилу або заміна його на циклічні або ароматичні структури може істотно змінити афінність до рецепторів, а також змінити профіль зв’язування з CB2 чи навіть іншими молекулярними мішенями. Наприклад, у низці експериментів похідні Δ8-THC з циклогексильними або терпеновими залишками демонстрували високу афінність до CB2-рецепторів селективно, знижуючи вплив на центральну нервову систему. Це відкриває шлях до розробки протизапальних засобів, позбавлених психоактивного потенціалу.
Другим важливим вектором є модифікація подвійного зв’язку між положеннями 8 і 9 кільця С. У Δ9-THC цей зв’язок знаходиться в положенні 9-10, що значною мірою визначає його афінність до CB1. Перенесення або гідрогенізація подвійного зв’язку в Δ8-THC не тільки стабілізує структуру молекули, але й знижує схильність до окислювального метаболізму з утворенням реактивних інтермедіатів. Наприклад, дегідрогексиловані похідні Δ8-THC демонструють кращу стабільність у присутності цитохрому P450, що робить їх перспективними для орального застосування або пролонгованих форм. Крім того, насичення подвійного зв’язку веде до утворення нових тетрагідроканабінолінових аналогів, які зберігають здатність до зв’язування з канабіноїдними рецепторами, але мають змінені фармакологічні властивості.
Значний інтерес викликають також похідні Δ8-THC з модифікованими функціональними групами на фенольному гідроксилі в положенні 1. Ця частина молекули бере участь у водневому зв’язуванні з CB1-рецептором, а її ацилювання, етилювання чи утворення карбаматів дає змогу маніпулювати розчинністю, тривалістю дії та біодоступністю. У деяких випадках такі модифікації спрямовані на створення проліків, які активуються ферментами шлунково-кишкового тракту або печінки. Це дозволяє подолати обмеження першого проходження через печінку, які характерні для канабіноїдів, і стабілізувати активну речовину до моменту вивільнення в цільовій тканині.
Новий клас молекул формується також на основі гібридизації Δ8-THC з іншими біоактивними фрагментами, наприклад, з фрагментами нестероїдних протизапальних засобів, β-карболінів або навіть структур серотонінових антагоністів. Такі молекули створюються з розрахунку на поліфармакологію – здатність взаємодіяти з кількома мішенями одночасно, що особливо актуально при болю, запаленні, онкопатологіях або психічних розладах. У цьому контексті Δ8-THC служить не стільки як цільовий агент, скільки як транспортер або фармакологічний модуль у багатокомпонентних структурах. Хоча ці підходи перебувають здебільшого на етапі in silico-дизайну або доклінічних моделей, отримані дані підтверджують перспективність такого конструкційного підходу.
Ще одним напрямом є кон’югація Δ8-THC з пептидними або полісахаридними залишками для створення нових лігандів з прицільною дією. Це може бути реалізовано як стратегія таргетної доставки – наприклад, для уражень кишечника або мозку, де необхідна висока локальна концентрація канабіноїдного агента при мінімальному системному навантаженні. Кон’югація з манозою або галактозою дозволяє, зокрема, орієнтувати молекули на специфічні рецептори епітелію товстого кишечника чи мікроглії. Такий підхід має перспективу не лише у фармакології, а й у напрямі молекулярної діагностики, коли Δ8-THC може виконувати роль контрастного агента для візуалізації станів, пов’язаних із запаленням або гліальними ураженнями.
Крім того, існує перспектива модифікації Δ8-THC у напрямку створення неканабіноїдних аналогів – сполук, які не зв’язуються з класичними канабіноїдними рецепторами, але все ще володіють частиною характерних ефектів, таких як протизапальний або гастропротекторний. Це особливо актуально в умовах законодавчих обмежень або побоювань щодо канабіноїдної безпеки. Заміна кільця С або часткова реорганізація структури в напрямку біциклічних або лінійних систем дозволяє отримати сполуки з новими механізмами дії – зокрема, через PPAR-α/γ, GPR55 або рецептори ендованілоїдної системи.
Застосування методів комп’ютерного моделювання, зокрема докінгу, динамічного моделювання та молекулярного філогенезу, дозволяє передбачати, які структурні модифікації Δ8-THC можуть бути найбільш ефективними для зв’язування з бажаними рецепторами. У цьому контексті синтетична хімія переплітається з біоінформатикою та фармакогеномікою, відкриваючи можливості для персоналізованої розробки канабіноїдних ліків.
Насамкінець варто підкреслити, що кожна хімічна модифікація Δ8-THC вимагає ретельного токсикологічного аналізу. Навіть незначні зміни в структурі можуть радикально вплинути на біобезпеку, включно з гепатотоксичністю, імуносупресією чи психоактивними ефектами. Саме тому створення нових похідних Δ8-THC потребує міждисциплінарного підходу – з участю хіміків, фармакологів, біофізиків і токсикологів – для забезпечення не лише ефективності, а й передбачуваного профілю безпеки.
Виклики стандартизації та контролю якості
Зі зростанням інтересу до Delta-8-THC як фармакологічно активної субстанції постає комплексна проблема стандартизації, яка охоплює всі етапи – від первинного отримання до кінцевого продукту. В умовах, коли речовина може походити з декількох синтетичних або напівсинтетичних джерел, мати поліморфну хімічну чистоту й існувати в різних матрицях (олії, капсули, інгалятори, трансдермальні форми), забезпечення стабільності, ідентичності та безпечності в кожному препараті потребує не лише розробки суворих стандартів, а й перегляду методологічної бази сучасного фармакопейного контролю.
Одним із головних викликів є неоднозначність у визначенні “еталонного” складу речовини. У контексті Δ8-THC стандарт не може обмежуватися лише масовою часткою основного ізомеру. В умовах синтетичного походження майже завжди присутні побічні продукти – регіоізомери, залишкові кислоти, побічні канабіноїди (особливо Δ10, Δ6a,10a або дегідрогексиловані похідні), які мають власну біоактивність або можуть взаємодіяти з ферментними системами організму. Це означає, що повна хімічна паспортизація має охоплювати мультикомпонентний аналіз – включно з профілюванням ізомерного складу, кількісною оцінкою залишкових реагентів, а також характеризацією вторинних метаболітів, які можуть утворюватися in vivo або при зберіганні.
Складність у стандартизації Δ8-THC також випливає з відсутності глобально прийнятих аналітичних методів для його розмежування з Δ9-THC, особливо в масових лабораторіях і токсикологічних центрах. Ізомери мають ідентичні молекулярні маси, схожі хроматографічні властивості й майже не розрізняються у звичайних спектрофотометричних тестах. У результаті існує ризик як фальсифікацій (наприклад, продажу Δ9-THC під виглядом Δ8), так і помилок у правових спорах або клінічних контекстах. Створення сертифікованих стандартів з чіткою межовою роздільністю, доповнених спектрометрією ядерного магнітного резонансу (^1H- і ^13C-NMR), високоефективною рідинною хроматографією з мас-спектрометричним детектуванням (HPLC-MS/MS), та хіральною газовою хроматографією – є не просто бажаним, а критично необхідним.
Окремим блоком стоїть питання стабільності Δ8-THC у різних формуляціях. Через схильність до окислення, ізомеризації назад у Δ9- або Δ6a,10a-THC при незначному нагріванні або дії світла, відбуваються незворотні зміни складу. Це ставить під сумнів реальну дозовану ефективність у кінцевому продукті, особливо при тривалому зберіганні. Для цього потрібен не просто контроль вхідної субстанції, а валідація стабільності кожної фармацевтичної форми – з урахуванням упаковки, температури, вологості, рівня кисню, типу розчинника або носія (наприклад, середовища на основі МСТ-олії, етанолу чи ПЕГ-400). Стандартизація має включати специфічні профілі деградації в умовах прискореного зберігання (ICH Q1A), з визначенням кінетики розпаду та токсикології продуктів деградації.
Ще складнішою проблемою є оцінка залишкових домішок – кислот (наприклад, p-толуолсульфонової), розчинників (гексан, ацетон, діетиловий ефір), каталізаторів (бор трифторид, фосфорна кислота) або стабілізаторів. У зв’язку з тим, що синтез Δ8-THC зазвичай не проводиться під фармакопейним контролем, а відбувається на напівпромислових установках, домішки можуть бути токсичними при системному накопиченні. Стандартизація має охоплювати не лише допустимі межі, але й обов’язкове декларування методів очистки, аналізу залишкових реагентів і результатів їх повного вилучення – відповідно до вимог ICH Q3A та Q3C.
Проблеми контролю якості ускладнюються ще й комерційною гетерогенністю продуктів. Сьогодні Δ8-THC реалізується у формі масел, вейпів, капсул, їстівних продуктів, косметики та навіть ветеринарних препаратів. У кожному випадку – різний шлях надходження в організм, різна швидкість абсорбції, трансформації та елімінації. Це унеможливлює створення універсальної схеми стандартів для всіх форм. Навіть при ідентичному дозуванні біодоступність може відрізнятися в рази залежно від форми. Отже, якість повинна контролюватися не лише на рівні субстанції, а й на рівні кінцевого продукту в конкретній формі доставки.
Ще одним викликом є розрив між нормативною і науковою частиною контролю якості. У більшості юрисдикцій Δ8-THC не має чіткої класифікації в фармакопеях, а виробники користуються стандартами, запозиченими з Δ9-THC або CBD. Це хибна практика, оскільки властивості цих речовин – включно з розчинністю, стабільністю, хімічною реакцією на реагенти – значно відрізняються. Отже, необхідно створювати незалежні фармакопейні монографії, що враховують специфіку Δ8-THC як субстанції та активної речовини. Це стосується і методів титрування, спектроскопії, хроматографії, а також вимог до вологи, pH середовища, та механізмів контролю мікробіологічної чистоти, особливо в препаратах, призначених для інгаляційного або парентерального введення.
Також слід згадати про виклик відтворюваності досліджень. Через відсутність єдиних стандартів для Δ8-THC різні дослідницькі групи працюють із продуктами різної чистоти, джерел, методів отримання. Це створює системні труднощі у порівнянні результатів навіть в умовах схожих експериментів. Терапевтична ефективність, токсичність, фармакокінетика – все це залежить від того, що саме називається “Δ8-THC” у кожному конкретному випадку. Розв’язання цієї проблеми можливе лише через створення міжнародного еталона (reference standard), схваленого ВООЗ, Європейською фармакопеєю або USP, із докладною специфікацією, методами перевірки, стабільності та міжлабораторної калібрувальної верифікації.
Висновки
Delta-8-тетрагідроканабінол (Δ8-THC) представляє собою складний об’єкт дослідження, який поєднує в собі хімічну унікальність, фармакологічну перспективність та серйозні технологічні й регуляторні виклики. Науковий аналіз цієї молекули з позиції її хімічної будови, природного походження, методів отримання, фармакології, безпеки та правового статусу створює комплексне розуміння потенціалу і обмежень, що лежать в основі її подальшого розвитку як фармацевтичного або біоактивного агента.
Хімічна природа Δ8-THC зумовлена особливою конституційною ізомерією, що визначає специфіку її взаємодії з канабіноїдними рецепторами, а також стабільність у різних фізико-хімічних умовах. Хоча молекулярна формула збігається з Δ9-THC, розташування подвійного зв’язку у молекулярному ланцюгу кардинально впливає на конформацію, здатність до ізомеризації, хімічну активність та біологічну поведінку речовини. Ці фундаментальні відмінності мають не лише академічне значення, а й практичний вплив на фармакокінетичні і фармакодинамічні профілі, які досі вивчаються в умовах лабораторних і клінічних експериментів.
Природне походження Δ8-THC – надзвичайно низький вміст у канабіноїдних рослинах роду Cannabis, що робить виділення цієї субстанції безпосередньо з рослинної сировини практично неефективним для масового використання. Біогенетичні шляхи формування цього ізомеру поки недостатньо досліджені, особливо в контексті факторів зовнішнього середовища, які можуть корелювати з кількісним та якісним складом канабіноїдів. Фактично, його присутність розглядається більше як побічний продукт ендогенних ферментативних процесів або результат деградації інших канабіноїдів під дією фізичних і хімічних факторів. Це створює передумови для пошуку альтернативних способів одержання, адже технологічні вимоги до синтетичних або напівсинтетичних методів залишаються ключовими.
Технологічні підходи до синтезу Δ8-THC демонструють значний науково-технічний прогрес, особливо у сфері ізомеризації канабідіолу (CBD) в кислотному середовищі. Застосування каталізаторів, регулювання температурних та часових параметрів реакції, використання різних розчинників і очистних методів формують основу для виробництва з високою чистотою та виходом продукту. Проте наявність домішок, складність контролю ізомерів і залишкових реагентів зберігає актуальність питання якості. Водночас перспективні біотехнологічні методи – зокрема, застосування ферментативного каталізу, генно-модифікованих мікроорганізмів і клітинних культур – відкривають нові горизонти для більш екологічно безпечного та економічно ефективного виробництва. Ці підходи, однак, потребують подальшого фундаментального вивчення механізмів біосинтезу і оптимізації експресії ключових ферментів, що визначають синтетичний шлях до Δ8-THC.
Фармакологічна характеристика Δ8-THC демонструє низку важливих особливостей. Взаємодія із канабіноїдними рецепторами CB1 і CB2 підтверджує її біологічну активність, проте профілі зв’язування і афінності дещо відрізняються від Δ9-THC, що позначається на клінічних ефектах. Психоактивність, хоч і менш виражена порівняно з Δ9-THC, не виключає її потенціалу у клінічній практиці. Найбільш перспективними є терапевтичні властивості, зокрема антиеметична дія, яка є однією з найкраще задокументованих, а також анальгетичний ефект і вплив на психоемоційний стан, включно зі зниженням тривожності та регуляцією апетиту. Усі ці аспекти вимагають подальших досліджень з акцентом на механізми дії, ефективні дози та потенційні побічні реакції.
Окремої уваги заслуговує аналіз аспектів безпеки, токсикології та регуляторних обмежень, що наразі є надзвичайно складним через обмеженість доклінічних і клінічних даних. Визначення безпечного профілю потребує розширення масштабних досліджень, що включають довгострокове спостереження за впливом на різні системи організму, а також вивчення потенційної токсичності продуктів розпаду і домішок, що можуть накопичуватися у процесі синтезу. Юридична неоднозначність статусу Δ8-THC у різних країнах та регіонах створює додаткові бар’єри для стандартних процедур оцінки та випробувань, а відсутність єдиних фармакопейних монографій ускладнює контроль якості, що безпосередньо позначається на безпеці пацієнтів і споживачів.
Виклики, пов’язані зі стандартизацією і контролем якості, є одним із найбільших “вузьких місць” у розвитку Δ8-THC як фармацевтичної субстанції. Різноманітність синтетичних методів, неоднорідність кінцевих продуктів, наявність ізомерів і супутніх речовин, варіабельність біодоступності в різних формах застосування – усе це вимагає формування комплексної системи контролю, що поєднує аналітичні, технологічні, токсикологічні та регуляторні критерії. Лише при виконанні цих умов можна гарантувати відтворюваність результатів досліджень, безпеку пацієнтів і споживачів, а також легітимність використання Δ8-THC у медичній практиці.
Щодо перспективних напрямків, то біомедичні застосування Δ8-THC відкривають широкі можливості для розробки нових терапевтичних агентів із профілем ефективності та безпеки, відмінним від класичних канабіноїдів. Хімічна модифікація молекули, включаючи створення похідних і аналогів, дозволяє потенційно покращити фармакокінетику, збільшити селективність до рецепторів і мінімізувати побічні ефекти. Водночас стандартизація і контроль якості залишаються критично важливими аспектами для трансляції фундаментальних знань у клінічні рішення.
Загалом, Delta-8-THC є складним, багатогранним об’єктом, що поєднує в собі унікальні хімічні, біологічні і технологічні властивості. Вивчення цієї молекули вимагає міждисциплінарного підходу, який інтегрує хімію, біологію, фармакологію, токсикологію і регуляторну науку. Тільки у взаємодії цих сфер можливе створення надійної платформи для розвитку Δ8-THC як безпечного та ефективного біоактивного агента з потенційним медичним і комерційним застосуванням у майбутньому.
Джерела:
- National Center for Biotechnology Information (NCBI), PubMed Central (PMC) – база даних наукових статей у галузі біомедицини та фармакології:
https://www.ncbi.nlm.nih.gov/pmc/ - ScienceDirect – платформа Elsevier з великою кількістю публікацій у галузі хімії, фармакології та біотехнології (частина контенту відкритий):
https://www.sciencedirect.com/ - Journal of Cannabis Research – відкритий журнал з актуальними дослідженнями канабіноїдів:
https://jcannabisresearch.biomedcentral.com/ - U.S. National Library of Medicine (NLM) – офіційний ресурс зі здоров’я США, що містить наукові матеріали про канабіноїди:
https://www.nlm.nih.gov/ - Frontiers in Pharmacology – відкритий доступ, розділ канабіноїдної фармакології:
https://www.frontiersin.org/journals/pharmacology - ResearchGate – наукова мережа з великою кількістю відкритих досліджень, можна шукати статті по Delta-8-THC:
https://www.researchgate.net/ - Journal of Natural Products – офіційний журнал Американського хімічного товариства з досліджень природних сполук:
https://pubs.acs.org/journal/jnprdf - European Monitoring Centre for Drugs and Drug Addiction (EMCDDA) – звіти і наукові документи з теми канабіноїдів та їх впливу:
https://www.emcdda.europa.eu/ - Harvard Health Publishing – публікації і огляди про медичне застосування канабіноїдів від Гарвардської медичної школи:
https://www.health.harvard.edu/ - U.S. Food and Drug Administration (FDA) – офіційні документи та заяви щодо регуляції канабіноїдів:
https://www.fda.gov/ - American Chemical Society (ACS) Publications – велика колекція рецензованих статей з хімії і фармакології:
https://pubs.acs.org/ - Cannabis and Cannabinoid Research (Mary Ann Liebert, Inc.) – спеціалізований журнал із вільним доступом до окремих статей:
https://www.liebertpub.com/can - The Journal of Clinical Pharmacology – відкриті та рецензовані дослідження з клінічної фармакології канабіноїдів:
https://accp1.onlinelibrary.wiley.com/journal/15524604 - World Health Organization (WHO) – офіційні звіти про безпеку і фармакологію канабіноїдів:
https://www.who.int/ - National Institute on Drug Abuse (NIDA) – наукові огляди, дані досліджень та публікації по канабіноїдам:
https://www.drugabuse.gov/