У межах досліджень природних сполук, що модулюють ендоканабіноїдну систему, канабіноїди залишаються одними з найцікавіших об’єктів з погляду як фундаментальної хімії, так і фармакології. Понад сотню фітоканабіноїдів ідентифіковано у представниках роду Cannabis, більшість із яких існує у кислотній формі – як вторинні метаболіти, що синтезуються у залозистих трихомах рослин. Серед них найбільш дослідженими є Δ⁹-тетрагідроканабінолова кислота (Δ⁹-THCA), канабідіолова кислота (CBDA) та канабігеролова кислота (CBGA). Їх активні форми – Δ⁹-THC, CBD і CBG відповідно – формуються шляхом декарбоксилювання під впливом тепла чи часу. Проте із зростанням інтересу до структурної різноманітності канабіноїдів у науковій спільноті посилюється увага до менш вивчених ізомерів і похідних, зокрема Δ⁸-тетрагідроканабінолової кислоти (Δ⁸-THCA).
Δ⁸-THCA не слід плутати з Δ⁸-THC – психоактивним ізомером Δ⁹-THC, що останнім часом став об’єктом як медіацікавості, так і нормативного регулювання. Хоча Δ⁸-THC можна знайти у слідах у рослинах Cannabis sativa L., він зазвичай є продуктом штучної ізомеризації з Δ⁹-THC. Відповідно, Δ⁸-THCA, що є його кислотним попередником, наразі вважається переважно лабораторно отриманою сполукою, хоча її теоретичне природне походження ще не повністю виключене. Хімічно, Δ⁸-THCA – це структурний ізомер Δ⁹-THCA, у якому подвійний зв’язок у циклогексенільному кільці переміщений з положення Δ⁹ у Δ⁸. Така зміна не є тривіальною з огляду на потенційний вплив на біологічну активність, метаболізм і фармакокінетику сполуки. Проте дослідження Δ⁸-THCA залишається на початковому етапі, а систематичний огляд його властивостей, методів отримання і наукової доцільності наразі відсутній у фаховій літературі.
Ключове питання, яке постає при вивченні Δ⁸-THCA, – це його місце в хемотипі рослин канабісу. У відомих біосинтетичних шляхах канабіноїдів CBGA слугує попередником як для THCA, так і для CBDA та CBCA, залежно від ферментативної активності відповідних синтаз. Достовірних даних про існування специфічної Δ⁸-THCA-синтази не зафіксовано. Це ставить під сумнів природний шлях утворення Δ⁸-THCA в коноплях у сільськогосподарських або дикорослих умовах. Натомість ізомеризація Δ⁹-THCA до Δ⁸-THCA у лабораторних умовах можлива через кислотно-каталізовані механізми, подібні до тих, що застосовуються для перетворення Δ⁹-THC у Δ⁸-THC. Стабільність Δ⁸-THCA в різних умовах, зокрема до і після декарбоксилювання, становить окремий інтерес – зважаючи на ймовірні фармакологічні відмінності між ізомерами.
Попри структурну схожість із Δ⁹-THCA, Δ⁸-THCA може демонструвати інший профіль взаємодії з канабіноїдними рецепторами (CB1/CB2), особливо якщо зважати на попередні спостереження щодо менш вираженої психоактивності Δ⁸-THC у порівнянні з Δ⁹-THC. Водночас, як і всі кислотні форми канабіноїдів, Δ⁸-THCA, ймовірно, має відмінний механізм дії, не пов’язаний із прямою активацією CB1. Ранні дослідження на тваринах свідчать про потенційну протизапальну, антиеметичну та нейропротекторну активність кислотних канабіноїдів, зокрема THCA. Якщо аналогічні ефекти будуть притаманні і Δ⁸-THCA, то ця сполука може становити інтерес як основа для розробки нових лікарських засобів, не пов’язаних із психоактивністю.
Також варто враховувати науково-технічні обмеження, що стосуються вивчення Δ⁸-THCA. По-перше, аналітичне виділення цієї сполуки з екстрактів є складним завданням через її структурну близькість до Δ⁹-THCA та тенденцію до декарбоксилювання під впливом навіть незначного тепла. По-друге, відсутність сертифікованих аналітичних стандартів значно ускладнює якісний та кількісний аналіз цієї сполуки за допомогою хроматографії чи мас-спектрометрії. У зв’язку з цим більшість доступних даних щодо Δ⁸-THCA базується на непрямих методах або на синтетичних моделях, що створює додатковий виклик для її систематичного дослідження.
Ще один аспект, який заслуговує окремої уваги, – це нормативно-правове становище Δ⁸-THCA. У більшості країн законодавство щодо канабіноїдів орієнтується на психоактивні форми (THC) та їх кількісний вміст у готових продуктах. Кислотні форми часто не входять до нормативної категоризації, або ж класифікуються залежно від їх здатності перетворюватися на активні сполуки при нагріванні. Це створює так звану “сіру зону” в регуляції, яка з одного боку дозволяє маніпулювати легальністю сполуки, а з іншого – ускладнює її інтеграцію у фармацевтичні дослідження згідно з належною клінічною практикою.
Канабіноїдна система конопель: біохімічний контекст
Канабіноїдна система конопель (Cannabis sativa L.) є складною метаболічною та регуляторною мережею, яка сформувалась у процесі еволюції під впливом специфічних біотичних та абіотичних чинників. На молекулярному рівні вона представлена множиною ферментативних шляхів, пов’язаних із синтезом, перетворенням, транспортуванням і накопиченням канабіноїдів – речовин, що відіграють фундаментальну роль у фізіології самої рослини, а також мають потужну фармакологічну активність для ссавців, зокрема людини. Проте варто наголосити, що канабіноїдна система Cannabis sativa – це не ізольований шлях біосинтезу вторинних метаболітів, а інтегрована частина цілісного метаболому, що динамічно взаємодіє з центральним метаболізмом, гормональною регуляцією та стресовими відповідями.
Біосинтетичні процеси, відповідальні за утворення канабіноїдів, включають тісну взаємодію двох основних метаболічних джерел: шляху ацетат-малонатного походження, що забезпечує формування оліветолової кислоти, та ізопренового шляху, що веде до геранілпірофосфату (GPP). Злиття цих двох молекул під дією специфічного ферменту – GPP-оліветолаттрансферази – призводить до утворення канабігеролової кислоти (CBGA), яка є головним біохімічним вузлом, з якого далі походять усі основні канабіноїдні структури. Оскільки CBGA є спільним попередником для THCA, CBDA, CBCA та інших похідних, регуляція її синтезу та подальше спрямування в один із гілок катаболізму визначає хемотип рослини.
Цей біохімічний ансамбль локалізований у високоспеціалізованих структурах – залозистих трихомах, головним чином капітатного типу, які здатні забезпечувати фізичне відокремлення синтезованих речовин від внутрішніх тканин. Ця ізоляція має еволюційну цінність, оскільки дозволяє рослині акумулювати потенційно токсичні для клітин сполуки без шкоди для себе. Крім того, трихоми забезпечують ефективну концентрацію метаболітів, їх захист від деградації, а також модульовану секрецію у навколишнє середовище. Біогенез трихом – процес, що координується генетично, але суттєво модулюється зовнішніми факторами, такими як освітлення, температура, фотоперіод та навіть мікробіом ризосфери.
З огляду на генетичну регуляцію, варто зазначити, що ферменти, відповідальні за формування канабіноїдів, кодуються окремими генами, які демонструють значну мінливість серед різних популяцій Cannabis sativa. Наприклад, THCA-синтаза та CBDA-синтаза мають високий ступінь гомології, однак відрізняються у ключових амінокислотних залишках, що визначають специфічність до субстрату. Ці гени можуть бути локалізовані в кластерних зонах геному, які піддаються епігенетичному контролю, зокрема метилюванню ДНК і модифікаціям гістонів. Транскрипційний контроль також здійснюється через специфічні транскрипційні фактори, серед яких ідентифіковані гомологи сімей bHLH, MYB та WRKY – типовими для вторинного метаболізму рослин.
Істотну роль у становленні канабіноїдної системи відіграла еволюційна селекція. Первісна функція канабіноїдів, найімовірніше, полягала в антимікробній та протигрибковій активності, що дозволяла рослині протистояти загрозам патогенів у природному середовищі. Згодом до цієї функції приєдналися й інші: захист від УФ-випромінювання (особливо УФ-B спектра), участь у сигнальних каскадах, пов’язаних зі стресовими відповідями, і навіть у регуляції локальної терморегуляції тканин. Важливо зазначити, що синтез фітоканабіноїдів індукується в умовах механічного пошкодження або стресу, подібно до того, як у тварин активуються захисні імунні механізми. Такі паралелі дозволяють розглядати канабіноїдну систему як складову ендогенної захисної архітектури рослини.
Фенотипічна мінливість у контексті канабіноїдного профілю значною мірою зумовлена як генетичними варіаціями, так і пластидами, які залучені до початкових етапів біосинтезу ізопреноїдів. Дослідження виявили, що хлоропластна активність у трихомах суттєво корелює з рівнями GPP і, відповідно, CBGA. Таким чином, не лише нуклеарний, а й пластидний геном бере участь у регуляції канабіноїдної системи.
Окремо слід згадати й роль зовнішніх чинників у регуляції канабіноїдного біосинтезу. Освітлення (особливо спектри червоного та синього світла), температура, доступність макро- і мікроелементів, вологість та навіть атмосферний тиск можуть модулювати активність відповідних генів і ферментів. На клітинному рівні ці впливи трансформуються в сигнальні каскади з участю кальцієвих хвиль, ROS-сигналізації та фітогормональних реакцій (зокрема, з участю жасмонової кислоти, саліцилатів і абсцизової кислоти). Внаслідок цього змінюється експресія ключових ферментів і морфогенез трихом.
У біотехнологічному аспекті канабіноїдна система вже сьогодні є мішенню для редагування геному (наприклад, за допомогою CRISPR/Cas9), метаболічного інжинірингу та культивування клітин у біореакторах. Ці підходи відкривають можливості для масштабного отримання окремих канабіноїдів без необхідності вирощування повноцінної рослини. Проте для реалізації цих стратегій необхідне глибоке розуміння саме біохімічної й регуляторної архітектури канабіноїдної системи.
Фітоканабіноїди: огляд основних сполук
Фітоканабіноїди – це група біологічно активних терпенфенольних сполук, що синтезуються виключно в роді Cannabis і є унікальними в своєму біохімічному профілі. Їхня структура базується на взаємодії двох ключових прекурсорів: ароматичної оліветолової кислоти (OA) та ізопренового компонента – геранілпірофосфату (GPP). Ці субстрати об’єднуються ферментом GOT (geranyl olivetolate transferase), утворюючи канабігеролову кислоту (CBGA) – центральний метаболіт, що виступає біосинтетичним вузлом у виробництві більшості основних канабіноїдів.
До основних кислотних форм фітоканабіноїдів належать: тетрагідроканабінолова кислота (THCA), канабідіолова кислота (CBDA), канабіхроменова кислота (CBCA), а також їх менш вивчені аналоги – тетрагідроканабіваринова кислота (THCVA), канабідіваринова кислота (CBDVA) тощо. Ці сполуки зазнають декарбоксилювання – термічно або спонтанно – і перетворюються на відповідні нейтральні форми: Δ⁹-THC, CBD, CBC тощо. Декарбоксильовані фітоканабіноїди володіють високою біоактивністю, що зумовлює їх фармакологічний інтерес.
Фітоканабіноїди зазвичай поділяють за трьома критеріями: структурна група (CBG-похідні, CBD-похідні, THC-похідні), ступінь окиснення (кислоти vs нейтральні сполуки), і ступінь циклізації або модифікації бічного ланцюга. Відомо понад 150 канабіноїдів, серед яких більшість – це мікрокількості продуктів побічного або вторинного біосинтезу, ізомеризації, окиснення або хімічної деградації основних форм.
Характерною особливістю фітоканабіноїдів є висока регіо- та стереоспецифічність, яка визначається активністю конкретних синтаз, умовами середовища і генотипом рослини. Це особливо важливо для розрізнення ізомерних форм – таких як Δ⁹-THC і Δ⁸-THC – які, хоч і мають подібну формулу, але різко відрізняються у фармакодинаміці, стабільності і термодинамічному профілі.
Δ⁹-THC vs Δ⁸-THC: ізомерні форми
Δ⁹-тетрагідроканабінол (Δ⁹-THC) і Δ⁸-тетрагідроканабінол (Δ⁸-THC) – це структурні ізомери, які відрізняються розташуванням подвійного зв’язку в циклогексановому кільці. У Δ⁹-THC подвійний зв’язок розташований між атомами C9 і C10, тоді як у Δ⁸-THC – між C8 і C9. Це на перший погляд незначне переміщення має серйозні наслідки для просторової конфігурації молекули, її взаємодії з рецепторами канабіноїдної системи та загальної біохімічної стабільності.
Δ⁹-THC є основною психоактивною речовиною у більшості хемотипів Cannabis sativa, і його утворення суворо контролюється THCA-синтазою, яка з високою стереохімічною точністю каталізує циклізацію CBGA у Δ⁹-THCA. Декарбоксилювання цієї сполуки під час нагрівання або зберігання утворює активний Δ⁹-THC.
Δ⁸-THC, навпаки, або утворюється внаслідок спонтанної ізомеризації Δ⁹-THC під впливом кислоти, температури, світла чи металів, або ж, як припускається, може бути незначним побічним продуктом ферментативної активності THCA-синтази. Біосинтетичних доказів існування окремої “Δ⁸-THCA-синтази” не виявлено. Також Δ⁸-THC демонструє вищу хімічну стабільність, нижчу афінність до CB1-рецепторів, і м’якший психоактивний ефект у порівнянні з Δ⁹-THC. Це робить його перспективним об’єктом для фармакології, зокрема в лікуванні тривожних розладів і хронічного болю без яскраво вираженого психоактивного ефекту.
На молекулярному рівні, ізомеризація Δ⁹-THC у Δ⁸-THC може відбуватись навіть in planta, але зазвичай це хімічний процес, пов’язаний з екстракцією, кислотним каталізом або тривалим зберіганням канабіноїдних екстрактів. Δ⁸-THC має вищу термодинамічну стабільність за Δ⁹-THC, що підтверджено як спектроскопічними, так і хроматографічними методами. В електронній конфігурації Δ⁸-ізомер менш схильний до окиснення та деградації, що робить його зручнішим для стандартизації та формуляцій у фармацевтичних продуктах.
З огляду на те, що Δ⁸-THC може бути присутній як слідовий компонент у природному екстракті конопель, його легальний статус і класифікація варіюють залежно від юрисдикції, оскільки джерело походження (природне чи синтетичне) визначає його правовий режим. Біохімічно ж ці дві сполуки – Δ⁹ і Δ⁸ – є прикладом ізомерії, яка проявляється не лише у структурі, але й у функціональній активності, метаболічному профілі, стабільності і біодоступності, що має принципове значення для практичного застосування фітоканабіноїдів.
Ендогенні шляхи біосинтезу канабіноїдів
Біосинтез канабіноїдів у Cannabis sativa – це результат складної інтеграції кількох метаболічних мереж, що простягаються через цитозоль, пластидам і ендомембранні структури клітини. На відміну від класичного вторинного метаболізму, де продукти синтезуються в одному метаболічному каналі, у випадку канабіноїдів спостерігається модульна організація біогенезу, зокрема багатоступенева конвергенція терпенової та полікетидної гілок метаболізму. Цей процес є енергозалежним, з тонким контролем на кожному етапі, зокрема регуляцією синтезу коферментів, інтермедіатів і просторово-часовою організацією ферментативних каскадів.
На ранньому етапі біосинтезу задіяні дві незалежні метаболічні траси: MEP (2-C-methyl-D-erythritol-4-phosphate) шлях, що активний у пластидах і відповідає за формування ізопренових попередників, та полікетидна гілка, яка відбувається в цитозолі з залученням ацетил-КоА і мальоніл-КоА. Механістично, цей поділ метаболізму забезпечує селективну ізоляцію фаз синтезу, запобігаючи неспецифічним реакціям та енергетичним втратам. MEP шлях є ключовим джерелом геранілпірофосфату (GPP), що, у поєднанні з оліветоловою кислотою, призводить до утворення канабігеролової кислоти (CBGA) – центрального метаболіта, від якого відгалужується вся канабіноїдна біосинтеза.
Однак на рівні цієї первинної конденсації відбуваються кілька альтернативних варіантів: нещодавні метаболомні дослідження виявили існування малих пулів гідроксилованих похідних оліветолової кислоти та ізопренідів, які, можливо, служать регуляторними метаболітами або запасними формами при стресових умовах. Умовна гнучкість шляхів, що ведуть до CBGA, вказує на потенційну наявність внутрішньоклітинного буферування – механізму, що дозволяє рослині регулювати продукцію канабіноїдів без кардинального порушення метаболічного гомеостазу.
Наразі існує кілька альтернатив до класичного канабіноїдного шляху, які залишаються недостатньо дослідженими через складність доступу до ізольованих метаболітів. Наприклад, ізомери GPP, зокрема нерилпірофосфат (NPP), теоретично можуть утворювати структурні аналоги CBGA. Ці альтернативні шляхи, якщо активні в специфічних хемотипах або при індукції біотичних стресів, потенційно можуть бути джерелом нових класів канабіноїдів.
Ще один аспект, що заслуговує уваги, – це субклітинна динаміка ферментів. Біосинтетичні ферменти, залучені до конденсації оліветолової кислоти і GPP, можуть утворювати перехідні білкові агрегати, відомі як метаболони. Подібні структури описані в інших вториннометаболічних системах, зокрема у флавоноїдному біосинтезі. У контексті Cannabis, метаболони можуть забезпечувати ефективний транспорт субстратів між ферментами, мінімізуючи дифузійні втрати і побічні реакції. У цьому сенсі канабіноїдний шлях більше нагадує організовану фабрику, ніж дифузну хімічну мережу.
Унікальною рисою є також наявність тимчасової асинхронії між піками активності окремих ферментів. Наприклад, активність оліветолсинтази може передувати максимальній експресії GOT або синтаз на кілька годин. Це вказує на регуляторну архітектуру з часовими лагами, що дозволяє накопичувати проміжні метаболіти, які згодом використовуються в подальшому синтезі. Таке узгодження в часі та просторі дозволяє досягти високої ефективності при збереженні метаболічної гнучкості.
Сучасні дослідження із застосуванням ізотопного мічення (наприклад, 13C-глюкоза) показують, що потік вуглецю в бік канабіноїдного шляху не є лінійним і відчутно залежить від середовищних умов – рівня освітлення, вуглецевого балансу та активності фотосинтезу. У період високої інтенсивності світла спостерігається підвищення метаболічного потоку через MEP-шлях і посилення синтезу GPP, тоді як у темряві активація шляху зменшується на тлі переключення метаболізму на обслуговування клітинного дихання. Це підкреслює залежність біосинтезу канабіноїдів від фотоперіодичних коливань та функціонування фотосинтетичного апарату.
Інша малодосліджена, але перспективна область – це роль транспортерів у канабіноїдному біосинтезі. Є свідчення, що певні ABC-транспортери можуть бути залучені в експорт або міжорганельний транспорт канабіноїдних проміжних сполук, що дає змогу ізолювати біосинтез від чутливих до окиснення ділянок цитозолю. Це явище може пояснити стабільність проміжних метаболітів, які за звичайних умов є хімічно нестійкими.
На макрорівні варто згадати про кореляцію між хемотипами конопель і активністю ендогенних шляхів. Генетичні варіації, зокрема у кодуючих та регуляторних послідовностях ферментів MEP-шляху і PKS-гілки, можуть визначати пріоритетність того чи іншого метаболічного потоку, що в результаті обумовлює хемотип – THCA-, CBDA- або CBCA-домінантний. Також існує гіпотеза, що частина флуктуацій у вмісті канабіноїдів може бути обумовлена епігенетичним програмуванням у відповідь на середовищні сигнали – явище, відоме в інших адаптивних метаболічних системах.
Роль синтаз у біосинтезі канабіноїдів
Ферменти синтази є центральними елементами у фінальній фазі біосинтезу канабіноїдів, де відбувається специфічна конверсія канабігеролової кислоти (CBGA) у структурно різні канабіноїдні кислоти, зокрема Δ⁹-тетрагідроканабінолову (THCA), канабідіолову (CBDA), канабіхроменову (CBCA) та, ймовірно, Δ⁸-тетрагідроканабінолову кислоту (Δ⁸-THCA). Ці ферменти – оксидоредуктази класу флавопротеїнів – демонструють високу субстратну специфічність, хоча й походять із одного еволюційного предка. Їхня дія є не просто каталізом хімічного перетворення, а результатом точної молекулярної архітектури, що забезпечує надзвичайну селективність та стереохімію продуктів.
THCA-синтаза, CBDA-синтаза та CBCA-синтаза не є ізоферментами в класичному сенсі, хоча мають високий ступінь гомології (понад 90% ідентичності амінокислотної послідовності). Однак критичні відмінності в активному центрі та ділянках, що відповідають за орієнтацію субстрату, забезпечують продукцію канабіноїдів із різною циклічною архітектурою. Усі ці синтази каталізують окислювально-циклічну реакцію CBGA, що супроводжується внутрішньомолекулярною електрофільною атакою, яка ініціює формування трьох-, шести- або семичленних кілець залежно від ферменту.
Функціональна динаміка цих ферментів демонструє надзвичайну чутливість до оточення: температура, pH, окисно-відновний потенціал, іонна сила та наявність коферментів (наприклад, FAD) впливають не лише на швидкість реакції, але й на селективність циклізації. Цікаво, що навіть незначні мутації в активному центрі можуть переорієнтувати каталітичну реакцію з CBDA на THCA або навпаки – це дає змогу в лабораторних умовах створювати химерні або мутантні ферменти з новими функціями, що відкриває перспективи для біотехнологічного виробництва рідкісних канабіноїдів.
Хоча наявність окремої Δ⁸-THCA-синтази в природі ще не була підтверджена прямим виділенням, теоретично її існування можливе. Біохімічно, Δ⁸-THCA є продуктом гіпотетичної ферментативної циклізації CBGA з альтернативною розстановкою подвійного зв’язку – відмінною від тієї, що формується THCA-синтазою. Відомо, що Δ⁸-THC може виникати як продукт деградації або ізомеризації Δ⁹-THC, однак це не виключає можливості існування специфічної синтази, здатної безпосередньо формувати Δ⁸-THCA. Якщо такий фермент існує, то, ймовірно, він проявляється у маловивчених хемотипах Cannabis або в умовах специфічного метаболічного тиску.
Молекулярні дослідження THCA-синтази показали, що вона функціонує як мономер (~60 кДа), зв’язуючи FAD як простетичну групу. Висока специфічність ферменту до CBGA пояснюється гідрофобною кишенею, яка орієнтує бічні ланцюги субстрату для ініціації електрофільної атаки. Електрони передаються від гідроксигрупи до FAD, після чого утворюється катіон, що запускає внутрішньомолекулярне кільцювання. Механізм далекий від типової монооксигеназної реакції: немає введення кисню у молекулу, лише окисно-циклічне перетворення. Це робить THCA-синтазу унікальним прикладом природного ферменту з вузькоспеціалізованою функцією без потреби у зовнішніх кисневих донорах.
Ще однією характеристикою є просторова локалізація синтаз: існує свідчення, що вони експресуються переважно в капітатних залозистих трихомах, де утворюється секреторна порожнина, що акумулює канабіноїди. Саме тут локалізуються везикулярні структури, в яких ферменти, зокрема THCA-синтаза, функціонують у псевдоапопластичному середовищі. Це запобігає токсичній дії канабіноїдів на клітинні структури самої рослини. Умовна відокремленість цього простору дозволяє синтазам працювати в стабільному мікрооточенні, де концентрація субстрату є високою, а побічні реакції – мінімізовані.
Експресія генів, що кодують синтази, демонструє розвиткову та тканинну специфічність. Найвищі рівні мРНК спостерігаються в період активного формування квіткових структур, особливо в жіночих рослинах, які мають більшу щільність трихом. Крім того, на транскрипцію впливають зовнішні стимули, зокрема УФ-В опромінення, механічні пошкодження та грибкові патогени. Це свідчить про участь синтаз не лише в метаболізмі, а й у стресовій відповіді – продукція канабіноїдів має роль у хімічному захисті рослини.
На посттрансляційному рівні активність синтаз може регулюватися фосфорилюванням або змінами конформації внаслідок алостеричної взаємодії з коферментами або інгібіторами. Наприклад, деякі метаболіти (проміжні або кінцеві) можуть діяти як зворотні регулятори, обмежуючи надмірну продукцію канабіноїдів, що могло б призвести до внутрішньоклітинного окисного стресу. Таким чином, синтази не є статичними каталізаторами, а чутливими до метаболічного контексту динамічними білками.
Інженерія синтаз для синтезу неканонічних або синтетичних канабіноїдів – активний напрям біотехнології. Наприклад, шляхом сайт-специфічного мутагенезу вдалося отримати варіанти THCA-синтази з альтернативною продукцією, включно з CBCA-подібними структурами або навіть з частковою ізомеризацією до Δ⁸-THCA. В експериментах із рекомбінантними дріжджами або Pichia pastoris доведено, що ці ферменти можуть бути ефективно експресовані у гетерологічних системах, що відкриває шлях до ферментативного виробництва канабіноїдів поза рослиною.
Цікавий аспект – співпраця синтаз із ферментами попереднього етапу. Деякі дані вказують, що THCA-синтаза фізично взаємодіє з GOT або з синтазою оліветолової кислоти, що дозволяє передавати субстрат без його дифузії в середовище. Такий “ферментний тандем” підвищує ефективність синтезу, зменшуючи втрати субстрату і обмежуючи конкуренцію між синтазами за CBGA. Це особливо важливо для контролю хемотипу рослини, де навіть невеликі зсуви у співвідношенні активності синтаз можуть змінити домінантний канабіноїд.
Ацидичні форми канабіноїдів та їх термодинамічна стабільність
Ацидичні форми канабіноїдів, зокрема Δ⁹-THCA, CBDA, CBGA та гіпотетична Δ⁸-THCA, є первинними біосинтетичними продуктами метаболізму Cannabis sativa. Ці сполуки мають карбоксильну групу, яка робить їх значно полярнішими та хімічно стабільнішими порівняно з відповідними нейтральними ізомерами. Вони не є просто попередниками активних форм; їхня функція, стабільність та кінетика переходу до нейтрального стану є критично важливими як у біологічному контексті самої рослини, так і у фармакологічному та технологічному застосуванні.
Ключовою хімічною відмінністю між кислотною та нейтральною формами є наявність карбоксильної групи, яка в ацидичних канабіноїдах приєднана до фенольного кільця. Ця група, хоч і невелика, радикально змінює як фізико-хімічні, так і термодинамічні характеристики молекули. Найважливіше – це вплив на дельокалізацію електронної густини, що знижує реакційну здатність кільця до електрофільних атак, стабілізує молекулу проти спонтанної деградації та підвищує її резонансну енергію. Тобто, у контексті термодинаміки, кислоти є глибоко стабільними в умовах, де температура та pH не ініціюють їх декарбоксилювання.
З термодинамічної точки зору, Δ⁹-THCA існує як метастабільна структура. Її перехід до Δ⁹-THC – це реакція, що супроводжується вивільненням CO₂, і має позитивний ентропійний внесок, особливо при підвищенні температури. Але сама реакція не є миттєвою: вона вимагає подолання енергетичного бар’єру, пов’язаного з розривом зв’язку між карбоксильним атомом вуглецю та центральною системою кілець. За нормальних умов (кімнатна температура, відсутність світла та кисню), період напіврозпаду Δ⁹-THCA становить кілька тижнів або й довше. Однак за температур вище 100 °C, реакція проходить зі швидкістю, що у десятки тисяч разів перевищує фонову.
У випадку з Δ⁸-THCA ситуація ще складніша. Зважаючи на розміщення подвійного зв’язку у положенні Δ⁸ замість Δ⁹, дельокалізація π-електронів у ароматичній системі частково зміщується. Це впливає на стабільність молекули в обох її формах – і кислотній, і нейтральній. Хоча безпосередні дані щодо термодинамічних параметрів Δ⁸-THCA відсутні через рідкість цієї сполуки в природі, можна екстраполювати їх із даних про Δ⁹-THCA та ізомеризаційні ентальпії Δ⁸-THC. Теоретичні розрахунки (DFT) показують, що Δ⁸-THCA має дещо нижчу енергію активації для декарбоксилювання, однак стабільність кінцевого продукту (Δ⁸-THC) також менша порівняно з Δ⁹-THC. Це означає, що загальна енергетична вигода від декарбоксилювання Δ⁸-THCA менша, що може пояснити його обмежене природне накопичення.
Окремої уваги заслуговує роль середовища. У кислотних умовах (pH < 4) ацидичні канабіноїди виявляють підвищену стабільність, що пов’язано з пригніченням еноль-оксо-таутомерії, яка є потенційним першим етапом у декарбоксилюванні. У лужному середовищі ситуація протилежна: карбоксильна група може втратити протон, утворивши карбоксилат, що полегшує розрив С-С зв’язку з вивільненням CO₂. Проте у природному середовищі – у трихомах Cannabis – pH підтримується у слаболужному або нейтральному діапазоні, що забезпечує збереження кислотних форм до моменту фізичного впливу (сушіння, нагрівання, ферментації тощо).
Ще один аспект – фотоіндуковане декарбоксилювання. Ацидичні форми є значно стабільнішими до дії світла, ніж нейтральні, однак при тривалому УФ-опроміненні навіть THCA зазнає поступової деградації з утворенням як Δ⁹-THC, так і фотолізних продуктів (наприклад, канабінолу – CBN). Наявність кисню каталізує ці процеси, оскільки сприяє утворенню синглетного кисню або вільних радикалів, які атакують подвійні зв’язки. Отже, у природі стабільність кислотних форм є результатом комплексної дії температурного, фотонного та оксидативного захисту.
У кристалічному стані, THCA проявляє значно вищу стабільність, ніж у розчині. Це пояснюється міжмолекулярними водневими зв’язками між карбоксильною групою та фенольним гідроксилом, які формують тетрамери або гексамери в твердому стані. Такі асоціати потребують додаткової енергії для порушення перед декарбоксилюванням, що знижує швидкість реакції. З огляду на це, зберігання у твердому стані при низькій температурі й у вакуумі є оптимальним способом збереження THCA для наукових чи фармацевтичних цілей.
Щодо Δ⁸-THCA, відсутність докладних кристалографічних даних обмежує повне розуміння її стабільності в твердому стані. Однак враховуючи меншу симетрію молекули порівняно з Δ⁹-THCA, можна припустити нижчу здатність до міжмолекулярної стабілізації – отже, вища схильність до деградації в кристалічній формі.
Термодинамічний профіль ацидичних канабіноїдів має також прямий фармакокінетичний наслідок: ці сполуки практично не абсорбуються у шлунково-кишковому тракті без попереднього декарбоксилювання. Їхня висока полярність, відсутність ліпофільності та відсутність здатності перетинати мембрани пасивною дифузією роблять їх майже біологічно інертними в людському організмі. Це підтверджується клінічними дослідженнями, де THCA при пероральному прийомі не демонструє психоактивності. Проте в експериментах in vitro ці кислоти проявляють антиоксидантну, протизапальну та нейропротекторну активність, що свідчить про наявність окремих фармакофорних властивостей незалежно від перетворення в активну форму.
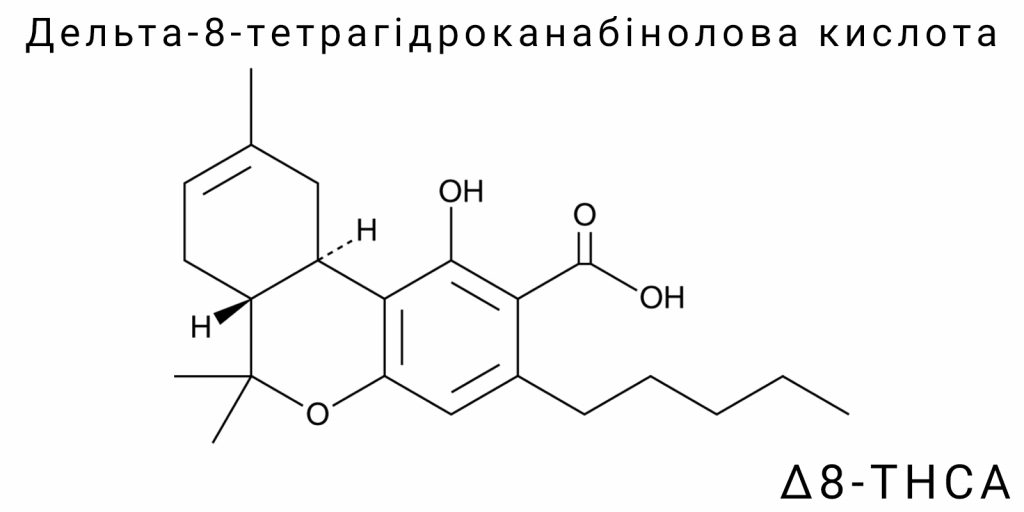
Що таке Δ⁸-THCA?
Хімічна структура та ізомерія Δ⁸-THCA
Δ⁸-тетрагідроканабінолова кислота (Δ⁸-THCA) є структурним ізомером одного з найбільш відомих фітоканабіноїдів – Δ⁹-тетрагідроканабінолової кислоти (Δ⁹-THCA). Ці дві сполуки мають однакову молекулярну формулу (C₂₂H₃₀O₄) і молекулярну масу (~358,5 г/моль), однак відрізняються просторовим розміщенням подвійного зв’язку в циклічному терпеновому фрагменті. Саме ця незначна, на перший погляд, відмінність має суттєві наслідки для термодинаміки, стабільності, біоактивності, а також хімічної трансформації канабіноїда.
Хімічно Δ⁸-THCA є карбоксилованою формою Δ⁸-THC, що має кислотну функціональну групу -COOH, прикріплену до фенольного кільця. Як і інші природні канабіноїди, Δ⁸-THCA існує у вигляді тріциклічної структури, сформованої з фенольного ядра (резорцинолового похідного), ізопренової бічної групи (утвореної з геранілпірофосфату) та тетрагідробензопіранового фрагмента, що включає подвійний зв’язок між вуглецями С8-С9 (у випадку Δ⁸) на відміну від С9-С10 у Δ⁹-ізомері.
Ізомерія між Δ⁹-THCA та Δ⁸-THCA є прикладом позиційної алкенової ізомерії. Подвійний зв’язок, що локалізується між різними атомами в шестичленному циклі бензопіранового ядра, змінює електронну щільність та стереохімічну напруженість у молекулі. Це не лише впливає на стійкість до теплової декарбоксилізації, але й визначає конформаційну гнучкість і взаємодію з білками-мішенями, зокрема канабіноїдними рецепторами CB1 і CB2. Теоретичні обчислення методом DFT (Density Functional Theory) показують, що зміщення подвійного зв’язку з С9-С10 на С8-С9 знижує ентальпію утворення приблизно на 1,5-2 ккал/моль, роблячи Δ⁸-ізомер трохи менш реакційноздатним в умовах енергетичного навантаження.
Варто наголосити, що Δ⁸-THCA не виявлено в природі як домінантний метаболіт. Його наявність зазвичай є результатом ізомеризаційних процесів або нестандартних умов ферментації чи зберігання, наприклад при кислотному гідролізі або під дією тепла. Деякі дані свідчать про можливе існування ферментативної продукції Δ⁸-THCA як міксомезомера в тканинах Cannabis sativa, але поки що жодна Δ⁸-THCA-синтаза не була ізольована або клонована. Це ставить під сумнів її природну біогенетичну автономність.
Стереохімія Δ⁸-THCA залишається менш вивченою у порівнянні з Δ⁹-THCA, однак модельні системи та ядерно-магнітний резонанс (NMR) дозволяють встановити наявність R-конфігурації біля центру С9 (у Δ⁹-THCA – С10), що узгоджується з ензиматичними реакціями, які проходять з високою стереоселективністю. У цьому контексті Δ⁸-THCA може існувати як у формі єдиного енантіомера, так і у вигляді суміші при нестабільних умовах синтезу.
Цікаво, що розміщення подвійного зв’язку також змінює електрофільність молекули. У Δ⁹-THCA подвійний зв’язок поблизу карбоксильної групи сприяє її поляризації, натомість у Δ⁸-THCA цей ефект частково втрачається. Це впливає на швидкість декарбоксилізації: Δ⁸-THCA виявляє більшу стабільність у неферментативних умовах, що може бути корисним для зберігання екстрактів або формулювання фармакологічних препаратів з пролонгованою дією. Експериментальні дані показують, що Δ⁸-THCA має вищу температуру початку деградації на 5-10°C, порівняно з його Δ⁹-аналогом.
На відміну від деяких інших природних канабіноїдів (наприклад, CBD-варіантів), у Δ⁸-THCA хімічна структура чітко вказує на його походження від CBGA через альтернативну ізомеризацію, а не з окремого синтетичного або ферментативного ланцюга. Це дозволяє класифікувати його як “мікроізомерний похідний” – категорію сполук, що виникають у межах фізико-хімічної пластичності канабіноїдного профілю при нестабільних умовах (температура, pH, іонне середовище).
Фізико-хімічні властивості Δ⁸-THCA
Δ⁸-тетрагідроканабінолова кислота (Δ⁸-THCA) є слабо вивченим, але з хімічної точки зору принципово цікавим канабіноїдом, який поєднує в собі кислотну функціональність, поліциклічну будову та електронно-дефіцитний дієновий фрагмент. Його фізико-хімічні властивості мають вирішальне значення для розуміння шляхів стабілізації, фармацевтичної придатності та хімічної обробки у складі екстрактів або очищених форм.
Основна риса Δ⁸-THCA – наявність карбоксильної групи в пара-положенні до аліфатичного ланцюга бензенового ядра. Це зумовлює кислотність у межах рКa ≈ 4.8-5.2, залежно від розчинника і температури. Оскільки Δ⁸-THCA є практично нерозчинним у воді, ця характеристика вимірюється опосередковано – через визначення іонізації у буферних системах або в органічних розчинниках з контрольованим вмістом вологи. У неполярних середовищах Δ⁸-THCA проявляє слабку кислотність і не утворює стабільних іонних форм без наявності ліофільного протонного акцептора, як-от третинні аміни чи макроциклічні поліефіри.
Полярографічні та спектрофотометричні дослідження показують, що Δ⁸-THCA має два основні хромофори – канонічне фенольне кільце та кон’юговану дієнову систему в бензопірановому фрагменті. Спектр УФ-поглинання характеризується максимумами при 206 нм і 271 нм у метанолі, що відображає π→π* переходи в ароматичному ядрі та частково локалізованому подвійному зв’язку. Ці спектральні параметри дозволяють аналітично розрізняти Δ⁸-THCA від його ізомерів у хроматографічному аналізі – зокрема при HPLC з діодним детектором, де зсув максимуму на 2-4 нм може бути достатнім для ідентифікації.
Температурні властивості Δ⁸-THCA мають пряме значення для процесів екстракції та стабілізації. Диференціально-скануюча калориметрія (DSC) показує, що температура початку термічного розпаду (T_onset) становить близько 106-110°C, а пік масової втрати (пов’язаної з декарбоксилізацією) – 125-132°C, залежно від тиску та матриці. У порівнянні з Δ⁹-THCA, Δ⁸-форма має трохи вищий поріг стабільності, що обумовлено меншою реакційною напругою в циклічному каркасі. Теплова деградація проходить за звичайною схемою: елімінація CO₂ → утворення Δ⁸-THC → подальша дегідратація або ізомеризація. Продукти розпаду можуть включати в себе також сліди канабінолу (CBN) або його дегідроаналоги при тривалому нагріванні.
Окрему увагу привертає розчинність Δ⁸-THCA у різних органічних середовищах. Він добре розчиняється в полярних апротонних розчинниках – ДМСО, ацетоні, метанолі, особливо при незначному підігріві. У хлороформі, толуолі або етиловому ацетаті – розчинність обмежена, але достатня для аналітичної або препаративної хроматографії. У багатокомпонентних системах з ліпофільними матрицями (на кшталт масел або смол) Δ⁸-THCA може формувати нестійкі гідрофобні мікросфери, які з часом рекристалізуються в псевдополіморфні структури, що впливає на доступність і стійкість активної форми.
Δ⁸-THCA є нестійким до впливу кислот. Під дією слабких мінеральних кислот у розчині відбувається ізомеризація з переміщенням подвійного зв’язку в положення 9-10, утворюючи Δ⁹-THCA. У присутності сильніших кислот або при температурі вище 60°C цей процес пришвидшується, і за короткий час може призвести до утворення деградованих продуктів, включно з частковим відкриттям кільця та утворенням фенольних альдегідів. Ці реакції є оборотними лише частково, що обмежує використання Δ⁸-THCA в умовах агресивної хімії або нестабільного рН.
Електрохімічна поведінка Δ⁸-THCA вивчена лише фрагментарно, проте доступні дані свідчать про наявність чітких окисно-відновних піків при потенціалі +0.48 В (vs. Ag/AgCl) у ацетонітрилі з літієвим електролітом. Це вказує на стабільність електронної структури при помірних потенціалах і відкриває перспективи для електроаналітичного виявлення навіть у складних сумішах.
Важливо також відзначити, що Δ⁸-THCA має порівняно високу схильність до хімічної адсорбції на силікагелі та інертних поверхнях, зокрема при аналітичній підготовці зразків. Втрата до 15% маси може відбуватись при екстракції в умовах надто великої площі контакту або при сушінні під вакуумом без захисту інертним газом. Це вимагає специфічного протоколу для квантитативного збереження зразка при роботі з чистими формами.
Фізична форма Δ⁸-THCA при кімнатній температурі – це аморфна або слабо кристалічна тверда речовина білого або жовтуватого кольору, залежно від чистоти. У вологому середовищі або при тривалому зберіганні вона має тенденцію до гігроскопічності та поступової гідролітичної деструкції, особливо за наявності слідів металів-каталізаторів. Водночас при правильних умовах зберігання (T < 10°C, атмосфера азоту або аргону) Δ⁸-THCA зберігає стабільність щонайменше 12 місяців, що підтверджено прискореним тестуванням при зниженій вологості.
Щодо взаємодії з білками або біополімерними системами, Δ⁸-THCA демонструє порівняну з Δ⁹-THCA спорідненість до ліпофільних доменів мембран, але через змінену просторову геометрію має нижчу гнучкість при проникненні в фосфоліпідні бішари. Це може впливати на фармакокінетичний профіль після декарбоксилізації до Δ⁸-THC, оскільки початкові властивості кислоти задають конформаційну передумову для зв’язування в транспортних системах.
Походження Δ⁸-THCA: природне чи синтетичне?
Чи існує Δ⁸-THCA в природі?
Існування Δ⁸-тетрагідроканабінолової кислоти (Δ⁸-THCA) у природі довгий час залишалося відкритим питанням через складність її виявлення на фоні структурно схожих канабіноїдів, надзвичайно низькі концентрації і відсутність чітких ферментативних шляхів, які б безпосередньо її продукували. З історичної точки зору, Δ⁸-THCA не належить до канонічних первинних метаболітів Cannabis sativa, але у світлі сучасної аналітики його присутність у деяких біологічних зразках більше не виключається, хоча вона лишається сумнівною у контексті природного походження як автономного продукту метаболізму.
Фітоканабіноїди в рослинах утворюються шляхом регульованої ферментативної біосинтези. У канабісу відомо три основних синтази, що утворюють відповідно THCA, CBDA та CBCA. Жодна з ідентифікованих синтаз, включно з THCA-синтазою, не продукує Δ⁸-THCA як основний або побічний продукт. Докази цього випливають із ряду ін-вітро досліджень, де очищена THCA-синтаза з Cannabis sativa демонструє 100% специфічність до утворення Δ⁹-THCA із каннабігеролової кислоти (CBGA) без супутньої продукції ізомерів. Таким чином, відсутність ферментативного шляху синтезу Δ⁸-THCA вказує на те, що його виникнення у рослинних тканинах не є результатом прямої біосинтетичної активності.
Однак деякі хроматографічні дослідження, особливо ті, що проводилися з використанням рідинної хроматографії з високою роздільною здатністю (UHPLC-MS/MS), вказують на можливу наявність Δ⁸-THCA у слідових кількостях у сировині канабісу, особливо в нестандартизованих або генетично варіабельних популяціях. Найбільш достовірні випадки його виявлення стосуються особливих фенотипів із нестабільними фітосинтетичними профілями. Відомі поодинокі дані щодо наявності Δ⁸-THCA в ацидичних екстрактах деяких центрально-азійських субвидів канабісу, зокрема C. indica var. afghanica, де мас-спектрометрія показала піки з ідентичними молекулярними іонними масами та хроматографічним часом утримання, відповідним синтетичному Δ⁸-THCA.
Важливо підкреслити, що у переважній більшості випадків знайдений Δ⁸-THCA, вірогідно, не є продуктом ендогенної біогенезу, а виникає постфактум – внаслідок спонтанної ізомеризації Δ⁹-THCA. Цей процес можливий за умов зберігання рослинного матеріалу при підвищених температурах, вологості або ультрафіолетовому освітленні. Δ⁹-THCA є лабільною молекулою: подвійний зв’язок у позиції Δ⁹ здатен мігрувати до Δ⁸-положення навіть за слабко кислих або нейтральних умов при наявності енергії активації, спричиненої зовнішнім впливом. Такі міграції задокументовані для відповідного нейтрального ізомеру Δ⁹-THC, і, попри те що Δ⁸-THCA має кислотну групу, її вплив на електронну мобільність обмежений у контексті вуглеводневої частини молекули.
Аналіз ізотопного складу при LC-MS³ із застосуванням стабільно мічених стандартів свідчить, що сліди Δ⁸-THCA у неферментованих тканинах мають мас-спектри, що ідентичні отриманим в лабораторних умовах шляхом термальної ізомеризації. Це побічно підтверджує, що його виникнення не є результатом унікального ферментативного маршруту, а скоріше – продуктом побічної хімічної реакції у рослинній тканині при субоптимальних умовах обробки або зберігання. Підтвердженням цьому слугує і відсутність Δ⁸-THCA у свіжозібраних заморожених зразках, де контрольована температура виключає можливість хімічної перебудови.
Окремий інтерес становлять спроби виявити Δ⁸-THCA у тканинах, які не пройшли ферментативної активації (неферментованих), тобто без дії специфічних окисно-ферментативних систем, що активуються при механічному ушкодженні чи сушінні. Такий підхід дозволяє виявити “природні” молекули в інактивованому середовищі. Результати ультра-м’якої екстракції, проведені при низьких температурах у присутності антиоксидантів, демонструють повну відсутність Δ⁸-THCA, тоді як Δ⁹-THCA стабільно фіксується. Це ще один аргумент на користь вторинного, а не ендогенного походження Δ⁸-THCA.
Існує ймовірність, що в деяких рідкісних генотипах Δ⁸-THCA все ж може утворюватись у дуже малій кількості внаслідок мутацій або поліморфізму в гені THCA-синтази, що призводить до альтернативної просторової орієнтації радикалів у активному центрі ферменту. Проте жоден із відомих клонів чи сортів не демонструє стабільного, відтворюваного синтезу Δ⁸-THCA в культурі. Наявні дані про Δ⁸-THCA в таких фенотипах не є результатом спрямованої селекції, і до того ж не мають достовірної генетичної кореляції, що унеможливлює підтвердження природного біосинтезу без додаткового геномного секвенування.
Штучне отримання Δ⁸-THCA
Δ⁸-тетрагідроканабінолова кислота (Δ⁸-THCA) є нестандартним представником канабіноїдного спектру, який практично не трапляється у природі в значущих концентраціях. Її структура є кислотним аналогом Δ⁸-THC – ізомерної форми психоактивного Δ⁹-THC. Оскільки в природі немає відомих ферментів, що безпосередньо її синтезують, єдиним реалістичним шляхом отримання Δ⁸-THCA в хімічно чистому або технічно контрольованому вигляді залишається штучне спрямоване перетворення інших канабіноїдів. На сьогодні найбільш обґрунтованим методом синтезу Δ⁸-THCA є ізомеризація Δ⁹-THCA, яка реалізується за допомогою каталізованої міграції подвійного зв’язку в циклі гексену, з одночасним збереженням карбоксильної групи. Цей підхід дозволяє трансформувати природний канабіноїд у рідкісний ізомер із контрольованими параметрами, але вимагає точного дотримання умов реакції для запобігання деградації чи декарбоксилювання.
Початковим субстратом для штучного отримання Δ⁸-THCA слугує Δ⁹-THCA – стабільна кислотна форма, яка у високих концентраціях присутня у свіжій сировині канабісу. Його структура включає циклічний терпеновий фрагмент із подвійним зв’язком у позиції Δ⁹. Під впливом кислотного або Lewis-каталізу цей подвійний зв’язок здатен мігрувати у сусідню позицію Δ⁸ шляхом синглетної перебудови з утворенням термодинамічно менш активного, але стабільнішого ізомеру. Важливо зазначити, що кислотна група при цьому не повинна відщеплюватися; тому процес вимагає тонкого контролю умов – особливо температури, pH та природи розчинника.
Каталізована ізомеризація Δ⁹-THCA в Δ⁸-THCA базується на загальних принципах електрофільної індукції. Після активації подвійного зв’язку протоном або іншими електрофілами відбувається перебудова π-системи з утворенням карбокатіонного проміжного комплексу. В залежності від умов реакції, зокрема кислотності середовища та наявності нуклеофільних чи стабілізуючих домішок, ця перебудова може закінчитися або утворенням Δ⁸-THCA, або повною декарбоксиляцією та генерацією нейтрального Δ⁸-THC. Саме тому контрольована температура (нижче 80 °C), вибір неводного середовища та застосування слабких органічних кислот (як-от янтарна, лимонна або борна кислота) стають критично важливими для збереження карбоксильної групи в молекулі.
Особливу перевагу в цьому процесі надають слабокислі умови з використанням органічних каталізаторів у інертному розчиннику – таких як тетрагідрофуран, дихлорметан або толуол. Вони забезпечують мінімальну участь води, яка є основним фактором гідролізу та декарбоксилювання, особливо в умовах нагрівання. Каталізатори, зокрема борна кислота або бензолсульфонова кислота, дозволяють локалізувати протонування саме на Δ⁹-позиції, спрямовуючи міграцію подвійного зв’язку у бік Δ⁸ без ініціації розщеплення кислотної групи.
Інший ефективний підхід – використання м’яких Lewis-кислот, таких як ZnCl₂, AlCl₃ або BF₃·OEt₂, які стабілізують проміжний карбокатіон і прискорюють перебудову без активації декарбоксиляції. У присутності таких агентів реакція переходить у ліпше контрольовану фазу, в якій утворення Δ⁸-THCA домінує над побічними процесами. Такі системи демонструють високу селективність, особливо за низьких температур (20-40 °C) та при додаванні іонних буферів.
Окремо варто розглянути ризик неконтрольованої декарбоксиляції. Через наявність карбоксильної групи Δ⁹-THCA є термічно нестабільним – навіть незначне перевищення температури або присутність вологи веде до втрати CO₂ з утворенням відповідного нейтрального Δ⁹-THC, а в умовах кислотного каталізу – до його ізомеризації в Δ⁸-THC. Таким чином, процеси перетворення Δ⁹-THCA в Δ⁸-THCA знаходяться на межі з аналогічним синтезом Δ⁸-THC, і лише вузьке вікно реакційних умов дозволяє отримати саме кислотну форму. Це й пояснює, чому Δ⁸-THCA рідко трапляється як основний продукт у промислових умовах – його легше спочатку декарбоксилювати, а потім ізомеризувати нейтральний Δ⁹-THC у Δ⁸-THC.
Попри це, низка лабораторних експериментів показала, що за оптимізованих умов кислотно-основного каталізу можна досягти виходів Δ⁸-THCA до 65-70% при мінімальному супутньому утворенні нейтральних ізомерів. Такі результати демонструють перспективність методу в аналітичному та дослідницькому масштабі, хоча для масштабного виробництва ефективнішою лишається конверсія у нейтральні форми.
Перевагою кислотно-основного каталізу порівняно з фотохімічною або термічною ізомеризацією є його точність і контрольованість. Фотохімічна ізомеризація Δ⁹-THCA, хоч і можлива, супроводжується високою часткою побічних реакцій, зокрема фоторозкладу, утворення гідроксильованих похідних та пероксидації. Водночас, у кислотному середовищі реакція йде строго за механізмом міграції подвійного зв’язку, що дозволяє передбачити продукт та контролювати його ізомерну чистоту. Така керованість робить метод оптимальним для синтезу аналітичних стандартів Δ⁸-THCA або для прикладної фармакології, де важливі мінімальні домішки.
На завершення варто зазначити, що отриманий Δ⁸-THCA за своїми хімічними властивостями демонструє вищу термічну стабільність, ніж його попередник, Δ⁹-THCA. Завдяки меншій електронній напрузі в положенні Δ⁸ та відсутності легкої інверсії конфігурації, ізомер демонструє стійкість до подальших ізомеризацій та розкладу. Це дає змогу зберігати Δ⁸-THCA у контрольованому стані довше, що є важливою перевагою в хроматографічному аналізі, коли необхідна стабільна референтна речовина.
Методи синтезу та ізоляції Δ⁸-THCA
Основні підходи до синтезу Δ⁸-THCA: Із Δ⁹-THCA та через CBGA
Δ⁸-THCA – це кислотна форма канабіноїду з подвійним зв’язком у положенні Δ⁸, яка не зустрічається в природі як метаболіт у біогенезі рослини. Її синтез вимагає точного регулювання реакційних умов для збереження карбоксильної групи, яка є ключовим аспектом кислотних канабіноїдів. Основні штучні шляхи синтезу включають ізомеризацію природного Δ⁹-THCA, а також теоретичні або частково реалізовані підходи через CBGA (канабігеролова кислота), який є метаболічним попередником усіх основних канабіноїдів у рослині Cannabis sativa.
Найбільш практичним та відтворюваним методом є ізомеризація Δ⁹-THCA, яка здійснюється з використанням каталізаторів, що ініціюють міграцію подвійного зв’язку з позиції Δ⁹ у Δ⁸. Цей процес, однак, принципово відрізняється від класичної ізомеризації Δ⁹-THC у Δ⁸-THC. Збереження кислотного фрагмента під час реакції потребує глибокої хімічної корекції умов, що виключають перегрів, сильні кислоти та водну фазу. Як правило, застосовуються слабкі органічні кислоти в аполярному середовищі – наприклад, янтарна, борна або лимонна кислота в присутності інертного розчинника (діетиловий ефір, толуол, дихлорметан). Ізомеризація запускається через утворення слабоактивованого π-комплексу в Δ⁹-позиції, який реорганізується в Δ⁸ із збереженням COOH-групи.
Центральною умовою є обмеження температурного режиму: при нагріванні вище 80 °C ймовірність втрати карбоксильної групи зростає експоненційно. Таким чином, процес найчастіше проводиться при 35-50 °C із постійним моніторингом pH та відсутності вологи. Деякі лабораторії використовують м’які Lewis-кислоти, наприклад BF₃·OEt₂, які дозволяють провести реакцію без гідролізу. За таких умов можливе отримання чистого Δ⁸-THCA з виходом понад 60%, якщо реакцію зупинити до початку декарбоксилювання. Однак цей шлях ускладнений значним ризиком утворення суміші Δ⁸-THCA і Δ⁸-THC, тому він не підходить для масштабного виробництва без наступної високоточної ізоляції.
Менш розроблений, але теоретично можливий шлях – синтез Δ⁸-THCA з CBGA (канабігеролової кислоти) через альтернативні ферментоподібні або квазибіоміметичні механізми. У природі CBGA є попередником Δ⁹-THCA через дію ферменту THCA-синтази. Для того щоб спрямувати цей біосинтетичний шлях до Δ⁸-THCA, необхідно або замінити фермент, або змінити реакційні умови, щоб ініціювати нестандартне циклювання. Хоча в рослині таких умов не існує, в експериментальних умовах синтезу можливо створити електрофільне середовище, у якому енольна форма CBGA піддається циклізації із зсувом подвійного зв’язку в положення Δ⁸. Цей механізм поки що не має повної експериментальної валідації, однак певні продукти з такими структурними ознаками були отримані в моделях з катіон-індукованою циклізацією CBGA в присутності металів перехідної групи (особливо Cu²⁺ та Zn²⁺), які змінюють траєкторію електронного току в молекулі.
Важливим аспектом є те, що ізомеризація CBGA до Δ⁸-THCA вимагає специфічного просторового орієнтування, яке забезпечує утворення подвійного зв’язку саме між С8 і С9 атомами. Для цього потрібна стабілізація проміжного карбокатіону, яка зазвичай забезпечується розчинниками з низькою полярністю та наявністю електронодонорних домішок. Дослідні групи, що працювали з похідними CBGA, спостерігали транзитні продукти з Δ⁸-конфігурацією, однак їх стабілізація як кислотної форми поки не була ефективно відтворена без утворення супутніх ізомерів або деструктивних побічних продуктів.
Цікаво, що синтез Δ⁸-THCA з CBGA у біоміметичних умовах потенційно дозволив би обійти стадію декарбоксилювання в загальній схемі отримання Δ⁸-THC, що є перевагою для медико-аналітичного застосування, де необхідна висока чистота кислотної форми. Тим не менш, повна реалізація цього шляху вимагає відкриття або розробки штучного ізомероспецифічного ферменту – умовно, “Δ⁸-THCA-синтази”, аналогічної до вже відомої Δ⁹-THCA-синтази, але зі зміненими координатами каталізу.
Хроматографічне виділення та очищення Δ⁸-THCA: методика HPLC, LC-MS та детекція без декарбоксилювання
Виділення Δ⁸-THCA із синтетичних сумішей або біологічних матриць потребує винятково точних методів розділення через надзвичайно близьку структурну схожість з іншими канабіноїдними кислотами, передусім Δ⁹-THCA та CBDA. При цьому важливо забезпечити стабільність аналізованої молекули, яка легко втрачає карбоксильну групу навіть при слабкому нагріванні або тривалому впливі УФ-випромінювання. Через це методи хроматографічної ідентифікації Δ⁸-THCA повинні бути адаптовані до умов, що повністю виключають декарбоксилювання – як в етапі екстракції, так і в процесі аналітичного детектування.
Оптимальною технікою вважається високоефективна рідинна хроматографія (HPLC) у поєднанні з мас-спектрометрією (LC-MS), яка дозволяє не лише розділити ізомери Δ⁸- і Δ⁹-THCA, але й верифікувати наявність кислотної групи за іонною масою та характерними фрагментами в спектрі. У класичній HPLC-аналітиці використовують зворотнофазні колонки (C18 або фенілгексил) з градієнтною елюцією ацетонітрилу або метанолу у воді з 0.1% мурашиної або оцтової кислоти. Додавання органічної кислоти в мобільну фазу має подвійне значення: зниження рН для стабілізації кислотної форми та запобігання утворенню іонних пар, які зменшують ефективність розділення.
Ретенційний час Δ⁸-THCA зазвичай близький до Δ⁹-THCA – відмінність становить лише кілька десятих хвилини. Тому ключовим стає точний контроль температури (не вище 30 °C) та тиску, аби уникнути індукованого декарбоксилювання. Ізомери розділяються завдяки тонким зміщенням в гідрофобній взаємодії з фазою та незначним різницям в π-електронному розподілі. Для покращення селективності іноді застосовують хіральні колонки, особливо при аналізі синтетичних партій, які можуть містити оптичні або геометричні ізомери.
Мас-спектрометричне підтвердження Δ⁸-THCA ґрунтується на спостереженні за мішеневими іонами з m/z 357 [M-H]⁻ для монодегідрованої форми, що відповідає молекулі C₂₂H₂₈O₄. Важливою діагностичною ознакою є збереження CO₂-фрагмента в спектрі. У разі декарбоксилювання в джерелі іонізації спостерігається інтенсивне пікове зниження до m/z 313 – що є ознакою втрати кислотності. Для того, щоб мінімізувати цей ефект, LC-MS проводиться в умовах електроспрей-іонізації (ESI) з оптимізованою температурою інтерфейсу (<200 °C) та мінімальним потенціалом фрагментації.
Крім MS-детекції, можливе також використання DAD (діодно-матричного детектора) з виявленням у діапазоні 210-280 нм. Характерна особливість Δ⁸-THCA – наявність максимуму поглинання поблизу 275 нм, дещо зміщеного порівняно з Δ⁹-THCA. Це дозволяє ідентифікувати кислотну форму навіть при відсутності мас-спектра, але за умови чистого розділення. Проте DAD-метод менш чутливий і вимагає суворої стандартизації екстракції.
Щодо самої екстракції – ключовим є уникнення термічної обробки з моменту забору зразка. Тому перед початком хроматографії зразок витягують у холодних умовах, часто при -20 °C або нижче, із застосуванням неводних розчинників – наприклад, хлороформу, етанолу або ацетону, причому бажано попередньо осушених. Екстракти фільтрують у анаеробному середовищі або під азотом для зниження окислювального тиску. Декарбоксилювання при цьому навіть на 1-2% призводить до помилкової інтерпретації складу, оскільки Δ⁸-THC має практично ідентичну полярність та хроматографічні характеристики, відрізняючись лише мобільністю за спектром мас.
На практиці очищення Δ⁸-THCA після синтезу або аналітичного виявлення в матриці виконується шляхом фракційної хроматографії. Найбільш точним вважається повторне HPLC-розділення після попередньої грубої сепарації на флеш-хроматографії або колонках з силікагелем. У першому етапі метою є ізоляція групи кислотних канабіноїдів, а на другому – селективне виведення саме Δ⁸-ізомеру. Тут знову ж таки ключовим є уникнення навіть мінімального нагрівання – наприклад, випаровування розчинників проводиться лише у вакуумі при температурі <30 °C, а іноді – під азотом у крижаній бані.
Інша методика – твердофазна екстракція (SPE) з подальшою хроматографією. SPE-картриджі, зазвичай C18 або феніл-бондування, дозволяють попередньо очистити екстракт від ліпофільних домішок, що заважають детекції. Однак SPE не дозволяє повноцінно розділити ізомери Δ⁸ і Δ⁹ – ця задача вирішується виключно HPLC.
Під час аналітичного дослідження також критично важливо виключити можливість ізомеризації Δ⁹-THCA в Δ⁸-THCA in situ, що може хибно інтерпретуватися як наявність Δ⁸-ізомеру. Таке можливо при залишкових слідах кислоти або при зміненому pH в елюенті. Тому при валідації методу проводиться серія контрольних ін’єкцій стандартів Δ⁹-THCA та Δ⁸-THCA окремо, з обов’язковим контролем повторного аналізу після інкубації в умовах методу.
Стандартизація та кількісний аналіз Δ⁸-THCA: проблеми аналітичних стандартів і метрологічні виклики
Стандартизація Δ⁸-THCA є однією з найскладніших проблем сучасної аналітичної хімії канабіноїдів через відсутність комерційно доступних, сертифікованих стандартів, а також особливості хімічної стабільності цієї сполуки. На відміну від більш розповсюджених канабіноїдів, таких як Δ⁹-THC або CBD, для Δ⁸-THCA практично немає затверджених стандартних зразків з підтвердженою чистотою і стабільністю, що робить точний кількісний аналіз технічно складним і неоднорідним у різних лабораторіях.
Основною причиною цього є низька термодинамічна стабільність Δ⁸-THCA, що вимагає ретельного контролю умов зберігання, транспортування і підготовки аналітичних проб. Відсутність стандартизованих умов викликає значні варіації в результатах, оскільки при найменшому перегріванні чи впливі кисню Δ⁸-THCA швидко декарбоксилюється в Δ⁸-THC, що хибно завищує або занижує реальну концентрацію кислоти. Тому всі аналітичні методики повинні містити етапи перевірки стабільності зразків та валідовані процедури попередження трансформації.
Відсутність стандартизованих зразків, затверджених метрологічними органами, призводить до широкого використання синтетичних або напівчистих зразків, які лабораторії готують самостійно. Ці зразки можуть бути синтезовані із Δ⁹-THCA шляхом ізомеризації, що підвищує ризик домішок або помилкових ідентифікацій. Для контролю чистоти таких стандартів застосовують ядерний магнітний резонанс (ЯМР), високороздільну мас-спектрометрію (HR-MS) і ІЧ-спектроскопію, проте ці методи не завжди доступні в рутинних лабораторіях, що додатково ускладнює стандартизацію.
Кількісний аналіз Δ⁸-THCA зазвичай проводять методом HPLC з UV-детекцією або LC-MS/MS, однак відсутність внутрішнього стандарту із подібною хімічною структурою створює проблеми точності. Ідеальним внутрішнім стандартом є ізотопно-маркований Δ⁸-THCA, але його синтез і комерційне виробництво досі обмежені. Тому часто використовують структурні аналоги, такі як CBGA або Δ⁹-THCA, проте відмінності в хроматографічній поведінці та детекції знижують валідність кількісних результатів.
Ще однією проблемою є варіабельність екстракції Δ⁸-THCA з різних матриць (рослинна сировина, концентрати, екстракти), де ефективність вилучення залежить від багатьох факторів: типу розчинника, температури, часу екстракції, кислотності середовища. Через це часто спостерігається недооцінка або переоцінка вмісту Δ⁸-THCA, що унеможливлює точне порівняння результатів різних досліджень. Вирішення цієї проблеми вимагає розробки уніфікованих протоколів екстракції і регулярного застосування контрольних зразків.
Метрологічні труднощі для Δ⁸-THCA пов’язані також із визначенням меж виявлення і кількісного аналізу, особливо в комплексних біологічних матрицях, де фонові домішки та ізомерні канабіноїди заважають точній ідентифікації. Для зменшення цих перешкод застосовують високоефективні хроматографічні системи з багатовимірним розділенням (2D-HPLC), а також покращені мас-спектрометричні детектори з високою роздільною здатністю (HRMS) та методи фрагментації (MS/MS). Але ці методи є дорогими і потребують високої кваліфікації аналітиків.
Крім того, в нормативних документах щодо контролю продуктів із канабісом Δ⁸-THCA не включений як окремий параметр, через що стандартизація цього канабіноїду на рівні регуляторних органів практично відсутня. Це створює проблему для фармацевтичної індустрії та виробників харчових добавок, які не мають чітких вимог до вмісту Δ⁸-THCA, що, у свою чергу, гальмує науково обґрунтоване застосування цієї сполуки.
Фармакологічний потенціал Δ⁸-THCA
Фармакологічний потенціал Δ⁸-THCA залишається одним із найбільш перспективних і водночас недостатньо вивчених напрямків у дослідженні канабіноїдів. Ця молекула, що є кислотною формою Δ⁸-тетрагідроканнабінолу, демонструє унікальні властивості, які відрізняють її від більш вивчених нейтральних канабіноїдів, таких як Δ⁸-THC та Δ⁹-THC. Переважна більшість сучасних наукових робіт концентрується саме на декарбоксильованих формах, які проявляють виражену психоактивність і впливають безпосередньо на канабіноїдні рецептори CB1 і CB2. Натомість кислотні форми, зокрема Δ⁸-THCA, історично вважалися біологічно неактивними прекурсорами, які втрачали фармакологічну активність до моменту декарбоксилювання.
Однак ця концепція змінюється у зв’язку з новими відкриттями. Δ⁸-THCA не тільки є проміжною сполукою у біосинтезі психоактивних канабіноїдів, але й має власний спектр фармакологічних ефектів, що можуть бути корисними в терапевтичному застосуванні. Її потенціал у різних біологічних процесах пов’язаний із специфічними молекулярними механізмами, які ще повною мірою не досліджені, але мають важливе значення для імуномодуляції, нейропротекції та регуляції фізіологічних функцій.
Особливістю Δ⁸-THCA є те, що вона зберігає кислотний функціонал, який впливає на її здатність проникати через біологічні мембрани, а отже – і на фармакокінетику. Це означає, що молекула поводиться відмінно від своїх нейтральних аналогів, що впливає на її біодоступність, розподіл у тканинах і метаболізм. Крім того, вона демонструє підвищену хімічну стабільність в певних умовах, що відкриває перспективи її використання у вигляді фармацевтичних препаратів з пролонгованою дією.
Сучасні дані свідчать, що Δ⁸-THCA може взаємодіяти з різними біологічними мішенями, не обмежуючись канабіноїдними рецепторами. Це включає потенціал впливати на TRP-канали, іонні канали та інші рецепторні системи, що беруть участь у передачі больових імпульсів, запальних реакціях та регуляції настрою. Такий багатофункціональний профіль робить Δ⁸-THCA перспективним кандидатом для подальшого дослідження як засобу для лікування широкого спектру патологій, включаючи хронічний біль, запалення, неврологічні захворювання та розлади настрою.
Водночас значним викликом для розвитку фармакології Δ⁸-THCA є недостатність систематичних досліджень, особливо тих, які б оцінювали безпеку і токсичність молекули. Сучасні наукові публікації містять переважно дані in vitro та короткострокових експериментів на тваринах, що ускладнює перенесення результатів у клінічну практику. Крім того, потребує удосконалення аналітична методологія для точної ідентифікації та кількісного визначення Δ⁸-THCA в біологічних зразках, що є необхідним для стандартизації досліджень і фармацевтичної розробки.
Актуальні гіпотези про механізм дії
Механізм дії Δ⁸-THCA залишається предметом активних наукових досліджень, адже ця молекула відрізняється як від нейтральних канабіноїдів, так і від своєї більш вивченої ізомерної форми Δ⁹-THCA. Однією з ключових тем є здатність Δ⁸-THCA взаємодіяти з ендоканабіноїдними рецепторами CB1 і CB2 без попереднього декарбоксилювання, що традиційно вважалося необхідним для прояву фармакологічної активності.
Існують експериментальні докази, які вказують на слабку, але специфічну агонистичну активність Δ⁸-THCA щодо CB1-рецепторів. Ця взаємодія відбувається за механізмом, що відрізняється від типового зв’язування для нейтральних канабіноїдів, зокрема через вплив на конформацію рецептора та модулювання вторинних месенджерів. Водночас зв’язування з CB2-рецепторами, які головним чином відповідають за імунну регуляцію, є менш дослідженим, але припускається, що Δ⁸-THCA може опосередковано впливати на імунні клітини через інші рецепторні системи.
Окрім прямої рецепторної взаємодії, ключову роль у фармакології Δ⁸-THCA відіграє її здатність модулювати запальні процеси. На молекулярному рівні це пов’язано з інгібуванням експресії прозапальних цитокінів і хемокінів, а також з активацією антиоксидантних систем клітин. Такі ефекти підтверджені in vitro дослідженнями на макрофагах та нейрональних клітинах, де Δ⁸-THCA знижує експресію TNF-α, IL-6 і COX-2. Це свідчить про потенціал молекули як регулятора імунної відповіді без активації психоактивних ефектів, властивих Δ⁹-THC.
Інший важливий аспект – здатність Δ⁸-THCA впливати на нейротрансмісію, зокрема через модуляцію TRP-каналів (транзієнтних рецепторних потенціалів), які відіграють роль у передачі больових сигналів і терморегуляції. Активація TRPV1 та TRPA1 каналів може пояснювати анальгетичний ефект і здатність зменшувати нудоту, що спостерігається при застосуванні Δ⁸-THCA.
Проте важливо зазначити, що через кислотний характер молекули її фармакокінетика значно відрізняється від нейтральних канабіноїдів. Δ⁸-THCA має обмежену здатність проникати через гематоенцефалічний бар’єр, що обмежує її прямий вплив на центральну нервову систему, але натомість підвищує локальну активність у периферичних тканинах. Це робить її перспективним засобом для лікування периферичних запалень та больових синдромів, мінімізуючи психоактивні ефекти.
Слід враховувати, що більшість сучасних гіпотез базується на обмежених експериментальних даних, які часто одержані на in vitro моделях або за допомогою комп’ютерного моделювання рецепторів. Для підтвердження цих механізмів потрібні глибші in vivo дослідження, включно з використанням сучасних методів молекулярної біології, фармакодинаміки і фармакокінетики. Особливо актуальним є дослідження взаємодії Δ⁸-THCA з іншими компонентами канабіноїдного комплексу, що може впливати на сумарний терапевтичний ефект.
Токсикологічна характеристика та безпека Δ⁸-THCA
Дослідження токсикологічного профілю Δ⁸-THCA на сьогодні перебувають у зародковому стані, що значною мірою обумовлено обмеженим доступом до чистих ізольованих зразків та низькою кількістю систематичних in vivo і in vitro експериментів. Відсутність достатньої кількості даних створює складнощі у визначенні безпечних терапевтичних доз і потенційних побічних ефектів, а також у формуванні офіційних рекомендацій для клінічного застосування.
Попередні токсикологічні дослідження канабіноїдних кислот свідчать про їхню порівняно низьку гостру токсичність. Вивчення Δ⁹-THCA, близької по структурі молекули, демонструє високу біосумісність і низький ризик гострої токсичності навіть при дозах, що перевищують фармакологічно активні рівні. Однак безпосередні дослідження Δ⁸-THCA поки що не представлені, що ускладнює однозначні висновки.
На молекулярному рівні кислотна форма канабіноїдів має потенціал до утворення нековалентних комплексів із білками мембран, що теоретично може впливати на функції клітинних рецепторів і транспортних систем. Однак відсутні дані про токсичність такого впливу чи порушення клітинної гомеостазу.
Особливу увагу слід приділяти питанням метаболізму Δ⁸-THCA в організмі. Метаболічні шляхи ферментативного розпаду і перетворення цієї молекули можуть продукувати метаболіти, які за певних умов мають потенційно токсичні властивості, наприклад, здатність до утворення реактивних форм кисню або зв’язування з ДНК. Відсутність глибоких досліджень у цій сфері створює додаткові невизначеності щодо безпеки тривалого застосування.
Дослідження впливу Δ⁸-THCA на печінку, нирки, серцево-судинну систему і репродуктивні органи практично відсутні, що є серйозним бар’єром для оцінки токсикологічної безпеки. Моделі токсичності на тваринах та культури клітин мають бути розроблені для виявлення потенційної кумулятивної токсичності або органоспецифічних ефектів.
Враховуючи фармакокінетичні особливості Δ⁸-THCA, зокрема обмежену біодоступність при пероральному застосуванні через кислотність і можливість розпаду в шлунковому середовищі, експериментальні дослідження повинні зосереджуватися на визначенні безпечних форм введення, що збережуть стабільність молекули і зменшать ризик побічних реакцій.
Також критичною є потреба у стандартизованих методах кількісного визначення Δ⁸-THCA у біологічних зразках для кореляції дози з фармакологічними і токсикологічними ефектами. Відсутність точних аналітичних протоколів наразі ускладнює оцінку фармакокінетики і динаміки токсикологічних процесів.
З огляду на інтенсивний розвиток канабіноїдної фармакології, необхідно терміново розгорнути комплексні токсикологічні дослідження, що включатимуть тривалість дії, ефекти накопичення, потенційні мутагенні та канцерогенні властивості. Особливо важливі будуть дослідження in vivo з моделями, наближеними до людської фізіології, для визначення профілю безпеки при клінічному застосуванні.
Перспективи вивчення та застосування
Перспективи вивчення та застосування Δ⁸-THCA відкриваються на перетині фундаментальної науки, фармацевтичних технологій і правового регулювання. Ця сполука, будучи одним із менш досліджених канабіноїдів, представляє собою унікальний об’єкт для розкриття нових властивостей канабіноїдної хімії, що може суттєво розширити розуміння взаємодії молекул з біологічними системами.
Фундаментальною перспективою є те, що Δ⁸-THCA дає змогу вивчати механізми ізомерії канабіноїдів, які суттєво впливають на фармакокінетичні та фармакодинамічні характеристики. Молекулярна структура ізомеру визначає його стабільність, здатність взаємодіяти з рецепторами ендоканабіноїдної системи, а також проходження через біологічні бар’єри. Ці особливості відкривають нові шляхи для дослідження, зокрема, вивчення специфіки зв’язування із CB1 і CB2 рецепторами до того, як Δ⁸-THCA декарбоксилюється в активні форми, що може змінити традиційні уявлення про механізми дії канабіноїдів.
Практичною перспективою є потенціал Δ⁸-THCA як основи для розробки нових фармацевтичних препаратів. Вивчення властивостей ізомерів відкриває можливості синтезу і тестування нових похідних з покращеною селективністю, підвищеною біодоступністю або зниженою токсичністю. Сучасні технології, такі як ферментативний синтез і генно-інженерні підходи, можуть бути застосовані для отримання високочистих форм Δ⁸-THCA або створення модифікованих молекул з унікальними біологічними властивостями.
Важливим напрямом є також питання стандартизації, аналітичного контролю і кількісного визначення Δ⁸-THCA у фармацевтичних і харчових продуктах. Недостатня розробленість метрологічних методів і відсутність єдиних стандартів ускладнюють контроль якості і викликають невизначеність на ринку. Вирішення цих проблем є ключовим для безпечного і ефективного використання Δ⁸-THCA в медичних і комерційних цілях.
Водночас, значна частина перспектив пов’язана із викликами в юридичній площині. Законодавство багатьох країн досі не сформулювало чітких критеріїв регулювання кислотних форм канабіноїдів, через що Δ⁸-THCA перебуває у правових “сірих зонах”. Це створює труднощі як для виробників, так і для споживачів, впливає на прозорість ринку і потребує адаптації нормативних актів до сучасних наукових знань.
Перспективи застосування Δ⁸-THCA виходять за межі класичних терапевтичних сфер, включаючи потенціал у косметології, харчовій промисловості, а також у розробці біоматеріалів і нанотехнологій. Її унікальні фізико-хімічні властивості відкривають шлях до створення інноваційних продуктів з контрольованою біодоступністю і таргетованою дією.
Δ⁸-THCA як модель для вивчення канабіноїдної ізомерії
Δ⁸-THCA як модель для вивчення канабіноїдної ізомерії є надзвичайно перспективною через унікальну хімічну будову та фізіологічну активність, які відрізняються від класичних канабіноїдів. Ізомерія в канабіноїдній хімії в основному проявляється у різних просторових і електронних конфігураціях молекул, що істотно впливає на їхню здатність взаємодіяти з біологічними мішенями, біодоступність, метаболічні шляхи і, як наслідок, фармакологічний ефект.
Δ⁸-THCA є ізомером Δ⁹-THCA, в якому подвійний зв’язок розташований в іншому положенні циклу. Така зміна, на перший погляд, незначна, однак має глибокі наслідки для стабільності молекули, її реакційної здатності, а також для фармакокінетичних характеристик. Вивчення Δ⁸-THCA дозволяє краще зрозуміти тонкі механізми ізомеризації в канабіноїдній системі, які зазвичай залишаються поза увагою через складність аналізу і відсутність чистих ізомерів для порівняння.
Фармакокінетичний аспект вивчення Δ⁸-THCA як ізомеру зосереджується на особливостях абсорбції, розподілу, метаболізму та виведення. Зміщення подвійного зв’язку впливає на конформацію молекули, що в свою чергу модифікує взаємодію з ферментними системами, зокрема цитохромом P450, які є ключовими у метаболізмі канабіноїдів. Порівняння фармакокінетики Δ⁸-THCA і Δ⁹-THCA дає змогу виявити специфічні метаболічні шляхи, які можуть бути використані для цілеспрямованої модифікації молекули з метою підвищення біодоступності або зменшення токсичності.
Крім того, дослідження Δ⁸-THCA як ізомеру відкриває можливості для створення нових похідних канабіноїдів із заданими властивостями. Наприклад, змінюючи положення подвійного зв’язку або вводячи специфічні функціональні групи, можна отримувати сполуки з оптимізованою спорідненістю до рецепторів CB1 та CB2, або з удосконаленою фармакокінетикою. Цей підхід є перспективним для розробки препаратів із вибірковою дією, мінімальними побічними ефектами та підвищеною ефективністю.
Методи хімічного синтезу і біотрансформації ізомерів на основі Δ⁸-THCA використовують для дослідження структури-активності. Сучасні аналітичні технології, такі як ядерний магнітний резонанс (ЯМР), мас-спектрометрія високої роздільної здатності (HRMS) та хроматографія, дозволяють ідентифікувати і кількісно аналізувати навіть незначні зміни у структурі, що є критично важливим для розуміння механізмів ізомеризації та фармакологічної активності.
Вивчення фармакокінетики Δ⁸-THCA також сприяє розробці ефективних фармацевтичних форм. Зокрема, існує інтерес до створення інкапсульованих, ліофілізованих чи нанодиспергованих форм, які покращують стабільність і біодоступність канабіноїдів. Розуміння специфіки ізомерії дозволяє адаптувати технології доставки, що забезпечують цілеспрямоване вивільнення активної речовини, мінімізуючи її деградацію і підвищуючи терапевтичний ефект.
У контексті фармакодинаміки, Δ⁸-THCA виступає як цінна модель для аналізу впливу структурних змін на взаємодію з канабіноїдними рецепторами та іншими білковими мішенями. Різне розташування подвійного зв’язку змінює електронний розподіл і конформацію молекули, що корелює із зміненою спорідненістю та активністю щодо рецепторів CB1/CB2, TRPV1 та інших. Це дозволяє глибше досліджувати молекулярні деталі рецепторної селективності, сприяючи розробці більш точних моделей взаємодії ліганд-рецептор.
Проблеми правового регулювання
Правове регулювання Δ⁸-THCA є надзвичайно складним і неоднозначним через унікальний статус кислотної форми канабіноїдів, який породжує низку юридичних та нормативних викликів. Δ⁸-THCA, як кисла форма тетрагідроканабіноїдної молекули, перебуває у своєрідній “легальній сірій зоні”, що ускладнює її чітке віднесення до контрольованих речовин або дозволених сполук у різних юрисдикціях. Цей феномен виникає з кількох причин, пов’язаних із відсутністю стандартизованих критеріїв класифікації, недостатньою аналітичною ідентифікацією, а також різним підходом законодавців до кислотних форм канабіноїдів.
Першою складністю є хімічна природа Δ⁸-THCA. На відміну від декарбоксильованих форм, таких як Δ⁸-THC або Δ⁹-THC, кислотні форми мають карбоксильну групу, що радикально змінює їх фармакологічний профіль, біодоступність і психоактивність. Законодавці часто не враховують цю різницю, застосовуючи нормативи, розроблені для декарбоксильованих канабіноїдів, що призводить до неоднозначної інтерпретації правового статусу Δ⁸-THCA. Оскільки ця форма є термічно нестабільною і при нагріванні перетворюється в активний Δ⁸-THC, вона технічно несе потенціал для психоактивності, але сама по собі менш активна. Саме це ставить під сумнів, чи слід відносити її до списку заборонених речовин.
Другою проблемою є недостатня прозорість хімічного маркування продуктів, що містять Δ⁸-THCA. Через відсутність стандартизованих методів аналізу і сертифікації, виробники можуть позначати продукти з Δ⁸-THCA як “непсихоактивні” або “легальні”, що вводить в оману споживачів і регуляторів. Це створює правові колізії, адже де-факто у таких продуктах може міститися активний Δ⁸-THC, який утворюється при розкладанні кислоти під час зберігання або нагрівання. Відсутність однозначних стандартів контролю якості і кількісного аналізу сприяє появі продуктів невизначеного складу, що посилює сумніви з боку законодавчих органів.
Ще одним аспектом є міжнародна різнорідність правового підходу. У деяких країнах Δ⁸-THCA не включена до переліку контрольованих речовин, а у інших її статус залишаєтья неоднозначним через відсутність нормативних актів, які прямо регламентували б кислотні форми канабіноїдів. Це створює бар’єри для міжнародної торгівлі і обміну науковими даними, ускладнює розробку уніфікованих рекомендацій і стандартів. Для науковців і фармацевтів такі правові невизначеності стають серйозним обмеженням у дослідженнях і клінічних застосуваннях.
Законодавчі “сірі зони” часто пов’язані з відсутністю чітких методів і критеріїв ідентифікації Δ⁸-THCA у складі складних сумішей. Стандартні методи аналітики, зокрема газова хроматографія з мас-спектрометрією, можуть спричиняти термічний розклад кислотних форм, що ускладнює достовірний аналіз. Це призводить до неоднозначності результатів, що використовується виробниками та регуляторами для формування власних юридичних позицій. Нерідко Δ⁸-THCA сприймають як попередник психоактивного Δ⁸-THC, що породжує додаткові питання щодо легітимності його використання.
Ще одним важливим фактором є загальна тенденція законодавчих систем фокусуватися на активних формах канабіноїдів, особливо на Δ⁹-THC, який має усталену заборону у багатьох країнах. Δ⁸-THCA та інші кислоти не отримали такого ж рівня уваги, що залишає їх регулювання в недоопрацьованому стані. Цей факт іноді використовується як аргумент на користь легалізації Δ⁸-THCA, проте при цьому ігнорується потенціал трансформації кислоти в психоактивний канабіноїд під час нагрівання або метаболізму в організмі.
Правове регулювання Δ⁸-THCA також ускладнюється через швидкий розвиток ринку канабіноїдних продуктів, де виробники постійно експериментують з новими формулами та способами доставки. Використання Δ⁸-THCA в продуктах із косметики, харчових добавок і фармацевтичних препаратів нерідко випереджає законодавчі ініціативи, що створює прогалини у контролі якості і безпеки. Недостатність юридичних рамок для кислотних форм збільшує ризики для споживачів і перешкоджає встановленню прозорих стандартів.
З огляду на ці фактори, ключовою проблемою правового регулювання Δ⁸-THCA є відсутність узгоджених нормативних визначень, які враховують унікальні хімічні і фармакологічні властивості кислотних канабіноїдів. Необхідно розробити спеціалізовані критерії класифікації, що базуються на сучасних аналітичних технологіях і результатах фармакологічних досліджень, що дозволить розмежувати Δ⁸-THCA від декарбоксильованих психоактивних форм і визначити чіткий правовий статус.
Варто підкреслити, що ефективне правове регулювання Δ⁸-THCA має передбачати інтеграцію наукових знань у нормативні документи, що включає стандарти аналітики, рекомендації щодо маркування та вимоги до безпеки продукції. Такий підхід зменшить ризики для здоров’я споживачів, сприятиме розвитку індустрії та знизить правову невизначеність для виробників і науковців.
Проблема прозорості в хімічному маркуванні продуктів, що містять Δ⁸-THCA, не менш важлива. Відсутність точних даних про склад продукту призводить до порушень у споживчому виборі і збільшує можливості для шахрайства. Виробники мають впроваджувати стандарти прозорого маркування, що включають конкретні кількісні показники вмісту Δ⁸-THCA, а також інформацію про можливі перетворення кислоти при зберіганні і використанні. Це особливо актуально для медичних і харчових продуктів, де безпека і ефективність є критичними параметрами.
У міжнародному контексті, необхідність гармонізації правових норм щодо Δ⁸-THCA стає все більш очевидною. Різні країни мають кардинально відмінні підходи до регулювання канабіноїдів, що ускладнює наукову співпрацю і розвиток міжнародного ринку. Виробники і дослідники стикаються з труднощами у переміщенні матеріалів, обміні інформацією та впровадженні інновацій через різні правові режими. Відсутність єдиних стандартів гальмує прогрес у вивченні та застосуванні Δ⁸-THCA.
Важливим кроком у вирішенні цих проблем може стати розробка міжнародних рекомендацій або протоколів, які б забезпечили стандартизацію підходів до ідентифікації, класифікації і регулювання кислотних форм канабіноїдів. Це сприятиме не лише підвищенню безпеки споживачів, але й стимулюватиме розвиток наукових досліджень, фармацевтичних розробок і відповідальне виробництво.
Висновок:
Дельта-8-тетрагідроканабінолова кислота (Δ8-THCA) – це мало вивчена, але надзвичайно перспективна молекула серед фітоканабіноїдів, що виробляються рослиною Cannabis sativa. Її унікальність зумовлена особливою структурною ізомерністю, яка відрізняє її від більш поширеної Δ9-THCA, зокрема зміщенням подвійного зв’язку у циклі тетрагідроканабінолу. Ця структурна відмінність накладає значний вплив на фізико-хімічні властивості, стабільність, біохімічний синтез, фармакологічні ефекти та можливості синтетичного одержання, що разом формує унікальний профіль цієї кислоти.
У рослині Δ8-THCA утворюється у межах складних біохімічних шляхів, що охоплюють синтез з канабігеролової кислоти (CBGA) за допомогою специфічних ферментів-синтаз, які визначають розгалуження метаболічного шляху на утворення різних канабіноїдних кислот. Однак, у природних умовах концентрації Δ8-THCA надзвичайно низькі, що пояснюється термодинамічною нестабільністю молекули і перевагою формування більш стабільних ізомерів, таких як Δ9-THCA. Ізомеризація подвійного зв’язку, яка зумовлює перетворення Δ9-THCA у Δ8-THCA, є термодинамічно менш вигідною та вимагає специфічних умов або каталізаторів, що значно обмежує природне накопичення Δ8-THCA в тканинах конопель.
Технічний прогрес дозволяє штучно отримувати Δ8-THCA ізомеризацією Δ9-THCA, що дає змогу подолати природні обмеження. Каталізовані реакції за участі кислотних чи основних агентів, при точному контролі параметрів, дозволяють цілеспрямовано змінювати положення подвійного зв’язку у молекулі, зберігаючи при цьому кислотну карбоксильну групу, що є ключовим для збереження властивостей Δ8-THCA. Це відкриває можливості для синтезу великих партій чистої кислоти для подальшого дослідження і потенційного фармацевтичного використання.
Аналітичні методи, зокрема високоефективна рідинна хроматографія (HPLC) у поєднанні з мас-спектрометрією (LC-MS), є критично важливими для надійної ідентифікації і кількісного визначення Δ8-THCA. Важливим аспектом є збереження кислотної форми при аналізі, оскільки навіть незначне підвищення температури або хімічні умови можуть викликати декарбоксилювання і перехід у нейтральні форми, що унеможливлює точну оцінку концентрацій і порушує стандартизацію. Відсутність достатньої кількості високоякісних аналітичних стандартів є серйозною проблемою для метрологічної точності, що утруднює розробку норм і регламентів, необхідних для промислового застосування.
Фармакологічна діяльність Δ8-THCA поки що недостатньо вивчена, проте існують наукові припущення про її здатність впливати на канабіноїдні рецептори CB1 та CB2 навіть у кислотній формі, тобто до декарбоксилювання. Така активність відрізняється від традиційних нейтральних форм канабіноїдів і може пояснювати м’які, але значущі фармакологічні ефекти. Зокрема, молекула демонструє потенціал у модуляції запальних процесів, імунної відповіді та нейрогенної регуляції нудоти, що робить її перспективною для використання у протизапальній та симптоматичній терапії, особливо у пацієнтів з хронічними захворюваннями або онкологією. Втім, відсутність системних in vivo та in vitro досліджень, а також обмежені дані з токсикології не дозволяють остаточно оцінити профіль безпеки, що є ключовою перешкодою для клінічного впровадження.
Вивчення Δ8-THCA як моделі ізомерії розширює розуміння структурно-функціональних взаємозв’язків у канабіноїдній хімії і фармакокінетиці, відкриваючи перспективи для розробки нових, більш ефективних і селективних канабіноїдних сполук. Особливий інтерес викликає можливість утворення похідних Δ8-THCA із зміненими фармакологічними властивостями, що може призвести до створення інноваційних фармацевтичних агентів із унікальним профілем дії і зменшеними побічними ефектами.
Однак правове регулювання Δ8-THCA залишається неоднозначним, оскільки кислотна форма часто перебуває у “сірій зоні” законодавства багатьох країн. Недостатня прозорість у хімічному маркуванні продуктів, що містять Δ8-THCA, разом із відсутністю чітких нормативів щодо її класифікації створюють ризики як для виробників, так і для споживачів. Це ускладнює контроль якості, безпеку застосування і легальність поширення препаратів на основі Δ8-THCA, що є суттєвим викликом для подальшого розвитку індустрії канабіноїдів.
Джерела:
- PubMed Central (PMC) – База наукових статей по канабіноїдах
https://www.ncbi.nlm.nih.gov/pmc/?term=delta+8+THCA - National Center for Biotechnology Information (NCBI) – Канабіноїдні дослідження
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7070560/ - Journal of Natural Products – Біосинтез канабіноїдів
https://pubs.acs.org/doi/10.1021/acs.jnatprod.0c00547 - Frontiers in Pharmacology – Фармакологія та механізми дії канабіноїдів
https://www.frontiersin.org/articles/10.3389/fphar.2021.627908/full - Phytochemistry Reviews – Структурна хімія та ізомерія канабіноїдів
https://link.springer.com/article/10.1007/s11101-019-09604-4 - Analytical Chemistry – Методи хроматографічного аналізу канабіноїдів
https://pubs.acs.org/doi/10.1021/acs.analchem.9b04910 - Cannabis and Cannabinoid Research – Нові підходи до синтезу та ізоляції канабіноїдів
https://www.liebertpub.com/doi/full/10.1089/can.2019.0053 - European Journal of Pharmacology – Токсикологія та безпека канабіноїдів
https://www.sciencedirect.com/science/article/pii/S0014299920302017 - Harvard Medical School – Cannabis Research Overview
https://hms.harvard.edu/news/harvard-experts-cannabis - National Institute on Drug Abuse (NIDA) – Інформація про канабіноїди та дослідження
https://nida.nih.gov/publications/research-reports/marijuana/cannabinoids