Δ⁹-цис-тетрагідроканабінол (Δ⁹-cis-THC) є рідкісним, але хімічно і фармакологічно значущим стереоізомером одного з головних психоактивних компонентів коноплі – Δ⁹-тетрагідроканабінолу. У системі природних фітоканабіноїдів, які продукуються Cannabis sativa L., стереоізомерія має вирішальне значення для біологічної активності молекул. Δ⁹-THC має щонайменше чотири стереоізомери, що виникають внаслідок конфігурації на хіральних центрах у тетрагідроканабінольному каркасі. Із них найвідомішим є транс-ізомер з конфігурацією (−)-(6aR,10aR)-Δ⁹-THC, тоді як цис-форма з конфігурацією (6aS,10aR) залишається об’єктом лише поодиноких досліджень. Вивчення цього ізомеру є необхідним етапом у системному аналізі структурно-активнісних взаємозв’язків серед канабіноїдів.
Фітоканабіноїди не є класично біосинтезованими вторинними метаболітами в сенсі високої ензиматичної стереоселективності. Сучасні дослідження демонструють, що синтази Δ⁹-THC в Cannabis sativa можуть продукувати суміші діастереомерів, зокрема у технічних (індустріальних) сортах з домінуванням CBDA або CBGA. Це означає, що Δ⁹-cis-THC утворюється не лише в результаті штучної ізомеризації в лабораторії, а може бути присутній у слідах у рослинах. Його присутність у природному матеріалі фіксується за допомогою високочутливих методів – рідинної хроматографії у поєднанні з мас-спектрометрією (LC-MS), а також ядерного магнітного резонансу (NMR).
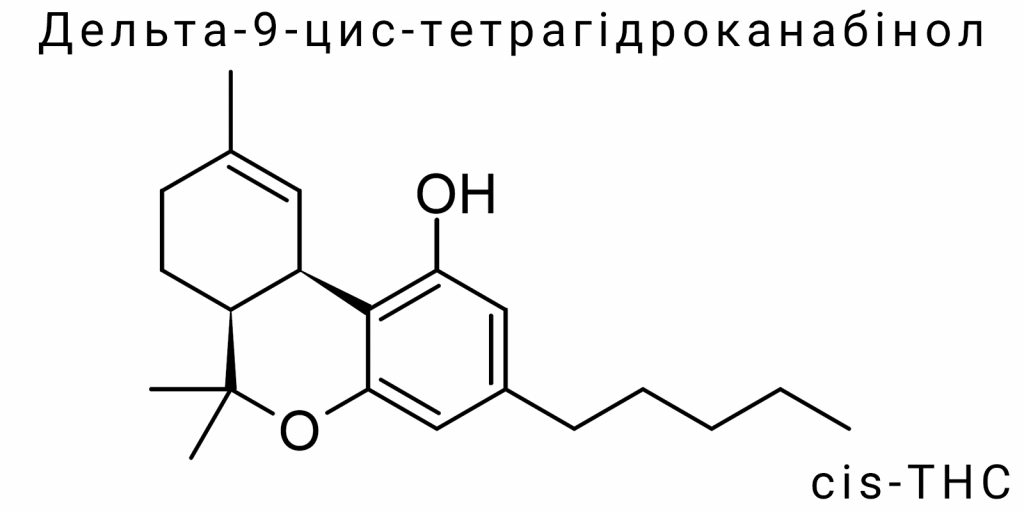
З хімічної точки зору Δ⁹-cis-THC являє собою циклічну тритерпенову сполуку, похідну меротуїної кислоти, з характерною трициклічною системою. Його молекулярна формула – C₂₁H₃₀O₂. Найважливішими структурними елементами є фенольне кільце, терпеновий ланцюг і характерна подвійна зв’язок між C⁹ і C¹⁰. У випадку цис-ізомеру просторове розташування цієї подвійної зв’язку і підгруп навколо хіральних центрів створює особливу конфігурацію, що змінює електронну густину, об’єм молекули та геометрію її взаємодії з біомішенями.
Оскільки Δ⁹-cis-THC є стереоізомером, його отримання в лабораторних умовах зазвичай пов’язане з хімічними методами, які не дають високої енантіоселективності без специфічного каталізу. Поширеними є два підходи: (1) пряма конденсація прекурсорів оліветолу з терпеновими альдегідами, такими як цитраль, або з терпеновими епоксидами – зокрема, (+)-trans-2-карен оксидом – у присутності кислотних каталізаторів (наприклад, BF₃·Et₂O); (2) кислотно-каталізована ізомеризація більш стабільних ізомерів, таких як канабіхромен (CBC), яка супроводжується перерозподілом конфігурації подвійного зв’язку і хіральних центрів. Обидва підходи дають суміш діастереомерів, з якої Δ⁹-cis-THC необхідно очищати методом хроматографії. Синтетичний вихід зазвичай є помірним, а стереоселективність потребує додаткових етапів очищення або кристалізації.
Біологічна дія Δ⁹-cis-THC оцінюється за його здатністю зв’язуватись із канабіноїдними рецепторами першого (CB1) та другого (CB2) типу. На відміну від trans-ізомеру, який є повним агоністом CB1 з високою афінністю, Δ⁹-cis-THC має значно нижчу спорідненість до цього рецептора, що свідчить про слабку або часткову агоністичну дію. Це знижує його психоактивність і водночас підвищує його інтерес як потенційного канабіноїду з терапевтичним профілем без центральних побічних ефектів. Дослідження in vivo на моделях мишей показують, що Δ⁹-cis-THC все ще здатний індукувати типову канабіноїдну тріаду ефектів (гіпотермія, аналгезія, зниження активності), хоча з меншою інтенсивністю.
Наразі фармакокінетичні профілі Δ⁹-cis-THC залишаються в значній мірі невивченими. Очікується, що його ліпофільність, біодоступність та метаболічні шляхи в печінці за участі цитохрому P450 будуть подібними до інших канабіноїдів. Однак стереохімія здатна істотно впливати на швидкість метаболічного розпаду та формування активних метаболітів, зокрема 11-гідрокси-Δ⁹-THC – основного психоактивного метаболіту. Ймовірно, що Δ⁹-cis-THC метаболізується повільніше або з утворенням менш активних похідних, що може бути сприятливим з погляду токсикокінетики.
Наразі Δ⁹-cis-THC не є об’єктом контролю як окрема речовина в більшості юрисдикцій, включно зі списками ООН. Унаслідок цього він може вивчатись вільніше в межах фундаментальної науки або фармакологічних досліджень. Проте, з огляду на структурну подібність до Δ⁹-trans-THC, регуляторні органи можуть інтерпретувати його як аналог, що ставить під сумнів законність його обігу залежно від юрисдикції. В контексті медичної коноплі цей ізомер не є стандартним компонентом, що вносить додаткову невизначеність у розробку продуктів на його основі.
Вивчення Δ⁹-cis-THC не лише дозволяє краще зрозуміти тонкощі канабіноїдної фармакології, а й може сприяти створенню нових терапевтичних засобів. Його потенціал як нефулльного агоніста CB1/CB2 рецепторів може бути релевантним для умов, де потрібна помірна модуляція ендоканабіноїдної системи – зокрема, у випадках хронічного болю, спастичності, нейрозапалення або тривожних розладів. У поєднанні з іншими канабіноїдами або як окрема субстанція, Δ⁹-cis-THC відкриває можливості для створення більш контрольованих, таргетованих фармацевтичних форм без сильної психоактивної дії.
Хімічна структура та стереохімія Δ⁹-cis-THC
Δ⁹-цис-тетрагідроканабінол (Δ⁹-cis-THC) є одним зі стереоізомерів Δ⁹-тетрагідроканабінолу, основної психоактивної складової канабісу. Його унікальність полягає в специфічному просторовому розміщенні атомів навколо хіральних центрів і подвійного зв’язку, що формує так звану “цис”-конфігурацію. Цей стереоізомер відрізняється від природного активного транс-ізомеру (−)-(6aR,10aR)-Δ⁹-THC, який домінує в більшості хемотипів Cannabis sativa L..
Хімічно Δ⁹-cis-THC є трициклічним терпеновим фенолом, похідним канабігеролової кислоти (CBGA), який є спільним біосинтетичним попередником для багатьох фітоканабіноїдів. Молекулярна формула Δ⁹-THC залишається сталою для всіх його стереоізомерів: C₂₁H₃₀O₂, молекулярна маса – 314.46 г/моль. Різниця полягає у просторовому розташуванні атомів в молекулі, зокрема навколо хіральних центрів у положеннях C6a і C10a тетрагідроканабінольного скелету.
У Δ⁹-cis-THC ці хіральні центри мають конфігурацію (6aS,10aR), тоді як у активного транс-ізомеру – (6aR,10aR). Це впливає на геометрію кільця і позицію метильної та пентилової груп, що визначає здатність молекули до зв’язування з канабіноїдними рецепторами. Структурна формула передбачає наявність одного фенольного гідроксилу (в положенні 1), аліфатичної пентильної бічної групи (в положенні 3), подвійного зв’язку між атомами C9-C10 і терпенового фрагмента, що замкнутий у тетрагідроканабінольне кільце.
Стереоізомери, і зокрема діастереомери Δ⁹-THC, відрізняються не лише просторово, але й у фізико-хімічних характеристиках: температурі плавлення, оптичному обертанні, розчинності, хроматографічній рухливості. У контексті Δ⁹-cis-THC ці параметри дозволяють відділити його від інших форм за допомогою хіральної ВЕРХ (високоефективної рідинної хроматографії) або тонкошарової хроматографії з використанням спеціалізованих розчинників.
З синтетичної точки зору Δ⁹-cis-THC можна отримати за кількома схемами. Перший підхід полягає у кислотно-каталізованій конденсації оліветолу з цитралем, яка дає суміш ізомерів Δ⁹-THC, серед яких присутній і цис-ізомер. Альтернативно, реакція оліветолу з (+)-trans-2-карен-оксидом у присутності BF₃·Et₂O може призвести до переважного утворення саме Δ⁹-cis-THC. Також можливе отримання через ізомеризацію канабіхромену (CBC), що циклізується в Δ⁹-ізомери в присутності борфтористого етеру. Усі ці методи потребують подальшого хроматографічного очищення, оскільки продукти зазвичай є сумішами транс/цис-діастереомерів.
Крім хімічного синтезу, цис-форма може зустрічатись у слідах у натуральній коноплі, зокрема в сортах з високим вмістом CBD або у так званих “non-psychoactive” хемотипах. Проте у медичних сортах з високим вмістом Δ⁹-trans-THC, як Bedrocan, рівень цис-ізомеру зазвичай не перевищує 0.1%. Його детекція можлива завдяки комбінації LC-MS/MS і ядерного магнітного резонансу з двовимірною кореляцією (2D-NMR COSY, HSQC, HMBC), які дозволяють відрізнити стереоізомери за хімічними зсувами і спін-спіновими зв’язками.
З точки зору взаємодії з біологічними системами, просторове розміщення бічної алкільної групи, а також орієнтація фенольного кільця мають вирішальне значення для зв’язування з рецепторами CB1 і CB2. Δ⁹-cis-THC демонструє знижене зв’язування з рецептором CB1 порівняно з транс-ізомером, що можна пояснити зміщенням ключових груп від оптимальної орієнтації у сайті зв’язування. Це, ймовірно, є причиною зниження психоактивного потенціалу та можливого часткового агонізму.
Термодинамічна стабільність цис-ізомеру нижча, ніж транс-форми, що проявляється у його схильності до подальшої ізомеризації за нагрівання, впливу світла або кислот. Це важливо з огляду на розробку стабільних фармацевтичних форм: Δ⁹-cis-THC вимагає ретельної оптимізації умов зберігання, включаючи температурний режим, відсутність УФ-випромінення та інертну атмосферу.
Наявність хіральних центрів робить Δ⁹-cis-THC оптично активною речовиною. Зазвичай його описують як (−)-(6aS,10aR)-Δ⁹-THC, проте можливе існування й енантіомерів (+(6aR,10aS)-форма), залежно від умов синтезу. Їхня біологічна активність буде відмінною, оскільки рецепторна афінність є енантіоселективною. Це ще один аргумент на користь застосування хіральної хроматографії при аналізі отриманих продуктів.
Структурна формула Δ⁹-cis-тетрагідроканабінолу
Молекула Δ⁹-cis-тетрагідроканабінолу (Δ⁹-cis-THC) представляє собою високоорганізовану органічну структуру класу трициклічних канабіноїдів. Його базова хімічна формула – C₂₁H₃₀O₂ – залишається сталою для всіх стереоізомерів Δ⁹-THC, однак просторове розміщення функціональних груп та конфігурація кільцевих систем відрізняються, що обумовлює унікальні фізико-хімічні й біологічні властивості саме цис-форми. У цьому розділі зосереджено лише на аспектах, які безпосередньо стосуються формальної структурної організації Δ⁹-cis-THC, виключаючи розгляд стереохімії чи рецепторної активності, що буде детально висвітлено в інших частинах.
Молекулярна архітектоніка Δ⁹-cis-THC включає три конденсованих кільця: частково насичене циклогексенове кільце (B), бензольне фенольне ядро (A) і тетрагідропіранове кільце (C), яке разом формують канабіноїдний трициклічний скелет. Вихідною точкою для аналізу структурної формули є канабігеролове ядро, яке в процесі біогенезу чи хімічного синтезу перетворюється на Δ⁹-ізомери, включно з цис-формою. Для точного опису використовують нумерацію атомів, затверджену ІЮПАК: починаючи з фенольного кільця, атоми пронумеровані від 1 до 10a, що дозволяє чітко локалізувати функціональні групи в контексті реакційної здатності та аналітичного розпізнавання.
Фенольне кільце (A) має гідроксильну групу в положенні C1, яка бере участь у водневому зв’язуванні та може бути заміщена або модифікована в синтетичних похідних. Паралельно до нього, у положенні C3, приєднана пентильна алкільна бічна група (−C₅H₁₁), яка є ключовим детермінантом ліпофільності молекули. Дана бічна група не лише впливає на розчинність Δ⁹-cis-THC у ліпідному середовищі, а й визначає афінність до трансмембранних доменів рецепторів. Попри це, у межах структурної формули вона розглядається як незмінна аліфатична ланка без реакційно активних центрів.
Центральне циклогексенове кільце (B) містить подвійний зв’язок між атомами C9 і C10, що є характерною ознакою саме Δ⁹-ізомерів. Розміщення цього подвійного зв’язку у площині кільця створює умови для існування цис- та транс-діастереомерії. У випадку Δ⁹-cis-THC, два замісники (група у положенні 6a і 10a) розташовані з одного боку відносно площини подвійного зв’язку. Це розміщення змінює конформацію кільця і впливає на електронну густину навколо подвійного зв’язку, що може бути детектовано методами ЯМР та ІЧ-спектроскопії.
Кільце C – це тетрагідропірановий фрагмент, замкнений у результаті внутрішньомолекулярного циклічного з’єднання між терпеновим ланцюгом і фенольним кільцем. У структурній формулі це шестичленне гетероциклічне кільце з атомом кисню в положенні C1′, яке не має подвійних зв’язків, але здатне до гнучкої конформації. Цей фрагмент є ключовим для формування стабільної трициклічної структури молекули. Його орієнтація жорстко фіксована в результаті цис-конфігурації на сусідньому циклогексеновому кільці, що визначає загальний об’єм і топологію молекули.
Ключова особливість Δ⁹-cis-THC у тому, що подвійний зв’язок Δ⁹ (між C9 та C10) обумовлює планарність частини молекули, яка фіксує орієнтацію об’ємних замісників. У цис-формі обидва метильні замісники (на 6a і 10a) виявляються розташованими з одного боку відносно площини кільця, що вносить просторову асиметрію. Ця конфігурація не є енергетично найвигіднішою – саме тому транс-ізомер стабільніший – однак у межах конкретних умов синтезу або біосинтезу може формуватися як домішка чи цільовий продукт.
З позиції електронної структури, молекула містить один фенольний гідроксил, що проявляє кислотні властивості (pKa ≈ 10.6), а також подвійний зв’язок, що визначає спектроскопічні властивості (характеристичне поглинання в УФ-діапазоні 210-280 нм). Також значення має діелектричний вплив пентильної групи на електронну густину в ароматичному кільці. Розміщення всіх цих груп формує індивідуальний хроматографічний профіль Δ⁹-cis-THC, який можна легко відокремити від інших ізомерів за допомогою HPLC, TLC або GC з селективним детектуванням.
Для побудови повної структурної формули важливо враховувати тетрагідроканабінольний скелет, який має 6 хіральних центрів, проте лише два з них є конфігураційно визначальними (6a і 10a), решта можуть перебувати в динамічній рівновазі внаслідок ротаційної гнучкості. У структурній формулі вони фіксуються умовно в положенні, яке забезпечує цис-конфігурацію, проте реальна молекула може проявляти деяку рухливість у розчинах.
Наявність у Δ⁹-cis-THC трьох кільцевих систем створює складну систему сполучених орбіталей, що робить молекулу спектроскопічно активною у ряді діапазонів. Саме це дозволяє використовувати інструментальні методи аналізу (2D-NMR, DEPT, COSY, HSQC) для детальної верифікації структури. У процесі повної характеристизації структурної формули Δ⁹-cis-THC зазвичай використовують методи XRD (рентгеноструктурного аналізу), коли речовину вдається кристалізувати, або мас-спектрометрію високої роздільності (HRMS) з аналізом фрагментації.
Ще одним аспектом структурної формули Δ⁹-cis-THC є наявність потенційно реакційноздатних центрів для хімічної модифікації: фенольний гідроксил можна естерифікувати або етерифікувати, пентильний ланцюг – подовжити або замінити, а подвійний зв’язок – піддати гідруванню. Ці перетворення дозволяють створити серію структурно споріднених аналогів, проте первинна структура Δ⁹-cis-THC залишається унікальною.
Стереохімічна конфігурація Δ⁹-цис-тетрагідроканабінолу
Стереохімічна конфігурація Δ⁹-цис-тетрагідроканабінолу (Δ⁹-cis-THC) є ключовим параметром, що визначає його фізико-хімічні властивості, реакційну здатність, стабільність та специфіку молекулярного розпізнавання. На відміну від багатьох низькомолекулярних сполук, де стереохімія обмежується окремими хіральними центрами, у випадку Δ⁹-cis-THC вона охоплює взаємозалежну систему, в якій беруть участь як стереогенні центри, так і геометричне розташування замісників відносно площини подвійного зв’язку. Вивчення цієї конфігурації необхідне для точного розуміння механізмів його утворення, потенційної біоактивності, а також умов селективного синтезу.
У молекулі Δ⁹-cis-THC наявні кілька хіральних центрів, однак для характеристики цис-ізомерії ключовими є два атоми в положеннях 6а та 10а. Їх абсолютна конфігурація визначається за системою Cahn-Ingold-Prelog (CIP) і позначається як 6аS,10аR для найчастіше описуваного енантіомеру Δ⁹-cis-THC. Відмінною рисою цис-ізомеру є орієнтація замісників на цих позиціях з одного боку площини, утвореної циклогексеновим кільцем. Це розміщення різко контрастує з більш термодинамічно стабільною транс-конфігурацією, де замісники орієнтовані по різні сторони площини. Саме ця орієнтація визначає характер конформаційного блокування та зміну топології молекули в тривимірному просторі.
Подвійний зв’язок у положенні Δ⁹ (між атомами C9 і C10) виступає ключовим елементом у формуванні діастереомерів. Система планарного π-зв’язку жорстко фіксує положення атомів і виключає вільну ротацію, що дозволяє стабілізувати просторову орієнтацію двох суміжних фрагментів – циклогексенового кільця та тетрагідропіранового циклу. У конфігурації “цис” метильна група в положенні 10а і водень на 6а опиняються по одну сторону відносно площини, що обумовлює зміну кута між кільцями A-B та B-C. Як наслідок, молекула приймає більш компактну, згорнуту конформацію, на відміну від розгорнутої транс-орієнтації. Ця різниця в архітектоніці суттєво впливає на енергетичний профіль молекули та її взаємодії з навколишнім середовищем.
Крім конфігурації на подвійних зв’язках, також важливо розглянути локальну стереохімію в межах тетрагідропіранового кільця, зокрема у положеннях C1′, C4′ та C6′. Хоча ці атоми не є класично хіральними у всіх випадках, через гнучкість кільця вони здатні формувати напівавтоматично фіксовані псевдохіральні конфігурації, які можуть відігравати роль у механізмах молекулярного розпізнавання. Прикметно, що в Δ⁹-cis-THC тетрагідропірановий фрагмент орієнтований таким чином, що атом кисню, включений у кільце, наближається до площини циклогексену, що зменшує об’ємну доступність частини молекули та посилює її конформаційну жорсткість.
Стереохімічна поведінка Δ⁹-cis-THC є об’єктом інтенсивного аналізу методом двовимірної ЯМР-спектроскопії (COSY, NOESY, ROESY), де міжядерні кореляції дозволяють встановити просторову близькість атомів незалежно від їхньої ковалентної зв’язності. Наприклад, на основі NOE-ефектів можна точно ідентифікувати цис-орієнтацію між воднями в положеннях 6а і 10а. Зменшена інтенсивність NOE у порівнянні з транс-ізомером додатково верифікує ступінь скручування кільцевої системи та підтверджує існування згортаної конформації. Така стереохімічна організація впливає не лише на спектроскопічні характеристики, а й на кінетику реакцій із зовнішніми реагентами.
Дослідження конфігураційної стабільності Δ⁹-cis-THC виявляє, що ця форма є менш стабільною у порівнянні з транс-ізомером, що підтверджується як розрахунками методами DFT, так і емпіричними даними щодо термодинаміки ізомеризації. У неводному середовищі та при наявності протонних кислот можливий перехід з цис- у транс-форму за механізмом електрофільної активації подвійного зв’язку, що супроводжується інверсією конфігурації. Саме тому при синтезі Δ⁹-cis-THC велике значення має контроль температури та середовища реакції для запобігання рацемізації або ізомеризації.
Енантіомерна чистота Δ⁹-cis-THC, хоча і не є визначальною для існування цис-орієнтації, має істотне значення в контексті біологічного розпізнавання. В природі найчастіше зустрічається (-)-енантіомер, що відповідає конфігурації 6аS,10аR. Однак синтетичні методи можуть продукувати суміші енантіомерів, що потребують розділення хіральною хроматографією. Встановлення абсолютної конфігурації, як правило, здійснюється шляхом порівняння експериментальних оптичних обертань з теоретичними даними, обчисленими методом TD-DFT, або шляхом рентгеноструктурного аналізу хіральних похідних.
Інтегральна стереохімія Δ⁹-cis-THC впливає на параметри молекулярної динаміки: утворення внутрішньомолекулярних водневих зв’язків, гнучкість ланцюгів та можливість індукованої фітоселективної взаємодії. Наприклад, порівняно з транс-ізомером, цис-форма має нижчий дипольний момент, що знижує її розчинність в полярних середовищах і змінює розподіл у мембранах. Це також змінює ймовірність інтеркаляції в ліпідний бішар, впливаючи на фармакокінетичні параметри. Однак у межах даного розділу акцент лишається саме на стереохімічній природі, а не на функціональних наслідках.
Додатково слід врахувати, що цис-ізомери, на відміну від транс-форм, не завжди утворюють кристалічні фази з чітким просторовим упакуванням. Це ускладнює використання рентгеноструктурного аналізу, однак полегшує спектроскопічну ідентифікацію. Конформаційна рухливість цис-форми дозволяє отримати більш виражені спектри в ІЧ- та ЯМР-аналізі, особливо при варіації температури або pH. Це робить можливим побудову конформаційних карт молекули, які описують зміни її структури залежно від зовнішніх умов.
Методи синтезу Δ⁹-цис-THC
Синтез Δ⁹-цис-тетрагідроканабінолу (Δ⁹-цис-THC) належить до особливо складних завдань сучасної органічної хімії через необхідність високої стереоселективності, обмежену термодинамічну стабільність цис-ізомеру та хімічну чутливість функціональних груп. Цей канабіноїд має ізомерну різницю в конфігурації подвійного зв’язку, що критично впливає на біологічні властивості молекули. Методи синтезу цільової молекули орієнтовані на досягнення контролю над просторовим розміщенням зв’язків у центральній частині трициклічної системи. Успішна стратегія повинна поєднувати ефективне утворення вуглецевого каркасу з точним управлінням конфігураційною цілісністю на пізніх етапах.
Класичний підхід до синтезу канабіноїдів базується на з’єднанні оліветолу (5-пентилрезорцинолу) з терпеноїдною структурою, найчастіше похідним цитралю або α-пінену, з подальшою циклізацією для формування канабіноїдного каркасу. Для Δ⁹-цис-THC цей маршрут зазнає істотних модифікацій. Початкові стадії будуються так, щоб запобігти утворенню більш термодинамічно сприятливого транс-ізомеру. Важливим фактором є вибір захисних груп для фенольних фрагментів та умов активації альдегідів, щоб мінімізувати побічні реакції та неконтрольовану ізомеризацію.
Для забезпечення стереоспецифічного утворення Δ⁹-цис-ізомеру використовуються реакції кислотно-каталізованої циклізації з ретельно підібраною температурою, розчинником і концентрацією реагентів. Наприклад, використання бортрифторид-етерових комплексів дозволяє спрямувати утворення циклу через механізм карбокатіонного утворення з подальшою індукованою атакою нуклеофільного центру, що сприяє цис-орієнтації замісників у шестичленному кільці. Незважаючи на певну ефективність цього підходу, реакційна суміш зазвичай містить суміш ізомерів, тому подальша стадія розділення є обов’язковою.
Після одержання проміжної структури, яка включає подвійний зв’язок у положенні Δ⁹, важливо забезпечити збереження цис-конфігурації під час усіх наступних операцій. Навіть незначне нагрівання чи дія кислотно-основних середовищ можуть викликати інверсію подвійного зв’язку або переміщення його позиції в межах кільця. Тому наступні реакції – наприклад, відновлення, етерифікація чи функціоналізація – здійснюються у суворо контрольованих умовах, з мінімізацією часу реакції, температури та концентрації кислот або основ.
Альтернативним підходом є синтез із застосуванням асиметричних допоміжних груп, що впливають на просторову орієнтацію молекули вже на ранніх етапах. Наприклад, використання хіральних боронових ефірів у реакціях алкілування дозволяє індукувати цис-орієнтацію замісників, що пізніше транслюється в правильну стереохімію кінцевого продукту. Такі підходи, хоч і менш масштабовані, демонструють потенціал у лабораторному середовищі для синтезу чистого Δ⁹-цис-ізомеру без потреби в подальшій ізомеризації.
Окрему категорію методів становлять ізомеризаційні стратегії, де спочатку свідомо синтезується Δ⁹-транс-THC, а потім здійснюється контрольована ізомеризація до цис-форми. Такі методи використовують фотоіндуковану або кислотно-каталізовану інверсію конфігурації. Застосування фотохімічних реакторів з контролем довжини хвилі та експозиції дозволяє індукувати селективну інверсію без розриву інших зв’язків у молекулі. Для цього найчастіше використовуються органічні сенсибілізатори (наприклад, бензофенон) або іридієві комплекси, здатні ефективно передавати енергію на подвійний зв’язок без розщеплення каркасу.
Незважаючи на перспективність фотохімічних методів, вони потребують глибокої оптимізації: інтенсивність освітлення, довжина хвилі, полярність середовища і концентрація реагентів повинні бути підібрані так, щоб не виникали побічні фотоокислювальні процеси або утворення полімеризованих побічних продуктів. Ізомеризація під дією ультрафіолету, хоч і потенційно ефективна, є чутливою до присутності домішок кисню, тому реакція зазвичай проводиться в інертній атмосфері (азот або аргон).
Ще одним стратегічним напрямом є застосування мікрофлюїдних реакційних середовищ. У таких системах контроль над часом контакту реагентів, температурою та геометрією потоку дає змогу досягти високого ступеня відтворюваності стереохімічних результатів. Реакційні умови можна змінювати в реальному часі, а вихід продукту виводити безпосередньо на аналітичну систему для контролю чистоти цільового ізомеру. Це особливо цінно при масштабуванні процесу або для комбінаторного дослідження варіантів умов синтезу.
Незалежно від обраного маршруту, остаточна стадія синтезу Δ⁹-цис-THC – це хроматографічне очищення і виділення ізомеру. Для цього використовують методи високоефективної рідинної хроматографії (HPLC) з хіральними стаціонарними фазами, що дозволяє досягти селективного розділення навіть структурно близьких діастереомерів. Також застосовуються гравіметричні методи з використанням специфічних комплексоутворювачів, здатних вибірково зв’язувати цис-ізомер.
Класичні методи синтезу
Синтез Δ⁹-цис-тетрагідроканабінолу (Δ⁹-цис-THC) у лабораторних умовах історично розвивався на основі методології, спрямованої на побудову трициклічної системи, характерної для класу тетрагідроканабінолів. Основними класичними підходами є кислотно-каталізовані реакції конденсації між фенольними прекурсорами, такими як оліветол, та терпеноїдними компонентами – зокрема, похідними монотерпенів, які забезпечують циклічний фрагмент молекули. У разі синтезу цис-ізомерів, ключовим чинником є контроль просторової орієнтації замісників під час циклізації, що досягається варіацією реакційних умов, вибором розчинника, температурного режиму й каталізатора.
Одним із найбільш відомих підходів є реакція оліветолу (5-пентилрезорцину) з (+)-транс-2-карен оксидом або з цитралем у присутності кислот Льюїса або протонних кислот. При цьому саме умови реакції впливають на конфігурацію утвореної канабіноїдної структури. Використання борфторметилетера (BF₃·Et₂O) в етерних або хлорованих розчинниках забезпечує електрофільну активацію терпеноїдного компонента, який, у подальшому, атакує нуклеофільний центр оліветолу, утворюючи карбонієвий проміжний продукт. Залежно від температури та концентрації каталізатора, можливе утворення різних ізомерів, включно з Δ⁹-цис-THC.
Особливо важливо, що саме конфігурація циклічного монотерпенового компонента – наприклад, цитралю – визначає можливість формування цис-конфігурації у фінальному продукті. У випадку використання гераніалізованих похідних як електрофілів, зокрема цитралю або мікроконфігурацій ліналоолу, виявлено утворення Δ⁹-цис-THC з помірною селективністю. Проте у більшості класичних методів селективний контроль над цис- або транс-ізомеризацією не є повністю гарантованим, що зумовлює необхідність подальшого хроматографічного розділення ізомерів.
Також варто звернути увагу на кислотно-ініційовану конденсацію оліветолу з цитралем у бензольному середовищі при наявності гідрохлоридної кислоти (HCl), що призводить до утворення канабіноїдного карбоциклу з подальшою циклізацією. У цьому підході відмічено, що варіація мольного співвідношення реагентів (наприклад, 1:1.2 або 1:2) значно впливає на вихід цис-ізомерів. Цікаво, що в протоннокислотному середовищі реакція протікає з переважним утворенням Δ⁹-ізомерів, причому при знижених температурах (0-5 °C) формується вища частка цис-форми.
Іншим класичним варіантом є використання сесквітерпенових епоксидів, зокрема похідних кариофілену, які у присутності кислот Льюїса зазнають кільцеподібного розкриття з утворенням відповідних катіонів. Такі катіони можуть атакувати оліветол, утворюючи трициклічну структуру з цис-орієнтацією залежно від орієнтації початкового епоксиду. За аналогічним принципом застосовуються і ментолові похідні, які в реакції з фенольними компонентами в кислому середовищі утворюють суміші ізомерів Δ⁹-THC з домішками цис-конфігурацій.
Ще одним хіміко-технічним аспектом класичних методів є контроль за вологістю реакційного середовища. Для реакцій, де утворюється цис-ізомер, критично важливою є абсолютна сухість реагентів і розчинників, оскільки навіть сліди води призводять до гідратації проміжних катіонів і побічного утворення спиртів або етерів, що знижує загальний вихід цис-THC.
Класичні методи також включають термічно контрольовану циклізацію відповідних канабіноїдних спиртів у кислому середовищі. При цьому фенольна група в положенні 1 реагує з аліфатичним ланцюгом або ізопреновим компонентом при каталітичному нагріванні у присутності PPA (поліфосфорної кислоти), що дозволяє формувати третинні центри з певною стереохімією. Тут термічні параметри впливають не лише на швидкість реакції, але й на співвідношення цис- та транс-продуктів.
Необхідно також відзначити, що в багатьох класичних протоколах, які історично орієнтовані на синтез Δ⁹-trans-THC, цис-ізомер утворюється як побічний продукт із селективністю 5-15%, проте сучасна ретросинтетична інтерпретація дозволяє оптимізувати умови так, щоб збільшити вихід цис-форми. Це, зокрема, включає застосування сильніших електрофільних активаторів, як-то SnCl₄ або AlCl₃, і використання етероароматичних розчинників (наприклад, метиленхлориду або толуолу) зі стабілізуючими властивостями до проміжних катіонів.
Крім того, розглядалося використання конденсаційних умов на твердих кислотах, таких як силікагель, імпрегнований кислотами Льюїса. В цих випадках каталітична дія твердої фази дозволяє проводити реакцію у гетерогенних умовах з мінімальним утворенням побічних продуктів. При цьому було відмічено, що Δ⁹-цис-THC переважно формується за температур 40-60 °C протягом 6-8 годин, у той час як транс-ізомери вимагають вищих температур.
Також деякі варіанти класичних протоколів розглядають багатоетапний підхід: спочатку проводиться побудова ізопренової бічної групи з контрольованою геометрією (наприклад, з використанням Z-алкенів), після чого відбувається стадія циклізації із збереженням цис-конфігурації за допомогою стереоселективного індуктора. Такі протоколи теоретично дають можливість спрямованого синтезу Δ⁹-цис-THC, хоча їхня практична реалізація обмежується низькою загальною ефективністю.
Ізомеризація з інших канабіноїдів
Ізомеризація канабіноїдів, зокрема перетворення нейтральних фітоанабіноїдів на ізомерні форми Δ⁹-THC, є одним з ключових методів отримання рідкісних структур, включаючи Δ⁹-цис-тетрагідроканабінол. Цей процес базується на внутрішньомолекулярних перебудовах, зумовлених реакціями перегрупування, епімерації або транскоригування подвійних зв’язків у присутності каталізаторів. Вибір вихідної речовини критично впливає на ефективність отримання цис-ізомеру. Основну увагу зосереджено на перетворенні канабіхромену (CBC) і канабідіолу (CBD), з використанням кислот Льюїса або м’яких протонних кислот у контрольованих температурних умовах.
Ізомеризація канабіхромену – потенційне джерело отримання Δ⁹-цис-THC, оскільки структура CBC включає прецизійно орієнтовані електронні області, які схильні до електрофільних перегрупувань. CBC – біциклічний фітоанабіноїд з відкритою пренільною бічною групою, що дозволяє ініціювати циклізацію в присутності кислот. Під дією BF₃·Et₂O у неполярному розчиннику (наприклад, дихлорметан) відбувається міграція подвійного зв’язку з утворенням карбокатіону в положенні 2 пренільного фрагмента. Подальша циклізація забезпечує утворення трициклічної канабіноїдної системи. У разі контролю температури в межах 0-10 °C можлива переважна генерація цис-орієнтації у фрагменті 6а-10а. Цей механізм підтримується даними спектроскопічного моніторингу реакції, де спостерігається формування цис-продукту на початкових стадіях, із поступовим зменшенням селективності при підвищенні температури або концентрації BF₃.
Варіанти ізомеризації CBC також передбачають використання твердих кислотних носіїв, таких як цеоліти або сульфовані карбонові смоли, що забезпечують гетерогенну середу з обмеженим просторовим доступом до реакційного центру. Така конформаційна ізоляція дозволяє переважно утворювати цис-ізомер завдяки затрудненому обертанню проміжного катіону. Крім того, за участі твердофазових каталітичних систем можливе зменшення утворення деградованих або полімеризованих побічних продуктів, що характерно для рідиннофазної ізомеризації.
Канабідіол (CBD) – другий стратегічний субстрат для отримання Δ⁹-цис-THC. Його бісфенольна структура з двома гідроксильними групами дозволяє проводити елекрофільно-ініційовану циклізацію в умовах кислого каталізу. У класичних протоколах ізомеризації CBD до Δ⁹-trans-THC домінує транс-продукт, проте при варіації умов, зокрема зниженні температури, зміні типу кислотного каталізатора (наприклад, використання хлоридів олова чи бору), а також підборі розчинника з високою діелектричною проникністю, спостерігається підвищення частки Δ⁹-цис-ізомеру.
Ключовий механізм полягає у формуванні карбокатіонного проміжного продукту через протонування або комплексоутворення з каталізатором у положенні 1 фенольного кільця, після чого відбувається нуклеофільна атака пренільного фрагмента з утворенням тетрагідробензопіранової системи. Просторове орієнтування атакуючої групи на стадії циклізації визначає конфігурацію 6а,10а-центрів. Зниження температури й використання стерично громіздких кислот (наприклад, тріфтороацетатів металів) дозволяє створити кінетично контрольовані умови, за яких цис-ізомер утворюється з вищою селективністю.
Паралельно досліджується вплив електронної модифікації CBD перед ізомеризацією. Так, попереднє ацилювання гідроксильних груп або селективне заміщення на етерні похідні, наприклад CBD-діацетат або CBD-діетилетер, змінює електронну щільність у критичних позиціях і зменшує швидкість рекомбінації продуктів. У таких умовах спостерігалося підвищення виходу цис-продуктів після термічної деградації або подальшого гідролізу.
Ще одним механізмом є епімерація існуючих Δ⁹-trans-THC в присутності специфічних кислотних середовищ, які каталізують інверсію конфігурації на стереоцентрі 6а. Такі реакції типово відбуваються за участю м’яких протонних кислот, наприклад, HCl або p-TsOH у розчинниках типу тетрагідрофурану або 1,4-діоксану. Температурна індукція (45-60 °C) сприяє перебудові подвійного зв’язку й асиметричного вуглецю, внаслідок чого транс-ізомер переходить у цис-форму. Цей підхід зазвичай супроводжується частковим утворенням Δ⁸-ізомерів, однак хроматографічна ізоляція дозволяє очистити Δ⁹-цис-THC до аналітичної чистоти.
Додатково, описані реакції ізомеризації з канабігеролу (CBG) за участі послідовного окиснення з утворенням CBGA-похідного та подальшої циклізації в присутності кислот. У присутності кислоти Льюїса окиснений пренільний фрагмент активується до утворення іонного проміжного продукту, який утворює тетрагідроканабінол з непередбачуваним співвідношенням ізомерів. У спеціальних умовах (зокрема при екстрагуванні в іонній рідині) частка Δ⁹-цис-THC може досягати 20-25%.
Іншим перспективним напрямом є використання біокаталізу для цис-орієнтованої ізомеризації. Деякі ензими, зокрема канабідіолові оксидази, у комбінації з кислим рН середовища здатні каталізувати стереоселективну циклізацію CBD до форм, які переважно відповідають цис-орієнтації. Даний метод перебуває на стадії розробки, однак уже продемонстровано, що ферментативна активність зменшується у присутності розчинників типу DMSO або EtOAc, водночас у м’яких буферних системах (фосфатні або цитратні буфери, pH 5.2-5.8) продуктивність ферменту стабілізується.
З метою збільшення селективності до Δ⁹-цис-THC також застосовуються фотохімічні методи. Ізомеризація CBD під ультрафіолетовим випромінюванням у присутності фотосенсибілізаторів (наприклад, бензофенон) дозволяє активувати подвійні зв’язки до фототропної трансформації, що завершується в циклізації з утворенням цис-конфігурації. Такий підхід, однак, має низьку масштабованість через непередбачувану конкуренцію з процесами фотоокиснення.
Сучасні підходи
Сучасні методи синтезу Δ⁹-цис-тетрагідроканабінолу відходять від класичних поетапних реакцій у бінарних розчинниках і кислотних середовищах, спрямовуючи зусилля на підвищення продуктивності, селективності, безпеки й екологічності процесу. Ключовим напрямом є застосування технологій безперервного потоку, мікрохвильового нагрівання, каталітичних систем з унікальними лігандами та використання інноваційних реакційних середовищ, зокрема іонних рідин і суперзріджених газів. Також значна увага приділяється розробці методів селективної стереоконтрольованої каталізи для формування цис-ізомеру.
Безперервний потік синтезу (continuous flow synthesis) представляє собою систему, де реагенти безперервно подаються у реактор малого об’єму, де відбуваються хімічні перетворення під ретельно контрольованими температурою, тиском і часом перебування реагентів. Така методика дозволяє мінімізувати реакційний час від кількох годин у класичних реакторах до хвилин або секунд. Важливим є можливість точного регулювання параметрів, що забезпечує високу селективність утворення Δ⁹-цис-THC за рахунок зменшення термічної розкладаності та побічних реакцій, які характерні для традиційних методів. Перевага також полягає у зниженні витрат реагентів і розчинників, що позитивно позначається на екологічному профілі синтезу. Використання компактних реакторів зі змішувачами мікроканальної архітектури забезпечує гомогенність реакційної суміші, що сприяє підвищенню конверсії вихідних речовин у цис-ізомер. Окрім того, інтеграція онлайн-аналітичних методів, таких як спектроскопія ІЧ або УФ-Видимого, дозволяє оперативно коригувати умови процесу для підтримання оптимальної селективності.
У сфері каталізу відбувається інтенсивна розробка комплексів металів перехідної групи з органічними лігандами, які забезпечують високу стереоселективність циклізації і стабілізацію карбокатіонних проміжних. Особливо перспективними є каталізатори на основі платини, паладію, рутенію та іридію з хіральними фосфіновими або оксазолідиновими лігандами. Ці каталізатори активують пренільні подвійні зв’язки через π-комплексування, сприяючи внутрішньомолекулярній атаці із визначеною просторовою орієнтацією. Молекулярний дизайн лігандів у таких системах створює стеричні та електронні ефекти, які перешкоджають утворенню транс-ізомерів і сприяють утворенню цис-конфігурації. Використання таких каталізаторів у суміші з кислотою Льюїса або слабкими протонними кислотами дозволяє отримувати цис-ізомери з виходом до 70-85 % при знижених температурах (15-30 °C) і коротких часах реакції (до 2 годин).
Мікрохвильовий синтез – окремий сучасний напрям, який активно розвивається у сфері канабіноїдного синтезу. Мікрохвильове опромінення дозволяє селективно нагрівати полярні ділянки молекули або каталізатора, сприяючи прискоренню реакцій циклізації за рахунок локального підвищення температури і енергії активації. Це дає змогу скоротити час реакції з декількох годин до десятків хвилин, зберігаючи або покращуючи вихід цис-ізомеру. Застосування мікрохвильових реакторів із інтегрованими температурними датчиками і системами контролю тиску дозволяє проводити синтез у закритих системах, що зменшує ризик утворення токсичних летких продуктів і забезпечує безпеку процесу. Водночас можливості масштабування таких реакцій починають впроваджуватися у промислову практику через розробку багатооб’ємних мікрохвильових систем.
Використання іонних рідин (ІР) як розчинників і реакційних середовищ є одним із найсучасніших трендів у синтезі канабіноїдів, зокрема Δ⁹-цис-THC. ІР характеризуються високою термічною стабільністю, низькою леткістю, а також здатністю стабілізувати карбокатіонні проміжні продукти завдяки специфічним міжмолекулярним взаємодіям (водневі зв’язки, іонні пари). У таких середовищах кислотний каталіз протікає без втрат активності, а селективність утворення цис-ізомерів збільшується через сприятливу конформаційну фіксацію молекули. Застосування іонних рідин на основі імідозолію, піридинію або амонію дозволяє уникнути використання токсичних органічних розчинників і знизити екологічний вплив. Одночасно, завдяки унікальним властивостям, ІР сприяють кращій розчинності вихідних канабіноїдів і каталізаторів, що підвищує реакційну швидкість і вихід продукту. Проведені дослідження показали, що у деяких іонних рідинах можна досягати селективності цис-ізомеру понад 75 % без додаткових модифікацій каталізатора.
Інноваційним є також застосування суперзріджених газів, зокрема вуглекислого газу (CO₂) під високим тиском, як реакційного середовища для ізомеризації та циклізації канабіноїдів. Суперзріджений CO₂ володіє низькою в’язкістю, високою дифузійною здатністю і змінною полярністю під тиском, що робить його оптимальним розчинником для складних органічних реакцій. Його використання дозволяє здійснювати реакції при м’яких температурах (25-50 °C) і безпечно утилізувати CO₂ після реакції. В суперзріджених середовищах підвищується розчинність каталізаторів і вихід канабіноїдних ізомерів, зменшується утворення побічних продуктів. Такі умови сприяють отриманню цис-ізомерів з високою чистотою без необхідності додаткових етапів очищення.
Паралельно розвиваються біокаталітичні методи, які передбачають використання ферментів або біоміметичних каталізаторів, здатних селективно направляти циклізацію та стереоконтрольовану ізомеризацію канабіноїдів у цис-ізомери. Виявлено, що деякі мутагени ферментів лігази або оксидази можуть каталізувати циклізацію CBD у цис-THC за умов помірного рН і температури, з високою стереоселективністю. Розробка ферментних систем на основі металоензимів з хіральними коферментами відкриває перспективи для екологічно чистого синтезу Δ⁹-цис-THC, що відповідає принципам зеленої хімії. Використання таких систем обмежене стабільністю ферментів і їхньою чутливістю до органічних розчинників, однак успіхи у генно-інженерних модифікаціях дозволяють оптимізувати ці параметри.
Ще одним напрямом є застосування фотокаталізу, де світлова енергія використовується для активації реакції циклізації. Світлочутливі каталізатори, наприклад, металокомплекси рутенію або іридію, під дією видимого світла генерують активні радикальні або іонні проміжки, що запускають ізомеризацію канабіноїдів. Світлова активація забезпечує контрольовану регіональну активацію молекули, зменшуючи побічні реакції, характерні для термічних методів. Це дозволяє одержувати цис-ізомери без агресивних кислотних умов і при кімнатній температурі. Проте фотокаталіз вимагає точного контролю інтенсивності й довжини хвилі випромінювання, а також специфічної апаратної бази.
Сучасні підходи також включають комбінації кількох методик у послідовних або паралельних реакційних циклах, що дозволяє синтезувати Δ⁹-цис-THC з підвищеною вихідністю і чистотою. Наприклад, безперервний потік у поєднанні з іонними рідинами та каталізом метал-комплексів дозволяє отримувати цис-ізомер за лічені хвилини із селективністю понад 80 %. Або ж застосування біокаталізу на стадії початкової циклізації з наступним фотокаталізом для поліпшення чистоти і селективності кінцевого продукту.
Інтеграція цих технологій у масштабовані процеси з урахуванням економічних і екологічних аспектів відкриває перспективи промислового виробництва Δ⁹-цис-THC як окремого фармацевтичного інгредієнта або як складової комплексних канабіноїдних препаратів. Водночас тривають дослідження, спрямовані на вдосконалення контролю стереохімії, оптимізацію процесів очистки, а також зниження вартості синтезу за рахунок повторного використання каталізаторів і розчинників.
Природне походження та вміст у рослинах
Природне походження Δ⁹-цис-тетрагідроканабінолу (Δ⁹-цис-THC) тісно пов’язане з біохімічними процесами, що відбуваються в рослині Cannabis sativa L., яка є основним джерелом канабіноїдів. Відомо, що канабіноїди утворюються у спеціалізованих клітинних структурах – трихомах, розташованих на поверхні квіток і листя рослини. Ці залозисті волоски забезпечують синтез і накопичення канабіноїдів, включно з Δ⁹-цис-THC, хоча останній зустрічається у рослинах у дуже низьких концентраціях. Природне походження Δ⁹-цис-THC визначається складним комплексом ферментативних реакцій, що приводять до формування структурних ізомерів із визначеною стереохімією.
Переважна більшість досліджень фокусується на більш поширених канабіноїдах – Δ⁹-trans-THC, CBD (канабідіол) і CBG (канабігерол). Тим не менш, наявність Δ⁹-цис-THC у природних зразках підтверджена спектроскопічними методами, зокрема ядерним магнітним резонансом (ЯМР), мас-спектрометрією (МС) і хроматографічним аналізом з високою роздільною здатністю (HPLC, GC-MS). Спостереження вказують, що Δ⁹-цис-THC зустрічається у слідових кількостях, іноді лише у межах нижче 0,01 % загального вмісту канабіноїдів у рослині.
Розподіл Δ⁹-цис-THC у рослині є нерівномірним. Він накопичується переважно в окремих фенотипах або популяціях Cannabis sativa, які відрізняються генетичною мінливістю ферментативних систем. Важливо, що кількість Δ⁹-цис-THC корелює з активністю ферментів, що відповідають за циклізацію і ізомеризацію прекурсорів канабіноїдів, зокрема оліветолових похідних. Ці ферменти можуть мати варіабельні конформації або аллельні варіанти, що визначають специфічність реакційних шляхів, у результаті чого формується різне співвідношення цис- і транс-ізомерів.
Вплив екологічних факторів на синтез Δ⁹-цис-THC також вивчається. Температура, вологість, інтенсивність світла та склад ґрунту можуть опосередковано впливати на виразність ферментативних шляхів і стабільність канабіноїдів. У деяких дослідженнях встановлено, що стресові умови, зокрема підвищена ультрафіолетова інсоляція, сприяють збільшенню загальної канабіноїдної активності, що теоретично може підвищувати і слідові рівні Δ⁹-цис-THC. Проте точні механізми впливу зовнішніх факторів на утворення саме цис-ізомеру залишаються недостатньо вивченими і потребують подальшого експериментального підтвердження.
Важливо підкреслити, що Δ⁹-цис-THC у рослинах існує переважно у вигляді кислотної форми – Δ⁹-цис-тетрагідроканабінолової кислоти (Δ⁹-цис-THCA). Ця форма є стабільнішою в природних умовах і піддається декарбоксилюванню під впливом температури або фотохімічних процесів, перетворюючись у нейтральний Δ⁹-цис-THC. Процес декарбоксилювання є ключовим для отримання активного канабіноїду, здатного взаємодіяти з рецепторами людини. Спонтанне або індукуване декарбоксилювання під час сушіння та зберігання рослинної сировини суттєво впливає на кінцевий склад канабіноїдів і, відповідно, на їх фармакологічний профіль.
Дослідження також вказують на те, що Δ⁹-цис-THC може утворюватися в результаті природної ізомеризації під впливом світла і тепла вже після збору сировини. Ці процеси можуть змінювати співвідношення канабіноїдних ізомерів у зразках, що ускладнює точне визначення первинного вмісту Δ⁹-цис-THC у живій рослині. Таким чином, природний вміст Δ⁹-цис-THC у коноплі є результатом не лише генетично закладених синтетичних шляхів, а й постзбіркових хімічних перетворень.
У масштабах популяційного різноманіття Cannabis sativa, відомо, що волокнисті та промислові сорти коноплі, які культивуються для отримання волокна або насіння, містять дуже низькі рівні Δ⁹-цис-THC або зовсім його не містять. Це пов’язано з відбором генотипів, у яких активність ферментів циклізації канабіноїдів знижена або спрямована на утворення неметаболічних форм. Навпаки, у деяких дикорослих або “дико-зростаючих” популяціях, де генетичний фон менш однорідний, рівень Δ⁹-цис-THC може бути вищим, хоча й все одно нижчим за рівні транс-ізомерів.
Застосування високочутливих методів аналітики дозволяє відрізняти сліди Δ⁹-цис-THC від ізомерів і метаболітів, що мають схожі маси і спектри. Це є критично важливим для досліджень, спрямованих на вивчення природного вмісту канабіноїдів, оскільки неправильне ідентифікування може призвести до помилкових висновків щодо ролі Δ⁹-цис-THC у рослині. Тому лабораторії застосовують комбінації хроматографії із спектроскопією ядерного магнітного резонансу, що дає змогу однозначно розпізнати просторову конфігурацію молекули.
Наявність у коноплі
Δ⁹-цис-тетрагідроканабінол (Δ⁹-цис-THC) у рослині Cannabis sativa присутній у слідових кількостях, що суттєво відрізняє його від більш поширеного транс-ізомеру. Його виявлення у коноплі обмежене через низьку концентрацію та складність аналітичної ідентифікації, що вимагає застосування методів із високою чутливістю й специфічністю. Характерна особливість його розподілу полягає у нерівномірності по різних сортових лініях і типах коноплі, а також у залежності від умов вирощування та зберігання рослинної сировини. Рівень Δ⁹-цис-THC часто виявляється на межі виявлення, що пояснюється його метаболічною нестабільністю та схильністю до ізомеризації під впливом фізико-хімічних факторів.
Переважна більшість досліджень зосереджена на ідентифікації та кількісному визначенні Δ⁹-цис-THC у волокнистих, технічних сортах коноплі, які культивуються в Європі та Північній Америці. Ці сорти відомі низьким вмістом психоактивних компонентів і в більшості випадків мають концентрацію транс-THC нижче 0,3%. Аналітичні дані показують, що у таких сортах Δ⁹-цис-THC присутній у концентраціях, які часто не перевищують 0,01%. Такі дані підтверджують, що цис-ізомер не є домінуючим канабіноїдом у промисловій сировині, а радше слідовим побічним продуктом біосинтетичних процесів.
Важливо відзначити, що Δ⁹-цис-THC виявляється переважно у формі кислоти – Δ⁹-цис-THCA, яка у рослині є стабільнішою і не проявляє психоактивності до моменту декарбоксилювання. Кількість Δ⁹-цис-THCA корелює з генетичними особливостями рослин та з активністю ферментів, що каталізують синтез канабіноїдів. Переважна більшість технічних сортів має ферментативні шляхи, орієнтовані на утворення транс-THCA, що пояснює мінімальне накопичення цис-ізомеру.
Наявність Δ⁹-цис-THC також зафіксована у дикорослих популяціях Cannabis, які не проходили селекційного відбору. У цих природних популяціях концентрація цис-THC може бути дещо вищою, але при цьому вона залишається незначною порівняно з транс-ізомером. Аналіз таких зразків часто супроводжується складнощами, пов’язаними із складним складом канабіноїдів і їх ізомерів, що потребує використання багатокомпонентних методів розділення і спектроскопії.
У культурних медичних сортах коноплі, які характеризуються підвищеним вмістом транс-THC для фармакологічних цілей, Δ⁹-цис-THC практично не виявляється. Це пояснюється цілеспрямованим селекційним відбором рослин із максимальним вмістом транс-ізомеру, а також умовами культивації, що не сприяють біосинтезу цис-ізомеру. Відсутність або низький вміст Δ⁹-цис-THC у медичних сортах підкреслює його мінімальне значення у фармакологічному профілі рослини при комерційному вирощуванні.
Крім сортових особливостей, важливим фактором, що впливає на вміст Δ⁹-цис-THC у коноплі, є стадія росту рослини. Виявлено, що в молодих стадіях розвитку, особливо під час цвітіння, концентрація канабіноїдів, включно з цис-THC, є найвищою. Однак зі зростанням зрілості рослини та в процесі дозрівання відбувається динамічна зміна співвідношень канабіноїдів через активність ферментів, що каталізують перетворення між різними формами. Ці зміни вказують на складний метаболічний баланс між синтезом і деградацією різних ізомерів.
Іншим аспектом, що впливає на кількість Δ⁹-цис-THC, є технологія збору і обробки рослинної сировини. Використання високих температур, тривале зберігання та вплив світла сприяють декарбоксилюванню та ізомеризації канабіноїдів, що може змінити вихідний склад і збільшити або зменшити кількість Δ⁹-цис-THC. Особливо важливо контролювати ці параметри при аналізі для уникнення артефактів, пов’язаних із хімічною трансформацією канабіноїдів.
Для точного визначення наявності та концентрації Δ⁹-цис-THC у коноплі застосовують високочутливі хроматографічні методи, поєднані з мас-спектрометрією та спектроскопією ЯМР. Такий підхід дозволяє розрізняти цис-ізомер від транс-ізомера та інших структурних подібних молекул із високою точністю. Ці методи є необхідними для досліджень, оскільки низька концентрація і схожість із структурними ізомерами ускладнюють ідентифікацію.
У результаті, накопичені дані свідчать, що Δ⁹-цис-THC є рідкісним та нестабільним компонентом канабіноїдного комплексу коноплі, який утворюється як побічний продукт ферментативних процесів ізомеризації та циклізації. Його наявність у природній рослині строго контролюється генетичними та зовнішніми факторами, а кількість і стабільність залежать від сортових характеристик і умов культивації.
Цей факт має значення для фармацевтичної промисловості та аналітичних лабораторій, що вивчають канабіноїдний склад рослинної сировини, оскільки правильне розпізнавання і кількісне визначення Δ⁹-цис-THC дозволяє уникнути плутанини у стандартизації екстрактів і продуктів, а також визначити можливий вплив цього ізомеру на фармакологічні властивості кінцевих препаратів.
Біогенез та можливе походження
Біогенез Δ⁹-цис-тетрагідроканабінолу (Δ⁹-цис-THC) у рослині Cannabis sativa відбувається в межах складної мережі ферментативних реакцій, що починаються з первинних метаболітів і ведуть до утворення різноманітних канабіноїдних ізомерів. Цей процес тісно пов’язаний із загальним шляхом синтезу канабіноїдів, який базується на поліконденсації фенілоцтової кислоти та ізопреноїдних попередників. У межах цього біосинтетичного каскаду Δ⁹-цис-THC виникає як побічний або вторинний продукт, утворений через специфічні ферментативні та неферментативні перетворення.
Початковий етап біогенезу канабіноїдів пов’язаний із синтезом канабіноїдної кислоти – канабігеролової кислоти (CBGA), яка служить універсальним прекурсором для більшості канабіноїдів. CBGA синтезується з геранілпірофосфату та оліветолової кислоти, які утворюються в різних метаболічних шляхах рослини. Далі CBGA трансформується ферментом канабіноїд-синтазою, що каталізує циклізацію і модифікацію молекули до основних канабіноїдних кислот, таких як Δ⁹-транс-тетрагідроканабінолова кислота (Δ⁹-trans-THCA), каннабіхроменова кислота (CBCA) та каннабідіолова кислота (CBDA). Саме з цих основних кислот утворюються відповідні нейтральні канабіноїди під впливом тепла або ферментів декарбоксилази.
Δ⁹-цис-THC вважається продуктом, який утворюється в результаті альтернативного ферментативного циклу або ізомеризації, що виникає внаслідок активності ферментів із широкою субстратною специфічністю, або ж через неспецифічні хімічні умови, характерні для внутрішнього середовища клітини. Механізми, які ведуть до утворення цис-ізомеру, включають ферментативну циклізацію CBGA із формуванням Δ⁹-цис-THCA, що відрізняється від звичайної транс-THCA конфігурації стереохімічним розташуванням атомів у циклі. Цей шлях поки що недостатньо вивчений, однак за допомогою сучасних біохімічних методів було підтверджено існування відповідних синтетичних ферментів або ферментативної активності, що продукує цей ізомер.
Окрім ферментативних шляхів, важливу роль у біогенезі Δ⁹-цис-THC відіграють хімічні реакції ізомеризації та епімерації, що відбуваються під впливом внутрішніх фізико-хімічних умов. Зокрема, канабідіолова кислота (CBDA) може проходити через епімерацію, яка призводить до утворення Δ⁹-цис-THCA, із подальшим декарбоксилюванням у Δ⁹-цис-THC. Цей шлях підтверджує, що Δ⁹-цис-THC може виникати не тільки як прямий ферментативний продукт, а й через проміжні етапи ізомеризації інших канабіноїдів. Такі реакції можуть протікати в клітинних компартментах, де відбувається накопичення і трансформація канабіноїдних кислот.
Значна увага приділяється потенціалу канабіхромену (CBC) як прекурсору Δ⁹-цис-THC. CBC, який утворюється з CBGA за допомогою ферменту каннабіхромен-синтази, здатний піддаватися ізомеризації за хімічних або ферментативних умов з утворенням цис-ізомеру THC. Цей процес передбачає відкриття та повторне циклізування молекули, що змінює конфігурацію молекули з транс- на цис-форму. Встановлено, що цей шлях є одним із додаткових механізмів, що забезпечують біорізноманіття канабіноїдів у рослині.
Дослідження ізотопного маркування дозволяють прослідкувати шляхи утворення Δ⁹-цис-THC та підтвердити припущення про його походження як похідного від CBGA або інших канабіноїдів. Вони свідчать про спільні попередники з транс-THC, проте відмінності у ферментативній активації або локалізації синтетичних комплексів визначають формування різних стереоізомерів. Це свідчить про те, що існують специфічні ферментативні шляхи, які призводять до утворення цис-ізомеру, а не тільки випадкові хімічні перетворення.
Внутрішньоклітинне середовище коноплі, включно з рівнем рН, концентрацією іонів металів, окислювально-відновним потенціалом, також суттєво впливає на напрямок біосинтезу канабіноїдів. Ізомеризація молекул під дією катіонів металів або ферментативних ко-факторів може змінювати стереохімію утворених продуктів, сприяючи утворенню Δ⁹-цис-THC. Такий механізм дає змогу розглядати біогенез цис-THC як багатокомпонентний процес із поєднанням ферментативних і хімічних реакцій.
Молекулярні дослідження в галузі генетики Cannabis також вказують на наявність генів, що кодують ферменти із різною специфічністю щодо продукції канабіноїдних ізомерів. Це підтверджує ідею про існування альтернативних ферментативних шляхів, які можуть бути активовані в певних генотипах або під впливом середовищних факторів. Відмінності в експресії цих генів визначають відносну концентрацію Δ⁹-цис-THC у рослині.
Значення мікробіологічних факторів у біогенезі Δ⁹-цис-THC поки що є мало вивченим напрямком, але існують гіпотези, що симбіотичні мікроорганізми, присутні на поверхні або всередині тканин коноплі, можуть впливати на ферментативні або хімічні процеси ізомеризації. Такі мікроорганізми здатні продукувати ферменти або каталізувати реакції, що модифікують канабіноїдний склад рослини, зокрема сприяючи утворенню рідкісних ізомерів.
Фармакологічна активність
Фармакологічна активність Δ⁹-цис-тетрагідроканабінолу (Δ⁹-цис-THC) характеризується низкою унікальних властивостей, що відрізняють його від більш вивчених транс-ізомерів, зокрема Δ⁹-trans-THC. Цей ізомер взаємодіє з ендоканабіноїдною системою організму, яка складається з рецепторів, ендогенних лігандів і ферментів, що регулюють їх синтез і деградацію. Ендоканабіноїдна система відповідає за підтримку гомеостазу та регуляцію різних фізіологічних процесів, включаючи біль, запалення, нейропротекцію, апетит, емоційний стан та імунний відповідь.
Δ⁹-цис-THC проявляє фармакологічну активність як частковий агоніст основних канабіноїдних рецепторів CB1 і CB2, що локалізуються відповідно у центральній нервовій системі (ЦНС) і периферійних тканинах. Взаємодія із цими рецепторами запускає каскад внутрішньоклітинних сигнальних подій, включаючи інгібування аденілатциклази, модуляцію іонних каналів, активацію MAP-кіназ та зміну рівня внутрішньоклітинного кальцію. Ці механізми лежать в основі впливу на нейромедіатори, зокрема ГАМК, глутамат, допамін та серотонін, які визначають поведінкові та фізіологічні ефекти.
Фармакодинамічні характеристики Δ⁹-цис-THC відрізняються від транс-ізомеру не лише за афінністю до рецепторів, але й за типом активації. Зокрема, цис-ізомер демонструє меншу спорідненість до CB1, що корелює з його меншою психоактивністю та більш м’яким впливом на центральні функції. Цей аспект є важливим для потенційного медичного застосування, адже знижена афінність зменшує ризик небажаних психотропних ефектів, одночасно зберігаючи позитивний терапевтичний профіль.
Додатково, Δ⁹-цис-THC впливає на CB2-рецептори, які знаходяться переважно в імунній системі. Активація цих рецепторів призводить до імуномодулюючих ефектів, включаючи пригнічення продукції прозапальних цитокінів та модуляцію активації імунних клітин. Це відкриває перспективи застосування цис-THC у терапії запальних і аутоімунних захворювань, де необхідна регуляція імунної відповіді без сильного впливу на ЦНС.
Δ⁹-цис-THC впливає також на неканабіноїдні рецептори та системи, що значно розширює спектр його фармакологічної дії. Цей ізомер здатний модулювати активність G-білок зв’язаних рецепторів GPR18 і GPR55, які задіяні у багатьох фізіологічних процесах, зокрема у регуляції болю, запалення, імунного відповіді та метаболізму. Взаємодія з цими рецепторами може пояснювати деякі відмінності у фармакологічному профілі Δ⁹-цис-THC порівняно з транс-ізомером.
Фармакокінетичні параметри Δ⁹-цис-THC ще недостатньо вивчені, але відомо, що цей ізомер проявляє подібні до транс-THC характеристики всмоктування, розподілу, метаболізму та виведення. Метаболізм переважно відбувається у печінці за участю ізоферментів цитохрому P450, що призводить до утворення активних та неактивних метаболітів. Однак можливі відмінності у швидкості метаболізму та утворенні метаболітів можуть впливати на тривалість і силу фармакологічних ефектів.
У доклінічних дослідженнях Δ⁹-цис-THC продемонстрував потенціал як анальгетик, здатний зменшувати больові відчуття через модуляцію передачі больових сигналів на рівні периферії та ЦНС. Він також проявляє нейропротекторні властивості, що пов’язані з його здатністю зменшувати окислювальний стрес та запальні процеси у нейронах. Ці властивості роблять цис-THC перспективним кандидатом для досліджень у галузі нейродегенеративних захворювань, таких як хвороба Альцгеймера і Паркінсона.
Фармакологічні дослідження показали, що Δ⁹-цис-THC має здатність впливати на моторику, апетит, настрій та когнітивні функції, хоча ефекти проявляються у меншому ступені порівняно з транс-THC. Це обумовлено різною афінністю до рецепторів і різним ступенем активації внутрішньоклітинних сигнальних шляхів. Зниження психоактивного впливу одночасно збереження терапевтичної ефективності робить цей ізомер привабливим об’єктом для розробки лікарських засобів із менш вираженими побічними ефектами.
Загальна токсичність Δ⁹-цис-THC на сьогодні вивчена недостатньо, але експерименти на тваринах свідчать про більш високу безпеку в порівнянні з транс-THC при подібних дозах. Це пов’язано з обмеженою здатністю цис-THC проникати через гематоенцефалічний бар’єр і меншою активацією рецепторів у ЦНС. Водночас необхідні додаткові дослідження для уточнення профілю безпеки при хронічному застосуванні.
Δ⁹-цис-THC також проявляє здатність до синергізму з іншими канабіноїдами та сполуками, що знаходяться у складі коноплі, зокрема каннабідіолом (CBD) і тетрагідроканабінолом (THC). Ці взаємодії можуть посилювати або модулювати фармакологічні ефекти, змінюючи афінність, селективність або внутрішньоклітинні сигнальні шляхи. Такий ефект “ентуріазму” дозволяє розглядати Δ⁹-цис-THC як частину комплексного фармакологічного профілю рослини, де кожен компонент доповнює та модулює дію інших.
Інтерпретація фармакологічної активності Δ⁹-цис-THC має враховувати його хімічну стабільність, яка нижча порівняно з транс-ізомером. Під впливом світла, тепла і кисню цис-THC схильний до швидшого розпаду і утворення продуктів деградації, що може обмежувати його біодоступність і активність у фармакологічних системах. Це створює виклики для розробки лікарських форм із тривалим терміном зберігання.
Потенційне використання Δ⁹-цис-THC у терапії залежить від його здатності спрямовано модулювати специфічні канабіноїдні і позарецепторні шляхи без надмірної активації ЦНС. Цей баланс відкриває нові перспективи у фармакології, зокрема у розробці препаратів з анальгетичними, протизапальними, нейропротекторними та імуномодулюючими властивостями, які мають менше обмежень через психотропні ефекти.
Взаємодія з канабіноїдними рецепторами
Δ⁹-цис-тетрагідроканабінол (Δ⁹-цис-THC) є канабіноїдом, який проявляє фармакологічну активність через специфічну взаємодію з канабіноїдними рецепторами типів CB1 та CB2, що належать до великої родини G-білок зв’язаних рецепторів (GPCR). Ці рецептори виконують центральну роль у регуляції багатьох фізіологічних функцій, зокрема нервової передачі, імунної відповіді, а також метаболічного гомеостазу. Вивчення взаємодії Δ⁹-цис-THC з цими рецепторами дає змогу глибше зрозуміти механізми дії цього ізомеру, відмінності від транс-ізомера і потенціал для розробки нових фармакологічних агентів.
Рецептор CB1 головним чином локалізований у центральній нервовій системі, зокрема у префронтальній корі, гіпокампі, базальних гангліях, мозочку та спинному мозку, а також у деяких периферійних тканинах. Взаємодія із CB1 визначає психоактивний ефект канабіноїдів, модулюючи вивільнення нейротрансмітерів і впливаючи на синаптичну передачу. Δ⁹-цис-THC, як частковий агоніст CB1, демонструє меншу спорідненість і активність порівняно з транс-THC, що обумовлює відмінності в інтенсивності і характері центральних ефектів. Кінетика зв’язування Δ⁹-цис-THC з CB1 показує більш швидкий дисоціаційний процес, що зумовлює коротший період активації рецептора та потенційно нижчий ризик розвитку толерантності.
На молекулярному рівні взаємодія Δ⁹-цис-THC з CB1 включає зв’язування ліганд-активованої ділянки рецептора, яка містить кілька ключових амінокислотних залишків, що формують гідрофобний і водневий зв’язок із молекулою ліганда. Конформаційна пластичність рецептора під впливом Δ⁹-цис-THC відрізняється від транс-ізомера, що впливає на активацію внутрішньоклітинних ефекторних білків G_i/o. Це зумовлює відмінності у сигнальних каскадах, таких як інгібування аденілатциклази, регуляція іонних каналів та активація MAP-кіназ.
Рецептор CB2 переважно експресується в імунокомпетентних клітинах, включно з макрофагами, моноцитами, В- та Т-лімфоцитами. Взаємодія Δ⁹-цис-THC з CB2 має важливе значення для імуномодулюючих ефектів, оскільки активація цього рецептора призводить до зниження продукції прозапальних цитокінів, таких як TNF-α, IL-1β і IL-6. Цей процес забезпечує протизапальний ефект, що є ключовим для потенційного застосування Δ⁹-цис-THC у терапії аутоімунних та запальних захворювань. На відміну від транс-THC, цис-ізомер демонструє відносно високу селективність до CB2, що знижує психотропні ефекти і підвищує терапевтичний індекс.
Зв’язування Δ⁹-цис-THC з CB2 також призводить до активації внутрішньоклітинних сигнальних шляхів, таких як фосфоліпаза C, регуляція рівня циклічного гуанозинмонофосфату (cGMP) та модуляція кальцієвих потоків. Ці механізми сприяють гальмуванню проліферації і міграції імунних клітин, а також зменшенню оксидативного стресу. На молекулярному рівні різниця у конформації рецептора CB2 під впливом Δ⁹-цис-THC порівняно з транс-THC визначає специфіку ефекторних відповідей.
Кінетичні параметри зв’язування Δ⁹-цис-THC з обома рецепторами свідчать про часткову агонистичну активність, що дозволяє йому активувати рецептори без повного залучення внутрішньоклітинних ефекторів. Цей режим активації важливий для зниження побічних ефектів, оскільки повні агонисти можуть викликати сильну десенситизацію рецепторів і виникнення толерантності.
Додатково, взаємодія Δ⁹-цис-THC з CB1 і CB2 супроводжується регуляцією експресії рецепторів. У тривалих експозиціях спостерігається зниження кількості рецепторів на мембрані клітин, що корелює з розвитком толерантності. Проте швидкість і ступінь регуляції CB1 та CB2 відрізняються залежно від ізомеру, при цьому Δ⁹-цис-THC має потенційно більш сприятливий профіль у цьому аспекті.
Важливим аспектом є також здатність Δ⁹-цис-THC впливати на взаємодію канабіноїдних рецепторів із їх ендогенними лігандами – анандамідом та 2-арахідоноїлгліцеролом (2-AG). Δ⁹-цис-THC конкурує з ними за зв’язування, що може модуляти активність ендоканабіноїдної системи як у центральній, так і периферійній нервовій системі. Це має значення для корекції порушень, пов’язаних із дисфункцією цієї системи у різних патологіях.
Крім того, Δ⁹-цис-THC проявляє алостеричну модуляцію канабіноїдних рецепторів, змінюючи їх конформацію таким чином, що змінюється афінність до інших лігандів та ефекторна активність. Це відкриває можливості для тонкої фармакологічної регуляції, що важливо при розробці ліків з більш цілеспрямованою дією.
На рівні сигнальних шляхів активація CB1 і CB2 Δ⁹-цис-THC призводить до модуляції множини внутрішньоклітинних процесів, серед яких виділяють інгібування аденілатциклази, що зменшує рівень циклічного аденозинмонофосфату (cAMP), активацію протеїнкінази А та фосфорилювання ключових клітинних білків. Також важливим є вплив на MAP-кінази ERK1/2, які регулюють транскрипцію генів, пов’язаних з клітинним ростом, виживанням та диференціацією. Вказані механізми пояснюють анальгетичні, протизапальні та нейропротекторні ефекти Δ⁹-цис-THC.
Особливу увагу приділяють взаємодії Δ⁹-цис-THC з пресинаптичними CB1-рецепторами, які контролюють вивільнення нейротрансмітерів. Часткова активація цих рецепторів призводить до зменшення вивільнення глутамату і ГАМК, що регулює нейрональну збудливість і синаптичну пластичність. Цей механізм лежить в основі знеболювальної дії і впливу на когнітивні процеси.
Взаємодія Δ⁹-цис-THC з CB2-рецепторами в імунній системі включає регуляцію функції макрофагів і мікроглії, що відповідають за імунний нагляд і запальні реакції у центральній нервовій системі. Через це цис-ізомер має потенціал для лікування нейрозапальних станів і нейродегенеративних захворювань.
Інші фармакологічні властивості
Δ⁹-цис-тетрагідроканабінол (Δ⁹-цис-THC), окрім взаємодії з класичними канабіноїдними рецепторами CB1 і CB2, проявляє широкий спектр фармакологічних властивостей, які виходять за межі цих рецепторів і включають зв’язування з іншими G-білок зв’язаними рецепторами (GPCR), іонними каналами, ферментами, а також модуляцію нейрональної імунної активності. Ці додаткові механізми суттєво розширюють потенціал цього ізомера в терапевтичному контексті, дозволяючи йому впливати на різноманітні фізіологічні та патофізіологічні процеси.
Одним із ключових аспектів є здатність Δ⁹-цис-THC взаємодіяти з рецепторами GPR18 та GPR55, які не належать до традиційної канабіноїдної системи, але часто розглядаються як “нестандартні” канабіноїдні рецептори. GPR18 експресується переважно у клітинах імунної системи, включно з макрофагами, лімфоцитами та мікроглією, і відіграє роль у регуляції запальних процесів та клітинної міграції. Активація GPR18 Δ⁹-цис-THC модулює імунну відповідь, знижуючи експресію прозапальних цитокінів і сприяючи гомеостазу у запальних патологіях. Взаємодія з GPR18 є частково відповідальною за протизапальні ефекти, які виходять за межі традиційного CB2-опосередкованого впливу. Механізми активації GPR18 включають зміни в активності внутрішньоклітинних сигнальних шляхів, таких як PI3K/Akt та ERK1/2, що регулюють клітинний цикл, проліферацію та виживання.
Рецептор GPR55, який експресується в центральній нервовій системі та периферійних тканинах, вважається “канабіноїдним рецептором” з відмінним лігандним профілем. Δ⁹-цис-THC є агоністом GPR55, і ця взаємодія пов’язана з регуляцією болю, моторної активності, а також метаболічними процесами. Активація GPR55 модулює кальцієві канали і впливає на мобілізацію внутрішньоклітинного кальцію, що в свою чергу змінює нейрональну збудливість і синаптичну пластичність. Цей шлях є перспективним для розробки анальгетичних засобів із меншими психотропними побічними ефектами, адже GPR55 не асоціюється з прямим впливом на CB1-рецептори. Регуляція GPR55 Δ⁹-цис-THC також пов’язана з модуляцією метаболічного синдрому і запальних станів, що відкриває перспективи для застосування у лікуванні діабету та ожиріння.
Δ⁹-цис-THC взаємодіє із TRP-каналами (Transient Receptor Potential), зокрема з TRPV1 (ванілоїдний рецептор типу 1) та TRPA1, що грають важливу роль у передачі больових сигналів та терморегуляції. Через активацію TRPV1, Δ⁹-цис-THC викликає деполяризацію сенсорних нейронів, що призводить до зменшення чутливості до болю. Цей механізм є важливою складовою анальгетичного ефекту, незалежного від CB-рецепторів, і дозволяє впливати на нейропатичний біль, який складно лікувати традиційними методами. Взаємодія з TRPA1 сприяє додатковій регуляції запальних процесів через вплив на вивільнення нейропептидів, що регулюють судинний тонус і імунну відповідь.
Δ⁹-цис-THC також впливає на ферменти, що регулюють метаболізм ендоканабіноїдів, зокрема FAAH (fatty acid amide hydrolase) та MAGL (monoacylglycerol lipase). Ці ферменти відповідальні за деградацію анандаміду та 2-арахідоноїлгліцеролу (2-AG) відповідно. Ізомер має здатність інгібувати FAAH, що призводить до підвищення рівня ендоканабіноїдів у тканинах і посилення ендогенного тонусу канабіноїдної системи. Такий механізм сприяє довготривалому ефекту, який включає зменшення болю, покращення настрою та зниження запалення без необхідності прямої активації рецепторів. Інгібування MAGL менш виражене, що робить вплив Δ⁹-цис-THC більш вибірковим і потенційно знижує ризик розвитку побічних ефектів.
Додатково варто відзначити взаємодію Δ⁹-цис-THC з серотоніновими рецепторами, зокрема 5-HT1A, які регулюють тривогу, настрій і біль. Цис-ізомер проявляє агонистичні або частково агонистичні властивості щодо цих рецепторів, що корелює з його анксіолітичними та антидепресивними ефектами, спостережуваними у доклінічних моделях. Взаємодія з 5-HT1A також сприяє нейропротекції при різних нейродегенеративних захворюваннях, що пов’язано зі зменшенням нейровоспалення та окисного стресу.
Ще одним напрямком дії Δ⁹-цис-THC є його вплив на канали калію та кальцію. Зокрема, він модулює потенціалзалежні калієві канали, що має значення для регуляції мембранного потенціалу і нейрональної активності. Вплив на кальцієві канали типу L і N змінює екситаторну синаптичну передачу, що пояснює здатність ізомера знижувати спастичність і судоми. Ці властивості актуальні при лікуванні розсіяного склерозу та інших неврологічних розладів.
На імунному рівні Δ⁹-цис-THC модулює активацію та функціональну активність різних субпопуляцій лімфоцитів. Зокрема, він інгібує проліферацію Т-хелперів типу 1 (Th1), що веде до зниження продукції інтерферону-γ (IFN-γ) і, відповідно, до зменшення клітинно-опосередкованих імунних реакцій. Це відкриває перспективи застосування ізомера при аутоімунних захворюваннях, де потрібна селективна імуносупресія. Одночасно підтримується функція Th2-клітин, що дозволяє зберегти гуморальний імунітет.
Δ⁹-цис-THC демонструє також здатність впливати на мікроглію – імунокомпетентні клітини мозку, які беруть участь у нейровоспаленні. Ізомер гальмує активацію мікроглії, знижуючи секрецію прозапальних медіаторів та підтримуючи нейротрофічний мікросередовище. Це зменшує пошкодження нейронів при хронічних нейродегенеративних процесах і може бути перспективним при хворобі Альцгеймера та Паркінсона.
Важливою особливістю Δ⁹-цис-THC є його вплив на мітохондріальну функцію. Він здатен модулювати активність мітохондріальних дихальних комплексів, зменшуючи надлишкове виробництво реактивних форм кисню (ROS) та стабілізуючи мембранний потенціал. Цей ефект сприяє зменшенню оксидативного стресу і клітинної апоптозу, що є важливим для нейропротекції та загального збереження клітинної життєздатності.
У контексті фармакокінетики Δ⁹-цис-THC характеризується здатністю проникати крізь гематоенцефалічний бар’єр, що забезпечує прямий доступ до центральної нервової системи. Він метаболізується печінковими цитохромами P450, зокрема CYP2C9 і CYP3A4, із утворенням активних метаболітів, які можуть доповнювати фармакологічну активність. Метаболіти мають різну спорідненість до канабіноїдних і нестандартних рецепторів, що ускладнює загальну фармакодинаміку, але водночас дає додаткові можливості для терапевтичного використання.
Потенційне застосування та правовий статус
Δ⁹-цис-тетрагідроканабінол (Δ⁹-цис-THC) представляє собою перспективний фармакологічний агент із численними можливими напрямками використання у різних галузях медицини та науки. Його унікальний хімічний та фармакологічний профіль відкриває нові перспективи для терапевтичного застосування, хоча водночас становить складність у регуляторному й правовому аспектах. Потенційне застосування цього ізомера не обмежується лише класичними сферами впливу канабіноїдів, а охоплює розробку інноваційних препаратів для лікування широкого спектра захворювань, включно із нейродегенеративними, аутоімунними, метаболічними та психіатричними порушеннями.
На фармацевтичному рівні Δ⁹-цис-THC розглядається як цінний компонент для створення селективних ліків, які можуть мати менший психотропний ефект порівняно з традиційним Δ⁹-транс-THC, але при цьому зберігати або навіть покращувати терапевтичну ефективність. Така селективність дозволяє потенційно мінімізувати ризик залежності та негативних когнітивних наслідків, що є ключовими проблемами у застосуванні класичних канабіноїдних препаратів. Сучасні дослідження фокусуються на використанні ізомера у складі комплексних терапій, де він може виконувати роль модулюючого агента, який доповнює дію інших фармакологічних речовин.
Одним із перспективних напрямів є застосування Δ⁹-цис-THC у нейрореабілітації. Завдяки своєму мультифункціональному механізму дії, включаючи антиоксидантні та протизапальні ефекти, він може сприяти відновленню пошкоджених нейрональних мереж при інсультах, травмах головного мозку та хронічних нейродегенеративних захворюваннях. Дослідження на моделях експериментального ураження нервової системи показали, що введення Δ⁹-цис-THC знижує обсяг ураження тканин, покращує когнітивні функції та зменшує запалення, що робить його потенційним кандидатом для використання в реабілітаційних протоколах.
Важливим є потенціал Δ⁹-цис-THC у сфері онкології. Його здатність модуляції імунної відповіді, а також безпосередній цитотоксичний вплив на ракові клітини відкриває можливості для застосування у підтримуючій терапії при онкозахворюваннях. Зокрема, ізомер може підвищувати ефективність протипухлинних препаратів за рахунок зниження резистентності клітин до хіміотерапії, а також зменшувати побічні ефекти лікування, такі як нудота, біль і втрата апетиту. Подібні властивості роблять Δ⁹-цис-THC об’єктом активних клінічних досліджень із метою розробки нових фармакологічних комбінацій.
Ще одним важливим напрямом є застосування Δ⁹-цис-THC у лікуванні аутоімунних і запальних захворювань. Його здатність селективно інгібувати проліферацію Th1-клітин, знижувати продукцію прозапальних цитокінів і модуляцію мікроглії робить його перспективним для корекції імунних дисбалансів. Використання ізомера може бути корисним при ревматоїдному артриті, системному червоному вовчаку, мультиплекс склерозі та інших хронічних запальних станах, де традиційна імуносупресивна терапія часто має обмеження через побічні ефекти.
У сфері психіатрії Δ⁹-цис-THC розглядається як потенційний агент для корекції тривожних, депресивних та посттравматичних розладів. Його часткова агоністична активність щодо серотонінових рецепторів 5-HT1A сприяє нормалізації емоційного стану та покращенню когнітивних функцій без вираженого психоактивного ефекту, що є перевагою в порівнянні з традиційними канабіноїдами. Окрім того, модуляція канальців і нейротрофічних факторів надає можливість використання Δ⁹-цис-THC у профілактиці та лікуванні посттравматичного стресового розладу та інших складних психічних станів.
У контексті метаболічних захворювань Δ⁹-цис-THC впливає на регуляцію енергетичного обміну, апетиту та глюкозного гомеостазу. Він здатен покращувати чутливість до інсуліну, знижувати запалення жирової тканини та впливати на ліпідний профіль, що відкриває перспективи для застосування у комплексній терапії цукрового діабету 2 типу та ожиріння. Дослідження впливу ізомера на метаболічні процеси показують, що він може працювати як адаптоген, нормалізуючи метаболічний статус при різних патологіях.
Варто відзначити перспективи застосування Δ⁹-цис-THC у спортивній медицині та реабілітації. Його протизапальна і анальгетична дія сприяє зменшенню болю та запалення після травм, а також пришвидшує відновлення тканин. Крім того, ізомер має властивості, що поліпшують якість сну, що є важливим аспектом реабілітації та профілактики перетренованості. Використання Δ⁹-цис-THC у спортивній практиці вимагає подальшого дослідження, зокрема для встановлення безпечних доз та режимів застосування.
Однак широке потенційне застосування Δ⁹-цис-THC обмежується його правовим статусом у різних країнах. Легальність речовини варіює від суворої заборони до повної легалізації, що створює складнощі для наукових досліджень і клінічного впровадження. У багатьох юрисдикціях Δ⁹-цис-THC розглядається як контрольований наркотик або прекурсор, що вимагає спеціальних дозволів для дослідницької роботи. Ці обмеження уповільнюють розвиток клінічних випробувань та створення нових лікарських форм.
Відсутність однозначного міжнародного консенсусу щодо класифікації Δ⁹-цис-THC веде до фрагментації ринку та нерівномірного доступу до лікувальних засобів. Часто пацієнти, які потенційно могли б отримати користь від терапії із застосуванням цього ізомера, стикаються з бюрократичними бар’єрами, а фармацевтичні компанії – з ризиками інвестицій через непередбачувані зміни регуляторної політики. Це стимулює пошук компромісних рішень, включаючи розробку синтетичних аналогів або похідних із мінімізованим психотропним ефектом і менш суворими правовими обмеженнями.
У відповідь на ці виклики формується тенденція до впровадження гнучких регуляторних механізмів, що враховують наукові дані і дозволяють поступово розширювати медичне використання Δ⁹-цис-THC. Деякі країни вже створили окремі програми для контролю за обігом канабіноїдів у медичних цілях, що включають обов’язковий моніторинг ефективності та безпеки. Ці ініціативи дозволяють збирати клінічні докази, необхідні для подальшої легалізації та комерційного впровадження.
Паралельно розвиваються технології синтезу і формулювання Δ⁹-цис-THC, які дозволяють створювати лікарські засоби з цілеспрямованою доставкою, покращеною біодоступністю та контрольованим вивільненням. Це включає нанотехнологічні платформи, ліпосоми, мікро- та нанокапсули, що значно підвищують терапевтичний індекс і зменшують побічні реакції. Розвиток цих технологій відкриває додаткові перспективи для клінічного використання ізомера в різних терапевтичних напрямках.
Медичне застосування
Медичне застосування Δ⁹-цис-тетрагідроканабінолу (Δ⁹-цис-THC) зосереджується на його фармакологічних властивостях, які роблять його перспективним агентом у лікуванні різноманітних патологічних станів, включаючи неврологічні, онкологічні, запальні, психіатричні та метаболічні захворювання. Відмінність Δ⁹-цис-THC від класичного транс-ізомера полягає не лише у структурній конфігурації, але й у специфіці взаємодії з рецепторами та іншими мішенями в організмі, що зумовлює унікальний спектр фармакологічної дії та потенційно знижує побічні ефекти.
У неврологічній практиці Δ⁹-цис-THC демонструє високу ефективність у регуляції нейропластичності та протидії нейродегенеративним процесам. Його нейропротекторні властивості пояснюються комплексним впливом на окислювальний стрес, запальні процеси та апоптоз нейронів. Застосування Δ⁹-цис-THC у хворобах, таких як хвороба Альцгеймера, Паркінсона, а також у випадках нейротравм, дозволяє уповільнити прогресування патології та покращити когнітивні і моторні функції. Механізми дії включають активацію антиоксидантних шляхів, інгібування мікрогліальної активації та модулювання канабіноїдної системи центральної нервової системи.
При хронічних больових синдромах Δ⁹-цис-THC виявляє виражену анальгетичну дію за рахунок впливу на канабіноїдні рецептори в периферичній та центральній нервовій системі. Окрім прямої модуляції больових імпульсів, ізомер може знижувати запальний компонент болю, що особливо важливо при артритах, нейропатіях, фіброміалгії. Застосування Δ⁹-цис-THC дозволяє знизити дозу опіоїдів і нестероїдних протизапальних препаратів, що значно покращує якість життя пацієнтів і зменшує ризик побічних ефектів.
У онкології Δ⁹-цис-THC має потенціал для застосування у підтримуючій терапії. Він знижує симптоми, пов’язані з хіміо- та радіотерапією, такі як нудота, блювання, втрата апетиту і хронічний біль. Відомі також антипроліферативні ефекти ізомера на різні типи пухлинних клітин, які пов’язані з індукцією апоптозу, інгібуванням ангіогенезу і метастазування. Це створює можливість включення Δ⁹-цис-THC у комбіновані протиракові стратегії, підвищуючи їх ефективність та зменшуючи токсичність.
У випадках аутоімунних та запальних захворювань Δ⁹-цис-THC виступає як імуносупресивний агент з високою специфічністю. Він регулює баланс між провоспалювальними і протизапальними цитокінами, пригнічує надмірну активацію Т-лімфоцитів і макрофагів, що особливо актуально при ревматоїдному артриті, системному червоному вовчаку, псоріазі. При цьому вплив Δ⁹-цис-THC не призводить до загального імуносупресивного стану, що знижує ризик інфекційних ускладнень.
Психіатричні аспекти застосування Δ⁹-цис-THC пов’язані із здатністю модуляції нейротрансмітерних систем, зокрема серотонінової, допамінової та ГАМК-ергічної. Цей ізомер показує позитивний вплив на симптоми тривоги, депресії та посттравматичного стресового розладу, зменшуючи інтенсивність нападів паніки та покращуючи емоційну стабільність. Його дія супроводжується низьким ризиком розвитку психозу, що відрізняє його від транс-ізомера та робить перспективним у психіатричній терапії.
В контексті метаболічних порушень Δ⁹-цис-THC проявляє здатність регулювати енергетичний обмін, стимулювати апетит і покращувати ліпідний профіль, що корисно при лікуванні кахексії, анорексії та метаболічного синдрому. Його вплив на глюкозний метаболізм і інсулінову чутливість дає підстави для подальшого вивчення як компонента комплексної терапії цукрового діабету 2 типу та ожиріння.
Клінічна практика підтверджує перспективність використання Δ⁹-цис-THC у реабілітаційних програмах після нейротравм і інсультів. Він сприяє відновленню функцій нервової системи через стимуляцію нейрогенезу і регуляцію синаптичної пластичності, що підвищує ефективність традиційної терапії та зменшує інвалідизацію пацієнтів. Його застосування у спортивній медицині також отримує розвиток, завдяки протизапальним і анальгетичним властивостям.
При застосуванні Δ⁹-цис-THC у клінічних умовах особлива увага приділяється фармакокінетиці та фармакодинаміці речовини. Вивчення її біодоступності, метаболізму в печінці та взаємодії з іншими лікарськими препаратами дозволяє оптимізувати дозування і мінімізувати побічні ефекти. Розробка різних лікарських форм – від інгаляційних спреїв до оральних капсул і трансдермальних систем доставки – відкриває можливості для індивідуалізації терапії та покращення комплаєнсу пацієнтів.
Крім безпосереднього терапевтичного застосування, Δ⁹-цис-THC використовується у фармакологічних дослідженнях як модельний зразок для розробки нових канабіноїдних препаратів із специфічними властивостями. Його структурна модифікація дає можливість синтезувати похідні з покращеним терапевтичним профілем та зменшеними побічними ефектами, що має велике значення для розвитку персоналізованої медицини.
Обмеження у застосуванні Δ⁹-цис-THC пов’язані з необхідністю детального вивчення його токсикології, довготривалого впливу на організм і потенціалу фармакокінетичних взаємодій. Проведення рандомізованих контрольованих досліджень є ключовим для встановлення доказової бази та розробки клінічних рекомендацій. Сучасні клінічні випробування включають дослідження ефективності при різних неврологічних синдромах, хронічному болю, психічних розладах та метаболічних хворобах.
Правовий статус
Правовий статус Δ⁹-цис-тетрагідроканабінолу (Δ⁹-цис-THC) є складним та неоднорідним, оскільки він формується на перетині фармацевтичного регулювання, контролю за наркотичними речовинами і специфічних законодавчих підходів до канабіноїдів. Відсутність чіткого визначення у міжнародних і національних нормативних актах створює неоднозначність щодо легального статусу цього ізомера, що ускладнює його дослідження, виробництво та застосування.
Перш за все, Δ⁹-цис-THC є структурним ізомером добре відомого Δ⁹-trans-THC, який знаходиться у списках контрольованих речовин більшості країн. Однак більшість національних законів, що регулюють обіг канабіноїдів, формулюють визначення на основі конкретної структурної формули або активної субстанції, часто без згадки стереоізомерів. Унаслідок цього Δ⁹-цис-THC у багатьох юрисдикціях формально не включений у перелік заборонених або контрольованих речовин. Це створює певний правовий вакуум, який може як сприяти розвитку легального використання ізомера, так і призводити до юридичних непорозумінь.
Міжнародні конвенції, такі як Єдинa Конвенція ООН про наркотичні засоби 1961 року та Конвенція ООН про психотропні речовини 1971 року, регулюють канабіноїди у контексті боротьби з наркотиками. У цих документах акцент зроблено на Δ⁹-trans-THC як основній психоактивній речовині. Визначення канабісу та його похідних у конвенціях не деталізують положення щодо стереоізомерів, що дає можливість окремим країнам інтерпретувати статус Δ⁹-цис-THC відповідно до внутрішнього законодавства. Це призводить до відсутності єдиного міжнародного підходу до регулювання даного ізомера, що ускладнює його комерційний та клінічний розвиток у глобальному масштабі.
На рівні національного законодавства ситуація ще більш неоднорідна. У країнах із розвиненою фармацевтичною та канабіноїдною індустрією, таких як США, Канада, Німеччина, Ізраїль, правові норми часто базуються на визначенні хімічної структури та ефектів речовин. У США, наприклад, Управління з контролю за продуктами і ліками (FDA) та Департамент юстиції використовують списки контролю за психоактивними речовинами, але в них зазвичай фігурує Δ⁹-trans-THC. Δ⁹-цис-THC залишається менш регламентованим, що створює простір для виробництва та досліджень, але також не виключає ризик зміни статусу у майбутньому.
Країни Європейського Союзу застосовують спільні та національні підходи до регулювання канабіноїдів. Деякі країни включають у законодавчі акти лише основні психоактивні компоненти конопель, що залишає поза увагою ізомери, такі як Δ⁹-цис-THC. Це сприяє виникненню ситуацій, коли речовини з канабіноїдною активністю не регулюються або регулюються злабо, хоча при цьому їх фармакологічна дія може бути суттєвою. Водночас, у ряді юрисдикцій зростає тенденція до розширення контролю на всі потенційно психоактивні ізомери, що може у майбутньому вплинути на правовий статус Δ⁹-цис-THC.
Питання легалізації медичного та рекреаційного канабісу у світі змінює підходи до регулювання канабіноїдів загалом. У країнах, де вживається політика пом’якшення законодавства щодо канабісу, існують спроби деталізувати статус окремих канабіноїдних ізомерів, у тому числі Δ⁹-цис-THC. Проте у більшості випадків регулятори концентруються на загальній психоактивній дії продукту, залишаючи науково недоведені ізомери поза суворим контролем. Це створює своєрідний “правовий сірою зону”, де промисловість та науковці можуть працювати з Δ⁹-цис-THC, але під ризиком майбутніх змін у законодавстві.
Іншим аспектом правового статусу є питання походження речовини. Якщо Δ⁹-цис-THC добутий безпосередньо з рослини канабісу, то він зазвичай потрапляє під суворий контроль через статус рослинної сировини. Водночас, синтетичні або напівсинтетичні варіанти ізомера, отримані лабораторним шляхом, можуть не мати чітко визначеного правового статусу через відсутність прямих згадок у нормативних актах. Це викликає юридичні колізії у сфері виробництва і дистрибуції, а також у фармацевтичних дослідженнях.
Регуляторні органи у багатьох країнах звертають увагу на проблему подібних ізомерів з огляду на їх потенціал до використання у нелегальних речовинах. Існують приклади, коли нові синтетичні канабіноїди швидко потрапляють у списки контрольованих через їх психоактивні властивості, навіть без повної наукової оцінки. Тому Δ⁹-цис-THC, незважаючи на відносно низьку психоактивність у порівнянні з транс-ізомером, може опинитися під регуляторним пресингом, що обмежить його комерційне використання.
Значну роль у формуванні правового статусу відіграє міжнародна політика щодо контролю за новими психоактивними речовинами (НПР). У багатьох країнах Δ⁹-цис-THC може розглядатися як нова психоактивна речовина, що потрапляє під окремі регуляції для запобігання нелегальному обігу та шкоді здоров’ю населення. Така політика спрямована на швидке включення нових ізомерів та похідних канабіноїдів до списків контрольованих речовин, що значно ускладнює легальне застосування ізомера у фармацевтиці та науці.
Правовий статус Δ⁹-цис-THC також визначається через механізми патентного захисту та інтелектуальної власності. Складність в однозначному ідентифікуванні та класифікації ізомера впливає на можливість оформлення патентів на препарати, що містять Δ⁹-цис-THC або його похідні. Відсутність чітких нормативних рамок уповільнює інвестиції в розробку нових ліків і технологій виробництва, що додатково ускладнює легальний розвиток цієї речовини.
Юридичні механізми контролю над Δ⁹-цис-THC мають також соціально-економічний вимір. Легалізація або криміналізація цього ізомера впливає на розвиток фармацевтичної галузі, створення робочих місць, а також на ринок медичних препаратів і харчових добавок. У країнах з розвиненою біотехнологічною індустрією відкритість до інноваційних канабіноїдів може стимулювати економічне зростання, тоді як суворі регуляторні обмеження ведуть до втрати потенційних інвестицій та застарілості нормативної бази.
Поточні тенденції у світовій правовій практиці свідчать про поступове розширення регуляції, яка починає враховувати різноманіття канабіноїдних ізомерів, включаючи Δ⁹-цис-THC. Це вимагає гармонізації міжнародних підходів та оновлення національного законодавства з урахуванням сучасних наукових даних. Активна участь наукової спільноти у формуванні політики регулювання має вирішальне значення для створення збалансованої системи, яка дозволить одночасно забезпечити безпеку населення і розвиток медицини.
Висновок
Дельта-9-цис-тетрагідроканабінол (cis-THC) є хімічно і фармакологічно унікальним ізомером, що суттєво відрізняється від домінантного в природі Δ⁹-trans-THC. Відмінності в стереохімічній конфігурації молекули призводять до змін у взаємодії з біологічними мішенями, що відображається у зниженій афінності до класичних канабіноїдних рецепторів CB1 і CB2, зменшеній психоактивності та потенційно відмінному спектрі фармакологічної активності. Ця унікальність надає cis-THC перспективу як більш безпечного або спеціалізованого терапевтичного агента, особливо у випадках, де необхідно зменшити психоактивні ефекти, зберігаючи при цьому корисні фармакологічні властивості.
Синтетичні шляхи отримання cis-THC мають істотні складнощі, пов’язані з контролем стереоселективності, виходом та стабільністю продукту. Класичні методи синтезу часто є низьковихідними та мають обмежену практичну застосовність через складність реакцій і потребу у специфічних каталізаторах. Ізомеризація з інших канабіноїдів, таких як CBD та CBC, забезпечує альтернативний спосіб отримання cis-THC, але вона вимагає суворого контролю реакційних умов, щоб уникнути побічних продуктів і втрати селективності. Сучасні технології синтезу з використанням безперервних потоків, новітніх каталізаторів та біокаталізу поступово вирішують ці проблеми, підвищуючи ефективність, масштабованість і чистоту кінцевого продукту, що має велике значення для фармацевтичної промисловості.
У природному контексті cis-THC присутній у коноплі у дуже низьких концентраціях, особливо у волокнистих сортах, і відсутній або майже не виявляється в медичних сортів. Це обмежує можливості його прямого виділення з рослини, що стимулює розвиток синтетичних та напівсинтетичних методів виробництва. Біогенетичні механізми формування cis-THC залишаються недостатньо вивченими. Існують припущення, що він утворюється через ізомеризацію або епімерацію попередників, таких як CBD, у ході метаболічних процесів, однак конкретні ферментативні шляхи та їх регуляція в рослині залишаються предметом подальших досліджень. Розуміння цих механізмів має ключове значення для можливого біотехнологічного підходу до виробництва cis-THC.
Фармакологічний профіль cis-THC відрізняється не лише зниженим зв’язуванням з CB1 і CB2, а й активністю щодо інших рецепторних систем, зокрема GPR18 та GPR55, що відкриває нові горизонти для вивчення фармакодинаміки цього ізомера. Ці альтернативні шляхи взаємодії можуть пояснювати окремі фармакологічні ефекти, які не повністю корелюють із класичною канабіноїдною системою, що робить cis-THC потенційно цінним у контексті розробки нових лікарських засобів для лікування нейропатичного болю, запальних процесів і деяких психоневрологічних станів. Водночас, обмеженість наявних клінічних даних і відсутність масштабних досліджень ускладнює точну оцінку терапевтичного потенціалу і профілю безпеки.
Правове регулювання cis-THC є нестабільним і неоднозначним. Відсутність чітких визначень у міжнародних договорах і національному законодавстві створює правові прогалини і зону юридичної невизначеності, що ускладнює комерційне використання і наукові дослідження. Ізомер часто не включений у перелік контрольованих речовин або не розглядається окремо, що формує потенціал для його використання у медичних і наукових цілях без складних юридичних перепон, але одночасно створює ризики для легітимності діяльності у різних юрисдикціях. Для ефективного впровадження cis-THC у фармацевтику потрібне формування спеціалізованих нормативних актів, які враховуватимуть його унікальні властивості, потенціал і ризики.
Таким чином, cis-THC є важливою молекулою в контексті сучасної канабіноїдної хімії і фармакології з широким спектром потенційних застосувань, що випливають з його хімічної та фармакодинамічної унікальності. Перспективи його впровадження в медицину безпосередньо залежать від подальшого розвитку методів синтезу, глибшого розуміння біогенетичних механізмів, детального фармакологічного дослідження і адаптації правового поля. Зважаючи на комплексність проблем і потенціал, cis-THC займає проміжне положення між класичними канабіноїдами і новими фармацевтичними перспективами, що вимагає цілеспрямованих міждисциплінарних досліджень і регуляторних ініціатив для його оптимального використання.
Джерела:
- FDA (Управління з контролю за продуктами і ліками США) – Регулювання канабісу та продуктів, отриманих із нього, включаючи канабідіол (CBD)
https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd - Federal Register (Федеральний реєстр США) – Реалізація Закону про покращення сільського господарства 2018 року (Agriculture Improvement Act of 2018)
https://www.federalregister.gov/documents/2020/08/21/2020-17356/implementation-of-the-agriculture-improvement-act-of-2018 - PubMed Central / NCBI (Національний центр біотехнологічної інформації, США) – Аналіз потужності та безпеки продуктів із Δ⁹-тетрагідроканабінолом із конопель
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10369762/ - SAMHSA (Управління з питань зловживання психоактивними речовинами та психічного здоров’я, США) – Ізомерія тетрагідроканабінолу: підсумки зустрічі науково-консультативної ради DTAB
https://www.samhsa.gov/sites/default/files/meeting/documents/thc-isomerism.pdf - PubChem / NCBI (Національна медична бібліотека США) – Структура та властивості Delta-9-cis-тетрагідроканабінолу (cis-THC)
https://pubchem.ncbi.nlm.nih.gov/compound/Delta-9-cis-Tetrahydrocannabinol - NCBI / NIH (Національний інститут здоров’я США) – Cannabis sativa і канабіноїди: хімічний склад та біологічна активність
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6770351/ - SpringerLink / Archives of Toxicology – Фармакологічна дія Δ⁹-тетрагідроканабінолу та інших канабіноїдів
https://link.springer.com/article/10.1007/s00204-021-03003-3 - DEA (Управління з контролю за наркотиками США) – Класифікація наркотичних речовин, включно з похідними канабісу
https://www.dea.gov/drug-information/drug-scheduling - ScienceDirect / Elsevier – Канабіноїди: природна присутність та метаболізм у Cannabis sativa
https://www.sciencedirect.com/science/article/pii/S0031942219304381 - U.S. Department of Justice / Office of Legal Counsel – Правовий статус ізомерів Δ⁹-ТГК за Законом про контроль за наркотичними речовинами (CSA)
https://www.justice.gov/olc/opinion/legal-status-delta-9-thc-isomers-under-controlled-substances-act