Молекула Δ9-тетрагідроканабінолу (Δ9-THC) – одна з найвідоміших, водночас найконтроверсійніших і найменш коректно зрозумілих сполук, яка коли-небудь була виявлена в природі. Її хімічна стабільність, біологічна активність та фармакологічна полівалентність давно вивели цю сполуку за межі простого природного алкалоїду чи фітокомпонента. Δ9-THC став предметом досліджень у нейронауках, молекулярній біології, фармакології, хімії природних сполук, а також епіцентром юридичних, етичних та соціальних дебатів. Такий статус обумовлюється не лише здатністю молекули впливати на центральну нервову систему людини, а й її унікальним механізмом дії, що задіює ендогенну сигнальну систему, яка була виявлена в організмі людини порівняно нещодавно – ендоканабіноїдну систему.
Історично, вивчення Δ9-THC розпочалося з ізоляції активного компонента канабісу у 1964 році ізраїльськими хіміками Рафаелем Мешуламом та Юхелем Гаоні. Однак використання канабісу як психоактивної речовини та фітотерапевтичного засобу налічує тисячоліття. Археологічні дані засвідчують культивування Cannabis sativa ще у IV тисячолітті до н.е. на території сучасного Китаю. З плином часу змінювалися лише соціокультурні наративи: від священної рослини, інструменту медитації, до об’єкта криміналізації у XX столітті. Проте сама молекула THC – стабільна, біохімічно активна, ліпофільна структура – залишалася незмінною, і лише людське знання поступово розширювалося щодо її властивостей.
У біохімічному аспекті Δ9-THC є третинним фенолом класу канабіноїдів, що синтезується у трихомах – мікроскопічних залозах на поверхні жіночих квіток Cannabis sativa. У природному вигляді канабіс не містить психоактивного Δ9-THC, а його кислотну попередницю – тетрагідроканабінолову кислоту (THCA), яка під впливом температури або тривалого зберігання проходить процес декарбоксилювання, перетворюючись у активну форму. Цей перехід відкриває ключ до розуміння механізму психоактивної дії, що розгортається через взаємодію Δ9-THC з канабіноїдними рецепторами першого (CB1) та другого (CB2) типу. Саме така взаємодія викликає ефекти, які дослідники класифікують як зміну афекту, когніції, моторної координації, сприйняття болю, апетиту та часової оцінки.
Сучасна наука не зводить THC лише до психоактивного агента. Навпаки, з розвитком нейрофармакології, біомедичних технологій та молекулярної діагностики виникає дедалі ширше поле застосування цієї молекули у медичному контексті. Знеболювальні, протиблювотні, анксіолітичні та апетитостимулювальні властивості THC вивчаються як потенційна альтернатива або доповнення до традиційної фармакотерапії, особливо в онкології, паліативній медицині, психіатрії та геронтології. Багатообіцяючими є результати клінічних досліджень у терапії хронічного болю, посттравматичного стресового розладу (PTSD), кахексії та глаукоми. Усе це вказує на значний біомедичний потенціал THC, який ще належить реалізувати повною мірою, але виключно в межах строгої наукової методології.
Хімічна індустрія водночас розробляє нові методи синтезу, екстракції та очищення THC, що дозволяють отримувати стандартизовані, фармакологічно передбачувані препарати. Замість традиційного використання сушеної рослинної сировини сучасні лабораторії оперують чистими ізолятами, дистилятами, мікроемульсіями та навіть наноформами. Завдяки цим технологіям стає можливим точне дозування, модифікація біодоступності, керована доставка активної речовини у визначені тканини. Наприклад, суперкритична екстракція CO₂ дозволяє отримувати чисту фракцію Δ9-THC без залишків органічних розчинників, зберігаючи терпеновий профіль і цілісність хімічної структури. Такі розробки мають важливе значення для фармацевтичного сектора, де біодоступність і стабільність препарату є критичними параметрами.
У той самий час не можна ігнорувати наукову складність вивчення THC через його високу фармакодинамічну варіативність. Відомо, що індивідуальні відмінності в експресії CB1-рецепторів, активності ферментів метаболізму (зокрема CYP2C9, FAAH) та навіть мікробіому шлунково-кишкового тракту суттєво впливають на суб’єктивні й об’єктивні ефекти молекули. Це викликає потребу у персоналізованих дослідженнях і застосуванні фармакогенетичних підходів у майбутньому.
Наразі наукова парадигма стосовно THC переживає фазу трансформації: від стигматизованої речовини до об’єкта системного міждисциплінарного аналізу. І тут важливо не зводити обговорення до бінарної дихотомії “користь чи шкода”. Δ9-THC – це не просто “психоактивна речовина” або “ліки”: це біологічно активна молекула, що взаємодіє із складною сигнальною мережею ендоканабіноїдної системи, наслідки якої можуть бути як терапевтичними, так і патогенними залежно від дозування, частоти, віку, генотипу, супутніх захворювань і багатьох інших змінних. Саме така багатовекторність ефектів унеможливлює спрощене трактування молекули.
Крім того, THC – це феномен, що має не лише біохімічний вимір, а й технологічний, соціальний, юридичний та філософський. З одного боку, ми маємо справу з хімічною сполукою, яка може бути синтезована у лабораторії чи екстрагована з рослинної сировини; з іншого – з субстанцією, наділеною складним історичним і нормативним контекстом. В одних країнах Δ9-THC є дозволеним фармацевтичним агентом, у інших – незаконною психоактивною речовиною. Але жоден правовий статус не змінює об’єктивної хімічної природи молекули – її фармакологічні властивості, взаємодії з рецепторами чи кінетику в тканинах.
У науковому розумінні важливо не робити жодних апріорних оцінок – ані позитивних, ані негативних – без суворих доказів. І саме тому сучасні дослідження THC зосереджені не на моральній чи політичній легітимності використання, а на точному описі його молекулярної дії, потенційних ризиків та користі. Такий підхід дозволяє поступово перетворювати THC з об’єкта табу на повноцінний елемент фармакопеї та предмет глибоких міждисциплінарних досліджень.
Хімічна природа Δ9-Тетрагідроканабінолу
Δ9-Тетрагідроканабінол (Δ9-THC) є представником класу натуральних ліпофільних терпен-фенолів, притаманних виключно роду Cannabis. Його хімічна природа є прикладом складної біоорганічної архітектури, яка демонструє високий рівень еволюційної адаптації до взаємодії з біологічними мішенями ссавців. Незважаючи на свою природну приналежність до рослинних метаболітів, Δ9-THC поєднує в собі ознаки структурної гнучкості, стереоспецифічності, функціональної мультипотентності й вираженої хімічної реактивності. Це не просто фармакологічно активна сполука – це біохімічно адаптований сигнальний модулятор, здатний змінювати нейробіологічні патерни через точну і специфічну взаємодію з канабіноїдними рецепторами, мембранними ліпідами, іонними каналами та численними ферментативними системами.
Хімічна природа Δ9-THC відображає три фундаментальні ознаки: багатокомпонентну циклічну будову, значну гідрофобність і наявність хірального центру. Трициклічна система з ароматичним ядром і частково насиченими кільцями створює молекулу, яка є одночасно структурно стабільною і конформаційно динамічною. Це забезпечує здатність до оборотної адаптації при зв’язуванні з білковими структурами, зокрема із гідрофобними кишенями рецепторів. Основна молекулярна рамка Δ9-THC містить бензольний кільцевий фрагмент, який забезпечує π-π взаємодії, а також фрагмент ізопренового походження – аліфатичний пентильний бічний ланцюг, що бере участь у гідрофобних зв’язках із білковими залишками. Такі ланцюги відіграють ключову роль у селективності та спорідненості до канабіноїдних рецепторів, адже навіть мінімальні модифікації в цій області призводять до радикальних змін фармакологічного профілю.
Унікальною рисою Δ9-THC є його здатність існувати у вигляді чітко визначеного стереоізомера. Природна форма – це (-)-trans-ізомер, який має один асиметричний центр при атомі вуглецю в положенні C9. Це означає, що молекула може існувати у двох енантіомерних формах, проте лише один енантіомер демонструє біологічну активність на рецепторах CB1 і CB2. Хіральність у цьому контексті не є другорядною характеристикою – це критичний чинник у визначенні фармакологічної специфічності. Дослідження з використанням хірально чистих синтетичних аналогів довели, що зміна конфігурації в ділянці C9 призводить до зниження спорідненості з рецептором більш ніж у 30 разів, навіть за збереження всіх інших структурних елементів.
Δ9-THC є хімічно амфіфільною сполукою, однак із суттєво переважаючими ліпофільними властивостями. Його коефіцієнт розподілу logP перевищує 6, що робить його однією з найбільш гідрофобних сполук серед натуральних продуктів рослинного походження, які мають фармакологічну активність. Ця властивість зумовлює кілька важливих біохімічних наслідків: по-перше, швидке накопичення в мембранних структурах нейронів і жировій тканині; по-друге, уповільнене виведення з організму; по-третє, здатність до перехресної взаємодії з іншими ліпофільними агентами, включно з лікарськими засобами. Саме через надзвичайну ліпофільність Δ9-THC демонструє схильність до нелінійної фармакокінетики, особливо при хронічному вживанні, коли відбувається насичення тканинних депо.
Іншим важливим аспектом хімічної природи Δ9-THC є його відносна нестабільність у середовищах, багатих на кисень, світло та тепло. Окислювальна деградація молекули – головним чином у присутності ультрафіолетового випромінювання – призводить до утворення канабінолу (CBN), який значно поступається THC за афінністю до рецепторів і практично не має психоактивного ефекту. Важливо зазначити, що цей процес не є миттєвим, але накопичується поступово, внаслідок чого старі зразки канабісу мають змінений хімічний профіль. Саме через це хіміко-аналітична ідентифікація та кількісне визначення THC повинна враховувати ступінь деградації та ізомеризації, які відбулись під час зберігання або обробки зразка.
Δ9-THC також виявляє схильність до взаємодій із металевими іонами, зокрема Mg²⁺ та Zn²⁺, що можуть мати значення в контексті ферментативної трансформації або біоакумуляції. Дослідження in vitro показують, що Δ9-THC може бути субстратом для систем цитохрому P450, особливо ізоферментів CYP2C9 і CYP3A4, які здійснюють окислювальний метаболізм молекули у печінці. Основними метаболітами є 11-гідрокси-THC (фармакологічно активний) та 11-нор-9-карбоксі-THC (неактивний, але метаболічно стабільний). Це означає, що хімічна природа Δ9-THC не обмежується лише його структурою в момент поглинання, а й включає повний спектр його трансформацій у біологічному середовищі.
Ще одним маловідомим аспектом хімічної природи Δ9-THC є його здатність до агрегації у ліпідних середовищах. Дослідження за допомогою атомно-силової мікроскопії та спектроскопії флуоресценції показали, що за певних умов концентрації THC може формувати нановезикули або ліпідоподібні домени, що мають здатність модулювати реологічні властивості мембран. Це відкриває новий напрямок вивчення мембранно-активних властивостей канабіноїдів, який раніше залишався практично недослідженим.
З хімічної точки зору Δ9-THC – це також сполука з великою потенційною реактивністю. Поряд із уже згаданими реакціями деградації, молекула здатна вступати у кон’югацію з глутатіоном, глюкуроновою кислотою або сульфатною групою – процеси, що мають критичне значення для її знешкодження і виведення. Такі реакції забезпечують перетворення гідрофобної молекули на більш водорозчинні похідні, які можуть транспортуватися плазмою крові або виводитись через нирки. Це вказує на складну, багатоетапну взаємодію хімічної природи Δ9-THC з детоксикаційними системами організму.
Хімічна природа Δ9-THC визначає також його взаємодію з іншими фітоканабіноїдами. Дослідження синергізму та антагонізму з канабідіолом (CBD), канабігеролом (CBG) чи канабіхроменом (CBC) вказують, що наявність THC у суміші з іншими канабіноїдами змінює його біологічну активність. Частково це пояснюється змінами у фізико-хімічних властивостях – наприклад, CBD може змінювати розчинність THC у водному середовищі, стабільність при нагріванні або метаболічний шлях.
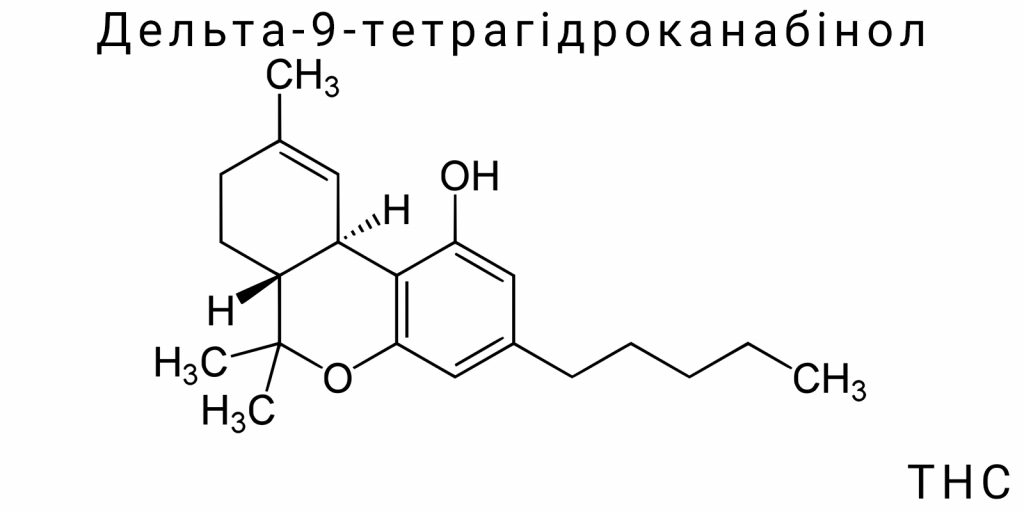
Структурна формула та основні властивості
Δ9-Тетрагідроканабінол – це високомолекулярна сполука з розгалуженою структурною організацією, в основі якої лежить трициклічна система, утворена поєднанням ароматичного кільця, частково насиченого циклопентану та тетрагідропіранового кільця. Така архітектура є нетиповою серед природних метаболітів, адже поєднує ознаки фенілу, терпеноїдної та полікетидної природи, що вказує на складну біосинтетичну еволюцію та глибоку функціональну спеціалізацію. Структура Δ9-THC може бути представлена за допомогою розгорнутої конституційної формули, яка чітко демонструє локалізацію ключових функціональних груп, зокрема фенольного гідроксилу, третинного спирту та метиленових сегментів пентильного ланцюга, що з’єднаний із ароматичним кільцем у положенні C3.
Фенольна гідроксильна група в положенні C1 відіграє важливу роль у реакціях кислотно-основної рівноваги, утворенні водневих зв’язків, а також потенційному метаболічному окисленні. У свою чергу, третинна гідроксильна група, розташована в аліциклічному кільці, є менш реактивною, проте вона виступає ключовим центром для фаз ІІ метаболізму, зокрема кон’югації з глюкуроновою кислотою. Протилежна сторона молекули утворена пентильною бічною групою – гнучким, незамкненим алкільним фрагментом, який взаємодіє з гідрофобними кишенями канабіноїдних рецепторів. Її довжина та розгалуження є критичними параметрами: варіації навіть на один метиленовий фрагмент радикально змінюють спорідненість до рецепторів CB1 і CB2, що підтверджено численними SAR-дослідженнями (Structure-Activity Relationship).
Ще одним принциповим структурним елементом є подвійний зв’язок у положенні Δ9 (між атомами вуглецю C9 і C10). Саме цей фрагмент визначає належність сполуки до категорії Δ9-ізомерів, на відміну від Δ8- або Δ10-форм, які є менш поширеними та мають змінені фармакологічні властивості. Локалізація цієї π-зв’язаної системи впливає на планарність частини молекули та її здатність до електронної делокалізації, що в свою чергу позначається на афінності до мембранних рецепторів. Тривимірна конфігурація молекули є напівжорсткою: хоч деякі зв’язки в аліфатичних ділянках здатні до вільного обертання, наявність циклічних фрагментів значно обмежує конформаційну гнучкість. Це створює унікальний профіль взаємодії з біологічними мішенями, що відрізняє Δ9-THC від простіших, більш флексибельних ліпофільних молекул.
Термодинамічні параметри THC, такі як температура плавлення (~66°C), температура кипіння (157°C при тиску 0.05 мм рт. ст.), а також низька розчинність у воді (<0.003 г/л), відображають його амфіфільну, проте виразно ліпофільну природу. Здатність Δ9-THC до сублімування при зниженому тиску та його нестійкість до тривалого нагрівання або УФ-опромінення пов’язані з делікатним балансом між кон’югованими й насиченими ділянками молекули. Цей баланс визначає також спектральні властивості сполуки: УФ-абсорбційний максимум у ділянці 270-280 нм, а також специфічні коливання в ІЧ-спектрі, що відображають фенольні, аліфатичні та етерні вібрації.
У розчині Δ9-THC може утворювати специфічні міжмолекулярні асоціати, особливо в неполярних середовищах, де гідрофобна агрегація призводить до формування мікрокластерів. Цей ефект не є тривіальним – він змінює розчинність, дифузію, та навіть фармакокінетичні параметри при трансдермальному або інгаляційному введенні. Також важливо зазначити, що конформаційна стабільність молекули зростає в ліпідному оточенні, що частково пояснює її тропність до ліпідних доменів біомембран та високу спорідненість до нейрональних рецепторів, занурених у фосфоліпідний бішар.
Молекулярна формула: C₂₁H₃₀O₂
Молекулярна формула Δ9-ТГК – C₂₁H₃₀O₂ – відображає точний кількісний склад елементів, які формують цю складну органічну сполуку. Ця формула демонструє наявність 21 атома вуглецю, 30 атомів водню і 2 атомів кисню, що відповідає відносній молекулярній масі близько 314.45 г/моль. Важливо не зводити її до простої числової конфігурації, адже кожен із цих атомів бере участь у визначенні функціональних і фізико-хімічних властивостей молекули. Наприклад, із 21 атома вуглецю щонайменше 15 беруть участь у формуванні циклічних структур або кон’югованих систем, які є критичними для активності на рецепторах CB1/CB2.
Наявність двох атомів кисню у складі молекули – це не просто функціональні групи, а стратегічно локалізовані атоми, які формують фенольний гідроксил (-OH) і третинний спирт. Обидва ці центри мають електронодонорний характер, впливають на електронну щільність у локальних ділянках молекули, та служать як потенційні точки для хімічної модифікації або біотрансформації. Слід враховувати також ізотопний склад – присутність стабільних ізотопів, таких як ¹³C або ²H (деутерій), може бути використана для мічення молекули в метаболомних дослідженнях або вивченні фармакокінетики за допомогою мас-спектрометрії.
C₂₁H₃₀O₂ – це формула, яка поєднує в собі терпенову та фенольну природу: 15 з 21 атома вуглецю походять із ізопренових одиниць, що свідчить про терпенову основу молекули, інші 6 є похідними фенольного ядра та пентильного ланцюга. Такий гібридний характер обумовлює особливу поведінку Δ9-THC у біологічних системах, зокрема здатність до перехресної взаємодії з іншими вторинними метаболітами, які мають подібну елементну формулу, але різну просторову структуру.
Молекулярна формула також визначає потенціал до іонізації, хоча Δ9-THC практично не іонізується у фізіологічному pH. Це пов’язано з відсутністю сильнокислотних або сильноосновних груп, що знижує здатність до електростатичних взаємодій, але збільшує здатність до проникнення через ліпідні мембрани. Крім того, обмежена кількість атомів кисню зменшує полярність молекули, що прямо впливає на коефіцієнт розподілу між органічною та водною фазами.
Формула C₂₁H₃₀O₂ також накладає обмеження на спектр можливих реакцій, в яких THC може брати участь. Наприклад, реакції галогенування, етерифікації, ацилювання чи окиснення можуть відбуватися лише за участі певних ділянок молекули. Це критично важливо для розробки напівсинтетичних похідних THC, які мають модифіковану біодоступність або специфічність до рецепторів. Таким чином, базова молекулярна формула є фундаментом для структурної модифікації та хімічного редизайну в фармацевтичному контексті.
Структура, хіральність, ліпофільність
Δ9-THC є типовим прикладом хіральної біоактивної сполуки з виразною ліпофільною характеристикою та структурною складністю, яка визначає його біохімічну поведінку. Хіральний центр локалізується в положенні C9, де вуглець має чотири різні замісники, що створює можливість існування двох енантіомерів. Природним є (-)-trans-ізомер, що володіє афінністю до рецепторів CB1/CB2, тоді як інші енантіомери, хоч і можуть бути синтезовані штучно, позбавлені значущої біологічної активності.
Наявність хіральності у Δ9-THC критично впливає на його фармакодинаміку, адже рецептор CB1 має хіральну кишеню, чутливу до конфігурації ліганду. Це означає, що лише правильна просторова орієнтація дозволяє здійснити повноцінну міжмолекулярну взаємодію. Розташування хірального центру також визначає специфіку зв’язування молекули в межах ліпідного шару біомембран, адже лише один із енантіомерів може займати термодинамічно стабільну конформацію при вбудовуванні в фосфоліпідний бішар.
Ліпофільність Δ9-THC є вираженою і багатоаспектною. Високий logP (більше 6) вказує на домінування неполярних ділянок у молекулі, що забезпечує пасивну дифузію через мембрани. Це особливо важливо для проникнення через гематоенцефалічний бар’єр, що зумовлює центральну дію THC. Проте така ліпофільність є причиною затримки в організмі, акумуляції в жировій тканині та довгого періоду напіввиведення. Крім того, вона створює труднощі для водорозчинних фармацевтичних форм, що стимулює пошук ліпідних носіїв або нанотранспортних систем для доставки THC.
Взаємозв’язок між структурою, хіральністю та ліпофільністю – це основа молекулярної фармакології Δ9-THC. Саме ця тріада дозволяє молекулі функціонувати як природний біоактивний агент, здатний до специфічного, гнучкого й адаптивного зв’язування з широким спектром клітинних мішеней.
Біогенез THC в Cannabis sativa
Біосинтез Δ9-Тетрагідроканабінолу (THC) у рослині Cannabis sativa являє собою складний багатоступеневий процес, що включає взаємодію численних ферментативних реакцій у специфічних клітинних структурах. Головним біохімічним шляхом утворення THC є канабіноїдний шлях, який починається із синтезу прекурсорів із загальноклітинних метаболічних мереж і завершується утворенням канабіноїдної кислоти – канабігінової кислоти (THCA), яка в подальшому за умов нагрівання перетворюється у психоактивний Δ9-THC. Відповідні ензими локалізовані переважно в олійних залозах (трихомах) рослини, де формуються характерні кристалічні структури, що відповідають за накопичення і концентрацію канабіноїдів.
Основний біохімічний маршрут починається з конденсації молекули геранілпірофосфату (GPP) та олівної кислоти (олевої кислоти), що каталізується ферментом канабіноїд-синтазою. Результатом цієї реакції є формування канабіноїдних кислот – зокрема, прекурсору THCA. Надалі THCA служить матрицею для формування активного THC, який є одним з головних психоактивних компонентів. Важливо, що біосинтез канабіноїдів є строго регульованим процесом, який залежить від генетичних факторів, екологічних умов та етапу розвитку рослини.
Продукція THCA переважно відбувається у спеціалізованих епідермальних клітинах трихом – мікроскопічних олійних залозах, які формують захисний бар’єр, одночасно накопичуючи активні метаболіти. Здатність трихом до синтезу і зберігання канабіноїдів визначає концентрацію Δ9-THC у кінцевому продукті, а їх морфологія і густина є ключовими показниками селекції для сортів із підвищеним вмістом психоактивних речовин.
Процес декарбоксилювання, тобто хімічне перетворення THCA у Δ9-THC, відбувається під впливом тепла або тривалого зберігання. Ця реакція включає втрату карбоксильної групи (CO₂), що змінює хімічну структуру, активуючи молекулу до здатності зв’язуватися з канабіноїдними рецепторами організму людини. Порушення або неповне декарбоксилювання може значно знизити фармакологічну активність кінцевого продукту. Тому оптимізація цього процесу є суттєвим етапом у виробництві медичних і рекреаційних препаратів із Cannabis sativa.
Канабіноїдний шлях біосинтезу
Канабіноїдний шлях біосинтезу є одним з найбільш детально вивчених метаболічних маршрутів у рослинах, який визначає формування унікальної групи тетрагідроканабінолових сполук. Його початком є реакція конденсації ізопренової одиниці геранілпірофосфату з фенольним прекурсором – олівою кислотою, утворюючи канабігеролову кислоту (CBGA), яка є ключовим проміжним продуктом. CBGA, у свою чергу, служить спільним предшественником для різних канабіноїдів, включно з THCA, CBDA (канабідіолова кислота) та CBCA (канабіхроменова кислота).
Ферментативне перетворення CBGA у THCA відбувається під дією ферменту THCA-синтази, яка є високоселективною оксидоредуктазою, що каталізує циклізацію та окислення молекули. Вивчення структури та механізму дії цього ферменту дозволяє зрозуміти молекулярну специфіку утворення психоактивного канабіноїда. Генетичні варіації ферменту, експресія відповідних генів, а також зовнішні фактори, такі як температура і світловий режим, суттєво впливають на кінцевий вихід THCA.
У контексті метаболічного контролю, канабіноїдний шлях включає взаємодію з іншими метаболічними ланками, такими як терапеновий та фенольний шляхи, які постачають субстрати і визначають хімічний профіль рослини. Така інтеграція забезпечує не лише синтез THC, але і формування комплексу супутніх вторинних метаболітів, які модулюють фармакологічну активність кінцевого продукту.
Роль олійних залоз (трихом)
Олійні залози, або трихоми, є мікроскопічними структурамі на поверхні Cannabis sativa, які виконують роль біореакторів для синтезу, накопичення та зберігання канабіноїдів, у тому числі THC. Вони представлені у трьох основних формах: голчасті, листові та капсульні трихоми, з яких капсульні найбільш відповідальні за продукцію олійного смоляного екстракту.
Морфологія трихом передбачає наявність залозистої голівки, наповненої ліпофільною смолою, багатою на канабіноїди та терпеноїди. Ці смоли захищають рослину від патогенів, ультрафіолетового випромінювання і висихання. Рівень розвитку трихом безпосередньо корелює із здатністю рослини продукувати THC, тому селекція і культивація рослин із високою щільністю трихом є стратегічним завданням для підвищення виходу психоактивних компонентів.
Біохімічні процеси всередині трихом включають високий рівень експресії ферментів канабіноїдного шляху, синтез коферментів та активну транспортну діяльність, яка забезпечує локалізацію метаболітів у секреторних вакуолях. Також трихоми виступають бар’єром, ізолюючи токсичні продукти метаболізму від основних тканин рослини, що мінімізує їх вплив на фізіологічні функції.
THCA → Δ9-THC: процес декарбоксилювання
Перетворення канабіноїдної кислоти THCA у активну форму Δ9-THC є хімічним процесом декарбоксилювання, що характеризується втратою карбоксильної групи (-COOH) у вигляді вуглекислого газу. Ця реакція критична для активації психоактивних властивостей канабіноїду, оскільки THCA сама по собі не взаємодіє з канабіноїдними рецепторами в організмі людини.
Процес декарбоксилювання відбувається при нагріванні THCA до температури близько 105-145 °C, що може бути реалізовано природним шляхом під впливом сонячного тепла, під час сушіння рослинної сировини, або штучно в технологічних установках. Кінетика реакції залежить від температурного режиму, вологості та тривалості обробки. Надмірне нагрівання може призвести до подальшої деградації THC у каннабінони, що має знижений фармакологічний потенціал.
На молекулярному рівні декарбоксилювання спричинює зміну електронної конфігурації молекули, що підвищує її спорідненість до CB1-рецепторів головного мозку, і, як наслідок, посилює психоактивний ефект. Розуміння детальної механіки цього процесу має ключове значення для оптимізації методів екстракції та виробництва лікарських засобів, які містять THC.
Виробництво: Від рослини до активної молекули
Процес трансформації канабісу з біологічної сировини у високоспецифічну активну речовину – Δ9-тетрагідроканабінол – є багатокомпонентною процедурою, яка охоплює повний ланцюг: від вирощування ботанічного матеріалу до отримання фармацевтично придатного субстрату з контрольованими параметрами чистоти, стабільності та біодоступності. У контексті цього перетворення варто розглядати не лише технологічну сторону, а й біохімічну, агрономічну та навіть нормативну, адже ці аспекти безпосередньо впливають на якісний склад кінцевого продукту.
Початковим етапом виробничого циклу є культивація рослин роду Cannabis, які, на відміну від багатьох інших лікарських культур, демонструють високий ступінь хемотипової варіативності. Навіть у межах одного виду можуть спостерігатися суттєві відмінності в профілі вторинних метаболітів, включно з кількісним співвідношенням Δ9-THC, канабідіолу (CBD), канабігеролу (CBG) та інших канабіноїдів. Ця хемоваріабельність зумовлена не лише генетичними чинниками, а й умовами культивації, такими як фотоперіод, температура, вологість, pH і склад ґрунту, а також інтенсивність ультрафіолетового випромінювання. Практика показує, що навіть незначні коливання в агротехнічних параметрах можуть призвести до зміни канабіноїдного профілю, зокрема концентрації Δ9-THC, в межах десятків відсотків. Саме тому сучасні виробничі підходи вимагають повної стандартизації умов вирощування, часто із застосуванням закритих тепличних систем, гідропоніки або аеропоніки з комп’ютеризованим контролем кожного етапу.
Після культивації та збору рослинної маси ключовим завданням є стабілізація сировини та запобігання деградації канабіноїдів. Це передбачає обережне сушіння при температурі, що не перевищує поріг декарбоксилювання кислоти THCA, який є неактивною формою Δ9-THC. Сушіння має бути достатнім для запобігання розвитку мікрофлори, але водночас не настільки інтенсивним, щоб стимулювати деградацію терпенів чи ініціювати конверсію THCA у Δ9-THC до того, як цей процес буде контрольовано реалізовано на наступному етапі. У цьому контексті особливу роль відіграє також стабільність трихом – спеціалізованих залозистих структур, у яких відбувається синтез і накопичення канабіноїдів. Надмірне механічне або термічне втручання в структуру трихом призводить до втрати біоактивних компонентів, що знижує вихід цільової речовини.
Наступним етапом є власне екстракція – виділення Δ9-THC із загального матриксу шляхом селективного руйнування клітинних стінок та перенесення активних сполук у рідке або напівтверде середовище. На цьому етапі застосовуються різні технології, які значно відрізняються за ефективністю, специфічністю, безпечністю й екологічністю. Традиційно використовували механічні методи, як-от просіювання сухої сировини (для отримання кефу) або ручне пресування (хеш). У промисловому контексті ці методи вважаються недостатньо ефективними, оскільки вони не забезпечують належного ступеня концентрації та очищення Δ9-THC. Натомість більш досконалими є розчинникові методи, які передбачають використання полярних або неполярних екстрагентів (етанолу, бутану, гексану, надкритичного CO₂) з подальшою фільтрацією, дистиляцією та рефракційним очищенням. Окремо варто згадати про сучасні підходи, зокрема хроматографічні методи, молекулярну дистиляцію, а також екстракцію за допомогою надкритичних флюїдів, які дозволяють досягати фармацевтичної чистоти без залишків токсичних розчинників.
Здобутий екстракт у більшості випадків містить Δ9-THC у вигляді кислотної форми – THCA, яка є фармакологічно неактивною. Перетворення THCA на Δ9-THC здійснюється шляхом контрольованого декарбоксилювання – процесу термічного руйнування карбоксильної групи з утворенням активної молекули та вивільненням вуглекислого газу. Цей процес критично залежить від температури й тривалості нагрівання: оптимальною вважається температура близько 110-120°C протягом 30-60 хвилин, однак у промислових умовах можуть застосовуватись більш точні температурно-часові протоколи з використанням вакуумного середовища для запобігання окисленню. У результаті цього етапу формується саме та цільова форма Δ9-THC, яка має високу біодоступність і рецепторну афінність.
Фінальний етап виробництва полягає в стандартизації, аналізі та стабілізації отриманої субстанції. Це передбачає кількісне визначення Δ9-THC за допомогою ВЕРХ або ГХ-МС (високоефективної рідинної або газової хроматографії), визначення залишкових розчинників, важких металів, мікробіологічних контамінантів, а також профілю терпенів. Продукт, що отримується на цьому етапі, може бути представлений у вигляді концентрату, ізоляту, смоли або мікроемульсії – залежно від призначення (фармацевтичного, нутрицевтичного або рекреаційного).
Джерело: ботанічні аспекти Cannabis sativa і Cannabis indica
Родина Cannabaceae включає кілька ботанічних видів, найбільш відомими серед яких є Cannabis sativa і Cannabis indica. Ці види є основними джерелами для виробництва Δ9-тетрагідроканабінолу (Δ9-THC) і мають суттєві відмінності на рівні морфології, хімічного складу і біологічної активності. Перш за все, важливо відзначити, що біологічні відмінності між цими видами пов’язані не лише з класичними ботанічними ознаками, а й з різною регуляцією синтезу вторинних метаболітів, що визначає їх застосування у медичній, промисловій та рекреаційній сферах.
Cannabis sativa історично асоціюється з північними та помірними кліматичними зонами, має більші за розмірами рослини із тонкими листками і менш щільними суцвіттями. Цей вид відрізняється довшим вегетаційним циклом, що може впливати на кінцевий вміст Δ9-THC. Біохімічно sativa схильна продукувати більшу кількість психоактивного Δ9-THC відносно інших канабіноїдів, проте існують значні варіації залежно від генотипу. З точки зору фармакокінетики і фармакодинаміки, продукти із sativa часто характеризуються більш стимулюючим ефектом, що пов’язують із співвідношенням канабіноїдів та терпеноїдів, а також із взаємодією із рецепторами центральної нервової системи.
Cannabis indica, в свою чергу, має компактніший стебло, ширші листя і більш щільні суцвіття. Цей вид краще пристосований до високогірних і субтропічних кліматичних умов, що проявляється у коротшому циклі цвітіння і більш інтенсивній біосинтетичній активності тривіальних метаболітів. Характерною рисою indica є, як правило, більш високий вміст CBD у співвідношенні до Δ9-THC, що формує більш виражений седативний ефект кінцевих препаратів. Ці властивості мають фундаментальне значення для фармакотерапії, зокрема у випадках потреби у зниженні тривоги, полегшенні болю та покращенні сну.
Генетична та хемотипова різноманітність обох видів визначає не лише фізичні параметри, а й продуктивність синтезу Δ9-THC. Результати недавніх молекулярно-генетичних досліджень показали, що механізми регуляції гена THCAS, який кодує фермент тетрагідроканабінол-синтазу, різняться між sativa і indica, що підтверджує концепцію їх роздільної еволюції та адаптації до різних екологічних ніш. Унаслідок цього концентрація і хімічний профіль Δ9-THC можуть суттєво коливатись не лише між видами, а й між окремими популяціями одного виду.
Морфологічні відмінності
Морфологічні особливості Cannabis sativa і Cannabis indica не лише визначають зовнішній вигляд рослин, а й впливають на метаболізм та накопичення активних речовин, зокрема Δ9-THC. Sativa характеризується високими стеблами, що можуть досягати 4-6 метрів, і вузькими, пальчастими листками із довгими, тонкими пальцями. Це забезпечує ефективне фотосприйняття в умовах відкритих просторів і більш тривалих світлових періодів. Суцвіття у sativa зазвичай більш розріджені, з меншою щільністю трихом, що потенційно впливає на концентрацію канабіноїдів у рослині.
Indica натомість має низькорослу, кущисту форму з більш широкими листками, які мають товстіший і більший розмір. Суцвіття більш компактні, густо вкриті смолистими трихомами, що забезпечує підвищене накопичення канабіноїдів і терпеноїдів. Ця морфологія відображає адаптацію до коротшого фотоперіоду і більш екстремальних кліматичних умов, зокрема у високогір’ях. Морфологічні відмінності також впливають на співвідношення площі листя до об’єму стебла, що віддзеркалюється у метаболічних процесах і накопиченні біоактивних компонентів.
Крім того, різниця в структурі трихом між видами відома як ключовий фактор, що визначає продуктивність Δ9-THC. Трихоми у indica більш численні і мають вищу концентрацію ферментів, відповідальних за синтез канабіноїдів, що сприяє збільшенню концентрації активної молекули. Водночас у sativa трихоми більш розріджені, що пояснює нижчий середній вміст Δ9-THC у сировині. Ця морфологічна база має важливе значення для агрономічного вибору сортів із метою оптимізації виробництва Δ9-THC.
На молекулярному рівні морфологічні характеристики також визначають регуляцію генів, що беруть участь у розвитку трихом і метаболізмі канабіноїдів. Проте варто зазначити, що міжморфологічні відмінності не завжди корелюють із хемотиповою різноманітністю, оскільки фактори зовнішнього середовища можуть модифікувати експресію генів і змінювати хімічний профіль рослин. Таким чином, морфологія є важливою, але не виключною ознакою, що характеризує ботанічні особливості джерела Δ9-THC.
Зміст THC залежно від сорту, ґрунтів, агротехніки
Концентрація Δ9-THC у рослинах Cannabis є динамічною величиною, яка значною мірою залежить від комбінації генетичних та екологічних чинників, а також від методів агротехнічного управління. На рівні сортів існує суттєва варіація в продуктивності синтезу Δ9-THC, що є результатом селекційних програм, спрямованих на підвищення терапевтичної або рекреаційної цінності рослин. Деякі сорти характеризуються екстремально високим вмістом Δ9-THC, що перевищує 20-25%, тоді як інші зосереджені на балансі з іншими канабіноїдами, зокрема CBD.
Ґрунтові умови відіграють критичну роль у визначенні рівня накопичення Δ9-THC, оскільки мінеральний склад, структура, аерація та водоутримувальна здатність впливають на метаболічні процеси в рослині. Наприклад, дефіцит азоту може призводити до зниження росту вегетативної маси, проте стимулювати підвищений синтез вторинних метаболітів, включно з Δ9-THC. Натомість надлишок азоту часто асоціюється зі зменшенням концентрації канабіноїдів. Аналогічно, рівень фосфору, калію, кальцію та мікроелементів має прямий вплив на функціонування ферментативних систем, що визначають продуктивність біосинтезу.
Агротехнічні практики, зокрема режими поливу, освітлення, густота посадок і застосування стимуляторів росту, також визначають кінцевий вміст Δ9-THC. Інтенсивність світлового режиму, особливо у спектрі UV-B, стимулює синтез канабіноїдів через активацію систем захисту рослини від ультрафіолетового стресу. У відповідь на такі умови рослини активізують виробництво смолистих речовин, серед яких основним є Δ9-THC. Контроль вологості повітря і ґрунту має забезпечувати оптимальні умови для росту трихом і запобігати розвитку хвороб, що можуть знизити якість сировини.
Методи екстракції Δ9-ТГК
Екстракція Δ9-тетрагідроканабінолу (Δ9-THC) є критичним етапом у виробництві як медичних, так і рекреаційних препаратів на основі конопель. Технологічна ефективність, чистота та вихід активної молекули залежать від обраного методу екстракції. Історично екстракція базувалась на простих механічних принципах, які з часом трансформувались у більш складні хімічні та фізико-хімічні процеси, що враховують хімічну природу Δ9-THC, його ліпофільність та термочутливість. Кожен метод має свої переваги і недоліки, а також специфічне застосування залежно від кінцевих цілей виробництва, обсягу та нормативних вимог.
Основою для ефективної екстракції є правильний підбір сировини, ступінь подрібнення, температура і тривалість процесу. Δ9-THC, як жиророзчинний і термочутливий канабіноїд, вимагає дотримання умов, що запобігають його деградації або трансформації в інші форми, зокрема Δ8-THC або каннабінол. Відповідно, оптимізація методів екстракції полягає в балансуванні між максимальною ефективністю вилучення і збереженням стабільності молекули.
Сучасний розвиток технологій передбачає перехід від традиційних, часто низькоефективних методів, до високотехнологічних систем, що включають використання супер-критичних флюїдів, ультразвуку та мембранних процесів очищення. Водночас базові механічні і хімічні способи залишаються широко розповсюдженими через простоту, доступність обладнання і економічну вигідність. Розуміння їхніх механізмів дії, а також обмежень, є важливим для комплексного підходу у промисловому масштабі.
Традиційні (механічні)
Традиційні механічні методи екстракції Δ9-THC базуються на фізичному відділенні смолистих речовин і трихом від рослинної матриці без застосування хімічних розчинників. Ці методи широко використовувалися задовго до появи складних технологій і збереглися у вигляді базових підходів через простоту реалізації і мінімальний вплив на довкілля.
Одним із найпоширеніших механічних способів є просіювання або фільтрація замороженого подрібненого рослинного матеріалу через сітки різного розміру. Цей процес дозволяє відокремити смолу, яка містить значну концентрацію Δ9-THC, у вигляді так званої “кінської шапки” або сухого конопляного пилу – концентрату трихомів. Важливою умовою є підтримка низьких температур, що мінімізує втрати летких компонентів та запобігає тепловій деградації Δ9-THC.
Ще одним традиційним методом є пресування (холодне або гаряче), під час якого механічним тиском із рослинної маси виділяють олії, багаті на Δ9-THC. Хоча цей метод дозволяє отримати концентрат без хімічних домішок, він не забезпечує високу чистоту, оскільки разом з активними речовинами можуть екстрагуватися вуглеводні, клітинні рештки та інші рослинні компоненти.
Використання льоду, води і механічного тертя у вигляді водяної екстракції теж відноситься до традиційних способів. Цей метод базується на здатності смолистих трихом відокремлюватись під впливом холодної води і руху, що дозволяє отримати концентрати, відомі як “ваш” або “bubble hash”. Він не залучає хімічних реагентів, проте є більш трудомістким і менш масштабованим для промислового виробництва.
Недоліком механічних методів є нижча концентрація кінцевого продукту, наявність домішок, а також значні втрати активної речовини через неповне вилучення або деградацію в процесі. Проте вони залишаються привабливими для невеликих виробництв і споживачів, які орієнтуються на натуральність і екологічність.
Хімічні (екстракція розчинниками)
Хімічна екстракція Δ9-THC використовує органічні розчинники для розчинення і вилучення активної молекули із рослинної тканини. Цей метод є домінуючим у промисловому масштабі через високу ефективність, можливість контролю процесу і отримання концентратів з високою чистотою.
Серед розчинників найбільш поширені бутан, етанол, ізопропанол, супер-критичний вуглекислий газ, а також гексан і ацетон. Вибір розчинника визначається хімічними властивостями Δ9-THC, зокрема його ліпофільністю, і вимогами до кінцевої продукції. Наприклад, бутан забезпечує швидку екстракцію з мінімальним впливом на структуру канабіноїдів, проте пов’язаний з ризиками пожежі і залишкових розчинників. Етанол вважається більш безпечним і екологічним варіантом, але часто вилучає разом з Δ9-THC і водорозчинні компоненти, що ускладнює подальше очищення.
Процес екстракції зазвичай складається з кількох стадій: мацерація або просочування рослинної сировини розчинником, витягування активних компонентів, фільтрація і випарювання розчинника. Важливо суворо контролювати температуру та час контакту для уникнення термічної деградації Δ9-THC і побічних реакцій, що можуть змінити профіль продукту.
Супер-критичний вуглекислий газ як розчинник є інноваційним підходом, що поєднує фізичні властивості газу і рідини, дозволяючи ефективно вилучати Δ9-THC при низьких температурах і без залишкових домішок. Ця технологія має високу селективність, регульовану за тиском і температурою, що робить її особливо цінною для отримання фармакологічно чистих екстрактів. Водночас капіталовкладення і складність обладнання є бар’єрами для її широкого застосування.
Хімічна екстракція забезпечує кращу концентрацію Δ9-THC у порівнянні з механічними методами, однак потребує ретельного очищення продукту від розчинників і домішок, що має велике значення для безпеки кінцевих препаратів.
Сучасні технології очищення
Після екстракції наступним важливим етапом є очищення концентратів Δ9-THC від побічних речовин, розчинників, хлорофілу, ліпідів і восків. Сучасні технології очищення базуються на фізико-хімічних методах, що дозволяють максимально зберегти структуру та активність Δ9-THC при одночасному підвищенні чистоти і стабільності кінцевого продукту.
Одним з основних напрямків є використання хроматографічних методів, включно з рідинною хроматографією високого тиску (HPLC) і колонковою хроматографією, які забезпечують селективне розділення канабіноїдів і домішок за різними фізико-хімічними властивостями. Ці методи широко застосовуються для виробництва медичних препаратів, де необхідні стандартизовані концентрації Δ9-THC.
Інтенсивно розвиваються мембранні технології, що базуються на селективному проникненні молекул через напівпроникні мембрани. Вони дозволяють ефективно відокремлювати Δ9-THC від розчинників і домішок при низьких енергетичних затратах і без хімічних реактивів. Такі системи підвищують екологічність процесу і спрощують масштабування.
Ультразвукове очищення використовує високочастотні звукові хвилі для руйнування структур домішок і збільшення розчинності цільових речовин, що прискорює і підвищує якість очищення. Комбіновані підходи з використанням ультразвуку і хроматографії відкривають нові перспективи у виробництві високочистих екстрактів.
Термічні методи, такі як вакуумна дистиляція і ректифікація, застосовуються для видалення летких розчинників і конденсації Δ9-THC з метою отримання максимально концентрованих продуктів. Вони вимагають точного контролю температурного режиму для запобігання ізомеризації та деградації молекули.
Механізм дії: Як Δ9-ТГК взаємодіє з людським організмом
Взаємодія Δ9-тетрагідроканабінолу (Δ9-THC) з людським організмом являє собою складний біохімічний процес, який є фундаментальним для розуміння фармакології цієї молекули. Δ9-THC – це ліпофільна сполука, що легко проникає через клітинні мембрани, що дозволяє їй взаємодіяти з низкою внутрішньоклітинних і мембранних компонентів. Його механізм дії суттєво відрізняється від традиційних фармакологічних агентів, оскільки він впливає на специфічну систему рецепторів, яка до відкриття ендоканабіноїдної системи залишалась невідомою.
Основою фармакодинаміки Δ9-THC є його здатність діяти як агоніст на канабіноїдні рецептори, що розподілені в нервовій системі та периферичних тканинах. Ця взаємодія модулює нейротрансмісію, впливаючи на вивільнення багатьох нейротрансмітерів, включаючи допамін, гамма-аміномасляну кислоту (ГАМК), глутамат та серотонін. Через це Δ9-THC має здатність змінювати когнітивні процеси, сприйняття, пам’ять, а також фізіологічні реакції організму.
Важливо відзначити, що Δ9-THC не є повним агоністом цих рецепторів, а має часткову агонистичну активність, що визначає його унікальний профіль дії. Він здатний викликати складний каскад внутрішньоклітинних подій, зокрема активацію G-протеїнових рецепторів, що призводить до інгібування аденілатциклази, зниження рівня циклічного аденозинмонофосфату (цАМФ) та впливу на іонні канали. Це, у свою чергу, викликає модуляцію електричної активності нейронів і зміну нейромедіаторного балансу.
Δ9-THC також взаємодіє з рецепторами, розташованими поза центральною нервовою системою, зокрема в імунній системі, що пояснює його вплив на запальні процеси і імунний гомеостаз. Окрім цього, досліджуються додаткові молекулярні цілі, зокрема TRPV1-рецептори, які беруть участь у передачі больових сигналів, що розширює спектр фармакологічної дії Δ9-THC.
Рух Δ9-THC в організмі характеризується швидкою абсорбцією при інгаляції та повільнішою, але більш тривалою дією при пероральному прийомі. Ліпофільність молекули сприяє її накопиченню у жирових тканинах і подальшій повільній депонізації, що впливає на фармакокінетичні параметри і тривалість дії. Метаболізм Δ9-THC здійснюється переважно в печінці через систему цитохрому P450 з утворенням активних і неактивних метаболітів, які мають різний вплив на організм.
Результатом цих молекулярних процесів є складна палітра біологічних ефектів, включно з психоактивними проявами, зміною сенсорного сприйняття, а також фізіологічними впливами, такими як аналгезія, протиблювотна дія, модуляція апетиту та запальних процесів. Особливості механізму дії Δ9-THC визначають його клінічне застосування і потенційні ризики, пов’язані з тривалим використанням.
Ендоканабіноїдна система
Ендоканабіноїдна система є молекулярною платформою, яка забезпечує цілісну інтеграцію між нервовою, імунною та ендокринною системами людини. Вона функціонує як механізм динамічного зворотного зв’язку, що постійно підтримує гомеостаз – стан біологічної рівноваги, необхідний для функціонування тканин і органів в умовах змін навколишнього середовища. Центральне значення цієї системи виявляється у її здатності регулювати синаптичну передачу, нейрозапалення, енергетичний обмін, а також процеси мотивації, пам’яті, болю, сну та імунної відповіді.
На відміну від класичних нейротрансмітерних систем, ендоканабіноїдна система працює переважно за ретроградним принципом: ендоканабіноїди синтезуються “на вимогу” у постсинаптичних нейронах, а потім дифундують назад через синаптичну щілину, де взаємодіють з пресинаптичними рецепторами, змінюючи ймовірність вивільнення медіаторів. Цей механізм робить систему унікальною регуляторною матрицею, яка забезпечує тонку настройку нейрональних мереж та локальну регуляцію клітинного середовища. До основних ендогенних лігандів системи належать анандамід (AEA) та 2-арахідонойлгліцерин (2-AG), обидва з яких є похідними арахідонової кислоти та діють як непостійні, короткотривалі сигналізатори. Синтез і деградація цих молекул строго контрольовані ферментативними системами, включаючи NAPE-PLD, DAGL, FAAH та MAGL, які координують появу і зникнення ендоканабіноїдів у потрібний момент.
Регуляторний потенціал цієї системи настільки гнучкий, що вона здатна як пригнічувати, так і стимулювати фізіологічні процеси залежно від тканинного контексту, типу клітини, стану гомеостазу й наявності зовнішніх подразників. Ця пластичність забезпечується широким спектром ефекторних механізмів, через які ендоканабіноїди впливають на внутрішньоклітинні сигнальні шляхи, включаючи MAP-кінази, PI3K/AKT, NF-κB та інші. ЕКС, таким чином, стає не просто локальною системою передачі сигналів, а мультифункціональною сигнальною сіткою, яка координує цілі організмові відповіді.
CB1 та CB2-рецептори: локалізація, функція
CB1 та CB2-рецептори є ключовими структурними компонентами ендоканабіноїдної системи, які реалізують її сигнальні функції шляхом активації G-білок-зв’язаних каскадів. Вони відрізняються не лише структурно, а й за патернами експресії, афінністю до лігандів і функціональним спрямуванням. CB1-рецептори переважають у центральній нервовій системі і відіграють провідну роль у регуляції синаптичної передачі, тоді як CB2 переважно представлені у клітинах імунної системи і мають чітко виражену роль у контролі запалення та імуномодуляції.
CB1-рецептори експресуються у високій щільності у таких ділянках, як гіпокамп, базальні ганглії, кора, мозочок і спинний мозок. Їх локалізація відповідає за контроль над моторикою, когніцією, емоційними реакціями та сенсорним сприйняттям. На синаптичному рівні CB1-рецептори розташовані на пресинаптичних терміналях, де вони інгібують вивільнення збуджувальних (глутамат) або гальмівних (ГАМК) нейротрансмітерів. Таким чином, CB1 опосередковують локальне “гальмування” зворотним зв’язком, знижуючи надмірну активність нейронів. Молекулярно це відбувається через активацію Gi/o-білків, що пригнічують аденілатциклазу, знижують рівень цАМФ, активують K+-канали та блокують Ca2+-канали, приводячи до гіперполяризації нейронів.
CB2-рецептори переважно локалізуються у клітинах периферичної імунної системи: макрофагах, нейтрофілах, мікроглії, Т-лімфоцитах, дендритних клітинах, а також у клітинах селезінки, мигдаликів і кісткового мозку. Їх функція полягає в модуляції продукції прозапальних та протизапальних цитокінів, активації фагоцитозу, контролі проліферації та апоптозу імунних клітин. Хоча CB2 у нормі рідко зустрічаються в центральній нервовій системі, експресія може зростати за умов нейрозапалення або патології, що відкриває нові можливості для терапії нейродегенеративних і автоімунних станів.
Афінність Δ9-THC до обох типів рецепторів підтверджує його здатність впливати як на нейрофізіологічні, так і на імунні функції. Але водночас CB1-рецептори є головною мішенню для психоактивних ефектів, тоді як CB2 реалізують переважно периферичну імунну дію без виражених змін у свідомості. Ця дихотомія має велике значення для фармакології: вона дозволяє створювати селективні молекули, що взаємодіють лише з одним підтипом рецепторів для досягнення бажаного терапевтичного ефекту з мінімальними побічними наслідками.
Агоністична дія THC
Δ9-ТГК діє як частковий агоніст до обох канабіноїдних рецепторів, але особливо сильну дію виявляє щодо CB1, до якого він має високу спорідненість. Його агоністична дія є дозозалежною і контекстуально змінною. При низьких концентраціях Δ9-THC може поводитись як слабкий агоніст або навіть антагоніст у присутності більш потужних ендогенних лігандів, таких як 2-AG. Проте при високих концентраціях він займає рецептори і активує повноцінний сигнальний каскад, що змінює нейротрансмісію, клітинну активність і поведінкові реакції.
Механізм агонізму Δ9-THC полягає в зміні конформаційного стану CB1-рецептора після зв’язування, що запускає внутрішньоклітинні події через Gi/o-білки. Це веде до зниження активності аденілатциклази, зменшення продукції цАМФ, а також до гальмування напругозалежних кальцієвих каналів, які відповідають за екзоцитоз везикул з нейротрансмітерами. Таким чином, Δ9-THC знижує вивільнення збуджувальних медіаторів, змінює баланс збудження і гальмування в нейрональних мережах, а це, своєю чергою, трансформується у зміни настрою, пам’яті, уваги, больового порогу та моторної координації.
Особливість часткового агонізму полягає в тому, що Δ9-THC не активує рецептор на повну потужність, як це роблять повні агоністи (наприклад, синтетичні канабіноїди), тому його дія є помірнішою, але тривалішою. Це знижує токсикологічний ризик, але також обмежує максимальний терапевтичний ефект. Більше того, Δ9-THC може проявляти інверсну агоністичну активність у присутності високих концентрацій ендоканабіноїдів, змінюючи конфігурацію рецептора у зворотному напрямку.
Його взаємодія з CB2-рецепторами менш потужна, але значуща в контексті запальних і імунних процесів. У клітинах імунної системи агоністична дія Δ9-THC пригнічує вивільнення прозапальних цитокінів, знижує експресію молекул адгезії, і модуляє реактивність імунних клітин до зовнішніх сигналів. Це має потенціал для використання в лікуванні автоімунних захворювань, хронічного запалення і навіть деяких форм пухлин.
Фармакокінетика і метаболізм
Фармакокінетика Δ9-Тетрагідроканабінолу є складною і варіабельною системою, що визначає біологічну доступність, динаміку розподілу, метаболічну трансформацію і виведення сполуки з організму. Усі ці параметри суттєво залежать від шляху введення, ліпофільної природи молекули та індивідуальних особливостей метаболізму, що обумовлює широкий діапазон варіацій у концентраціях і тривалості дії навіть при однаковому дозуванні.
Після інгаляційного введення Δ9-ТГК швидко абсорбується через альвеолярну мембрану в легенях, досягаючи пікових концентрацій у плазмі протягом 3-10 хвилин. Абсолютна біодоступність при курінні становить від 10 до 35%, залежно від техніки інгаляції, об’єму вдиху, тривалості затримки дихання та втрат при згоранні. При пероральному прийомі біодоступність істотно нижча – у межах 6-10%, що обумовлено пресистемним метаболізмом у печінці (ефект першого проходження) і повільною абсорбцією в шлунково-кишковому тракті. Ліпофільна природа Δ9-ТГК призводить до його активного зв’язування з харчовими жирами, що подовжує час до досягнення Cmax (від 1 до 3 годин) і збільшує інтеріндивідуальну варіативність.
Після потрапляння в системний кровообіг Δ9-ТГК майже повністю зв’язується з білками плазми – до 97%, головним чином з альбуміном, що обмежує його вільну фракцію і модулює швидкість проникнення у тканини. Завдяки своїй високій ліпофільності молекула швидко розподіляється у добре перфузовані ліпідні компартменти: головний мозок, легені, печінка, серце. При хронічному вживанні спостерігається акумуляція Δ9-ТГК і його метаболітів у жировій тканині, звідки відбувається поступове вивільнення протягом днів і навіть тижнів після припинення вживання, що пояснює тривале виявлення в біологічних середовищах навіть після одноразового вживання.
Метаболізм Δ9-ТГК переважно відбувається в печінці за участю ферментів системи цитохрому P450, головно ізоформ CYP2C9, CYP2C19 та CYP3A4. Основним шляхом є гідроксилювання молекули з утворенням 11-гідрокси-Δ9-ТГК (11-OH-THC), який є фармакологічно активним і в багатьох аспектах навіть потужнішим за материнську сполуку. Цей метаболіт має здатність швидко проникати через гематоенцефалічний бар’єр і спричиняти психоактивні ефекти, особливо виражені при пероральному прийомі, де його концентрація зростає значно більше, ніж при інгаляції. Подальший метаболізм 11-OH-THC приводить до утворення неактивного 11-нор-9-карбоксі-Δ9-ТГК (THC-COOH), який є основною мішенню для імунологічного та хроматографічного виявлення в аналізах сечі.
Час напіввиведення Δ9-ТГК варіює в широких межах: від 1-2 годин при гострому введенні до 5-13 днів при хронічному вживанні внаслідок депонування у жировій тканині. THC-COOH і його кон’югати виводяться з організму переважно з калом (до 65%) і меншою мірою з сечею (20-35%) у вигляді глюкуронідованих метаболітів. Гідрофільність вторинних метаболітів забезпечує їх здатність до ниркової екскреції, однак значна частина залишається доступною для рециркуляції через ентерогепатичний шлях, що подовжує загальний період виведення.
Особливу роль у фармакокінетиці відіграють генетичні поліморфізми CYP2C9, які визначають швидкість перетворення Δ9-ТГК у 11-OH-THC. Індивіди з варіантами *2/*3 демонструють уповільнений метаболізм, що підвищує ризик кумуляції активної форми і посилення психотропних ефектів. Додатково, одночасне вживання інгібіторів або індукторів CYP3A4 (наприклад, кетоконазолу чи рифампіцину) значно змінює плазмові рівні Δ9-ТГК, що має критичне значення при терапевтичному застосуванні в пацієнтів, які отримують супутню фармакотерапію.
Окрему увагу привертає фармакокінетика при інших шляхах введення, таких як сублінгвальний, трансдермальний або інтраназальний. Ці шляхи сприяють частковому обходу печінкового метаболізму, дозволяючи досягти вищих концентрацій Δ9-ТГК при зниженій частці 11-OH-THC. Таким чином, фармакодинамічний профіль змінюється у бік більш короткої, але контрольованішої дії, що є перевагою в медичному використанні.
Фармакокінетичні властивості Δ9-ТГК є ключовим фактором у визначенні його дози, частоти введення, очікуваних ефектів і ризиків. Висока варіабельність, залежність від шляху введення, метаболічного профілю та жирової маси пацієнта ускладнює стандартизацію дози. Тому індивідуалізація дозування є принципово важливою умовою для мінімізації побічних ефектів і досягнення терапевтичного результату.
Біологічні ефекти
Біологічна дія Δ9-Тетрагідроканабінолу є результатом його селективної взаємодії з рецепторними структурами ендоканабіноїдної системи, що інтегрована в низку регуляторних контурів центральної та периферичної нервової системи, а також в імунну, ендокринну, шлунково-кишкову, серцево-судинну та інші фізіологічні системи. Ця взаємодія не обмежується нейромедіаторною модуляцією, а має трансмембранні, транскрипційні та метаболічні наслідки, що робить Δ9-ТГК унікальною сполукою з поліфункціональним профілем дії. Біологічна відповідь на Δ9-ТГК не є гомогенною: вона варіює в залежності від дози, шляху введення, віку, генетики, нейробіологічного статусу, частоти вживання та контекстуальної обстановки. Водночас вона проявляється у двох взаємопов’язаних, але різних площинах: психоактивній та фізіологічній. Перша зумовлює зміни у сприйнятті, настрої та поведінці, друга – модулює больову чутливість, нудоту, апетит, температуру тіла, тонус судин та інші параметри вегетативної функції.
Психоактивні (евфорія, зміна сприйняття)
Психоактивні ефекти Δ9-ТГК є результатом специфічного впливу на нейромедіаторні системи, насамперед дофамінергічну, глутаматергічну та ГАМК-ергічну. Через CB1-рецептори, густо представлені в мезолімбічній дофаміновій системі (особливо в вентральній тегментальній області та nucleus accumbens), Δ9-ТГК підвищує дофамінову передачу, викликаючи суб’єктивно приємні відчуття, які кваліфікуються як еуфорія. Це відчуття не є простим “піднесенням настрою”, а являє собою складну когнітивно-афективну зміну з формуванням гедоністичної оцінки поточної реальності, і це має як нейропсихологічні, так і поведінкові кореляти.
Крім дофамінового впливу, Δ9-ТГК модулює вивільнення глутамату та ГАМК у префронтальній корі та гіпокампі. Це пояснює типові для психоактивного стану порушення короткочасної пам’яті, зміну часових структур мислення, дезорієнтацію в просторі та явища гіперфокусування на незначних сенсорних деталях. Зорові, слухові й соматосенсорні стимули інтерпретуються суб’єктивно як інтенсивніші або більш емоційно забарвлені. Це формує феномен зміненого сприйняття, який не є галюцинацією в класичному сенсі, а радше становить інтенсифікацію нормальної перцепції – феномен, що особливо характерний для помірних доз Δ9-ТГК.
Іншою фундаментальною характеристикою психоактивного ефекту є дизінтеграція функціональних мереж мозку. ФМРТ-дослідження демонструють зниження функціональної когерентності в DMN (default mode network) – мережі, що підтримує інтроспекцію, самосвідомість і потік свідомості. Це може пояснити такі феномени, як суб’єктивне “розчинення его”, втрата ідентичності, порушення внутрішнього монологу. Водночас активуються салієнтна та сенсорна мережі, що обумовлює посилену увагу до сенсорних подразників.
Зміна афективного стану не завжди обмежується позитивною валентністю. У частини індивідів Δ9-ТГК індукує тривогу, параноїдальні думки, загострену саморефлексію та інтероцептивну гіперчутливість, особливо в незнайомому середовищі або при високих дозах. Вважається, що це обумовлено індивідуальними відмінностями в CB1-рецепторній чутливості та співвідношенні між активністю дофамінової та ГАМК-ергічної систем.
Психоактивний спектр ефектів є дозозалежним: низькі дози сприяють психомоторній релаксації, підвищенню настрою, соціальній відкритості, тоді як високі можуть викликати когнітивний розлад, дизфорію або навіть кататоноподібні стани. При хронічному вживанні змінюється чутливість рецепторних систем (десенситизація CB1, нейроадаптація), що веде до розвитку толерантності, потреби у збільшенні дози для досягнення того самого ефекту, а також до феномену анедонії в стані абстиненції.
Фізіологічні (знеболення, антиметичний ефект)
Фізіологічна дія Δ9-ТГК ґрунтується на широкій експресії CB1 та CB2-рецепторів у різних органах і тканинах, а також на модуляції вторинних сигнальних шляхів, включаючи системи циклічного АМФ, іонних каналів та факторів транскрипції. Одним із найкраще досліджених фізіологічних ефектів є анальгетичний потенціал. Δ9-ТГК чинить знеболювальну дію як на рівні периферичної, так і центральної нервової системи. У спинному мозку канабіноїдні рецептори регулюють вивільнення субстанції P та глутамату в ноцицептивних синапсах, знижуючи передачу больового сигналу. У таламусі та корі – впливають на інтеграцію больової інформації, тоді як в мезолімбічних структурах – на афективне сприйняття болю. Це пояснює як зменшення фізичного дискомфорту, так і психоемоційне полегшення, характерне для канабіноїдного аналгезії.
Антиметичний ефект Δ9-ТГК опосередкований впливом на область postrema стовбура мозку – зону, що відповідає за детекцію токсинів у крові й ініціацію блювотного рефлексу. CB1-рецептори тут регулюють активацію серотонінергічних 5-HT3-рецепторів, інгібуючи блювотні імпульси. Це дозволяє використовувати Δ9-ТГК у терапії нудоти та блювання, індукованих хіміотерапією, де класичні антиметики можуть бути неефективними. Додатково, центральна активація канабіноїдних рецепторів стимулює гіпоталамічні механізми голоду, активуючи секрецію нейропептиду Y та інгібуючи прозапальні цитокіни, що пояснює апетитостимулюючий ефект.
Інші фізіологічні ефекти включають судинну дилатацію (особливо на рівні кон’юнктиви), зниження внутрішньоочного тиску, міорелаксацію, тахікардію, транзиторну гіпотензію, інгібування моторики шлунково-кишкового тракту та пригнічення секреції інтерлейкінів. При цьому канабіноїди не викликають пригнічення дихального центру, що відрізняє їх від опіоїдів і робить більш безпечними у плані летального передозування.
Довготривалі ефекти включають модифікацію нейроендокринних осей, зокрема гіпоталамо-гіпофізарно-гонадної, що виявляється у зниженні лютеїнізуючого гормону та тестостерону у чоловіків при хронічному вживанні. Імуномодуляторна дія Δ9-ТГК реалізується через CB2-рецептори на лімфоцитах, макрофагах і мікроглії: спостерігається пригнічення проліферації Т-клітин, зменшення продукції TNF-α, IL-2 та інтерферону-гамма, що має терапевтичний потенціал при аутоімунних патологіях.
Сфери застосування: Від медичної до фундаментальної науки
Δ9-Тетрагідроканабінол, як фармакологічно активна речовина з унікальним профілем дії на ендоканабіноїдну систему, перетнув межі суто психоактивного або рекреаційного використання та набув статусу молекули з високим інтелектуальним потенціалом для медицини, біотехнологій та фундаментальних наук. Його молекулярна дія, що інтегрує сигнальні каскади центральної нервової системи, імунітету, ендокринної регуляції та метаболізму, дозволяє розглядати Δ9-ТГК як модельну сполуку не лише для симптоматичного лікування, а й для дослідження базових принципів гомеостатичних механізмів у людини.
Сфера застосування Δ9-ТГК розгортається у трьох взаємопов’язаних вимірах: клінічному, дослідницькому та технологічному. У клініці його використовують як анальгетик, антиеметик, міорелаксант, апетитостимулятор і навіть як імуномодулятор – при цьому в кожному випадку точка докладання зусиль ґрунтується на строго визначених рецепторних і трансдукційних механізмах. Це відрізняє Δ9-ТГК від багатьох малоспецифічних фітопрепаратів і наближає його до класу прецизійних ліків, ефективність яких корелює з рецепторною експресією, поліморфізмом ферментів метаболізму і станом нейрональних мереж.
Поза клінікою Δ9-ТГК є об’єктом масштабних досліджень у сфері нейронаук, молекулярної біології, фармакогенетики й психіатрії. Модель дії канабіноїдів дозволяє з високою точністю вивчати механізми синаптичної пластичності, формування короткочасної пам’яті, нейрогенезу та епігенетичних змін у мозку дорослої особи. Завдяки здатності Δ9-ТГК впливати на внутрішньоклітинні шляхи передачі сигналу, включно з MAPK, PI3K/AKT та CREB-залежними процесами, він розглядається як інструментальне знаряддя в нейробіології на рівні клітинної та мережевої регуляції.
Особливий інтерес становлять дослідження, де Δ9-ТГК використовують для моделювання психічних станів: тривожності, дисоціації, деперсоналізації, параноїдальних ідей. Це дозволяє перевіряти гіпотези щодо нейрофізіологічної природи шизофренії, тривожних розладів, ПТСР і навіть нейроетологічних механізмів свідомості. Канабіноїдні ефекти в цьому контексті постають не як артефакт, а як інструмент доступу до латентних психофізіологічних процесів, що не можуть бути ініційовані іншими фармакологічними засобами з такою самою селективністю.
З прикладної точки зору Δ9-ТГК відкрив нову парадигму у фармацевтичному проєктуванні – препарати на його основі стали полем тестування для концепцій нанотаргетингу, векторного транспорту в ЦНС, оптимізації біодоступності ліпофільних агентів, а також персоналізованої медицини з урахуванням фармакогенетичних параметрів. Комерційні перспективи охоплюють розробку інгаляційних форм, трансдермальних систем, оральних ліпосомальних капсул і навіть інтеграцію Δ9-ТГК у платформи “смарт-доставки” на основі функціоналізованих наночастинок, які здатні адресно проникати через гематоенцефалічний бар’єр.
Фундаментальна наука, у свою чергу, використовує Δ9-ТГК як зонд для вивчення регуляторних механізмів імунної системи, нейроваскулярної взаємодії, інтероцепції та нейровізуалізації. Канабіноїдні рецептори, активовані цією сполукою, були виявлені в кістковій тканині, серцевому м’язі, мікроглії, кишечнику, підшлунковій залозі, що робить її релевантною для досліджень у таких галузях, як регенеративна медицина, метаболоміка, мікробіоміка, онкологія. Окрім цього, Δ9-ТГК дозволяє відстежувати вплив психоактивних агентів на розвиток мозку – як в експериментальних моделях пренатального впливу, так і в дослідженнях підліткової нейропластичності.
Медичне використання
Медичне застосування Δ9-Тетрагідроканабінолу ґрунтується не на побічних чи другорядних ефектах психоактивності, а на цілеспрямованому фармакологічному впливі на канабіноїдну систему, яка інтегрована в ключові механізми регуляції болю, нудоти, апетиту, м’язового тонусу, запалення та нейроендокринної гомеостатики. Ендоканабіноїдна система діє як нейромодуляторна надбудова над класичними нейромедіаторними мережами, а Δ9-ТГК, як її потужний екзогенний агоніст, забезпечує терапевтичну інтервенцію в патологічні стани, що супроводжуються порушенням цих регуляторних осей. Саме це обґрунтовує його включення до медичних протоколів у різних клінічних сценаріях – передусім при хронічному больовому синдромі, рефрактерній нудоті та кахексії, індукованій імунодефіцитними станами. Ці ефекти не є спорадичними чи емпіричними: вони задокументовані в систематичних оглядах, подвійних сліпих рандомізованих дослідженнях і клінічних метааналізах, що підтверджують як ефективність, так і прийнятний профіль безпеки Δ9-ТГК у терапевтичних дозах.
Особливість його медичного застосування полягає в тому, що його ефекти часто виявляються у випадках, коли класичні фармакологічні агенти втрачають ефективність або мають неприйнятний рівень токсичності. Це надає Δ9-ТГК статус препарату не першої лінії, а високоспеціалізованої терапевтичної опції, застосовної тоді, коли конвенційні засоби не досягають цільового результату. При цьому значення має не лише його дія на окремі симптоми, а й полікомпонентна модуляція соматичних і нейропсихічних параметрів пацієнта, що дозволяє досягати багатовекторного клінічного покращення.
Терапія хронічного болю
Анальгетичний ефект Δ9-ТГК у контексті хронічного болю не є синонімом пригнічення больового сигналу, як у випадку опіоїдів, а реалізується через гнучке модуляційне втручання в декілька рівнів ноцицептивного процесу: периферичний, спинномозковий, таламокортикальний та афективно-мотиваційний. Через CB1-рецептори, розташовані на аферентних нейронах задніх рогів спинного мозку, Δ9-ТГК знижує вивільнення глутамату та субстанції P, що є ключовими медіаторами передачі больового сигналу на першому синаптичному етапі. У центральній нервовій системі його дія поширюється на таламус, гіпокамп, мигдалеподібне тіло й префронтальну кору, де реалізується модифікація емоційного забарвлення болю та його когнітивної інтеграції в загальну тілесну схему пацієнта.
У випадках нейропатичного болю, резистентного до НПЗЗ або антидепресантів, Δ9-ТГК виявляє здатність знижувати сенситизацію, індуковану гліальними клітинами, зокрема мікроглією, що активується у відповідь на пошкодження нервової тканини. За рахунок впливу на CB2-рецептори, експресовані імунними клітинами в центральній нервовій системі, він блокує продукцію прозапальних цитокінів (TNF-α, IL-1β, IL-6), які посилюють нейропатичну гіпералгезію. Це особливо важливо при таких станах, як розсіяний склероз, хронічний радикуліт, постгерпетична невралгія або діабетична нейропатія.
Клінічні дослідження з використанням стандартизованих екстрактів канабісу, які містять Δ9-ТГК, показали зниження інтенсивності болю, оціненого за візуально-аналоговою шкалою, на 30-50% у пацієнтів з рефрактерним хронічним болем. Цей ефект досягається при значно нижчому ризику розвитку залежності або дихальної депресії, порівняно з опіоїдами. При цьому Δ9-ТГК не лише знижує інтенсивність больових імпульсів, а й покращує якість сну, зменшує м’язову ригідність, тривожність та депресивні симптоми, які часто супроводжують хронічний біль і формують його психосоматичний компонент. Важливо, що в дозозалежному режимі його ефекти можуть бути підлаштовані під індивідуальну клінічну картину, а формати доставки – від інгаляцій до сублінгвальних спреїв – забезпечують контрольований фармакокінетичний профіль.
З урахуванням цього Δ9-ТГК усе ширше застосовується як ад’ювант до стандартної анальгетичної терапії, а в низці випадків – як монотерапія. Його ефективність особливо виражена у пацієнтів, які мають протипоказання до НПЗЗ через шлунково-кишкову токсичність або не переносять опіоїди через нудоту, запори або когнітивні побічні ефекти. У таких випадках Δ9-ТГК демонструє стабільну клінічну відповідь без формування медикаментозної звички чи вираженого синдрому відміни.
Антиеметик при хіміотерапії
Антиеметичний потенціал Δ9-ТГК базується на його здатності модулювати серотонінергічну активність у центральних блювотних центрах, зокрема в зоні postrema та nucleus tractus solitarius, де зосереджені 5-HT3-рецептори, чутливі до хіміотерапевтичних агентів. Δ9-ТГК блокує активацію цих рецепторів, інгібуючи вивільнення серотоніну з ентерохромафінних клітин кишечника та запобігаючи передачі сигналу про токсичність до ЦНС. Це пояснює ефективність канабіноїдів у профілактиці та лікуванні нудоти, резистентної до класичних антагоністів 5-HT3.
У пацієнтів, які отримують платиновмісні хіміопрепарати, часто розвивається як гостра, так і затримана нудота, яку важко контролювати навіть за допомогою тройної антиеметичної терапії. Δ9-ТГК у таких випадках демонструє ефективність як у монотерапії, так і в комбінованих схемах. Його перевага – вплив не лише на рецепторний механізм, а й на інтегральну афективну оцінку стану, що дозволяє знижувати не лише соматичний, а й емоційний дискомфорт, пов’язаний із хіміотерапією. Окрім цього, Δ9-ТГК нормалізує апетит, стабілізує настрій, покращує сон і зменшує астенічні прояви, які є вторинними до інтенсивного блювання.
Фармакокінетична властивість Δ9-ТГК – пролонгована дія при оральному прийомі – робить його особливо корисним у запобіганні затриманій нудоті, яка виникає на другий-третій день після введення хіміопрепарату. У пацієнтів із частими епізодами блювання застосування Δ9-ТГК дозволяє уникнути дегідратації, електролітного дисбалансу, нутритивної недостатності та порушення режиму лікування. Ці переваги дозволили офіційно схвалити синтетичні аналоги Δ9-ТГК (дронабінол, набілон) для використання в онкології як антиеметики другого ряду при неефективності стандартної терапії.
Ключовим також є те, що Δ9-ТГК не блокує нормальний шлунковий мотилітет, на відміну від деяких антиеметиків, що спричиняють гастростаз і погіршують абсорбцію поживних речовин. Це особливо важливо в умовах виснаження, характерного для пацієнтів у процесі хіміотерапії. При цьому ефективна доза може бути мінімальною й не супроводжуватися вираженими психоактивними ефектами, що критично важливо для пацієнтів похилого віку або ослаблених хворобою.
Апетитостимулятор при ВІЛ
Δ9-ТГК показав клінічну ефективність у терапії ВІЛ-асоційованої кахексії – стану, що характеризується анорексією, м’язовою атрофією, втратою підшкірної жирової клітковини та загальним зниженням нутритивного статусу. Механізм його дії полягає в активації CB1-рецепторів у гіпоталамусі, зокрема в ядер arcuate та paraventricular, що відповідають за регуляцію голоду й насичення. Стимуляція цих ядер веде до підвищення експресії нейропептиду Y та агуті-подібного білка, які ініціюють харчову поведінку й збільшення калорійного споживання.
Клінічні випробування показали, що Δ9-ТГК здатен не лише підвищувати апетит, а й сприяти стабільному приросту маси тіла без втрати м’язової маси, що є критичним фактором виживаності у пацієнтів з ВІЛ. Його ефект не обмежується короткочасною евфоричною активацією: при регулярному дозуванні він нормалізує харчову поведінку, зменшує нудоту, усуває аверію до їжі й знижує загальну астенію. У результаті покращується загальний фізичний стан, відновлюється метаболічна стабільність і знижується ризик вторинних інфекцій.
Δ9-ТГК також модулює системне запалення через CB2-рецептори, зменшуючи рівень прозапальних цитокінів, які відіграють роль у патогенезі ВІЛ-індукованої кахексії. Це дозволяє досягти більш стабільного нутритивного ефекту, ніж при застосуванні стимуляторів апетиту на основі стероїдів або прогестинів, які супроводжуються значними побічними явищами. Δ9-ТГК, на відміну від них, не спричиняє гіперглікемії, затримки рідини чи гінекомастії, що робить його придатним для довготривалого застосування.
Ефективність Δ9-ТГК у цій сфері особливо цінна з огляду на обмежений арсенал безпечних і дієвих засобів для лікування ВІЛ-асоційованої анорексії. Його застосування сприяє збереженню терапевтичного режиму, покращенню якості життя та загальної прогностичної перспективи пацієнтів з тяжкими формами імунодефіциту.
Дослідження в нейронауках та психофармакології
Інтенсивні дослідження Δ9-ТГК у сфері нейронаук виявили набагато складніший профіль його дії, ніж первинно передбачалося, виходячи з поверхневої характеристики як “рекреаційного психоактивного засобу”. Підходи сучасної нейрофармакології відкрили фундаментальну роль канабіноїдної сигналізації у регуляції когнітивних процесів, емоційної гомеостатики, синаптичного ремоделювання, а також нейровідновлення після стресу чи травми. Δ9-ТГК, взаємодіючи з CB1-рецепторами, експресованими у високоорганізованих структурах центральної нервової системи – гіпокампі, префронтальній корі, мигдалині, вентральному стріатумі, – модулює механізми памʼяті, навчання, афективного стану та нейропластичності. Цей вплив не є уніфіковано інгібуючим або стимулюючим, як часто некоректно подається у спрощених популярних джерелах, а радше контекстно-залежним: він змінюється залежно від фаз консолідації памʼяті, типу інформації (емоційно насичена чи нейтральна), умов стресу, хронічної тривожності чи нейровісцеральної дисфункції.
Роль Δ9-ТГК в екзогенній модуляції ендоканабіноїдної системи у психонейрофізіологічному контексті доводиться через експериментальні моделі на тваринах, функціональну МРТ, PET-дослідження, електрофізіологію синаптичної передачі та аналіз транскриптомного профілю нейронів. Зокрема, виявлено, що дія Δ9-ТГК може призводити до короткочасного пригнічення глутаматергічної передачі в CA1 зоні гіпокампа, що знижує обсяг інформації, здатної до консолідації в довготривалу памʼять. Водночас в інших контекстах Δ9-ТГК виявляє нейрозахисні властивості: при експериментальних моделях індукованої тривожності чи посттравматичних реакцій він нормалізує гіперактивність амигдали та знижує патологічне формування страхового спогаду.
Нейронаукові дослідження підтверджують, що канабіноїдний тонус – одна з ключових надбудов над синаптичною пластичністю, що діє у форматі зворотного контролю: CB1-рецептори, розташовані на пресинаптичних терміналях, активуються ретроградними ендоканабіноїдами, які виділяються постсинаптично, що забезпечує фокусну синаптичну інгібіцію без загального гальмування. Екзогенний Δ9-ТГК, активуючи ті ж самі механізми, втручається в тонку динаміку синаптичної ваги, іноді підсилюючи, іноді знижуючи її залежно від активності мереж. Це відкриває простір не лише для вивчення потенційних когнітивних ризиків, а й для контролю патологічного синаптичного ремоделювання, наприклад, при ПТСР або нейродегенеративних хворобах.
Вплив на памʼять, навчання, синаптичну пластичність
Експериментальні дані демонструють, що Δ9-ТГК порушує короткотривалу памʼять у здорових субʼєктів шляхом пригнічення синаптичної передачі в гіпокампі – головній структурі, відповідальній за консолідацію подієвої памʼяті. Пресинаптичні CB1-рецептори, активовані Δ9-ТГК, блокують вивільнення глутамату й ГАМК, змінюючи баланс збудження/гальмування в ключових нейрональних мікросхемах. Це може призводити до порушення формування LTP (довготривалої потенціації) – електрофізіологічного підґрунтя для навчання. У молодих здорових субʼєктів це проявляється як транзиторне погіршення вербальної памʼяті або зниження швидкості когнітивної обробки.
Водночас за умов патологічної нейрональної надзбудливості, як-от при хронічному стресі, травматичних переживаннях, епілепсії або нейрозапаленні, Δ9-ТГК виступає як нормалізуючий агент, який знижує надмірну синаптичну активність і захищає від синаптотоксичності. У таких випадках він блокує патологічну гіперпотенціацію та перешкоджає фіксації надмірно афективно забарвленої інформації. При моделюванні ПТСР у тварин Δ9-ТГК запобігає консилідації патологічної страхоасоційованої памʼяті й пришвидшує її згасання, що відкриває перспективи для терапії розладів, повʼязаних із патологічною персистенцією травматичних спогадів.
Крім того, Δ9-ТГК здатен впливати на механізми нейрогенезу. У дорослому гіпокампі експресія CB1-рецепторів на нейральних стовбурових клітинах визначає швидкість проліферації та диференціації нових нейронів. Деякі дані свідчать, що при хронічному введенні низьких доз Δ9-ТГК у старих тварин відбувається відновлення нейропластичності, покращення когнітивних функцій та зменшення запального профілю мозку. Це ставить питання про потенціал Δ9-ТГК або його модифікованих аналогів у корекції когнітивного спаду при старінні або при легких когнітивних порушеннях початкових стадій деменції.
Однак існує й зворотна сторона: при хронічному зловживанні Δ9-ТГК у підлітковому віці, коли префронтальна кора й гіпокамп ще перебувають у фазі активного розвитку, фіксується довготривале зниження LTP, зменшення об’єму синапсів, зниження експресії генів, повʼязаних із нейропластичністю (наприклад, BDNF), що корелює з дефіцитом робочої памʼяті та виконавчих функцій. Це демонструє критичну важливість дозування, віку, тривалості та контексту в оцінці когнітивного впливу Δ9-ТГК.
Потенціал у терапії PTSD, тривожності
Посттравматичний стресовий розлад є складною нейропсихіатричною патологією, в основі якої лежить порушення ендоканабіноїдного контролю над системами емоційної памʼяті, стрес-реакції й гальмування страху. У пацієнтів із ПТСР виявлено зниження базального рівня ендоканабіноїдів в плазмі крові, гіпоактивність CB1-рецепторів і гіперактивність амигдали при впливі травматичних тригерів. Δ9-ТГК у цьому контексті діє як функціональний модулятор, який компенсує дефіцит ендоканабіноїдної передачі, знижує афективну інтенсивність спогадів, інгібує реактивність гіпоталамо-гіпофізарно-надниркової осі та пришвидшує згасання патологічної памʼяті страху. Це доведено у клінічних пілотних дослідженнях, де застосування Δ9-ТГК перед сесіями експозиційної психотерапії знижувало рівень тривоги, сприяло утворенню нових асоціацій безпеки й підвищувало ефективність психотерапевтичного втручання.
Окрім PTSD, клінічні та нейровізуалізаційні дані свідчать про те, що Δ9-ТГК у низьких дозах може зменшувати патологічну тривожність шляхом нормалізації гіперактивності мигдалини й зниження патологічного зв’язку між амигдалою і префронтальною корою. У випадках генералізованого тривожного розладу, соціальної фобії та обсесивно-компульсивного розладу спостерігається позитивна динаміка на фоні прийому Δ9-ТГК, зокрема зменшення фізіологічних симптомів тривоги – тахікардії, напруження м’язів, шлунково-кишкових розладів. Ефекти, втім, мають вузьке терапевтичне вікно: при перевищенні дози Δ9-ТГК сам по собі може індукувати тривожність або панічну атаку, що вимагає строгого контролю та індивідуалізації схеми застосування.
У спектрі тривожних порушень Δ9-ТГК виконує роль не седації чи гальмування, а тонкого реставратора нейроафективного балансу, де головна мішень – патологічна збудливість нейронних мереж, що реагують на незначні тригери як на загрозу. Його фармакологічна дія не є ізольованою, вона доповнює психотерапевтичні підходи, забезпечуючи нейробіологічну “пластичність вікна”, в межах якого психотерапія може бути ефективнішою.
Сучасні дослідження, зокрема з використанням PET, виявили, що пацієнти з ПТСР мають дефіцит CB1-рецепторної щільності, особливо в лівій мигдалині й гіпокампі. У таких випадках Δ9-ТГК частково компенсує втрату чутливості до ендоканабіноїдів, що пояснює його ефективність саме в цій категорії пацієнтів. На цьому тлі розвиваються дослідження синтетичних аналогів Δ9-ТГК із модифікованою афінністю до CB1/CB2 або частковим агонізмом, які дозволять мінімізувати ризики психоактивності при збереженні терапевтичного профілю. Це особливо перспективно для майбутньої психофармакотерапії тривожних розладів, рефрактерних до SSRI або SNRI.
Промислове та фармацевтичне виробництво
Розгортання виробничих ліній для виготовлення Δ9-ТГК-сировини та препаратів на її основі вимагає надзвичайно жорсткої технологічної, фармацевтичної та регуляторної дисципліни. Це не просто масштабування ботанічної екстракції, а радше складний мультиетапний біотехнологічний процес, що поєднує агрогеноміку, високоточну екстракцію, хроматографічне очищення, стандартизацію концентрацій та включення в придатні для клінічного застосування форми. На перетині хімії, біоінженерії та молекулярної фармакології, сучасне виробництво Δ9-ТГК вийшло далеко за межі канабіс-культивації, увібравши в себе найсучасніші розробки в галузі нанотехнологій, векторного транспорту, фармакокінетичного програмування та молекулярної стабілізації. Домінуючими парадигмами є мікродозування, максимальна біодоступність при мінімальному психоактивному навантаженні та точна контрольована дія, орієнтована на специфічний рецепторний профіль пацієнта.
Структура фармацевтичного циклу включає вирощування генетично стандартизованих сортів з прогнозованим профілем канабіноїдів, далі – надкритичну CO₂-екстракцію, хроматографічне розділення, фракційне очищення, декарбоксилювання та контрольну стабілізацію Δ9-ТГК. У процесі очищення досягається ізоляція не тільки чистого Δ9-ТГК, а й синтез його фармацевтично адаптованих аналогів – наприклад, дронобінолу, левонанабінолу або новіших варіантів з модифікованими афінностями до CB1/CB2-рецепторів. Стандарти GMP регламентують допустимі домішки до мікрограмів на грам, що перетворює канабісову сировину з аграрного продукту на фармацевтичну субстанцію високої чистоти. Цей рівень контролю необхідний для того, щоб гарантувати стабільність фармакокінетики, виключити зміни психоактивності від партії до партії та забезпечити достовірність дозування в умовах клінічного застосування.
Значну роль відіграє також формат препарату: ізольований Δ9-ТГК в олійній основі, капсулах, мікроемульсіях, назальних спреях або трансдермальних системах. Кожна форма розробляється з урахуванням специфіки захворювання, швидкості настання ефекту, тривалості дії та профілю небажаних ефектів. Фармакотехнологи модулюють кінетику вивільнення через використання матричних полімерів, ліпідних носіїв або наносуспензій, адаптуючи їх до вимог пацієнт-орієнтованої терапії. Це стає особливо критичним у випадках нейропсихіатричних розладів або онкопатологій, де допустимий діапазон концентрацій у плазмі надзвичайно вузький.
Індустріальна трансформація Δ9-ТГК вимагає і глибокого правового регламентування. У країнах із легалізованим медичним канабісом застосовуються моделі ліцензування, контрольного протоколювання, електронного рецептурного обігу й повної простежуваності партій – від рослини до препарату. Це формує новий підхід до стандартизації фітоканабіноїдів як фармакоактивних речовин, які за всіма параметрами повинні відповідати вимогам Європейської фармакопеї або USP. Водночас формується інноваційна екосистема – від біобанків сортів до штучного інтелекту в оптимізації культиваційних умов, що забезпечують необхідний хемотип канабіноїдного профілю для подальшого фармацевтичного синтезу.
Прецизійна медицина
Прецизійна медицина на основі Δ9-ТГК виходить з принципу індивідуального фармакогенетичного профілю пацієнта – з урахуванням поліморфізмів генів рецепторів CB1/CB2, ферментів CYP2C9 та FAAH, стану ендоканабіноїдного тонусу та особливостей метаболізму. Вже встановлено, що варіанти в гені CNR1 можуть модулювати чутливість до Δ9-ТГК, формуючи схильність до як терапевтичного, так і побічного ефекту – наприклад, когнітивного пригнічення або психотичних реакцій. Так само поліморфізм CYP2C9*3 знижує швидкість метаболізму Δ9-ТГК, подовжуючи його дію та підвищуючи ризик кумуляції. У рамках персоналізованого підходу це вимагає адаптації дози, ритму прийому та форми препарату.
Прецизійна терапія Δ9-ТГК також враховує специфіку клінічного стану: наприклад, у пацієнтів з нейропатичним болем перевага надається високошвидкісним інгаляційним або сублінгвальним формам із піковою концентрацією протягом 5-10 хвилин, тоді як при онкологічному кахексичному синдромі – повільнодіючим трансдермальним системам, що забезпечують стабільний рівень протягом доби. Для хворих на ПТСР чи тривожні розлади обираються мікродози з подовженим вивільненням, які не викликають психоактивності, але забезпечують нормалізацію тонусу амигдали.
Технологічно це реалізується через застосування новітніх методів мікроінкапсуляції Δ9-ТГК у біодеградуючі полімери, які дозволяють контролювати швидкість вивільнення та уникати пікових коливань концентрації. Системи з контекстно-залежною активацією (наприклад, фоточутливі або pH-чутливі нанокапсули) відкривають можливість введення Δ9-ТГК у вигляді “інтелектуальних препаратів”, які активуються лише у специфічному мікрооточенні патологічного процесу – наприклад, в зоні нейрозапалення чи пухлини.
Окремим напрямком є алгоритмічне програмування фармакотерапії – використання штучного інтелекту для адаптації схеми призначення Δ9-ТГК залежно від біомаркерів пацієнта, нейровізуалізаційного профілю, психометричних даних та метаболічних індикаторів. Такі системи в експериментальних умовах вже демонструють покращення контролю хронічного болю, зниження тривожності та зменшення побічних ефектів завдяки точному динамічному дозуванню в реальному часі. Це створює новий вимір у фармакотерапії на основі Δ9-ТГК – не лише як речовини, а як керованої платформи.
Векторні розробки наноформ THC
Використання нанотехнологій у формуванні векторних систем доставки Δ9-ТГК стало одним з ключових проривів у подоланні фармакокінетичних барʼєрів цієї молекули. Через високу ліпофільність та схильність до метаболізму першого проходження Δ9-ТГК має низьку біодоступність при пероральному введенні – близько 6-10%. Наноформуляції у вигляді ліпосом, наноструктурованих ліпідних носіїв, полісахаридних матриць або полімерних нанокапсул забезпечують захист молекули від ензиматичної деградації, покращують її розчинність у водному середовищі, подовжують час циркуляції та дозволяють адресну доставку до специфічних тканин.
У системах векторного транспорту Δ9-ТГК може бути інкапсульований у наночастинки з модифікованою поверхневою функціональністю – наприклад, за допомогою лігандів до рецепторів CD44 (які експресуються при запаленні), або антиепітопів до клітин пухлини. Це забезпечує прецизійну локалізацію препарату в зонах патології при мінімальній системній експозиції. При нейродегенеративних захворюваннях, де порушений гематоенцефалічний барʼєр, наноформульований Δ9-ТГК демонструє здатність проникати в мозок з вищою ефективністю, ніж звичайні ліпофільні молекули.
Також розробляються гібридні системи, в яких Δ9-ТГК поєднується з іншими біоактивними компонентами, наприклад, протизапальними пептидами або інгібіторами FAAH, що забезпечує синергічний ефект. Ці композиції дозволяють модулювати не лише силу та тривалість ефекту Δ9-ТГК, але й його якісний характер – наприклад, зменшити ризик психоактивності при збереженні аналгезії.
Векторні форми також відкривають шлях до нових шляхів введення – інтраназального, інгаляційного, трансдермального або навіть інтракраніального, що особливо актуально для лікування локалізованих пухлин ЦНС або фокусної епілепсії. Усі ці технології активно патентуються та вже частково входять у клінічну практику в рамках експериментальних протоколів або розширеного доступу для тяжких пацієнтів.
Висновок
Комплексне вивчення Δ9-тетрагідроканабінолу (Δ9-ТГК) у межах мультидисциплінарного підходу, який охоплює хімію, ботаніку, біохімію, молекулярну фармакологію, нейронауки, медицину та індустріальні технології, демонструє, що дана сполука є винятковим прикладом біоактивного природного продукту з багатовекторним механізмом дії, високим біохімічним потенціалом і фармакологічною селективністю. На відміну від багатьох психоактивних речовин рослинного походження, Δ9-ТГК не лише перетворився на об’єкт інтенсивного наукового інтересу, але й сформував навколо себе цілу індустрію, яка одночасно керується суворими науковими критеріями, клінічними протоколами, фармацевтичними стандартами і водночас регуляторними, юридичними та соціальними обмеженнями. Усе це формує унікальний випадок у сучасній науці, коли хімічна речовина, виділена з природної матриці, виступає як поліфункціональний агент у фундаментальних і прикладних дослідженнях.
Хімічна природа Δ9-ТГК, що проявляється в складній структурній організації молекули, визначає його надзвичайно специфічну біоактивність. Класична терпенова будова з наявністю ароматичного кільця, аліфатичного ланцюга та гідроксильної групи не лише забезпечує високу афінність до рецепторів ендоканабіноїдної системи, але й впливає на його ліпофільні властивості, хіральність, метаболічну стабільність і фармакокінетику. Ліпофільна природа дозволяє ТГК вільно проходити через гематоенцефалічний бар’єр, що забезпечує швидкий психоактивний ефект. Стереохімія молекули, зокрема її хіральні центри, визначають афінність до конкретних рецепторних субтипів, що зумовлює часткову агоністичну специфіку, особливо до CB1-рецепторів у ЦНС. Біосинтетичне походження Δ9-ТГК у рослині Cannabis sativa – ще одна критично важлива ланка: від синтезу попередника CBGA до його перетворення у THCA і наступного декарбоксилювання до активної молекули – усі ці етапи чітко контролюються ферментативними каскадами та умовами навколишнього середовища, включаючи температуру, світло і метаболічний статус трихом.
Перехід від природного походження до фармацевтичної доступності потребує складної технологічної обробки. Виробництво Δ9-ТГК передбачає ретельну селекцію сортів канабісу з високим вмістом канабіноїдів, адаптацію агротехнічних умов, зокрема специфічний pH ґрунту, контроль іонного складу, індексів освітлення, вологості та фенофаз. Морфологічні особливості C. sativa і C. indica – відмінності у розташуванні суцвіть, формі листя, щільності трихом – прямо корелюють з якісним і кількісним профілем канабіноїдів, що підтверджено аналітикою за допомогою методів ВЕРХ, ГЖХ і мас-спектрометрії. Різниця у вмісті Δ9-ТГК серед сортів може сягати порядку десятків відсотків, що зумовлює необхідність стандартизації сировини, особливо в контексті клінічного застосування.
Сучасні методи екстракції – це не просто технологічні процеси вилучення, а цілий інженерний напрям, орієнтований на збереження хімічної цілісності Δ9-ТГК, зниження рівня домішок і стандартизацію дозування. Традиційні механічні методи, такі як сухе скиртування і ручне добування трихом, мають історичну цінність, однак не витримують конкуренції з сучасними хімічними та надкритичними екстракційними системами. Використання етанолу, бутану, CO₂ у надкритичному стані – це не лише підвищення виходу, але й можливість точного фракціонування, видалення хлорофілів, восків і продуктів окислення. Далі відбувається багатоетапне очищення, включаючи зимування, дистиляцію, адсорбцію на силікагелі або активованому вугіллі, що гарантує фармацевтичну чистоту субстанції.
Молекулярна мішень Δ9-ТГК – ендоканабіноїдна система – є одним із найбільш складних і недостатньо вивчених регуляторних кластерів в організмі людини. CB1-рецептори, локалізовані переважно в головному мозку (гіпокамп, базальні ганглії, префронтальна кора), регулюють пам’ять, настрій, мотивацію, сприйняття болю та моторну координацію. CB2-рецептори, більш представлені в імунній системі та периферичних тканинах, опосередковують протизапальні, імуномодулюючі та тканинно-регенераторні ефекти. Δ9-ТГК, діючи як частковий агоніст обох підтипів рецепторів, модулює їх функцію за принципом конформаційної пластичності, що дозволяє впливати на широкий спектр фізіологічних параметрів без універсального механізму. Ця властивість одночасно є джерелом терапевтичної потенції та викликів у стандартизації клінічного застосування.
Фармакокінетичний профіль Δ9-ТГК варіює залежно від шляху введення: інгаляційний шлях забезпечує максимальну біодоступність і швидке досягнення пікових концентрацій у плазмі, у той час як пероральне застосування зумовлює суттєвий ефект першого проходження через печінку з утворенням активного метаболіту 11-OH-THC, що володіє підвищеною психоактивністю. Наявність ентерогепатичної циркуляції подовжує ефект, сприяє кумуляції і, відповідно, ускладнює дозування. Метаболізм відбувається переважно за участі ізоферментів цитохрому P450 – CYP2C9, CYP3A4 – з наступною кон’югацією до глюкуронідів і виведенням через нирки і жовч. Понад 80 метаболітів можуть бути ідентифіковані в біологічних рідинах після одноразового введення, що створює складну картину для токсикокінетики, зокрема в умовах хронічного застосування або поліпрагмазії.
Фармакодинамічні ефекти Δ9-ТГК охоплюють надзвичайно широкий діапазон. На рівні ЦНС спостерігаються зміни в нейротрансмісії дофаміну, глутамату, ГАМК та ацетилхоліну, що призводить до психоактивних феноменів – ейфорії, порушень короткотривалої пам’яті, зміненого сенсорного сприйняття, синестезії, змін у часовому сприйнятті. Водночас, периферичні ефекти – вазодилатація, гіпотермія, антиметична дія, міорелаксація – опосередковуються складним каскадом нейроімунних механізмів, де рецепторна дія поєднується з непрямими ефектами, такими як інгібування аденілатциклази або модифікація кальцієвих каналів. Біологічна дія Δ9-ТГК не є гомогенним феноменом, а варіює в залежності від дози, часу введення, генетичних факторів і стану ендоканабіноїдного тонусу.
У клінічному застосуванні Δ9-ТГК демонструє ефективність у терапії хронічного невропатичного болю, нудоти та блювання, індукованих хіміотерапією, стимуляції апетиту при кахексії у пацієнтів з ВІЛ. Проте його застосування потребує строгої стандартизації, зокрема щодо співвідношення з CBD, тривалості курсу, дозування та шляху введення. У нейронауках Δ9-ТГК виступає як експериментальний інструмент для моделювання змін у синаптичній пластичності, LTP/LTD-динаміці, вивчення нейровразливості при PTSD, тривожних розладах і навіть депресії. Нові підходи, що включають наноформуляції, ліпосомальні системи доставки, мікроемульсії, спрямовані на підвищення біодоступності, мінімізацію психоактивності і таргетну дію на конкретні тканини.
Векторні розробки включають стратегії із застосуванням носіїв, модифікованих пептидів, анти-TAG-антитіл, спрямованих на інтеграцію Δ9-ТГК у систему прецизійної медицини. Перспективним напрямком є конструювання селективних агоністів/антагоністів на базі Δ9-ТГК із заданою афінністю до CB1 або CB2-рецепторів, що дозволить створювати препарати з передбачуваним терапевтичним профілем. Сучасні індустріальні лінії з виробництва ТГК базуються на інтеграції біотехнологій, органічного синтезу, аналітичного контролю та фармацевтичного інжинірингу, що формує основу для регуляторного допуску у вигляді GMP-сертифікованих субстанцій.
Таким чином, Δ9-тетрагідроканабінол є поліаспектним об’єктом, що інтегрує природничо-наукові, клінічні та технологічні виміри. Його вивчення має не лише фундаментальне значення для розуміння ендогенних механізмів регуляції, але й утилітарну цінність у межах персоналізованої медицини, фармацевтичної розробки та біоінженерних інновацій. Цей канабіноїд уособлює перехід від стигматизованого рослинного компоненту до повноцінного молекулярного інструмента, здатного трансформувати практики лікування, розуміння нейробіології та парадигму фармакотерапії загалом.
Джерела:
- Tetrahydrocannabinol (THC) – StatPearls, NCBI Bookshelf
Огляд фармакології, клінічного застосування та механізму дії THC.
https://www.ncbi.nlm.nih.gov/books/NBK563174/ - Therapeutic Effects of Cannabis and Cannabinoids – National Academies of Sciences, Engineering, and Medicine
Систематичний огляд доказів щодо терапевтичного потенціалу канабіноїдів.
https://www.ncbi.nlm.nih.gov/books/NBK425767/ - Cannabis and Cannabinoids (PDQ®) – National Cancer Institute
Державний ресурс про використання канабісу в онкологічній практиці.
https://www.cancer.gov/about-cancer/treatment/cam/hp/cannabis-pdq - FDA and Cannabis: Research and Drug Approval Process – U.S. Food & Drug Administration
Про політику FDA щодо наукових досліджень і легалізації канабісу.
https://www.fda.gov/news-events/public-health-focus/fda-and-cannabis-research-and-drug-approval-process - Cannabis and Brain Health – Centers for Disease Control and Prevention (CDC)
Про вплив THC на функціонування мозку.
https://www.cdc.gov/cannabis/health-effects/brain-health.html - Cannabis and the Brain – Harvard Medical School
Нейробіологічні ефекти THC з позиції доказової медицини.
https://hms.harvard.edu/news-events/publications-archive/brain/cannabis-brain - UChicago Research on Demographic Effects of Cannabis – University of Chicago
Дослідження про вплив THC на різні групи населення.
https://news.uchicago.edu/story/uchicago-research-examines-how-cannabis-impacts-distinct-demographics-differently - Industrial Hemp and Medical Cannabis Research – Georgia Southern University
Інформація про сорти, склад і промислові дослідження канабісу.
https://ww2.georgiasouthern.edu/research/researchintegrity/cannabis-research/ - Medical Marijuana Research – Philadelphia College of Osteopathic Medicine (PCOM)
Огляд поточних досліджень медичного канабісу.
https://www.pcom.edu/research/research-areas/medical-cannabis.html - Cannabis and Working Memory – University of Colorado Anschutz Medical Campus
Найбільше на сьогодні дослідження впливу THC на робочу памʼять.
https://news.cuanschutz.edu/news-stories/largest-study-ever-done-on-cannabis-and-brain-function-finds-impact-on-working-memory - Rising THC Potency and Health Risks – Yale School of Medicine
Про зростання концентрації THC в сучасних сортах і потенційні ризики.
https://medicine.yale.edu/news-article/not-your-grandmothers-marijuana-rising-thc-concentrations-in-cannabis-can-pose-devastating-health-risks/ - Know the Risks of Marijuana – Substance Abuse and Mental Health Services Administration (SAMHSA)
Фізіологічні та психічні наслідки вживання THC.
https://www.samhsa.gov/substance-use/learn/marijuana/risks - MedlinePlus – Marijuana Overview
Медичні аспекти марихуани та компонента Δ9-ТГК.
https://medlineplus.gov/marijuana.html - Study on THC Enhancement via CBD – University of Mississippi
Дослідження потенціалу CBD у посиленні ефекту THC.
https://olemiss.edu/news/2025/2/cbd-study-chittiboyina/index.html - Cannabis Facts & Statistics – CDC
Актуальні статистичні дані щодо вживання канабісу.
https://www.cdc.gov/cannabis/data-research/facts-stats/index.html