Канабіноїди – це клас терпен-фенольних сполук, які мають природне, синтетичне або ендогенне походження та взаємодіють з рецепторною системою ендоканабіноїдів у хребетних. Рослина Cannabis sativa L. є унікальним природним джерелом фітоканабіноїдів, серед яких виділяється група кислотних форм – біосинтетичних попередників нейтральних (декарбоксильованих) канабіноїдів. Однією з центральних кислотних молекул є Δ9-тетрагідроканабінолова кислота А (THCA-A), що є безпосереднім попередником психоактивного Δ9-тетрагідроканабінолу (Δ9-THC). У межах біохімії канабісу ця сполука відіграє ключову роль у метаболічному каскаді, а також виступає об’єктом незалежного фармакологічного інтересу, з огляду на свою непсихоактивну, але біоактивну природу.
THCA-A утворюється на пізньому етапі біосинтезу фітоканабіноїдів, шляхом ферментативного перетворення канабігеролової кислоти (CBGA) – так званої “материнської” сполуки, з якої синтезуються основні кислотні форми канабіноїдів. Фермент THCA-синтаза, локалізований у трихомах квіток рослини, каталізує реакцію окислювального циклізування CBGA з утворенням THCA-A. Цей процес є високоспецифічним та генетично детермінованим: відповідні ферментативні шляхи активуються залежно від хемотипу рослини. Тобто, штами з високим рівнем THCA-синтази продукують переважно THCA-A, тоді як інші – CBDA або CBCA відповідно до наявності CBDA- чи CBCA-синтаз.
З точки зору хімічної структури THCA-A є карбоксильованою формою Δ9-THC і має додаткову карбоксильну групу (-COOH), що обумовлює її вищу гідрофільність, знижену проникність через гематоенцефалічний бар’єр, та інші фармакокінетичні властивості. Важливо, що при термічній обробці (нагріванні, сушінні або під впливом ультрафіолету) ця карбоксильна група відщеплюється – відбувається реакція декарбоксилювання, результатом якої є утворення Δ9-THC, молекули, яка легко зв’язується з канабіноїдними рецепторами типу CB1, викликаючи психоактивні ефекти.
THCA-A традиційно розглядалася переважно як проміжна форма, обов’язкова для отримання Δ9-THC. Відповідно, багато дослідницьких програм і фармацевтичних стратегій були спрямовані на максимізацію ефективності декарбоксилювання та стабілізацію кінцевого продукту – Δ9-THC. Проте згодом з’ясувалося, що THCA-A сама по собі має фармакологічну активність, яка реалізується за механізмами, відмінними від канонічного CB1/CB2-рецепторного зв’язування. Вона здатна впливати на молекулярні мішені, що не є частиною ендоканабіноїдної системи, включаючи ферменти, іонні канали, ядерні рецептори та сигнальні білки. Зокрема, з’явилися дані про її вплив на PPARγ-рецептори (пероксисомальні проліфератори), модуляцію експресії COX-2, пригнічення вироблення прозапальних цитокінів, а також нейропротекторну дію в умовах гіпоксії або оксидативного стресу.
Важливо зазначити, що THCA-A у природних умовах не накопичується у стабільному вигляді: він швидко зазнає декарбоксилювання навіть при незначному підвищенні температури або тривалому зберіганні рослинної сировини. Це створює суттєві труднощі для його лабораторного вивчення, вимагає спеціальних умов екстракції та зберігання, а також вдосконалених методів аналітичного контролю. Стандартизація препаратів на основі THCA-A є складною задачею навіть для провідних фармацевтичних лабораторій, оскільки необхідно враховувати час, температуру, кислотність середовища та присутність кисню під час усіх етапів – від збору сировини до упаковки готового продукту.
Інтерес до THCA-A значно зріс в останнє десятиліття, коли кілька незалежних дослідницьких груп повідомили про його потенційні ефекти в контексті хронічного болю, автоімунних захворювань, нейродегенеративних процесів (наприклад, хвороби Паркінсона або Альцгеймера), а також при хіміотерапевтичній нудоті. При цьому відсутність психоактивного профілю робить цю сполуку особливо привабливою для медичного використання, оскільки вона не викликає стану ейфорії, не порушує когнітивні функції і не має абузного потенціалу. З позиції регуляторної політики це означає, що THCA-A може не підпадати під ті ж самі правові обмеження, що й Δ9-THC, хоча в багатьох країнах ця відмінність іще не врахована в законодавстві.
Особливого значення THCA-A набуває у сфері прикладної біотехнології. Вивчення та модифікація THCA-синтази – ферменту, що відповідає за утворення THCA-A – дозволяє генетично програмувати рослини на синтез певних канабіноїдів. Таким чином, контроль за експресією ферментів канабіноїдного шляху стає одним із напрямків створення цільових сортів канабісу для медичного використання. Відомі експерименти з використанням дріжджів та інших мікроорганізмів для біосинтетичного продукування THCA-A in vitro, що відкриває можливість до масштабного біотехнологічного виробництва без залучення самої рослини Cannabis sativa.
Варто підкреслити, що наукова література щодо THCA-A досі обмежена в порівнянні з нейтральними формами канабіноїдів. Більшість даних походить з доклінічних моделей або з описових фармакобіохімічних досліджень. Відсутність широкомасштабних клінічних випробувань знижує обґрунтованість медичного застосування цієї сполуки, що вимагає активізації дослідницьких програм, створення стандартизованих протоколів та системної оцінки безпеки.
Біосинтез та природне походження THCA-A
Δ9-тетрагідроканабінолова кислота A (THCA-A) є ключовим метаболітом вторинного обміну рослини Cannabis sativa L., що належить до класу кислотних фітоканабіноїдів. Вона не існує у вигляді вільного Δ9-тетрагідроканабінолу (Δ9-THC) в свіжих частинах рослини, а навпаки – є його біогенетичним попередником. На відміну від кінцевої, декарбоксильованої форми, THCA-A не має психоактивної активності, що відкриває перспективи її вивчення в медичних застосуваннях без небезпеки викликати емоційно-когнітивні побічні ефекти.
Біосинтез THCA-A відбувається через строго регламентовану послідовність ферментативних реакцій у межах канабіноїдного метаболічного каскаду. Центральною молекулою у цьому процесі виступає канабігеролова кислота (CBGA), яка функціонує як основний попередник для синтезу трьох основних кислотних канабіноїдів: THCA-A, канабідіолової кислоти (CBDA) та канабіхроменової кислоти (CBCA). У свою чергу, CBGA утворюється внаслідок конденсації геранілпірофосфату (GPP) та оліветолової кислоти за участі ензиму типу “арилпренілтрансферази”, що також є визначальним моментом у канабіноїдному шляху.
Подальша доля CBGA в рослині визначається активністю специфічних ферментів-синтаз. У випадку синтезу THCA-A ключовим є фермент THCA-синтаза, який каталізує реакцію окислювального циклізування, трансформуючи CBGA в THCA-A. Дана реакція є строго ензим-опосередкованою: у відсутності THCA-синтази перетворення не відбувається, а отже – утворення THCA-A є контрольованим генетичним процесом, що залежить від експресії відповідного гена THCAS. У рослин з типом хемотипу I – тобто сортів з переважним синтезом Δ9-THC – ферментативний профіль зумовлює домінування THCA-A як основного канабіноїду.
Цей ферментативний шлях має просторову специфічність: синтез THCA-A відбувається головним чином у голчастих залозистих трихомах, які розташовані на жіночих генеративних органах (особливо – на приквітках квіток). Саме в цих структурах сконцентрована активність ферментів, пов’язаних із канабіноїдною біогенезою. Трихоми функціонують як мікроорганели вторинного метаболізму, де в умовах захищеного середовища – зокрема, в межах їхнього секреторного везикулярного простору – накопичуються біоактивні сполуки у кислотній формі. THCA-A утворюється всередині таких мікрокомпартментів та депонується у смолистих ексудатах, які виводяться на поверхню трихом.
Просторово-часова регуляція синтезу THCA-A у рослині Cannabis sativa є динамічним процесом, пов’язаним із фазами вегетації й цвітіння. Максимальна продукція спостерігається на пізніх етапах фази цвітіння, коли трихоми досягають повної морфофункціональної зрілості. Біосинтетична активність THCA-синтази на цьому етапі істотно зростає, що корелює з підвищенням концентрації THCA-A у фітомасі. Важливо, що в період росту (вегетативна стадія) концентрація канабіноїдів незначна, що підтверджує вторинний характер цих сполук – вони не є структурними або енергетичними метаболітами, а виконують захисно-сигнальні функції.
Природне походження THCA-A, є результатом комплексної біоінженерної стратегії самої рослини, спрямованої на хімічну оборону, адаптацію до довкілля, регуляцію взаємодій з патогенами та опосередковану комунікацію з біотичними агентами (наприклад, запилювачами). Біохімічний синтез канабіноїдів – включаючи THCA-A – належить до класу полікітетидно-терпеноїдних гібридних шляхів, які поєднують елементи двох головних класів метаболітів: жирних кислот і ізопренів. Це робить канабіноїди еволюційно унікальними сполуками, що мають подвійне походження та широку функціональну пластичність.
Канабіноїдний біогенетичний шлях
Канабіноїдний біогенетичний шлях у Cannabis sativa представляє собою специфічний гіллястий метаболічний каскад, в якому продукуються три головні кислотні фітоканабіноїди: Δ9-тетрагідроканабінолова кислота (THCA-A), канабідіолова кислота (CBDA) і канабіхроменова кислота (CBCA). Усі ці сполуки походять від спільного попередника – канабігеролової кислоти (CBGA). Даний шлях функціонує як ендогенна біосинтетична програма вторинного метаболізму, активність якої координується ферментативною системою, зумовленою транскрипційною експресією специфічних генів. Його унікальність полягає у поєднанні елементів полікітетидного й мевалонатного шляху, що перехрещуються в утворенні CBGA, з якої потім спеціалізовані ферменти каталітично продукують відповідні кислотні канабіноїди.
На початку біогенезу канабіноїдів відбувається синтез оліветолової кислоти (OA) шляхом конденсації шести атомів вуглецю з ацетил-КоА, через послідовне додавання малоніл-КоА у полікітетидному шляху. Після утворення OA вона вступає в реакцію з геранілпірофосфатом (GPP) – продуктом мевалонатного (або MEP, залежно від тканини) шляху – утворюючи CBGA. Цей процес каталізується арилпренілтрансферазою (APT), яка специфічно розпізнає оліветолову кислоту як арильний субстрат і переносить геранільну групу.
На цьому етапі CBGA є ключовою точкою розгалуження біогенетичного потоку. Її подальша доля залежить від того, який фермент-синтаза експресується в конкретній клітині трихоми. Якщо домінує THCA-синтаза – результатом буде синтез THCA-A; якщо переважає CBDA-синтаза – синтез CBDA; відповідно, при експресії CBCA-синтази утворюється CBCA. Таким чином, сам хемотип рослини, тобто її профіль канабіноїдної продукції, визначається алельним статусом та активністю одного або кількох генів синтаз.
THCA-синтаза є флавопротеїном, що каталізує окислювальне циклізування CBGA до THCA-A, перетворення, що супроводжується утворенням нових циклічних структур, характерних для Δ9-тетрагідроканабінолового ядра. Даний процес не є термодинамічно спонтанним і потребує високої специфічності та просторової орієнтації субстрату в активному центрі ферменту. Особливістю цього шляху є те, що він локалізований переважно у секреторних клітинах головчастих трихом, які спеціалізуються на продукції смолистих метаболітів.
Важливим аспектом є також синхронізація ферментативної активності з фазами онтогенезу рослини. У молодих трихомах синтез CBGA є переважаючим, а зі зростанням ферментативної активності THCA-синтази відбувається зміщення в бік THCA-A. Це свідчить про строго регульований темпороспецифічний контроль біосинтезу, що координується гормональною сигналізацією, рівнем транскрипції та, ймовірно, епігенетичними механізмами.
Ферментативне утворення THCA-A з канабігеролової кислоти (CBGA)
Ферментативна трансформація CBGA в THCA-A є ключовою стадією в канабіноїдному біогенезі й визначає специфічний канабіноїдний профіль у типових “THC-домінантних” сортах Cannabis sativa. Цей процес каталізується ферментом THCA-синтазою – монооксигеназою, яка здійснює окисне циклізування бічного ланцюга CBGA. Реакція, що при цьому відбувається, належить до класу аеробних ферментативних циклізацій, в якій задіяна флавін-аденін-динуклеотид (FAD) як кофактор.
CBGA – субстрат для реакції – має відкриту ароматичну структуру, що містить гідроксильну групу, ізопреноїдний бічний ланцюг і карбоксильну функцію. У присутності THCA-синтази CBGA проходить процес окислення з утворенням реакційноздатного кватерніонного інтермедіату, який реорганізується в тетрагідроканабінолову структуру шляхом електрофільного атаки на ароматичне ядро. Завершується процес замиканням кільця та стабілізацією електронної структури, з утворенням повноцінної молекули THCA-A.
Ця реакція є стереоселективною і стереоспецифічною, тобто THCA-синтаза не лише каталізує циклізацію, а й визначає точну конфігурацію хіральних центрів у кінцевому продукті. Відсутність активності ферменту або його заміна на CBDA-синтазу змінює траєкторію біосинтезу, що доводить критичну залежність кінцевого складу канабіноїдів від цього одного ензиму.
Функціонування ферменту можливе лише у сприятливих фізіологічних умовах, зокрема при наявності кисню, достатньому рівні pH та температурі, сумісній із клітинним гомеостазом. Додатково, CBGA має бути попередньо транспортований до місця локалізації синтази – найчастіше в апопластичний простір трихом – що вказує на існування активних транспортних систем, ймовірно, задіяних у внутрішньоклітинному переміщенні канабіноїдних попередників.
Кінцевий продукт – THCA-A – акумулюється у везикулах трихомального секрету і залишається стабільним у кислотній формі до моменту теплового впливу. При нагріванні або тривалому зберіганні відбувається неферментативна декарбоксиляція, яка перетворює THCA-A на Δ9-THC, що має психоактивну активність. Таким чином, ферментативне утворення THCA-A є критичною стадією у контролі біологічної активності фітоканабіноїдів і опосередковує перехід між інертною та активною формою сполуки.
Роль ферменту THCA-синтази
Фермент THCA-синтаза є функціональним центром синтезу Δ9-тетрагідроканабінолової кислоти й відіграє унікальну роль у визначенні хемотипу Cannabis sativa. Це білок, який за своєю структурою належить до флавін-монооксигеназ (FMO), із молекулярною масою близько 60 кДа, кодується ядерним геном THCAS, що активується в тріхомальних клітинах.
Біохімічна активність THCA-синтази полягає в каталізі внутрішньомолекулярної реакції, в якій CBGA піддається окисленню з утворенням фенольного напівхінону. Далі відбувається циклізація із замиканням піронового кільця, що формує канонічну структуру THCA-A. Реакція проходить у м’яких умовах, без потреби в коензимах, але вимагає присутності кисню та флавіну. Просторова структура ферменту має активну кишеню, в якій субстрат фіксується через гідрофобні та водневі взаємодії. Ця специфічність до CBGA забезпечує відсутність побічних продуктів та максимальну ефективність.
Ген THCAS є поліморфним, з існуванням алельних варіантів, які можуть продукувати неактивні або частково активні білки. Це пояснює фенотипову різноманітність між сортами: канабіси з низькою активністю THCA-синтази синтезують переважно CBGA або CBDA, в той час як THC-домінантні генотипи мають повнофункціональний фермент. Експресія THCAS є строго тканинно-специфічною, і виявляється майже виключно в головчастих трихомах.
Фермент демонструє високий ступінь консервативності в активному центрі, але має варіабельні ділянки, які можуть впливати на каталітичну ефективність. Це створює потенціал для біоінженерного редизайну ферменту з метою отримання нових канабіноїдів або підвищення виходу THCA-A в рекомбінантних системах (наприклад, у дріжджах чи рослинах-гетерологах). Власне THCA-синтаза стає об’єктом біотехнологічних досліджень, спрямованих на стандартизоване промислове виробництво THCA-A поза межами самої Cannabis sativa.
Просторово-часова регуляція синтезу у рослині Cannabis sativa
Біосинтез THCA-A у Cannabis sativa відбувається не рівномірно по всій рослині, а має виражену просторову та фазову спеціалізацію. Найбільша концентрація THCA-A акумулюється в залозистих трихомах жіночих квіток, особливо на приквітках, тоді як у вегетативних тканинах (листках, стеблах) його рівень є низьким або відсутнім. Така локалізація зумовлена диференціацією трихомальних структур як органел вторинного метаболізму, в яких забезпечується ізольоване середовище для ферментативної активності.
Просторова регуляція синтезу охоплює не лише тканинну, але й субклітинну організацію: ферменти, субстрати та продукти синтезу ізольовані в межах апопласту секреторних клітин трихом, що запобігає небажаним реакціям у цитозолі. Секреторні везикули, в яких накопичується THCA-A, мають багатошарову ліпідну оболонку, що обмежує дифузію продукту та захищає від деградації.
Часова регуляція є не менш важливою. Пік синтезу припадає на кінець фази цвітіння, коли трихоми досягають максимального розвитку, а транскрипційна активність THCAS зростає внаслідок гормональних сигналів – зокрема, впливу жасмонатів, абсцизової кислоти та можливо – світлових стимулів. Паралельно зростає і рівень CBGA, що свідчить про координацію синтезу попередників і активності THCA-синтази.
Структурні характеристики молекули
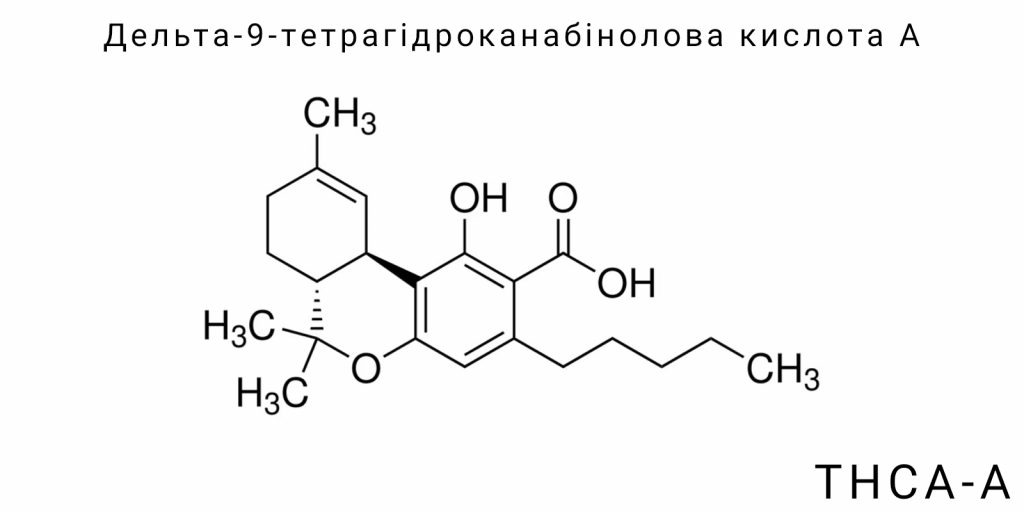
Хімічна і структурна організація Δ⁹-тетрагідроканабінолової кислоти А (THCA-A) є центральним чинником, що визначає її біологічну функціональність, фізико-хімічні властивості та відмінність від її декарбоксильованого аналога Δ⁹-тетрагідроканабінолу (Δ⁹-THC). Як попередник психоактивної форми Δ⁹-THC, THCA-A не має психоактивного ефекту у своєму природному стані, однак завдяки своїй молекулярній будові вона володіє низкою унікальних властивостей, які зумовлюють її функціональну роль у біохімії рослини та потенційне фармакологічне застосування. Глибоке розуміння хімічної природи цієї молекули включає аналіз її складу, просторової конфігурації та функціональних груп, а також їхнього впливу на взаємодію з біологічними мішенями. При цьому критично важливо розрізняти THCA-A від споріднених канабіноїдів, особливо з точки зору стабільності, полярності та афінності до рецепторів.
Хімічна формула та молекулярна маса
Молекула THCA-A має молекулярну формулу C₂₂H₃₀O₄, що відображає наявність двадцяти двох атомів вуглецю, тридцяти атомів водню і чотирьох атомів кисню. Її молекулярна маса становить приблизно 358.48 г/моль. Ця маса є більшою за масу Δ⁹-THC через наявність карбоксильної групи (-COOH), яка є ключовим відмінним елементом. Карбоксильна група робить молекулу полярнішою та водорозчинною порівняно з нейтральним Δ⁹-THC. Крім того, карбоксильна група збільшує кислотність молекули, хоча вона залишається слабкою органічною кислотою. У біохімічному сенсі це означає, що THCA-A може вступати в водневі зв’язки з білками, ліпідами або іншими молекулами, що надає їй специфічних фармакокінетичних властивостей, відмінних від психоактивного аналога. З погляду органічної хімії, хімічна формула також відображає наявність ароматичного кільця, алкільного ланцюга та ізопреноїдного фрагмента, що структурно виводиться з канабігеролової кислоти – материнського прекурсора для більшості фітоканабіноїдів.
Ароматичне кільце, притаманне для фенольних сполук, формує основу молекули і бере участь у численних реакціях оксидації й гідроксилювання. Наявність гідроксильної групи в орто-положенні відносно карбоксильної групи посилює електронодонорні властивості цієї частини молекули, що може бути важливим для хелатування металів у ґрунті або взаємодії з ферментними системами. Наявність бічного пентильного ланцюга, типової структурної ознаки більшості Δ⁹-канабіноїдів, забезпечує гідрофобність та впливає на проникність клітинних мембран, зокрема через ліпідні двошари. Таким чином, хімічна формула THCA-A не є простою кількісною характеристикою; вона відображає структурно-функціональні принципи, закладені в самій молекулярній архітектоніці, які визначають біоактивність, розчинність, деградацію та шлях метаболізму.
Стереохімія та конфігурація
THCA-A має чітко визначену тривимірну структуру, що формується внаслідок наявності декількох хіральних центрів у молекулі. Основні хіральні центри розташовані в області циклогексанового кільця, де конформація впливає на загальну біоактивність речовини. Переважна конфігурація цих центрів є (6aR,10aR), що відповідає природній ізомерії, яка синтезується в рослині за участі THCA-синтази. Конформаційна стабільність молекули підтримується внутрішньомолекулярними водневими зв’язками, які зумовлені взаємодією гідроксильних та карбоксильних груп, що, у свою чергу, впливає на температуру плавлення, розчинність у воді й органічних розчинниках, а також хімічну реактивність.
Просторова конфігурація THCA-A обумовлює її можливість селективно взаємодіяти з біомолекулами, зокрема білками, ліпідами та нуклеїновими кислотами, через специфічне просторове комплементарне упізнавання. Ця специфічність є критично важливою при вивченні потенційних терапевтичних механізмів дії, оскільки навіть незначні зміни у стереохімії можуть призводити до значних змін у біологічній активності або втрати активності взагалі. Важливо зазначити, що стереоізомери, які не зустрічаються в природі, але можуть бути синтезовані штучно, зазвичай не мають такої ж біоактивності, як природна форма, що знову ж таки вказує на еволюційну адаптацію ферментативних систем рослини до синтезу тільки одного просторового варіанта.
Також просторове розміщення атомів визначає здатність молекули до автокаталітичної декарбоксилювання. Наявність карбоксильної групи в α-положенні відносно ароматичного кільця підвищує ймовірність термічної нестабільності. Цей фактор важливий у контексті приготування екстрактів або продуктів на основі канабісу, оскільки навіть незначне нагрівання може ініціювати декарбоксилювання й перетворення в Δ⁹-THC. Тобто, стереохімія THCA-A не тільки визначає його хімічну інертність щодо психоактивності, але й програмує термодинамічну долю молекули в процесах зовнішньої обробки.
Відмінності від нейтралізованої форми Δ⁹-THC
Ключова відмінність між THCA-A та Δ⁹-THC полягає у наявності карбоксильної групи в THCA-A, яка відсутня у Δ⁹-THC внаслідок процесу декарбоксилювання. Ця структурна різниця є визначальною не лише з точки зору хімічного складу, але й з огляду на фармакодинамічні та фармакокінетичні властивості. THCA-A не взаємодіє ефективно з канабіноїдними рецепторами CB1, які є основними мішенями психоактивного Δ⁹-THC. Причина такої неефективності криється саме в просторовій і електронній конфігурації молекули: карбоксильна група заважає щільному зв’язуванню з активним сайтом рецептора через стеричне обмеження та електростатичну невідповідність.
На відміну від Δ⁹-THC, який є ліпофільним і легко проходить через гематоенцефалічний бар’єр, THCA-A має більшу полярність і тому характеризується слабшим проникненням у центральну нервову систему. Це пояснює відсутність психоактивного ефекту та одночасно відкриває можливості для використання THCA-A у терапевтичних цілях, не пов’язаних із впливом на психіку. Крім того, THCA-A демонструє стабільніші фармакокінетичні профілі в шлунково-кишковому тракті, де кислота краще резистентна до деградації, на відміну від Δ⁹-THC, який легко метаболізується в печінці до 11-гідрокси-THC – активного метаболіту з посиленою психоактивністю.
У термічному аспекті THCA-A є термолабільною сполукою, яка при нагріванні декарбоксилюється з утворенням Δ⁹-THC. Цей перехід відбувається у межах температури 105-120°C, що є критичним при сушінні, курінні або термічному екстрагуванні. У свою чергу, Δ⁹-THC є термічно стабільнішою молекулою з розширеним діапазоном застосування у фармацевтичних препаратах. Проте саме здатність THCA-A до контрольованої трансформації в Δ⁹-THC дає змогу регулювати рівень психоактивних компонентів у продуктах із канабісу, що є ключовим фактором у фармацевтичному формулюванні.
Технології добування THCA-A: Сфери застосування – від медичної до фундаментальної науки
Δ⁹-Тетрагідроканабінолова кислота А (THCA-A), незважаючи на свою попередникову функцію відносно психоактивного Δ⁹-THC, сьогодні дедалі більше привертає увагу як самостійна молекула з унікальним спектром властивостей. На відміну від інших фітоканабіноїдів, її статус як нестабільного, термолабільного кислотного компонента диктує специфічні умови для видобування, зберігання і застосування. Саме ці особливості створили імпульс для розвитку спеціалізованих технологій видобутку, очистки та ідентифікації THCA-A. Проте ще більш вагомим є питання її практичного застосування. Наразі THCA-A розглядається як перспективний об’єкт у різних напрямах – від прикладної медицини до фармакогнозії, агрономії та молекулярної біохімії.
Початково THCA-A здебільшого сприймалася як перехідна форма до Δ⁹-THC і не піддавалася цілеспрямованому дослідженню як біоактивна речовина. Однак розширення методів ізоляції нестабільних молекул без декарбоксилювання, зокрема через розвиток кріогенної екстракції та прецизійної хроматографії, відкрило шлях до експериментального та клінічного вивчення властивостей THCA-A у її первинній кислотній формі. Ця ізольована форма виявила низку властивостей, які роблять її особливою у порівнянні з нейтралізованими канабіноїдами. Найбільше досліджень сконцентровано навколо її протизапального, нейропротекторного, антипроліферативного та імуномодулювального потенціалу.
У медичних дослідженнях THCA-A демонструє селективну активність щодо ключових мішеней запального каскаду, таких як COX-1, TNF-α, IL-6, а також факторів транскрипції типу NF-κB. При цьому вона не стимулює психоактивні шляхи, що робить її придатною для тривалого застосування у пацієнтів із хронічними захворюваннями без ризику психогенних побічних ефектів. Особливо перспективними є дослідження щодо нейродегенеративних станів – таких як хвороба Альцгеймера, Паркінсона, розсіяний склероз. Тут THCA-A виявляє здатність стабілізувати мікроглію та регулювати глутаматну нейротрансмісію, що підтверджується результатами іn vitro та дослідженнями на тваринних моделях.
Крім того, THCA-A виявляє цитостатичну активність у ряді онкологічних моделей, включаючи колоректальний рак, рак молочної залози та гліобластому. Механізм дії базується на інгібуванні клітинного циклу на стадії G1/S, а також модуляції експресії генів апоптозу, таких як BAX, BCL-2 та каспази. Дослідники вказують на здатність THCA-A впливати на сигнальні шляхи PI3K/Akt та MAPK, що забезпечує селективну токсичність для ракових клітин при збереженні життєздатності нормальних клітин. На відміну від Δ⁹-THC, який має психоактивну обмеженість у дозуванні, THCA-A дозволяє розширити терапевтичне вікно і застосовувати більш високі дози без побічних нейроповедінкових ефектів.
Ще одним перспективним напрямом є гастроентерологія, зокрема терапія запальних захворювань кишечника (ВЗК), таких як хвороба Крона та виразковий коліт. У попередніх клінічних дослідженнях THCA-A знижувала рівень маркерів запалення та сприяла відновленню слизової оболонки кишечника через модуляцію ендоканабіноїдної системи без залучення CB1/CB2-рецепторів. Ймовірно, у цьому задіяні альтернативні мішені – зокрема PPARγ та TRP-канали, які залишаються активними в кислотних похідних канабіноїдів. Цей аспект відображає складну взаємодію між хімічною формою, рецепторною специфікою та фізіологічною активністю, що відкриває можливості для створення неканонічних фармакологічних підходів.
У сфері неврології досліджуються антиконвульсантні властивості THCA-A. Попередні результати показують, що у моделях епілепсії THCA-A знижує частоту нападів і не змінює базовий рівень збудливості, що вигідно відрізняє її від Δ⁹-THC, який може мати як протисудомні, так і провокаційні ефекти залежно від дозування. Крім того, THCA-A не викликає толерантності навіть при тривалому застосуванні, що робить її привабливою альтернативою для пацієнтів із фармакорезистентною епілепсією.
Поза клінічним контекстом THCA-A розглядається як зручний маркер у фармакогностичних дослідженнях сортів Cannabis sativa. Його вміст дозволяє класифікувати фенотипи канабісу, відстежувати стадії зрілості суцвіть, а також оптимізувати умови культивації. У лабораторних умовах THCA-A виступає субстратом для вивчення каталітичних властивостей THCA-синтази, що важливо для синтетичної біології та біотехнологій. Зокрема, розробляються методи генетичної модифікації дріжджів та бактерій, здатних до біосинтезу THCA-A шляхом експресії канабіноїдних ферментів. Це відкриває шлях до біоферментативного виробництва канабіноїдів без вирощування рослин, що має потенціал для промислового масштабування.
Крім того, THCA-A активно досліджується у фундаментальній біохімії як модельна структура для вивчення взаємодій малих органічних молекул з білками. Його добре вивчена стереохімія, наявність полярної та гідрофобної частин, а також здатність до автокаталітичної трансформації роблять його ідеальним кандидатом для використання у дослідженнях ензиматичних реакцій, молекулярного докінгу та протеоміки. Спектроскопічні й хроматографічні методи, розроблені для аналізу THCA-A, наразі адаптуються для інших природних кислотних канабіноїдів, включаючи CBDA та CBGA, що розширює аналітичний інструментарій у фітохімії.
Методи екстракції сирого канабісу
Екстракція THCA-A із сирого канабісу є ключовим етапом для отримання чистого та стабільного продукту, який зберігає кислотну форму канабіноїду. Процес екстракції потребує дотримання специфічних фізико-хімічних умов, оскільки THCA-A є термолабільною сполукою, чутливою до нагрівання, світла та окислення. Для збереження біологічної активності та хімічної цілісності молекули застосовують низькотемпературні технології та мінімізують контакт із киснем і ультрафіолетовим випромінюванням.
Рослинна сировина – сирий канабіс – готується до екстракції шляхом акуратного збору у фазі максимального накопичення THCA-A, що зазвичай припадає на кінець цвітіння. Матеріал подрібнюють з метою збільшення площі контакту з розчинником, при цьому суворо контролюють температуру, щоб уникнути початку термального розкладу. Сировина після подрібнення зберігається у холодних умовах, що запобігає ферментативним перетворенням і хімічній деструкції.
Вибір методу екстракції залежить від вимог до кінцевого продукту та специфіки застосування. Екстракція, що виконується при низьких температурах із використанням відповідних розчинників, забезпечує максимальне збереження THCA-A. Застосування полярних та неполярних розчинників дозволяє варіювати спектр екстрагованих сполук, від канабіноїдів до терпеноїдів, проте умови процесу строго регламентують температуру та час контакту, щоб уникнути перетворення THCA-A у Δ⁹-THC. Розроблені методики знижують негативний вплив окислювальних процесів, зокрема шляхом використання інертних газів у зоні екстракції і герметизації продукту.
Сировина, оброблена відповідним чином, проходить через технологічні цикли, що оптимізують ступінь вилучення THCA-A. У межах цих циклів розроблені умови мінімізують присутність побічних компонентів, таких як хлорофіл, ліпіди та інші полярні речовини, які можуть впливати на якість екстракту. У зв’язку з цим застосовуються попередні етапи очищення та фільтрації, що підвищують селективність видобутку.
Технологічні підходи також враховують необхідність адаптації процесу до промислових масштабів виробництва, що вимагає балансу між виходом продукту та якістю. Оптимізація експлуатаційних параметрів екстракційних систем дозволяє підтримувати стабільний рівень активної речовини при мінімальних втратах. Також важливим фактором є безпека процесу, що передбачає контроль за можливими залишками розчинників і запобігання вибухонебезпечних умов.
Умови збереження кислотної форми (низька температура, відсутність світла)
Δ⁹-Тетрагідроканабінолова кислота А (THCA-A) є хімічно нестабільною сполукою, що вимагає особливих умов для збереження її кислотної форми під час зберігання та обробки. Основними факторами, які призводять до деградації THCA-A, є підвищена температура, дія ультрафіолетового та видимого світла, а також окислювальні процеси, що можуть ініціювати декарбоксилювання – хімічне перетворення кислоти в нейтральний Δ⁹-тетрагідроканабінол (THC). Оскільки THCA-A має унікальні фармакологічні властивості, відмінні від THC, збереження її структури є пріоритетним завданням у технологіях виробництва та зберігання канабіноїдних препаратів.
Температурний режим є ключовим параметром стабільності THCA-A. При температурах вище 40 °C відбувається значне пришвидшення декарбоксилювання, що призводить до втрати кислотної форми і переходу в активну, але вже нейтральну молекулу THC. У лабораторних та промислових умовах зберігання екстрактів, що містять THCA-A, рекомендовано підтримувати температуру в межах від -20 °C до +4 °C. Цей температурний діапазон мінімізує кінетичні шляхи розпаду та попереджає активацію термолабільних реакцій. Особливо критично підтримувати низькі температури під час транспортування та довгострокового зберігання, оскільки навіть короткочасне підвищення температури може призвести до помітного зниження концентрації THCA-A.
Крім температури, значний вплив має вплив світла, особливо ультрафіолетового (UV) випромінювання, яке індукує фотодеградацію молекули. THCA-A має кон’юговану систему подвійних зв’язків у бензольному кільці, що робить її чутливою до фотохімічних реакцій. При дії світла порушується електронна структура, активуються радикальні процеси, які сприяють руйнуванню молекули або її конверсії. Тому весь процес екстракції, очищення і зберігання повинен відбуватися у мінімальному світловому режимі: застосовують непрозорі або бурштинові контейнери, а також ізолюють матеріал від прямих променів сонця або лабораторних ламп.
Окислювальне середовище також суттєво впливає на стабільність THCA-A. Контакт із киснем атмосферного повітря сприяє утворенню пероксидних радикалів, які ініціюють полімеризацію або деградацію молекули. Для мінімізації цього процесу використовують герметичні контейнери, часто наповнені інертними газами (аргоном, азотом), що створюють пасивне середовище та знижують активність кисню. Додатково у деяких технологіях застосовують антиоксиданти, які стабілізують екстракти, запобігаючи окислювальному пошкодженню.
Іншим аспектом є вплив вологості повітря. Висока вологість може сприяти гідролітичним реакціям або активізувати ферментативні процеси, що непрямо впливають на стабільність THCA-A. Тому приміщення для зберігання мають підтримувати оптимальний рівень вологості (близько 30-50%) із застосуванням осушувачів повітря або контролю клімату.
Етанольна, вуглекислотна та бутанова екстракція
Екстракція THCA-A із сирого канабісу здійснюється різними розчинниками, серед яких етанол, надкритичний вуглекислий газ (SC-CO₂) та бутан мають особливе значення через свої фізико-хімічні властивості та специфіку взаємодії з рослинним матеріалом. Кожен з цих методів характеризується своїми перевагами і технологічними викликами, що впливають на вихід і чистоту цільового канабіноїду.
Етанольна екстракція – одна з найпоширеніших і найдавніших технологій. Етанол має полярність, достатню для вилучення широкого спектра фітохімічних компонентів, включно з THCA-A, терпеноїдами та флавоноїдами. Його перевагою є відносна безпека, доступність і можливість контролю температури, що дозволяє мінімізувати декарбоксилювання. Етанол охолоджують до низьких температур (-20 °C і нижче), щоб знизити розчинність небажаних компонентів, таких як хлорофіл, що полегшує подальше очищення. Після екстракції розчинник видаляють вакуумним випарюванням при температурі нижче 40 °C, що зберігає кислотну форму THCA-A. Недоліком етанолу є те, що він екстрагує не лише канабіноїди, але й значну кількість інших рослинних сполук, що ускладнює процес очищення і потребує додаткових кроків фільтрації та хроматографії.
Вуглекислий газ у надкритичному стані (SC-CO₂) представляє більш технологічно складний, але високоефективний метод. SC-CO₂ поєднує властивості газу і рідини, що дозволяє проникати глибоко в тканини рослини і вибірково розчиняти цільові компоненти. Контроль тиску і температури дає змогу маніпулювати розчинністю THCA-A та інших сполук, що сприяє отриманню чистих екстрактів з мінімальним вмістом домішок. Цей метод особливо цінний тим, що не залишає токсичних залишків розчинників, а процес відбувається без доступу кисню, що підтримує стабільність кислотної форми. Водночас SC-CO₂ екстракція потребує дорогого обладнання і суворого контролю параметрів, що обмежує її застосування у малих лабораторіях.
Бутанова екстракція характеризується високою розчинністю неполярних і слабкополярних речовин, що забезпечує високий вихід канабіноїдів, у тому числі THCA-A. Вона проводиться при низьких температурах, що зменшує ризик термічної деструкції, а розчинник легко видаляється шляхом випаровування. Метод широко використовується в промислових масштабах для отримання концентрованих продуктів. Проте бутан є легкозаймистим і токсичним газом, що вимагає суворого дотримання правил безпеки і ретельного контролю за залишками у кінцевому продукті. Важливо, що цей метод може видобувати переважно неполярні сполуки, що іноді потребує комбінації з іншими техніками для отримання комплексних екстрактів.
Методи холодного пресування та живого концентрату (live resin)
Холодне пресування і виробництво живих концентратів (live resin) – це технології, що дозволяють максимізувати збереження біологічно активних компонентів сирого канабісу, включно з THCA-A, за рахунок мінімізації теплового та окисного стресу на матеріал. Вони становлять альтернативу традиційним методам екстракції із застосуванням розчинників.
Холодне пресування базується на механічному виділенні екстрактів шляхом стиснення рослинної сировини при низьких температурах (зазвичай близько 0-5 °C). Відсутність нагріву запобігає декарбоксилюванню THCA-A і втраті летких терпеноїдів, які є важливими для повного фармакологічного профілю продукту. Процес здійснюється на спеціалізованих пресах із застосуванням повільного стиску, що мінімізує механічне ушкодження тканин і витік домішок. Отриманий концентрат характеризується високою концентрацією THCA-A у чистій кислотній формі, зберігаючи при цьому натуральний склад рослинних метаболітів.
Живі концентрати (live resin) виробляються із свіжозібраної або замороженої сировини канабісу, яка не піддавалася сушці або сушилася мінімально. Технологія полягає у швидкому заморожуванні рослини відразу після збирання, що фіксує хімічний склад і структуру клітин. Заморожений матеріал потім піддається екстракції, зазвичай за допомогою надкритичного CO₂ або бутану, при низьких температурах, що дозволяє зберегти максимально повний спектр канабіноїдів, включно з нестабільним THCA-A, і леткі терпеноїди. Цей метод є високотехнологічним і дозволяє отримувати концентрати, які близькі за хімічним складом до живої рослини, забезпечуючи максимальну фармакологічну ефективність.
Обидва методи, холодне пресування і live resin, застосовуються для отримання продуктів, які максимально наближені до природного складу канабісу і відрізняються високою біологічною активністю. Вони вимагають ретельного контролю температури і швидкості обробки, а також використання спеціалізованого обладнання, що мінімізує контакт із киснем і світлом, зберігаючи кислотну форму THCA-A. Ці технології набули поширення у виробництві фармацевтичних препаратів, косметичних засобів та дослідницьких матеріалів, де необхідна висока якість і стабільність хімічного складу.
Лабораторне виділення та очищення
У лабораторній практиці ізольоване отримання Δ9-тетрагідроканабінолової кислоти A (THCA-A) з високим ступенем чистоти є необхідною передумовою для подальших фармакологічних, біохімічних або аналітичних досліджень. На відміну від промислових методів екстракції, орієнтованих на масове виробництво канабіноїдних концентратів, лабораторні процедури передбачають точну селекцію мішеневої молекули серед складної матриці вторинних метаболітів, що характерні для рослини Cannabis sativa. Це завдання ускладнюється високою реакційною нестабільністю THCA-A, особливо під впливом температури, світла або підвищеного pH, що зумовлює її швидку декарбоксиляцію до психоактивної форми Δ9-THC. Тому будь-яке ефективне виділення та очищення THCA-A вимагає поєднання специфічної температурної стратегії, контролю умов середовища та застосування високоточних аналітичних методів, зокрема хроматографічних і спектроскопічних технік.
Одним із головних завдань лабораторного очищення є збереження кислотної функціональної групи карбоксилу в структурі THCA-A, що визначає її біохімічну специфіку і фармакодинамічну відмінність від декарбоксильованих форм. Структура кислотного канабіноїду значно ускладнює класичні методи кристалізації, тому пріоритет віддається методам поділу на основі роздільної здатності між молекулярними фракціями за фізико-хімічними властивостями, такими як полярність, молекулярна маса та спорідненість до сорбентів. За умов суворого контролю середовища, комбінація рідинної хроматографії та спектрального моніторингу дає змогу отримувати препарати THCA-A з чистотою понад 98%, необхідною для фундаментальної науки й фармацевтичного синтезу.
Хроматографічні методики (HPLC, TLC, колонкова хроматографія)
Хроматографія відіграє ключову роль у процедурі виділення THCA-A, оскільки дозволяє ефективно відокремлювати цільову молекулу від супутніх канабіноїдів, терпенів, флавоноїдів і хлорофілів без потреби в агресивних хімічних перетвореннях, що можуть порушити кислотну форму. Одним із найточніших методів у цьому контексті є високоефективна рідинна хроматографія (HPLC), яка застосовується для як аналітичного, так і препаративного розділення. Основна перевага HPLC полягає у здатності працювати при кімнатній або знижений температурі, що принципово важливо для уникнення декарбоксиляції THCA-A.
В умовах HPLC відбувається розділення складної суміші за рахунок різної спорідненості її компонентів до стаціонарної фази (зазвичай зворотньо-фазної C18) та рухомої фази, яка представляє собою водно-органічний градієнт. Оптимальні умови для поділу THCA-A включають низькотемпературну подачу елюенту, контрольований рН та детекцію при довжині хвилі близько 220-280 нм. За допомогою масштабування параметрів потоку і концентрації, HPLC також може бути адаптована для отримання міліграмових і грамових кількостей чистого THCA-A.
Тонкошарова хроматографія (TLC), хоча й менш чутлива, залишається цінним методом для первинного скринінгу наявності та чистоти THCA-A у зразках, а також для відслідковування етапів очищення. Вона базується на розділенні речовин у капілярному полі тонкого шару сорбенту (зазвичай силікагелю), де THCA-A проявляється як характерна пляма за використання специфічних проявників (наприклад, ванілін-сірчанокислий реагент). Проте, TLC не дозволяє повноцінно ідентифікувати або ізолювати великі кількості речовини і використовується лише як додатковий метод.
Колонкова хроматографія є класичним препаративним підходом, що дозволяє проводити розділення канабіноїдів у великих обсягах. Для очищення THCA-A колонка заповнюється полярним сорбентом (наприклад, силікагель або алюмосилікати), а як рухому фазу використовують суміші органічних розчинників, зокрема гексану, етилацетату, метанолу або їх градієнтів. Очищення здійснюється у контрольованих температурних умовах для запобігання термічному розпаду. Послідовне фракціонування елюатів дозволяє ізолювати цільову фракцію з домінуючим вмістом THCA-A, яка далі піддається аналітичній перевірці на чистоту і структурну цілісність.
Аналіз чистоти та ідентифікація за допомогою спектроскопії (NMR, MS)
Після хроматографічного виділення наступним критичним етапом є підтвердження ідентичності та визначення ступеня чистоти THCA-A. Для цього використовуються високоточні спектроскопічні методи, головним чином ядерний магнітний резонанс (NMR) та мас-спектрометрія (MS), які забезпечують повний структурний аналіз і дозволяють верифікувати наявність або відсутність домішок із точністю до слідів.
ЯМР-спектроскопія (NMR) є незамінною при верифікації хімічної структури THCA-A. Метод базується на взаємодії атомних ядер з магнітним полем і виявленні резонансних сигналів, характерних для конкретних типів хімічного оточення. У випадку THCA-A найбільший аналітичний інтерес становлять протони карбоксильної групи, олефінових фрагментів та ароматичного кільця, які дають змогу точно диференціювати кислотну форму від нейтральної Δ9-THC. Використання двовимірної ЯМР-спектроскопії (COSY, HSQC, HMBC) дає змогу точно картувати всі міжатомні зв’язки, підтверджуючи повноту структури та відсутність ізомеризацій чи побічних продуктів.
Мас-спектрометрія (MS) дозволяє ідентифікувати молекулярну масу та фрагментаційний профіль речовини. THCA-A має характерну молекулярну масу 358,48 г/моль, а її іонізаційні продукти дають характерні піки у спектрі з точними масами фрагментів, які дозволяють підтвердити її наявність навіть у надзвичайно малих кількостях. При поєднанні з хроматографією (наприклад, HPLC-MS) мас-спектрометрія забезпечує подвійний рівень ідентифікації – як за ретенційним часом, так і за спектральною сигнатурою.
У деяких випадках також використовується інфрачервона спектроскопія (FTIR), яка дозволяє виявити специфічні функціональні групи, зокрема карбоксил і фенольні фрагменти, що є ключовими маркерами THCA-A. Ультрафіолетова спектроскопія (UV-VIS) теж застосовується як допоміжний інструмент для визначення концентрації в аналітичному середовищі.
Поєднання хроматографічного розділення з багатовимірною спектроскопічною ідентифікацією забезпечує високий ступінь достовірності у підтвердженні структури і чистоти THCA-A, що критично важливо для його подальшого застосування в експериментальній біомедицині, токсикології, фармакокінетиці та хімічному синтезі похідних. Ці методи утворюють еталонну процедуру, що дозволяє уникнути артефактів та помилкових інтерпретацій при дослідженні канабіноїдної біохімії.
Фармакологічні та фізіологічні властивості THCA-A
Δ9-Тетрагідроканабінолова кислота A (THCA-A) є первинною кислотною формою Δ9-тетрагідроканабінолу (THC), яка накопичується в сирому канабісі до моменту термічної чи фотохімічної декарбоксиляції. Попри структурну схожість із Δ9-THC, THCA-A демонструє принципово інший фармакологічний профіль, зумовлений наявністю карбоксильної групи, що обмежує її проникнення через гематоенцефалічний бар’єр та змінює афінність до основних канабіноїдних рецепторів. Упродовж тривалого часу THCA-A розглядалася лише як попередник психоактивного Δ9-THC, однак сучасна наука поступово реабілітує цю сполуку як незалежний біоактивний агент із власним спектром фізіологічної активності. Її властивості дедалі частіше вивчаються у межах прикладної фармакології, нейронаук, онкобіології та імуномодуляції.
Однією з ключових особливостей THCA-A є її низька психотропність, що відкриває перспективи для створення терапевтичних препаратів без ризику когнітивної чи поведінкової інтоксикації. Це значно розширює можливості її клінічного застосування, зокрема у пацієнтів із нейродегенеративними захворюваннями, онкологічними патологіями або хронічними запальними станами, які потребують тривалого фармакологічного супроводу без змін у свідомості. У даному контексті THCA-A цікавий насамперед як потенційний модулятор ензимних каскадів, інгібітор прозапальних сигнальних шляхів та як агент з нейропротекторним ефектом.
Слід підкреслити, що THCA-A не є фармакологічно інертною молекулою. Її біоактивність зумовлюється не взаємодією з класичними CB1-рецепторами, до яких вона має низьке споріднення, а через опосередкований вплив на інші молекулярні мішені, включно з ферментами циклооксигеназного каскаду (COX-1, COX-2), іонними каналами та, ймовірно, сигнальними рецепторами типу PPARγ, TRPV1 і GPR55. Крім того, з’являється дедалі більше свідчень про те, що THCA-A може діяти як антипроліферативний агент у деяких пухлинних лініях клітин, а також проявляти здатність до стабілізації нейрональної активності у моделях нейродегенерації. Окремі дослідження вказують на потенційну антиеметичну активність, що може бути використано при супроводі хіміотерапії.
Іншим важливим аспектом є обмежене проникнення THCA-A через гематоенцефалічний бар’єр, що, з одного боку, обмежує її центральні ефекти, але з іншого – робить її привабливою для таргетної дії в периферичних тканинах, де вона може безпосередньо впливати на клітини імунної системи, запальні компоненти та рецепторні мережі без психоактивного впливу. Це відкриває перспективу створення THCA-A-орієнтованих лікарських форм, спрямованих на системне, а не нейропсихічне лікування.
Крім того, THCA-A демонструє значну хімічну лабільність, яка вимагає жорсткого контролю умов зберігання та введення в організм. Фармакокінетичні властивості THCA-A ще залишаються недостатньо вивченими, однак попередні дані свідчать про те, що її біодоступність при пероральному вживанні є вищою, ніж у декарбоксильованої форми, завдяки кращій розчинності у водному середовищі. Проте метаболічна стабільність і шляхи виведення потребують подальших досліджень, особливо з урахуванням можливих трансформацій у шлунково-кишковому тракті та печінці.
Біоактивність без декарбоксилювання
THCA-A, як природна кислота, яка утворюється в рослинах Cannabis sativa, відрізняється від своєї нейтралізованої форми Δ9-THC не лише структурно, а й за фізіологічними та фармакологічними властивостями. Найважливішим аспектом біоактивності THCA-A є те, що вона функціонує в організмі без необхідності попереднього декарбоксилювання, тобто без втрати карбоксильної групи, яка суттєво впливає на молекулярні взаємодії та фармакодинаміку сполуки. Такий факт радикально розширює можливості використання THCA-A як біоактивного компонента з унікальними характеристиками, відмінними від психоактивного THC.
Нейтралізація карбоксильної групи в процесі декарбоксилювання трансформує молекулу в активний психоактивний канабіноїд, здатний проникати через гематоенцефалічний бар’єр, активно зв’язуватися з CB1-рецепторами центральної нервової системи і викликати психоактивні ефекти. У той же час THCA-A, зберігаючи карбоксильну групу, має значно нижчу спорідненість до канабіноїдних рецепторів, особливо CB1, що пояснює відсутність типових для THC психоактивних ефектів при введенні неактивованої форми.
Біоактивність THCA-A характеризується її здатністю модулювати різні молекулярні цілі в організмі, які не пов’язані з класичними рецепторами ендоканабіноїдної системи, зокрема ферментативні системи, іонні канали та запальні сигнальні каскади. Таким чином, THCA-A демонструє потенціал як агент, що впливає на фізіологічні процеси поза межами центральної нервової системи, відкриваючи шлях для фармакологічних стратегій без психотропного навантаження.
Значний інтерес викликають дані про те, що THCA-A є потужним інгібітором ферментів циклооксигенази COX-1 і COX-2, ключових каталізаторів синтезу прозапальних простагландинів. Через це вона може діяти як природний протизапальний агент, регулюючи активність імунних клітин та знижуючи рівень запальних медіаторів у тканинах. Така властивість робить її перспективною для досліджень у контексті аутоімунних захворювань, хронічного болю та нейродегенеративних розладів, де запальні процеси відіграють фундаментальну роль.
Водночас, THCA-A взаємодіє з різними рецепторами, не належними до класичної системи CB1/CB2, зокрема PPARγ – ядерним рецептором, який регулює метаболічні процеси, диференціацію клітин та імунну відповідь. Активація PPARγ пов’язана з антіінфляторними, антипрофіляторними та нейропротекторними ефектами, що робить цю взаємодію фармакологічно значущою. Крім того, THCA-A може впливати на іонні канали типу TRPV1, які беруть участь у передачі больових сигналів і регуляції терморегуляції, що потенційно пояснює деякі її аналгетичні та нейромодулювальні властивості.
Таким чином, біоактивність THCA-A без декарбоксилювання полягає в її здатності функціонувати як мультицільовий молекулярний агент, який модуляє ключові фізіологічні та патофізіологічні процеси без психоактивного ефекту. Це відкриває перспективи її застосування в медицині як базового компонента терапевтичних схем, що потребують зниження запалення, регуляції імунної відповіді, захисту нейронів та пом’якшення болю без порушення когнітивних функцій.
Відсутність психоактивної дії
Відсутність психоактивної дії THCA-A є одним із найважливіших її відмінностей від Δ9-THC, що робить її привабливою для медичного застосування без супутніх побічних ефектів, пов’язаних з інтоксикацією. Психоактивність Δ9-THC зумовлена його високою афінністю до CB1-рецепторів, які локалізуються у великій кількості в центральній нервовій системі, включно з мозком, де регулюють нейромедіаторні процеси, психомоторну активність, когнітивні функції і сприйняття. THCA-A, маючи карбоксильну групу, є більш полярною молекулою, що значно знижує її здатність проникати через гематоенцефалічний бар’єр, обмежуючи вплив на центральну нервову систему.
Розміщення карбоксильної групи в молекулі THCA-A змінює її просторову конфігурацію, що суттєво впливає на взаємодію з рецепторами CB1. Ця структурна відмінність викликає зниження спорідненості молекули до цих рецепторів на кілька порядків у порівнянні з Δ9-THC, тому THCA-A не викликає типових психотропних ефектів, таких як ейфорія, порушення когнітивних функцій чи сенсорна дезорієнтація. В експериментальних моделях in vitro та in vivo було підтверджено, що THCA-A не активує сигнальні каскади CB1-рецепторів, що обумовлює її фармакологічну безпечність у цьому контексті.
Відсутність психоактивності не означає, що THCA-A є фармакологічно неактивною. Навпаки, вона проявляє широкий спектр біологічних дій на периферичному рівні, зокрема через інші молекулярні цілі, які не асоціюються з психоактивністю. Проте цей фактор значно спрощує використання THCA-A в терапії, оскільки пацієнти можуть приймати препарати на її основі без ризику виникнення психічних розладів, а також без обмежень, пов’язаних з координацією рухів і мислення.
Фармакокінетичні дослідження демонструють, що при системному введенні THCA-A вона має обмежену здатність до накопичення у центральній нервовій системі, що додатково гарантує відсутність тривалих психоактивних ефектів навіть при багаторазовому застосуванні. Це є критично важливим для розробки безпечних лікарських форм, орієнтованих на лікування хронічних запальних, нейродегенеративних та онкологічних процесів.
Загалом, відсутність психоактивної дії є визначальною фармакологічною перевагою THCA-A, яка дозволяє розглядати її як безпечний біологічний агент для широкого кола медичних застосувань, де обмеження, пов’язані з психотропністю, є неприйнятними.
Вплив на ензимні системи, рецептори, запальні каскади
THCA-A виявляє комплексний вплив на низку ключових ензимних систем, рецепторів і запальних каскадів, що зумовлює її фармакологічний профіль поза межами класичної канабіноїдної системи. Однією з найзначущих мішеней є ферменти циклооксигенази (COX-1 та COX-2), які каталізують синтез простагландинів, медіаторів запалення і болю. THCA-A діє як інгібітор цих ферментів, що приводить до зниження продукції прозапальних простагландинів, ефективно пригнічуючи запальний процес на молекулярному рівні. Цей механізм збігається з фармакологією нестероїдних протизапальних препаратів, але THCA-A має потенціал бути більш селективним і менш токсичним.
Крім COX, THCA-A може впливати на систему ліпоксигеназ, що бере участь у метаболізмі арахідонової кислоти, а також на інші ферменти, пов’язані з окислювальним стресом і метаболізмом оксидативних сполук. Такі взаємодії сприяють антиоксидантній дії THCA-A, що є особливо актуальним для нейропротекції та запобігання дегенеративним змінам у тканинах.
Рецепторний профіль THCA-A включає активацію ядерних рецепторів типу PPARγ, які відіграють роль у регуляції імунної відповіді, метаболізму глюкози та диференціації клітин. Взаємодія з PPARγ забезпечує антіінфляторний і антипроліферативний ефекти, що мають важливе значення при терапії хронічних запальних та онкологічних захворювань. Унікальність цієї взаємодії полягає у можливості регулювати імунологічні процеси без прямої активації центральної нервової системи.
Додатково, THCA-A може модулювати іонні канали сімейства TRP, зокрема TRPV1, які беруть участь у передачі больових сигналів та запальних реакціях. Вплив на TRPV1 може сприяти аналгетичній дії і зниженню нейропатичного болю, що підтверджується експериментальними даними.
Крім того, THCA-A має потенціал впливати на інші G-білок зв’язані рецептори, зокрема GPR55, які беруть участь у регуляції запальних процесів та імунної відповіді. Взаємодія з цими рецепторами ще вивчається, але вона може відігравати значну роль у загальній фармакології THCA-A
Дослідження потенційних ефектів
Потенційні фармакологічні ефекти THCA-A стають предметом інтенсивного дослідження завдяки унікальній структурі цієї молекули, що дозволяє їй взаємодіяти з різноманітними біологічними мішенями без прояву психоактивності, характерної для Δ9-THC. Останні наукові дані підтверджують, що THCA-A може володіти нейропротекторними, протизапальними, а також антиеметичними і протипухлинними властивостями. Всі ці характеристики надають THCA-A значний терапевтичний потенціал і стимулюють подальші доклінічні та клінічні дослідження.
Нейропротекторна дія THCA-A пов’язана з її здатністю модулювати окислювальний стрес, запальні процеси в нервовій тканині, а також зберігати структурну цілісність нейронів. Дослідження на моделей нейродегенеративних захворювань показують, що THCA-A може захищати нервові клітини від апоптотичного стресу, знижуючи рівень вільних радикалів і активуючи антиоксидантні механізми. Крім того, молекула демонструє вплив на специфічні сигнальні шляхи, такі як MAPK та NF-kB, які регулюють експресію прозапальних генів і цитокінів у мозку, що є важливим для профілактики дегенеративних процесів.
Протизапальний потенціал THCA-A зумовлений здатністю пригнічувати активність ключових ферментів і молекул, що беруть участь у генерації і підтриманні запальної реакції. Особливо важливим є її вплив на циклооксигенази COX-1 та COX-2, що значно знижує синтез прозапальних простагландинів. Це дає змогу зменшити локальний і системний запальний процес, що є особливо актуальним для лікування аутоімунних захворювань, артритів, а також хронічних запальних станів. Крім того, THCA-A здатна модулювати активність лейкоцитів та макрофагів, пригнічуючи вироблення прозапальних цитокінів, що створює додатковий механізм протидії хронічному запаленню.
Антиеметичні та протипухлинні ефекти THCA-A досліджуються у доклінічних моделях і підтверджують широкий спектр її фармакологічної активності. THCA-A виявляє здатність пригнічувати проліферацію ракових клітин, зокрема в дослідах на культурах пухлинних клітин, таких як лімфоми, раку молочної залози і колоректального раку. Ці ефекти пов’язані з індукцією апоптозу, а також здатністю пригнічувати ключові сигнальні шляхи, що відповідають за ріст і метастазування пухлин. Антиеметичний потенціал THCA-A проявляється у здатності знижувати нудоту і блювання, що часто виникають при хіміотерапії, через вплив на рецептори, які регулюють центри блювоти в центральній нервовій системі.
Нейропротекторна дія
Нейропротекторні властивості THCA-A є одним із ключових напрямків наукових досліджень, пов’язаних з потенційним використанням цього канабіноїду у терапії нейродегенеративних захворювань. Молекулярний механізм дії THCA-A включає здатність знижувати рівень окислювального стресу, що є одним із фундаментальних факторів у розвитку хвороб типу Альцгеймера, Паркінсона та інших нейродегенерацій.
У доклінічних моделях THCA-A демонструє значне зниження продукції вільних радикалів і маркерів окисного пошкодження ліпідів і білків у тканинах мозку. Цей ефект пов’язаний з активацією ендогенної антиоксидантної системи, зокрема підвищенням активності ферментів супероксиддисмутази та каталази. Завдяки цьому THCA-A зменшує пошкодження клітинних мембран, стабілізує мітохондріальні функції і сприяє збереженню нейрональної життєздатності.
Крім антиоксидантної дії, THCA-A впливає на запальні процеси у мозку, пригнічуючи активність мікроглії – ключових імунних клітин центральної нервової системи, які при надмірній активації сприяють нейрональному пошкодженню. Вона знижує секрецію прозапальних цитокінів, таких як TNF-α та IL-1β, що допомагає контролювати запалення і попереджати подальше нейродегенеративне руйнування.
Також THCA-A модуляє сигнальні шляхи, пов’язані з апоптозом, включно з каспазним каскадом і регуляцією білків родини Bcl-2, що контролюють виживання нейронів. Ця дія сприяє захисту мозкових клітин від запрограмованої загибелі, що має велике значення при хронічних захворюваннях, пов’язаних з прогресивною втратою нейронів.
Вплив THCA-A на іонні канали TRPV1 у нервовій системі сприяє модуляції больової чутливості і регуляції нервової передачі, що може доповнювати її нейропротекторний ефект за рахунок зниження нейропатичного болю.
Протизапальний потенціал
Протизапальна активність THCA-A випливає з її здатності впливати на ключові молекулярні ланки запального процесу, що відрізняє її від багатьох інших канабіноїдів. Експериментальні дані показують, що THCA-A ефективно інгібує активність ферментів циклооксигенази COX-1 і COX-2, що призводить до зниження синтезу простагландинів – медіаторів, які відіграють центральну роль у розвитку запалення, болю і набряку.
Інгібування COX ферментів зумовлює не лише послаблення симптомів, а й уповільнення прогресування запального процесу на молекулярному рівні. При цьому THCA-A має більш селективний профіль дії порівняно з традиційними нестероїдними протизапальними препаратами, що потенційно знижує ризик побічних ефектів, таких як ушкодження шлунково-кишкового тракту.
Крім впливу на COX, THCA-A пригнічує продукцію прозапальних цитокінів, таких як інтерлейкіни IL-6 і IL-8, а також фактор некрозу пухлини TNF-α, що відбувається через модулювання транскрипційних факторів, зокрема NF-kB, які керують генетичною експресією запальних медіаторів. Це дозволяє THCA-A ефективно регулювати імунну відповідь та знижувати хронічне запалення, що часто є основою багатьох хронічних хвороб, включаючи аутоімунні захворювання.
Також THCA-A демонструє здатність зменшувати активність макрофагів та інфільтрацію запальних клітин у тканинах, що додатково сприяє регуляції запальних процесів і сприяє відновленню тканинної гомеостазії.
Антиеметичні та протипухлинні ефекти (дані доклінічних досліджень)
Антиеметичний ефект THCA-A підтверджується дослідженнями на моделях нудоти і блювання, які часто супроводжують онкологічну терапію. Цей канабіноїд діє через взаємодію з рецепторами центральної нервової системи, зокрема CB1, а також потенційно 5-HT3 серотоніновими рецепторами, що є важливими медіаторами контролю блювотного рефлексу. У доклінічних дослідженнях THCA-A знижує інтенсивність та частоту блювоти, що може значно покращити якість життя пацієнтів, які проходять хіміотерапію.
Потрібно відзначити, що THCA-A не проявляє психоактивності, що робить її більш безпечною альтернативою класичним канабіноїдам для контролю симптомів хіміотерапії.
Протипухлинні властивості THCA-A є одним із найбільш перспективних напрямків, що активно вивчаються у доклінічних експериментах. У культурах ракових клітин THCA-A показує здатність пригнічувати їх проліферацію, індукувати апоптоз і зупиняти клітинний цикл. Молекулярні механізми цих ефектів включають активацію каспаз, модуляцію сигнальних шляхів PI3K/Akt/mTOR і MAPK, що відіграють ключову роль у регуляції росту та виживання пухлинних клітин.
Дані також свідчать про те, що THCA-A може інгібувати ангіогенез – процес формування нових кровоносних судин, необхідних для росту пухлини і метастазування. Це досягається за рахунок зниження експресії факторів росту, таких як VEGF, що забезпечують судинний розвиток пухлин.
Окремі дослідження демонструють ефективність THCA-A щодо пухлин молочної залози, лімфоми, а також колоректального раку, що робить її перспективним агентом для комплексної онкологічної терапії, особливо в поєднанні з традиційними методами лікування.
Декарбоксилювання: переходи THCA-A у Δ9-THC
Декарбоксилювання THCA-A у Δ9-THC є ключовим хімічним процесом, що визначає перехід канабіноїдів із неактивної або слабоактивної кислотої форми у біологічно активну психоактивну форму. THCA-A (транс-каннабінолова кислота А) за своєю природою є прекурсором, який в рослині накопичується у вигляді кислоти. Вона не має помітної психоактивної дії через наявність карбоксильної групи, яка обмежує її здатність до взаємодії з канабіноїдними рецепторами, зокрема CB1, що відповідають за психоактивні ефекти. Процес декарбоксилювання включає втрату карбоксильної групи у вигляді вуглекислого газу (CO2), що відбувається під впливом тепла, часу та інших зовнішніх факторів. Цей хімічний перетворення є необхідним для активації THCA-A і утворення Δ9-THC, що істотно змінює фармакологічні властивості речовини.
Процес декарбоксилювання є природним, але може контролюватися за умовами приготування, зберігання та обробки канабісу. При нагріванні сирої рослинної маси канабісу чи концентратів, температура сприяє активації реакції розщеплення карбоксильної групи, що вивільняє CO2 і формує активний канабіноїд. Відсутність або недостатність нагріву зберігає THCA-A у кислотній формі, що зумовлює її фармакологічну специфіку.
Важливо підкреслити, що декарбоксилювання не є миттєвим і проходить через низку проміжних станів, де залежно від температурних і часових параметрів може відбуватися часткове або повне перетворення. Крім теплового фактора, на швидкість і ефективність декарбоксилювання впливають вологість, присутність каталізаторів, а також тип матеріалу, у якому проходить реакція.
З хімічної точки зору, декарбоксилювання – це проста реакція розкладу карбоксильної групи, але з біохімічної – це перетворення з радикальними наслідками для взаємодії з рецепторами ендоканабіноїдної системи. Після декарбоксилювання Δ9-THC набуває здатності ефективно зв’язуватися з рецепторами CB1, викликаючи типові психоактивні ефекти, що лежать в основі рекреаційного і терапевтичного використання канабісу.
Розуміння і контроль процесу декарбоксилювання є критично важливими для фармацевтичної індустрії та медичного застосування канабіноїдів. Від цього залежить як ступінь активації активних сполук, так і профіль фармакодинамічних властивостей препаратів, що створюються на основі канабісу. Деякі терапевтичні підходи свідомо уникають декарбоксилювання для збереження специфічних ефектів THCA-A, тоді як інші навпаки прагнуть максимальної конверсії в Δ9-THC.
Декарбоксилювання також впливає на стабільність та термін зберігання канабіноїдних продуктів, адже THCA-A є відносно більш стабільною сполукою в порівнянні з Δ9-THC, який є більш чутливим до окиснення і розпаду при тривалому зберіганні. Тому в умовах виробництва, зберігання та транспортування канабіноїдів необхідно ретельно регулювати параметри, щоб уникнути небажаної деструкції або втрати активності.
Механізм і кінетика реакції
Декарбоксилювання THCA-A є хімічною реакцією, яка супроводжується відщепленням молекули вуглекислого газу (CO₂) від карбоксильної групи, прикріпленої до основного канабіноїдного скелету. Цей процес відбувається за рахунок термічного впливу, що надає молекулі необхідну енергію для переходу до активної форми – Δ9-тетрагідроканабінолу (Δ9-THC). Реакція відноситься до класу термодеструктивних реакцій, які не потребують участі води або додаткових реагентів, але є залежними від температурного режиму, часу експозиції, типу середовища та агрегатного стану самої сполуки. У випадку THCA-A відбувається розрив ковалентного зв’язку між карбоксильною групою (-COOH) та рештою молекули, з утворенням вуглекислого газу та перехідної форми молекули, яка майже миттєво стабілізується у структурі Δ9-THC.
На молекулярному рівні механізм включає утворення перехідного стану з перегрупуванням електронної густини, що спричиняє втрату CO₂. Цей процес є ендергонічним на першому етапі, що означає потребу в поглинанні енергії, але після досягнення перехідного стану реакція стає термодинамічно сприятливою. Кінетика реакції є складною, оскільки швидкість залежить не лише від абсолютної температури, але й від фізико-хімічних властивостей середовища: вологості, тиску, наявності інших компонентів у матриці, а також від морфології зразка (подрібнення, густина, ступінь дисперсності). Важливо зазначити, що декарбоксилювання в реальному середовищі є частиною ширшого комплексу деградаційних процесів, тому його аналіз потребує ізоляції реакції в експериментальних умовах.
Фармакологічна релевантність цієї реакції полягає в тому, що саме Δ9-THC виявляє повноцінну активність до CB1-рецепторів центральної нервової системи, тоді як THCA-A є антагоністично нейтральним у цьому контексті. Саме тому ефективне декарбоксилювання є необхідною умовою для приготування лікарських форм з психоактивними або центрально діючими ефектами. Додатково, продукти часткового або неповного декарбоксилювання можуть мати власну біоактивність, що вимагає окремого вивчення, адже утворення проміжних сполук здатне впливати на спектр дії кінцевого препарату.
Температурна та часові залежності
Температурна залежність декарбоксилювання THCA-A відображає класичні закономірності термохімічних реакцій, підпорядкованих правилу Арреніуса. Підвищення температури сприяє прискоренню реакції через збільшення середньої кінетичної енергії молекул та частоти ефективних зіткнень. Дослідження показують, що декарбоксилювання THCA-A починається при температурах вище 90-100°C, тоді як оптимальний діапазон для повного перетворення лежить між 110°C і 145°C. У цьому діапазоні реакція відбувається з максимальною ефективністю без суттєвого ризику термічної деградації утвореного Δ9-THC. Поза цими межами – як при надто низьких, так і надто високих температурах – відбуваються побічні явища: неповне перетворення, ізомеризація Δ9-THC у Δ8-THC або деградація у CBN.
Часовий аспект також критично важливий. Для низькотемпературного декарбоксилювання необхідні довші періоди, іноді до 60-90 хвилин, тоді як при вищих температурах (понад 130°C) реакція завершується за 20-30 хвилин. Однак скорочення тривалості при високих температурах супроводжується ризиком утворення продуктів окислення, особливо за умов наявності кисню або вологи. У цьому контексті забезпечення анаеробного середовища та контроль вологості стають критичними технологічними параметрами, особливо при підготовці екстрактів для медичного використання.
Наявність води чи інших летких компонентів може змінити температуру кипіння системи і таким чином вплинути на локальну температуру самої молекули. Вміст вологи в сирій рослинній масі здатен відтермінувати початок реакції або викликати нерівномірне декарбоксилювання. Саме тому, в аналітичній практиці та промисловому виробництві застосовують попереднє висушування зразка або контроль вологості через вакуумні сушарки. Відомо також, що різні матриці – ефірні олії, ліпіди, терпенові профілі – мають свій теплопровідний потенціал, що змінює локальні умови реакції і потребує корекції температурного режиму в кожному окремому випадку.
Залежність між температурою, часом і стабільністю кінцевого продукту є нелінійною, і для досягнення оптимального результату часто використовують математичне моделювання кінетики реакції. Такі моделі дозволяють передбачити поведінку системи при заданих параметрах і адаптувати їх до конкретної технології – сушіння, випікання, екстракції, або синтезу концентратів. Визначення часової константи реакції в межах конкретного температурного діапазону дає змогу точного контролю і мінімізації побічних процесів.
Каталіз та зовнішні чинники
Хоча реакція декарбоксилювання THCA-A традиційно вважається термічно індукованою, певні зовнішні чинники можуть виступати як каталізатори або модифікатори реакційної кінетики. Найочевиднішими серед них є світло, кисень, волога, а також присутність кислотно-основних домішок, які можуть знижувати енергію активації або змінювати маршрут реакції. Зокрема, експозиція до ультрафіолетового або видимого світла призводить до передчасного або нерівномірного декарбоксилювання, особливо у зразках, що зберігаються у прозорій тарі. Світло викликає фотохімічне збудження, яке здатне запускати реакції деградації ще до настання температурного впливу, знижуючи вихід Δ9-THC та прискорюючи утворення окиснених побічних продуктів.
Кисень у присутності світла або високої температури діє як потужний окисник, що не лише стимулює декарбоксилювання, а й призводить до подальшої деградації Δ9-THC до CBN, що є небажаним у більшості випадків. З огляду на це, процеси декарбоксилювання зазвичай проводяться в інертній атмосфері – азоту або аргону – або в умовах вакууму. Це дозволяє не тільки підвищити ефективність перетворення, але й зберегти стабільність утвореного Δ9-THC.
Каталіз кислотно-основного типу потенційно можливий у присутності домішок, таких як мінеральні кислоти або луги, що можуть залишатися у матеріалі після екстракції. В таких умовах декарбоксилювання може проходити за альтернативними механізмами, з утворенням побічних продуктів, або навіть змінюватися стереохімія молекули. Також встановлено, що присутність іонів металів, особливо Fe³⁺, Cu²⁺ та інших перехідних елементів, може каталізувати реакцію через координацію до карбоксильної групи, знижуючи бар’єр активації.
Крім того, сама структура матриці впливає на ефективність теплопередачі. Наприклад, при використанні рослинного матеріалу, що містить ліпіди, терпенові компоненти або залишки целюлози, теплопровідність є нерівномірною. Це створює температурні градієнти, що локально прискорюють або затримують реакцію. З огляду на це, сучасні технології декарбоксилювання передбачають використання гомогенізованих матриць, стандартизованих за вологістю, вмістом органічних домішок та розміром частинок.
Біохімічні наслідки декарбоксилювання
Після декарбоксилювання тетрагідроканабінолової кислоти A (THCA-A) до нейтральної форми Δ9-тетрагідроканабінолу (Δ9-THC) відбувається суттєва трансформація фармакологічного та рецепторного профілю молекули. Цей процес полягає у втраті карбоксильної групи з формуванням нового просторового електронного розподілу в молекулі, що кардинально змінює її біохімічну активність. THCA-A у природному стані не зв’язується ефективно з рецептором CB1, що обумовлює його непсихоактивність. Натомість Δ9-THC є потужним агоністом CB1-рецепторів, що пояснює основну психоактивність канабісу після нагрівання. Окрім взаємодії з канабіноїдними рецепторами, декарбоксильована форма демонструє також змінений профіль взаємодії з іншими молекулярними мішенями – зокрема, трансмембранними іонними каналами та ферментативними комплексами, такими як COX-2 або FAAH. Ці зміни мають глибокі біохімічні та фізіологічні наслідки, що впливають на спектр дії Δ9-THC в організмі.
Зміна рецепторного профілю
Рецепторний профіль THCA-A значною мірою обмежений його структурною полярністю, пов’язаною з наявністю вільної карбоксильної групи, яка знижує здатність молекули проникати крізь гідрофобну мембрану клітин. Відповідно, навіть у випадку наявності теоретичної афінності до CB1 або CB2 рецепторів, реальна біодоступність THCA-A у центральній нервовій системі обмежена. Це суттєво контрастує з Δ9-THC, який унаслідок декарбоксилювання набуває ліпофільних властивостей, що забезпечують вільне проникнення через гематоенцефалічний бар’єр і безпосередню активацію CB1-рецепторів у ЦНС. Ці рецептори є Gi/o-зв’язаними GPCR, експресованими у високій щільності в гіпокампі, базальних гангліях, мозочку та префронтальній корі – структурах, що відповідають за пам’ять, моторику, емоції та сприйняття. Взаємодія Δ9-THC з CB1 викликає каскад внутрішньоклітинних подій, зокрема зменшення рівня цАМФ, інгібування кальцієвих каналів та активацію GIRK-каналів, що призводить до нейромодуляції.
THCA-A, хоча і демонструє певну афінність до CB2-рецепторів, не активує їх у тій мірі, що спостерігається при дії Δ9-THC або інших канабіноїдів. Деякі дані вказують на можливу алостеричну модуляцію CB1-рецепторів THCA-A, однак ці ефекти залишаються слабкими та скороминущими. Поза канабіноїдними рецепторами, THCA-A має активність щодо деяких TRP-каналів, особливо TRPM8 і TRPV1, що потенційно пояснює його слабку протизапальну дію. Але після декарбоксилювання молекула Δ9-THC набуває додаткової активності щодо широкого спектра мішеней: PPARγ, GPR55, а також інгібіторів ацілгідролаз жирних кислот, що забезпечує глибший вплив на нейроендокринну та імунну системи.
Поява психоактивності
Ключовим наслідком декарбоксилювання THCA-A є перехід до стану, у якому молекула здатна викликати зміну психоемоційного стану людини. В основі цього лежить утворення Δ9-THC – речовини з високою афінністю до CB1-рецепторів у головному мозку. Саме ця властивість забезпечує психоактивність – здатність впливати на когнітивні, сенсорні та афективні процеси. Активований CB1-рецептор змінює вивільнення нейромедіаторів, таких як глутамат, ГАМК, дофамін, серотонін, що обумовлює характерні ефекти Δ9-THC: ейфорію, зміни у сприйнятті часу та простору, зниження тривожності або навпаки – її посилення, залежно від індивідуальної нейрофізіології.
Психоактивність не з’являється поступово – вона є наслідком досягнення певного фармакологічного порогу концентрації Δ9-THC у ЦНС. Цей поріг залежить від шляху введення, ступеня декарбоксилювання і ступеня метаболізації першого проходження. У випадку інгаляцій Δ9-THC надходить до мозку практично негайно, у той час як при пероральному споживанні – після трансформації в 11-гідрокси-THC, що має ще вищу психоактивність. THCA-A не здатна пройти ці шляхи, оскільки не проходить крізь гематоенцефалічний бар’єр у достатніх концентраціях і не активує CB1.
У контексті клінічної фармакології, поява психоактивності – критичний параметр, що визначає терапевтичне вікно, дозування, режим введення та популяційні обмеження для пацієнтів. Декарбоксилювання, хоч і необхідне для активації канабіноїда як нейротропної субстанції, створює значні ризики побічних ефектів, особливо при довготривалому або неконтрольованому вживанні. Психоактивність Δ9-THC є однією з головних причин розвитку толерантності, залежності, а також короткочасних когнітивних порушень. Навпаки, THCA-A не асоціюється з жодним з цих ризиків, що робить його перспективним для створення непсихоактивних терапевтичних засобів.
На нейрофізіологічному рівні психоактивність Δ9-THC виявляється в модуляції активності γ-ритмів у корі головного мозку, змінах локальної синхронізації нейронної активності та порушенні стандартного балансу між збудливими та гальмівними сигналами. Це пояснює появу зміненого сприйняття, творчої активності, а також можливого транзиторного параноїдального мислення. Натомість THCA-A не викликає жодної з цих реакцій, що підтверджено як клінічними спостереженнями, так і фМРТ-даними.
Актуальні та перспективні напрями застосування THCA-A
Незважаючи на обмежену біодоступність та інертність у психоактивному сенсі, THCA-A набуває дедалі більшого інтересу з боку медичної, фармакологічної, аналітичної та біотехнологічної спільнот. Його цінність не обмежується статусом попередника Δ9-THC, а розгортається у низці унікальних функціональних застосувань, де збереження кислотної форми не лише бажане, а й необхідне. Вивчення THCA-A відбувається в контексті пошуку ефективних, але безпечніших для пацієнтів фітокомпонентів, здатних виконувати специфічні функції без характерних для нейтралізованих канабіноїдів ефектів. Його потенціал охоплює сфери фундаментальної науки, клінічної фармакології, контролю якості рослинної сировини, і навіть біотехнологій, орієнтованих на генетичну модифікацію ферментативних систем.
Одним з основних векторів інтересу до THCA-A залишається його природна форма, яка на відміну від Δ9-THC не взаємодіє з канабіноїдними рецепторами CB1 з високим афінітетом. Це відкриває можливість цілеспрямованої терапії без супутніх психоактивних ефектів. У цьому контексті зростає роль THCA-A як дослідницького інструменту для розділення ефектів, пов’язаних із CB1-активацією, від інших, можливо, периферичних або неканабіноїдних механізмів дії.
Поряд із медичними аспектами, THCA-A дедалі активніше розглядається як маркер біогенетичного статусу канабісу. Його стабільна присутність у неекстрагованій рослинній масі до моменту термічної обробки є основою для створення систем контролю якості, автентичності штамів, фітосанітарного моніторингу. В аналітичній хімії THCA-A виступає не лише об’єктом кількісного визначення, а й індикатором умов зберігання, транспортування та екстракції канабісу.
Біотехнологічні напрями досліджень також демонструють зростання інтересу до ферменту THCA-синтази, що каталізує останній крок у біосинтезі THCA-A. Оскільки цей фермент має чітко визначену специфічність до CBGA, його модифікація може дозволити регулювання співвідношення кислотних форм канабіноїдів у рослинній біомасі. Це відкриває шлях до створення канабісу нового покоління – штамів, орієнтованих на медичні потреби без ризику конверсії до Δ9-THC навіть під впливом температури.
Крім того, THCA-A поступово інтегрується у комплексну концепцію фітотерапевтичної стандартизації. Його включають у протоколи фітоконтролю, зокрема при оцінці “живих екстрактів” (live extracts), які зберігають повний кислотний профіль. Ці екстракти вважаються перспективними через збереження первинного хімічного складу без термічного розщеплення, що важливо при розробці продуктів для мікродозованої або місцевої терапії.
Медицина
THCA-A, як кислотна попередниця Δ9-тетрагідроканабінолу, демонструє унікальні властивості, що виокремлюють її серед інших канабіноїдів і роблять надзвичайно перспективною для медичних досліджень і терапевтичного застосування. На відміну від свого декарбоксильованого аналога, THCA-A не взаємодіє з канабіноїдними рецепторами CB1 у центральній нервовій системі в такий спосіб, що спричиняв би психоактивний ефект. Це відразу ставить його в особливе становище: він зберігає біологічну активність, потенційно корисну для лікування хронічних і системних захворювань, залишаючись при цьому позбавленим негативного впливу на когнітивні функції чи психоемоційний стан.
Цей профіль є особливо привабливим для клінічної фармакології, яка все більше фокусується на пошуку сполук з максимальною терапевтичною селективністю та мінімізацією побічних ефектів. THCA-A не проникає через гематоенцефалічний бар’єр у значущих кількостях, уникаючи взаємодії з нейрональними CB1-рецепторами, однак демонструє активність через інші молекулярні мішені, включно з PPARγ, TRP-каналами і потенційно – GPR55, що забезпечує вплив на запальні, імунні, обмінні та нейродегенеративні процеси без центрального психотропного ефекту.
Проблема психоактивності Δ9-THC в умовах тривалого лікування є фундаментальною у сучасній медичній канабіноїдній терапії. Саме тому THCA-A розглядається як стратегічно важливий кандидат на роль молекули для безпечного, довготривалого використання у терапевтичній практиці, де контроль за свідомістю, психічною стабільністю та працездатністю пацієнта має критичне значення. Особливої уваги заслуговує застосування THCA-A у педіатричній неврології, геріатрії та в умовах хронічного аутоімунного запалення, де мінімізація психоактивних ефектів є безкомпромісною вимогою.
Ревматологічні стани, включно з ревматоїдним артритом та системним червоним вовчаком, демонструють імунозапальну природу, де ключовими механізмами є гіперактивація макрофагів, продукція прозапальних цитокінів і патологічне ремоделювання тканин. THCA-A впливає на ці процеси, модуляючи активність циклооксигенази-2 (COX-2), інгібуючи продукцію TNF-α та IL-6, а також проявляючи антиоксидантні властивості. Ці дії не лише зменшують інтенсивність запалення, а й уповільнюють його хронізацію, що особливо важливо в терапії хронічних запальних захворювань сполучної тканини.
Крім імуномодулюючих властивостей, THCA-A демонструє високий потенціал для неврологічної фармакології. Його нейропротекторна дія опосередкована, зокрема, через активацію ядерного рецептора PPARγ, що має здатність пригнічувати нейрозапалення, підтримувати мітохондріальну функцію та запобігати оксидативному стресу. Це відкриває перспективи використання THCA-A у лікуванні таких патологій, як хвороба Альцгеймера, Паркінсона, аміотрофічний латеральний склероз, а також посттравматичні ушкодження головного мозку. Важливо, що ця нейропротекція не супроводжується зниженням когнітивної продуктивності, зміненою мотивацією чи дезорганізацією свідомості – що характерно для Δ9-THC.
У багатьох неврологічних станах, зокрема епілепсії, розсіяного склерозу, хронічному болю центрального походження, застосування THCA-A потенційно може зменшити частоту загострень, інтенсивність симптоматики та потребу у комбінаціях з системними імуносупресорами чи наркотичними аналгетиками. У клінічних протоколах, де канабіноїди вже інтегровані в паліативну чи підтримувальну терапію, заміщення Δ9-THC на THCA-A може поліпшити переносимість лікування, особливо в уразливих групах населення.
Окрему увагу слід приділити можливості використання THCA-A в умовах онкологічних захворювань як компоненту підтримувальної терапії. Хоча його протипухлинний потенціал потребує подальшої верифікації, вже зараз відомо про здатність цієї молекули знижувати нудоту, спричинену хіміотерапією, покращувати апетит і водночас не викликати залежності чи когнітивного притуплення. Це критично важливо для пацієнтів, які отримують агресивне лікування та повинні залишатися ментально активними протягом тривалого періоду.
Пошук не-психоактивних альтернатив Δ9-THC
Проблема психоактивності Δ9-THC залишається одним із головних бар’єрів для його повноцінної інтеграції у фармакотерапію. Незважаючи на доведений анальгетичний, анксіолітичний, протизапальний і нейропротекторний потенціал, його здатність змінювати когнітивні функції, викликати залежність і толерантність суттєво обмежує застосування в амбулаторних умовах, особливо серед уразливих категорій – дітей, літніх осіб, пацієнтів із психічними порушеннями. У цьому контексті активізувався пошук не-психоактивних молекул з аналогічною або близькою біологічною активністю, але без впливу на центральну нервову систему через CB1-рецептори. Одним із найперспективніших кандидатів у цьому напрямі є THCA-A – кислотна форма Δ9-THC, яка не проходить крізь гематоенцефалічний бар’єр у значущих концентраціях і не зв’язується з CB1-акцептором у функціонально релевантний спосіб.
THCA-A не викликає ейфорії, не порушує концентрацію, не спричиняє змін у сприйнятті простору, часу чи себе – основних ознак психоактивності Δ9-THC. Водночас він демонструє широкий спектр біологічної активності, зокрема протизапальну, антиоксидантну, спазмолітичну та нейропротекторну дію. Це дозволяє розглядати його як безпечну альтернативу при станах, де використання Δ9-THC є недоцільним через ризик когнітивного чи психоемоційного впливу. Потенціал THCA-A особливо цінний у контексті терапії хронічного болю, аутоімунних патологій, функціональних неврозів та синдромів м’язової ригідності – де бажане збереження ментальної ясності без зниження ефективності знеболення чи імуносупресії.
На рівні фармакодинаміки THCA-A демонструє взаємодію з низкою неканабіноїдних мішеней, серед яких домінують PPARγ, деякі TRP-канали (особливо TRPA1, TRPM8), а також потенційно – GPR55. Ці мішені мають відношення до регуляції запалення, апоптозу, окисного стресу, мітохондріальної динаміки та гліальної реактивності. У той час як Δ9-THC реалізує свою активність переважно через CB1 і CB2-рецептори, THCA-A діє поза цією віссю, що дозволяє йому мати відмінний спектр ефектів при збереженні базової схожості в антиноцицептивному й нейрозахисному потенціалі. Це створює унікальну ситуацію, коли структурна подібність двох сполук не передбачає тотожності механізмів дії, але забезпечує терапевтичну надбудову без побічних ефектів психотропного порядку.
Клінічні пріоритети також диктують потребу в препаратах з довготривалою безпекою. Декарбоксильований Δ9-THC викликає розвиток толерантності, синдрому відміни й може погіршувати пам’ять, увагу, викликати тривожні розлади або провокувати латентні психози. У випадку THCA-A ці ризики відсутні навіть при тривалому застосуванні, що дозволяє формувати нові фармакотерапевтичні схеми, розраховані на місяці чи роки без втрати клінічної ефективності або когнітивного навантаження на пацієнта. Водночас THCA-A не накопичується в нервовій тканині, не порушує дофамінового гомеостазу й не бере участі в нейрональній пластичності CB1-залежного типу, що забезпечує його фармакологічну інертність у плані формування залежності.
Терапевтичний потенціал у неврології та ревматології
Неврологічні й ревматологічні захворювання часто поєднують низку патогенетичних механізмів, серед яких домінують хронічне запалення, активація глії, оксидативний стрес, а також порушення клітинної енергетики та мітохондріального гомеостазу. У таких станах традиційна фармакотерапія зазвичай базується на поліпрагмазії – поєднанні протизапальних, нейромодулюючих, імуносупресивних і знеболювальних препаратів, що підвищує ризик токсичних ефектів. У цьому контексті THCA-A є перспективною молекулою, здатною одночасно впливати на кілька ключових патофізіологічних ланок без необхідності залучення великої кількості фармакологічних агентів.
У нейродегенеративних хворобах, зокрема хворобі Альцгеймера, THCA-A демонструє здатність зменшувати гліальну активацію та секрецію прозапальних цитокінів, що сповільнює дегенерацію нейронів і захищає синаптичну пластичність. Механізми дії пов’язані з індукцією антиоксидантних ферментів, зменшенням продукції оксиду азоту, нормалізацією кальцієвого гомеостазу в нейронах і пригніченням експресії IL-1β та TNF-α у мікроглії. У хворобі Паркінсона додатковим фактором дії є покращення мітохондріального метаболізму та зменшення утворення активних форм кисню, що знижує рівень нейронального апоптозу в нігростріарному комплексі.
У пацієнтів із розсіяним склерозом THCA-A може зменшувати інтенсивність запальних вогнищ у центральній нервовій системі, не викликаючи седативного чи психоактивного ефекту. Це забезпечує його придатність для денного прийому в амбулаторних умовах, що принципово важливо при підтримуючій терапії. Аналогічно, у епілептології, особливо дитячій, THCA-A показує протисудомну дію через механізми, не пов’язані з CB1-рецепторною інгібіцією, а отже – без супутніх змін у настрої, увазі або сні.
У ревматології ключовими ефектами THCA-A є зниження продукції прозапальних медіаторів у синовіальній тканині, гальмування міграції нейтрофілів та пригнічення ферментативної активності COX-2 без ризику шлункової токсичності. Цей ефект особливо корисний у ревматоїдному артриті, де запалення має системний характер. THCA-A здатен модулювати імунну відповідь без глибокого пригнічення клітинного імунітету, що відрізняє його від стероїдних і нестероїдних протизапальних засобів.
Системні захворювання сполучної тканини, включно з системним червоним вовчаком, часто супроводжуються хронічною активацією інтерферонової відповіді й порушенням балансу між Т-хелперами та регуляторними Т-клітинами. THCA-A впливає на цю вісь, зменшуючи активність прозапальних ліній, не впливаючи на загальну імунокомпетентність, що важливо для уникнення вторинних інфекцій. Крім того, його антиоксидантна активність зменшує ризик ушкодження судинного ендотелію – одного з ключових механізмів органного ураження при системних васкулітах.
Аналітична хімія та фітоконтроль
Аналітична хімія в контексті канабіноїдів – це фундаментальна галузь, яка забезпечує точну ідентифікацію, кількісний аналіз та стандартизацію складних композицій рослинного матеріалу. THCA-A, як найбільш поширена канабіноїдна кислота у сирому канабісі, виступає не просто як одна з багатьох компонентів, а як ключовий маркер, що відображає біохімічний стан рослини до стадії екстракції або термічної обробки. Саме його присутність і концентрація стають основою для якісного контролю, розмежування штамів, а також визначення умов збирання та зберігання рослинної сировини. Точне вимірювання THCA-A дозволяє створювати уніфіковані протоколи контролю фітоматеріалу, що є надзвичайно важливим для фармацевтичної та медичної промисловості, де кожен грам сировини повинен відповідати встановленим стандартам.
Визначення THCA-A здійснюється за допомогою сучасних методів хроматографії, включно з ВЕРХ, ГХ-МС, а також спектрометрії з високою роздільною здатністю. Застосування цих методів забезпечує не лише точність аналізу, але й дозволяє відрізнити THCA-A від декарбоксильованих форм, таких як Δ9-THC, що критично важливо через різницю у фармакологічних властивостях і законодавчому регулюванні. Ці аналітичні методики дозволяють встановити час збирання ідеальної сировини, коли вміст THCA-A максимальний, а трансформація у психоактивний THC мінімальна. Такий контроль сприяє не тільки ефективнішому вирощуванню та зберіганню, але й дає змогу відмовитися від суб’єктивних оцінок якості на користь об’єктивних кількісних показників.
Під час аналітичного процесу критичною є не лише сама кількісна характеристика THCA-A, а й її співвідношення з іншими канабіноїдами та терпенами, що формує унікальний “фітохімічний відбиток” конкретного штаму. Ця складова дає змогу класифікувати та диференціювати штами канабісу з високою точністю, що унеможливлює підміни або несанкціоноване розширення асортименту. Таким чином, THCA-A виконує функцію біомаркера, який є базисом для створення глобальних бібліотек профілів канабіноїдів із високим ступенем відтворюваності.
Інновації у сфері аналітичної хімії також спрямовані на розробку швидких і недорогих методів визначення THCA-A у польових умовах, що відкриває нові горизонти для контролю якості у виробничих і лабораторних процесах. Поява портативних пристроїв, заснованих на спектроскопії, та біосенсорів, чутливих до кислотної форми THC, здатні змінити традиційний підхід до фітоконтролю, знизити витрати і підвищити оперативність прийняття рішень. Це особливо актуально для легалізованих ринків, де точний облік активних речовин – питання законодавчої відповідальності і безпеки кінцевого споживача.
Інтеграція аналітичних даних з біоінформатикою і системним аналізом відкриває перспективи для глибокого вивчення динаміки біосинтезу THCA-A в межах окремих клітинних і тканинних структур рослини, що може призвести до генетичного вдосконалення штамів із заданими фармакологічними властивостями. Цей напрям має великий потенціал для розвитку індивідуалізованих фітопрепаратів із точним дозуванням і прогнозованою ефективністю.
Біомаркер сирого канабісу
Визначення THCA-A як біомаркера сирого канабісу базується на його унікальній властивості бути домінуючою канабіноїдною кислотою у первинній сировині до початку термічної обробки. Це відрізняє його від більшості інших канабіноїдів, які здебільшого присутні в декарбоксильованій формі у висушеному чи обробленому продукті. THCA-A, будучи попередником Δ9-THC, відображає метаболічний стан рослини у момент збору, що робить його безперечним маркером свіжості і ступеня біохімічної зрілості матеріалу. Відсутність або значне зниження рівня THCA-A свідчить про початок або завершення процесів деградації та декарбоксилювання, що впливає на якість і фармакологічний профіль кінцевого продукту.
Використання THCA-A як біомаркера є принципово важливим у сировинній базі для фармацевтичних препаратів, де суворий контроль складу і стабільності є визначальним фактором. Контроль концентрації THCA-A дає змогу оцінити не лише якість збору, а й вплив умов зберігання, включаючи температуру, вологість і тривалість експозиції. При цьому навіть незначні зміни у концентрації THCA-A можуть сигналізувати про небезпечні для цілісності канабіноїдного профілю процеси, що можуть знизити ефективність або безпеку продукту.
Крім того, THCA-A дозволяє відрізняти сирий канабіс від кондитерських чи екстрактних продуктів, що пройшли теплову обробку, де рівень кислоти практично відсутній. Такий біомаркерний підхід значно спрощує процедури кваліфікації ідентичності матеріалу, запобігаючи фальсифікаціям і зловживанням у комерційній діяльності.
Дослідження свіжості сировини на основі THCA-A також відкривають можливості для контролю біологічної активності та передбачення терапевтичного профілю продуктів. Високий вміст THCA-A корелює з оптимальним спектром активності, особливо у випадку застосування канабісу для лікування запальних і нейродегенеративних станів, що дозволяє прогнозувати результативність терапії ще на етапі сировини.
В умовах масового вирощування канабісу, де агротехнічні умови, добрива, освітлення і час збору варіюються, THCA-A стає незамінним індикатором для стандартизації сировини і уникнення варіабельності у фармакологічних властивостях кінцевого продукту. Завдяки цьому знижується ризик непередбачуваних клінічних результатів і підвищується довіра до препаратів на основі канабісу.
Контроль якості та відповідність штамів
Точне визначення складу канабіноїдів, у першу чергу THCA-A, виступає фундаментом для контролю якості, що в умовах індустріалізації вирощування канабісу має критичне значення. Контроль якості ґрунтується не лише на кількісному аналізі, а й на повній ідентифікації хімічного профілю, який включає співвідношення канабіноїдів, терпеноїдів і флавоноїдів. У цьому контексті THCA-A є ключовим маркером, що визначає, чи відповідає продукт заявленому штаму і профілю.
Штам канабісу – це комплекс генетичних та фенотипічних характеристик, які проявляються через фітохімічний профіль. Наявність і кількість THCA-A, у поєднанні з іншими компонентами, створюють своєрідний “хімічний паспорт”, який використовується для верифікації та класифікації рослин. Ця інформація дозволяє уникнути плутанини у комерційних поставках, а також гарантує відповідність між очікуваними і фактичними фармакологічними ефектами, особливо в медичній сфері.
Впровадження стандартів контролю на основі THCA-A забезпечує виявлення підробок і фальсифікацій, які можуть мати місце у тіньових ринках. Визначення співвідношення кислоти і декарбоксильованих форм допомагає ідентифікувати зберігання і транспортування, що порушують технологічний ланцюг, а також використовувати “хімічні відбитки” для відстеження походження продукту. Це дає можливість розробити системи прослідковуваності та сертифікації якості, необхідні для легалізованих ринків.
У сучасних виробництвах контроль якості стає багаторівневим процесом, де THCA-A вимірюється у декілька етапів – від культивації до кінцевого продукту. Такі стандарти забезпечують стабільність і передбачуваність ефектів, що є основою для формування довіри з боку медичних працівників і пацієнтів. Без цього контрольного механізму важко гарантувати відповідність фармакологічних властивостей продуктів заявленим вимогам.
Біотехнології
Сучасні біотехнологічні підходи до канабісу, зокрема до метаболізму та синтезу THCA-A, відкривають нові горизонти в удосконаленні продуктивності рослини, контролі якості сировини та створенні спеціалізованих фармакологічних продуктів. Біотехнологія дозволяє не лише глибше зрозуміти молекулярні механізми ферментативного синтезу канабіноїдів, але й кардинально змінити спосіб вирощування і підготовки рослин, спрямовуючи їхній метаболізм у потрібне русло. У цьому контексті ключове значення має інженерія ферментів THCA-синтази – основного каталізатора, що трансформує прекурсори в активну канабіноїдну кислоту, а також розробка генетично модифікованих штамів, здатних накопичувати високі рівні THCA-A з мінімальним або відсутнім утворенням Δ9-THC. Ці напрями не просто підвищують ефективність виробництва, а створюють передумови для більш безпечного, керованого і стандартизованого застосування канабіноїдів у фармації та медицині.
Інженерія ферментів THCA-синтази
Фермент THCA-синтаза, що каталізує реакцію перетворення канабігераолової кислоти (CBGA) у THCA, є центральним елементом біосинтетичного шляху канабіноїдів. Розуміння його структури, каталитичної механіки та регуляції дозволяє здійснювати цілеспрямовані втручання на молекулярному рівні, змінюючи активність, специфічність або стабільність ферменту. За допомогою методів генної інженерії, зокрема направленої еволюції, сайт-специфічного мутагенезу та рекомбінантної експресії, можливо отримати варіанти ферменту з підвищеною продуктивністю, меншою схильністю до деградації або зі зміненим субстратним спектром.
Однією з ключових цілей є підвищення ефективності синтезу THCA без збільшення утворення побічних продуктів або токсичних проміжних сполук. Інженерія THCA-синтази дозволяє оптимізувати її активний центр для більш ефективної взаємодії з CBGA, що призводить до прискорення реакції та підвищення виходу кінцевого продукту. Також увага приділяється стабілізації ферменту в умовах культивації, де фактори навколишнього середовища можуть впливати на його активність.
Важливою задачею є зміна регуляції експресії гена THCA-синтази, що дозволяє керувати кількістю ферменту у тканинах рослини. За допомогою промотерів із специфічною активністю у відповідних клітинних типах можна домогтися локалізації ферментативної активності у певних органах або фазах розвитку. Такий підхід відкриває можливість для більш тонкого контролю над синтезом THCA, зменшуючи втрати і забезпечуючи стабільність складу канабіноїдів.
Інженерія ферментів також передбачає розробку штучних біокаталізаторів, які можуть працювати в ізольованих системах, наприклад, у біореакторах, що відкриває перспективи масштабного виробництва THCA-A за межами рослинного організму. Цей підхід здатен значно знизити виробничі витрати, усунути залежність від агрокліматичних факторів і підвищити чистоту кінцевого продукту.
Додатково проводяться дослідження, спрямовані на розуміння взаємодії THCA-синтази з іншими ферментами у біосинтетичному шляху, що може дозволити створення комплексних ферментних систем із синергічною активністю. Це відкриває потенціал для маніпуляції метаболічними потоками у рослині, що дозволяє коригувати профіль канабіноїдів під конкретні терапевтичні задачі.
Інтеграція біоінформатичних підходів і машинного навчання в процес інженерії ферментів значно прискорює пошук оптимальних варіантів, дозволяючи моделювати структуру і функцію ферменту ще до проведення лабораторних експериментів. Це знижує час і вартість розробки нових біокаталізаторів, роблячи їх доступними для комерційних і наукових застосувань.
Вирощування канабісу зі збільшеним вмістом THCA-A без THC
Розробка штамів канабісу, здатних накопичувати значні кількості THCA-A при одночасному зниженні або повній відсутності психоактивного Δ9-THC, є одним з найважливіших напрямів у сучасній біотехнології рослин. Це дозволяє створювати безпечні для широкого застосування продукти з вираженим терапевтичним потенціалом, уникаючи юридичних і клінічних проблем, пов’язаних із психоактивністю.
Генетичний контроль синтезу Δ9-THC здійснюється на рівні експресії ферментів, відповідальних за декарбоксилювання і подальшу модифікацію THCA. Використання методів генної інженерії дозволяє селективно глушити або мутагенезувати гени, що кодують ключові ферменти у цьому шляху, зокрема THC-синтазу, яка трансформує THCA у Δ9-THC. При цьому фермент THCA-синтаза залишається активним, що забезпечує накопичення саме кислотої форми.
Методи редагування генома, такі як CRISPR/Cas9, відкривають безпрецедентні можливості для точного та ефективного впливу на окремі гени, що регулюють синтез психоактивних канабіноїдів. Це дозволяє створювати гібриди та мутанти із стабільною відсутністю THC навіть при збереженні високого рівня THCA-A, що є революційним кроком у виробництві фармакологічної сировини.
Також широко застосовуються селекційні підходи, засновані на фенотипічному і молекулярному скринінгу рослин із природно низьким рівнем THC. Поєднання традиційної селекції з молекулярним маркуванням дає змогу прискорити процес формування нових сортів із заданим хімічним профілем.
Удосконалення агротехнічних технологій, таких як контроль освітлення, температурного режиму, живлення та вологості, також суттєво впливає на баланс між THCA і THC. Біотехнології дозволяють інтегрувати ці фактори в комплексні моделі керування метаболізмом, забезпечуючи стабільність і повторюваність виробництва.
Вирощування таких “безпсихоактивних” штамів є критично важливим для розробки медичних препаратів, які можуть застосовуватися у пацієнтів із низьким порогом чутливості до психоактивних ефектів або у випадках, коли важливо уникнути когнітивних порушень. Крім того, це розширює ринок легальних продуктів, роблячи їх доступними у юрисдикціях з жорсткими обмеженнями на Δ9-THC.
Екологічний аспект також набуває значення: штами з високим вмістом THCA-A без THC можуть вирощуватися в умовах, що не потребують складного контролю і забезпечують стабільність виробництва без додаткових витрат на утилізацію психоактивних побічних продуктів.
Етичні та регуляторні аспекти
Розвиток використання THCA-A у медичних, наукових та промислових сферах стикається з низкою складних етичних та регуляторних викликів, пов’язаних з позиціонуванням цього канабіноїду в рамках правового поля, безпеки споживачів і суспільних норм. Відсутність психоактивності THCA-A створює потенціал для його застосування як безпечної альтернативи традиційним канабіноїдам, однак відсутність чітких нормативних визначень у багатьох юрисдикціях породжує неоднозначність у регулюванні обігу та контролю. Етична сторона полягає у збалансуванні інтересів пацієнтів і дослідників з правовими обмеженнями, які виникають через історичні, політичні та соціальні фактори, а також у забезпеченні прозорості, якості та безпеки продуктів із THCA-A. Визначення місця THCA-A у нормативно-правових документах і міжнародних угодах є ключовим для формування відповідної інфраструктури, яка підтримає безпечне впровадження цієї сполуки у фармацевтичну практику та наукові дослідження.
Роль THCA-A в нормативно-правових документах щодо канабісу
Враховуючи відсутність психоактивних властивостей, THCA-A не завжди чітко ідентифікується у нормативно-правових актах, які регламентують обіг канабіноїдів. Це призводить до неоднозначностей у класифікації та застосуванні таких продуктів. У більшості країн законодавство орієнтується на регуляцію Δ9-THC, як основного психоактивного компонента канабісу, залишаючи THCA-A у сірій зоні. Однак, оскільки THCA-A є попередником Δ9-THC, багато нормативів включають його під загальне визначення “канабіноїдів” без детального розмежування. Такий підхід створює складнощі для виробників і користувачів, особливо у випадках, коли продукти містять високий рівень THCA-A при майже відсутньому Δ9-THC.
Це породжує юридичну невизначеність, зокрема у питаннях легальності транспортування, зберігання та використання сировини з високим вмістом THCA-A. У країнах із жорстким контролем на психоактивні речовини, наявність THCA-A може призводити до затримань і конфіскації, навіть якщо психоактивних ефектів у речовини немає. Така ситуація підкреслює необхідність розробки специфічних критеріїв для ідентифікації та регулювання THCA-A, що враховують його фармакологічні властивості та потенціал.
Крім того, в нормативних документах поступово зростає увага до стандартів контролю якості та маркування продукції з THCA-A, що має забезпечити чітке інформування споживача про відсутність психоактивності і сприяти формуванню довіри до таких препаратів. Водночас регулятори стикаються з викликами у стандартизації аналітичних методів для точного визначення THCA-A у сировині та кінцевих продуктах, що є основою для законного обігу і наукових досліджень.
Інтеграція нових знань про THCA-A у нормативну базу вимагає узгодження з міжнародними конвенціями та національними законами, що є тривалим і складним процесом, але необхідним для подолання існуючих правових колізій і забезпечення розвитку інноваційних медичних продуктів на основі канабіноїдів.
Міжнародні підходи до класифікації
На міжнародному рівні класифікація і регулювання канабіноїдів, у тому числі THCA-A, є предметом багатосторонніх дискусій і неоднорідних підходів. Різні країни і міжнародні організації демонструють суттєві відмінності у трактуванні статусу THCA-A у порівнянні з Δ9-THC, що обумовлено історичними, культурними і політичними факторами, а також рівнем наукового розвитку і готовністю нормативних систем до інновацій.
У більшості міжнародних конвенцій, таких як Єдиний конвенційний акт ООН про наркотичні засоби 1961 року, основна увага приділяється психоактивним канабіноїдам, зокрема Δ9-THC, а THCA-A не виділяється як окрема субстанція, що створює законодавчі “білі плями”. Це ускладнює розробку узгоджених політик і сприяє регіональним розбіжностям у підходах до контролю та використання.
Деякі країни, особливо ті, які мають розвинені програми легалізації медичного канабісу, намагаються диференціювати THCA-A від Δ9-THC у національних законодавчих актах, що дозволяє гнучкіше регулювати обіг продукції, зокрема визначати порогові значення для вмісту психоактивних речовин і впроваджувати стандарти безпеки. Такий підхід забезпечує легальний доступ до препаратів на основі THCA-A і сприяє розвитку наукових досліджень.
Водночас у багатьох країнах регуляторні органи утримуються від такого поділу через побоювання нелегального використання або неможливість ефективного контролю за трансформацією THCA-A у Δ9-THC. Це відображається у заборонах або жорстких обмеженнях на всі продукти канабісу, незалежно від специфічного канабіноїдного профілю.
Міжнародні організації, такі як Всесвітня організація охорони здоров’я (ВООЗ), поступово включають оцінку немарих або неактивних канабіноїдів у свої рекомендації, проте це відбувається повільно і залежить від накопичення наукових даних. Рекомендації ВООЗ щодо делегалізації або пом’якшення регулювання Δ9-THC не завжди охоплюють THCA-A, що створює додаткову неоднозначність.
Висновок:
Delta-9-Tetrahydrocannabinol Acid A (THCA-A) є фундаментальною хімічною сполукою у біосинтетичному шляху канабіноїдів у рослині Cannabis sativa. Його статус як прекурсора психоактивного Δ9-THC визначає його ключове значення в канабісній хімії, фармакології та промисловості. Аналіз структури, хімічної природи та реакційних механізмів THCA-A виявляє складну природу цієї молекули, яка є водночас стабільною при низьких температурах та чутливою до термічних та часових впливів, що призводить до її декарбоксилювання і утворення Δ9-THC з властивостями, кардинально відмінними від початкової сполуки.
З хімічної точки зору THCA-A характеризується карбоксильною групою, яка обумовлює його кислотні властивості і надає сполуці унікальні фізико-хімічні характеристики, що мають значний вплив на її біологічну активність. Основний біохімічний процес, що визначає подальшу поведінку THCA-A, – це термічне декарбоксилювання, яке не лише модифікує молекулярну структуру, а й кардинально змінює фармакологічний профіль канабіноїду, трансформуючи його з неактивної або слабкоактивної форми у потужний психоактивний агент Δ9-THC.
Механізм декарбоксилювання вимагає детального вивчення через його складну кінетику та залежність від зовнішніх факторів, включно з температурою, часом нагріву, наявністю каталізаторів і умовами середовища. Температурна залежність реакції має експоненціальний характер із різким збільшенням швидкості при підвищенні температури, що пояснює необхідність ретельного контролю технологічних процесів, особливо при виробництві медичних та харчових продуктів на основі канабісу. Часовий фактор і каталізатори, включно з металевими і хімічними агентами, можуть модулювати процес, прискорюючи або гальмуючи перетворення, що є критично важливим для забезпечення стабільності та прогнозованості кінцевого продукту.
З фармакологічної точки зору THCA-A не має класичних психоактивних властивостей, характерних для Δ9-THC, через відсутність здатності ефективно зв’язуватись з канабіноїдними рецепторами CB1 у ЦНС. Натомість він виявляє значний потенціал у регуляції імунних відповідей, протизапальній дії, а також може модулювати інші біологічні системи, не викликаючи звичних побічних ефектів, притаманних Δ9-THC. Ця особливість створює перспективи для застосування THCA-A у якості безпечного терапевтичного агента, особливо у галузях, де психоактивність є небажаною або шкідливою.
Важливою складовою фармакологічного профілю THCA-A є зміни рецепторної взаємодії після декарбоксилювання, що веде до появи психоактивності та значного підвищення афінності до CB1-рецепторів. Це дозволяє розглядати THCA-A і Δ9-THC як два взаємопов’язані етапи одного біохімічного процесу з різними клінічними та соціальними наслідками. Поява психоактивності після перетворення диктує жорсткі вимоги до контролю процесів декарбоксилювання, особливо у медичному і комерційному секторах, де необхідно чітко відмежувати продукти з психоактивним ефектом від неактивних.
В аспекті аналітичної хімії THCA-A виступає важливим біомаркером сирого канабісу, що дозволяє ідентифікувати якість сировини, її походження та ступінь обробки. Методи точного визначення вмісту THCA-A є базою для контролю якості і відповідності штамів канабісу, що має безпосередній вплив на стандартизацію продукції та її законність. Визначення співвідношення THCA-A і Δ9-THC слугує ключовим показником технологічного статусу сировини та дає змогу прогнозувати фармакологічний ефект кінцевого продукту.
У біотехнологічному контексті THCA-A відкриває нові горизонти для інженерії ферментів, зокрема THCA-синтази, яка відповідає за його синтез у рослині. Можливості модифікації активності та специфічності цього ферменту дозволяють отримувати канабісні штами з підвищеним вмістом THCA-A, одночасно знизивши або повністю усунувши рівень психоактивного Δ9-THC. Такі технології кардинально змінюють підходи до культивування і виробництва канабіноїдних препаратів, відкриваючи шлях до легалізації і застосування без психоактивних ризиків.
Вирощування рослин зі збільшеним вмістом THCA-A без Δ9-THC є стратегічно важливим напрямом, що сприяє розвитку медичної канабінотерапії, оскільки дозволяє створювати ефективні препарати з мінімальними побічними ефектами. Це також має соціальне значення, оскільки знижує ризики зловживання і залежності, що традиційно асоціюються з Δ9-THC, та відповідає вимогам регуляторних органів щодо безпеки і контролю.
Етичні та регуляторні аспекти використання THCA-A є надзвичайно актуальними, з огляду на його законодавчий статус і потенціал до терапевтичного застосування. Нормативно-правова база у більшості країн не має чітких положень, що регламентують обіг THCA-A як окремої хімічної субстанції, що створює труднощі у легалізації, контролі якості та науковому дослідженні. Відсутність точних визначень і розмежувань із Δ9-THC призводить до юридичних колізій, які негативно впливають на інноваційний розвиток і доступ до терапевтичних засобів.
Управління ризиками, пов’язаними з декарбоксилюванням THCA-A у Δ9-THC, стає ключовим фактором при розробці стандартів якості і безпеки. Відмінність між сировиною з високим THCA-A і високим Δ9-THC потребує офіційного визнання і впровадження у нормативно-правові акти, що дозволить диференціювати медичні продукти за їх потенційною активністю і ризиками. Такі підходи сприятимуть формуванню прозорого і науково обґрунтованого правового поля, яке підтримуватиме розвиток інновацій у фармацевтиці та сільському господарстві.
Міжнародна регуляторна практика демонструє неоднорідність підходів до класифікації THCA-A, що ускладнює формування уніфікованої стратегії розвитку канабіноїдних препаратів. Відсутність узгоджених міжнародних стандартів обмежує обмін науковими знаннями, ускладнює торгівлю і спричиняє різні рівні доступності терапевтичних продуктів у різних країнах. Для подолання цих викликів необхідна гармонізація нормативної бази, яка враховуватиме специфіку THCA-A як речовини, що є передумовою психоактивного Δ9-THC, але сама по собі не має його властивостей.
Таким чином, THCA-A можна розглядати як ключовий компонент майбутнього розвитку фармацевтичних і біотехнологічних напрямків, пов’язаних із канабіноїдами. Його унікальні властивості створюють основу для безпечних не-психоактивних терапевтичних засобів, а також для удосконалення агротехнічних процесів вирощування канабісу з оптимізованим хімічним профілем.
Цей канабіноїд відкриває нові перспективи для персоналізованої медицини і високоточного контролю фармакологічних ефектів, забезпечуючи баланс між терапевтичною ефективністю і безпекою. Подальші дослідження мають зосередитися на детальному вивченні біохімічних механізмів взаємодії THCA-A з різними біомолекулами, а також на розробці сучасних технологій контролю за декарбоксилюванням і стабілізації сполуки в кінцевих продуктах.
Джерела:
- PubMed Central (PMC) – Національна бібліотека медицини США
База відкритих наукових статей з медицини, фармакології та біохімії.
https://www.ncbi.nlm.nih.gov/pmc/ - National Institute on Drug Abuse (NIDA)
Авторитетний ресурс із дослідженнями канабіноїдів, фармакології та впливу на здоров’я.
https://www.drugabuse.gov/ - Journal of Cannabis Research
Відкритий журнал з публікаціями на теми канабісу, включно з фармакологією і біохімією.
https://jcannabisresearch.biomedcentral.com/ - Frontiers in Pharmacology
Авторитетний відкритий журнал із статтями про фармакологію канабіноїдів, біохімію та терапію.
https://www.frontiersin.org/journals/pharmacology - ScienceDirect (Open Access Articles)
Платформа Elsevier, яка має багато відкритих статей з фармакології та біохімії канабіноїдів.
https://www.sciencedirect.com/ - United States Food and Drug Administration (FDA)
Офіційні документи і позиції регулятора щодо канабіноїдів, включаючи нормативні рекомендації.
https://www.fda.gov/ - European Monitoring Centre for Drugs and Drug Addiction (EMCDDA)
Європейський центр моніторингу наркотиків та їхнього впливу, має аналітичні звіти і нормативи.
https://www.emcdda.europa.eu/ - World Health Organization (WHO) – Expert Committee on Drug Dependence Reports
Оцінки та рекомендації по канабіноїдам і їхній класифікації.
https://www.who.int/teams/health-product-policy-and-standards/controlled-substances/expert-committee-on-drug-dependence - Journal of Natural Products (American Chemical Society)
Публікації про хімічний склад та біосинтез канабіноїдів.
https://pubs.acs.org/journal/jnprdf - Cannabis and Cannabinoid Research (Mary Ann Liebert, Inc.)
Науковий журнал, що спеціалізується на сучасних дослідженнях канабіноїдів.
https://www.liebertpub.com/can - National Center for Biotechnology Information (NCBI) – Gene and Protein Databases
Інформація про ферменти, генетику та біохімію, зокрема THCA-синтази.
https://www.ncbi.nlm.nih.gov/ - Scopus (Open Access Articles)
Бібліографічна база даних з доступом до відкритих статей з медицини та біотехнологій.
https://www.scopus.com/ - Harvard Health Publishing
Оглядові матеріали і публікації про канабіноїди в медицині.
https://www.health.harvard.edu/ - The Journal of Biological Chemistry
Публікації з біохімії ферментів, включно з THCA-синтазою та іншими ферментами канабіноїдного шляху.
https://www.jbc.org/ - National Agricultural Library (NAL) – US Department of Agriculture
Матеріали по сільському господарству, біотехнологіях і контролю якості рослин.
https://www.nal.usda.gov/