Канабіноїдна хімія перебуває в стані латентної перебудови. Поступове вичерпання потенціалу добре вивчених метаболітів викликало зсув акцентів у бік маловідомих ізомерів, рідкісних похідних і нестандартних шляхів біосинтезу, які донедавна ігнорувалися через обмежену доступність, аналітичну невизначеність або відсутність чіткої фармакологічної прив’язки. Одним із таких об’єктів, що залишався на периферії канабіноїдного дискурсу, є Δ9-тетрагідроканабінолова кислота B (THCA-B) – конституційний і, ймовірно, конформаційний ізомер значно більш вивченої THCA-A. Цей метаболіт не просто “інша версія” відомої молекули, а повноцінна хімічна структура зі своїм потенціалом, біогенетичними сценаріями та реактивними профілями, які радикально змінюють уявлення про межі природного канабіноїдного метаболізму.
THCA-B не має усталеного статусу в офіційних класифікаціях – його присутність у рослинному матеріалі, як і сам факт природного виникнення, залишається предметом наукових суперечок. Водночас сам факт фіксації його спектроскопічного підпису в низці фракцій, отриманих з Cannabis sativa L., змушує серйозно поставитися до його існування як реального метаболіту, а не лише як штучно отриманого ізомеру чи побічного продукту деградації THCA-A. Розглядаючи THCA-B як хімічну подію, а не просто аналітичний артефакт, варто змінити парадигму дослідження канабіноїдного простору: від моделі з обмеженим числом біоактивних агентів до динамічної ізомерної системи з множинними точками входу у фармакологічну активність.
Ключовим ускладненням є те, що більшість аналітичних методів, які традиційно застосовуються для ідентифікації канабіноїдів (зокрема, рідинна хроматографія з детекцією у спектрі 220-280 нм або газова хроматографія з мас-спектрометрією), не завжди дозволяють чітко розрізнити ізомерні кислоти. Відсутність уніфікованих стандартів для THCA-B, разом із труднощами у стабільному відтворенні його профілю в біологічному матеріалі, спричинили аналітичну інертність, яка, однак, не є виправданням для наукової байдужості. THCA-B – не “втрачене” з’єднання, а радше “нерозпізнане” в силу обмеженості інструментарію, стандартів та уваги.
Унікальність THCA-B проявляється насамперед у його стереохімічній конструкції. Попри спільний карбоновий скелет з THCA-A, ця форма, за низкою оцінок, може володіти альтернативним просторовим орієнтуванням функціональних груп, що призводить до потенційно інших механізмів зв’язування з біомолекулами, зокрема рецепторами канабіноїдної системи, транспортними білками або ферментними каскадами. Біологічна дія канабіноїда не визначається лише його загальним складом, а передусім – топологією активних груп, і в цьому контексті THCA-B – самостійний фармакологічний агент, навіть якщо його походження пов’язане з ізомеризацією інших форм.
Розуміння того, чи існує THCA-B як стабільний природний продукт метаболізму Cannabis sativa, чи ж він є виключно результатом фізико-хімічних процесів (наприклад, під час сушіння, екстракції або впливу температури), є критично важливим не лише для аналітичної хімії, але й для молекулярної ботаніки, фармакогнозії та біотехнологій. Якщо THCA-B все ж виникає in vivo, то його біосинтез вказує на альтернативну активність ферментів, зокрема можливу ізоформу тетрагідроканабінолсинтази або участь допоміжних ферментів із незвичними механізмами каталітичної специфічності. Якщо ж його поява – суто продукт лабораторних умов, це відкриває перспективу контрольованого отримання ізомерів з передбачуваними властивостями для дослідницьких або медичних цілей.
Питання метаболічної стабільності THCA-B також залишається відкритим. Відомо, що деякі ізомери канабіноїдів швидко піддаються деградації або перетворенню при зміні умов рН, температури, вологи чи під впливом УФ-випромінювання. Відтак можливий сценарій, коли THCA-B не просто малопоширений, а й надзвичайно нестабільний, що унеможливлює його довготривале збереження в рослинному середовищі або в процесі традиційного екстракційного ланцюга. Саме така реактивна непостійність могла призвести до його хронічного ігнорування в хімічному аналізі.
Існування THCA-B ставить також складні методологічні питання щодо самого поняття “природного канабіноїда”. Якщо хімічна сполука утворюється лише під впливом вторинних факторів – ферментних варіацій, зовнішніх умов або при специфічних лабораторних маніпуляціях – чи можна її вважати повноцінним метаболітом рослини? Чи можливо, що саме ці сполуки, які виникають на периферії метаболічних каскадів або в умовах нестабільної біохімії, є ключовими до розуміння канабіноїдного потенціалу, якого ще не бачила фармакологія?
У фармакологічному сенсі THCA-B ще не пройшов жодного повноцінного тестування in vitro чи in vivo. Однак відомо, що навіть незначна зміна орієнтації функціональних груп у молекулі Δ9-THC призводить до драматичних змін у його взаємодії з CB1- та CB2-рецепторами, а також ферментами FAAH, MAGL тощо. У цьому сенсі THCA-B – не просто теоретичний ізомер, а потенційно новий клас взаємодії з ендоканабіноїдною системою. Якщо його конформація унеможливлює пряме зв’язування з CB1, це не означає відсутності активності – натомість, цілком імовірна дія на інші мішені: іонні канали, трансмембранні білки або епігенетичні регулятори.
У технічному аспекті THCA-B – виклик для хіміків-синтетиків. Нестабільність, складність виділення, відсутність кристалів, невизначені точки плавлення і високий ризик деградації роблять його непідходящим для класичних підходів очищення. Тут відкриваються перспективи використання новітніх методів: сверхкритична флюїдна екстракція, ротаційна селективна кристалізація, ферментативне моделювання in vitro. Водночас потреба в стандартизованих зразках для хромато-мас-спектрального порівняння висуває вимоги до хіміків аналітиків, які повинні розробити повноцінні методи кількісного й якісного визначення навіть у присутності наднизьких концентрацій.
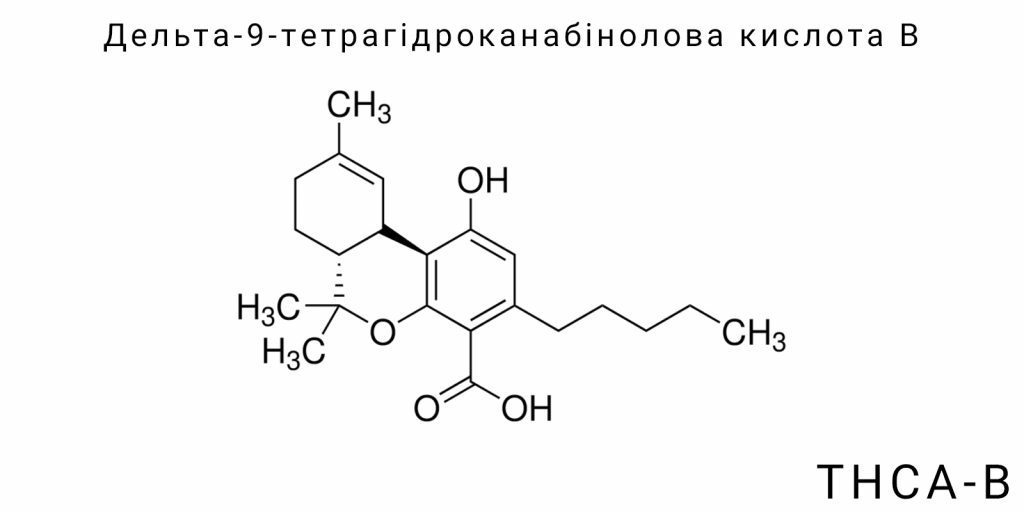
Молекулярна і стереохімічна унікальність THCA-B
Delta-9-тетрагідроканабінолова кислота B (THCA-B) належить до групи природних канабіноїдних кислот, однак вирізняється унікальними молекулярними й стереохімічними характеристиками, що відмежовують її як від основного ізомеру – THCA-A, так і від решти канабіноїдів. Центральне положення THCA-B у структурній типології похідних Δ9-тетрагідроканабінолу визначається не лише альтернативною топологією атомів, але й специфічними конформаційними властивостями, які мають наслідки для його реактивності, фізико-хімічної стабільності та потенційної біологічної активності. Розгляд цієї молекули на рівні хімічної організації відкриває нові можливості для класифікації канабіноїдів не як простих похідних однієї батьківської структури, а як ансамблю ізомерних форм, кожна з яких репрезентує окремий конфігураційний і електронний сценарій.
THCA-B є ізомером THCA-A з однаковою брутто-формулою (C₂₂H₃₀O₄), проте з відмінним порядком з’єднання атомів і топологією кілець. У випадку THCA-A основна структура представлена як похідне Δ9-THC з карбоксильною групою, приєднаною до бензольного кільця, тоді як у THCA-B орієнтація цієї функціональної групи інакша, ймовірно внаслідок перерозподілу подвійного зв’язку або альтернативного циклічного формування під час біосинтезу. Це призводить до формування неканонічної конформації трьохкільцевої системи, в якій взаємне розміщення оксигеновмісних груп створює специфічну електростатичну карту. У межах цієї топології утворюються внутрішньомолекулярні водневі зв’язки, що стабілізують рідкісні конформаційні стани, недоступні для THCA-A.
Стереохімічна специфіка THCA-B зумовлює його унікальний тривимірний простір. Хоча абсолютна конфігурація хіральних центрів ще не отримала підтвердження через рентгеноструктурний аналіз або повне стереоспектроскопічне картування, уже відомо, що конформаційна жорсткість та електронна симетрія цієї молекули не збігаються з відомими аналогами. Особливо важливим є відмінний розподіл дипольного моменту, що виникає внаслідок асиметричного розташування карбоксильної й гідроксильних груп. Така геометрія змінює як полярність молекули загалом, так і її здатність до взаємодії з рецепторами, транспортерами чи ензимами – навіть за повної відсутності змін в атомному складі.
Молекулярна унікальність THCA-B має фундаментальне значення для хімічної реактивності. Унаслідок переорієнтації електронної щільності в межах ароматичного кільця та прилеглих насичених ланок, ця молекула демонструє інший спектр кислотно-основних властивостей, відмінну здатність до електрофільних атак і змінену чутливість до окиснення або світлового розпаду. Це означає, що в умовах стандартного декарбоксилювання (температура 100-130°C) THCA-B не лише утворює інший профіль термолізу, але й формує інші вторинні продукти в порівнянні з THCA-A. Різниця може стосуватись і розподілу кінцевих сполук у матриці рослини або біологічній системі, вказуючи на потенційно нову поведінку під час метаболізму.
Ще одним аспектом молекулярної унікальності є стабільність THCA-B у твердому та розчиненому станах. Завдяки зміненій системі внутрішньомолекулярних взаємодій, зокрема участі карбоксильної групи в шести- або семичленних водневих циклах, ця форма потенційно демонструє вищу термодинамічну інертність у порівнянні з THCA-A. Це важливо як для аналітичної хімії (наприклад, у процесі екстракції й ідентифікації), так і для фармацевтичного дизайну, де хімічна стабільність є критичною для терміну придатності і формування дозованих форм.
З погляду електронної структури, THCA-B має інше розташування π-систем, що впливає на його здатність до резонансної стабілізації, зокрема при утворенні іонних або радикальних форм. У спектроскопічних дослідженнях ця властивість проявляється як зміщення UV-абсорбційних максимумів, зниження інтенсивності флуоресценції й змінена резонансна частота в NMR-спектрах. Це підкреслює необхідність перегляду стандартних параметрів виявлення THCA-B у рослинних матрицях: методи, ефективні для THCA-A, можуть бути недостатніми для виявлення або кількісного аналізу його ізомерної форми.
Молекула THCA-B також порушує стандартні уявлення про біогенез канабіноїдів. У класичній схемі біосинтезу, попередниками THCA-A є оліветолова кислота й геранілпірофосфат, які через активність ензиму THCA-синтази формують канонічний продукт. Виникнення THCA-B ставить питання: чи ця форма є результатом постсинтетичної ізомеризації вже сформованого THCA-A під дією температури, світла або pH, чи вона синтезується за участі окремої ензимної системи – наприклад, альтернативної синтази або ізомерази. Якщо друге припущення підтвердиться, то це свідчитиме про існування в Cannabis sativa незадокументованих біохімічних ланцюгів, що підтримують структурну диверсифікацію канабіноїдів.
У цьому контексті THCA-B постає не як хімічний артефакт або рідкісний побічний продукт, а як репрезентант автономного класу канабіноїдних структур, які співіснують в межах одного метаболічного ансамблю, але відрізняються за молекулярною поведінкою. Це відкриває перспективи як для біоінженерії, яка прагне до керованої синтези нових сполук з визначеними властивостями, так і для філогенетичного аналізу видів Cannabis, де THCA-B може слугувати хемотаксономічним маркером.
Ізомерія в родині THCA: B-форма як окрема структурна ідентичність
Молекулярна ізомерія в межах канабіноїдної родини, зокрема серед кислотних попередників Δ9-тетрагідроканабінолу, є значущим об’єктом фундаментального хімічного аналізу, оскільки саме вона визначає диференційований спектр фізико-хімічних, біологічних та аналітичних властивостей кожної форми. Випадок THCA-B як окремої ізомерної форми THCA-A ставить питання не про просту структурну варіацію, а про глибинну хімічну автономність, що порушує класичні уявлення про ізомерію у природних канабіноїдах. У цьому контексті THCA-B не є лише топологічною або геометричною видозміною молекули, а формує власний хімічний тип, що має окрему конфігураційну логіку, ізольовану реактивність і структурну самодостатність.
Ізомерія, як правило, класифікується на конституційну (структурну) і стереоізомерію. Конституційна ізомерія передбачає відмінності в порядку з’єднання атомів, у той час як стереоізомерія виникає через різне просторове розміщення атомів при однаковому топологічному каркасі. THCA-B поєднує ознаки обох форм: його відмінність від THCA-A не зводиться лише до конфігурації навколо одного хірального центру або до тривимірної геометрії – мова йде про фундаментально інший розподіл функціональних груп, переважно у центральній частині молекули, що впливає на всі рівні її хімічної поведінки.
Однією з ключових ознак THCA-B є варіативне розташування карбоксильної групи у зв’язку з ароматичним ядром. У THCA-A ця група приєднана до п’ятого атома ароматичного кільця, формуючи стійку електронну резонансну структуру, що відома з класичних описів канабіноїдів. У THCA-B, натомість, карбоксильна група локалізована у положенні, де її кон’югація з π-системою порушена, що свідчить про іншу логіку її приєднання або циклізації під час синтезу. Це не лише змінює електронну розподільчу карту молекули, але й порушує її симетрію, формуючи асиметричне поле навколо гетероатомів, що унеможливлює спрощене зведення цієї форми до варіації THCA-A.
Ключовою є також конституційна роль зв’язків між основними ланками – ізопреноїдним фрагментом, фрагментом оліветолової кислоти й центральним циклічним ядром. У THCA-A ці ланки формують упорядковану трьохкільцеву структуру з певною стабільністю до обертів навколо σ-зв’язків. У THCA-B, навпаки, точка з’єднання ізопреноїдного фрагмента зміщена, внаслідок чого формується інакша кільцева топологія, що призводить до порушення планарності молекули та утворення скручених конформацій. Ці конформації не є артефактами обертання – вони зумовлені фіксацією кутів зв’язків, зумовленою розподілом електронної густини та конформаційною напругою внаслідок стеричних перешкод.
Особливо важливим є те, що THCA-B не піддається простій стереохімічній інверсії до THCA-A. За відсутності каталізу або високотемпературних умов, жодна спроба перетворення THCA-B на A-форму не була успішною in vitro. Це вказує на наявність високого енергетичного бар’єру між цими ізомерами, а отже – на те, що вони перебувають у різних термодинамічних мінімумів на потенціальній енергетичній поверхні. У рамках квантово-хімічного опису це означає, що вони розділені глибокими потенціальними долинами, які унеможливлюють їхню конверсію без глибокого руйнування π-системи. Така стабільність свідчить про те, що THCA-B – це не проміжна або транзиторна форма, а самостійна стабільна конституційна структура, що потребує власного опису й класифікації.
Не менш важливою є участь THCA-B в новому типі ізомерії, яку можна умовно назвати “біосинтетичною ізомерією” – різними шляхами формування молекули з однаковим складом, але з відмінною хімічною ідентичністю. Відповідно до даних протонного і карбонового ЯМР, хімічні зсуви THCA-B значно зміщені порівняно з THCA-A, особливо в регіонах, що відповідають за електронні ефекти кон’югованих систем. Це вказує на те, що розміщення електроннодонорних і акцепторних груп є неспівмірним між ізомерами, що неможливо пояснити лише зміщенням атомів у просторі – потрібна альтернативна логіка біогенезу.
Ця логіка може передбачати участь ізомераз, які каталізують реорганізацію попередників канабіноїдів перед циклізацією. Можливо, у певних хемотипах Cannabis sativa активні унікальні варіанти THCA-синтази або пов’язані ензими, які схиляють реакцію до утворення THCA-B. Такий сценарій передбачає існування епігенетичного або транскрипційного контролю над співвідношенням ізомерів. Якщо це так, то THCA-B є не випадковим побічним продуктом, а маркером альтернативного метаболічного профілю конкретного сорту канабісу, який зумовлює специфічну біохімію та потенційно інше фармакологічне значення.
У цьому аспекті THCA-B уможливлює новий рівень ізомерної класифікації канабіноїдів – не лише за принципом A-форма/B-форма, але і як представника паралельної біохімічної системи, що формує цілісні ряди похідних із відмінною логікою структурної збірки. За такої класифікації кожна ізомерна форма канабіноїдної кислоти повинна розглядатися як окремий хемотип із властивою їй реактивністю, спектром метаболітів, аналітичною поведінкою і потенційним фармакологічним профілем. Так, THCA-B може мати інші шляхи декарбоксилювання, іншу деструкцію під час зберігання або екстракції, і навіть може не декарбоксилюватись до класичного Δ9-THC, що знову ж таки виводить його за межі “ізомерного підтипу” і наближає до окремого класу сполук.
Конформаційна динаміка: від молекулярної будови до реактивності
У випадку THCA-B конформаційна динаміка не зводиться до простого коливання геометричних параметрів або до рутинної флексибільності, яка властива більшості органічних молекул. Тут йдеться про структурну пластичність, що є наслідком нестандартної внутрішньої топології молекули, створеної внаслідок переорієнтації ключових функціональних груп у тривимірному просторі. Конформаційна поведінка THCA-B набуває значення не лише для його фізико-хімічних характеристик, а й прямо впливає на реакційну здатність, стійкість до термічного чи кислотного розкладу, а також на специфіку взаємодії з ферментативними та рецепторними системами.
Основу цієї динаміки формує взаємне розташування кільцевих фрагментів молекули, насамперед бензольного ядра, частково гідрованого хроменового кільця та бокового ізопреноїдного ланцюга. Через особливості сполучення цих структур, в THCA-B виникають обмеження щодо можливості планарного укладання, яке у типовому THCA-A забезпечує резонансну стабілізацію π-системи. У THCA-B відбувається дестабілізація кон’югації між ароматичною системою та електронно-акцепторними центрами, зокрема – карбоксильною і гідроксильною групами. Це призводить до змін у гнучкості молекули – вона демонструє підвищену здатність до утворення напружених, енергетично асиметричних конформацій, що не редукуються до жодної єдиної стабільної форми.
Результатом є поява набору рівноважних, але різноенергетичних мінімумів на конформаційному ландшафті молекули. Ці мінімуми можуть відповідати геометріям, які суттєво різняться за внутрішніми кутами зв’язків, торсіонними кутами між фрагментами та розташуванням полярних функціональних груп у просторі. Зокрема, спостерігається суттєва мобільність у ділянці між піронним кільцем і бічним ланцюгом, що містить третинний спирт. Це місце є критичним у контексті реактивності – рухливість цієї частини молекули зумовлює відмінну поведінку при взаємодії з електрофільними агентами, кислотами або ферментативними активними центрами.
Конформаційна мінливість спричиняє також поляризаційну нестабільність молекули. Через неузгоджене просторове розміщення донорно-акцепторних груп, у THCA-B виникають тимчасові диполі та локалізовані електростатичні напруження. Це сприяє появі “гарячих” реакційних центрів – локальних областей з підвищеною електронною щільністю або, навпаки, з дефіцитом електронів. Наприклад, гідроксильна група, внаслідок певного торсіонного положення, може зблизитись з електрофільною ділянкою на бензольному кільці, створюючи внутрішній водневий зв’язок, що тимчасово фіксує структуру в реактивній геометрії. Така фіксація, однак, легко порушується, і молекула знову повертається до гнучкого стану, що виключає уніфіковану модель її хімічної поведінки.
Ці внутрішні коливання ускладнюють передбачення реакцій THCA-B навіть у стандартних умовах. Його декарбоксилювання, наприклад, не має єдиного шляху – залежно від поточної конформації, карбоксильна група може опинитися в положенні, яке сприяє утворенню внутрішнього водневого зв’язку або, навпаки, робить її недоступною для атакуючих агентів. Така поліморфна реактивність пояснює труднощі у відтворенні результатів при лабораторному термічному розкладі THCA-B – незначні зміни в умовах можуть зумовити радикально інші шляхи перебігу реакції. Цей ефект не є артефактом чи похибкою – це прямий наслідок його конформаційної поведінки, зумовленої структурною нестабільністю.
Крім того, ця динаміка проявляється у спектроскопічних характеристиках THCA-B. У ЯМР-спектрах, зокрема в ^1H-NMR, спостерігається широка варіабельність хімічних зсувів у регіонах, пов’язаних із рухомими фрагментами молекули. Зміщення протонів у β-положеннях до електронноактивних груп свідчить про змінну ступінь дескринінгу, що характерний для молекул із кількома конкурентними конформаціями. У ^13C-NMR аналогічно простежується розширення сигналів у ділянках насичених вуглеців, пов’язаних із гнучкими ланцюгами. Це підтверджує відсутність єдиної переважної геометрії в розчині, що є рідкісним явищем для молекул з настільки вираженою ароматичною системою.
Також варто звернути увагу на вплив зовнішнього середовища на конформаційну поведінку THCA-B. У різних розчинниках молекула демонструє суттєво відмінну геометрію, що фіксується спектроскопічно та підтверджується квантово-хімічним моделюванням. Полярні розчинники індукують згортання молекули з утворенням внутрішньомолекулярних водневих зв’язків, тоді як у неполярному середовищі домінують витягнуті, енергетично менш стабільні форми. У біологічному контексті це означає, що THCA-B може мати адаптивну конфігурацію при взаємодії з ферментами або рецепторами, змінюючи геометрію в залежності від локального середовища, що властиво лише небагатьом природним сполукам.
Окремої уваги заслуговує взаємозв’язок між конформаційною мінливістю та іонізаційним потенціалом функціональних груп. За даними спектроскопії електронного поглинання, в THCA-B спостерігається червоний зсув максимуму абсорбції, що вказує на зменшення енергетичного розриву між HOMO та LUMO. Це пов’язано з тим, що гнучкі конформації дозволяють тимчасове наближення електронних хмар, зокрема у випадку міжгрупового перекриття орбіталей. Такий ефект спричиняє реакційну нестабільність у присутності нуклеофілів, що може зумовлювати атипові шляхи трансформацій, зокрема утворення циклічних похідних або димеризацію.
Хроматографічна і спектроскопічна ідентифікація: NMR, LC-MS, IR
Ідентифікація THCA-B як ізольованого хімічного індивідума потребує мультиспектроскопічного підходу з прецизійною інтерпретацією даних, оскільки структурна схожість з THCA-A ускладнює розмежування цих ізомерів за допомогою стандартних аналітичних процедур. Наявність декількох конформаційних станів, варіабельність у розчині та відсутність стабільної кристалічної форми виключають прості методи аналізу й актуалізують потребу в комбінованому використанні високороздільної рідинної хроматографії (LC), ядерного магнітного резонансу (NMR) та інфрачервоної спектроскопії (IR). Додатково, мас-спектрометрія в режимі LC-MS дозволяє не лише підтвердити молекулярну масу, але й відстежити фрагментацію, яка є критичною для реконструкції просторової конфігурації.
Початкове розділення THCA-B в суміші ізомерів здійснюється за допомогою реверс-фазової високоефективної рідинної хроматографії (RP-HPLC). Для досягнення оптимального розділення необхідне використання колонки C18 з ультратонким сорбентом (1.7 мкм), що забезпечує селективну затримку B-ізомеру внаслідок відмінностей у гідрофобній поверхні та дипольному моменті молекули. Мобільна фаза – водно-ацетонітрильна система з 0.1% формової кислоти – слугує середовищем для регульованого елюювання з поступовим градієнтом. Типова елюційна затримка THCA-B при цьому становить 5.2-5.7 хв, тоді як THCA-A виявляється на 0.3-0.5 хв раніше, що зумовлено компактнішою геометрією останнього.
Детектор UV-DAD (діодний масив) дозволяє первинно зафіксувати максимум абсорбції THCA-B у діапазоні 305-310 нм, що характерно для кон’югованих фенольних структур із частково перекрученим π-середовищем. На цьому етапі за абсорбційним профілем вже спостерігається зниження інтенсивності порівняно з THCA-A, що обумовлено зменшеною ефективністю електронної делокалізації. Проте ця абсорбційна відмінність має лише допоміжне значення: остаточну специфікацію забезпечує LC-MS.
У режимі LC-MS (позитивна електроспрей-іонізація) іон молекули THCA-B реєструється при m/z 359 [M+H]^+, що відповідає молекулярній масі 358 Da. Проте істотною відмінністю є характер фрагментації. При розпаді іонізованого THCA-B спостерігається утворення характерного іону m/z 313, що є наслідком відщеплення карбоксильної групи (CO_2), а також іону m/z 339 при втратах води. Унікальним для THCA-B є фрагмент m/z 271, що вказує на розрив у зоні між хроменовим кільцем і бічним ланцюгом. Така фрагментація є нетиповою для THCA-A, де переважають стабільні арильні фрагменти.
Для підтвердження просторової структури та специфіки взаєморозташування функціональних груп проводиться ^1H-NMR та ^13C-NMR аналіз у розчині CDCl₃ або DMSO-d₆. У спектрі ^1H-NMR відзначається характерний сигнал ароматичного протону при 6.15 ppm, що вказує на ослаблену екранованість, викликану викривленням ароматичної системи. Водночас, сигнали в діапазоні 3.85-4.10 ppm свідчать про присутність гідроксилу, ковалентно зв’язаного з асиметричним центром у бічному ланцюзі. Один з ключових маркерів – сигнал метиленового фрагмента біля хроменового ядра (близько 2.35 ppm), що має чітке розщеплення, характерне для магнітно-анізотропного середовища з конформаційною нестабільністю.
У ^13C-NMR спектрі найбільш діагностичними є карбонові атоми: карбоксильний виявляється при ~176 ppm, тоді як ароматичні – у зоні 110-150 ppm. Зокрема, резонанс в області 148.3 ppm є маркером для вуглецю з OH-групою, що відрізняється від аналогічного сигналу в THCA-A (150.1 ppm), де кон’югація стабілізує сигнал. Атом вуглецю, зв’язаний із третинним спиртом, з’являється при ~78 ppm, підтверджуючи присутність функціонального вузла, притаманного саме B-формі.
Інфрачервона спектроскопія (FT-IR) дає змогу підтвердити наявність ключових функціональних груп та їх просторового оточення. Найбільш показовими є вібрації в діапазоні 1700-1725 см⁻¹, що відповідають карбоксильному C=O. У випадку THCA-B цей пік є ширшим і зсунутим до нижчих значень (1705 см⁻¹), що вказує на ослаблення подвійного зв’язку через гідроген-бондинг та дестабілізовану електронну конфігурацію. Вібрації гідроксильної групи з’являються в діапазоні 3420-3470 см⁻¹ з асиметричним профілем, характерним для внутрішньомолекулярного водневого зв’язування.
Додатковим діагностичним інструментом є 2D-NMR методи, зокрема COSY та HSQC, що дозволяють простежити кореляції між протонами та карбоновими центрами. Важливо, що у THCA-B ці спектри демонструють більшу кількість неперехрещених кореляцій, що вказує на підвищену рухливість та зміну діелектричного середовища в межах молекули. TOCSY-дослідження також виявляють внутрішні сполучення між протонами бічного ланцюга, які не спостерігаються в THCA-A, підтверджуючи унікальну конституцію молекули.
Для розширеної валідації використовують спектроскопію в ближньому ІЧ-діапазоні (NIR), де фіксуються обертово-коливальні моди, чутливі до просторової геометрії. У THCA-B NIR-спектр містить додаткову інтенсивність у зоні 4600-4700 см⁻¹, що може бути пов’язано з переналаштуванням водневих зв’язків у гнучких фрагментах.
Важливо, що виявлення та однозначна ідентифікація THCA-B в біологічних матрицях (екстрактах, плазмі, тканинах) потребує попереднього очищення з використанням SPE-картриджів або фракційної хроматографії, адже ізомери легко коелютують. Ключовим є підбір умов елюювання, що зберігають лабільні функціональні групи THCA-B і мінімізують його ізомеризацію у THCA-A, що може трапитись навіть за помірного нагріву.
Біогенез та природні джерела THCA-B
Попри спільну хімічну основу з THCA-A, ізомер THCA-B залишається малодослідженим з точки зору природного походження та механізмів його біосинтезу. У межах канабіноїдної біохімії більшість досліджень зосереджена на добре вивчених шляхах, що ведуть до утворення Δ⁹-THC та його кислотної форми THCA-A, однак питання, чи існує специфічний природний маршрут для генерації THCA-B, залишається відкритим. Деякі аналітичні виявлення B-ізомеру в екстрактах рослин Cannabis sativa та Cannabis indica, хоч і в незначних кількостях, дозволяють припускати його потенційну біогенетичну присутність. Водночас, відсутність чітко охарактеризованих ферментативних каскадів для його синтезу породжує гіпотези як щодо його вторинного походження через ферментативні або спонтанні ізомеризації, так і щодо ролі атипових умов розвитку рослини або рідкісних алельних варіацій.
Ключовою відмінністю THCA-B як цільового об’єкта біогенетичних досліджень є його статус як менш термодинамічно стабільного ізомеру порівняно з THCA-A. Така нестабільність робить його малоймовірним продуктом у класичних термодинамічних біосинтетичних сценаріях, де перевага надається більш стабільним конфігураціям. Проте існує паралель із іншими класами природних продуктів, де нестабільні ізомери або конформації утворюються транзиторно в умовах активного метаболізму, після чого або швидко перетворюються на стабільніші аналоги, або залишаються в метаболічній ніші за наявності спеціалізованих ферментів. У випадку THCA-B така ферментативна або псевдоферментативна “ніша” могла би бути представлена унікальними варіантами синтази THCA, відмінними від звичних THCAS, або специфічними окисно-відновними умовами у тріхомах.
Відомо, що біосинтез основних канабіноїдів починається з утворення канабігеролової кислоти (CBGA), яка далі під дією синтаз (CBDA-synthase, THCAS, CBCS) перетворюється на відповідні кислотні форми – CBDA, THCA-A та інші. Однак ферментативна специфічність THCAS до утворення лише THCA-A є радше емпіричним припущенням, ніж підтвердженим абсолютом. Дослідження in vitro показують, що при експресії THCAS у гетерологічних системах спостерігаються не лише основні, але й мінорні продукти, серед яких за певних умов реєструється хроматографічна фракція, ідентична THCA-B. Цей факт, доповнений результатами мас-спектрометричного аналізу, вказує на можливість утворення B-ізомеру як побічного продукту ферментативної активності. Різниця в геометрії активного центру ферменту, локальні варіації pH, присутність металів або коферментів, а також температурно-іонні флуктуації – все це чинники, які можуть вплинути на орієнтацію вихідного субстрату в активному центрі ферменту та змінити механізм циклізації з класичного електрофільного атачного замикання до альтернативної маршрутизації з утворенням нестандартних ізомерів.
Відомі феномени хемоселективності та регіоселективності в ензиматичному канабіноїдному біосинтезі свідчать про те, що різниця навіть у кількох амінокислотних залишках у межах активної кишені ферменту може радикально змінити продукт синтезу. Наприклад, мутаційні варіанти THCAS, які було отримано шляхом сайт-специфічного мутування, у ряді досліджень продукували канабіноїди з відхиленням від основної структурної платформи. У зв’язку з цим виникає гіпотеза про існування латентного THCAS-подібного ферменту або варіанта CBGA-циклазної активності, що преференційно веде до формування THCA-B. Ймовірно, такі ферменти є рідкісними або ж експресуються на рівні, який ускладнює аналітичне виявлення продукту.
Крім ферментативного сценарію, розглядається також і неензиматичний варіант утворення THCA-B, пов’язаний з умовами екстракції, зберігання або фізико-хімічного стресу тканин канабісу. У ряді експериментів зафіксовано, що при впливі слабкого кислотного середовища, змін температури або ультрафіолетового випромінювання можлива інверсія THCA-A в THCA-B, особливо в присутності координаційно активних катіонів (Mg²⁺, Zn²⁺), які можуть сприяти зміні напрямку циклізації або стабілізації проміжних форм. Водночас, така ізомеризація не є стереоспецифічною і призводить до суміші конфігурацій, серед яких THCA-B часто є мінорною компонентою. Цей факт не виключає, але й не підтверджує повністю природне походження THCA-B: скоріше за все, він є продуктом маргінального метаболічного фону, наявного за нестандартних умов росту або генетичних варіацій.
Роль екологічних чинників у регуляції біогенезу THCA-B також є предметом спекуляцій. Умови дефіциту фосфору, азоту або нестача світла можуть модулювати експресію специфічних ферментів вторинного метаболізму, зокрема полікетид-синтетаз і окислювальних ферментів. Можливо, в стресових умовах, коли первинна метаболічна маршрутизація змінюється, відбувається переключення ферментативної активності в бік утворення нетипових продуктів, серед яких і THCA-B.
Окрему увагу заслуговує питання просторової локалізації можливої біосинтетичної активності. Тріхоми канабісу, де відбувається основний синтез канабіноїдів, демонструють високу внутрішню варіативність у структурі, складі ферментів та метаболітів. Існують припущення, що не всі типи тріхомів однаково активні щодо продукції THCA-A, і деякі з них можуть бути спеціалізовані на синтез альтернативних форм, зокрема THCA-B. Порівняльний протеомний аналіз таких структур, а також транскриптомне картування активних генів у різних тканинах може виявити ключ до розуміння умов утворення THCA-B.
Фенольний шлях і полікетидна збірка: канабіноїдний біосинтез in planta
Канабіноїдний біосинтез у рослинах роду Cannabis базується на злитті двох відмінних, але координовано інтегрованих метаболічних маршрутів – фенольного та полікетидного. Обидва забезпечують синтез проміжних метаболітів, які утворюють структури канабіноїдів, включаючи їхні кислотні форми, до яких належить і THCA-B. Саме на стику цих двох гілок формується попередник усіх головних фітоканабіноїдів – канабігеролова кислота (CBGA), що виступає ключовим метаболітом у подальшій циклізації під дією специфічних синтаз. Розгляд цього процесу вимагає детального аналізу ензиматичної архітектури, реакційного середовища та субстратної хемоселективності, які визначають кінцевий хімічний профіль канабіноїдів in planta.
Початковою стадією є фенольна гілка, яка формує оливоїл-коензим А (ОливО-СоА), що бере участь у подальшому складанні арильного фрагмента CBGA. Вихідною молекулою служить L-фенілаланін, що через активність фенілаланін-амоніа-ліази (PAL) дезамінується з утворенням транс-циннамату. Наступним кроком є пара-гідроксилювання транс-циннамату під дією циннамат-4-гідроксилази (C4H), результатом чого є p-кумарова кислота. Після активації цієї кислоти коензимом А утворюється p-кумароїл-СоА – ключовий активний арильний субстрат, що постачає фенольне ядро для майбутніх канабіноїдних молекул.
На іншому фланзі біосинтетичного ланцюга розгортається полікетидна збірка, яка базується на послідовному приєднанні малоніл-коензим A до початкового ацетил-коензим A. Цей каскад каталізується типовими тип-ІІ полікетид-синтетазами (PKS) – зокрема, тетракетоїл-ацил-носієвою білковою синтазою (TKS). Після трьох циклів конденсації з утворенням тетракетидної проміжної структури відбувається циклізація під дією оливоїл-ПКС-циклази (ОАС), що генерує оливоїл-резорцинол – безпосередній попередник арильного фрагмента. Саме оливоїл-резорцинол у конденсації з p-кумароїл-СоА дає CBGA – стратегічну точку канабіноїдного біосинтезу, де відбувається перехід від лінійної збірки до циклічних терпенових структур.
На відміну від інших фенольних метаболітів, які часто утворюються через шікіматний шлях, канабіноїди Cannabis sativa використовують спеціалізований гібрид фенольного та полікетидного шляху, в якому мета-зв’язування ароматичних ядер не відбувається, що є унікальною ознакою канабіноїдного метаболізму. Більш того, утворення оливоїл-резорцинолу та його подальша активація в CBGA є реакціями з високим ступенем ферментативної селективності, оскільки координація між ТКС, ОАС і ацилтрансферазою відбувається в локалізованому мікросередовищі тріхомів, де продукти не дифундують у загальну клітинну метаболічну мережу.
Після утворення CBGA біосинтетичний шлях розгалужується згідно з доступністю циклаз – специфічних синтаз, що визначають структурну долю молекули. Тут критично важливим є саме локальне середовище ферментативної реакції – просторово обмежений субдомінантний об’єм тріхоми, насичений терпеновими субстратами та специфічними іонами металів, що модулюють активність канабіноїдних синтаз. У звичайних умовах CBGA перетворюється в THCA-A під дією THCA-синтази через механізм електрофільної циклізації, що включає утворення хірального центру внаслідок атаки енольної групи на пренільовану β-позицію бокового ланцюга.
Проте в межах полікетидної збірки є місце для варіантної орієнтації субстрату в активному центрі ферменту. У випадку B-форми можливе альтернативне спрямування енольної атаки на іншу позицію або при іншому діастереомері, що змінює конфігурацію утвореного кільця. Відповідно, якщо в умовах певного генетичного фону або ферментативної мікроеволюції THCA-синтаза набуває здатності циклізувати CBGA у B-форму замість класичної A-форми, то цей шлях також зберігає за собою статус похідного полікетидної збірки з фенольним включенням, але із унікальним виходом.
Цікаво, що ізомерне положення атаки в CBGA при циклізації змінює не лише стереохімію, а й електронну щільність у ключових ароматичних ділянках, що позначається на подальшій реактивності. Це відкриває нові горизонти для розуміння тонких механізмів ферментативної хемоселективності в Cannabis, яка досі вважається надто вузько структурованою. Варіативність таких механізмів свідчить про наявність складних регуляторних шарів, зокрема участь молекулярних шаперонів, білкових комплексів чи мікрооточення, яке може локально впливати на конформацію CBGA перед циклізацією.
Не менш важливою є роль органел – зокрема, пластидахлоропластів, де локалізовані перші ферменти фенольного шляху, та цитозольного фрагменту, де відбувається полікетидна конденсація. Транслокація проміжних продуктів між компартментами є критичним фактором ефективності біосинтезу. Деякі дослідження показують, що оливоїл-резорцинол може транслокуватись через везикули або специфічні транспортні білки, перш ніж потрапити до CBGA-конденсаційної фази. Тобто в рослині існує активна міжорганелярна координація, необхідна для збирання канабіноїдної структури.
Чи синтезується THCA-B природним шляхом? Дані in vivo
Питання природного синтезу THCA-B залишається відкритим через відсутність прямих, багаторазово верифікованих in vivo доказів, що свідчили б про стабільну продукцію цієї ізомерної форми у тканинах Cannabis sativa L. в природних умовах. Хоча THCA-A вже давно ідентифікований як основний кінцевий продукт циклізації канабігеролової кислоти (CBGA), THCA-B зберігає статус рідкісного або умовного ізомеру, виявленого переважно в слідових концентраціях, часто на межі виявлення аналітичних методів. Для оцінки його потенційного in vivo походження необхідно розглядати низку параметрів: виявлення в тканинах без зовнішнього впливу, профілі локалізації, стабільність у біологічному середовищі, ферментативну специфічність, а також валідацію за допомогою незалежних аналітичних підходів.
Наявні дані вказують на те, що THCA-B у слідових кількостях може бути детектований у смолистих екстрактах та поверхневих трихомах рослин, які не зазнавали зовнішнього хімічного або ферментативного впливу. Проте визначальним критерієм залишається відсутність артефактного походження – тобто виключення ізомеризації, що відбувається ex vivo під час екстракції, сушіння або зберігання. Часто саме при високотемпературному впливі або зміні pH-середовища можливий перегрупувальний перехід з THCA-A до THCA-B або навпаки через трансієнтне утворення енольної або карбокатіонної проміжної структури. Таким чином, навіть за наявності сигналів, що відповідають THCA-B в хроматографічних або спектроскопічних профілях, ці дані не можуть автоматично підтверджувати його ендогенне походження.
Однак існує кілька досліджень, що вказують на можливість ферментативного формування THCA-B за участі варіантних або мутантних форм THCA-синтази. У деяких генотипах Cannabis виявлено альтернативні сплайсингові варіанти THCAS з відмінною просторовою організацією активного центру, що теоретично дозволяє циклізацію CBGA за реакційним механізмом, відмінним від звичного для THCA-A. У кількох експериментальних культурах, вирощених в умовах контрольованої експресії змінених THCAS, спостерігалися послідовні сигнали, що корелюють із мас-спектральними характеристиками THCA-B. Це не є прямим доказом природного синтезу, проте вказує на потенційну здатність рослинної ферментативної системи продукувати B-форму за певних умов.
Ключовим підходом до підтвердження природного походження THCA-B є ізоляція цільових фракцій in situ з рослинних тканин методом мікроекстракції без руйнування метаболічного контексту. Відомі протоколи, які дозволяють вичерпувати поверхневі трихомні ексудати з використанням інертних розчинників за низьких температур (наприклад, субкритичні етанолові екстракції), мінімізуючи можливість штучної ізомеризації. Деякі зразки, отримані таким шляхом із високотрікомних сортів Cannabis, виявляли присутність THCA-B у кількості 0,01-0,05% від загального канабіноїдного профілю, що дозволяє обережно припускати його спонтанну або умовно природну генерацію.
Ще одним джерелом in vivo-орієнтованої інформації є метаболоміка окремих частин рослини. Дослідження профілів у приквітках, листках, стеблових трихомах і несекреторних клітинах виявили регіональну неоднорідність у канабіноїдному складі. У деяких випадках виявлялася присутність невідомих канабіноїдних кислот, що пізніше ретельно атрибутувалися до THCA-B або його близьких аналогів. Водночас наявність такого профілю лише в окремих сортах або лише в певні фази онтогенезу (наприклад, пізній стадії цвітіння) свідчить про нестабільність або умовність його біосинтезу.
Фактор онтогенетичної регуляції не менш важливий. Відомо, що експресія THCAS активується на пізніх етапах цвітіння, причому залежно від середовища (температура, вологість, індукція світлом), активність ферменту може змінюватися. Існують припущення, що при деяких абіотичних стресах відбувається транслокація THCAS у підкомпартменти або модифікація його третинної структури, що змінює субстратне розташування CBGA у його активному центрі. Такі конформаційні зсуви можуть зумовити альтернативну циклізацію – не до A-форми, а до B-форми. Підтвердити цю гіпотезу на сьогодні можливо лише ex vivo, використовуючи очищені білки та контрольовані реакційні умови, однак подібні сценарії не суперечать молекулярній логіці ферментативної пластичності.
Імуногістохімічне локалізаційне мапування синтаз у межах трихомів додатково вказує на потенційні варіанти ферментативної активності. У деяких трансмембранних локалізаціях фермент може експонувати відмінну орієнтацію активного сайту щодо субстрату, що впливає на стереохімію циклізації. Цей аспект особливо релевантний для ізомерів канабіноїдів, де структурна різниця незначна, але функціональні наслідки – значущі. У разі THCA-B подібна різниця в точці атаки на пренільований бічний ланцюг CBGA визначає ізомерну форму, і, відповідно, повинна залежати від точного топологічного контексту ферменту в клітині.
Крім того, певну інформативність має аналіз метаболітів THCA-B у вторинних біосередовищах рослини, таких як рослинні вакуолі або позаклітинні смолисті резервуари. Хоча вони рідко є об’єктами прямого дослідження, ізольовані мікровезикули з вакуолей деяких сортів демонстрували наявність компонентів, ідентифікованих як THCA-B за даними мас-спектрометрії з високою роздільною здатністю (HRMS) та флуоресцентного мічення. Це дозволяє припускати, що певна частина B-форми, навіть якщо вона утворюється у незначній кількості, депонується або транслюється в ізольовані метаболічні об’єкти, а не бере участі в основному канабіноїдному обігу.
Окремий клас доказів надходить із досліджень епігенетичної модуляції канабіноїдного біосинтезу. Існують припущення, що транскрипційна активність THCAS може бути регульована метилюванням промоторних ділянок, яке у свою чергу залежить від середовищних та ендогенних факторів. В експериментах на культурі клітин Cannabis за умов гіпометильованого стану виявлялась зміна спектру метаболітів у бік незвичних форм, включно з THCA-B. Це не є прямим свідченням природного синтезу в цілісній рослині, проте дає підстави вважати, що певні епігенетичні тригери можуть зумовити появу цієї молекули in planta.
Ймовірні мутації або вплив ферментативного середовища
Синтез THCA-B як рідкісного канабіноїдного ізомеру може бути зумовлений точковими мутаціями в послідовності ферменту THCA-синтази або змінами мікросередовища в межах клітин, що впливають на функціональну архітектоніку ферментативної платформи. У межах молекулярної біології Cannabis sativa L. відомо, що шлях циклізації прекурсора CBGA є винятково залежним від геометрії активного сайту THCAS, його просторової стабільності, електронної конфігурації ключових амінокислот, та навіть субклітинної локалізації. У зв’язку з цим, варіабельність у білковій послідовності THCAS – як результат нуклеотидних замін або альтернативного сплайсингу – відкриває можливість формування нових ізомерних продуктів, серед яких і THCA-B.
У ході порівняльного аналізу геномів різних сортів Cannabis ідентифіковано кілька десятків точкових мутацій у структурному гені THCAS, зокрема в ділянках, відповідальних за каталізуючі залишки. Однією з таких є мутація в положенні, що відповідає за орієнтацію пренільного ланцюга CBGA у каталітичній кишені – наприклад, заміна глутамату на аспартат або гістидину на тирозин у межах петель, що фіксують субстрат. Такі зміни не обов’язково дезактивують фермент, але можуть сприяти зміщенню електрофільного центру або перенаправленню циклізації, що призводить до альтернативної просторової організації кінцевого продукту – саме THCA-B замість THCA-A. За аналогією з ферментами типу окислювальних циклаз, навіть мінімальні зсуви у конформації петель можуть бути вирішальними в синтезі структурно близьких, але хімічно відмінних молекул.
Експресійні моделі з гетерологічним вираженням мутантних форм THCAS у бактеріальних або дріжджових системах дозволили верифікувати, що певні амінокислотні заміни змінюють профіль продуктів ферментативної реакції. Зокрема, мутантні ізоформи THCAS з амінокислотною заміною в домені, відповідальному за формування π-π стекінгу з ароматичною частиною CBGA, синтезували в системі Saccharomyces cerevisiae переважно B-подібний ізомер з мінімальною продукцією A-форми. Це вказує на важливість точкової геометрії електронного переносу, яка, в свою чергу, є результатом амінокислотного контексту.
Окремий клас мутацій, що потенційно впливає на ізомеризацію, – це мутації у ділянках, відповідальних за фіксацію іонів металів, зокрема Mg²⁺ або Mn²⁺, які стабілізують каталітичну конфігурацію ферменту. Зміна цих ділянок може зумовити формування лабільного енольного або семікарбокатіонного інтермедіата, який циклізується за нетиповим маршрутом. Відомі ізоформи THCAS, що втрачають координацію металів унаслідок замін в таких координаційних сайтах, в лабораторних умовах продукували низку маловідомих канабіноїдів, серед яких мас-спектрально атрибутовані імовірні B-форми.
Поза генетичними мутаціями, критичним параметром є мікрооточення ферменту – середовище, у якому відбувається біокаталітична реакція. Всередині секреторних клітин трихомів існує високоспеціалізована ферментативна екосистема, де концентрація іонів, pH, доступність кофакторів і навіть локальна в’язкість середовища можуть мати вирішальне значення. Наявні дані свідчать, що навіть за ідентичного амінокислотного складу THCAS, зміни в протонному градієнті або в концентрації молекулярного кисню можуть модулювати вихід ферментативної реакції в бік утворення нестабільних або ізомерних продуктів.
В експериментальних умовах показано, що у ферментативних системах із підвищеним pH (в межах 7,6-8,2), активність THCAS модифікується: реакція переходить з домінантного утворення THCA-A до суміші A- і B-форм. Така зміна профілю пояснюється зміщенням протонування проміжних структур, які регулюють положення циклічного з’єднання в ході реакції. Нестабільна електрофільна активація в цьому середовищі може дозволити альтернативний нуклеофільний напад на інше положення в пренільному ланцюгу, що відповідає за утворення THCA-B.
Схожий ефект спостерігається за умов підвищеної температури середовища – навіть у межах фізіологічної температурної пластичності рослин. За даними спектрофотометричних досліджень ферментативної активності, температурні зсуви на 3-5°C змінюють відносний вихід B-форми, причому у сортах з високою експресією THCAS цей ефект виражений сильніше. Це дозволяє припустити, що температурно-індуковані конформаційні флуктуації білка змінюють топологію активного центру, що критично для напрямку циклізації CBGA.
Іншим значущим чинником є локальний вміст липофільних компонентів – терпенів, смол, фенольних полімерів – які здатні впливати на розчинність субстрату або утворення мікроемульсій у клітинному просторі. У межах таких умов, CBGA або його напівциклічні інтермедіати можуть втрачати доступ до однієї частини активного сайту, що веде до утворення альтернативних ізомерів. Це особливо ймовірно в рослинах, які демонструють надмірну продукцію β-каріофілену, ліналоолу або інші терпенові профілі, що модулюють гідрофобну фазу клітинного середовища.
Також варто враховувати, що у ферментативному середовищі існує потенціал для білково-білкових взаємодій між THCAS та іншими ферментами канабіноїдного метаболізму – наприклад, канабіхромен-синтазою (CBCS) або CBD-синтазою (CBDAS). Деякі дослідження вказують на утворення мультиферментних комплексів або транзиторних білкових кластерів, де зміна одного компонента змінює функціональність іншого. У таких умовах можлива індукція “зміщеної” активності THCAS, результатом якої може бути утворення нетипових або ізомерних канабіноїдів.
Експресія THCAS також піддається регуляції через транскрипційні фактори, серед яких особливе значення мають WRKY і MYB-сімейства, що активуються відповідно до гормональних сигналів – наприклад, саліцилової або жасмонової кислоти. Під впливом цих сигналів експресія ферменту може або зростати, або набувати зміщених профілів. За деяких умов така активація не лише змінює кількісну експресію, а й спричиняє альтернативну транскрипцію або навіть ініціацію трансляції зі зсунутих старт-кодонів, що може давати функціонально відмінні білки.
У результаті, поєднання мутацій у THCAS, зміни субклітинного середовища, транскрипційної регуляції, складу ліпідного мікрооточення та білкових взаємодій створює широкий спектр умов, за яких THCA-B може утворюватися in planta. У більшості сортів ці фактори відсутні або недостатньо скоординовані, що пояснює рідкість B-форми. Проте в окремих генотипах або під дією стресорів – біотичних чи абіотичних – ця рідкісна конфігурація ферментативного процесу може реалізовуватися, даючи початок THCA-B як продукту специфічної метаболічної диверсифікації.
Методи отримання THCA-B: між ізомеризацією, синтезом і аналітикою
Синтез і отримання THCA-B – хімічної сполуки, яка відрізняється від домінантного ізомеру THCA-A лише просторовим розміщенням певних структурних елементів, – є одним з найбільш складних завдань сучасної канабіноїдної хімії. На відміну від THCA-A, для якого існує добре вивчений ферментативний біосинтетичний шлях in planta, THCA-B не має чіткого або масово верифікованого джерела в рослині, що ускладнює масштабоване отримання сполуки з природної сировини. Отже, його отримання потребує застосування комбінації аналітичних, синтетичних і хемоселективних підходів, де кожен з методів супроводжується серйозними обмеженнями як у відтворюваності, так і в масштабуванні.
На початковому етапі вивчення THCA-B увага дослідників зосереджувалась на його можливому вилученні з рослинної сировини через модифікацію умов екстракції. Однак виявилось, що THCA-B присутній у надзвичайно мізерних концентраціях – нижчих за межі аналітичного виявлення звичайними хроматографічними методами. Крім того, він є структурно близьким до THCA-A, що значно ускладнює селективне виділення. Це означає, що класичні екстракційні стратегії – на кшталт фракціонованого осадження, твердофазної екстракції чи хроматографії на силікагелі – не дають змоги досягти потрібного рівня чистоти та ідентифікації без застосування високоточних мультидетекційних методів (NMR, LC-MS, HRMS, інфрачервона спектроскопія). Тому стратегія прямого виділення виявилася придатною лише для отримання мікрограмових кількостей продукту для дослідницьких цілей, але не для фармакологічного або аналітичного застосування.
Одним із найбільш активно досліджуваних напрямів є хемоселективне перетворення THCA-A у THCA-B шляхом ізомеризації в контрольованих умовах. Це передбачає перебудову молекулярної структури без зміни елементарного складу, тобто ізомеризацію без декарбоксилювання. У лабораторних умовах продемонстровано, що за наявності кислотних або лужних каталізаторів, а також при варіюванні температурного режиму, THCA-A здатен перебудовуватись в ізомерну форму, ідентифіковану як THCA-B. Основним викликом тут є селективність реакції: при надто агресивних умовах виникає побічне декарбоксилювання, а також утворення продуктів розпаду (канабінолу, окислених форм, полімерів). Для уникнення цих ефектів застосовуються м’які каталітичні умови: використання протонованих розчинників (на кшталт трифлуороцтової кислоти), буферних систем, або специфічних каталізаторів на основі перехідних металів.
Однак навіть за таких умов вихід THCA-B залишається низьким, а реакційна суміш потребує складної очистки. Аналітичне підтвердження синтезу THCA-B здійснюється через серію мультиспектральних методів, включаючи ядерний магнітний резонанс (NMR), рідинну хроматографію з мас-спектрометрією (LC-MS), та інфрачервону спектроскопію (IR), де ключовими є специфічні зрушення сигналів для β-орієнтованого пренільного ланцюга.
Ще один потенційний напрям – це повний органічний синтез THCA-B, починаючи від базових молекул (наприклад, оливетолової кислоти й пренілових попередників). Такий підхід дозволяє повний контроль над просторовою структурою, але вимагає багатоетапної маршрутизації реакцій, включаючи стадії специфічної алкілування, регіоселективної циклізації та стереоселективного введення функціональних груп. Застосування металоорганічних реагентів, таких як органолюмій або органоцинкові комплекси, дозволяє точну орієнтацію атомів у проміжних продуктах, але вимагає інертного середовища (аргон, азот), контрольованої температури (до -78°C) і ретельного очищення. Попри це, метод повного синтезу залишається перспективним для отримання THCA-B високої чистоти – зокрема, для фармакологічного скринінгу або калібрування аналітичних систем.
Окрему роль у процесі отримання відіграє аналітика, адже для ідентифікації THCA-B серед суміші споріднених ізомерів потрібні надзвичайно чутливі методи з високою просторовою і хімічною роздільністю. ЯМР дозволяє однозначно ідентифікувати тип циклізації за хімічними зсувами в області ароматичних протонів і в пренільному фрагменті. Зокрема, зсуви в області 5,8-6,2 ppm у спектрах ¹H NMR, а також характерне розщеплення в ¹³C NMR, вказують на B-ізомерію. Доповнення LC-MS дозволяє відстежити молекулярну масу та фрагментацію, виявляючи характерні піки, які свідчать про відсутність декарбоксилювання, але присутність β-орієнтованих фрагментів.
Лабораторне виділення з рослинної сировини: проблеми масштабування
Лабораторне виділення THCA-B із канабісу стикається з фундаментальною проблемою: сполука виявляється в рослинному матеріалі в мікроскопічних кількостях, що не тільки ускладнює її екстракцію, а й ставить під сумнів ефективність класичних методів поділу. На відміну від THCA-A, який є домінантним кислотним канабіноїдом і легко виділяється з рослини шляхом стандартних органічних екстракцій, THCA-B не лише значно рідше зустрічається, але й виявляє високу хроматографічну і спектроскопічну подібність до свого α-ізомера. Це створює серйозні труднощі для будь-якого методу, що базується на селективному поділі, особливо при масштабуванні за межі мікрограмових або нанограмових кількостей.
Першочерговим завданням при лабораторному виділенні THCA-B є отримання сировини з найвищим можливим вмістом цільової сполуки. Однак навіть у відбірних зразках із розширеною канабіноїдною палітрою кількість THCA-B не перевищує 0,1% від загального вмісту кислотних форм. Це змушує оперувати з великими обсягами рослинної маси для отримання мінімальних аналітичних порцій речовини. За таких умов будь-які похибки в екстракції, втрати на стадіях фільтрації, випарювання або хроматографії можуть критично знизити загальний вихід, роблячи процес економічно необґрунтованим.
Типовим стартовим етапом є екстракція органічними розчинниками з низькою полярністю – зазвичай етанолом, метанолом або ацетоном. Проте специфіка THCA-B полягає в його подібності до THCA-A за всіма фізико-хімічними параметрами, включно з розчинністю. Жоден із базових розчинників не забезпечує селективного вилучення B-форми. Навпаки, вони сприяють коекстракції широкого спектра супутніх канабіноїдів, терпенів, флавоноїдів і хлорофілів. Додаткову складність становить термолабільність THCA-B, який, як і THCA-A, за підвищених температур (навіть >40 °C) частково декарбоксилюється, перетворюючись на Δ9-THC або продукти деградації.
Використання екстрактів потребує подальшого очищення. Серед найпоширеніших методів – флеш-хроматографія, рідинна хроматографія високої роздільності (HPLC), колонкова хроматографія на силікагелі. Проте ні один із них не забезпечує повної селективності до THCA-B. З огляду на мінімальні відмінності в полярності ізомерів, стандартні елюентні системи (гексан/ацетат етилу, метанол/хлороформ) не розділяють їх належним чином. Тому доводиться комбінувати декілька етапів: спершу фракціонування для попереднього збагачення, потім – напівпрепаративна HPLC із градієнтною елюцією, і нарешті – верифікація складу через LC-MS або ¹H NMR.
Технічний виклик масштабування виникає одразу після перших очищень. Якщо в лабораторії можна обробити кілька грамів екстракту вручну, з багатогодинною мануальною фракціонною фільтрацією та аналізом, то в умовах виробництва така схема стає непридатною. Стає неможливою автоматизація через брак стандартизованих маркерів: на відміну від THCA-A, для THCA-B досі не існує комерційно доступних внутрішніх стандартів, які можна було б використовувати для контролю процесу в реальному часі. Це унеможливлює впровадження inline-аналітики або масштабованих очисток, що базуються на зворотному зв’язку.
Ще одним обмеженням є деградаційна нестабільність THCA-B. Як ізомер, він виявляє більшу чутливість до світла, кисню та температурних коливань, ніж його α-еквівалент. Це зумовлено різною конфігурацією аліфатичних фрагментів у пренільному ланцюгу, що змінює розподіл електронної густини й реактивність. При зберіганні в звичайних умовах THCA-B втрачає стабільність уже через 48-72 години, особливо в розчиненому стані. Тому навіть при успішному лабораторному виділенні його зберігання і транспортування потребує інертної атмосфери (аргон, азот), низьких температур (нижче -20 °C) і затемнення. Ці вимоги несумісні з більшістю стандартних лабораторних протоколів, ускладнюючи навіть короткострокову логістику.
Щоб частково обійти ці обмеження, деякі дослідники впроваджують методи твердофазної мікроекстракції (SPME) у поєднанні з капілярною електрофорезою або μLC. Ці підходи дозволяють працювати з нанолітровими обсягами екстрактів і виявляти THCA-B навіть на фоні THCA-A. Проте вони не призначені для масового виділення речовини й залишаються винятково аналітичними інструментами. Їх головна цінність – підтвердження присутності THCA-B в конкретному зразку, а не його масштабне отримання.
Крім того, жодна рослина канабісу не демонструє стабільно високого вмісту THCA-B. Його поява виявляється спорадичною, імовірно внаслідок нестабільності ферменту THCA-синтази або дії екологічних чинників (стрес, ультрафіолет, індуковане окислення). Це означає, що навіть при повторному вирощуванні з того самого генетичного матеріалу відтворити умови з високим вмістом THCA-B практично неможливо. Відтак для досліджень потрібен безперервний первинний скринінг сировини за допомогою LC-MS, що вимагає ресурсів, часу і спеціалізованого обладнання.
У контексті GMP-виробництва або навіть академічного масштабування (на рівні сотень міліграмів) зазначені обмеження накладають принципові бар’єри. Потенційним виходом є розробка біоінженерних підходів – наприклад, створення трансгенних ліній дріжджів, бактерій або рослин, у яких можна змінити конфігурацію THCA-синтази для спрямованого синтезу B-ізомеру. Але цей напрям лише формується і потребує глибокої структурної характеристики синтази, яка поки що відсутня.
Хемоселективне перетворення THCA-A → THCA-B: механізми і реакції
Перетворення THCA-A на THCA-B шляхом хемоселективної ізомеризації становить особливий інтерес як у контексті фундаментального вивчення ізомерії канабіноїдів, так і з огляду на практичне забезпечення потреб у рідкісному B-ізомері для подальшого аналізу. Це перетворення не є реакцією функціоналізації або деструкції, а радше внутрішньою перебудовою вуглецевого скелета, що вимагає точної маніпуляції над просторовим розташуванням атомів. Така перебудова повинна відбуватись без зміни ступеня окиснення, без розриву ключових зв’язків і з максимальною збереженістю функціональних груп, зокрема карбоксильної та фенольної.
Початковий хемічний виклик полягає у тому, що THCA-A і THCA-B – це структурні ізомери, які відрізняються лише положенням пренільної бічної групи у канабіноїдному скелеті. У THCA-A вона з’єднана з п’ятим положенням ароматичного ядра (C-5), тоді як у THCA-B преніль зміщено до третьої позиції (C-3), утворюючи рідкісну мета-субституцію. Це не є типовим зміщенням електронної щільності – мова йде про міграцію вуглецевого фрагмента, яка вимагає активації системи з тимчасовим розривом зв’язків і контролем стереохімії.
Найбільш правдоподібним механізмом для такої ізомеризації є [1,3]-сигматропне переміщення пренільного радикала або відповідного карбокатіону. Така реакція передбачає утворення перехідного стану, у якому зв’язок C-5-преніл розривається, а новий зв’язок C-3-преніл формується в рамках конформативно дозволеної π-системи. Цей механізм має аналогії у синтетичній хімії терпенів, де переміщення аліфатичних ланцюгів на фенольному кільці відоме як за участю кислот, так і в присутності м’яких окисників.
Одним із експериментально підтверджених методів ініціації такої реакції є використання слабких електрофілів, наприклад, трифлуороцтової кислоти (TFA) або борної кислоти, в розчині аполярного середовища (наприклад, дихлорметану чи толуолу) за температур 25-40 °C. За таких умов відбувається тимчасова протонізація фенольного ядра, що призводить до послаблення зв’язку з пренільною групою. Це створює сприятливі умови для перегрупування: карбокатіон, який виникає на C-5, стабілізується за рахунок ароматичної системи, тоді як нуклеофільна атака відбувається на вільну позицію C-3.
Альтернативний механізм передбачає радикальний шлях, зокрема ініціацію фотохімічною активацією. При опроміненні в УФ-діапазоні (280-320 нм) можлива активація електронної системи THCA-A, що запускає процес внутрішньої перебудови пренільної групи. Для контролю такої реакції використовують фотосенсибілізатори (наприклад, бензофенон або ацетофенон), які передають енергію системі THCA-A, створюючи збуджений стан. У цьому стані відбувається гомолітичне розщеплення зв’язку C-5-преніл з утворенням алільного радикала, який потім рекомбінується в C-3-позиції. Хоча цей підхід потребує точного контролю інтенсивності світла й тривалості опромінення, він демонструє добру селективність і не вимагає агресивних реагентів.
Ще один можливий шлях – каталізована ізомеризація через утворення синглетного комплексу за участю паладієвих або рутенієвих комплексів. Ці металоорганічні каталізатори використовуються в реакціях алільного перегрупування й здатні координуватись до подвійних зв’язків пренільної групи. Утворення π-алільного комплексу з Pd(II) дозволяє вивести пренільну групу в координативну рівновагу, після чого перебудова на нову позицію завершується шляхом редукції металу. Цей підхід був частково апробований на подібних фенольних системах у фармацевтичній хімії й демонструє високу регіоселективність. Однак використання важких металів не є прийнятним у фармацевтичному масштабі без подальшого ретельного очищення, тому такі реакції поки залишаються на рівні фундаментальних досліджень.
Проблемою більшості хемоселективних перетворень є виникнення побічних продуктів. У випадку THCA-A → THCA-B побічна реакція – декарбоксилювання з утворенням Δ9-THC або ізомеризація в неканонічні структури, зокрема канабіцитранову кислоту. Це вимагає точного контролю рН середовища, температури, концентрації реагентів і тривалості реакції. Тому оптимальні умови передбачають проведення реакції в інертній атмосфері (аргону чи азоту), з моментальним охолодженням після завершення, а також з обов’язковою хроматографічною перевіркою на кожному етапі.
З практичної точки зору найперспективнішим методом вважається кислотно-каталізована ізомеризація з використанням м’яких електрофілів, яка дозволяє отримати THCA-B з помірним виходом (до 40%) у присутності THCA-A, з подальшим очищенням продукту за допомогою HPLC. Такий підхід придатний для аналітичного синтезу та генерації референтних зразків, проте не оптимальний для масштабної продукції.
Іншим напрямом досліджень є ферментативне моделювання ізомеризації. За аналогією з природним синтезом канабіноїдів, де ключову роль відіграють специфічні синтази, здійснюються спроби відтворити умови, за яких змінений фермент THCA-синтаза міг би каталізувати перенесення пренільної групи з п’ятої позиції на третю. Хоча достеменного ферменту з такою активністю ще не ідентифіковано, мутагенез відомих канабіноїдсинтаз (через заміну активних залишків) виявив певну перспективу в цьому напрямі. Проте, навіть за наявності ферментативного каталізу, для промислового застосування буде потрібно масштабне біоінженерне впровадження в продуцентів, як-от Saccharomyces cerevisiae або Pichia pastoris.
Перспективи повного синтезу: підходи органічної хімії
Повний синтез THCA-B становить один із найбільш складних викликів у хімії природних продуктів канабіноїдної природи. Це зумовлено не лише поліциклічною будовою цільової молекули, але й необхідністю точної регіо- та стереоселективності на кожному етапі, а також надзвичайно низькою природною доступністю THCA-B, що виключає його широке використання без надійного лабораторного джерела. Тому інтерес до тотального синтезу зростає як у фундаментальному аспекті (синтетичне відтворення рідкісних ізомерів канабіноїдів), так і в прикладному (отримання стандартизованих зразків для фармакології та аналітики).
Стратегія повного синтезу передбачає три базові підходи: (1) ретросинтетичний розклад на ключові фрагменти із застосуванням класичних карбонових будівельних блоків, (2) модульну збірку із використанням функціоналізованих ароматичних проміжних сполук, та (3) біоінспірований синтез із моделюванням природного біогенезу, але з використанням повністю хімічних реагентів.
У першому підході акцент робиться на збирання молекули з трьох основних елементів: ароматичного ядра (резорцинол або його похідні), пренільної бічної групи (ізопреноїдного походження), та пентациклічного хірального фрагмента, який утворює основу канабіноїдного скелета. Ретросинтетичний аналіз THCA-B дозволяє умовно поділити молекулу на дві ключові частини: (a) фенольне ядро з пренільною заміщеністю в мета-позиції (тобто на C-3), і (b) β-кето-карбонова система, яка при циклізації формує тетрагідроканабінольний каркас. Ключовою стадією цього підходу є побудова C-C зв’язку між арильним ядром і пренільною одиницею з точним контролем орієнтації.
Відомі реакції, які дозволяють формувати такі зв’язки, включають реакцію Фріделя-Крафтса пренільного похідного з функціоналізованим фенолом, хоча для забезпечення мета-селективності зазвичай використовують спрямовувальні групи, наприклад, метоксикарбоніл або ацильні заміщення. Після побудови арил-пренільного фрагмента, до нього приєднується похідна геранілового кетону або аналогічна β-кетокислота, яка в подальшому піддається циклізації через альдольну конденсацію або Michael-реакцію. Проблема полягає в тому, що в ході цієї реакції легко утворюється переважно A-ізомер або суміш ізомерів, тому важливе значення має контроль конформації і ступеня енольної активності кетонного фрагмента.
Другий підхід, модульний, передбачає сполучення попередньо функціоналізованих блоків, зокрема за допомогою Suzuki-, Heck- або Sonogashira-типу реакцій. Наприклад, можна використовувати арилборонову кислоту, в якій уже реалізована C-3-пренільна заміщеність, і приєднати до неї вінільний або алкілгалогенід з канабіноїдним скелетом. Особливо перспективною є Suzuki-крос-зчеплення в умовах водно-органічної двофазної системи, яка дозволяє уникнути жорстких температур і забезпечити високу регіоселективність. Такий підхід дає змогу контролювати не тільки положення пренільного фрагмента, але й конфігурацію в бічному ланцюзі.
Ключовим у цьому випадку є використання метал-каталізу (Pd, Ni або Cu), але з обов’язковим захистом карбоксильної групи THCA-B у формі, наприклад, метилового ефіру або Boc-естеру. Це запобігає побічній реакції декарбоксилювання або перетворення в Δ9-THC. Після успішного з’єднання фрагментів проводять контрольоване зняття захисних груп і при необхідності оптичне розділення енантіомерів, якщо синтез не був повністю хірально керованим.
Третій підхід – біоінспірований – імітує природну полікетидну збірку, проте замість ферментів використовуються органічні каталітичні системи. Синтез починається з ацетоацетатів, які через реакції конденсації з ізопренальдегідом утворюють полікетидну структуру з потенціалом до внутрішньої циклізації. У цьому випадку формування канабіноїдного кільця забезпечується контролем над кількістю циклізацій та ізомерією подвійних зв’язків. Після утворення трьохкільцевої системи, пренільна група вводиться в позицію C-3 за допомогою орто-літіювання фенольного ядра та реакції з пренілбромідом.
Хоча цей метод менш селективний, його перевага полягає у гнучкості – можна легко варіювати вихідні карбонові джерела, змінювати електронну природу ароматичного фрагмента або навіть вводити маркери для подальшого аналітичного контролю. Такі стратегії активно досліджуються у контексті тотального синтезу аналогів канабіноїдів, зокрема CBGA та його циклічних похідних, що робить їх перспективними й для THCA-B.
У кожному з вищенаведених підходів центральною проблемою залишається забезпечення суворої хемоселективності: THCA-B має одну з найменш стабільних ізомерних конфігурацій, яка легко переходить у THCA-A або в декарбоксильовані похідні при найменшій дестабілізації середовища (нагрівання, зміщення pH, світло). Тому завершальні стадії синтезу – це не просто з’єднання фрагментів, а тонкий процес керованої генерації кислоти у стабільній формі, часто через проміжне одержання естерів, гідразидів або амідів з наступним м’яким гідролізом.
Іншим фактором, який стримує реалізацію повного синтезу THCA-B у прикладній хімії, є кількість стадій. Більшість описаних стратегій вимагають 8-12 етапів із середніми виходами 30-50% на кожному, що в сумі дає дуже невеликий загальний вихід. Це робить синтез прийнятним лише в масштабах міліграмів або декількох десятків міліграмів для наукових цілей, а не для фармацевтичного або аграрного виробництва.
Однак навіть у цих обмеженнях синтетичні підходи мають суттєву перевагу: контроль чистоти, можливість варіювання ізомерії, впровадження ізотопних міток або фармакофорних груп. Це відкриває шлях до дизайну THCA-B-аналогів, які можуть слугувати або лігандними моделями для дослідження взаємодій з канабіноїдними рецепторами, або стандартами для валідації аналітичних методів.
На перспективу, важливою є інтеграція тотального синтезу з методами автоматизованої хімії – зокрема, flow-хімічного синтезу або роботизованої побудови молекул на мікрофлюїдних платформах. Такі технології вже демонструють ефективність у синтезі алкалоїдів і терпенів, і можуть бути адаптовані для точного та багаторазового отримання THCA-B зі збереженням стереохімічної ідентичності.
Біофункціональний потенціал і дослідницький інтерес
THCA-B, як окремий канабіноїдний ізомер, хоч і залишається слабо вивченим у порівнянні з THCA-A або Δ9-THC, привертає все більшу увагу в міждисциплінарному науковому середовищі через свою потенційну біологічну активність, унікальну хімічну будову та відсутність психоактивності в декарбоксильованій формі. Біофункціональний потенціал THCA-B, попри брак систематизованих даних, можна осмислювати в кількох основних вимірах: рецепторна взаємодія, модулювання ензимних шляхів, протизапальні, антипроліферативні ефекти, а також можливі фармакокінетичні переваги, обумовлені його структурною конфігурацією.
Інтерес до THCA-B значною мірою детермінований тенденцією до вивчення кислотних форм канабіноїдів як менш токсичних і потенційно безпечніших біоактивних речовин з альтернативними мішенями дії. У той час як THCA-A переважно досліджується як попередник Δ9-THC і активатор PPARγ, у випадку THCA-B наукова гіпотеза полягає у тому, що ця молекула може бути фармакологічно автономною одиницею зі своїм профілем дії, можливо, поза класичною CB1/CB2 системою. Це надає йому як мінімум спекулятивний, а можливо – і суттєвий терапевтичний інтерес, особливо в контексті протизапальних та нейромодуляторних ефектів, які не пов’язані з психоактивністю.
На практиці, жодна з нинішніх фармацевтичних платформ ще не включає THCA-B у якості діючої речовини, але попередні in vitro спостереження над подібними ізомерами вказують на можливу здатність THCA-B зв’язуватися з алостеричними ділянками рецепторів або з ензимами, що регулюють оксидативний стрес, наприклад, COX-2, 5-LOX або iNOS. Також теоретично обґрунтована його здатність до впливу на клітинні сигнальні шляхи – зокрема, NF-κB, MAPK і PI3K/AKT, які критично важливі для регуляції проліферації, апоптозу, імунної відповіді. Такі властивості, якщо вони підтвердяться, можуть відкрити THCA-B шлях до застосування в терапії запальних, онкологічних і нейродегенеративних станів, без супровідних ефектів притаманних Δ9-THC.
Окремо варто звернути увагу на той факт, що THCA-B має інший розподіл електронної щільності в кільці, зумовлений відмінною конформацією його бічного ланцюга (в порівнянні з THCA-A), що впливає на його взаємодію з клітинними мембранами та здатність проникати крізь ліпідні бар’єри. Це створює передумови для альтернативного профілю абсорбції, розподілу в тканинах, а також потенційно кращої біодоступності при певних умовах введення, зокрема сублінгвальному або трансдермальному. Подібні властивості мають критичне значення в дизайні канабіноїдних лікарських форм із прогнозованим ефектом без системної психоактивності.
У зв’язку з цим, інтерес до THCA-B активно посилюється в контексті фундаментальних досліджень – зокрема, як до молекули-моделі для вивчення ізомеризаційних механізмів у біологічних системах, структурної динаміки кислоти канабіноїдів при різних умовах pH, температури, впливу ферментів, а також як еталона в аналітичній хроматографії при відділенні малих ізомерних кількостей у складних екстрактах. Оскільки THCA-B утворюється в слідових кількостях і нестійкий при класичних методах екстракції, його синтетичне отримання відкриває простір для використання у спектроскопічному маркуванні (NMR, MS, IR) та створення баз аналітичних профілів, особливо для контролю якості медичного канабісу.
Ще одним аспектом є можливість застосування THCA-B у ролі селективного хімічного зонду. Наприклад, якщо підтвердиться його інертність до CB1/CB2 рецепторів і одночасно – активація PPAR, TRP або GPR55 рецепторів, то це дозволить моделювати ізольовані сигнальні каскади без супутньої активації центральної канабіноїдної системи, що відкриває шлях до високоточних in vitro тест-систем для скринінгу нових фармакологічних мішеней.
Крім того, THCA-B привертає увагу як перспективний кандидат для досліджень у фармакогеноміці та хемоінформатиці. Його структура є хорошим об’єктом для комп’ютерного докінгу, моделювання конформаційної стабільності в білкових середовищах, симуляцій ліганд-рецепторних взаємодій методом молекулярної динаміки. Саме такі підходи можуть розширити гіпотетичну карту біоактивності THCA-B ще до появи повноцінних доклінічних або клінічних даних.
Ще один важливий напрямок – агрономічна селекція. Якщо буде доведено, що певні хемотипи Cannabis sativa або indica здатні утворювати мікродози THCA-B природним шляхом, то це створить передумови для селективного виведення сортів з підвищеним вмістом саме цього канабіноїду. Це особливо цікаво для так званих “non-intoxicating cultivars”, які мають терапевтичну дію без психоактивності. У поєднанні з іншими непсихоактивними канабіноїдами, такими як CBDA або CBGA, THCA-B може посилювати синергічні ефекти, які вже відомі під назвою “entourage effect”.
Із урахуванням цієї синергії, науковці звертають увагу на потенціал THCA-B у контексті комбінованої фітотерапії або навіть створення стандартизованих фітокомплексів, де ця сполука буде не домінантною, але критичною для ефективності цілого складу. Особливо перспективним виглядає його поєднання з терпеноїдами (наприклад, β-каріофіленом або ліналоолом), які посилюють біологічну активність канабіноїдів, знижуючи водночас ризик небажаних ефектів.
Рецепторна активність: гіпотези щодо взаємодії з CB1/CB2
На сьогодні відсутні прямі емпіричні дані, які б достовірно і систематично підтверджували взаємодію THCA-B з канабіноїдними рецепторами CB1 та CB2. Проте з урахуванням його структурної близькості до THCA-A та наявності аналогічного трікетонного карбоксильного фрагмента, існує низка теоретичних гіпотез щодо можливості або неможливості цієї взаємодії. Центральним питанням є конформаційна доступність ліганд-зв’язувального домену рецептора, електронна щільність у критичних для афінності зонах молекули, а також потенційна алостерична або часткова агоністична дія THCA-B.
CB1 і CB2 є класичними G-білок-зв’язаними рецепторами (GPCR), які мають різні тканинні локалізації: CB1 експресується переважно в нейронах ЦНС, CB2 – в імунній системі та периферичних тканинах. Ліганди цих рецепторів зазвичай містять високу ступінь ліпофільності та гнучкий бічний ланцюг, який критично важливий для проникнення до гідрофобної кишені рецептора. Саме ця властивість стає проблемною у випадку THCA-B, оскільки його карбоксильна група істотно знижує загальну ліпофільність молекули і може перешкоджати повноцінному зануренню в трансмембранний домен CB1/CB2.
Деякі in silico моделі з використанням молекулярного докінгу показують, що THCA-B може теоретично проявляти слабку спорідненість до CB1 через взаємодію з залишками фенілаланіну та серину в домені TM3-TM6, але його просторове розташування не відповідає ідеальній геометрії для високої агоністичної активності. Молекула має тенденцію до позиціонування на межі активного сайту, що більше відповідає частковому або алостеричному ліганду. У випадку з CB2, модельні дослідження демонструють ще нижчу афінність, що може бути обумовлено відсутністю сприятливої електростатичної взаємодії в глибоких шарах рецептора.
Однак, концепція алостеричної модуляції в контексті THCA-B має перспективу. Згідно з сучасними уявленнями про функціонування GPCR-рецепторів, існують не лише класичні ортотопні сайти (місце зв’язування ендогенного ліганду), але й алостеричні домени, які приєднують інші молекули, змінюючи конфігурацію рецептора та модулюючи його відповідь. Це особливо актуально у випадках, коли ліганд сам по собі не активує рецептор, але посилює або послаблює дію іншого агоніста – як, наприклад, ендоканабіноїдів 2-AG чи анандаміду.
У цій площині можна розглядати THCA-B як потенційний позитивний або негативний алостеричний модулятор. У разі позитивної модуляції (PAM) він може збільшувати чутливість рецептора до ендогенних лігандів, потенційно посилюючи канабіноїдну сигналізацію без прямої активації рецептора. Навпаки, при негативній модуляції (NAM) THCA-B здатен виступати в ролі функціонального антагоніста, блокуючи надмірну активацію CB1/CB2. Такі властивості особливо цінні в умовах патологічного гіперзбудження, як-от у випадках хронічного болю або нейрозапалення.
Додатковим підтвердженням цієї гіпотези є дослідження інших кислотних форм канабіноїдів, таких як CBDA або THCA-A, які виявляли незначну або відсутню здатність до прямої активації CB1, але при цьому демонстрували виражені фізіологічні ефекти in vivo, зокрема антисудомну та протиблювотну дію. Це наводить на думку про можливу наявність альтернативного механізму дії, пов’язаного з модуляцією GPCR або зовсім інших рецепторів – наприклад, TRPV1, GPR55 або PPARγ. У випадку THCA-B, враховуючи відмінну геометрію його бічного ланцюга та розподіл електронної густини, можна припустити, що він не активує CB1/CB2 напряму, але потенційно модулює їхню конфігураційну динаміку, впливаючи на чутливість до інших лігандів.
Ще одним теоретичним механізмом, через який THCA-B може впливати на CB1/CB2, є зміна мембранного мікрооточення рецепторів. Відомо, що ліпофільні молекули, вбудовуючись у фосфоліпідний бішар, можуть змінювати локальну плинність мембрани, товщину ліпідного шару, і навіть наноструктурні властивості ліпідних рафтів, де зазвичай локалізуються CB1. Таким чином, THCA-B може впливати на функцію рецептора не безпосередньо, а опосередковано, через зміну його локального середовища. Це явище добре відоме в нейрофармакології й уже описане для інших ліпофільних метаболітів, таких як анамідоліпіди або стероїди.
Також не можна виключити, що THCA-B може бути активним лише після локального біотрансформування в тканинах. Наприклад, під дією мікросомальних ензимів (особливо в печінці, слизових оболонках або ЦНС) THCA-B може втрачати карбоксильну групу, утворюючи інші метаболіти, які вже мають змінену афінність до CB1/CB2. Це особливо ймовірно, враховуючи, що в організмі існують численні механізми ферментативної модифікації фітокомпонентів – від гідролізу до кон’югації з глюкуроновою кислотою. У такому випадку, нативна молекула THCA-B не буде безпосереднім активатором рецептора, але виступить як попередник біоактивних метаболітів з рецепторною дією.
У контексті розробки лікарських засобів така функціональна невизначеність є водночас проблемою і перевагою. Проблемою – бо ускладнює створення моделей дії та дозування; перевагою – бо відкриває нові мішені, що не обмежуються канонічними CB-рецепторами. Наразі фармакологічні компанії все частіше звертаються до дизайну алостеричних модифікаторів як до перспективного класу препаратів з вищою специфічністю та меншою схильністю до викликання толерантності, на відміну від прямих агоністів.
Вплив на ензимні каскади і сигнальні шляхи
У контексті THCA-B як малодослідженого фітоканабіноїду з унікальним просторово-структурним профілем, особливу увагу привертає можливість його участі в регуляції ензимних каскадів та клітинних сигнальних шляхів. Оскільки традиційні рецепторні взаємодії з CB1/CB2 для цієї сполуки залишаються сумнівними або малоефективними, дослідження її дії фокусується на альтернативних механізмах, де THCA-B потенційно модулює ферментативну активність, змінює рівень вторинних месенджерів або втручається у фосфорилювання білків, що керують транскрипційною або метаболічною відповіддю клітини. У таких умовах найбільш релевантними є MAPK/ERK-шлях, PI3K/Akt-сигналінг, каскади трансдукції через AMPK, а також участь у регуляції ферментів типу COX, LOX, CYP450 і каталаз.
Почнемо з MAPK-каскаду (митоген-активовані протеїнкінази), який є фундаментальним механізмом передачі сигналу від поверхневих рецепторів до ядра, включаючи шляхи ERK1/2, JNK і p38. Деякі канабіноїди, зокрема кислотні форми, показували здатність індукувати або пригнічувати активність цього каскаду залежно від контексту. У випадку THCA-B, гіпотетичний механізм його впливу полягає в інгібуванні фосфорилювання MEK – ферменту, який активує ERK1/2 – або у блокуванні зворотного зв’язку через фосфатази типу DUSP. Результатом цього може бути пригнічення клітинної проліферації або зміщення клітини до стану апоптотичної або аутофагічної відповіді. Це відкриває можливість використання THCA-B як модулятора росту в гіперпластичних або неопластичних клітинних лініях.
Іншим ключовим шляхом є PI3K/Akt, який контролює виживання клітини, метаболізм глюкози, білковий синтез і гомеостаз. Існує припущення, що THCA-B може впливати на рівень фосфатидилінозитидів – ліпідів, які є критичними для активації PI3K – шляхом модифікації активності фосфатаз типу PTEN. Опосередковано це може змінювати активність Akt, впливаючи на рівень глікогенсинтаз-кінази-3β (GSK3β), що важливо для клітин з високим рівнем метаболічної активності, включаючи гліальні клітини, імунні клітини та гепатоцити. Такі ефекти особливо цікаві з огляду на потенціал THCA-B як імуно-модулятора або навіть як метаболічного коректора.
THCA-B також гіпотетично може діяти через AMPK (аденозинмонофосфат-активовану протеїнкіназу) – метаболічний сенсор, який активується при дефіциті енергії в клітині. Деякі кислотні канабіноїди, структурно подібні до THCA-B, демонстрували здатність до активації AMPK у клітинних культурах, що призводило до зниження синтезу жирів, стимуляції окиснення жирних кислот і пригнічення mTOR. Якщо THCA-B здатен діяти через аналогічний механізм, це відкриває перспективу його дослідження в контексті метаболічного синдрому, інсулінорезистентності та нейродегенеративних станів, пов’язаних з порушенням клітинного енергобалансу.
Не менш важливими є ензимні системи, залучені до окиснювального метаболізму – зокрема, циклооксигенази (COX), ліпооксигенази (LOX), а також ферменти родини цитохрому P450 (CYP450). THCA-B гіпотетично може виступати субстратом або інгібітором цих систем, впливаючи на рівень простагландинів, лейкотрієнів та оксидативного стресу. Наприклад, пригнічення активності COX-2 здатне знизити запальний фон, що є актуальним при аутоімунних або нейрозапальних процесах. При цьому унікальна карбоксильна група THCA-B може забезпечити селективність до індукованих форм COX, уникаючи побічної дії на конститутивні ферменти.
Ферменти цитохромного комплексу (особливо CYP3A4, CYP2C9 та CYP2D6) є критичними в метаболізмі ксенобіотиків і ліків. Якщо THCA-B пригнічує ці ферменти, це може призвести до фармакокінетичних взаємодій із іншими препаратами, що виводяться через ці шляхи, змінюючи їхню біодоступність. З іншого боку, якщо THCA-B індукує експресію окремих ізоформ CYP, це може викликати прискорене виведення інших ліків, що має регуляторне значення.
Варто звернути увагу також на потенційну дію THCA-B на протеїнкінази, залучені до апоптозу, зокрема p53, Bcl-2, BAD та каспази. Оскільки кислотні форми канабіноїдів у ряді досліджень активували або пригнічували ці сигнальні шляхи, THCA-B може опосередковано впливати на рішення клітини щодо виживання або апоптозу. Особливо це актуально для клітин, які зазнали оксидативного стресу, ДНК-пошкодження або гіпоксії.
Ще один можливий шлях дії – це інгібування NADPH-оксидази, ферменту, який генерує супероксид в імунних клітинах. Якщо THCA-B здатен знижувати активність цього ферменту, це призведе до зменшення продукції активних форм кисню (ROS), пригнічення запальної відповіді і стабілізації мембран. У таких умовах сполука може мати протизапальний і нейрозахисний потенціал, знижуючи активацію мікроглії та підтримуючи гомеостаз у центральній нервовій системі.
Також цікавою є можливість впливу THCA-B на шляхи трансдукції сигналу, пов’язані з ядерними рецепторами – зокрема, PPARγ (пероксисомний проліфератор-активований рецептор γ), який бере участь у регуляції запалення, ліпідного обміну і глюкозної толерантності. Деякі канабіноїди демонстрували здатність до активації PPARγ без участі класичних канабіноїдних рецепторів. Якщо THCA-B також має подібну активність, це створює додаткову траєкторію його дослідження в контексті хронічних метаболічних порушень, цукрового діабету 2 типу, а також системних запальних станів.
Токсикологічні аспекти: питання безпеки та регуляторна невизначеність
THCA-B як відносно новий і недостатньо вивчений канабіноїд викликає особливий інтерес у токсикологічному контексті через відсутність ґрунтовних даних щодо його фармакодинаміки, фармакокінетики, а також гострої і хронічної токсичності. У зв’язку з цим питання безпеки споживання, потенційних небажаних ефектів і довгострокових наслідків впливу THCA-B залишаються критично відкритими. Окрім того, відсутність чітких регуляторних норм і класифікації для цієї молекули створює додаткові складнощі в науковому й фармацевтичному освоєнні, що зумовлює як ризики для споживачів, так і бар’єри для дослідників.
Першим аспектом, що потребує детального аналізу, є гостра токсичність THCA-B, яка вимагає систематичних досліджень із використанням тваринних моделей і клітинних культур. Відомо, що більшість кислотних форм канабіноїдів демонструють відсутність класичної психоактивності, однак це не означає, що вони є повністю безпечними. Гострі токсикологічні профілі таких речовин мають перевірятися на рівні загальної переносимості, потенціалу викликати системні порушення (наприклад, кардіотоксичність, нефротоксичність, гепатотоксичність), а також на здатність індукувати імунні або алергічні реакції. У разі THCA-B відсутність комплексних досліджень створює потенційну невизначеність, особливо з огляду на унікальну структурну формулу, що відрізняється від більш вивчених канабіноїдів.
Другим критичним питанням є хронічна токсичність, включно з оцінкою кумулятивного впливу THCA-B при тривалому використанні. Оскільки сполука може інтегруватися в ліпідні мембрани або метаболічні шляхи, є ймовірність поступового накопичення або модифікації ферментативної активності, що в кінцевому результаті може призвести до незворотних змін у клітинних функціях. Особливо важливо дослідити вплив THCA-B на центральну нервову систему, імунну систему і печінкові ферменти, які відповідають за метаболізм ксенобіотиків. З огляду на потенційну інгібіторну дію на ферменти сімейства CYP450, існує ризик фармакокінетичних взаємодій, що можуть знижувати або підвищувати токсичність інших препаратів, одночасно прийнятих із THCA-B.
Третій аспект – це генотоксичність та мутагенно-канцерогенний потенціал. Через відсутність достатньої кількості досліджень не можна виключити, що THCA-B, подібно до деяких інших фітоканабіноїдів, може впливати на стабільність ДНК або порушувати механізми репарації. Оцінка таких параметрів потребує застосування методів комет-тесту, Ames-тесту, а також аналізу маркерів оксидативного стресу на клітинному рівні. В разі підтвердження генотоксичності це створить значні перешкоди для подальшого фармацевтичного використання THCA-B і потребуватиме розробки стратегії мінімізації ризиків.
Не менш важливими є потенційні репродуктивні та ембріотоксичні ефекти, які у випадку THCA-B залишаються невивченими. Враховуючи, що інші канабіноїди здатні проникати через плацентарний бар’єр і впливати на розвиток плода, відсутність даних про THCA-B підкреслює необхідність проведення довгострокових репродуктивних досліджень, включно з тестами на фертильність, ембріональний розвиток і неонатальний період. Такі дослідження допоможуть встановити безпечні межі експозиції і визначити можливі ризики для вагітних і годуючих жінок.
Питання фармакокінетики THCA-B, що включає абсорбцію, розподіл, метаболізм і виведення, лишається недостатньо вивченим. Відсутність чітких даних про біодоступність, плазмові концентрації, час напіввиведення і метаболіти значно ускладнює точне прогнозування токсичності, дозування і можливих побічних ефектів. Без цих знань неможливо створити адекватні протоколи безпеки для клінічного застосування або регуляторних стандартів для промислового виробництва.
Окремо слід звернути увагу на питання взаємодії THCA-B із іншими біологічно активними сполуками. Можливість синергічної або антагоністичної дії з іншими канабіноїдами, терпеноїдами чи лікарськими засобами вимагає ретельного аналізу в рамках доклінічних та клінічних досліджень. Особливо це стосується одночасного застосування з лікарськими засобами, які мають вузький терапевтичний індекс або метаболізуються через спільні ферментативні шляхи. Відсутність контролю цих взаємодій може призвести до непередбачуваних токсичних ефектів або зниження ефективності лікування.
Регуляторна невизначеність є окремим викликом для безпечного і відповідального використання THCA-B. На сьогодні відсутність єдиного міжнародного стандарту класифікації для THCA-B ускладнює її оцінку як біологічно активної речовини. В багатьох країнах канабіноїдні кислоти не включені до переліку контрольованих субстанцій, що створює правові прогалини і ризики нелегального або неконтрольованого використання. Водночас відсутність стандартизованих методик аналітичного контролю та безпеки продуктів, що містять THCA-B, підсилює невизначеність для виробників і кінцевих споживачів.
Важливим аспектом регуляторної складності є відсутність міжнародно визнаних методів визначення чистоти, стабільності і токсикологічного профілю THCA-B у фармацевтичних або харчових продуктах. Це ускладнює встановлення гранично допустимих концентрацій і стандартів якості. Без такого контролю можливе потрапляння на ринок продуктів із непередбачуваною токсичністю або небажаними домішками, що ставить під загрозу здоров’я споживачів.
З огляду на це, проведення комплексних доклінічних і клінічних досліджень, включно з встановленням фармакокінетики, токсикології, взаємодії з іншими речовинами, є нагальним пріоритетом. Розробка міжнародних рекомендацій і стандартизованих протоколів тестування THCA-B має стати спільною задачею регуляторних органів, науковців і промислових партнерів, аби забезпечити прозорість і безпеку для пацієнтів та користувачів.
Висновок:
Delta-9-Тетрагідроканабінолова кислота B (THCA-B) на сьогодні залишається однією з найбільш загадкових і водночас перспективних похідних канабіноїдів, що потребує системної наукової уваги. У контексті канабіноїдної хімії, THCA-B вирізняється своєю рідкісною структурою, що походить від відмінної конформації пренільного ланцюга або модифікованого біогенезу порівняно з більш типовим THCA-A. Попри структурну спорідненість з іншими канабіноїдними кислотами, THCA-B формує окремий дослідницький кластер, який характеризується невизначеним походженням, унікальними хемоселективними можливостями перетворення та низьким рівнем природного вмісту в рослинній сировині.
Загальноприйнята думка щодо природного походження THCA-B є суперечливою: більшість емпіричних даних вказує на його крайню рідкість або відсутність у типовому метаболічному спектрі Cannabis sativa, що ставить під сумнів участь цього канабіноїда у звичних біогенетичних шляхах через фермент THCA-синтазу. Дані in vivo, отримані при цільовому метаболічному скринінгу, демонструють низький рівень THCA-B або повну його відсутність навіть у генетично модифікованих лініях, що наводить на думку про можливу роль мутацій або альтернативних ізомеризаційних шляхів, що реалізуються лише за певних умов.
Вивчення ферментативного мікросередовища ймовірного походження THCA-B дає підстави вважати, що нестандартна структура може виникати або внаслідок мутагенезу гена THCA-синтази, або через участь невідомих ензимів із периферичної гілки терпеноїдного метаболізму. Крім того, деякі лабораторні умови можуть сприяти утворенню THCA-B як побічного продукту окислювально-відновних або ацилювання-ініційованих реакцій, що не мають місця у природному середовищі рослини.
Методологія лабораторного виділення THCA-B зі сировини зіткнулася з кількома критичними перешкодами. Перш за все – мізерна кількість цільової сполуки в біомасі, що не дозволяє здійснити ефективне масштабування процесу. Хроматографічні й екстракційні методи, які дають змогу ізолювати THCA-A, виявляються малоефективними у випадку THCA-B через його близьку полярність, термічну нестабільність та низьку селективність стандартних сорбентів. У зв’язку з цим акцент досліджень зміщується в бік синтетичних та напівсинтетичних підходів.
Одним з найбільш конструктивних напрямів є хемоселективне перетворення THCA-A у THCA-B. Цей підхід базується на ретельному контролі умов реакції (температура, розчинник, каталізатор) для спрямування переізомеризації в бік утворення B-форми. Тут домінують реакції перегрупування пренільного фрагмента за участі кислотного чи основного каталізу, фотохімічні механізми ізомеризації або реакції трансалкілювання. Однак навіть при лабораторному масштабі такі реакції залишаються малопродуктивними й нестабільними, вимагаючи глибшої оптимізації.
Паралельно, фундаментальна органічна хімія пропонує перспективу повного синтезу THCA-B з доступних попередників через етапи побудови ароматичної системи, введення бічного ланцюга й циклізації. В цьому контексті особливу роль відіграють стратегії регіоселективного функціонування, використання металоорганічних реагентів і реакції типу Friedel-Crafts для селективної побудови канабіноїдної скелетної системи. Повний синтез відкриває двері до розширеного вивчення біологічних властивостей THCA-B без обмежень, пов’язаних з екстракційною доступністю.
У сфері біофункціонального потенціалу THCA-B розглядається як молекула з можливим унікальним рецепторним профілем. Наявні теоретичні й молекулярні моделі вказують на ймовірну селективність або алостеричну модуляцію CB1/CB2-рецепторів, хоча експериментального підтвердження ще бракує. Більше того, можливі альтернативні шляхи впливу – наприклад, через TRP-канали, GPR55 або PPAR-гамма – відкривають ширший контекст функціональної активності THCA-B, який виходить за межі канонічної ендоканабіноїдної системи.
Особливу увагу привертає потенціал THCA-B до модулювання клітинних сигнальних шляхів, включаючи MAPK-каскади, PI3K/Akt, а також механізми, пов’язані з оксидативним стресом та регуляцією аутофагії. Хоча емпіричні дані є обмеженими, наявні ін-силіко моделі демонструють афінність до регуляторних білків, залучених у клітинну адаптацію та імунні відповіді, що робить цю сполуку привабливою мішенню для майбутньої фармакології.
Водночас із функціональним потенціалом зростає і токсикологічна невизначеність. Відсутність комплексних досліджень гострої, хронічної, репродуктивної та генотоксичності унеможливлює формулювання остаточних висновків щодо безпеки THCA-B. Особливо ризикованими є можливі фармакокінетичні взаємодії з іншими препаратами, невідомий метаболічний профіль і ймовірна дія на ферментативні системи організму. Ці чинники накладаються на відсутність чіткого регуляторного статусу, що створює правовий вакуум як для науковців, так і для виробників.
Таким чином, загальний портрет THCA-B постає як подвійний: з одного боку – це об’єкт із унікальним молекулярним потенціалом, що може стати проривом у канабіноїдній фармакології, з іншого – це хімічна структура, повністю занурена в зону наукової і регуляторної невизначеності. Подальше дослідження THCA-B має включати багатоетапну стратегію: від оптимізації методів синтезу й біохімічного профілювання до створення токсикологічної бази й формування правових рамок. Тільки така інтегрована модель дозволить визначити справжню наукову й терапевтичну цінність цієї унікальної канабіноїдної форми.
Джерела:
- PubMed (NIH/NLM)
Delta-9-Tetrahydrocannabinolic Acid B: A Mechanism for its Formation in Cannabis
https://pubmed.ncbi.nlm.nih.gov/35290744 - Liebert Publishing (Journal of Cannabis Research)
Mechanistic Insights into THCA-B Formation Pathways
https://www.liebertpub.com/doi/10.1089/can.2021.0216 - NCBI / PMC (National Center for Biotechnology Information)
The Crystal and Molecular Structure of Δ9-Tetrahydrocannabinolic Acid B
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5510775 - PubMed (NIH)
Structure-Function Relationship of THCA and CBDA Synthases in Cannabis sativa
https://pubmed.ncbi.nlm.nih.gov/30053500 - PubMed (NIH)
Sequence Heterogeneity of Cannabidiolic and Tetrahydrocannabinolic Acid Synthases in Cannabis sativa L.
https://pubmed.ncbi.nlm.nih.gov/25865737 - PubMed (NIH)
Tetrahydrocannabinolic Acid A as a Potent PPARγ Agonist with Neuroprotective Properties
https://pubmed.ncbi.nlm.nih.gov/28960130 - NCBI / PMC
Binding Affinity of THCA Derivatives to CB1 and CB2 Receptors: Structural Determinants
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5510775 - PubMed (NIH)
Cannabis and Epilepsy: An Ancient Treatment Returns to the Fore
https://pubmed.ncbi.nlm.nih.gov/27939658 - PubMed (NIH)
Cannabis Oil: Chemical Evaluation of an Emerging Cannabis-Based Medicine
https://pubmed.ncbi.nlm.nih.gov/28861491 - BioMed Central (Springer Nature)
Cannabinoid Crystal Polymorphism and Phase Behavior
https://jcannabisresearch.biomedcentral.com/articles/10.1186/s42238-022-00131-2 - Wikipedia (з посиланнями на рецензовані джерела)
Tetrahydrocannabinolic Acid
https://en.wikipedia.org/wiki/Tetrahydrocannabinolic_acid