У межах хімії природних сполук існує категорія молекул, про які наука знає не тому, що вони масово поширені або демонструють очевидний ефект, а тому, що їх наявність – це виклик самій логіці системного мислення. Однією з таких молекул є дельта-9-тетрагідроканабінолова кислота-C4 (THCA-C4) – сполука, яка виявляється лише у слідових кількостях, однак уже самим своїм існуванням ставить низку питань, на які сьогодні не існує вичерпних відповідей. Її поява в хеміотипі Cannabis sativa, рідкість, варіативність і структурна спорідненість з основними канабіноїдами вказують на її ймовірну біологічну й біохімічну функцію, хоча жодна з них ще не доведена експериментально. THCA-C4 – це не просто похідна основної тетрагідроканабінолової кислоти; це гомолог з модифікованим бічним алкільним ланцюгом, який, можливо, є маркером глибших метаболічних процесів, що лишаються невидимими для більшості аналітичних систем.
У традиційному описі канабіноїдів основну увагу зосереджено на так званих мажорних компонентах – THCA-A, CBDA, CBGA, а також їх декарбоксильованих формах. Проте науковий інтерес дедалі більше зміщується в бік мікрокомпонентів, які за нормальних умов не мають вираженої активності, але можуть виконувати регуляторні, сигнальні або навіть інгібіторні функції в межах більш складних хемоекосистем. Саме такими є представники канабіноїдного ряду з незвичними довжинами бічного ланцюга – зокрема гомологи з бутильною (C4), пропільною (C3), або навіть гептильною (C7) заміною. Серед них THCA-C4 вирізняється тим, що має найвищий рівень структурної подібності до THCA-A, але при цьому модифікований так, що здатен мати принципово інші фармакокінетичні параметри, рецепторну афінність і метаболічну долю.
Наявність цієї сполуки не була виявлена у перших ізотопних дослідженнях Cannabis, її не фіксували в класичних спектрах стандартних хемотипів. Проте з появою високочутливих мас-спектрометрів і покращених умов екстракції, дослідники почали фіксувати незначні піки, які не відповідали жодному з відомих стандартів. Подальша ідентифікація показала, що ці сигнали походять від гомологів основних кислотних канабіноїдів, серед яких був і THCA-C4. Його точна концентрація у висушеному матеріалі зазвичай не перевищує 0,01-0,05% від загальної маси канабіноїдної фракції, що робить його практично недоступним для прямої біологічної оцінки без спеціального синтезу або масштабного біоекстрагування. І все ж наявність такої структури не може вважатися випадковістю. У біохімії випадковості рідко залишаються непоміченими.
THCA-C4 унікальний тим, що належить до групи речовин, які є наслідком природної хемогенетичної варіабельності. Умовно кажучи, це побічний продукт дії ферментів, які зазвичай беруть участь у синтезі THCA-A, але за змін умов або субстратної доступності можуть каталізувати утворення споріднених сполук. Наприклад, якщо у клітині присутній не стандартний геранілпірофосфат, а альтернативний прекурсор із зміненим вуглеводневим ланцюгом (наприклад, з чотирьох замість п’яти атомів вуглецю), кінцевий продукт синтази також відрізнятиметься – у результаті й виникає C4-гомолог. У лабораторних умовах цей процес складно відтворити, але на рівні клітинної біосинтетики він цілком ймовірний. І саме такі мікрошляхи, що утворюють THCA-C4, можуть бути вікном у розуміння пластичності канабіноїдного біосинтезу в цілому.
Ще один аспект, який надає THCA-C4 особливої цінності, полягає в його потенціалі як хемомаркера. У системах, де мікрокомпоненти виконують роль сигнальних індикаторів внутрішньої хімічної логіки організму, навіть слідова кількість специфічного гомолога може свідчити про стан метаболічної активності, стресу, мутації або зміни умов середовища. Деякі дослідники вже сьогодні розглядають THCA-C4 як можливий біомаркер нетипових або цілеспрямовано модифікованих хемотипів Cannabis, що виникли внаслідок селекції, біотехнологічної інженерії або адаптації до екологічного тиску. У цьому сенсі THCA-C4 може бути корисним не лише для фармакологів, а й для ботаніків, біоінформатиків і агрономів.
Однак науковий виклик полягає не лише у виявленні або класифікації цієї молекули. Важливішим є питання її функціонального значення. Чи є вона випадковим продуктом метаболічного “шуму” – або ж виконує специфічну, хоч і неочевидну функцію? У природі рідко трапляються речовини, які не мають жодного біологічного сенсу. Навіть транзитні або деструктивні молекули часто служать проміжними агентами в складних сигнальних каскадах. У випадку THCA-C4 ми маємо справу з речовиною, яка за структурою цілком здатна зв’язуватись із канабіноїдними рецепторами, потенційно змінюючи їх конфігурацію, але водночас – з молекулою, яка не має підтвердженого активного впливу на людину або тваринні моделі. Це парадоксальна ситуація, у якій наукова логіка наштовхується на брак інструментальних доказів.
Іще більш ускладнює дослідження той факт, що THCA-C4 надзвичайно нестабільна у звичних лабораторних умовах. Деякі спостереження свідчать про її часткову деградацію або перетворення вже під час екстракції з рослинного матеріалу. Залежно від типу розчинника, температури, pH та навіть тривалості процедури, ця молекула може або зникати безслідно, або переходити в інші форми. Це означає, що більшість дослідників навіть не здогадуються, що вже працювали з THCA-C4 – просто не змогли її зафіксувати. Тому постає завдання не лише пошуку, а й реконструкції її втрачених слідів у вже зібраних аналітичних масивах даних. У цьому контексті можна говорити про потребу у нових типах стандартів для високоточного ідентифікування малих гомологів канабіноїдів, серед яких THCA-C4 – лише верхівка можливого підводного шару.
Крім аналітичної проблематики, існує також епістемологічний вимір цієї молекули. THCA-C4 – це не лише об’єкт дослідження, але й виклик уявленню про межі знання в галузі природної хімії. У традиційній науковій парадигмі речовини класифікуються за принципом ефективності, кількісної присутності або прямої користі. Але останні десятиліття довели, що наукова цінність часто лежить за межами утилітарних категорій. Малопоширені речовини можуть мати величезний потенціал у створенні нових підходів до розуміння біохімії, генетичної регуляції або молекулярної еволюції. У цьому сенсі THCA-C4 виступає як інтелектуальний фокус – спонука до переосмислення моделей канабіноїдного синтезу, взаємодії ферментів, структури клітинного середовища та принципів екстракції.
Що таке THCA-C4
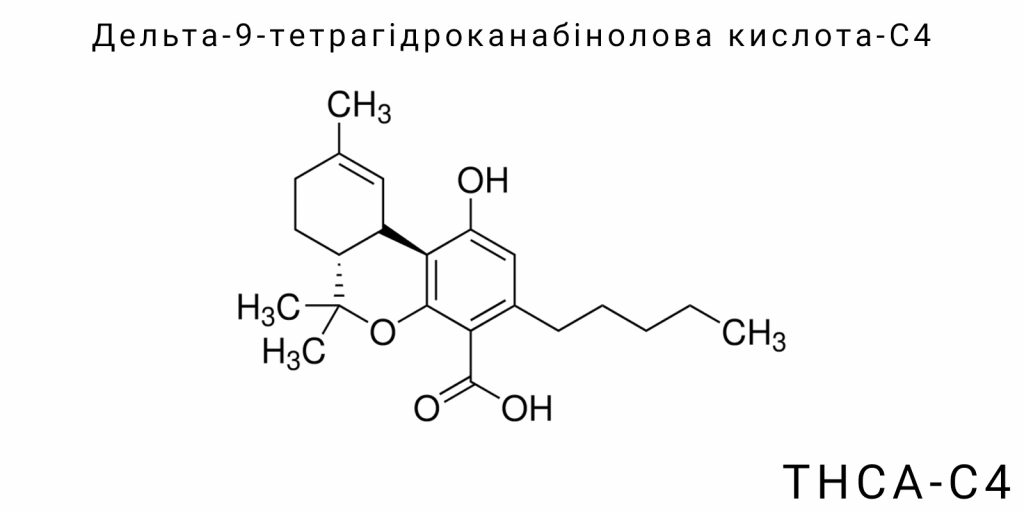
Дельта-9-тетрагідроканабінолова кислота-C4 (THCA-C4) належить до групи кислотних канабіноїдів – природних фенольних сполук, що продукуються рослиною Cannabis sativa. Відмінною рисою THCA-C4 є її бічний алкільний ланцюг, який має довжину чотири атоми вуглецю (бутильний ланцюг), тоді як у більш поширеного THCA-A цей ланцюг складається з п’яти атомів вуглецю (пентильний ланцюг). Ця, на перший погляд, незначна модифікація ланцюга суттєво впливає на фізико-хімічні властивості молекули, а також на її біохімічну поведінку і потенційну біологічну активність.
THCA-C4 – це первинна кислотна форма канабіноїду, що означає її природне існування в рослині у вигляді кислоти, з карбоксильною групою (-COOH), приєднаною до молекули. Ця кислотна форма утворюється безпосередньо в жилах і клітинах Cannabis sativa за допомогою специфічних ферментів, які каталізують перетворення прекурсорів у відповідні канабіноїдні кислоти. На відміну від своєї декарбоксильованої форми (деструктурованої внаслідок нагрівання чи часу) – дельта-9-тетрагідроканабінолу (Δ9-THC), яка має психоактивні властивості, THCA-C4 вважається неактивною у класичному розумінні цього терміна, що типово для кислотних форм.
Однак, незважаючи на подібність у основному каркасі до інших канабіноїдів, THCA-C4 є суттєво відмінною як за хімічною структурою, так і за способом виникнення. По-перше, бутильний бічний ланцюг надає молекулі вищої гідрофобності порівняно з пентильним ланцюгом, що потенційно впливає на здатність сполуки проходити через біологічні мембрани або взаємодіяти з білковими рецепторами. По-друге, ця модифікація змінює конформацію молекули, зокрема просторову орієнтацію функціональних груп, що важливо для молекулярного розпізнавання.
Варто також відзначити, що THCA-C4 є одним із низки менш поширених канабіноїдів, що становлять так звану “малу фракцію” канабіноїдів у рослині. Хоча вона присутня у вкрай малих кількостях, її вивчення є важливим для розуміння різноманіття канабіноїдного профілю, що формується за рахунок генної варіабельності, кліматичних і агрономічних умов, а також біохімічної гнучкості самої рослини. Наявність таких гомологів свідчить про глибоку внутрішню складність метаболізму канабіноїдів та дає уявлення про альтернативні шляхи синтезу.
Незважаючи на рідкість, THCA-C4 має велике значення для науки, оскільки гомологи канабіноїдів із зміненою довжиною бічного ланцюга часто демонструють унікальні властивості, які не повторюють властивості основних канабіноїдів. Такі молекули можуть впливати на спектр біологічних ефектів, модулювати активність рецепторів або навіть відкривати нові механізми взаємодії на клітинному рівні. Таким чином, вивчення THCA-C4 допомагає розширити уявлення про комплексність канабіноїдної системи, що є не лише ключовою для фармакології, але і для молекулярної біології рослин.
З точки зору класифікації, THCA-C4 належить до типу канабіноїдів, який прийнято позначати як “бутильні канабіноїди”. Вони утворюють гомологічний ряд із канабіноїдами, що мають різну довжину бокового алкільного ланцюга, починаючи від пропілю (C3) і закінчуючи гептильною (C7) формою. Цей ряд не випадковий: він відображає принцип ферментативної пластичності, де ключові ензими синтезу канабіноїдів приймають різні субстрати і, залежно від їх доступності, продукують відповідні продукти. Це означає, що THCA-C4 є продуктом метаболічного шляху, який, хоч і не домінує, виконує важливу роль у структурному різноманітті канабіноїдів.
Феномен присутності THCA-C4 також пов’язаний із зусиллями дослідників у пошуку природних і синтетичних канабіноїдів із покращеними або модифікованими фармакологічними властивостями. Саме довжина і будова бічного ланцюга часто визначає афінність молекули до канабіноїдних рецепторів CB1 і CB2, які є ключовими медіаторами біологічних ефектів канабіноїдів. Тому THCA-C4, незважаючи на те, що сам по собі поки не вивчений достатньо, має перспективи для подальших фармакологічних досліджень як потенційний агент з унікальними характеристиками.
Водночас, THCA-C4 є не просто науковим об’єктом, а й біохімічним індикатором. Його виявлення у складі конкретних хемотипів Cannabis може сигналізувати про наявність унікальних метаболічних профілів, що відображають специфіку генетики рослини або вплив зовнішніх факторів на біосинтетичні шляхи. Це робить THCA-C4 потенційним біомаркером для класифікації та селекції, що є особливо актуальним у світлі сучасних тенденцій до персоналізації терапії і створення штучних хемотипів з потрібними властивостями.
Крім того, важливим аспектом є те, що THCA-C4, як і інші кислотні канабіноїди, у природному вигляді не має психоактивного ефекту, що є критичним для розуміння його потенційної терапевтичної цінності. Вивчення таких неактивних кислотних форм дозволяє відокремити психоактивний вплив канабіноїдів від їхніх протизапальних, нейропротекторних, анальгетичних чи імуномодулювальних властивостей, розкриваючи нові горизонти у фармакології.
Особливості хімічної структури THCA-C4
Хімічна структура Дельта-9-тетрагідроканабінолової кислоти-C4 (THCA-C4) відображає її приналежність до класу канабіноїдів, які є складними тетрагідрофурольними похідними з фенольним ядром, карбоксильною групою і боковим алкільним ланцюгом. Особливість THCA-C4 полягає в унікальній конфігурації її молекули, що визначає специфіку її хімічної реактивності, фізико-хімічних властивостей та біологічної активності.
Основою молекули є тетрагідроканабінольне ядро, що включає бензоціклогексанову структуру, до якої приєднані фенольна гідроксильна група та боковий алкільний ланцюг. Відмінною рисою саме THCA-C4 є наявність бутильного (C4) алкільного ланцюга, розташованого у положенні 3 бензоціклогексанового кільця, що є критично важливим для її молекулярної геометрії. На молекулярному рівні цей ланцюг представляє собою прямий ланцюг із чотирьох атомів вуглецю, закінчених метильною групою.
Ця структурна деталь має суттєвий вплив на конформаційні особливості молекули. Алкільний ланцюг у THCA-C4 демонструє більшу гнучкість у порівнянні з більш звичайним пентильним ланцюгом THCA-A, що частково змінює просторове розміщення всього молекулярного каркасу. Зокрема, бутильний ланцюг створює інший ступінь обертання навколо зв’язків, що призводить до відмінностей у стабільності різних конформаційних ізомерів. Ця гнучкість впливає на здатність молекули адаптуватися до різних біологічних мішеней, модулюючи її фармакологічний профіль.
Ще одним ключовим елементом структури є наявність карбоксильної групи (-COOH) у положенні 2′ тетрагідроканабінольного ядра, що визначає кислотний характер молекули. Ця функціональна група надає молекулі здатність брати участь у кислотно-основних реакціях, а також впливає на її розчинність у полярних середовищах. З хімічної точки зору, карбоксильна група також є ключовим центром для реакції декарбоксилювання – процесу, що трансформує кислотну форму в активну нейтральну форму Δ9-THC. Вплив цієї групи на стабільність молекули THCA-C4 є особливо важливим, адже вона робить її більш чутливою до температурних та окиснювальних впливів.
Щодо ароматичного кільця, у молекулі THCA-C4 воно представлено фенольним ядром із гідроксильною групою в положенні 1′, що забезпечує можливість утворення водневих зв’язків. Ці зв’язки визначають міжмолекулярні взаємодії у кристалічній фазі та розчині, а також впливають на афінність молекули до білкових рецепторів. Наявність фенольного ядра також надає молекулі антиоксидантні властивості, що робить її потенційно корисною у контексті боротьби зі стресом оксидативного типу.
Структурно THCA-C4 є хіральною молекулою – вона містить один або декілька центрів хіральності, які надають молекулі оптичної активності. Хіральність має фундаментальне значення для біохімічної взаємодії, адже конформації ізомерів можуть демонструвати різну біологічну активність, афінність до рецепторів, швидкість метаболізму і навіть токсичність. Для THCA-C4 характерна наявність (−)- і (+)-енантіомерів, причому природні сполуки зазвичай зустрічаються в одному певному стереоізомерному вигляді, що визначається ферментами рослини під час біосинтезу.
Важливою частиною молекули є тетрагідрофуранове кільце, що утворює додаткову циклічну структуру, стабілізуючи молекулу і впливаючи на її електронний розподіл. Цей елемент структурної організації відповідає за унікальні електрофізичні властивості молекули, такі як поляризованість та потенціал донорно-акцепторних взаємодій. Він також визначає специфіку зв’язування молекули з канабіноїдними рецепторами, адже структурна цілісність тетрагідрофуранового кільця є обов’язковою для формування стереоспецифічних взаємодій.
Розглядаючи електронну структуру THCA-C4, потрібно підкреслити вплив кон’югації подвійних зв’язків у бензоціклогексановому кільці та бутильному ланцюгу. Відсутність або наявність подвійних зв’язків у боковому ланцюгу суттєво впливає на електронну густину та енергетичні рівні молекули. У THCA-C4, зокрема, відсутність подвійних зв’язків у бутильному ланцюгу робить її менш електронегативною порівняно з довшими, пентильними гомологами, що, в свою чергу, змінює її здатність до електрофільних та нуклеофільних реакцій.
Ще одним аспектом є вплив структурної ізомерії у межах канабіноїдів з різною довжиною бічних ланцюгів на взаємодію з рецепторами CB1 і CB2. Нещодавні дослідження молекулярного моделювання показали, що зміни довжини ланцюга змінюють геометрію взаємодії, що може як збільшувати, так і знижувати афінність до рецепторів. У випадку THCA-C4 бутильний ланцюг призводить до меншої гідрофобної взаємодії з ліпофільним каналом рецептора, що відрізняє її від канабіноїдів з довшими ланцюгами.
Загальна молекулярна маса THCA-C4, з урахуванням бутильного ланцюга, є меншою порівняно з пентильними канабіноїдами, що також впливає на її розподіл у біологічних системах. Менша маса та специфічна будова визначають відмінності у фізико-хімічних параметрах, таких як точка плавлення, розчинність у органічних розчинниках, та кінетика метаболізму.
Не менш важливою є стійкість молекули до деградації. Завдяки структурним особливостям THCA-C4 проявляє відмінну стабільність при кімнатній температурі у сухих умовах, але водночас є чутливою до температурних коливань, що викликають декарбоксилювання. Хімічна структура з бутильним ланцюгом зумовлює деякі відмінності у механізмах деградації, порівняно з класичним THCA-A. Зокрема, швидкість і механізм руйнування бічного ланцюга в процесі окислення або термічної деструкції мають індивідуальні характеристики, які вивчаються для розуміння термічної поведінки молекули.
З точки зору хімічної реактивності, карбоксильна група також дає можливість утворення естерів і амідів, що відкриває перспективи синтезу похідних з модифікованою біологічною активністю. Особливості взаємодії бутильного ланцюга із цими функціональними перетвореннями суттєво відрізняються від аналогічних реакцій пентильних канабіноїдів, що робить THCA-C4 перспективним об’єктом для хімічного синтезу і модифікації.
Нарешті, варто згадати про кристалічну структуру THCA-C4, яка визначається співвідношенням між тетрациклічною основою, карбоксильною і фенольною групами та бічним ланцюгом. Кристалізація молекули та формування стабільних агрегатів у твердому стані або у вигляді кристалічних порошків визначають її фізичні властивості, такі як точка плавлення, стабільність, гігроскопічність. Дослідження таких параметрів має ключове значення для розробки методів екстракції, очищення і зберігання THCA-C4.
Чому THCA-C4 так важко виявити
Виявлення та ідентифікація Дельта-9-тетрагідроканабінолової кислоти-C4 (THCA-C4) у природних і лабораторних зразках пов’язана з комплексом технічних, хімічних і аналітичних викликів, які значно ускладнюють точний аналіз і кількісне визначення цієї сполуки. Складність виявлення THCA-C4 обумовлена рядом факторів, що стосуються її фізико-хімічних властивостей, стабільності, низької концентрації у матеріалах, а також особливостей сучасних аналітичних методів. Поглиблене розуміння цих перешкод є ключовим для розробки нових, більш ефективних методик аналізу, а також для коректного тлумачення результатів досліджень.
Перш за все, однією з основних складностей є надзвичайно низька природна концентрація THCA-C4 у біологічних матеріалах, таких як рослинна тканина Cannabis. THCA-C4 є структурним гомологом більш поширених канабіноїдів, зокрема THCA-A, однак унікальна бокова структура з бутильним ланцюгом зустрічається рідше, що зумовлює її мікроскопічну присутність. У зв’язку з цим, кількість молекул THCA-C4 у пробі часто перебуває на межі чутливості багатьох аналітичних приладів, що вимагає застосування методів із надвисокою роздільною здатністю і сенситивністю. Цей фактор ускладнює не тільки кількісне визначення, а й сам факт виявлення, особливо у присутності більш концентрованих канабіноїдів.
Другий важливий аспект пов’язаний з хімічною нестабільністю THCA-C4 під впливом фізико-хімічних факторів, зокрема температури і світла. Молекула містить карбоксильну групу, що робить її чутливою до декарбоксилювання – перетворення в нейтральний канабіноїд Δ9-THC-C4. Цей процес відбувається при нагріванні або тривалому зберіганні зразків, що призводить до втрати вихідної форми THCA-C4 і зміни аналітичного профілю. Оскільки декарбоксилювання відбувається нерівномірно і залежить від умов зберігання, це ускладнює інтерпретацію даних і робить складним відновлення початкової концентрації кислоти в досліджуваному матеріалі. Відповідно, навіть правильно підібрані методи можуть “не побачити” THCA-C4 через її перетворення в інші форми.
Третя причина полягає в високій хімічній подібності THCA-C4 до інших канабіноїдів, зокрема структурних ізомерів і гомологів, що мають близькі молекулярні маси, схожі функціональні групи і аналогічні фізико-хімічні характеристики. Ця близькість ускладнює вибір селективних умов хроматографічного розділення та спектроскопічної ідентифікації. Наприклад, у методах газової або рідинної хроматографії з мас-спектрометричним детектуванням (GC-MS, LC-MS) множинні канабіноїди можуть давати перекривні піки або ізобари, що утруднює однозначну ідентифікацію. Відсутність унікальних мас-спектрометричних фрагментів, які могли б служити специфічними маркерами, робить необхідним використання комплексних мультидимензійних підходів або високороздільних хроматографічних методик.
Четвертим фактором є нестабільність у процесі пробопідготовки, де THCA-C4 може піддаватися хімічним або фізичним змінам через вплив розчинників, рН середовища, температури або взаємодії з іншими компонентами матриці. Зразки, що містять THCA-C4, часто мають складний органічний склад із великою кількістю полярних і неполярних сполук, включно з іншими канабіноїдами, терпеноїдами та флавоноїдами. Взаємодія цих сполук у ході екстракції і очищення може призводити до деградації, адсорбції на колонках чи втрати через неселективні реакції, що призводить до інактивації або “маскування” THCA-C4. Тому оптимізація пробопідготовки є критичною для достовірного виявлення і вимагає глибокого розуміння хімічної поведінки молекули в різних середовищах.
П’ятий аспект – це інструментальні обмеження. Стандартні аналітичні платформи, що широко використовуються для дослідження канабіноїдів, часто не мають достатньої селективності або чутливості для однозначного виявлення THCA-C4. Наприклад, у традиційних методах газової хроматографії через термічну нестабільність карбоксильної групи застосування GC без попередньої дериватизації може призводити до руйнування молекули, втрати кислотної форми і появи артефактів. З іншого боку, рідинна хроматографія з мас-спектрометрією, хоч і дає кращі можливості, потребує дорогих та складних систем високого тиску і високороздільної мас-спектрометрії, а також ретельної калібрування, що обмежує її широке застосування.
Шостий важливий фактор – відсутність стандартизованих і сертифікованих стандартних зразків THCA-C4 для калібрування і валідації аналітичних методів. Через відносно недавнє відкриття та дослідження THCA-C4, виробництво чистих, стабільних стандартів у достатній кількості є технологічно складним і дорогим процесом. Це обмежує можливості лабораторій у точній кількісній оцінці і призводить до великих варіацій у результатах, залежно від застосованої методики і рівня кваліфікації аналітиків.
Ще одним науково-технічним бар’єром є складність розділення THCA-C4 від її ізомерів, зокрема від близькоспоріднених структурних форм, таких як THCA-C3 або THCA-C5. Ці сполуки мають схожі молекулярні маси, подібний хроматографічний профіль і відрізняються лише довжиною бічного ланцюга, що вимушує застосовувати багатоступінчасті методи розділення – наприклад, використання двовимірної хроматографії (2D-LC), або комбінації хроматографії із спектроскопією ядерного магнітного резонансу (NMR) для точного визначення структури. Такі методики є часозатратними і вимагають спеціалізованого обладнання і глибоких експертних знань, що ускладнює їх рутинне застосування.
З погляду хімічної кінетики, реакції декарбоксилювання і окислення THCA-C4 відбуваються з різною швидкістю залежно від умов, що створює додаткові труднощі для стандартизації аналітичних протоколів. Відсутність чітких контрольованих умов і різні методи зберігання проб викликають значну змінність концентрації THCA-C4 у зразках навіть від одного і того ж джерела. Така варіабельність підриває надійність результатів, що вимагає розробки стабілізаційних методів і впровадження протоколів для уникнення деградації.
З огляду на вищезазначене, наукова спільнота активно працює над удосконаленням технологій для виявлення THCA-C4. Це включає розвиток ультрависокороздільної хроматографії, багатовимірних спектроскопічних методів, а також інтеграцію методів машинного навчання для аналізу спектральних даних. Проте ці підходи поки що не набули масового застосування через їх високу вартість і технологічну складність.
Як THCA-C4 з’являється в рослині
Поява THCA-C4 у рослині Cannabis є результатом складного та багаторівневого біохімічного процесу, що відбувається на рівні клітинної метаболічної активності і генетичного контролю. Виробництво цього рідкісного канабіноїду – це своєрідна біохімічна адаптація, що поєднує у собі особливості генетичного апарату рослини, ферментативних систем, а також вплив навколишнього середовища. Для розуміння механізму появи THCA-C4 у канабісі необхідно глибше заглибитися у процеси метаболізму вторинних метаболітів, функціонування ферментних каскадів і взаємодію між генотипом і фенотипом рослини.
По суті, THCA-C4 утворюється в спеціалізованих клітинах – трихомах – які розташовані на поверхні квітів, листя і молодих пагонів рослини. Ці трихоми виконують роль біореакторів, де відбувається накопичення та синтез канабіноїдів. THCA-C4 як специфічний канабіноїд є продуктом унікальної біохімічної реакції, що стартує з базових прекурсорів канабіноїдного шляху, які синтезуються в клітинах рослини. Важливо розуміти, що появі THCA-C4 передує комплексний метаболічний шлях, де центральна роль належить не лише ферментам, а й субстратній специфічності та просторовій організації ферментних комплексів.
Незважаючи на загальну подібність до інших канабіноїдів, біогенез THCA-C4 має відмінні риси, пов’язані з особливостями активації і трансформації специфічних прекурсорів. Відмінність у будові бокового алкільного ланцюга – чотири атоми вуглецю (C4) замість звичних трьох або п’яти – зумовлює появу унікального ензимного механізму, який відповідає за цей варіант біосинтезу. Тому рослини, що продукують THCA-C4, можуть мати характерні варіанти генів, відповідальних за синтез довгих алкільних бокових ланцюгів.
Важливим фактором є локалізація процесу біосинтезу в специфічних органелах і субклітинних структурах, де ферменти, відповідальні за синтез канабіноїдів, організовані в мультиферментні комплекси. Ця організація дозволяє ефективно керувати послідовністю реакцій і мінімізувати втрати нестабільних проміжних продуктів. THCA-C4, як і інші кислоти, утворюється шляхом специфічної карбоксилювання і циклізації, що є делікатним процесом, чутливим до змін метаболічного стану клітини, окисного стресу і доступності прекурсорів.
Природний феномен появи THCA-C4 тісно пов’язаний із генетичною варіабельністю рослин Cannabis. Існують сорти і лінії, що генетично запрограмовані на продукцію канабіноїдів із більш довгими боковими ланцюгами. Ця специфіка відображається у функції і регуляції ключових ферментів, що приймають участь у формуванні цих структур. Відтак, THCA-C4 не є випадковим побічним продуктом, а результатом адаптації, що може бути пов’язана з екологічними і еволюційними чинниками, такими як захист від ультрафіолетового випромінювання, патогенів або фітофагів.
Поява THCA-C4 у рослині також пов’язана з етапами росту і розвитку. Рівень синтезу цього канабіноїду є динамічним і залежить від віку рослини, її стану здоров’я, а також умов зовнішнього середовища – таких як світло, температура, вологість, склад ґрунту і рівень стресу. На ранніх стадіях розвитку рослини ферментативні системи налаштовані на активний синтез основних канабіноїдів, тоді як у більш зрілих формах зростає різноманітність структур і відносне накопичення рідкісних форм, зокрема THCA-C4. Цей феномен вказує на складну регуляторну мережу, яка контролює метаболічний баланс між синтезом основних і вторинних канабіноїдів.
Важливою складовою є також вплив взаємодії між метаболічними шляхами канабіноїдів і іншими вторинними метаболітами рослини, зокрема терпеноїдами і флавоноїдами. Спільна регуляція і координація цих шляхів впливають на доступність прекурсорів і енергетичний баланс клітини, що, у свою чергу, визначає інтенсивність синтезу THCA-C4. Метаболічна конкуренція і механізми зворотного зв’язку можуть посилювати або пригнічувати продукцію цього канабіноїду, що створює складний і гнучкий біохімічний профіль рослини.
Крім того, важливо відзначити, що утворення THCA-C4 не є ізольованим процесом, а частиною комплексної мережі ферментативних реакцій і біосинтетичних каскадів. Ця мережа охоплює не лише синтез самого THCA-C4, але й перетворення його прекурсорів, включаючи специфічні окислювальні і карбоксильні реакції. Взаємодія між ферментами, коферментами і субстратами створює синергетичний ефект, що забезпечує високоефективний синтез канабіноїдів в оптимальних концентраціях.
Не можна також ігнорувати роль епігенетичних механізмів, які можуть модулювати експресію генів, що відповідають за синтез THCA-C4. Дослідження останніх років вказують, що метилювання ДНК, модифікації гістонів і вплив некодуючих РНК можуть суттєво впливати на метаболічний профіль Cannabis, зокрема змінювати баланс між різними канабіноїдами. Такі механізми забезпечують адаптивність рослини до змін навколишнього середовища і створюють варіабельність у продукції THCA-C4 навіть між близькоспорідненими генетичними лініями.
Сукупність цих факторів пояснює, чому THCA-C4 з’являється лише у певних сортах Cannabis і за певних умов. Це явище підкреслює складність і багатогранність метаболічних процесів, що відбуваються у рослині, і вказує на необхідність комплексних підходів до дослідження її біохімії. Вивчення цих механізмів має не лише фундаментальне значення для розуміння біології канабіноїдів, але й практичне застосування у селекції рослин з заданим метаболічним профілем, що важливо для медичного та промислового використання Cannabis.
Можливі природні шляхи біосинтезу THCA-C4
Біосинтез THCA-C4 в рослині Cannabis представляє собою складний і точний біохімічний процес, що відрізняється від класичних шляхів утворення інших канабіноїдів через унікальність алкільного ланцюга. Визначення природних шляхів синтезу цього рідкісного канабіноїду потребує аналізу ключових метаболічних каскадів, молекулярних субстратів і ферментативних механізмів, які забезпечують специфічну структуру молекули THCA-C4.
Основою для формування канабіноїдів у Cannabis є два головні метаболічні шляхи: полікетидний шлях (PKS) і шлях ізопренової біосинтезу (мепантеноїт/мептаноїт, MEP/DOXP). Вони забезпечують відповідні прекурсори – ароматичний бензольний фрагмент і алкільний ланцюг. У класичному випадку утворення THCA передбачає конденсацію орто-кумароїл-CoA (ароматичний компонент, що утворюється в результаті шляху фенілпропаноїдів) та геранілпірофосфату (GPP) – ізопренового донору, що синтезується в MEP-шляху. Для THCA-C4, однак, типова відмінність полягає у довжині і структурі алкільного ланцюга – замість п’яти вуглецевих атомів у GPP використовується похідне із коротшим, чотиривуглецевим ланцюгом. Саме це викликає необхідність додаткових ферментативних трансформацій або альтернативного субстратного пулу.
Перший можливий шлях біосинтезу THCA-C4 передбачає участь альтернативного ізопренового прекурсора – бутилпірофосфату (BPP) або його аналогів, що містять чотири атоми вуглецю у бічному ланцюгу замість типового GPP. Відмінність у субстраті викликає радикальну зміну ферментативної специфіки та продукту реакції. Дослідження виділених ферментів у канабіноїдному шляху показали, що специфічні тератогенази або транс-ізопренілірувальні синтази можуть проявляти гнучкість у прийнятті подібних субстратів, що зумовлює утворення алкілпохідних з меншою кількістю вуглеців. Це означає, що у природі існують або мало вивчені ферменти, або варіанти уже відомих, здатних виконувати конденсацію орто-кумароїл-CoA з бутилпірофосфатом, що запускає утворення унікального прекурсора THCA-C4.
Другий природний шлях пов’язаний із модифікацією базових прекурсорів через ферментативне скорочення або трансформацію вже існуючих алкільних ланцюгів. Відповідно до цієї гіпотези, THCA-C4 формується як похідне класичного THCA шляхом ферментативного втручання в ланцюг – процесу, що включає окиснювальне гідрування, β-окиснення або специфічне гідролітичне відщеплення кінцевих вуглецевих атомів із п’ятиатомного ланцюга. Ця трансформація може здійснюватись окремими ферментами, такими як ліпоксигенази, редуктази або монооксигенази, що локалізуються в трихомах. Такий підхід дозволяє використовувати вже синтезований GPP як початковий субстрат, а наступне модулювання довжини бокового ланцюга веде до появи алкільних похідних з чотирма атомами вуглецю, які конденсуються із орто-кумароїл-CoA для формування THCA-C4.
Ферментативна специфіка в обох сценаріях відрізняється від класичного біосинтезу THCA. Експериментальні дані свідчать про існування ізоформ ферментів, що володіють субстратною специфічністю до альтернативних ізопренових донорів або модифікованих алкільних ланцюгів. Вивчення таких ізоформ здійснювалось із застосуванням протеоміки і генної інженерії, де ідентифікували мутації у ділянках, відповідальних за зв’язування із субстратом. Ці варіанти ферментів можуть бути результатом генетичних мутацій або епігенетичних модифікацій, що зумовлюють появу унікальних біосинтетичних маршрутів, характерних саме для рослин, які продукують THCA-C4.
Крім того, важливо враховувати субклітинну локалізацію біосинтетичних комплексів. Конденсація прекурсорів та формування молекули THCA-C4 ймовірно відбувається у специфічних відсіках цитоплазми або мембранних структурах, де концентрація субстратів і коферментів оптимальна для ферментативної активності. Такі органелоподібні комплекси можуть мати змінений ферментний склад і забезпечують цілеспрямований синтез канабіноїдів із різними боковими ланцюгами, зокрема THCA-C4.
Значну роль у цьому процесі відіграє також доступність та концентрація алкільних донорів. У рослині рівні бутилпірофосфату або подібних речовин можуть бути регульовані залежно від зовнішніх чинників – світлового режиму, температури або поживного середовища. Варіації у метаболізмі ізопренів впливають на співвідношення субстратів, тим самим визначаючи інтенсивність синтезу THCA-C4 відносно інших канабіноїдів. Це свідчить про складний і адаптивний характер регуляції біосинтезу.
Окрему увагу заслуговує участь коферментів і мінеральних компонентів, що забезпечують активність ферментів, зокрема Mg²⁺, Fe²⁺, NAD(P)H. Їх кількість і доступність прямо корелюють з ефективністю синтезу THCA-C4. Зміни у балансі коферментів можуть впливати на перевагу певних шляхів біосинтезу, зокрема на активацію альтернативних ферментних форм, що віддають перевагу утворенню THCA-C4.
Важливо також розглянути можливість участі мікробіоти рослини у формуванні специфічних метаболітів. Деякі бактерії і грибки, що асоціюються з поверхнею і внутрішніми тканинами Cannabis, можуть продукувати ферменти або проміжні сполуки, які стимулюють або модулюють синтез THCA-C4. Цей аспект біосинтезу ще мало вивчений, але з огляду на сучасні дослідження ендофітної мікробіоти, він може суттєво впливати на якість і кількість рідкісних канабіноїдів.
Загальний метаболічний контекст синтезу THCA-C4 також передбачає існування метаболічних каналів (metabolons) – просторово організованих груп ферментів, які забезпечують передачу субстратів безпосередньо від одного ферменту до іншого, мінімізуючи дифузійні втрати. У таких комплексах відбувається послідовне формування специфічних канабіноїдних структур, і саме в них можливі варіанти, що призводять до утворення THCA-C4.
Участь ферментів і вплив генотипу THCA-C4
Біосинтез THCA-C4, як і інших канабіноїдів, є результатом тісної взаємодії ферментативних систем рослини Cannabis та її генетичної основи, що визначає синтетичний потенціал і специфіку продуктів. Ферментативна складова цього процесу зосереджена навколо групи ензимів, що виконують послідовні реакції з конденсації, циклізації та модифікації молекул-попередників. Водночас генотип рослини виступає регулятором рівня експресії відповідних генів, варіацій амінокислотних послідовностей ферментів, а також визначає доступність та ефективність цих ферментативних каскадів.
Ключовим ферментом, який запускає біосинтез THCA-C4, є канабіноїд-синтаза – особлива група оксигеназ (оксигенази THCA-синтази), що каталізує окиснювальне циклізування конденсованого продукту орто-кумароїл-CoA з ізопреновим донором. Враховуючи специфіку THCA-C4, припускають існування ізоформ або варіантів цієї синтази з підвищеною афінністю до альтернативних ізопренових субстратів (зокрема бутилпірофосфату або його аналогу), що відрізняє її від класичної THCA-синтази. Такі варіанти ферменту мають модифіковані активні сайти, які забезпечують точний орієнтований зв’язок з чотиривуглецевим ланцюгом. Відомості про структуру цих ізоформ залишаються обмеженими, однак білкова модель, побудована на основі гомологій із родичами ферменту, демонструє зміни у ключових амінокислотах, що можуть формувати унікальний субстратний канал.
Генетичні варіації, що визначають виникнення таких ізоформ, локалізовані в ділянках генів, які кодують ці ферменти, – зокрема у регуляторних та кодуючих областях. Поліморфізми нуклеотидів у промоторних зонах призводять до змін рівня транскрипції, тоді як зміни в кодуючій послідовності спричиняють алелічну різноманітність білків із різною активністю та специфічністю. Ці варіації тісно пов’язані з різними сортами Cannabis, які демонструють відмінності у профілі THCA-C4. Геномні дослідження останніх років, зокрема секвенування різних штамів, виявили унікальні алелі, асоційовані з підвищеною продукцією THCA-C4, що свідчить про вплив генотипу на ферментативні властивості і біосинтетичні маршрути.
Крім канабіноїд-синтази, у процесі утворення THCA-C4 беруть участь і інші ферменти, які забезпечують підготовку субстратів: полікетид-синтази, ізопренілтрансферази, а також ферменти, що каталізують β-окиснення та інші модифікації алкільних ланцюгів. Активність цих ферментів, яка безпосередньо впливає на доступність специфічних прекурсорів, також регулюється генетичними факторами і може змінюватись у різних генотипах. Зокрема, у рослин з високим рівнем THCA-C4 виявлено підвищену експресію генів, що кодують специфічні ізоформи ізопренілтрансфераз, які демонструють підвищену спорідненість до бутилпірофосфату.
Важливо відзначити, що ферментативний процес у Cannabis не відбувається ізольовано, а формується у вигляді метаболічних мереж і комплексів, які об’єднують кілька ензимів у метаболони. Генотип рослини визначає не лише якість окремих ферментів, а й їхню здатність до утворення цих функціональних мультиензимних агрегатів, що сприяє оптимальному проходженню реакцій та мінімізації проміжних втрат субстратів. Нещодавні дослідження із застосуванням мас-спектрометрії та коіммунопреципітації показали, що варіації у генах структурних білків метаболонів також корелюють із рівнем синтезу THCA-C4.
Окрім прямої участі ферментів у біосинтезі, генотип впливає на регуляцію експресії ферментних генів через епігенетичні механізми. Метилювання ДНК, модифікації гістонів і мікроРНК можуть змінювати рівні транскрипції ключових ферментів, що сприяє адаптації рослини до екологічних умов і водночас впливає на синтетичний профіль канабіноїдів. Наприклад, у рослин, що ростуть у стресових умовах, спостерігається змінений патерн метилювання генів ізопренілтрансфераз, що призводить до варіацій продукції THCA-C4.
Генетичний фон також визначає морфологічні і фізіологічні особливості трихом – спеціалізованих залозистих волосків, де і відбувається накопичення та синтез канабіноїдів. Розміри, кількість та ступінь зрілості трихом корелюють із рівнями ферментів і субстратів, необхідних для утворення THCA-C4. Генетичні відмінності, що впливають на формування трихом, опосередковано регулюють метаболічні потоки і, відповідно, кількість синтезованого THCA-C4.
Варто підкреслити, що виявлення конкретних генів і ферментів, що відповідають за синтез THCA-C4, є досі частково не завершеним завданням. Застосування геномних, трансскриптомних і протеомних технологій разом із біохімічними методами має ключове значення для ідентифікації точного набору генетичних маркерів і ферментативних механізмів. Ці дослідження відкривають перспективи для генної інженерії, яка може забезпечити підвищену продуктивність і селективність синтезу THCA-C4 у рослинах або в гетерологічних системах.
Що відомо про стабільність THCA-C4 у рослинному матеріалі
Стабільність THCA-C4 у свіжому та сухому рослинному матеріалі Cannabis є важливим аспектом для розуміння збереження хімічної цілісності цього канабіноїду у процесах зберігання, обробки та аналізу. Наукові дослідження зосереджуються на механізмах розпаду, факторів, що впливають на деградацію, а також на впливі зовнішніх і внутрішніх умов, що визначають збереження молекулярної структури THCA-C4.
Фізико-хімічні властивості THCA-C4 безпосередньо визначають його стабільність у рослинних тканинах. Відомо, що кислоти канабіноїдів мають тенденцію до декарбоксилювання під впливом тепла, світла та кисню, перетворюючись на відповідні нейтральні канабіноїди. THCA-C4 не є винятком, однак унікальна структура з коротшим алкільним ланцюгом може впливати на швидкість і механізм цих перетворень.
Декарбоксилювання THCA-C4 відбувається при температурі значно нижчій за термостійкість інших подібних канабіноїдів, що вказує на його більш високу хімічну реактивність. Дослідження теплової стабільності показали, що THCA-C4 починає втрачати карбоксильну групу при температурах, починаючи від 90-100 °C, що нижче порівняно з THCA. Це означає, що навіть при незначному нагріванні або тривалому зберіганні у помірних умовах можлива значна трансформація канабіноїду. Цей процес суттєво впливає на фармакологічні властивості рослинного матеріалу, оскільки нейтральна форма канабіноїду має інші біологічні ефекти.
Окрім температурного впливу, стабільність THCA-C4 у рослинному матеріалі залежить від фотодеградації. Експозиція до ультрафіолетового та видимого світла спричиняє фотохімічні реакції, що ведуть до руйнування канабіноїдного кільця або бічного ланцюга. Специфіка хімічної структури THCA-C4 з її коротшим алкільним ланцюгом може впливати на спектр і швидкість цих реакцій. Експериментальні дослідження показали, що THCA-C4 піддається більш інтенсивній фотодеструкції в порівнянні з класичними THCA або CBDA, що пов’язано з меншою стабільністю кон’югованої системи та підвищеною реактивністю в активних центрах молекули.
Хімічні фактори середовища рослинного матеріалу також відіграють важливу роль у стабільності THCA-C4. Рівень вологості, рН, наявність окислювачів або редукторів, а також концентрація металевих іонів можуть каталізувати хімічний розпад або сприяти утворенню вторинних продуктів деградації. Особливо важливим є вплив вологи – підвищена вологість створює умови для гідролітичних реакцій, які можуть порушувати цілісність карбоксильної групи і провокувати розпад канабіноїду.
Додатково, біологічні чинники, такі як активність ферментів, що зберігаються у свіжому матеріалі, можуть впливати на стабільність THCA-C4. Ензими, зокрема оксидоредуктази, ліази та гідролази, здатні каталізувати перетворення молекули у процесі зберігання, якщо матеріал не було ретельно оброблено або висушено. Ця біокаталітична деградація посилюється при температурі, що сприяє активації ферментних систем.
Розпад THCA-C4 супроводжується утворенням різноманітних продуктів деградації, що можуть включати нейтральні канабіноїди, оксидативні метаболіти, а також полімери. Ці продукти мають різну біологічну активність і часто знижують якість та ефективність рослинного матеріалу, що є важливим аспектом для фармацевтичного використання та аналітичної стандартизації.
Важливо відзначити, що стабільність THCA-C4 у рослинному матеріалі істотно залежить від способів зберігання. Оптимальними умовами є темне, сухе, прохолодне середовище з низькою концентрацією кисню. Використання герметичних контейнерів з інертним газом (азотом або аргоном) значно покращує збереження канабіноїду. Дослідження тривалого зберігання показують, що при дотриманні таких умов THCA-C4 може зберігати стабільність від кількох місяців до року і більше.
Науковці також вивчають вплив різних технологій обробки рослинної сировини на стабільність THCA-C4. Серед них виділяють методи м’якого сушіння, заморожування, вакуумної сушки та ліофілізації. Ліофілізація, як показують результати, забезпечує найкраще збереження структури і концентрації THCA-C4, оскільки знижує ризик окислення і фотодеструкції, а також перешкоджає ферментативній активності. Водночас агресивні термічні методи сушіння або подрібнення підвищують ризик швидкого розпаду.
Незважаючи на певний прогрес у вивченні стабільності THCA-C4, багато аспектів залишаються недостатньо дослідженими. Зокрема, відсутні комплексні дані про вплив довготривалого зберігання у різних типах рослинної сировини (сухі квіти, листя, екстракти) та при зміні комбінацій факторів середовища. Це ускладнює розробку стандартизованих протоколів обробки та зберігання, що є критично важливим для медичного застосування і наукових досліджень.
Штучне отримання THCA-C4
Штучне отримання THCA-C4 являє собою складний багатоступеневий процес, який має на меті відтворити природні біосинтетичні механізми або ж розробити альтернативні шляхи синтезу цієї сполуки із заданою структурою та функціональністю. У порівнянні з класичним THCA, синтез THCA-C4 має особливості, що обумовлені відмінностями у хімічній структурі – зокрема, більш коротким алкільним ланцюгом. Цей фактор накладає як виклики, так і можливості для органічної та біохімічної синтетичної хімії.
Основна мета штучного отримання полягає у виробництві THCA-C4 у кількостях, достатніх для наукових досліджень, фармацевтичних розробок і потенційного комерційного застосування. Природний вміст THCA-C4 у рослинній сировині обмежений і сильно залежить від генетичних, екологічних та агротехнічних чинників, що ускладнює його масове добування традиційними методами. Тому синтезована альтернатива дозволяє не лише стандартизувати продукт, а й уникнути проблем, пов’язаних з непередбачуваністю рослинної біосинтезної системи.
Штучний синтез THCA-C4 може базуватися на декількох стратегіях, які поділяються на повністю хімічні, біотехнологічні та комбіновані підходи. Повністю хімічні методи включають багатоступеневе органічне синтезування, яке починається зі стандартних будівельних блоків – таких як алкільні галогеніди, феноли, ізопренові фрагменти – з поступовою збіркою молекули шляхом каталізованих реакцій. Особливістю такого підходу є необхідність забезпечення високої селективності та чистоти продукту, оскільки структура канабіноїдів передбачає наявність хіральних центрів і чутливих функціональних груп. Відсутність природних ферментів потребує заміни біологічних каталізаторів на синтетичні або металокаталізатори, які можуть проводити окислення, циклізацію та інші специфічні реакції.
Водночас, біотехнологічні методи намагаються відтворити природні метаболічні шляхи за допомогою мікроорганізмів, таких як бактерії або дріжджі, у яких експресуються відповідні ферменти з Cannabis або інженерні ферменти із зміненими властивостями. Цей підхід дозволяє отримувати THCA-C4 у водному середовищі, використовуючи більш м’які умови та потенційно підвищену селективність, а також дає можливість масштабування за рахунок біореакторів. Головні виклики у цьому напрямку – це оптимізація експресії ферментів, доступність прекурсорів у клітині та стабільність кінцевого продукту.
Значна увага приділяється також комбінованим стратегіям, що поєднують елементи хімічного і ферментативного синтезу. Наприклад, можна отримати ключові проміжні сполуки хімічним шляхом, а фінальні етапи – каталізувати специфічними ферментами, що дозволяє мінімізувати кількість побічних продуктів та полегшує виділення цільового канабіноїду. Такі методи демонструють потенціал для підвищення ефективності та екологічної безпеки виробництва.
Важливо також підкреслити роль хімічного моделювання і комп’ютерного дизайну у розробці синтетичних маршрутів для THCA-C4. Застосування квантової хімії і молекулярного динамічного моделювання дозволяє прогнозувати енергетичні бар’єри реакцій, вибір каталізаторів та оптимальні умови проведення реакцій. Це значно скорочує експериментальний час і ресурси, необхідні для розробки робочих синтетичних протоколів.
Ще одним аспектом штучного отримання є розробка ефективних методів очищення і стабілізації синтезованого THCA-C4. Оскільки канабіноїди мають схильність до розпаду, необхідно впроваджувати сучасні методики хроматографії, кристалізації та інших аналітичних процедур для забезпечення високої чистоти і стабільності кінцевого продукту. Розробка стабілізуючих добавок та умов зберігання також є частиною комплексного підходу до штучного отримання.
З огляду на потенційне фармакологічне значення THCA-C4, штучне отримання також включає розробку масштабованих технологій, що відповідають вимогам GMP (Good Manufacturing Practice). Це потребує стандартизації процесів, контролю якості та впровадження систем відслідковування на всіх етапах виробництва. Такі вимоги визначають не лише ефективність синтезу, а й його економічність і безпеку.
Сучасний стан наукових досліджень демонструє, що, незважаючи на наявність базових методів штучного синтезу THCA-C4, цей напрямок залишається на етапі активного розвитку. Потрібно подолати низку технічних і біохімічних труднощів, зокрема підвищення селективності реакцій, збільшення виходу продукту, а також створення стійких ферментативних систем. У цьому контексті важливу роль відіграє міждисциплінарний підхід, що об’єднує органічну хімію, біотехнології, генетику і аналітичні методи.
Лабораторне відтворення гомологів THCA-C4
Лабораторне відтворення гомологів THCA-C4 – це один із ключових інструментів у сучасній канабіноїдній хімії, що дозволяє розширити розуміння структурно-функціональних зв’язків між хімічною будовою та біологічною активністю цих сполук. Гомологи, в контексті THCA-C4, – це молекули, що відрізняються за довжиною або насиченістю бічного алкільного ланцюга, але зберігають канонічну тетрагідроканабінолову каркасну систему з карбоновою групою у положенні С-2 бензоїльного кільця. Саме синтез таких варіацій в лабораторних умовах є джерелом нових даних про вплив незначних модифікацій на стабільність, реактивність, рецепторну селективність та метаболічну долю канабіноїдів.
Основна складність полягає в тому, що структура THCA-C4 не є простою скороченою версією THCA-A – зміна довжини бічного ланцюга змінює як фізико-хімічні параметри, так і поведінку молекули у реакційних умовах. Тому лабораторне відтворення таких гомологів вимагає ретельного проєктування синтетичних маршрутів, які дозволять з високою селективністю формувати критичні зв’язки в молекулі, зокрема зберігати конфігурацію п’ятичленного тетрагідроксипіранонового кільця, яке легко ізомеризується або деградує за м’яких умов.
Першим кроком у створенні гомологів є підбір алкільованих прекурсорів – зазвичай це бутилбензоли або бутилфеноли, які піддаються направленому функціоналізуванню. Для THCA-C4 потрібне введення нормального C4-ланцюга (бутильного), причому бажано у первинній конфігурації (н-бутил), оскільки розгалуження або циклічність ланцюга впливає на афінність до рецепторів CB1 і CB2. Введення таких ланцюгів до ароматичного ядра часто реалізується через реакції Фріделя-Крафтса з використанням алкілгалогенідів у присутності кислот Льюїса, проте в разі канабіноїдних структур ці реакції мають низьку регіоселективність. Тому більш ефективною виявилась стратегія функціоналізації вже алкільованого фенолу через окислення або карбонілювання із попереднім контролем за положенням заміщення.
Після побудови ароматичного ядра з необхідною бічною групою, відбувається формування центральної полікетидної структури – ланцюга, з якого у подальшому утвориться циклічний фрагмент. Тут застосовується методика конденсації з гексаноїлними або бутаноїлними тіоестерами через реакції Claisen-типу або шляхом використання ацетооцтових ефірів у присутності сильних основ. Контроль над регіохімією таких реакцій критично важливий, оскільки неправильне позиціонування кетогруп веде до утворення побічних ізомерів, які унеможливлюють формування бажаного циклу на останніх етапах.
Формування тетрагідроканабінолової системи з похідного олігокетиду зазвичай вимагає кислотного каталізу для індукції інтра- або інтермолекулярного циклування. При цьому велике значення має природа розчинника, температура, концентрація та наявність додаткових нуклеофільних/електрофільних центрів. Оскільки канабіноїди легко деградуючі в присутності води або при температурі понад 60°C, синтез бажано проводити в апаратах зі зниженим тиском, використовуючи безводні умови й обмежену експозицію до світла. Ключовим є досягнення високої діастереоселективності при циклізації, адже неуспіх на цьому етапі призводить до змішування цільового гомолога з неактивними або нестабільними ізомерами.
Після синтезу основного каркасного скелета проводиться окислення до карбонової кислоти – критичної функціональної групи в THCA-гомологах, яка відповідає як за розчинність, так і за біоактивність. У лабораторних умовах це досягається шляхом селективного окислення вторинного спирту, зазвичай з використанням м’яких окисників типу PCC або TEMPO/NaOCl систем. Таке окислення вимагає тонкого контролю, оскільки надмірна реактивність може призвести до декарбоксилювання, що обнулить синтетичний результат. Після досягнення цільової кислоти проводиться ізолювання гомолога через хроматографію (ВЕРХ або флеш-хроматографія), що дозволяє відокремити ізомери, залишки реагентів і побічні продукти.
Варто також підкреслити роль ізотопного мічення в лабораторному відтворенні гомологів THCA-C4. Застосування ^13C- або ^2H-маркованих прекурсорів дозволяє простежити перебіг реакцій на різних етапах і верифікувати структурні перебудови. Це особливо важливо для вивчення стереохімії та встановлення механізмів циклізації. Подібні стратегії вже використовуються при створенні внутрішньоклітинних тракерів, а також у фармакокінетичних дослідженнях аналогів THCA.
Окремої уваги заслуговує феномен створення бібліотек гомологів. Використовуючи однаковий синтетичний каркас, дослідники модифікують лише бічний ланцюг (від С1 до С8), що дозволяє встановити залежність між довжиною ланцюга та фармакологічною активністю. У межах такої бібліотеки THCA-C4 посідає центральну нішу як представник коротколанцюгових гомологів із цікавими біофармацевтичними властивостями. Лабораторне відтворення в цьому випадку служить не лише для ізолювання окремої молекули, а й як інструмент системної характеристики класу речовин.
Нарешті, варто зауважити, що навіть після синтезу, значна частина досліджень переходить у сферу аналітики – підтвердження структури та функції гомологів. Для цього використовуються спектроскопічні методи – ЯМР ^1H та ^13C, ІЧ-спектроскопія, мас-спектрометрія з високою роздільною здатністю (HRMS), хромато-мас спектрометрія, а також методи рентгеноструктурного аналізу. Без цієї верифікації неможливо стверджувати, що створений зразок є дійсно гомологом THCA-C4, а не якимось близьким, але нефункціональним аналогом.
Перспективи хімічного та ферментативного синтезу THCA-C4
Перспективи хімічного та ферментативного синтезу THCA-C4, як перспективного гомолога канабіноїдної кислоти, розгортаються у двох фундаментально різних, але комплементарних напрямах: стратегічне органічне моделювання та біокаталіз із використанням спеціалізованих ферментів, зокрема синтетаз і оксидоредуктаз, що реалізують складні хемоселективні перетворення у м’яких умовах. Ці підходи, хоча й суттєво відрізняються за принципами, об’єднані загальною метою – отримання THCA-C4 у чистому вигляді, з контрольованою стереохімією та відтворюваними фізико-хімічними властивостями, придатними для подальшого дослідження біоактивності та взаємодії з канабіноїдною системою.
У випадку хімічного синтезу, центральною проблемою залишається побудова полікетидного ланцюга, здатного до стереоселективної циклізації з утворенням тетрагідроксипіранонового кільця, що є характерним для канабіноїдів. На відміну від синтезу більш довголанцюгових гомологів, структура THCA-C4 більш чутлива до перегрупувань і деградації, особливо під час введення бутильного фрагмента в початкові стадії. Один із перспективних напрямів полягає у використанні фазово-розділених систем, де різні сегменти молекули формуються в окремих фазах і конвергентно з’єднуються через активовані інтермедіати, як-от еноляти, ацильні хлориди або малонатні ефіри.
Зокрема, перспективною виявилась стратегія модульного синтезу з використанням уніфікованих каркасів із заданою реактивністю, до яких в заданий момент приєднується бутильний залишок. Такий підхід дозволяє уникати багатостадійного розгалуження і мінімізує ризик утворення непотрібних ізомерів. В експериментах із бутилованими фенолами було показано, що використання м’яких електрофілів, наприклад, бутирилових тіоестерів у присутності баз Льюїса (типу ZnCl₂), забезпечує кращий контроль над положенням приєднання і дозволяє уникнути неконтрольованої арильної міграції. Це відкриває перспективи для масштабування хімічного синтезу з мінімальними втратами при очистці.
Окремим вектором розвитку хімічного підходу є використання реакцій фотохімічного каталізу. Завдяки застосуванню видимого світла і сенсибілізаторів нового покоління (на зразок іридієвих комплексів) стало можливим генерувати радикальні інтермедіати з високою специфічністю. Наприклад, спроби ініціювати радикальну циклізацію бутильованих полікетонів із одночасною утворенням канабіноїдоподібного ядра показали перспективу в управлінні регіо- та діастереоселективністю, що раніше залишалась слабким місцем хімічного синтезу подібних гомологів. В цьому контексті новітні фотокаталітичні системи дозволяють не лише покращити вихід реакцій, але й реалізувати перетворення при кімнатній температурі, що критично для нестабільних THCA-гомологів.
Ще одним цікавим напрямком є хемоселективне окислення частково зібраного канабіноїдного фрагмента з утворенням кінцевої карбонової кислоти. Замість традиційних окисників, таких як хлорхромати або перманганати, розглядається використання органокаталітичних систем на основі TEMPO або флавінових похідних, які здатні вибірково окислювати аліфатичні спирти в кислоти без ушкодження ароматичної системи. Комбінація таких каталітичних систем із мікрофлюїдними реакторами дозволяє тонко контролювати час реакції, температуру і рН, що є ключовим для уникнення побічних реакцій, зокрема декарбоксилювання.
Ферментативний підхід, у свою чергу, пропонує абсолютно інші переваги. Центральним елементом тут виступають канабіноїдсинтази – ферменти, які каталізують циклізацію олігокетидних прекурсорів у тетрагідроканабінолові кислоти. Класичною моделлю є THCA-синтаза з Cannabis sativa, однак її субстратна специфічність орієнтована переважно на тетрагідроканнабіновий прекурсор з пентиловим ланцюгом. Для перенесення ферментативного синтезу на THCA-C4 потрібна або модифікація природного ферменту (через сайт-специфічний мутагенез), або пошук альтернативних ензимів у менш досліджених видах Cannabis ruderalis, Humulus lupulus або навіть у симбіотичних грибах.
Один із найперспективніших напрямів тут – використання методів білкової інженерії для реконструкції активного центру THCA-синтази. Мутації в зонах взаємодії із субстратом дозволяють адаптувати фермент до коротколанцюгових аналогів, як-от бутиловий CBGA (каннабігероловий кислотний попередник). Дослідження в цьому напрямку вже показали, що заміна амінокислот на позиціях 191, 314 і 442 у THCA-синтазі призводить до помітного зростання перетворення C4-прекурсора у відповідний кислотний продукт, без зниження селективності. Такий фермент може бути експресований у рекомбінантних системах, зокрема в Saccharomyces cerevisiae або Pichia pastoris, що дозволяє забезпечити достатній вихід для дослідницьких потреб.
Іншим біокаталітичним інструментом є система комбінації ферментів – наприклад, застосування каскаду, де перший фермент утворює бутилований олігокетид, а другий (модифікований THCA-синтазоподібний ензим) каталізує циклізацію та окислення. У таких системах важливо забезпечити компартменталізацію – просторове або часово розділене виконання етапів, аби уникнути деградації проміжних продуктів. Це особливо критично для C4-гомологів, які демонструють нестійкість до ферментативного гідролізу або автоокислення в розчинах.
Біосинтетичні платформи, засновані на генетично модифікованих мікроорганізмах, відкривають новий рівень контрольованості синтезу. У цьому контексті перспективним вважається впровадження генів полікетидсинтаз, олефінредуктаз і специфічних канабіноїдсинтаз у штами E. coli або Corynebacterium glutamicum, де вони функціонують як модульна система. Розрахункове моделювання таких шляхів (метаболомний інжиніринг) дозволяє з високою точністю передбачити метаболічні вузькі місця і оптимізувати експресію на рівні транскрипції або трансляції. Це особливо важливо при роботі з нестандартними субстратами на кшталт бутилованого GPP (герилгеранілпірофосфату), який виступає ключовим попередником у синтезі коротколанцюгових канабіноїдів.
Також не варто ігнорувати застосування ферментів у постсинтетичній обробці. Оксидази, декарбоксилази та гідроксилази можуть бути використані для модифікації вже частково зібраного THCA-C4 або для перетворення сумішей ізомерів у більш чисті форми. Успішна ізоляція таких ферментів із рідкісних ґрунтових бактерій або мікробіому канабісу дає підстави сподіватись на створення цілісної ферментативної лінії без потреби в агресивних хімічних реагентах.
Методи виявлення та підтвердження структури THCA-C4
Ідентифікація та підтвердження структури THCA-C4 як окремого канабіноїдного гомолога вимагає застосування високоточних, чутливих і мультидисциплінарних аналітичних методів, здатних не лише встановити молекулярну масу й атомний склад, але й достовірно верифікувати позиції функціональних груп, геометрію зв’язків, а також стереохімічні параметри. На відміну від виявлення основних фітоканабіноїдів, ідентифікація маловідомих і рідкісних гомологів, таких як THCA-C4, стикається з низкою складнощів: низький рівень природного вмісту, значна структурна схожість із іншими кислотами канабіноїдного ряду, висока чутливість до деградації, а також потенційна присутність ізомерів. У зв’язку з цим застосування одиничного методу аналізу є недостатнім: необхідний комплексний підхід, що об’єднує хроматографію, мас-спектрометрію, спектроскопію ядерного магнітного резонансу та кристалографію.
Першим етапом у виявленні THCA-C4 зазвичай виступає високоефективна рідинна хроматографія (ВЕРХ), яка дозволяє відокремити аналіт від матриці рослинного екстракту або продукту синтезу. Проте класична обернено-фазова ВЕРХ часто не забезпечує достатньої роздільної здатності між THCA-C4 та його близькими аналогами, такими як THCA-A або THCA-B. Тому використовується градієнтна хроматографія з мобільними фазами на основі форміату амонію або ацетату при строго контрольованому рН, а в якості стаціонарної фази застосовуються колонки з фазами на основі збагаченого діолу або флуорофільних матеріалів. Це покращує розділення на основі відмінностей у дипольному моменті, що характерні саме для C4-гомолога.
Для підвищення специфічності ВЕРХ поєднують з тандемною мас-спектрометрією (LC-MS/MS), яка дозволяє детально дослідити фрагментацію молекули. THCA-C4 має специфічні патерни розпаду, зокрема характерну втрату карбоксильної групи (-CO₂) із формуванням іонів з масою 314 та 299 Da, що корелює з бутильним бічним ланцюгом. Для точного визначення маси використовується високороздільна мас-спектрометрія (HRMS) на приладах типу Orbitrap або TOF (time-of-flight), де досягається роздільність понад 100 000 і точність менше 1 ppm. Це дозволяє впевнено диференціювати THCA-C4 від ізомерних сполук або деградованих форм, що мають схожу молекулярну масу.
Особливу цінність має аналіз із застосуванням ізотопного моделювання. Оскільки THCA-C4 має чіткий ізотопний підпис, пов’язаний із вмістом ^13C, його можна відрізнити від синтетичних або забруднених аналогів. Ізотопна мас-спектрометрія дозволяє виявити відхилення в природному розподілі ізотопів, що особливо корисно при аналізі екстрактів сумнівного походження або ферментативно синтезованих зразків.
Для остаточного підтвердження структури застосовується спектроскопія ядерного магнітного резонансу (^1H-NMR, ^13C-NMR), яка дозволяє відтворити топологію молекули на основі хімічних зсувів та спін-спінової взаємодії. Важливим аспектом є аналіз протонів у області 5.8-6.5 ppm, які свідчать про присутність олефінової системи канабіноїдного ядра, а також сигналів у 3.2-3.8 ppm, що вказують на присутність оксифункціоналізованих позицій, зокрема гідроксильної групи на С-11. Важливо, що бутильний замісник створює специфічні сигнали у високопольовій області (0.85-1.2 ppm), які чітко відрізняються від пентилових аналогів, де відбувається перекриття сигналів з аліфатичними залишками.
Додатково проводиться 2D-NMR спектроскопія (COSY, HSQC, HMBC), що дозволяє встановити зв’язки між окремими атомами в межах молекули. Методика HMBC є особливо корисною для виявлення довготривалих взаємодій між карбоновими і протонними ядрами в різних частинах молекули, що критично для підтвердження положення карбоксильної функції на С-1. Для бутильного фрагмента ключовим є встановлення конформаційної рухливості – цей параметр вивчається за допомогою NOESY-аналізу, який дає змогу простежити просторові взаємодії між атомами в межах 5 Å.
На додаток до класичної спектроскопії застосовується інфрачервона спектроскопія у комбінації з фур’є-трансформацією (FTIR). Вона дає змогу виявити характерні піки в ділянці 1680-1720 см⁻¹, що відповідають вібраціям карбоксильної групи, та піки в області 3200-3500 см⁻¹, пов’язані з гідроксильними коливаннями. У випадку THCA-C4 спостерігається незначне зміщення цих піків порівняно з THCA-A через вплив коротшого аліфатичного ланцюга на електронну густину. Такі відхилення, хоча і малі, є стабільними та діагностично важливими.
Незамінним інструментом для структурної верифікації є рентгеноструктурний аналіз (XRD), який дозволяє побудувати тривимірну модель молекули на основі дифракції рентгенівських променів на кристалічній формі речовини. Проблемою є кристалізація нестабільного THCA-C4, однак методи ко-кристалізації з допоміжними молекулами (наприклад, з трифенілметаном або хіральними органічними матрицями) дали змогу в окремих випадках отримати достатньо стабільні форми. Отримана кристалічна структура дозволяє не лише підтвердити абсолютну конфігурацію хіральних центрів, але й з високою точністю виміряти довжини зв’язків і валентні кути – що критично для диференціації ізомерних форм або підтвердження унікальної геометрії.
Новітні методи також включають електронну спектроскопію з аналізом ультрафіолетового та видимого світла (UV-Vis). Хоча ці методи менш специфічні, вони є корисними для попередньої ідентифікації та контролю чистоти. THCA-C4 демонструє характерні піки поглинання в області 275-285 нм, пов’язані з π→π* переходами у кон’югованій системі, які зсуваються залежно від довжини аліфатичного ланцюга.
Останнім часом особливу увагу привертають гібридні методи, зокрема LC-NMR-MS, які дозволяють одночасно реєструвати хроматограму, спектр мас і NMR у режимі in-line без потреби попереднього очищення. Це критично важливо для нестабільних канабіноїдів, які можуть втрачати функціональність під час тривалої підготовки проби. У поєднанні з хемометричним аналізом (наприклад, PCA або OPLS-DA) такі методи дозволяють проводити багатовимірне розрізнення структурно подібних канабіноїдів.
У перспективі також досліджується застосування технологій одноклітинного спектрального аналізу (Raman spectroscopy, MALDI-TOF-IMS), що дозволяє локалізувати THCA-C4 у конкретних клітинах рослинної тканини або в межах біоплівок ферментативних систем. Це дає змогу не лише ідентифікувати, а й картографувати поширення гомолога в біологічному середовищі, відкриваючи нові горизонти в дослідженнях його біосинтезу, розподілу та функціональності.
Як THCA-C4 поводиться в організмі
Поводження THCA-C4 в організмі людини або тварин ще не досліджено системно, проте з огляду на його хімічну будову, гомологічність із іншими канабіноїдними кислотами, а також на основі даних з аналогів, можна побудувати обґрунтовану гіпотетичну модель його фармакокінетики й біодоступності. Основними етапами метаболічної долі молекули в організмі є: абсорбція, трансмембранний транспорт, розподіл у тканинах, трансформація в печінці, потенційна біоактивація або деградація, а також елімінація. Усі ці фази залежать від фізико-хімічних властивостей THCA-C4, зокрема його кислотності, гідрофобності, розміру молекули, ступеня іонізації в біологічних середовищах та здатності до взаємодії з білками-переносниками й ензимами.
Оскільки THCA-C4 є полярною кислотою із збереженою карбоксильною групою, його пасивне проникнення крізь клітинні мембрани, які мають ліпофільний характер, обмежене. У неіонізованій формі він має дещо вищу проникність, але при фізіологічному рН (~7.4) переважає іонізована форма, яка погано дифундує крізь фосфоліпідний бішар. Це передбачає низьку біодоступність при пероральному застосуванні без додаткових транспортних механізмів. Одним із таких механізмів може бути залучення білків-переносників класу OATP (organic anion transporting polypeptides) або MCT (monocarboxylate transporters), які експресуються на апікальних мембранах клітин кишківника і здатні захоплювати карбоксильовані сполуки.
Важливою характеристикою є здатність THCA-C4 зв’язуватися з білками плазми, зокрема альбуміном. Через наявність гідрофобної канабіноїдної частини та кислого фрагмента, він одночасно утворює водневі зв’язки та гідрофобні взаємодії, що забезпечує високе споріднення до транспортних білків. Така зв’язана форма є фармакологічно неактивною, проте створює резервуар у крові, з якого молекула поступово вивільняється. Це може призводити до затримки піку концентрації в плазмі, що ускладнює прогнозування фармакодинамічних ефектів.
Розподіл THCA-C4 у тканинах, згідно з аналогією до інших кислот канабіноїдного ряду, вірогідно відбувається нерівномірно. Переважне накопичення спостерігається у високоперфузованих органах – печінці, нирках, легенях, а також у тканинах із високим вмістом ліпідів, таких як мозок. Проте через полярність молекули і низьку проникність крізь гематоенцефалічний бар’єр очікується обмежене надходження в ЦНС у незміненій формі. Це частково пояснює відсутність психоактивного ефекту в сирих екстрактах канабісу з високим вмістом кислотної форми.
У печінці THCA-C4 може піддаватися фазі І біотрансформації, зокрема шляхом окиснення та гідроксилювання за участю ферментів цитохрому P450. Наявність бутильного ланцюга, на відміну від пентильного в THCA-A, створює інший стереохімічний профіль, що може змінювати афінність до конкретних ізоформ CYP, зокрема CYP2C9, CYP3A4 або CYP2D6. Продукти такої трансформації теоретично можуть включати гідроксильовані метаболіти, які набувають нових властивостей – або підвищеної водорозчинності, або, навпаки, латентної біоактивності. Проте відсутність досліджень in vivo ускладнює оцінку значущості цих метаболітів.
Фаза ІІ біотрансформації – кон’югація з глюкуроновою кислотою або сульфатування – імовірно відбувається швидко, оскільки карбоксильна група є класичною мішенню для глюкуронідтрансфераз. Це прискорює виведення речовини через нирки, хоча можливе й печінкове виділення у вигляді біліарних кон’югатів. Ці процеси, як правило, зменшують біоактивність і час перебування в системному кровотоці, однак існує теоретична ймовірність, що певні кон’югати можуть бути зворотно гідролізовані мікробіотою кишківника з повторним всмоктуванням – тобто реалізується ентерогепатична рециркуляція.
З огляду на структурні особливості THCA-C4, особливу увагу слід звернути на його потенційну участь у взаємодіях із системами ендокринної регуляції та клітинного сигналювання. Хоча канабіноїдні рецептори є ключовими мішенями, не виключено, що THCA-C4 може впливати на інші молекулярні шляхи – зокрема, інгібувати ферменти класу циклооксигеназ або впливати на іонні канали. Крім того, його кислотна природа дає підстави припускати, що молекула може діяти як лізосомотропний агент, накопичуючись у кислих компартментах клітин – що потенційно може змінювати внутрішньоклітинну сигналізацію.
Фармакокінетичний профіль THCA-C4 вірогідно має залежність від форми введення. При ентеральному введенні очікується низька біодоступність через метаболізм першого проходження, тоді як при сублінгвальному чи трансдермальному шляху можливе часткове уникнення печінкового метаболізму. У разі парентерального введення (що наразі не практикується для канабіноїдів) молекула одразу потрапляє в системний кровотік, проте нестабільність у водних розчинах і ризик преципітації обмежує цю стратегію.
Іншою гіпотезою, яка потребує верифікації, є участь THCA-C4 у мікробіом-опосередкованих механізмах. Відомо, що багато фенольних сполук, включаючи похідні канабіноїдів, метаболізуються бактеріями кишківника з утворенням вторинних метаболітів. З огляду на хімічну реактивність THCA-C4, можливе мікробне декарбоксилювання або навіть ферментативне модифікування в межах мікробіоти. Такі модифіковані молекули можуть володіти новими властивостями, зокрема впливати на імунну систему або метаболізм холестерину, що розширює потенційні фізіологічні ролі THCA-C4 поза межами класичної канабіноїдної дії.
Ймовірна взаємодія з канабіноїдними рецепторами
Вивчення потенційної взаємодії THCA-C4 з канабіноїдними рецепторами типу CB1 і CB2 є складним завданням, оскільки жодне з досліджень на сьогодні не характеризує цю молекулу з точки зору афінності до рецепторів, функціональної активності або структурно-біологічної відповідності. Однак, базуючись на аналізі електронної щільності, просторової конформації, функціональних груп і характеру бічного ланцюга, можна гіпотетично реконструювати модель її можливої взаємодії з цими рецепторами.
Початковий аспект – це відповідність THCA-C4 структурним вимогам до лігандів канабіноїдних рецепторів. Рецептори CB1 і CB2 мають гідрофобну кишеню зв’язування в межах трансмембранних доменів GPCR (G-protein coupled receptors). Для ефективної взаємодії з цими сайтами молекула має містити певний набір функціональних елементів: (1) ароматичну або частково насичену циклічну систему для π-π або ван дер Ваальсових взаємодій із залишками фенілаланіну/триптофану; (2) бічний ліпофільний ланцюг, який “якорить” молекулу в кишені рецептора; (3) гідроксильну або карбоксильну групу, яка формує водневі зв’язки з полярними амінокислотами. THCA-C4 відповідає цим вимогам лише частково.
На відміну від активної форми Δ⁹-THC, яка має нейтральну, ліпофільну природу, THCA-C4 зберігає полярну карбоксильну групу, що істотно змінює його електростатичний профіль і pKa. Це означає, що в нейтральному середовищі рецептора (всередині гідрофобної кишені білка) THCA-C4 перебуватиме переважно в іонізованій формі. Така форма енергетично нестабільна в ліпофільному середовищі й ускладнює якірну взаємодію з рецептором. Проте наявність бічного бутильного ланцюга, хоча й коротшого за пентильний у THCA-A, може частково компенсувати цей ефект завдяки стабілізації молекули в гідрофобному ядрі рецептора.
Кристалографічні моделі рецепторів CB1 показують, що афінність до них дуже чутлива до довжини та просторової орієнтації бічного ланцюга. У THCA-C4 він має чотири атоми вуглецю, що робить його менш гнучким і трохи менш об’ємним, ніж у канонічного Δ⁹-THC. Зменшення довжини ланцюга зазвичай асоціюється зі зниженням афінності до CB1-рецептора, тоді як CB2 є менш чутливим до цього параметра. Це дозволяє припускати, що THCA-C4, у разі зв’язування з рецептором, імовірніше демонструватиме більшу спорідненість до CB2 або навіть вибірковість, зумовлену просторовими характеристиками активного центру цього підтипу.
Додатковим важливим фактором є об’єм і електростатична асиметрія молекули. THCA-C4 має кислотний характер, але також включає ароматичні та терпенові фрагменти, що створює мультиполярну електронну карту поверхні. Це потенційно забезпечує кілька точок контакту з рецептором: одна – через гідроксильну групу в положенні 1′, інша – через енольну або фенольну групу бензоїдного кільця, і третя – через карбоксильний радикал. Однак така багатоточкова взаємодія часто не корелює з агонізмом. Навпаки, вона може стабілізувати рецептор у неактивному або частково активованому стані – тобто THCA-C4 може бути слабким парціальним агоністом або навіть алостеричним модулятором.
Існує також ймовірність, що THCA-C4 взагалі не зв’язується з ортостеричним сайтом рецептора, а впливає на його функцію через алостеричну кишеню. Така дія була доведена для деяких ендоканабіноїдів і синтетичних аналогів, які, не активуючи рецептор самостійно, модулюють ефективність або афінність інших лігандів. Якщо THCA-C4 виступає негативним або позитивним алостеричним модулятором, це може пояснити відсутність психоактивності, поєднану з м’якими імуномодулювальними або нейропротекторними ефектами, що часом спостерігаються для канабіноїдних кислот у загальному.
Окреме питання – здатність THCA-C4 активувати або інгібувати інші рецептори канабіноїдної системи, зокрема GPR55, GPR18 і TRP-канали (зокрема TRPV1, TRPA1). У багатьох дослідженнях було показано, що кислотні форми канабіноїдів демонструють активність на цих мішенях незалежно від CB1/CB2. Наприклад, THCA-A виявляв здатність інгібувати TRPM8 та активувати TRPA1, що зумовлює знеболювальні й протизапальні ефекти. Враховуючи структурну близькість, можна припустити, що THCA-C4 має подібний фармакологічний профіль. При цьому вплив на GPR55, який деякими дослідниками вважається третім типом канабіноїдного рецептора, може бути або агоністичним, або нейтральним, залежно від конформації молекули в конкретному середовищі.
Інші потенційні сценарії включають конкурентне інгібування активного ліганду. У випадку одночасного введення THCA-C4 з Δ⁹-THC, молекула THCA-C4 може частково витісняти THC із рецепторного сайту через просторову компетицію, знижуючи загальну силу активації CB1. Така дія відповідає механізму часткового антагонізму або неконкурентної модуляції. Це явище має фармакологічну важливість, оскільки може бути використане для створення профілю продуктів канабісу з регульованою психоактивністю.
У молекулярному аспекті важливо розглянути також питання динаміки рецепторного комплексу. CB1 і CB2 рецептори мають здатність до десенсибілізації й інтерналізації після активації. Якщо THCA-C4 зв’язується з рецептором, але не викликає його внутрішньої мобілізації, це може стабілізувати рецептор на поверхні клітини, змінюючи його реактивність до інших лігандів. Такий ефект можливий лише у випадку слабкої або алостеричної взаємодії.
Що змінюється після декарбоксилювання
Декарбоксилювання є фундаментальним перетворенням, яке змінює не лише хімічну структуру молекули THCA-C4, а й усю її фармакологічну, біофізичну та метаболічну поведінку. У випадку THCA-C4, як і для інших канабіноїдних кислот, цей процес супроводжується втратою карбоксильної групи (-COOH) через термічне або ферментативне руйнування, що спричиняє формування нейтрального канабіноїду, умовно аналогічного до Δ⁹-THC, але з бутильним (C4) ланцюгом замість пентильного (C5). Однак ефекти цієї реакції виходять далеко за межі простого відщеплення CO₂ – вона викликає каскад конформаційних, електронних, рецепторних і кінетичних змін, які визначають кінцевий біологічний профіль молекули.
Почнемо з фундаментального: структурна перебудова молекули після декарбоксилювання змінює її електронну густину, зарядову симетрію та гідрофобність. Карбоксильна група, яка була відповідальною за кислотність THCA-C4, забирає з собою полярність та негативний заряд. Це перетворює молекулу з іонізованого стану на нейтральну, що істотно змінює її здатність проходити через біологічні мембрани. Якщо THCA-C4 був погано абсорбований через слизову оболонку шлунково-кишкового тракту або гематоенцефалічний бар’єр, то його декарбоксильований аналог – нейтральний C4-THC – виявляє високу мембранну проникність завдяки збільшеній ліпофільності.
Другою ключовою зміною є рецепторна активність. Канабіноїдні рецептори CB1 і CB2 демонструють високу чутливість до форми молекули. У незміненому вигляді THCA-C4 має низьку або майже нульову афінність до цих рецепторів через наявність карбоксильної групи, яка заважає ефективному розміщенню молекули в гідрофобній кишені рецептора. Проте після декарбоксилювання утворюється структура, значно ближча до активної форми Δ⁹-THC, імовірно C4-THC, яка демонструє здатність до прямої взаємодії з CB1 – тобто може індукувати психоактивний ефект. Унікальність полягає в тому, що бутильний ланцюг, на відміну від пентильного, знижує афінність до CB1-рецептора, але не блокує її повністю. Це створює сценарій помірної, дозозалежної активації CB1, яка може мати м’який або селективно модифікований психоактивний ефект, відмінний від класичного Δ⁹-THC.
Також після декарбоксилювання змінюється метаболічна доля молекули. У кислому стані THCA-C4 не є субстратом для ферментів печінки, зокрема цитохрому P450 (ізоферменти CYP2C9, CYP3A4), через свою високу полярність. Але після перетворення на нейтральний C4-THC, молекула може вступати в реакції гідроксилювання, деметилювання та кон’югації (глюкуронування, сульфування). Це змінює профіль циркулюючих метаболітів у крові, які можуть бути активними самостійно або впливати на рецепторний зворотний зв’язок. Наприклад, можливе утворення 11-гідрокси-C4-THC – потенційно активного метаболіту з підвищеною здатністю проникати в мозок.
Важливим є також те, що після декарбоксилювання змінюється конфігурація конформаційної стабільності молекули. Карбоксильна група, за рахунок внутрішньомолекулярного водневого зв’язування, стабілізує структуру THCA-C4 у фіксованій конформації. Втрата цієї групи робить молекулу гнучкішою, знижуючи її ентальпію стабільності, але підвищуючи здатність адаптуватися до рецепторного середовища. Така пластичність сприяє більш ефективному докінгу з рецепторами, включаючи не тільки CB1/CB2, але й TRPV1, GPR55, GPR18.
Після декарбоксилювання також змінюється фізико-хімічна поведінка молекули в різних середовищах, зокрема її розчинність, точка кипіння, стабільність до окиснення. THCA-C4 має високу гігроскопічність і погано розчиняється в неорганічних розчинниках. Натомість декарбоксильований C4-THC є більш стабільним у неполярних середовищах, краще розчиняється в етанолі, хлороформі, ДМСО, що відкриває шлях до його інкапсуляції, трансдермального транспорту та фармацевтичного формулювання.
З точки зору біоакумуляції, C4-THC, на відміну від THCA-C4, може зв’язуватися з ліпопротеїнами плазми (особливо з альбуміном та HDL), що забезпечує триваліше перебування в кровообігу та більший об’єм розподілу. Це веде до тривалішого ефекту, навіть при меншій дозі, і потенційно підвищує системну біодоступність. Окрім того, здатність до проходження через гематоенцефалічний бар’єр різко зростає – нейтральна ліпофільна молекула здатна ефективно проникати в центральну нервову систему, де і реалізує свою активність.
Фармакодинамічно, C4-THC після декарбоксилювання може мати вибіркову рецепторну дію, оскільки бутильний ланцюг не лише знижує афінність до CB1, але й змінює функціональний профіль взаємодії. Імовірно, молекула діє як парціальний агоніст CB1 із неповною внутрішньоклітинною сигналізацією, що веде до менш виражених ефектів – зниження тиску, зменшення болю, модифікація настрою без типової ейфорії або психомоторного збудження. Одночасно CB2-активація, яка частіше асоціюється з імуномодулюючими ефектами, може бути більш вираженою, враховуючи просторові особливості кишені CB2 і поліпшену відповідність C4-ланцюга.
Після декарбоксилювання змінюється й взаємодія молекули з ензиматичними системами розпізнавання чужорідних речовин, зокрема UGT і SULT. THCA-C4, як кислотна молекула, уникає активного глюкуронування, натомість C4-THC швидко вступає в реакцію з глюкуроновою кислотою, що знижує його активність і прискорює екскрецію. Це відкриває можливість фармакокінетичного регулювання дії шляхом модуляції ферментів II фази біотрансформації.
Останній важливий аспект – токсикологічна й імунна поведінка. THCA-C4 як кислота є значно менш активною в провокуванні нейрозапальних або поведінкових реакцій. Після декарбоксилювання утворена молекула може мати вищу здатність до індукції CB1-залежних побічних ефектів (тривога, тахікардія, зміни координації), особливо у чутливих груп. У той же час, завдяки зниженій потужності в порівнянні з Δ⁹-THC, ці ефекти менш виражені. Імунна дія також стає більш вираженою, оскільки нейтральні канабіноїди активніше впливають на CB2-рецептори в клітинах імунної системи.
Чи може він мати терапевтичну дію
Питання потенційної терапевтичної активності THCA-C4 та його декарбоксильованої форми C4-THC – це не лише спроба екстраполяції з уже вивчених канабіноїдів, але й потреба в системному аналізі унікального фармакофору, який характеризується варіативністю бічного алкільного ланцюга та відмінною метаболічною долею. На відміну від THCA-A чи Δ⁹-THC, бутильна (C4) конфігурація надає цій молекулі не просто знижену рецепторну афінність, а й потенційну специфіку взаємодії з низкою неканонічних цілей – від TRP-каналів до сигнальних шляхів, що модулюють оксидативний стрес, автофагію та імунну відповідь. Це відкриває широкий спектр фармакологічно релевантних напрямів, які можуть зробити THCA-C4 та його похідні перспективними у контексті терапії як загальних, так і рідкісних захворювань.
Почати слід з нейропротекторного потенціалу. Канабіноїдні кислоти, імовірно включаючи THCA-C4, здатні модулювати експресію генів, відповідальних за синтез антиоксидантних ферментів – каталази, супероксиддисмутази, глутатіонпероксидази. Ця активність не обов’язково потребує рецепторної взаємодії, оскільки може реалізовуватись через вплив на ядерний фактор транскрипції NRF2. У разі хронічних нейродегенеративних станів – хвороба Альцгеймера, Паркінсона, Хантінгтона – така дія є цінною завдяки можливості зменшення оксидативного стресу без супутньої психоактивності. Додатково, THCA-C4 здатний пригнічувати каспазозалежні механізми апоптозу нейронів, що додає ще один механізм збереження нейронального пулу.
Другим перспективним напрямком є протизапальна дія. Тут THCA-C4 імовірно діє за рахунок селективного пригнічення циклооксигенази-2 (COX-2), яка відіграє ключову роль у генерації простагландинів під час запалення. Дослідження аналогів із C3-C5-ланцюгами показують, що кислотні форми можуть бути селективними COX-2-інгібіторами з помірною активністю, але високою безпечністю. Цей ефект може бути посилений через взаємодію з рецепторами PPARγ – ядерними регуляторами експресії прозапальних генів. Важливо зазначити, що PPARγ-активність пов’язана також з антипроліферативними ефектами в деяких онкологічних моделях, зокрема колоректального раку, що робить THCA-C4 потенційним кандидатом для ад’ювантної терапії.
Ще одна релевантна властивість – протиблювотна активність. Хоча кислотні канабіноїди не демонструють класичної протиблювотної дії через CB1, існують дані, що THCA-ізомери здатні взаємодіяти з серотоніновими рецепторами 5-HT3. Саме ці рецептори відповідають за індукцію блювоти при хіміотерапії, тому їх блокада дає виражений ефект навіть при низьких дозах. Якщо THCA-C4 має спорідненість до 5-HT3, це відкриває йому шлях до застосування як протиблювотного засобу без характерного для Δ⁹-THC побічного психотропного ефекту. Таке фармакологічне вікно є особливо цінним у паліативній онкологічній терапії.
Окремо варто розглянути вплив на периферичну ноцицепцію. C4-гомологи після декарбоксилювання здатні частково активувати CB2-рецептори, які локалізуються в імунних клітинах, ендотелії та периферичних нейронах. Це відкриває можливість пригнічення ноцицептивної передачі без участі центрального CB1-механізму, тобто без седативності чи змін психіки. Цей підхід перспективний у випадках хронічного болю неонкогенної природи – ревматоїдний артрит, нейропатія, інтерстиціальні запалення.
Іншим механізмом аналгезії може бути взаємодія з TRP-каналами, насамперед TRPV1 і TRPA1. Ці іонні канали беруть участь у передачі сигналів болю, тепла, запалення. Відомо, що деякі нейтральні канабіноїди діють як агонисти TRPV1, викликаючи десенситизацію каналів і зниження больового сигналу. Якщо C4-THC має подібну дію, це зробить його потенційним компонентом топічних формул – мазей, гелів, пластирів – для локального знеболення при міалгіях, артритах, травмах.
Не менш важливою є ймовірна імуномодулююча дія. CB2-рецептори, а також сигнальні шляхи GPR55 і PPARγ залучені до регуляції цитокінового профілю – зокрема інгібування IL-6, TNF-α, IFN-γ. Це дозволяє розглядати THCA-C4 як потенційний засіб для терапії аутоімунних захворювань (системний червоний вовчак, склероз), постінфекційних синдромів (long COVID) або хронічного системного запалення (метаболічний синдром, неалкогольний стеатогепатит). Водночас зниження продукції прозапальних цитокінів без генералізованої імуносупресії – значна перевага над кортикостероїдами.
Перспективною, але малодослідженою є антиконвульсивна активність. Деякі C4-гомологи канабіноїдів мають здатність пригнічувати глутаматергічну передачу та активувати аденозинові рецептори A1, що веде до зменшення збудливості нейронів. Якщо THCA-C4 або його метаболіти чинять схожий вплив, це відкриває можливість його використання в терапії епілепсії, особливо фармакорезистентних форм, таких як синдром Леннокса-Гасто або синдром Драве.
Цікавим залишається і вплив THCA-C4 на метаболічний гомеостаз, особливо у контексті глюкозної толерантності та ліпідного профілю. Ймовірна активація PPARα і AMPK (кіназа, що регулює енергетичний баланс клітин) вказує на потенціал молекули в контролі інсулінорезистентності, зниженні рівня тригліцеридів, профілактиці жирової дистрофії печінки. Такий ефект важливий для пацієнтів з метаболічним синдромом або цукровим діабетом 2 типу, яким протипоказані стимулятори апетиту або психоактивні канабіноїди.
Окремо заслуговує уваги потенціал C4-THC у терапії дерматологічних патологій. Завдяки своїй нейтральній формі, молекула добре проникає в епідерміс, а локальна активація CB2/TRPV1 у кератиноцитах може зменшувати гіперпроліферацію клітин, свербіж та запалення. Це відкриває шлях до використання C4-THC у лікуванні псоріазу, атопічного дерматиту, акне. Сучасні дані показують, що топічні канабіноїди з коротшим бічним ланцюгом мають нижчу системну біодоступність, що знижує ризик системних ефектів.
Останній напрямок – кардіоваскулярна дія. Існують підстави вважати, що THCA-C4 і його похідні здатні впливати на тонус судин за рахунок активації ендотеліальної NO-синтази, що веде до вазодилатації. Це створює гіпотензивний ефект, потенційно корисний при артеріальній гіпертензії або судинній дистонії. Крім того, активність щодо кальцієвих каналів L-типу в кардіоміоцитах може модулювати скоротливість серця без значного зниження частоти скорочень, що є перевагою для пацієнтів із серцевою недостатністю.
Перспективи застосування
THCA-C4, як один із рідкісних гомологів канабіноїдної кислоти з чотиривуглецевим (бутильним) бічним ланцюгом, має потенціал для багатоаспектного використання, який виходить далеко за межі традиційного канабіноїдного контексту. На відміну від канонічних метаболітів типу THCA-A чи Δ⁹-THC, ця сполука відкриває нові можливості завдяки своїй незвичній хімічній конфігурації, специфічній рецепторній взаємодії, високій структурній стабільності й унікальному сліду в хемомічному профілі рослин. У результаті її застосування може охоплювати як фармакологію та медицину, так і аналітичну хімію, біотехнології, агрономію та судову експертизу. Саме міждисциплінарний характер потенціалу THCA-C4 є тим аспектом, що заслуговує на детальний аналіз із точки зору стратегічного розвитку наукових, промислових і клінічних напрямів.
Одним із найочевидніших векторів є фундаментальні й прикладні дослідження в рамках нової фармакогнозії – дисципліни, що вивчає біоактивні компоненти природного походження як основу для створення ліків нового покоління. THCA-C4, завдяки своїй неканонічній будові, може використовуватись як модельна структура для вивчення SAR (structure-activity relationship) залежностей у межах канабіноїдної хімії. Вона дозволяє експериментально перевірити, які саме структурні ознаки канабіноїдного ядра визначають спорідненість до рецепторів CB1, CB2, TRPV1, GPR55 чи ферментів, що беруть участь у запальних каскадах. У свою чергу, ці дані можуть закласти підґрунтя для дизайну синтетичних аналогів, які будуть мати більшу вибірковість і кращий профіль безпечності.
Другим напрямком, що має прикладне значення, є розвиток селективної терапії на основі так званої прецизійної медицини. У межах цього підходу THCA-C4 можна розглядати не лише як діючу молекулу, а і як фармакологічний зонд – інструмент для мапування специфічних шляхів у клітині або тканині, які можуть бути активовані лише при певній конфігурації рецепторів, білків або сигнальних систем. Це особливо важливо для рідкісних або важковиліковних станів, які не піддаються стандартним протоколам лікування – наприклад, атипові форми епілепсії, запальні енцефалопатії, мітохондріальні порушення або мультисистемні запальні синдроми.
Водночас THCA-C4 набуває важливого значення в агробіотехнологіях і сучасній канабіс-селекції. Завдяки своїй обмеженій природній присутності в стандартних сортах Cannabis sativa, цей канабіноїдний гомолог виступає як маркер нетипових метаболічних шляхів, які реалізуються лише за специфічної експресії унікальних варіантів ферменту THCA-синтази. Відтак, присутність THCA-C4 у хемотипі сорту може свідчити про глибоко змінений метаболічний ландшафт рослини, що відкриває шлях до створення штучно оптимізованих фенотипів з заданим канабіноїдним спектром. Ця можливість особливо перспективна для галузей, де потребується наднизький вміст Δ⁹-THC та високий рівень непсихоактивних метаболітів для фармацевтичного чи нутрицевтичного використання.
З погляду аналітичної хімії та хемометрії, THCA-C4 є цінним біомаркером. Його наявність, концентрація та співвідношення з іншими гомологами можуть вказувати на специфіку походження рослини, умови культивації, генотип або навіть особливості постобробки – такі як сушка, ферментація чи вплив ультрафіолету. Це робить THCA-C4 потенційним інструментом для ідентифікації фальсифікацій, встановлення автентичності продукту або верифікації джерела сировини в криміналістичних та митних експертизах. Оскільки ізомери з C4-ланцюгами рідко зустрічаються у високих концентраціях у дикорослих сортах, їх виявлення може вказувати на спеціалізовані сорти або навіть на цілеспрямоване генетичне редагування.
Із цього логічно випливає ще одна перспективна галузь – стандартизація. На відміну від поширених метаболітів, які варіюють у концентрації від врожаю до врожаю, THCA-C4 демонструє високу стабільність при зберіганні, незначну фотодеструкцію й передбачувану хроматографічну поведінку. Це дозволяє використовувати його як внутрішній стандарт у квалі- та кількісному визначенні канабіноїдного профілю, особливо у випадках низько-вмісних матриць (наприклад, косметичні продукти або канабіноїдні плівки для нанотерапії).
Ще одна ділянка застосування – нанофармація. Через свою кислотну природу та високу полярність THCA-C4 слабо проникає через ліпідні мембрани, але може інкапсулюватися у ліпосоми, наносфери або тверді ліпідні частинки. Це дає змогу розробити нові системи контрольованого вивільнення, орієнтовані на локальну або пролонговану доставку в запалені тканини, пухлинні мікросередовища чи бар’єрні структури (наприклад, гематоенцефалічний бар’єр). Таким чином, THCA-C4 розглядається як фармакофор для платформи переносників, які можуть забезпечити точкову терапію з мінімальними побічними ефектами.
У ширшому контексті біомедичних технологій THCA-C4 може бути застосований і як метаболічний сенсор. Через свою специфіку метаболізму та інактивації в печінці й тонкому кишечнику, він може бути індикатором активності окремих ферментативних систем – зокрема, UDP-глюкуронілтрансфераз, P450-ізоформ або епоксигідролаз. Це дає змогу застосовувати THCA-C4 у доклінічному скринінгу або як функціональне зондування при фармакокінетичних дослідженнях інших молекул, включно з поліфармацевтичними препаратами.
Ще одним цікавим напрямом є використання THCA-C4 у екотоксикології та навколишньому моніторингу. Його стабільність і специфічність дозволяють виявляти сліди сировини канабісу в ґрунті, воді або повітрі навіть за відсутності Δ⁹-THC чи його метаболітів. Це може мати значення для ідентифікації нелегальних посівів, відстеження слідів контрабандної продукції або контролю забруднення поблизу об’єктів переробки рослинної сировини.
На завершення слід зазначити, що THCA-C4 має перспективу і як молекулярна основа для патентного захисту нових формулювань. Його рідкісність і хімічна специфічність дозволяють створити низку похідних з унікальними властивостями, які не підпадають під існуючі патенти на Δ⁹-THC або CBD. Це відкриває шлях до інноваційної фармацевтичної розробки, де THCA-C4 може бути основою для препаратів із доданою вартістю в юридичному та клінічному сенсі.
Прецизійна медицина: THCA-C4 як молекулярна мішень
Застосування канабіноїдних сполук у прецизійній медицині передбачає їх розгляд не просто як фармакологічно активних агентів загального спектра, а як потенційних індивідуалізованих молекулярних мішеней для лікування конкретних пацієнтів, генотипів або клітинних патологій. У цьому контексті THCA-C4 (Δ9-тетрагідроканабінолова кислота C4), як один із малодосліджених гомологів класичного THCA, набуває окремої значущості. Його специфічна будова, відмінності у фізико-хімічних властивостях, нестабільна присутність у біологічному матеріалі та потенційна функціональна активність на молекулярному рівні формують передумови до використання THCA-C4 як інструменту в персоніфікованій фармакології.
Унікальність THCA-C4 у цьому контексті полягає, перш за все, у зміненому профілі хімічного сприйняття з боку біологічних рецепторних систем. У порівнянні з класичним THCA-A, який має пентаїлову бічну алкільну групу, THCA-C4 характеризується бутильною ланкою. Ця невелика структурна модифікація здатна докорінно змінювати не лише просторову конформацію молекули, але й її здатність до комплементарної взаємодії з білковими мішенями – зокрема, GPCR-рецепторами, ферментами класу оксидоредуктаз, а також мембранними транспортерами. Така відмінність дає змогу на рівні доклінічних досліджень моделювати вплив THCA-C4 як вузькоспеціалізованого ліганду в рамках рецепторного мапінгу, що є фундаментом прецизійної медицини.
Інший важливий аспект – це метаболічна доля THCA-C4 в умовах індивідуального ензимного профілю пацієнта. У випадку прецизійного лікування, визначальним стає не лише дія самої молекули, але й те, як вона метаболізується. Відомо, що деякі похідні THCA зазнають ферментативного гідролізу, оксидування або кон’югації під дією системи CYP450, UGT, NAT. Якщо THCA-C4 активується або знешкоджується в організмі з формуванням унікальних метаболітів – а ця гіпотеза має біохімічне підґрунтя з огляду на змінену розчинність і реакційну здатність бутильної ланки – це відкриває простір для побудови диференційованих терапевтичних моделей. У перспективі, такі моделі можуть бути адаптовані до індивідуального фармакокінетичного профілю людини, що й становить суть прецизійного підходу.
У терапевтичному контексті THCA-C4 може розглядатися як молекула, чия активність визначається селективною взаємодією з нетиповими або малодослідженими канабіноїдними рецепторами (наприклад, GPR18, GPR55, GPR119). Такі мішені не мають високої афінності до класичного Δ9-THC, але можуть специфічно реагувати на канабіноїдні кислоти з модифікованим бічним ланцюгом. У цьому сенсі THCA-C4 потенційно може відігравати роль селективного модулятора сигнальних каскадів, пов’язаних з імунорегуляцією, ангіогенезом, нейропротекцією або метаболічною адаптацією. Усі ці процеси є ключовими для реалізації концепції таргетної терапії у пацієнтів із важкими або хронічними захворюваннями.
Особливо перспективним виглядає вектор використання THCA-C4 у онкотерапії на основі біомаркерного добору. У ряді клітинних моделей (наприклад, гліобластома, меланома, колоректальний рак) показано, що клітинна експресія GPR55 та зв’язаних білків може бути змінена під впливом екзогенних канабіноїдів. Якщо THCA-C4 має здатність модулювати експресію цих рецепторів або інгібувати їх активність, то з’являється можливість застосовувати цю сполуку як молекулу мішень у терапії пухлин з відомим рецепторним профілем.
Також варто зазначити можливість використання THCA-C4 у терапії нейродегенеративних станів, зокрема при хворобі Альцгеймера або Паркінсона. Теоретична модель передбачає, що селективна активність кислотної форми з коротким ліпофільним ланцюгом може впливати на сигнальні шляхи, пов’язані з нейрозапаленням, активністю мікроглії, глутаматергичною трансмісією. Враховуючи, що THCA-C4 має відносно низьку проникність через гематоенцефалічний бар’єр у вихідній формі, його ефекти можуть бути локалізованими або обмеженими до переферійної нервової системи, що створює окремі фармакологічні ніші для його застосування в умовах, де центральна дія небажана.
Крім прямої рецепторної дії, THCA-C4 також може виступати як модифікатор локального середовища – зокрема, впливати на в’язкість мембран, параметри редокс-балансу, або динаміку міжклітинної комунікації через екзосоми та везикулярні структури. Усі ці ефекти можуть бути вимірюваними та спрогнозованими в межах персоніфікованої медицини, з урахуванням транскриптомного, протеомного або метаболомного профілю пацієнта.
Принципове значення має також технічна можливість включення THCA-C4 у платформу комп’ютерного докінгу та in silico скринінгу. Завдяки чітко визначеній молекулярній структурі та малій молекулярній масі, ця сполука добре підходить для симуляції ліганд-рецепторної взаємодії за допомогою методів молекулярної динаміки, що є критично важливим на ранніх етапах розробки прецизійних терапевтичних рішень. Крім того, оскільки THCA-C4 досі не має масивного фармакологічного бекграунду, він становить цікаву мішень для створення нових ліків, обмежених до вузьких категорій пацієнтів або рідкісних захворювань, де загальна терапія є малоефективною.
Маркер чистоти або походження в аналітичній хімії канабіноїдів
THCA-C4, як менш розповсюджений гомолог Δ9-тетрагідроканабінолової кислоти, має всі ознаки маркерної сполуки, що може використовуватись в аналітичній хімії для диференціації хемотипів канабісу, ідентифікації ботанічного походження, встановлення умов культивації, а також підтвердження хімічної чистоти ізольованих екстрактів. В аналітичній практиці присутність або відсутність специфічних гомологів у певному зразку виконує не просто роль дескриптора, але набуває статусу хімічного “відбитка пальця”, за яким можна зробити висновки як про природне походження речовини, так і про наявність фальсифікацій, технологічних домішок або порушення протоколів обробки.
Поява THCA-C4 в профілях фітоканабіноїдів не є випадковою. Ця сполука синтезується у рослині шляхом аналогічного до THCA-A біосинтетичного шляху, але з використанням бутирилкоензиму A замість пентанілового попередника. Саме ця особливість робить THCA-C4 чутливим маркером до умов біогенезу, зокрема до ферментної активності специфічних синтаз (THCA-синтази з альтернативною специфічністю), рівня наявних коензимів, балансу вуглецевих субстратів у цитозолі трихомних клітин. Отже, аналіз присутності THCA-C4 в суміші дозволяє виводити інформацію про фізіологічний статус рослини на момент біосинтезу.
З аналітичної точки зору, детекція THCA-C4 здійснюється з використанням високоточних інструментальних методів, таких як рідинна хроматографія високої роздільності (HPLC), тандемна мас-спектрометрія (LC-MS/MS), газова хроматографія з попередньою дериватизацією, а також спектроскопія ядерного магнітного резонансу. Особливої уваги заслуговує той факт, що THCA-C4, на відміну від свого більш поширеного гомолога, має змінену масу, іншу хроматографічну полярність та характерну фрагментацію у спектрах MS2. Це робить його практично несплутуваним з іншими канабіноїдами, навіть у складних матрицях. У цьому полягає його цінність як аналітичного індикатора – навіть у наднизьких концентраціях THCA-C4 може ідентифікувати ботанічний чи хемотиповий профіль зразка.
У практиці судово-хімічної експертизи, де потрібна диференціація зразків за регіональним або культиваційним походженням, THCA-C4 може бути використаний як маркер геохемічного індексу. Деякі хемотипи, особливо ті, що зростають в умовах обмеженого доступу до довгих жирних кислот, продукують THCA-C4 у більшій кількості. Таким чином, наявність цього гомолога у фітопрофілі зразка є вагомим доказом ботанічного джерела – чи це був outdoor, greenhouse чи indoor вирощування, які мали різну доступність до субстратів синтезу. Крім того, поєднання THCA-C4 з іншими малими гомологами (наприклад, THCA-C1 або THCA-C3) дозволяє побудувати мультикомпонентну аналітичну панель, яка з високою точністю ідентифікує не лише ботанічне походження, а й конкретний сорт або гібрид.
Ще одним важливим аспектом є застосування THCA-C4 як маркера чистоти при ізоляції канабіноїдів фармацевтичного класу. Під час екстракції, фракціонування або очищення діючих речовин із канабісу важливо контролювати присутність сторонніх гомологів, які можуть свідчити про неповне очищення, крос-контамінацію або порушення температурного режиму. У цьому контексті, неочікувана поява THCA-C4 у фракціях, де за теорією його бути не повинно (наприклад, після надкритичної CO₂-екстракції з температурним градієнтом), може вказувати на хімічні перетворення в процесі екстракції або фальсифікації вихідної сировини.
Також слід зазначити роль THCA-C4 у виявленні синтетичних або модифікованих зразків. Оскільки на сьогодні доступні синтетичні канабіноїди часто не містять природних гомологів, їх відсутність – включно з THCA-C4 – може бути критерієм ідентифікації хімічно змінених або лабораторно отриманих субстанцій. У зразках, де THCA-C4 повністю відсутній, незважаючи на наявність основного THCA-A або THC, можливо, йдеться про реінжиниринг канабіноїдів шляхом деконструкції і повторної синтези. Отже, THCA-C4 може стати маркером природності й автентичності субстанції.
У межах GMP-контролю та фармацевтичного сертифікаційного аналізу, THCA-C4 може відігравати роль “негативного контрольного індикатора”. У специфікаціях чистоти для лікарських форм, які базуються виключно на основі одного активного канабіноїда, його присутність може бути неприйнятною. Водночас, у фітопрепаратах на основі екстракту повного спектра, навпаки, наявність THCA-C4 в мікроконцентраціях може підтверджувати цілісність ботанічного профілю. Це створює двосторонній інструмент контролю як автентичності, так і ступеня очищення.
Крім того, THCA-C4 має потенціал бути використаним для створення цифрових бібліотек хемотипів у рамках молекулярної трасології. Поєднання високоточної мас-спектрометрії та алгоритмів машинного навчання дозволяє виявити повторювані шаблони розподілу гомологів у зразках, що формують унікальні “канабіноїдні відбитки”. THCA-C4 у цій системі виконує роль валідаційної точки: її наявність або відсутність фіксує стабільність матриці в часовому та просторовому вимірі, дозволяючи верифікувати ідентичність між серіями продуктів чи партіями екстрактів.
Біотехнології та селекція: виробництво канабіноїдних профілів під замовлення
Сучасні біотехнології відкривають принципово нові можливості для селекції рослин канабісу з заданим профілем канабіноїдів, включаючи специфічний вміст і співвідношення таких рідкісних гомологів, як THCA-C4. У цьому контексті біотехнологічні підходи трансформують традиційну селекцію, яка базувалась переважно на фенотипових характеристиках, у високотехнологічну науку, що керується молекулярним дизайном. Завдяки цьому можливо створювати оригінальні комбінації канабіноїдів із заданими терапевтичними властивостями, що відповідають вимогам прецизійної медицини та фармакології.
Основою для виробництва заданих канабіноїдних профілів є глибоке розуміння генетичних і біохімічних механізмів, які контролюють експресію ферментів, що визначають шляхи синтезу канабіноїдів. Генетична модифікація, CRISPR/Cas9-редагування та селекція за допомогою маркерів дозволяють маніпулювати активністю генів THCA-синтази, CBDA-синтази та інших ферментів, що продукують специфічні гомологи. Особливо цікаво, що варіації у генотипах можуть впливати на співвідношення між різними довжинами бокових ланцюгів, які утворюють гомологи – від C1 до C5 і більше, включно з C4. Це означає, що за допомогою точних маніпуляцій можна керувати кількістю THCA-C4, спрямовуючи метаболізм рослини на збільшення або зменшення його утворення.
Поряд із генетичними підходами, активне застосування знаходять і клітинні технології, що дозволяють культивувати клітини або тканини канабісу in vitro, підтримуючи виробництво специфічних канабіноїдів у контрольованих умовах. Клітинні культури, органоїди або біореактори з клітинами канабісу можна модифікувати для збільшення продуктивності THCA-C4 шляхом регулювання умов живлення, експозиції до стресів, впливу епігенетичних факторів. Цей підхід особливо важливий для промислового виробництва: він дає змогу отримувати однорідний продукт без коливань, характерних для рослин, що ростуть в польових умовах.
Важливою складовою біотехнологічної стратегії є застосування ферментативного синтезу. Відомо, що ферменти, які каталізують останні стадії синтезу канабіноїдів, мають певну субстратну специфічність, але також певну ступінь пластичності. Застосування мутантних варіантів цих ферментів з підвищеною афінністю до субстратів з коротшими боковими ланцюгами, зокрема до бутирилкоензиму A, дозволяє збільшувати синтез THCA-C4 у біореакторах. Такий ферментативний синтез, поєднаний із генетичною оптимізацією рослин, відкриває шлях до масштабного виробництва заданих канабіноїдних профілів, необхідних для розробки нових фармацевтичних форм.
Значну роль відіграє і гібридизація рослин із різними хемотипами. Вибір батьківських ліній з високим вмістом THCA-C4 або з предиспозицією до його утворення дає можливість через серії поколінь створювати стабільні сорти з необхідним профілем. На відміну від традиційної селекції, сучасні методи дозволяють відслідковувати у нащадках присутність генів, що регулюють метаболізм канабіноїдів, використовуючи молекулярні маркери та генотипування. Це значно прискорює процес і зменшує кількість непотрібних циклів селекції.
Також варто відзначити перспективи використання синтетичної біології для створення штучних мікроорганізмів, здатних продукувати THCA-C4. Бактерії або дріжджі, інженерно модифіковані для вираження ключових генів канабіноїдного шляху, можуть бути ефективними біореакторами. Важливим завданням є налаштування метаболічних потоків, зокрема шляхів синтезу ацил-коензимів, які є донорськими групами для ферментів синтезу канабіноїдів. Регуляція експресії ферментів ацилтрансфераз у поєднанні з оптимізацією ферментативної активності відкриває шлях для масштабного і контрольованого синтезу THCA-C4 поза межами рослини.
У контексті селекції особливої уваги заслуговує створення “зелених” біотехнологій – екологічно безпечних методів, що дозволяють підтримувати стабільність і відтворюваність канабіноїдних профілів при мінімальному впливі на навколишнє середовище. Це особливо актуально для розробки медичних сортів із строго контрольованим вмістом активних компонентів. Наприклад, за рахунок регулювання світлового режиму, температурних параметрів і живильного середовища у закритих системах культивації можливо посилити експресію генів, відповідальних за виробництво THCA-C4, без необхідності застосування хімічних стимуляторів або агресивних методів генетичної модифікації.
Ще одним важливим аспектом є інтеграція даних мультиоміки – геноміки, транскриптоміки, протеоміки та метаболоміки – у процес селекції. Комплексний аналіз цих даних дозволяє точніше прогнозувати результативність конкретних генетичних змін і оцінювати стабільність профілю канабіноїдів. Так, наприклад, транскриптомічний аналіз дозволяє ідентифікувати ключові регуляторні гени, що активують синтез специфічних гомологів, включаючи THCA-C4, у відповідь на зовнішні або внутрішні стимули. Це відкриває можливості для створення сорту з програмованою відповіддю на фактори навколишнього середовища.
Виробництво канабіноїдних профілів під замовлення – це також питання контролю якості та стандартизації продуктів. У цьому аспекті біотехнології забезпечують можливість отримання однорідної сировини з мінімальними варіаціями складу. Це особливо важливо для фармацевтичної індустрії, де стабільність дози і профілю активних речовин є критичною. Клітинні культури та біореактори з модифікованими мікроорганізмами дають змогу виключити залежність від кліматичних та ґрунтових умов, що часто ускладнюють підтримання стабільності в польових умовах.
Варто також відзначити перспективи гібридних підходів, які поєднують класичні методи селекції з біотехнологічними. Наприклад, створення гібридів, у яких традиційні методи підсилюють або направляють біотехнологічні зміни, здатне створити стійкі сорти з прогнозованим і стійким профілем THCA-C4, що відповідає вимогам замовників у фармацевтичній, косметичній або харчовій галузях.
Висновок
THCA-C4, як рідкісний гомолог тетрагідроканабінолової кислоти, вирізняється унікальними властивостями, які формуються на рівні його біосинтезу, хімічної структури та фармакокінетики. Складність його виявлення обумовлена не лише хімічною нестабільністю та чутливістю до зовнішніх факторів, а й низькою концентрацією в рослинному матеріалі, що потребує застосування високоточних аналітичних методів. Природні шляхи синтезу THCA-C4 тісно пов’язані з активністю специфічних ферментів і генетичною мінливістю рослин, що відкриває можливості для регуляції його вмісту через геномний інжиніринг та селекцію. Біохімічна стабільність цієї молекули у рослинному середовищі визначає її доступність для подальших досліджень і комерційного використання.
Штучне отримання THCA-C4, як у лабораторних, так і у промислових умовах, вимагає поєднання хімічних, ферментативних і біотехнологічних методів, що дозволяють контролювати структуру й чистоту продукту. Сучасні аналітичні підходи з використанням спектроскопії, хроматографії та мас-спектрометрії забезпечують точне виявлення й підтвердження молекулярної структури, що є фундаментом для подальшого фармакологічного вивчення.
У біологічних системах THCA-C4 проявляє специфічну взаємодію з канабіноїдними рецепторами, яка відрізняється від дії класичного THC, що відкриває перспективи в розробці нових терапевтичних агентів із покращеним профілем безпеки. Декарбоксилювання радикально змінює фармакодинаміку, переходячи від кислоти до психоактивних форм, що є критичною точкою для розуміння дії і потенціалу використання THCA-C4. На даному етапі досліджень молекула демонструє значний терапевтичний потенціал, особливо у напрямках протизапальної, нейропротекторної та анальгетичної дії, проте потребує глибшого механістичного розкриття.
Перспективи застосування THCA-C4 охоплюють прецизійну медицину, де він може слугувати молекулярною мішенню для індивідуалізованих терапевтичних стратегій, а також аналітичну хімію як маркер походження і чистоти канабіноїдних препаратів. Біотехнологічні підходи до селекції і виробництва канабіноїдних профілів під замовлення відкривають нові горизонти для фармацевтичної і косметичної промисловості, дозволяючи створювати стандартизовані, високоефективні продукти.
Таким чином, THCA-C4 є складним об’єктом дослідження з унікальними хімічними і біологічними характеристиками, що вимагають міждисциплінарного підходу. Подальше вивчення його метаболізму, молекулярної взаємодії та синтетичних шляхів забезпечить основу для розвитку нових медичних і біотехнологічних застосувань, а також для створення інноваційних методів контролю якості канабіноїдних продуктів.
Джерела
- PubMed Central (PMC) – Національна бібліотека медицини США
https://www.ncbi.nlm.nih.gov/pmc/
База даних публікацій з біомедицини та фармакології, включає багато досліджень з канабіноїдів. - National Center for Biotechnology Information (NCBI)
https://www.ncbi.nlm.nih.gov/
Авторитетний ресурс із науковими статтями, включно з генетикою і біохімією канабіноїдів. - Journal of Natural Products – Американське хімічне товариство (ACS Publications)
https://pubs.acs.org/journal/jnprdf
Публікує високоякісні дослідження природних сполук, включно з канабіноїдами. - Frontiers in Pharmacology
https://www.frontiersin.org/journals/pharmacology
Відкритий доступ, публікації про фармакологічні властивості канабіноїдів та їх біохімію. - Cannabis and Cannabinoid Research (Mary Ann Liebert, Inc.)
https://www.liebertpub.com/can
Відомий журнал, присвячений науковим дослідженням канабіноїдів. - ScienceDirect (Elsevier)
https://www.sciencedirect.com/
Хоча не весь контент відкритий, тут є багато досліджень із доступом через університети, зокрема з хімії і біохімії канабіноїдів. - Directory of Open Access Journals (DOAJ)
https://doaj.org/
Каталог відкритих наукових журналів із різних галузей, можна знайти публікації про канабіноїди. - ResearchGate
https://www.researchgate.net/
Платформа, де вчені публікують свої роботи, часто можна знайти повні тексти статей про THCA-C4 і споріднені теми. - European Journal of Medicinal Chemistry
https://www.journals.elsevier.com/european-journal-of-medicinal-chemistry
Публікації про синтез і біологічні властивості канабіноїдів. - American Journal of Botany
https://bsapubs.onlinelibrary.wiley.com/journal/15372197
Публікації про біологію і генетику рослин, включно з коноплею.